Aminy pochodne amoniaku, w których
|
|
|
- Barbara Sowa
- 8 lat temu
- Przeglądów:
Transkrypt
1 A M I N Y
2 Aminy pochodne amoniaku, w których jeden (aminy 1 o ), dwa (aminy 2 o ) lub trzy (aminy 3 o ) atomy wodoru zostały zastąpione resztami organicznymi (alifatycznymi bądź aromatycznymi).
3 Przykłady amin Aminy pierwszorzędowe (1 o ) CH 3 CH 2 etyloamina (CH 3 ) 2 CH izopropyloamina (CH 3 ) 3 C tert-butyloamina CH 2 H cykloheksyloamina anilina benzyloamina -naftyloamina
4 Aminy drugorzędowe (2 o ) (CH 3 CH 2 ) 2 dietyloamina NH (CH 3 ) 2 CH NH N-fenylo-N-izopropyloamina NH CH 3 CH 2 NH CH 3 N-metyloanilina N-benzylo-N-metyloamina
5 Aminy trzeciorzędowe (3 o ) N (CH 3 ) 2 (CH 3 CH 2 ) 3 N trietyloamina N,N-dimetyloanilina CH 2 CH 2 CH 3 CH 2 N CH N (CH 3 2 CH 3 ) 2 N-benzylo-N-metylo-N-propyloamina N,N-dietylo-N- -naftyloamina
6 Inne związki organiczne zawierające azot Iminy R CH NH R CH NAr Nitryle R C N C N benzenokarbonitryl (benzonitryl, cyjanek fenylu)
7 Amidy i imidy R C R C NHR' R C NR' 2 C NH Związki nitrowe butyrolaktam amid cykliczny ftalimid NH R N 2 nitroalkan N 2 nitrobenzen
8 Związki nitrozowe N N H nitrozocykloheksan nitrozobenzen Pochodne hydroksyloaminy R CH NH NH H fenylohydroksyloamina R C NHH Pochodne hydrazyny (H 3 C) 2 N NH 1,1-dimetylohydrazyna fenylohydrazyna
9 Azozwiązki i sole diazoniowe Aromatyczne związki heterocykliczne N H N N N N X azobenzen (difenylodiazen) N H N N sól benzenodiazoniowa pirol imidazol pirydyna chinolina N N N N N N N H N pirymidyna puryna akrydyna
10 Nazewnictwo amin 1. do słowa amina dodaje się w przedrostku nazwę reszty alkilowej lub arylowej przyłączonej do atomu azotu, np. propyloamina, benzyloamina, metyloamina; CH 3 CH 2 CH 2 propyloamina CH 2 benzyloamina CH 3 metyloamina 2. słowo amina poprzedza się nazwą macierzystego węglowodoru połączonego literką o, np. metanoamina, benzenoamina, etanoamina; CH 3 metanoamina benzenoamina CH 3 CH 2 etanoamina
11 3. przedrostek amina dodaje się do rdzenia nazwy węglowodoru macierzystego, np. aminoetan, aminobenzen, aminobutan; CH 3 aminometan aminobenzen CH 3 CH 2 CH 2 CH 2 aminobutan 4. nazwę reszty alkilowej lub arylowej połączonej z atomem azotu dodaje się do rdzenia azan, np. metyloazan, fenyloazan, etyloazan; CH 3 metyloazan fenyloazan CH 3 CH 2 etyloazan
12 5. dla amin 2 o i 3 o podajemy alfabetycznie wszystkie łańcuchy węglowodorowe połączone z atomem azotu stawiając przed jej nazwą dużą literkę N- co oznacza, że reszta alkilowa lub arylowa związana jest bezpośrednio z atomem azotu grupy aminowej, np. N,N-dietylobutyloamina, N-metylo-N-(2-pentylo)amina. CH 3 CH 2 CH 2 CH 2 N CH 3 CH 3 N,N-dimetylobutyloamina NH CH 3 CH 3 CHCH 2 CH 2 CH 3 N-metylo-N-(2-pentylo)amina
13 Właściwości fizykochemiczne Aminy są słabymi zasadami. W roztworach wodnych pozostają w równowadze z jonem amoniowym. Aminy są związkami polarnymi, w wodzie rozpuszczają się podobnie jak alkohole, co wynika, ze zdolności tworzenia wiązań wodorowych. Rozpuszczalność amin w wodzie maleje wraz ze wzrostem liczby atomów węgla w cząsteczce. N H H H H H N H
14 Niskocząsteczkowe aminy mieszają się z wodą w całym zakresie stężeń, charakteryzują się one nieprzyjemnym, rybim zapachem. Większość amin to ciecze, jedynie metyloamina, dimetyloamina, trimetyloamina i etyloamina są w temp. pokojowej gazami. Metyloamina CH 3 trujący, bezbarwny, łatwopalny gaz o nieprzyjemnym zapachu. Przechowuje się ją skroploną w ampułkach, albo w postaci chlorowodorku metyloaminy CH 3 NH 3+ Cl -. Handlowo dostępna jest jako 40% roztwór wodny. Znalazła ona zastosowanie przy produkcji barwników, pestycydów, surfaktantów, w preparatyce farmaceutycznej, a skroplona jako rozpuszczalnik. Dimetyloamina (CH 3 ) 2 NH bezbarwny gaz o zapachu gnijących ryb. Jest produktem rozkładu białek w wyniku gnicia. Stosowana jest jako adsorbent gazów kwaśnych, czynnik flotacyjny, stabilizator benzyny i rozpuszczalnik, w przemyśle włókienniczym oraz do produkcji mydeł, środków depilacyjnych i czyszczących. Etyloamina CH 3 CH 2 bezbarwna, łatwopalna, lotna amina o zapachu amoniaku. Wykorzystywana jest do produkcji leków, pestycydów, inhibitorów korozji, rafinacji ropy naftowej oraz w syntezie organicznej.
15 Hybrydyzacja atomu azotu sp 3 i geometria cząsteczki piramidalna o kątach między wiązaniami wynoszącymi w ~109 o. Atom azotu związany jest z trzema podstawnikami za pośrednictwem wiązań s. N sp 3 Cząsteczki amin zawierające trzy różne podstawniki związane z atomem azotu są chiralne. Nie można jednak ich rozdzielić na enancjomery, ponieważ w temperaturze pokojowej szybko zachodzi inwersja konfiguracji (przekształcenie jednego enancjomeru w drugi). W inwersji bierze udział płaski produkt przejściowy, powstający w wyniku zmiany hybrydyzacji atomu azotu z sp 3 na sp 2, wolna para elektronowa atomu azotu zajmuje orbital p.
16 R R' "R sp 3 N "R R N sp 2 R' sp 3 N R" R R' Stan przejściowy, płaski Enancjomery W przypadku 4 o soli amoniowych nie dochodzi do inwersji konfiguracji więc ich formy enancjomeryczne można wyodrębnić.
17 Zasadowość amin Aminy wykazują właściwości zasadowe (mają zdolność do reakcji z kwasami) ze względu na obecność wolnej pary elektronowej na atomie azotu.
18 1. Reakcje amin z kwasami mineralnymi i kwasami Lewisa (CH 3 CH 2 ) 3 N trietyloamina + H 2 S 4 (CH 3 CH 2 ) 3 NH HS 4 wodorosiarczan trietyloamoniowy + HCl anilina (nierozpuszczalna w wodzie) NH 3 Cl chlorek fenyloamoniowy chlorowodorek aniliny (rozpuszczalny w wodzie) (CH 3 CH 2 ) 3 N + BF 3 (CH 3 CH 2 ) 3 N BF 3 trietyloamina kwas Lewisa kompleks
19 2. Stała równowagi reakcji amin z wodą (K b ) i pk b jako miara ich zasadowości H H R N + H 2 K b R N H + H H amina H kation amoniowy K b = [R-NH 3] [ H] [R- ] pk b = - log K b miara zasadowości amin
20 3. Stała równowagi reakcji kationu amoniowego z wodą (K a ) i pk a jako miara jego kwasowości H R N H + H 2 K a H kation amoniowy H R N H amina + H 3 K a = [R-] [H 3 ] [R-NH 3 ] pk a = - log K a miara kwasowości kationu amoniowego pk a + pk b = 14 pk b = 14 - pk a Im wyższa wartość pk a kationu amoniowego (im słabszy kwas), tym mocniejsza amina (zasada z nim sprzężona).
21 4.Porównanie zasadowości amin w zależności od ich rzędowości, w roztworach wodnych
22 5. Porównanie zasadowości amin alifatycznych i aromatycznych H 3 C N H H N 2 p-nitroanilina anilina CH 3 toluidyna metyloamina pk b wzrost zasadowości
23 * Aminy alifatyczne są mocniejszymi zasadami od amin aromatycznych tej samej rzędowości. Grupy alkilowe wywołujące +I stabilizują jon amoniowy i zwiększają zasadowość amin. Solwatacja jonu amoniowego przez cząsteczki wody, również działa na ten jon stabilizująco i wpływa na wzrost zasadowości amin. Zazwyczaj, aminy 1 o i 2 o są mocniejszymi zasadami niż aminy 3 o. Aminy aromatyczne są słabszymi zasadami niż alifatyczne, ponieważ wolna para elektronowa atomu azotu oddziałuje z elektronami p pierścienia aromatycznego, co zmniejsza jej dostępność dla tworzenia wiązania z protonem. Na zasadowość amin aromatycznych mają wpływ podstawniki znajdujące się w pierścieniu aromatycznym.
24 * Podstawniki elektronodonorowe (np., -R, - CH 3 (alkil)) w pozycjach orto i para względem grupy aminowej zwiększają gęstość elektronową w pierścieniu, co sprzyja stabilizacji jonu amoniowego i zwiększa zasadowość amin aromatycznych.
25 * Podstawniki elektronoakceptorowe (np. CH, -CR, -N 2, -S 3 R, -CF 3 ) w pozycjach orto i para względem grupy aminowej zmniejszają zasadowość amin aromatycznych.
26 Nukleofilowość amin Aminy wykazują właściwości nukleofilowe ze względu na obecność wolnej pary elektronowej na atomie azotu, tj. reagują z halogenkami alkilowymi oraz ulegają acylowaniu w reakcji substytucji nukleofilowej (S N ). Alkilowanie amin H N + R' X H N X = Cl; Br; I R' + X anilina NaHC 3 + CH 2 Cl NHCH 2 90 o C chlorek benzylu N-benzyloanilina
27 R R R X R NH B + HB + X - B R R N R R X + HB + X - R X R R N R X R czwartorzędowa sól amoniowa
28 Arylowanie amin N 2 N 2 2 N F + H N B 2 N N Acylowanie amin H N + R C Y B R C N Y = Cl; Br; CH 3 ; CR' amid CH 3 CH 2 CH 2 propyloamina + CH 3 CH 2 C Cl chlorek propionylu - HCl CH 3 CH 2 C NHCH 2 CH 2 CH 3 N-propylopropanoamid
29 Metody otrzymywania amin 1. Alkilowanie amoniaku i amin nie można otrzymać czystej aminy bez zanieczyszczeń aminami o wyższej rzędowości. 2. trzymywanie amin 1 o Synteza Gabriela CH 3 CH CHCH 2 Cl 1-chlorobut-2-en 1. N-ftalimidek potasu, DMF CH 3 CH CHCH 2 2., EtH 1-aminobut-2-en (- ftalazyna)
30 R amina 1 o + H H kwas ftalowy hydroliza N ftalimid H KH N K N-ftalimidek potasu R X -KX N R N-alkiloftalimid EtH hydrazyna R amina 1 o + NH NH ftalazyna NH NH R
31 Przegrupowanie Hofmanna i Curtiusa R C amid Br 2 4NaH, H 2 R + 2NaBr + Na 2 C 3 + 2H 2 amina 1 o R C Cl chlorek kwasowy NaN 3 (-NaCl) R C N N azydek N (-N 2 ) R N C izocyjanian H 2 R + C 2 amina 1 o
32 Redukcyjne aminowanie aldehydów i ketonów (reakcja z amoniakiem) otrzymuje się aminy o jeden rząd wyższe w porównaniu do aminy użytej w reakcji R C R' H + NH 3 R C R' (-H 2 ) R C R' aldehyd lub keton hemaminal NH imina [H] : H 2 / Ni; LiAlH 4 ; NaBH 3 CN (cyjanotrihydroboran sodu) R [H] CH R' amina 1 o + NH 3 H 2 / Ni NH H cykloheksanon imina cykloheksyloamina
33 Redukcja nitrozwiązków Ar N 2 [H] Ar [H] - Sn/HCl, NaH; H 2 /kat. wobec tlenków Cu 2, Cr 2 3 lub Ba N 2 1. Fe, HCl 2. H nitrobenzen anilina N 2 Na 2 S H 2 N 2 N 2 1,3-dinitrobenzen 3-nitroanilina
34 becnie najlepsza przemysłowa metoda otrzymywania aniliny technologia bezodpadowa: fenol H NH 3 (amonoliza) 425 o C, 20 MPa, kat. anilina + H 2
35 Redukcja nitryli R C N 1. LiAlH 4 nitryl 2. H 2 R amina 1 o C N cyjanek cyklopropylu 1. LiAlH 4 2. H 2 Redukcja azydków CH 2 cyklopropylometyloamina R Br NaN 3 1. LiAlH 4 R N N N R azydek alkilu 2. H 2 amina 1 o
36 Redukcja amidów R C amid 1. LiAlH 4 2. H 2 R CH 2 amina 1 o
37 trzymywanie amin 1 o zawierających grupę - przy 3 o atomie węgla, np. t-butyloaminy, którą trudno otrzymać na innej drodze (reakcja Rittera): CH 3 H 3 C C CH 3 H t-butanol C H 3 C CH 3 izobuten H 2 S 4 H 2 S 4 CH 3 CH 3 H 3 C C CH 3 - H 2 C H H H 3 C CH 3 karbokation t-butylowy
38 CH 3 CH 3 C + CH 3 CH 2 C N H 3 C C N C CH 2 CH 3 H 3 C CH 3 propionitryl CH 3 karbokation t-butylowy CH 3 CH 3 H 3 C C N C CH 2 CH 3 CH 3 H H H 2 H 3 C C N C CH 2 CH 3 CH 3 CH 3 - H H 3 C C N CH 3 C CH 2 CH 3 H H 3 C CH 3 H 3 C 1. H / H 2 C CH 3 t-butyloamina + CH 3 C N C CH 2 CH 3 CH 3 H amid 2. H CH 3 CH 2 C anion propionianowy
39 3. trzymywanie amin 2 o Redukcja amidów monopodstawionych H 3 C C NHC(CH 3 ) 3 N-tert-butyloacetamid 1. LiAlH 4 2. H 2 H 3 C CH 2 NHC(CH 3 ) 3 N-tert-butylo-N-etyloamina
40 Redukcyjne aminowanie aldehydów i ketonów (reakcja z aminą 1 o ) CH 3 (CH 2 ) 5 C heptanal H + H 2 N CH 3 (CH 2 ) 5 CH N imina anilina H 2 / Ni CH 3 (CH 2 ) 5 CH 2 NH N-heptyloanilina
41 4. trzymywanie amin 3 o Redukcja amidów dipodstawionych C N(CH 3 ) 2 1. LiAlH 4 2. H 2 CH 2 N(CH 3 ) 2 N,N-dimetylocykloheksylokarboksyamid N,N-dimetylo(cykloheksylometylo)- amina Redukcyjne aminowanie aldehydów i ketonów (reakcja z aminą 2 o ) CH 3 (CH 2 ) 3 pentanal C H H + CH 3 (CH 2 ) 3 C N H piperydyna jon iminowy N H 2 / Ni + H CH 3 (CH 2 ) 3 CH 2 N N-pentylopiperydyna
42 Pytanie Wychodząc z propan-1-olu otrzymać propyloaminę wykorzystując cztery różne metody syntezy. dpowiedź CH 3 CH 2 CH 2 H PBr 3 propan-1-ol lub HBr CH 3 CH 2 CH 2 Br bromek propylu CH 3 CH 2 CH 2 Br + N K S N 2 N CH 2 CH 2 CH 3 bromek propylu NH NH + CH 3 CH 2 CH 2 propyloamina
43 CH 3 CH 2 CH 2 Br NaN 3 1. LiAlH 4 CH 3 CH 2 CH 2 N 3 CH 3 CH 2 CH 2 2. H 2 bromek propylu azydek propylu propyloamina CH 3 CH 2 CH 2 H propan-1-ol PCC CH 2 Cl 2 CH 3 CH 2 C propanal H NH 3 H 2 / Ni CH 3 CH 2 CH 2 propyloamina CH 3 CH 2 CH 2 H KMn 4 propan-1-ol CH 3 CH 2 C H kwas propanowy 1. SCl 2 2. NH 3 CH 3 CH 2 C propanoamid 1. LiAlH 4 2. H 2 CH 3 CH 2 CH 2 propyloamina
44 Wpływ grupy aminowej na reaktywność pierścienia aromatycznego w reakcji substytucji elektrofilowej (S E ) Grupa aminowa jest grupą elektronodonorową (+M), która silnie aktywuje pierścień aromatyczny na S E kierując podstawniki w pozycje orto i para.
45 Bromowanie aniliny Br2 Br Br H 2 anilina Br 2,4,6-tribromoanilina Ac 2 Py NHAc Br2 -HBr Br NHAc NaH H 2 Br CH 2 CH 3 CH 2 CH 3 CH 2 CH 3 CH 2 CH 3 4-etyloanilina 2-bromo-4-etyloanilina N-acetylo- 4-etyloanilina N-acetylo-2-bromo- 4-etyloanilina
46 Nitrowanie aniliny aniliny nie poddaje się bezpośredniemu nitrowaniu, ponieważ kwas azotowy ma właściwości utleniające, a pierścień aromatyczny wzbogacony w elektrony jest bardzo podatny na utlenianie. Ac 2 Py NHAc HN3 H 2 S 4 NHAc N 2 NHAc anilina acetanilid o-nitroacetanilid N 2 p-nitroacetanilid + H 2, H - N 2 + o-nitroanilina N 2 p-nitroanilina
47 Sulfonowanie aniliny NH 3 3 SH NHS 3 H H2S4 - H o C anilina wodorosiarczan aniliniowy S 3 H kwas sulfanilowy kwas 4-aminobenzenosulfonowy NH 3 NH 3 H H S 3 H S 3 jon obojnaczy S 3
48 Alkilowanie i acylowanie Friedla-Craftsa jest możliwe po uprzednim zacylowaniu grupy aminowej, ponieważ grupa aminowa tworzy kompleks z kwasem Lewisa biorącym udział w reakcji. Po przeprowadzeniu reakcji substytucji amid można zhydrolizować z powrotem do aminy. N-Acylowane aminy to słabe zasady oraz złe odczynniki nukleofilowe. Grupa acyloaminowa osłabia własności elektronodonorowe grupy aminowej, pierścień fenylowy w anilidach jest mniej podatny na S E niż w anilinie. NHAc anilina Ac 2 Py NHAc N-acetyloanilina CCl AlCl 3 C NaH H 2 C 4-aminobenzofenon
49 Utlenianie amin aminy są bardzo podatne na działanie utleniaczy. Przebieg reakcji zależy od budowy aminy, rodzaju utleniacza oraz od warunków reakcji. [] [] [] R R NHH R N R N 2 amina hydroksyloamina związek nitrozo związek nitrowy K 2 Cr 2 7, H + anilina p-chinon
50 Utlenianie 1 o i 2 o amin alifatycznych prowadzi z reguły do mieszaniny różnych produktów. KMn 4 R CH NH H 2 R CH R CH 2 1 o amina H 2 2, RC 3 H R CH 2 NHH + R CH 2 N + R CH 2 N 2
51 Eliminacja Hofmanna otrzymywanie alkenów mniej rozgałęzionych w wyniku eliminacji 4 o wodorotlenków amoniowych. Reguła Hofmanna czwartorzędowe kationy amoniowe ulegają eliminacji z utworzeniem mniej rozgałęzionego alkenu. butyloamina CH 3 I nadmiar N(CH 3 ) 3 I jodek trimetylobutyloamoniowy - AgI Ag 2 H 2 N(CH 3 ) 3 + trimetyloamina but-1-en - H 2 H N(CH 3 ) 3 H wodorotlenek trimetylobutyloamoniowy
52 sec-butyloamina CH 3 I nadmiar N(CH 3 ) 3 I jodek sec-butylotrimetyloamoniowy Ag 2 H 2 H N(CH 3 ) 3 H H + AgI wodorotlenek sec-butylotrimetyloamoniowy - H 2 N(CH 3 ) 3 + trimetyloamina but-2-en (5%) + but-1-en (95%)
53 Testy analityczne 1. test rozpuszczalności aminy nierozpuszczalne w wodzie rozpuszczają się w rozcieńczonych roztworach mocnych kwasów tworząc sole rozpuszczalne w H 2 ; 2. test izonitrylowy aminy 1 o można wykryć na podstawie przykrego zapachu powstającego izonitrylu; R + CHCl 3 + 3KH R N C lub Ar N C Ar amina 1 o izonitryl + 3KCl + 3H 2
54 3. test Hinsberga reakcja z benzenosulfochlorkiem wobec roztworu NaH: S Cl + R B amina 1 o S NH-R sulfonamid rozpuszczalny w alkaliach S Cl + R NH R amina 2 o B R S N R sulfonamid nierozpuszczalny w alkaliach S Cl + R N R R amina 3 o B nie reaguje
55 Reakcje amin z kwasem azotawym (azotowym(iii), HN 2 ) Kwas azotawy (HN 2 ) jest bardzo nietrwały, rozkłada się w temp. pokojowej, dlatego generuje się go in situ w środowisku reakcji z azotanu(iii) sodu (NaN 2 ) i odpowiedniego kwasu: HCl, H 2 S 4, HCH, AcH.
56 Aminy alifatyczne Aminy 1 o alifatyczne z kwasem azotawym tworzą nietrwałe sole diazoniowe, które szybko ulegają przemianie w alkeny, alkohole oraz inne produkty podstawienia: CH 3 CH 3 H 3 C C t-butyloamina NaN 2 HCl CH 3 CH 3 H 3 C C CH 2 + H 3 C C CH 3 + izobuten H t-butanol CH 3 H 3 C C CH 3 Cl chlorek t-butylu
57
58 Aminy 2 o alifatyczne z kwasem azotawym dają N-nitrozoaminy: (CH 3 CH 2 ) 2 NH dietyloamina NaN 2 HCl (CH 3 CH 2 ) 2 N N N-nitrozodietyloamina Aminy 3 o alifatyczne nie reagują z kwasem azotawym.
59 Aminy aromatyczne Aminy 1 o aromatyczne dają z kwasem azotawym sole diazoniowe: NaN 2 HCl N N Cl anilina chlorek benzenodiazoniowy
60 Aminy 2 o aromatyczne z kwasem azotawym dają N-nitrozoaminy: N H CH 2 CH 3 N-etyloanilina NaN 2 HCl N N CH 2 CH 3 N-nitrozo-N-etyloanilina
61 Aminy 3 o aromatyczne reagują z kwasem azotawym ulegając reakcji substytucji elektrofilowej (S E ) w pierścieniu aromatycznym dając p-nitrozopochodne: N CH 2CH 3 CH 2 CH 3 NaN 2 HCl N N CH 2CH 3 CH 2 CH 3 N,N-dietyloanilina (N ) S E p-nitrozo-n,n-dietyloanilina
62 Przykładowe pytania 1. Następujące związki uszereguje według malejącej zasadowości: a. anilina, benzyloamina, o-nitroanilina, benzamid b. metyloamina, anilina, N-metyloanilina, amoniak c. 2,4-dichloroanilina, 2,4-dinitroanilina, 2,4-dimetyloanilina, 4-chloro-2-nitroanilina 2. Podaj wzory i nazwy produktów następujących reakcji: a. anilina + acetaldehyd H 2, Ni b. c. anilina + jodek metylu (nadmiar) anilina + bezwodnik octowy d. N,N-dietyloanilina NaN 2, H 2 S 4 H 2
63 3. Jak rozróżnić na drodze chemicznej: a. etyloaminę od trimetyloaminy b. cykloheksyloaminę od aniliny c. N-metyloanilinę od p-toluidyny 4. Wykorzystując reakcję aminolizy redukcyjnej otrzymać: a. dibenzyloaminę b. N-benzylopiperydynę c. N,N-dimetylobenzyloaminę 5. Mając do dyspozycji butyroamid podaj kolejne etapy otrzymywania propyloaminy. 6. Następujące związki lub/i aniony uszereguje według malejącej zasadowości: a. H 3 C -, H 2 N -, H -, F - b. H 2, NH 3, H 2 N -, H - c. H 2 N -, H -, CN -, N 3 -
64 7. Podaj kolejne etapy następujących transformacji: a. b. butan-1-ol cykloheksanol pentyloamina N-metylocykloheksyloamina c. d. alkohol izopropylowy alkohol izopropylowy 1-amino-2-metylopropan-2-ol 1-aminopropan-2-ol 8. Podaj produkty (wzór + nazwa) reakcji acetanilidu z każdym z następujących reagentów: a. LiAlH 4 b. HN 3 / H 2 S 4 c. Br 2 / AcH d. chlorek acetylu / AlCl 3 e. 6M HCl, Δ f. NaH aq., Δ
65 9. Podaj struktury związków A-C w następującej transformacji: (S)-oktan-2-ol + H 3 C S 2 Cl pirydyna A NaN 3 MeH / H 2 C 1. LiAlH 4 2. H B 10. Jakie produkty otrzymasz w następujących reakcjach: a. + (CH 3 ) 2 C CHCCH 3 NH 3 b. + HN
66 Dziękuję za uwagę
AMINY. nikotyna. tytoń szlachetny. pseudoefedryna (SUDAFED) atropina. muskaryna H 3 C CH 3 O
 AMINY nikotyna H 3 C NH tytoń szlachetny OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN 2 NUKLEOFILOWOŚĆ i ZASADOWOŚĆ AMIN 3 REAKCJA AMIN Z KWASAMI MINERALNYMI I KARBOKSYLOWYMI
AMINY nikotyna H 3 C NH tytoń szlachetny OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN 2 NUKLEOFILOWOŚĆ i ZASADOWOŚĆ AMIN 3 REAKCJA AMIN Z KWASAMI MINERALNYMI I KARBOKSYLOWYMI
AMINY. tytoń szlachetny. nikotyna. pseudoefedryna (SUDAFED) atropina. muskaryna H 3 C CH 3 O
 AMINY tytoń szlachetny H 3 C NH nikotyna OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN amoniak amina 1 amina 2 amina 3 HYBRYDYZACJA ATOMU AZOTU I TETRAEDRYCZNA BUDOWA
AMINY tytoń szlachetny H 3 C NH nikotyna OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN amoniak amina 1 amina 2 amina 3 HYBRYDYZACJA ATOMU AZOTU I TETRAEDRYCZNA BUDOWA
Kwasy karboksylowe grupa funkcyjna: -COOH. Wykład 8 1
 Kwasy karboksylowe grupa funkcyjna: -CH Wykład 8 1 1. Reakcje utleniania a) utlenianie alkoholi pierwszorzędowych trzymywanie kwasów CH 3 H 3 C C CH 2 H CH 3 alkohol pierwszorzędowy CH K 2 Cr 2 3 7 H 3
Kwasy karboksylowe grupa funkcyjna: -CH Wykład 8 1 1. Reakcje utleniania a) utlenianie alkoholi pierwszorzędowych trzymywanie kwasów CH 3 H 3 C C CH 2 H CH 3 alkohol pierwszorzędowy CH K 2 Cr 2 3 7 H 3
amoniak amina 1 amina 2 amina 3
 AMINY 1. Klasyfikacja 5 godz. amoniak amina 1 amina 2 amina 3 1.1. 1 (pierwszorzędowe), np. izopropyloamina. 1.2. 2 (drugorzędowe), np. pirolidyna. 1.3. 3 (trzeciorzędowe), np. N,N-dimetyloanilina. 2.
AMINY 1. Klasyfikacja 5 godz. amoniak amina 1 amina 2 amina 3 1.1. 1 (pierwszorzędowe), np. izopropyloamina. 1.2. 2 (drugorzędowe), np. pirolidyna. 1.3. 3 (trzeciorzędowe), np. N,N-dimetyloanilina. 2.
Aminy. - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin
 Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Slajd 1. Slajd 2. Aminy. trietyloamina. amoniak. chlorofil
 Slajd 1 Aminy chlorofil Slajd 2 amoniak trietyloamina Slajd 3 Wypadkowy moment dipolowy 1 lub 2 aminy: donory lub akceptory wiązania wodorowego 3 aminy: mogą być wyłącznie akceptorami wiązania wodorowego
Slajd 1 Aminy chlorofil Slajd 2 amoniak trietyloamina Slajd 3 Wypadkowy moment dipolowy 1 lub 2 aminy: donory lub akceptory wiązania wodorowego 3 aminy: mogą być wyłącznie akceptorami wiązania wodorowego
1 Marek Żylewski. Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii Organicznej. NO 2 Zn, HCl HNO 3 N H 2. NH 2 Na 2. S x CHO.
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe związki azotowe Związki nitrowe 1. Redukcja związków nitrowych. Grupa nitrowa jest bardzo podatna na działanie
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe związki azotowe Związki nitrowe 1. Redukcja związków nitrowych. Grupa nitrowa jest bardzo podatna na działanie
Organiczne związki azotu
 Organiczne związki azotu 1. arysuj wzory: a. acetylocholina b. adrenalina c. putrescyna d. dopamina e. kolamina 2. azwij poniższe związki: H 2 CH H C CH 2 A. B. C. D. OH H 2 2 2 E. F. G. H. H 2 I. 2 J.
Organiczne związki azotu 1. arysuj wzory: a. acetylocholina b. adrenalina c. putrescyna d. dopamina e. kolamina 2. azwij poniższe związki: H 2 CH H C CH 2 A. B. C. D. OH H 2 2 2 E. F. G. H. H 2 I. 2 J.
RJC E + E H. Slides 1 to 41
 Aromatyczne Substytucje Elektrofilowe E + E H -H E Slides 1 to 41 Aromatyczne Addycje Elektrofilowe...do pierścienia aromatycznego przerywa sprzęŝenie elektronów π i powoduje utratę stabilizacji poprzez
Aromatyczne Substytucje Elektrofilowe E + E H -H E Slides 1 to 41 Aromatyczne Addycje Elektrofilowe...do pierścienia aromatycznego przerywa sprzęŝenie elektronów π i powoduje utratę stabilizacji poprzez
Reakcje alkoholi, eterów, epoksydów, amin i tioli
 22-24. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas Chemia rganiczna,
22-24. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas Chemia rganiczna,
Reakcje benzenu i jego pochodnych
 39-42. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień
39-42. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień
Elementy chemii organicznej
 Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 )
 FLUOROWCOPOCODNE alogenki alkilowe- Cl C 2 -C 2 -C 2 -C 3 C 3 -C-C 3 C 2 -C-C 3 pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 ) I C 3 C 3 Cl-C 2 -C=C 2 Cl-C-C=C 2 1 2 3 Allilowe atom fluorowca
FLUOROWCOPOCODNE alogenki alkilowe- Cl C 2 -C 2 -C 2 -C 3 C 3 -C-C 3 C 2 -C-C 3 pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 ) I C 3 C 3 Cl-C 2 -C=C 2 Cl-C-C=C 2 1 2 3 Allilowe atom fluorowca
11. Reakcje alkoholi, eterów, epoksydów, amin i tioli
 11. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas 1 11.1. Reakcja
11. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas 1 11.1. Reakcja
18. Reakcje benzenu i jego pochodnych
 18. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień benzenowy
18. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień benzenowy
Zarówno 1 o aminy alifatyczne jak i aromatyczne reagują z kwasem azotowym(iii) (HNO 2 ) dając sole diazoniowe. Do przeprowadzenia procesu diazowania
 Zarówno 1 o aminy alifatyczne jak i aromatyczne reagują z kwasem azotowym(iii) (HNO 2 ) dając sole diazoniowe. Do przeprowadzenia procesu diazowania najczęściej wykorzystuje się reakcję amin z kwasem azotowym(iii)
Zarówno 1 o aminy alifatyczne jak i aromatyczne reagują z kwasem azotowym(iii) (HNO 2 ) dając sole diazoniowe. Do przeprowadzenia procesu diazowania najczęściej wykorzystuje się reakcję amin z kwasem azotowym(iii)
Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego. ĆWICZENIE 6 i 7. Aminy i amidy kwasowe
 ĆWICZENIE 6 i 7 Aminy i amidy kwasowe Do amin zaliczamy związki organiczne, których wzór można wyprowadzić ze wzoru amoniaku przez podstawienie w nim atomu lub atomów wodoru grupą lub grupami alkilowymi
ĆWICZENIE 6 i 7 Aminy i amidy kwasowe Do amin zaliczamy związki organiczne, których wzór można wyprowadzić ze wzoru amoniaku przez podstawienie w nim atomu lub atomów wodoru grupą lub grupami alkilowymi
Slajd 1. Związki aromatyczne
 Slajd 1 Związki aromatyczne Slajd 2 Reguły aromatyczności 1. Związek musi posiadać cykliczną chmurę elektronową ponad i pod płaszczyzną cząsteczki 2. Chmura elektronów π musi zawierać nieparzystą liczbę
Slajd 1 Związki aromatyczne Slajd 2 Reguły aromatyczności 1. Związek musi posiadać cykliczną chmurę elektronową ponad i pod płaszczyzną cząsteczki 2. Chmura elektronów π musi zawierać nieparzystą liczbę
Związki aromatyczne (by Aleksandra Kołodziejczyk, UG)
 Związki aromatyczne (by Aleksandra Kołodziejczyk, UG) 4 stopnie nienasycenia. ak reakcji A Źródła: - piroliza węgla smoła pogazowa; - reforming ropy naftowej Nazewnictwo przedrostek nazwa podstawnika C
Związki aromatyczne (by Aleksandra Kołodziejczyk, UG) 4 stopnie nienasycenia. ak reakcji A Źródła: - piroliza węgla smoła pogazowa; - reforming ropy naftowej Nazewnictwo przedrostek nazwa podstawnika C
Spis treści 1. Struktura elektronowa związków organicznych 2. Budowa przestrzenna cząsteczek związków organicznych
 Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
ZWIĄZKI FOSFOROORGANICZNE
 ZWIĄZKI FSFGANICZNE Związki fosforoorganiczne związki zawierające wiązanie węgiel-fosfor (C-) Wiązanie fosfor-wodór (-H; 77 kcal/mol) jest słabsze niż wiązanie azot-wodór (N-H; 93.4 kcal/mol). Wiązanie
ZWIĄZKI FSFGANICZNE Związki fosforoorganiczne związki zawierające wiązanie węgiel-fosfor (C-) Wiązanie fosfor-wodór (-H; 77 kcal/mol) jest słabsze niż wiązanie azot-wodór (N-H; 93.4 kcal/mol). Wiązanie
Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO:
 FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
Pochodne węglowodorów, w cząsteczkach których jeden atom H jest zastąpiony grupą hydroksylową (- OH ).
 Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
C H N O L B I O T E ORGANICZNA I A. Nomenklatura
 B T E L EMA G GAZA A omenklatura B T E L EMA G GAZA A Synteza AMY -rzędowe ' 2 2 2 ' 2 0 0 0 1 2 3 Typy amin -rzędowych w zależności od rzędowości atomu węgla związanego z grupą aminową METDY EDUKYJE
B T E L EMA G GAZA A omenklatura B T E L EMA G GAZA A Synteza AMY -rzędowe ' 2 2 2 ' 2 0 0 0 1 2 3 Typy amin -rzędowych w zależności od rzędowości atomu węgla związanego z grupą aminową METDY EDUKYJE
Chemia organiczna. Mechanizmy reakcji chemicznych. Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego
 Chemia organiczna Mechanizmy reakcji chemicznych Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego 1 homoliza - homolityczny rozpad wiązania w jednym z reagentów; powstają produkty zawierające
Chemia organiczna Mechanizmy reakcji chemicznych Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego 1 homoliza - homolityczny rozpad wiązania w jednym z reagentów; powstają produkty zawierające
CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA. POLIMERYZACJA.
 INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA.
INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA.
Reakcje kwasów karboksylowych i ich pochodnych
 27-29. eakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór N grupa karbonylowa atom (, N lub Cl) o większej
27-29. eakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór N grupa karbonylowa atom (, N lub Cl) o większej
Otrzymywanie halogenków alkilów
 Otrzymywanie halogenków alkilów 1) Wymiana grupy OH w alkoholach C O H HX 2) reakcja podstawienia alkanów C X H 3 C CH CH 2 HBr C H 3 OH H 3 C CH CH 2 C H 3 Br h + + CH CH 2 3 Cl 2 Cl HCl CH CH 3 3 CH
Otrzymywanie halogenków alkilów 1) Wymiana grupy OH w alkoholach C O H HX 2) reakcja podstawienia alkanów C X H 3 C CH CH 2 HBr C H 3 OH H 3 C CH CH 2 C H 3 Br h + + CH CH 2 3 Cl 2 Cl HCl CH CH 3 3 CH
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
WĘGLOWODORY AROMATYCZNE
 WĘGLOWODORY AROMATYCZNE cykliczne węglowodory spełniające warunki aromatyczności: Ale: związki niearomatyczne 1 ZWIĄZKI AROMATYCZNE - przykłady 2 NOMENKLATURA Monocykliczne węglowodory aromatyczne są nazywane
WĘGLOWODORY AROMATYCZNE cykliczne węglowodory spełniające warunki aromatyczności: Ale: związki niearomatyczne 1 ZWIĄZKI AROMATYCZNE - przykłady 2 NOMENKLATURA Monocykliczne węglowodory aromatyczne są nazywane
REAKCJE PROBÓWKOWE 5. Aminy, aminokwasy, białka
 REAKCJE PROBÓWKOWE 5. Aminy, aminokwasy, białka imię i nazwisko data nr str. Rubryki oznaczone po prawej stronie ciemnym prostokątem należy wypełniać przed zajęciami. W reakcjach obowiązują wzory strukturalne
REAKCJE PROBÓWKOWE 5. Aminy, aminokwasy, białka imię i nazwisko data nr str. Rubryki oznaczone po prawej stronie ciemnym prostokątem należy wypełniać przed zajęciami. W reakcjach obowiązują wzory strukturalne
14. Reakcje kwasów karboksylowych i ich pochodnych
 14. Reakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór R N R R grupa karbonylowa atom (, N lub Cl) o
14. Reakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór R N R R grupa karbonylowa atom (, N lub Cl) o
Chemia organiczna. Związki zawierające azot. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Chemia organiczna Związki zawierające azot Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Grupy funkcyjne zawierające azot Grupa funkcyjna Przykład związku Wzór Nazwa Wzór Nazwa -NO 2 nitrowa CH3NO2
Chemia organiczna Związki zawierające azot Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Grupy funkcyjne zawierające azot Grupa funkcyjna Przykład związku Wzór Nazwa Wzór Nazwa -NO 2 nitrowa CH3NO2
CHEMIA 10. Oznaczenia: R - podstawnik węglowodorowy, zwykle alifatyczny (łańcuchowy) X, X 2 - atom lub cząsteczka fluorowca
 INSTYTUT MEDICUS Kurs przygotowawczy na studia medyczne kierunek lekarski, stomatologia, farmacja, analityka medyczna tel. 0501 38 39 55 www.medicus.edu.pl CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE.
INSTYTUT MEDICUS Kurs przygotowawczy na studia medyczne kierunek lekarski, stomatologia, farmacja, analityka medyczna tel. 0501 38 39 55 www.medicus.edu.pl CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE.
Stałe siłowe. Spektroskopia w podczerwieni. Spektrofotometria w podczerwieni otrzymywanie widm
 Spektroskopia w podczerwieni Spektrofotometria w podczerwieni otrzymywanie widm absorpcyjnych substancji o różnych stanach skupienia. Powiązanie widm ze strukturą pozwala na identyfikację związku. Widmo
Spektroskopia w podczerwieni Spektrofotometria w podczerwieni otrzymywanie widm absorpcyjnych substancji o różnych stanach skupienia. Powiązanie widm ze strukturą pozwala na identyfikację związku. Widmo
MIKROANALIZY WĘGLOWODORY. W1 Utlenianie węglowodorów nadmanganianem potasu w środowisku kwaśnym (w temp. pokojowej) RÓWNANIA REAKCJI: OBSERWACJE:
 MIKROANALIZY imię i nazwisko Rubryki odpowiednio opisane (lekko przyciemnione) należy wypełniać przed rozpoczęciem zajęć. Opisując obserwacje reakcji należy wyraźnie napisać co się zmienia lub nie. Jeśli
MIKROANALIZY imię i nazwisko Rubryki odpowiednio opisane (lekko przyciemnione) należy wypełniać przed rozpoczęciem zajęć. Opisując obserwacje reakcji należy wyraźnie napisać co się zmienia lub nie. Jeśli
fenol ninhydryna difenyloamina kwas octowy Określ ph amin: n-butyloamina dietyloamina difenyloamina anilina N,N-dimetyloanilina
 REAKCJE PROBÓWKOWE 5. Aminy, aminokwasy, białka imię i nazwisko data nr str. Rubryki oznaczone po prawej stronie ciemnym prostokątem należy wypełniać przed zajęciami. W reakcjach obowiązują wzory strukturalne
REAKCJE PROBÓWKOWE 5. Aminy, aminokwasy, białka imię i nazwisko data nr str. Rubryki oznaczone po prawej stronie ciemnym prostokątem należy wypełniać przed zajęciami. W reakcjach obowiązują wzory strukturalne
Aminy - budowa. R alkil Alkiloamina Amina alifatyczna. Ar aryl Aryloamina Amina aromatyczna AMINA I - RZĘDOWA AMINA III - RZĘDOWA AMINA II - RZĘDOWA
 Aminy Aminy - budowa R alkil Alkiloamina Amina alifatyczna Ar aryl Aryloamina Amina aromatyczna AMINA I - RZĘDOWA AMINA II - RZĘDOWA AMINA III - RZĘDOWA Aminy - budowa ALKILOAMINY PIRAMIDA TRYGONALNA ARYLOAMINY
Aminy Aminy - budowa R alkil Alkiloamina Amina alifatyczna Ar aryl Aryloamina Amina aromatyczna AMINA I - RZĘDOWA AMINA II - RZĘDOWA AMINA III - RZĘDOWA Aminy - budowa ALKILOAMINY PIRAMIDA TRYGONALNA ARYLOAMINY
Chemia organiczna. Związki zawierające azot. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Chemia organiczna Związki zawierające azot Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Grupy funkcyjne zawierające azot Grupa funkcyjna Przykład związku Wzór Nazwa Wzór Nazwa -NO 2 nitrowa CH3NO2
Chemia organiczna Związki zawierające azot Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Grupy funkcyjne zawierające azot Grupa funkcyjna Przykład związku Wzór Nazwa Wzór Nazwa -NO 2 nitrowa CH3NO2
Zadanie: 1 (3 pkt) Metanoamina (metyloamina) rozpuszcza się w wodzie, a także reaguje z nią.
 Zadanie: 1 (3 pkt) Metanoamina (metyloamina) rozpuszcza się w wodzie, a także reaguje z nią. Napisz, posługując się wzorami grupowymi (półstrukturalnymi) związków organicznych, równanie reakcji metanoaminy
Zadanie: 1 (3 pkt) Metanoamina (metyloamina) rozpuszcza się w wodzie, a także reaguje z nią. Napisz, posługując się wzorami grupowymi (półstrukturalnymi) związków organicznych, równanie reakcji metanoaminy
KARTA KURSU. Kod Punktacja ECTS* 4
 KARTA KURSU Nazwa Nazwa w j. ang. Chemia organiczna Organic chemistry Kod Punktacja ECTS* 4 Koordynator dr Waldemar Tejchman Zespół dydaktyczny dr Waldemar Tejchman Opis kursu (cele kształcenia) Celem
KARTA KURSU Nazwa Nazwa w j. ang. Chemia organiczna Organic chemistry Kod Punktacja ECTS* 4 Koordynator dr Waldemar Tejchman Zespół dydaktyczny dr Waldemar Tejchman Opis kursu (cele kształcenia) Celem
R 2 III-rzędowe R 1 N R 3
 ZWIĄZKI ZAWIERAJĄE AZT W GRUPA FUKYJY I. Wprowadzenie teoretyczne Ważniejsze związki organiczne zawierające azot w grupie funkcyjnej to aminy, aminokwasy, związki nitrowe oraz hydrazyna i jej pochodne.
ZWIĄZKI ZAWIERAJĄE AZT W GRUPA FUKYJY I. Wprowadzenie teoretyczne Ważniejsze związki organiczne zawierające azot w grupie funkcyjnej to aminy, aminokwasy, związki nitrowe oraz hydrazyna i jej pochodne.
1. Substytucja nukleofilowa we fluorowcopochodnych
 B T E L EMA G GAZA A Synteza 1. Substytucja nukleofilowa we fluorowcopochodnych 1a) Etery dialkilowe można otrzymywać w reakcji pierwszorzędowych fluorowcopochodnych z ALKLAAM. Jest to reakcja Williamsona.
B T E L EMA G GAZA A Synteza 1. Substytucja nukleofilowa we fluorowcopochodnych 1a) Etery dialkilowe można otrzymywać w reakcji pierwszorzędowych fluorowcopochodnych z ALKLAAM. Jest to reakcja Williamsona.
Elementy chemii organicznej
 Elementy chemii organicznej Węglowodory alifatyczne Alkany C n H 2n+2 Alkeny C n H 2n Alkiny C n H 2n-2 Alkany C n H 2n+2 struktura Kekulégo wzór skrócony model Dreidinga metan etan propan butan Nazewnictwo
Elementy chemii organicznej Węglowodory alifatyczne Alkany C n H 2n+2 Alkeny C n H 2n Alkiny C n H 2n-2 Alkany C n H 2n+2 struktura Kekulégo wzór skrócony model Dreidinga metan etan propan butan Nazewnictwo
liczba kwantowa, n kwantowa, l Wanad 3 2 [Ar] 3d 3 4s 2
![liczba kwantowa, n kwantowa, l Wanad 3 2 [Ar] 3d 3 4s 2 liczba kwantowa, n kwantowa, l Wanad 3 2 [Ar] 3d 3 4s 2](/thumbs/65/54124071.jpg) Arkusz odpowiedzi Nr Proponowane rozwiązanie zadani a Liczba niesparowanych elektronów w jonie r 3+ jest (mniejsza / większa) od liczby elektronów niesparowanych w jonie Mn +. Pierwiastkiem, którego jony
Arkusz odpowiedzi Nr Proponowane rozwiązanie zadani a Liczba niesparowanych elektronów w jonie r 3+ jest (mniejsza / większa) od liczby elektronów niesparowanych w jonie Mn +. Pierwiastkiem, którego jony
δ + δ - δ + R O H RJC R δ + δ - δ - δ + R O R Grupy Funkcyjne δ + O NH 2 R N H H R N Slides 1 to 41
 1 δ + δ + δ + R R X Grupy Funkcyjne δ + δ + R R R δ + R δ + X δ + R N R δ + R δ + R R δ + R δ + N 2 R δ + R N δ + δ + Slides 1 to 41 2 Grupy Funkcyjne Zawierające eteroatomy Grupy funkcyjne mają często
1 δ + δ + δ + R R X Grupy Funkcyjne δ + δ + R R R δ + R δ + X δ + R N R δ + R δ + R R δ + R δ + N 2 R δ + R N δ + δ + Slides 1 to 41 2 Grupy Funkcyjne Zawierające eteroatomy Grupy funkcyjne mają często
Chemia organiczna. Zagadnienia i przykładowe pytania do kolokwiów dla Biotechnologii (I rok)
 Chemia organiczna Zagadnienia i przykładowe pytania do kolokwiów dla Biotechnologii (I rok) Zakład Chemii Organicznej Wydział Chemii Uniwersytet Wrocławski 2005 Lista zagadnień: Kolokwium I...3 Kolokwium
Chemia organiczna Zagadnienia i przykładowe pytania do kolokwiów dla Biotechnologii (I rok) Zakład Chemii Organicznej Wydział Chemii Uniwersytet Wrocławski 2005 Lista zagadnień: Kolokwium I...3 Kolokwium
Węglowodory aromatyczne (areny) to płaskie cykliczne związki węgla i wodoru. Areny. skondensowane liniowo. skondensowane kątowo
 Spis treści Podstawowe pojęcia Właściwości chemiczne benzenu Wielopierścieniowe węglowodory aromatyczne Homologi benzenu Nazewnictwo związków aromatycznych Występowanie i otrzymywanie arenów Węglowodory
Spis treści Podstawowe pojęcia Właściwości chemiczne benzenu Wielopierścieniowe węglowodory aromatyczne Homologi benzenu Nazewnictwo związków aromatycznych Występowanie i otrzymywanie arenów Węglowodory
WARSZTATY olimpijskie. Co już było: Atomy i elektrony Cząsteczki i wiązania Stechiometria Gazy, termochemia Równowaga chemiczna Kinetyka
 WARSZTATY olimpijskie Co już było: Atomy i elektrony Cząsteczki i wiązania Stechiometria Gazy, termochemia Równowaga chemiczna inetyka WARSZTATY olimpijskie Co będzie: Data Co robimy 1 XII 2016 wasy i
WARSZTATY olimpijskie Co już było: Atomy i elektrony Cząsteczki i wiązania Stechiometria Gazy, termochemia Równowaga chemiczna inetyka WARSZTATY olimpijskie Co będzie: Data Co robimy 1 XII 2016 wasy i
EGZAMIN WSTĘPNY NA STUDIUM DOKTORANCKIE W CBMIM PAN W ŁODZI. Zestaw pytań z chemii organicznej
 EGZMIN WSTĘPNY N STUDIUM DKTRNKIE W BMIM PN W ŁDZI Zestaw pytań z chemii organicznej 1. Proszę narysować orbitalny obraz cząsteczki allenu 2 == 2. Jaka jest hybrydyzacja środkowego atomu węgla: sp 2 czy
EGZMIN WSTĘPNY N STUDIUM DKTRNKIE W BMIM PN W ŁDZI Zestaw pytań z chemii organicznej 1. Proszę narysować orbitalny obraz cząsteczki allenu 2 == 2. Jaka jest hybrydyzacja środkowego atomu węgla: sp 2 czy
KWASY KARBOKSYLOWE I ICH POCHODNE. R-COOH lub R C gdzie R = H, CH 3 -, C 6 H 5 -, itp.
 KWASY KARBKSYLWE I IH PHDNE I. Wprowadzenie teoretyczne Kwasy karboksylowe Kwasami organicznymi nazywamy związki, w których grupa funkcyjna H zwana grupą karboksylową jest związana z rodnikiem węglowodorowym
KWASY KARBKSYLWE I IH PHDNE I. Wprowadzenie teoretyczne Kwasy karboksylowe Kwasami organicznymi nazywamy związki, w których grupa funkcyjna H zwana grupą karboksylową jest związana z rodnikiem węglowodorowym
Krystyna Dzierzbicka
 Krystyna Dzierzbicka Fenole związki organiczne, w których grupa hydroksylowa związana jest bezpośrednio z atomem węgla układu aromatycznego (z węglem o hybrydyzacji sp 2 ). Przykłady i -naftol -naftol
Krystyna Dzierzbicka Fenole związki organiczne, w których grupa hydroksylowa związana jest bezpośrednio z atomem węgla układu aromatycznego (z węglem o hybrydyzacji sp 2 ). Przykłady i -naftol -naftol
Grupa karbonylowa. Grupa karbonylowa to grupa funkcyjna, w której atom tlenu połączony jest z atomem węgla podwójnym wiązaniem
 ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
Addycje Nukleofilowe do Grupy Karbonylowej
 J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA CHEMII ORGANICZNEJ, BIOORGANICZNEJ I BIOTECHNOLOGII
 POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA CHEMII ORGANICZNEJ, BIOORGANICZNEJ I BIOTECHNOLOGII Instrukcja do ćwiczeń laboratoryjnych WŁAŚCIWOŚCI KWASOWOZASADOWE ZWIĄZKÓW ORGANICZNYCH; BADANIE ROZPUSZCZALNOŚCI
POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA CHEMII ORGANICZNEJ, BIOORGANICZNEJ I BIOTECHNOLOGII Instrukcja do ćwiczeń laboratoryjnych WŁAŚCIWOŚCI KWASOWOZASADOWE ZWIĄZKÓW ORGANICZNYCH; BADANIE ROZPUSZCZALNOŚCI
Zagadnienia obowiązujące przy każdym kolokwium z ćwiczeń syntetycznych:
 Zagadnienia obowiązujące przy każdym kolokwium z ćwiczeń syntetycznych: - znajomość instrukcji (kolejność i cel poszczególnych operacji; umiejętność zapisu równań wszystkich przeprowadzanych reakcji; konstrukcja
Zagadnienia obowiązujące przy każdym kolokwium z ćwiczeń syntetycznych: - znajomość instrukcji (kolejność i cel poszczególnych operacji; umiejętność zapisu równań wszystkich przeprowadzanych reakcji; konstrukcja
AMINY I ICH POCHODNE
 AMIY I I PDE rganiczne pochodne amoniaku. 4/5 powietrza azot. W naturze: aminokwasy, peptydy, białka, alkaloidy (kokaina, nikotyna, morfina, meskalina ), neurotransmitery, stymulanty, kwasy nukleinowe
AMIY I I PDE rganiczne pochodne amoniaku. 4/5 powietrza azot. W naturze: aminokwasy, peptydy, białka, alkaloidy (kokaina, nikotyna, morfina, meskalina ), neurotransmitery, stymulanty, kwasy nukleinowe
Podział związków organicznych
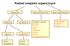 Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
1. REAKCJA ZE ZWIĄZKAMI POSIADAJĄCYMI KWASOWY ATOM WODORU:
 B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
ALDEHYDY, KETONY. I. Wprowadzenie teoretyczne
 ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami
 Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami I. Otrzymywanie halogenowęglowodorów 1. Reakcje halogenacji (substytucji rodnikowej halogenów (Cl, ) na
Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami I. Otrzymywanie halogenowęglowodorów 1. Reakcje halogenacji (substytucji rodnikowej halogenów (Cl, ) na
WĘGLOWODORY, ALKOHOLE, FENOLE. I. Wprowadzenie teoretyczne
 WĘGLWDRY, ALKHLE, FENLE I. Wprowadzenie teoretyczne Węglowodory Węglowodory są to połączenia organiczne zbudowane z atomów węgla i wodoru. Ze względu na różne sposoby łączenia się atomów węgla w tych związkach
WĘGLWDRY, ALKHLE, FENLE I. Wprowadzenie teoretyczne Węglowodory Węglowodory są to połączenia organiczne zbudowane z atomów węgla i wodoru. Ze względu na różne sposoby łączenia się atomów węgla w tych związkach
Zarys Chemii Organicznej
 Zarys hemii Organicznej hemię organiczną definiuje się jako chemię związków węgla. Ogólna liczba znanych związków organicznych przekracza obecnie 18 milionów i wielokrotnie przewyższa liczbę znanych związków
Zarys hemii Organicznej hemię organiczną definiuje się jako chemię związków węgla. Ogólna liczba znanych związków organicznych przekracza obecnie 18 milionów i wielokrotnie przewyższa liczbę znanych związków
Materiały dodatkowe kwasy i pochodne
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe kwasy i pochodne Kwasy 1. Kwasowość Kwasy karboksylowe są kwasami o stosunkowo niewielkiej mocy. Ich stała dysocjacji
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe kwasy i pochodne Kwasy 1. Kwasowość Kwasy karboksylowe są kwasami o stosunkowo niewielkiej mocy. Ich stała dysocjacji
Aminy. Aminy 1 0 RNH 2 NH. Aminy 3 0 R 3
 Aminy Aminy 1 0 R 2 Aminy 2 0 R 2 Aminy 3 0 R 3 C 3 C 3 C C 3 C 3 C 3 C 2 C 3 C 3 C 3 C 3 alkohol 3 o amina 1 o amina 3 o Czwartorzędowa sól amoniowa: R R R R X 1 Aminy alifatyczne ( wszystkie podstawniki
Aminy Aminy 1 0 R 2 Aminy 2 0 R 2 Aminy 3 0 R 3 C 3 C 3 C C 3 C 3 C 3 C 2 C 3 C 3 C 3 C 3 alkohol 3 o amina 1 o amina 3 o Czwartorzędowa sól amoniowa: R R R R X 1 Aminy alifatyczne ( wszystkie podstawniki
CHEMII POZIOM ROZSZERZONY
 CHEMII PZIM RZSZERZNY zadanianumer Kryteria oceniania czekiwana odpowiedź Za narysowanie klatkowego modelu konfiguracji elektronów walencyjnych: (4s ) (4p 3 ) Uwagi Zwroty strzałek na podpowłoce 4p mogą
CHEMII PZIM RZSZERZNY zadanianumer Kryteria oceniania czekiwana odpowiedź Za narysowanie klatkowego modelu konfiguracji elektronów walencyjnych: (4s ) (4p 3 ) Uwagi Zwroty strzałek na podpowłoce 4p mogą
Podstawy chemii organicznej. T. 2 / Aleksander Kołodzieczyk, Krystyna Dzierzbicka. Gdańsk, Spis treści
 Podstawy chemii organicznej. T. 2 / Aleksander Kołodzieczyk, Krystyna Dzierzbicka. Gdańsk, 2013 Spis treści 14. ZWIĄZKI KARBONYLOWE 11 14.1. Budowa grupy karbonylowej 11 14.2. Reaktywność związków karbonylowych
Podstawy chemii organicznej. T. 2 / Aleksander Kołodzieczyk, Krystyna Dzierzbicka. Gdańsk, 2013 Spis treści 14. ZWIĄZKI KARBONYLOWE 11 14.1. Budowa grupy karbonylowej 11 14.2. Reaktywność związków karbonylowych
Reakcje związków karbonylowych zudziałem atomu węgla alfa (C- )
 34-37. eakcje związków karbonylowych zudziałem atomu węgla alfa (C- ) stabilizacja rezonansem (przez delokalizację elektronów), może uczestniczyć w delokalizacji elektronów C- -, podatny na oderwanie ze
34-37. eakcje związków karbonylowych zudziałem atomu węgla alfa (C- ) stabilizacja rezonansem (przez delokalizację elektronów), może uczestniczyć w delokalizacji elektronów C- -, podatny na oderwanie ze
Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup
 Cz. XXV - Kwasy karboksylowe Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup karboksylowych - CH ( - C - H ), atom C w grupie funkcyjnej jest na hybrydyzacji sp 2,
Cz. XXV - Kwasy karboksylowe Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup karboksylowych - CH ( - C - H ), atom C w grupie funkcyjnej jest na hybrydyzacji sp 2,
Materiały dodatkowe alkohole, fenole, etery
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe alkohole, fenole, etery Alkohole i fenole 1 Własności kwasowo-zasadowe alkoholi i fenoli becność grupy H, posiadającej
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe alkohole, fenole, etery Alkohole i fenole 1 Własności kwasowo-zasadowe alkoholi i fenoli becność grupy H, posiadającej
Reakcje chemiczne. Typ reakcji Schemat Przykłady Reakcja syntezy
 Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
Politechnika Krakowska im. Tadeusza Kościuszki. Karta przedmiotu. obowiązuje studentów rozpoczynających studia w roku akademickim 2013/2014
 Politechnika Krakowska im. Tadeusza Kościuszki Karta przedmiotu obowiązuje studentów rozpoczynających studia w roku akademickim 2013/2014 Wydział Inżynierii i Technologii Chemicznej Kierunek studiów: Inżynieria
Politechnika Krakowska im. Tadeusza Kościuszki Karta przedmiotu obowiązuje studentów rozpoczynających studia w roku akademickim 2013/2014 Wydział Inżynierii i Technologii Chemicznej Kierunek studiów: Inżynieria
Chemia organiczna to chemia związków węgla.
 Chemia organiczna to chemia związków węgla. Do tej pory wyizolowano lub zsyntetyzowano kilkanaście milionów związków organicznych. Na dużą różnorodność chemii organicznej mają wpływ: średnia elektroujemność
Chemia organiczna to chemia związków węgla. Do tej pory wyizolowano lub zsyntetyzowano kilkanaście milionów związków organicznych. Na dużą różnorodność chemii organicznej mają wpływ: średnia elektroujemność
Laboratorium. Podstawowe procesy jednostkowe w technologii chemicznej
 Laboratorium Podstawowe procesy jednostkowe w technologii chemicznej Studia niestacjonarne Ćwiczenie Alkilowanie toluenu chlorkiem tert-butylu 1 PROCESY ALKILOWANIA PIERŚCIENIA AROMATYCZNEGO: ALKILOWANIE
Laboratorium Podstawowe procesy jednostkowe w technologii chemicznej Studia niestacjonarne Ćwiczenie Alkilowanie toluenu chlorkiem tert-butylu 1 PROCESY ALKILOWANIA PIERŚCIENIA AROMATYCZNEGO: ALKILOWANIE
ZWIĄZKI MAGNEZOORGANICZNE. Krystyna Dzierzbicka
 ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
VIII Podkarpacki Konkurs Chemiczny 2015/2016
 III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
18 i 19. Substytucja nukleofilowa w halogenkach alkili
 8 i 9. Substytucja nukleofilowa w halogenkach alkili Związki pojadające wiązanie C (sp 3 )-atom o większej elektroujemności od at. C elektroujemny atom sp 3 polarne wiązanie 9.. Typowe reakcje halogenków
8 i 9. Substytucja nukleofilowa w halogenkach alkili Związki pojadające wiązanie C (sp 3 )-atom o większej elektroujemności od at. C elektroujemny atom sp 3 polarne wiązanie 9.. Typowe reakcje halogenków
AZOTOWCE. dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
 AZTWCE fosfor biały ciało bezbarwne, przeświecające, miękkie jak wosk, nierozpuszczalny w wodzie i alkoholu, dobrze rozpuszczalny w CS 2, jest silną trucizną (już 0,1 g fosforu wprowadzony do żołądka działa
AZTWCE fosfor biały ciało bezbarwne, przeświecające, miękkie jak wosk, nierozpuszczalny w wodzie i alkoholu, dobrze rozpuszczalny w CS 2, jest silną trucizną (już 0,1 g fosforu wprowadzony do żołądka działa
Halogenki alkilowe RX
 alogenki alkilowe X Nazewnictwo halogenków alkilowych 1. Znajdź i nazwij łańcuch macierzysty. Tak jak przy nazywaniu alkanów, wybierz najdłuższy łańcuch. Jeżeli w cząsteczce obecne jest wiązanie podwójne
alogenki alkilowe X Nazewnictwo halogenków alkilowych 1. Znajdź i nazwij łańcuch macierzysty. Tak jak przy nazywaniu alkanów, wybierz najdłuższy łańcuch. Jeżeli w cząsteczce obecne jest wiązanie podwójne
RJC A-B A + B. Slides 1 to 27
 Reakcje Rodnikowe rodniki substytucja addycja polimeryzacje A-B A + B Slides 1 to 27 Reakcje Organiczne... powstawanie i rozrywanie wiązań kowalencyjnych. Addycja A + B AB Podstawienie AB + C A + BC Eliminacja
Reakcje Rodnikowe rodniki substytucja addycja polimeryzacje A-B A + B Slides 1 to 27 Reakcje Organiczne... powstawanie i rozrywanie wiązań kowalencyjnych. Addycja A + B AB Podstawienie AB + C A + BC Eliminacja
BENZEN - własności chemiczne
 B I T N L MIA G GANIZNA I A BNZN - własności chemiczne 1) edukcja katalityczna wodorem PD WYSKIM IŚNINIM (do cykloheksanu). Jako katalizatory najczęściej stosowane są: Pt, Pd, Ni / Ni 2 p = 100 atm. T
B I T N L MIA G GANIZNA I A BNZN - własności chemiczne 1) edukcja katalityczna wodorem PD WYSKIM IŚNINIM (do cykloheksanu). Jako katalizatory najczęściej stosowane są: Pt, Pd, Ni / Ni 2 p = 100 atm. T
Wykład 6. Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.)
 Wykład 6 Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.) Dieny Dieny są alkenami, których cząsteczki zawierają 2 podwójne wiązania C=C. Zasadnicze właściwości dienów są takie jak alkenów.
Wykład 6 Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.) Dieny Dieny są alkenami, których cząsteczki zawierają 2 podwójne wiązania C=C. Zasadnicze właściwości dienów są takie jak alkenów.
R E A K C J E E L I M I N A C J I
 E A K J E E L I M I N A J I Związki organiczne zawierające dobrą grupę odchodzącą mogą ulegać reakcji eliminacji w wyniku czego powstają alkeny: B - - - - -= + B Grupami odchodzącymi są te same jony lub
E A K J E E L I M I N A J I Związki organiczne zawierające dobrą grupę odchodzącą mogą ulegać reakcji eliminacji w wyniku czego powstają alkeny: B - - - - -= + B Grupami odchodzącymi są te same jony lub
Spis treści. Budowa i nazewnictwo fenoli
 Spis treści 1 Budowa i nazewnictwo fenoli 2 Kwasowość fenoli 2.1 Kwasowość atomów wodoru 2.2 Fenole jako kwasy organiczne. 3 Reakcje fenoli. 3.1 Zastosowanie fenolu Budowa i nazewnictwo fenoli Fenolami
Spis treści 1 Budowa i nazewnictwo fenoli 2 Kwasowość fenoli 2.1 Kwasowość atomów wodoru 2.2 Fenole jako kwasy organiczne. 3 Reakcje fenoli. 3.1 Zastosowanie fenolu Budowa i nazewnictwo fenoli Fenolami
Spis treści. Nazewnictwo kwasów karboksylowych.
 Do tej klasy zaliczamy związki zawierające grupę karboksylową, zapisywaną w skrócie jako COOH. W tej grupie karbonylowy atom węgla jest związany dodatkowo z grupą hydroksylową. Z uwagi na hybrydyzację
Do tej klasy zaliczamy związki zawierające grupę karboksylową, zapisywaną w skrócie jako COOH. W tej grupie karbonylowy atom węgla jest związany dodatkowo z grupą hydroksylową. Z uwagi na hybrydyzację
Węglowodory Aromatyczne
 Węglowodory Aromatyczne Benzen Rezonans & Aromatyczność Nazewnictwo (nomenklatura) Slides 1 to 38 Węglowodory Aromatyczne W pierwotnym znaczeniu słowo aroma nawiązywało do pachnących składników roślin;
Węglowodory Aromatyczne Benzen Rezonans & Aromatyczność Nazewnictwo (nomenklatura) Slides 1 to 38 Węglowodory Aromatyczne W pierwotnym znaczeniu słowo aroma nawiązywało do pachnących składników roślin;
Fluorowcowęglowodory są to pochodne węglowodorów, gdzie jeden lub więcej atomów wodoru jest podstawione atomem fluorowca. Fluorowcowęglowodory mogą
 Fluorowcowęglowodory są to pochodne węglowodorów, gdzie jeden lub więcej atomów wodoru jest podstawione atomem fluorowca. Fluorowcowęglowodory mogą być alifatyczne i aromatyczne. Grupą funkcyjną dla tych
Fluorowcowęglowodory są to pochodne węglowodorów, gdzie jeden lub więcej atomów wodoru jest podstawione atomem fluorowca. Fluorowcowęglowodory mogą być alifatyczne i aromatyczne. Grupą funkcyjną dla tych
Treść podstawy programowej
 CHEMIA ZR Ramowy rozkład materiału w kolejnych tomach podręczników I. Atomy, cząsteczki i stechiometria chemiczna Tom I 1. Masa atomowa I.2. 2. Izotopy I.1., I.3. 3. Reakcje jądrowe I.4. 4. Okres półtrwania
CHEMIA ZR Ramowy rozkład materiału w kolejnych tomach podręczników I. Atomy, cząsteczki i stechiometria chemiczna Tom I 1. Masa atomowa I.2. 2. Izotopy I.1., I.3. 3. Reakcje jądrowe I.4. 4. Okres półtrwania
Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy. Dział Zakres treści
 Anna Kulaszewicz Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy lp. Dział Temat Zakres treści 1 Zapoznanie z przedmiotowym systemem oceniania i wymaganiami edukacyjnymi z
Anna Kulaszewicz Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy lp. Dział Temat Zakres treści 1 Zapoznanie z przedmiotowym systemem oceniania i wymaganiami edukacyjnymi z
Aleksander Kołodziejczyk Krystyna Dzierzbicka CHEMII. organicznej Tom 2
 Aleksander Kołodziejczyk Krystyna Dzierzbicka CHEMII organicznej Tom 2 Gdansk 2014 PRZEWODNICZĄCY KOMITETU REDAKCYJNEGO WYDAWNICTWA POLITECHNIKI GDAŃSKIEJ Janusz T. Cieśliński RECENZENT Elżbieta Luboch
Aleksander Kołodziejczyk Krystyna Dzierzbicka CHEMII organicznej Tom 2 Gdansk 2014 PRZEWODNICZĄCY KOMITETU REDAKCYJNEGO WYDAWNICTWA POLITECHNIKI GDAŃSKIEJ Janusz T. Cieśliński RECENZENT Elżbieta Luboch
Zagadnienia obowiązujące przy każdym kolokwium z ćwiczeń syntetycznych (rok akademicki 2013/14):
 Zagadnienia obowiązujące przy każdym kolokwium z ćwiczeń syntetycznych (rok akademicki 2013/14): - znajomość instrukcji (kolejność i cel poszczególnych operacji; umiejętność zapisu równań wszystkich przeprowadzanych
Zagadnienia obowiązujące przy każdym kolokwium z ćwiczeń syntetycznych (rok akademicki 2013/14): - znajomość instrukcji (kolejność i cel poszczególnych operacji; umiejętność zapisu równań wszystkich przeprowadzanych
Podstawowe pojęcia i prawa chemiczne
 Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Skala ocen: ndst 0 20, dst , dst , db , db , bdb Informacja:
 Kolokwium III Autorzy: A. Berlicka, E. Dudziak Imię i nazwisko Kierunek studiów azwisko prowadzącego Data Wersja B czas: 60 minut Skala ocen: ndst 0 20, dst 20.5 24, dst 24.5 28, db 28.5 32, db 32.5 36,
Kolokwium III Autorzy: A. Berlicka, E. Dudziak Imię i nazwisko Kierunek studiów azwisko prowadzącego Data Wersja B czas: 60 minut Skala ocen: ndst 0 20, dst 20.5 24, dst 24.5 28, db 28.5 32, db 32.5 36,
Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego ĆWICZENIE 5. Związki aromatyczne
 ĆWICENIE 5 wiązki aromatyczne wiązki aromatyczne są związkami pierścieniowymi o płaskich cząsteczkach zawierających zgodnie z regułą uckla (4n2) elektrony π (n=0,1,2, ). Przedstawicielem takich związków
ĆWICENIE 5 wiązki aromatyczne wiązki aromatyczne są związkami pierścieniowymi o płaskich cząsteczkach zawierających zgodnie z regułą uckla (4n2) elektrony π (n=0,1,2, ). Przedstawicielem takich związków
R-X X = halogen Nazewnictwo: podstawnik halogenowy w szkielecie alkanu lub halogenek alkilu/arylu. F Br H 3 C
 alogenoalkany (by Aleksandra Kołodziejczyk, UG) R-X X = halogen Nazewnictwo: podstawnik halogenowy w szkielecie alkanu lub halogenek alkilu/arylu 3 I jodometan (jodek metylu) F 3 3 fluorocykloheksan (fluorek
alogenoalkany (by Aleksandra Kołodziejczyk, UG) R-X X = halogen Nazewnictwo: podstawnik halogenowy w szkielecie alkanu lub halogenek alkilu/arylu 3 I jodometan (jodek metylu) F 3 3 fluorocykloheksan (fluorek
Wykład 7. Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.)
 Wykład 7 Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.) Otrzymywanie węglowodorów aromatycznych 1. z katalitycznego reformingu (frakcje C 6 -C 10 ) 2. synteza alkilowych pochodnych
Wykład 7 Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.) Otrzymywanie węglowodorów aromatycznych 1. z katalitycznego reformingu (frakcje C 6 -C 10 ) 2. synteza alkilowych pochodnych
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY
 ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania zadań, uwzględniające
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM ROZSZERZONY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania zadań, uwzględniające
Slajd 1. Reakcje alkinów
 Slajd 1 Reakcje alkinów Slajd 2 Alkiny to węglowodory zawierające wiązanie potrójne węgiel-węgiel Wzór ogólny: C n H 2n 2 (łańcuchowy); C n H 2n 4 (cykliczny) 1-heksyn terminalny alkin 3-heksyn wewnętrzny
Slajd 1 Reakcje alkinów Slajd 2 Alkiny to węglowodory zawierające wiązanie potrójne węgiel-węgiel Wzór ogólny: C n H 2n 2 (łańcuchowy); C n H 2n 4 (cykliczny) 1-heksyn terminalny alkin 3-heksyn wewnętrzny
