NAZEWNICTWO WYBRANYCH KLAS ZWIĄZKÓW ORGANICZNYCH 1 ALKANY
|
|
|
- Mariusz Baran
- 8 lat temu
- Przeglądów:
Transkrypt
1 NAZEWNITW WYBRANYH KLAS ZWIĄZKÓW RGANIZNYH ALKANY Pierwsze cztery nierozgałęzione alkany mają nazwy zwyczajowe: metan, etan, propan, butan. Nazwy wyższych członów szeregu homologicznego składają się z rdzenia liczebnikowego (w języku greckim lub łacińskim) odpowiadającego liczbie atomów węgla w łańcuchu oraz końcówki (przyrostka) an. Tabela Liczba Nazwa alkanu Liczba Nazwa alkanu atomów atomów metan 7 heptan etan 8 oktan propan 9 nonan butan 0 dekan pentan undekan heksan dodekan Nazwy nierozgałęzionych grup alkilowych powstałych przez odjęcie jednego atomu wodoru od krańcowego atomu węgla tworzy się zastępując końcówkę an w nazwie węglowodoru końcówką yl (lub il). gólna nazwa grupy R alkil. H H H H H H (H ) 8 H metyl etyl propyl butyl decyl Przy tworzeniu nazw alkanów o łańcuchach rozgałęzionych należy postępować według poniższych wskazówek:. Wybiera się najdłuższy łańcuch węglowy (łańcuch główny) i nadaje mu nazwę zależną od liczby atomów węgla (patrz tab. ). HH H H H H HH H H H H łańcuch główny: butan łańcuch główny: heksan łańcuch główny: heptan Gdy w cząsteczce można wyróżnić dwa (lub więcej) tak samo długie łańcuchy, to jako łańcuch główny wybiera się ten, który zawiera największą liczbę rozgałęzień (podstawników). HHHHH H H wybór prawidłowy - podstawniki HHHHH H H wybór nieprawidłowy - podstawniki HHHHH H H wybór nieprawidłowy - podstawniki. Nazywa się wszystkie podstawniki (łańcuchy boczne) połączone z łańcuchem głównym (nazwy grup alkilowych są podane wyżej oraz w tab. ).
2 . Atomy węgla w łańcuchu głównym numeruje się czyli przypisuje się im tzw. lokanty. Należy wybrać taki kierunek numeracji, aby położenie pierwszego podstawnika (łańcucha bocznego) zostało oznaczone najmniejszym lokantem. H HH H 7 H H HH H H Jeżeli w łańcuchu głównym są dwa podstawniki w takiej samej odległości od obu jego krańców, to o kierunku numeracji atomów węgla decyduje kolejność alfabetyczna nazw tych podstawników, czyli podstawnik, którego nazwa zaczyna się na wcześniejszą literę alfabetu uzyskuje niższy lokant. H 7 8 H HH H HH prawidłowa numeracja: (etyl uzyskuje niższy lokant niż metyl) H 8 7 H HH H HH nieprawidłowa numeracja. Nazwy alkanów o łańcuchu rozgałęzionym tworzy się wymieniając w kolejności alfabetycznej nazwy grup alkilowych (łańcuchów bocznych) przed nazwą najdłuższego łańcucha węglowego. Położenie grup alkilowych w łańcuchu głównym określa się podając właściwy lokant przed nazwą danej grupy. H H H HHH H H HH H H -etylo--metylopentan -etylo--metylo-propyloheptan. becność kilku identycznych niepodstawionych łańcuchów bocznych zaznacza się podając przed nazwą przedrostek di-, tri-, tetra-, itp. określający ich krotność, a odpowiednie lokanty przedziela się przecinkami. Przedrostki te nie są brane pod uwagę przy ustalaniu kolejności alfabetycznej nazw podstawników. H HHHHH,-dimetylobutan H H,,-trimetylo--propyloheptan. Zasady tworzenia nazw rozgałęzionych grup alkilowych (łańcuchów bocznych) i numerowanie atomów węgla w tych grupach ilustrują przykłady umieszczone w tab.. Tabela Wzór grupy Nazwa systematyczna Nazwa zwyczajowa -metyloetyl izopropyl H
3 -metylopropyl sec-butyl H H H -metylopropyl izobutyl HH,-dimetyloetyl tert-butyl H,-dimetylopropyl neopentyl Atom węgla, którym grupa alkilowa jest połączona z łańcuchem głównym jest zawsze oznaczany lokantem. Przykłady: H HH HHHHH H H H H HHH H -(-etylopropylo)-,,-trimetylononan -(,-dimetyloetylo)-,-dimetylooktan Przedrostki di-, tri-, itd. są brane pod uwagę przy ustalaniu kolejności alfabetycznej nazw rozgałęzionych podstawników (grup alkilowych). 7.becność kilku identycznych rozgałęzionych grup alkilowych w łańcuchu głównym zaznacza się podając przed ich systematyczną nazwą przedrostki bis-, tris-, tetrakis-, itd. (zamiast przedrostków di-, tri-, tetra-, itd.). Jeśli jednak podaje się nazwy zwyczajowe rozgałęzionych grup alkilowych (zob. tab. ), to przed ich nazwą umieszcza się przedrostki di-, tri-, tetra-, itd. H 7 8 H H HHH H H,-bis(-metyloetylo)oktan ale,-diizopropylooktan
4 . AYKLIZNE WĘGLWDRY NIENASYNE (alkeny, alkiny, alkadieny, alkadiyny). Nazwy węglowodorów nienasyconych zawierających jedno wiązanie podwójne tworzy się przez zamianę przyrostka -an w nazwie odpowiedniego węglowodoru nasyconego na przyrostek -en (ogólna nazwa alkeny), zaś w przypadku węglowodorów zawierających jedno wiązanie potrójne na przyrostek -yn lub -in (ogólna nazwa alkiny).. Wybiera się najdłuższy łańcuch węglowy (łańcuch główny), w skład którego wchodzą oba atomy węgla wiązania podwójnego (potrójnego).. Numeruje się atomy węgla tego łańcucha tak, aby wiązanie wielokrotne znalazło się możliwie najbliżej krańca łańcucha głównego, czyli uzyskało możliwie najniższe lokanty.. Na początku nazwy wymienia się nazwy podstawników (w kolejności alfabetycznej) poprzedzając je lokantami określającymi położenie podstawników w łańcuchu głównym, a następnie podaje się nazwę łańcucha głównego przedzieloną (przed końcówką en) lokantem określającym położenie wiązania wielokrotnego, przy czym wymienia się jedynie lokant pierwszego z kolei atomu węgla tworzącego to wiązanie (niższy lokant).. Jeśli wiązanie wielokrotne znajduje się dokładnie po środku łańcucha głównego, wówczas o kierunku numerowania atomów węgla w tym łańcuchu decyduje położenie podstawników (zob. wskazówki z rozdz..). H =HH H HH=HH HH H H=H -metylopent--en -metyloheks--en -metyloheks--en H H H H H -metylopent--yn -metyloheks--yn. W przypadku dwu lub więcej wiązań podwójnych stosuje się przyrostek -adien, -atrien, -atetraen, itd. (ogólna nazwa alkadieny, alkatrieny, itd.), zaś w przypadku dwu lub więcej wiązań potrójnych stosuje się przyrostek -adiyn, -atriyn, itd. (ogólna nazwa alkadiyny, alkatriyny, itd.). H H =HH=H H = =H 7 8 H H H H -etylo--propyloheksa-,-dien,-dimetylobuta-,-dien okta-,-diyn 7 H =HH=HH=H hepta-,,-trien 7 H H H hepta-,,-triyn 7. Jeśli w łańcuchu głównym występuje jedno wiązanie podwójne i jedno potrójne, to nazwa kończy się przyrostkiem -enyn. Położenie obu wiązań wielokrotnych w łańcuchu głównym określa się przy pomocy możliwie najniższych lokantów, nawet jeśli przyrostek -yn uzyska
5 niższy lokant niż przyrostek -en. Jeśli jednak możliwy jest wybór kierunku numeracji atomów węgla w łańcuchu, to przyrostek -en oznacza się niższym lokantem. H H H=H pent--en--yn H=HH H heks--en--yn 8. Nazwy grup utworzonych z węglowodorów nienasyconych uzyskują przyrostki: -enyl, -ynyl, -dienyl, itd. Atomy węgla z wolną wartościowością (na wzorach jest to zaznaczone kreską) są oznaczane lokantem, a położenie wiązań wielokrotnych i rozgałęzień określa się według poprzednio omówionych reguł. H =H H=H H =HH H=HH etenyl prop--enyl prop--enyl but--enyl H H H etynyl prop--ynyl prop--ynyl H =HH=H H =H=H H H=H buta-,-dienyl -metylobuta-,-dienyl but--en--ynyl Zostały utrzymane nazwy zwyczajowe następujących grup: H =H H =HH winyl (dla etynylu) allil (dla prop--enylu). WĘGLWDRY ALIFATYZNE MNYKLIZNE (cykloalkany, cykloalkeny, cykloalkadieny). Nazwy nasyconych węglowodorów monocyklicznych tworzy się przez dodanie przyrostka cyklo- do nazwy alkanu o tej samej liczbie atomów węgla (ogólna nazwa cykloalkany). H H H H H H H H H H H H H H cyklopropan cyklopentan cykloheksan. becność podstawników w pierścieniu oznacza się zgodnie z poprzednio omówionymi regułami (rozdz..).
6 H,-dimetylocykloheksan H -etylo-,-dimetylocyklopentan. becność wiązania (wiązań) wielokrotnego w pierścieniu zaznacza się w nazwie przez zamianę przyrostka -an na -en (jedno wiązanie podwójne) lub -adien (dwa wiązania podwójne), itd. Położenie wiązań podwójnych w pierścieniu oznacza się możliwie najniższymi lokantami. cykloheksen -metylocykloheksa-,-dien,-dimetylocyklopenten. Nazwy grup wywodzących się od węglowodorów cyklicznych tworzy się: a) w przypadku pierścieni nasyconych przez zamianę przyrostka -an na -yl (-il), b) w przypadku pierścieni z jednym wiązaniem podwójnym przez zamianę przyrostka -en na -enyl, c) w przypadku pierścieni z dwoma wiązaniami podwójnymi przez zamianę przyrostka -dien na -dienyl. Atom węgla z wolną wartościowością (na wzorach jest to zaznaczone kreską) jest zawsze oznaczany lokantem. Położenia wiązań podwójnych i łańcuchów bocznych oznacza się według poprzednio podanych reguł. -metylocyklopentyl H,-dimetylocykloheksyl cykloheks--enyl H -metylocyklopenta-,-dienyl Dwuwartościowe grupy wywodzące się od węglowodorów cyklicznych mają w nazwie przyrostek -yliden, np.:
7 7 cykloheksyliden WĘGLWDRY BIYKLIZNE (mostkowe). Nazwy nasyconych węglowodorów bicyklicznych (dwupierścieniowych), które mają dwa wspólne atomy węgla, tworzy się przez dodanie przedrostka bicyklo- do nazwy węglowodoru acyklicznego o takiej samej liczbie atomów węgla. W nazwie należy wskazać liczbę atomów węgla w każdym z trzech łańcuchów ( mostków ), które łączą dwa mostkowe atomy węgla; liczby te podaje się w nawiasach kwadratowych w sekwencji malejącej i oddziela kropkami. H H H H bicyklo[..0]butan 7 H H H H 8 H H H H 7 bicyklo[..]oktan 8 H H 7 8 H H H H H H bicyklo[..]oktan 7 8 H 8 H H H H H H H 7 bicylko[..0]oktan Numerację atomów węgla zaczyna się od jednego z atomów mostkowych i prowadzi wzdłuż najdłuższego łańcucha (mostka) do drugiego atomu mostkowego; następnie numeruje się atomy w kolejnym dłuższym łańcuchu (mostku) i na końcu atomy węgla w najkrótszym łańcuchu (brak atomów węgla w najkrótszym łańcuchu zaznacza się liczbą zero ).. becność wiązań podwójnych lub podstawników w pierścieniach oznacza się zgodnie z poprzednio podanymi regułami; jeśli jest możliwy wybór, to położenie wiązań podwójnych (i ewentualnie podstawników) oznacza się możliwie najniższymi lokantami H etylobicyklo[..0]non--en 8-metylobicyklo[..0]deka-,8-dien WĘGLWDRY ARMATYZNE (ARENY)
8 8. Monocykliczne węglowodory aromatyczne są nazywane jako pochodne benzenu, przy czym zachowane są też nazwy zwyczajowe niektórych związków, np. H H=H H benzen toluen ksylen (izomer orto) styren kumen. W pochodnych benzenu położenie podstawników określa się numerami, zachowując poprzednio omówione reguły (możliwie najniższe lokanty i kolejność alfabetyczna nazw). W przypadku dwupodstawionych pochodnych zamiast numeracji,-,,-,,- można stosować określenia : o- (orto), m- (meta), p- (para). H H H H H,-dietylobenzen lub p-dietylobenzen -etylo--metylobenzen lub m-etylotoluen H -etylo--metylo--propylobenzen. gólna nazwa węglowodorów aromatycznych to areny, a symbolem skrótowym można ich wzór zapisać jako Ar H.. Nazwy ważniejszych grup jedno- i dwuwartościowych zawierających pierścień benzenowy to: H H fenyl p-tolil (-metylofenyl) benzyl (fenylometyl) benzyliden (fenylometylen). WĘGLWDRY ARMATYZNE PLIYKLIZNE (o pierścieniach skondensowanych) Przykłady węglowodorów aromatycznych z dwoma i trzema pierścieniami benzenowymi; zachowane są ich nazwy zwyczajowe.
9 naftalen antracen fenantren 7 FLURWPHDNE. Związki zawierające fluorowce można nazywać stosując dwa rodzaje nomenklatury: a) nomenklaturę podstawnikową, która ma zastosowanie ogólne i jest zalecana, b) nomenklaturę grupowo-funkcyjną, która jest dość powszechnie stosowana w przypadku pochodnych alifatycznych o niezbyt złożonej budowie.. Nazwy podstawnikowe związków zawierających fluorowce tworzy się przez dodanie do nazwy szkieletu węglowego przedrostka: fluoro-, chloro-, bromo- lub jodo- i oznaczeniu odpowiednim lokantem jego położenia; zachowuje się przy tym poprzednio omówione reguły (kolejność alfabetyczną, najniższy zestaw lokantów, itd.). Br l Br Br Br I I H H H H HH HH H H -bromobutan -bromo--chloropentan,-dibromobutan,-dijodobutan H H =HHH H l Br F -chloro--metylopent--en (-bromoetylo)cykloheksan -fluorocykloheks--en (najniższy lokant ma wiązanie (nazwę złożonego podstawnika (atomy węgla wiązania podwójnego podwójne) ujmuje się w nawiasy) w pierścieniu mają lokanty i ) l l Br l m-bromotoluen -chloro-,-dimetylobenzen,-dichloronaftalen. Nazwy grupowo-funkcyjne składają się z dwóch słów; pierwsze słowo to fluorek, chlorek, bromek lub jodek, a następnie wymienia się nazwę grupy organicznej.
10 0 l H H Br HBr chlorek metylu bromek propylu bromek izopropylu bromek -metyloetylu HH l chlorek izobutylu chlorek -metylopropylu Br H H I H H bromek tert-butylu bromek,-dimetyloetylu jodek benzylu jodek fenylometylu Br bromek sec-butylu bromek -metylopropylu 8. Alkohole 8 HYDRKSYPHDNE. Nazwy alkoholi można tworzyć według nomenklatury podstawnikowej dodając przyrostek ol do nazwy związku macierzystego. Grupa hydroksylowa (H) jest oznaczana niższym lokantem niż wiązanie wielokrotne (ma pierwszeństwo w nazwie). H HH H =HH H H HH H H H H butan--ol but--en--ol butano-,-diol H H H H H H H H H -fenyloetanol,-dimetylopropan--ol cykloheks--en--ol,-dimetylocyklopentan--ol. Nazwy grupowo-funkcyjne alkoholi składają się z dwóch słów: po pierwszym słowie alkohol wymienia się nazwę grupy (w formie przymiotnikowej) wywodzącej się ze związku macierzystego. H H alkohol izopropylowy *) *) nazwa "izopropanol" jest nieprawidłowa H H H H H H H HH H alkohol butylowy alkohol sec-butylowy alkohol izobutylowy
11 H H H H H =HH H alkohol tert-butylowy alkohol benzylowy alkohol allilowy. Utrzymane są następujące nazwy zwyczajowe: H =HH H alkohol allilowy HH H H glikol etylenowy HH H(H)H H glicerol (gliceryna). Jeśli w cząsteczce oprócz grupy hydroksylowej (H) jest inna grupa funkcyjna, która ma pierwszeństwo w nazwie, wówczas grupę hydroksylową określa się przedrostkiem hydroksy (traktuje się jak podstawnik). H HH -hydroksypentan--on 8. Fenole Utrzymane są nazwy zwyczajowe następujących aromatycznych związków hydroksylowych: H H H H N N fenol m-krezol (oraz izomery orto i para) -naftol ( -naftol) N (oraz izomer ) kwas pikrynowy 8. Grupy R i Ar Nazwy grup wywodzących się z hydroksyzwiązków nazywa się dodając do nazwy grupy R (Ar) przyrostek oksy. H H H pentyloksy H =HH alliloksy ( ) HH H izopentyloksy H H benzyloksy -naftyloksy Wyjątkami od powyższej reguły są następujące nazwy skrócone: metoksy H etoksy
12 H propoksy H H butoksy H fenoksy ( ) H izopropoksy ( ) HH izobutoksy H H( ) sec-butoksy ( ) tert-butoksy 8. Sole alkoholi i fenoli. Nazwy anionów alkoholanowych i fenolanowych tworzy się przez zamianę końcówki ol w nazwie związku macierzystego na końcówkę olan. Na metanolan sodu H Na fenolan sodu [( ) H] Al. tri(propan--olan) glinu. Alternatywne nazwy anionów alkoholanowych i fenolanowych tworzy się przez zamianę końcówki oksy w nazwie grupy R (Ar) na końcówkę oksylan. H H Na benzyloksylan sodu H Na etoksylan sodu H Na fenoksylan sodu [( ) H] Al triizopropoksylan glinu ( ) K tert-butoksylan potasu 9 ETERY. Etery acykliczne mają ogólny wzór R R, gdzie R i R są grupami alkilowymi lub arylowymi. Nazwy eterów można tworzyć stosując nomenklaturę podstawnikową lub grupowo-funkcyjną.. Nazwy podstawnikowe eterów tworzy się przez wymienienie nazwy grupy R (lub R ) przed nazwą węglowodoru odpowiadającego drugiej grupie R H (lub R H ). Wyboru grupy (R lub R ), która jest uznawana jako węglowodór, dokonuje się zgodnie z hierarchią ich starszeństwa. H H H -etoksypropan H H=H etoksyetylen H( )H -metoksy--metylopropan H metoksybenzen (anizol) -etoksy--metylocyklopentan. Nazwy grupowo-funkcyjne eterów tworzy się przez wymienienie po słowie eter nazw grup R i R w formie przymiotnikowej i w kolejności alfabetycznej, przy czym nazwy tych grup oddziela się łącznikiem (kreską). W przypadku eterów o budowie symetrycznej (R = R ) nazwę grupy poprzedza się przedrostkiem di-. H H eter dietylowy H H eter propylowo-metylowy H H eter etylowo-fenylowy H H eter difenylowy
13 eter cyklopentylowo-fenylowy. Etery cykliczne są to związki zawierające atom tlenu, który jest połączony z dwoma atomami łańcucha węglowego lub pierścienia.. ykliczne etery trójczłonowe nazywa się dołączając przedrostek epoksy do nazwy związku macierzystego. Można też traktować je jako związki heterocykliczne i nazywać w sposób właściwy dla danej klasy. H H epoksyetan lub tlenek etylenu H H,-epoksy--metylobutan lub -metylo-,-epoksybutan lh H H -chloro-,-epoksypropan lub (chlorometylo)epoksyetan Trójczłonowy pierścień z tlenem jako heteroatomem ma również nazwę oksiran. H H H H lh H H oksiran -etylo--metylooksiran -(chlorometylo)oksiran. Przykłady eterów cyklicznych o pierścieniach pięcioczłonowych i sześcioczłonowych. furan tetrahydrofuran (THF),-dioksan tetrahydropiran 0 ALDEHYDY. Związki zawierające grupę połączoną z atomem węgla mają ogólną nazwę aldehyd. H. Nazwy aldehydów acyklicznych (łańcuchowych) tworzy się przez dodanie przyrostka al. (dla monoaldehydu) lub dial (dla dialdehydu) do nazwy węglowodoru zawierającego tę samą (co aldehyd) liczbę atomów węgla (włączając atomy węgla grup aldehydowych). Grupa aldehydowa ma pierwszeństwo w nazwie przed grupami: =, H; numeracja dotycząca wiązań wielokrotnych i podstawników podlega ogólnym regułom.
14 H (H ) H H H H H metanal etanal butanal -metylopropanal H =HH H H H H H H H=H H H H H pent--enal pentanodial heks--enodial H. Nazwę aldehydu, w którym grupa aldehydowa jest połączona bezpośrednio z układem pierścieniowym (alifatycznym lub aromatycznym) tworzy się dodając przyrostek -karboaldehyd (lub dikarboaldehyd) do nazwy układu cyklicznego. H H H cykloheksanokarboaldehyd naftaleno-,-dikarboaldehyd. Grupę aldehydową jako podstawnik nazywa się dodając do nazwy układu macierzystego przedrostek formylo (lub metanoilo) H H kwas -formylocykloheksanokarboksylowy (grupa H ma pierwszeństwo w nazwie przed grupą H). prócz nazw systematycznych stosowane są nazwy zwyczajowe aldehydów (dla wielu aldehydów są one powszechnie stosowane); tworzy się je przez zastąpienie słowa kwas w nazwie zwyczajowej danego kwasu karboksylowego słowem aldehyd (a) lub przez zamianę końcówki -oil (lub yl) w nazwie grupy acylowej na przyrostek aldehyd (b). (Nazwy kwasów karboksylowych i grup acylowych zob. rozdz..). Przykłady HH a) aldehyd mrówkowy b) formaldehyd H a) aldehyd octowy b) acetaldehyd H H a) aldehyd propionowy b) propionoaldehyd H H H a) aldehyd masłowy b) butyroaldehyd ( ) HH a) aldehyd izomasłowy b) izobutyroaldehyd H H a) aldehyd benzoesowy b) benzaldehyd
15 H H=HH a) aldehyd cynamonowy KETNY. Związki zawierające grupę = (karbonylową) połączoną z dwoma atomami węgla mają ogólną nazwę keton.. Nazwy podstawnikowe ketonów tworzy się przez dodanie przyrostka on do nazwy macierzystego węglowodoru (acyklicznego lub cyklicznego) lub dion (dwie grupy ketonowe, itd.). Atom węgla z grupy karbonylowej oznacza się możliwie najniższym lokantem. (grupa = ma pierwszeństwo w nazwie przed grupami H i =). H H H H H H H butan--on pantan--on pentan--on heksano-,-dion H =HH H H HH H H pent--en--on -fenyl--hydroksyobutan--on -fenylobutan--on. Grupowo-funkcyjne nazwy ketonów acyklicznych o wzorze = tworzy się wymieniając nazwy grup R i R (w formie przymiotnikowej i w kolejności alfabetycznej) po słowie keton ; nazwy obu grup rozdziela się łącznikiem (kreską). R R H H H H H H keton metylowo-propylowy keton metylowo-(-metylopropylowy) keton dietylowy keton dicykloheksylowy keton cykloheksylowo-metylowy. Nazwy ketonów cyklicznych, w których grupa = stanowi człon pierścienia, tworzy się przez dodanie przyrostka on (lub dion, -trion, itd.) do nazwy układu cyklicznego. -metylocyklopentan--on cykloheks--en--on,-dimetylocykloheksano-.-dion
16 . Grupę karbonylową jako podstawnik nazywa się dodając do nazwy układu macierzystego przedrostek okso H H H H H H H kwas -oksopentanowy -oksoheksanal. Utrzymane są nazwy zwyczajowe następujących ketonów: aceton H acetofenon H H benzofenon H H propiofenon H H=H H chalkon KWASY KARBKSYLWE. Związki zawierające grupę H połączoną z atomem węgla mają ogólną nazwę kwas karboksylowy.. Nazwy kwasów karboksylowych wywodzących się od węglowodorów acyklicznych, w których krańcowe grupy zostały zastąpione grupami H, tworzy się przez dodanie przyrostka owy (jedna grupa H) lub diowy (dwie grupy H) do nazwy macierzystego węglowodoru oraz wymienienie słowa kwas na początku nazwy. H H H H H H kwas heptanowy HH H H H H H kwas heptanodiowy H=HH H H H kwas hept--enowy. Alternatywne nazwy kwasów można utworzyć dodając przyrostek karboksylowy do nazwy szkieletu węglowego, z którym połączona jest grupa H (lub dikarboksylowy, jeśli są dwie grupy H, itd.); numeracja atomów węgla nie obejmuje atomu węgla grupy H. Nazwy te są zawsze stosowane w przypadku układów cyklicznych. Natomiast dla acyklicznych kwasów mono- i dikarboksylowych zaleca się stosowanie nomenklatury omówionej w punkcie. Jedynie pochodne zawierające trzy i więcej grup H nazywa się stosując przyrostek trikarboksylowy, itd. H H kwas -metylocyklopentanokarboksylowy kwas cykloheks--enokarboksylowy H H H HHH H H kwas heksano-,,-trikarboksylowy H H kwas naftaleno-,,-trikarboksylowy
17 7. Zachowane zostały (i są zalecane) nazwy zwyczajowe następujących kwasów: HH kwas mrówkowy H kwas octowy H H kwas propionowy (H ) H kwas masłowy ( ) HH kwas izomasłowy H H kwas benzoesowy H =HH kwas akrylowy H H=HH kwas cynamonowy (izomer E) H H kwas szczawiowy HH H kwas malonowy HH H H kwas bursztynowy H H H H H = = H H H H H kwas ftalowy kwas maleinowy kwas fumarowy. Nazwy grup acylowych powstałych przez odjęcie H od grupy H wywodzi się z nazwy odpowiedniego kwasu: a) końcówkę owy zamienia się na oil (lub yl), gdy nazwa kwasu została utworzona według p., b) końcówkę karboksylowy zamienia się na karbonyl, gdy nazwa kwasu została utworzona zgodnie z p. ). W obu przypadkach pomija się słowo kwas. H H H H H H metanoil *) etanoil *) propanoil *) heksanoil *) zalecane są nazwy zwyczajowe (patrz p. ) cyklopentanokarbonyl. Nazwy grup acylowych wywodzących się od nazw zwyczajowych kwasów karboksylowych: H H H H ( ) H formyl acetyl propionyl butyryl izobutyryl
18 8 benzoil o-toluoil -naftoil ftaloil H H sukcynyl (od kwasu bursztynowego) PHDNE KWASÓW KARBKSYLWYH. Halogenki acylowe Pochodne kwasów karboksylowych, w których grupa hydroksylowa jest zastąpiona fluorowcem (najczęściej jest to chlor) nazywa się podając nazwę fluorowca (np. chlorek) przed nazwą grupy acylowej (patrz poprzedni podrozdział). l chlorek acetylu (chlorek etanoilu) H l chlorek propionylu (chlorek propanoilu) H H bromek butyrylu (bromek butanoliu) Br l l l l chlorek benzoilu chlorek cyklopentanokarbonylu chlorek ftaloilu. Bezwodniki kwasowe. Symetryczne bezwodniki kwasów karboksylowych nazywa się zastępując słowo kwas słowem bezwodnik.
19 9 H H bezwodnik octowy (bezwodnik etanowy) bezwodnik propionowy (bezwodnik propanowy) bezwodnik cykloheksanokarboksylowy. Bezwodniki mieszane (zbudowane z reszt dwóch różnych kwasów monokarboksylowych) nazywa się wymieniając po słowie bezwodnik nazwy kwasów w kolejności alfabetycznej i oddzielając je łącznikiem. H bezwodnik octowo-propionowy H bezwodnik benzoesowo-octowy. Bezwodniki cykliczne kwasów dikarboksylowych nazywa się tak samo, jak bezwodniki kwasów acyklicznych (lub jako układy heterocykliczne). H H bezwodnik bursztynowy bezwodnik ftalowy. Sole i estry kwasów karboksylowych. bojętne sole kwasów karboksylowych nazywa się wymieniając nazwę anionu karboksylanowego oraz nazwę kationu. Nazwy anionów powstałych po odjęciu protonu od grupy H tworzy się zamieniając w nazwie kwasu końcówkę -owy na końcówkę -an (lub -ian (po literze n). Wyjątkami są: mrówczan (H ) i maślan ( H 7 ). (H ) K heptanian potasu Na octan sodu HNa mrówczan sodu H K benzoesan potasu H H=HNa cynamonian sodu ( ) a dioctan wapnia. bojętne estry kwasów karboksylowych nazywa w ten sam sposób, jak odpowiadające im sole z tym, że zamiast nazwy kationu wymienia się nazwę grupy alkilowej, arylowej, itd., z która połączona jest z atomem tlenu grupy karboksylowej. H H mrówczan etylu (metanian etylu) octan metylu (etanian metylu) H H propionian etylu (propanian etylu) H H H( ) maślan izopropylu (butanian -metyloetylu) H H H H H walerianian propylu (pentanian propylu) H H benzoesan fenylu
20 0 H ( H ) malonian dietylu cyklopentanokarboksylan metylu. Amidy kwasowe. Nazwy monoacylowych pochodnych amoniaku o ogólnej budowie RNH tworzy się: a) zmieniając przyrostek oil lub yl w nazwie (zwyczajowej lub systematycznej) acyklicznej grupy acylowej na przyrostek -amid lub b) zmieniając przyrostek karboksylowy w nazwie kwasu na przyrostek karboksyamid. H NH NH H H H H NH H formamid acetamid heksanoamid benzamid H NH cykloheksanokarboksyamid. N-Podstawione amidy nazywa się : a) wymieniając na początku nazwy amidu nazwy podstawników, b) traktując grupę acylową jako N-podstawnik odpowiedniej aminy. NH N( ) a) N,N-dimetyloacetamid b) N-acetylodimetyloamina NH H N-fenyloacetamid N-acetyloanilina (acetanilid) H NH N-metylobenzamid N-benzoilometyloamina H N( ) H N H a) N,N-dimetylobenzamid b) N-benzoilodimetyloamina N-fenylo-N-metylobenzamid N-benzoilo-N-metyloanilina. ykliczne imidy ( pochodne kwasów dikarboksylowych): ftalimid NH H NH H sukcynoimid
21 AMINY gólna nazwa aminy obejmuje związki o budowie RNH, RR NH i RR R N, które klasyfikuje się jako odpowiednio pierwszorzędowe, drugorzędowe i trzeciorzędowe. Aminy pierwszorzędowe. Nazwy pierwszorzędowych amin tworzy się dodając przyrostek amina : a) do nazwy grupy R (alkilowej, arylowej, itd.) lub b) do nazwy macierzystego układu RH. Metoda a) jest częściej stosowana; metoda b) jest stosowana w przypadku diamin. HNH H NH H HNH etyloamina -metylopropyloamina sec-butyloamina -metyloetyloamina izopropyloamina NH H H NH NH NH,-dimetyloetyloamina tert-butyloamina benzyloamina cykloheksyloamina -naftyloamina NH NH HH H H heksano-,-diamina. Zachowuje się nazwy zwyczajowe następujących amin aromatycznych: NH NH NH anilina m-toluidyna (oraz izomery orto i para) o-anizydyna (oraz izomery meta i para). Aminy drugo- i trzeciorzędowe. Nazwy symetrycznych amin drugorzędowych i trzeciorzędowych tworzy się dodając przed nazwą grupy przedrostek di lub tri. ( ) NH dimetyloamina ( H H ) NH dipropyloamina ( H ) N trietyloamina ( H H ) NH dibenzyloamina. Niesymetryczne drugorzędowe i trzeciorzędowe aminy nazywa się jako N-podstawione (lub N,N-dwupodstawione) pochodne amin pierwszorzędowych. Jako podstawę nazwy
22 macierzystej aminy wybiera się najbardziej złożoną spośród grup związanych z atomem azotu. H H H N( ) N,N-dimetylobutyloamina N H H HN N-etylo-N-metyloanilina N,N-dimetylo-(-metyloetylo)amina. W przypadku, gdy grupy aminowe nie są grupami głównymi (są podstawnikami), nazywa się je przy pomocy przedrostków: grupa NH amino-, grupa NHR alkiloamino-, grupa N(R) dialkiloamino-. H N( ) kwas p-dimetyloaminobenzoesowy. Sole amoniowe (aminiowe). Sole i wodorotlenki zawierające czterowiązalny atom azotu R N + X, w których R oznacza takie same lub różne grupy, nazywa się dodając do wymienionych alfabetycznie nazw podstawników związanych z atomem azotu przyrostek amoniowy i podając na początku nazwę anionu (jako oddzielne słowo). [ H H N( ) ] + H wodorotlenek benzylotrimetyloamoniowy [( ) N] + I jodek tetrametyloamoniowy [( H ) NH ] + l chlorek dietyloamoniowy. W przypadkach, gdy nazwa aminy nie kończy się na amina, czwartorzędowy charakter związku określa się dodając do nazwy tej zasady końcówkę iowy (z pominięciem końcowej litery a (jeśli ta samogłoska jest na końcu aminy) i podając na początku nazwę anionu. [ H NH ] + l chlorek aniliniowy [ H NH ( )] + Br bromek N-metyloaniliniowy N H l chlorek pirydyniowy ZWIĄZKI AZWE I SLE DIAZNIWE (wg hemical Abstracts). Związki monoazowe mają wzór ogólny R N=N R. Związki z grupą azową N=N połączoną z grupami pochodzącymi od związków, które w przypadku braku podstawników są identyczne, nazywa się dodając przedrostek azo do nazwy niepodstawionego związku macierzystego (RH). Nazwy podstawników określa się za pomocą przedrostków. Składnikowi zawierającemu mniejszą liczbę podstawników nadaje się lokanty ze wskaźnikami górnymi ( primami ). Jeśli liczba podstawników w obu składnikach jest jednakowa, wówczas primuje się układ z wyższymi lokantami. Grupa azowa ma pierwszeństwo przy wyborze możliwie najniższego lokantu.
23 Sposób ten stosuje się w przypadku nieobecności podstawników, których nazwy podaje się jako przyrostki. Przykłady: N=N l,,,, N=N l azobenzen,,,`-dichloroazobenzen,, N=N,, N( ) l,, -chloro-`-dimetyloaminoazobenzen. Dla innych związków monoazowych R N=N R, pochodzących od związków, które w przypadku braku podstawników są identyczne, jako związek macierzysty obiera się ten związek RH, który zawiera grupę wymienianą w nazwie w postaci przyrostka i nazywa się go jako układ podstawiony przez wszystkie inne grupy. R w układzie RN=N traktowanym jako podstawnik nazywa się jako grupę arylową. H N=N H S H-p kwas p-fenyloazobenzenosulfonowy H N=N S H kwas p-(-metylo-fenyloazo)benzenosulfonowy H N=N N( ) -(-dimetyloamino-fenyloazo)-fenol. Związki RN + X nazywa się dodając przyrostek diazoniowy do nazwy związku macierzystego RH; całość nazwy uzupełnia się podając nazwę anionu X umieszczoną na początku jako osobne słowo. H N l N BF chlorek benzenodiazoniowy tetrafluoroboran 8-hydroksynaftaleno--diazoniowy
24 N HS N wodorosiarczan p-nitrobenzenodiazoniowy
AMINY. nikotyna. tytoń szlachetny. pseudoefedryna (SUDAFED) atropina. muskaryna H 3 C CH 3 O
 AMINY nikotyna H 3 C NH tytoń szlachetny OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN 2 NUKLEOFILOWOŚĆ i ZASADOWOŚĆ AMIN 3 REAKCJA AMIN Z KWASAMI MINERALNYMI I KARBOKSYLOWYMI
AMINY nikotyna H 3 C NH tytoń szlachetny OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN 2 NUKLEOFILOWOŚĆ i ZASADOWOŚĆ AMIN 3 REAKCJA AMIN Z KWASAMI MINERALNYMI I KARBOKSYLOWYMI
Elementy chemii organicznej
 Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
3. Wprowadzenie do nazewnictwa związków organicznych
 3. Wprowadzenie do nazewnictwa związków organicznych 1 3.1. omologia i izomeria konstytucyjna omologi związki z tej samej klasy, każdy związek różni się od swego poprzednika o jedną grupę metylenową (C
3. Wprowadzenie do nazewnictwa związków organicznych 1 3.1. omologia i izomeria konstytucyjna omologi związki z tej samej klasy, każdy związek różni się od swego poprzednika o jedną grupę metylenową (C
NOMENKLATURA ZWIĄZKÓW ORGANICZNYCH
 MEKLATURA ZWIĄZKÓW RGAIZY AZEWITW ALKAÓW Tabela. azwy alkanów prostych o danej liczbie atomów węgla. Liczba atomów węgla metan etan propan butan pentan 6 heksan 7 heptan 8 oktan 9 nonan 0 dekan undekan
MEKLATURA ZWIĄZKÓW RGAIZY AZEWITW ALKAÓW Tabela. azwy alkanów prostych o danej liczbie atomów węgla. Liczba atomów węgla metan etan propan butan pentan 6 heksan 7 heptan 8 oktan 9 nonan 0 dekan undekan
B I O T E. p e n t a n d e k a n
 CnHn+ Węglowodory o łańcuchu prostym: B I O T E C H N O L EMIA O G ORGANICZNA I A Nomenklatura n nazwa n nazwa n nazwa n nazwa metan dodekan 9 nonakozan 90 NONAKONTAN etan tridekan 0 TRIAKONTAN 00 H E
CnHn+ Węglowodory o łańcuchu prostym: B I O T E C H N O L EMIA O G ORGANICZNA I A Nomenklatura n nazwa n nazwa n nazwa n nazwa metan dodekan 9 nonakozan 90 NONAKONTAN etan tridekan 0 TRIAKONTAN 00 H E
AMINY. tytoń szlachetny. nikotyna. pseudoefedryna (SUDAFED) atropina. muskaryna H 3 C CH 3 O
 AMINY tytoń szlachetny H 3 C NH nikotyna OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN amoniak amina 1 amina 2 amina 3 HYBRYDYZACJA ATOMU AZOTU I TETRAEDRYCZNA BUDOWA
AMINY tytoń szlachetny H 3 C NH nikotyna OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN amoniak amina 1 amina 2 amina 3 HYBRYDYZACJA ATOMU AZOTU I TETRAEDRYCZNA BUDOWA
Materiały do zajęć dokształcających z chemii organicznej
 hemia Warta Poznania - nowa JAKOŚĆ studiowania -zwiększenie liczby absolwentów oraz atrakcyjności studiów na kierunku EMIA na Uniwersytecie im. A. Mickiewicza w Poznaniu Materiały do zajęć dokształcających
hemia Warta Poznania - nowa JAKOŚĆ studiowania -zwiększenie liczby absolwentów oraz atrakcyjności studiów na kierunku EMIA na Uniwersytecie im. A. Mickiewicza w Poznaniu Materiały do zajęć dokształcających
wzory skrócone Kwasy aromatyczne grupa arylowa połączona z grupą karboksylową. kwas benzoesowy
 KWASY KARBKSYLWE wzór ogólny wzory skrócone grupa karboksylowa Kwasy alifatyczne grupa alkilowa połączona z grupą karboksylową kwas propionowy kwas mrówkowy Kwasy aromatyczne grupa arylowa połączona z
KWASY KARBKSYLWE wzór ogólny wzory skrócone grupa karboksylowa Kwasy alifatyczne grupa alkilowa połączona z grupą karboksylową kwas propionowy kwas mrówkowy Kwasy aromatyczne grupa arylowa połączona z
NOMENKLATURA ZWIĄZKÓW ORGANICZNYCH
 Zakład hemii rganicznej UMB Materiał omenklatura związków organicznych Farmacja 0 MEKLATURA ZWIĄZKÓW RGAIZY ALKAY Tabela. azwy alkanów prostych o danej liczbie atomów węgla. Liczba atomów azwa węglowodoru
Zakład hemii rganicznej UMB Materiał omenklatura związków organicznych Farmacja 0 MEKLATURA ZWIĄZKÓW RGAIZY ALKAY Tabela. azwy alkanów prostych o danej liczbie atomów węgla. Liczba atomów azwa węglowodoru
pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 )
 FLUOROWCOPOCODNE alogenki alkilowe- Cl C 2 -C 2 -C 2 -C 3 C 3 -C-C 3 C 2 -C-C 3 pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 ) I C 3 C 3 Cl-C 2 -C=C 2 Cl-C-C=C 2 1 2 3 Allilowe atom fluorowca
FLUOROWCOPOCODNE alogenki alkilowe- Cl C 2 -C 2 -C 2 -C 3 C 3 -C-C 3 C 2 -C-C 3 pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 ) I C 3 C 3 Cl-C 2 -C=C 2 Cl-C-C=C 2 1 2 3 Allilowe atom fluorowca
węglowodory łańcuchowe lub cykliczne posiadające dwa wiązania podwójne C=C KLASYFIKACJA DIENY SKUMULOWANE alleny (kumuleny)
 DIENY węglowodory łańcuchowe lub cykliczne posiadające dwa wiązania podwójne C=C KLASYFIKACJA DIENY SKUMULOWANE alleny (kumuleny) 2 C C C 2 2 C C C C C 3 propa-1,2-dien penta-1,2,3-trien DIENY IZOLOWANE
DIENY węglowodory łańcuchowe lub cykliczne posiadające dwa wiązania podwójne C=C KLASYFIKACJA DIENY SKUMULOWANE alleny (kumuleny) 2 C C C 2 2 C C C C C 3 propa-1,2-dien penta-1,2,3-trien DIENY IZOLOWANE
ZASADY SYSTEMATYCZNEGO NAZEWNICTWA ZWIĄZKÓW ORGANICZNYCH część I. WĘGLOWODORY. 1. ALKANY i CYKLOALKANY
 ZASADY SYSTEMATYZNEG NAZEWNITWA ZWIĄZKÓW RGANIZNY część I. WĘGLWDRY 1. ALKANY i YKLALKANY Nazwy łańcuchów węglowych 1-20 : 1 - metan 6 - heksan 11 - undekan 16 - heksadekan 2 - etan 7 - heptan 12 - dodekan
ZASADY SYSTEMATYZNEG NAZEWNITWA ZWIĄZKÓW RGANIZNY część I. WĘGLWDRY 1. ALKANY i YKLALKANY Nazwy łańcuchów węglowych 1-20 : 1 - metan 6 - heksan 11 - undekan 16 - heksadekan 2 - etan 7 - heptan 12 - dodekan
4-6. Wprowadzenie do nazewnictwa związków organicznych
 4-6. Wprowadzenie do nazewnictwa związków organicznych 1 3.1. omologia i izomeria konstytucyjna omologi związki z tej samej klasy, każdy związek różni się od swego poprzednika o jedną grupę metylenową
4-6. Wprowadzenie do nazewnictwa związków organicznych 1 3.1. omologia i izomeria konstytucyjna omologi związki z tej samej klasy, każdy związek różni się od swego poprzednika o jedną grupę metylenową
Klasyfikacja i przykłady ETERY
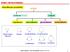 ETERY I EPKSYZWIĄZKI Klasyfikacja i przykłady ETERY acykliczne R--R cykliczne trójczłonowe czteroczłonowe pięcioczłonowe sześcioczłonowe tlenek etylenu (oksiran) oksetan tetrahydrofuran tetrahydropiran
ETERY I EPKSYZWIĄZKI Klasyfikacja i przykłady ETERY acykliczne R--R cykliczne trójczłonowe czteroczłonowe pięcioczłonowe sześcioczłonowe tlenek etylenu (oksiran) oksetan tetrahydrofuran tetrahydropiran
-pinen (składnik terpentyny)
 ALKENY (OLEFINY) WZÓR SUMARYZNY n 2n - alkeny łańcuchowe; n 2n-2 - alkeny cykliczne (cykloalkeny) etylen (produkcja polietylenu) WŁAŚIWOŚI FIZYZNE -pinen (składnik terpentyny) cis-trikoz-9-en (hormon płciowy
ALKENY (OLEFINY) WZÓR SUMARYZNY n 2n - alkeny łańcuchowe; n 2n-2 - alkeny cykliczne (cykloalkeny) etylen (produkcja polietylenu) WŁAŚIWOŚI FIZYZNE -pinen (składnik terpentyny) cis-trikoz-9-en (hormon płciowy
ZASADY SYSTEMATYCZNEGO NAZEWNICTWA ZWIĄZKÓW ORGANICZNYCH CZĘŚĆ I. WĘGLOWODORY 1. ALKANY I CYKLOALKANY
 ZASADY SYSTEMATYZEG AZEWITWA ZWIĄZKÓW GAIZY 1. ALKAY I YKLALKAY ZĘŚĆ I. WĘGLWDY azwy łańcuchów węglowych 1-20 : 1 - metan 6 - heksan 11 - undekan 16 - heksadekan 2 - etan 7 - heptan 12 - dodekan 17 - heptadekan
ZASADY SYSTEMATYZEG AZEWITWA ZWIĄZKÓW GAIZY 1. ALKAY I YKLALKAY ZĘŚĆ I. WĘGLWDY azwy łańcuchów węglowych 1-20 : 1 - metan 6 - heksan 11 - undekan 16 - heksadekan 2 - etan 7 - heptan 12 - dodekan 17 - heptadekan
Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO:
 FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
δ + δ - δ + R O H RJC R δ + δ - δ - δ + R O R Grupy Funkcyjne δ + O NH 2 R N H H R N Slides 1 to 41
 1 δ + δ + δ + R R X Grupy Funkcyjne δ + δ + R R R δ + R δ + X δ + R N R δ + R δ + R R δ + R δ + N 2 R δ + R N δ + δ + Slides 1 to 41 2 Grupy Funkcyjne Zawierające eteroatomy Grupy funkcyjne mają często
1 δ + δ + δ + R R X Grupy Funkcyjne δ + δ + R R R δ + R δ + X δ + R N R δ + R δ + R R δ + R δ + N 2 R δ + R N δ + δ + Slides 1 to 41 2 Grupy Funkcyjne Zawierające eteroatomy Grupy funkcyjne mają często
Grupa karbonylowa. Grupa karbonylowa to grupa funkcyjna, w której atom tlenu połączony jest z atomem węgla podwójnym wiązaniem
 ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
Stałe siłowe. Spektroskopia w podczerwieni. Spektrofotometria w podczerwieni otrzymywanie widm
 Spektroskopia w podczerwieni Spektrofotometria w podczerwieni otrzymywanie widm absorpcyjnych substancji o różnych stanach skupienia. Powiązanie widm ze strukturą pozwala na identyfikację związku. Widmo
Spektroskopia w podczerwieni Spektrofotometria w podczerwieni otrzymywanie widm absorpcyjnych substancji o różnych stanach skupienia. Powiązanie widm ze strukturą pozwala na identyfikację związku. Widmo
H H H. Wzór "płaskostrukturalny": Wzór klinowy: H H. Model kulkowy cząsteczki: (obrazuje długosci wiązań, kąty między wiązaniami)
 Autor: Marek Walnik, 04 Alkany - węglowodory nasycone, parafiny. Związki węgla z wodorem, w których cząsteczkach występują wyłącznie wiązania pojedyncze. Szczególną klasę związków tego typu stanowią cykloalkany
Autor: Marek Walnik, 04 Alkany - węglowodory nasycone, parafiny. Związki węgla z wodorem, w których cząsteczkach występują wyłącznie wiązania pojedyncze. Szczególną klasę związków tego typu stanowią cykloalkany
CHEMIA ORGANICZNA. dr hab. Włodzimierz Gałęzowski Wydział Chemii UAM (61)
 EMIA ORGANIZNA dr hab. Włodzimierz Gałęzowski Wydział hemii UAM (61) 829 1477 wlodgal@amu.edu.pl Materiał wymagany na egzaminie: wykłady ćwiczenia szkoła średnia http://staff.amu.edu.pl/~wlodgal Podręczniki
EMIA ORGANIZNA dr hab. Włodzimierz Gałęzowski Wydział hemii UAM (61) 829 1477 wlodgal@amu.edu.pl Materiał wymagany na egzaminie: wykłady ćwiczenia szkoła średnia http://staff.amu.edu.pl/~wlodgal Podręczniki
Reakcje kwasów karboksylowych i ich pochodnych
 27-29. eakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór N grupa karbonylowa atom (, N lub Cl) o większej
27-29. eakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór N grupa karbonylowa atom (, N lub Cl) o większej
14. Reakcje kwasów karboksylowych i ich pochodnych
 14. Reakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór R N R R grupa karbonylowa atom (, N lub Cl) o
14. Reakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór R N R R grupa karbonylowa atom (, N lub Cl) o
Spis treści 1. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2001 2 2. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2002 7
 Spis treści 1. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2001 2 2. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2002 7 3. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2003 13 4. MIELEC - DANE ZA ROK 2001 19 5. MIELEC
Spis treści 1. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2001 2 2. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2002 7 3. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2003 13 4. MIELEC - DANE ZA ROK 2001 19 5. MIELEC
ALDEHYDY związki zawierające grupę formylową ( atomem węgla. KETONY związki zawierające grupę karbonylową ( dwoma atomami węgla.
 ALDEHYDY I KETNY ALDEHYDY związki zawierające grupę formylową ( atomem węgla. C H ) połączoną z KETNY związki zawierające grupę karbonylową ( dwoma atomami węgla. C ) połączoną z NMENKLATURA ALDEHYDÓW
ALDEHYDY I KETNY ALDEHYDY związki zawierające grupę formylową ( atomem węgla. C H ) połączoną z KETNY związki zawierające grupę karbonylową ( dwoma atomami węgla. C ) połączoną z NMENKLATURA ALDEHYDÓW
Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup
 Cz. XXV - Kwasy karboksylowe Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup karboksylowych - CH ( - C - H ), atom C w grupie funkcyjnej jest na hybrydyzacji sp 2,
Cz. XXV - Kwasy karboksylowe Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup karboksylowych - CH ( - C - H ), atom C w grupie funkcyjnej jest na hybrydyzacji sp 2,
Alkeny. Wzór ogólny alkenów C n H 2n. (Uwaga identyczny wzór ogólny mają cykloakany!!!)
 Alkeny Wzór ogólny alkenów n 2n (Uwaga identyczny wzór ogólny mają cykloakany!!!) Węglowodory nienasycone, zawierające wiązanie podwójne, hybrydyzacja atomow węgla biorących udział w tworzeniu wiązania
Alkeny Wzór ogólny alkenów n 2n (Uwaga identyczny wzór ogólny mają cykloakany!!!) Węglowodory nienasycone, zawierające wiązanie podwójne, hybrydyzacja atomow węgla biorących udział w tworzeniu wiązania
Nazewnictwo Związków Organicznych
 I. Nazewnictwo Związków rganicznych 1 Nazewnictwo Związków rganicznych I. Nazewnictwo Związków rganicznych 2 I. Nomenklatura węglowodorów 1. Nazewnictwo węglowodorów nasyconych Węglowodory nasycone acykliczne
I. Nazewnictwo Związków rganicznych 1 Nazewnictwo Związków rganicznych I. Nazewnictwo Związków rganicznych 2 I. Nomenklatura węglowodorów 1. Nazewnictwo węglowodorów nasyconych Węglowodory nasycone acykliczne
Kwasy karboksylowe grupa funkcyjna: -COOH. Wykład 8 1
 Kwasy karboksylowe grupa funkcyjna: -CH Wykład 8 1 1. Reakcje utleniania a) utlenianie alkoholi pierwszorzędowych trzymywanie kwasów CH 3 H 3 C C CH 2 H CH 3 alkohol pierwszorzędowy CH K 2 Cr 2 3 7 H 3
Kwasy karboksylowe grupa funkcyjna: -CH Wykład 8 1 1. Reakcje utleniania a) utlenianie alkoholi pierwszorzędowych trzymywanie kwasów CH 3 H 3 C C CH 2 H CH 3 alkohol pierwszorzędowy CH K 2 Cr 2 3 7 H 3
Alkany. Alkeny. Alkiny
 Węglowodory Alkany Alkeny Alkiny Spis treści: Podział węglowodorów. Porównanie Alkany: budowa cząsteczki, szereg homologiczny, konformacje i izomeria, nazewnictwo, właściwości fizyczne, właściwości chemiczne.
Węglowodory Alkany Alkeny Alkiny Spis treści: Podział węglowodorów. Porównanie Alkany: budowa cząsteczki, szereg homologiczny, konformacje i izomeria, nazewnictwo, właściwości fizyczne, właściwości chemiczne.
WĘGLOWODORY AROMATYCZNE
 WĘGLOWODORY AROMATYCZNE cykliczne węglowodory spełniające warunki aromatyczności: Ale: związki niearomatyczne 1 ZWIĄZKI AROMATYCZNE - przykłady 2 NOMENKLATURA Monocykliczne węglowodory aromatyczne są nazywane
WĘGLOWODORY AROMATYCZNE cykliczne węglowodory spełniające warunki aromatyczności: Ale: związki niearomatyczne 1 ZWIĄZKI AROMATYCZNE - przykłady 2 NOMENKLATURA Monocykliczne węglowodory aromatyczne są nazywane
CHEMIA ORGANICZA - węglowodory. Podział węglowodorów
 EMIA ORGANIZA - węglowodory Podział węglowodorów Najprostsze związki organiczne Alkany są to węglowodory nasycone, w których występują tylko pojedyncze wiązania węgiel węgiel Wszystkie nazwy alkanów charakteryzuje
EMIA ORGANIZA - węglowodory Podział węglowodorów Najprostsze związki organiczne Alkany są to węglowodory nasycone, w których występują tylko pojedyncze wiązania węgiel węgiel Wszystkie nazwy alkanów charakteryzuje
A B C D A B C 4. D A B C D
 1. Kartkówka, 21 października 2015; zestaw Imię i azwisko: Zad. 1. (1 p) Wśród podanych związków,, i D, wszystkie atomy węgla występują w tym samym stanie hybrydyzacji w związkach: i i D 3. i 4. i D Zad.
1. Kartkówka, 21 października 2015; zestaw Imię i azwisko: Zad. 1. (1 p) Wśród podanych związków,, i D, wszystkie atomy węgla występują w tym samym stanie hybrydyzacji w związkach: i i D 3. i 4. i D Zad.
RJC # Defin i i n c i ja
 Alkany - Izomery Strukturalne & Konformacyjne - Nomenklatura - Projekcje Newmana Slides 1 to 41 Definicja Wzór ogólny dla alkanów C n 2n+2 Przykładowo... metan C 4 etan C 2 6 propan C 3 8 butan C 4 10
Alkany - Izomery Strukturalne & Konformacyjne - Nomenklatura - Projekcje Newmana Slides 1 to 41 Definicja Wzór ogólny dla alkanów C n 2n+2 Przykładowo... metan C 4 etan C 2 6 propan C 3 8 butan C 4 10
Rodzaje wiązań chemicznych
 Rodzaje wiązań chemicznych Teoria Lewisa (1916) atomy łączą się ze sobą przez przeniesienie (1 lub więcej) elektronów z jednego atomu na drugi wiązanie jonowe lub przez uwspólnienie par elektronowych aby
Rodzaje wiązań chemicznych Teoria Lewisa (1916) atomy łączą się ze sobą przez przeniesienie (1 lub więcej) elektronów z jednego atomu na drugi wiązanie jonowe lub przez uwspólnienie par elektronowych aby
Spis treści 1. Struktura elektronowa związków organicznych 2. Budowa przestrzenna cząsteczek związków organicznych
 Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Węglowodory aromatyczne (areny) to płaskie cykliczne związki węgla i wodoru. Areny. skondensowane liniowo. skondensowane kątowo
 Spis treści Podstawowe pojęcia Właściwości chemiczne benzenu Wielopierścieniowe węglowodory aromatyczne Homologi benzenu Nazewnictwo związków aromatycznych Występowanie i otrzymywanie arenów Węglowodory
Spis treści Podstawowe pojęcia Właściwości chemiczne benzenu Wielopierścieniowe węglowodory aromatyczne Homologi benzenu Nazewnictwo związków aromatycznych Występowanie i otrzymywanie arenów Węglowodory
Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego. ĆWICZENIE 6 i 7. Aminy i amidy kwasowe
 ĆWICZENIE 6 i 7 Aminy i amidy kwasowe Do amin zaliczamy związki organiczne, których wzór można wyprowadzić ze wzoru amoniaku przez podstawienie w nim atomu lub atomów wodoru grupą lub grupami alkilowymi
ĆWICZENIE 6 i 7 Aminy i amidy kwasowe Do amin zaliczamy związki organiczne, których wzór można wyprowadzić ze wzoru amoniaku przez podstawienie w nim atomu lub atomów wodoru grupą lub grupami alkilowymi
trzeciorzędowe (3 ) (CH 3 ) 3 COH tert-butanol
 ALKOLE I FENOLE ALKOLE - KLASYFIKACJA pierwszorzędowe (1 ) drugorzędowe (2 ) trzeciorzędowe (3 ) allilowe benzylowe CH 2 etanol ( ) 2 CH alkohol izopropylowy ( ) 3 C tert-butanol CH 2 =CHCH 2 alkohol allilowy
ALKOLE I FENOLE ALKOLE - KLASYFIKACJA pierwszorzędowe (1 ) drugorzędowe (2 ) trzeciorzędowe (3 ) allilowe benzylowe CH 2 etanol ( ) 2 CH alkohol izopropylowy ( ) 3 C tert-butanol CH 2 =CHCH 2 alkohol allilowy
STRUKTURA określa w jaki sposób poszczególne atomy połączone są w cząsteczce
 Jakie zagadnienia będą poruszane podczas zgłębiania chemii związków węgla, czyli chemii organicznej? STRUKTURA określa w jaki sposób poszczególne atomy połączone są w cząsteczce MEANIZM - w jaki sposób
Jakie zagadnienia będą poruszane podczas zgłębiania chemii związków węgla, czyli chemii organicznej? STRUKTURA określa w jaki sposób poszczególne atomy połączone są w cząsteczce MEANIZM - w jaki sposób
węglowodory posiadające wiązanie podwójne (p) C=C a-pinen (składnik terpentyny)
 ALKENY (OLEFINY) węglowodory posiadające wiązanie podwójne (p) = WZÓR SUMARYZNY n 2n - alkeny łańcuchowe; n 2n-2 - alkeny cykliczne (cykloalkeny) etylen (produkcja polietylenu) a-pinen (składnik terpentyny)
ALKENY (OLEFINY) węglowodory posiadające wiązanie podwójne (p) = WZÓR SUMARYZNY n 2n - alkeny łańcuchowe; n 2n-2 - alkeny cykliczne (cykloalkeny) etylen (produkcja polietylenu) a-pinen (składnik terpentyny)
CHEMIA ORGANICZNA. Zakres materiału
 EMIA ORGANIZNA Zakres materiału lp wykład data temat 1 W1-W2 7.10.2015 klasy zw org alkany i cykloalkany 2 W3-W4 14.10.2015 stereoizomeria 3 W5-W6 21.10.2015 alkeny i cykloalkeny 4 W7-W8 28.10.2015 alkadieny
EMIA ORGANIZNA Zakres materiału lp wykład data temat 1 W1-W2 7.10.2015 klasy zw org alkany i cykloalkany 2 W3-W4 14.10.2015 stereoizomeria 3 W5-W6 21.10.2015 alkeny i cykloalkeny 4 W7-W8 28.10.2015 alkadieny
Chemia organiczna to chemia związków węgla.
 Chemia organiczna to chemia związków węgla. Do tej pory wyizolowano lub zsyntetyzowano kilkanaście milionów związków organicznych. Na dużą różnorodność chemii organicznej mają wpływ: średnia elektroujemność
Chemia organiczna to chemia związków węgla. Do tej pory wyizolowano lub zsyntetyzowano kilkanaście milionów związków organicznych. Na dużą różnorodność chemii organicznej mają wpływ: średnia elektroujemność
Zdzisław Głowacki. Zakres podstawowy i rozszerzony. Odpowiedzi i rozwiązania zadań. Rozdział 2. Strona Linia zadanie Jest Powinno być
 Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 2 Errata do drugiego rozdziału ćwiczeń: Strona Linia zadanie Jest Powinno być Str. 52 Zadanie
Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 2 Errata do drugiego rozdziału ćwiczeń: Strona Linia zadanie Jest Powinno być Str. 52 Zadanie
Pochodne węglowodorów, w cząsteczkach których jeden atom H jest zastąpiony grupą hydroksylową (- OH ).
 Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Zarys Chemii Organicznej
 Zarys hemii Organicznej hemię organiczną definiuje się jako chemię związków węgla. Ogólna liczba znanych związków organicznych przekracza obecnie 18 milionów i wielokrotnie przewyższa liczbę znanych związków
Zarys hemii Organicznej hemię organiczną definiuje się jako chemię związków węgla. Ogólna liczba znanych związków organicznych przekracza obecnie 18 milionów i wielokrotnie przewyższa liczbę znanych związków
Biotechnologia sem. II. Rok akademicki 2012/2013. Ćwiczenia tablicowe z chemii organicznej. Zestaw nr 1
 I. Nazewnictwo systematyczne w skrócie: Biotechnologia sem. II Rok akademicki 2012/2013 Ćwiczenia tablicowe z chemii organicznej Zestaw nr 1 Nazwa związku organicznego składa się z prefiksów (przedrostków),
I. Nazewnictwo systematyczne w skrócie: Biotechnologia sem. II Rok akademicki 2012/2013 Ćwiczenia tablicowe z chemii organicznej Zestaw nr 1 Nazwa związku organicznego składa się z prefiksów (przedrostków),
Cząsteczki wieloatomowe - hybrydyzacja. Czy w oparciu o koncepcję orbitali molekularnych można wytłumaczyć budowę cząsteczek?
 ząsteczki wieloatomowe - hybrydyzacja zy w oparciu o koncepcję orbitali molekularnych można wytłumaczyć budowę cząsteczek? Koncepcja OA OA O zdelokalizowane OA hyb OA O zlokalizowane OA hyb OA hyb OA orbitale
ząsteczki wieloatomowe - hybrydyzacja zy w oparciu o koncepcję orbitali molekularnych można wytłumaczyć budowę cząsteczek? Koncepcja OA OA O zdelokalizowane OA hyb OA O zlokalizowane OA hyb OA hyb OA orbitale
17. CH 2 CH CH 2 C CH 18. CH
 1. NAZEWNICTW ZWIĄZKÓW RGANICZNY węglowodory nasycone: alkany, cykloalkany węglowodory nienasycone: alkeny, alkiny, cykloalkeny Podać nazwy systematyczne następujących węglowodorów, uwzględnić izomerię:
1. NAZEWNICTW ZWIĄZKÓW RGANICZNY węglowodory nasycone: alkany, cykloalkany węglowodory nienasycone: alkeny, alkiny, cykloalkeny Podać nazwy systematyczne następujących węglowodorów, uwzględnić izomerię:
Slajd 1. Wstęp do chemii organicznej. Nomenklatura, własności fizyczne, struktura. eter. mapa potencjału elektrostatycznego cząsteczki eteru etylowego
 Slajd 1 Wstęp do chemii organicznej Nomenklatura, własności fizyczne, struktura hybrydyzacja sp 3 eter mapa potencjału elektrostatycznego cząsteczki eteru etylowego Slajd 2 Alkany to węglowodory zawierające
Slajd 1 Wstęp do chemii organicznej Nomenklatura, własności fizyczne, struktura hybrydyzacja sp 3 eter mapa potencjału elektrostatycznego cząsteczki eteru etylowego Slajd 2 Alkany to węglowodory zawierające
ODPORNOŚD CHEMICZNA TERMOPLASTÓW
 PMMA PC PU PCV PVDF PTFE PP PE PET POMH POMC PA66 PA6 ODPORNOŚD CHEMICZNA TERMOPLASTÓW Odporny. Niewielkie lub żadne zmiany w masie. Nieznaczny wpływ na właściwości mechaniczne. Częściowo odporny. Wraz
PMMA PC PU PCV PVDF PTFE PP PE PET POMH POMC PA66 PA6 ODPORNOŚD CHEMICZNA TERMOPLASTÓW Odporny. Niewielkie lub żadne zmiany w masie. Nieznaczny wpływ na właściwości mechaniczne. Częściowo odporny. Wraz
Pochodne kwasów karboksylowych. Krystyna Dzierzbicka
 Pochodne kwasów karboksylowych Krystyna Dzierzbicka halogenki kwasowe X X = l, Br, I bezwodniki kwasowe ' estry ' amidy N 2 sole nitryle N Nazwy grup acylowych 3 3 2 acyl metanoil formyl etanoil acetyl
Pochodne kwasów karboksylowych Krystyna Dzierzbicka halogenki kwasowe X X = l, Br, I bezwodniki kwasowe ' estry ' amidy N 2 sole nitryle N Nazwy grup acylowych 3 3 2 acyl metanoil formyl etanoil acetyl
Spis treści. Budowa alkanów. 1 Budowa alkanów 2 Reakcje chemiczne alkanów 3 Izomeria 4 Rzędowość atomów węgla 5 Energia wewnętrzna. Konformacje.
 Spis treści 1 Budowa alkanów 2 Reakcje chemiczne alkanów 3 Izomeria 4 Rzędowość atomów węgla 5 Energia wewnętrzna. Konformacje. Budowa alkanów Poznawanie związków organicznych zaczniemy od substancji najprostszych
Spis treści 1 Budowa alkanów 2 Reakcje chemiczne alkanów 3 Izomeria 4 Rzędowość atomów węgla 5 Energia wewnętrzna. Konformacje. Budowa alkanów Poznawanie związków organicznych zaczniemy od substancji najprostszych
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Wytrzymałość chemiczna krat z tworzywa
 Wytrzymałość chemiczna krat z tworzywa 2 A Aceton 25 50 częściowo odporne odporne odporne Aceton 100 każda nieodporne nieodporne nieodporne Aldehyd mrówkowy 44 45 nieodporne częściowo odporne odporne Aldehyd
Wytrzymałość chemiczna krat z tworzywa 2 A Aceton 25 50 częściowo odporne odporne odporne Aceton 100 każda nieodporne nieodporne nieodporne Aldehyd mrówkowy 44 45 nieodporne częściowo odporne odporne Aldehyd
Materiał powtórzeniowy do sprawdzianu - węglowodory nasycone - alkany + przykładowe zadania
 Materiał powtórzeniowy do sprawdzianu - węglowodory nasycone - alkany + przykładowe zadania I. Atom węgla w związkach organicznych i jego rzędowość 1. Hybryzdyzacja atomu węgla a) konfiguracja elektronowa
Materiał powtórzeniowy do sprawdzianu - węglowodory nasycone - alkany + przykładowe zadania I. Atom węgla w związkach organicznych i jego rzędowość 1. Hybryzdyzacja atomu węgla a) konfiguracja elektronowa
WYKAZ METOD BADAWCZYCH W WKJ 4
 1 Gazy odlotowe próbki gazów odlotowych pobrane do pipet/worków 2 Gazy odlotowe 3 Gazy odlotowe 4 Gazy odlotowe 5 Gazy odlotowe Stężenie gazów w powietrzu (H 2 S) Stężenie gazów w powietrzu (O 2 ) Stężenie
1 Gazy odlotowe próbki gazów odlotowych pobrane do pipet/worków 2 Gazy odlotowe 3 Gazy odlotowe 4 Gazy odlotowe 5 Gazy odlotowe Stężenie gazów w powietrzu (H 2 S) Stężenie gazów w powietrzu (O 2 ) Stężenie
Halogenki alkilowe RX
 alogenki alkilowe X Nazewnictwo halogenków alkilowych 1. Znajdź i nazwij łańcuch macierzysty. Tak jak przy nazywaniu alkanów, wybierz najdłuższy łańcuch. Jeżeli w cząsteczce obecne jest wiązanie podwójne
alogenki alkilowe X Nazewnictwo halogenków alkilowych 1. Znajdź i nazwij łańcuch macierzysty. Tak jak przy nazywaniu alkanów, wybierz najdłuższy łańcuch. Jeżeli w cząsteczce obecne jest wiązanie podwójne
Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka
 Slajd 1 Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka Slajd 2 Alkeny Węglowodory te zawierają wiązanie podwójne C C wiązanie double podwójne bond the grupa functional funkcyjna group centrum
Slajd 1 Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka Slajd 2 Alkeny Węglowodory te zawierają wiązanie podwójne C C wiązanie double podwójne bond the grupa functional funkcyjna group centrum
Zakres materiału do sprawdzianu - alkeny, alkiny i areny + przykładowe zadania
 Zakres materiału do sprawdzianu - alkeny, alkiny i areny + przykładowe zadania I. Węglowodory nienasycone 1. Alkeny - węglowodory nienasycone w cząsteczkach których między atomami węgla występuje jedno
Zakres materiału do sprawdzianu - alkeny, alkiny i areny + przykładowe zadania I. Węglowodory nienasycone 1. Alkeny - węglowodory nienasycone w cząsteczkach których między atomami węgla występuje jedno
 1. NAZEWNITW ZWIĄZKÓW RGANIZNY węglowodory nasycone: alkany, cykloalkany węglowodory nienasycone: alkeny, alkiny, cykloalkeny Podać nazwy systematyczne następujących węglowodorów, uwzględnić izomerię:
1. NAZEWNITW ZWIĄZKÓW RGANIZNY węglowodory nasycone: alkany, cykloalkany węglowodory nienasycone: alkeny, alkiny, cykloalkeny Podać nazwy systematyczne następujących węglowodorów, uwzględnić izomerię:
Slajd 1. Reakcje alkinów
 Slajd 1 Reakcje alkinów Slajd 2 Alkiny to węglowodory zawierające wiązanie potrójne węgiel-węgiel Wzór ogólny: C n H 2n 2 (łańcuchowy); C n H 2n 4 (cykliczny) 1-heksyn terminalny alkin 3-heksyn wewnętrzny
Slajd 1 Reakcje alkinów Slajd 2 Alkiny to węglowodory zawierające wiązanie potrójne węgiel-węgiel Wzór ogólny: C n H 2n 2 (łańcuchowy); C n H 2n 4 (cykliczny) 1-heksyn terminalny alkin 3-heksyn wewnętrzny
Aminy. - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin
 Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Elementy chemii organicznej
 Elementy chemii organicznej Węglowodory alifatyczne Alkany C n H 2n+2 Alkeny C n H 2n Alkiny C n H 2n-2 Alkany C n H 2n+2 struktura Kekulégo wzór skrócony model Dreidinga metan etan propan butan Nazewnictwo
Elementy chemii organicznej Węglowodory alifatyczne Alkany C n H 2n+2 Alkeny C n H 2n Alkiny C n H 2n-2 Alkany C n H 2n+2 struktura Kekulégo wzór skrócony model Dreidinga metan etan propan butan Nazewnictwo
Węglowodory Aromatyczne
 Węglowodory Aromatyczne Benzen Rezonans & Aromatyczność Nazewnictwo (nomenklatura) Slides 1 to 38 Węglowodory Aromatyczne W pierwotnym znaczeniu słowo aroma nawiązywało do pachnących składników roślin;
Węglowodory Aromatyczne Benzen Rezonans & Aromatyczność Nazewnictwo (nomenklatura) Slides 1 to 38 Węglowodory Aromatyczne W pierwotnym znaczeniu słowo aroma nawiązywało do pachnących składników roślin;
Podział związków organicznych
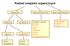 Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Odporność chemiczna. Chemikalia 20 C 50 C Aceton 100% - - Żywica poliestrowa
 Aceton 100% - - kwas adypinowy, wszystkie konc.. + 0 Ałun,wszystkie konc. + 0 Alkohol (butylowy-), 100% + - Alkohol (etylowy), 10% + 0 Alkohol (etylowy), 50% + 0 Alkohol (etylowy), 100% 0 - Alkohol (metylowy),
Aceton 100% - - kwas adypinowy, wszystkie konc.. + 0 Ałun,wszystkie konc. + 0 Alkohol (butylowy-), 100% + - Alkohol (etylowy), 10% + 0 Alkohol (etylowy), 50% + 0 Alkohol (etylowy), 100% 0 - Alkohol (metylowy),
HCOOH kwas metanowy ( mrówkowy ) CH 3. COOH kwas etanowy ( octowy ) CH 2
 Kwasy karboksylowe, Ar Nazewnictwo: Kwasy, które są pochodnymi alkanów o otwartych łańcuchach, są nazywane w sposób systematyczny przez dodanie nazwy kwas i dodanie końcówki owy do alkanu - kwas alkanowy
Kwasy karboksylowe, Ar Nazewnictwo: Kwasy, które są pochodnymi alkanów o otwartych łańcuchach, są nazywane w sposób systematyczny przez dodanie nazwy kwas i dodanie końcówki owy do alkanu - kwas alkanowy
1. Katalityczna redukcja węglowodorów zawierających wiązania wielokrotne
 B T E C N L CEMA G RGANCZNA A Synteza 1. Katalityczna redukcja węglowodorów zawierających wiązania wielokrotne C C / Pt C C C C W reakcji tej łańcuch węglowy pozostaje zachowany (nie ulega zmianie jego
B T E C N L CEMA G RGANCZNA A Synteza 1. Katalityczna redukcja węglowodorów zawierających wiązania wielokrotne C C / Pt C C C C W reakcji tej łańcuch węglowy pozostaje zachowany (nie ulega zmianie jego
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
1
 100 Tlenek węgla - pomiar z użyciem tabeli stężeń (5-1,000) (10 rurek/opakowanie) 101S Acetylen (50-1,000) (10 rurek/opakowanie) 102SA Aceton (0.1-5.0%) (10 rurek/opakowanie) 102SA Tetrahydrofuran (0.2-5.0%)
100 Tlenek węgla - pomiar z użyciem tabeli stężeń (5-1,000) (10 rurek/opakowanie) 101S Acetylen (50-1,000) (10 rurek/opakowanie) 102SA Aceton (0.1-5.0%) (10 rurek/opakowanie) 102SA Tetrahydrofuran (0.2-5.0%)
Kilka wskazówek ułatwiających analizę widm w podczerwieni
 Kilka wskazówek ułatwiających analizę widm w podczerwieni Opracowanie wg dostępnej literatury spektroskopowej: Dr Alina T. Dubis e-mail: alina@uwb.edu.pl Instytut Chemii Uniwersytet w Białymstoku Al. J.
Kilka wskazówek ułatwiających analizę widm w podczerwieni Opracowanie wg dostępnej literatury spektroskopowej: Dr Alina T. Dubis e-mail: alina@uwb.edu.pl Instytut Chemii Uniwersytet w Białymstoku Al. J.
Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r.
 Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r. Lp. Temat lekcji 1. Szereg homologiczny alkanów. 2. Izomeria konstytucyjna w alkanach. 3.
Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r. Lp. Temat lekcji 1. Szereg homologiczny alkanów. 2. Izomeria konstytucyjna w alkanach. 3.
(86) Data i numer zgłoszenia międzynarodowego: 29.10.2002, PCT/EP02/012076
 PL 211461 B1 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 211461 (21) Numer zgłoszenia: 368322 (22) Data zgłoszenia: 29.10.2002 (86) Data i numer zgłoszenia
PL 211461 B1 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 211461 (21) Numer zgłoszenia: 368322 (22) Data zgłoszenia: 29.10.2002 (86) Data i numer zgłoszenia
TABELA ODPORNOŚCI CHEMICZNEJ DLA MATERIAŁÓW KOŃCÓWEK I ZŁĄCZY
 Aceton A B B B A A A A Acetylen A X X B B A A X Alkohol benzylowy B B B B A A A Alkohol butylowy A B A B A A A A Alkohol diacetonowy A A B B A B B Alkohol etylowy A B B B B A A A Alkohol heksylowy (heksanol)
Aceton A B B B A A A A Acetylen A X X B B A A X Alkohol benzylowy B B B B A A A Alkohol butylowy A B A B A A A A Alkohol diacetonowy A A B B A B B Alkohol etylowy A B B B B A A A Alkohol heksylowy (heksanol)
Izomerię konstytucyjną można podzielić na podgrupy a) izomeria szkieletowa, która polega na różnej budowie szkieletu węglowego cząsteczek Przykład:
 1 1) Informacje ogólne Izomery są to związki, które maja identyczne wzory sumaryczne ale różnią się sposobem lub kolejnością powiązania atomów lub rozmieszczeniem atomów w przestrzeni. rozróżnia się izomerię
1 1) Informacje ogólne Izomery są to związki, które maja identyczne wzory sumaryczne ale różnią się sposobem lub kolejnością powiązania atomów lub rozmieszczeniem atomów w przestrzeni. rozróżnia się izomerię
Alkohole i fenole. Opracowanie: Bartłomiej SIEPSIAK klasa 3d Opiekun: p. Teresa Gębicka
 Alkohole i fenole Opracowanie: Bartłomiej SIEPSIAK klasa d Opiekun: p. Teresa Gębicka Budowa alkoholi i fenoli Szereg homologiczny alkoholi Nazewnictwo Podział alkoholi Otrzymywanie alkoholi Właściwości
Alkohole i fenole Opracowanie: Bartłomiej SIEPSIAK klasa d Opiekun: p. Teresa Gębicka Budowa alkoholi i fenoli Szereg homologiczny alkoholi Nazewnictwo Podział alkoholi Otrzymywanie alkoholi Właściwości
KWASY KARBOKSYLOWE I ICH POCHODNE. R-COOH lub R C gdzie R = H, CH 3 -, C 6 H 5 -, itp.
 KWASY KARBKSYLWE I IH PHDNE I. Wprowadzenie teoretyczne Kwasy karboksylowe Kwasami organicznymi nazywamy związki, w których grupa funkcyjna H zwana grupą karboksylową jest związana z rodnikiem węglowodorowym
KWASY KARBKSYLWE I IH PHDNE I. Wprowadzenie teoretyczne Kwasy karboksylowe Kwasami organicznymi nazywamy związki, w których grupa funkcyjna H zwana grupą karboksylową jest związana z rodnikiem węglowodorowym
Rozdział 6. Odpowiedzi i rozwiązania zadań. Chemia organiczna. Zdzisław Głowacki. Zakres podstawowy i rozszerzony
 Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Węglowodory nienasycone
 AUTORZY SKRYPTU Szymon Michalski OPIEKUN MERYTORYCZNY mgr Adam Makówka Węglowodory nienasycone Alkeny Spis treści: 1.Określenie i wzór ogólny alkenów 2.Szereg homologiczny alkenów 3.Nazewnictwo alkenów
AUTORZY SKRYPTU Szymon Michalski OPIEKUN MERYTORYCZNY mgr Adam Makówka Węglowodory nienasycone Alkeny Spis treści: 1.Określenie i wzór ogólny alkenów 2.Szereg homologiczny alkenów 3.Nazewnictwo alkenów
Pochodne węglowodorów
 Pochodne węglowodorów 1. Pochodne węglowodorów To związki chemiczne pochodzące od węglowodorów, które w cząsteczkach oprócz węgla, wodoru mają inne pierwiastki chemiczne, np. tlen, azot, chlor. Pochodne
Pochodne węglowodorów 1. Pochodne węglowodorów To związki chemiczne pochodzące od węglowodorów, które w cząsteczkach oprócz węgla, wodoru mają inne pierwiastki chemiczne, np. tlen, azot, chlor. Pochodne
Organiczne związki azotu
 Organiczne związki azotu 1. arysuj wzory: a. acetylocholina b. adrenalina c. putrescyna d. dopamina e. kolamina 2. azwij poniższe związki: H 2 CH H C CH 2 A. B. C. D. OH H 2 2 2 E. F. G. H. H 2 I. 2 J.
Organiczne związki azotu 1. arysuj wzory: a. acetylocholina b. adrenalina c. putrescyna d. dopamina e. kolamina 2. azwij poniższe związki: H 2 CH H C CH 2 A. B. C. D. OH H 2 2 2 E. F. G. H. H 2 I. 2 J.
Slajd 1. Slajd 2. Aminy. trietyloamina. amoniak. chlorofil
 Slajd 1 Aminy chlorofil Slajd 2 amoniak trietyloamina Slajd 3 Wypadkowy moment dipolowy 1 lub 2 aminy: donory lub akceptory wiązania wodorowego 3 aminy: mogą być wyłącznie akceptorami wiązania wodorowego
Slajd 1 Aminy chlorofil Slajd 2 amoniak trietyloamina Slajd 3 Wypadkowy moment dipolowy 1 lub 2 aminy: donory lub akceptory wiązania wodorowego 3 aminy: mogą być wyłącznie akceptorami wiązania wodorowego
Chemia organiczna. Alkohole Fenole. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
Kwasy karboksylowe to jednofunkcyjne pochodne węglowodorów o grupie funkcyjnej -COOH zwanej grupą karboksylową.
 Spis treści: Charakterystyka grupy karboksylowej Podział kwasów karboksylowych Nazewnictwo kwasy monokarboksylowe alifatyczne nasycone kwasy monokarboksylowe alifatyczne nienasycone kwasy dikarboksylowe
Spis treści: Charakterystyka grupy karboksylowej Podział kwasów karboksylowych Nazewnictwo kwasy monokarboksylowe alifatyczne nasycone kwasy monokarboksylowe alifatyczne nienasycone kwasy dikarboksylowe
ZWIĄZKI MAGNEZOORGANICZNE. Krystyna Dzierzbicka
 ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami
 Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami I. Otrzymywanie halogenowęglowodorów 1. Reakcje halogenacji (substytucji rodnikowej halogenów (Cl, ) na
Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami I. Otrzymywanie halogenowęglowodorów 1. Reakcje halogenacji (substytucji rodnikowej halogenów (Cl, ) na
Tabela odporności chemicznej dla materiałów końcówek i złączy (W.2/2018)
 Tabela odporności służy do wstępnego określenia materiału końcówek i złączy, odpowiedniego dla danego środowiska pracy. W celu właściwego doboru materiału prosimy kontaktować się z TUBES INTERNATIONAL.
Tabela odporności służy do wstępnego określenia materiału końcówek i złączy, odpowiedniego dla danego środowiska pracy. W celu właściwego doboru materiału prosimy kontaktować się z TUBES INTERNATIONAL.
Zadanie 1. Wskaż grupę związków chemicznych, do której należy węglowodór o gęstości 2,5 normalne). C. alkiny D. areny
 Węglowodory Zadanie 1. Wskaż grupę związków chemicznych, do której należy węglowodór o gęstości 2,5 normalne). (warunki A. alkany B. alkeny C. alkiny D. areny Zadanie 2. Wskaż wzór półstrukturalny węglowodoru
Węglowodory Zadanie 1. Wskaż grupę związków chemicznych, do której należy węglowodór o gęstości 2,5 normalne). (warunki A. alkany B. alkeny C. alkiny D. areny Zadanie 2. Wskaż wzór półstrukturalny węglowodoru
Węglowodory poziom rozszerzony
 Węglowodory poziom rozszerzony Zadanie 1. (1 pkt) Źródło: KE 2010 (PR), zad. 21. Narysuj wzór strukturalny lub półstrukturalny (grupowy) węglowodoru, w którego cząsteczce występuje osiem wiązań σ i jedno
Węglowodory poziom rozszerzony Zadanie 1. (1 pkt) Źródło: KE 2010 (PR), zad. 21. Narysuj wzór strukturalny lub półstrukturalny (grupowy) węglowodoru, w którego cząsteczce występuje osiem wiązań σ i jedno
11.Chemia organiczna. Irena Zubel Wydział Elektroniki Mikrosystemów i Fotoniki Politechnika Wrocławska (na prawach rękopisu)
 11.Chemia organiczna. Irena Zubel Wydział Elektroniki Mikrosystemów i Fotoniki Politechnika Wrocławska (na prawach rękopisu) Związki organiczne CHEMIA ORGANICZNA Def. 1. (Gmelin 1848, Kekule 1851 ) chemia
11.Chemia organiczna. Irena Zubel Wydział Elektroniki Mikrosystemów i Fotoniki Politechnika Wrocławska (na prawach rękopisu) Związki organiczne CHEMIA ORGANICZNA Def. 1. (Gmelin 1848, Kekule 1851 ) chemia
KWASY KARBOKSYLOWE. Krystyna Dzierzbicka
 KWASY KARBKSYLWE Krystyna Dzierzbicka Kwasy karboksylowe są związkami organicznymi zawierającymi grupę karboksylową - zbudowaną z grupy karbonylowej () i hydroksylowej (). R (Ar) karboksylowy Możemy je
KWASY KARBKSYLWE Krystyna Dzierzbicka Kwasy karboksylowe są związkami organicznymi zawierającymi grupę karboksylową - zbudowaną z grupy karbonylowej () i hydroksylowej (). R (Ar) karboksylowy Możemy je
Cząsteczki wieloatomowe - hybrydyzacja. Czy w oparciu o koncepcję orbitali molekularnych można wytłumaczyć budowę cząsteczek?
 ząsteczki wieloatomowe - hybrydyzacja zy w oparciu o koncepcję orbitali molekularnych można wytłumaczyć budowę cząsteczek? Fakty doświadczalne Wiązanie ząsteczka Długość wiązania [pm] - - 97-2 96-2 2 97-3
ząsteczki wieloatomowe - hybrydyzacja zy w oparciu o koncepcję orbitali molekularnych można wytłumaczyć budowę cząsteczek? Fakty doświadczalne Wiązanie ząsteczka Długość wiązania [pm] - - 97-2 96-2 2 97-3
Alkany i cykloalkany
 Alkany i cykloalkany ALKANY WĘGLOWODORY NASYCONE WĘGLOWODORY ALIFATYCZNE SKŁĄDAJĄ SIĘ Z ATOMÓW WĘGLA I WODORU POJEDYNCZE WIĄZANIA WĘGIEL WĘGIEL ATOM WĘGLA W HYBRYDYZACJI sp 3 KĄTY MIĘDZY WIĄZANIAMI, DŁUGOŚCI
Alkany i cykloalkany ALKANY WĘGLOWODORY NASYCONE WĘGLOWODORY ALIFATYCZNE SKŁĄDAJĄ SIĘ Z ATOMÓW WĘGLA I WODORU POJEDYNCZE WIĄZANIA WĘGIEL WĘGIEL ATOM WĘGLA W HYBRYDYZACJI sp 3 KĄTY MIĘDZY WIĄZANIAMI, DŁUGOŚCI
Podstawy i Metody Oceny Środowiska Pracy 2011, nr 4(70), s
 Podstawy i Metody Oceny Środowiska Pracy 2011, nr 4(70), s. 176 180 Indeks metod oznaczania najwyższych dopuszczalnych stężeń (NDS) substancji chemicznych w powietrzu oraz procedur oznaczania poziomu najwyższych
Podstawy i Metody Oceny Środowiska Pracy 2011, nr 4(70), s. 176 180 Indeks metod oznaczania najwyższych dopuszczalnych stężeń (NDS) substancji chemicznych w powietrzu oraz procedur oznaczania poziomu najwyższych
Narysuj stereoizomery cis i trans dla 1,2-dibromocyklobutanu. Czy ulegają one wzajemnej przemianie, odpowiedź uzasadnij.
 WERSJA A EGZAMIN z hemii rganicznej I. IZMERIA ZWIĄZKÓW RGANIZNY 1. Narysuj wzory w projekcji konikowej i w projekcji Newmana 1,2-dibromoetanu 1,1-dibromoetanu w konformacji synklinalnej (gauche) w najbardziej
WERSJA A EGZAMIN z hemii rganicznej I. IZMERIA ZWIĄZKÓW RGANIZNY 1. Narysuj wzory w projekcji konikowej i w projekcji Newmana 1,2-dibromoetanu 1,1-dibromoetanu w konformacji synklinalnej (gauche) w najbardziej
wykład: Alkohole, Etery i Fenole
 wykład: Alkohole, Etery i Fenole Alkohole Alkohole związki organiczne o wzorze ogólnym R- w których grupa hydroksylowa połączona jest z atomem węgla z łańcucha węglowego. Alkohole nasycone Alkohole nienasycone
wykład: Alkohole, Etery i Fenole Alkohole Alkohole związki organiczne o wzorze ogólnym R- w których grupa hydroksylowa połączona jest z atomem węgla z łańcucha węglowego. Alkohole nasycone Alkohole nienasycone
Odporność chemiczna - PVC
 dporność chemiczna - PVC dporność chemiczna nieplastyfikowanego PVC niepodlegającego naprężeniu mechanicznemu na płyny przy 20 C i 60 C L.p Chemikalia lub produkty Stężenie Temperatura 20 C 60 C 1. Aceton
dporność chemiczna - PVC dporność chemiczna nieplastyfikowanego PVC niepodlegającego naprężeniu mechanicznemu na płyny przy 20 C i 60 C L.p Chemikalia lub produkty Stężenie Temperatura 20 C 60 C 1. Aceton
Węglowodory. Michał Szewczyk Kl. IV TI
 Węglowodory Michał Szewczyk Kl. IV TI Węglowodory nasycone (Alkany) Węglowodory nasycone (Alkany)- to związki węgla z wodorem, w których pomiędzy atomami węgla występują tylko pojedyncze wiązania. Wzór
Węglowodory Michał Szewczyk Kl. IV TI Węglowodory nasycone (Alkany) Węglowodory nasycone (Alkany)- to związki węgla z wodorem, w których pomiędzy atomami węgla występują tylko pojedyncze wiązania. Wzór
