Materiał powtórzeniowy do sprawdzianu - węglowodory nasycone - alkany + przykładowe zadania
|
|
|
- Teresa Bednarczyk
- 8 lat temu
- Przeglądów:
Transkrypt
1 Materiał powtórzeniowy do sprawdzianu - węglowodory nasycone - alkany + przykładowe zadania I. Atom węgla w związkach organicznych i jego rzędowość 1. Hybryzdyzacja atomu węgla a) konfiguracja elektronowa atomu węgla w stanie podstawowym: 1s 2 2s 2 2p 2 b) konfiguracja w stanie wzbudzonym - w wyniku oddziaływania atomu węgla z atomem innego pierwiastka elektron z orbitalu atomowego 2s 2 przechodzi na orbital 2p: 1s 2 2s 1 2p 3 c) stany zybrydyzowane - jest to postulat (operacja matematyczna na funkcjach falowych opisujących stany kwantowe - elektrony) wyjaśniający równocenność pod względem energii i długości wiązań chemicznych tworzonych przez atom C Hybrydyzacja sp 3 (tetraedryczna) - 1 elektron z orbitalu 2s i 3 elektrony z orbitalu 2p tworzą 4 nowe orbitale zhybrydyzowane (pośrednie) typy sp 3, które przestrzenie są ustawione w stosunku do siebie pod kątem 109 o 28 - są skierowane do narożników czworościanu foremnego. Atom węgla tworzy cztery wiązania pojedyncze sigma () sp 3 C sp 3 C sp 3 C Hybrydyzacja sp 2 (trygonalna) - 1 elektron z orbitalu 2s i 2 elektrony z orbitalu 2p tworzą 3 nowe orbitale zhybrydyzowane (pośrednie) typy sp 2, które przestrzenie są ustawione w stosunku do siebie pod kątem 120 o - są skierowane do narożników trójkąta równoramiennego, czyli leżą w jednej płaszczyźnie, 3 elektron z orbitalu 2p nie bierze udziału w hybrydyzacji, jest skierowany prostopadle do płaszczyzny w które znajdują się 3 orbitale sp 2. Orbitale hybrydyzowane sp 2 tworzą wiązania pojedyncze sigma (), natomiast niehybrydyzowany orbital 2p utworzy wiązanie pi (π) z drugim atomem C (lub innego pierwiastka O, N). \ sp 2 C sp 2 C sp 3 C / π
2 Hybrydyzacja sp (diagonalna) - 1 elektron z orbitalu 2s i 1 elektron z orbitalu 2p tworzą 2 nowe orbitale zhybrydyzowane (pośrednie) typy sp, które przestrzenie są ustawione w stosunku do siebie pod kątem 180 o - leżą liniowo na jednej osi, 2 elektrony z orbitali 2p nie biorą udziału w hybrydyzacji, orbitale są skierowane prostopadle do osi w której znajdują się 2 orbitale sp. Orbitale hybrydyzowane sp tworzą wiązania pojedyncze sigma (), natomiast niehybrydyzowane orbitale 2p utworzą wiązania pi (π) z drugim atomem C. sp C spc sp 3 C 2π Zad1. Dla poniższej cząsteczki węglowodoru, dla każdego atomu C w cząsteczce przypisz typ hybrydyzacji, podaj łączną liczbę wiązań sigma oraz wiązań pi. H H H H H / H 1 C 2 C 3 C 4 C 5 C 6 C 7 C \ H H H 8 C H H H Rozwiązanie Nr at. C Typ hybrydyzacji sp 3 sp 3 sp sp sp 3 sp 2 sp 2 sp 3 Łączna liczba wiązań sigma 19 Łączna liczba wiązań pi 3 Zad.2. Dla poniższej cząsteczki węglowodoru, dla każdego atomu C w cząsteczce przypisz typ hybrydyzacji, podaj łączną liczbę wiązań sigma oraz wiązań pi. H H - sp 2 ; 1,2,3,4,5,6,7,8 \ - sp 3 ; 9 7 C 8 C 9 C H - w. sigma - 15 / - w. pi C // \ H 6 C 2 C H H 5 C 3 C H \\ / 4 C H
3 2. Rzędowość atomu węgla w cząsteczkach związków organicznych - klasyfikacja atomów C na podstawie związanych z nim innych atomów węgla: pierwszorzędowy (1 o /I-rz) at. C związany jest z jednym at. C; drugorzędowy (2 o /II-rz), at. C związany jest z dwoma at. C; trzeciorzędowy (3 o /III-rz) at. C związany jest z trzema at. C; czwartorzędowy (4 o /IV-rz) at. C związany jest z czteroma at. C Zad. 3. Dla atomów węgla w poniższej cząsteczce węglowodoru określ ich rzędowość: 8 9 Rozwiązanie; 1 o : 1, 5, 7, 8, 9 2 o : 3, CH 3 CH 2 4 C 5 3 o : 2 4 o : 4 6 CH 2 7 II. Szereg homologiczny alkanów, izomeria szkieletowa (łańcuchowa) i nazewnictwo systematyczne 1. Węglowodory nasycone - alkany - węglowodory (związki chemiczne, których cząsteczki zbudowane są wyłącznie z atomów węgla i atomów wodoru) w cząsteczkach których między atomami węgla występują wyłącznie wiązania pojedyncze (sigma, at. C są na hybrydyzacji sp 3 ). Alkany tworzą szereg homologiczny o ogólnym wzorze C n H 2n+2 2. Szereg homologiczny alkanów - tworzą homologi (cząsteczki) o ogólnym w/w wzorze, ale różniące się miedzy sobą stałą grupą atomów - CH 2 - (grupa metylenowa) lub jej wielokrotnością n Wzór sumaryczny C n H 2n+2 Nazwa systematyczna Wzór grupowy Grupa alkilowa - CnH 2n+1 Nazwa grupy alkilowej (R) 1 CH 4 Metan CH 4 - metyl 2 C 2 H 6 Etan - - C 2 H 5 etyl 3 C 3 H 8 Propan - CH C 3 H 7 propyl 4 C 4 H 10 Butan - CH 2 -CH C 4 H 9 butyl - (CH 2 ) 2-5 C 5 H 12 Pentan -CH 2- CH 2 -CH C 5 H 11 pentyl - (CH 2 ) 3-6 C 6 H 14 Heksan -CH 2 -CH 2- CH 2 -CH 2 - heksyl -(CH 2 ) 4-7 C 7 H 16 Heptan - (CH 2 ) 5 - heptyl 8 C 8 H 18 Oktan - (CH 2 ) 6 - oktyl 9 C 9 H 20 Nonan - (CH 2 ) 7 - nonyl 10 C 10 H 22 Dekan - (CH 2 ) 8 - dekyl
4 Zad. 3 Ustal wzór rzeczywisty alkanu, którego masa cząsteczkowa wynosi 128u. - z ogólnego wzoru alkanów : n m atc + (2n+2)m ath = 128u - n 12u + (2n+2) 1u = 128u; 14n = 128-2; 14n = 126; n = 9, - stąd C 9 H 20 (nonan) Zad. 4. Ustal wzór rzeczywisty alkanu, którego gęstość wyznaczona w warunkach normalnych wynosi 2,589g/dm 3. - mol każdego gazu w warunkach normalnych zajmuje objętość: V mol = 22,4dm 3 /mol - obliczenie masy molowej alkanu 1dm ,589g 22,4dm 3 /mol x x = 57,99g/mol = 58g/mol - n 12g/mol + (2n+2) 1g/mol = 58g/mol ; 14n = 58-2; 14n = 56; n = 4 - stąd C 4 H 10 (butan) III. Izomeria szkieletowa - łańcuchowa alkanów 1. Izomeria konstytucyjna - zjawisko występowania cząsteczek o takim samym wzorze sumarycznym, w których atomy są połączone w odmienny sposób, wśród izomerii konstytucyjnej wyróżnia się: szkieletową (łańcuchową) - atomy węgla w szkielecie węglowym są połączone w odmienny sposób( szkielety proste, rozgałęzione, cykliczne) pozycyjną dot. położenia wiązania wielokrotnego lub grupy funkcyjnej, geometryczną, optyczną, funkcjonalną - w przypadku szeregu homologicznego alkanów od butanu występuje wyłącznie izomeria szkieletowa, w wśród halogenoalkanów dodatkowo izomeria pozycyjna dot. położenia podstawnika halogenowego (X: F, Cl, Br, I) 2. Reguły tworzenia nazw systematycznych: ustalenie najdłuższego łańcucha węglowego i nazwy alkanu jako podstawy nazwy, nadanie numerów (lokautów) kolejnych w głównym szkielecie węglowym przestrzegając zasady, że suma lokantów na których znajdują się podstawniki alkilowe i halogenowe musi być jak najniższa podstawniki halogenowe (o ile występują w cząsteczce) wymienia się w kolejności alfabetycznej przed podstawnikami alkilowymi, które też wymienia się w kolejności alfabetycznej w obu przypadkach z podaniem lokautu, dla określenia liczby podstawników tego samego rodzaju stosuje się liczebniki: 2 - di, 3 - tri, 4 - tetra, 5 - penta, 6 - heksa, w nazwie fragmenty liczbowe z fragmentami literowymi łączy się myślnikiem, nazwy podstawników muszą mieć dodaną końcówkę o, np. chloro, metylo.
5 cząsteczki, które występują odmianach izomerycznych w nazwie o łańcuchu nierozgałęzionym dodaje się przedrostek n (normalny), np. n-pentan, dla odmian rozgałęzionych przedrostek izo, dla wszystkich izomerów, np. izo-pentan. Zad. 5 Dla alkanu o 14 atomach wodoru w cząsteczce zapisz wzory grupowe wszystkich jego izomerów i nadaj im nazwy systematyczne. - n = 6 C 6 H 14 - CH 2 - CH 2 - CH 2 - CH 2 - : n-heksan izo-heksany 1-2 CH - 3 CH 2-4 CH 2-5 : 1-2 CH 2-3 CH - 4 CH 2-5 : 1-2 CH - 3 CH - 4 : 2-metylopentan 3-metylopentan 2,3-dimetylobutan 1-2 C - 3 CH 2-4 : 2,2-dimetylobutan Uwaga - łańcuch nie może być rozgałęziony na krańcowych atomach C w szkielecie, są to tylko zagięcia głównego szkieletu. CH C - 3 CH 2 : 2,2-dimetylobutan Zad. 6 Dla cząsteczek o poniższych wzorach grupowych nadaj nazwy systematyczne: C 2 H 5 C 3 H 7 A. 9-8 CH 2-7 CH - 6 CH 2-5 C - 4 CH - 3 CH - 2 C - 1 C 2 H 5 Odp. 5,7-dietylo-2,2,3,4-tetrametylo-5-propylononan (suma lokautów = 28, przy lokantach od prawej do lewej suma = 42)
6 B. Br C 4 H 9 Cl C 2 H 5 F 1 CH - 2 CH - 3 C - 4 CH 2-5 CH - 6 C - 7 CH - 8 CH - 9 CH - 10 Br I C 3 H 7 Br Odp. 1,1,9-tribromo-6-chloro-8-fluoro-3-jodo-5-butylo-7-etylo-2,3-dimetylo-6-propylodekan (suma lokantów = 51, gdyby lokanty nadać od prawej do lewej strony, to suma = 70) IV. Otrzymywanie alkanów - metanu metodami laboratoryjnymi 1. Hydroliza w kwasowa lub w środowisku wodnym węglika glinu Al 4 C 3 : Al 4 C HCl 3CH 4 + 4AlCl 3 Al4C H 2 O 3CH 4 + 4Al(OH) 3 2. Termiczny rozkład octanu sodu z stałym NaOH - COONa + NaOH CH 4 + Na 2 CO 3 Zad. 7 Oblicz, jaką objętość zajmie metan (warunki normalne), jeżeli w reakcji z kwasem chlorowodorowym całkowicie przereagowało 7,2g węglika glinu V mol = 22,4dm 3 /mol: M Al4C3 = 144g/mol Al 4 C HCl 3CH 4 + 4AlCl 3 1 mol + 12moli 3mole + 4mole 144g + 12mol 3 22,4dm 3 + 4mole 144g ,2dm 3 metanu 7,2g x x = 3,36dm 3 metanu Zad. 8 Oblicz, jaką objętość zajmie (warunki normalne), jeżeli w reakcji octanu sodu z wodorotlenkiem sodu powstało 5,3g węglanu(iv) sodu. V mol = 22,4dm 3 /mol: M Na2CO3 = 106g/mol - COONa + NaOH CH 4 + Na 2 CO 3 1 mol + 1mol 1 mol + 1mol 1mol + 1 mol 22,4dm g 22,4dm g x ,2g x = 1,098dm 3 metanu V. Wałaściwości chemiczne alkanów 1. Reakcje spalania - w zależności od dostępu tlenu wyróżnia się: Spalanie całkowite CO 2 + H 2 O Półspalanie CO + H 2 O Spalenie niecałkowite C + H 2 O
7 Zad. 9. Zapisz równania reakcji spalania propanu przy różnym dostępie tlenu C 3 H 8 + 5O 2 3CO 2 + 4H 2 O 2C 3 H 8 + 7O 2 6CO + 8H 2 O C 3 H 8 + 2O 2 3C + 4H 2 O Zad. 10. Oblicz jaką objętość zajmie tlen (warunki normalne) niezbędny do całkowitego spalenia 0,5dm 3 alkanu, którego gęstość wyznaczona w warunkach normalnych wynosi 2,59g/dm3. - alkanem jest butan (patrz zadanie 4) 2C 4 H O 2 8CO H 2 O 44,8dm ,2dm 3 2mole + 13moli 8moli + 10moli 0,5dm x 2 22,4dm ,4dm 3 8moli + 10moli x = 3,25dm 3 tlenu 2. Reakcje substytucji - podstawienia Reakcje polega na zastąpieniu (podstawieniu) atomu(ów) H w cząsteczce alkanu atomem fluorowca (halogenu), produktem ubocznym jest odpowiedni halogenowodór (HX) C n H 2n+2 + X 2 C n H 2n+1 -X + HX Reakcja przebiega wieloetapowo z udziałem rodnika - atom lub grupa atomów posiadająca niesparowany elektron (substytucja rodnikowa), aż do wyczerpania się rodników Na dłuższych łańcuchach alkanów reakcja przebiega współbieżnie zgodnie z regułą Zajcewa - najłatwiej substytucja zachodzi na at. C 3 o, najtrudniej na 1 o, w I etapie reakcji powstaje mieszanina różnych halogenowęglowodorów, Reakcja substytucji fluorem zachodzi gwałtownie i wybuchowo, z chlorem pod wpływem światła uv, z bromem w podwyższonej temp., z jodem reakcje praktycznie nie zachodzą. Zad. 11 Zapisz równanie reakcji I etapu chlorowania 2-metylobutanu, zapisz wszystkie możliwe produkty, które mogą powstać w tym procesie, nadaj nazwy systematyczne do produktów reakcji, wskaż produkt, który powstanie w największej i najmniejszej ilości. CH 2 Cl - CH - CH HCl (a) (1-chloro-2-metylobutan) UV - CH( ) -CHCl - + HCl (b) - CH - CH Cl 2 (2-chloro-3-metylobutan) -CH( ) - CH 2 - CH 2 Cl + HCl (c) (1-chloro-3-metylobutan) - CCl - CH HCl (d) (2-chloro-2-metylobutan) Odp. głównym produktem jest związek d, najmniej powstanie produktów a i c.
Wskaż grupy reakcji, do których można zaliczyć proces opisany w informacji wstępnej. A. I i III B. I i IV C. II i III D. II i IV
 Informacja do zadań 1. i 2. Proces spalania pewnego węglowodoru przebiega według równania: C 4 H 8(g) + 6O 2(g) 4CO 2(g) + 4H 2 O (g) + energia cieplna Zadanie 1. (1 pkt) Procesy chemiczne można zakwalifikować
Informacja do zadań 1. i 2. Proces spalania pewnego węglowodoru przebiega według równania: C 4 H 8(g) + 6O 2(g) 4CO 2(g) + 4H 2 O (g) + energia cieplna Zadanie 1. (1 pkt) Procesy chemiczne można zakwalifikować
RJC # Defin i i n c i ja
 Alkany - Izomery Strukturalne & Konformacyjne - Nomenklatura - Projekcje Newmana Slides 1 to 41 Definicja Wzór ogólny dla alkanów C n 2n+2 Przykładowo... metan C 4 etan C 2 6 propan C 3 8 butan C 4 10
Alkany - Izomery Strukturalne & Konformacyjne - Nomenklatura - Projekcje Newmana Slides 1 to 41 Definicja Wzór ogólny dla alkanów C n 2n+2 Przykładowo... metan C 4 etan C 2 6 propan C 3 8 butan C 4 10
Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami
 Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami I. Otrzymywanie halogenowęglowodorów 1. Reakcje halogenacji (substytucji rodnikowej halogenów (Cl, ) na
Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami I. Otrzymywanie halogenowęglowodorów 1. Reakcje halogenacji (substytucji rodnikowej halogenów (Cl, ) na
Materiały do zajęć dokształcających z chemii organicznej
 hemia Warta Poznania - nowa JAKOŚĆ studiowania -zwiększenie liczby absolwentów oraz atrakcyjności studiów na kierunku EMIA na Uniwersytecie im. A. Mickiewicza w Poznaniu Materiały do zajęć dokształcających
hemia Warta Poznania - nowa JAKOŚĆ studiowania -zwiększenie liczby absolwentów oraz atrakcyjności studiów na kierunku EMIA na Uniwersytecie im. A. Mickiewicza w Poznaniu Materiały do zajęć dokształcających
Alkany. Alkeny. Alkiny
 Węglowodory Alkany Alkeny Alkiny Spis treści: Podział węglowodorów. Porównanie Alkany: budowa cząsteczki, szereg homologiczny, konformacje i izomeria, nazewnictwo, właściwości fizyczne, właściwości chemiczne.
Węglowodory Alkany Alkeny Alkiny Spis treści: Podział węglowodorów. Porównanie Alkany: budowa cząsteczki, szereg homologiczny, konformacje i izomeria, nazewnictwo, właściwości fizyczne, właściwości chemiczne.
PRZYKŁADOWE ZADANIA WĘGLOWODORY
 PRZYKŁADOWE ZADANIA WĘGLOWODORY INFORMACJA DO ZADAŃ 678 680 Poniżej przedstawiono wzory półstrukturalne lub wzory uproszczone różnych węglowodorów. 1. CH 3 2. 3. CH 3 -CH 2 -CH C CH 3 CH 3 -CH-CH 2 -C
PRZYKŁADOWE ZADANIA WĘGLOWODORY INFORMACJA DO ZADAŃ 678 680 Poniżej przedstawiono wzory półstrukturalne lub wzory uproszczone różnych węglowodorów. 1. CH 3 2. 3. CH 3 -CH 2 -CH C CH 3 CH 3 -CH-CH 2 -C
Spis treści. Budowa alkanów. 1 Budowa alkanów 2 Reakcje chemiczne alkanów 3 Izomeria 4 Rzędowość atomów węgla 5 Energia wewnętrzna. Konformacje.
 Spis treści 1 Budowa alkanów 2 Reakcje chemiczne alkanów 3 Izomeria 4 Rzędowość atomów węgla 5 Energia wewnętrzna. Konformacje. Budowa alkanów Poznawanie związków organicznych zaczniemy od substancji najprostszych
Spis treści 1 Budowa alkanów 2 Reakcje chemiczne alkanów 3 Izomeria 4 Rzędowość atomów węgla 5 Energia wewnętrzna. Konformacje. Budowa alkanów Poznawanie związków organicznych zaczniemy od substancji najprostszych
Dział: Węglowodory - Zadania powtórzeniowe
 Dział: Węglowodory - Zadania powtórzeniowe Zadanie 1. Jaka objętość metanu wydzieli się podczas reakcji 80 g węgliku glinu, zawierającego 10% zanieczyszczeń, z kwasem solnym? Zadanie 2. 56 cm³ mieszaniny
Dział: Węglowodory - Zadania powtórzeniowe Zadanie 1. Jaka objętość metanu wydzieli się podczas reakcji 80 g węgliku glinu, zawierającego 10% zanieczyszczeń, z kwasem solnym? Zadanie 2. 56 cm³ mieszaniny
CHEMIA ORGANICZA - węglowodory. Podział węglowodorów
 EMIA ORGANIZA - węglowodory Podział węglowodorów Najprostsze związki organiczne Alkany są to węglowodory nasycone, w których występują tylko pojedyncze wiązania węgiel węgiel Wszystkie nazwy alkanów charakteryzuje
EMIA ORGANIZA - węglowodory Podział węglowodorów Najprostsze związki organiczne Alkany są to węglowodory nasycone, w których występują tylko pojedyncze wiązania węgiel węgiel Wszystkie nazwy alkanów charakteryzuje
H H H. Wzór "płaskostrukturalny": Wzór klinowy: H H. Model kulkowy cząsteczki: (obrazuje długosci wiązań, kąty między wiązaniami)
 Autor: Marek Walnik, 04 Alkany - węglowodory nasycone, parafiny. Związki węgla z wodorem, w których cząsteczkach występują wyłącznie wiązania pojedyncze. Szczególną klasę związków tego typu stanowią cykloalkany
Autor: Marek Walnik, 04 Alkany - węglowodory nasycone, parafiny. Związki węgla z wodorem, w których cząsteczkach występują wyłącznie wiązania pojedyncze. Szczególną klasę związków tego typu stanowią cykloalkany
Zakres materiału do sprawdzianu - alkeny, alkiny i areny + przykładowe zadania
 Zakres materiału do sprawdzianu - alkeny, alkiny i areny + przykładowe zadania I. Węglowodory nienasycone 1. Alkeny - węglowodory nienasycone w cząsteczkach których między atomami węgla występuje jedno
Zakres materiału do sprawdzianu - alkeny, alkiny i areny + przykładowe zadania I. Węglowodory nienasycone 1. Alkeny - węglowodory nienasycone w cząsteczkach których między atomami węgla występuje jedno
Wojewódzki Konkurs Przedmiotowy z chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2010/2011
 Wojewódzki Konkurs Przedmiotowy z chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2010/2011 KOD UCZNIA Etap: Data: Czas pracy: rejonowy 7 lutego 2011r 90 minut Informacje dla ucznia
Wojewódzki Konkurs Przedmiotowy z chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2010/2011 KOD UCZNIA Etap: Data: Czas pracy: rejonowy 7 lutego 2011r 90 minut Informacje dla ucznia
Cz. I Stechiometria - Zadania do samodzielnego wykonania
 Cz. I Stechiometria - Zadania do samodzielnego wykonania A. Ustalenie wzoru rzeczywistego związku chemicznego na podstawie składu procentowego. Zadanie i metoda rozwiązania Ustal wzór rzeczywisty związku
Cz. I Stechiometria - Zadania do samodzielnego wykonania A. Ustalenie wzoru rzeczywistego związku chemicznego na podstawie składu procentowego. Zadanie i metoda rozwiązania Ustal wzór rzeczywisty związku
Węglowodory poziom podstawowy
 Węglowodory poziom podstawowy Zadanie 1. (2 pkt) Źródło: CKE 2010 (PP), zad. 19. W wyniku całkowitego spalenia 1 mola cząsteczek węglowodoru X powstały 2 mole cząsteczek wody i 3 mole cząsteczek tlenku
Węglowodory poziom podstawowy Zadanie 1. (2 pkt) Źródło: CKE 2010 (PP), zad. 19. W wyniku całkowitego spalenia 1 mola cząsteczek węglowodoru X powstały 2 mole cząsteczek wody i 3 mole cząsteczek tlenku
Zdzisław Głowacki. Zakres podstawowy i rozszerzony. Odpowiedzi i rozwiązania zadań. Rozdział 1. Powinno być
 Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 1 Errata do pierwszego rozdziału ćwiczeń: Strona Linia / zadanie Str. 10. Linia 1. Str. 16.
Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 1 Errata do pierwszego rozdziału ćwiczeń: Strona Linia / zadanie Str. 10. Linia 1. Str. 16.
Test sprawdzający, wielostopniowy z chemii: Węglowodory
 Test sprawdzający, wielostopniowy z chemii: Węglowodory Typ szkoły: Autor testu: technikum mgr Ewa Jagoda Skonstruowany przeze mnie test zawiera pytania zamknięte czterokrotnego wyboru, w których tylko
Test sprawdzający, wielostopniowy z chemii: Węglowodory Typ szkoły: Autor testu: technikum mgr Ewa Jagoda Skonstruowany przeze mnie test zawiera pytania zamknięte czterokrotnego wyboru, w których tylko
Konspekt wykładu Chemia Organiczna dla studentów Wydziału Inżynierii Chemicznej i Procesowej
 Konspekt wykładu hemia Organiczna dla studentów Wydziału Inżynierii hemicznej i Procesowej ALKANY 2 godz. 1. Wzór sumaryczny: n 2n+2 (n = liczba naturalna) - węglowodory posiadające tylko wiązania pojedyncze
Konspekt wykładu hemia Organiczna dla studentów Wydziału Inżynierii hemicznej i Procesowej ALKANY 2 godz. 1. Wzór sumaryczny: n 2n+2 (n = liczba naturalna) - węglowodory posiadające tylko wiązania pojedyncze
Nazwy pierwiastków: ...
 Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Spis treści. Metoda VSEPR. Reguły określania struktury cząsteczek. Ustalanie struktury przestrzennej
 Spis treści 1 Metoda VSEPR 2 Reguły określania struktury cząsteczek 3 Ustalanie struktury przestrzennej 4 Typy geometrii cząsteczek przykłady 41 Przykład 1 określanie struktury BCl 3 42 Przykład 2 określanie
Spis treści 1 Metoda VSEPR 2 Reguły określania struktury cząsteczek 3 Ustalanie struktury przestrzennej 4 Typy geometrii cząsteczek przykłady 41 Przykład 1 określanie struktury BCl 3 42 Przykład 2 określanie
Przemiany substancji
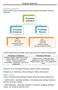 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie) Kod ucznia Suma punktów Witamy Cię na trzecim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie) Kod ucznia Suma punktów Witamy Cię na trzecim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 2014/2015. Etap wojewódzki
 Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 04/05 Etap wojewódzki Klucz odpowiedzi i schemat punktowania Część I. Test jednokrotnego wyboru z jedną poprawną odpowiedzią
Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 04/05 Etap wojewódzki Klucz odpowiedzi i schemat punktowania Część I. Test jednokrotnego wyboru z jedną poprawną odpowiedzią
LCH 1 Zajęcia nr 60 Diagnoza końcowa. Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach:
 LCH 1 Zajęcia nr 60 Diagnoza końcowa Zadanie 1 (3 pkt) Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach: H 3 C CH 2 CH 2 CH 2 CH 2 a) b) W tym celu: a) wybierz odpowiedni
LCH 1 Zajęcia nr 60 Diagnoza końcowa Zadanie 1 (3 pkt) Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach: H 3 C CH 2 CH 2 CH 2 CH 2 a) b) W tym celu: a) wybierz odpowiedni
Pochodne węglowodorów, w cząsteczkach których jeden atom H jest zastąpiony grupą hydroksylową (- OH ).
 Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Modele: kulkowy i czaszowy: wzór półstrukturalny: H 2 C=CH 2. Obecność wiązania podwójnego sygnalizuje końcówka nazwy "-en" Wzór strukturalny:
 Opracowanie: Marek Walnik, 0 Nazewnictwo alkenów Alkeny, zwane też olefinami, to węglowodory, w których cząsteczkach występują wiązania podwójne =. Węglowodory takie, ook alkinów, z potrójnymi wiązaniami,
Opracowanie: Marek Walnik, 0 Nazewnictwo alkenów Alkeny, zwane też olefinami, to węglowodory, w których cząsteczkach występują wiązania podwójne =. Węglowodory takie, ook alkinów, z potrójnymi wiązaniami,
Zdzisław Głowacki. Zakres podstawowy i rozszerzony. Odpowiedzi i rozwiązania zadań. Rozdział 2. Strona Linia zadanie Jest Powinno być
 Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 2 Errata do drugiego rozdziału ćwiczeń: Strona Linia zadanie Jest Powinno być Str. 52 Zadanie
Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 2 Errata do drugiego rozdziału ćwiczeń: Strona Linia zadanie Jest Powinno być Str. 52 Zadanie
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Alkany i cykloalkany
 Alkany i cykloalkany ALKANY WĘGLOWODORY NASYCONE WĘGLOWODORY ALIFATYCZNE SKŁĄDAJĄ SIĘ Z ATOMÓW WĘGLA I WODORU POJEDYNCZE WIĄZANIA WĘGIEL WĘGIEL ATOM WĘGLA W HYBRYDYZACJI sp 3 KĄTY MIĘDZY WIĄZANIAMI, DŁUGOŚCI
Alkany i cykloalkany ALKANY WĘGLOWODORY NASYCONE WĘGLOWODORY ALIFATYCZNE SKŁĄDAJĄ SIĘ Z ATOMÓW WĘGLA I WODORU POJEDYNCZE WIĄZANIA WĘGIEL WĘGIEL ATOM WĘGLA W HYBRYDYZACJI sp 3 KĄTY MIĘDZY WIĄZANIAMI, DŁUGOŚCI
Geometria cząsteczek wieloatomowych. Hybrydyzacja orbitali atomowych.
 Geometria cząsteczek wieloatomowych. Hybrydyzacja orbitali atomowych. Geometria cząsteczek Geometria cząsteczek decyduje zarówno o ich właściwościach fizycznych jak i chemicznych, np. temperaturze wrzenia,
Geometria cząsteczek wieloatomowych. Hybrydyzacja orbitali atomowych. Geometria cząsteczek Geometria cząsteczek decyduje zarówno o ich właściwościach fizycznych jak i chemicznych, np. temperaturze wrzenia,
X / \ Y Y Y Z / \ W W ... imię i nazwisko,nazwa szkoły, miasto
 Zadanie 1. (3 pkt) Nadtlenek litu (Li 2 O 2 ) jest ciałem stałym, występującym w temperaturze pokojowej w postaci białych kryształów. Stosowany jest w oczyszczaczach powietrza, gdzie ważna jest waga użytego
Zadanie 1. (3 pkt) Nadtlenek litu (Li 2 O 2 ) jest ciałem stałym, występującym w temperaturze pokojowej w postaci białych kryształów. Stosowany jest w oczyszczaczach powietrza, gdzie ważna jest waga użytego
WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 STOPIEŃ WOJEWÓDZKI 9 MARCA 2018 R.
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
EGZAMIN SPRAWDZAJĄCY Z CHEMII - WĘGLOWODORY DLA UCZNIÓW KLASY III
 Miejsce na naklejkę z kodem szkoły iejsce na naklejkę z kodem szkoły dysleksja Liczba pkt: Wynik %: Ocena: MCH-R1A1P-062 EGZAMIN SPRAWDZAJĄCY Z CHEMII - WĘGLOWODORY DLA UCZNIÓW KLASY III ARKUSZ II Arkusz
Miejsce na naklejkę z kodem szkoły iejsce na naklejkę z kodem szkoły dysleksja Liczba pkt: Wynik %: Ocena: MCH-R1A1P-062 EGZAMIN SPRAWDZAJĄCY Z CHEMII - WĘGLOWODORY DLA UCZNIÓW KLASY III ARKUSZ II Arkusz
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 KOD UCZNIA Etap: Data: Czas pracy: rejonowy 26 stycznia 2015 r. 90 minut Informacje dla ucznia
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 KOD UCZNIA Etap: Data: Czas pracy: rejonowy 26 stycznia 2015 r. 90 minut Informacje dla ucznia
Kod ucznia Liczba punktów A X B C X
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 18 STYCZNIA 2016 R. 1. Test konkursowy zawiera 19 zadań. Są to zadania zamknięte i otwarte. Na ich
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 18 STYCZNIA 2016 R. 1. Test konkursowy zawiera 19 zadań. Są to zadania zamknięte i otwarte. Na ich
III Podkarpacki Konkurs Chemiczny 2010/2011. ETAP I r. Godz Zadanie 1
 III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
Elementy chemii organicznej
 Elementy chemii organicznej Węglowodory alifatyczne Alkany C n H 2n+2 Alkeny C n H 2n Alkiny C n H 2n-2 Alkany C n H 2n+2 struktura Kekulégo wzór skrócony model Dreidinga metan etan propan butan Nazewnictwo
Elementy chemii organicznej Węglowodory alifatyczne Alkany C n H 2n+2 Alkeny C n H 2n Alkiny C n H 2n-2 Alkany C n H 2n+2 struktura Kekulégo wzór skrócony model Dreidinga metan etan propan butan Nazewnictwo
3. Wprowadzenie do nazewnictwa związków organicznych
 3. Wprowadzenie do nazewnictwa związków organicznych 1 3.1. omologia i izomeria konstytucyjna omologi związki z tej samej klasy, każdy związek różni się od swego poprzednika o jedną grupę metylenową (C
3. Wprowadzenie do nazewnictwa związków organicznych 1 3.1. omologia i izomeria konstytucyjna omologi związki z tej samej klasy, każdy związek różni się od swego poprzednika o jedną grupę metylenową (C
Budowa atomu Poziom: rozszerzony Zadanie 1. (2 pkt.)
 Budowa atomu Poziom: rozszerzony Zadanie 1. (2 pkt.) Zadanie 1 2 3 4 5 6 7 8 9 10 Punkty Okres połowiczego rozpadu pewnego radionuklidu wynosi 16 godzin. a) Określ, ile procent atomów tego izotopu rozpadnie
Budowa atomu Poziom: rozszerzony Zadanie 1. (2 pkt.) Zadanie 1 2 3 4 5 6 7 8 9 10 Punkty Okres połowiczego rozpadu pewnego radionuklidu wynosi 16 godzin. a) Określ, ile procent atomów tego izotopu rozpadnie
Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO:
 FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
Sprawdzian 2. CHEMIA. Przed próbną maturą. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34. Imię i nazwisko ...
 CHEMIA Przed próbną maturą Sprawdzian 2. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34 Imię i nazwisko... Liczba punktów Procent 2 Informacja do zadań 1 i 2. Naturalny chlor występuje
CHEMIA Przed próbną maturą Sprawdzian 2. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34 Imię i nazwisko... Liczba punktów Procent 2 Informacja do zadań 1 i 2. Naturalny chlor występuje
I KSZTAŁCENIA PRAKTYCZNEGO. Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO XV Konkurs Chemii Organicznej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1 (9 pkt) Ciekłą mieszaninę,
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO XV Konkurs Chemii Organicznej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1 (9 pkt) Ciekłą mieszaninę,
b) Podaj liczbę moli chloru cząsteczkowego, która całkowicie przereaguje z jednym molem glinu.
 Informacja do zadań 1 i 2 Chlorek glinu otrzymuje się w reakcji glinu z chlorowodorem lub działając chlorem na glin. Związek ten tworzy kryształy, rozpuszczalne w wodzie zakwaszonej kwasem solnym. Z roztworów
Informacja do zadań 1 i 2 Chlorek glinu otrzymuje się w reakcji glinu z chlorowodorem lub działając chlorem na glin. Związek ten tworzy kryształy, rozpuszczalne w wodzie zakwaszonej kwasem solnym. Z roztworów
Liczba cząsteczek w 1 molu. Liczba atomów w 1 molu. Masa molowa M
 Materiał powtórzeniowy do sprawdzianu - liczba Avogadro, mol, masa molowa, molowa objętość gazów, obliczenia stechiometryczne + zadania z rozwiązaniami I. Podstawowe definicje 1. Masa atomowa - masa atomu
Materiał powtórzeniowy do sprawdzianu - liczba Avogadro, mol, masa molowa, molowa objętość gazów, obliczenia stechiometryczne + zadania z rozwiązaniami I. Podstawowe definicje 1. Masa atomowa - masa atomu
WĘGLOWODORY POWTÓRZENIE WIADOMOŚCI
 WĘGLOWODORY POWTÓRZENIE WIADOMOŚCI 1. W kórym punkcie zapisano wyłącznie węglowodory odbarwiające wodę bromową: a) C 2 H 6 ; C 4 H 10 ; C 6 H 14 b) C 9 H 20 ; C 8 H 16 ; C 2 H 4 c) C 2 H 2 ; C 3 H 6 ;
WĘGLOWODORY POWTÓRZENIE WIADOMOŚCI 1. W kórym punkcie zapisano wyłącznie węglowodory odbarwiające wodę bromową: a) C 2 H 6 ; C 4 H 10 ; C 6 H 14 b) C 9 H 20 ; C 8 H 16 ; C 2 H 4 c) C 2 H 2 ; C 3 H 6 ;
MATERIAŁY POMOCNICZE 1 GDYBY MATURA 2002 BYŁA DZISIAJ CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY ARKUSZ EGZAMINACYJNY I
 MATERIAŁY POMOCNICZE 1 GDYBY MATURA 00 BYŁA DZISIAJ OKRĘ GOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY Informacje ARKUSZ EGZAMINACYJNY I 1. Przy każdym zadaniu podano
MATERIAŁY POMOCNICZE 1 GDYBY MATURA 00 BYŁA DZISIAJ OKRĘ GOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY Informacje ARKUSZ EGZAMINACYJNY I 1. Przy każdym zadaniu podano
Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka
 Slajd 1 Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka Slajd 2 Alkeny Węglowodory te zawierają wiązanie podwójne C C wiązanie double podwójne bond the grupa functional funkcyjna group centrum
Slajd 1 Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka Slajd 2 Alkeny Węglowodory te zawierają wiązanie podwójne C C wiązanie double podwójne bond the grupa functional funkcyjna group centrum
Sprawdzian 1. CHEMIA. Przed próbną maturą. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 32. Imię i nazwisko ...
 CHEMIA Przed próbną maturą Sprawdzian 1. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 32 Imię i nazwisko Liczba punktów Procent 2 Zadanie 1. Cząsteczka pewnej substancji chemicznej
CHEMIA Przed próbną maturą Sprawdzian 1. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 32 Imię i nazwisko Liczba punktów Procent 2 Zadanie 1. Cząsteczka pewnej substancji chemicznej
Wykład 19 XII 2018 Żywienie
 Wykład 19 XII 2018 Żywienie Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas
Wykład 19 XII 2018 Żywienie Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
1 i 2. Struktura elektronowa atomów, tworzenie wiązań chemicznych
 1 i 2. Struktura elektronowa atomów, tworzenie wiązań chemicznych 1 1.1. Struktura elektronowa atomów Rozkład elektronów na pierwszych czterech powłokach elektronowych 1. powłoka 2. powłoka 3. powłoka
1 i 2. Struktura elektronowa atomów, tworzenie wiązań chemicznych 1 1.1. Struktura elektronowa atomów Rozkład elektronów na pierwszych czterech powłokach elektronowych 1. powłoka 2. powłoka 3. powłoka
WYMAGANIA EDUKACYJNE w klasie III
 WYMAGANIA EDUKACYJNE w klasie III Nr lekcji Temat lekcji Treści nauczania (pismem pogrubionym zostały zaznaczone treści Podstawy Programowej) Węgiel i jego związki z wodorem Wymagania i kryteria ocen Uczeń:
WYMAGANIA EDUKACYJNE w klasie III Nr lekcji Temat lekcji Treści nauczania (pismem pogrubionym zostały zaznaczone treści Podstawy Programowej) Węgiel i jego związki z wodorem Wymagania i kryteria ocen Uczeń:
Węglowodory poziom rozszerzony
 Węglowodory poziom rozszerzony Zadanie 1. (1 pkt) Źródło: KE 2010 (PR), zad. 21. Narysuj wzór strukturalny lub półstrukturalny (grupowy) węglowodoru, w którego cząsteczce występuje osiem wiązań σ i jedno
Węglowodory poziom rozszerzony Zadanie 1. (1 pkt) Źródło: KE 2010 (PR), zad. 21. Narysuj wzór strukturalny lub półstrukturalny (grupowy) węglowodoru, w którego cząsteczce występuje osiem wiązań σ i jedno
Wykład 5 XII 2018 Żywienie
 Wykład 5 XII 2018 Żywienie Witold Bekas SGGW Chemia organiczna 1828 Wöhler - przypadkowa synteza mocznika izocyjanian amonu NH4NCO związek nieorganiczny mocznik H2NCONH2 związek organiczny obalenie teorii
Wykład 5 XII 2018 Żywienie Witold Bekas SGGW Chemia organiczna 1828 Wöhler - przypadkowa synteza mocznika izocyjanian amonu NH4NCO związek nieorganiczny mocznik H2NCONH2 związek organiczny obalenie teorii
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII
 KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin 20.01.2010 r. godz. 9 00 Czas pracy: 90 minut ETAP II Ilość punktów za rozwiązanie zadań Część I Część II Ilość punktów za zadanie Ilość punktów
KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin 20.01.2010 r. godz. 9 00 Czas pracy: 90 minut ETAP II Ilość punktów za rozwiązanie zadań Część I Część II Ilość punktów za zadanie Ilość punktów
Wiązania kowalencyjne
 Wiązania kowalencyjne (pierw. o dużej E + pierw. o dużej E), E < 1,8 TERIE WIĄZANIA KWALENCYJNEG Teoria hybrydyzacji orbitali atomowych Teoria orbitali molekularnych Teoria pola ligandów YBRYDYZACJA RBITALI
Wiązania kowalencyjne (pierw. o dużej E + pierw. o dużej E), E < 1,8 TERIE WIĄZANIA KWALENCYJNEG Teoria hybrydyzacji orbitali atomowych Teoria orbitali molekularnych Teoria pola ligandów YBRYDYZACJA RBITALI
VI Podkarpacki Konkurs Chemiczny 2013/2014
 VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
Zadania powtórkowe do egzaminu maturalnego z chemii Wiązania chemiczne, budowa cząsteczek
 strona 1/11 Zadania powtórkowe do egzaminu maturalnego z chemii Wiązania chemiczne, budowa cząsteczek Monika Gałkiewicz Zad. 1 () Podaj wzory dwóch dowolnych kationów i dwóch dowolnych anionów posiadających
strona 1/11 Zadania powtórkowe do egzaminu maturalnego z chemii Wiązania chemiczne, budowa cząsteczek Monika Gałkiewicz Zad. 1 () Podaj wzory dwóch dowolnych kationów i dwóch dowolnych anionów posiadających
Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.
![Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów. Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.](/thumbs/97/131732752.jpg) 2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
Twórcza szkoła dla twórczego ucznia Projekt współfinansowany ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego
 SCENARIUSZ LEKCJI PRZEDMIOT: CHEMIA TEMAT: POWTÓRZENIE WIADOMOŚCI O WĘGLU I WĘGLOWODORACH AUTOR SCENARIUSZA: mgr Ewa Gryczman OPRACOWANIE ELEKTRONICZNO GRAFICZNE : mgr Beata Rusin TEMAT LEKCJI Powtórzenie
SCENARIUSZ LEKCJI PRZEDMIOT: CHEMIA TEMAT: POWTÓRZENIE WIADOMOŚCI O WĘGLU I WĘGLOWODORACH AUTOR SCENARIUSZA: mgr Ewa Gryczman OPRACOWANIE ELEKTRONICZNO GRAFICZNE : mgr Beata Rusin TEMAT LEKCJI Powtórzenie
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje rejonowe Zadanie
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 4 lutego 2016 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 4 lutego 2016 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 4 lutego 2016 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Powodzenia!!! WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII III ETAP. Termin: r. Czas pracy: 90 minut. Liczba otrzymanych punktów
 KOD Ucznia WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII III ETAP Termin: 21.03.2006r. Czas pracy: 90 minut Numer zadania Liczba możliwych punktów 1 6 2 3 3 6 4 7 5 7 6 6 7 6 8 3 9 6 10 8 Razem 58 Liczba otrzymanych
KOD Ucznia WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII III ETAP Termin: 21.03.2006r. Czas pracy: 90 minut Numer zadania Liczba możliwych punktów 1 6 2 3 3 6 4 7 5 7 6 6 7 6 8 3 9 6 10 8 Razem 58 Liczba otrzymanych
Zarys Chemii Organicznej
 Zarys hemii Organicznej hemię organiczną definiuje się jako chemię związków węgla. Ogólna liczba znanych związków organicznych przekracza obecnie 18 milionów i wielokrotnie przewyższa liczbę znanych związków
Zarys hemii Organicznej hemię organiczną definiuje się jako chemię związków węgla. Ogólna liczba znanych związków organicznych przekracza obecnie 18 milionów i wielokrotnie przewyższa liczbę znanych związków
Mechanizm dehydratacji alkoholi
 Wykład 5 Mechanizm dehydratacji alkoholi I. Protonowanie II. odszczepienie cząsteczki wody III. odszczepienie protonu Etap 1 Reakcje alkenów Najbardziej reaktywne jest wiązanie podwójne, lub jego sąsiedztwo
Wykład 5 Mechanizm dehydratacji alkoholi I. Protonowanie II. odszczepienie cząsteczki wody III. odszczepienie protonu Etap 1 Reakcje alkenów Najbardziej reaktywne jest wiązanie podwójne, lub jego sąsiedztwo
A. 3-bromo-3,4-dimetyloheks-5-yn B. 4-bromo-4-etylo-3-metylopent-1-yn C. 4-bromo-3,4-dimetyloheks-1-yn D. 2-etylo-2-bromo-3-metylopent-4-yn
 Zadanie 1. (1 pkt) Wskaż poprawną nazwę poniższego związku. A. 3-bromo-3,4-dimetyloheks-5-yn B. 4-bromo-4-etylo-3-metylopent-1-yn C. 4-bromo-3,4-dimetyloheks-1-yn D. 2-etylo-2-bromo-3-metylopent-4-yn Zadanie
Zadanie 1. (1 pkt) Wskaż poprawną nazwę poniższego związku. A. 3-bromo-3,4-dimetyloheks-5-yn B. 4-bromo-4-etylo-3-metylopent-1-yn C. 4-bromo-3,4-dimetyloheks-1-yn D. 2-etylo-2-bromo-3-metylopent-4-yn Zadanie
Różnorodny świat izomerów powtórzenie wiadomości przed maturą
 Różnorodny świat izomerów powtórzenie wiadomości przed maturą Maria Kluz Klasa III, profil biologiczno-chemiczny i matematyczno-chemiczny 1 godzina lekcyjna, praca w grupie 16-osobowej. Cele edukacyjne:
Różnorodny świat izomerów powtórzenie wiadomości przed maturą Maria Kluz Klasa III, profil biologiczno-chemiczny i matematyczno-chemiczny 1 godzina lekcyjna, praca w grupie 16-osobowej. Cele edukacyjne:
Węglowodory. Michał Szewczyk Kl. IV TI
 Węglowodory Michał Szewczyk Kl. IV TI Węglowodory nasycone (Alkany) Węglowodory nasycone (Alkany)- to związki węgla z wodorem, w których pomiędzy atomami węgla występują tylko pojedyncze wiązania. Wzór
Węglowodory Michał Szewczyk Kl. IV TI Węglowodory nasycone (Alkany) Węglowodory nasycone (Alkany)- to związki węgla z wodorem, w których pomiędzy atomami węgla występują tylko pojedyncze wiązania. Wzór
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2012/2013 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2012/2013 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2012/2013 eliminacje rejonowe Zadanie
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 1 marca 2017 r. zawody III stopnia (wojewódzkie)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 1 marca 2017 r. zawody III stopnia (wojewódzkie) Kod ucznia Suma punktów Witamy Cię na trzecim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 1 marca 2017 r. zawody III stopnia (wojewódzkie) Kod ucznia Suma punktów Witamy Cię na trzecim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2016/2017 CHEMIA
 WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2016/2017 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu wpisz swój kod ustalony
WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2016/2017 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu wpisz swój kod ustalony
Wojewódzki Konkurs Wiedzy Chemicznej 2016/17 Klasy maturalne str. 1
 Wojewódzki Konkurs Wiedzy Chemicznej 2016/17 Klasy maturalne str. 1 Zadanie I. [16 punktów] W zadaniach od 1 5 jedna odpowiedź jest poprawna. Zadanie 1. Aby otrzymać roztwór kwasu azotowego(v) o stężeniu
Wojewódzki Konkurs Wiedzy Chemicznej 2016/17 Klasy maturalne str. 1 Zadanie I. [16 punktów] W zadaniach od 1 5 jedna odpowiedź jest poprawna. Zadanie 1. Aby otrzymać roztwór kwasu azotowego(v) o stężeniu
Slajd 1. Reakcje alkinów
 Slajd 1 Reakcje alkinów Slajd 2 Alkiny to węglowodory zawierające wiązanie potrójne węgiel-węgiel Wzór ogólny: C n H 2n 2 (łańcuchowy); C n H 2n 4 (cykliczny) 1-heksyn terminalny alkin 3-heksyn wewnętrzny
Slajd 1 Reakcje alkinów Slajd 2 Alkiny to węglowodory zawierające wiązanie potrójne węgiel-węgiel Wzór ogólny: C n H 2n 2 (łańcuchowy); C n H 2n 4 (cykliczny) 1-heksyn terminalny alkin 3-heksyn wewnętrzny
KONKURS CHEMICZNY KLAS TRZECICH GIMNAZJALNYCH
 IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 14 maja 2011 Im. Jana Kasprowicza INOWROCŁAW KONKURS CHEMICZNY KLAS TRZECICH GIMNAZJALNYCH ROK SZKOLNY
IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 14 maja 2011 Im. Jana Kasprowicza INOWROCŁAW KONKURS CHEMICZNY KLAS TRZECICH GIMNAZJALNYCH ROK SZKOLNY
Węgiel i jego związki z wodorem
 Węgiel i jego związki z wodorem 1. Związki organiczne i nieorganiczne są to związki chemiczne, które w swoich cząsteczkach zawierają atomy węgla są to związki chemiczne, które w swoich cząsteczkach nie
Węgiel i jego związki z wodorem 1. Związki organiczne i nieorganiczne są to związki chemiczne, które w swoich cząsteczkach zawierają atomy węgla są to związki chemiczne, które w swoich cząsteczkach nie
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE
 PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów dotychczasowych gimnazjów województwa śląskiego w roku szkolnym 2017/2018
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów dotychczasowych gimnazjów województwa śląskiego w roku szkolnym 2017/2018 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów dotychczasowych gimnazjów województwa śląskiego w roku szkolnym 2017/2018 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów
Część I ZADANIA PROBLEMOWE (26 punktów)
 Zadanie 1 (0 6 punktów) Część I ZADANIA PROBLEMOWE (26 punktów) W podanym niżej tekście w miejsce kropek wpisz: - kwas solny - kwas mlekowy - kwas octowy - zjełczałe masło - woda sodowa - pokrzywa - zsiadłe
Zadanie 1 (0 6 punktów) Część I ZADANIA PROBLEMOWE (26 punktów) W podanym niżej tekście w miejsce kropek wpisz: - kwas solny - kwas mlekowy - kwas octowy - zjełczałe masło - woda sodowa - pokrzywa - zsiadłe
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
Orbitale typu σ i typu π
 Orbitale typu σ i typu π Dwa odpowiadające sobie orbitale sąsiednich atomów tworzą kombinacje: wiążącą i antywiążącą. W rezultacie mogą powstać orbitale o rozkładzie przestrzennym dwojakiego typu: σ -
Orbitale typu σ i typu π Dwa odpowiadające sobie orbitale sąsiednich atomów tworzą kombinacje: wiążącą i antywiążącą. W rezultacie mogą powstać orbitale o rozkładzie przestrzennym dwojakiego typu: σ -
IX Podkarpacki Konkurs Chemiczny 2016/2017. ETAP II r. Godz
 KOPKCh IX Podkarpacki Konkurs Chemiczny 2016/2017 ETAP II 17.12.2016 r. Godz. 10.30-12.30 Uwaga! Masy molowe pierwiastków i związków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Płytkę Zn zanurzono do
KOPKCh IX Podkarpacki Konkurs Chemiczny 2016/2017 ETAP II 17.12.2016 r. Godz. 10.30-12.30 Uwaga! Masy molowe pierwiastków i związków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Płytkę Zn zanurzono do
Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r.
 Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r. Lp. Temat lekcji 1. Szereg homologiczny alkanów. 2. Izomeria konstytucyjna w alkanach. 3.
Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r. Lp. Temat lekcji 1. Szereg homologiczny alkanów. 2. Izomeria konstytucyjna w alkanach. 3.
Aminy. - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin
 Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Mat. powtórzeniowy: zad. dot. procesów wieloetapowych w chemii organicznej
 Mat. powtórzeniowy: zad. dot. procesów wieloetapowych w chemii organicznej Zad.1. Zapisz równania reakcji przedstawionych na poniższym schemacie, określ typ rekcji w chemii organicznej, nadaj nazwy systematyczne
Mat. powtórzeniowy: zad. dot. procesów wieloetapowych w chemii organicznej Zad.1. Zapisz równania reakcji przedstawionych na poniższym schemacie, określ typ rekcji w chemii organicznej, nadaj nazwy systematyczne
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
Budowa tłuszczów // // H 2 C O H HO C R 1 H 2 C O C R 1 // // HC O H + HO C R 2 HC - O C R 2 + 3H 2 O
 Tłuszcze (glicerydy) - Budowa i podział tłuszczów, - Wyższe kwasy tłuszczowe, - Hydroliza (zmydlanie) tłuszczów - Utwardzanie tłuszczów -Próba akroleinowa -Liczba zmydlania, liczba jodowa Budowa tłuszczów
Tłuszcze (glicerydy) - Budowa i podział tłuszczów, - Wyższe kwasy tłuszczowe, - Hydroliza (zmydlanie) tłuszczów - Utwardzanie tłuszczów -Próba akroleinowa -Liczba zmydlania, liczba jodowa Budowa tłuszczów
Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków ROZWIĄZANIA ZADAŃ. Po wprowadzeniu bezwodnego kwasu fosforowego(v):
 ROZWIĄZANIA ZADAŃ ZADANIE 1 Szukane: m roztw. = 200 g C mol roztw. =? C p roztw. = 10% m s = 40 g VH 2O= 240 cm 3 Rozwiązanie: 10 g H 3 PO 4 --------------------------- 100 g roztw. x g H 3 PO 4 ---------------------------
ROZWIĄZANIA ZADAŃ ZADANIE 1 Szukane: m roztw. = 200 g C mol roztw. =? C p roztw. = 10% m s = 40 g VH 2O= 240 cm 3 Rozwiązanie: 10 g H 3 PO 4 --------------------------- 100 g roztw. x g H 3 PO 4 ---------------------------
Alkeny. Wzór ogólny alkenów C n H 2n. (Uwaga identyczny wzór ogólny mają cykloakany!!!)
 Alkeny Wzór ogólny alkenów n 2n (Uwaga identyczny wzór ogólny mają cykloakany!!!) Węglowodory nienasycone, zawierające wiązanie podwójne, hybrydyzacja atomow węgla biorących udział w tworzeniu wiązania
Alkeny Wzór ogólny alkenów n 2n (Uwaga identyczny wzór ogólny mają cykloakany!!!) Węglowodory nienasycone, zawierające wiązanie podwójne, hybrydyzacja atomow węgla biorących udział w tworzeniu wiązania
imię i nazwisko, nazwa szkoły, miejscowość Zadania I etapu Konkursu Chemicznego Trzech Wydziałów PŁ V edycja
 Zadanie 1 (2 pkt.) Zmieszano 80 cm 3 roztworu CH3COOH o stężeniu 5% wag. i gęstości 1,006 g/cm 3 oraz 70 cm 3 roztworu CH3COOK o stężeniu 0,5 mol/dm 3. Obliczyć ph powstałego roztworu. Jak zmieni się ph
Zadanie 1 (2 pkt.) Zmieszano 80 cm 3 roztworu CH3COOH o stężeniu 5% wag. i gęstości 1,006 g/cm 3 oraz 70 cm 3 roztworu CH3COOK o stężeniu 0,5 mol/dm 3. Obliczyć ph powstałego roztworu. Jak zmieni się ph
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2018/2019 ETAP REJONOWY
 Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa szkoły KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2018/2019 ETAP REJONOWY Uzyskane
Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa szkoły KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2018/2019 ETAP REJONOWY Uzyskane
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas II LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania
 Cz. I Materiał powtórzeniowy do sprawdzianu dla klas II LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas II LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
Węglowodory powtórzenie wiadomości
 Węglowodory powtórzenie wiadomości 1. Cele lekcji a) Wiadomości Uczeń zna: pojęcia: węglowodór nasycony, nienasycony i aromatyczny, izomeria konstytucyjna i geometryczna, sekstet elektronowy, wiązanie
Węglowodory powtórzenie wiadomości 1. Cele lekcji a) Wiadomości Uczeń zna: pojęcia: węglowodór nasycony, nienasycony i aromatyczny, izomeria konstytucyjna i geometryczna, sekstet elektronowy, wiązanie
Zadanie 1. Wskaż grupę związków chemicznych, do której należy węglowodór o gęstości 2,5 normalne). C. alkiny D. areny
 Węglowodory Zadanie 1. Wskaż grupę związków chemicznych, do której należy węglowodór o gęstości 2,5 normalne). (warunki A. alkany B. alkeny C. alkiny D. areny Zadanie 2. Wskaż wzór półstrukturalny węglowodoru
Węglowodory Zadanie 1. Wskaż grupę związków chemicznych, do której należy węglowodór o gęstości 2,5 normalne). (warunki A. alkany B. alkeny C. alkiny D. areny Zadanie 2. Wskaż wzór półstrukturalny węglowodoru
CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA. POLIMERYZACJA.
 INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA.
INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA.
4-6. Wprowadzenie do nazewnictwa związków organicznych
 4-6. Wprowadzenie do nazewnictwa związków organicznych 1 3.1. omologia i izomeria konstytucyjna omologi związki z tej samej klasy, każdy związek różni się od swego poprzednika o jedną grupę metylenową
4-6. Wprowadzenie do nazewnictwa związków organicznych 1 3.1. omologia i izomeria konstytucyjna omologi związki z tej samej klasy, każdy związek różni się od swego poprzednika o jedną grupę metylenową
WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2017/2018 CHEMIA
 WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2017/2018 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu
WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2017/2018 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu
Kod ucznia... Czas trwania: 100 minut. Arkusz zawiera 17 zadań. Liczba punktów możliwych do uzyskania: 55 pkt.
 XVI Wojewódzki Konkurs z Chemii dla uczniów klas trzecich gimnazjów oraz klas trzecich oddziałów gimnazjalnych prowadzonych w szkołach innego typu województwa świętokrzyskiego w roku szkolnym 2018/2019
XVI Wojewódzki Konkurs z Chemii dla uczniów klas trzecich gimnazjów oraz klas trzecich oddziałów gimnazjalnych prowadzonych w szkołach innego typu województwa świętokrzyskiego w roku szkolnym 2018/2019
Jednostki Ukadu SI. Jednostki uzupełniające używane w układzie SI Kąt płaski radian rad Kąt bryłowy steradian sr
 Jednostki Ukadu SI Wielkość Nazwa Symbol Długość metr m Masa kilogram kg Czas sekunda s Natężenie prądu elektrycznego amper A Temperatura termodynamiczna kelwin K Ilość materii mol mol Światłość kandela
Jednostki Ukadu SI Wielkość Nazwa Symbol Długość metr m Masa kilogram kg Czas sekunda s Natężenie prądu elektrycznego amper A Temperatura termodynamiczna kelwin K Ilość materii mol mol Światłość kandela
PRÓBNY EGZAMIN MATURALNY Z CHEMII
 Miejsce na naklejkę z kodem (Wpisuje zdający przed rozpoczęciem pracy) KOD ZDAJĄCEGO OKRĘGOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE PRÓBNY EGZAMIN MATURALNY Z CHEMII Czas pracy 90 minut Informacje 1.
Miejsce na naklejkę z kodem (Wpisuje zdający przed rozpoczęciem pracy) KOD ZDAJĄCEGO OKRĘGOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE PRÓBNY EGZAMIN MATURALNY Z CHEMII Czas pracy 90 minut Informacje 1.
