NOMENKLATURA ZWIĄZKÓW ORGANICZNYCH
|
|
|
- Amelia Milewska
- 7 lat temu
- Przeglądów:
Transkrypt
1 MEKLATURA ZWIĄZKÓW RGAIZY AZEWITW ALKAÓW Tabela. azwy alkanów prostych o danej liczbie atomów węgla. Liczba atomów węgla metan etan propan butan pentan 6 heksan 7 heptan 8 oktan 9 nonan 0 dekan undekan azwa węglowodoru azwy tworzymy dodając przyrostek an do liczebnika greckiego (lub łacińskiego) odpowiadającego liczbie atomów węgla w najdłuższym łańcuchu prostym, z wyjątkiem alkanów (Tabela.). Główne zasady. Znaleźć najdłuższy ciągły łańcuch węglowy i nazwać go. Jeżeli są dwa łańcuchy tej samej długości to należy wybrać ten o większej liczbie punktów rozgałęzienia.. Ponumerować atomy węgla w łańcuchu głównym zaczynając od końca bliższego pierwszemu punktowi rozgałęzienia. Jeżeli rozgałęzienie jest usytuowane w tej samej odległości od obu końców, to należy tak ponumerować, aby następny w kolejności podstawnik miał najniższy numer (lokant).. W przypadku identycznego położenia dwóch podstawników łańcuch numeruje się tak, żeby podstawnik wcześniej pojawiający się w nazwie (alfabetycznie) miał niższy numer.. azwać podstawniki i przypisać im lokanty.. Zapisać nazwę w postaci jednego słowa stosując łączniki do rozdzielenia różnych przedrostków, a przecinki do rozdzielenia cyfr. Podstawniki zapisuje się w kolejności alfabetycznej. 6 -metylopentan -etylo--metyloheksan 6. Jeśli jest więcej takich samych podstawników, to używa się przedrostków di (), tri (), tetra (), penta (), heksa (6) itd. Kolejność alfabetyczna nie dotyczy przedrostków ,,-trimetylo-6-(-metylopropylo)undekan,-dimetylo-6-(-metylopropylo)undekan
2 izobutyl sec-butyl 7. Jeżeli jeden z podstawników jest rozgałęziony, to nazywamy go zgodnie z poprzednio podanymi regułami rozpoczynając numerację od atomu węgla dołączonego do głównego łańcucha. azwę jego umieszczamy w nawiasach. 8. Alkil to nazwa grupy pochodzącej od alkanu, ale pozbawionej jednego atomu wodoru. tert-butyl (t-butyl) Konkretną nazwę tworzymy dodając przyrostek yl do nazwy alkanu: metyl, butyl, pentyl. Utrzymane jest stosowanie nazw zwyczajowych dla rodników: izopropyl izobutyl izopentyl neopentyl sec-butyl tert-butyl (t-butyl) tert-pentyl izopentyl AZEWITW YKLALKAÓW. Sprawdzamy liczbę atomów węgla w pierścieniu i najdłuższym podstawniku. Przyjmuje się mniejszą jednostkę jako podstawnik w jednostce większej. neopentyl cyklopentan 6 -cykloheksyloheptan -cykloheksyloheptan. Jeżeli w pierścieniu występuje kilka podstawników, to pierścień numeruje się tak, aby liczba utworzona z ich lokantów była najmniejsza.. Jeżeli możliwe są dwa warianty numeracji, to wybieramy ten, w którym wcześniej pojawiający się w nazwie podstawnik uzyskuje niższy numer. 6 7 AZEWITW ALKEÓW. Znajdujemy najdłuższy łańcuch zawierający wiązanie podwójne i nazywamy go dodając do nazwy macierzystego węglowodoru końcówkę en.. Łańcuch numerujemy tak, żeby podwójne wiązanie otrzymało najmniejszy numer.. Podajemy nazwę wyliczając podstawniki w porządku alfabetycznym i numer pierwszego atomu węgla przy podwójnym wiązaniu po nazwie macierzystego węglowodoru, a przed przyrostkiem -en: -metyloheks--en, -propyloheks--en.. Gdy jest więcej wiązań podwójnych, to dodajemy kolejny lokant i końcówkę -dien, -trien. 6 heks-,-dien heksa-,-dien
3 . ykliczne alkeny numerujemy tak, żeby atomy węgla wiązania podwójnego otrzymały numery, a pierwszy podstawnik miał numer najniższy. 6. Utrzymane są nazwy alkenów i rodników: -izopropylocykloheksen eten = etylen propyn winyl = acetylen allil AZEWITW ALKIÓW. Stosuje się te same zasady jak w nazewnictwie alkanów i alkenów. Do nazwy łańcucha (cyklu) dodajemy przyrostek in lub yn, jeżeli obecne jest jedno wiązanie potrójne; diyn, triyn,... jeżeli obecnych jest więcej takich wiązań. Akceptowana jest nazwa zwyczajowa jak acetylen dla etynu.. Znajdujemy najdłuższy łańcuch zawierający wiązania wielokrotne. umerujemy tak, aby wiązanie potrójne miało najniższy numer. Jeżeli występuje również wiązanie podwójne to niższy numer dajemy wiązaniu podwójnemu. pent--en--yn AZEWITW PDY BEZEU pent--en--yn. Unia IUPA dopuszcza stosowanie wielu nazw zwyczajowych, które utrwaliły się w literaturze. benzen fenyl benzyl. azwy monopodstawionych benzenów tworzy się dodając do podstawowej nazwy benzen przedrostek oznaczający nazwę podstawnika. Utrzymuje się nazwę toluen dla metylobenzenu.. azwy związków aromatycznych (arenów) podstawionych podstawnikami alkilowymi tworzy się zależnie od długości łańcucha alkilowego. Jeżeli łańcuch alkilowy ma 6 i mniej atomów węgla, to uzyskuje nazwę jako pochodna benzenu. Jeżeli główny łańcuch ma więcej atomów węgla, to nazywamy związek jako pochodną alkilową z przyłączonym podstawnikiem fenylowym (Ph, Φ).
4 -fenyloheptan nitrobenzen. azwy dipodstawionych pochodnych benzenu tworzy się przy pomocy przedrostków orto (o), meta (m), para (p) lub odpowiednio cyfr,-,,-,,-, często stosując nazwę zwyczajową monopochodnej. o-metylotoluen m-metylotoluen p-metylotoluen. azwy pochodnych benzenu mających więcej niż dwa podstawniki tworzy się przez podanie pozycji podstawienia i nazwy podstawnika w porządku alfabetycznym jako przedrostka. Podstawniki numeruje się tak, aby miały najmniejsze numery. -etylo--propylo--t-butylobenzen AZEWITW ALGEKÓW. Łańcuch numerujemy od krańca bliższego pierwszemu atomowi fluorowca. Jeżeli w molekule występuje więcej atomów tego samego pierwiastka, to w nazwie uwzględniamy to używając przedrostków di, tri, tetra.... Podstawniki w nazwie umieszczamy w porządku alfabetycznym. l l -bromo-,-dichlorobenzen -bromo-,-dichlorobenzen. azwy grupowo-funkcyjne tworzy się poprzedzając nazwę słowem chlorek, bromek czy jodek, np. l chlorek metylu () l chlorek t-butylu 6 - -Br bromek benzylu.. Utrzymuje się nazwy zwyczajowe: chloroform l, jodoform I. Br
5 AZEWITW ALKLI. azwy alkoholi tworzy się od nazwy macierzystego alkanu przez dołączenie przyrostka ol: np. etanol, cykloheksanol. Przy wyższych alkoholach do nazwy alkanu dołączamy lokant i końcówkę ol, np. butan--ol, butan--ol. azwy: izopropanol czy sec-butanol są błędne, ponieważ nie ma węglowodorów izopropan czy sec-butan. Dopuszczalne są jednak alkohol izopropylowy czy alkohol sec-butylowy. alkohol izopropylowy (propan--ol) propan--ol. Łańcuch numerujemy tak, żeby grupa hydroksylowa miała najmniejszy numer. AZEWITW FELI. Utrzymuje się nazwy zwyczajowe: fenol AZEWITW ETERÓW p-krezol hydrochinon. Etery proste, nie zawierające grup funkcyjnych, nazywa się używając słowa eter i podając w kolejności alfabetycznej nazwy dwóch grup organicznych przyłączonych do atomu tlenu. eter dietylowy eter cyklopentylo-metylowy cyklopentano-metylowy. Jeżeli w molekule znajdują się inne grupy funkcyjne część eterowa nazywana jest podstawnikiem alkoksylowym. propoksybenzen AZEWITW ALDEYDÓW I KETÓW. Wyszukujemy najdłuższy łańcuch zawierający grupę aldehydową i do nazwy macierzystego alkanu dodajemy końcówkę al. etanal heks--endial heks--enodial
6 . umerujemy atomy węgla rozpoczynając od atomu węgla aldehydowego.. Jeżeli grupa aldehydowa stanowi podstawnik, stosujemy przedrostek formylo. -formyloheksanodial. Ketony numerujemy tak, aby karbonylowy atom węgla miał najniższy numer. Do nazwy macierzystego alkanu dodajemy końcówkę on i podajemy numer atomu węgla karbonylowego. W nomenklaturze grupowo-funkcyjnej podajemy słowo keton i wymieniamy przyłączone grupy. pent--en--on pent--en--on keton etylowo-metylowy. Zaakceptowano nazwę zwyczajową acetonu. 6. Jeżeli grupa R-= jest traktowana jako podstawnik, wówczas przyjmuje nazwę acyl. azwy konkretnych grup przyjmują przyrostki yl, il: - acetyl (grupa acetylowa), 6 - benzoil (grupa benzoilowa). 7. Używa się nazw: acetofenon benzofenon AZEWITW KWASÓW KARBKSYLWY. Szukamy najdłuższego łańcucha zawierającego grupę karboksylową i numerujemy atomy węgla przypisując grupie karboksylowej cyfrę.. azywamy łańcuch macierzysty zgodnie z najwyższym numerem atomu węgla i tworzymy nazwę przez podanie słowa kwas i przyrostka owy.. Jeżeli w molekule występuje więcej niż jedna grupa karboksylowa to do nazwy dodajemy przyrostek oznaczający ilość grup, np. diowy kwas,-difenyloheptanodiowy kwas cykloheksanokarboksylowy 6
7 . Używa się nazw zwyczajowych do wielu kwasów: wzór nazwa kwasu nazwa grupy acylowej mrówkowy metanowy octowy etanowy propionowy propanowy masłowy butanowy walerianowy pentanowy heksadekanowy palmitynowy oktadekanowy stearynowy szczawiowy etanodiowy malonowy propanodiowy bursztynowy butanodiowy benzenokarboksylowy benzoesowy formylacetylpropionylpropanoilbutyrylbutanoilwalerylpentanoilpalmitoilstearoiloksalilmalonylsukcynylbenzoil- AZEWITW ESTRÓW. azwę estru tworzy się wymieniając jako pierwszy człon nazwę anionu kwasu karboksylowego, a jako drugi człon resztę alkilową bądź arylową. octan etylu octan benzylu benzoesan fenylu (etanian etylu) cykloheksanokarboksylan metylu AZEWITW AMIDÓW. azywanie amidów polega na dodaniu do nazwy węglowodoru o takiej samej liczbie atomów węgla, co w amidzie (węglowodoru macierzystego) końcówki -amid i łącznika o, np. etanoamid (etan + o + amid), propanoamid czy heksanoamid. Utrzymuje się nazwy zwyczajowe, pochodzące od macierzystych kwasów, np.: benzamid,-dimetylobutanoamid acetamid acetanilid 7
8 . -podstawione amidy nazywa się ze wskazaniem rodników przez literę :,-dimetylobutanoamid acetanilid MEKLATURA AMI. azwy I-rzędowych amin tworzy się dodając przyrostek amina do nazwy macierzystego węglowodoru lub stosując przedrostek amino.. Utrzymuje się nazwę zwyczajową dla I-rz. aminy aromatycznej: anilina. etyloamina -propylobutyloamina cykloheksanoamina anilina etyloamina -aminoheptan (aminobenzen). Symetryczne II- i III-rzędowe aminy nazywa się dodając przedrostek di-, tri- do przyrostka amina lub wymieniając alfabetycznie wszystkie podstawniki. iesymetryczne aminy traktuje się jako podstawione aminy I-rzędowe. cykloheksylometyloetyloamina cykloheksyloetylometyloamina -izopropylo--pentyloanilina -izopropylo--pentyloanilina 8
9 PIERWSZEŃSTW I MEKLATURA GRUP FUKYJY grupa funkcyjna przyrostek przedrostek kwasy karboksylowe kwas owy karboksy- - kwas karboksylowy bezwodniki kwasowe ---bezwodnik owy bezwodnik -karboksylowy estry -an -ylu alkoksykarbonylo- --R- -karboksylan -ylu halogenki kwasowe halogenek oilu halokarbonylo- --Xamidy -amid karbamoilo- -- (=R, R ) -karboksyamid nitryle - -nitryl -karbonitryl cyjanocyjanek aldehydy -al okso- - -karboaldehyd ketony -on okso- R--R alkohole -ol hydroksy- - fenole -ol hydroksy- Φ- tiole -tiol sulfanylo- -S aminy -amina amino- - alkeny -en alkenyloalkiny -in alkinyloalkany -an alkilo- Grupy podrzędne etery R--R sulfidy -R-Shalogenki -X związki nitrowe - związki nitrozo - -alkoksy -alkilosulfanylo -halo -nitro -nitrozo ZASADY AZEWITWA ZWIĄZKÓW WIELFUKYJY. kreślić rodzaj grupy, która została uznana za główną, patrz: Pierwszeństwo i nomenklatura grup funkcyjnych.. Wszystkie pozostałe grupy muszą być podane jako przedrostki.. kreślić łańcuch główny.. Wprowadzić numerację atomów.. Zachować kolejność alfabetyczną przedrostków. 9
10 PYTAIA SPRAWDZAJĄE azwać następujące związki: 6 S l
11 arysować następujące związki:.,-dimetylo--propyloheptan.,,-trimetylookta-,,6-trien. okta-,-dien-6-in. -bromo--neopentylotoluen. eter cyklopentylowopropylowy 6. keton benzylowometylowy 7. -chloro--oksopentan 8. yklopentanokarboksylan izopropylowy 9. -izopropylo--metylocykloheksyloamina 0. kwas trifenylooctowy.,-diaminobutan. -fenyloacetamid. chlorek -metoksy--metylobut--enoilu. -metoksy--metylo--etylo--metyloanilina. eter benzylowo-etylowy 6. -aminobenzoesan fenylowy 7. o-allilofenol 8. benzoesan tetrametyloamoniowy 9. cykloheks--enol 0. kwas,,6-trinitrobenzoesowy
NOMENKLATURA ZWIĄZKÓW ORGANICZNYCH
 Zakład hemii rganicznej UMB Materiał omenklatura związków organicznych Farmacja 0 MEKLATURA ZWIĄZKÓW RGAIZY ALKAY Tabela. azwy alkanów prostych o danej liczbie atomów węgla. Liczba atomów azwa węglowodoru
Zakład hemii rganicznej UMB Materiał omenklatura związków organicznych Farmacja 0 MEKLATURA ZWIĄZKÓW RGAIZY ALKAY Tabela. azwy alkanów prostych o danej liczbie atomów węgla. Liczba atomów azwa węglowodoru
Elementy chemii organicznej
 Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
ZASADY SYSTEMATYCZNEGO NAZEWNICTWA ZWIĄZKÓW ORGANICZNYCH CZĘŚĆ I. WĘGLOWODORY 1. ALKANY I CYKLOALKANY
 ZASADY SYSTEMATYZEG AZEWITWA ZWIĄZKÓW GAIZY 1. ALKAY I YKLALKAY ZĘŚĆ I. WĘGLWDY azwy łańcuchów węglowych 1-20 : 1 - metan 6 - heksan 11 - undekan 16 - heksadekan 2 - etan 7 - heptan 12 - dodekan 17 - heptadekan
ZASADY SYSTEMATYZEG AZEWITWA ZWIĄZKÓW GAIZY 1. ALKAY I YKLALKAY ZĘŚĆ I. WĘGLWDY azwy łańcuchów węglowych 1-20 : 1 - metan 6 - heksan 11 - undekan 16 - heksadekan 2 - etan 7 - heptan 12 - dodekan 17 - heptadekan
δ + δ - δ + R O H RJC R δ + δ - δ - δ + R O R Grupy Funkcyjne δ + O NH 2 R N H H R N Slides 1 to 41
 1 δ + δ + δ + R R X Grupy Funkcyjne δ + δ + R R R δ + R δ + X δ + R N R δ + R δ + R R δ + R δ + N 2 R δ + R N δ + δ + Slides 1 to 41 2 Grupy Funkcyjne Zawierające eteroatomy Grupy funkcyjne mają często
1 δ + δ + δ + R R X Grupy Funkcyjne δ + δ + R R R δ + R δ + X δ + R N R δ + R δ + R R δ + R δ + N 2 R δ + R N δ + δ + Slides 1 to 41 2 Grupy Funkcyjne Zawierające eteroatomy Grupy funkcyjne mają często
Materiały do zajęć dokształcających z chemii organicznej
 hemia Warta Poznania - nowa JAKOŚĆ studiowania -zwiększenie liczby absolwentów oraz atrakcyjności studiów na kierunku EMIA na Uniwersytecie im. A. Mickiewicza w Poznaniu Materiały do zajęć dokształcających
hemia Warta Poznania - nowa JAKOŚĆ studiowania -zwiększenie liczby absolwentów oraz atrakcyjności studiów na kierunku EMIA na Uniwersytecie im. A. Mickiewicza w Poznaniu Materiały do zajęć dokształcających
ZASADY SYSTEMATYCZNEGO NAZEWNICTWA ZWIĄZKÓW ORGANICZNYCH część I. WĘGLOWODORY. 1. ALKANY i CYKLOALKANY
 ZASADY SYSTEMATYZNEG NAZEWNITWA ZWIĄZKÓW RGANIZNY część I. WĘGLWDRY 1. ALKANY i YKLALKANY Nazwy łańcuchów węglowych 1-20 : 1 - metan 6 - heksan 11 - undekan 16 - heksadekan 2 - etan 7 - heptan 12 - dodekan
ZASADY SYSTEMATYZNEG NAZEWNITWA ZWIĄZKÓW RGANIZNY część I. WĘGLWDRY 1. ALKANY i YKLALKANY Nazwy łańcuchów węglowych 1-20 : 1 - metan 6 - heksan 11 - undekan 16 - heksadekan 2 - etan 7 - heptan 12 - dodekan
CHEMIA ORGANICZNA. dr hab. Włodzimierz Gałęzowski Wydział Chemii UAM (61)
 EMIA ORGANIZNA dr hab. Włodzimierz Gałęzowski Wydział hemii UAM (61) 829 1477 wlodgal@amu.edu.pl Materiał wymagany na egzaminie: wykłady ćwiczenia szkoła średnia http://staff.amu.edu.pl/~wlodgal Podręczniki
EMIA ORGANIZNA dr hab. Włodzimierz Gałęzowski Wydział hemii UAM (61) 829 1477 wlodgal@amu.edu.pl Materiał wymagany na egzaminie: wykłady ćwiczenia szkoła średnia http://staff.amu.edu.pl/~wlodgal Podręczniki
węglowodory łańcuchowe lub cykliczne posiadające dwa wiązania podwójne C=C KLASYFIKACJA DIENY SKUMULOWANE alleny (kumuleny)
 DIENY węglowodory łańcuchowe lub cykliczne posiadające dwa wiązania podwójne C=C KLASYFIKACJA DIENY SKUMULOWANE alleny (kumuleny) 2 C C C 2 2 C C C C C 3 propa-1,2-dien penta-1,2,3-trien DIENY IZOLOWANE
DIENY węglowodory łańcuchowe lub cykliczne posiadające dwa wiązania podwójne C=C KLASYFIKACJA DIENY SKUMULOWANE alleny (kumuleny) 2 C C C 2 2 C C C C C 3 propa-1,2-dien penta-1,2,3-trien DIENY IZOLOWANE
3. Wprowadzenie do nazewnictwa związków organicznych
 3. Wprowadzenie do nazewnictwa związków organicznych 1 3.1. omologia i izomeria konstytucyjna omologi związki z tej samej klasy, każdy związek różni się od swego poprzednika o jedną grupę metylenową (C
3. Wprowadzenie do nazewnictwa związków organicznych 1 3.1. omologia i izomeria konstytucyjna omologi związki z tej samej klasy, każdy związek różni się od swego poprzednika o jedną grupę metylenową (C
pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 )
 FLUOROWCOPOCODNE alogenki alkilowe- Cl C 2 -C 2 -C 2 -C 3 C 3 -C-C 3 C 2 -C-C 3 pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 ) I C 3 C 3 Cl-C 2 -C=C 2 Cl-C-C=C 2 1 2 3 Allilowe atom fluorowca
FLUOROWCOPOCODNE alogenki alkilowe- Cl C 2 -C 2 -C 2 -C 3 C 3 -C-C 3 C 2 -C-C 3 pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 ) I C 3 C 3 Cl-C 2 -C=C 2 Cl-C-C=C 2 1 2 3 Allilowe atom fluorowca
B I O T E. p e n t a n d e k a n
 CnHn+ Węglowodory o łańcuchu prostym: B I O T E C H N O L EMIA O G ORGANICZNA I A Nomenklatura n nazwa n nazwa n nazwa n nazwa metan dodekan 9 nonakozan 90 NONAKONTAN etan tridekan 0 TRIAKONTAN 00 H E
CnHn+ Węglowodory o łańcuchu prostym: B I O T E C H N O L EMIA O G ORGANICZNA I A Nomenklatura n nazwa n nazwa n nazwa n nazwa metan dodekan 9 nonakozan 90 NONAKONTAN etan tridekan 0 TRIAKONTAN 00 H E
4-6. Wprowadzenie do nazewnictwa związków organicznych
 4-6. Wprowadzenie do nazewnictwa związków organicznych 1 3.1. omologia i izomeria konstytucyjna omologi związki z tej samej klasy, każdy związek różni się od swego poprzednika o jedną grupę metylenową
4-6. Wprowadzenie do nazewnictwa związków organicznych 1 3.1. omologia i izomeria konstytucyjna omologi związki z tej samej klasy, każdy związek różni się od swego poprzednika o jedną grupę metylenową
Alkeny. Wzór ogólny alkenów C n H 2n. (Uwaga identyczny wzór ogólny mają cykloakany!!!)
 Alkeny Wzór ogólny alkenów n 2n (Uwaga identyczny wzór ogólny mają cykloakany!!!) Węglowodory nienasycone, zawierające wiązanie podwójne, hybrydyzacja atomow węgla biorących udział w tworzeniu wiązania
Alkeny Wzór ogólny alkenów n 2n (Uwaga identyczny wzór ogólny mają cykloakany!!!) Węglowodory nienasycone, zawierające wiązanie podwójne, hybrydyzacja atomow węgla biorących udział w tworzeniu wiązania
Halogenki alkilowe RX
 alogenki alkilowe X Nazewnictwo halogenków alkilowych 1. Znajdź i nazwij łańcuch macierzysty. Tak jak przy nazywaniu alkanów, wybierz najdłuższy łańcuch. Jeżeli w cząsteczce obecne jest wiązanie podwójne
alogenki alkilowe X Nazewnictwo halogenków alkilowych 1. Znajdź i nazwij łańcuch macierzysty. Tak jak przy nazywaniu alkanów, wybierz najdłuższy łańcuch. Jeżeli w cząsteczce obecne jest wiązanie podwójne
CHEMIA ORGANICZA - węglowodory. Podział węglowodorów
 EMIA ORGANIZA - węglowodory Podział węglowodorów Najprostsze związki organiczne Alkany są to węglowodory nasycone, w których występują tylko pojedyncze wiązania węgiel węgiel Wszystkie nazwy alkanów charakteryzuje
EMIA ORGANIZA - węglowodory Podział węglowodorów Najprostsze związki organiczne Alkany są to węglowodory nasycone, w których występują tylko pojedyncze wiązania węgiel węgiel Wszystkie nazwy alkanów charakteryzuje
AMINY. nikotyna. tytoń szlachetny. pseudoefedryna (SUDAFED) atropina. muskaryna H 3 C CH 3 O
 AMINY nikotyna H 3 C NH tytoń szlachetny OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN 2 NUKLEOFILOWOŚĆ i ZASADOWOŚĆ AMIN 3 REAKCJA AMIN Z KWASAMI MINERALNYMI I KARBOKSYLOWYMI
AMINY nikotyna H 3 C NH tytoń szlachetny OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN 2 NUKLEOFILOWOŚĆ i ZASADOWOŚĆ AMIN 3 REAKCJA AMIN Z KWASAMI MINERALNYMI I KARBOKSYLOWYMI
Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup
 Cz. XXV - Kwasy karboksylowe Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup karboksylowych - CH ( - C - H ), atom C w grupie funkcyjnej jest na hybrydyzacji sp 2,
Cz. XXV - Kwasy karboksylowe Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup karboksylowych - CH ( - C - H ), atom C w grupie funkcyjnej jest na hybrydyzacji sp 2,
-pinen (składnik terpentyny)
 ALKENY (OLEFINY) WZÓR SUMARYZNY n 2n - alkeny łańcuchowe; n 2n-2 - alkeny cykliczne (cykloalkeny) etylen (produkcja polietylenu) WŁAŚIWOŚI FIZYZNE -pinen (składnik terpentyny) cis-trikoz-9-en (hormon płciowy
ALKENY (OLEFINY) WZÓR SUMARYZNY n 2n - alkeny łańcuchowe; n 2n-2 - alkeny cykliczne (cykloalkeny) etylen (produkcja polietylenu) WŁAŚIWOŚI FIZYZNE -pinen (składnik terpentyny) cis-trikoz-9-en (hormon płciowy
STRUKTURA określa w jaki sposób poszczególne atomy połączone są w cząsteczce
 Jakie zagadnienia będą poruszane podczas zgłębiania chemii związków węgla, czyli chemii organicznej? STRUKTURA określa w jaki sposób poszczególne atomy połączone są w cząsteczce MEANIZM - w jaki sposób
Jakie zagadnienia będą poruszane podczas zgłębiania chemii związków węgla, czyli chemii organicznej? STRUKTURA określa w jaki sposób poszczególne atomy połączone są w cząsteczce MEANIZM - w jaki sposób
17. DODATKI Tabela 1. Symbole okre laj ce wielokrotno ci i podwielokrotno ci ułamków dziesi tnych Symbol Okre lenie Wielokrotno Tabela 2.
 17. DDATKI Tabela 1. Symbole określające wielokrotności i podwielokrotności ułamków dziesiętnych Symbol kreślenie Wielokrotność T tera 10 12 G giga 10 9 M mega 10 6 k kilo 10 3 h hekto 10 2 da deka 10
17. DDATKI Tabela 1. Symbole określające wielokrotności i podwielokrotności ułamków dziesiętnych Symbol kreślenie Wielokrotność T tera 10 12 G giga 10 9 M mega 10 6 k kilo 10 3 h hekto 10 2 da deka 10
Rodzaje wiązań chemicznych
 Rodzaje wiązań chemicznych Teoria Lewisa (1916) atomy łączą się ze sobą przez przeniesienie (1 lub więcej) elektronów z jednego atomu na drugi wiązanie jonowe lub przez uwspólnienie par elektronowych aby
Rodzaje wiązań chemicznych Teoria Lewisa (1916) atomy łączą się ze sobą przez przeniesienie (1 lub więcej) elektronów z jednego atomu na drugi wiązanie jonowe lub przez uwspólnienie par elektronowych aby
Biotechnologia sem. II. Rok akademicki 2012/2013. Ćwiczenia tablicowe z chemii organicznej. Zestaw nr 1
 I. Nazewnictwo systematyczne w skrócie: Biotechnologia sem. II Rok akademicki 2012/2013 Ćwiczenia tablicowe z chemii organicznej Zestaw nr 1 Nazwa związku organicznego składa się z prefiksów (przedrostków),
I. Nazewnictwo systematyczne w skrócie: Biotechnologia sem. II Rok akademicki 2012/2013 Ćwiczenia tablicowe z chemii organicznej Zestaw nr 1 Nazwa związku organicznego składa się z prefiksów (przedrostków),
Stałe siłowe. Spektroskopia w podczerwieni. Spektrofotometria w podczerwieni otrzymywanie widm
 Spektroskopia w podczerwieni Spektrofotometria w podczerwieni otrzymywanie widm absorpcyjnych substancji o różnych stanach skupienia. Powiązanie widm ze strukturą pozwala na identyfikację związku. Widmo
Spektroskopia w podczerwieni Spektrofotometria w podczerwieni otrzymywanie widm absorpcyjnych substancji o różnych stanach skupienia. Powiązanie widm ze strukturą pozwala na identyfikację związku. Widmo
Cząsteczki wieloatomowe - hybrydyzacja. Czy w oparciu o koncepcję orbitali molekularnych można wytłumaczyć budowę cząsteczek?
 ząsteczki wieloatomowe - hybrydyzacja zy w oparciu o koncepcję orbitali molekularnych można wytłumaczyć budowę cząsteczek? Koncepcja OA OA O zdelokalizowane OA hyb OA O zlokalizowane OA hyb OA hyb OA orbitale
ząsteczki wieloatomowe - hybrydyzacja zy w oparciu o koncepcję orbitali molekularnych można wytłumaczyć budowę cząsteczek? Koncepcja OA OA O zdelokalizowane OA hyb OA O zlokalizowane OA hyb OA hyb OA orbitale
Cząsteczki wieloatomowe - hybrydyzacja. Czy w oparciu o koncepcję orbitali molekularnych można wytłumaczyć budowę cząsteczek?
 ząsteczki wieloatomowe - hybrydyzacja zy w oparciu o koncepcję orbitali molekularnych można wytłumaczyć budowę cząsteczek? Fakty doświadczalne Wiązanie ząsteczka Długość wiązania [pm] - - 97-2 96-2 2 97-3
ząsteczki wieloatomowe - hybrydyzacja zy w oparciu o koncepcję orbitali molekularnych można wytłumaczyć budowę cząsteczek? Fakty doświadczalne Wiązanie ząsteczka Długość wiązania [pm] - - 97-2 96-2 2 97-3
Alkany. Alkeny. Alkiny
 Węglowodory Alkany Alkeny Alkiny Spis treści: Podział węglowodorów. Porównanie Alkany: budowa cząsteczki, szereg homologiczny, konformacje i izomeria, nazewnictwo, właściwości fizyczne, właściwości chemiczne.
Węglowodory Alkany Alkeny Alkiny Spis treści: Podział węglowodorów. Porównanie Alkany: budowa cząsteczki, szereg homologiczny, konformacje i izomeria, nazewnictwo, właściwości fizyczne, właściwości chemiczne.
Grupa karbonylowa. Grupa karbonylowa to grupa funkcyjna, w której atom tlenu połączony jest z atomem węgla podwójnym wiązaniem
 ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
Slajd 1. Wstęp do chemii organicznej. Nomenklatura, własności fizyczne, struktura. eter. mapa potencjału elektrostatycznego cząsteczki eteru etylowego
 Slajd 1 Wstęp do chemii organicznej Nomenklatura, własności fizyczne, struktura hybrydyzacja sp 3 eter mapa potencjału elektrostatycznego cząsteczki eteru etylowego Slajd 2 Alkany to węglowodory zawierające
Slajd 1 Wstęp do chemii organicznej Nomenklatura, własności fizyczne, struktura hybrydyzacja sp 3 eter mapa potencjału elektrostatycznego cząsteczki eteru etylowego Slajd 2 Alkany to węglowodory zawierające
Elementy chemii organicznej
 Elementy chemii organicznej Węglowodory alifatyczne Alkany C n H 2n+2 Alkeny C n H 2n Alkiny C n H 2n-2 Alkany C n H 2n+2 struktura Kekulégo wzór skrócony model Dreidinga metan etan propan butan Nazewnictwo
Elementy chemii organicznej Węglowodory alifatyczne Alkany C n H 2n+2 Alkeny C n H 2n Alkiny C n H 2n-2 Alkany C n H 2n+2 struktura Kekulégo wzór skrócony model Dreidinga metan etan propan butan Nazewnictwo
Reakcje kwasów karboksylowych i ich pochodnych
 27-29. eakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór N grupa karbonylowa atom (, N lub Cl) o większej
27-29. eakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór N grupa karbonylowa atom (, N lub Cl) o większej
RJC # Defin i i n c i ja
 Alkany - Izomery Strukturalne & Konformacyjne - Nomenklatura - Projekcje Newmana Slides 1 to 41 Definicja Wzór ogólny dla alkanów C n 2n+2 Przykładowo... metan C 4 etan C 2 6 propan C 3 8 butan C 4 10
Alkany - Izomery Strukturalne & Konformacyjne - Nomenklatura - Projekcje Newmana Slides 1 to 41 Definicja Wzór ogólny dla alkanów C n 2n+2 Przykładowo... metan C 4 etan C 2 6 propan C 3 8 butan C 4 10
H H H. Wzór "płaskostrukturalny": Wzór klinowy: H H. Model kulkowy cząsteczki: (obrazuje długosci wiązań, kąty między wiązaniami)
 Autor: Marek Walnik, 04 Alkany - węglowodory nasycone, parafiny. Związki węgla z wodorem, w których cząsteczkach występują wyłącznie wiązania pojedyncze. Szczególną klasę związków tego typu stanowią cykloalkany
Autor: Marek Walnik, 04 Alkany - węglowodory nasycone, parafiny. Związki węgla z wodorem, w których cząsteczkach występują wyłącznie wiązania pojedyncze. Szczególną klasę związków tego typu stanowią cykloalkany
HCOOH kwas metanowy ( mrówkowy ) CH 3. COOH kwas etanowy ( octowy ) CH 2
 Kwasy karboksylowe, Ar Nazewnictwo: Kwasy, które są pochodnymi alkanów o otwartych łańcuchach, są nazywane w sposób systematyczny przez dodanie nazwy kwas i dodanie końcówki owy do alkanu - kwas alkanowy
Kwasy karboksylowe, Ar Nazewnictwo: Kwasy, które są pochodnymi alkanów o otwartych łańcuchach, są nazywane w sposób systematyczny przez dodanie nazwy kwas i dodanie końcówki owy do alkanu - kwas alkanowy
Alkohole i fenole Grupa funkcyjna OH
 Alkohole i fenole Grupa funkcyjna OH Alkohole - związki posiadające grupę funkcyjną "z prawdziwego zdarzenia" - grupę główną. Wiązanie podwójne (lub potrójne) C-C zaliczane jest do grup funkcyjnych, ale
Alkohole i fenole Grupa funkcyjna OH Alkohole - związki posiadające grupę funkcyjną "z prawdziwego zdarzenia" - grupę główną. Wiązanie podwójne (lub potrójne) C-C zaliczane jest do grup funkcyjnych, ale
Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO:
 FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
Spis treści. Budowa alkanów. 1 Budowa alkanów 2 Reakcje chemiczne alkanów 3 Izomeria 4 Rzędowość atomów węgla 5 Energia wewnętrzna. Konformacje.
 Spis treści 1 Budowa alkanów 2 Reakcje chemiczne alkanów 3 Izomeria 4 Rzędowość atomów węgla 5 Energia wewnętrzna. Konformacje. Budowa alkanów Poznawanie związków organicznych zaczniemy od substancji najprostszych
Spis treści 1 Budowa alkanów 2 Reakcje chemiczne alkanów 3 Izomeria 4 Rzędowość atomów węgla 5 Energia wewnętrzna. Konformacje. Budowa alkanów Poznawanie związków organicznych zaczniemy od substancji najprostszych
Grupy główne wg malejcego pierwszestwa. Alkohole i fenole Grupa funkcyjna OH
 Alkohole i fenole Grupa funkcyjna OH Alkohole - zwizki posiadajce grup funkcyjn "z prawdziwego zdarzenia" - grup główn. Wizanie podwójne (lub potrójne) C-C zaliczane jest do grup funkcyjnych, ale w nazwie
Alkohole i fenole Grupa funkcyjna OH Alkohole - zwizki posiadajce grup funkcyjn "z prawdziwego zdarzenia" - grup główn. Wizanie podwójne (lub potrójne) C-C zaliczane jest do grup funkcyjnych, ale w nazwie
Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r.
 Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r. Lp. Temat lekcji 1. Szereg homologiczny alkanów. 2. Izomeria konstytucyjna w alkanach. 3.
Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r. Lp. Temat lekcji 1. Szereg homologiczny alkanów. 2. Izomeria konstytucyjna w alkanach. 3.
Spis treści 1. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2001 2 2. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2002 7
 Spis treści 1. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2001 2 2. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2002 7 3. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2003 13 4. MIELEC - DANE ZA ROK 2001 19 5. MIELEC
Spis treści 1. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2001 2 2. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2002 7 3. WOJEWÓDZTWO PODKARPACKIE - DANE ZA ROK 2003 13 4. MIELEC - DANE ZA ROK 2001 19 5. MIELEC
14. Reakcje kwasów karboksylowych i ich pochodnych
 14. Reakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór R N R R grupa karbonylowa atom (, N lub Cl) o
14. Reakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór R N R R grupa karbonylowa atom (, N lub Cl) o
CHEMIA klasa 3 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery.
 CHEMIA klasa 3 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery. Dział - Węgiel i jego związki. określa, czym zajmuje się chemia organiczna definiuje
CHEMIA klasa 3 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery. Dział - Węgiel i jego związki. określa, czym zajmuje się chemia organiczna definiuje
Wymagania na poszczególne oceny z chemii w klasie III VII. Węgiel i jego związki z wodorem
 Wymagania na poszczególne oceny z chemii w klasie III VII. Węgiel i jego związki z wodorem 1 Uczeń: wyjaśnia, czym zajmuje się chemiaorganiczna (2) definiuje pojęcie węglowodory (2) wymienia naturalne
Wymagania na poszczególne oceny z chemii w klasie III VII. Węgiel i jego związki z wodorem 1 Uczeń: wyjaśnia, czym zajmuje się chemiaorganiczna (2) definiuje pojęcie węglowodory (2) wymienia naturalne
Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka
 Slajd 1 Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka Slajd 2 Alkeny Węglowodory te zawierają wiązanie podwójne C C wiązanie double podwójne bond the grupa functional funkcyjna group centrum
Slajd 1 Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka Slajd 2 Alkeny Węglowodory te zawierają wiązanie podwójne C C wiązanie double podwójne bond the grupa functional funkcyjna group centrum
Pochodne węglowodorów
 Pochodne węglowodorów 1. Pochodne węglowodorów To związki chemiczne pochodzące od węglowodorów, które w cząsteczkach oprócz węgla, wodoru mają inne pierwiastki chemiczne, np. tlen, azot, chlor. Pochodne
Pochodne węglowodorów 1. Pochodne węglowodorów To związki chemiczne pochodzące od węglowodorów, które w cząsteczkach oprócz węgla, wodoru mają inne pierwiastki chemiczne, np. tlen, azot, chlor. Pochodne
Kilka wskazówek ułatwiających analizę widm w podczerwieni
 Kilka wskazówek ułatwiających analizę widm w podczerwieni Opracowanie wg dostępnej literatury spektroskopowej: Dr Alina T. Dubis e-mail: alina@uwb.edu.pl Instytut Chemii Uniwersytet w Białymstoku Al. J.
Kilka wskazówek ułatwiających analizę widm w podczerwieni Opracowanie wg dostępnej literatury spektroskopowej: Dr Alina T. Dubis e-mail: alina@uwb.edu.pl Instytut Chemii Uniwersytet w Białymstoku Al. J.
Klasyfikacja i przykłady ETERY
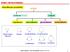 ETERY I EPKSYZWIĄZKI Klasyfikacja i przykłady ETERY acykliczne R--R cykliczne trójczłonowe czteroczłonowe pięcioczłonowe sześcioczłonowe tlenek etylenu (oksiran) oksetan tetrahydrofuran tetrahydropiran
ETERY I EPKSYZWIĄZKI Klasyfikacja i przykłady ETERY acykliczne R--R cykliczne trójczłonowe czteroczłonowe pięcioczłonowe sześcioczłonowe tlenek etylenu (oksiran) oksetan tetrahydrofuran tetrahydropiran
10. Alkeny wiadomości wstępne
 0. Alkeny wiadomości wstępne 5.. Nazewnictwo Nazwa systematyczna eten propen cyklopenten cykloheksen Nazwa zwyczajowa etylen propylen Wiązanie = w łańcuchu głównym, lokant = najniższy z możliwych -propyloheks--en
0. Alkeny wiadomości wstępne 5.. Nazewnictwo Nazwa systematyczna eten propen cyklopenten cykloheksen Nazwa zwyczajowa etylen propylen Wiązanie = w łańcuchu głównym, lokant = najniższy z możliwych -propyloheks--en
17. CH 2 CH CH 2 C CH 18. CH
 1. NAZEWNICTW ZWIĄZKÓW RGANICZNY węglowodory nasycone: alkany, cykloalkany węglowodory nienasycone: alkeny, alkiny, cykloalkeny Podać nazwy systematyczne następujących węglowodorów, uwzględnić izomerię:
1. NAZEWNICTW ZWIĄZKÓW RGANICZNY węglowodory nasycone: alkany, cykloalkany węglowodory nienasycone: alkeny, alkiny, cykloalkeny Podać nazwy systematyczne następujących węglowodorów, uwzględnić izomerię:
Materiał powtórzeniowy do sprawdzianu - węglowodory nasycone - alkany + przykładowe zadania
 Materiał powtórzeniowy do sprawdzianu - węglowodory nasycone - alkany + przykładowe zadania I. Atom węgla w związkach organicznych i jego rzędowość 1. Hybryzdyzacja atomu węgla a) konfiguracja elektronowa
Materiał powtórzeniowy do sprawdzianu - węglowodory nasycone - alkany + przykładowe zadania I. Atom węgla w związkach organicznych i jego rzędowość 1. Hybryzdyzacja atomu węgla a) konfiguracja elektronowa
Pochodne węglowodorów, w cząsteczkach których jeden atom H jest zastąpiony grupą hydroksylową (- OH ).
 Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
ZWIĄZKI MAGNEZOORGANICZNE. Krystyna Dzierzbicka
 ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
I. Węgiel i jego związki z wodorem
 NaCoBeZU z chemii dla klasy 3 I. Węgiel i jego związki z wodorem 1. Poznajemy naturalne źródła węglowodorów wymieniam kryteria podziału chemii na organiczną i nieorganiczną wyjaśniam, czym zajmuje się
NaCoBeZU z chemii dla klasy 3 I. Węgiel i jego związki z wodorem 1. Poznajemy naturalne źródła węglowodorów wymieniam kryteria podziału chemii na organiczną i nieorganiczną wyjaśniam, czym zajmuje się
Zarys Chemii Organicznej
 Zarys hemii Organicznej hemię organiczną definiuje się jako chemię związków węgla. Ogólna liczba znanych związków organicznych przekracza obecnie 18 milionów i wielokrotnie przewyższa liczbę znanych związków
Zarys hemii Organicznej hemię organiczną definiuje się jako chemię związków węgla. Ogólna liczba znanych związków organicznych przekracza obecnie 18 milionów i wielokrotnie przewyższa liczbę znanych związków
WĘGLOWODORY AROMATYCZNE
 WĘGLOWODORY AROMATYCZNE cykliczne węglowodory spełniające warunki aromatyczności: Ale: związki niearomatyczne 1 ZWIĄZKI AROMATYCZNE - przykłady 2 NOMENKLATURA Monocykliczne węglowodory aromatyczne są nazywane
WĘGLOWODORY AROMATYCZNE cykliczne węglowodory spełniające warunki aromatyczności: Ale: związki niearomatyczne 1 ZWIĄZKI AROMATYCZNE - przykłady 2 NOMENKLATURA Monocykliczne węglowodory aromatyczne są nazywane
CHEMIA ORGANICZNA. Zakres materiału
 EMIA ORGANIZNA Zakres materiału lp wykład data temat 1 W1-W2 7.10.2015 klasy zw org alkany i cykloalkany 2 W3-W4 14.10.2015 stereoizomeria 3 W5-W6 21.10.2015 alkeny i cykloalkeny 4 W7-W8 28.10.2015 alkadieny
EMIA ORGANIZNA Zakres materiału lp wykład data temat 1 W1-W2 7.10.2015 klasy zw org alkany i cykloalkany 2 W3-W4 14.10.2015 stereoizomeria 3 W5-W6 21.10.2015 alkeny i cykloalkeny 4 W7-W8 28.10.2015 alkadieny
Pochodne kwasów karboksylowych. Krystyna Dzierzbicka
 Pochodne kwasów karboksylowych Krystyna Dzierzbicka halogenki kwasowe X X = l, Br, I bezwodniki kwasowe ' estry ' amidy N 2 sole nitryle N Nazwy grup acylowych 3 3 2 acyl metanoil formyl etanoil acetyl
Pochodne kwasów karboksylowych Krystyna Dzierzbicka halogenki kwasowe X X = l, Br, I bezwodniki kwasowe ' estry ' amidy N 2 sole nitryle N Nazwy grup acylowych 3 3 2 acyl metanoil formyl etanoil acetyl
Zakres materiału do sprawdzianu - alkeny, alkiny i areny + przykładowe zadania
 Zakres materiału do sprawdzianu - alkeny, alkiny i areny + przykładowe zadania I. Węglowodory nienasycone 1. Alkeny - węglowodory nienasycone w cząsteczkach których między atomami węgla występuje jedno
Zakres materiału do sprawdzianu - alkeny, alkiny i areny + przykładowe zadania I. Węglowodory nienasycone 1. Alkeny - węglowodory nienasycone w cząsteczkach których między atomami węgla występuje jedno
Plan wynikowy z chemii do klasy III gimnazjum w roku szkolnym 2017/2018. Liczba godzin tygodniowo: 1.
 1 Plan wynikowy z chemii do klasy III gimnazjum w roku szkolnym 2017/2018. Liczba godzin tygodniowo: 1. Tytuł rozdziału w podręczniku Temat lekcji podstawowe Węgiel i jego związki z wodorem 1.Omówienie
1 Plan wynikowy z chemii do klasy III gimnazjum w roku szkolnym 2017/2018. Liczba godzin tygodniowo: 1. Tytuł rozdziału w podręczniku Temat lekcji podstawowe Węgiel i jego związki z wodorem 1.Omówienie
Podział związków organicznych
 Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Węglowodory Aromatyczne
 Węglowodory Aromatyczne Benzen Rezonans & Aromatyczność Nazewnictwo (nomenklatura) Slides 1 to 38 Węglowodory Aromatyczne W pierwotnym znaczeniu słowo aroma nawiązywało do pachnących składników roślin;
Węglowodory Aromatyczne Benzen Rezonans & Aromatyczność Nazewnictwo (nomenklatura) Slides 1 to 38 Węglowodory Aromatyczne W pierwotnym znaczeniu słowo aroma nawiązywało do pachnących składników roślin;
Slajd 1. Reakcje alkinów
 Slajd 1 Reakcje alkinów Slajd 2 Alkiny to węglowodory zawierające wiązanie potrójne węgiel-węgiel Wzór ogólny: C n H 2n 2 (łańcuchowy); C n H 2n 4 (cykliczny) 1-heksyn terminalny alkin 3-heksyn wewnętrzny
Slajd 1 Reakcje alkinów Slajd 2 Alkiny to węglowodory zawierające wiązanie potrójne węgiel-węgiel Wzór ogólny: C n H 2n 2 (łańcuchowy); C n H 2n 4 (cykliczny) 1-heksyn terminalny alkin 3-heksyn wewnętrzny
Nazewnictwo Związków Organicznych
 I. Nazewnictwo Związków rganicznych 1 Nazewnictwo Związków rganicznych I. Nazewnictwo Związków rganicznych 2 I. Nomenklatura węglowodorów 1. Nazewnictwo węglowodorów nasyconych Węglowodory nasycone acykliczne
I. Nazewnictwo Związków rganicznych 1 Nazewnictwo Związków rganicznych I. Nazewnictwo Związków rganicznych 2 I. Nomenklatura węglowodorów 1. Nazewnictwo węglowodorów nasyconych Węglowodory nasycone acykliczne
WYMAGANIA EDUKACYJNE z chemii dla klasy trzeciej
 Lucyna Krupa Rok szkolny 2016/2017 Anna Mikrut WYMAGANIA EDUKACYJNE z chemii dla klasy trzeciej Wyróżnia się wymagania na: ocenę dopuszczającą ocenę dostateczną (obejmują wymagania na ocenę dopuszczającą)
Lucyna Krupa Rok szkolny 2016/2017 Anna Mikrut WYMAGANIA EDUKACYJNE z chemii dla klasy trzeciej Wyróżnia się wymagania na: ocenę dopuszczającą ocenę dostateczną (obejmują wymagania na ocenę dopuszczającą)
Spis treści 1. Struktura elektronowa związków organicznych 2. Budowa przestrzenna cząsteczek związków organicznych
 Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Chemia organiczna. Alkohole Fenole. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
E l e m e n t y c h e m i i o r g a n i c z n e j
 Elementy c h e m i i o r g a n i c z n e j Elementy chemii organicznej Strona 2 / 11 SPIS TREŚCI 1. PODSTAWY...3 2. WĘGLOWODORY...3 2.1. Alkany... 4 2.2. Alkeny... 5 2.3. Alkiny... 5 2.4. Reakcje alkenów
Elementy c h e m i i o r g a n i c z n e j Elementy chemii organicznej Strona 2 / 11 SPIS TREŚCI 1. PODSTAWY...3 2. WĘGLOWODORY...3 2.1. Alkany... 4 2.2. Alkeny... 5 2.3. Alkiny... 5 2.4. Reakcje alkenów
Wymagania edukacyjne niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych CHEMIA klasa III Oceny śródroczne:
 Wymagania edukacyjne niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych CHEMIA klasa III Oceny śródroczne: Ocenę dopuszczającą otrzymuje uczeń, który: -określa, co to są
Wymagania edukacyjne niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych CHEMIA klasa III Oceny śródroczne: Ocenę dopuszczającą otrzymuje uczeń, który: -określa, co to są
Wyróżnione wymagania programowe odpowiadają wymaganiom ogólnym i szczegółowym zawartym w treściach nauczania podstawy programowej.
 Wymagania programowe na poszczególne oceny (IV etap edukacyjny) przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
Wymagania programowe na poszczególne oceny (IV etap edukacyjny) przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
Reakcje aldehydów i ketonów. grupa karbonylowa Z = H, aldehyd Z = R (czyli at. C), keton
 30-33. Reakcje aldehydów i ketonów grupa karbonylowa Z =, aldehyd Z = R (czyli at. C), keton Chemia rganiczna, dr hab. inż. Mariola Koszytkowska-Stawińska, WChem PW; 2017/2018 1 15.1. Nazewnictwo Aldehyd
30-33. Reakcje aldehydów i ketonów grupa karbonylowa Z =, aldehyd Z = R (czyli at. C), keton Chemia rganiczna, dr hab. inż. Mariola Koszytkowska-Stawińska, WChem PW; 2017/2018 1 15.1. Nazewnictwo Aldehyd
KWASY KARBOKSYLOWE. Krystyna Dzierzbicka
 KWASY KARBKSYLWE Krystyna Dzierzbicka Kwasy karboksylowe są związkami organicznymi zawierającymi grupę karboksylową - zbudowaną z grupy karbonylowej () i hydroksylowej (). R (Ar) karboksylowy Możemy je
KWASY KARBKSYLWE Krystyna Dzierzbicka Kwasy karboksylowe są związkami organicznymi zawierającymi grupę karboksylową - zbudowaną z grupy karbonylowej () i hydroksylowej (). R (Ar) karboksylowy Możemy je
 1. NAZEWNITW ZWIĄZKÓW RGANIZNY węglowodory nasycone: alkany, cykloalkany węglowodory nienasycone: alkeny, alkiny, cykloalkeny Podać nazwy systematyczne następujących węglowodorów, uwzględnić izomerię:
1. NAZEWNITW ZWIĄZKÓW RGANIZNY węglowodory nasycone: alkany, cykloalkany węglowodory nienasycone: alkeny, alkiny, cykloalkeny Podać nazwy systematyczne następujących węglowodorów, uwzględnić izomerię:
WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne. Z CHEMII W KLASIE III gimnazjum
 WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne Z CHEMII W KLASIE III gimnazjum Program nauczania chemii w gimnazjum autorzy: Teresa Kulawik, Maria Litwin Program realizowany przy pomocy
WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne Z CHEMII W KLASIE III gimnazjum Program nauczania chemii w gimnazjum autorzy: Teresa Kulawik, Maria Litwin Program realizowany przy pomocy
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
WYMAGANIA EDUKACYJNE
 GIMNAZJUM NR 2 W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie III GIMNAZJUM Wymagania edukacyjne niezbędne do uzyskania
GIMNAZJUM NR 2 W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie III GIMNAZJUM Wymagania edukacyjne niezbędne do uzyskania
Kwasy karboksylowe grupa funkcyjna: -COOH. Wykład 8 1
 Kwasy karboksylowe grupa funkcyjna: -CH Wykład 8 1 1. Reakcje utleniania a) utlenianie alkoholi pierwszorzędowych trzymywanie kwasów CH 3 H 3 C C CH 2 H CH 3 alkohol pierwszorzędowy CH K 2 Cr 2 3 7 H 3
Kwasy karboksylowe grupa funkcyjna: -CH Wykład 8 1 1. Reakcje utleniania a) utlenianie alkoholi pierwszorzędowych trzymywanie kwasów CH 3 H 3 C C CH 2 H CH 3 alkohol pierwszorzędowy CH K 2 Cr 2 3 7 H 3
Węgiel i jego związki z wodorem
 Węgiel i jego związki z wodorem 1. Związki organiczne i nieorganiczne są to związki chemiczne, które w swoich cząsteczkach zawierają atomy węgla są to związki chemiczne, które w swoich cząsteczkach nie
Węgiel i jego związki z wodorem 1. Związki organiczne i nieorganiczne są to związki chemiczne, które w swoich cząsteczkach zawierają atomy węgla są to związki chemiczne, które w swoich cząsteczkach nie
ODPORNOŚD CHEMICZNA TERMOPLASTÓW
 PMMA PC PU PCV PVDF PTFE PP PE PET POMH POMC PA66 PA6 ODPORNOŚD CHEMICZNA TERMOPLASTÓW Odporny. Niewielkie lub żadne zmiany w masie. Nieznaczny wpływ na właściwości mechaniczne. Częściowo odporny. Wraz
PMMA PC PU PCV PVDF PTFE PP PE PET POMH POMC PA66 PA6 ODPORNOŚD CHEMICZNA TERMOPLASTÓW Odporny. Niewielkie lub żadne zmiany w masie. Nieznaczny wpływ na właściwości mechaniczne. Częściowo odporny. Wraz
A B C D A B C 4. D A B C D
 1. Kartkówka, 21 października 2015; zestaw Imię i azwisko: Zad. 1. (1 p) Wśród podanych związków,, i D, wszystkie atomy węgla występują w tym samym stanie hybrydyzacji w związkach: i i D 3. i 4. i D Zad.
1. Kartkówka, 21 października 2015; zestaw Imię i azwisko: Zad. 1. (1 p) Wśród podanych związków,, i D, wszystkie atomy węgla występują w tym samym stanie hybrydyzacji w związkach: i i D 3. i 4. i D Zad.
Ocena dobra [ ] Uczeń:
![Ocena dobra [ ] Uczeń: Ocena dobra [ ] Uczeń:](/thumbs/67/57994710.jpg) Chemia - klasa III Wymagania edukacyjne 1.Węglowodory Ocena dopuszczająca [1] definiuje pojęcia: węglowodory, alkany, alkeny, alkiny, szereg homologiczny, grupa alkilowa, reakcje podstawiania (substytucji),
Chemia - klasa III Wymagania edukacyjne 1.Węglowodory Ocena dopuszczająca [1] definiuje pojęcia: węglowodory, alkany, alkeny, alkiny, szereg homologiczny, grupa alkilowa, reakcje podstawiania (substytucji),
Alkohole i fenole. Opracowanie: Bartłomiej SIEPSIAK klasa 3d Opiekun: p. Teresa Gębicka
 Alkohole i fenole Opracowanie: Bartłomiej SIEPSIAK klasa d Opiekun: p. Teresa Gębicka Budowa alkoholi i fenoli Szereg homologiczny alkoholi Nazewnictwo Podział alkoholi Otrzymywanie alkoholi Właściwości
Alkohole i fenole Opracowanie: Bartłomiej SIEPSIAK klasa d Opiekun: p. Teresa Gębicka Budowa alkoholi i fenoli Szereg homologiczny alkoholi Nazewnictwo Podział alkoholi Otrzymywanie alkoholi Właściwości
WYMAGANIA EDUKACYJNE w klasie III
 WYMAGANIA EDUKACYJNE w klasie III Nr lekcji Temat lekcji Treści nauczania (pismem pogrubionym zostały zaznaczone treści Podstawy Programowej) Węgiel i jego związki z wodorem Wymagania i kryteria ocen Uczeń:
WYMAGANIA EDUKACYJNE w klasie III Nr lekcji Temat lekcji Treści nauczania (pismem pogrubionym zostały zaznaczone treści Podstawy Programowej) Węgiel i jego związki z wodorem Wymagania i kryteria ocen Uczeń:
Alkany i Cykloalkany C n H 2n+2
 Alkany i Cykloalkany C n H 2n+2 C n H 2n Alkany - węglowodory nasycone RH węglowodory ponieważ składają się jedynie z atomów C i H nasycone, bo zawierają jedynie pojedyncze wiązania C C i tym samym mają
Alkany i Cykloalkany C n H 2n+2 C n H 2n Alkany - węglowodory nasycone RH węglowodory ponieważ składają się jedynie z atomów C i H nasycone, bo zawierają jedynie pojedyncze wiązania C C i tym samym mają
Kwasy karboksylowe to jednofunkcyjne pochodne węglowodorów o grupie funkcyjnej -COOH zwanej grupą karboksylową.
 Spis treści: Charakterystyka grupy karboksylowej Podział kwasów karboksylowych Nazewnictwo kwasy monokarboksylowe alifatyczne nasycone kwasy monokarboksylowe alifatyczne nienasycone kwasy dikarboksylowe
Spis treści: Charakterystyka grupy karboksylowej Podział kwasów karboksylowych Nazewnictwo kwasy monokarboksylowe alifatyczne nasycone kwasy monokarboksylowe alifatyczne nienasycone kwasy dikarboksylowe
Zadanie 1. Wskaż grupę związków chemicznych, do której należy węglowodór o gęstości 2,5 normalne). C. alkiny D. areny
 Węglowodory Zadanie 1. Wskaż grupę związków chemicznych, do której należy węglowodór o gęstości 2,5 normalne). (warunki A. alkany B. alkeny C. alkiny D. areny Zadanie 2. Wskaż wzór półstrukturalny węglowodoru
Węglowodory Zadanie 1. Wskaż grupę związków chemicznych, do której należy węglowodór o gęstości 2,5 normalne). (warunki A. alkany B. alkeny C. alkiny D. areny Zadanie 2. Wskaż wzór półstrukturalny węglowodoru
Rozdział 6. Odpowiedzi i rozwiązania zadań. Chemia organiczna. Zdzisław Głowacki. Zakres podstawowy i rozszerzony
 Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Zdzisław Głowacki. Zakres podstawowy i rozszerzony. Odpowiedzi i rozwiązania zadań. Rozdział 2. Strona Linia zadanie Jest Powinno być
 Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 2 Errata do drugiego rozdziału ćwiczeń: Strona Linia zadanie Jest Powinno być Str. 52 Zadanie
Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 2 Errata do drugiego rozdziału ćwiczeń: Strona Linia zadanie Jest Powinno być Str. 52 Zadanie
18. Reakcje benzenu i jego pochodnych
 18. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień benzenowy
18. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień benzenowy
C OH ALKOHOLE ETERY R OH R O R R' O FENOLE. Ar OH NOMENKLATURA ALKOHOLE ZWIĄZKI ORGANICZNE ZAWIERAJĄCE W STRUKTURZE ATOMY TLENU C O C OH CH 3 OH
 ZWIĄZKI GANIZNE ZAWIEAJĄE W STUKTUZE ATMY TLENU 8 1s2 2s 2 2p 4 okres 2; grupa VI w związkach jest dwuwiążący, z dwoma niewiążącymi parami elektronów drugi w skali elektroujemności Paulinga 3.5 (za fluorem)
ZWIĄZKI GANIZNE ZAWIEAJĄE W STUKTUZE ATMY TLENU 8 1s2 2s 2 2p 4 okres 2; grupa VI w związkach jest dwuwiążący, z dwoma niewiążącymi parami elektronów drugi w skali elektroujemności Paulinga 3.5 (za fluorem)
Kwasy karboksylowe C O OH OH C CH 2 H OH CH 2 C CH 3 C OH C OH C OH. propionowy. mrówkowy. akrylowy. octowy. masłowy metakrylowy.
 Kwasy karboksylowe Największą kwasowość spośród związków organicznych wykazują kwasy karboksylowe. Związki te zawierają w cząsteczce grupę karboksylową H, połączoną albo z grupą alkilową R (RH) albo grupą
Kwasy karboksylowe Największą kwasowość spośród związków organicznych wykazują kwasy karboksylowe. Związki te zawierają w cząsteczce grupę karboksylową H, połączoną albo z grupą alkilową R (RH) albo grupą
Wymagania edukacyjne niezbędne do uzyskania oceny klasyfikacyjnej z chemii klasa trzecia -chemia organiczna
 Wymagania edukacyjne niezbędne do uzyskania oceny klasyfikacyjnej z chemii klasa trzecia -chemia organiczna 1. Chemia organiczna jako chemia związków węgla Ocena dopuszczająca Ocena dostateczna Ocena dobra
Wymagania edukacyjne niezbędne do uzyskania oceny klasyfikacyjnej z chemii klasa trzecia -chemia organiczna 1. Chemia organiczna jako chemia związków węgla Ocena dopuszczająca Ocena dostateczna Ocena dobra
Wymagania edukacyjne z chemii oraz sposoby sprawdzania wiedzy i umiejętności
 Wymagania edukacyjne z chemii oraz sposoby sprawdzania wiedzy i umiejętności Kwasy Wymagania edukacyjne z podstawy programowej - klasa VIII Uczeń: definiuje pojęcie kwasy zgodnie z teorią Arrheniusa opisuje
Wymagania edukacyjne z chemii oraz sposoby sprawdzania wiedzy i umiejętności Kwasy Wymagania edukacyjne z podstawy programowej - klasa VIII Uczeń: definiuje pojęcie kwasy zgodnie z teorią Arrheniusa opisuje
Krystyna Dzierzbicka
 Krystyna Dzierzbicka Fenole związki organiczne, w których grupa hydroksylowa związana jest bezpośrednio z atomem węgla układu aromatycznego (z węglem o hybrydyzacji sp 2 ). Przykłady i -naftol -naftol
Krystyna Dzierzbicka Fenole związki organiczne, w których grupa hydroksylowa związana jest bezpośrednio z atomem węgla układu aromatycznego (z węglem o hybrydyzacji sp 2 ). Przykłady i -naftol -naftol
1. Chemia organiczna jako chemia związków węgla. 2. Węglowodory
 Propozycje wymagań programowych na poszczególne oceny przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
Propozycje wymagań programowych na poszczególne oceny przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
CHEMIA KLASA Chemia organiczna jako chemia związków węgla. 2. Węglowodory
 CHEMIA KLASA 3 Wymagania programowe na poszczególne oceny przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
CHEMIA KLASA 3 Wymagania programowe na poszczególne oceny przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
Wyróżnione wymagania programowe odpowiadają wymaganiom ogólnym i szczegółowym zawartym w treściach nauczania podstawy programowej.
 Wymagania programowe z chemii na poszczególne oceny. IV etap edukacyjny - przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. Podręcznika dla liceum
Wymagania programowe z chemii na poszczególne oceny. IV etap edukacyjny - przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. Podręcznika dla liceum
Wyróżnione wymagania programowe odpowiadają wymaganiom ogólnym i szczegółowym zawartym w treściach nauczania podstawy programowej.
 Propozycje wymagań programowych na poszczególne oceny (IV etap edukacyjny) przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum
Propozycje wymagań programowych na poszczególne oceny (IV etap edukacyjny) przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum
Odporność chemiczna. Chemikalia 20 C 50 C Aceton 100% - - Żywica poliestrowa
 Aceton 100% - - kwas adypinowy, wszystkie konc.. + 0 Ałun,wszystkie konc. + 0 Alkohol (butylowy-), 100% + - Alkohol (etylowy), 10% + 0 Alkohol (etylowy), 50% + 0 Alkohol (etylowy), 100% 0 - Alkohol (metylowy),
Aceton 100% - - kwas adypinowy, wszystkie konc.. + 0 Ałun,wszystkie konc. + 0 Alkohol (butylowy-), 100% + - Alkohol (etylowy), 10% + 0 Alkohol (etylowy), 50% + 0 Alkohol (etylowy), 100% 0 - Alkohol (metylowy),
Wyróżnione wymagania programowe odpowiadają wymaganiom ogólnym i szczegółowym zawartym w treściach nauczania podstawy programowej.
 Wymagania na poszczególne oceny (IV etap edukacyjny) przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego i
Wymagania na poszczególne oceny (IV etap edukacyjny) przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego i
Ocena dobra [ ] Uczeń:
![Ocena dobra [ ] Uczeń: Ocena dobra [ ] Uczeń:](/thumbs/55/35935976.jpg) KLASA III A Wymagania edukacyjne na poszczególne oceny przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
KLASA III A Wymagania edukacyjne na poszczególne oceny przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
