czyli politropa jest w tym przypadku przemianą przy stałym ciśnieniu nazywaną izobarą. Równanie przemiany izobarycznej ma postać (2.
|
|
|
- Jolanta Kurek
- 8 lat temu
- Przeglądów:
Transkrypt
1 remiany_gau_dosk Charakterystyne remiany gau doskonałego. Premiana oitroowa Premianą oitroową naywamy remianę o równaniu idem (. ub V idem (. gdie V / m. W równaniah (. i (. jest wykładnikiem oitroy. Podstawowe remiany gau doskonałego można roatrywać jako segóe ryadki oitroy. W aeżnośi od wartośi oitroa może być remianą ry stałym iśnieniu, remianą ry stałej objętośi, remianą ry stałej temerature, y remianą ry stałej entroii.. Iobara Da wykładnika oitroy 0 jest 0 idem yi oitroa jest w tym ryadku remianą ry stałym iśnieniu naywaną iobarą. ównanie remiany iobarynej ma ostać idem (. Na rys. 4.4 i 4.5 redstawiono eksansję iobaryną. Podas eksansji iobarynej więksa się objętość gau ora wrasta temeratura. Cieło jest dorowadane do gau a raa wyrowadana. Na rys. 4.5 da orównania narysowano też remianę iohoryną, która jest inią bardiej stromą. Funkja (s da = idem ub :4:00
2 remiany_gau_dosk = idem jest funkją wykładnią. Premianę iobaryną można reaiować w yindre amkniętym resuwnym tłokiem, na który diała stała siła, dorowadają (eksansja ub odrowadają (komresja ieło. ermine równanie stanu da oątku remiany iobarynej - (. ermine równanie stanu da końa remiany iobarynej - (.3 Po odieeniu równania (.3 re równanie (. dostajemy (.4 ównanie (.4 można rekstałić do ostai (.5 Z równania (.5 wynika, że objętość gau odgrewanego iobarynie wrasta roorjonaie do temeratury. Jeżei temeratura gau wrośnie dwukrotnie, to również jego objętość wrośnie dwukrotnie. Jednostkową raę bewgędną remiany wynaymy ogóej aeżnośi ( d [J/kg] (.6 gdie da remiany iobarynej funkja ( ma ostać idem (.7 Po odstawieniu (.7 do równania (.6 i sałkowaniu otrymujemy ( (.8 ównanie (.8 jest słusne da dowoego ynnika termodynaminego, yi także da gaów reywistyh, iey i iał stałyh. Jednostkowa raa tehnina remiany t ( d ( d 0 [J/kg] (.9 Cieło właśiwe ry stałym iśnieniu,, ma da okreśonego gau doskonałego wartość stałą. Stąd jednostkowe ieło remiany iobarynej jest równe q ( [J/kg] (.0 Pryrost właśiwej energii wewnętrnej :4:00
3 remiany_gau_dosk u ( [J/kg] (. Zaeżność (. jest słusna da dowoej remiany gau doskonałego, onieważ energia wewnętrna jest arametrem stanu, yi jej ryrost nie aeży od rodaju remiany. Pryrost entaii właśiwej i ( [J/kg] (. Zaeżność (. jest słusna da dowoej remiany gau doskonałego, onieważ entaia jest arametrem stanu, yi jej ryrost nie aeży od rodaju remiany. Pierwsa ostać ierwsej asada termodynamiki (I Z q u (.3 Druga ostać ierwsej asada termodynamiki q i t i (.4 Pryrost entroii właśiwej można obiyć aeżnośi s [J/(kg K] (.5 ub s [J/(kg K] (.6 Zaeżnośi (.5 i (.6 są słusne da dowoej remiany gau doskonałego, onieważ entroia jest arametrem stanu, yi jej ryrost nie aeży od rodaju remiany. Da remiany iobarynej równanie (.6 urasa się do ostai s (.7 Ponieważ równanie (.7 wykorystuje aeżność, jego stosowaość ostała ograniona do remiany iobarynej gau doskonałego. Da ałkowitej iośi substanji w układie L J mkg J / kg n t t 3 3 kmo J / kmo V um J / um u (.8 L m (.9 Q mq (.0 U mu (. I mi (. S ms ( :4:00
4 remiany_gau_dosk 3. Iohora idem (3. idem Wykładnik oitroy (3. (3.3 ównanie remiany idem (3.4 Premiana redstawiona na rys. 4. ora 4.3 jest srężaniem iohorynym, onieważ odas remiany wrasta iśnienie. Premianę iohoryną można reaiować w biorniku o stałej objętośi dorowadają do ynnika (srężanie ub wyrowadają (rorężanie ieło. ermine równanie stanu da stanu oątkowego (3.5 ermine równanie stanu da stanu końowego (3.6 Po odieeniu stronami równania (3.6 re równanie (3.5 dostajemy ( :4:00
5 remiany_gau_dosk (3.8 Z równania (3.8 wynika, że iśnienie gau odgrewanego iohorynie wrasta roorjonaie do temeratury. Jeżei temeratura gau wrośnie dwukrotnie, to również jego iśnienie wrośnie dwukrotnie. Jednostkowa raa bewgędna remiany ( d ( d 0 [J/kg] (3.9 Jednostkowa raa tehnina remiany t ( d ( [J/kg] (3.0 Praa tehnina dana równaniem (3.0 nie ma sensu fiynego da ojedynej remiany. Praę taką naeżałoby dorowadić (w ryadku srężania do masyny reływowej, aby retłoyć ynnik e biornika, w którym anuje iśnienie, do biornika, w którym anuje iśnienie. W ryadku remiany iohorynej wrost iśnienia wynika nie e miany objętośi, e e miany temeratury (odgranie gau od temeratury do temeratury. Jednostkowe ieło remiany q ( [J/kg] (3. Pryrost właśiwej energii wewnętrnej u ( [J/kg] (3. Pryrost entaii właśiwej i ( [J/kg] (3.3 Pierwsa asada termodynamiki (I Z q u u (3.4 q i (3.5 t Pryrost entroii właśiwej s [J/(kg K] (3.6 s [J/(kg K] ( Ioterma idem (4. Nieh wykładnik oitroy będie równy ( :4:00
6 remiany_gau_dosk Wówas równanie remiany oitroowej (4. ma ostać idem (4.3 ermine równanie stanu da oątku i końa roważanej remiany (4.4 (4.5 Z równania (4.3 wynika, że ewe strony równań (4.4 i (4.5 są sobie równe (4.6 stąd również rawe strony tyh równań są sobie równe (4.7 yi remiana oitroowa wykładnikiem oitroy jest równy jednośi jest remianą, odas której nie mienia się temeratura gau. Premiana taka naywana jest iotermą. idem (4.8 Jednostkowa raa bewgędna remiany ( d (4.9 Z równania (4.6 wynaamy funkję ( :4:00
7 remiany_gau_dosk ( (4.0 Prawą stronę równania (4.0 odstawiamy do równania (4.9 i ałkujemy d (4. Jednostkowa raa tehnina remiany t ( d (4. Z (4.6 ( (4.3 (4.3 do (4. t d (4.4 Z (4.6 (4.5 (4.5 do (4.4 t (4.6 Z orównania (4.6 (4. wynika, że t (4.7 Cieło właśiwe remiany ioterminej q q (4.8 Pryrost właśiwej energii wewnętrnej u ( ( 0 (4.9 Pryrost entaii właśiwej i ( ( 0 (4.0 Pierwsa asada termodynamiki (I Z q u (4. q i t (4. t Pryrost entroii właśiwej :4:00
8 remiany_gau_dosk :4:00 s (4.3 s ( Adiaterma odwraaa - ientroa idem (5. Wykładnik oitroy (5. ównanie remiany idem (5.3 Z (5.3 da dwóh dowoyh stanów (5.4 ermine równanie stanu (5.5 (5.6 (5.6/(5.5 (5.7 (5.4 do (5.7 (5.8 (5.9 (5.9 do (5.7 (5.0 (5.0 // (5.
9 remiany_gau_dosk :4:00 Jednostkowa raa bewgędna remiany ( d (5. Z (5.4 ( (5.3 Prawą stronę równania (5.3 odstawiamy do rawej strony równania (5. a funkję ( d (5.4 Jednostkowa raa tehnina remiany ( t d (5.5 Z (5.4 ( (5.6 (5.6 do (5.5 d t (5.7 Porównanie (5.4 (5.7 rowadi do aeżnośi t (5.8 Da gaów doskonałyh jest (5.9 Po rowiąaniu układu (5.9 e wgędu na i otrymujemy (5.0 (5. Pryrost entroii właśiwej s (5.
10 remiany_gau_dosk (5.8 do (5. s Po uwgędnieniu (5.0 dostajemy (5.3 s 0 (5.4 yi s s s idem (5.5 Cieło remiany ientroowej s s s s q ( s ds ( s ds 0 (5.6 Cieło właśiwe remiany ientroowej q 0 s 0 (5.7 Pryrost właśiwej energii wewnętrnej u ( (5.8 Pryrost entaii właśiwej i ( (5.9 Pierwsa asada termodynamiki (I Z :4:00
11 remiany_gau_dosk :4:00 u q (5.30 t i q (5.3 Po uwgędnieniu (5.6 u u u (5.3 Z (5.3 ( (5.33 (5. do (5.33 ( Poitroa - ogóie idem (6. Z (6. da dwóh dowoyh stanów (6. ermine równanie stanu (6.3 (6.4 (6.4/(6.3 (6.5 (6. do (6.5 (6.6 (6.7 (6.7 do (6.5 (6.8 (6.8 //
12 remiany_gau_dosk :4:00 (6.9 Jednostkowa raa bewgędna remiany ( d (6.0 Z (6. ( (6. (6. do (6.0 d (6. (6.6 i (6.3 do (6. (6.3 Jednostkowa raa tehnina remiany ( t d (6.4 Z (6. ( (6.5 (6.5 do (6.4 t d (6.6 Porównanie (6. (6.6 ry uwgędnieniu (6. daje t (6.7 Pryrost właśiwej energii wewnętrnej ( u (6.8 Pryrost entaii właśiwej ( i (6.9 Cieło remiany
13 remiany_gau_dosk q (6.0 gdie jest iełem właśiwym remiany oitroowej. Pierwsa asada termodynamiki (I Z q u (6. q i (6. t (6.0 i rawa strona (6.3 do (6. ( ( ( (6.3 (6.3/ (6.4 Wniosek: ieło właśiwe oitroy jest wiekośią stałą. ( do (6.4 ( Cieło właśiwe oitroy gau doskonałego (7.. 0 ( = idem, iobara 0 0. ( = idem, iohora 3. ( = idem, ioterma (7. (7.3 ( (s = idem, ientroa :4:00
14 remiany_gau_dosk 0 (7.5 Na rys. 5.4 ora 5.5 wykładnik oitroy jest onaony jako m. Na rys. 4.9 wykładnik oitroy jest onaony jako n :4:00
u (1.2) T Pierwsza zasada termodynamiki w formie różniczkowej ma postać (1.3)
 obl_en_wew_enal-2.do Oblizanie energii wewnęrznej i enalii 1. Energia wewnęrzna subsanji rosej Właśiwa energia wewnęrzna, u[j/kg] jes funkją sanu. Sąd dla subsanji rosej jes ona funkją dwóh niezależnyh
obl_en_wew_enal-2.do Oblizanie energii wewnęrznej i enalii 1. Energia wewnęrzna subsanji rosej Właśiwa energia wewnęrzna, u[j/kg] jes funkją sanu. Sąd dla subsanji rosej jes ona funkją dwóh niezależnyh
PLAN WYKŁADU. Ciepło właściwe Proces adiabatyczny Temperatura potencjalna II zasada termodynamiki. Procesy odwracalne i nieodwracalne 1 /35
 PLAN WYKŁADU Cieło właśiwe Proes adiabatyzny emeratura otenjalna II zasada termodynamiki Proesy odwraalne i nieodwraalne 1 /35 Podręzniki Salby, Chater 2, Chater 3 C&W, Chater 2 2 /35 CIEPŁO WŁAŚCIWE 3
PLAN WYKŁADU Cieło właśiwe Proes adiabatyzny emeratura otenjalna II zasada termodynamiki Proesy odwraalne i nieodwraalne 1 /35 Podręzniki Salby, Chater 2, Chater 3 C&W, Chater 2 2 /35 CIEPŁO WŁAŚCIWE 3
Entropia i druga zasada termodynamiki
 Entroia-drga zasada- Entroia i drga zasada termodynamiki.9.6 :5: Entroia-drga zasada- Przemiana realizowana w kładzie rzedstawionym na rys. 3.7 jest równowagową rzemianą beztariową. Jest ona wię odwraalna.
Entroia-drga zasada- Entroia i drga zasada termodynamiki.9.6 :5: Entroia-drga zasada- Przemiana realizowana w kładzie rzedstawionym na rys. 3.7 jest równowagową rzemianą beztariową. Jest ona wię odwraalna.
v! są zupełnie niezależne.
 Zasada ekwiartyji energii 7-7. Zasada ekwiartyji energii ównowaga termizna układów Zerowa zasada termodynamiki Jeżeli układy A i B oraz A i są arami w równowadze termiznej, to również układy B i są w równowadze
Zasada ekwiartyji energii 7-7. Zasada ekwiartyji energii ównowaga termizna układów Zerowa zasada termodynamiki Jeżeli układy A i B oraz A i są arami w równowadze termiznej, to również układy B i są w równowadze
LABORATORIUM TECHNIKI CIEPLNEJ INSTYTUTU TECHNIKI CIEPLNEJ WYDZIAŁ INŻYNIERII ŚRODOWISKA I ENERGETYKI POLITECHNIKI ŚLĄSKIEJ
 INSTYTUTU TECHNIKI CIEPLNEJ WYDZIAŁ INŻYNIERII ŚRODOWISKA I ENERGETYKI POLITECHNIKI ŚLĄSKIEJ INSTRUKCJA LABORATORYJNA Temat ćwenia: WYZNACZANIE WYKŁADNIKA IZENTROPY κ DLA POWIETRZA Wyznazanie wykłnika
INSTYTUTU TECHNIKI CIEPLNEJ WYDZIAŁ INŻYNIERII ŚRODOWISKA I ENERGETYKI POLITECHNIKI ŚLĄSKIEJ INSTRUKCJA LABORATORYJNA Temat ćwenia: WYZNACZANIE WYKŁADNIKA IZENTROPY κ DLA POWIETRZA Wyznazanie wykłnika
Fizykochemiczne podstawy inżynierii procesowej. Wykład IV Proste przemiany cd: Przemiana adiabatyczna Przemiana politropowa
 Fizykoheizne odstawy inżynierii roesowej Wykład IV Proste rzeiany d: Przeiana adiabatyzna Przeiana olitroowa Przeiana adiabatyzna (izentroowa) Przeiana adiabatyzna odbywa się w układzie adiabatyzny tzn.
Fizykoheizne odstawy inżynierii roesowej Wykład IV Proste rzeiany d: Przeiana adiabatyzna Przeiana olitroowa Przeiana adiabatyzna (izentroowa) Przeiana adiabatyzna odbywa się w układzie adiabatyzny tzn.
Uwagi do rozwiązań zadań domowych - archiwalne
 Uwagi do rozwiązań zadań doowyh - arhiwalne ROK AKADEMICKI 07/08 Zad. nr 8 [08.0.8] Przeiana nie była izohorą. Wykładnik oliroy ożna było oblizyć z równania z z Zad. nr 6 [07..9] Końową eeraurę rzeiany
Uwagi do rozwiązań zadań doowyh - arhiwalne ROK AKADEMICKI 07/08 Zad. nr 8 [08.0.8] Przeiana nie była izohorą. Wykładnik oliroy ożna było oblizyć z równania z z Zad. nr 6 [07..9] Końową eeraurę rzeiany
UZUPEŁNIENIA DO WYKŁADÓW D, E
 . Hofman, Wykłady z Chemii fizyznej I - Uzuełnienia, Wydział Chemizny PW, kierunek: ehnologia hemizna, sem.3 2017/2018 D. II ZASADA ERMODYNAMIKI UZUPEŁNIENIA DO WYKŁADÓW D, E D.1. Warunki stabilnośi, określająe
. Hofman, Wykłady z Chemii fizyznej I - Uzuełnienia, Wydział Chemizny PW, kierunek: ehnologia hemizna, sem.3 2017/2018 D. II ZASADA ERMODYNAMIKI UZUPEŁNIENIA DO WYKŁADÓW D, E D.1. Warunki stabilnośi, określająe
Termodynamika 2. Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
 ermodynamika Projekt wsółfinansowany rzez Unię Euroejską w ramach Euroejskiego Funduszu Sołecznego Siik ciey siikach (maszynach) cieych cieło zamieniane jest na racę. Elementami siika są: źródło cieła
ermodynamika Projekt wsółfinansowany rzez Unię Euroejską w ramach Euroejskiego Funduszu Sołecznego Siik ciey siikach (maszynach) cieych cieło zamieniane jest na racę. Elementami siika są: źródło cieła
PLAN WYKŁADU. Opis powietrza zawierającego parę wodną w stanie nasyconym oraz wodę. Entalpia Energia wewnętrzna Entropia 1 /23
 PAN WYKŁADU Ois owietza zawieająego aę woną w stanie nasyony oaz woę Entaia Enegia wewnętzna Entoia 1 /23 Poęzniki Saby, Cate 5 C&W, Cate 4 R&Y, Cate 2 2 /23 Paa wona w atosfeze Da teeatu i iśnień sotykany
PAN WYKŁADU Ois owietza zawieająego aę woną w stanie nasyony oaz woę Entaia Enegia wewnętzna Entoia 1 /23 Poęzniki Saby, Cate 5 C&W, Cate 4 R&Y, Cate 2 2 /23 Paa wona w atosfeze Da teeatu i iśnień sotykany
Fizykochemiczne podstawy inżynierii procesowej
 Fizykohemizne odtay inżynierii roeoej Wykład III Prote rzemiany termodynamizne Prote rzemiany termodynamizne Sośród bardzo ielu możliyh rzemian termodynamiznyh zzególną rolę odgryają rzemiany ełniająe
Fizykohemizne odtay inżynierii roeoej Wykład III Prote rzemiany termodynamizne Prote rzemiany termodynamizne Sośród bardzo ielu możliyh rzemian termodynamiznyh zzególną rolę odgryają rzemiany ełniająe
10. FALE, ELEMENTY TERMODYNAMIKI I HYDRODY- NAMIKI.
 0. FALE, ELEMENY ERMODYNAMIKI I HYDRODY- NAMIKI. 0.9. Podstawy termodynamiki i raw gazowych. Podstawowe ojęcia Gaz doskonały: - cząsteczki są unktami materialnymi, - nie oddziałują ze sobą siłami międzycząsteczkowymi,
0. FALE, ELEMENY ERMODYNAMIKI I HYDRODY- NAMIKI. 0.9. Podstawy termodynamiki i raw gazowych. Podstawowe ojęcia Gaz doskonały: - cząsteczki są unktami materialnymi, - nie oddziałują ze sobą siłami międzycząsteczkowymi,
Podstawowe pojęcia analizy wektorowej - przypomnienie
 Dnamia Gaów em.i Wład Slajd Podtawowe ojęia anali wetorowej - romnienie Gradient F alar nabla j i F F F gradf F F F gradf,, j i F Dnamia Gaów em.i Wład Slajd Dwergenja - wetor di Rotaja rot i j i - wetor
Dnamia Gaów em.i Wład Slajd Podtawowe ojęia anali wetorowej - romnienie Gradient F alar nabla j i F F F gradf F F F gradf,, j i F Dnamia Gaów em.i Wład Slajd Dwergenja - wetor di Rotaja rot i j i - wetor
Ć W I C Z E N I E N R C-3
 INSTYTUT FIZYKI WYDZIAŁ INŻYNIERII PRODUKCJI I TECHNOLOGII MATERIAŁÓW POLITECHNIKA CZĘSTOCHOWSKA PRACOWNIA FIZYKI CZĄSTECZKOWEJ I CIEPŁA Ć W I C Z E N I E N R C-3 WYZNACZANIE STOSUNKU DLA POWIETRZA METODĄ
INSTYTUT FIZYKI WYDZIAŁ INŻYNIERII PRODUKCJI I TECHNOLOGII MATERIAŁÓW POLITECHNIKA CZĘSTOCHOWSKA PRACOWNIA FIZYKI CZĄSTECZKOWEJ I CIEPŁA Ć W I C Z E N I E N R C-3 WYZNACZANIE STOSUNKU DLA POWIETRZA METODĄ
Jest to zasada zachowania energii w termodynamice - równoważność pracy i ciepła. Rozważmy proces adiabatyczny sprężania gazu od V 1 do V 2 :
 I zasada termodynamiki. Jest to zasada zachowania energii w termodynamice - równoważność racy i cieła. ozważmy roces adiabatyczny srężania gazu od do : dw, ad - wykonanie racy owoduje rzyrost energii wewnętrznej
I zasada termodynamiki. Jest to zasada zachowania energii w termodynamice - równoważność racy i cieła. ozważmy roces adiabatyczny srężania gazu od do : dw, ad - wykonanie racy owoduje rzyrost energii wewnętrznej
TERMODYNAMIKA PROCESOWA
 ERMODYNAMIKA PROCESOWA Wykład IV Charakterystyka ośrodków termodynamiznyh Prof. Antoni Kozioł, Wydział Chemizny Politehniki Wroławskiej Charakterystyka ośrodków termodynamiznyh właśiwośi termodynamizne
ERMODYNAMIKA PROCESOWA Wykład IV Charakterystyka ośrodków termodynamiznyh Prof. Antoni Kozioł, Wydział Chemizny Politehniki Wroławskiej Charakterystyka ośrodków termodynamiznyh właśiwośi termodynamizne
Układ jednostek miar SI
 Układ jednostek iar SI Wiekośi i jednostki odstawowe Wiekość fizyzna Sybo Jednostka Długość [] etr Czas t [s] sekunda Masa,M [kg] kiogra eeratura terodynaizna (teeratura bezwzgędna) [K] kewin Natężenie
Układ jednostek iar SI Wiekośi i jednostki odstawowe Wiekość fizyzna Sybo Jednostka Długość [] etr Czas t [s] sekunda Masa,M [kg] kiogra eeratura terodynaizna (teeratura bezwzgędna) [K] kewin Natężenie
ZADANIA Z CHEMII Efekty energetyczne reakcji chemicznej - prawo Kirchhoffa
 ZADANIA Z HEII Efekty energetyzne reakji hemiznej - rawo Kirhhoffa. Prawo Kirhhoffa Różnizkują względem temeratury wyrażenie, ilustrująe rawo Hessa: Otrzymuje się: U= n r,i U tw,r,i n s,i U tw,s,i () d(
ZADANIA Z HEII Efekty energetyzne reakji hemiznej - rawo Kirhhoffa. Prawo Kirhhoffa Różnizkują względem temeratury wyrażenie, ilustrująe rawo Hessa: Otrzymuje się: U= n r,i U tw,r,i n s,i U tw,s,i () d(
Podstawy termodynamiki
 Podstawy termodynamiki Wykład Wroław University of ehnology 8-0-0 Podstawy termodynamiki 0 ermodynamika klasyzna Ois układu N ząstek na grunie mehaniki klasyznej wymaga rozwiązania N równań ruhu. d dt
Podstawy termodynamiki Wykład Wroław University of ehnology 8-0-0 Podstawy termodynamiki 0 ermodynamika klasyzna Ois układu N ząstek na grunie mehaniki klasyznej wymaga rozwiązania N równań ruhu. d dt
I zasada termodynamiki
 W3 30 Układ termodynamizny ównowaga termodynamizna Praa I zasada dla układu zamkniętego Entalia I zasada dla układu otwartego Cieło o właśiwew К Srawność jest zastosowaniem zasady zahowania energii do
W3 30 Układ termodynamizny ównowaga termodynamizna Praa I zasada dla układu zamkniętego Entalia I zasada dla układu otwartego Cieło o właśiwew К Srawność jest zastosowaniem zasady zahowania energii do
Entalpia swobodna (potencjał termodynamiczny)
 Entalia swobodna otencjał termodynamiczny. Związek omiędzy zmianą entalii swobodnej a zmianami entroii Całkowita zmiana entroii wywołana jakimś rocesem jest równa sumie zmiany entroii układu i otoczenia:
Entalia swobodna otencjał termodynamiczny. Związek omiędzy zmianą entalii swobodnej a zmianami entroii Całkowita zmiana entroii wywołana jakimś rocesem jest równa sumie zmiany entroii układu i otoczenia:
Stany materii. Masa i rozmiary cząstek. Masa i rozmiary cząstek. m n mol. n = Gaz doskonały. N A = 6.022x10 23
 Stany materii Masa i rozmiary cząstek Masą atomową ierwiastka chemicznego nazywamy stosunek masy atomu tego ierwiastka do masy / atomu węgla C ( C - izoto węgla o liczbie masowej ). Masą cząsteczkową nazywamy
Stany materii Masa i rozmiary cząstek Masą atomową ierwiastka chemicznego nazywamy stosunek masy atomu tego ierwiastka do masy / atomu węgla C ( C - izoto węgla o liczbie masowej ). Masą cząsteczkową nazywamy
Wielokryteriowa optymalizacja liniowa (WPL)
 arek isyński BO UŁ 007 - Wielokryteriowa optymaliaja liniowa (WPL) -. Wielokryteriowa optymaliaja liniowa (WPL) Zadaniem WPL naywamy następująe adanie optymaliaji liniowej: a a m L O L L O L L a a n n
arek isyński BO UŁ 007 - Wielokryteriowa optymaliaja liniowa (WPL) -. Wielokryteriowa optymaliaja liniowa (WPL) Zadaniem WPL naywamy następująe adanie optymaliaji liniowej: a a m L O L L O L L a a n n
Fale skrętne w pręcie
 ae skrętne w ręcie + -(+) eement ręta r π ) ( 4 Lokane skręcenie o () moment skręcając moduł stwności r romień ręta r 4 ) ( π Pod włwem wadkowego momentu eement ręta uskuje rsiesenie kątowe i sełnion jest
ae skrętne w ręcie + -(+) eement ręta r π ) ( 4 Lokane skręcenie o () moment skręcając moduł stwności r romień ręta r 4 ) ( π Pod włwem wadkowego momentu eement ręta uskuje rsiesenie kątowe i sełnion jest
= T. = dt. Q = T (d - to nie jest różniczka, tylko wyrażenie różniczkowe); z I zasady termodynamiki: przy stałej objętości. = dt.
 ieło właściwe gazów definicja emiryczna: Q = (na jednostkę masy) T ojemność cielna = m ieło właściwe zależy od rocesu: Q rzy stałym ciśnieniu = T dq = dt rzy stałej objętości Q = T (d - to nie jest różniczka,
ieło właściwe gazów definicja emiryczna: Q = (na jednostkę masy) T ojemność cielna = m ieło właściwe zależy od rocesu: Q rzy stałym ciśnieniu = T dq = dt rzy stałej objętości Q = T (d - to nie jest różniczka,
Fizykochemiczne podstawy inżynierii procesowej. Wykład V Charakterystyka ośrodków termodynamicznych
 Fizykohemizne odstawy inżynierii roesowej Wykład V Charakterystyka ośrodków termodynamiznyh Charakterystyka ośrodków termodynamiznyh Z inżynierskiego unktu widzenia bardzo ważny jest ois ośrodka który
Fizykohemizne odstawy inżynierii roesowej Wykład V Charakterystyka ośrodków termodynamiznyh Charakterystyka ośrodków termodynamiznyh Z inżynierskiego unktu widzenia bardzo ważny jest ois ośrodka który
Instalacje pompowe. Zadania do samodzielnego rozwiązania v ,1. dr inż. Michał Strzeszewski,
 dr inż. Michał Stresewski, 00-008 Instalacje omowe Zadania do samodielnego rowiąania v. 1.5 Zadanie 1 Obli wymaganą wydajność omy obiegowej ry nastęujących ałożeniach: oblieniowa moc cielna instalacji
dr inż. Michał Stresewski, 00-008 Instalacje omowe Zadania do samodielnego rowiąania v. 1.5 Zadanie 1 Obli wymaganą wydajność omy obiegowej ry nastęujących ałożeniach: oblieniowa moc cielna instalacji
TERMODYNAMIKA. Termodynamika jest to dział nauk przyrodniczych zajmujący się własnościami
 TERMODYNAMIKA Termodynamika jest to dział nauk rzyrodniczych zajmujący się własnościami energetycznymi ciał. Przy badaniu i objaśnianiu własności układów fizycznych termodynamika osługuje się ojęciami
TERMODYNAMIKA Termodynamika jest to dział nauk rzyrodniczych zajmujący się własnościami energetycznymi ciał. Przy badaniu i objaśnianiu własności układów fizycznych termodynamika osługuje się ojęciami
nieciągłość parametrów przepływu przyjmuje postać płaszczyzny prostopadłej do kierunku przepływu
 CZĘŚĆ II DYNAMIKA GAZÓW 4 Rozdział 6 Prostoadła fala 6. Prostoadła fala Podstawowe własności: nieciągłość arametrów rzeływu rzyjmuje ostać łaszczyzny rostoadłej do kierunku rzeływu w zbieżno - rozbieżnym
CZĘŚĆ II DYNAMIKA GAZÓW 4 Rozdział 6 Prostoadła fala 6. Prostoadła fala Podstawowe własności: nieciągłość arametrów rzeływu rzyjmuje ostać łaszczyzny rostoadłej do kierunku rzeływu w zbieżno - rozbieżnym
1. Cykl odwrotny Carnota reprezentują poniższe diagramy w zmiennych p-v ( ) i T-S
 Zad. domowe nr 5: druga zasada termodynamiki, elementy termodynamiki statystyznej, rawo Gaussa. Grua 1 II zasada termodynamiki 1. Cykl odwrotny Carnota rerezentują oniższe diagramy w zmiennyh -V (3 2 1
Zad. domowe nr 5: druga zasada termodynamiki, elementy termodynamiki statystyznej, rawo Gaussa. Grua 1 II zasada termodynamiki 1. Cykl odwrotny Carnota rerezentują oniższe diagramy w zmiennyh -V (3 2 1
Definicja szybkości reakcji. Szybkości reakcji. Równanie kinetyczne reakcji ...
 Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany v zmiana stężenia zas potrzebny do zajśia dx
Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany v zmiana stężenia zas potrzebny do zajśia dx
GAZY DOSKONAŁE I PÓŁDOSKONAŁE
 TERMODYNAMIKA GAZY DOSKONAŁE I PÓŁDOSKONAŁE Prawo Boyle a Marotte a p V = const gdy T = const Prawo Gay-Lussaca V = const gdy p = const T Równane stanu gau dosonałego półdosonałego p v = R T gde: p cśnene
TERMODYNAMIKA GAZY DOSKONAŁE I PÓŁDOSKONAŁE Prawo Boyle a Marotte a p V = const gdy T = const Prawo Gay-Lussaca V = const gdy p = const T Równane stanu gau dosonałego półdosonałego p v = R T gde: p cśnene
Materiały pomocnicze do ćwiczeń z przedmiotu: Termodynamika techniczna
 Materiały omocnicze do ćwiczeń z rzedmiotu: Termodynamika techniczna Materiały omocnicze do rzedmiotu Termodynamika techniczna. Sis treści Sis treści... 3 Gaz jako czynnik termodynamiczny... 5. Prawa
Materiały omocnicze do ćwiczeń z rzedmiotu: Termodynamika techniczna Materiały omocnicze do rzedmiotu Termodynamika techniczna. Sis treści Sis treści... 3 Gaz jako czynnik termodynamiczny... 5. Prawa
Definicja szybkości reakcji
 Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany. v zas zmiana stężenia potrzebny do zajśia
Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany. v zas zmiana stężenia potrzebny do zajśia
Definicja szybkości reakcji
 Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany. v zas zmiana stężenia potrzebny do zajśia
Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany. v zas zmiana stężenia potrzebny do zajśia
Podstawowe przemiany cieplne
 Podstawowe rzemiay iele Przemiaa izohoryza zahodzi, gdy objętość układu ozostaje stała ( ost), zyli 0. ówaie izohory () ost rzemiaie tej ie jest wykoywaa raa, bo 0, wię zgodie z ierwszą zasadą termodyamiki,
Podstawowe rzemiay iele Przemiaa izohoryza zahodzi, gdy objętość układu ozostaje stała ( ost), zyli 0. ówaie izohory () ost rzemiaie tej ie jest wykoywaa raa, bo 0, wię zgodie z ierwszą zasadą termodyamiki,
THERMODYNAMICS OF PISTON COMBUSTION ENGINE WORK CYCLE
 Journal of KONES Internal Combustion Engines 2005, ol. 12, 3-4 HERMODYNAMICS OF PISON COMBUSION ENGINE WORK CYCLE Anrej Ambroik ehnial Uniersity of Kiele Al. ysiąleia Państa Polskiego 7, 25-314 Kiele,
Journal of KONES Internal Combustion Engines 2005, ol. 12, 3-4 HERMODYNAMICS OF PISON COMBUSION ENGINE WORK CYCLE Anrej Ambroik ehnial Uniersity of Kiele Al. ysiąleia Państa Polskiego 7, 25-314 Kiele,
Temat:Termodynamika fotonów.
 Temat:Termodynamika fotonów. I Wstę Jak już sam temat sugeruje ostaram się rzedstawić 'termodynamikę' fotonów. Skąd taki omysł? Przez ewien zas hodziłem śieżki termodynamiki gazu doskonałego, lizyłem srawnośi
Temat:Termodynamika fotonów. I Wstę Jak już sam temat sugeruje ostaram się rzedstawić 'termodynamikę' fotonów. Skąd taki omysł? Przez ewien zas hodziłem śieżki termodynamiki gazu doskonałego, lizyłem srawnośi
Gaz doskonały model idealnego układu bardzo wielu cząsteczek, które: i. mają masę w najprostszym przypadku wszystkie taką samą
 Terodynaika 16-1 16 Terodynaika Założenia teorii kinetycno oekuarnej Ga doskonały ode ideanego układu bardo wieu cąstecek, które: i ają asę w najprostsy prypadku wsystkie taką saą, ii nie ają objętości
Terodynaika 16-1 16 Terodynaika Założenia teorii kinetycno oekuarnej Ga doskonały ode ideanego układu bardo wieu cąstecek, które: i ają asę w najprostsy prypadku wsystkie taką saą, ii nie ają objętości
Para wodna najczęściej jest produkowana w warunkach stałego ciśnienia.
 PARA WODNA 1. PRZEMIANY FAZOWE SUBSTANCJI JEDNORODNYCH Para wodna najczęściej jest produkowana w warunkach stałego ciśnienia. Przy niezmiennym ciśnieniu zmiana wody o stanie początkowym odpowiadającym
PARA WODNA 1. PRZEMIANY FAZOWE SUBSTANCJI JEDNORODNYCH Para wodna najczęściej jest produkowana w warunkach stałego ciśnienia. Przy niezmiennym ciśnieniu zmiana wody o stanie początkowym odpowiadającym
A - przepływ laminarny, B - przepływ burzliwy.
 PRZEPŁYW CZYNNIK ŚCIŚLIWEGO. Definicje odstaoe Rys... Profile rędkości rurze. - rzeły laminarny, B - rzeły burzliy. Liczba Reynoldsa Re D [m/s] średnia rędkość kanale D [m] średnica enętrzna kanału ν [m
PRZEPŁYW CZYNNIK ŚCIŚLIWEGO. Definicje odstaoe Rys... Profile rędkości rurze. - rzeły laminarny, B - rzeły burzliy. Liczba Reynoldsa Re D [m/s] średnia rędkość kanale D [m] średnica enętrzna kanału ν [m
Ćwiczenia do wykładu Fizyka Statystyczna i Termodynamika
 Ćwiczenia do wykładu Fizyka tatystyczna i ermodynamika Prowadzący dr gata Fronczak Zestaw 5. ermodynamika rzejść fazowych: równanie lausiusa-laeyrona, własności gazu Van der Waalsa 3.1 Rozważ tyowy diagram
Ćwiczenia do wykładu Fizyka tatystyczna i ermodynamika Prowadzący dr gata Fronczak Zestaw 5. ermodynamika rzejść fazowych: równanie lausiusa-laeyrona, własności gazu Van der Waalsa 3.1 Rozważ tyowy diagram
Stan równowagi chemicznej
 Stan równowagi hemiznej Równowaga hemizna to taki stan układu złożonego z roduktów i substratów dowolnej reakji odwraalnej, w którym szybkość owstawania roduktów jest równa szybkośi ih rozadu Odwraalność
Stan równowagi hemiznej Równowaga hemizna to taki stan układu złożonego z roduktów i substratów dowolnej reakji odwraalnej, w którym szybkość owstawania roduktów jest równa szybkośi ih rozadu Odwraalność
TERMODYNAMIKA PROCESOWA I TECHNICZNA
 ERMODYNAMIKA PROCESOWA I ECHNICZNA Wykład II Podstawowe definicje cd. Podstawowe idealizacje termodynamiczne I i II Zasada termodynamiki Proste rzemiany termodynamiczne Prof. Antoni Kozioł, Wydział Chemiczny
ERMODYNAMIKA PROCESOWA I ECHNICZNA Wykład II Podstawowe definicje cd. Podstawowe idealizacje termodynamiczne I i II Zasada termodynamiki Proste rzemiany termodynamiczne Prof. Antoni Kozioł, Wydział Chemiczny
Rozkład Maxwell a prędkości cząsteczek gazu Prędkości poszczególnych cząsteczek mogą być w danej chwili dowolne
 Rozkład Maxwll a rędkośi ząstzk gazu 9-9. Rozkład Maxwll a rędkośi ząstzk gazu Prędkośi oszzgólnyh ząstzk ogą być w danj hwili dowoln 3 a tylko rędkość śrdnia kwadratowa wynosi sk. Można się jdnak sodziwać,
Rozkład Maxwll a rędkośi ząstzk gazu 9-9. Rozkład Maxwll a rędkośi ząstzk gazu Prędkośi oszzgólnyh ząstzk ogą być w danj hwili dowoln 3 a tylko rędkość śrdnia kwadratowa wynosi sk. Można się jdnak sodziwać,
13) Na wykresie pokazano zależność temperatury od objętości gazu A) Przemianę izotermiczną opisują krzywe: B) Przemianę izobaryczną opisują krzywe:
 ) Ołowiana kula o masie kilograma sada swobodnie z wysokości metrów. Który wzór służy do obliczenia jej energii na wysokości metrów? ) E=m g h B) E=m / C) E=G M m/r D) Q=c w m Δ ) Oblicz energię kulki
) Ołowiana kula o masie kilograma sada swobodnie z wysokości metrów. Który wzór służy do obliczenia jej energii na wysokości metrów? ) E=m g h B) E=m / C) E=G M m/r D) Q=c w m Δ ) Oblicz energię kulki
Odkształcalność podłoża gruntowego Compressibility & settlement. Marek Cała Katedra Geomechaniki, Budownictwa i Geotechniki
 Odkstałalność podłoża gruntowego opressibility & settleent Odkstałalność ośrodków iągłyh i rodrobnionyh Każdy ośrodek odkstała się po ianie układu i wartośi diałająyh nań sił. Ośrodki o budowie iągłej
Odkstałalność podłoża gruntowego opressibility & settleent Odkstałalność ośrodków iągłyh i rodrobnionyh Każdy ośrodek odkstała się po ianie układu i wartośi diałająyh nań sił. Ośrodki o budowie iągłej
Przeanalizujmy układ termodynamiczny przedstawiony na rysunku 1. - początkowa, przejściowa i końcowa objętość kontrolnej ilości gazu w naczyniu.
 M. Chorowski Podstawy Kriogeniki, wykład 5. 3. Metody zyskiwania niskih temperatr - iąg dalszy 3.3. Wypływ swobodny ze stałej objętośi Rozważmy adiabatyzną ekspansję gaz wypływająego z nazynia o stałej
M. Chorowski Podstawy Kriogeniki, wykład 5. 3. Metody zyskiwania niskih temperatr - iąg dalszy 3.3. Wypływ swobodny ze stałej objętośi Rozważmy adiabatyzną ekspansję gaz wypływająego z nazynia o stałej
Doświadczenie Joule a i jego konsekwencje Ciepło, pojemność cieplna sens i obliczanie Praca sens i obliczanie
 Pierwsza zasada termodynamiki 2.2.1. Doświadczenie Joule a i jego konsekwencje 2.2.2. ieło, ojemność cielna sens i obliczanie 2.2.3. Praca sens i obliczanie 2.2.4. Energia wewnętrzna oraz entalia 2.2.5.
Pierwsza zasada termodynamiki 2.2.1. Doświadczenie Joule a i jego konsekwencje 2.2.2. ieło, ojemność cielna sens i obliczanie 2.2.3. Praca sens i obliczanie 2.2.4. Energia wewnętrzna oraz entalia 2.2.5.
WYKŁAD 2_2. 1.Entropia definicja termodynamiczna. przemiana nieodwracalna. Sumaryczny zapis obu tych relacji
 .Entroia definicja termodynamiczna. d d rzemiana odwracaa rzemiana nieodwracaa umaryczny zais obu tych relacji Q d el WYKŁAD _ rzykład a Obliczyć zmianę entroii, gdy 5 moli wodoru rozręŝa się odwracaie
.Entroia definicja termodynamiczna. d d rzemiana odwracaa rzemiana nieodwracaa umaryczny zais obu tych relacji Q d el WYKŁAD _ rzykład a Obliczyć zmianę entroii, gdy 5 moli wodoru rozręŝa się odwracaie
Podstawy Procesów i Konstrukcji Inżynierskich. Teoria kinetyczna INZYNIERIAMATERIALOWAPL. Kierunek Wyróżniony przez PKA
 Podstawy Procesów i Konstrukcji Inżynierskich Teoria kinetyczna Kierunek Wyróżniony rzez PKA 1 Termodynamika klasyczna Pierwsza zasada termodynamiki to rosta zasada zachowania energii, czyli ogólna reguła
Podstawy Procesów i Konstrukcji Inżynierskich Teoria kinetyczna Kierunek Wyróżniony rzez PKA 1 Termodynamika klasyczna Pierwsza zasada termodynamiki to rosta zasada zachowania energii, czyli ogólna reguła
WARUNKI RÓWNOWAGI UKŁADU TERMODYNAMICZNEGO
 WARUNKI RÓWNOWAGI UKŁADU ERMODYNAMICZNEGO Proces termodynamiczny zachodzi doóty, doóki układ nie osiągnie stanu równowagi. W stanie równowagi odowiedni otencjał termodynamiczny układu osiąga minimum, odczas
WARUNKI RÓWNOWAGI UKŁADU ERMODYNAMICZNEGO Proces termodynamiczny zachodzi doóty, doóki układ nie osiągnie stanu równowagi. W stanie równowagi odowiedni otencjał termodynamiczny układu osiąga minimum, odczas
Temperatura i ciepło E=E K +E P +U. Q=c m T=c m(t K -T P ) Q=c przem m. Fizyka 1 Wróbel Wojciech
 emeratura i cieło E=E K +E P +U Energia wewnętrzna [J] - ieło jest energią rzekazywaną między układem a jego otoczeniem na skutek istniejącej między nimi różnicy temeratur na sosób cielny rzez chaotyczne
emeratura i cieło E=E K +E P +U Energia wewnętrzna [J] - ieło jest energią rzekazywaną między układem a jego otoczeniem na skutek istniejącej między nimi różnicy temeratur na sosób cielny rzez chaotyczne
prawa gazowe Model gazu doskonałego Temperatura bezwzględna tościowa i entalpia owy Standardowe entalpie tworzenia i spalania 4. Stechiometria 1 tość
 5. Gazy, termochemia Doświadczalne rawa gazowe Model gazu doskonałego emeratura bezwzględna Układ i otoczenie Energia wewnętrzna, raca objęto tościowa i entalia Prawo Hessa i cykl kołowy owy Standardowe
5. Gazy, termochemia Doświadczalne rawa gazowe Model gazu doskonałego emeratura bezwzględna Układ i otoczenie Energia wewnętrzna, raca objęto tościowa i entalia Prawo Hessa i cykl kołowy owy Standardowe
Parametry pracy adiabatycznego modelu łożyska krótkiego z panewką pływającą
 Parametry racy adiabatycnego modelu łożyska krótkiego anewką ływającą 5 ZGDNIENI EKSPOCJI MSZYN Zesyt (5) 7 EKSNDE MZUKOW Parametry racy adiabatycnego modelu łożyska krótkiego anewką ływającą Słowa klucowe
Parametry racy adiabatycnego modelu łożyska krótkiego anewką ływającą 5 ZGDNIENI EKSPOCJI MSZYN Zesyt (5) 7 EKSNDE MZUKOW Parametry racy adiabatycnego modelu łożyska krótkiego anewką ływającą Słowa klucowe
M10. Własności funkcji liniowej
 M10. Własności funkcji liniowej dr Artur Gola e-mail: a.gola@ajd.czest.pl pokój 3010 Definicja Funkcję określoną wzorem y = ax + b, dla x R, gdzie a i b są stałymi nazywamy funkcją liniową. Wykresem funkcji
M10. Własności funkcji liniowej dr Artur Gola e-mail: a.gola@ajd.czest.pl pokój 3010 Definicja Funkcję określoną wzorem y = ax + b, dla x R, gdzie a i b są stałymi nazywamy funkcją liniową. Wykresem funkcji
Zadania domowe z termodynamiki I dla wszystkich kierunków A R C H I W A L N E
 Zadania domowe z termodynamiki I dla wszystkich kierunków A R C H I W A L N E ROK AKADEMICKI 2015/2016 Zad. nr 4 za 3% [2015.10.29 16:00] Ciepło właściwe przy stałym ciśnieniu gazu zależy liniowo od temperatury.
Zadania domowe z termodynamiki I dla wszystkich kierunków A R C H I W A L N E ROK AKADEMICKI 2015/2016 Zad. nr 4 za 3% [2015.10.29 16:00] Ciepło właściwe przy stałym ciśnieniu gazu zależy liniowo od temperatury.
Turbinowy silnik odrzutowy obieg rzeczywisty. opracował Dr inż. Robert Jakubowski
 urbinowy ilni odrzutowy obieg rzezywity oraował Dr inż. Robert Jaubowi Obieg turbinowego ilnia jednorzeływowego -orównanie ilnia idealnego i ilnia rzezywitego (z uwzględnieniem trat) i 3 3 q do 4 S 4 4
urbinowy ilni odrzutowy obieg rzezywity oraował Dr inż. Robert Jaubowi Obieg turbinowego ilnia jednorzeływowego -orównanie ilnia idealnego i ilnia rzezywitego (z uwzględnieniem trat) i 3 3 q do 4 S 4 4
II zasada termodynamiki
 TERMODYNAMIKA: DRUGA ZAADA TERMODYNAMIKI ą rocesy zgodne z zasadą zachowania energii, tóre nigdy nie wystęują w rzyrodzie. Przyład: długois leżący na stole Druga zasada termodynamii odowiada na ytanie,
TERMODYNAMIKA: DRUGA ZAADA TERMODYNAMIKI ą rocesy zgodne z zasadą zachowania energii, tóre nigdy nie wystęują w rzyrodzie. Przyład: długois leżący na stole Druga zasada termodynamii odowiada na ytanie,
TERMODYNAMIKA TECHNICZNA I CHEMICZNA
 TERMODYNAMIKA TECHNICZNA I CHEMICZNA WYKŁAD IX RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO STAŁE-CIECZ (krystalizacja) ADSORPCJA KRYSTALIZACJA, ADSORPCJA 1 RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO STAŁE-CIECZ (krystalizacja)
TERMODYNAMIKA TECHNICZNA I CHEMICZNA WYKŁAD IX RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO STAŁE-CIECZ (krystalizacja) ADSORPCJA KRYSTALIZACJA, ADSORPCJA 1 RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO STAŁE-CIECZ (krystalizacja)
II zasada termodynamiki.
 II zasada termodynamiki. Według I zasady termodynamiki nie jest do omyślenia roces, w którym energia wewnętrzna układu doznałaby zmiany innej, niż wynosi suma algebraiczna energii wymienionych z otoczeniem.
II zasada termodynamiki. Według I zasady termodynamiki nie jest do omyślenia roces, w którym energia wewnętrzna układu doznałaby zmiany innej, niż wynosi suma algebraiczna energii wymienionych z otoczeniem.
Rozdział 2. Krzywe stożkowe. 2.1 Elipsa. Krzywe stożkowe są zadane ogólnym równaniem kwadratowym na płaszczyźnie
 Rozdział Krzywe stożkowe Krzywe stożkowe są zadane ogólnym równaniem kwadratowym na płaszczyźnie x + By + Cxy + Dx + Ey + F = 0. (.) W zależności od relacji pomiędzy współczynnikami otrzymujemy elipsę,
Rozdział Krzywe stożkowe Krzywe stożkowe są zadane ogólnym równaniem kwadratowym na płaszczyźnie x + By + Cxy + Dx + Ey + F = 0. (.) W zależności od relacji pomiędzy współczynnikami otrzymujemy elipsę,
DWUCZĘŚCIOWE ŁOŻYSKO POROWATE
 PROBLEMY NIEKONWENCJONALNYCH UKŁADÓW ŁOŻYSKOWYCH Łódź, 1 14 maja 1999 r. Karol Kremiński Politechnika Warsawska DWUCZĘŚCIOWE ŁOŻYSKO POROWATE SŁOWA KLUCZOWE: łożysko śligowe, tuleja porowata, prepuscalność
PROBLEMY NIEKONWENCJONALNYCH UKŁADÓW ŁOŻYSKOWYCH Łódź, 1 14 maja 1999 r. Karol Kremiński Politechnika Warsawska DWUCZĘŚCIOWE ŁOŻYSKO POROWATE SŁOWA KLUCZOWE: łożysko śligowe, tuleja porowata, prepuscalność
Opis ruchu płynu rzeczywistego
 Pedmio wykładu 7 Hipoea Newona płyny newonowskie płyny nienewonowskie Równanie uhu płynu lepkiego Naviea Sokesa - meody owiąywania układu [RNS]-[RC] 1 n dn = d dn 3 d ds 1 N N s m N s kg ; n s m m m m
Pedmio wykładu 7 Hipoea Newona płyny newonowskie płyny nienewonowskie Równanie uhu płynu lepkiego Naviea Sokesa - meody owiąywania układu [RNS]-[RC] 1 n dn = d dn 3 d ds 1 N N s m N s kg ; n s m m m m
Ø Cząstka powietrza poruszająca się pionowo w płynie jest poddawana sprężaniu lub rozprężaniu adiabatycznemu; zatem jej temperatura ulega zmianie
 1 Ø Roatrujemy ionowe resunięcia łynu, który jest w równowae hyrostatycnej Ø Cąstka owietra orusająca się ionowo w łynie jest oawana srężaniu lub rorężaniu aiabatycnemu; atem jej temeratura ulea mianie
1 Ø Roatrujemy ionowe resunięcia łynu, który jest w równowae hyrostatycnej Ø Cąstka owietra orusająca się ionowo w łynie jest oawana srężaniu lub rorężaniu aiabatycnemu; atem jej temeratura ulea mianie
Pochodna kierunkowa i gradient Równania parametryczne prostej przechodzącej przez punkt i skierowanej wzdłuż jednostkowego wektora mają postać:
 ochodna kierunkowa i gradient Równania parametrcne prostej prechodącej pre punkt i skierowanej wdłuż jednostkowego wektora mają postać: Oblicam pochodną kierunkową u ( u, u ) 1 + su + su 1 (, ) d d d ˆ
ochodna kierunkowa i gradient Równania parametrcne prostej prechodącej pre punkt i skierowanej wdłuż jednostkowego wektora mają postać: Oblicam pochodną kierunkową u ( u, u ) 1 + su + su 1 (, ) d d d ˆ
[1] CEL ĆWICZENIA: Identyfikacja rzeczywistej przemiany termodynamicznej poprzez wyznaczenie wykładnika politropy.
![[1] CEL ĆWICZENIA: Identyfikacja rzeczywistej przemiany termodynamicznej poprzez wyznaczenie wykładnika politropy. [1] CEL ĆWICZENIA: Identyfikacja rzeczywistej przemiany termodynamicznej poprzez wyznaczenie wykładnika politropy.](/thumbs/74/71369716.jpg) [1] CEL ĆWICZENIA: Identyfikacja rzeczywistej przemiany termodynamicznej poprzez wyznaczenie wykładnika politropy. [2] ZAKRES TEMATYCZNY: I. Rejestracja zmienności ciśnienia w cylindrze sprężarki (wykres
[1] CEL ĆWICZENIA: Identyfikacja rzeczywistej przemiany termodynamicznej poprzez wyznaczenie wykładnika politropy. [2] ZAKRES TEMATYCZNY: I. Rejestracja zmienności ciśnienia w cylindrze sprężarki (wykres
MODELOWANIE POŻARÓW. Ćwiczenia laboratoryjne. Ćwiczenie nr 1. Obliczenia analityczne parametrów pożaru
 MODELOWANIE POŻARÓW Ćwiczenia laboratoryjne Ćwiczenie nr Obliczenia analityczne arametrów ożaru Oracowali: rof. nadzw. dr hab. Marek Konecki st. kt. dr inż. Norbert uśnio Warszawa Sis zadań Nr zadania
MODELOWANIE POŻARÓW Ćwiczenia laboratoryjne Ćwiczenie nr Obliczenia analityczne arametrów ożaru Oracowali: rof. nadzw. dr hab. Marek Konecki st. kt. dr inż. Norbert uśnio Warszawa Sis zadań Nr zadania
Wykład 7. Energia wewnętrzna jednoatomowego gazu doskonałego wynosi: 3 R . 2. Ciepło molowe przy stałym ciśnieniu obliczymy dzięki zależności: nrt
 W. Dominik Wydział Fizyki UW ermodynamika 08/09 /7 Wykład 7 Zasada ekwiartycji energii Stonie swobody ruchu cząsteczek ieło właściwe ciał stałych ównanie adiabaty w modelu kinetyczno-molekularnym g.d.
W. Dominik Wydział Fizyki UW ermodynamika 08/09 /7 Wykład 7 Zasada ekwiartycji energii Stonie swobody ruchu cząsteczek ieło właściwe ciał stałych ównanie adiabaty w modelu kinetyczno-molekularnym g.d.
TERMODYNAMIKA. Przedstaw cykl przemian na wykresie poniższym w układach współrzędnych przedstawionych poniżej III
 Włodzimierz Wolczyński 44 POWÓRKA 6 ERMODYNAMKA Zadanie 1 Przedstaw cykl rzemian na wykresie oniższym w układach wsółrzędnych rzedstawionych oniżej Uzuełnij tabelkę wisując nazwę rzemian i symbole: >0,
Włodzimierz Wolczyński 44 POWÓRKA 6 ERMODYNAMKA Zadanie 1 Przedstaw cykl rzemian na wykresie oniższym w układach wsółrzędnych rzedstawionych oniżej Uzuełnij tabelkę wisując nazwę rzemian i symbole: >0,
LICEALIŚCI LICZĄ ph różnych roztworów < materiały pomocnicze do sprawdzianu nr 2 > Przykładowe zadania:
 LICEALIŚCI LICZĄ ph różnyh rotoró < materiały pomonie do spradianu nr > Spradian będie obejmoał 5 typó adań:. Oblianie artośi ph rotoró monyh kasó i asad uględnieniem spółynnika aktynośi jonó H + /OH -
LICEALIŚCI LICZĄ ph różnyh rotoró < materiały pomonie do spradianu nr > Spradian będie obejmoał 5 typó adań:. Oblianie artośi ph rotoró monyh kasó i asad uględnieniem spółynnika aktynośi jonó H + /OH -
FUNKCJA LINIOWA. A) B) C) D) Wskaż, dla którego funkcja liniowa określona wzorem jest stała. A) B) C) D)
 FUNKCJA LINIOWA 1. Funkcja jest rosnąca, gdy 2. Wskaż, dla którego funkcja liniowa jest rosnąca Wskaż, dla którego funkcja liniowa określona wzorem jest stała. 3. Funkcja liniowa A) jest malejąca i jej
FUNKCJA LINIOWA 1. Funkcja jest rosnąca, gdy 2. Wskaż, dla którego funkcja liniowa jest rosnąca Wskaż, dla którego funkcja liniowa określona wzorem jest stała. 3. Funkcja liniowa A) jest malejąca i jej
Katedra Silników Spalinowych i Pojazdów ATH ZAKŁAD TERMODYNAMIKI. Wyznaczanie ciepła właściwego c p dla powietrza
 Katedra Silików Saliowych i Pojazdów ATH ZAKŁAD TERMODYNAMIKI Wyzaczaie cieła właściweo c dla owietrza Wrowadzeie teoretycze Cieło ochłoięte rzez ciało o jedostkowej masie rzy ieskończeie małym rzyroście
Katedra Silików Saliowych i Pojazdów ATH ZAKŁAD TERMODYNAMIKI Wyzaczaie cieła właściweo c dla owietrza Wrowadzeie teoretycze Cieło ochłoięte rzez ciało o jedostkowej masie rzy ieskończeie małym rzyroście
>> ω z, (4.122) Przybliżona teoria żyroskopu
 Prybliżona teoria żyroskopu Żyroskopem naywamy ciało materialne o postaci bryły obrotowej (wirnika), osadone na osi pokrywającej się osią geometrycną tego ciała wanej osią żyroskopową. ζ K θ ω η ω ζ y
Prybliżona teoria żyroskopu Żyroskopem naywamy ciało materialne o postaci bryły obrotowej (wirnika), osadone na osi pokrywającej się osią geometrycną tego ciała wanej osią żyroskopową. ζ K θ ω η ω ζ y
DZIAŁ: HYDRODYNAMIKA ĆWICZENIE B: Wyznaczanie oporów przy przepływie płynów [OMÓWIENIE NAJWAŻNIEJSZYCH ZAGADNIEŃ] opracowanie: A.W.
![DZIAŁ: HYDRODYNAMIKA ĆWICZENIE B: Wyznaczanie oporów przy przepływie płynów [OMÓWIENIE NAJWAŻNIEJSZYCH ZAGADNIEŃ] opracowanie: A.W. DZIAŁ: HYDRODYNAMIKA ĆWICZENIE B: Wyznaczanie oporów przy przepływie płynów [OMÓWIENIE NAJWAŻNIEJSZYCH ZAGADNIEŃ] opracowanie: A.W.](/thumbs/24/4265481.jpg) DZIAŁ: HYDRODYNAMIKA ĆWICZENIE B: Wynacanie ooró ry rełyie łynó [OMÓWIENIE NAJWAŻNIEJSZYCH ZAGADNIEŃ] oracoanie: A.W. rys.. Rokład rędkości rekroju rury dla rełyu laminarnego i turbulentnego LICZBY KRYTERIALNE:
DZIAŁ: HYDRODYNAMIKA ĆWICZENIE B: Wynacanie ooró ry rełyie łynó [OMÓWIENIE NAJWAŻNIEJSZYCH ZAGADNIEŃ] oracoanie: A.W. rys.. Rokład rędkości rekroju rury dla rełyu laminarnego i turbulentnego LICZBY KRYTERIALNE:
Wykład 3. Prawo Pascala
 018-10-18 Wykład 3 Prawo Pascala Pływanie ciał Ściśliwość gazów, cieczy i ciał stałych Przemiany gazowe Równanie stanu gazu doskonałego Równanie stanu gazu van der Waalsa Przejścia fazowe materii W. Dominik
018-10-18 Wykład 3 Prawo Pascala Pływanie ciał Ściśliwość gazów, cieczy i ciał stałych Przemiany gazowe Równanie stanu gazu doskonałego Równanie stanu gazu van der Waalsa Przejścia fazowe materii W. Dominik
Termodynamika 1. Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
 Termodynamika Projekt wsółfinansowany rzez Unię Euroejską w ramach Euroejskiego Funduszu Sołecznego Układ termodynamiczny Układ termodynamiczny to ciało lub zbiór rozważanych ciał, w którym obok innych
Termodynamika Projekt wsółfinansowany rzez Unię Euroejską w ramach Euroejskiego Funduszu Sołecznego Układ termodynamiczny Układ termodynamiczny to ciało lub zbiór rozważanych ciał, w którym obok innych
11. Termodynamika. Wybór i opracowanie zadań od 11.1 do Bogusław Kusz.
 ermodynamia Wybór i oracowanie zadań od do 5 - Bogusław Kusz W zamniętej butelce o objętości 5cm znajduje się owietrze o temeraturze t 7 C i ciśnieniu hpa Po ewnym czasie słońce ogrzało butelę do temeratury
ermodynamia Wybór i oracowanie zadań od do 5 - Bogusław Kusz W zamniętej butelce o objętości 5cm znajduje się owietrze o temeraturze t 7 C i ciśnieniu hpa Po ewnym czasie słońce ogrzało butelę do temeratury
Wykład 13 Druga zasada termodynamiki
 Wyład 3 Druga zasada termodynamii Entroia W rzyadu silnia Carnota z gazem dosonałym otrzymaliśmy Q =. (3.) Q Z tego wzoru wynia, że wielość Q Q = (3.) dla silnia Carnota jest wielością inwariantną (niezmienniczą).
Wyład 3 Druga zasada termodynamii Entroia W rzyadu silnia Carnota z gazem dosonałym otrzymaliśmy Q =. (3.) Q Z tego wzoru wynia, że wielość Q Q = (3.) dla silnia Carnota jest wielością inwariantną (niezmienniczą).
Krzywa izobarycznego ogrzewania substancji rzeczywistej. p=const. S wrz. S top. Ttop. Twrz. T dt. top. top. Równanie Clausiusa-Clapeyrona (1)
 ykła Entroia.. Równanie Clausiusa-Claeyrona rania równowai faz Iealna maszyna ielna Cykl Carnot. Dominik yział Fizyki U ermoynamika 8/9 /9 Entroia - rzyomnienie Entroia S jest miarą stanu uorząkowania
ykła Entroia.. Równanie Clausiusa-Claeyrona rania równowai faz Iealna maszyna ielna Cykl Carnot. Dominik yział Fizyki U ermoynamika 8/9 /9 Entroia - rzyomnienie Entroia S jest miarą stanu uorząkowania
Dodawanie i mnożenie liczb zespolonych są działaniami wewnętrznymi tzn., że ich wynikiem jest liczba zespolona.
 Wykład - LICZBY ZESPOLONE Algebra licb espolonych, repreentacja algebraicna i geometrycna, geometria licb espolonych. Moduł, argument, postać trygonometrycna, wór de Moivre a.' Zbiór Licb Zespolonych Niech
Wykład - LICZBY ZESPOLONE Algebra licb espolonych, repreentacja algebraicna i geometrycna, geometria licb espolonych. Moduł, argument, postać trygonometrycna, wór de Moivre a.' Zbiór Licb Zespolonych Niech
Gaz rzeczywisty zachowuje się jak modelowy gaz doskonały, gdy ma małą gęstość i umiarkowaną
 F-Gaz doskonaly/ GAZY DOSKONAŁE i PÓŁDOSKONAŁE Gaz doskonały cząsteczki są bardzo małe w porównaniu z objętością naczynia, które wypełnia gaz cząsteczki poruszają się chaotycznie ruchem postępowym i zderzają
F-Gaz doskonaly/ GAZY DOSKONAŁE i PÓŁDOSKONAŁE Gaz doskonały cząsteczki są bardzo małe w porównaniu z objętością naczynia, które wypełnia gaz cząsteczki poruszają się chaotycznie ruchem postępowym i zderzają
STANY SKUPIENIA MATERII
 STANY SKUPIENIA MATERII GAZOWY CIEK Y STA Y GAZ biór c¹stecek (lub atomów), bêd¹cych w ci¹g³ym chaotycnym ruchu ga wype³nia ca³kowicie ka de nacynie, w którym siê najduje (nie ma swojego ksta³tu) energia
STANY SKUPIENIA MATERII GAZOWY CIEK Y STA Y GAZ biór c¹stecek (lub atomów), bêd¹cych w ci¹g³ym chaotycnym ruchu ga wype³nia ca³kowicie ka de nacynie, w którym siê najduje (nie ma swojego ksta³tu) energia
Budowa materii Opis statystyczny - NAv= 6.022*1023 at.(cz)/mol Opis termodynamiczny temperatury -
 ermoynamika Pojęcia i zaganienia ostawowe: Buowa materii stany skuienia: gazy, ciecze, ciała stale Ois statystyczny wielka liczba cząstek - N A 6.0*0 at.(cz)/mol Ois termoynamiczny Pojęcie temeratury -
ermoynamika Pojęcia i zaganienia ostawowe: Buowa materii stany skuienia: gazy, ciecze, ciała stale Ois statystyczny wielka liczba cząstek - N A 6.0*0 at.(cz)/mol Ois termoynamiczny Pojęcie temeratury -
ZADANIE 9.5. p p T. Dla dwuatomowego gazu doskonałego wykładnik izentropy = 1,4 (patrz tablica 1). Temperaturę spiętrzenia obliczymy następująco
 ZADANIE 9.5. Do dyszy Bendemanna o rzekroju wylotowym A = mm doływa owetrze o cśnenu =,85 MPa temeraturze t = C, z rędkoścą w = 5 m/s. Cśnene owetrza w rzestrzen, do której wyływa owetrze z dyszy wynos
ZADANIE 9.5. Do dyszy Bendemanna o rzekroju wylotowym A = mm doływa owetrze o cśnenu =,85 MPa temeraturze t = C, z rędkoścą w = 5 m/s. Cśnene owetrza w rzestrzen, do której wyływa owetrze z dyszy wynos
1. Definicje podstawowe. Rys Profile prędkości w rurze. A przepływ laminarny, B - przepływ burzliwy. Liczba Reynoldsa
 . Defncje odstaoe Rys... Profle rędkośc rurze. rzeły lamnarny, B - rzeły burzly. Lczba Reynoldsa D Re [m /s] - sółczynnk lekośc knematycznej Re 3 - rzeły lamnarny Re - rzeły burzly Średna rędkość masoa
. Defncje odstaoe Rys... Profle rędkośc rurze. rzeły lamnarny, B - rzeły burzly. Lczba Reynoldsa D Re [m /s] - sółczynnk lekośc knematycznej Re 3 - rzeły lamnarny Re - rzeły burzly Średna rędkość masoa
POLITECHNIKA KRAKOWSKA Instytut Inżynierii Cieplnej i Procesowej Zakład Termodynamiki i Pomiarów Maszyn Cieplnych
 POLITECHNIKA KRAKOWSKA Instytut Inżynierii Cieplnej i Proesowej Zakład Termodynamiki i Pomiarów Maszyn Cieplnyh LABORATORIUM TERMODYNAMIKI I POMIARÓW MASZYN CIEPLNYCH Podstawy teoretyzne do ćwizeń laboratoryjnyh
POLITECHNIKA KRAKOWSKA Instytut Inżynierii Cieplnej i Proesowej Zakład Termodynamiki i Pomiarów Maszyn Cieplnyh LABORATORIUM TERMODYNAMIKI I POMIARÓW MASZYN CIEPLNYCH Podstawy teoretyzne do ćwizeń laboratoryjnyh
Przykład 6.3. Uogólnione prawo Hooke a
 Prkład 6 Uogónione prawo Hooke a Zwiąki międ odkstałceniami i naprężeniami w prpadku ciała iotropowego opisuje uogónione prawo Hooke a: ] ] ] a Rowiąując równania a wgędem naprężeń otrmujem wiąki: b W
Prkład 6 Uogónione prawo Hooke a Zwiąki międ odkstałceniami i naprężeniami w prpadku ciała iotropowego opisuje uogónione prawo Hooke a: ] ] ] a Rowiąując równania a wgędem naprężeń otrmujem wiąki: b W
MATEMATYKA POZIOM ROZSZERZONY
 EGZAMIN MATURALNY W ROKU SZKOLNYM 06/07 FORMUŁA OD 05 ( NOWA MATURA ) MATEMATYKA POZIOM ROZSZERZONY ZASADY OCENIANIA ROZWIĄZAŃ ZADAŃ ARKUSZ MMA-P CZERWIEC 07 Kluz punktowania zadań zamkniętyh Numer zadania
EGZAMIN MATURALNY W ROKU SZKOLNYM 06/07 FORMUŁA OD 05 ( NOWA MATURA ) MATEMATYKA POZIOM ROZSZERZONY ZASADY OCENIANIA ROZWIĄZAŃ ZADAŃ ARKUSZ MMA-P CZERWIEC 07 Kluz punktowania zadań zamkniętyh Numer zadania
Fale rzeczywiste. dudnienia i prędkość grupowa
 Fale rzezywiste dudnienia i rędkość gruowa Czysta fala harmonizna nie istnieje. Rzezywisty imuls falowy jest skońzony w zasie i w rzestrzeni: Rzezywisty imuls falowy (iąg falowy) można rzedstawić jako
Fale rzezywiste dudnienia i rędkość gruowa Czysta fala harmonizna nie istnieje. Rzezywisty imuls falowy jest skońzony w zasie i w rzestrzeni: Rzezywisty imuls falowy (iąg falowy) można rzedstawić jako
Funkcje pola we współrzędnych krzywoliniowych cd.
 Funkcje pola we współrędnych krywoliniowych cd. Marius Adamski 1. spółrędne walcowe. Definicja. Jeżeli M jest rutem punktu P na płascynę xy, a r i ϕ są współrędnymi biegunowymi M, to mienne u = r, v =
Funkcje pola we współrędnych krywoliniowych cd. Marius Adamski 1. spółrędne walcowe. Definicja. Jeżeli M jest rutem punktu P na płascynę xy, a r i ϕ są współrędnymi biegunowymi M, to mienne u = r, v =
2... Pˆ - teoretyczna wielkość produkcji (wynikająca z modelu). X X,..., b b,...,
 Główne zynniki produkji w teorii ekonoii: praa żywa (oznazenia: L, ), praa uprzediotowiona (kapitał) (oznazenia: K, ), zieia (zwłaszza w rolnitwie). Funkja produkji Cobba-Douglasa: b b b P ˆ b... k 0 k
Główne zynniki produkji w teorii ekonoii: praa żywa (oznazenia: L, ), praa uprzediotowiona (kapitał) (oznazenia: K, ), zieia (zwłaszza w rolnitwie). Funkja produkji Cobba-Douglasa: b b b P ˆ b... k 0 k
3. Zapas stabilności układów regulacji 3.1. Wprowadzenie
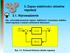 3. Zapas stabilności układów regulacji 3.. Wprowadenie Dla scharakteryowania apasu stabilności roważymy stabilny układ regulacji o nanym schemacie blokowym: Ws () Gs () Ys () Hs () Rys. 3.. Schemat blokowy
3. Zapas stabilności układów regulacji 3.. Wprowadenie Dla scharakteryowania apasu stabilności roważymy stabilny układ regulacji o nanym schemacie blokowym: Ws () Gs () Ys () Hs () Rys. 3.. Schemat blokowy
10 zadań związanych z granicą i pochodną funkcji.
 0 zadań związanych z granicą i pochodną funkcji Znajdź przedziały monotoniczności funkcji f() 4, określonej dla (0,) W przedziale ( 0,) wyrażenie 4 przyjmuje wartości ujemne, dlatego dla (0,) funkcja f()
0 zadań związanych z granicą i pochodną funkcji Znajdź przedziały monotoniczności funkcji f() 4, określonej dla (0,) W przedziale ( 0,) wyrażenie 4 przyjmuje wartości ujemne, dlatego dla (0,) funkcja f()
3. Przyrost temperatury gazu wynosi 20 C. Ile jest równy ten przyrost w kelwinach?
 1. Która z podanych niżej par wielkości fizycznych ma takie same jednostki? a) energia i entropia b) ciśnienie i entalpia c) praca i entalpia d) ciepło i temperatura 2. 1 kj nie jest jednostką a) entropii
1. Która z podanych niżej par wielkości fizycznych ma takie same jednostki? a) energia i entropia b) ciśnienie i entalpia c) praca i entalpia d) ciepło i temperatura 2. 1 kj nie jest jednostką a) entropii
5. PRZEMIANY GAZU DOSKONAŁEGO
 Przeiany gazu doskonałego /5 5. PZEMIANY GAZU DOSKONAŁEGO Przeianą gazu zawartego w układzie nazywa się ciągłą zianę jego stanu terodynaicznego (określanego rzez araetry stanu gazu, któryi są: ciśnienie,
Przeiany gazu doskonałego /5 5. PZEMIANY GAZU DOSKONAŁEGO Przeianą gazu zawartego w układzie nazywa się ciągłą zianę jego stanu terodynaicznego (określanego rzez araetry stanu gazu, któryi są: ciśnienie,
Dwuprzepływowe silniki odrzutowe. dr inż. Robert JAKUBOWSKI
 Dwurzeływowe silniki odrzutowe dr inż. Robert JAKUBOWSK Silnik z oddzielnymi dyszami wylotowymi kanałów V 2500 (Airbus A320, D90) Ciąg 98 147 kn Stoień dwurzeływowości 4,5 5,4 Pierwsze konstrukcje dwurzeływowe
Dwurzeływowe silniki odrzutowe dr inż. Robert JAKUBOWSK Silnik z oddzielnymi dyszami wylotowymi kanałów V 2500 (Airbus A320, D90) Ciąg 98 147 kn Stoień dwurzeływowości 4,5 5,4 Pierwsze konstrukcje dwurzeływowe



