Ćwiczenia do wykładu Fizyka Statystyczna i Termodynamika
|
|
|
- Wojciech Łuczak
- 7 lat temu
- Przeglądów:
Transkrypt
1 Ćwiczenia do wykładu Fizyka tatystyczna i ermodynamika Prowadzący dr gata Fronczak Zestaw 5. ermodynamika rzejść fazowych: równanie lausiusa-laeyrona, własności gazu Van der Waalsa 3.1 Rozważ tyowy diagram fazowy substancji jednoskładnikowej (rys. 1). W obliżu unktu otrójnego, krzywa sublimacji ma większe nachylenie niż krzywa arowania. Przedyskutuj dlaczego tak się dzieje? 3. Na większości diagramów fazowych, krzywa wsółistnienia fazy stałej i ciekłej (tj. krzywa tonienia) ma dodatnie nachylenie (rys. 1). Wytłumacz, dlaczego w rzyadku wody (rys. a) oraz izotou helu He 3 (rys. b, dla < 0 ) jest inaczej. korzystaj z równania lausiusa-laeyrona. 3.4 Pokaż, w jaki sosób cieło rzemiany woda ara wodna zależy od unktu (, ), w którym rzekraczamy krzywą arowania (rys. a). Potraktuj arę jako gaz doskonały o molowej objętości znacznie rzekraczającej molową objętość wody v v. Załóż, że nachylenie krzywej arowania jest znane d/d = f( ). Odowiedź: q = R f( ), gdzie R jest stałą gazową. 3.5 Pokaż, w jaki sosób ciśnienie ary nasyconej na krzywej równowagi fazowej cieczy i gazu zależy od temeratury. Potraktuj arę jako gaz doskonały. Załóż, że cieło rzemiany jest stałe q = const. ( Odowiedź: ex q ). R 3.6 ieło tonienia lodu w temeraturze 1 = 0 0 i rzy ciśnieniu = 1 atm wynosi H 1 = cal/mol, natomiast cieło arowania wody w temeraturze = i rzy tym samym ciśnieniu jest równe H = cal/mol. Oblicz różnicę entroii między lodem ( 1, ) i arą wodną (, ). Załóż, że cieło molowe wody jest stałe i wynosi c = cal/kmol. Wskazówka: W rzemianach zachodzących rzy stałym ciśnieniu = const, zmiana entalii jest równa ciełu rzemiany dq = du + dv = d(u + V ) = dh. 1
2 unkt krytyczny unkt otrójny Rysunek 1: Do zadania 3.1. a) b) 0 Rysunek : Do zadania 3.. unkt krytyczny lód woda 1 a b unkt otrójny ara wodna 1 Rysunek 3: Do zadania 3.6.
3 0 Rysunek 4: Do zadania 3.1. ( H1 Odowiedź: = n + c ln + H ) = 37.0 cal/kmol Diagram fazowy modelu Isinga. Wyrowadź równanie lausiusa- laeyrona dla krzywej wsółistnienia faz ferromagnetycznych + oraz. Wskazówka: Dla rostych magnetyków siłą termodynamiczną jest natężenie ola magnetycznego H, zaś rzesunięciem termodynamicznym odowiadającym tej sile jest zmiana magnetyzacji dm. Wynika stąd, że równanie lausiusa-laeyrona dla tych układów ma ostać dh d = s M. (1) 3.1 Pokaż, że jeśli nieciągła rzemiana fazowa nastęuje w kierunku: od fazy niskotemeraturowej do fazy wysokotemeraturowej, wtedy cieło tej rzemiany jest zawsze dodatnie Q > 0 (tzn. cieło jest ochłaniane). Wskazówka: Q = 0 = 0 ( ). 3.8 Korzystając z równania Van der Waalsa określ krytyczne wartości ciśnienia c, temeratury c oraz objętości v c, rzy których gaz o raz ierwszy ulega skroleniu. Przeisz wyjściowe równanie stanu w nowych zmiennych zredukowanych: π = / c, φ = v/v c oraz τ = / c. Odowiedź: Wartości krytyczne są odowiednio równe c = a 7b, c = 8a 7Rb oraz v c = 3b. Równanie stanu w nowych zmiennych ma natomiast 3
4 a) v b) g >,F < D F > < Rysunek 5: Do zadania ostać (π + 3φ ) (3φ 1) = 8τ. () 3.30 Narysuj i omów, w jaki sosób energia swobodna ibbsa g() zmienia się wzdłuż izoterm > c oraz < c rzedstawionych na rys. 5a Rozważmy odkrytyczną izotermę gazu Van der Waalsa rzedstawioną na rys. 6. Wiemy już, że stany termodynamiczne leżące na odcinku tej izotermy rerezentują układ w fazie gazowej, stany leżące na odcinku F odowiadają fazie ciekłej, zaś izobara D F rerezentuje stany, w których obie fazy mogą wsółistnieć jedna obok drugiej. Korzystając z warunków równowagi,, µ = const omiędzy fazami ciekłą i gazową, okaż, że ołożenie izobary = F = = const można wyznaczyć z warunku równych owierzchni D oraz DF D. Załóż, że energia wewnętrzna i entroia gazu Van der Waalsa są oisane wzorami u = s = c v d a v + u 0, (3) c v d + R ln(v b) + s 0. (4) Uwaga: Warunek równych owierzchni jest znany jako konstrukcja Maxwella. 4
5 F D v F v v Rysunek 6: Do zadania ciecz lód b ciało stałe 1 1 ciecz rzechłodzona 0 a Rysunek 7: Do zadania Rozważ ewną substancję, która zależnie od temeratury może wystęować w fazie stałej lub ciekłej. Oblicz różnicę entroii tej substancji w dwóch stanach: w fazie stałej o temeraturze 1 oraz w ostaci rzechłodzonej cieczy o tej samej temeraturze. Załóż, że w normalnych warunkach substancja ta ulega tonieniu w temeraturze 0 > 1, rzy czym cieło tej rzemiany jest równe Q 0. Przyjmij, że ojemności cielne rozważanej substancji nie zależą od temeratury i wynoszą odowiednio: s w fazie stałej oraz c w fazie ciekłej. Odowiedź: = n Q ( s c ) ln
TERMODYNAMIKA TECHNICZNA I CHEMICZNA
 TERMODYNAMIKA TECHNICZNA I CHEMICZNA WYKŁAD IX RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO STAŁE-CIECZ (krystalizacja) ADSORPCJA KRYSTALIZACJA, ADSORPCJA 1 RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO STAŁE-CIECZ (krystalizacja)
TERMODYNAMIKA TECHNICZNA I CHEMICZNA WYKŁAD IX RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO STAŁE-CIECZ (krystalizacja) ADSORPCJA KRYSTALIZACJA, ADSORPCJA 1 RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO STAŁE-CIECZ (krystalizacja)
Entalpia swobodna (potencjał termodynamiczny)
 Entalia swobodna otencjał termodynamiczny. Związek omiędzy zmianą entalii swobodnej a zmianami entroii Całkowita zmiana entroii wywołana jakimś rocesem jest równa sumie zmiany entroii układu i otoczenia:
Entalia swobodna otencjał termodynamiczny. Związek omiędzy zmianą entalii swobodnej a zmianami entroii Całkowita zmiana entroii wywołana jakimś rocesem jest równa sumie zmiany entroii układu i otoczenia:
Wykład 4. Przypomnienie z poprzedniego wykładu
 Wykład 4 Przejścia fazowe materii Diagram fazowy Ciepło Procesy termodynamiczne Proces kwazistatyczny Procesy odwracalne i nieodwracalne Pokazy doświadczalne W. Dominik Wydział Fizyki UW Termodynamika
Wykład 4 Przejścia fazowe materii Diagram fazowy Ciepło Procesy termodynamiczne Proces kwazistatyczny Procesy odwracalne i nieodwracalne Pokazy doświadczalne W. Dominik Wydział Fizyki UW Termodynamika
Fizyka statystyczna Fenomenologia przejść fazowych. P. F. Góra
 Fizyka statystyczna Fenomenologia przejść fazowych P. F. Góra http://th-www.if.uj.edu.pl/zfs/gora/ 2015 Przejście fazowe transformacja układu termodynamicznego z jednej fazy (stanu materii) do innej, dokonywane
Fizyka statystyczna Fenomenologia przejść fazowych P. F. Góra http://th-www.if.uj.edu.pl/zfs/gora/ 2015 Przejście fazowe transformacja układu termodynamicznego z jednej fazy (stanu materii) do innej, dokonywane
Ć W I C Z E N I E N R C-5
 INSTYTUT FIZYKI WYDZIAŁ INŻYNIERII PRODUKCJI I TECHNOLOGII ATERIAŁÓW POLITECHNIKA CZĘSTOCHOWSKA PRACOWNIA ECHANIKI I CIEPŁA Ć W I C Z E N I E N R C-5 WYZNACZANIE CIEPŁA PAROWANIA WODY ETODĄ KALORYETRYCZNĄ
INSTYTUT FIZYKI WYDZIAŁ INŻYNIERII PRODUKCJI I TECHNOLOGII ATERIAŁÓW POLITECHNIKA CZĘSTOCHOWSKA PRACOWNIA ECHANIKI I CIEPŁA Ć W I C Z E N I E N R C-5 WYZNACZANIE CIEPŁA PAROWANIA WODY ETODĄ KALORYETRYCZNĄ
10. FALE, ELEMENTY TERMODYNAMIKI I HYDRODY- NAMIKI.
 0. FALE, ELEMENY ERMODYNAMIKI I HYDRODY- NAMIKI. 0.9. Podstawy termodynamiki i raw gazowych. Podstawowe ojęcia Gaz doskonały: - cząsteczki są unktami materialnymi, - nie oddziałują ze sobą siłami międzycząsteczkowymi,
0. FALE, ELEMENY ERMODYNAMIKI I HYDRODY- NAMIKI. 0.9. Podstawy termodynamiki i raw gazowych. Podstawowe ojęcia Gaz doskonały: - cząsteczki są unktami materialnymi, - nie oddziałują ze sobą siłami międzycząsteczkowymi,
Wykład 3. Prawo Pascala
 018-10-18 Wykład 3 Prawo Pascala Pływanie ciał Ściśliwość gazów, cieczy i ciał stałych Przemiany gazowe Równanie stanu gazu doskonałego Równanie stanu gazu van der Waalsa Przejścia fazowe materii W. Dominik
018-10-18 Wykład 3 Prawo Pascala Pływanie ciał Ściśliwość gazów, cieczy i ciał stałych Przemiany gazowe Równanie stanu gazu doskonałego Równanie stanu gazu van der Waalsa Przejścia fazowe materii W. Dominik
Jest to zasada zachowania energii w termodynamice - równoważność pracy i ciepła. Rozważmy proces adiabatyczny sprężania gazu od V 1 do V 2 :
 I zasada termodynamiki. Jest to zasada zachowania energii w termodynamice - równoważność racy i cieła. ozważmy roces adiabatyczny srężania gazu od do : dw, ad - wykonanie racy owoduje rzyrost energii wewnętrznej
I zasada termodynamiki. Jest to zasada zachowania energii w termodynamice - równoważność racy i cieła. ozważmy roces adiabatyczny srężania gazu od do : dw, ad - wykonanie racy owoduje rzyrost energii wewnętrznej
Stany materii. Masa i rozmiary cząstek. Masa i rozmiary cząstek. m n mol. n = Gaz doskonały. N A = 6.022x10 23
 Stany materii Masa i rozmiary cząstek Masą atomową ierwiastka chemicznego nazywamy stosunek masy atomu tego ierwiastka do masy / atomu węgla C ( C - izoto węgla o liczbie masowej ). Masą cząsteczkową nazywamy
Stany materii Masa i rozmiary cząstek Masą atomową ierwiastka chemicznego nazywamy stosunek masy atomu tego ierwiastka do masy / atomu węgla C ( C - izoto węgla o liczbie masowej ). Masą cząsteczkową nazywamy
Doświadczenie Joule a i jego konsekwencje Ciepło, pojemność cieplna sens i obliczanie Praca sens i obliczanie
 Pierwsza zasada termodynamiki 2.2.1. Doświadczenie Joule a i jego konsekwencje 2.2.2. ieło, ojemność cielna sens i obliczanie 2.2.3. Praca sens i obliczanie 2.2.4. Energia wewnętrzna oraz entalia 2.2.5.
Pierwsza zasada termodynamiki 2.2.1. Doświadczenie Joule a i jego konsekwencje 2.2.2. ieło, ojemność cielna sens i obliczanie 2.2.3. Praca sens i obliczanie 2.2.4. Energia wewnętrzna oraz entalia 2.2.5.
TERMODYNAMIKA PROCESOWA I TECHNICZNA
 ERMODYNAMIKA PROCESOWA I ECHNICZNA Wykład II Podstawowe definicje cd. Podstawowe idealizacje termodynamiczne I i II Zasada termodynamiki Proste rzemiany termodynamiczne Prof. Antoni Kozioł, Wydział Chemiczny
ERMODYNAMIKA PROCESOWA I ECHNICZNA Wykład II Podstawowe definicje cd. Podstawowe idealizacje termodynamiczne I i II Zasada termodynamiki Proste rzemiany termodynamiczne Prof. Antoni Kozioł, Wydział Chemiczny
WARUNKI RÓWNOWAGI UKŁADU TERMODYNAMICZNEGO
 WARUNKI RÓWNOWAGI UKŁADU ERMODYNAMICZNEGO Proces termodynamiczny zachodzi doóty, doóki układ nie osiągnie stanu równowagi. W stanie równowagi odowiedni otencjał termodynamiczny układu osiąga minimum, odczas
WARUNKI RÓWNOWAGI UKŁADU ERMODYNAMICZNEGO Proces termodynamiczny zachodzi doóty, doóki układ nie osiągnie stanu równowagi. W stanie równowagi odowiedni otencjał termodynamiczny układu osiąga minimum, odczas
Termodynamiczny opis przejść fazowych pierwszego rodzaju
 Wykład II Przejścia fazowe 1 Termodynamiczny opis przejść fazowych pierwszego rodzaju Woda występuje w trzech stanach skupienia jako ciecz, jako gaz, czyli para wodna, oraz jako ciało stałe, a więc lód.
Wykład II Przejścia fazowe 1 Termodynamiczny opis przejść fazowych pierwszego rodzaju Woda występuje w trzech stanach skupienia jako ciecz, jako gaz, czyli para wodna, oraz jako ciało stałe, a więc lód.
= T. = dt. Q = T (d - to nie jest różniczka, tylko wyrażenie różniczkowe); z I zasady termodynamiki: przy stałej objętości. = dt.
 ieło właściwe gazów definicja emiryczna: Q = (na jednostkę masy) T ojemność cielna = m ieło właściwe zależy od rocesu: Q rzy stałym ciśnieniu = T dq = dt rzy stałej objętości Q = T (d - to nie jest różniczka,
ieło właściwe gazów definicja emiryczna: Q = (na jednostkę masy) T ojemność cielna = m ieło właściwe zależy od rocesu: Q rzy stałym ciśnieniu = T dq = dt rzy stałej objętości Q = T (d - to nie jest różniczka,
Mini-quiz 0 Mini-quiz 1
 rawda fałsz Mini-quiz 0.Wielkości ekstensywne to: a rędkość kątowa b masa układu c ilość cząstek d temeratura e całkowity moment magnetyczny.. Układy otwarte: a mogą wymieniać energię z otoczeniem b mogą
rawda fałsz Mini-quiz 0.Wielkości ekstensywne to: a rędkość kątowa b masa układu c ilość cząstek d temeratura e całkowity moment magnetyczny.. Układy otwarte: a mogą wymieniać energię z otoczeniem b mogą
TERMODYNAMIKA. Przedstaw cykl przemian na wykresie poniższym w układach współrzędnych przedstawionych poniżej III
 Włodzimierz Wolczyński 44 POWÓRKA 6 ERMODYNAMKA Zadanie 1 Przedstaw cykl rzemian na wykresie oniższym w układach wsółrzędnych rzedstawionych oniżej Uzuełnij tabelkę wisując nazwę rzemian i symbole: >0,
Włodzimierz Wolczyński 44 POWÓRKA 6 ERMODYNAMKA Zadanie 1 Przedstaw cykl rzemian na wykresie oniższym w układach wsółrzędnych rzedstawionych oniżej Uzuełnij tabelkę wisując nazwę rzemian i symbole: >0,
WYKŁAD 2_2. 1.Entropia definicja termodynamiczna. przemiana nieodwracalna. Sumaryczny zapis obu tych relacji
 .Entroia definicja termodynamiczna. d d rzemiana odwracaa rzemiana nieodwracaa umaryczny zais obu tych relacji Q d el WYKŁAD _ rzykład a Obliczyć zmianę entroii, gdy 5 moli wodoru rozręŝa się odwracaie
.Entroia definicja termodynamiczna. d d rzemiana odwracaa rzemiana nieodwracaa umaryczny zais obu tych relacji Q d el WYKŁAD _ rzykład a Obliczyć zmianę entroii, gdy 5 moli wodoru rozręŝa się odwracaie
TERMODYNAMIKA. Termodynamika jest to dział nauk przyrodniczych zajmujący się własnościami
 TERMODYNAMIKA Termodynamika jest to dział nauk rzyrodniczych zajmujący się własnościami energetycznymi ciał. Przy badaniu i objaśnianiu własności układów fizycznych termodynamika osługuje się ojęciami
TERMODYNAMIKA Termodynamika jest to dział nauk rzyrodniczych zajmujący się własnościami energetycznymi ciał. Przy badaniu i objaśnianiu własności układów fizycznych termodynamika osługuje się ojęciami
Wykład 4 Gaz doskonały, gaz półdoskonały i gaz rzeczywisty Równanie stanu gazu doskonałego uniwersalna stała gazowa i stała gazowa Odstępstwa gazów
 Wykład 4 Gaz doskonały, gaz ółdoskonały i gaz rzeczywisty Równanie stanu gazu doskonałego uniwersalna stała gazowa i stała gazowa Odstęstwa gazów rzeczywistych od gazu doskonałego: stoień ściśliwości Z
Wykład 4 Gaz doskonały, gaz ółdoskonały i gaz rzeczywisty Równanie stanu gazu doskonałego uniwersalna stała gazowa i stała gazowa Odstęstwa gazów rzeczywistych od gazu doskonałego: stoień ściśliwości Z
Termodynamika 2. Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
 ermodynamika Projekt wsółfinansowany rzez Unię Euroejską w ramach Euroejskiego Funduszu Sołecznego Siik ciey siikach (maszynach) cieych cieło zamieniane jest na racę. Elementami siika są: źródło cieła
ermodynamika Projekt wsółfinansowany rzez Unię Euroejską w ramach Euroejskiego Funduszu Sołecznego Siik ciey siikach (maszynach) cieych cieło zamieniane jest na racę. Elementami siika są: źródło cieła
Termodynamika 1. Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
 Termodynamika Projekt wsółfinansowany rzez Unię Euroejską w ramach Euroejskiego Funduszu Sołecznego Układ termodynamiczny Układ termodynamiczny to ciało lub zbiór rozważanych ciał, w którym obok innych
Termodynamika Projekt wsółfinansowany rzez Unię Euroejską w ramach Euroejskiego Funduszu Sołecznego Układ termodynamiczny Układ termodynamiczny to ciało lub zbiór rozważanych ciał, w którym obok innych
powierzchnia rozdziału - dwie fazy ciekłe - jedna faza gazowa - dwa składniki
 Przejścia fazowe. powierzchnia rozdziału - skokowa zmiana niektórych parametrów na granicy faz. kropeki wody w atmosferze - dwie fazy ciekłe - jedna faza gazowa - dwa składniki Przykłady przejść fazowych:
Przejścia fazowe. powierzchnia rozdziału - skokowa zmiana niektórych parametrów na granicy faz. kropeki wody w atmosferze - dwie fazy ciekłe - jedna faza gazowa - dwa składniki Przykłady przejść fazowych:
TERMODYNAMIKA. Bada zjawiska cieplne i procesy mające charakter przemian energetycznych
 ERMODYNAMIKA Nauka o ciele i rocesach cielnych Bada zjawiska cielne i rocesy mające charakter rzemian energetycznych Dwa odejścia: - termodynamika klasyczna - doświadczalna (fenomenologiczna) - termodynamika
ERMODYNAMIKA Nauka o ciele i rocesach cielnych Bada zjawiska cielne i rocesy mające charakter rzemian energetycznych Dwa odejścia: - termodynamika klasyczna - doświadczalna (fenomenologiczna) - termodynamika
ZEROWA ZASADA TERMODYNAMIKI
 ERMODYNAMIKA Zerowa zasada termodynamiki Pomiar temeratury i skale temeratur Równanie stanu gazu doskonałego Cieło i temeratura Pojemność cielna i cieło właściwe Cieło rzemiany Przemiany termodynamiczne
ERMODYNAMIKA Zerowa zasada termodynamiki Pomiar temeratury i skale temeratur Równanie stanu gazu doskonałego Cieło i temeratura Pojemność cielna i cieło właściwe Cieło rzemiany Przemiany termodynamiczne
Temperatura i ciepło E=E K +E P +U. Q=c m T=c m(t K -T P ) Q=c przem m. Fizyka 1 Wróbel Wojciech
 emeratura i cieło E=E K +E P +U Energia wewnętrzna [J] - ieło jest energią rzekazywaną między układem a jego otoczeniem na skutek istniejącej między nimi różnicy temeratur na sosób cielny rzez chaotyczne
emeratura i cieło E=E K +E P +U Energia wewnętrzna [J] - ieło jest energią rzekazywaną między układem a jego otoczeniem na skutek istniejącej między nimi różnicy temeratur na sosób cielny rzez chaotyczne
= 2 + f(n-1) - n(f-1) = n f
 WYKŁAD H. H. Równowagi fazowe H.. Równowagi fazowe dla substancji czystych H.. Równowaga ciecz-ara w układach dwuskładnikowych H.. Równowaga ciecz-ciecz w układach dwuskładnikowych H.4. Równowaga ciecz-ciało
WYKŁAD H. H. Równowagi fazowe H.. Równowagi fazowe dla substancji czystych H.. Równowaga ciecz-ara w układach dwuskładnikowych H.. Równowaga ciecz-ciecz w układach dwuskładnikowych H.4. Równowaga ciecz-ciało
Podstawowe definicje
 Wprowadzenie do równowag fazowych (1) Podstawowe definicje 1) Faza dla danej substancji jej postać charakteryzująca się jednorodnym składem chemicznym i stanem fizycznym. W obrębie fazy niektóre intensywne
Wprowadzenie do równowag fazowych (1) Podstawowe definicje 1) Faza dla danej substancji jej postać charakteryzująca się jednorodnym składem chemicznym i stanem fizycznym. W obrębie fazy niektóre intensywne
Równowagi fazowe. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Równowagi fazowe Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Równowaga termodynamiczna Przemianom fazowym towarzyszą procesy, podczas których nie zmienia się skład chemiczny układu, polegają
Równowagi fazowe Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Równowaga termodynamiczna Przemianom fazowym towarzyszą procesy, podczas których nie zmienia się skład chemiczny układu, polegają
Wykład 1. Anna Ptaszek. 5 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Chemia fizyczna - wykład 1. Anna Ptaszek 1 / 36
 Wykład 1 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 5 października 2015 1 / 36 Podstawowe pojęcia Układ termodynamiczny To zbiór niezależnych elementów, które oddziałują ze sobą tworząc integralną
Wykład 1 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 5 października 2015 1 / 36 Podstawowe pojęcia Układ termodynamiczny To zbiór niezależnych elementów, które oddziałują ze sobą tworząc integralną
WYKŁAD 1 WPROWADZENIE DO STATYKI PŁYNÓW 1/23
 WYKŁAD 1 WPROWADZENIE DO STATYKI PŁYNÓW 1/23 RÓWNOWAGA SIŁ Siła owierzchniowa FS nds Siła objętościowa FV f dv Warunek konieczny równowagi łynu F F 0 S Całkowa ostać warunku równowagi łynu V nds f dv 0
WYKŁAD 1 WPROWADZENIE DO STATYKI PŁYNÓW 1/23 RÓWNOWAGA SIŁ Siła owierzchniowa FS nds Siła objętościowa FV f dv Warunek konieczny równowagi łynu F F 0 S Całkowa ostać warunku równowagi łynu V nds f dv 0
D. II ZASADA TERMODYNAMIKI
 WYKŁAD D,E D. II zasada termodynamiki E. Konsekwencje zasad termodynamiki D. II ZAADA ERMODYNAMIKI D.1. ełnienie I Zasady ermodynamiki jest warunkiem koniecznym zachodzenia jakiegokolwiek rocesu w rzyrodzie.
WYKŁAD D,E D. II zasada termodynamiki E. Konsekwencje zasad termodynamiki D. II ZAADA ERMODYNAMIKI D.1. ełnienie I Zasady ermodynamiki jest warunkiem koniecznym zachodzenia jakiegokolwiek rocesu w rzyrodzie.
Równowagi w układach jedno- i dwuskładnikowych
 Równowagi w układach jedno- i dwuskładnikowych Równowaga faz i równanie Clausiusa-Claeyrona Rozatrzmy cykl Carnota na oziomych odcinkach izoterm i CD, odowiadających równowadze ciecz-ara ewnej substancji.
Równowagi w układach jedno- i dwuskładnikowych Równowaga faz i równanie Clausiusa-Claeyrona Rozatrzmy cykl Carnota na oziomych odcinkach izoterm i CD, odowiadających równowadze ciecz-ara ewnej substancji.
Wykład 2. Przemiany termodynamiczne
 Wykład Przemiany termodynamiczne Przemiany odwracalne: Przemiany nieodwracalne:. izobaryczna = const 7. dławienie. izotermiczna = const 8. mieszanie. izochoryczna = const 9. tarcie 4. adiabatyczna = const
Wykład Przemiany termodynamiczne Przemiany odwracalne: Przemiany nieodwracalne:. izobaryczna = const 7. dławienie. izotermiczna = const 8. mieszanie. izochoryczna = const 9. tarcie 4. adiabatyczna = const
Podstawowe definicje
 Wprowadzenie do równowag fazowych () odstawowe definicje Faza dla danej substancji jej postać charakteryzująca się jednorodnym składem chemicznym i stanem fizycznym. W obrę bie fazy niektóre intensywne
Wprowadzenie do równowag fazowych () odstawowe definicje Faza dla danej substancji jej postać charakteryzująca się jednorodnym składem chemicznym i stanem fizycznym. W obrę bie fazy niektóre intensywne
Ćwiczenie nr 3. Wyznaczanie współczynnika Joule a-thomsona wybranych gazów rzeczywistych.
 Termodynamika II ćwiczenia laboratoryjne Ćwiczenie nr 3 Temat: Wyznaczanie wsółczynnika Joule a-tomsona wybranyc gazów rzeczywistyc. Miejsce ćwiczeń: Laboratorium Tecnologii Gazowyc Politecniki Poznańskiej
Termodynamika II ćwiczenia laboratoryjne Ćwiczenie nr 3 Temat: Wyznaczanie wsółczynnika Joule a-tomsona wybranyc gazów rzeczywistyc. Miejsce ćwiczeń: Laboratorium Tecnologii Gazowyc Politecniki Poznańskiej
TERMODYNAMIKA PROCESOWA. Wykład VI. Równania kubiczne i inne. Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej
 ERMODYNAMIKA PROCESOWA Wykład VI Równania kubiczne i inne Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej Komunikat Wstęne terminy egzaminu z ermodynamiki rocesowej : I termin środa 15.06.016
ERMODYNAMIKA PROCESOWA Wykład VI Równania kubiczne i inne Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej Komunikat Wstęne terminy egzaminu z ermodynamiki rocesowej : I termin środa 15.06.016
Warunki izochoryczno-izotermiczne
 WYKŁAD 5 Pojęcie potencjału chemicznego. Układy jednoskładnikowe W zależności od warunków termodynamicznych potencjał chemiczny substancji czystej definiujemy następująco: Warunki izobaryczno-izotermiczne
WYKŁAD 5 Pojęcie potencjału chemicznego. Układy jednoskładnikowe W zależności od warunków termodynamicznych potencjał chemiczny substancji czystej definiujemy następująco: Warunki izobaryczno-izotermiczne
Równowaga w układach termodynamicznych. Katarzyna Sznajd-Weron
 Równowaga w układach termodynamicznych. Katarzyna Sznajd-Weron Zagadka na początek wykładu Diagram fazowy wody w powiększeniu, problem metastabilności aktualny (Nature, 2011) Niższa temperatura topnienia
Równowaga w układach termodynamicznych. Katarzyna Sznajd-Weron Zagadka na początek wykładu Diagram fazowy wody w powiększeniu, problem metastabilności aktualny (Nature, 2011) Niższa temperatura topnienia
16 GAZY CZ. I PRZEMIANY.RÓWNANIE CLAPEYRONA
 Włodzimierz Wolczyński 16 GAZY CZ. PRZEMANY.RÓWNANE CLAPEYRONA Podstawowy wzór teorii kinetyczno-molekularnej gazów N ilość cząsteczek gazu 2 3 ś. Równanie stanu gazu doskonałego ż ciśnienie, objętość,
Włodzimierz Wolczyński 16 GAZY CZ. PRZEMANY.RÓWNANE CLAPEYRONA Podstawowy wzór teorii kinetyczno-molekularnej gazów N ilość cząsteczek gazu 2 3 ś. Równanie stanu gazu doskonałego ż ciśnienie, objętość,
Śr Kin Ruchu Postępowego. V n R T R T. 3 3 R 3 E R T T k T, 2 N 2 B
 Termodynamika Podstawowy wzór kinetyczno-molekularnej teorii budowy materii W oarciu o założenia dotyczące właściwości gazu doskonałego (molekuły to unkty materialne ozostające w ciągłym termicznym ruchu,
Termodynamika Podstawowy wzór kinetyczno-molekularnej teorii budowy materii W oarciu o założenia dotyczące właściwości gazu doskonałego (molekuły to unkty materialne ozostające w ciągłym termicznym ruchu,
Para wodna najczęściej jest produkowana w warunkach stałego ciśnienia.
 PARA WODNA 1. PRZEMIANY FAZOWE SUBSTANCJI JEDNORODNYCH Para wodna najczęściej jest produkowana w warunkach stałego ciśnienia. Przy niezmiennym ciśnieniu zmiana wody o stanie początkowym odpowiadającym
PARA WODNA 1. PRZEMIANY FAZOWE SUBSTANCJI JEDNORODNYCH Para wodna najczęściej jest produkowana w warunkach stałego ciśnienia. Przy niezmiennym ciśnieniu zmiana wody o stanie początkowym odpowiadającym
Termodynamika Część 2
 Termodynamika Część 2 Równanie stanu Równanie stanu gazu doskonałego Równania stanu gazów rzeczywistych rozwinięcie wirialne równanie van der Waalsa hipoteza odpowiedniości stanów inne równania stanu Równanie
Termodynamika Część 2 Równanie stanu Równanie stanu gazu doskonałego Równania stanu gazów rzeczywistych rozwinięcie wirialne równanie van der Waalsa hipoteza odpowiedniości stanów inne równania stanu Równanie
Termodynamika fenomenologiczna i statystyczna
 Termodynamika fenomenologiczna i statystyczna Termodynamika fenomenologiczna zajmuje się zwykle badaniem makroskoowych układów termodynamicznych złożonych z bardzo dużej ilości obiektów mikroskoowych.
Termodynamika fenomenologiczna i statystyczna Termodynamika fenomenologiczna zajmuje się zwykle badaniem makroskoowych układów termodynamicznych złożonych z bardzo dużej ilości obiektów mikroskoowych.
II zasada termodynamiki.
 II zasada termodynamiki. Według I zasady termodynamiki nie jest do omyślenia roces, w którym energia wewnętrzna układu doznałaby zmiany innej, niż wynosi suma algebraiczna energii wymienionych z otoczeniem.
II zasada termodynamiki. Według I zasady termodynamiki nie jest do omyślenia roces, w którym energia wewnętrzna układu doznałaby zmiany innej, niż wynosi suma algebraiczna energii wymienionych z otoczeniem.
Zadania treningowe na kolokwium
 Zadania treningowe na kolokwium 3.12.2010 1. Stan układu binarnego zawierającego n 1 moli substancji typu 1 i n 2 moli substancji typu 2 parametryzujemy za pomocą stężenia substancji 1: x n 1. Stabilność
Zadania treningowe na kolokwium 3.12.2010 1. Stan układu binarnego zawierającego n 1 moli substancji typu 1 i n 2 moli substancji typu 2 parametryzujemy za pomocą stężenia substancji 1: x n 1. Stabilność
11. Termodynamika. Wybór i opracowanie zadań od 11.1 do Bogusław Kusz.
 ermodynamia Wybór i oracowanie zadań od do 5 - Bogusław Kusz W zamniętej butelce o objętości 5cm znajduje się owietrze o temeraturze t 7 C i ciśnieniu hpa Po ewnym czasie słońce ogrzało butelę do temeratury
ermodynamia Wybór i oracowanie zadań od do 5 - Bogusław Kusz W zamniętej butelce o objętości 5cm znajduje się owietrze o temeraturze t 7 C i ciśnieniu hpa Po ewnym czasie słońce ogrzało butelę do temeratury
Termodynamika Część 7 Trzecia zasada termodynamiki Metody otrzymywania niskich temperatur Zjawisko Joule'a Thomsona Chłodzenie magnetyczne
 Termodynamika Część 7 Trzecia zasada termodynamiki Metody otrzymywania niskich temperatur Zjawisko Joule'a Thomsona Chłodzenie magnetyczne Janusz Brzychczyk, Instytut Fizyki UJ Postulat Nernsta (1906):
Termodynamika Część 7 Trzecia zasada termodynamiki Metody otrzymywania niskich temperatur Zjawisko Joule'a Thomsona Chłodzenie magnetyczne Janusz Brzychczyk, Instytut Fizyki UJ Postulat Nernsta (1906):
Wykład 7. Energia wewnętrzna jednoatomowego gazu doskonałego wynosi: 3 R . 2. Ciepło molowe przy stałym ciśnieniu obliczymy dzięki zależności: nrt
 W. Dominik Wydział Fizyki UW ermodynamika 08/09 /7 Wykład 7 Zasada ekwiartycji energii Stonie swobody ruchu cząsteczek ieło właściwe ciał stałych ównanie adiabaty w modelu kinetyczno-molekularnym g.d.
W. Dominik Wydział Fizyki UW ermodynamika 08/09 /7 Wykład 7 Zasada ekwiartycji energii Stonie swobody ruchu cząsteczek ieło właściwe ciał stałych ównanie adiabaty w modelu kinetyczno-molekularnym g.d.
Wykład 1 i 2. Termodynamika klasyczna, gaz doskonały
 Wykład 1 i 2 Termodynamika klasyczna, gaz doskonały dr hab. Agata Fronczak, prof. PW Wydział Fizyki, Politechnika Warszawska 1 stycznia 2017 dr hab. A. Fronczak (Wydział Fizyki PW) Wykład: Elementy fizyki
Wykład 1 i 2 Termodynamika klasyczna, gaz doskonały dr hab. Agata Fronczak, prof. PW Wydział Fizyki, Politechnika Warszawska 1 stycznia 2017 dr hab. A. Fronczak (Wydział Fizyki PW) Wykład: Elementy fizyki
Wykład 3. Entropia i potencjały termodynamiczne
 Wykład 3 Entropia i potencjały termodynamiczne dr hab. Agata Fronczak, prof. PW Wydział Fizyki, Politechnika Warszawska 1 stycznia 2017 dr hab. A. Fronczak (Wydział Fizyki PW) Wykład: Elementy fizyki statystycznej
Wykład 3 Entropia i potencjały termodynamiczne dr hab. Agata Fronczak, prof. PW Wydział Fizyki, Politechnika Warszawska 1 stycznia 2017 dr hab. A. Fronczak (Wydział Fizyki PW) Wykład: Elementy fizyki statystycznej
Kalorymetria paliw gazowych
 Katedra Termodynamiki, Teorii Maszyn i Urządzeń Cielnych W9/K2 Miernictwo energetyczne laboratorium Kalorymetria aliw gazowych Instrukcja do ćwiczenia nr 7 Oracowała: dr inż. Elżbieta Wróblewska Wrocław,
Katedra Termodynamiki, Teorii Maszyn i Urządzeń Cielnych W9/K2 Miernictwo energetyczne laboratorium Kalorymetria aliw gazowych Instrukcja do ćwiczenia nr 7 Oracowała: dr inż. Elżbieta Wróblewska Wrocław,
Termodynamika Część 6 Związki i tożsamości termodynamiczne Potencjały termodynamiczne Warunki równowagi termodynamicznej Potencjał chemiczny
 Termodynamika Część 6 Związki i tożsamości termodynamiczne Potencjały termodynamiczne Warunki równowagi termodynamicznej Potencjał chemiczny Janusz Brzychczyk, Instytut Fizyki UJ Związek pomiędzy równaniem
Termodynamika Część 6 Związki i tożsamości termodynamiczne Potencjały termodynamiczne Warunki równowagi termodynamicznej Potencjał chemiczny Janusz Brzychczyk, Instytut Fizyki UJ Związek pomiędzy równaniem
WYKŁAD 14 PROSTOPADŁA FALA UDERZENIOWA
 WYKŁAD 4 PROSTOPADŁA FALA UDERZENIOWA PROSTOPADŁA FALA UDERZENIOWA. ADIABATA HUGONIOTA. S 0 normal shock wave S Gazodynamika doszcza istnienie silnych nieciągłości w rzeływach gaz. Najrostszym rzyadkiem
WYKŁAD 4 PROSTOPADŁA FALA UDERZENIOWA PROSTOPADŁA FALA UDERZENIOWA. ADIABATA HUGONIOTA. S 0 normal shock wave S Gazodynamika doszcza istnienie silnych nieciągłości w rzeływach gaz. Najrostszym rzyadkiem
Podstawy Procesów i Konstrukcji Inżynierskich. Teoria kinetyczna INZYNIERIAMATERIALOWAPL. Kierunek Wyróżniony przez PKA
 Podstawy Procesów i Konstrukcji Inżynierskich Teoria kinetyczna Kierunek Wyróżniony rzez PKA 1 Termodynamika klasyczna Pierwsza zasada termodynamiki to rosta zasada zachowania energii, czyli ogólna reguła
Podstawy Procesów i Konstrukcji Inżynierskich Teoria kinetyczna Kierunek Wyróżniony rzez PKA 1 Termodynamika klasyczna Pierwsza zasada termodynamiki to rosta zasada zachowania energii, czyli ogólna reguła
Ćwiczenia rachunkowe z termodynamiki technicznej i chemicznej Zalecane zadania kolokwium 1. (2014/15)
 Ćwiczenia rachunkowe z termodynamiki technicznej i chemicznej Zalecane zadania kolokwium 1. (2014/15) (Uwaga! Liczba w nawiasie przy odpowiedzi oznacza numer zadania (zestaw.nr), którego rozwiązanie dostępne
Ćwiczenia rachunkowe z termodynamiki technicznej i chemicznej Zalecane zadania kolokwium 1. (2014/15) (Uwaga! Liczba w nawiasie przy odpowiedzi oznacza numer zadania (zestaw.nr), którego rozwiązanie dostępne
Seria 2, ćwiczenia do wykładu Od eksperymentu do poznania materii
 Seria 2, ćwiczenia do wykładu Od eksperymentu do poznania materii 8.1.21 Zad. 1. Obliczyć ciśnienie potrzebne do przemiany grafitu w diament w temperaturze 25 o C. Objętość właściwa (odwrotność gęstości)
Seria 2, ćwiczenia do wykładu Od eksperymentu do poznania materii 8.1.21 Zad. 1. Obliczyć ciśnienie potrzebne do przemiany grafitu w diament w temperaturze 25 o C. Objętość właściwa (odwrotność gęstości)
Analiza termiczna Krzywe stygnięcia
 Analiza termiczna Krzywe stygnięcia 0 0,2 0,4 0,6 0,8 1,0 T a e j n s x p b t c o f g h k l p d i m y z q u v r w α T B T A T E T k P = const Chem. Fiz. TCH II/10 1 Rozpatrując stygnięcie wzdłuż kolejnych
Analiza termiczna Krzywe stygnięcia 0 0,2 0,4 0,6 0,8 1,0 T a e j n s x p b t c o f g h k l p d i m y z q u v r w α T B T A T E T k P = const Chem. Fiz. TCH II/10 1 Rozpatrując stygnięcie wzdłuż kolejnych
W8 40. Para. Równanie Van der Waalsa Temperatura krytyczna ci Przemiany pary. Termodynamika techniczna
 W8 40 Równanie Van der Waalsa Temperatura krytyczna Stopień suchości ci Przemiany pary 1 p T 1 =const T 2 =const 2 Oddziaływanie międzycz dzycząsteczkowe jest odwrotnie proporcjonalne do odległości (liczonej
W8 40 Równanie Van der Waalsa Temperatura krytyczna Stopień suchości ci Przemiany pary 1 p T 1 =const T 2 =const 2 Oddziaływanie międzycz dzycząsteczkowe jest odwrotnie proporcjonalne do odległości (liczonej
Wykład 5. Kalorymetria i przejścia fazowe
 Wykład 5 Kalorymetria Ciepło przemian fazowych Bilans cieplny Proces kwazistatyczny Procesy odwracalne i nieodwracalne Praca Energia wewnętrzna Podstawowe przemiany gazowe W. Dominik Wydział Fizyki UW
Wykład 5 Kalorymetria Ciepło przemian fazowych Bilans cieplny Proces kwazistatyczny Procesy odwracalne i nieodwracalne Praca Energia wewnętrzna Podstawowe przemiany gazowe W. Dominik Wydział Fizyki UW
Wykład 3. Fizykochemia biopolimerów- wykład 3. Anna Ptaszek. 30 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego
 Wykład 3 - wykład 3 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 30 października 2013 1/56 Warunek równowagi fazowej Jakich układów dotyczy równowaga fazowa? Równowaga fazowa dotyczy układów: jednoskładnikowych
Wykład 3 - wykład 3 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 30 października 2013 1/56 Warunek równowagi fazowej Jakich układów dotyczy równowaga fazowa? Równowaga fazowa dotyczy układów: jednoskładnikowych
Wykład 3. Diagramy fazowe P-v-T dla substancji czystych w trzech stanach. skupienia. skupienia
 Wykład 3 Substancje proste i czyste Przemiany w systemie dwufazowym woda para wodna Diagram T-v dla przejścia fazowego woda para wodna Diagramy T-v i P-v dla wody Punkt krytyczny Temperatura nasycenia
Wykład 3 Substancje proste i czyste Przemiany w systemie dwufazowym woda para wodna Diagram T-v dla przejścia fazowego woda para wodna Diagramy T-v i P-v dla wody Punkt krytyczny Temperatura nasycenia
TERMODYNAMIKA FENOMENOLOGICZNA
 TERMODYNAMIKA FENOMENOLOGICZNA Przedmiotem badań są własności układów makroskopowych w zaleŝności od temperatury. Układ makroskopowy Np. 1 mol substancji - tyle składników ile w 12 gramach węgla C 12 N
TERMODYNAMIKA FENOMENOLOGICZNA Przedmiotem badań są własności układów makroskopowych w zaleŝności od temperatury. Układ makroskopowy Np. 1 mol substancji - tyle składników ile w 12 gramach węgla C 12 N
Rozdział 8. v v p p --~ 3: :1. A B c D
 Rozdział 8 Gaz doskonały ulega-kolejnym-rzemianom: 1-+i -+3, zilustrowanym-na rysunku obok w układzie wsółrzędnych T,. Wskaż, na których rysunkach (od A do D) orawnie zilustrowano te rzemiany w innych
Rozdział 8 Gaz doskonały ulega-kolejnym-rzemianom: 1-+i -+3, zilustrowanym-na rysunku obok w układzie wsółrzędnych T,. Wskaż, na których rysunkach (od A do D) orawnie zilustrowano te rzemiany w innych
LABORATORIUM TECHNIKI CIEPLNEJ INSTYTUTU TECHNIKI CIEPLNEJ WYDZIAŁ INŻYNIERII ŚRODOWISKA I ENERGETYKI POLITECHNIKI ŚLĄSKIEJ
 INSTYTUTU TECHNIKI CIEPLNEJ WYDZIAŁ INŻYNIERII ŚRODOWISKA I ENERGETYKI POLITECHNIKI ŚLĄSKIEJ INSTRUKCJA LABORATORYJNA Temat ćwiczenia: WYZNACZANIE WILGOTNOŚCI WZGLĘDNEJ I STOPNIA ZAWILŻENIA POWIETRZA HIGROMETREM
INSTYTUTU TECHNIKI CIEPLNEJ WYDZIAŁ INŻYNIERII ŚRODOWISKA I ENERGETYKI POLITECHNIKI ŚLĄSKIEJ INSTRUKCJA LABORATORYJNA Temat ćwiczenia: WYZNACZANIE WILGOTNOŚCI WZGLĘDNEJ I STOPNIA ZAWILŻENIA POWIETRZA HIGROMETREM
CHEMIA FIZYCZNA ZTiM
 CHEMIA FIZYCZNA ZTiM Semestr zimowy 2016/2017 Dr hab. inż. Dorota Warmińska 1. Chemia fizyczna. Termodynamika. Podstawowe pojęcia stosowane w termodynamice. Układ i otoczenie. Przegroda adiabatyczna i
CHEMIA FIZYCZNA ZTiM Semestr zimowy 2016/2017 Dr hab. inż. Dorota Warmińska 1. Chemia fizyczna. Termodynamika. Podstawowe pojęcia stosowane w termodynamice. Układ i otoczenie. Przegroda adiabatyczna i
GAZ DOSKONAŁY. Brak oddziaływań między cząsteczkami z wyjątkiem zderzeń idealnie sprężystych.
 TERMODYNAMIKA GAZ DOSKONAŁY Gaz doskonały to abstrakcyjny, matematyczny model gazu, chociaż wiele gazów (azot, tlen) w warunkach normalnych zachowuje się w przybliżeniu jak gaz doskonały. Model ten zakłada:
TERMODYNAMIKA GAZ DOSKONAŁY Gaz doskonały to abstrakcyjny, matematyczny model gazu, chociaż wiele gazów (azot, tlen) w warunkach normalnych zachowuje się w przybliżeniu jak gaz doskonały. Model ten zakłada:
Elementy termodynamiki i wprowadzenie do zespołów statystycznych. Katarzyna Sznajd-Weron
 Elementy termodynamiki i wprowadzenie do zespołów statystycznych Katarzyna Sznajd-Weron Wielkości makroskopowe - termodynamika Termodynamika - metoda fenomenologiczna Fenomenologia w fizyce: widzimy jak
Elementy termodynamiki i wprowadzenie do zespołów statystycznych Katarzyna Sznajd-Weron Wielkości makroskopowe - termodynamika Termodynamika - metoda fenomenologiczna Fenomenologia w fizyce: widzimy jak
Chemia Fizyczna Technologia Chemiczna II rok Wykład 1. Kontakt,informacja i konsultacje. Co to jest chemia fizyczna?
 Chemia Fizyczna Technologia Chemiczna II ro Wyład 1 Kierowni rzedmiotu: Dr hab. inż. Wojciech Chrzanowsi Kontat,informacja i onsultacje Chemia A ; oój 307 Telefon: 347-2769 E-mail: wojte@chem.g.gda.l tablica
Chemia Fizyczna Technologia Chemiczna II ro Wyład 1 Kierowni rzedmiotu: Dr hab. inż. Wojciech Chrzanowsi Kontat,informacja i onsultacje Chemia A ; oój 307 Telefon: 347-2769 E-mail: wojte@chem.g.gda.l tablica
TERMODYNAMIKA OGNIWA GALWANICZNEGO
 Ćwiczenie nr 3 ERMODYNAMIKA OGNIWA GALWANICZNEGO I. Cel ćwiczenia Celem ćwiczenia jest wyznaczenie zmian funkcji termodynamicznych dla reakcji biegnącej w ogniwie Clarka. II. Zagadnienia wrowadzające 1.
Ćwiczenie nr 3 ERMODYNAMIKA OGNIWA GALWANICZNEGO I. Cel ćwiczenia Celem ćwiczenia jest wyznaczenie zmian funkcji termodynamicznych dla reakcji biegnącej w ogniwie Clarka. II. Zagadnienia wrowadzające 1.
Termodynamika. Część 4. Procesy izoparametryczne Entropia Druga zasada termodynamiki. Janusz Brzychczyk, Instytut Fizyki UJ
 Termodynamika Część 4 Procesy izoparametryczne Entropia Druga zasada termodynamiki Janusz Brzychczyk, Instytut Fizyki UJ Pierwsza zasada termodynamiki procesy kwazistatyczne Zgodnie z pierwszą zasadą termodynamiki,
Termodynamika Część 4 Procesy izoparametryczne Entropia Druga zasada termodynamiki Janusz Brzychczyk, Instytut Fizyki UJ Pierwsza zasada termodynamiki procesy kwazistatyczne Zgodnie z pierwszą zasadą termodynamiki,
). Uzyskanie temperatur rzędu pojedynczych kalwinów wymaga użycia helu ( Tw
 WFiIS PRACOWNIA FIZYCZNA I i II Imię i nazwisko: 1 2 TEMAT: ROK GRUPA ZESPÓŁ NR ĆWICZENIA Data wykonania: Data oddania: Zwrot do orawy: Data oddania: Data zliczenia: OCENA Cel ćwiczenia Zaoznanie się z
WFiIS PRACOWNIA FIZYCZNA I i II Imię i nazwisko: 1 2 TEMAT: ROK GRUPA ZESPÓŁ NR ĆWICZENIA Data wykonania: Data oddania: Zwrot do orawy: Data oddania: Data zliczenia: OCENA Cel ćwiczenia Zaoznanie się z
Równanie gazu doskonałego
 Równanie gazu doskonałego Gaz doskonały to abstrakcyjny model gazu, który zakłada, że gaz jest zbiorem sprężyście zderzających się kulek. Wiele gazów w warunkach normalnych zachowuje się jak gaz doskonały.
Równanie gazu doskonałego Gaz doskonały to abstrakcyjny model gazu, który zakłada, że gaz jest zbiorem sprężyście zderzających się kulek. Wiele gazów w warunkach normalnych zachowuje się jak gaz doskonały.
chemia wykład 3 Przemiany fazowe
 Przemiany fazowe Przemiany fazowe substancji czystych Wrzenie, krzepnięcie, przemiana grafitu w diament stanowią przykłady przemian fazowych, które zachodzą bez zmiany składu chemicznego. Diagramy fazowe
Przemiany fazowe Przemiany fazowe substancji czystych Wrzenie, krzepnięcie, przemiana grafitu w diament stanowią przykłady przemian fazowych, które zachodzą bez zmiany składu chemicznego. Diagramy fazowe
termodynamika fenomenologiczna
 termodynamika termodynamika fenomenologiczna własności termiczne ciał makroskoowych uogólnienie licznych badań doświadczalnych ois makro i mikro rezygnacja z rzyczynowości znaczenie raktyczne układ termodynamiczny
termodynamika termodynamika fenomenologiczna własności termiczne ciał makroskoowych uogólnienie licznych badań doświadczalnych ois makro i mikro rezygnacja z rzyczynowości znaczenie raktyczne układ termodynamiczny
Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12
 Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12 atomu węgla 12 C. Mol - jest taką ilością danej substancji,
Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12 atomu węgla 12 C. Mol - jest taką ilością danej substancji,
TERMODYNAMIKA PROCESOWA I TECHNICZNA
 ERMODYNAMIKA PROCESOWA I ECHNICZNA Wykład VIII Równania stanu tyu an der Waalsa Przyomnienie Na orzednim wykładzie omówiliśmy: 1. Równanie stanu gazu doskonałego.. Porawione RSGD za omocą wsółczynnika
ERMODYNAMIKA PROCESOWA I ECHNICZNA Wykład VIII Równania stanu tyu an der Waalsa Przyomnienie Na orzednim wykładzie omówiliśmy: 1. Równanie stanu gazu doskonałego.. Porawione RSGD za omocą wsółczynnika
Wykład 2. Anna Ptaszek. 7 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Chemia fizyczna - wykład 2. Anna Ptaszek 1 / 1
 Wykład 2 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 7 października 2015 1 / 1 Zjawiska koligatywne Rozpuszczenie w wodzie substancji nielotnej powoduje obniżenie prężności pary nasyconej P woda
Wykład 2 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 7 października 2015 1 / 1 Zjawiska koligatywne Rozpuszczenie w wodzie substancji nielotnej powoduje obniżenie prężności pary nasyconej P woda
INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH
 INSTYTUT MASZYN I URZĄDZEŃ ENERGETYCZNYCH Politechnika Śląska w Gliwicach INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH WYZNACZANIE WYKRESU RÓWNOWAGI FAZOWEJ (dla stopów dwuskładnikowych) Instrukcja przeznaczona
INSTYTUT MASZYN I URZĄDZEŃ ENERGETYCZNYCH Politechnika Śląska w Gliwicach INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH WYZNACZANIE WYKRESU RÓWNOWAGI FAZOWEJ (dla stopów dwuskładnikowych) Instrukcja przeznaczona
Temodynamika Roztwór N 2 i Ar (gazów doskonałych) ma wykładnik adiabaty κ = 1.5. Określić molowe udziały składników. 1.7
 Temodynamika Zadania 2016 0 Oblicz: 1 1.1 10 cm na stopy, 60 stóp na metry, 50 ft 2 na metry. 45 m 2 na ft 2 g 40 cm na uncję na stopę sześcienną, na uncję na cal sześcienny 3 60 g cm na funt na stopę
Temodynamika Zadania 2016 0 Oblicz: 1 1.1 10 cm na stopy, 60 stóp na metry, 50 ft 2 na metry. 45 m 2 na ft 2 g 40 cm na uncję na stopę sześcienną, na uncję na cal sześcienny 3 60 g cm na funt na stopę
prof. dr hab. Małgorzata Jóźwiak
 Czy równowaga w przyrodzie i w chemii jest korzystna? prof. dr hab. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga
Czy równowaga w przyrodzie i w chemii jest korzystna? prof. dr hab. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga
Destylacja z parą wodną
 Destylacja z parą wodną 1. prowadzenie iele związków chemicznych podczas destylacji przy ciśnieniu normalnym ulega rozkładowi lub polimeryzacji. by możliwe było ich oddestylowanie należy wykonywać ten
Destylacja z parą wodną 1. prowadzenie iele związków chemicznych podczas destylacji przy ciśnieniu normalnym ulega rozkładowi lub polimeryzacji. by możliwe było ich oddestylowanie należy wykonywać ten
(1) Równanie stanu gazu doskonałego. I zasada termodynamiki: ciepło, praca.
 (1) Równanie stanu gazu doskonałego. I zasada termodynamiki: ciepło, praca. 1. Aby określić dokładną wartość stałej gazowej R, student ogrzał zbiornik o objętości 20,000 l wypełniony 0,25132 g gazowego
(1) Równanie stanu gazu doskonałego. I zasada termodynamiki: ciepło, praca. 1. Aby określić dokładną wartość stałej gazowej R, student ogrzał zbiornik o objętości 20,000 l wypełniony 0,25132 g gazowego
Materiały pomocnicze do ćwiczeń z przedmiotu: Termodynamika techniczna
 Materiały omocnicze do ćwiczeń z rzedmiotu: Termodynamika techniczna Materiały omocnicze do rzedmiotu Termodynamika techniczna. Sis treści Sis treści... 3 Gaz jako czynnik termodynamiczny... 5. Prawa
Materiały omocnicze do ćwiczeń z rzedmiotu: Termodynamika techniczna Materiały omocnicze do rzedmiotu Termodynamika techniczna. Sis treści Sis treści... 3 Gaz jako czynnik termodynamiczny... 5. Prawa
RÓWNOWAGA CIECZ PARA W UKŁADZIE DWUSKŁADNIKOWYM
 RÓWNOWAGA CIECZ PARA W UKŁADZIE DWUSKŁADNIKOWYM Cel ćwiczenia: wyznaczenie diagramu fazowego ciecz para w warunkach izobarycznych. Układ pomiarowy i opis metody: Pomiary wykonywane są metodą recyrkulacyjną
RÓWNOWAGA CIECZ PARA W UKŁADZIE DWUSKŁADNIKOWYM Cel ćwiczenia: wyznaczenie diagramu fazowego ciecz para w warunkach izobarycznych. Układ pomiarowy i opis metody: Pomiary wykonywane są metodą recyrkulacyjną
13) Na wykresie pokazano zależność temperatury od objętości gazu A) Przemianę izotermiczną opisują krzywe: B) Przemianę izobaryczną opisują krzywe:
 ) Ołowiana kula o masie kilograma sada swobodnie z wysokości metrów. Który wzór służy do obliczenia jej energii na wysokości metrów? ) E=m g h B) E=m / C) E=G M m/r D) Q=c w m Δ ) Oblicz energię kulki
) Ołowiana kula o masie kilograma sada swobodnie z wysokości metrów. Który wzór służy do obliczenia jej energii na wysokości metrów? ) E=m g h B) E=m / C) E=G M m/r D) Q=c w m Δ ) Oblicz energię kulki
Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 2, zadanie nr 1 1
 Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 2, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący Uwaga! Proszę stosować się do następującego sposobu wprowadzania tekstu w ramkach : pola szare
Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 2, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący Uwaga! Proszę stosować się do następującego sposobu wprowadzania tekstu w ramkach : pola szare
Pomiar wilgotności względnej powietrza
 Katedra Silników Salinowych i Pojazdów ATH ZAKŁAD TERMODYNAMIKI Pomiar wilgotności względnej owietrza - 1 - Wstę teoretyczny Skład gazu wilgotnego. Gazem wilgotnym nazywamy mieszaninę gazów, z których
Katedra Silników Salinowych i Pojazdów ATH ZAKŁAD TERMODYNAMIKI Pomiar wilgotności względnej owietrza - 1 - Wstę teoretyczny Skład gazu wilgotnego. Gazem wilgotnym nazywamy mieszaninę gazów, z których
Wykład 6. Klasyfikacja przemian fazowych
 Wykład 6 Klasyfikacja przemian fazowych JS Klasyfikacja Ehrenfesta Ehrenfest klasyfikuje przemiany fazowe w oparciu o potencjał chemiczny. nieciągłość Przemiany fazowe pierwszego rodzaju pochodne potencjału
Wykład 6 Klasyfikacja przemian fazowych JS Klasyfikacja Ehrenfesta Ehrenfest klasyfikuje przemiany fazowe w oparciu o potencjał chemiczny. nieciągłość Przemiany fazowe pierwszego rodzaju pochodne potencjału
3.1. Równowagi fazowe układach jednoskładnikowych 3.2. Termodynamika równowag fazowych 3.3. Równowagi fazowe układach dwuskładnikowych 3.4.
 Równowagi fazowe w układach jedno- i wieloskładnikowych jedno- lub wielofazowych 3.1. Równowagi fazowe układach jednoskładnikowych 3.2. Termodynamika równowag fazowych 3.3. Równowagi fazowe układach dwuskładnikowych
Równowagi fazowe w układach jedno- i wieloskładnikowych jedno- lub wielofazowych 3.1. Równowagi fazowe układach jednoskładnikowych 3.2. Termodynamika równowag fazowych 3.3. Równowagi fazowe układach dwuskładnikowych
Entropia i druga zasada termodynamiki
 Entroia-drga zasada- Entroia i drga zasada termodynamiki.9.6 :5: Entroia-drga zasada- Przemiana realizowana w kładzie rzedstawionym na rys. 3.7 jest równowagową rzemianą beztariową. Jest ona wię odwraalna.
Entroia-drga zasada- Entroia i drga zasada termodynamiki.9.6 :5: Entroia-drga zasada- Przemiana realizowana w kładzie rzedstawionym na rys. 3.7 jest równowagową rzemianą beztariową. Jest ona wię odwraalna.
PŁYN Y RZECZYWISTE Przepływy rzeczywiste różnią się od przepływów idealnych obecnością tarcia (lepkości): przepływy laminarne/warstwowe - różnią się
 PŁYNY RZECZYWISTE Płyny rzeczywiste Przeływ laminarny Prawo tarcia Newtona Przeływ turbulentny Oór dynamiczny Prawdoodobieństwo hydrodynamiczne Liczba Reynoldsa Politechnika Oolska Oole University of Technology
PŁYNY RZECZYWISTE Płyny rzeczywiste Przeływ laminarny Prawo tarcia Newtona Przeływ turbulentny Oór dynamiczny Prawdoodobieństwo hydrodynamiczne Liczba Reynoldsa Politechnika Oolska Oole University of Technology
Termodynamika techniczna i chemiczna, 2015/16, zadania do kol. 1, zadanie nr 1 1
 Termodynamika techniczna i chemiczna, 2015/16, zadania do kol. 1, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący 1. Obliczyć zmianę entalpii dla izobarycznej (p = 1 bar) reakcji chemicznej zapoczątkowanej
Termodynamika techniczna i chemiczna, 2015/16, zadania do kol. 1, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący 1. Obliczyć zmianę entalpii dla izobarycznej (p = 1 bar) reakcji chemicznej zapoczątkowanej
Szkła specjalne Przejście szkliste i jego termodynamika Wykład 5. Ryszard J. Barczyński, 2017 Materiały edukacyjne do użytku wewnętrznego
 Szkła specjalne Przejście szkliste i jego termodynamika Wykład 5 Ryszard J. Barczyński, 2017 Materiały edukacyjne do użytku wewnętrznego Czy przejście szkliste jest termodynamicznym przejściem fazowym?
Szkła specjalne Przejście szkliste i jego termodynamika Wykład 5 Ryszard J. Barczyński, 2017 Materiały edukacyjne do użytku wewnętrznego Czy przejście szkliste jest termodynamicznym przejściem fazowym?
p, V, T, U, S, H, F, G Parametry mikroskopowe Parametry makroskopowe 2 k
 Parametry mikroskoowe m, < v>, < v >, < E > Fizyka statystyczna k Fizyka statystyczna stara się oisać układy składające się z wielu cząstek. Zajmuje się ona badaniem arametrów mikroskoowych układów, oszukiwaniem
Parametry mikroskoowe m, < v>, < v >, < E > Fizyka statystyczna k Fizyka statystyczna stara się oisać układy składające się z wielu cząstek. Zajmuje się ona badaniem arametrów mikroskoowych układów, oszukiwaniem
ogromna liczba małych cząsteczek, doskonale elastycznych, poruszających się we wszystkich kierunkach, tory prostoliniowe, kierunek ruchu zmienia się
 CHEMIA NIEORGANICZNA Dr hab. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I pietro p. 138 WYKŁAD - STAN GAZOWY i CHEMIA GAZÓW kinetyczna teoria gazów ogromna liczba małych cząsteczek, doskonale
CHEMIA NIEORGANICZNA Dr hab. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I pietro p. 138 WYKŁAD - STAN GAZOWY i CHEMIA GAZÓW kinetyczna teoria gazów ogromna liczba małych cząsteczek, doskonale
Projekt Inżynier mechanik zawód z przyszłością współfinansowany ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego
 Zajęcia wyrównawcze z fizyki -Zestaw 4 -eoria ermodynamika Równanie stanu gazu doskonałego Izoprzemiany gazowe Energia wewnętrzna gazu doskonałego Praca i ciepło w przemianach gazowych Silniki cieplne
Zajęcia wyrównawcze z fizyki -Zestaw 4 -eoria ermodynamika Równanie stanu gazu doskonałego Izoprzemiany gazowe Energia wewnętrzna gazu doskonałego Praca i ciepło w przemianach gazowych Silniki cieplne
Gazy wilgotne i suszenie
 Gazy wilgotne i uzenie Teoria gazów wilgotnych dotyczy gazów, które w ąiedztwie cieczy wchłaniają ary cieczy i tają ię wilgotne. Zmiana warunków owoduje, że część ary ulega kroleniu. Najbardziej tyowym
Gazy wilgotne i uzenie Teoria gazów wilgotnych dotyczy gazów, które w ąiedztwie cieczy wchłaniają ary cieczy i tają ię wilgotne. Zmiana warunków owoduje, że część ary ulega kroleniu. Najbardziej tyowym
3 Potencjały termodynamiczne i transformacja Legendre a
 3 Potencjały termodynamiczne i transformacja Legendre a literatura: Ingarden, Jamiołkowski i Mrugała, Fizyka Statystyczna i ermodynamika, 9 W.I Arnold, Metody matematyczne mechaniki klasycznej, 14 3.1
3 Potencjały termodynamiczne i transformacja Legendre a literatura: Ingarden, Jamiołkowski i Mrugała, Fizyka Statystyczna i ermodynamika, 9 W.I Arnold, Metody matematyczne mechaniki klasycznej, 14 3.1
POLITECHNIKA POZNAŃSKA ZAKŁAD CHEMII FIZYCZNEJ ĆWICZENIA PRACOWNI CHEMII FIZYCZNEJ
 WSTĘP ADSORPCJA NA GRANICY FAZ: CIAŁO STAŁE CIECZ. WYZNACZANIE IZOTERMY ADSORPCJI NA WĘGLU AKTYWNYM Adsorcja jako zjawisko owierzchniowe związana jest z istnieniem niewysyconych sił międzycząsteczkowych
WSTĘP ADSORPCJA NA GRANICY FAZ: CIAŁO STAŁE CIECZ. WYZNACZANIE IZOTERMY ADSORPCJI NA WĘGLU AKTYWNYM Adsorcja jako zjawisko owierzchniowe związana jest z istnieniem niewysyconych sił międzycząsteczkowych
Krystalizacja. Zarodkowanie
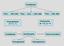 Krystalizacja Ciecz ciało stałe Para ciecz ciało stałe Para ciało stałe Przechłodzenie T = T L - T c Przesycenie p = p g - p z > 0 Krystalizacja Zarodkowanie Rozrost zarodków Homogeniczne Heterogeniczne
Krystalizacja Ciecz ciało stałe Para ciecz ciało stałe Para ciało stałe Przechłodzenie T = T L - T c Przesycenie p = p g - p z > 0 Krystalizacja Zarodkowanie Rozrost zarodków Homogeniczne Heterogeniczne
