Wykład 8. Silnik Stirlinga (R. Stirling, 1816)
|
|
|
- Dominika Chmiel
- 6 lat temu
- Przeglądów:
Transkrypt
1 Wykład 8 Maszyny ceplne c.d. Rozkład Maxwella -wstęp Entalpa Entalpa reakcj chemcznych Entalpa przeman azowych Procesy odwracalne neodwracalne Entropa W. Domnk Wydzał Fzyk UW Termodynamka 018/019 1/6 Slnk Strlnga (R. Strlng, 1816) slnk ceplny, który przetwarza energę ceplną w energę mechanczną bez procesu wewnętrznego spalana palwa, a na skutek dostarczana cepła z zewnątrz. Substancja robocza: gaz o dobrym przewodnctwe ceplnym w zbornku zamknętym ruchomym tłokam 1. rozprężane zotermczne. chłodzene zochoryczne 3. sprężane zotermczne 4. grzane zochoryczne V RT b H TL ln V a S V RT b H ln CV T H T V L a Zbudowane prototypy slnka osągały moc do 500 KM dobre współczynnk sprawnośc 35-40% Gaz roboczy o dużej przewodnośc ceplnej (wodór, hel) Układy kogeneracj produkcj cepła energ elektrycznej małej mocy (do 34 kw) Copyrght 005 John Wley and Sons, Inc W. Domnk Wydzał Fzyk UW Termodynamka 018/019 /7 1
2 p 1 p 0 p 1 Idealna maszyna parowa tłokowa 5 3 V 0 V 1 V 4 V Cykl maszyny parowej: 1. Tłok spoczywa, para dostaje sę z kotła do cylndra, wzrasta cśnene.. Tłok porusza sę, para dopływa, cśnene stałe, objętość rośne. 3. Dostęp pary zamknęty, adabatyczne rozprężane 4. Otwarce cylndra do chłodncy, szybk spadek cśnena, stała objętość. 5. Usuwane resztek pary, stałe cśnene, objętość maleje. pl.wkpeda.org/wk/maszyna_parowa W. Domnk Wydzał Fzyk UW Termodynamka 018/019 3/7 Knetyczno-molekularna teora gazów Prędkość cząsteczek energa knetyczna Średna energa knetyczna ruchu postępowego cząsteczk: Perwastek średnej prędkośc kwadratowej cząsteczk: Wnosek: dla danej temperatury T średna energa knetyczna cząsteczk <E k > ne zależy od masy m, ale średna wartość prędkośc zależy od masy m; m lżejsze cząsteczk tym wększa prędkośc z jaką sę poruszają w gaze. m : masa cząsteczk M : masa molowa Przykład: W powetrzu o ustalonej temperaturze najszybsze są cząsteczk wodoru. Znaczne jest prawdopodobeństwo osągnęca przez cząsteczkę wodoru prędkośc wększej nż druga prędkość kosmczna E k 1 m 3 kbt v II =11. km/s Wodór uceka z atmosery Zem, a pozostają cęższe składnk gazowe. rms 3k B T m 3RT M Rozkład Maxwella-Boltzmanna W. Domnk Wydzał Fzyk UW Termodynamka 018/019 4/30
3 Entalpa Rozważmy proces (przemana zobaryczna): proces zachodz pod stałym cśnenem p prowadz od stanu początkowego do stanu końcowego p=const Q stan stan I zasada termodynamk: Praca objętoścowa: Q W Q = U U + W pdv p dv p V V U U pv V U pv U pv H H W. Domnk Wydzał Fzyk UW Termodynamka 018/019 5/6 Entalpa Adabatyczne dławene przepływu gazu dla przepływu ustalonego p 1, V 1, U 1 p, V, U Adabatyczny przepływ przez zawór, Dławene przepływu p < p 1 Opór stawany przez zawór powoduje spadek cśnena DU = -W poneważ przemana adabatyczna W = p V p 1 V 1 U + p V = U 1 + p 1 V 1 Przepchnęce porcj gazu przez zawór odbywa sę kosztem otoczena wymuszającego ruch gazu. W procese tym zachowana jest welkość : H = U + pv W. Domnk Wydzał Fzyk UW Termodynamka 018/019 6/6 3
4 ENTALPIA cepła reakcj chemcznych Wprowadzamy unkcję stanu H zwaną entalpą Entalpa: H U + pv [ H] J W procesach zachodzących pod stałym cśnenem p od stanu do stanu dostarczone do układu cepło można zapsać : Q = H Badane eektów ceplnych reakcj chemcznych (G.H. Hess ) : cepło wymenane podczas reakcj zależy jedyne od stanu początkowego końcowego, a ne zależy od rodzaju lczby kroków pośrednch (czyl drog łączącej stan początkowy końcowy). W. Domnk Wydzał Fzyk UW Termodynamka 018/019 7/6 Entalpa Wele procesów, w naturze w laboratorum, zachodz przy stałym cśnenu. W blanse energetycznym musmy wtedy brać pod uwagę pracę zwązaną ze zmaną objętośc. Wprowadzene entalp upraszcza analzę takch procesów H U + pv H entalpa układu U energa wewnętrzna układu p cśnene V - objętość Z powyższego wzoru wynka sens zyczny entalp. Entalpa jest równa sume: energ wewnętrznej, czyl energ U, jaka jest potrzebna do utworzena układu, gdy jest on tworzony w otoczenu próżn oraz loczynu pv, który jest równy pracy, jaką należy wykonać nad otoczenem, by w danych warunkach uzyskać mejsce na układ W. Domnk Wydzał Fzyk UW Termodynamka 018/019 8/6 4
5 Entalpa Entalpa (zawartość cepła) w termodynamce welkość zyczna będąca unkcją stanu mającą wymar energ, będąca też potencjałem termodynamcznym, Wszystke welkośc denujące entalpę (U, p, V) są parametram stanu, dlatego entalpa też jest unkcją stanu. Gdy układ wykonuje wyłączne pracę objętoścową oraz cśnene jest stałe, to zmana entalp jest równa cepłu dostarczonemu do układu: H = Q p DH Q p Zmana entalp układu w warunkach stałego cśnena jest równa energ dostarczonej jako cepło W. Domnk Wydzał Fzyk UW Termodynamka 018/019 9/6 Entalpa, cepło molowe przemany zobarycznej Rozważmy różnczkową zmanę entalp: dh d U pv du pdv V dp, ale (I zasada termodynamk): Q du W du pdv, (jeśl ne ma nnej pracy nż objętoścowa) czyl dh = δq + V dp Dla procesów zachodzących pod stałym cśnenem mamy węc: dh = du + p dv dh = δq (p = const.) δq = nc p dt Zachodz węc : C p = 1 n H T p W termodynamce techncznej stosuje sę welkośc termodynamczne właścwe (odnesone do jednostk masy rozpatrywanego czynnka termodynamcznego). J Wprowadza sę węc entalpę właścwą: kg h = H m W. Domnk Wydzał Fzyk UW Termodynamka 018/019 10/6 5
6 Entalpa reakcj chemcznych Przemany przebegające przy stałym cśnenu są bardzo często spotykane w praktyce (np. kocoł parowy, przemany azowe, reakcje chemczne), stąd entalpa jest unkcją stanu bardzo często wykorzystywaną w oblczenach. Reakcje chemczne przebegają na ogół przy stałym cśnenu Możemy wyobrażać sobe, że entalpa jest całkowtą energą potrzebną do tego, aby wytworzyć układ o energ U objętośc V umeścć go w otoczenu o cśnenu p. Czyl rozepchnąć otoczene przy p=const, aby zrobć mejsce dla układu. W tablcach chemcznych zycznych można znaleźć tzw. entalpę tworzena dla welu procesów (przeman azowych, reakcj chemcznych, jonzacj, rozpuszczana td.), określone zazwyczaj dla cśnena normalnego temperatury 5ºC (98 K). Punktem odnesena są substraty w ch najtrwalszej postac, dla których przyjmuje sę entalpę tworzena równą zeru. Typowe równane termochemczne obejmujące eekt ceplny reakcj chemcznej: Przykład: C (gr) + O (g) = CO (g) DH = kj W. Domnk Wydzał Fzyk UW Termodynamka 018/019 11/6 Entalpa standardowa Entalpa standardowa to entalpa tworzena 1 mola danej substancj w jej czystej postac w warunkach standardowych, to jest przy cśnenu 1 bar temperaturze 98 K. Nazwa substancj Standardowa entalpa tworzena ΔH 0 [kj/mol] azot N (gaz) 0,00 tlen O (gaz) 0,00 węgel/grat C gr 0,00 wodór H (gaz) 0,00 dwutlenek węgla CO (gaz) -393,5 tlenek węgla CO (g) -110,53 woda H O (gaz) -41,8 woda H O (cecz) -85,8 metan CH 4(gaz) -74,6 dwutlenek azotu NO (g) 33,8 benzen C 6 H 6(g) 8,85 Perwastk Wartość entalp tworzena perwastków równa zero DH < 0 proces egzotermczny DH > 0 proces endotermczny W. Domnk Wydzał Fzyk UW Termodynamka 018/019 1/6 6
7 Przykład: synteza wody Reakcja syntezy wody w temperaturze 5ºC (98 K) pod cśnenem normalnym: H g + 1 O (g) H O(c) Z tablc: entalpa tworzena w tych warunkach jednego mola wody w stane cekłym z substratów w najbardzej trwałej postac (a takm są wodór tlen cząsteczkowy) wynos: H o = kj Take cepło wydzel sę podczas reakcj syntezy 1 mola wody. Wększość tej energ pochodz z energ wewnętrznej (wązana chemczne), ale pewna część pochodz z pracy jaką wykona atmosera zajmująca mejsce substratów. H = U + p dv Jeśl pomnemy objętość wody (ceczy) w porównanu z objętoścą gazów, które z kole potraktujemy jako gazy doskonałe, to: p V = p 0 V O + V H = pv O + pv H = 1 RT + RT = 3 RT = J 98 K = 3716 J K W. Domnk Wydzał Fzyk UW Termodynamka 017/ /6 Reakcja spalana 1 mola metanu w temperaturze 5ºC (98 K) pod cśnenem normalnym: Przykład: spalane metanu CH 4 (g) + O (g) CO (g) + H O(g) W tablcach znajdujemy wartośc entalp tworzena substratów produktów: H o CH 4 = 74.6 kj H o CO = kj H o O g = 0 kj H o H O g = 41.8 kj Zmana entalp w rozważanej reakcj (woda w postac pary): H = H o CH 4 H o O + H o CO + H o H O = = 80.5 kj Zmana energ układu (jeśl woda powstaje w postac pary): U = H p V = H poneważ DV=0 w tym przypadku Gdyby woda powstawała w stane cekłym, to: H = kj U = H p V = H p RT n = H + RT = kj p W. Domnk Wydzał Fzyk UW Termodynamka 018/019 14/6 7
8 Cśnene [bar] Porównane energ wewnętrznej entalp Energa wewnętrzna, U w ogólnośc du = δq p dv Entalpa, H w ogólnośc dh = δq + V dp C V = 1 n U T V C p = 1 n H T p przemana zochoryczna U = U U = Q U U = n C V dt gaz doskonały U = n C V T przemana zobaryczna H = H H = Q H H = n gaz doskonały H = n C p T C V = R C p = + C p dt W. Domnk Wydzał Fzyk UW Termodynamka 018/019 15/6 R Cepła przeman azowych Przemana azowa (zmana stanu skupena) skokowa zmana własnośc substancj np. gęstośc, energ wewnętrznej, entalp cała. Równowaga mędzy azam występuje przy ścśle określonej temperaturze zależnej od cśnena Przejśce azowe następuje w stałej temperaturze. Podczas przejśca azowego cało oddaje cepło do otoczena lub pobera cepło od otoczena. Energę koneczną do całkowtej przemany 1 mola substancj przy stałym cśnenu nazywamy molowym cepłem (entalpą) przemany azowej: 1 H x Qx n J mol gdze x określa rodzaj przemany Temperatura [ºC] W. Domnk Wydzał Fzyk UW Termodynamka 018/019 16/6 cało stałe cecz topnene krzepnęce sublmacja resublmacja Entalpę można też odneść do parowane skraplane gaz całkowtej przemany jednostkowej masy substancj: 1 hx Q m x J kg 8
9 Cepła przeman azowych c.d Na przykład: W tablcach znajdujemy cepła przemany wody: Cepło parowana: h p =57 kj/kg (H p =40.63 kj/mol) Cepło topnena (lodu): h t =333.7 kj/kg (H t =6.008 kj/mol) DH J wrz mol Pamętamy, że : DH DU pdv VDp Przemana przy stałym cśnenu Jeśl pomnemy objętość wody (ceczy) w porównanu z objętoścą pary, którą potraktujemy jak gaz doskonały, to: pdv p V pv RT para 0 para J K K J (na 1 mol) Ogromna wększość cepła parowana dze na zwększene energ wewnętrznej! Jaka część cepła topnena wody zwązana jest ze zmaną objętośc? Uwaga: objętość wody maleje podczas topnena (w temperaturze 0 C gęstość wody: 0,9998 g/cm³, a lodu: 0,9167 g/cm³) W. Domnk Wydzał Fzyk UW Termodynamka 018/019 17/6 Cepło parowana zależy od temperatury Cepło parowana zmnejsza sę wraz ze wzrostem temperatury znka w temperaturze krytycznej (poneważ w punkce krytycznym znka różnca mędzy ceczą a parą). D H par kj mol sublmacja Molowe cepło parowana wody parowane Przemana azowa krzepnęce/topnene Temperatura krytyczna T C T [ºC] Molowe cepło parowana ceczy: H parowane = DH = H gaz H cecz W. Domnk Wydzał Fzyk UW Termodynamka 018/019 18/6 9
10 Energa skraplana pary wodnej Kocoł grzewczy kondensacyjny z zamknętą komorą spalana Ogrzewane spalnam powetrza do komory spalana, w tym cepłem skraplana pary wodnej w spalnach Ile można zyskać przez wykorzystane cepła kondensacj pary? Entalpa skraplana H O : H skraplana 44 kj mol Załóżmy, że spalamy 10 m 3 gazu (metanu) na dobę 10 m mol metanu 1 mol CH 4 mole H O W cągu doby produkujemy ~900 mol pary H O H skraplana 44 kj 900 mol = 39.6 MJ mol Cepło właścwe wody : 4.18 kj/kg Odzyskując cepło skraplana można podgrzać ~950 kg wody o 10 o C W. Domnk Wydzał Fzyk UW Termodynamka 018/019 19/6 10
Wykład 9. Silnik Stirlinga (R. Stirling, 1816)
 Wykład 9 Maszyny celne c.d. Entala Entala reakcj chemcznych Entala rzeman azowych Procesy odwracalne neodwracalne Entroa ykl arnot W. Domnk Wydzał Fzyk UW Termodynamka 06/07 /0 Slnk Strlnga (R. Strlng,
Wykład 9 Maszyny celne c.d. Entala Entala reakcj chemcznych Entala rzeman azowych Procesy odwracalne neodwracalne Entroa ykl arnot W. Domnk Wydzał Fzyk UW Termodynamka 06/07 /0 Slnk Strlnga (R. Strlng,
Wykład Turbina parowa kondensacyjna
 Wykład 9 Maszyny ceplne turbna parowa Entropa Równane Claususa-Clapeyrona granca równowag az Dośwadczena W. Domnk Wydzał Fzyk UW ermodynamka 08/09 /5 urbna parowa kondensacyjna W. Domnk Wydzał Fzyk UW
Wykład 9 Maszyny ceplne turbna parowa Entropa Równane Claususa-Clapeyrona granca równowag az Dośwadczena W. Domnk Wydzał Fzyk UW ermodynamka 08/09 /5 urbna parowa kondensacyjna W. Domnk Wydzał Fzyk UW
Podstawy termodynamiki
 Podstawy termodynamk Temperatura cepło Praca jaką wykonuje gaz I zasada termodynamk Przemany gazowe zotermczna zobaryczna zochoryczna adabatyczna Co to jest temperatura? 40 39 38 Temperatura (K) 8 7 6
Podstawy termodynamk Temperatura cepło Praca jaką wykonuje gaz I zasada termodynamk Przemany gazowe zotermczna zobaryczna zochoryczna adabatyczna Co to jest temperatura? 40 39 38 Temperatura (K) 8 7 6
Dr inż. Andrzej Tatarek. Siłownie cieplne
 Dr nż. Andrzej Tatarek Słowne ceplne Wykład 2 Podstawowe przemany energetyczne Jednostkowe zużyce cepła energ chemcznej palwa w elektrown parowej 2 Podstawowe przemany Proces przetwarzana energ elektrycznej
Dr nż. Andrzej Tatarek Słowne ceplne Wykład 2 Podstawowe przemany energetyczne Jednostkowe zużyce cepła energ chemcznej palwa w elektrown parowej 2 Podstawowe przemany Proces przetwarzana energ elektrycznej
Zmiana entropii w przemianach odwracalnych
 Wykład 4 Zmana entrop w przemanach odwracalnych: przemany obegu Carnota, spręŝane gazu półdoskonałego ze schładzanem, zobaryczne wytwarzane przegrzewane pary techncznej rzemany zentropowe gazu doskonałego
Wykład 4 Zmana entrop w przemanach odwracalnych: przemany obegu Carnota, spręŝane gazu półdoskonałego ze schładzanem, zobaryczne wytwarzane przegrzewane pary techncznej rzemany zentropowe gazu doskonałego
Wykład 13. Rozkład kanoniczny Boltzmanna Rozkład Maxwella-Boltzmanna III Zasada Termodynamiki. Rozkład Boltzmanna!!!
 Wykład 13 Rozkład kanonczny Boltzmanna Rozkład Maxwella-Boltzmanna III Zasada Termodynamk W. Domnk Wydzał Fzyk UW Termodynamka 2018/2019 1/30 Rozkład Boltzmanna!!! termostat T E n układ P n exp E n Z warunku
Wykład 13 Rozkład kanonczny Boltzmanna Rozkład Maxwella-Boltzmanna III Zasada Termodynamk W. Domnk Wydzał Fzyk UW Termodynamka 2018/2019 1/30 Rozkład Boltzmanna!!! termostat T E n układ P n exp E n Z warunku
PAŃSTWOWA WYŻSZA SZKOŁA ZAWODOWA W PILE INSTYTUT POLITECHNICZNY. Zakład Budowy i Eksploatacji Maszyn PRACOWNIA TERMODYNAMIKI TECHNICZNEJ INSTRUKCJA
 PAŃSTWOWA WYŻSZA SZKOŁA ZAWODOWA W PILE INSTYTUT POLITECHNICZNY Zakład Budowy Eksploatacj Maszyn PRACOWNIA TERMODYNAMIKI TECHNICZNEJ INSTRUKCJA Temat ćwczena: PRAKTYCZNA REALIZACJA PRZEMIANY ADIABATYCZNEJ.
PAŃSTWOWA WYŻSZA SZKOŁA ZAWODOWA W PILE INSTYTUT POLITECHNICZNY Zakład Budowy Eksploatacj Maszyn PRACOWNIA TERMODYNAMIKI TECHNICZNEJ INSTRUKCJA Temat ćwczena: PRAKTYCZNA REALIZACJA PRZEMIANY ADIABATYCZNEJ.
α i = n i /n β i = V i /V α i = β i γ i = m i /m
 Ćwczene nr 2 Stechometra reakcj zgazowana A. Część perwsza: powtórzene koncentracje stężena 1. Stężene Stężene jest stosunkem lośc substancj rozpuszczonej do całkowtej lośc rozpuszczalnka. Sposoby wyrażena
Ćwczene nr 2 Stechometra reakcj zgazowana A. Część perwsza: powtórzene koncentracje stężena 1. Stężene Stężene jest stosunkem lośc substancj rozpuszczonej do całkowtej lośc rozpuszczalnka. Sposoby wyrażena
V. TERMODYNAMIKA KLASYCZNA
 46. ERMODYNAMIKA KLASYCZNA. ERMODYNAMIKA KLASYCZNA ermodynamka jako nauka powstała w XIX w. Prawa termodynamk są wynkem obserwacj welu rzeczywstych procesów- są to prawa fenomenologczne modelu rzeczywstośc..
46. ERMODYNAMIKA KLASYCZNA. ERMODYNAMIKA KLASYCZNA ermodynamka jako nauka powstała w XIX w. Prawa termodynamk są wynkem obserwacj welu rzeczywstych procesów- są to prawa fenomenologczne modelu rzeczywstośc..
Termochemia Prawo Hessa Równania termochemiczne Obliczanie efektów cieplnych Prawo Kirchoffa
 ermchema.3.. Praw essa.3.. Równana termchemczne.3.3. Oblczane efektów ceplnych.3.4. Praw Krchffa ermchema praw essa ERMOCEMIA CIEPŁO REAKCJI - PRAWO ESSA W warunkach zchrycznych termchema zajmuje sę pmarem
ermchema.3.. Praw essa.3.. Równana termchemczne.3.3. Oblczane efektów ceplnych.3.4. Praw Krchffa ermchema praw essa ERMOCEMIA CIEPŁO REAKCJI - PRAWO ESSA W warunkach zchrycznych termchema zajmuje sę pmarem
2 PRAKTYCZNA REALIZACJA PRZEMIANY ADIABATYCZNEJ. 2.1 Wprowadzenie
 RAKTYCZNA REALIZACJA RZEMIANY ADIABATYCZNEJ. Wprowadzene rzeana jest adabatyczna, jeśl dla każdych dwóch stanów l, leżących na tej przeane Q - 0. Z tej defncj wynka, że aby zrealzować wyżej wyenony proces,
RAKTYCZNA REALIZACJA RZEMIANY ADIABATYCZNEJ. Wprowadzene rzeana jest adabatyczna, jeśl dla każdych dwóch stanów l, leżących na tej przeane Q - 0. Z tej defncj wynka, że aby zrealzować wyżej wyenony proces,
TERMODYNAMIKA TECHNICZNA I CHEMICZNA
 TRMODYNAMIKA TCHNICZNA I CHMICZNA Część IV TRMODYNAMIKA ROZTWORÓW TRMODYNAMIKA ROZTWORÓW FUGATYWNOŚCI I AKTYWNOŚCI a) Wrowadzene Potencjał chemczny - rzyomnene de G n na odstawe tego, że otencjał termodynamczny
TRMODYNAMIKA TCHNICZNA I CHMICZNA Część IV TRMODYNAMIKA ROZTWORÓW TRMODYNAMIKA ROZTWORÓW FUGATYWNOŚCI I AKTYWNOŚCI a) Wrowadzene Potencjał chemczny - rzyomnene de G n na odstawe tego, że otencjał termodynamczny
Termodynamika Techniczna dla MWT, Rozdział 14. AJ Wojtowicz IF UMK. 5.2. Generacja entropii; transfer ciepła przy skończonej róŝnicy temperatur
 ermodynamka echnczna dla MW, Rozdzał 4. AJ Wojtowcz IF UMK Rozdzał 4. Zmana entrop w przemanach odwracalnych.. rzemany obegu Carnota.. SpręŜane gazu półdoskonałego ze schładzanem.3. Izobaryczne wytwarzane
ermodynamka echnczna dla MW, Rozdzał 4. AJ Wojtowcz IF UMK Rozdzał 4. Zmana entrop w przemanach odwracalnych.. rzemany obegu Carnota.. SpręŜane gazu półdoskonałego ze schładzanem.3. Izobaryczne wytwarzane
1. PIERWSZA I DRUGA ZASADA TERMODYNAMIKI TERMOCHEMIA
 . PIERWSZA I DRUGA ZASADA ERMODYNAMIKI ERMOCHEMIA Zadania przykładowe.. Jeden mol jednoatomowego gazu doskonałego znajduje się początkowo w warunkach P = 0 Pa i = 300 K. Zmiana ciśnienia do P = 0 Pa nastąpiła:
. PIERWSZA I DRUGA ZASADA ERMODYNAMIKI ERMOCHEMIA Zadania przykładowe.. Jeden mol jednoatomowego gazu doskonałego znajduje się początkowo w warunkach P = 0 Pa i = 300 K. Zmiana ciśnienia do P = 0 Pa nastąpiła:
ZADANIA Z CHEMII Efekty energetyczne reakcji chemicznej - prawo Hessa
 Prawo zachowania energii: ZADANIA Z CHEMII Efekty energetyczne reakcji chemicznej - prawo Hessa Ogólny zasób energii jest niezmienny. Jeżeli zwiększa się zasób energii wybranego układu, to wyłącznie kosztem
Prawo zachowania energii: ZADANIA Z CHEMII Efekty energetyczne reakcji chemicznej - prawo Hessa Ogólny zasób energii jest niezmienny. Jeżeli zwiększa się zasób energii wybranego układu, to wyłącznie kosztem
Wykład Mikroskopowa interpretacja ciepła i pracy Entropia
 Wykład 7 5.13 Mkroskopowa nterpretacja cepła pracy. 5.14 Entropa 5.15 Funkcja rozdzału 6 II zasada termodynamk 6.1 Sformułowane Claususa oraz Kelvna-Plancka II zasady termodynamk 6.2 Procesy odwracalne
Wykład 7 5.13 Mkroskopowa nterpretacja cepła pracy. 5.14 Entropa 5.15 Funkcja rozdzału 6 II zasada termodynamk 6.1 Sformułowane Claususa oraz Kelvna-Plancka II zasady termodynamk 6.2 Procesy odwracalne
termodynamika fenomenologiczna p, VT V, teoria kinetyczno-molekularna <v 2 > termodynamika statystyczna n(v) to jest długi czas, zachodzi
 fzka statstczna stan makroskopow układ - skończon obszar przestrzenn (w szczególnośc zolowan) termodnamka fenomenologczna p, VT V, teora knetczno-molekularna termodnamka statstczna n(v) stan makroskopow
fzka statstczna stan makroskopow układ - skończon obszar przestrzenn (w szczególnośc zolowan) termodnamka fenomenologczna p, VT V, teora knetczno-molekularna termodnamka statstczna n(v) stan makroskopow
Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12
 Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12 atomu węgla 12 C. Mol - jest taką ilością danej substancji,
Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12 atomu węgla 12 C. Mol - jest taką ilością danej substancji,
ELEKTROCHEMIA. ( i = i ) Wykład II b. Nadnapięcie Równanie Buttlera-Volmera Równania Tafela. Wykład II. Równowaga dynamiczna i prąd wymiany
 Wykład II ELEKTROCHEMIA Wykład II b Nadnapęce Równane Buttlera-Volmera Równana Tafela Równowaga dynamczna prąd wymany Jeśl układ jest rozwarty przez elektrolzer ne płyne prąd, to ne oznacza wcale, że na
Wykład II ELEKTROCHEMIA Wykład II b Nadnapęce Równane Buttlera-Volmera Równana Tafela Równowaga dynamczna prąd wymany Jeśl układ jest rozwarty przez elektrolzer ne płyne prąd, to ne oznacza wcale, że na
W praktyce często zdarza się, że wyniki obu prób możemy traktować jako. wyniki pomiarów na tym samym elemencie populacji np.
 Wykład 7 Uwaga: W praktyce często zdarza sę, że wynk obu prób możemy traktować jako wynk pomarów na tym samym elemence populacj np. wynk x przed wynk y po operacj dla tego samego osobnka. Należy wówczas
Wykład 7 Uwaga: W praktyce często zdarza sę, że wynk obu prób możemy traktować jako wynk pomarów na tym samym elemence populacj np. wynk x przed wynk y po operacj dla tego samego osobnka. Należy wówczas
Kryteria samorzutności procesów fizyko-chemicznych
 Kryteria samorzutności procesów fizyko-chemicznych 2.5.1. Samorzutność i równowaga 2.5.2. Sens i pojęcie entalpii swobodnej 2.5.3. Sens i pojęcie energii swobodnej 2.5.4. Obliczanie zmian entalpii oraz
Kryteria samorzutności procesów fizyko-chemicznych 2.5.1. Samorzutność i równowaga 2.5.2. Sens i pojęcie entalpii swobodnej 2.5.3. Sens i pojęcie energii swobodnej 2.5.4. Obliczanie zmian entalpii oraz
TERMOCHEMIA SPALANIA
 TERMOCHEMIA SPALANIA I ZASADA TERMODYNAMIKI dq = dh Vdp W przemianach izobarycznych: dp = 0 dq = dh dh = c p dt dq = c p dt Q = T 2 T1 c p ( T)dT Q ciepło H - entalpia wewnętrzna V objętość P - ciśnienie
TERMOCHEMIA SPALANIA I ZASADA TERMODYNAMIKI dq = dh Vdp W przemianach izobarycznych: dp = 0 dq = dh dh = c p dt dq = c p dt Q = T 2 T1 c p ( T)dT Q ciepło H - entalpia wewnętrzna V objętość P - ciśnienie
ZADANIE 9.5. p p T. Dla dwuatomowego gazu doskonałego wykładnik izentropy = 1,4 (patrz tablica 1). Temperaturę spiętrzenia obliczymy następująco
 ZADANIE 9.5. Do dyszy Bendemanna o rzekroju wylotowym A = mm doływa owetrze o cśnenu =,85 MPa temeraturze t = C, z rędkoścą w = 5 m/s. Cśnene owetrza w rzestrzen, do której wyływa owetrze z dyszy wynos
ZADANIE 9.5. Do dyszy Bendemanna o rzekroju wylotowym A = mm doływa owetrze o cśnenu =,85 MPa temeraturze t = C, z rędkoścą w = 5 m/s. Cśnene owetrza w rzestrzen, do której wyływa owetrze z dyszy wynos
TERMODYNAMIKA. Andrzej Syrwid. Kraków 2011 r.
 ERMODYNAMIKA Andrzej Syrwd Kraków 011 r. Sps treśc 1 Podstawowe pojęca 5 Zasady termodynamk 6 3 Podstawowe skale temperatur 6 4 Podstawowe zależnośc pomędzy parametram opsującym układ 7 5 Gaz doskonały
ERMODYNAMIKA Andrzej Syrwd Kraków 011 r. Sps treśc 1 Podstawowe pojęca 5 Zasady termodynamk 6 3 Podstawowe skale temperatur 6 4 Podstawowe zależnośc pomędzy parametram opsującym układ 7 5 Gaz doskonały
Wykład 10 Teoria kinetyczna i termodynamika
 Wykład 0 Teora knetyczna termodynamka Prawa gazów doskonałych Z dośwadczeń wynka, że przy dostateczne małych gęstoścach, wszystke gazy, nezależne od składu chemcznego wykazują podobne zachowana: w stałej
Wykład 0 Teora knetyczna termodynamka Prawa gazów doskonałych Z dośwadczeń wynka, że przy dostateczne małych gęstoścach, wszystke gazy, nezależne od składu chemcznego wykazują podobne zachowana: w stałej
Tadeusz Hofman, WYKŁADY Z CHEMII FIZYCZNEJ I dla chemików
 T. Hofman, Wykłady z Chem fzycznej I, Wydzał Chemczny PW, kerunek: Technologa chemczna, sem.3 2016/2017 Tadeusz Hofman, WYKŁADY Z CHEMII FIZYCZNEJ I dla chemków Adres nternetowy: http://hof.ch.pw.edu.pl/chf1.htm,
T. Hofman, Wykłady z Chem fzycznej I, Wydzał Chemczny PW, kerunek: Technologa chemczna, sem.3 2016/2017 Tadeusz Hofman, WYKŁADY Z CHEMII FIZYCZNEJ I dla chemków Adres nternetowy: http://hof.ch.pw.edu.pl/chf1.htm,
GAZY DOSKONAŁE I PÓŁDOSKONAŁE
 TERMODYNAMIKA GAZY DOSKONAŁE I PÓŁDOSKONAŁE Prawo Boyle a Marotte a p V = const gdy T = const Prawo Gay-Lussaca V = const gdy p = const T Równane stanu gau dosonałego półdosonałego p v = R T gde: p cśnene
TERMODYNAMIKA GAZY DOSKONAŁE I PÓŁDOSKONAŁE Prawo Boyle a Marotte a p V = const gdy T = const Prawo Gay-Lussaca V = const gdy p = const T Równane stanu gau dosonałego półdosonałego p v = R T gde: p cśnene
WYKŁAD 2 TERMODYNAMIKA. Termodynamika opiera się na czterech obserwacjach fenomenologicznych zwanych zasadami
 WYKŁAD 2 TERMODYNAMIKA Termodynamika opiera się na czterech obserwacjach fenomenologicznych zwanych zasadami Zasada zerowa Kiedy obiekt gorący znajduje się w kontakcie cieplnym z obiektem zimnym następuje
WYKŁAD 2 TERMODYNAMIKA Termodynamika opiera się na czterech obserwacjach fenomenologicznych zwanych zasadami Zasada zerowa Kiedy obiekt gorący znajduje się w kontakcie cieplnym z obiektem zimnym następuje
Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2018/19)
 Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2018/19) Uwaga! Uzyskane wyniki mogą się nieco różnić od podanych w materiałach, ze względu na uaktualnianie wartości zapisanych
Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2018/19) Uwaga! Uzyskane wyniki mogą się nieco różnić od podanych w materiałach, ze względu na uaktualnianie wartości zapisanych
Układ termodynamiczny Parametry układu termodynamicznego Proces termodynamiczny Układ izolowany Układ zamknięty Stan równowagi termodynamicznej
 termodynamika - podstawowe pojęcia Układ termodynamiczny - wyodrębniona część otaczającego nas świata. Parametry układu termodynamicznego - wielkości fizyczne, za pomocą których opisujemy stan układu termodynamicznego,
termodynamika - podstawowe pojęcia Układ termodynamiczny - wyodrębniona część otaczającego nas świata. Parametry układu termodynamicznego - wielkości fizyczne, za pomocą których opisujemy stan układu termodynamicznego,
TERMOCHEMIA SPALANIA
 TERMOCHEMIA SPALANIA I ZASADA TERMODYNAMIKI dq = dh Vdp W przemianach izobarycznych: dp = 0 dq = dh dh = c p dt dq = c p dt Q = T 2 T1 c p ( T)dT Q ciepło H - entalpia wewnętrzna V objętość P - ciśnienie
TERMOCHEMIA SPALANIA I ZASADA TERMODYNAMIKI dq = dh Vdp W przemianach izobarycznych: dp = 0 dq = dh dh = c p dt dq = c p dt Q = T 2 T1 c p ( T)dT Q ciepło H - entalpia wewnętrzna V objętość P - ciśnienie
Stanisław Cichocki. Natalia Nehrebecka. Wykład 7
 Stansław Cchock Natala Nehrebecka Wykład 7 1 1. Zmenne cągłe a zmenne dyskretne 2. Interpretacja parametrów przy zmennych dyskretnych 1. Zmenne cągłe a zmenne dyskretne 2. Interpretacja parametrów przy
Stansław Cchock Natala Nehrebecka Wykład 7 1 1. Zmenne cągłe a zmenne dyskretne 2. Interpretacja parametrów przy zmennych dyskretnych 1. Zmenne cągłe a zmenne dyskretne 2. Interpretacja parametrów przy
Para wodna najczęściej jest produkowana w warunkach stałego ciśnienia.
 PARA WODNA 1. PRZEMIANY FAZOWE SUBSTANCJI JEDNORODNYCH Para wodna najczęściej jest produkowana w warunkach stałego ciśnienia. Przy niezmiennym ciśnieniu zmiana wody o stanie początkowym odpowiadającym
PARA WODNA 1. PRZEMIANY FAZOWE SUBSTANCJI JEDNORODNYCH Para wodna najczęściej jest produkowana w warunkach stałego ciśnienia. Przy niezmiennym ciśnieniu zmiana wody o stanie początkowym odpowiadającym
Jednostki podstawowe. Tuż po Wielkim Wybuchu temperatura K Teraz ok. 3K. Długość metr m
 TERMODYNAMIKA Jednostki podstawowe Wielkość Nazwa Symbol Długość metr m Masa kilogramkg Czas sekunda s Natężenieprąduelektrycznego amper A Temperaturatermodynamicznakelwin K Ilość materii mol mol Światłość
TERMODYNAMIKA Jednostki podstawowe Wielkość Nazwa Symbol Długość metr m Masa kilogramkg Czas sekunda s Natężenieprąduelektrycznego amper A Temperaturatermodynamicznakelwin K Ilość materii mol mol Światłość
GAZ DOSKONAŁY. Brak oddziaływań między cząsteczkami z wyjątkiem zderzeń idealnie sprężystych.
 TERMODYNAMIKA GAZ DOSKONAŁY Gaz doskonały to abstrakcyjny, matematyczny model gazu, chociaż wiele gazów (azot, tlen) w warunkach normalnych zachowuje się w przybliżeniu jak gaz doskonały. Model ten zakłada:
TERMODYNAMIKA GAZ DOSKONAŁY Gaz doskonały to abstrakcyjny, matematyczny model gazu, chociaż wiele gazów (azot, tlen) w warunkach normalnych zachowuje się w przybliżeniu jak gaz doskonały. Model ten zakłada:
3. Przyrost temperatury gazu wynosi 20 C. Ile jest równy ten przyrost w kelwinach?
 1. Która z podanych niżej par wielkości fizycznych ma takie same jednostki? a) energia i entropia b) ciśnienie i entalpia c) praca i entalpia d) ciepło i temperatura 2. 1 kj nie jest jednostką a) entropii
1. Która z podanych niżej par wielkości fizycznych ma takie same jednostki? a) energia i entropia b) ciśnienie i entalpia c) praca i entalpia d) ciepło i temperatura 2. 1 kj nie jest jednostką a) entropii
Rys. 1. Temperatura punktu rosy na wykresie p-t dla wody.
 F-Pow wlot / Powetrze wlotne. Defncje odstawowe Powetrze wlotne jest roztwore (lub eszanną) owetrza sucheo wody w ostac: a) ary rzerzanej lub b) ary nasyconej suchej lub c) ary nasyconej suchej ły cekłej
F-Pow wlot / Powetrze wlotne. Defncje odstawowe Powetrze wlotne jest roztwore (lub eszanną) owetrza sucheo wody w ostac: a) ary rzerzanej lub b) ary nasyconej suchej lub c) ary nasyconej suchej ły cekłej
I. Elementy analizy matematycznej
 WSTAWKA MATEMATYCZNA I. Elementy analzy matematycznej Pochodna funkcj f(x) Pochodna funkcj podaje nam prędkość zman funkcj: df f (x + x) f (x) f '(x) = = lm x 0 (1) dx x Pochodna funkcj podaje nam zarazem
WSTAWKA MATEMATYCZNA I. Elementy analzy matematycznej Pochodna funkcj f(x) Pochodna funkcj podaje nam prędkość zman funkcj: df f (x + x) f (x) f '(x) = = lm x 0 (1) dx x Pochodna funkcj podaje nam zarazem
TERMODYNAMIKA. przykłady zastosowań. I.Mańkowski I LO w Lęborku
 TERMODYNAMIKA przykłady zastosowań I.Mańkowski I LO w Lęborku 2016 UKŁAD TERMODYNAMICZNY Dla przykładu układ termodynamiczny stanowią zamknięty cylinder z ruchomym tłokiem, w którym znajduje się gaz tak
TERMODYNAMIKA przykłady zastosowań I.Mańkowski I LO w Lęborku 2016 UKŁAD TERMODYNAMICZNY Dla przykładu układ termodynamiczny stanowią zamknięty cylinder z ruchomym tłokiem, w którym znajduje się gaz tak
RUCH OBROTOWY Można opisać ruch obrotowy ze stałym przyspieszeniem ε poprzez analogię do ruchu postępowego jednostajnie zmiennego.
 RUCH OBROTOWY Można opsać ruch obrotowy ze stałym przyspeszenem ε poprzez analogę do ruchu postępowego jednostajne zmennego. Ruch postępowy a const. v v at s s v t at Ruch obrotowy const. t t t Dla ruchu
RUCH OBROTOWY Można opsać ruch obrotowy ze stałym przyspeszenem ε poprzez analogę do ruchu postępowego jednostajne zmennego. Ruch postępowy a const. v v at s s v t at Ruch obrotowy const. t t t Dla ruchu
Wykład 7. Podstawy termodynamiki i kinetyki procesowej - wykład 7. Anna Ptaszek. 21 maja Katedra Inżynierii i Aparatury Przemysłu Spożywczego
 Wykład 7 knetyk knetyk procesowej - Katedra Inżyner Aparatury Przemysłu Spożywczego 21 maja 2018 1 / 31 Układ weloskładnkowy dwufazowy knetyk P woda 1 atm lód woda cek a woda + substancja nelotna para
Wykład 7 knetyk knetyk procesowej - Katedra Inżyner Aparatury Przemysłu Spożywczego 21 maja 2018 1 / 31 Układ weloskładnkowy dwufazowy knetyk P woda 1 atm lód woda cek a woda + substancja nelotna para
3 BADANIE WYDAJNOŚCI SPRĘŻARKI TŁOKOWEJ. 1. Wprowadzenie
 3 BADANIE WYDAJNOŚCI SPRĘŻARKI TŁOKOWEJ. Wprowadzene Sprężarka jet podtawowym przykładem otwartego układu termodynamcznego. Jej zadanem jet medzy nnym podwyżzene cśnena gazu w celu: uzykane czynnka napędowego
3 BADANIE WYDAJNOŚCI SPRĘŻARKI TŁOKOWEJ. Wprowadzene Sprężarka jet podtawowym przykładem otwartego układu termodynamcznego. Jej zadanem jet medzy nnym podwyżzene cśnena gazu w celu: uzykane czynnka napędowego
Wykład 10 Równowaga chemiczna
 Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
DRUGA ZASADA TERMODYNAMIKI
 DRUGA ZASADA TERMODYNAMIKI Procesy odwracalne i nieodwracalne termodynamicznie, samorzutne i niesamorzutne Proces nazywamy termodynamicznie odwracalnym, jeśli bez spowodowania zmian w otoczeniu możliwy
DRUGA ZASADA TERMODYNAMIKI Procesy odwracalne i nieodwracalne termodynamicznie, samorzutne i niesamorzutne Proces nazywamy termodynamicznie odwracalnym, jeśli bez spowodowania zmian w otoczeniu możliwy
Termochemia elementy termodynamiki
 Termochemia elementy termodynamiki Termochemia nauka zajmująca się badaniem efektów cieplnych reakcji chemicznych Zasada zachowania energii Energia całkowita jest sumą energii kinetycznej i potencjalnej.
Termochemia elementy termodynamiki Termochemia nauka zajmująca się badaniem efektów cieplnych reakcji chemicznych Zasada zachowania energii Energia całkowita jest sumą energii kinetycznej i potencjalnej.
Stanisław Cichocki. Natalia Nehrebecka. Wykład 6
 Stansław Cchock Natala Nehrebecka Wykład 6 1 1. Zastosowane modelu potęgowego Przekształcene Boxa-Coxa 2. Zmenne cągłe za zmenne dyskretne 3. Interpretacja parametrów przy zmennych dyskretnych 1. Zastosowane
Stansław Cchock Natala Nehrebecka Wykład 6 1 1. Zastosowane modelu potęgowego Przekształcene Boxa-Coxa 2. Zmenne cągłe za zmenne dyskretne 3. Interpretacja parametrów przy zmennych dyskretnych 1. Zastosowane
Wykłady z termodynamiki i fizyki statystycznej. Semestr letni 2009/2010 Ewa Gudowska-Nowak, IFUJ, p.441 a
 Wykłady z termodynamk fzyk statystycznej. Semestr letn 2009/2010 Ewa Gudowska-Nowak, IFUJ, p.441 a gudowska@th.f.uj.edu.pl Zalecane podręcznk: 1.Termodynamka R. Hołyst, A. Ponewersk, A. Cach 2. Podstay
Wykłady z termodynamk fzyk statystycznej. Semestr letn 2009/2010 Ewa Gudowska-Nowak, IFUJ, p.441 a gudowska@th.f.uj.edu.pl Zalecane podręcznk: 1.Termodynamka R. Hołyst, A. Ponewersk, A. Cach 2. Podstay
Rys. 1. Temperatura punktu rosy na wykresie p-t dla wody.
 Powetrze wlotne. Defncje odstawowe Powetrze wlotne jest roztwore (lub eszanną) owetrza sucheo wody w ostac: a) ary rzerzanej lub b) ary nasyconej suchej lub c) ary nasyconej suchej ły cekłej lub lodowej.
Powetrze wlotne. Defncje odstawowe Powetrze wlotne jest roztwore (lub eszanną) owetrza sucheo wody w ostac: a) ary rzerzanej lub b) ary nasyconej suchej lub c) ary nasyconej suchej ły cekłej lub lodowej.
Kwantowa natura promieniowania elektromagnetycznego
 Efekt Comptona. Kwantowa natura promenowana elektromagnetycznego Zadane 1. Foton jest rozpraszany na swobodnym elektrone. Wyznaczyć zmanę długośc fal fotonu w wynku rozproszena. Poneważ układ foton swobodny
Efekt Comptona. Kwantowa natura promenowana elektromagnetycznego Zadane 1. Foton jest rozpraszany na swobodnym elektrone. Wyznaczyć zmanę długośc fal fotonu w wynku rozproszena. Poneważ układ foton swobodny
Część III: Termodynamika układów biologicznych
 Część III: Termodynamka układów bologcznych MATERIAŁY POMOCNICZE DO WYKŁADÓW Z PODSTAW BIOFIZYKI IIIr. Botechnolog prof. dr hab. nż. Jan Mazersk TERMODYNAMIKA UKŁADÓW BIOLOGICZNYCH Nezwykle cenną metodą
Część III: Termodynamka układów bologcznych MATERIAŁY POMOCNICZE DO WYKŁADÓW Z PODSTAW BIOFIZYKI IIIr. Botechnolog prof. dr hab. nż. Jan Mazersk TERMODYNAMIKA UKŁADÓW BIOLOGICZNYCH Nezwykle cenną metodą
Zadania domowe z termodynamiki I dla wszystkich kierunków A R C H I W A L N E
 Zadania domowe z termodynamiki I dla wszystkich kierunków A R C H I W A L N E ROK AKADEMICKI 2015/2016 Zad. nr 4 za 3% [2015.10.29 16:00] Ciepło właściwe przy stałym ciśnieniu gazu zależy liniowo od temperatury.
Zadania domowe z termodynamiki I dla wszystkich kierunków A R C H I W A L N E ROK AKADEMICKI 2015/2016 Zad. nr 4 za 3% [2015.10.29 16:00] Ciepło właściwe przy stałym ciśnieniu gazu zależy liniowo od temperatury.
Podstawowe prawa opisujące właściwości gazów zostały wyprowadzone dla gazu modelowego, nazywanego gazem doskonałym (idealnym).
 Spis treści 1 Stan gazowy 2 Gaz doskonały 21 Definicja mikroskopowa 22 Definicja makroskopowa (termodynamiczna) 3 Prawa gazowe 31 Prawo Boyle a-mariotte a 32 Prawo Gay-Lussaca 33 Prawo Charlesa 34 Prawo
Spis treści 1 Stan gazowy 2 Gaz doskonały 21 Definicja mikroskopowa 22 Definicja makroskopowa (termodynamiczna) 3 Prawa gazowe 31 Prawo Boyle a-mariotte a 32 Prawo Gay-Lussaca 33 Prawo Charlesa 34 Prawo
DRUGA ZASADA TERMODYNAMIKI
 DRUGA ZASADA TERMODYNAMIKI Procesy odwracalne i nieodwracalne termodynamicznie, samorzutne i niesamorzutne Proces nazywamy termodynamicznie odwracalnym, jeśli bez spowodowania zmian w otoczeniu możliwy
DRUGA ZASADA TERMODYNAMIKI Procesy odwracalne i nieodwracalne termodynamicznie, samorzutne i niesamorzutne Proces nazywamy termodynamicznie odwracalnym, jeśli bez spowodowania zmian w otoczeniu możliwy
Zadania pochodzą ze zbioru zadań P.W. Atkins, C.A. Trapp, M.P. Cady, C. Giunta, CHEMIA FIZYCZNA Zbiór zadań z rozwiązaniami, PWN, Warszawa 2001
 Zadania pochodzą ze zbioru zadań P.W. Atkins, C.A. Trapp, M.P. Cady, C. Giunta, CHEMIA FIZYCZNA Zbiór zadań z rozwiązaniami, PWN, Warszawa 2001 I zasada termodynamiki - pojęcia podstawowe C2.4 Próbka zawierająca
Zadania pochodzą ze zbioru zadań P.W. Atkins, C.A. Trapp, M.P. Cady, C. Giunta, CHEMIA FIZYCZNA Zbiór zadań z rozwiązaniami, PWN, Warszawa 2001 I zasada termodynamiki - pojęcia podstawowe C2.4 Próbka zawierająca
Stanisław Cichocki Natalia Nehrebecka. Zajęcia 4
 Stansław Cchock Natala Nehrebecka Zajęca 4 1. Interpretacja parametrów przy zmennych zerojedynkowych Zmenne 0-1 Interpretacja przy zmennej 0 1 w modelu lnowym względem zmennych objaśnających Interpretacja
Stansław Cchock Natala Nehrebecka Zajęca 4 1. Interpretacja parametrów przy zmennych zerojedynkowych Zmenne 0-1 Interpretacja przy zmennej 0 1 w modelu lnowym względem zmennych objaśnających Interpretacja
Stanisław Cichocki. Natalia Nehrebecka. Wykład 6
 Stansław Cchock Natala Nehrebecka Wykład 6 1 1. Interpretacja parametrów przy zmennych objaśnających cągłych Semelastyczność 2. Zastosowane modelu potęgowego Model potęgowy 3. Zmenne cągłe za zmenne dyskretne
Stansław Cchock Natala Nehrebecka Wykład 6 1 1. Interpretacja parametrów przy zmennych objaśnających cągłych Semelastyczność 2. Zastosowane modelu potęgowego Model potęgowy 3. Zmenne cągłe za zmenne dyskretne
Materiały pomocnicze do laboratorium z przedmiotu Metody i Narzędzia Symulacji Komputerowej
 Materiały pomocnicze do laboratorium z przedmiotu Metody i Narzędzia Symulacji Komputerowej w Systemach Technicznych Symulacja prosta dyszy pomiarowej Bendemanna Opracował: dr inż. Andrzej J. Zmysłowski
Materiały pomocnicze do laboratorium z przedmiotu Metody i Narzędzia Symulacji Komputerowej w Systemach Technicznych Symulacja prosta dyszy pomiarowej Bendemanna Opracował: dr inż. Andrzej J. Zmysłowski
Inżynieria procesów przetwórstwa węgla, zima 15/16
 Inżynieria procesów przetwórstwa węgla, zima 15/16 Ćwiczenia 1 7.10.2015 1. Załóżmy, że balon ma kształt sfery o promieniu 3m. a. Jaka ilość wodoru potrzebna jest do jego wypełnienia, aby na poziomie morza
Inżynieria procesów przetwórstwa węgla, zima 15/16 Ćwiczenia 1 7.10.2015 1. Załóżmy, że balon ma kształt sfery o promieniu 3m. a. Jaka ilość wodoru potrzebna jest do jego wypełnienia, aby na poziomie morza
Wykład 7 Entalpia: odwracalne izobaryczne rozpręŝanie gazu, adiabatyczne dławienie gazu dla przepływu ustalonego, nieodwracalne napełnianie gazem
 Wykład 7 Entalpia: odwracalne izobaryczne rozpręŝanie gazu, adiabatyczne dławienie gazu dla przepływu ustalonego, nieodwracalne napełnianie gazem pustego zbiornika rzy metody obliczeń entalpii gazu doskonałego
Wykład 7 Entalpia: odwracalne izobaryczne rozpręŝanie gazu, adiabatyczne dławienie gazu dla przepływu ustalonego, nieodwracalne napełnianie gazem pustego zbiornika rzy metody obliczeń entalpii gazu doskonałego
Natalia Nehrebecka. Zajęcia 4
 St ł Cchock Stansław C h k Natala Nehrebecka Zajęca 4 1. Interpretacja parametrów przy zmennych zerojedynkowych Zmenne 0 1 Interpretacja przy zmennej 0 1 w modelu lnowym względem zmennych objaśnających
St ł Cchock Stansław C h k Natala Nehrebecka Zajęca 4 1. Interpretacja parametrów przy zmennych zerojedynkowych Zmenne 0 1 Interpretacja przy zmennej 0 1 w modelu lnowym względem zmennych objaśnających
WYKŁAD 3 TERMOCHEMIA
 WYKŁAD 3 TERMOCHEMIA Termochemia jest działem termodynamiki zajmującym się zastosowaniem pierwszej zasady termodynamiki do obliczania efektów cieplnych procesów fizykochemicznych, a w szczególności przemian
WYKŁAD 3 TERMOCHEMIA Termochemia jest działem termodynamiki zajmującym się zastosowaniem pierwszej zasady termodynamiki do obliczania efektów cieplnych procesów fizykochemicznych, a w szczególności przemian
Procentowa zawartość sodu (w molu tej soli są dwa mole sodu) wynosi:
 Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Jak mierzyć i jak liczyć efekty cieplne reakcji?
 Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia Zdolność do wykonywania pracy lub do produkowania ciepła Praca objętościowa praca siła odległość 06_73 P F A W F h N m J P F A Area A ciśnienie
Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia Zdolność do wykonywania pracy lub do produkowania ciepła Praca objętościowa praca siła odległość 06_73 P F A W F h N m J P F A Area A ciśnienie
Modele wzrostu kryształów stałych
 Materały do wykładu Modele wzrostu kryształów stałych Marek Izdebsk Instytut Fzyk PŁ 2016 Sps treśc Temat 1. Termodynamczne podstawy równowag fazowej krystalzacj....1 1.1. Równowaga quas-równowaga...1
Materały do wykładu Modele wzrostu kryształów stałych Marek Izdebsk Instytut Fzyk PŁ 2016 Sps treśc Temat 1. Termodynamczne podstawy równowag fazowej krystalzacj....1 1.1. Równowaga quas-równowaga...1
TERMOCHEMIA. TERMOCHEMIA: dział chemii, który bada efekty cieplne towarzyszące reakcjom chemicznym w oparciu o zasady termodynamiki.
 1 TERMOCHEMIA TERMOCHEMIA: dział chemii, który bada efekty cieplne towarzyszące reakcjom chemicznym w oparciu o zasady termodynamiki. TERMODYNAMIKA: opis układu w stanach o ustalonych i niezmiennych w
1 TERMOCHEMIA TERMOCHEMIA: dział chemii, który bada efekty cieplne towarzyszące reakcjom chemicznym w oparciu o zasady termodynamiki. TERMODYNAMIKA: opis układu w stanach o ustalonych i niezmiennych w
Termodynamiczne modelowanie procesów spalania, wybuchu i detonacji nieidealnych układów wysokoenergetycznych
 BIULETYN WAT VOL. LIX, NR 3, 2010 Termodynamczne modelowane procesów spalana, wybuchu detonacj nedealnych układów wysokoenergetycznych SEBASTIAN GRYS, WALDEMAR A. TRZCIŃSKI Wojskowa Akadema Technczna,
BIULETYN WAT VOL. LIX, NR 3, 2010 Termodynamczne modelowane procesów spalana, wybuchu detonacj nedealnych układów wysokoenergetycznych SEBASTIAN GRYS, WALDEMAR A. TRZCIŃSKI Wojskowa Akadema Technczna,
Doświadczenie Joule a i jego konsekwencje Ciepło, pojemność cieplna sens i obliczanie Praca sens i obliczanie
 Perwsza zasada termodynamk 2.2.. Dośwadczene Joule a jego konsekwencje 2.2.2. eło, ojemność celna sens oblczane 2.2.3. Praca sens oblczane 2.2.4. Energa wewnętrzna oraz entala 2.2.5. Konsekwencje I zasady
Perwsza zasada termodynamk 2.2.. Dośwadczene Joule a jego konsekwencje 2.2.2. eło, ojemność celna sens oblczane 2.2.3. Praca sens oblczane 2.2.4. Energa wewnętrzna oraz entala 2.2.5. Konsekwencje I zasady
Praca objętościowa - pv (wymiana energii na sposób pracy) Ciepło reakcji Q (wymiana energii na sposób ciepła) Energia wewnętrzna
 Energia - zdolność danego układu do wykonania dowolnej pracy. Potencjalna praca, którą układ może w przyszłości wykonać. Praca wykonana przez układ jak i przeniesienie energii może manifestować się na
Energia - zdolność danego układu do wykonania dowolnej pracy. Potencjalna praca, którą układ może w przyszłości wykonać. Praca wykonana przez układ jak i przeniesienie energii może manifestować się na
1. 1 J/(kg K) nie jest jednostką a) entropii właściwej b) indywidualnej stałej gazowej c) ciepła właściwego d) pracy jednostkowej
 1. 1 J/(kg K) nie jest jednostką a) entropii właściwej b) indywidualnej stałej gazowej c) ciepła właściwego d) pracy jednostkowej 2. 1 kmol każdej substancji charakteryzuje się taką samą a) masą b) objętością
1. 1 J/(kg K) nie jest jednostką a) entropii właściwej b) indywidualnej stałej gazowej c) ciepła właściwego d) pracy jednostkowej 2. 1 kmol każdej substancji charakteryzuje się taką samą a) masą b) objętością
4. 1 bar jest dokładnie równy a) Pa b) 100 Tr c) 1 at d) 1 Atm e) 1000 niutonów na metr kwadratowy f) 0,1 MPa
 1. Adiatermiczny wymiennik ciepła to wymiennik, w którym a) ciepło płynie od czynnika o niższej temperaturze do czynnika o wyższej temperaturze b) nie ma strat ciepła na rzecz otoczenia c) czynniki wymieniające
1. Adiatermiczny wymiennik ciepła to wymiennik, w którym a) ciepło płynie od czynnika o niższej temperaturze do czynnika o wyższej temperaturze b) nie ma strat ciepła na rzecz otoczenia c) czynniki wymieniające
Projekt Inżynier mechanik zawód z przyszłością współfinansowany ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego
 Zajęcia wyrównawcze z fizyki -Zestaw 4 -eoria ermodynamika Równanie stanu gazu doskonałego Izoprzemiany gazowe Energia wewnętrzna gazu doskonałego Praca i ciepło w przemianach gazowych Silniki cieplne
Zajęcia wyrównawcze z fizyki -Zestaw 4 -eoria ermodynamika Równanie stanu gazu doskonałego Izoprzemiany gazowe Energia wewnętrzna gazu doskonałego Praca i ciepło w przemianach gazowych Silniki cieplne
TERMODYNAMIKA Zajęcia wyrównawcze, Częstochowa, 2009/2010 Ewa Mandowska
 1. Bilans cieplny 2. Przejścia fazowe 3. Równanie stanu gazu doskonałego 4. I zasada termodynamiki 5. Przemiany gazu doskonałego 6. Silnik cieplny 7. II zasada termodynamiki TERMODYNAMIKA Zajęcia wyrównawcze,
1. Bilans cieplny 2. Przejścia fazowe 3. Równanie stanu gazu doskonałego 4. I zasada termodynamiki 5. Przemiany gazu doskonałego 6. Silnik cieplny 7. II zasada termodynamiki TERMODYNAMIKA Zajęcia wyrównawcze,
TERMODYNAMIKA FENOMENOLOGICZNA
 TERMODYNAMIKA FENOMENOLOGICZNA Przedmiotem badań są własności układów makroskopowych w zaleŝności od temperatury. Układ makroskopowy Np. 1 mol substancji - tyle składników ile w 12 gramach węgla C 12 N
TERMODYNAMIKA FENOMENOLOGICZNA Przedmiotem badań są własności układów makroskopowych w zaleŝności od temperatury. Układ makroskopowy Np. 1 mol substancji - tyle składników ile w 12 gramach węgla C 12 N
LABORATORIUM TECHNIKI CIEPLNEJ INSTYTUTU TECHNIKI CIEPLNEJ WYDZIAŁ INŻYNIERII ŚRODOWISKA I ENERGETYKI POLITECHNIKI ŚLĄSKIEJ
 INSTYTUTU TECHNIKI CIEPLNEJ WYDZIAŁ INŻYNIERII ŚRODOWISKA I ENERGETYKI POLITECHNIKI ŚLĄSKIEJ INSTRUKCJA LABORATORYJNA Temat ćwczena: BADANIE POPRAWNOŚCI OPISU STANU TERMICZNEGO POWIETRZA PRZEZ RÓWNANIE
INSTYTUTU TECHNIKI CIEPLNEJ WYDZIAŁ INŻYNIERII ŚRODOWISKA I ENERGETYKI POLITECHNIKI ŚLĄSKIEJ INSTRUKCJA LABORATORYJNA Temat ćwczena: BADANIE POPRAWNOŚCI OPISU STANU TERMICZNEGO POWIETRZA PRZEZ RÓWNANIE
Temperatura jest wspólną własnością dwóch ciał, które pozostają ze sobą w równowadze termicznej.
 1 Ciepło jest sposobem przekazywania energii z jednego ciała do drugiego. Ciepło przepływa pod wpływem różnicy temperatur. Jeżeli ciepło nie przepływa mówimy o stanie równowagi termicznej. Zerowa zasada
1 Ciepło jest sposobem przekazywania energii z jednego ciała do drugiego. Ciepło przepływa pod wpływem różnicy temperatur. Jeżeli ciepło nie przepływa mówimy o stanie równowagi termicznej. Zerowa zasada
Zasady termodynamiki
 Zasady termodynamiki Energia wewnętrzna (U) Opis mikroskopowy: Jest to suma średnich energii kinetycznych oraz energii oddziaływań międzycząsteczkowych i wewnątrzcząsteczkowych. Opis makroskopowy: Jest
Zasady termodynamiki Energia wewnętrzna (U) Opis mikroskopowy: Jest to suma średnich energii kinetycznych oraz energii oddziaływań międzycząsteczkowych i wewnątrzcząsteczkowych. Opis makroskopowy: Jest
2. Podczas spalania 2 objętości pewnego gazu z 4 objętościami H 2 otrzymano 1 objętość N 2 i 4 objętości H 2O. Jaki gaz uległ spalaniu?
 1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
Wykład FIZYKA I. 14. Termodynamika fenomenologiczna cz.ii. Dr hab. inż. Władysław Artur Woźniak
 Wykład FIZYKA I 14. Termodynamika fenomenologiczna cz.ii Dr hab. inż. Władysław Artur Woźniak Instytut Fizyki Politechniki Wrocławskiej http://www.if.pwr.wroc.pl/~wozniak/fizyka1.html GAZY DOSKONAŁE Przez
Wykład FIZYKA I 14. Termodynamika fenomenologiczna cz.ii Dr hab. inż. Władysław Artur Woźniak Instytut Fizyki Politechniki Wrocławskiej http://www.if.pwr.wroc.pl/~wozniak/fizyka1.html GAZY DOSKONAŁE Przez
ZASADA ZACHOWANIA MOMENTU PĘDU: PODSTAWY DYNAMIKI BRYŁY SZTYWNEJ
 ZASADA ZACHOWANIA MOMENTU PĘDU: PODSTAWY DYNAMIKI BYŁY SZTYWNEJ 1. Welkośc w uchu obotowym. Moment pędu moment sły 3. Zasada zachowana momentu pędu 4. uch obotowy były sztywnej względem ustalonej os -II
ZASADA ZACHOWANIA MOMENTU PĘDU: PODSTAWY DYNAMIKI BYŁY SZTYWNEJ 1. Welkośc w uchu obotowym. Moment pędu moment sły 3. Zasada zachowana momentu pędu 4. uch obotowy były sztywnej względem ustalonej os -II
Współczynniki aktywności w roztworach elektrolitów. W.a. w roztworach elektrolitów (2) W.a. w roztworach elektrolitów (3) 1 r. Przypomnienie!
 Współczynnk aktywnośc w roztworach elektroltów Ag(s) ½ (s) Ag (aq) (aq) Standardowa molowa entalpa takej reakcj jest dana wzorem: H H H r Przypomnene! tw, Ag ( aq) tw, ( aq) Jest ona merzalna ma sens fzyczny.
Współczynnk aktywnośc w roztworach elektroltów Ag(s) ½ (s) Ag (aq) (aq) Standardowa molowa entalpa takej reakcj jest dana wzorem: H H H r Przypomnene! tw, Ag ( aq) tw, ( aq) Jest ona merzalna ma sens fzyczny.
XLI OLIMPIADA FIZYCZNA ETAP WSTĘPNY Zadanie teoretyczne
 XLI OLIMPIADA FIZYCZNA ETAP WSTĘPNY Zadane teoretyczne Rozwąż dowolne rzez sebe wybrane dwa sośród odanych nże zadań: ZADANIE T Nazwa zadana: Protony antyrotony A. Cząstk o mase równe mase rotonu, ale
XLI OLIMPIADA FIZYCZNA ETAP WSTĘPNY Zadane teoretyczne Rozwąż dowolne rzez sebe wybrane dwa sośród odanych nże zadań: ZADANIE T Nazwa zadana: Protony antyrotony A. Cząstk o mase równe mase rotonu, ale
Kinetyczna teoria gazów Termodynamika. dr Mikołaj Szopa Wykład
 Kinetyczna teoria gazów Termodynamika dr Mikołaj Szopa Wykład 7.11.015 Kinetyczna teoria gazów Kinetyczna teoria gazów. Termodynamika Termodynamika klasyczna opisuje tylko wielkości makroskopowe takie
Kinetyczna teoria gazów Termodynamika dr Mikołaj Szopa Wykład 7.11.015 Kinetyczna teoria gazów Kinetyczna teoria gazów. Termodynamika Termodynamika klasyczna opisuje tylko wielkości makroskopowe takie
I piętro p. 131 A, 138
 CHEMIA NIEORGANICZNA Dr hab. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I piętro p. 131 A, 138 WYKŁAD - 4 RÓWNOWAGA Termochemia i termodynamika funkcje termodynamiczne, prawa termodynamiki,
CHEMIA NIEORGANICZNA Dr hab. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I piętro p. 131 A, 138 WYKŁAD - 4 RÓWNOWAGA Termochemia i termodynamika funkcje termodynamiczne, prawa termodynamiki,
Fizykochemiczne podstawy inżynierii procesowej
 Fizykochemiczne podstawy inżynierii procesowej Wykład II Podstawowe definicje cd. Podstawowe idealizacje termodynamiczne I i II Zasada termodynamiki Proste przemiany termodynamiczne PRZYPOMNIENIE Z OSTATNIEGO
Fizykochemiczne podstawy inżynierii procesowej Wykład II Podstawowe definicje cd. Podstawowe idealizacje termodynamiczne I i II Zasada termodynamiki Proste przemiany termodynamiczne PRZYPOMNIENIE Z OSTATNIEGO
Inżynieria Biomedyczna. Wykład IV Elementy termochemii czyli o efektach cieplnych reakcji
 Inżynieria Biomedyczna Wykład IV Elementy termochemii czyli o efektach cieplnych reakcji Plan Terminologia i jednostki energii Pojemność cieplna Reaktywność chemiczna I prawo termodynamiki Entalpia Prawo
Inżynieria Biomedyczna Wykład IV Elementy termochemii czyli o efektach cieplnych reakcji Plan Terminologia i jednostki energii Pojemność cieplna Reaktywność chemiczna I prawo termodynamiki Entalpia Prawo
Wykład 4. Przypomnienie z poprzedniego wykładu
 Wykład 4 Przejścia fazowe materii Diagram fazowy Ciepło Procesy termodynamiczne Proces kwazistatyczny Procesy odwracalne i nieodwracalne Pokazy doświadczalne W. Dominik Wydział Fizyki UW Termodynamika
Wykład 4 Przejścia fazowe materii Diagram fazowy Ciepło Procesy termodynamiczne Proces kwazistatyczny Procesy odwracalne i nieodwracalne Pokazy doświadczalne W. Dominik Wydział Fizyki UW Termodynamika
Energia potencjalna jest energią zgromadzoną w układzie. Energia potencjalna może być zmieniona w inną formę energii (na przykład energię kinetyczną)
 1 Enega potencjalna jest enegą zgomadzoną w układze. Enega potencjalna może być zmenona w nną omę eneg (na pzykład enegę knetyczną) może być wykozystana do wykonana pacy. Sumę eneg potencjalnej knetycznej
1 Enega potencjalna jest enegą zgomadzoną w układze. Enega potencjalna może być zmenona w nną omę eneg (na pzykład enegę knetyczną) może być wykozystana do wykonana pacy. Sumę eneg potencjalnej knetycznej
PODSTAWY TERMODYNAMIKI
 ODAWY ERMODYNAMIKI ( punkty (OŚ_3--7 Zad.. W zbiorniku zamkniętym tłokiem znajduje się moli metanu, który można z powodzeniem potraktować jako az doskonały. emperatura początkowa metanu wynosi 5 C a ciśnienie
ODAWY ERMODYNAMIKI ( punkty (OŚ_3--7 Zad.. W zbiorniku zamkniętym tłokiem znajduje się moli metanu, który można z powodzeniem potraktować jako az doskonały. emperatura początkowa metanu wynosi 5 C a ciśnienie
Termodynamika Część 7 Trzecia zasada termodynamiki Metody otrzymywania niskich temperatur Zjawisko Joule'a Thomsona Chłodzenie magnetyczne
 Termodynamika Część 7 Trzecia zasada termodynamiki Metody otrzymywania niskich temperatur Zjawisko Joule'a Thomsona Chłodzenie magnetyczne Janusz Brzychczyk, Instytut Fizyki UJ Postulat Nernsta (1906):
Termodynamika Część 7 Trzecia zasada termodynamiki Metody otrzymywania niskich temperatur Zjawisko Joule'a Thomsona Chłodzenie magnetyczne Janusz Brzychczyk, Instytut Fizyki UJ Postulat Nernsta (1906):
Podstawy termodynamiki
 Podstawy termodynamiki Temperatura i ciepło Praca jaką wykonuje gaz I zasada termodynamiki Przemiany gazowe izotermiczna izobaryczna izochoryczna adiabatyczna Co to jest temperatura? 40 39 38 Temperatura
Podstawy termodynamiki Temperatura i ciepło Praca jaką wykonuje gaz I zasada termodynamiki Przemiany gazowe izotermiczna izobaryczna izochoryczna adiabatyczna Co to jest temperatura? 40 39 38 Temperatura
Wykład 1 i 2. Termodynamika klasyczna, gaz doskonały
 Wykład 1 i 2 Termodynamika klasyczna, gaz doskonały dr hab. Agata Fronczak, prof. PW Wydział Fizyki, Politechnika Warszawska 1 stycznia 2017 dr hab. A. Fronczak (Wydział Fizyki PW) Wykład: Elementy fizyki
Wykład 1 i 2 Termodynamika klasyczna, gaz doskonały dr hab. Agata Fronczak, prof. PW Wydział Fizyki, Politechnika Warszawska 1 stycznia 2017 dr hab. A. Fronczak (Wydział Fizyki PW) Wykład: Elementy fizyki
CIEPŁO (Q) jedna z form przekazu energii między układami termodynamicznymi. Proces przekazu energii za pośrednictwem oddziaływania termicznego
 CIEPŁO, PALIWA, SPALANIE CIEPŁO (Q) jedna z form przekazu energii między układami termodynamicznymi. Proces przekazu energii za pośrednictwem oddziaływania termicznego WYMIANA CIEPŁA. Zmiana energii wewnętrznej
CIEPŁO, PALIWA, SPALANIE CIEPŁO (Q) jedna z form przekazu energii między układami termodynamicznymi. Proces przekazu energii za pośrednictwem oddziaływania termicznego WYMIANA CIEPŁA. Zmiana energii wewnętrznej
Kryteria samorzutności procesów fizyko-chemicznych
 Kytea samozutnośc ocesów fzyko-chemcznych 2.5.1. Samozutność ównowaga 2.5.2. Sens ojęce ental swobodnej 2.5.3. Sens ojęce eneg swobodnej 2.5.4. Oblczane zman ental oaz eneg swobodnych KRYERIA SAMORZUNOŚCI
Kytea samozutnośc ocesów fzyko-chemcznych 2.5.1. Samozutność ównowaga 2.5.2. Sens ojęce ental swobodnej 2.5.3. Sens ojęce eneg swobodnej 2.5.4. Oblczane zman ental oaz eneg swobodnych KRYERIA SAMORZUNOŚCI
CIEPŁO (Q) jedna z form przekazu energii między układami termodynamicznymi. Proces przekazu energii za pośrednictwem oddziaływania termicznego
 CIEPŁO, PALIWA, SPALANIE CIEPŁO (Q) jedna z form przekazu energii między układami termodynamicznymi. Proces przekazu energii za pośrednictwem oddziaływania termicznego WYMIANA CIEPŁA. Zmiana energii wewnętrznej
CIEPŁO, PALIWA, SPALANIE CIEPŁO (Q) jedna z form przekazu energii między układami termodynamicznymi. Proces przekazu energii za pośrednictwem oddziaływania termicznego WYMIANA CIEPŁA. Zmiana energii wewnętrznej
relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
 1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
Teoria kinetyczna gazów
 Teoria kinetyczna gazów Mikroskopowy model ciśnienia gazu wzór na ciśnienie gazu Mikroskopowa interpretacja temperatury Średnia energia cząsteczki gazu zasada ekwipartycji energii Czy ciepło właściwe przy
Teoria kinetyczna gazów Mikroskopowy model ciśnienia gazu wzór na ciśnienie gazu Mikroskopowa interpretacja temperatury Średnia energia cząsteczki gazu zasada ekwipartycji energii Czy ciepło właściwe przy
Wykład Efekt Joule a Thomsona
 Wykład 5 4.5 Efekt Joule a Thomsona Rozpatrzmy następujący proces rozprężana sę gazu. Rozprężane gazu następuje w warunkach zolacj termcznej, (dq=0) od stanu początkowego p,v,t,, do stanu końcowego p f,
Wykład 5 4.5 Efekt Joule a Thomsona Rozpatrzmy następujący proces rozprężana sę gazu. Rozprężane gazu następuje w warunkach zolacj termcznej, (dq=0) od stanu początkowego p,v,t,, do stanu końcowego p f,
MPEC wydaje warunki techniczne KONIEC
 1 2 3 1 2 2 1 3 MPEC wydaje warunk technczne 4 5 6 10 9 8 7 11 12 13 14 15 KONIEC 17 16 4 5 Chcesz wedzeć, czy masz możlwość przyłączena budynku Możlwośc dofnansowana wymany peców węglowych do sec mejskej?
1 2 3 1 2 2 1 3 MPEC wydaje warunk technczne 4 5 6 10 9 8 7 11 12 13 14 15 KONIEC 17 16 4 5 Chcesz wedzeć, czy masz możlwość przyłączena budynku Możlwośc dofnansowana wymany peców węglowych do sec mejskej?
Przemiany substancji
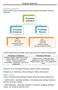 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Współczynniki aktywności w roztworach elektrolitów
 Współczynnk aktywnośc w roztworach elektroltów Ag(s) + ½ 2 (s) = Ag + (aq) + (aq) Standardowa molowa entalpa takej reakcj jest dana wzorem: H r Przypomnene! = H tw, Ag + + ( aq) Jest ona merzalna ma sens
Współczynnk aktywnośc w roztworach elektroltów Ag(s) + ½ 2 (s) = Ag + (aq) + (aq) Standardowa molowa entalpa takej reakcj jest dana wzorem: H r Przypomnene! = H tw, Ag + + ( aq) Jest ona merzalna ma sens
