Krystyna Dzierzbicka
|
|
|
- Ryszard Białek
- 8 lat temu
- Przeglądów:
Transkrypt
1 Krystyna Dzierzbicka
2 Aldehydy i ketony są pochodnymi węglowodorów zawierającymi grupę karbonylową =. Aldehydy związki zawierające grupę formylową (-) połączoną z atomem węgla: R(Ar)-, R reszta alkilowa; Ar reszta arylowa lub atom wodoru (- - formaldehyd). Ketony związki zawierające grupę karbonylową (--) połączoną z dwoma atomami węgla: R(Ar)--R(Ar), R reszta alkilowa; Ar reszta arylowa.
3 Budowa grupy karbonylowej hybrydyzacja sp 2 karbonylowego atomu węgla polaryzacja wiązania, struktury mezomeryczne i rozkład ładunków w grupie =
4 Nazewnictwo aldehydów Nazwy zwyczajowe wywodzą się od nazw odpowiednich kwasów karboksylowych, np. aldehyd mrówkowy od kwasu mrówkowego, aldehyd octowy od kwasu octowego. Nazwy systematyczne aldehydów tworzy się przez dodanie końcówki al do nazwy węglowodoru macierzystego z zaznaczeniem lokantu przy którym się ona znajduje. Możemy również grupę formylową (-) potraktować jako podstawnik nazywając ją karboaldehydem.
5 Przykłady aldehydów
6 Nazewnictwo ketonów Nazwy systematyczne ketonów tworzy się przez dodanie końcówki on do nazwy węglowodoru macierzystego z podaniem lokantu, przy którym się ona znajduje. Możemy też stosować nazwy, w których do słowa keton dodaje się w formie przymiotnikowej nazwy odpowiednich grup węglowodorowych w kolejności alfabetycznej oddzielonych myślnikiem, np. keton etylowometylowy, keton n-butylowo-propylowy.
7 Przykłady ketonów
8 Metody otrzymywania aldehydów utlenianie alkoholi 1 o ozonoliza alkenów heptan-3-ol hydratacja alkinów Zn, Ac 2 propanal acetylen 2, gs 4 2 S 4 3 etanal (aldehyd octowy)
9 redukcja pochodnych kwasów karboksylowych: chlorków kwasowych czy estrów [] l chlorek kwasu heptanowego heptanal [] - 2 /Pd/BaS 4 /chinolina; LiAl(tBu) 3 1. DIBA, toluen, -78 o R' 2. + / 2 ester kwasu heptanowego heptanal formylowanie benzenu, alkilobenzenów, fenoli lub eterów alkilowo-fenylowych, np. formylowanie fenoli (reakcja Reimera-Tiemanna) l 3, Na, 2 fenol aldehyd o-hydroksybenzoesowy (aldehyd salicylowy)
10 Metody otrzymywania ketonów utlenianie alkoholi 2 o [] heptan-3-ol heptan-3-on (keton butylowo-etylowy) [] - Na 2 r 2 7 / 2 S 4 ; K 2 r 2 7 / 2 S 4 ; KMn 4, 2, - ozonoliza alkenów Zn, Ac 1-metylocykloheksen 6-oksoheptanal
11 acylowanie Friedla-raftsa (S E ) + l All 3 benzen chlorek benzoilu benzofenon (keton difenylowy) reakcja związków magnezoorganicznych z nitrylami R N + R' MgX zwiazek nitryl Grignarda N - + MgX R R' anion iminy + / 2 R R' keton
12 Właściwości aldehydów i ketonów reakcje utleniania a. aldehydy łatwo utleniają się do kwasów karboksylowych; ketony, znacznie trudniej:
13 b. test Tollensa, Fehlinga (odróżnienie aldehydów od ketonów) odczynnik Tollensa + Ag o lustro srebrowe odczynnik Tollensa - AgN 3 /N 3 / 2 odczynnik Fehlinga + u 2 pomarańczowy osad tlenku miedzi(i) odczynnik Fehlinga - us 4 / 2 S 4 / 2 /Na/KNa / 2
14 reakcje addycji nukleofilowej a. addycja alkoholi reakcja odwracalna, katalizowana kwasami (w tym kwasami Lewisa); otrzymywanie acetali, które są trwałe w środowisku zasadowym, a w środowisku kwaśnym łatwo hydrolizują do wyjściowego aldehydu lub ketonu i odpowiedniego alkoholu; acetale wykorzystuje się w syntezie organicznej do zabezpieczania grupy karbonylowej: butanal b. addycja cyjanowodoru otrzymywanie cyjanohydryn, reakcja katalizowana jonami cyjankowymi (N - ): hemiacetal acetal 1,1-dietoksybutan N N - N cykloheksanon 1-hydroksycykloheksylonitryl
15 c. addycja związków Grignarda - otrzymywanie alkoholi: z formaldehydem powstają alkohole 1 o, z aldehydami alkohole 2 o, z ketonami alkohole 3 o : MgBr + bromek fenylomagnezowy formaldehyd 1. Et / 2 2 alkohol benzylowy, 1 o MgBr bromek fenylomagnezowy Et / 2 aldehyd octowy 3 1-fenyloetanol, 2 o MgBr bromek fenylomagnezowy aceton 1. Et / fenylo-1-metyloetanol, 3 o
16 d. addycja amoniaku i jego pochodnych aldehydy lub ketony w reakcji z amoniakiem dają iminy [-=N-], z aminami 1 o iminy (zasada Schiffa) [-=N-R], z hydroksyloaminą oksymy [-=N-], z hydrazyną hydrazony [-=N-N 2 ], z fenylohydrazyną fenylohydrazony [-=N-NPh], z aminami 2 o enaminy [-=-NR 2 ]): Mechanizm addycji amin 1 o N 2 -R'' R (R') aldehyd lub keton R - + N 2 -R'' N-R'' (R') R (R') aminoalkohol + R N-R'' (R') imina - + R (R') + N-R'' - 2 R + 2 N-R'' (R')
17 Mechanizm addycji amin 2 o NR 2 '' R- 2 (R') R- 2 aldehyd lub keton - + NR 2 '' NR (R') R- 2 2 '' (R') + R- (R') enamina NR 2 '' - + R- 2 (R') + NR 2 '' - 2 R- 2 2 NR 2 '' (R') Reakcje aldehydów i ketonów z aminami są katalizowane kwasami, optymalne p reakcji powinno wynosić ~ 4. +
18 e. addycja wodorosiarczynu sodu do aldehydów, metyloketonów i ketonów cyklicznych prowadzi do tworzenia krystalicznych adduktów, trudno rozpuszczalnych w wodzie, które łatwo ulegają rozkładowi pod wpływem kwasów lub zasad do wyjściowych związków karbonylowych:
19 f. addycja anionu wodorkowego - reakcje redukcji tetrahydroboranem sodu [NaB 4 /R lub 2 ], tetrahydroglinianem litu [LiAl 4 /Et 2 lub TF]; redukcja aldehydów prowadzi do alkoholi 1 o ; redukcja ketonów alkoholi 2 o ): 3 2 propanal NaB 4 Et propan-1-ol 1. LiAl cykloheksanon cykloheksanol
20 g. addycja ylidów fosforowych (reakcja Wittiga) otrzymywanie alkenów: P trifenylofosfina Br S N 2 halogenek alkilowy 1 o (np. bromek etylu) + ( 6 5 ) 3 P 2 3 Br sól fosfoniowa bromek trifenyloetylofosfoniowy BuLi ( 6 5 ) 3 P 2 3 Br + - ( 6 5 ) 3 P 3 ylid ( 6 5 ) 3 P 3 ylid fosforowy A N + (6 5 ) 3 P 3 - ( 6 5 ) 3 P 3 3 ( 6 5 ) 3 P tlenek trifenylofosfiny but-2-en (alken)
21 h. reakcja annizzaro reakcja aldehydów nie posiadających α, np., Ar-, R 3 - w środowisku stężonej, mocnej zasady; w mieszanej reakcji annizzaro stosuje się mieszaninę dwóch aldehydów, jednym z nich jest formaldehyd, działa on zawsze jako donor jonów wodorkowych (Dlaczego?) i utlenia się do kwasu mrówkowego. Podaj przykład takiej reakcji i przedstaw jej mechanizm benzaldehyd kwas benzoesowy alkohol benzylowy
22 reakcje zachodzące z udziałem atomu węgla α a.tautomeria keto-enolowa aldehydy i ketony posiadające przynajmniej jeden atom wodoru przy α występują w dwóch izomerycznych formach będących w równowadze, których budowa różni się położeniem wiązania podwójnego i atomu wodoru; w środowisku obojętnym tautomeria zachodzi wolno, natomiast w obecności kwasów lub zasad jej szybkość znacznie wzrasta. Forma karbonylowa Forma enolowa % % 98.8% 1.2% % 76%
23 b. a-halogenowanie metyloketonów (reakcja haloformowa) reakcja halogenu (chlor, brom, jod) z metyloketonem w środowisku zasadowym w wyniku, której otrzymuje się kwasy karboksylowe I 2 I 3 aceton 3 - I I 3 jodoform + 3 kwas octowy
24 c. -alkilowanie ketonów halogenkami alkilowymi (1 o ), allilowymi, benzylowymi reakcja szeroko stosowana w syntezie organicznej do wydłużania łańcucha węglowego. W pierwszym etapie reakcji w środowisku zasadowym tworzy się anion enolanowy (stabilizowany mezomerycznie), który następnie reaguje z halogenopochodnymi w reakcji S N 2. Aniony enolanowe są reaktywnymi ambidentnymi odczynnikami nukleofilowymi czyli zdolnymi do reagowania w dwóch miejscach cząsteczki (przy atomie węgla albo przy atomie tlenu) K aceton pentano-2,4-dion - cykloheksanon l chlorek allilu (3-chloroprop-1-en) NaN 2 eter 3 S N 2 I metylopentano-2,4-dion (2-oksocykloheksylo)-propen
25 kondensacja aldolowa reakcji ulegają aldehydy i ketony posiadające przynajmniej jeden atom wodoru przy atomie węgla α ; produktami reakcji są aldole czyli 3-hydroksyaldehydy lub 3-hydroksyketony; ketony znacznie trudniej ulegają kondensacji aldolowej niż aldehydy; aldehydy posiadające tylko jeden podstawnik przy atomie α reagują najłatwiej: 3 acetaldehyd anion enolanowy - 3 A N hydroksybutanal aldol but-2-en-1-al
26 mieszana kondensacja aldolowa kondensacja dwóch różnych aldehydów lub aldehydu z ketonem; jeden z reagentów nie może posiadać α, czyli nie może być źródłem anionu enolanowego: benzaldehyd acetaldehyd aldehyd -fenylo- -hydroksypropionowy aldehyd cynamonowy
27 wewnątrzcząsteczkowa kondensacja aldolowa oksoheptanal keton 1-cyklopentenylowo-metylowy
28 kondensacja Mannicha polega na działaniu aminą 2 o i aldehydem mrówkowym na związki zawierające czynne atomy wodoru, np. ketony, diestry, alifatyczne związki nitrowe, itp. dając aminy 3 o, tzw. zasady Mannicha, z których możemy otrzymywać różnorodne związki: + R 2 N + 2 = R 2 N- 2 R R 2 N= - 2 N Ph 2 R 2 N- 2 2 Ph Zasada Mannicha Ac 2 Ph / Ni Ph-= 2 Ph- 2 2 Ac Przykładem reakcji Mannicha jest otrzymywanie graminy z indolu. 2, ( 3 ) 2 N 2 N( 3 ) 2 N 3 N
29 Zastosowanie aldehydów i ketonów aldehydy otrzymywanie tworzyw sztucznych i barwników, w przemyśle spożywczym (jako aromaty spożywcze) i kosmetycznym (składniki kompozycji zapachowych), w garbarstwie, 40 % wodny roztwór aldehydu mrówkowego (formalina) stosowany jest do konserwacji preparatów biologicznych. ketony rozpuszczalniki przy produkcji farb i lakierów, w przemyśle kosmetycznym (składniki kompozycji zapachowych), półprodukty w różnych syntezach organicznych.
30 Przykładowe pytania 1. Podaj nazwy IUPA dla następujących związków 2. Uzupełnij następujące reakcje:
31 3. Podaj wzory strukturalne dla niżej podanych związków: a. oksym acetonu; b. 2-metylocykloheks-2-en-1-on; c. keton diizobutylowy; d. benzofenon; e. enol chloroacetonu f. produkt deprotonowania i protonowania etanalu. 4. Jak z butanalu otrzymać: n-butanol, kwas butanowy, but-1-yn, pentan-2-ol, keton metylowo-propylowy. 5. Jaki produkt otrzymamy w reakcji pentanalu z: a. NaB 4 w uwodnionym Na; b. LiAl 4, później 2 ; c. zimny KMn 4, - ; d. odczynnikiem Tollensa i Fehlinga; e. 6 5 MgBr, 3 + ; f. N/KN; g. fenylohydrazyną.
32 6. Przedstaw mechanizm krzyżowej reakcji annizzaro na dowolnie wybranym przykładzie. 7. Jaki produkt powstanie w reakcji kondensacji aldolowej butanalu. Dlaczego aldole łatwiej ulegają dehydratacji niż alkohole? 8. Podaj przykład mieszanej (krzyżowej) kondensacji aldolowej. Przedstaw jej mechanizm. 9. Z propanalu i metanolu w obecności kwasu można otrzymać acetal. Zaproponuj mechanizm powstawania acetalu i podaj jego wzór.
33 10. Wykorzystując reakcję Wittiga przedstaw mechanizm a. następującej transformacji: b. 2 3
34 Dziękuję za uwagę
Krystyna Dzierzbicka
 Krystyna Dzierzbicka Aldehydy i ketony są pochodnymi węglowodorów zawierającymi grupę karbonylową =. Aldehydy związki zawierające grupę formylową (-) połączoną z resztą organiczną: R(Ar)-, R reszta alkilowa;
Krystyna Dzierzbicka Aldehydy i ketony są pochodnymi węglowodorów zawierającymi grupę karbonylową =. Aldehydy związki zawierające grupę formylową (-) połączoną z resztą organiczną: R(Ar)-, R reszta alkilowa;
Aldehydy i Ketony. Grupa karbonylowa: Keton. Aldehyd R H CO R 1 R 2
 Aldehydy i Ketony Grupa karbonylowa: Aldehyd Keton R R 1 R 2 1 Aldehyd = alcohol dehydrogenatus alkohol odwodorniony Nazewnictwo: 1. alkan + al grupa aldehydowa = lokant 1 propanal 3 2 1,3-propanodial
Aldehydy i Ketony Grupa karbonylowa: Aldehyd Keton R R 1 R 2 1 Aldehyd = alcohol dehydrogenatus alkohol odwodorniony Nazewnictwo: 1. alkan + al grupa aldehydowa = lokant 1 propanal 3 2 1,3-propanodial
Rozdział 6. Odpowiedzi i rozwiązania zadań. Chemia organiczna. Zdzisław Głowacki. Zakres podstawowy i rozszerzony
 Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Addycje Nukleofilowe do Grupy Karbonylowej
 J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
Grupa karbonylowa. Grupa karbonylowa to grupa funkcyjna, w której atom tlenu połączony jest z atomem węgla podwójnym wiązaniem
 ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
Reakcje aldehydów i ketonów. grupa karbonylowa Z = H, aldehyd Z = R (czyli at. C), keton
 30-33. Reakcje aldehydów i ketonów grupa karbonylowa Z =, aldehyd Z = R (czyli at. C), keton Chemia rganiczna, dr hab. inż. Mariola Koszytkowska-Stawińska, WChem PW; 2017/2018 1 15.1. Nazewnictwo Aldehyd
30-33. Reakcje aldehydów i ketonów grupa karbonylowa Z =, aldehyd Z = R (czyli at. C), keton Chemia rganiczna, dr hab. inż. Mariola Koszytkowska-Stawińska, WChem PW; 2017/2018 1 15.1. Nazewnictwo Aldehyd
Elementy chemii organicznej
 Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
ZWIĄZKI MAGNEZOORGANICZNE. Krystyna Dzierzbicka
 ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
Materiały dodatkowe związki karbonylowe
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe związki karbonylowe 1. Polaryzacja wiązania C= Charakterystyczną cechą związków posiadających grupę karbonylową
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe związki karbonylowe 1. Polaryzacja wiązania C= Charakterystyczną cechą związków posiadających grupę karbonylową
Reakcje związków karbonylowych zudziałem atomu węgla alfa (C- )
 34-37. eakcje związków karbonylowych zudziałem atomu węgla alfa (C- ) stabilizacja rezonansem (przez delokalizację elektronów), może uczestniczyć w delokalizacji elektronów C- -, podatny na oderwanie ze
34-37. eakcje związków karbonylowych zudziałem atomu węgla alfa (C- ) stabilizacja rezonansem (przez delokalizację elektronów), może uczestniczyć w delokalizacji elektronów C- -, podatny na oderwanie ze
Spis treści 1. Struktura elektronowa związków organicznych 2. Budowa przestrzenna cząsteczek związków organicznych
 Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
ZWIĄZKI FOSFOROORGANICZNE
 ZWIĄZKI FSFGANICZNE Związki fosforoorganiczne związki zawierające wiązanie węgiel-fosfor (C-) Wiązanie fosfor-wodór (-H; 77 kcal/mol) jest słabsze niż wiązanie azot-wodór (N-H; 93.4 kcal/mol). Wiązanie
ZWIĄZKI FSFGANICZNE Związki fosforoorganiczne związki zawierające wiązanie węgiel-fosfor (C-) Wiązanie fosfor-wodór (-H; 77 kcal/mol) jest słabsze niż wiązanie azot-wodór (N-H; 93.4 kcal/mol). Wiązanie
Materiały dodatkowe kwasy i pochodne
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe kwasy i pochodne Kwasy 1. Kwasowość Kwasy karboksylowe są kwasami o stosunkowo niewielkiej mocy. Ich stała dysocjacji
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe kwasy i pochodne Kwasy 1. Kwasowość Kwasy karboksylowe są kwasami o stosunkowo niewielkiej mocy. Ich stała dysocjacji
ALDEHYDY, KETONY. I. Wprowadzenie teoretyczne
 ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
Halogenki alkilowe RX
 alogenki alkilowe X Nazewnictwo halogenków alkilowych 1. Znajdź i nazwij łańcuch macierzysty. Tak jak przy nazywaniu alkanów, wybierz najdłuższy łańcuch. Jeżeli w cząsteczce obecne jest wiązanie podwójne
alogenki alkilowe X Nazewnictwo halogenków alkilowych 1. Znajdź i nazwij łańcuch macierzysty. Tak jak przy nazywaniu alkanów, wybierz najdłuższy łańcuch. Jeżeli w cząsteczce obecne jest wiązanie podwójne
Reakcje związków karbonylowych. Maria Burgieł R R C O. C O + Nu E C
 eakcje związków karbonylowych Maria Burgieł Związki zawierające grupę = nazywamy związkami karbonylowymi. Do najprostszych związków karbonylowych należą aldehydy, w których grupa = jest połączona z jedną
eakcje związków karbonylowych Maria Burgieł Związki zawierające grupę = nazywamy związkami karbonylowymi. Do najprostszych związków karbonylowych należą aldehydy, w których grupa = jest połączona z jedną
Pochodne węglowodorów, w cząsteczkach których jeden atom H jest zastąpiony grupą hydroksylową (- OH ).
 Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
wykład: Aldehydy i Ketony
 wykład: Aldehydy i Ketony Grupa karbonylowa Grupa karbonylowa - grupa funkcyjna występująca w wielu typach związków organicznych, składająca się z atomu węgla połączonego wiązaniem podwójnym z atomem tlenu.
wykład: Aldehydy i Ketony Grupa karbonylowa Grupa karbonylowa - grupa funkcyjna występująca w wielu typach związków organicznych, składająca się z atomu węgla połączonego wiązaniem podwójnym z atomem tlenu.
Kwasy karboksylowe grupa funkcyjna: -COOH. Wykład 8 1
 Kwasy karboksylowe grupa funkcyjna: -CH Wykład 8 1 1. Reakcje utleniania a) utlenianie alkoholi pierwszorzędowych trzymywanie kwasów CH 3 H 3 C C CH 2 H CH 3 alkohol pierwszorzędowy CH K 2 Cr 2 3 7 H 3
Kwasy karboksylowe grupa funkcyjna: -CH Wykład 8 1 1. Reakcje utleniania a) utlenianie alkoholi pierwszorzędowych trzymywanie kwasów CH 3 H 3 C C CH 2 H CH 3 alkohol pierwszorzędowy CH K 2 Cr 2 3 7 H 3
1. REAKCJA ZE ZWIĄZKAMI POSIADAJĄCYMI KWASOWY ATOM WODORU:
 B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
CH 3 OH C 2 H 5 OH H 3 C CH 2 CH 2 OH H 3 C CH CH 3 OH metanol etanol propan-1-ol propan-2-ol H 2 C CH 2 OH OH H 2 C CH CH 2 OH OH OH
 Alkohole Alkohole to związki organiczne, posiadające w cząsteczce przynajmniej jedną hydroksylową grupę funkcyjną ( ). Jeżeli grupa ta jest połączona bezpośrednio z pierścieniem aromatycznym, to taki związek
Alkohole Alkohole to związki organiczne, posiadające w cząsteczce przynajmniej jedną hydroksylową grupę funkcyjną ( ). Jeżeli grupa ta jest połączona bezpośrednio z pierścieniem aromatycznym, to taki związek
Zidentyfikuj związki A i B. w tym celu podaj ich wzory półstrukturalne Podaj nazwy grup związków organicznych, do których one należą.
 Zadanie 1. (2 pkt) Poniżej przedstawiono schemat syntezy pewnego związku. Zidentyfikuj związki A i B. w tym celu podaj ich wzory półstrukturalne Podaj nazwy grup związków organicznych, do których one należą.
Zadanie 1. (2 pkt) Poniżej przedstawiono schemat syntezy pewnego związku. Zidentyfikuj związki A i B. w tym celu podaj ich wzory półstrukturalne Podaj nazwy grup związków organicznych, do których one należą.
KWASY KARBOKSYLOWE. Krystyna Dzierzbicka
 KWASY KARBKSYLWE Krystyna Dzierzbicka Kwasy karboksylowe są związkami organicznymi zawierającymi grupę karboksylową - zbudowaną z grupy karbonylowej () i hydroksylowej (). R (Ar) karboksylowy Możemy je
KWASY KARBKSYLWE Krystyna Dzierzbicka Kwasy karboksylowe są związkami organicznymi zawierającymi grupę karboksylową - zbudowaną z grupy karbonylowej () i hydroksylowej (). R (Ar) karboksylowy Możemy je
Pochodne kwasów karboksylowych. Krystyna Dzierzbicka
 Pochodne kwasów karboksylowych Krystyna Dzierzbicka halogenki kwasowe X X = l, Br, I bezwodniki kwasowe ' estry ' amidy N 2 sole nitryle N Nazwy grup acylowych 3 3 2 acyl metanoil formyl etanoil acetyl
Pochodne kwasów karboksylowych Krystyna Dzierzbicka halogenki kwasowe X X = l, Br, I bezwodniki kwasowe ' estry ' amidy N 2 sole nitryle N Nazwy grup acylowych 3 3 2 acyl metanoil formyl etanoil acetyl
Skala ocen: ndst 0 20, dst , dst , db , db , bdb Informacja:
 Kolokwium III Autorzy: A. Berlicka, E. Dudziak Imię i nazwisko Kierunek studiów azwisko prowadzącego Data Wersja B czas: 60 minut Skala ocen: ndst 0 20, dst 20.5 24, dst 24.5 28, db 28.5 32, db 32.5 36,
Kolokwium III Autorzy: A. Berlicka, E. Dudziak Imię i nazwisko Kierunek studiów azwisko prowadzącego Data Wersja B czas: 60 minut Skala ocen: ndst 0 20, dst 20.5 24, dst 24.5 28, db 28.5 32, db 32.5 36,
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Mg I. I Mg. Nie można ich jednak otrzymać ze związków, które posiadają grupy chlorowcowe w tak zwanym ustawieniu wicynalnym.
 nformacje do zadań kwalifikacyjnych na "Analizę retrosyntetyczną" Urszula Chrośniak, Marcin Goławski Właściwe zadania znajdują się na stronach 9.-10. Strony 1.-8. zawieraja niezbędne informacje wstępne.
nformacje do zadań kwalifikacyjnych na "Analizę retrosyntetyczną" Urszula Chrośniak, Marcin Goławski Właściwe zadania znajdują się na stronach 9.-10. Strony 1.-8. zawieraja niezbędne informacje wstępne.
Fluorowcowęglowodory są to pochodne węglowodorów, gdzie jeden lub więcej atomów wodoru jest podstawione atomem fluorowca. Fluorowcowęglowodory mogą
 Fluorowcowęglowodory są to pochodne węglowodorów, gdzie jeden lub więcej atomów wodoru jest podstawione atomem fluorowca. Fluorowcowęglowodory mogą być alifatyczne i aromatyczne. Grupą funkcyjną dla tych
Fluorowcowęglowodory są to pochodne węglowodorów, gdzie jeden lub więcej atomów wodoru jest podstawione atomem fluorowca. Fluorowcowęglowodory mogą być alifatyczne i aromatyczne. Grupą funkcyjną dla tych
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Br Br. Br Br OH 2 OH NH NH 2 2. Zakład Chemii Organicznej: kopiowanie zabronione
 Kolokwium III Autorzy: A. Berlicka, M. Cebrat, E. Dudziak, A. Kluczyk, Imię i nazwisko Kierunek studiów azwisko prowadzącego Data Wersja A czas: 45 minut Skala ocen: ndst 0 20, dst 20.5 24, dst 24.5 28,
Kolokwium III Autorzy: A. Berlicka, M. Cebrat, E. Dudziak, A. Kluczyk, Imię i nazwisko Kierunek studiów azwisko prowadzącego Data Wersja A czas: 45 minut Skala ocen: ndst 0 20, dst 20.5 24, dst 24.5 28,
REAKCJE PROBÓWKOWE 3. Aldehydy, ketony, cukry*
 REAKCJE PROBÓWKOWE 3. Aldehydy, ketony, cukry* imię i nazwisko data nr str. Rubryki oznaczone po prawej stronie ciemnym prostokątem należy wypełniać przed zajęciami. W reakcjach obowiązują wzory strukturalne
REAKCJE PROBÓWKOWE 3. Aldehydy, ketony, cukry* imię i nazwisko data nr str. Rubryki oznaczone po prawej stronie ciemnym prostokątem należy wypełniać przed zajęciami. W reakcjach obowiązują wzory strukturalne
Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO:
 FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
Aleksander Kołodziejczyk Krystyna Dzierzbicka CHEMII. organicznej Tom 2
 Aleksander Kołodziejczyk Krystyna Dzierzbicka CHEMII organicznej Tom 2 Gdansk 2014 PRZEWODNICZĄCY KOMITETU REDAKCYJNEGO WYDAWNICTWA POLITECHNIKI GDAŃSKIEJ Janusz T. Cieśliński RECENZENT Elżbieta Luboch
Aleksander Kołodziejczyk Krystyna Dzierzbicka CHEMII organicznej Tom 2 Gdansk 2014 PRZEWODNICZĄCY KOMITETU REDAKCYJNEGO WYDAWNICTWA POLITECHNIKI GDAŃSKIEJ Janusz T. Cieśliński RECENZENT Elżbieta Luboch
Alkohole i fenole. Opracowanie: Bartłomiej SIEPSIAK klasa 3d Opiekun: p. Teresa Gębicka
 Alkohole i fenole Opracowanie: Bartłomiej SIEPSIAK klasa d Opiekun: p. Teresa Gębicka Budowa alkoholi i fenoli Szereg homologiczny alkoholi Nazewnictwo Podział alkoholi Otrzymywanie alkoholi Właściwości
Alkohole i fenole Opracowanie: Bartłomiej SIEPSIAK klasa d Opiekun: p. Teresa Gębicka Budowa alkoholi i fenoli Szereg homologiczny alkoholi Nazewnictwo Podział alkoholi Otrzymywanie alkoholi Właściwości
Kwasy karboksylowe C O OH OH C CH 2 H OH CH 2 C CH 3 C OH C OH C OH. propionowy. mrówkowy. akrylowy. octowy. masłowy metakrylowy.
 Kwasy karboksylowe Największą kwasowość spośród związków organicznych wykazują kwasy karboksylowe. Związki te zawierają w cząsteczce grupę karboksylową H, połączoną albo z grupą alkilową R (RH) albo grupą
Kwasy karboksylowe Największą kwasowość spośród związków organicznych wykazują kwasy karboksylowe. Związki te zawierają w cząsteczce grupę karboksylową H, połączoną albo z grupą alkilową R (RH) albo grupą
pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 )
 FLUOROWCOPOCODNE alogenki alkilowe- Cl C 2 -C 2 -C 2 -C 3 C 3 -C-C 3 C 2 -C-C 3 pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 ) I C 3 C 3 Cl-C 2 -C=C 2 Cl-C-C=C 2 1 2 3 Allilowe atom fluorowca
FLUOROWCOPOCODNE alogenki alkilowe- Cl C 2 -C 2 -C 2 -C 3 C 3 -C-C 3 C 2 -C-C 3 pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 ) I C 3 C 3 Cl-C 2 -C=C 2 Cl-C-C=C 2 1 2 3 Allilowe atom fluorowca
Podstawy chemii organicznej. T. 2 / Aleksander Kołodzieczyk, Krystyna Dzierzbicka. Gdańsk, Spis treści
 Podstawy chemii organicznej. T. 2 / Aleksander Kołodzieczyk, Krystyna Dzierzbicka. Gdańsk, 2013 Spis treści 14. ZWIĄZKI KARBONYLOWE 11 14.1. Budowa grupy karbonylowej 11 14.2. Reaktywność związków karbonylowych
Podstawy chemii organicznej. T. 2 / Aleksander Kołodzieczyk, Krystyna Dzierzbicka. Gdańsk, 2013 Spis treści 14. ZWIĄZKI KARBONYLOWE 11 14.1. Budowa grupy karbonylowej 11 14.2. Reaktywność związków karbonylowych
A B C D A B C 4. D A B C D
 1. Kartkówka, 21 października 2015; zestaw Imię i azwisko: Zad. 1. (1 p) Wśród podanych związków,, i D, wszystkie atomy węgla występują w tym samym stanie hybrydyzacji w związkach: i i D 3. i 4. i D Zad.
1. Kartkówka, 21 października 2015; zestaw Imię i azwisko: Zad. 1. (1 p) Wśród podanych związków,, i D, wszystkie atomy węgla występują w tym samym stanie hybrydyzacji w związkach: i i D 3. i 4. i D Zad.
I KSZTAŁCENIA PRAKTYCZNEGO. Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO XV Konkurs Chemii Organicznej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1 (9 pkt) Ciekłą mieszaninę,
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO XV Konkurs Chemii Organicznej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1 (9 pkt) Ciekłą mieszaninę,
Chemia organiczna. Zagadnienia i przykładowe pytania do kolokwiów dla Biotechnologii (I rok)
 Chemia organiczna Zagadnienia i przykładowe pytania do kolokwiów dla Biotechnologii (I rok) Zakład Chemii Organicznej Wydział Chemii Uniwersytet Wrocławski 2005 Lista zagadnień: Kolokwium I...3 Kolokwium
Chemia organiczna Zagadnienia i przykładowe pytania do kolokwiów dla Biotechnologii (I rok) Zakład Chemii Organicznej Wydział Chemii Uniwersytet Wrocławski 2005 Lista zagadnień: Kolokwium I...3 Kolokwium
KWASY KARBOKSYLOWE I ICH POCHODNE. R-COOH lub R C gdzie R = H, CH 3 -, C 6 H 5 -, itp.
 KWASY KARBKSYLWE I IH PHDNE I. Wprowadzenie teoretyczne Kwasy karboksylowe Kwasami organicznymi nazywamy związki, w których grupa funkcyjna H zwana grupą karboksylową jest związana z rodnikiem węglowodorowym
KWASY KARBKSYLWE I IH PHDNE I. Wprowadzenie teoretyczne Kwasy karboksylowe Kwasami organicznymi nazywamy związki, w których grupa funkcyjna H zwana grupą karboksylową jest związana z rodnikiem węglowodorowym
Program wykładu Chemia Organiczna I
 Program wykładu Chemia Organiczna I Semestr III - 2016/2017 r. poziom A i B Wtorek 17:30-18:15 (B, sala 338), czwartek 14:30 15:15 (A i B, aula) oraz piątek 11:30 13:00 (A i B, aula), prof. dr hab. R.
Program wykładu Chemia Organiczna I Semestr III - 2016/2017 r. poziom A i B Wtorek 17:30-18:15 (B, sala 338), czwartek 14:30 15:15 (A i B, aula) oraz piątek 11:30 13:00 (A i B, aula), prof. dr hab. R.
KARTA KURSU. Kod Punktacja ECTS* 4
 KARTA KURSU Nazwa Nazwa w j. ang. Chemia organiczna Organic chemistry Kod Punktacja ECTS* 4 Koordynator dr Waldemar Tejchman Zespół dydaktyczny dr Waldemar Tejchman Opis kursu (cele kształcenia) Celem
KARTA KURSU Nazwa Nazwa w j. ang. Chemia organiczna Organic chemistry Kod Punktacja ECTS* 4 Koordynator dr Waldemar Tejchman Zespół dydaktyczny dr Waldemar Tejchman Opis kursu (cele kształcenia) Celem
HCOOH kwas metanowy ( mrówkowy ) CH 3. COOH kwas etanowy ( octowy ) CH 2
 Kwasy karboksylowe, Ar Nazewnictwo: Kwasy, które są pochodnymi alkanów o otwartych łańcuchach, są nazywane w sposób systematyczny przez dodanie nazwy kwas i dodanie końcówki owy do alkanu - kwas alkanowy
Kwasy karboksylowe, Ar Nazewnictwo: Kwasy, które są pochodnymi alkanów o otwartych łańcuchach, są nazywane w sposób systematyczny przez dodanie nazwy kwas i dodanie końcówki owy do alkanu - kwas alkanowy
Kwasy karboksylowe. 1. Cele lekcji. 2. Metoda i forma pracy. 3. Środki dydaktyczne. 4. Przebieg lekcji. a) Wiadomości.
 Kwasy karboksylowe 1. Cele lekcji a) Wiadomości Uczeń zna budowę kwasów karboksylowych, nazewnictwo kwasów karboksylowych, podział kwasów karboksylowych, sposoby otrzymywania kwasów karboksylowych, właściwości
Kwasy karboksylowe 1. Cele lekcji a) Wiadomości Uczeń zna budowę kwasów karboksylowych, nazewnictwo kwasów karboksylowych, podział kwasów karboksylowych, sposoby otrzymywania kwasów karboksylowych, właściwości
1. Katalityczna redukcja węglowodorów zawierających wiązania wielokrotne
 B T E C N L CEMA G RGANCZNA A Synteza 1. Katalityczna redukcja węglowodorów zawierających wiązania wielokrotne C C / Pt C C C C W reakcji tej łańcuch węglowy pozostaje zachowany (nie ulega zmianie jego
B T E C N L CEMA G RGANCZNA A Synteza 1. Katalityczna redukcja węglowodorów zawierających wiązania wielokrotne C C / Pt C C C C W reakcji tej łańcuch węglowy pozostaje zachowany (nie ulega zmianie jego
ĆWICZENIE 2. Reakcje grupy hydroksylowej i karbonylowej
 ĆWICZENIE 2 Reakcje grupy hydroksylowej i karbonylowej Alkohole R-H, fenole Ar-H Pochodne węglowodorów alifatycznych zawierające grupę H połączoną z atomem węgla o hybrydyzacji sp 3, nazywa się alkoholami,
ĆWICZENIE 2 Reakcje grupy hydroksylowej i karbonylowej Alkohole R-H, fenole Ar-H Pochodne węglowodorów alifatycznych zawierające grupę H połączoną z atomem węgla o hybrydyzacji sp 3, nazywa się alkoholami,
LCH 1 Zajęcia nr 60 Diagnoza końcowa. Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach:
 LCH 1 Zajęcia nr 60 Diagnoza końcowa Zadanie 1 (3 pkt) Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach: H 3 C CH 2 CH 2 CH 2 CH 2 a) b) W tym celu: a) wybierz odpowiedni
LCH 1 Zajęcia nr 60 Diagnoza końcowa Zadanie 1 (3 pkt) Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach: H 3 C CH 2 CH 2 CH 2 CH 2 a) b) W tym celu: a) wybierz odpowiedni
Podział związków organicznych
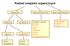 Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Zadanie: 2 (4 pkt) Napisz, uzgodnij i opisz równania reakcji, które zaszły w probówkach:
 Zadanie: 1 (1 pkt) Aby otrzymać ester o wzorze CH 3 CH 2 COOCH 3 należy jako substratów użyć: a) Kwasu etanowego i metanolu b) Kwasu etanowego i etanolu c) Kwasu metanowego i etanolu d) Kwasu propanowego
Zadanie: 1 (1 pkt) Aby otrzymać ester o wzorze CH 3 CH 2 COOCH 3 należy jako substratów użyć: a) Kwasu etanowego i metanolu b) Kwasu etanowego i etanolu c) Kwasu metanowego i etanolu d) Kwasu propanowego
Aminy. - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin
 Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
REAKCJE JONÓW ENOLANOWYCH
 REKCJE JÓW ELWYC Część I MTERIŁY PRZYGTWUJĄCE D CLLQUIUM KŃCWEG PRCWI ZWSW CEMI RGICZ zasada Dr artosz Trzewik Kraków, 9 listopada 2013 r. 1 Spis treści: 1. Kwasowość atomów wodoru α, jony enolanowe 2.
REKCJE JÓW ELWYC Część I MTERIŁY PRZYGTWUJĄCE D CLLQUIUM KŃCWEG PRCWI ZWSW CEMI RGICZ zasada Dr artosz Trzewik Kraków, 9 listopada 2013 r. 1 Spis treści: 1. Kwasowość atomów wodoru α, jony enolanowe 2.
REAKCJE W CHEMII ORGANICZNEJ
 Katedra Biochemii ul. Akademicka 12, 20-033 Lublin tel. 081 445 66 08 www.biochwet.up.lublin.pl REAKCJE W CHEMII ORGANICZNEJ I. Reakcje utleniania na przykładzie różnych związków organicznych. 1. Utlenienie
Katedra Biochemii ul. Akademicka 12, 20-033 Lublin tel. 081 445 66 08 www.biochwet.up.lublin.pl REAKCJE W CHEMII ORGANICZNEJ I. Reakcje utleniania na przykładzie różnych związków organicznych. 1. Utlenienie
liczba kwantowa, n kwantowa, l Wanad 3 2 [Ar] 3d 3 4s 2
![liczba kwantowa, n kwantowa, l Wanad 3 2 [Ar] 3d 3 4s 2 liczba kwantowa, n kwantowa, l Wanad 3 2 [Ar] 3d 3 4s 2](/thumbs/65/54124071.jpg) Arkusz odpowiedzi Nr Proponowane rozwiązanie zadani a Liczba niesparowanych elektronów w jonie r 3+ jest (mniejsza / większa) od liczby elektronów niesparowanych w jonie Mn +. Pierwiastkiem, którego jony
Arkusz odpowiedzi Nr Proponowane rozwiązanie zadani a Liczba niesparowanych elektronów w jonie r 3+ jest (mniejsza / większa) od liczby elektronów niesparowanych w jonie Mn +. Pierwiastkiem, którego jony
Chemia organiczna. Alkohole Fenole. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
Zadanie 1. (1 pkt) Zapach mięty pochodzi od mentolu, alkoholu o uproszczonym wzorze:
 Zadanie 1. (1 pkt) Zapach mięty pochodzi od mentolu, alkoholu o uproszczonym wzorze: Mentol w wyniku reakcji utleniania roztworem K 2 Cr 2 O 7 w środowisku kwaśnym daje związek należący do ketonów cyklicznych.
Zadanie 1. (1 pkt) Zapach mięty pochodzi od mentolu, alkoholu o uproszczonym wzorze: Mentol w wyniku reakcji utleniania roztworem K 2 Cr 2 O 7 w środowisku kwaśnym daje związek należący do ketonów cyklicznych.
Slajd 1. Alkohole i fenole. Cholesterol. Slajd 2. Budowa alkoholi. metanol. metanol. Grupą funkcyjną jest (OH) Tlen posiada hybrydyzacjęsp 3
 Slajd 1 Alkohole i fenole Cholesterol Slajd 2 Budowa alkoholi woda woda metanol metanol Grupą funkcyjną jest () Tlen posiada hybrydyzacjęsp 3 Slajd 3 Podział alkoholi Pierwszorzędowe: grupa połączona jest
Slajd 1 Alkohole i fenole Cholesterol Slajd 2 Budowa alkoholi woda woda metanol metanol Grupą funkcyjną jest () Tlen posiada hybrydyzacjęsp 3 Slajd 3 Podział alkoholi Pierwszorzędowe: grupa połączona jest
PRZYKŁADOWE ZADANIA KWASY
 PRZYKŁADOWE ZADANIA KWASY Zadanie 1014 (3 pkt) Pr.XII/2004 A2 Określ typ podanych niżej reakcji: I. C 17 H 33 COOH + Br 2 C 17 H 33 Br 2 COOH Al 2O 3, temp II. C 2 H 5 OH C 2 H 4 + H 2 O hγ III. CH 4 +
PRZYKŁADOWE ZADANIA KWASY Zadanie 1014 (3 pkt) Pr.XII/2004 A2 Określ typ podanych niżej reakcji: I. C 17 H 33 COOH + Br 2 C 17 H 33 Br 2 COOH Al 2O 3, temp II. C 2 H 5 OH C 2 H 4 + H 2 O hγ III. CH 4 +
węglowodory łańcuchowe lub cykliczne posiadające dwa wiązania podwójne C=C KLASYFIKACJA DIENY SKUMULOWANE alleny (kumuleny)
 DIENY węglowodory łańcuchowe lub cykliczne posiadające dwa wiązania podwójne C=C KLASYFIKACJA DIENY SKUMULOWANE alleny (kumuleny) 2 C C C 2 2 C C C C C 3 propa-1,2-dien penta-1,2,3-trien DIENY IZOLOWANE
DIENY węglowodory łańcuchowe lub cykliczne posiadające dwa wiązania podwójne C=C KLASYFIKACJA DIENY SKUMULOWANE alleny (kumuleny) 2 C C C 2 2 C C C C C 3 propa-1,2-dien penta-1,2,3-trien DIENY IZOLOWANE
Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r.
 Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r. Lp. Temat lekcji 1. Szereg homologiczny alkanów. 2. Izomeria konstytucyjna w alkanach. 3.
Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r. Lp. Temat lekcji 1. Szereg homologiczny alkanów. 2. Izomeria konstytucyjna w alkanach. 3.
REAKCJE PROBÓWKOWE 3. Aldehydy, ketony, cukry
 REAKCJE PROBÓWKOWE 3. Aldehydy, ketony, cukry imię i nazwisko data nr str. Rubryki oznaczone po prawej stronie ciemnym prostokątem należy wypełniać przed zajęciami. W reakcjach obowiązują wzory strukturalne
REAKCJE PROBÓWKOWE 3. Aldehydy, ketony, cukry imię i nazwisko data nr str. Rubryki oznaczone po prawej stronie ciemnym prostokątem należy wypełniać przed zajęciami. W reakcjach obowiązują wzory strukturalne
Test dla kl. II Związki jednofunkcyjne
 .. imię i nazwisko Test dla kl. II Związki jednofunkcyjne.. klasa. A. Podaj nazwy niżej podanych związków: a) CH 3 -CH 2 -CH 2 -H - b) CH 3 -C-CH 3 - c) CH 3 -CH - d) HCH - e) CH 3 CCH 3-2. Napisz wzory
.. imię i nazwisko Test dla kl. II Związki jednofunkcyjne.. klasa. A. Podaj nazwy niżej podanych związków: a) CH 3 -CH 2 -CH 2 -H - b) CH 3 -C-CH 3 - c) CH 3 -CH - d) HCH - e) CH 3 CCH 3-2. Napisz wzory
KOLOKWIUM II - ROZWIĄZANIA Chemia organiczna B,
 KLKWIUM II - RZWIĄZANIA Chemia organiczna B, 0..008 Zad.. (0 p.) Przedstaw mechanizmy następujących reakcji. W punktach a-c należy posłużyć się wzorami przestrzennymi lub krzesłowymi. a) (R)--fenylobutan--ol
KLKWIUM II - RZWIĄZANIA Chemia organiczna B, 0..008 Zad.. (0 p.) Przedstaw mechanizmy następujących reakcji. W punktach a-c należy posłużyć się wzorami przestrzennymi lub krzesłowymi. a) (R)--fenylobutan--ol
18. Reakcje benzenu i jego pochodnych
 18. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień benzenowy
18. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień benzenowy
ĆWICZENIE III. Reakcje charakterystyczne na węglowodory (alifatyczne, aromatyczne), alkohole, aldehydy i ketony
 ĆWIZENIE III eakcje charakterystyczne na węglowodory (alifatyczne, aromatyczne), alkohole, aldehydy i ketony I. eakcje charakterystyczne odróżniające węglowodory alifatyczne nasycone od nienasyconych 1.
ĆWIZENIE III eakcje charakterystyczne na węglowodory (alifatyczne, aromatyczne), alkohole, aldehydy i ketony I. eakcje charakterystyczne odróżniające węglowodory alifatyczne nasycone od nienasyconych 1.
Elementy chemii organicznej
 Elementy chemii organicznej Węglowodory alifatyczne Alkany C n H 2n+2 Alkeny C n H 2n Alkiny C n H 2n-2 Alkany C n H 2n+2 struktura Kekulégo wzór skrócony model Dreidinga metan etan propan butan Nazewnictwo
Elementy chemii organicznej Węglowodory alifatyczne Alkany C n H 2n+2 Alkeny C n H 2n Alkiny C n H 2n-2 Alkany C n H 2n+2 struktura Kekulégo wzór skrócony model Dreidinga metan etan propan butan Nazewnictwo
Reakcje benzenu i jego pochodnych
 39-42. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień
39-42. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień
Reakcje alkoholi, eterów, epoksydów, amin i tioli
 22-24. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas Chemia rganiczna,
22-24. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas Chemia rganiczna,
Wymagania na poszczególne oceny z chemii w klasie III VII. Węgiel i jego związki z wodorem
 Wymagania na poszczególne oceny z chemii w klasie III VII. Węgiel i jego związki z wodorem 1 Uczeń: wyjaśnia, czym zajmuje się chemiaorganiczna (2) definiuje pojęcie węglowodory (2) wymienia naturalne
Wymagania na poszczególne oceny z chemii w klasie III VII. Węgiel i jego związki z wodorem 1 Uczeń: wyjaśnia, czym zajmuje się chemiaorganiczna (2) definiuje pojęcie węglowodory (2) wymienia naturalne
MIKROANALIZY WĘGLOWODORY. W1 Utlenianie węglowodorów nadmanganianem potasu w środowisku kwaśnym (w temp. pokojowej) RÓWNANIA REAKCJI: OBSERWACJE:
 MIKROANALIZY imię i nazwisko Rubryki odpowiednio opisane (lekko przyciemnione) należy wypełniać przed rozpoczęciem zajęć. Opisując obserwacje reakcji należy wyraźnie napisać co się zmienia lub nie. Jeśli
MIKROANALIZY imię i nazwisko Rubryki odpowiednio opisane (lekko przyciemnione) należy wypełniać przed rozpoczęciem zajęć. Opisując obserwacje reakcji należy wyraźnie napisać co się zmienia lub nie. Jeśli
Podstawowe pojęcia i prawa chemiczne
 Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Wymagania edukacyjne niezbędne do otrzymania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z chemii dla klasy VIII
 Wymagania edukacyjne niezbędne do otrzymania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z chemii dla klasy VIII Temat 1.Wzory i nazwy kwasów. dopuszczająca - zna zasady bezpiecznego posługiwania
Wymagania edukacyjne niezbędne do otrzymania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z chemii dla klasy VIII Temat 1.Wzory i nazwy kwasów. dopuszczająca - zna zasady bezpiecznego posługiwania
Alkeny. Wzór ogólny alkenów C n H 2n. (Uwaga identyczny wzór ogólny mają cykloakany!!!)
 Alkeny Wzór ogólny alkenów n 2n (Uwaga identyczny wzór ogólny mają cykloakany!!!) Węglowodory nienasycone, zawierające wiązanie podwójne, hybrydyzacja atomow węgla biorących udział w tworzeniu wiązania
Alkeny Wzór ogólny alkenów n 2n (Uwaga identyczny wzór ogólny mają cykloakany!!!) Węglowodory nienasycone, zawierające wiązanie podwójne, hybrydyzacja atomow węgla biorących udział w tworzeniu wiązania
Chemia organiczna. Związki zawierające grupę karbonylową. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Chemia organiczna Związki zawierające grupę karbonylową Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Grupy związków zawierających grupę karbonylową C=O aldehyd ester keton kwasy karboksylowy
Chemia organiczna Związki zawierające grupę karbonylową Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Grupy związków zawierających grupę karbonylową C=O aldehyd ester keton kwasy karboksylowy
Slajd 1. Etery i epoksydy. Slajd 2. Wprowadzenie. Wzór R-O-R, gdzie R tos alkil lub aryl Symetryczne lub asymetryczne Przykłady: CH 3 O CH 3 O CH 3
 Slajd 1 Etery i epoksydy Slajd 2 Wprowadzenie Wzór R--R, gdzie R tos alkil lub aryl Symetryczne lub asymetryczne Przykłady: C 3 C 3 C 3 Slajd 3 Budowa i polarność Wygięta struktura Atom tlenu posiada hybrydyzacjęsp
Slajd 1 Etery i epoksydy Slajd 2 Wprowadzenie Wzór R--R, gdzie R tos alkil lub aryl Symetryczne lub asymetryczne Przykłady: C 3 C 3 C 3 Slajd 3 Budowa i polarność Wygięta struktura Atom tlenu posiada hybrydyzacjęsp
13. B E Z W O D N I K I I H A L O G E N K I K W A S O W E Aleksander Kołodziejczyk sierpień 2007
 13. B E Z W D N I K I I A L G E N K I K W A S W E Aleksander Kołodziejczyk sierpień 2007 A L G E N K I K W A S W E alogenki kwasowe są pochodnymi kwasów karboksylowych, w których funkcja hydroksylowa została
13. B E Z W D N I K I I A L G E N K I K W A S W E Aleksander Kołodziejczyk sierpień 2007 A L G E N K I K W A S W E alogenki kwasowe są pochodnymi kwasów karboksylowych, w których funkcja hydroksylowa została
1 Marek Żylewski. Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii Organicznej. NO 2 Zn, HCl HNO 3 N H 2. NH 2 Na 2. S x CHO.
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe związki azotowe Związki nitrowe 1. Redukcja związków nitrowych. Grupa nitrowa jest bardzo podatna na działanie
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe związki azotowe Związki nitrowe 1. Redukcja związków nitrowych. Grupa nitrowa jest bardzo podatna na działanie
Materiały dodatkowe węglowodany
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe węglowodany 1. Mutarotacja Cukry występują głównie w formie pierścieniowej zawartość formy łańcuchowej w stanie
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe węglowodany 1. Mutarotacja Cukry występują głównie w formie pierścieniowej zawartość formy łańcuchowej w stanie
δ + δ - δ + R O H RJC R δ + δ - δ - δ + R O R Grupy Funkcyjne δ + O NH 2 R N H H R N Slides 1 to 41
 1 δ + δ + δ + R R X Grupy Funkcyjne δ + δ + R R R δ + R δ + X δ + R N R δ + R δ + R R δ + R δ + N 2 R δ + R N δ + δ + Slides 1 to 41 2 Grupy Funkcyjne Zawierające eteroatomy Grupy funkcyjne mają często
1 δ + δ + δ + R R X Grupy Funkcyjne δ + δ + R R R δ + R δ + X δ + R N R δ + R δ + R R δ + R δ + N 2 R δ + R N δ + δ + Slides 1 to 41 2 Grupy Funkcyjne Zawierające eteroatomy Grupy funkcyjne mają często
Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy. Dział Zakres treści
 Anna Kulaszewicz Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy lp. Dział Temat Zakres treści 1 Zapoznanie z przedmiotowym systemem oceniania i wymaganiami edukacyjnymi z
Anna Kulaszewicz Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy lp. Dział Temat Zakres treści 1 Zapoznanie z przedmiotowym systemem oceniania i wymaganiami edukacyjnymi z
AMINY. nikotyna. tytoń szlachetny. pseudoefedryna (SUDAFED) atropina. muskaryna H 3 C CH 3 O
 AMINY nikotyna H 3 C NH tytoń szlachetny OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN 2 NUKLEOFILOWOŚĆ i ZASADOWOŚĆ AMIN 3 REAKCJA AMIN Z KWASAMI MINERALNYMI I KARBOKSYLOWYMI
AMINY nikotyna H 3 C NH tytoń szlachetny OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN 2 NUKLEOFILOWOŚĆ i ZASADOWOŚĆ AMIN 3 REAKCJA AMIN Z KWASAMI MINERALNYMI I KARBOKSYLOWYMI
Sprawdzian 3. CHEMIA. Przed próbną maturą (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34. Imię i nazwisko ...
 CEMIA Przed próbną maturą 2017 Sprawdzian 3. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34 Imię i nazwisko Liczba punktów Procent 2 Zadanie 1. (0 1) Związki krzemu z wodorem noszą
CEMIA Przed próbną maturą 2017 Sprawdzian 3. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34 Imię i nazwisko Liczba punktów Procent 2 Zadanie 1. (0 1) Związki krzemu z wodorem noszą
Slajd 1. Slajd 2. Aminy. trietyloamina. amoniak. chlorofil
 Slajd 1 Aminy chlorofil Slajd 2 amoniak trietyloamina Slajd 3 Wypadkowy moment dipolowy 1 lub 2 aminy: donory lub akceptory wiązania wodorowego 3 aminy: mogą być wyłącznie akceptorami wiązania wodorowego
Slajd 1 Aminy chlorofil Slajd 2 amoniak trietyloamina Slajd 3 Wypadkowy moment dipolowy 1 lub 2 aminy: donory lub akceptory wiązania wodorowego 3 aminy: mogą być wyłącznie akceptorami wiązania wodorowego
REAKCJE JONÓW ENOLANOWYCH
 REKCJE JNÓW ENLNWYC Część II MTERIŁY PRZYGTWUJĄCE D CLLQUIUM KŃCWEG PRCWNI ZWNSWN CEMI RGNICZN Dr artosz Trzewik Kraków, 12 listopada 2013 r. 25 Spis treści części I i II 1. Kwasowość atomów wodoru α,
REKCJE JNÓW ENLNWYC Część II MTERIŁY PRZYGTWUJĄCE D CLLQUIUM KŃCWEG PRCWNI ZWNSWN CEMI RGNICZN Dr artosz Trzewik Kraków, 12 listopada 2013 r. 25 Spis treści części I i II 1. Kwasowość atomów wodoru α,
Wymagania edukacyjne z chemii oraz sposoby sprawdzania wiedzy i umiejętności
 Wymagania edukacyjne z chemii oraz sposoby sprawdzania wiedzy i umiejętności Kwasy Wymagania edukacyjne z podstawy programowej - klasa VIII Uczeń: definiuje pojęcie kwasy zgodnie z teorią Arrheniusa opisuje
Wymagania edukacyjne z chemii oraz sposoby sprawdzania wiedzy i umiejętności Kwasy Wymagania edukacyjne z podstawy programowej - klasa VIII Uczeń: definiuje pojęcie kwasy zgodnie z teorią Arrheniusa opisuje
ALDEHYDY związki zawierające grupę formylową ( atomem węgla. KETONY związki zawierające grupę karbonylową ( dwoma atomami węgla.
 ALDEHYDY I KETNY ALDEHYDY związki zawierające grupę formylową ( atomem węgla. C H ) połączoną z KETNY związki zawierające grupę karbonylową ( dwoma atomami węgla. C ) połączoną z NMENKLATURA ALDEHYDÓW
ALDEHYDY I KETNY ALDEHYDY związki zawierające grupę formylową ( atomem węgla. C H ) połączoną z KETNY związki zawierające grupę karbonylową ( dwoma atomami węgla. C ) połączoną z NMENKLATURA ALDEHYDÓW
Technologia chemiczna. Dwiczenie nr 4. OTRZYMYWANIE OCTANU n-butylu
 Technologia chemiczna Dwiczenie nr 4 OTRZYMYWANIE OCTANU n-butylu Wrocław, 2010 ESTRY BUDOWA, WŁAŚCIWOŚCI, OTRZYMYWANIE Estry to związki organiczne, które są pochodnymi kwasów karboksylowych (lub nieorganicznych)
Technologia chemiczna Dwiczenie nr 4 OTRZYMYWANIE OCTANU n-butylu Wrocław, 2010 ESTRY BUDOWA, WŁAŚCIWOŚCI, OTRZYMYWANIE Estry to związki organiczne, które są pochodnymi kwasów karboksylowych (lub nieorganicznych)
Treść podstawy programowej
 CHEMIA ZR Ramowy rozkład materiału w kolejnych tomach podręczników I. Atomy, cząsteczki i stechiometria chemiczna Tom I 1. Masa atomowa I.2. 2. Izotopy I.1., I.3. 3. Reakcje jądrowe I.4. 4. Okres półtrwania
CHEMIA ZR Ramowy rozkład materiału w kolejnych tomach podręczników I. Atomy, cząsteczki i stechiometria chemiczna Tom I 1. Masa atomowa I.2. 2. Izotopy I.1., I.3. 3. Reakcje jądrowe I.4. 4. Okres półtrwania
WYMAGANIA EDUKACYJNE
 SZKOŁA PODSTAWOWA W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie 8 Szkoły Podstawowej Wymagania edukacyjne niezbędne
SZKOŁA PODSTAWOWA W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie 8 Szkoły Podstawowej Wymagania edukacyjne niezbędne
CHEMIA klasa 3 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery.
 CHEMIA klasa 3 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery. Dział - Węgiel i jego związki. określa, czym zajmuje się chemia organiczna definiuje
CHEMIA klasa 3 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery. Dział - Węgiel i jego związki. określa, czym zajmuje się chemia organiczna definiuje
Kilka wskazówek ułatwiających analizę widm w podczerwieni
 Kilka wskazówek ułatwiających analizę widm w podczerwieni Opracowanie wg dostępnej literatury spektroskopowej: Dr Alina T. Dubis e-mail: alina@uwb.edu.pl Instytut Chemii Uniwersytet w Białymstoku Al. J.
Kilka wskazówek ułatwiających analizę widm w podczerwieni Opracowanie wg dostępnej literatury spektroskopowej: Dr Alina T. Dubis e-mail: alina@uwb.edu.pl Instytut Chemii Uniwersytet w Białymstoku Al. J.
WYMAGANIA EDUKACYJNE w klasie III
 WYMAGANIA EDUKACYJNE w klasie III Nr lekcji Temat lekcji Treści nauczania (pismem pogrubionym zostały zaznaczone treści Podstawy Programowej) Węgiel i jego związki z wodorem Wymagania i kryteria ocen Uczeń:
WYMAGANIA EDUKACYJNE w klasie III Nr lekcji Temat lekcji Treści nauczania (pismem pogrubionym zostały zaznaczone treści Podstawy Programowej) Węgiel i jego związki z wodorem Wymagania i kryteria ocen Uczeń:
PROGRAM ĆWICZEŃ Program ćwiczeń z chemii organicznej obejmuje wykonanie jedenastu zadań praktycznych i zdanie czterech kolokwiów.
 Wrocław 2019-10-01 REGULAMIN PRZEDMIOTU CHEMIA ORGANICZNA DLA STUDENTÓW II ROKU WYDZIAŁU FARMACEUTYCZNEGO UMW WE WROCŁAWIU (150 godzin ćwiczeń, 60 godzin wykładów) w roku akademickim 2019/ 2020 PROGRAM
Wrocław 2019-10-01 REGULAMIN PRZEDMIOTU CHEMIA ORGANICZNA DLA STUDENTÓW II ROKU WYDZIAŁU FARMACEUTYCZNEGO UMW WE WROCŁAWIU (150 godzin ćwiczeń, 60 godzin wykładów) w roku akademickim 2019/ 2020 PROGRAM
ALKOHOLE, FENOLE, ALDEHYDY, KETONY
 LKOHOLE, FENOLE, LDEHYDY, KETONY ZDNIE DOMOWE ZDNIE 1. (2 P.): Poniżej przedstawiono cykl reakcji zachodzących z udziałem związków organicznych. Określ typ każdej reakcji (1. 4.) z powyższego schematu,
LKOHOLE, FENOLE, LDEHYDY, KETONY ZDNIE DOMOWE ZDNIE 1. (2 P.): Poniżej przedstawiono cykl reakcji zachodzących z udziałem związków organicznych. Określ typ każdej reakcji (1. 4.) z powyższego schematu,
11. Reakcje alkoholi, eterów, epoksydów, amin i tioli
 11. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas 1 11.1. Reakcja
11. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas 1 11.1. Reakcja
ALKENY WĘGLOWODORY NIENASYCONE
 Alkeny ALKENY WĘGLOWODORY NIENASYCONE WĘGLOWODORY ALIFATYCZNE SKŁĄDAJĄ SIĘ Z ATOMÓW WĘGLA I WODORU ZAWIERAJĄ JEDNO LUB KILKA WIĄZAŃ PODWÓJNYCH WĘGIEL WĘGIEL ATOM WĘGLA WIĄZANIA PODWÓJNEGO W HYBRYDYZACJI
Alkeny ALKENY WĘGLOWODORY NIENASYCONE WĘGLOWODORY ALIFATYCZNE SKŁĄDAJĄ SIĘ Z ATOMÓW WĘGLA I WODORU ZAWIERAJĄ JEDNO LUB KILKA WIĄZAŃ PODWÓJNYCH WĘGIEL WĘGIEL ATOM WĘGLA WIĄZANIA PODWÓJNEGO W HYBRYDYZACJI
Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami
 Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami I. Otrzymywanie halogenowęglowodorów 1. Reakcje halogenacji (substytucji rodnikowej halogenów (Cl, ) na
Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami I. Otrzymywanie halogenowęglowodorów 1. Reakcje halogenacji (substytucji rodnikowej halogenów (Cl, ) na
Plan wynikowy z chemii do klasy III gimnazjum w roku szkolnym 2017/2018. Liczba godzin tygodniowo: 1.
 1 Plan wynikowy z chemii do klasy III gimnazjum w roku szkolnym 2017/2018. Liczba godzin tygodniowo: 1. Tytuł rozdziału w podręczniku Temat lekcji podstawowe Węgiel i jego związki z wodorem 1.Omówienie
1 Plan wynikowy z chemii do klasy III gimnazjum w roku szkolnym 2017/2018. Liczba godzin tygodniowo: 1. Tytuł rozdziału w podręczniku Temat lekcji podstawowe Węgiel i jego związki z wodorem 1.Omówienie
Spis treści. Nazewnictwo kwasów karboksylowych.
 Do tej klasy zaliczamy związki zawierające grupę karboksylową, zapisywaną w skrócie jako COOH. W tej grupie karbonylowy atom węgla jest związany dodatkowo z grupą hydroksylową. Z uwagi na hybrydyzację
Do tej klasy zaliczamy związki zawierające grupę karboksylową, zapisywaną w skrócie jako COOH. W tej grupie karbonylowy atom węgla jest związany dodatkowo z grupą hydroksylową. Z uwagi na hybrydyzację
PRZYKŁADOWE ZADANIA ALKOHOLE I FENOLE
 PRZYKŁADOWE ZADANIA ALKOHOLE I FENOLE INFORMACJA DO ZADAŃ 864 865 Poniżej przedstawiono cykl reakcji zachodzących z udziałem związków organicznych. 1 2 cykloheksen cykloheksan chlorocykloheksan Zadanie
PRZYKŁADOWE ZADANIA ALKOHOLE I FENOLE INFORMACJA DO ZADAŃ 864 865 Poniżej przedstawiono cykl reakcji zachodzących z udziałem związków organicznych. 1 2 cykloheksen cykloheksan chlorocykloheksan Zadanie
