Technologie biochemiczne 2016/17
|
|
|
- Antonina Król
- 8 lat temu
- Przeglądów:
Transkrypt
1 Technologie biochemiczne 2016/17 ćwiczenia Imię i nazwisko, nr grupy: 1
2 Ćwiczenie 2a Izolacja drobnoustrojów zdolnych do metabolizowania ksenobiotyków o budowie aromatycznej (technologie bioremediacyjne) Cel ćwiczenia: Izolacja szczepów mikroorganizmów zdolnych do metabolizowania salicylanów i fenoli. Odczynniki i podłoża: Agar z wyciągiem glebowym i ekstraktem drożdżowym (YS) wyciąg glebowy 1000 ml ekstrakt drożdżowy 1,0 g agar 20,0 g Agar mineralny (MSA) z ksenobiotykiem jako jedynym źródłem węgla MgSO 4 0,5 g Na 2HPO 4 1,0 g KH 2PO 4 0,5 g NH 4NO 3 2,5 g CaCl 2 0,01 g Fe 2(SO 4) 3 0,01 g MnSO 4 0,01 mg Co(NO 3) 2 0,005 mg (NH 4) 6Mo 7O 24 0,1 mg Agar 20 g Woda do 1000 ml ph=6.8 Płytki z fenolem: przygotować 0,1 M roztwór fenolu w wodzie. Roztwór w podanych poniżej ilościach rozprowadzić równomiernie po powierzchni agaru sterylną głaszczką, zostawić do wyschnięcia: 50 µl 0,1 M fenolu końcowe stęż.: 0,5 mm 100 µl 0,1 M fenolu końcowe stęż.: 1 mm 200 µl 0,1 M fenolu końcowe stęż.: 2 mm Płytki z salicylanem: przygotować 0,1 M roztwór salicylanu sodu w wodzie. Roztwór w podanych poniżej ilościach rozprowadzić równomiernie po powierzchni agaru sterylną głaszczką, zostawić do wyschnięcia: 50 µl 0,1 M salicylanu końcowe stęż.: 0,5 mm 100 µl 0,1 M salicylanu końcowe stęż.: 1 mm 200 µl 0,1 M salicylanu końcowe stęż.: 2 mm 0,1% roztwór Tween 80 w soli fizjologicznej 0,9% NaCl Materiał: próbka gleby (pochodząca ze środowiska zdegradowanego) Miejsce pobrania próbki gleby: 2
3 Wykonanie ćwiczenia: 1. Przygotować wyciąg glebowy: odważyć 10 g gleby, zawiesić w 90 ml soli fizjologicznej z dodatkiem Tweenu i wytrząsać przez około 30 minut. Odstawić na 1 minutę do opadnięcia większych cząstek). 2. Następnie przygotować szereg 10-krotnych rozcieńczeń wyciągu glebowego w soli fizjologicznej ( ) po 1 ml rozcieńczenia na 9 ml soli fizjologicznej. Wyciąg glebowy traktować jako rozcieńczenie Wykonać posiew powierzchniowy (mazany) głaszczką na podłożu agarowym z wyciągiem glebowym, po 100 µl każdego z rozcieńczeń. Inkubować hodowle przez 7 dni w temp. 28 C. Ćwiczenie 2b Selekcja drobnoustrojów metodą replik 1. Przygotować podłoża z fenolem i salicylanem sodu (patrz: odczynniki i podłoża). Jedna podgrupa przygotowuje płytki z jednym czynnikiem selekcyjnym. 2. Wybrać jedną z nich i przenieść kolonie na płytki z ksenobiotykiem, za pomocą welwetowego stempla. Pamiętać o zaznaczeniu orientacji płytek! 3
4 Stempel do replikacji umożliwia transfer kolonii drobnoustrojów z jednej płytki z pożywką na inną płytkę. Aby skopiować płytkę z kolonią należy przy pomocy pierścienia umocować sterylne płótno na stemplu. Stempel i pierścień należy poddać wcześniejszej sterylizacji etanolem, podobne pincetę, którą płótna zostaną wyjęte z opakowania i położone miękką stroną na górnej części bloku. Następnie płytka z koloniami zostaje górną stroną lekko dociśnięta do stempla. Proces ten powtarza się z drugą szalką Petriego, w której znajduje się właściwa pożywka. W ten sposób wytwarza się odbicie (replikę) pierwotnego rozmieszczenia kolonii na nowej płytce. Jeżeli podczas przenoszenia kolonii szalki Petriego zostaną jedynie lekko przyciśnięte, z reguły można sporządzić 2-3 replik. 4. Inkubować hodowle przez 7 dni w temperaturze 28 C. 5. Odczytać wyniki na kolejnych ćwiczeniach. Wyniki: Określić liczbę kolonii (CFU) wyrosłych na szalkach (agar z wyciągiem glebowym, agar mineralny) przy poszczególnych rozcieńczeniach wyciągu glebowego. Opisać morfologię kolonii. Wyniki podać w poniższej tabeli. Liczba kolonii (CFU) wyrosłych na podłożu z wyciągiem glebowym i na agarze mineralnym Rozcieńczenie wyciągu glebowego agar glebowy agar mineralny Ocena liczby (CFU) i morfologii kolonii wyrosłych na płytkach z agarem mineralnym w obecności czynników selekcyjnych. Ocena częstości występowania (w procentach) szczepów drobnoustrojów zdolnych do rozkładu/biotransformacji badanych związków w analizowanej próbce gleby. liczba kolonii drobnoustrojów glebowych morfologia kolonii drobnoustrojów glebowych częstość występowania drobnoustrojów zdolnych do rozkładu WWA 0,5 mm fenol 1 mm 2 mm 0,5 mm salicylan sodu 1 mm 2 mm 4
5 Wnioski: 5
6 Ćwiczenie 3. Izolacja laseczek przetrwalnikujących z gleby Cel ćwiczenia: Izolacja i testowanie przydatności biotechnologicznej laseczek z rodzaju Bacillus występujących w glebie. Odczynniki i podłoża: Agar odżywczy wyciąg mięsny wyciąg drożdżowy pepton NaCl agar woda 1,0 g 2,0 g 5,0 g 5,0 g 20,0 g do 1000 ml; ph=7,4 Płytki mleczne Zmieszać w równych ilościach jałowe mleko odtłuszczone (0-0,5%) oraz jałowy bulion o składzie: pepton (20 g/l), ekstrakt drożdżowy (10 g/l), NaCl (20 g/l), agar (70 g/l). Płytki ze skrobią Skład podłoża mineralnego (MSB): K 2HPO 4 1,0 g (NH 4) 2SO 4 2,0 g MgSO 4 x 7H 2O 0,2 g FeSO 4 x 7H 2O 0,01 g CaCl 2 x 6H 2O 0,02 g MnCl 2 x 4H 2O 0,002 g agar 20,0 g woda do 1000 ml; ph=7,0 Do jednego litra medium dodać 10,0 g skrobi ziemniaczanej lub kukurydzianej i mieszać do uzyskania zawiesiny. Sterylizować w autoklawie. Materiał: świeża próbka gleby Wykonanie (3a): 1. Napełnić łaźnię wodną i podgrzewać do wrzenia. 2. Dodać jałowo (przy palniku) około 2 g gleby do probówki z 20 ml bulionu odżywczego. 3. Zatkać probówkę i umieścić we wrzącej łaźni dokładnie na 12 minut! Poziom wody w łaźni powinien przez cały czas znajdować się nad powierzchnią bulionu, aby całość probówki uległa jednakowemu ogrzewaniu. 4. Wyciągnąć probówkę z łaźni, schłodzić. Inkubować przez tydzień w cieplarce (temp. 32 C). Gotowanie próbki gleby w bulionie odżywczym powoduje zabicie praktycznie wszystkich bakterii, a jednocześnie stymuluje kiełkowanie przetrwalników Bacillus sp. (szok cieplny). Kiełkujące spory przekształcają się w podłożu hodowlanym w komórki wegetatywne dające początek koloniom. 6
7 Następne ćwiczenia (3b): 5. Wysiać ezą materiał na podłoża stałe i inkubować w cieplarce (32 C): a. agar mineralny ze skrobią b. płytki mleczne c. agar odżywczy (kontrola) Następne ćwiczenia (3c): 6. Ocenić morfologię kolonii i wykonać preparaty mikroskopowe: a. Morfologia kolonii: kolonie Bacillus sp. są płaskie, białe, mogą nieco przypominać kolonie grzybów (kształt rhizoidalny). Wiele gatunków wykazuje ruchliwość, dlatego kolonie mogą migrować po szalce pokrywając całą powierzchnię agaru. b. Ocena morfologii komórek pod mikroskopem (barwienie fioletem krystalicznym lub metodą Grama patrz załącznik). c. Wykrywanie zarodników Bacillus sp. za pomocą barwienia Schaeffera-Fultona (patrz załącznik). 7. Ocenić zdolność wyizolowanych kolonii Bacillus sp. do produkcji enzymów pozakomórkowych: a. Wytwarzanie amylaz: na agarze mineralnym ze skrobią. Po tygodniu hodowli nanieść na powierzchnię szalki płyn Lugola. Po usunięciu płynu obserwować obecność stref przejaśnienia wokół kolonii. b. Wytwarzanie proteaz (zdolność do rozkładu kazeiny): na płytkach mlecznych obserwować strefy przejaśnień wokół kolonii. Wyniki: Ocena liczby (lub % powierzchni szlaki porośniętej koloniami) i morfologii kolonii Bacillus rodzaj podłoża agar odżywczy płytki mleczne płytki ze skrobią ilość kolonii morfologia kolonii 7
8 Morfologia komórek Bacillus sp. (barwienie metodą Grama) Wykrywanie zarodników Bacillus sp. (barwienie metodą Schaeffera-Fultona) Testowanie zdolności Bacillus sp. do wytwarzania enzymów zewnątrzkomórkowych rodzaj podłoża wyniki obserwacji płytki mleczne płytki ze skrobią agar odżywczy Wnioski: 8
9 Załącznik BARWIENIE METODĄ Grama Metoda opracowana w 1884 roku przez duńskiego lekarza Hansa Christiana Grama. 1. Na szkiełku podstawowym umieścić 1-2 oczka ezy zawiesiny bakteryjnej. 2. Rozprowadzić zawiesinę ezą po powierzchni szkiełka. Pozostawić w temperaturze pokojowej do wyschnięcia. 3. Utrwalić preparat w płomieniu palnika. 4. Przeprowadzić barwienie wg poniższego schematu: a. Barwienie fioletem krystalicznym (1-2 min.). b. Płukanie wodą. c. Płyn Lugola lub jodyna (0.5-1 min.). d. Płukanie wodą. e. Odbarwienie alkoholem (10-20 sek.). f. Płukanie wodą. g. Barwienie safraniną lub fuksyną zasadową (15-40 sek.). h. Płukanie wodą. 5. Osuszyć preparat bibułą i oglądać pod imersją. Wyniki: komórki bakterii Gram(+) niebiesko-fioletowe, komórki bakterii Gram(-) różowe. Rozprowadzenie hodowli na szkiełku podstawowym, wysuszenie i utrwalenie Barwienie fioletem krystalicznym, płukanie wodą Dodanie płynu Lugola, płukanie wodą Odbarwianie etanolem, płukanie wodą G - G + Dobarwienie fuksyną zasadową lub safraniną, płukanie wodą 9
10 Mechanizm barwienia: 1. Wszystkie komórki bakteryjne, zarówno Gram(+), jak i Gram(-), zabarwiają się fioletem krystalicznym. 2. Dodanie płynu Lugola powoduje, że fiolet reaguje z jodem, w wyniku czego tworzą się stosunkowo duże kompleksy złożone z barwnika i jodu komórki przyjmują zabarwienie granatowe. 3. Płukanie w alkoholu powoduje, że w komórkach Gram(+) następuje zmniejszenie pustej przestrzeni w wielowarstwowych ścianach komórkowych, mających wygląd wielu nałożonych na siebie siatek. W rezultacie kompleksy fioletu krystalicznego z jodem nie ulegają wypłukaniu. W przypadku 1-2 warstwowej ściany bakterii Gram(-) nie jest przeszkodą - alkohol świetnie wypłukuje barwnik. 4. Po zakończonym płukaniu komórki Gram(+) są granatowo-fioletowe, a Gram(-) bezbarwne. 5. Dodatkowy barwnik dobarwia komórki Gram(-), nie zmieniając barwy komórek Gram(+). Zjawisko Gram-chwiejności dotyczy głównie bakterii Gram(+) z rodzajów Bacillus, Clostridium, Corynebacterium, Propionibacterium. Pewne gatunki bakterii rosnąc w starej hodowli w późnej fazie wzrostu tracą swoją cechę barwliwości. Dzieje się tak na skutek wyczerpania się w pożywce składników niezbędnych do syntezy ściany komórkowej. Podobnie zachowują się bakterie podczas podziału. Działanie czynników, które zaburzają proces syntezy ściany komórkowej (np. penicyliny, cefalosporyny) bądź uszkadzają ścianę komórkową (lizozym) powoduje, że bakterie Gram(+) barwią się ujemnie. BARWIENIE przetrwalników bakteryjnych METODĄ Schaeffera-Fultona Barwniki: * 1% roztwór zieleni malachitowej (rozpuścić bez podgrzewania w 1% fenolu) * 0,5% roztwór safraniny. Procedura: Rozmaz bakteryjny wysuszyć na powietrzu, następnie utrwalić nad płomieniem. Zalać preparat zielenią malachitową i odparować (nie zagotować!) umieszczając preparat na zlewce z gotującą się wodą na 5 minut (w razie potrzeby uzupełnić ilość barwnika na szkiełku). Płukać w wodzie przez 1 minutę. Dobarwić przez 30 sekund roztworem safraniny. Wynik barwienia: przetrwalniki zielone, komórki wegetatywne zabarwione na kolor czerwony. Opisać kształt zarodników i położenie w komórce; wykonać odpowiedni rysunek. 10
11 Ćwiczenie 4. Izolacja bakterii zdolnych do wzrostu w środowiskach narażonych na metale ciężkie (technologie bioługowania) Cel ćwiczenia: izolacja szczepów bakterii metaloopornych z gleby Materiał: próbka gleby (najlepiej pochodząca ze środowiska zdegradowanego) Miejsce pobrania próbki gleby: Odczynniki i podłoża: Agar odżywczy z dodatkiem metali ciężkich wyciąg mięsny 1,0 wyciąg drożdżowy 2,0 pepton 5,0 NaCl 5,0 agar 20,0 woda do 1000 ml; ph=7,4 0,1% roztwór Tween 80 w soli fizjologicznej 0,9% NaCl IZOLACJA SZCZEPÓW METALOOPORNYCH Przygotowanie płytek hodowlanych: Przygotować po 60 ml roztworów metali, wysterylizować w autoklawie: AgNO 3 1 mm (przechowywać w ciemności) CuSO 4 x 5H 2O 20 mm Roztwory przechowywać w 4 C nie dłużej niż 2 tygodnie. Zmieszać roztwory z jałowym, roztopionym agarem odżywczym w stosunku 1:10 (15 ml r-ru metalu ml agaru odżywczego; końcowa objętość: 150 ml), wylać na około 10 szalek. Dodatkowo wylać szalki kontrolne bez zawartości metali (patrz: wykonanie) Wykonanie ćwiczenia Wersja A: 1. Przygotować wyciąg glebowy (10 g gleby wytrząsać w 90 ml soli fizjologicznej z dodatkiem Tweenu przez około 30 minut, odstawić na 1 minutę do opadnięcia większych cząstek). 2. Następnie przygotować szereg 10-krotnych rozcieńczeń w soli fizjologicznej ( ) po 1 ml rozcieńczenia na 9 ml soli fizjologicznej. Wyciąg glebowy traktujemy jako rozcieńczenie
12 3. Wykonać posiew powierzchniowy (mazany) na agarze po 0,1 ml każdego z rozcieńczeń. Wykonać posiewy badane (na płytkach z metalami) oraz kontrolne (płytki z agarem odżywczym) dla każdego rozcieńczenia. 4. Inkubować hodowle przez h w temperaturze C. 5. Dokonać analizy wyników. Wersja B (z użyciem metody replik): 1. Jak w wersji A. 2. Jak w wersji A. 3. Wykonać posiew powierzchniowy (mazany) na agarze po 0,1 ml każdego z rozcieńczeń tylko na płytkach kontrolnych (agar odżywczy). 4. Inkubować hodowle przez h w temperaturze C. 5. Policzyć wyrosłe kolonie, opisać ich morfologię, wyniki umieścić w tabeli. 6. Następnie wykonać repliki uzyskanych hodowli za pomocą stempla welwetowego na płytkach z dodatkiem metali. Inkubować hodowle przez kolejne h w temperaturze C. 7. Policzyć wyrosłe kolonie. Wyniki zebrać w tabeli i przeanalizować. 8. Wybrać po jednej kolonii dla każdego badanego metalu i wykonać badanie metalooporności, MIC oraz eliminacji plazmidu oporności na metal (patrz: poniżej). Wyniki: Określenie liczby kolonii (CFU) na poszczególnych szalkach rozcieńczenie wyciągu glebowego liczba kolonii (CFU) agar odżywczy (K-) agar odżywczy + Ag rozcieńczenie wyciągu glebowego liczba kolonii (CFU) agar odżywczy (K-) agar odżywczy + Cu
13 Wnioski: 13
14 Ćwiczenie 5. Wykorzystanie metody płytek gradientowych w biotechnologii: selekcja drobnoustrojów metaloopornych; badanie tempa eliminacji plazmidów oraz wyznaczanie wartości MIC (technologie bioługowania) I. Selekcja drobnoustrojów metaloopornych metodą płytek gradientowych 1. Przygotować roztwory zapasowe metali w podanych poniżej stężeniach, wysterylizować w autoklawie. Zmieszać z agarem odżywczym w stosunku 1:10, wylać na płytki ustawione pod takim kątem, aby uformować skos przez całą średnicę, zostawić do zestalenia. stock stężenie wyjściowe AgNO mm 10 mm (przechowywać w ciemności) CuSO 4 x 5H 2O 1 M 100 mm 2. Następnie wylać górną warstwę pożywki czysty agar odżywczy, tak aby przykryć całą powierzchnię płytki. Zostawić do zestalenia. 3. Badane hodowle rozcieńczyć 10-krotnie w czystym bulionie (1 ml) i wysiać po 0,1 ml na płytki. 4. Inkubować płytki przez 24 h w temp C. odczytać wyniki i sformułować wnioski. Wyniki: Wnioski: 14
15 II. Wyznaczanie minimalnego stężenia hamującego 1. Przygotować roztwory zapasowe metali w podanych poniżej stężeniach, wysterylizować w autoklawie: stock stężenie wyjściowe (w pierwszej probówce) AgNO mm 10 mm (przechowywać w ciemności) CuSO 4 x 5H 2O 1 M 100 mm ZnSO 4 x 7H 2O 1 M 100 mm 2. Sporządzić szereg rozcieńczeń roztworu metalu w bulionie odżywczym w dziesięciu sterylnych probówkach: do każdej probówki dodać po 5 ml bulionu; do pierwszej probówki dodać 4 ml bulionu + 1 ml roztworu stock metalu, dokładnie wymieszać. Wykonać szereg rozcieńczeń przenosząc po 5 ml mieszaniny do kolejnej probówki (probówki 1-9). Z dziewiątej probówki usunąć 5 ml nadmiaru do śmieci. Ostatnią próbówkę potraktować jako kontrolę wzrostu. 3. Probówki zaszczepić kroplą (ok. 50 µl) zawiesiny izolatu glebowego. 4. Inkubować probówki w cieplarce (temp. 30 C) przez h. 5. Odczytać wyniki wyznaczyć MIC na podstawie zmętnienia. Wyniki: Obserwacja wzrostu mikroorganizmów glebowych w szeregu rozcieńczeń metali nr probówki stężenie AgNO 3 wzrost (+/-) stężenie CuSO 4 wzrost (+/-) stężenie ZnSO 4 wzrost (+/-) Minimalne stężenie hamujące Ag + Cu 2+ Zn 2+ Wnioski: 15
16 III. Badanie tempa eliminacji plazmidów 1. Przygotować 2 kolbki lub probówki z 4 ml bulionu odżywczego. Pierwsza posłuży jako kontrola. Do drugiej dodać ciprofloksacynę lub nowobiocynę do uzyskania końcowego stężenia 15 µg/ml bulionu. 2. Zaszczepić obie kolbki 0,5 ml zawiesiny izolowanej kolonii. 3. Inkubować obie hodowle z wytrząsaniem przez h: hodowlę kontrolną w temp. 25 C (eliminacja spontaniczna), hodowlę badaną w temp. 40 C (eliminacja indukowana ciprofloksacyną/nowobiocyną i szokiem termicznym). 4. Każdą hodowlę rozcieńczyć 10-krotnie w czystym bulionie (1 ml) i wysiać po 0,1 ml na płytki z odpowiednim metalem oraz na płytki kontrolne (bulion odżywczy). 5. Inkubować płytki przez 24 h w temp C. 6. Podać ogólną liczbę kolonii (CFU) na 1 ml pożywki (tabela), a następnie wyznaczyć stopień eliminacji plazmidów metalooporności (procentowy udział bakterii, które utraciły plazmid) wg poniższego schematu. Opracować wnioski. próbka kontrolna próbka badana agar odżywczy (A) agar + metal (B) agar odżywczy (C) agar + metal (D) Ag + Cu 2+ Zn 2+ Spontaniczna utrata plazmidów = [(A-B) / A] x 100 Spontaniczna i indukowana utrata plazmidów = [(C-D) / C] x 100 Wnioski: 16
17 Ćwiczenie 6. Biotechnologia enzymów (I): oznaczanie aktywności amylaz w hodowli Bacillus cereus Cel ćwiczenia: Detekcja i oznaczanie aktywności enzymów amylolitycznych metodą Nelsona wytwarzanych pozakomórkowo w hodowli Bacillus cereus. Odczynniki i podłoża: Bufor fosforanowy o ph=6,4: roztwór A (11,87 g Na 2HPO 4 /1000 ml) + roztwór B (9,07 g KH 2PO 4 /1000 ml) w stosunku 73,9 ml A i 26,4 ml B. Odczynnik miedziowy Bezpośrednio przed użyciem zmieszać roztwory A i B w stosunku 1:4: A (36 g Na 2SO 4 i 4 g CuSO 4 /200 ml), B (16 g NaHCO 3 i 144 g Na 2SO 4 /800 ml). Odczynnik arsenowo-molibdenowy Nelsona A: 25 g molibdenianu amonu rozpuścić w 450 ml wody, dodać 21 ml stęż. H 2SO 4. B: 3 g arsenianu sodu rozpuścić w 25 ml wody; połączyć roztwory A i B). Gotowy odczynnik przechowywać w ciemności w temp. pokojowej. Przed użyciem dokładnie zmieszać (!) i ogrzać do 37 C. 1% roztwór skrobi w buforze fosforanowym (ph=6,4). Materiał: 48-godzinna hodowla wytrząsana B. cereus (PCM 2019) na podłożu skrobiowym w temperaturze 30 C. Wykonanie ćwiczenia: 1. Odwirować hodowlę (1800 x g, 10 ), pobrać supernatant do oznaczeń. 2. Przygotować serię rozcieńczeń płynu pohodowlanego w buforze fosforanowym w końcowej objętości 0,5 ml: 1:5, 1:10, 1:20, 1:20 (próbka kontrolna). Przygotować również próbkę nierozcieńczoną. 3. Inkubować próbki badane oraz próbkę kontrolną przez 10 w temperaturze 30 C. 4. Do próbki kontrolnej dodać 1 ml odczynnika miedziowego w celu związania cukrów redukujących. 5. Dodać do wszystkich próbek (także kontrolnej) po 0,5 ml roztworu skrobi w buforze fosforanowym, inkubować próbki przez 30 w temperaturze 30 C. 6. Dodać tylko do próbek badanych po 1 ml odczynnika miedziowego. 7. Inkubować wszystkie próbki przez 30 we wrzącej łaźni wodnej, a następnie schłodzić w zimnej wodzie. 17
18 8. Dodać po 1 ml odczynnika Nelsona mieszając do rozpuszczenia osadu tlenku miedzi i ustania wydzielania się pęcherzyków CO Uzupełnić wodą do 10 ml, zmieszać, a następnie dokonać pomiary absorbancji na spektrofotometrze przy fali o długości 650 nm (próbki zerować na próbkę kontrolną!). 10. Odczytać wyniki z krzywej standardowej glukozy * 11. Obliczyć aktywność enzymatyczną amylaz w 1 ml nierozcieńczonej próbki na podstawie wzoru: S rozcieńczenie próbki aktywność [I] = μg glukozy x S x 2/180 Definicja: 1 jednostka aktywności enzymatycznej odpowiada ilości enzymu, która w ciągu 30 minut powoduje, w temperaturze 30 C, uwolnienie za skrobi cukrów redukujących w ilości równej 1 μm glukozy. * Przygotowanie standardów: przygotować serię rozcieńczeń roztworu glukozy (10 mg/ml) od 0 do 1,5 mg/ml (0, 0,25; 0,5; 0,75; 1,0; 1,5). Postępować ze standardami wg schematu punkty Wyniki: Wartość absorbancji dla standardów stężenie glukozy [mg/ml] 0 0,25 0,5 0,75 1 1,5 absorbancja Wartość absorbancji dla próbek badanych rozcieńczenie nierozcieńczona 1:5 1:10 1:20 1:20 (kontrola) absorbancja stężenie 18
19 Krzywa wzorcowa Stężenie glukozy w badanej hodowli wynosi: Aktywność enzymatyczna amylaz w badanej hodowli wynosi Wnioski: 19
20 Ćwiczenie 7. Biotechnologia enzymów (II): oznaczanie aktywności proteaz w hodowli Bacillus subtilis Cel ćwiczenia: detekcja i oznaczanie aktywności enzymów proteolitycznych wytwarzanych pozakomórkowo w hodowli Bacillus subtilis. Materiał: 48-godzinna hodowla wytrząsana B. subtilis ssp. subtilis (PCM 2021) na bulionie prostym w temperaturze 30 C. Odczynniki i podłoża: 2% roztwór kazeiny w buforze Tris (ph=8,0) lub 2% wodny roztwór albuminy Odczynnik Folina-Ciocalteu (rozcieńczyć ex tempore wodą destylowaną w stosunku 1:4) 5% roztwór TCA 6% roztwór Na 2CO 3 Zasada metody: odczynnik Folina-Ciocalteu (mieszanina kwasu fosfowolframowego i fosfomolibdenowego) powoduje utlenianie grup fenolowych obecnych w tyrozynie z wytworzeniem barwnego produktu. Wykonanie ćwiczenia: 1. Odwirować 48-godzinną hodowlę (3000 g, 15 ), pobrać supernatant do oznaczeń. 2. Przygotować serię rozcieńczeń płynu pohodowlanego w końcowej objętości 1 ml: 1:0 (nierozc.), 1:2, 1:5, 1:10, 1:10 (próbka kontrolna). 3. Do każdej próby dodać po 2 ml roztworu kazeiny (ogrzanego do temp. 30 C). 4. Do próbki kontrolnej dodać dodatkowo 5 ml TCA. 5. Inkubować wszystkie próbki przez 15 minut w temp. 30 C. 6. Dodać po 5 ml TCA do prób badanych. 7. Przenieść po 1,5 ml do probówek typy eppendorf i zwirować przy x g przez 5 minut. 8. Ostrożnie pobrać po 1 ml przesączu (tak, by nie zaciągnąć osadu) i przenieść do nowych probówek (szklanych). 9. Do wszystkich prób dodać po 4 ml roztworu węglanu sodu i po 1 ml rozcieńczonego (!) odczynnika Folina-Ciocalteu. 10. Wykonać pomiary absorbancji na spektrofotometrze przy fali o długości 750 nm (próbki zerować na próbę kontrolną). 20
21 Definicja: 1 jednostka aktywności enzymatycznej odpowiada ilości enzymu, która w ciągu 1 minuty powoduje, w temperaturze 30 C, uwolnienie z kazeiny 1 μm tyrozyny. Wyniki: 1:0 1:2 1:5 1:10 1:10 (kontrola) absorbancja Odczytać z krzywej standardowej zawartość tyrozyny uwolnionej przez proteazy, a następnie obliczyć aktywność enzymatyczną proteaz w badanym płynie pohodowlanym na podstawie wzoru: gdzie: akt. proteaz [µm tyrozyny/min.] = µg tyrozyny x rozc. x 8 / 181 x 15 8 przelicznik wynikający z rozcieńczenia próby, 181 masa molowa tyrozyny, 15 czas inkubacji prób (enzymatycznej aktywności proteaz). Wnioski: 21
22 Ćwiczenie 8. Technologie fermentacyjne (I): fermentacja etanolowa produkcja wina i piwa Cele ćwiczenia: wykorzystanie fermentacji etanolowej do produkcji piwa, ocena morfologiczna szczepów drożdży, zapoznanie z techniką immobilizacji komórek drobnoustrojów. Podłoże ZT: brzeczka słodowa 16 Blg ekstrakt drożdżowy glukoza woda 500 ml 4,0 g 20,0 g do 1000 ml Bulion Sabouraud: pepton 10,0 g glukoza 20,0 woda 1000 ml; ph=5,7 Materiał: 48-godzinna hodowla wytrząsana drożdży piwnych (Saccharomyces cerevisiae ssp. uvarum var. carlsbergensis) na podłożu ZT lub na bulionie Sabouraud (podłoża do namnażania grzybów mikroskopowych). IMMOBILIZACJA KOMÓREK DROŻDŻY 1. Odwirować hodowlę drożdży (1500 rpm, 10 ), przemyć jałowym roztworem 0,9% NaCl, ponownie odwirować. Osad zawiesić w 25 ml 0,9% NaCl. Pobrać po 10 ml zawiesiny komórek do eksperymentu. 2. Zawiesinę komórek połączyć z 4% roztworem alginianu sodu w 0,9% NaCl w stosunku 1:1, zmieszać delikatnie sterylną bagietką. Przenieść mieszaninę do strzykawki. 3. Wprowadzać kroplami zawiesinę komórek z alginianem do 10 ml jałowego roztworu 0,2 M CaCl 2 stale mieszając. W celu utwardzenia powstających kulek, pozostawić roztwór przez Przemyć otrzymane kulki jałowym roztworem 0,9% NaCl. 5. Zawiesiny komórek (immobilizowane i kontrolne) przenieść do kolb ze 150 ml brzeczki słodowej 8 Blg. Inkubować bez wytrząsania w temperaturze 28 C przez 3 dni. 6. Określić stopień odfermentowania brzeczki oraz przybliżoną zawartość alkoholu w otrzymanym piwie na podstawie poniższego wzoru: (Blg początk. Blg końc.) : 1,938 = potencjalna objętość alkoholu [%] Wynik: 22
23 OCENA MORFOLOGII DROŻDŻY A. BADANIE ŻYWOTNOŚCI HODOWLI Wykonać preparat przyżyciowy barwiony 1% roztworem błękitu metylenowego. Wyznaczyć żywotność hodowli poprzez określenie liczby komórek żywych i martwych. Opisać morfologię komórek, jakiego typu skupiska tworzą, odnaleźć i policzyć komórki pączkujące. Proporcja komórek żywych do martwych: B. BARWIENIE PRZYŻYCIOWE GLIKOGENU W kropli płynu Lugola rozprowadzić oczko ezy hodowli drożdży. Przykryć preparat szkiełkiem nakrywkowym i po 2-3 oglądać pod imersją. C. BARWIENIE PRZYŻYCIOWE WAKUOLI Umieścić zawiesinę komórek drożdży w kropli czerwieni obojętnej, przykryć szkiełkiem nakrywkowym i natychmiast oglądać. Barwnik jest aktywnie pochłaniany przez wakuole nadając im czerwony kolor, który blaknie po jest wydalany. D. BARWIENIE KROPELEK TŁUSZCZY SUDANEM III Na szkiełku zmieszać kroplę starej hodowli drożdży z kroplą Sudanu III (Sudan III 0,01 g, 96% etanol i glicerol 1:1/100 ml), przykryć szkiełkiem nakrywkowym i odstawić na kilka minut. Na tle nie zabarwionej protoplazmy widoczne są kropelki tłuszczu zabarwione na kolor czerwony. 23
24 E. BARWIENIE ZIAREN WOLUTYNY METODĄ ALBERTA (w modyfikacji Laybourna) Utrwalić preparat drożdży w płomieniu palnika, barwić odczynnikiem Alberta przez 5 (skład: błękit toluidyny 0,15 g; zieleń malachitowa 0,20 g; lodowaty kwas octowy 1 cm 3 ; etanol 96% 2 cm 3 ; woda do 100 cm 3 ). Wysuszyć bez spłukiwania wodą (w ukośnym położeniu), barwić przez 1 płynem Lugola, delikatnie spłukać wodą. Gotowy preparat oglądać pod imersją. Ziarna wolutyny mogą być bardzo drobne, zabarwione na ciemnozielono-granatowy kolor (w celu uwidocznienia należy regulować śrubą mikrometryczną), protoplast przezroczysty lub lekko zabarwiony na kolor zielonkawy. F. BARWIENIE PRZYŻYCIOWE MITOCHONDRIÓW Przygotować w 3 probówkach umiarkowanie gęstą zawiesinę drożdży w wodzie w ilościach: 9 cm 3 ; 9,5 cm 3 ; 0,1 cm 3 i dopełnić do 10 ml barwnikiem (0,1% roztwór błękitu Janusowego). Końcowe stężenie błękitu Janus wynosi odpowiednio: 0,01%, 0,005% i 0,001%. Pobrać ezą na szkiełka podstawowe otrzymane zawiesiny drożdży, przykryć preparaty szkiełkami nakrywkowymi i oglądać pod imersją. Reakcja barwna jest wywołana obecnością w mitochondriach oksydazy cytochromowej, która utrzymuje barwnik w obrębie mitochondrium w postaci utlenionej (barwnej), podczas gdy w cytoplazmie barwnik jest redukowany do postaci bezbarwnej. Wnioski (z całego ćwiczenia): 24
25 Ćwiczenie 9. Nadprodukcja kwasu glutaminowego w hodowli Corynebacterium glutamicum Cel ćwiczenia: ocena zdolności bakterii C. glutamicum do produkcji kwasu glutaminowego. Corynebacterium glutamicum (syn. Micrococcus glutamicum) jest gram-dodatnią, wolnożyjącą bakterią glebową. Należy do grupy bakterii tlenowych o wysokiej zawartości guaniny i cytozyny (ok. 53% GC). Są to bakterie szybko rosnące, nieruchliwe; nie wytwarzają spor. Komórki C. glutamicum zwykle mają kształt maczugowaty (z grec. coryne maczuga), czyli wydłużonych pałeczek ze zgrubieniami na końcach. Często formują także V-kształtne struktury, będące rezultatem podziałów komórkowych (nierównomierne rozdzielanie się komórek). Komórki C. glutamicum mogą też agregować w nieco większe skupiska o nieregularnym wyglądzie - przypominającym znaki chińskie. Bakterie z rodzaju Corynebacterium sp. tworzą wraz z rodzajami Mycobacterium sp. i Nocardia sp. grupę (tzw. grupa CMN) bakterii o charakterystycznym składzie ściany komórkowej. Jest ona zbudowana podobnie jak u bakterii Gram(-), jednak do mureiny przyłączone są reszty arabinogalaktanowe tworzące łańcuchy wielocukrowe. Ponadto dołączone są do niego charakterystyczne lipidy - głównie kwasy mikolinowe. Są to rozgałęzionymi 3-hydroksykwasami, podstawionymi łańcuchami alifatycznymi. U maczugowców mają one najczęściej atomów węgla. Komórki mogą także zawierać ciałka inkluzyjne (ziarna metachromatyczne) zbudowane z nieorganicznych polifosforanów (np. wolutyny). Nie są one związane z błoną i mogą stanowić rezerwę energetyczną. Obecność granuli daje po wybarwieniu obraz nieregularnie wybarwionych segmentów. Podłoże hodowlane: agar odżywczy (temp. hodowli: 30 C). Podłoże produkcyjne: melasa 16 Blg 800 ml NH 4SO 4 5,0 Tween 40 1,0 olej arachidowy 5,0 woda do 1000 ml Po sterylizacji dodać roztwór penicyliny lub cefalosporyny (końcowe stężenie: 50 μg/ml) Materiał: 3-dniowa hodowla Corynebacterium glutamicum (PCM 1946) na podłożu produkcyjnym. Hodowla wstrząsana (warunki tlenowe), temp C. 25
26 ANALIZA MIKROSKOPOWA Corynebacterium glutamicum (PCM 1946): Pobrać z hodowli na podłożu zestalonym pojedynczą kolonię, wykonać preparat utrwalony wpłomieniu palnika, wybarwić fioletem krystalicznym. Obserwować pod imersją, wykonać rysunki. WYKRYWANIE KW. GLUTAMINOWEGO I LIZYNY W HODOWLI C. glutamicum TECHNIKĄ CHROMATOGRAFII CIENKOWARSTWOWEJ: Faza nieruchoma: płytki chromatograficzne pokryte żelem krzemionkowym GF Faza ruchoma: mieszanina n-butanol-kwas octowy-woda (4:1:1) Roztwory wzorcowe: roztwory 0,5% kwasu glutaminowego i lizyny w wodzie Wykonanie oznaczenia: 1. Na płytkę nanieść po 5, 10 i 15 μl roztworów wzorcowych oraz po 10 μl płynu pohodowlanego (przygotować rozcieńczenia w wodzie: 0-, 2- i 10-krotne). 2. Umieścić płytkę w komorze chromatograficznej nasyconej parami fazy rozwijającej. 3. Po rozwinięciu zaznaczyć na chromatogramie czoło i wysuszyć w temperaturze pokojowej. 4. Następnie spryskać odczynnikiem wywołującym (0,3% kwaśny roztwór ninhydryny w butanolu). 5. Po wysuszeniu chromatogramu wyznaczyć współczynniki R f kwasu glutaminowego i lizyny, porównać z chromatogramem badanego roztworu, oszacować stężenie wykrywanych aminokwasów w płynie hodowlanym. Wyniki: lizyna (0,5%) kwas glutaminowy (0,5%) płyn pohodowlany (10 µl) 5 µl 10 µl 15 µl 5 µl 10 µl 15 µl nierozc. 2 x rozc. 10 x rozc. R f stężenie aminokwasów w hodowli Lys Glu 26
27 Wnioski: 27
28 Ćwiczenie 10. Produkcja kwasów organicznych: oznaczanie zawartości kwasu cytrynowego w hodowlach Aspergillus niger Cel ćwiczenia: detekcja produktów fermentacji cytrynianowej w hodowli Aspergillus niger Odczynniki i podłoża: Podłoża produkcyjne (do produkcji kwasu cytrynowego przez szczepy A. niger): Podłoże melasowe: melasa zagęszczona kwas fosforowy 85% żelazocyjanek potasu woda 300,0 g 0,05 ml 0,4 g do 1000 ml, ph=6,3 Podłoże sacharozowe: sacharoza NH 4NO 3 MgSO 4 KH 2PO 4 FeSO 4 woda 100,0 g 3,0 g 1,0 g 1,0 g ślad do 1000 ml, ph=7,0 Warunki hodowli: 5-7 dni w temperaturze 30 C, hodowla wgłębna lub powierzchniowa Opis wyglądu makroskopowego grzybni: Wykrywanie kwasu szczawiowego: Kroplę płynu pofermentacyjnego zmieszać z nasyconym roztworem chlorku wapnia na szkiełku zegarkowym. Pojawiają się kryształy szczawianu wapnia. Wynik: 28
29 Oznaczanie zawartości kwasu cytrynowego w medium pofermentacyjnym (na podstawie FP V): W metodzie tej oznaczana jest tzw. ogólna kwasowość, czyli suma wszystkich kwasów organicznych powstających w trakcie przeprowadzonej fermentacji cytrynianowej. Ponad 90% stanowi kwas cytrynowy, pozostałą część stanowią głównie kwas szczawiowy (produkt uboczny) oraz kwas glukonowy. Wykonanie ćwiczenia: 1. 2 ml płynu pofermentacyjnego rozcieńczyć do 20 ml wodą. 2. Dodać ok. 0,05 ml roztworu fenoloftaleiny i miareczkować roztworem wodorotlenku sodu (0,05 mol/l). 1 ml roztworu NaOH 0,05 mol/l odpowiada 3,02 mg bezwodnego kwasu cytrynowego. Typowa hodowla powinna wykazywać kwasowość ogólną na poziomie odpowiadającym około mg czystego kwasu cytrynowego na 100 ml hodowli. Wyniki i wnioski: 29
30 Ćwiczenie 11. Technologie biotransformacyjne: badanie właściwości ketogennych bakterii Gluconobacter suboxydans (produkcja kwasu octowego i kwasu glukonowego) Cel ćwiczenia: charakterystyka zdolności szczepów przemysłowych Gluconobacter suboxydans do biotransformacji glukozy i etanolu do kwasów organicznych. I. Badanie morfologii bakterii octowych Gluconobacter suboxydans Sporządzić preparat mikroskopowy, utrwalić i wybarwić fioletem krystalicznym. Obserwować pod imersją. Podłoże do hodowli i namnażania Gluconobacter suboxydans: trypton ekstrakt drożdżowy glukoza K 2HPO 4 CaCO 3 agar woda 10,0 g 5,0 g 20,0 g 1,0 g 1,0 g 20,0 g do 1000 ml RYSUNEK: komórki o typowej morfologii formy inwolucyjne II. Wykrywanie właściwości ketogennych bakterii octowych Przeprowadzić hodowlę wytrząsaną Gluconobacter suboxydans (3 doby, temp. 28 C) w podłożu zawierającym ekstrakt drożdżowy i dodatek 5% glicerolu. Do 2 ml hodowli dodać kilka kropli 20% roztworu CuSO 4 i podgrzać. Wytrącanie pomarańczowego osadu wskazuje na zachodzenie procesu redukcji miedzi (II) przez powstały w podłożu dihydroksyaceton. Podłoże z glicerolem: ekstrakt drożdżowy glicerol woda 50,0 g 50,0 g do 1000 ml, ph=6,0-6,5. 30
31 Obserwacje: III. Produkcja kwasu glukonowego i octowego przez bakterie G. suboxydans 1. Oznaczanie zawartości kwasu octowego w hodowli Gluconobacter suboxydans: Materiał: 3-dniowa hodowla wytrząsana Gluconobacter suboxydans na brzeczce z dodatkiem 3% etanolu (temp C). Podłoże z etanolem: brzeczka 5 Blg 1000 ml etanol 30,0 g Wykonanie oznaczenia: po 3 dobach hodowli określić zawartość kwasu octowego za pomocą miareczkowania 20 ml rozcieńczonego (1:10) płynu pofermentacyjnego 0,1 M NaOH wobec fenoloftaleiny. Podać stężenie lub zawartość kwasu octowego na 100 ml hodowli. 2. Oznaczanie zawartości kwasu glukonowego w hodowli Gluconobacter suboxydans: Materiał: hodowla 3-dobowa wstrząsana na podłożu półsyntetycznym z dodatkiem glukozy (temp. 28 C). Podłoże z glukozą: ekstrakt drożdżowy glukoza (NH 4) 2HPO 4 KH 2PO 4 MgSO 4 x 7H 2O woda 1,0 g 100,0 g 1,0 g 1,0 g 0,1 g do 1000 ml, ph=4,8-5,0. Wykonanie oznaczenia: po 3 dobach hodowli określić zawartość kwasu glukonowego za pomocą miareczkowania 20 ml rozcieńczonego (1:10) płynu pofermentacyjnego 0,1 M NaOH w obecności fenoloftaleiny. Podać stężenie lub zawartość kwasu glukonowego w 100 ml hodowli (UWAGA: uwzględnić wyjściową kwasowość podłoża hodowlanego).. 31
32 IV. PRODUKCJA OCTU JABŁKOWEGO Składniki: ½ kg skórek z jabłek (można tez dodać skórkę z gruszek) 2 łyżeczki cukru 1 szklanka wody Przygotowanie: Skórki z jabłek włożyć do słoika, dodać cukier i zalać letnią wodą. Zabezpieczyć gazą, odstawić w ciepłe miejsce. Gdy płyn zrobi się kwaśny i klarowny, przecedzić, przelać do butelki i zakorkować. 32
33 Ćwiczenie 12. Technologie z udziałem bakterii kwasu mlekowego: wykorzystanie fermentacji mlekowej, masłowej i propionowej Cel ćwiczenia: Analiza mikrobiologiczno-biochemiczna fermentowanych produktów spożywczych. A. Analiza fermentowanych produktów spożywczych Materiał: Hodowle czystych szczepów bakterii kwasu mlekowego Lactobacillus acidophilus i Lactoccus lactis ssp. lactis (PCM 2678) na podłożach zestalonych lub w jałowym mleku oraz produkty spożywcze (kiszona kapusta, kiszone ogórki, kefir, jogurt, żurek itp.). Obserwacje cech morfologicznych bakterii fermentacji mlekowej Wykonać bezpośredni preparat utrwalony i wybarwiony fioletem goryczkowym. Obserwować pod imersją. Opisać morfologię obserwowanych komórek. W przypadku produktów mlecznych (kefir, jogurt) preparat mikroskopowy wykonać wg następującej procedury: probówkę z hodowlą ogrzewać na łaźni wodnej w temperaturze C do momentu oddzielenia się sernika od serwatki. Kilka kropli serwatki pobrać na szkiełko, utrwalić rozmaz w płomieniu, przemyć kilkakrotnie etanolem w celu odtłuszczenia, spłukać wodą, zabarwić fioletem. Obserwować pod imersją. Ocena produktów spożywczych na podstawie podanych poniżej kryteriów kiszonek: Kiszonka bardzo dobra: Stosunek drożdży do bakterii 1: 80 do 200; ph 3,5 Kiszonka dobra : Stosunek drożdży do bakterii 1: 3 do 30; ph 4,5 Przy większej ilości drożdży i wyższym ph kiszonki są złej jakości. Wytwarzanie acetoiny (odczyn Voges-Proskauera) Przenieść 1 ml materiału do probówki, dodać 0,5 ml 0,6% alkoholowego roztworu α-naftolu i 0,5 ml 40% KOH. Wstrząsnąć i inkubować probówkę przez 20 minut w łaźni wodnej w temp. 37 C. 33
34 Wyniki: JOGURT obraz mikroskopowy ph D : B Wytwarzanie acetoiny KEFIR obraz mikroskopowy ph D : B Wytwarzanie acetoiny MAŚLANKA obraz mikroskopowy ph D : B Wytwarzanie acetoiny ŻUREK obraz mikroskopowy ph D : B Wytwarzanie acetoiny 34
35 OGÓRKI KISZONE obraz mikroskopowy ph D : B Wytwarzanie acetoiny KAPUSTA KISZONA obraz mikroskopowy ph D : B Wytwarzanie acetoiny obraz mikroskopowy ph D : B Wytwarzanie acetoiny D : B stosunek drożdży do bakterii Wnioski: 35
36 B. Oznaczanie zawartości kwasu mlekowego w hodowli bakteryjnej Do celów spożywczych i farmaceutycznych kwas mlekowy pozyskiwany jest na drodze biologicznej z hodowli czystych kultur bakterii fermentacji mlekowej przeprowadzających homofermentację (kwas mlekowy jest głównym produktem fermentacji), np. Lactobacillus plantarum. Stosowane podłoża zawierają dodatek węglanu wapnia, dzięki czemu powstający kwas mlekowy jest neutralizowany, a po zakończeniu fermentacji odzyskiwany z mleczanu wapnia za pomocą kwasu siarkowego. Roztwór kwasu mlekowego po oddzieleniu od gipsu poddawany jest oczyszczaniu i zagęszczeniu do 50% - jest to gotowa postać trafiająca na rynek. Wydajność praktyczna tego bioprocesu wynosi 80-90% wydajności teoretycznej. Materiał badany: hodowla szczepu Lactobacillus plantarum w odtłuszczonym mleku, prowadzona w warunkach beztlenowych, bez wytrząsania, w temperaturze 30 C przez 7 dni. Oznaczanie zawartości kwasu mlekowego: 1. Zacier pofermentacyjny (serwatkę) oddzielić od sernika oraz osadu. 2. Do kolby odmierzyć 10 ml zacieru oraz 10 ml 0,5 M Na 2CO Mieszaninę podgrzać do wrzenia i przesączyć przez sączek. 4. Następnie do 10 ml przesączu, zawierającego 5 ml zacieru i 5 ml roztworu węglanu sodu, dodać równoważną ilość (5 ml) 0,5 M H 2SO 4. Gotować mieszaninę przez ok. 3 minuty w celu odpędzenia dwutlenku węgla. 5. Gotowy roztwór miareczkować 0,1 M NaOH wobec fenoloftaleiny. 6. Podać zawartość procentową kwasu mlekowego w badanym materiale. 1 ml 0,1 M NaOH odpowiada 9,0 mg kwasu mlekowego. (CH 3CHOHCOO) 2Ca + 2 Na 2CO 3 2 CH 3CHOHCOONa + Na 2CO 3 + CaCO 3 2 CH 3CHOHCOONa + Na 2CO H 2SO 4 2 CH 3CHOHCOOH + 2 Na 2SO 4 + CO 2 + H 2O Wyniki: Zawartość kwasu mlekowego w badanej hodowli wynosi: 36
37 C. Detekcja produktów fermentacji masłowej i propionowej Materiał: 7-dniowy nastaw fermentacyjny bakterii masłowych (w wysokim słupie pożywki pod parafiną) w temp. 35 C. Skład podłoża fermentacyjnego: sacharoza kiełki słodowe CaCO 3 woda ph=7,0 5,0 g 1,0 g 2,0 g 100 ml Wykonanie ćwiczenia: 1. opisać makroskopowy wygląd nastawu fermentacyjnego: obserwować pojawienie się zmętnienia, gazów oraz zapachu gnilnego. 2. Wykonać preparat utrwalony komórek wegetatywnych (barwienie fioletem krystalicznym) oraz przetrwalników (barwienie metodą Schaeffer-Fultona). 3. Wykrywanie obecności kwasu masłowego: a. ocena organoleptyczna: sprawdzić obecność zapachu zjełczałego masła; b. ocena wizualna: tworzenie maślanu żelaza (do probówki z 5 ml nastawu fermentacyjnego dodać 2 ml 5% FeCl 3 i podgrzać w łaźni wodnej) powstaje brązowe zabarwienie. c. przeprowadzenie kwasu masłowego w ester etylowy: do 2 ml nastawu fermentacyjnego dodać 0,5 ml 96% etanolu i 1-2 ml stęż. H 2SO 4 (bardzo ostrożnie po ściankach probówki), zmieszać i ogrzać w łaźni wodnej. Maślan etylu powinien spowodować powstawanie zapachu ananasów Ilustracje: 37
38 Wyniki i wnioski: D. Badanie morfologii grzybów strzępkowych obecnych w serach dojrzewających Materiał: próbki różnych typów serów (np. Brie, Camembert, Gorgonzola). Skład pożywek hodowlanych: * Podłoże ZT * Podłoże Sabouraud * Podłoże PL2 Brzeczka 12 Blg 500 ml (Neo)pepton 10 g Brzeczka 12 Blg 100 ml Ekstr. drożdżowy 4 g Glukoza 40 g Aminobak 5 g Glukoza 4 g Agar 20 g Ekstrakt drożdżowy 5 g Agar 25 g Woda 1000 ml KH 2PO 4 5 g woda do 1000 ml ph=5,8-7,4 Glukoza 20 g ph=6,6-7,0 Agar 25 g Woda do 1000 ml ph=5,8-6,0 Wykonanie ćwiczenia: Na szalkach z podłożem hodowlanym wykonać posiew (metodą odciskową) z badanego materiału. Po tygodniu ocenić wzrost grzybów, opisać morfologię plechy oraz wykonać preparaty mikroskopowe. Obserwacje:.. Ilustracje: 38
39 Wnioski: 39
40 Ćwiczenie 13. Procesy biosyntezy w biotechnologii: produkcja dekstranu przez bakterie Leuconostoc mesenteroides Cel ćwiczenia: Analiza mikrobiologiczna oraz badanie zdolności kultur przemysłowych bakterii Leuconostoc mesenteroides do produkcji dekstranu. Biosynteza zewnątrzkomórkowych polisacharydów przez drobnoustroje została wykorzystana praktycznie do otrzymywania około 20 produktów. Są nimi zarówno homo- jak i heteropolimery oparte na jednostkach glukozowych. Najważniejszymi wielocukrami otrzymywanymi metodami biotechnologicznymi na skalę przemysłową są: dekstran, ksantan, alginian, kurdlan, pululan, skleroglukan. Wykorzystanie polisacharydów obejmuje przemysł spożywczy, farmaceutyczny, chemiczny i kosmetyczny. Najważniejszym polisacharydem produkowanym na skalę przemysłową jest dekstran. Do produkcji dekstranu wykorzystywane są najczęściej szczepy bakterii mlekowych Leuconostoc mesenteroides. Są ziarniaki rosnące w postaci dwoinek lub krótkich łańcuszków. Należą do bakterii heterofermentatywnych. Nie wykazują zdolności do ruchu, są względnymi beztlenowcami. Szczepy produkcyjne wytwarzają dekstran liniowy zawierający ok. 95% wiązań 1,6-α i nieliczne rozgałęzienia boczne w pozycjach 1,3 i 1,4. Masa cząsteczkowa dekstranów wynosi od kilku tysięcy do kilku milionów Da i zależy od warunków hodowli. Enzym umożliwiający biosyntezę dekstranu to dekstranosacharaza (2-glukozylotransferaza 1,6-α-glukan:D-fruktoza). Enzym ten, w procesie transglikozylacji, przenosi resztę glukozy (z udziałem UDP) z sacharozy na odpowiedni akceptor (niskocząsteczkowy dekstran, maltozę lub inną cząsteczkę sacharozy): sacharoza + UDP = UDP-glukoza + fruktoza UDP-glukoza + akceptor = akceptor-glukoza + UDP Podłoże produkcyjne zawiera sacharozę oraz sole mineralne i źródło azotu organicznego (ekstrakt drożdżowy). Optymalne ph dla enzymu wynosi 6,5-7,0, a temperatura 23 C. Natomiast optimum dla wzrostu L. mesenteroides wynosi 30 C. Bioproces prowadzony jest bez napowietrzania metodą hodowli okresowej do 48 h. Stosowana jest także hodowla ciągła oraz synteza z wykorzystaniem izolowanego enzymu w postaci immobilizowanej. Dekstran surowy stanowi mieszaninę cząsteczek o różnej masie zawierających mln jednostek glukozowych. Efekt biologiczny dekstranu zależy od wielkości jego cząsteczek. Do celów 40
41 leczniczych wykorzystuje się dekstrany o małej masie i w miarę jednorodnej zakresie. Stosowane są dwa typy dekstranu: średniocząsteczkowy (średnia masa cząsteczkowa tys. Da) i niskocząsteczkowy (śr. masa tys. Da). Dekstran o masie kda stosowany jest jako środek osoczozastępczy w postaci 6% roztworu w soli fizjologicznej lub glukozie. 10% roztwór dekstranu stosowany do wczesnego uzupełniania płynów lub do zwiększania objętości osocza w leczeniu wspomagającym niektórych rodzajów wstrząsu lub zagrażającego wstrząsu, wynikającego z oparzeń, zabiegów operacyjnych, infekcji, krwotoku lub urazu, kiedy istnieje deficyt krwi krążącej, w celu przywrócenia objętości osocza i jego ciśnienia koloidoosmotycznego. Kompleksy dekstranu z jonami żelaza mogą być stosowane w leczeniu niedokrwistości. Niskocząsteczkowy dekstran może także służyć jako antykoagulant o właściwościach zbliżonych do heparyny. W biotechnologii dekstran modyfikowany wykorzystuje się do immobilizacji enzymów lub całych komórek. Ryc. 1 Schemat budowy cząsteczki dekstranu Odczynniki i podłoża: Leuconostoc mesenteroides rośnie dobrze na podłożach dla innych szczepów bakterii mlekowych głównie MRS oraz na zmodyfikowanym podłożu z sokiem pomidorowym. Podłoże produkcyjne do otrzymywania dekstranu zawiera przede wszystkim sacharozę, będącą substratem do biosyntezy dekstranu, oraz składniki mineralne, w tym nieorganiczne źródła azotu. Podłoże Leuconostoc do hodowli L. mesenteroides ekstrakt mięsny ekstrakt drożdżowy pepton sacharoza K 2HPO 4 NaCl MgSO 4 agar woda destylowana 10,0 g 3,0 g 2,5 g 150,0 g 2,0 g 1,0 g 0,2 g 20,0 g do 1000 ml 41
42 Podłoże do produkcji dekstranu sacharoza 100 g ekstrakt drożdżowy 0,4 g KH 2PO 4 1 g NH 4NaHPO 4 4,5 g MgSO 4 x 7 H 2O 0,2 g KCl 0,1 g MnCl 2 x 4 H 2O 0,02 g (NH 4) 6Mo 7O 24 x 4 H 2O 0,005 g woda destylowana do 1000 ml ph 6,7 Odczynnika Luffa-Schoorla (syn. roztwór cytrynianu miedzi II alkaliczny) Skład (proporcje na 1000 ml): roztwór siarczanu miedziowego: rozpuścić 25 g CuSO 4 x 5H 2O w 100 ml wody roztwór węglanu sodu: rozpuścić 143,8 g czystego, bezwodnego Na 2CO 3 w ok. 300 ml ciepłej wody roztwór kwasu cytrynowego: rozpuścić 50 g czystego kwasu cytrynowego w 50 ml wody Starannie mieszając, wlać roztwór kwasu cytrynowego do roztworu węglanu sodowego. Dolać roztworu siarczanu miedziowego i uzupełnić wodą do 1000 ml. Odstawić roztwór na noc do odstania się i przefiltrować. Wartość ph roztworu powinna wynosić w przybliżeniu 9,4. Szczepy: Czyste kultury Leuconostoc mesenteroides ssp. dextranicus (KKP 402) hodowle na podłożach zestalonych oraz podłożu płynnym (hodowla wstrząsana) do produkcji dekstranu (4 doby). Temperatura inkubacji: C. Obserwacje czystych kultur Leuconostoc mesenteroides: Opisać wygląd makroskopowy kolonii na agarze hodowlanym (agar Leuconostoc) oraz produkcyjnym (podłoże z sacharozą). Wykonać preparaty mikroskopowe wybarwione fioletem goryczkowym, obserwować pod imersją wykonać rysunki. Opisać wygląd hodowli płynnej zwrócić uwagę na opalescencję hodowli, określić w przybliżeniu lepkość hodowli (określić czas wypływu 10 ml hodowli z pipety w odniesieniu do czystej wody). 42
43 Wygląd makroskopowy kolonii L. mesenteroides na podłożu hodowlanym i produkcyjnym. Wygląd komórek L. mesenteroides w preparacie mikroskopowym z podłoża PRODUKCJA DEKSTRANU W SKALI LABORATORYJNEJ I. Oznaczenie suchej masy dekstranu: Wytrącić dekstran z hodowli za pomocą etanolu 96%. Otrzymaną kulkę wysuszyć w temp. 50 C i zważyć. Oznaczanie suchej masy dekstranu: [g] z ml hodowli. II. Oznaczenie zawartości fruktozy w hodowli metodą Luffa-Schoorla: Metoda Luffa Schoorla Zasada oznaczenia opiera się na reakcji redukcji jonów Cu 2+ zawartych w płynie Luffa przez sacharydy redukujące obecne w badanym roztworze. Reakcja zachodzi w środowisku zasadowym (ph ok. 9,5) w temperaturze wrzenia. W skład płynu Luffa wchodzi: siarczan(vi) miedzi(ii) (CuSO 4 5H 2O), węglan sodu (Na 2CO 3 10H 2O), kwas cytrynowy (C 6H 8O 7 H 2O). W środowisku zasadowym sacharydy redukują siarczan(vi) miedzi(ii) do tlenku miedzi(i). Wprowadzenie do roztworu jodku potasu (KI) i kwasu siarkowego(vi) powoduje wydzielenie jodowodoru (HI). Ulega on reakcji z niezredukowanym przez sacharydy siarczanem (VI) miedzi(ii) i powstaje jodek miedzi(i). Nadmiar jodu (z dodatku KI) odmiareczkowuje się tiosiarczanem(vi) sodu (Na 2S 2O 3): 2 CuSO KI 2 K 2SO 4 + Cu 2I 2 + I 2 I Na 2S 2O 3 2 NaI + Na 2S 4O 6 43
44 Wykonuje się ślepą próbę, aby ustalić zużycie roztworu tiosiarczanu(vi) sodu na zmiareczkowanie jodu wydzielonego przez całkowitą ilość miedzi zawartej w płynie Luffa. Objętość tiosiarczanu(vi) sodu odpowiadająca ilości miedzi(ii) podlegającej redukcji przez sacharydy oblicza się jako różnicę objętości uzyskanych z dwóch miareczkowań (próby ślepej i właściwej), a następnie z odpowiedniej krzywej wzorcowej odczytuje się zawartość sacharydów redukujących w analizowanej próbce. Wykonanie: 1. Odmierzyć 20 ml hodowli, przenieść do litrowej kolby miarowej, uzupełnić wodą do kreski. 2. Pobrać 20 ml do kolby z szeroką szyjką, dodać 20 ml odczynnika Luffa-Schoorla i gotować przez 10 min. 3. Po ostudzeniu ostrożnie dodać 20 ml 25% H 2SO 4 wydzielający się dwutlenek węgla może spowodować wycieknięcie mieszaniny z kolby! 4. Dodać 2 g jodku potasu i miareczkować 0,1 M roztworem tiosiarczanu sodu wobec 1% skrobi. Wyniki odnieść do próby ślepej, którą stanowi czysta woda (20 ml). 5. Obliczyć wartość R (różnica w mililitrach pomiędzy ilością titranta zużytą do zmiareczkowania próby ślepej, a ilością zużytą do zmiareczkowania próby badanej). Odczytać z tabeli zawartość fruktozy w badanej hodowli. 6. Określić teoretyczną i praktyczną wydajność biosyntezy dekstranu na podstawie oznaczonej zawartości fruktozy oraz znanej, początkowej ilości sacharozy w podłożu, wykorzystując równanie: n C 12H 22O 11 = [C 6H 12O 5]n + n C 6H 12O 6 sacharoza dekstran fruktoza 100 g 47,36 g 52,64 g Oznaczanie zawartości fruktozy metodą Lufa-Schoorla: ilość titranta próba ślepa [ml] ilość titranta próba badana [ml] średnia średnia różnica [ml] zawartość fruktozy w badanej hodowli 44
45 Teoretyczna i praktyczna wydajność biosyntezy: III. Określenie lepkości hodowli: 1) Czas wypływu 20 ml wody z pipety: 2) Czas wypływu 20 ml hodowli z pipety: Wnioski (z całego ćwiczenia): 45
46 Ćwiczenie 15. Doskonalenie cech produkcyjnych drobnoustrojów na drodze mutagenezy indukowanej Cel ćwiczenia: wykorzystanie mutagenezy fizycznej do zwiększania produkcyjności drożdży fermentacji piwnej; wyznaczanie dawki letalnej czynników mutagennych (fizycznych i chemicznych) A. Indukcja chemiczna: 1. Przygotować w jałowych kolbkach po 10 ml 0,5% fenolu lub 0,5% kwasu siarkowego. 2. Do 10 jałowych probówek rozlać po 10 ml jałowej brzeczki 9 Blg. 3. Do kolbek z czynnikami mutagennymi wprowadzić po 1 ml 24-godzinnej hodowli drożdży piwnych na brzeczce, zmieszać dokładnie. 4. W określonych odstępach czasowych (po 5, 10, 15, 20, 30, 40, 50 i 60 minutach) pobierać jałowo po 3 krople hodowli traktowanej mutagenami (dokładnie mieszając roztwory!) i zaszczepiać probówki z jałową brzeczką. 5. Po 7 dniach ocenić wzrost drożdży w poszczególnych probówkach. Można także określić stopień odfermentowania brzeczki (patrz: ćwiczenie 8.). Ocenić wpływ czasu ekspozycji (dawki) mutagenu na zdolności wzrostowe oraz produkcyjne drożdży. wzrost Czas ekspozycji na czynnik mutagenny [min.] FENOL stopień odfermentowania brzeczki KWAS SIARKOWY wzrost stopień odfermentowania brzeczki Wnioski: 46
47 B. Indukcja fizyczna: 1. Na płytki z agarem słodowym nanieść po 0,1 ml hodowli drożdży. 2. Postępować jak w punkcie A od 3 do Po tygodniu ocenić wzrost na poszczególnych płytkach oraz w hodowli kontrolnej. Liczba kolonii Czas ekspozycji na promieniowanie UV [min.] Wnioski: 47
Do jednego litra medium dodać 10,0 g skrobi ziemniaczanej lub kukurydzianej i mieszać do uzyskania zawiesiny. Sterylizować w autoklawie.
 Ćwiczenie 3. Izolacja laseczek przetrwalnikujących z gleby Cel ćwiczenia: Izolacja i testowanie przydatności biotechnologicznej laseczek z rodzaju Bacillus występujących w glebie. Odczynniki i podłoża:
Ćwiczenie 3. Izolacja laseczek przetrwalnikujących z gleby Cel ćwiczenia: Izolacja i testowanie przydatności biotechnologicznej laseczek z rodzaju Bacillus występujących w glebie. Odczynniki i podłoża:
Ćwiczenie 15. Procesy biosyntezy w biotechnologii: produkcja dekstranu przez bakterie Leuconostoc mesenteroides
 Ćwiczenie 15. Procesy biosyntezy w biotechnologii: produkcja dekstranu przez bakterie Leuconostoc mesenteroides Cel ćwiczenia: Analiza mikrobiologiczna oraz badanie zdolności kultur przemysłowych bakterii
Ćwiczenie 15. Procesy biosyntezy w biotechnologii: produkcja dekstranu przez bakterie Leuconostoc mesenteroides Cel ćwiczenia: Analiza mikrobiologiczna oraz badanie zdolności kultur przemysłowych bakterii
Ćwiczenie 14. Technologie z udziałem bakterii kwasu mlekowego: wykorzystanie fermentacji mlekowej, masłowej i propionowej
 Ćwiczenie 14. Technologie z udziałem bakterii kwasu mlekowego: wykorzystanie fermentacji mlekowej, masłowej i propionowej Cel ćwiczenia: Analiza mikrobiologiczno-biochemiczna fermentowanych produktów spożywczych.
Ćwiczenie 14. Technologie z udziałem bakterii kwasu mlekowego: wykorzystanie fermentacji mlekowej, masłowej i propionowej Cel ćwiczenia: Analiza mikrobiologiczno-biochemiczna fermentowanych produktów spożywczych.
woda do 1000 ml ph=6,9-7,1. Po sterylizacji dodać nystatynę (końcowe stężenie ok. 50 μg/ml). Agar z wyciągiem glebowym i ekstraktem drożdżowym (YS)
 Ćwiczenie 1, 2, 3, 4 Skrining ze środowiska naturalnego: selekcja promieniowców zdolnych do produkcji antybiotyków. Testowanie zdolności do syntezy antybiotyków przez wyselekcjonowane szczepy promieniowców
Ćwiczenie 1, 2, 3, 4 Skrining ze środowiska naturalnego: selekcja promieniowców zdolnych do produkcji antybiotyków. Testowanie zdolności do syntezy antybiotyków przez wyselekcjonowane szczepy promieniowców
Laboratorium 3 Toksykologia żywności
 Laboratorium 3 Toksykologia żywności Literatura zalecana: Orzeł D., Biernat J. (red.) 2012. Wybrane zagadnienia z toksykologii żywności. Wydawnictwo Uniwersytetu Przyrodniczego we Wrocławiu. Wrocław. Str.:
Laboratorium 3 Toksykologia żywności Literatura zalecana: Orzeł D., Biernat J. (red.) 2012. Wybrane zagadnienia z toksykologii żywności. Wydawnictwo Uniwersytetu Przyrodniczego we Wrocławiu. Wrocław. Str.:
ĆWICZENIE 3. Cukry mono i disacharydy
 ĆWICZENIE 3 Cukry mono i disacharydy Reakcja ogólna na węglowodany (Reakcja Molischa) 1 ml 1% roztworu glukozy 1 ml 1% roztworu fruktozy 1 ml 1% roztworu sacharozy 1 ml 1% roztworu skrobi 1 ml wody destylowanej
ĆWICZENIE 3 Cukry mono i disacharydy Reakcja ogólna na węglowodany (Reakcja Molischa) 1 ml 1% roztworu glukozy 1 ml 1% roztworu fruktozy 1 ml 1% roztworu sacharozy 1 ml 1% roztworu skrobi 1 ml wody destylowanej
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN
 ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
HODOWLA PERIODYCZNA DROBNOUSTROJÓW
 Cel ćwiczenia: Celem ćwiczenia jest porównanie zdolności rozkładu fenolu lub wybranej jego pochodnej przez szczepy Stenotrophomonas maltophilia KB2 i Pseudomonas sp. CF600 w trakcie prowadzenia hodowli
Cel ćwiczenia: Celem ćwiczenia jest porównanie zdolności rozkładu fenolu lub wybranej jego pochodnej przez szczepy Stenotrophomonas maltophilia KB2 i Pseudomonas sp. CF600 w trakcie prowadzenia hodowli
ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1)
 ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1) z dnia 6 listopada 2002 r. w sprawie metodyk referencyjnych badania stopnia biodegradacji substancji powierzchniowoczynnych zawartych w produktach, których stosowanie
ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1) z dnia 6 listopada 2002 r. w sprawie metodyk referencyjnych badania stopnia biodegradacji substancji powierzchniowoczynnych zawartych w produktach, których stosowanie
PRACOWNIA ANALIZY ILOŚCIOWEJ. Analiza substancji biologicznie aktywnej w preparacie farmaceutycznym kwas acetylosalicylowy
 PRACOWNIA ANALIZY ILOŚCIOWEJ Analiza substancji biologicznie aktywnej w preparacie farmaceutycznym kwas acetylosalicylowy Ćwiczenie obejmuje: 1. Oznaczenie jakościowe kwasu acetylosalicylowego 2. Przygotowanie
PRACOWNIA ANALIZY ILOŚCIOWEJ Analiza substancji biologicznie aktywnej w preparacie farmaceutycznym kwas acetylosalicylowy Ćwiczenie obejmuje: 1. Oznaczenie jakościowe kwasu acetylosalicylowego 2. Przygotowanie
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
ĆWICZENIE I - BIAŁKA. Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi.
 ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
ĆWICZENIE 1. Aminokwasy
 ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Mikrobiologia na kierunku chemia kosmetyczna
 1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Mikrobiologia na kierunku chemia kosmetyczna 2 Zakład Mikrobiologii UJK Zakres materiału (zagadnienia)
1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Mikrobiologia na kierunku chemia kosmetyczna 2 Zakład Mikrobiologii UJK Zakres materiału (zagadnienia)
data ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1
 Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1 Cel: Wyznaczanie klirensu endogennej kreatyniny. Miarą zdolności nerek do usuwania i wydalania
Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1 Cel: Wyznaczanie klirensu endogennej kreatyniny. Miarą zdolności nerek do usuwania i wydalania
Oznaczanie aktywności proteolitycznej trypsyny metodą Ansona
 Oznaczanie aktywności proteolitycznej trypsyny metodą Ansona Wymagane zagadnienia teoretyczne 1. Enzymy proteolityczne, klasyfikacja, rola biologiczna. 2. Enzymy proteolityczne krwi. 3. Wewnątrzkomórkowa
Oznaczanie aktywności proteolitycznej trypsyny metodą Ansona Wymagane zagadnienia teoretyczne 1. Enzymy proteolityczne, klasyfikacja, rola biologiczna. 2. Enzymy proteolityczne krwi. 3. Wewnątrzkomórkowa
ĆWICZENIE 5 Barwniki roślinne. Ekstrakcja barwników asymilacyjnych. Rozpuszczalność chlorofilu
 ĆWICZENIE 5 Barwniki roślinne Ekstrakcja barwników asymilacyjnych 400 mg - zhomogenizowany w ciekłym azocie proszek z natki pietruszki 6 ml - etanol 96% 2x probówki plastikowe typu Falcon na 15 ml 5x probówki
ĆWICZENIE 5 Barwniki roślinne Ekstrakcja barwników asymilacyjnych 400 mg - zhomogenizowany w ciekłym azocie proszek z natki pietruszki 6 ml - etanol 96% 2x probówki plastikowe typu Falcon na 15 ml 5x probówki
Ćwiczenia nr 2: Stężenia
 Ćwiczenia nr 2: Stężenia wersja z 5 listopada 2007 1. Ile gramów fosforanu(v) sodu należy zużyć w celu otrzymania 2,6kg 6,5% roztworu tego związku? 2. Ile należy odważyć KOH i ile zużyć wody do sporządzenia
Ćwiczenia nr 2: Stężenia wersja z 5 listopada 2007 1. Ile gramów fosforanu(v) sodu należy zużyć w celu otrzymania 2,6kg 6,5% roztworu tego związku? 2. Ile należy odważyć KOH i ile zużyć wody do sporządzenia
Ćwiczenie 1. Technika ważenia oraz wyznaczanie błędów pomiarowych. Ćwiczenie 2. Sprawdzanie pojemności pipety
 II. Wagi i ważenie. Roztwory. Emulsje i koloidy Zagadnienia Rodzaje wag laboratoryjnych i technika ważenia Niepewność pomiarowa. Błąd względny i bezwzględny Roztwory właściwe Stężenie procentowe i molowe.
II. Wagi i ważenie. Roztwory. Emulsje i koloidy Zagadnienia Rodzaje wag laboratoryjnych i technika ważenia Niepewność pomiarowa. Błąd względny i bezwzględny Roztwory właściwe Stężenie procentowe i molowe.
GOSPODARKA ODPADAMI. Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów
 GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE: Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE: Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
PODSTAWY STECHIOMETRII
 PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
Ćwiczenie 4. Identyfikacja wybranych cukrów w oparciu o niektóre reakcje charakterystyczne
 Klasyczna Analiza Jakościowa Organiczna, Ćw. 4 - Identyfikacja wybranych cukrów Ćwiczenie 4 Identyfikacja wybranych cukrów w oparciu o niektóre reakcje charakterystyczne Zagadnienia teoretyczne: 1. Budowa
Klasyczna Analiza Jakościowa Organiczna, Ćw. 4 - Identyfikacja wybranych cukrów Ćwiczenie 4 Identyfikacja wybranych cukrów w oparciu o niektóre reakcje charakterystyczne Zagadnienia teoretyczne: 1. Budowa
2. Procenty i stężenia procentowe
 2. PROCENTY I STĘŻENIA PROCENTOWE 11 2. Procenty i stężenia procentowe 2.1. Oblicz 15 % od liczb: a. 360, b. 2,8 10 5, c. 0.024, d. 1,8 10 6, e. 10 Odp. a. 54, b. 4,2 10 4, c. 3,6 10 3, d. 2,7 10 7, e.
2. PROCENTY I STĘŻENIA PROCENTOWE 11 2. Procenty i stężenia procentowe 2.1. Oblicz 15 % od liczb: a. 360, b. 2,8 10 5, c. 0.024, d. 1,8 10 6, e. 10 Odp. a. 54, b. 4,2 10 4, c. 3,6 10 3, d. 2,7 10 7, e.
1. Oznaczanie aktywności lipazy trzustkowej i jej zależności od stężenia enzymu oraz żółci jako modulatora reakcji enzymatycznej.
 ĆWICZENIE OZNACZANIE AKTYWNOŚCI LIPAZY TRZUSTKOWEJ I JEJ ZALEŻNOŚCI OD STĘŻENIA ENZYMU ORAZ ŻÓŁCI JAKO MODULATORA REAKCJI ENZYMATYCZNEJ. INHIBICJA KOMPETYCYJNA DEHYDROGENAZY BURSZTYNIANOWEJ. 1. Oznaczanie
ĆWICZENIE OZNACZANIE AKTYWNOŚCI LIPAZY TRZUSTKOWEJ I JEJ ZALEŻNOŚCI OD STĘŻENIA ENZYMU ORAZ ŻÓŁCI JAKO MODULATORA REAKCJI ENZYMATYCZNEJ. INHIBICJA KOMPETYCYJNA DEHYDROGENAZY BURSZTYNIANOWEJ. 1. Oznaczanie
g % ,3%
 PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
8. MANGANOMETRIA. 8. Manganometria
 8. MANGANOMETRIA 5 8. Manganometria 8.1. Oblicz ile gramów KMnO 4 zawiera 5 dm 3 roztworu o stężeniu 0,0285 mol dm 3. Odp. 22,5207 g 8.2. W jakiej objętości 0,0205 molowego roztworu KMnO 4 znajduje się
8. MANGANOMETRIA 5 8. Manganometria 8.1. Oblicz ile gramów KMnO 4 zawiera 5 dm 3 roztworu o stężeniu 0,0285 mol dm 3. Odp. 22,5207 g 8.2. W jakiej objętości 0,0205 molowego roztworu KMnO 4 znajduje się
Ćwiczenie 4-5 Mikrobiologiczne kryteria oceny sanitarnej wody
 ĆWICZENIA Z GOSPODARKI ENERGETYCZNEJ, WODNEJ I ŚCIEKOWEJ CZĘŚĆ MIKROBIOLOGICZNA Ćwiczenie 4-5 Mikrobiologiczne kryteria oceny sanitarnej wody Część teoretyczna: 1. Kryteria jakości sanitarnej wody przeznaczonej
ĆWICZENIA Z GOSPODARKI ENERGETYCZNEJ, WODNEJ I ŚCIEKOWEJ CZĘŚĆ MIKROBIOLOGICZNA Ćwiczenie 4-5 Mikrobiologiczne kryteria oceny sanitarnej wody Część teoretyczna: 1. Kryteria jakości sanitarnej wody przeznaczonej
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ. Ćwiczenie 7
 CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 7 Wykorzystanie metod jodometrycznych do miedzi (II) oraz substancji biologicznie aktywnych kwas askorbinowy, woda utleniona.
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 7 Wykorzystanie metod jodometrycznych do miedzi (II) oraz substancji biologicznie aktywnych kwas askorbinowy, woda utleniona.
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna.
 Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
ĆWICZENIE 4. Oczyszczanie ścieków ze związków fosforu
 ĆWICZENIE 4 Oczyszczanie ścieków ze związków fosforu 1. Wprowadzenie Zbyt wysokie stężenia fosforu w wodach powierzchniowych stojących, spiętrzonych lub wolno płynących prowadzą do zwiększonego przyrostu
ĆWICZENIE 4 Oczyszczanie ścieków ze związków fosforu 1. Wprowadzenie Zbyt wysokie stężenia fosforu w wodach powierzchniowych stojących, spiętrzonych lub wolno płynących prowadzą do zwiększonego przyrostu
UWAGA NA WRZĄCY OLEJ!!!!
 ĆWICZENIE 4 Lipidy Wykazanie obecności glicerolu próba akroleinowa 0,5 ml oleju 0,5ml glicerolu kilka kryształów bezwodnego CuSO 4 2x pipetka plastikowa kuchenka elektryczna 1x chwytak do probówek Przygotuj
ĆWICZENIE 4 Lipidy Wykazanie obecności glicerolu próba akroleinowa 0,5 ml oleju 0,5ml glicerolu kilka kryształów bezwodnego CuSO 4 2x pipetka plastikowa kuchenka elektryczna 1x chwytak do probówek Przygotuj
liczba godzin 2 MIKROBIOLOGIA KOSMETOLOGICZNA dla studentów II roku, studiów I st. kierunku KOSMETOLOGIA półpłynne stałe
 MIKROBIOLOGIA KOSMETOLOGICZNA dla studentów II roku, studiów I st. kierunku KOSMETOLOGIA Ćwiczenie 6 i 7 6 Fizjologia drobnoustrojów Wymagania metaboliczne bakterii. Rodzaje podłóż mikrobiologicznych.
MIKROBIOLOGIA KOSMETOLOGICZNA dla studentów II roku, studiów I st. kierunku KOSMETOLOGIA Ćwiczenie 6 i 7 6 Fizjologia drobnoustrojów Wymagania metaboliczne bakterii. Rodzaje podłóż mikrobiologicznych.
SPRAWOZDANIE Z ĆWICZEŃ Z HIGIENY, TOKSYKOLOGII I BEZPIECZEŃSTWA ŻYWNOŚCI
 Data.. Imię, nazwisko, kierunek, grupa SPRAWOZDANIE Z ĆWICZEŃ Z HIGIENY, TOKSYKOLOGII I BEZPIECZEŃSTWA ŻYWNOŚCI OCENA JAKOŚCI WODY DO PICIA Ćwiczenie 1. Badanie właściwości fizykochemicznych wody Ćwiczenie
Data.. Imię, nazwisko, kierunek, grupa SPRAWOZDANIE Z ĆWICZEŃ Z HIGIENY, TOKSYKOLOGII I BEZPIECZEŃSTWA ŻYWNOŚCI OCENA JAKOŚCI WODY DO PICIA Ćwiczenie 1. Badanie właściwości fizykochemicznych wody Ćwiczenie
ĆWICZENIE NR 3 BADANIE MIKROBIOLOGICZNEGO UTLENIENIA AMONIAKU DO AZOTYNÓW ZA POMOCĄ BAKTERII NITROSOMONAS sp.
 ĆWICZENIE NR 3 BADANIE MIKROBIOLOGICZNEGO UTLENIENIA AMONIAKU DO AZOTYNÓW ZA POMOCĄ BAKTERII NITROSOMONAS sp. Uwaga: Ze względu na laboratoryjny charakter zajęć oraz kontakt z materiałem biologicznym,
ĆWICZENIE NR 3 BADANIE MIKROBIOLOGICZNEGO UTLENIENIA AMONIAKU DO AZOTYNÓW ZA POMOCĄ BAKTERII NITROSOMONAS sp. Uwaga: Ze względu na laboratoryjny charakter zajęć oraz kontakt z materiałem biologicznym,
REAKCJE W CHEMII ORGANICZNEJ
 Katedra Biochemii ul. Akademicka 12, 20-033 Lublin tel. 081 445 66 08 www.biochwet.up.lublin.pl REAKCJE W CHEMII ORGANICZNEJ I. Reakcje utleniania na przykładzie różnych związków organicznych. 1. Utlenienie
Katedra Biochemii ul. Akademicka 12, 20-033 Lublin tel. 081 445 66 08 www.biochwet.up.lublin.pl REAKCJE W CHEMII ORGANICZNEJ I. Reakcje utleniania na przykładzie różnych związków organicznych. 1. Utlenienie
GOSPODARKA ODPADAMI. Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów
 GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
OZNACZANIE ZAWARTOŚCI MANGANU W GLEBIE
 OZNACZANIE ZAWARTOŚCI MANGANU W GLEBIE WPROWADZENIE Przyswajalność pierwiastków przez rośliny zależy od procesów zachodzących między fazą stałą i ciekłą gleby oraz korzeniami roślin. Pod względem stopnia
OZNACZANIE ZAWARTOŚCI MANGANU W GLEBIE WPROWADZENIE Przyswajalność pierwiastków przez rośliny zależy od procesów zachodzących między fazą stałą i ciekłą gleby oraz korzeniami roślin. Pod względem stopnia
1.1 Reakcja trójchlorkiem antymonu
 ĆWICZENIE IV - WYKRYWANIE WITAMIN Odczynniki: - chloroform bezwodny, - bezwodnik kwasu octowego, - trójchlorek antymonu roztwór nasycony w chloroformie, - 1,3-dichlorohydryna gliceryny - żelazicyjanek
ĆWICZENIE IV - WYKRYWANIE WITAMIN Odczynniki: - chloroform bezwodny, - bezwodnik kwasu octowego, - trójchlorek antymonu roztwór nasycony w chloroformie, - 1,3-dichlorohydryna gliceryny - żelazicyjanek
VII. Pałeczki Gram-dodatnie: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus - ćwiczenia praktyczne
 VII. Pałeczki Gram-dodatnie: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus - ćwiczenia praktyczne Ćwiczenie 1. Wykonanie barwionych preparatów mikroskopowych preparat barwiony metodą Grama z
VII. Pałeczki Gram-dodatnie: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus - ćwiczenia praktyczne Ćwiczenie 1. Wykonanie barwionych preparatów mikroskopowych preparat barwiony metodą Grama z
Ćwiczenie 5. Badanie właściwości chemicznych aldehydów, ketonów i kwasów karboksylowych. Synteza kwasu sulfanilowego.
 Ćwiczenie 5. Badanie właściwości chemicznych aldehydów, ketonów i kwasów karboksylowych. Synteza kwasu sulfanilowego. Wprowadzenie teoretyczne Cel ćwiczeń: Zapoznanie studentów z właściwościami chemicznymi
Ćwiczenie 5. Badanie właściwości chemicznych aldehydów, ketonów i kwasów karboksylowych. Synteza kwasu sulfanilowego. Wprowadzenie teoretyczne Cel ćwiczeń: Zapoznanie studentów z właściwościami chemicznymi
Piotr Chojnacki 1. Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą reakcji charakterystycznych.
 SPRAWOZDANIE: REAKCJE CHARAKTERYSTYCZNE WYBRANYCH ANIONÓW. Imię Nazwisko Klasa Data Uwagi prowadzącego 1.Wykrywanie obecności jonu chlorkowego Cl - : Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą
SPRAWOZDANIE: REAKCJE CHARAKTERYSTYCZNE WYBRANYCH ANIONÓW. Imię Nazwisko Klasa Data Uwagi prowadzącego 1.Wykrywanie obecności jonu chlorkowego Cl - : Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą
Zakład Biologii Sanitarnej i Ekotechniki ĆWICZENIE 3
 ĆWICZENIE 3 ROLA ORGANIZMÓW AUTOTROFICZNYCH W ŚRODOWISKU. DROBNOUSTROJE FOTO- I CHEMOSYNTETYZUJĄCE I ICH ROLA W INŻYNIERII ŚRODOWISKA /Opiekun merytoryczny: dr hab. Teodora M. Traczewska, prof. nadzw.
ĆWICZENIE 3 ROLA ORGANIZMÓW AUTOTROFICZNYCH W ŚRODOWISKU. DROBNOUSTROJE FOTO- I CHEMOSYNTETYZUJĄCE I ICH ROLA W INŻYNIERII ŚRODOWISKA /Opiekun merytoryczny: dr hab. Teodora M. Traczewska, prof. nadzw.
HYDROLIZA SOLI. ROZTWORY BUFOROWE
 Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
MECHANIZMY REAKCJI CHEMICZNYCH. REAKCJE CHARAKTERYSTYCZNE GRUP FUNKCYJNYCH ZWIĄZKÓW ORGANICZNYCH
 Ćwiczenie 2 semestr 2 MECHANIZMY REAKCJI CHEMICZNYCH. REAKCJE CHARAKTERYSTYCZNE GRUP FUNKCYJNYCH ZWIĄZKÓW ORGANICZNYCH Obowiązujące zagadnienia: Związki organiczne klasyfikacja, grupy funkcyjne, reakcje
Ćwiczenie 2 semestr 2 MECHANIZMY REAKCJI CHEMICZNYCH. REAKCJE CHARAKTERYSTYCZNE GRUP FUNKCYJNYCH ZWIĄZKÓW ORGANICZNYCH Obowiązujące zagadnienia: Związki organiczne klasyfikacja, grupy funkcyjne, reakcje
E.coli Transformer Kit
 E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
KINETYKA HYDROLIZY SACHAROZY
 Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie z wytworzeniem -D-glukozy i -D-fruktozy. Jest to reakcja
Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie z wytworzeniem -D-glukozy i -D-fruktozy. Jest to reakcja
Badanie aktywności enzymów z klasy oksydoreduktaz. Oznaczenie witaminy C
 1 S t r o n a U W A G A!!!!!! Badanie aktywności enzymów z klasy oksydoreduktaz. Oznaczenie witaminy C A. Badanie aktywności enzymów z klasy oksydoreduktaz. Odczynniki : - 3% roztwór H 2 O 2, - roztwór
1 S t r o n a U W A G A!!!!!! Badanie aktywności enzymów z klasy oksydoreduktaz. Oznaczenie witaminy C A. Badanie aktywności enzymów z klasy oksydoreduktaz. Odczynniki : - 3% roztwór H 2 O 2, - roztwór
Oznaczanie żelaza i miedzi metodą miareczkowania spektrofotometrycznego
 Oznaczanie żelaza i miedzi metodą miareczkowania spektrofotometrycznego Oznaczanie dwóch kationów obok siebie metodą miareczkowania spektrofotometrycznego (bez maskowania) jest możliwe, gdy spełnione są
Oznaczanie żelaza i miedzi metodą miareczkowania spektrofotometrycznego Oznaczanie dwóch kationów obok siebie metodą miareczkowania spektrofotometrycznego (bez maskowania) jest możliwe, gdy spełnione są
Oznaczanie dekstranu w sokach cukrowniczych
 Oznaczanie dekstranu w sokach cukrowniczych mgr inż. Aneta Antczak Instytut Chemicznej Technologii Żywności Specjalistyczne Laboratorium Analityki Cukrowniczej Instytut Chemicznej Technologii Żywności
Oznaczanie dekstranu w sokach cukrowniczych mgr inż. Aneta Antczak Instytut Chemicznej Technologii Żywności Specjalistyczne Laboratorium Analityki Cukrowniczej Instytut Chemicznej Technologii Żywności
REDOKSYMETRIA ZADANIA
 REDOKSYMETRIA ZADANIA 1. Na zmiareczkowanie 0,1952 g kwasu szczawiowego H 2 C 2 O 4 2H 2 O zużyto 31,24 cm 3 mianowanego roztworu KMnO 4. Oblicz miano KMnO 4. m.m. H 2 C 2 O 4 2H 2 O=126,068 g/mol Odp.
REDOKSYMETRIA ZADANIA 1. Na zmiareczkowanie 0,1952 g kwasu szczawiowego H 2 C 2 O 4 2H 2 O zużyto 31,24 cm 3 mianowanego roztworu KMnO 4. Oblicz miano KMnO 4. m.m. H 2 C 2 O 4 2H 2 O=126,068 g/mol Odp.
Obliczanie stężeń roztworów
 Obliczanie stężeń roztworów 1. Ile mililitrów stężonego, ok. 2,2mol/l (M) roztworu NaOH należy pobrać, aby przygotować 800ml roztworu o stężeniu ok. 0,2 mol/l [ M ]? {ok. 72,7ml 73ml } 2. Oblicz, jaką
Obliczanie stężeń roztworów 1. Ile mililitrów stężonego, ok. 2,2mol/l (M) roztworu NaOH należy pobrać, aby przygotować 800ml roztworu o stężeniu ok. 0,2 mol/l [ M ]? {ok. 72,7ml 73ml } 2. Oblicz, jaką
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli
 E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
XLVII Olimpiada Chemiczna
 M P IA O L I D A 47 1954 2000 CH N A E M Z I C XLVII Olimpiada Chemiczna Etap III KOMITET GŁÓWNY OLIMPIADY CHEMICZNEJ Zadania laboratoryjne Zadanie 1 Analiza miareczkowa jest użyteczną metodą ilościową,
M P IA O L I D A 47 1954 2000 CH N A E M Z I C XLVII Olimpiada Chemiczna Etap III KOMITET GŁÓWNY OLIMPIADY CHEMICZNEJ Zadania laboratoryjne Zadanie 1 Analiza miareczkowa jest użyteczną metodą ilościową,
CEL ĆWICZENIA: Zapoznanie się z przykładową procedurą odsalania oczyszczanych preparatów enzymatycznych w procesie klasycznej filtracji żelowej.
 LABORATORIUM 3 Filtracja żelowa preparatu oksydazy polifenolowej (PPO) oczyszczanego w procesie wysalania siarczanem amonu z wykorzystaniem złoża Sephadex G-50 CEL ĆWICZENIA: Zapoznanie się z przykładową
LABORATORIUM 3 Filtracja żelowa preparatu oksydazy polifenolowej (PPO) oczyszczanego w procesie wysalania siarczanem amonu z wykorzystaniem złoża Sephadex G-50 CEL ĆWICZENIA: Zapoznanie się z przykładową
Karta przedmiotu. 2. Poziom kształcenia: I stopień biotechnologia medyczna. 3. Forma studiów: stacjonarne 4. Rok: II 5.
 Karta przedmiotu Informacje ogólne o przedmiocie. Kierunek studiów: 2. Poziom kształcenia: I stopień biotechnologia medyczna 3. Forma studiów: stacjonarne. Rok: II 5. Semestr: IV 6. Nazwa przedmiotu: TECHNOLOGIE
Karta przedmiotu Informacje ogólne o przedmiocie. Kierunek studiów: 2. Poziom kształcenia: I stopień biotechnologia medyczna 3. Forma studiów: stacjonarne. Rok: II 5. Semestr: IV 6. Nazwa przedmiotu: TECHNOLOGIE
Oznaczanie SO 2 w powietrzu atmosferycznym
 Ćwiczenie 6 Oznaczanie SO w powietrzu atmosferycznym Dwutlenek siarki bezwodnik kwasu siarkowego jest najbardziej rozpowszechnionym zanieczyszczeniem gazowym, występującym w powietrzu atmosferycznym. Głównym
Ćwiczenie 6 Oznaczanie SO w powietrzu atmosferycznym Dwutlenek siarki bezwodnik kwasu siarkowego jest najbardziej rozpowszechnionym zanieczyszczeniem gazowym, występującym w powietrzu atmosferycznym. Głównym
WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 STOPIEŃ WOJEWÓDZKI 9 MARCA 2018 R.
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks
 Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
REAKCJE UTLENIAJĄCO-REDUKCYJNE
 7 REAKCJE UTLENIAJĄCO-REDUKCYJNE CEL ĆWICZENIA Zapoznanie się z reakcjami redoks. Zakres obowiązującego materiału Chemia związków manganu. Ich właściwości red-ox. Pojęcie utleniania, redukcji oraz stopnia
7 REAKCJE UTLENIAJĄCO-REDUKCYJNE CEL ĆWICZENIA Zapoznanie się z reakcjami redoks. Zakres obowiązującego materiału Chemia związków manganu. Ich właściwości red-ox. Pojęcie utleniania, redukcji oraz stopnia
Laboratorium. Technologia i Analiza Aromatów Spożywczych
 Laboratorium Technologia i Analiza Aromatów Spożywczych Regulamin pracowni Technologii i Analizy Aromatów Spożywczych...3 Ćw. 1. Mikrokapsułkowanie olejków eterycznych z wykorzystaniem drożdży piwnych...4
Laboratorium Technologia i Analiza Aromatów Spożywczych Regulamin pracowni Technologii i Analizy Aromatów Spożywczych...3 Ćw. 1. Mikrokapsułkowanie olejków eterycznych z wykorzystaniem drożdży piwnych...4
Odpowiedź:. Oblicz stężenie procentowe tlenu w wodzie deszczowej, wiedząc, że 1 dm 3 tej wody zawiera 0,055g tlenu. (d wody = 1 g/cm 3 )
 PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
2.4. ZADANIA STECHIOMETRIA. 1. Ile moli stanowi:
 2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
X. Diagnostyka mikrobiologiczna bakterii chorobotwórczych z rodzaju: Corynebacterium, Mycobacterium, Borrelia, Treponema, Neisseria
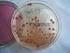 X. Diagnostyka mikrobiologiczna bakterii chorobotwórczych z rodzaju: Corynebacterium, Mycobacterium, Borrelia, Treponema, Neisseria Maczugowce (rodzaj Corynebacterium) Ćwiczenie 1. Wykonanie preparatu
X. Diagnostyka mikrobiologiczna bakterii chorobotwórczych z rodzaju: Corynebacterium, Mycobacterium, Borrelia, Treponema, Neisseria Maczugowce (rodzaj Corynebacterium) Ćwiczenie 1. Wykonanie preparatu
Identyfikacja wybranych kationów i anionów
 Identyfikacja wybranych kationów i anionów ZACHOWAĆ SZCZEGÓLNĄ OSTRORZNOŚĆ NIE ZATYKAĆ PROBÓWKI PALCEM Zadanie 1 Celem zadania jest wykrycie jonów Ca 2+ a. Próba z jonami C 2 O 4 ZACHOWAĆ SZCZEGÓLNĄ OSTRORZNOŚĆ
Identyfikacja wybranych kationów i anionów ZACHOWAĆ SZCZEGÓLNĄ OSTRORZNOŚĆ NIE ZATYKAĆ PROBÓWKI PALCEM Zadanie 1 Celem zadania jest wykrycie jonów Ca 2+ a. Próba z jonami C 2 O 4 ZACHOWAĆ SZCZEGÓLNĄ OSTRORZNOŚĆ
OBLICZANIE WYNIKÓW ANALIZ I
 OBLICZANIE WYNIKÓW ANALIZ I 1. Ile gramów zasady sodowej zawiera próbka roztworu, jeżeli na jej zmiareczkowanie zużywa się średnio 53,24ml roztworu HCl o stężeniu 0,1015mol/l? M (NaOH) - 40,00 2. Ile gramów
OBLICZANIE WYNIKÓW ANALIZ I 1. Ile gramów zasady sodowej zawiera próbka roztworu, jeżeli na jej zmiareczkowanie zużywa się średnio 53,24ml roztworu HCl o stężeniu 0,1015mol/l? M (NaOH) - 40,00 2. Ile gramów
Otrzymany w pkt. 8 osad, zawieszony w 2 ml wody destylowanej rozpipetować do 4 szklanych probówek po ok. 0.5 ml do każdej.
 Kwasy nukleinowe izolacja DNA, wykrywanie składników. Wymagane zagadnienia teoretyczne 1. Struktura, synteza i degradacja nukleotydów purynowych i pirymidynowych. 2. Regulacja syntezy nukleotydów. Podstawowe
Kwasy nukleinowe izolacja DNA, wykrywanie składników. Wymagane zagadnienia teoretyczne 1. Struktura, synteza i degradacja nukleotydów purynowych i pirymidynowych. 2. Regulacja syntezy nukleotydów. Podstawowe
ĆWICZENIE 4. Roztwory i ich właściwości
 I. Roztwory rzeczywiste ĆWICZENIE 4 Roztwory i ich właściwości 1. Sporządzanie roztworu CuSO 4 o określonym stężeniu procentowym - wykonać w zespołach 2-osobowych W celu sporządzenia 25 lub 50 ml 10% m/v
I. Roztwory rzeczywiste ĆWICZENIE 4 Roztwory i ich właściwości 1. Sporządzanie roztworu CuSO 4 o określonym stężeniu procentowym - wykonać w zespołach 2-osobowych W celu sporządzenia 25 lub 50 ml 10% m/v
Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Inżynieria bioprocesowa na kierunku biotechnologia
 1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Inżynieria bioprocesowa na kierunku biotechnologia 2 Zakład Mikrobiologii UJK Zakres materiału
1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Inżynieria bioprocesowa na kierunku biotechnologia 2 Zakład Mikrobiologii UJK Zakres materiału
009 Ile gramów jodu i ile mililitrów alkoholu etylowego (gęstość 0,78 g/ml) potrzeba do sporządzenia 15 g jodyny, czyli 10% roztworu jodu w alkoholu e
 STĘŻENIA - MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Ile gramów wodnego roztworu azotanu sodu o stężeniu 10,0% można przygotować z 25,0g NaNO3? 002 Ile gramów kwasu siarkowego zawiera 25 ml jego
STĘŻENIA - MIX ZADAŃ Czytaj uważnie polecenia. Powodzenia! 001 Ile gramów wodnego roztworu azotanu sodu o stężeniu 10,0% można przygotować z 25,0g NaNO3? 002 Ile gramów kwasu siarkowego zawiera 25 ml jego
G-VII. Substancje o znaczeniu biologicznym
 G-VII. Substancje o znaczeniu biologicznym Odczynnik Postać Piktogram GHS Hasło Zwroty H HCl roztwór 5% UWAGA H315, H319, H335 HNO 3 H 2 SO 4 stężony stężony NaOH roztwór 5% H314, EUH071 H314 H314 CuSO
G-VII. Substancje o znaczeniu biologicznym Odczynnik Postać Piktogram GHS Hasło Zwroty H HCl roztwór 5% UWAGA H315, H319, H335 HNO 3 H 2 SO 4 stężony stężony NaOH roztwór 5% H314, EUH071 H314 H314 CuSO
STĘŻENIA ROZTWORÓW. 2. W 100 g wody rozpuszczono 25 g cukru. Oblicz stężenie procentowe roztworu.
 STĘŻENIA ROZTWORÓW Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. W 150 g roztworu znajduje się 10 g soli kuchennej (NaCl). Jakie jest stężenie procentowe
STĘŻENIA ROZTWORÓW Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. W 150 g roztworu znajduje się 10 g soli kuchennej (NaCl). Jakie jest stężenie procentowe
PREPARATYKA NIEORGANICZNA. Przykład 1 Ile kilogramów siarczanu(vi) żelaza (II) można otrzymać z 336 kg metalicznego żelaza?
 PREPARATYKA NIEORGANICZNA W laboratorium chemicznym jedną z podstawowych czynności jest synteza i analiza. Każda z nich wymaga specyficznych umiejętności, które można przyswoić w trakcie ćwiczeń laboratoryjnych.
PREPARATYKA NIEORGANICZNA W laboratorium chemicznym jedną z podstawowych czynności jest synteza i analiza. Każda z nich wymaga specyficznych umiejętności, które można przyswoić w trakcie ćwiczeń laboratoryjnych.
Litowce i berylowce- lekcja powtórzeniowa, doświadczalna.
 Doświadczenie 1 Tytuł: Badanie właściwości sodu Odczynnik: Sód metaliczny Szkiełko zegarkowe Metal lekki o srebrzystej barwie Ma metaliczny połysk Jest bardzo miękki, można kroić go nożem Inne właściwości
Doświadczenie 1 Tytuł: Badanie właściwości sodu Odczynnik: Sód metaliczny Szkiełko zegarkowe Metal lekki o srebrzystej barwie Ma metaliczny połysk Jest bardzo miękki, można kroić go nożem Inne właściwości
Oznaczanie aktywności - i β- amylazy słodu metodą kolorymetryczną
 KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Oznaczanie aktywności - i β- amylazy słodu metodą kolorymetryczną ĆWICZENIE 5 OZNACZANIE AKTYWNOŚCI -AMYLAZY SŁODU METODĄ KOLORYMETRYCZNĄ Enzymy
KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Oznaczanie aktywności - i β- amylazy słodu metodą kolorymetryczną ĆWICZENIE 5 OZNACZANIE AKTYWNOŚCI -AMYLAZY SŁODU METODĄ KOLORYMETRYCZNĄ Enzymy
ROZPORZĄDZENIA. (4) Środki przewidziane w niniejszym rozporządzeniu są zgodne z opinią Komitetu ds. Wspólnej Organizacji Rynków Rolnych, Artykuł 1
 8.10.2016 L 273/5 ROZPORZĄDZENIA ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) 2016/1784 z dnia 30 września 2016 r. zmieniające rozporządzenie (EWG) nr 2568/91 w sprawie właściwości oliwy z oliwek i oliwy z wytłoczyn
8.10.2016 L 273/5 ROZPORZĄDZENIA ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) 2016/1784 z dnia 30 września 2016 r. zmieniające rozporządzenie (EWG) nr 2568/91 w sprawie właściwości oliwy z oliwek i oliwy z wytłoczyn
VII. Fizjologia bakterii - ćwiczenia praktyczne
 VII. Fizjologia bakterii - ćwiczenia praktyczne Ćwiczenie 1. Rodzaje pożywek i ich zastosowanie a. Podłoże stałe - proste Agar zwykły (AZ) b. Podłoża wzbogacone Agar z dodatkiem 5% odwłóknionej krwi baraniej
VII. Fizjologia bakterii - ćwiczenia praktyczne Ćwiczenie 1. Rodzaje pożywek i ich zastosowanie a. Podłoże stałe - proste Agar zwykły (AZ) b. Podłoża wzbogacone Agar z dodatkiem 5% odwłóknionej krwi baraniej
XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych. a. Candida albicans preparat z hodowli barwiony metoda Grama
 XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych a. Candida albicans preparat z hodowli barwiony metoda Grama Opis preparatu: b. Saccharomyces cerevisiae preparat z hodowli
XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych a. Candida albicans preparat z hodowli barwiony metoda Grama Opis preparatu: b. Saccharomyces cerevisiae preparat z hodowli
ĆWICZENIE 1. Aminokwasy
 ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
mgr Sławomir Sułowicz Katedra Mikrobiologii UŚ
 mgr Sławomir Sułowicz Katedra Mikrobiologii UŚ 1) Analiza sanitarna wody 2) Analiza mikrobiologiczna gleby 3) Analiza sanitarna powietrza 4) Charakterystyka szczepów bakterii opornych na antybiotyki, wyizolowanych
mgr Sławomir Sułowicz Katedra Mikrobiologii UŚ 1) Analiza sanitarna wody 2) Analiza mikrobiologiczna gleby 3) Analiza sanitarna powietrza 4) Charakterystyka szczepów bakterii opornych na antybiotyki, wyizolowanych
Ćwiczenia laboratoryjne 2
 Ćwiczenia laboratoryjne 2 Ćwiczenie 5: Wytrącanie siarczków grupy II Uwaga: Ćwiczenie wykonać w dwóch zespołach (grupach). A. Przygotuj w oddzielnych probówkach niewielką ilość roztworów zawierających
Ćwiczenia laboratoryjne 2 Ćwiczenie 5: Wytrącanie siarczków grupy II Uwaga: Ćwiczenie wykonać w dwóch zespołach (grupach). A. Przygotuj w oddzielnych probówkach niewielką ilość roztworów zawierających
Ćwiczenie 3. Otrzymywanie i badanie właściwości chemicznych alkanów, alkenów, alkinów i arenów.
 Ćwiczenie 3. Otrzymywanie i badanie właściwości chemicznych alkanów, alkenów, alkinów i arenów. Wprowadzenie teoretyczne Cel ćwiczeń: Poznanie metod otrzymywania oraz badania właściwości węglowodorów alifatycznych
Ćwiczenie 3. Otrzymywanie i badanie właściwości chemicznych alkanów, alkenów, alkinów i arenów. Wprowadzenie teoretyczne Cel ćwiczeń: Poznanie metod otrzymywania oraz badania właściwości węglowodorów alifatycznych
5. STECHIOMETRIA. 5. Stechiometria
 5. STECHIOMETRIA 25 5. Stechiometria 5.1. Ile gramów magnezu wzięło udział w reakcji z tlenem, jeśli otrzymano 6,0 g tlenku magnezu? Odp. 3,60 g 5.2. Do 50 cm 3 roztworu kwasu siarkowego (VI) o stężeniu
5. STECHIOMETRIA 25 5. Stechiometria 5.1. Ile gramów magnezu wzięło udział w reakcji z tlenem, jeśli otrzymano 6,0 g tlenku magnezu? Odp. 3,60 g 5.2. Do 50 cm 3 roztworu kwasu siarkowego (VI) o stężeniu
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW. Eliminacje rejonowe II stopień
 POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
KATALITYCZNE OZNACZANIE ŚLADÓW MIEDZI
 6 KATALITYCZNE OZNACZANIE ŚLADÓW MIEDZI CEL ĆWICZENIA Zapoznanie studenta z zagadnieniami katalizy homogenicznej i wykorzystanie reakcji tego typu do oznaczania śladowych ilości jonów Cu 2+. Zakres obowiązującego
6 KATALITYCZNE OZNACZANIE ŚLADÓW MIEDZI CEL ĆWICZENIA Zapoznanie studenta z zagadnieniami katalizy homogenicznej i wykorzystanie reakcji tego typu do oznaczania śladowych ilości jonów Cu 2+. Zakres obowiązującego
Ilościowe oznaczenie glikogenu oraz badanie niektórych jego właściwości
 Ilościowe oznaczenie glikogenu oraz badanie niektórych jego właściwości Cel ćwiczenia Celem ćwiczenia jest zapoznanie się z podstawową wiedzą dotyczącą budowy, funkcji i właściwości glikogenu jak również
Ilościowe oznaczenie glikogenu oraz badanie niektórych jego właściwości Cel ćwiczenia Celem ćwiczenia jest zapoznanie się z podstawową wiedzą dotyczącą budowy, funkcji i właściwości glikogenu jak również
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru
 1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
Współczesne metody chromatograficzne: Chromatografia cienkowarstwowa
 Ćwiczenie 2: Chromatografia dwuwymiarowa (TLC 2D) 1. Celem ćwiczenia jest zaobserwowanie rozdziału mieszaniny aminokwasów w dwóch układach rozwijających. Aminokwasy: Asp, Cys, His, Leu, Ala, Val (1% roztwory
Ćwiczenie 2: Chromatografia dwuwymiarowa (TLC 2D) 1. Celem ćwiczenia jest zaobserwowanie rozdziału mieszaniny aminokwasów w dwóch układach rozwijających. Aminokwasy: Asp, Cys, His, Leu, Ala, Val (1% roztwory
Synteza Cu(CH 3 COO) 2 H 2 O oraz (NH 4 ) 2 Ni(SO 4 ) 2 6H 2 O
 ĆWICZENIE 2 Synteza Cu(CH 3 COO) 2 H 2 O oraz (NH 4 ) 2 Ni(SO 4 ) 2 6H 2 O 1. Zakres materiału Podstawowe czynności w laboratorium chemicznym (ogrzewanie substancji, filtracja, ważenie substancji, itp.).
ĆWICZENIE 2 Synteza Cu(CH 3 COO) 2 H 2 O oraz (NH 4 ) 2 Ni(SO 4 ) 2 6H 2 O 1. Zakres materiału Podstawowe czynności w laboratorium chemicznym (ogrzewanie substancji, filtracja, ważenie substancji, itp.).
II. OZNACZANIE LICZBY BAKTERII Z GRUPY COLI I BAKTERII Z GRUPY COLI TYP FEKALNY METODĄ PŁYTKOWĄ W ŻYWNOŚCI I INNYCH PRODUKTACH wg PN-ISO 4832: 2007
 Katedra i Zakład Mikrobiologii i Wirusologii Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Mikrobiologia ogólna Biotechnologia medyczna II rok / I o Temat: Żywność jako środowisko życia mikroorganizmów.
Katedra i Zakład Mikrobiologii i Wirusologii Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Mikrobiologia ogólna Biotechnologia medyczna II rok / I o Temat: Żywność jako środowisko życia mikroorganizmów.
XIX. Pałeczki Gram-ujemne część I - ćwiczenia praktyczne
 XIX. Pałeczki Gram-ujemne część I - ćwiczenia praktyczne Ćwiczenie 1. Wykonanie preparatu mikroskopowego barwionego metodą Grama Opis preparatu: Ćwiczenie 2. Ocena wzrostu szczepów na podłożach stałych
XIX. Pałeczki Gram-ujemne część I - ćwiczenia praktyczne Ćwiczenie 1. Wykonanie preparatu mikroskopowego barwionego metodą Grama Opis preparatu: Ćwiczenie 2. Ocena wzrostu szczepów na podłożach stałych
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
Zadania laboratoryjne
 M P I O L I D 47 1954 2000 Zadania laboratoryjne CH N E M Z I C ZDNIE 1 Ustalenie nudowy kompleksu szczawianowego naliza miareczkowa jest użyteczną metodę ilościową, którą wykorzystasz do ustalenia budowy
M P I O L I D 47 1954 2000 Zadania laboratoryjne CH N E M Z I C ZDNIE 1 Ustalenie nudowy kompleksu szczawianowego naliza miareczkowa jest użyteczną metodę ilościową, którą wykorzystasz do ustalenia budowy
Metody otrzymywania kwasów, zasad i soli. Reakcje chemiczne wybranych kwasów, zasad i soli. Ćwiczenie 1. Reakcja otrzymywania wodorotlenku sodu
 V. Metody otrzymywania kwasów, zasad i soli. Reakcje chemiczne wybranych kwasów, zasad i soli Zagadnienia Kwasy i metody ich otrzymywania Wodorotlenki i metody ich otrzymywania Sole i metody ich otrzymywania
V. Metody otrzymywania kwasów, zasad i soli. Reakcje chemiczne wybranych kwasów, zasad i soli Zagadnienia Kwasy i metody ich otrzymywania Wodorotlenki i metody ich otrzymywania Sole i metody ich otrzymywania
III-B. Chemia w kuchni
 III-B. Chemia w kuchni III-B.1. POKAZ: Właściwości napoju typu coca-cola. III-B.2. Wykrywanie białek: a) POKAZ: reakcja ksantoproteinowa, b) reakcja biuretowa III-B.3 Badanie składu pierwiastkowego białka
III-B. Chemia w kuchni III-B.1. POKAZ: Właściwości napoju typu coca-cola. III-B.2. Wykrywanie białek: a) POKAZ: reakcja ksantoproteinowa, b) reakcja biuretowa III-B.3 Badanie składu pierwiastkowego białka
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ. Ćwiczenie 6. Manganometryczne oznaczenia Mn 2+ i H 2 O 2
 CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 6 Manganometryczne oznaczenia Mn 2+ i H 2 O 2 Ćwiczenie obejmuje: 1. Oznaczenie miana roztworu KMnO 4 2. Manganometryczne
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 6 Manganometryczne oznaczenia Mn 2+ i H 2 O 2 Ćwiczenie obejmuje: 1. Oznaczenie miana roztworu KMnO 4 2. Manganometryczne
XIII. Staphylococcus, Micrococcus ćwiczenia praktyczne
 XIII. Staphylococcus, Micrococcus ćwiczenia praktyczne Ćwiczenie 1. Ocena wzrostu szczepów gronkowców na: a. agarze z dodatkiem 5% odwłóknionej krwi baraniej (AK) typ hemolizy morfologia kolonii.. b. podłożu
XIII. Staphylococcus, Micrococcus ćwiczenia praktyczne Ćwiczenie 1. Ocena wzrostu szczepów gronkowców na: a. agarze z dodatkiem 5% odwłóknionej krwi baraniej (AK) typ hemolizy morfologia kolonii.. b. podłożu
Protokół: Reakcje charakterystyczne cukrowców
 Protokół: Reakcje charakterystyczne cukrowców 1. Rekcja na obecność cukrów: próba Molischa z -naftolem Jest to najbardziej ogólna reakcja na cukrowce, tak wolne jak i związane. Ujemny jej wynik wyklucza
Protokół: Reakcje charakterystyczne cukrowców 1. Rekcja na obecność cukrów: próba Molischa z -naftolem Jest to najbardziej ogólna reakcja na cukrowce, tak wolne jak i związane. Ujemny jej wynik wyklucza
