Zakład Radiobiologii i Immunologii UJK
|
|
|
- Izabela Przybysz
- 8 lat temu
- Przeglądów:
Transkrypt
1 1 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Zakład Radiobiologii i Immunologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Biotechnologia mikrobiologiczna na kierunku biotechnologia wykład: 15 godzin ćwiczenia: 60 godzin
2 2 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Zakres materiału omawiany na wykładach z przedmiotu biotechnologia mikrobiologiczna 1. Gleba jako źródło drobnoustrojów o znaczeniu aplikacyjnym 2. Czynniki przeciwbakteryjne izolowane z gleby: antybiotyki, bakteriofagi 3. Metody hodowli drobnoustrojów: okresowa, półokresowa i ciągła 4. Bioreaktor budowa, mierzalne parametry fizykochemiczne, przegląd typów i ich zastosowań 5. Immobilizacja drobnoustrojów wady i zalety, znaczenie praktyczne 6. Wybrane procesy biosyntezy enzymów, witamin i antybiotyków 7. Przykłady procesów biokonwersji związków organicznych przez drobnoustroje 8. Bioakumulacja i biotransformacja metali 9. Techniki doskonalenia szczepów przemysłowych 10. Metody przechowywanie szczepów Literatura podstawowa: Biotechnologia mikrobiologiczna ćwiczenia i pracownie specjalistyczne, Praca zbiorowa pod red. Jerzego Długońskiego, Wyd. UŁ 1997 Podstawy biotechnologii przemysłowej W. Bednarski, WNT, 2006 Różalski A, Ćwiczenia z mikrobiologii ogólnej: część I teoretyczna. wydanie II rozdział 6,7,8,15 Artykuły Niczyporuk J.S., Bartoszcze M. Fagowe enzymy lityczne nowe nadzieje w walce z zakażeniami bakteryjnymi. Przegląd Epidemiologiczny 2007; 61: (link) Brzozowska E., Bazan J., Gamian A.: Funkcje białek bakteriofagowych. Postępy Higieny i Medycyny Doświadczalnej 2011; 65: (link) Duliński R. Biotechnologiczne metody produkcji witamin z wykorzystaniem mikroorganizmów. Żywność. Nauka. Technologia. Jakość 2010; 1 (68), (link) Bobek B., Smyłła A., Rychter P., Biczak R., Kowalczuk M. Degradacja wybranych poliestrów w glebie z udziałem mikroorganizmów. Proceedings of ECOpole 2009; 3: (link)
3 3 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Schemat części praktycznej zajęć
4 4 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK 1 Zestawienie tabelaryczne instrukcji do ćwiczeń Omówienie zasad BHP oraz podstaw teoretycznych cyklu ćwiczeń laboratoryjnych 2 Izolacja z gleby czystych hodowli mikroorganizmów 3 4 Ocena makro i mikroskopowa hodowli mikroorganizmów, uzyskanie czystych kultur Ocena wybranych właściwości biochemicznych hodowli mikroorganizmów o znaczeniu praktycznym 5 Analiza właściwości lipolitycznych i ureolitycznych immobilizowanych mikroorganizmów 6 Przygotowanie bioreaktora sterylizacja i kalibracja sond 7 Produkcja biomasy a właściwości lipolityczne wzrostu bakterii w bioreaktorze 8 Izolacja i analiza właściwości litycznych bakteriofagów Przygotowanie medium hodowlanego, zasady hodowli komórek eukariotycznych in vitro Analiza żywotności komórek A549 i HepG2 traktowanych różnymi stężeniami lizatów środowiskowych Analiza apoptozy komórek A549 i HepG2 traktowanych różnymi stężeniami lizatów środowiskowych za pomocą cytometru przepływowego Analiza częstości mikrojąder w komórkach A549 i HepG2 traktowanych różnymi stężeniami lizatów środowiskowych Analiza przeżywalności komórek A549 i HepG2 traktowanych różnymi stężeniami lizatów środowiskowych test klonogenny 14 Cytotoksyczność podsumowanie wyników i ich analiza statystyczna 15 Kolokwium z części praktycznej Zajęcia realizowane w Zakładzie Mikrobiologii UJK ćw. 1-8 Zajęcia realizowane w Zakładzie Radiobiologii i Immunologii UJK ćw. 9-14
5 5 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Ćwiczenie nr. 1 Temat: Omówienie zasad BHP oraz podstaw teoretycznych cyklu ćwiczeń laboratoryjnych Ćwiczenie nr. 2 Temat: Izolacja z gleby czystych hodowli mikroorganizmów 1. Gleba jako źródło mikoorganizmów 2. Właściwości biochemiczne mikroorganizmów glebowych o znaczeniu praktycznym 3. Podłoża mikrobiologiczne identyfikujące określone właściwości biologiczne 4. Metody stymulacji wzrostu wybranych grup drobnoustrojów 1. Przygotowanie wyciągu z gleby Odważyć 5 g gleby, przenieść do kolby o pojemności 100 ml zawierającej 50 ml 0.1 % roztwór Tween 80 w 0.9% NaCl. Próbkę inkubować 45 min. na wytrząsarce w temperaturze pokojowej. 2. Przygotowanie szeregu rozcieńczeń wyciągu gleby Przygotować szereg 5 probówek zawierających 9 ml 0.9 % NaCl. Do pierwszej probówki przenieść 1 ml wyciągu glebowego (po opadnięciu większych cząstek), wymieszać przez pipetowanie i przenieść 1 ml do kolejnej probówki. Czynność powtórzyć w kolejnych probówkach. Uzyskane rozcieńczenia wyciągu glebowego (1/10; 1/100; 1/1 000; 1/10 000; 1/ ) wysiać na poniższe podłoża (po 100 l, metoda płytek mazanych): podłoże agar-lb, podłoże agar-lb 1/500, podłoże Sabourauda. Płytki inkubować 7 dni w 25 C. 3. Przygotowanie podłoży do izolacji czystych kultur i oceny ich właściwości biochemicznych Przygotować podłoża według danych w tabeli: Aktywność Sposób sprawdzenia Podłoże/skład Cel/Właściwości biologiczna - Posiew redukcyjny na płytki z agar- Agar-LB/według Namnażanie bakterii LB producenta - Posiew redukcyjny na płytki z podłożem Sabourauda Sabourauda/według producenta Namnażanie grzybów mikroskopowych - Posiew redukcyjny na płytki z Agar-LB 1/500 Namnażanie promieniowców podłożem agar-lb 1/500 według producenta Proteazy Posiew redukcyjny na płytki z podłożem agar-lb z dodatkiem odtłuszczonego mleka (kazeina) Agar-LB/według producenta + 5% mleko odtłuszczone (przefiltrować Ø 0.2 M) Zaobserwować przejrzyste strefy wokół linii wzrostu szczepów hydrolizujących kazeinę Amylazy Lipazy Ureaza Posiew redukcyjny na płytki z podłożem agar-lb z dodatkiem skrobi Posiew redukcyjny na płytki z podłożem agar-lb z Tween 80 Posiew redukcyjny na płytki z podłożem Christensena Agar-LB/według producenta + 1% skrobia według producenta + 80 mm CaCl2 i 1% (w/v) Tween 80 według producenta + 3 % mocznik i czerwień fenolowa Płytki zalać płynem Lugola. Brak fioletowego zabarwienia wokół strefy wzrostu bakterii świadczy o rozkładzie skrobi. Zaobserwować strefę wytrąconego wapnia ( mydło wapniowe ) Amoniak uwalniany podczas wzrostu bakterii silnie alkalizuje pożywkę, powodując zmianę jej barwy z żółtej na fioletową
6 6 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Ćwiczenie nr. 3 Temat: Ocena makro i mikroskopowa hodowli mikroorganizmów, uzyskanie czystych kultur 1. Cechy charakteryzujące morfologię makroskopową bakterii 2. Techniki barwienia bakterii 1. Wykonanie posiewów w celu uzyskania czystych kultur jak również oceny ich właściwości biologicznych na podłożach przygotowanych wg. instrukcji w ćw 2. Posiew szczepów wzorcowych z kolekcji Zakładu Mikrobiologii UJK na powyższe podłoża Hodowla w temperaturze 25 C, 48 godzin. 2. Barwienie metodą Grama uzyskanych hodowli mikroorganizmów glebowych i obserwacja preparatów mikroskopowych: Wysuszony rozmaz bakterii barwić wg procedury: a. 1,5 min. fiolet krystaliczny b. 1,5 min. płyn Lugola c. spłukać pod wodą bieżącą, odbarwić i ponownie spłukać d. 8 sek. fuksyna, po czym preparat spłukać wodą 3. Obliczenie ilości bakterii (cfu/ml) na podstawie odczytu wyników z ćwiczenia nr. 2 Ilość bakterii (cfu/ml wyciągu gleby):. Ilość grzybów (cfu/ml wyciągu gleby):.. Ilość promieniowców (cfu/ml wyciągu gleby):.
7 7 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Ćwiczenie nr. 4 Temat: Ocena wybranych właściwości biochemicznych hodowli mikroorganizmów o znaczeniu praktycznym 1. Podłoża mikrobiologiczne identyfikujące określone właściwości biochemiczne 2. Przykłady właściwości biochemicznych bakterii o znaczeniu praktycznym 1. Opracowanie tabelaryczne uzyskanych wyników posiewu z ćwiczenia 3 w systemie +/-: L.p. (kod szczepu) Barwienie Grama Aktywność biologiczna Proteaza Amylaza Lipaza Ureaza 2. Metoda przechowywania szczepów a. Przygotowanie wybranych hodowli bakteryjnych do zamrożenia w temperaturze -80 C. Hodowlę z podłoża stałego (18 godzinną) zawiesić w 1 ml TSB z dodatkiem 8% DMSO. b. Liofilizacja wcześniej przygotowanych zawiesin bakteryjnych, zamrożonych w temperaturze -80 C obsługa liofilizatora
8 8 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Ćwiczenie nr. 5 Temat: Analiza właściwości lipolitycznych i ureolitycznych immobilizowanych mikroorganizmów 1. Zasadność immobilizacji szczepów mikroorganizmów 2. Wady i zalety immobilizacji 1. Do dwóch kolb o pojemności 250 ml dodać 100 ml wody oraz 1.5 g alginianu sodu. Próbki wymieszać do całkowitego rozpuszczenia na mieszadle magnetycznym i wysterylizować w autoklawie mikrofalowym. 2. Przygotować po 20 ml zawiesiny bakterii środowiskowych w jałowej wodzie destylowanej (Abs 600nm = ) 3. Po ostygnięciu do próbki dodać zawiesinę bakterii środowiskowych o właściwościach lipolitycznych lub ureolitycznych i wymieszać do uzyskania jednorodnej mieszaniny. 4. Przygotować 100 ml 2.5% roztworu chlorku wapnia w zlewce o pojemności 250 ml. Po rozpuszczeniu roztwór przefiltrować. 5. Z uzyskanej zawiesiny bakterii (lipolitycznych lub ureolitycznych) pobrać po 1 ml (10 razy) i wkraplać powoli do 2.5% roztworu chlorku wapnia. 6. Po 20 min. po ostatnim wkropleniu zawiesiny bakterii uzyskane kulki alginianowe z immobilizowanymi bakterami przepłukać jałową wodą destylowaną. 7. Przygotować hodowle według tabeli: Kolba (250 ml) Bakterie (10 ml) 1 zawiesina bakterii ureolitycznych 2 zawiesina bakterii ureolitycznych immobilizowanych 3 zawiesin bakterii lipolitycznych 4 zawiesin bakterii lipolitycznych immobilizowanych Podłoże (100 ml) 1/10 LB z 3 % mocznikiem i czerwienią fenolową 1/10 LB z 3 % mocznikiem i czerwienią fenolową 20 mm Tris-HCl 80 mm CaCl2 1% (w/v) Tween mm Tris-HCl 80 mm CaCl2 1% (w/v) Tween 80 Ocena aktywności ph, 560 nm ph, 560 nm 450 nm 450 nm Ocena jałowości CFU/ml płytki lane CFU/ml płytki lane CFU/ml płytki lane CFU/ml płytki lane 8. Zmierzyć ph oraz absorbancję hodowli przy odpowiednich do badanych właściwości długościach fal. 9. Ocena aktywności biochemicznej (jak wyżej) oraz jałowości po 3, 18 i 72 h hodowli w temp. 25 C z mieszaniem.
9 9 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Ćwiczenie nr. 6 Temat: Przygotowanie bioreaktora sterylizacja i kalibracja sond Zajęcia prowadzone z wykorzystaniem bioreaktora Biostat B Plus firmy Sartorius (link do strony producenta). Zostanie omówiona metodyka przygotowania urządzenia wraz z oprzyrządowaniem do przeprowadzenia hodowli bakteryjnej na kolejnych zajęciach. 1. Budowa bioreaktora ( w tym wykorzystanego na zajęciach) 2. Metody hodowli drobnoustrojów: okresowa, półokresowa i ciągła 3. Typy bioreaktorów złożenie zestawu (bioreaktor, układ grzewczy, moduł sterujący) omówienia oraz kalibracji sond sterylizacją wraz z jej kontrolą omówienie obsługi modułu sterującego pracę bioreaktora Ćwiczenie nr. 7 Temat: Produkcja biomasy a właściwości lipolityczne wzrostu bakterii w bioreaktorze 1. Budowa bioreaktora ( w tym wykorzystanego na zajęciach) 2. Metody hodowli drobnoustrojów: okresowa, półokresowa i ciągła 3. Pojęcie turbidymetrii 4. Ocena ilościowa właściwości lipolitycznych (ćw. 5) 1. Dzień 1 - Przygotować 3 L podłoża 1/100 LB z dodatkiem 1% (w/v) Tween 80 w bioreaktorze, przeprowadzić kalibrację sondy ph. Sterylizacja układu (121 C, 30 min.) w autoklawie przez prowadzącego zajęcia. 2. Dzień 2 - Po wyjałowieniu i schłodzeniu układu, zmontować bioreaktor wraz z modułem grzewczym (ustawić 25 C) i sterującym (ustawienie warunków wzrostu: kalibracja sond, napowietrzanie, przygotowanie buforów) i pozostawić na 24 godziny (kontrola jałowości). 3. Dzień 3 - przygotować inokulum; 300 ml 1/100 LB z dodatkiem 1% (w/v) Tween 80 zaszczepić odmłodzoną hodowlą Bacillus subtilis (kolekcja Zakładu Mikrobiologii UJK), hodowla 5 godzin w 25 C z wytrząsaniem. Następnie zaszczepić (inokulum) medium hodowlane w bioreaktorze z zastosowaniem pompy perystaltycznej, z zachowaniem warunków sterylności. Pobrać jałowo próbnikiem ok. 10 ml medium i ocenić absorbancję przy długości fali 450 nm. Analizę powtórzyć po 72 godzinnej hodowli. Odczytać zmiany gęstości hodowli (pomiar sondy turbidymetrycznej w funkcji czasu).
10 10 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Ćwiczenie nr. 8 Temat: Izolacja i analiza właściwości litycznych bakteriofagów 1. Środowisko jako źródło bakteriofagów 2. Zastosowanie praktyczne bakteriofagów: fagoterapia, fagotypowanie, inżynieria genetyczna 3. Cykl lityczny i lizogenny bakteriofagów Izolacja bakteriofagów z gleby Odważyć 10 g gleby, przenieść do kolby o pojemności 100 ml zawierającej 50 ml wody. Próbkę inkubować 45 min. na wytrząsarce w temperaturze pokojowej. Zawiesinę przesączyć przez bibułę, a następnie przefiltrować przez filtr strzykawkowy o Ø 0.45 m. Do 20 ml przesączu dodać 1 ml chloroformu i wytrząsać energicznie przez 5 min. Próbkę odstawić na 20 min. w celu opadnięcia chloroformu. Górną warstwę zwirować (4000 obr./min; 40 min.), zlać nadsącz do kolby i napowietrzać go przez wytrząsanie w celu odparowania chloroformu Ocena właściwości litycznych bakteriofagów Właściwości lityczne uzyskanych fagów określić wobec szczepów wzorcowych: E. coli, S. epidermidis, P. aeruginosa, B. subtilis. Kontrola pozytywna: bakteriofag T4 Do 20 ml odmłodzonej hodowli bakteryjnej (18 godzinnej) dodać 2 ml uzyskanej przez chloroformowanie zawiesiny fagów i hodować w warunkach optymalnych dla szczepów przez 48 godzin. Następnie przefiltrować hodowlę przez filtr strzykawkowy o Ø 0.2 m. Do 10 ml przesączu dodać 0.5 ml chloroformu i wytrząsać energicznie przez 5 min. Próbkę odstawić na 20 min. w celu opadnięcia chloroformu. Górną warstwę zwirować (4000 obr./min; 40 min.), zlać nadsącz do kolby i napowietrzać go przez wytrząsanie w celu odparowania chloroformu. Hodowlę i chloroformowanie powtórzyć 3-krotnie (6 dni). Ocena miana faga test płytek z agarem dwuwarstwowym (łysinkowy) Wylać cienką warstwę agaru LB do szalki Petriego i poczekać aż zastygnie (30 min.). Do jałowej probówki szklanej dodać 100 l zawiesiny bakterii oraz 2 ml agaru miękkiego (agar LB ½) schłodzonego do 42 C (łaźnia wodna) oraz 200 l zawiesiny faga. Po wymieszaniu wylać zawartość probówki do wcześniej przygotowanej szalki z zastygniętym agarem LB, delikatnie rozprowadzić po powierzchni i zostawić do zastygnięcia. Szalki przenieść do cieplarki i hodować w warunkach optymalnych dla szczepów przez 24 godziny.
11 11 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Ćwiczenie nr. 9 Temat: Przygotowanie medium hodowlanego, zasady hodowli komórek eukariotycznych in vitro 1. Zasady hodowli komórek eukariotycznych in vitro 2. Rodzaje mediów hodowlanych Przygotowanie medium hodowlanego do hodowli komórek A549 W sterylnej butelce przygotować 100 ml medium hodowlanego. Skład medium: pożywka F12-HAM 10 % surowicy płodowej bydlęcej 5 ml antybiotyku (antybiotyk dodajemy do nowo otwartej butelki medium na 500 ml) Przygotowanie medium hodowlanego do hodowli komórek HepG2 W sterylnej butelce przygotować 100 ml medium hodowlanego. Skład medium: pożywka William s Medium 10 % surowicy płodowej bydlęcej 5ml antybiotyku (antybiotyk dodajemy do nowo otwartej butelki medium na 500 ml) 5ml L-glutamuny (L-glutaminę dodajemy do nowo otwartej butelki medium na 500 ml) Pasażowanie komórek A549 i HepG2 Obejrzeć komórki pod mikroskopem odwróconym i ocenić czy komórki nadają się do pasażowania. Ściągnąć pożywkę z hodowli. Wlać do szalki 3 ml PBS. Wylać PBS. Dodać do hodowli 1 ml trypsyny. Wstawić do inkubatora na 2 minuty. Dodać do szalki 2 ml pożywki. Oderwać komórki energicznie pipetując. Przenieść 250 μl zawiesiny komórek do nowej sterylnej szalki i dopełnić odpowiednią pożywką do 5 ml. Obejrzeć komórki pod mikroskopem odwróconym Wstawić do inkubatora. Literatura: 1. Stokłosa S. Hodowla komórek i tkanek. PWN. Warszawa 2011, wyd Stasiak P, Sznitowska M. Zastosowanie hodowli komórkowych w badaniach biofarmaceutycznych. Badania farmaceutyczne. 2010: 66, 3. (link)
12 12 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Ćwiczenie nr. 10 Temat: Analiza żywotności komórek A549 i HepG2 traktowanych różnymi stężeniami lizatów środowiskowych 1. Metody oznaczania żywotności komórek Przygotowanie komórek A549 i HepG2 do analizy żywotności Zlać płyn z nad komórek do próbówki wirówkowej, przepłukać komórki PBS (3 ml), dodać około 1 ml trypsyny i wstawić do inkubatora na 2 minuty, po tym czasie zablokować działanie trypsyny przez dodanie do naczynia hodowlanego 2 ml pełnej pożywki, oderwać komórki od podłoża przez energiczne pipetowanie. Następnie, zawiesinę przenieść do uprzednio przygotowanej probówki, a następnie połowę objętości przenieść do drugiej probówki w celu analizy żywotności jodkiem propidyny (analiza w cytometrze przepływowym). Zawiesiny odwirować (900 obr./min., przez 10 min.); nadsącz zlać, a komórki zawiesić w 0,5 ml odpowiedniej pożywki (barwienie błękitem trypanu) lub 100 μl buforu BB (ang. Binding Buffer); analiza w cytometrze przepływowym) i dokładnie rozpipetować. Przygotowanie buforu BB; rozcieńczenie 1:10 z wodą destylowaną. Barwienie i liczenie komórek testem z błękitem trypanu przy użyciu mikroskopu świetlnego W przygotowanej zawiesinie oznaczyć żywotność komórek testem z błękitem trypanu. W tym celu na szkiełko podstawowe nanieść kroplę zawiesiny komórek oraz kroplę wodnego roztworu błękitu trypanu, dokładnie wymieszać i nakryć szkiełkiem nakrywkowym. Po ok. 3 minutach analizować komórki pod mikroskopem świetlnym. Zanalizować 1000 komórek i określić procent komórek żywych (komórki martwe barwią się na niebiesko). Uwaga: błękit trypanu przy dłuższej inkubacji jest dla komórek toksyczny! Barwienie i liczenie komórek testem z błękitem trypanu przy użyciu czytnika automatycznego typu ang. cell counter W przygotowanej zawiesinie oznaczyć żywotność komórek testem z błękitem trypanu przy użyciu cell counter. W tym celu do probówki typu eppendorf dodać 10 μl zawiesiny komórek oraz 10 μl błękitu trypanu a następnie wymieszać. Pobrać 10 μl zawiesiny komórek i przenieść do komory a następnie analizować w czytniku po wybraniu odpowiednich ustawień. Barwienie i liczenie komórek testem z jodkiem propidyny przy użyciu cytometru przepływowego Zawiesinę komórek przenieść do probówek cytometrycznych (hodowle kontrolną podzielić na dwie części i uzupełnić buforem BB do 100 μl) a następnie dodać 5 μl jodku propidyny do wszystkich probówek z pominięciem jednej kontroli, która posłuży do ustawień pomiaru. Inkubować w ciemności przez 15 minut. Po tym czasie dodać 200 μl buforu BB, a następnie analizować komórki w cytometrze przepływowym. Literatura Skierski J. Badanie działania cytotoksycznego substancji chemicznych. Postępy Biologii Komórki 2008: 35; (link)
13 13 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Ćwiczenie nr. 11 Temat: Analiza apoptozy komórek A549 i HepG2 traktowanych różnymi stężeniami lizatów środowiskowych za pomocą cytometru przepływowego 1. Pojęcie apoptozy 2. Budowa i zasada działania cytometru przepływowego 3. Metody pomiaru apoptozy Przygotowanie komórek A549 i HepG2 do analizy apoptozy Zlać płyn z nad komórek do próbówki wirówkowej, przepłukać komórki PBS (3 ml), dodać około 1 ml trypsyny i wstawić do inkubatora na 2 minuty, po tym czasie zablokować działanie trypsyny przez dodanie do naczynia hodowlanego 2 ml pełnej pożywki, oderwać komórki od podłoża przez energiczne pipetowanie. Następnie zawiesinę przenieść do uprzednio przygotowanej probówki, komórki odwirować (900obr./min., przez 10 min.); nadsącz delikatnie odciągnąć Przygotowanie buforu BB (ang. Binding Buffer); rozcieńczenie 1:10 z wodą destylowaną. Przygotowanie cytometru do pracy a) Przepłukać cytometr Facs Rince i wodą destylowaną. W tym celu do probówki cytometrycznej wlać 4 ml Facs Rince, pozostawić ramię odchylone aż pozostanie połowa płynu, wtedy podstawić ramię i poczekać 2 minuty. W analogiczny sposób przeprowadzić płukanie cytometru wodą destylowaną. b) Wykonać CST Cytometer Settings Tracking Do probówki cytometrycznej wlać 350 μl Facs Flow, a następnie dodać 1 kroplę odpowiednich beadsów. Przeprowadzić badanie w cytometrze wybierając ustawienia CST. Przygotowanie prób do kompensacji W celu wykonania kompensacji przygotować komórki niebarwione (kontrola), komórki barwione PI (kontrola pozytywna) oraz komórki barwione aneksyną V znakowaną fluoresceiną (kontrola pozytywna) (3 probówki). W celu wykonania pomiarów przygotować 2 probówki barwione aneksyną V sprzężoną z fluoresceiną i jodkiem propidyny (PI) (kontrola i kontrola pozytywna). Znakowanie komórek wykonać za pomocą komercyjnego zestawu Annexin V-FITC Apoptosis Detection Kit I (Becton Dickinson, USA). W tym celu do probówki z komórkami kontrolnymi dodać 200 μl binding buffer a do probówki z kontrolą pozytywną dodać 300 μl bufor BB a następnie przenieść po 100 μl zawiesiny komórek do probówek cytometrycznych (komórki z kontroli rozdzielić do dwóch probówek a komórki z kontroli pozytywnej rozdzielić do trzech probówek). Jedną z probówek z komórkami kontrolnymi pozostawić niebarwioną a do drugiej probówki dodać aleksynę V znakowaną fluoresceiną i PI. Do 1 probówki z komórkami z kontroli pozytywnej dodać 5 μl jodku propidyny, do drugiej 5 μl aneksyny V, znakowanej fluoresceiną a do trzeciej probówki dodać aneksynę V znakowaną fluoresceiną i PI. Komórki wymieszać i pozostawić w ciemności na minut. Po tym czasie do każdej probówki dodać 200 μl buforu BB i zrobić kompensację w cytometrze. Następnie przygotować arkusz pracy i wykonać pomiar apoptozy w probówce z komórkami kontrolnymi i z komórkami z kontroli pozytywnej.
14 14 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Analiza apoptozy Po odwirowaniu i odciągnięciu nadsączu komórki zawiesić w 100 μl buforu BB i przenieść do uprzednio podpisanych probówek cytometrycznych. Znakowanie komórek wykonać za pomocą komercyjnego zestawu Annexin V-FITC Apoptosis Detection Kit I (Becton Dickinson, USA). Do każdej probówki dodać 5 μl jodku propidyny i 5 μl aneksyny V, znakowanej fluoresceiną. Komórki inkubować w ciemności, w temperaturze pokojowej przez 15 minut, a następnie dodać do zawiesiny 200 μl buforu BB. Znakowane komórki analizować w cytometrze przepływowym LSR II (Becton Dickinson). Wyróżnić 4 populacje komórek: komórki żywe (annexin-/ip-), komórki we wczesnej apoptozie (annexin+/ip-), komórki w późnej apoptozie (annexin+/ip+) oraz komórki nekrotyczne (annexin -/IP+). Q1 Q2 Q1 komórki nekrotyczne Q2 komórki w późnej apoptozie Q3 komórki żywe Q4 komórki we wczesnej apoptozie Q3 Q4 Literatura Skotny A., Pucińska J. Współczesna cytometria przepływowa. Acta Bio-Optica et Informatica Medica. Inżynieria Biomedyczna, 2013, 19 (link)
15 15 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Ćwiczenie nr. 12 Temat: Analiza częstości mikrojąder w komórkach A549 i HepG2 traktowanych różnymi stężeniami lizatów środowiskowych Zasady testu mikrojądrowego, Fenech 2003; Mutation Research 534 (2003) Schemat powstawania mikrojąder fragment acentryczny Schemat eksperymentu lizat Cytochalazyna B 24h 24h 24h założenie hodowli komórkowej Grupy eksperymentalne: 1. Lizat I, dawki: 50µM, 125µM, 250µM, komórki A Lizat I, dawki: 50µM, 125µM, 250µM, komórki HepG2 3. Lizat II, dawki: 50µM, 125µM, 250µM, komórki A Lizat II, dawki: 50µM, 125µM, 250µM, komórki HepG2 zebranie komórek i utrwalenie
16 16 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Stężenia lizatów (10 mg/ml) na 3ml pożywki hodowlanej (3000µl): 50µM - 15µl 125µM 37,5µl 250µM - 75µl Zagadnienia praktycznę Na ćwiczenia przygotowano hodowle komórek, dodano odpowiednie dawki lizatów oraz cytochalazynę B. Zebranie komórek a) zlać pożywkę z szalek z komórkami b) przepłukać komórki PBS (3ml) c) dodać po 0,5 ml trypsyny i wstawić komórki do inkubatora na 2 min d) dodać do szalek po 3 ml pożywki hodowlanej e) oderwać komórki od dna szalki przez energiczne pipetowanie f) przenieść zawiesiny komórek do probówek (wcześniej odpowiednio podpisanych) Utrwalanie komórek a) odwirować komórki, 900 obr/min, 5 min b) odciągnąć supernatant zostawiając ok. 0,5 ml zawiesiny, dodać 5 ml 0,14M KCl (powoli, mieszać na mieszadle), pozostawić na 15 min c) odwirować komórki, 900 obr/min, 5 min d) odciągnąć supernatant zostawiając ok. 0,5 ml zawiesiny, dodać powoli utrwalacza I, zostawić na 10 min e) odwirować komórki, 1000 obr/min, 5 min, zebrać supernatant, dodać powoli utrwalacza II f) czynność e) powtórzyć 2-3 razy g) odwirować komórki, 1000 obr/min, 5 min, zebrać supernatant zostawiając ok. 0,3 ml zawiesiny h) zawiesinę nakroplić na umyte etanolem szkiełka podstawowe mikroskopowe i) preparaty suszyć w temperaturze pokojowej kilka godzin Barwienie komórek a) przygotować w kominku 5% roztwór barwnika Giemsy (w buforze Sorensena) b) barwić preparaty 10 min c) płukać szkiełka w wodzie destylowanej d) suszyć kilka minut Utrwalanie i wybarwianie kolonii a) zlać pożywkę b) przepłukać komórki zimnym PBS (3ml) c) dodać 3 ml metanolu na 5 min d) zlać metanol i pozostawić szalki do wyschnięcia (ok. 15 min) Analiza mikrojąder a) liczyć mikrojądra występujące wyłącznie w binukleatach i notować na załączonym arkuszu b) zanalizować binukleatów, podać liczbę mikrojąder na 1000 binukleatów
17 17 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Ćwiczenie nr. 13 Temat: Analiza przeżywalności komórek A549 i HepG2 traktowanych różnymi stężeniami lizatów środowiskowych test klonogenny Zasady klonogennego testu przeżywalności, Basic clinical radiobiology. Gordon Steel Test przeżywalności - schemat eksperymentu komórki w hodowli trypsyna zawiesina komórek liczenie gęstości komórek w komorze B ü rkera rozsianie kontrola D 5µM D 15µM D 30µM D 60µM D 100µM inkubacja: 1-2 tygodnie Grupy eksperymentalne: Lizat I, dawki: 5µM, 15µM, 30µM, 60µM, 100µM, komórki A549 Lizat I, dawki: 5µM, 15µM, 30µM, 60µM, 100µM, komórki HepG2 Lizat II, dawki: 5µM, 15µM, 30µM, 60µM, 100µM, komórki A549 Lizat II, dawki: 5µM, 15µM, 30µM, 60µM, 100µM, komórki HepG2 Dawki lizatów na 3ml pożywki hodowlanej (3000µl): 5µM - 15µl 15µM - 45µl 30µM - 90µl 60µM - 180µl 100µM - 300µl Zagadnienia praktyczne Przygotowanie zawiesiny pojedynczych komórek a) zlać pożywkę z szalki z komórkami b) przepłukać komórki PBS (3ml) c) dodać 1 ml trypsyny i wstawić komórki do inkubatora na 2 min d) dodać do szalki 3 ml pożywki hodowlanej e) oderwać komórki od dna szalki przez energiczne pipetowanie f) przenieść zawiesinę komórek do probówki
18 18 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Liczenie komórek w komorze Bǘrkera a) dobrze wymieszać zawiesinę komórek i po kropli umieścić w komorze Bǘrkera a następnie policzyć gęstość komórek b) policzyć w jakiej objętości znajduje się 100, 150 i 200 komórek, przygotować odpowiednie rozcieńczenia komórek 1. Liczymy komórki w dużych kwadratach. 2. Komórki leżące na krawędziach liczymy tylko z dwóch krawędzi (np. górnej i prawej). 3. Wyliczamy średnią liczbę komórek w jednym kwadracie. 4. W oparciu o policzoną średnią komórek i dane komory Bürkera (powierzchnia dużego kwadratu = 0,04 mm 2,a objętość = 0,004 mm 3 obliczamy liczbę komórek w dowolnej objętości. Założenie hodowli komórkowych z odpowiednią liczbą komórek wg schematu a) przygotować po 6 szalek na każdą grupę eksperymentalną, odpowiednio je opisać (ważne!) b) do każdej szalki wlać 2 ml pożywki hodowlanej c) do szalek dodać odpowiednią liczbę komórek d) dodać odpowiednią dawkę lizatu środowiskowego e) uzupełnić pożywkę do 3ml f) umieścić hodowle w inkubatorze i inkubować przez 2 tygodnie Utrwalenie i wybarwianie kolonii a) zlać pożywkę b) przepłukać komórki zimnym PBS (3ml) c) dodać 3 ml metanolu na 5 min d) zlać metanol i pozostawić szalki do wyschnięcia (ok. 15 min) Wykreślanie krzywej przeżywalności Policzyć kolonie komórek A549 / HepG2 w hodowlach traktowanych kolejnymi dawkami lizatów środowiskowych oraz w hodowli kontrolnej. Następnie obliczyć wydajność klonowania PE oraz frakcje przeżywalności SF. Wykreślić krzywą przeżywalności.
19 19 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK PE wydajność klonowania (plating efficiency) Dawka (µm) liczba komórek liczba kolonii PE SF PE = liczba kolonii liczba komórek SF - frakcja przeżywalności (surviving fraction) SF = PE komórek traktowanych PE komórek kontrolnych
Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Inżynieria bioprocesowa na kierunku biotechnologia
 1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Inżynieria bioprocesowa na kierunku biotechnologia 2 Zakład Mikrobiologii UJK Zakres materiału
1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Inżynieria bioprocesowa na kierunku biotechnologia 2 Zakład Mikrobiologii UJK Zakres materiału
Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Mikrobiologia na kierunku chemia kosmetyczna
 1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Mikrobiologia na kierunku chemia kosmetyczna 2 Zakład Mikrobiologii UJK Zakres materiału (zagadnienia)
1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Mikrobiologia na kierunku chemia kosmetyczna 2 Zakład Mikrobiologii UJK Zakres materiału (zagadnienia)
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN
 ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
Do jednego litra medium dodać 10,0 g skrobi ziemniaczanej lub kukurydzianej i mieszać do uzyskania zawiesiny. Sterylizować w autoklawie.
 Ćwiczenie 3. Izolacja laseczek przetrwalnikujących z gleby Cel ćwiczenia: Izolacja i testowanie przydatności biotechnologicznej laseczek z rodzaju Bacillus występujących w glebie. Odczynniki i podłoża:
Ćwiczenie 3. Izolacja laseczek przetrwalnikujących z gleby Cel ćwiczenia: Izolacja i testowanie przydatności biotechnologicznej laseczek z rodzaju Bacillus występujących w glebie. Odczynniki i podłoża:
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna.
 Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
E.coli Transformer Kit
 E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
Komórki macierzyste zastosowania w biotechnologii i medycynie BT Metody identyfikacji i fenotypowania populacji komórek macierzystych
 Metody identyfikacji i fenotypowania populacji komórek macierzystych 1 Wstęp Szpik kostny zawiera hematopoetyczne (HSC) oraz niehematopoetyczne komórki macierzyste (KM). Do niehematopoetycznych KM należą:
Metody identyfikacji i fenotypowania populacji komórek macierzystych 1 Wstęp Szpik kostny zawiera hematopoetyczne (HSC) oraz niehematopoetyczne komórki macierzyste (KM). Do niehematopoetycznych KM należą:
Technika hodowli komórek leukemicznych
 Fizjologiczne Techniki Badań Technika hodowli komórek leukemicznych Zasady prowadzenia hodowli komórek leukemicznych, pasażowania, mrożenia, rozmrażania i przechowywania komórek leukemicznych Warunki wstępne:
Fizjologiczne Techniki Badań Technika hodowli komórek leukemicznych Zasady prowadzenia hodowli komórek leukemicznych, pasażowania, mrożenia, rozmrażania i przechowywania komórek leukemicznych Warunki wstępne:
woda do 1000 ml ph=6,9-7,1. Po sterylizacji dodać nystatynę (końcowe stężenie ok. 50 μg/ml). Agar z wyciągiem glebowym i ekstraktem drożdżowym (YS)
 Ćwiczenie 1, 2, 3, 4 Skrining ze środowiska naturalnego: selekcja promieniowców zdolnych do produkcji antybiotyków. Testowanie zdolności do syntezy antybiotyków przez wyselekcjonowane szczepy promieniowców
Ćwiczenie 1, 2, 3, 4 Skrining ze środowiska naturalnego: selekcja promieniowców zdolnych do produkcji antybiotyków. Testowanie zdolności do syntezy antybiotyków przez wyselekcjonowane szczepy promieniowców
ĆWICZENIA Z MECHANIZMÓW DZIAŁANIA WYBRANYCH GRUP LEKÓW
 UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z MECHANIZMÓW DZIAŁANIA WYBRANYCH GRUP LEKÓW dla studentów I roku II 0 biotechnologii medycznej
UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z MECHANIZMÓW DZIAŁANIA WYBRANYCH GRUP LEKÓW dla studentów I roku II 0 biotechnologii medycznej
ALGALTOXKIT F Procedura testu
 ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
Novabeads Food DNA Kit
 Novabeads Food DNA Kit Novabeads Food DNA Kit jest nowej generacji narzędziem w technikach biologii molekularnej, umożliwiającym izolację DNA z produktów spożywczych wysoko przetworzonych. Metoda oparta
Novabeads Food DNA Kit Novabeads Food DNA Kit jest nowej generacji narzędziem w technikach biologii molekularnej, umożliwiającym izolację DNA z produktów spożywczych wysoko przetworzonych. Metoda oparta
BIOLOGIA KOMÓRKI BANKOWANIE KOMÓREK
 BIOLOGIA KOMÓRKI BANKOWANIE KOMÓREK WSTĘP Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta
BIOLOGIA KOMÓRKI BANKOWANIE KOMÓREK WSTĘP Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta
HODOWLA PERIODYCZNA DROBNOUSTROJÓW
 Cel ćwiczenia: Celem ćwiczenia jest porównanie zdolności rozkładu fenolu lub wybranej jego pochodnej przez szczepy Stenotrophomonas maltophilia KB2 i Pseudomonas sp. CF600 w trakcie prowadzenia hodowli
Cel ćwiczenia: Celem ćwiczenia jest porównanie zdolności rozkładu fenolu lub wybranej jego pochodnej przez szczepy Stenotrophomonas maltophilia KB2 i Pseudomonas sp. CF600 w trakcie prowadzenia hodowli
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli
 E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
II. OZNACZANIE LICZBY BAKTERII Z GRUPY COLI I BAKTERII Z GRUPY COLI TYP FEKALNY METODĄ PŁYTKOWĄ W ŻYWNOŚCI I INNYCH PRODUKTACH wg PN-ISO 4832: 2007
 Katedra i Zakład Mikrobiologii i Wirusologii Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Mikrobiologia ogólna Biotechnologia medyczna II rok / I o Temat: Żywność jako środowisko życia mikroorganizmów.
Katedra i Zakład Mikrobiologii i Wirusologii Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Mikrobiologia ogólna Biotechnologia medyczna II rok / I o Temat: Żywność jako środowisko życia mikroorganizmów.
XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych. a. Candida albicans preparat z hodowli barwiony metoda Grama
 XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych a. Candida albicans preparat z hodowli barwiony metoda Grama Opis preparatu: b. Saccharomyces cerevisiae preparat z hodowli
XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych a. Candida albicans preparat z hodowli barwiony metoda Grama Opis preparatu: b. Saccharomyces cerevisiae preparat z hodowli
ĆWICZENIE NR 3 BADANIE MIKROBIOLOGICZNEGO UTLENIENIA AMONIAKU DO AZOTYNÓW ZA POMOCĄ BAKTERII NITROSOMONAS sp.
 ĆWICZENIE NR 3 BADANIE MIKROBIOLOGICZNEGO UTLENIENIA AMONIAKU DO AZOTYNÓW ZA POMOCĄ BAKTERII NITROSOMONAS sp. Uwaga: Ze względu na laboratoryjny charakter zajęć oraz kontakt z materiałem biologicznym,
ĆWICZENIE NR 3 BADANIE MIKROBIOLOGICZNEGO UTLENIENIA AMONIAKU DO AZOTYNÓW ZA POMOCĄ BAKTERII NITROSOMONAS sp. Uwaga: Ze względu na laboratoryjny charakter zajęć oraz kontakt z materiałem biologicznym,
ĆWICZENIE 5 Barwniki roślinne. Ekstrakcja barwników asymilacyjnych. Rozpuszczalność chlorofilu
 ĆWICZENIE 5 Barwniki roślinne Ekstrakcja barwników asymilacyjnych 400 mg - zhomogenizowany w ciekłym azocie proszek z natki pietruszki 6 ml - etanol 96% 2x probówki plastikowe typu Falcon na 15 ml 5x probówki
ĆWICZENIE 5 Barwniki roślinne Ekstrakcja barwników asymilacyjnych 400 mg - zhomogenizowany w ciekłym azocie proszek z natki pietruszki 6 ml - etanol 96% 2x probówki plastikowe typu Falcon na 15 ml 5x probówki
BIOLOGIA KOMÓRKI. Testy witalności komórek
 BIOLOGIA KOMÓRKI Testy witalności komórek WSTĘP Każda komórka jest układem termodynamicznie otwartym wymieniającym ze swym otoczeniem materię i energię. Wymiana ta odbywa się poprzez błonę komórkową, której
BIOLOGIA KOMÓRKI Testy witalności komórek WSTĘP Każda komórka jest układem termodynamicznie otwartym wymieniającym ze swym otoczeniem materię i energię. Wymiana ta odbywa się poprzez błonę komórkową, której
BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK
 BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO-FAZOWYM;
BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO-FAZOWYM;
Zestaw do izolacji genomowego DNA z bakterii
 Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
OSTRACODTOXKIT F Procedura testu
 OSTRACODTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI SKONCENTROWANYCH SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 PRZELAĆ ZAWARTOŚĆ 5 FIOLEK
OSTRACODTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI SKONCENTROWANYCH SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 PRZELAĆ ZAWARTOŚĆ 5 FIOLEK
liczba godzin 2 MIKROBIOLOGIA KOSMETOLOGICZNA dla studentów II roku, studiów I st. kierunku KOSMETOLOGIA półpłynne stałe
 MIKROBIOLOGIA KOSMETOLOGICZNA dla studentów II roku, studiów I st. kierunku KOSMETOLOGIA Ćwiczenie 6 i 7 6 Fizjologia drobnoustrojów Wymagania metaboliczne bakterii. Rodzaje podłóż mikrobiologicznych.
MIKROBIOLOGIA KOSMETOLOGICZNA dla studentów II roku, studiów I st. kierunku KOSMETOLOGIA Ćwiczenie 6 i 7 6 Fizjologia drobnoustrojów Wymagania metaboliczne bakterii. Rodzaje podłóż mikrobiologicznych.
Zakład Biologii Molekularnej, Wydział Farmaceutyczny, WUM.
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zakład Biologii Molekularnej, Wydział Farmaceutyczny, WUM.
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
II. Badanie lekowrażliwości drobnoustrojów ćwiczenia praktyczne. Ćwiczenie 1. Oznaczanie lekowrażliwości metodą dyfuzyjno-krążkową
 II. Badanie lekowrażliwości drobnoustrojów ćwiczenia praktyczne Ćwiczenie 1. Oznaczanie lekowrażliwości metodą dyfuzyjno-krążkową Zasada metody: Krążki bibułowe nasycone odpowiednimi ilościami antybiotyków
II. Badanie lekowrażliwości drobnoustrojów ćwiczenia praktyczne Ćwiczenie 1. Oznaczanie lekowrażliwości metodą dyfuzyjno-krążkową Zasada metody: Krążki bibułowe nasycone odpowiednimi ilościami antybiotyków
Temat ćwiczenia: Techniki stosowane w badaniach toksyczności in vitro
 Temat ćwiczenia: Techniki stosowane w badaniach toksyczności in vitro Miarą aktywności cytotoksycznej badanej substancji jest określenie stężenia hamującego, IC 50 (ang. inhibitory concentration), dla
Temat ćwiczenia: Techniki stosowane w badaniach toksyczności in vitro Miarą aktywności cytotoksycznej badanej substancji jest określenie stężenia hamującego, IC 50 (ang. inhibitory concentration), dla
Ćwiczenie 1 Morfologia I fizjologia bakterii
 Ćwiczenie 1 Morfologia I fizjologia bakterii 1. Barwienie złożone - metoda Grama Przygotowanie preparatu: odtłuszczone szkiełko podstawowe, nałożenie bakterii ( z hodowli płynnej 1-2 oczka ezy lub ze stałej
Ćwiczenie 1 Morfologia I fizjologia bakterii 1. Barwienie złożone - metoda Grama Przygotowanie preparatu: odtłuszczone szkiełko podstawowe, nałożenie bakterii ( z hodowli płynnej 1-2 oczka ezy lub ze stałej
ĆWICZENIE 3 DGGE- ELEKTROFOREZA W ŻELU Z GRADIENTEM CZYNNIKA DENATURUJĄCEGO
 ĆWICZENIE 3 DGGE- ELEKTROFOREZA W ŻELU Z GRADIENTEM CZYNNIKA DENATURUJĄCEGO CZĘŚĆ TEORETYCZNA Metody badań i cechy w oparciu o które przeprowadzana jest klasyfikacja i identyfikacja mikroorganizmówh Struktura
ĆWICZENIE 3 DGGE- ELEKTROFOREZA W ŻELU Z GRADIENTEM CZYNNIKA DENATURUJĄCEGO CZĘŚĆ TEORETYCZNA Metody badań i cechy w oparciu o które przeprowadzana jest klasyfikacja i identyfikacja mikroorganizmówh Struktura
Izolowanie DNA i RNA z komórek hodowlanych. Ocena jakości uzyskanego materiału
 II ROK KIERUNEK WETERYNARIA UJCM INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH VIII Izolowanie DNA i RNA z komórek hodowlanych. Ocena jakości uzyskanego materiału 2013/2014 2 ĆWICZENIE VIII Preparatyka całkowitego
II ROK KIERUNEK WETERYNARIA UJCM INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH VIII Izolowanie DNA i RNA z komórek hodowlanych. Ocena jakości uzyskanego materiału 2013/2014 2 ĆWICZENIE VIII Preparatyka całkowitego
PODSTAWY BIOLOGII KOMÓRKI. Bankowanie komórek i ocena ich żywotności
 PODSTAWY BIOLOGII KOMÓRKI Wstęp Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta jest szczególnie
PODSTAWY BIOLOGII KOMÓRKI Wstęp Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta jest szczególnie
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Ćwiczenie 3 Izolacja i rozdział
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Ćwiczenie 3 Izolacja i rozdział
Ćwiczenie 4-5 Mikrobiologiczne kryteria oceny sanitarnej wody
 ĆWICZENIA Z GOSPODARKI ENERGETYCZNEJ, WODNEJ I ŚCIEKOWEJ CZĘŚĆ MIKROBIOLOGICZNA Ćwiczenie 4-5 Mikrobiologiczne kryteria oceny sanitarnej wody Część teoretyczna: 1. Kryteria jakości sanitarnej wody przeznaczonej
ĆWICZENIA Z GOSPODARKI ENERGETYCZNEJ, WODNEJ I ŚCIEKOWEJ CZĘŚĆ MIKROBIOLOGICZNA Ćwiczenie 4-5 Mikrobiologiczne kryteria oceny sanitarnej wody Część teoretyczna: 1. Kryteria jakości sanitarnej wody przeznaczonej
PODSTAWY BIOLOGII KOMÓRKI. Bankowanie komórek i ocena ich żywotności
 PODSTAWY BIOLOGII KOMÓRKI Wstęp Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta jest szczególnie
PODSTAWY BIOLOGII KOMÓRKI Wstęp Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta jest szczególnie
BIOLOGIA KOMÓRKI. Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli wewnątrzkomórkowych
 BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
Separacja komórek w gradiencie gęstości PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 231)
 Separacja komórek w gradiencie gęstości PRAKTIKUM Z BIOLOGII KOMÓRKI () Separacja komórek Separacja komórek w gradiencie gęstości W wielu dziedzinach nauk przyrodniczych istnieje potrzeba stosowania określonej
Separacja komórek w gradiencie gęstości PRAKTIKUM Z BIOLOGII KOMÓRKI () Separacja komórek Separacja komórek w gradiencie gęstości W wielu dziedzinach nauk przyrodniczych istnieje potrzeba stosowania określonej
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii. Biologia komórki nowotworowej: Ćwiczenie B
 Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Biologia komórki nowotworowej: Ćwiczenie B Badanie zmian w budowie błony cytoplazmatycznej komórek wybranych linii nowotworowych
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Biologia komórki nowotworowej: Ćwiczenie B Badanie zmian w budowie błony cytoplazmatycznej komórek wybranych linii nowotworowych
Laboratorium 3 Toksykologia żywności
 Laboratorium 3 Toksykologia żywności Literatura zalecana: Orzeł D., Biernat J. (red.) 2012. Wybrane zagadnienia z toksykologii żywności. Wydawnictwo Uniwersytetu Przyrodniczego we Wrocławiu. Wrocław. Str.:
Laboratorium 3 Toksykologia żywności Literatura zalecana: Orzeł D., Biernat J. (red.) 2012. Wybrane zagadnienia z toksykologii żywności. Wydawnictwo Uniwersytetu Przyrodniczego we Wrocławiu. Wrocław. Str.:
Interpretacja wyników analiz ilości i obecności drobnoustrojów zgodnie z zasadami badań mikrobiologicznych żywności i pasz?
 Wydział Biotechnologii i Nauk o Żywności Seminarium STC 2018 Interpretacja wyników analiz ilości i obecności drobnoustrojów zgodnie z zasadami badań mikrobiologicznych żywności i pasz? Dr inż. Agnieszka
Wydział Biotechnologii i Nauk o Żywności Seminarium STC 2018 Interpretacja wyników analiz ilości i obecności drobnoustrojów zgodnie z zasadami badań mikrobiologicznych żywności i pasz? Dr inż. Agnieszka
Otrzymany w pkt. 8 osad, zawieszony w 2 ml wody destylowanej rozpipetować do 4 szklanych probówek po ok. 0.5 ml do każdej.
 Kwasy nukleinowe izolacja DNA, wykrywanie składników. Wymagane zagadnienia teoretyczne 1. Struktura, synteza i degradacja nukleotydów purynowych i pirymidynowych. 2. Regulacja syntezy nukleotydów. Podstawowe
Kwasy nukleinowe izolacja DNA, wykrywanie składników. Wymagane zagadnienia teoretyczne 1. Struktura, synteza i degradacja nukleotydów purynowych i pirymidynowych. 2. Regulacja syntezy nukleotydów. Podstawowe
OZNACZANIE ZAWARTOŚCI MANGANU W GLEBIE
 OZNACZANIE ZAWARTOŚCI MANGANU W GLEBIE WPROWADZENIE Przyswajalność pierwiastków przez rośliny zależy od procesów zachodzących między fazą stałą i ciekłą gleby oraz korzeniami roślin. Pod względem stopnia
OZNACZANIE ZAWARTOŚCI MANGANU W GLEBIE WPROWADZENIE Przyswajalność pierwiastków przez rośliny zależy od procesów zachodzących między fazą stałą i ciekłą gleby oraz korzeniami roślin. Pod względem stopnia
mgr Sławomir Sułowicz Katedra Mikrobiologii UŚ
 mgr Sławomir Sułowicz Katedra Mikrobiologii UŚ 1) Analiza sanitarna wody 2) Analiza mikrobiologiczna gleby 3) Analiza sanitarna powietrza 4) Charakterystyka szczepów bakterii opornych na antybiotyki, wyizolowanych
mgr Sławomir Sułowicz Katedra Mikrobiologii UŚ 1) Analiza sanitarna wody 2) Analiza mikrobiologiczna gleby 3) Analiza sanitarna powietrza 4) Charakterystyka szczepów bakterii opornych na antybiotyki, wyizolowanych
1 Zakład Mikrobiologii UJK. Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Mikrobiologia na kierunku biologia
 1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Mikrobiologia na kierunku biologia 2 Zakład Mikrobiologii UJK Organizacja zajęć laboratoryjnych
1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Mikrobiologia na kierunku biologia 2 Zakład Mikrobiologii UJK Organizacja zajęć laboratoryjnych
RAPORT Z BADAŃ 01369/2015/D/AGST. Blirt S.A Gdańsk, ul. Trzy Lipy 3/1.38. Dział DNA-Gdańsk. Nr zlecenia
 Strona1/7 Blirt S.A. 80-172 Gdańsk, ul. Trzy Lipy 3/1.38 RAPORT Z BADAŃ Dział DNA-Gdańsk Nr zlecenia 01369/2015/D/AGST NAZWA I ADRES KLIENTA Zenon Koszorz Ground-Therm Sp z o.o. Ul. Stepowa 30 44-105 Gliwice
Strona1/7 Blirt S.A. 80-172 Gdańsk, ul. Trzy Lipy 3/1.38 RAPORT Z BADAŃ Dział DNA-Gdańsk Nr zlecenia 01369/2015/D/AGST NAZWA I ADRES KLIENTA Zenon Koszorz Ground-Therm Sp z o.o. Ul. Stepowa 30 44-105 Gliwice
Zestaw do izolacji genomowego DNA z bakterii
 Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
BIOLOGIA KOMÓRKI. Analiza żywotności komórek w warunkach in vitro
 BIOLOGIA KOMÓRKI Analiza żywotności komórek w warunkach in vitro Wstęp Każda komórka jest układem termodynamicznie otwartym wymieniającym ze swym otoczeniem materię i energię. Wymiana ta odbywa się poprzez
BIOLOGIA KOMÓRKI Analiza żywotności komórek w warunkach in vitro Wstęp Każda komórka jest układem termodynamicznie otwartym wymieniającym ze swym otoczeniem materię i energię. Wymiana ta odbywa się poprzez
Polimeraza Taq (1U/ l) 1-2 U 1 polimeraza Taq jako ostatni składniki mieszaniny końcowa objętość
 Ćwiczenie 6 Technika PCR Celem ćwiczenia jest zastosowanie techniki PCR do amplifikacji fragmentu DNA z bakterii R. leguminosarum bv. trifolii TA1 (RtTA1). Studenci przygotowują reakcję PCR wykorzystując
Ćwiczenie 6 Technika PCR Celem ćwiczenia jest zastosowanie techniki PCR do amplifikacji fragmentu DNA z bakterii R. leguminosarum bv. trifolii TA1 (RtTA1). Studenci przygotowują reakcję PCR wykorzystując
Technika radioimmunologicznego oznaczania poziomu hormonów (RIA) dr Katarzyna Knapczyk-Stwora
 Technika radioimmunologicznego oznaczania poziomu hormonów (RIA) dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Radioimmunologiczne metody oznaczania hormonów steroidowych
Technika radioimmunologicznego oznaczania poziomu hormonów (RIA) dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Radioimmunologiczne metody oznaczania hormonów steroidowych
Zakład Biologii Sanitarnej i Ekotechniki ĆWICZENIE 2 BUDOWA I FUNKCJE ENZYMÓW. ZASTOSOWANIE BADAŃ ENZYMATYCZNYCH W INŻYNIERII ŚRODOWISKA.
 ĆWICZENIE 2 BUDOWA I FUNKCJE ENZYMÓW. ZASTOSOWANIE BADAŃ ENZYMATYCZNYCH W INŻYNIERII ŚRODOWISKA. /Opiekun merytoryczny: dr hab. Teodora M. Traczewska, prof. nadzw. PWr modyfikacja: dr inż. Agnieszka Trusz-Zdybek
ĆWICZENIE 2 BUDOWA I FUNKCJE ENZYMÓW. ZASTOSOWANIE BADAŃ ENZYMATYCZNYCH W INŻYNIERII ŚRODOWISKA. /Opiekun merytoryczny: dr hab. Teodora M. Traczewska, prof. nadzw. PWr modyfikacja: dr inż. Agnieszka Trusz-Zdybek
SYLABUS. Wydział Biologiczno - Rolniczy. Katedra Biotechnologii i Mikrobiologii
 SYLABUS 1.1. PODSTAWOWE INFORMACJE O PRZEDMIOCIE/MODULE Nazwa przedmiotu/ modułu Mikrobiologia Kod przedmiotu/ modułu* Wydział (nazwa jednostki prowadzącej kierunek) Nazwa jednostki realizującej przedmiot
SYLABUS 1.1. PODSTAWOWE INFORMACJE O PRZEDMIOCIE/MODULE Nazwa przedmiotu/ modułu Mikrobiologia Kod przedmiotu/ modułu* Wydział (nazwa jednostki prowadzącej kierunek) Nazwa jednostki realizującej przedmiot
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016 Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa farmacjamolekularna@wum.edu.pl
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016 Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa farmacjamolekularna@wum.edu.pl
CEL ĆWICZENIA: Zapoznanie się z przykładową procedurą odsalania oczyszczanych preparatów enzymatycznych w procesie klasycznej filtracji żelowej.
 LABORATORIUM 3 Filtracja żelowa preparatu oksydazy polifenolowej (PPO) oczyszczanego w procesie wysalania siarczanem amonu z wykorzystaniem złoża Sephadex G-50 CEL ĆWICZENIA: Zapoznanie się z przykładową
LABORATORIUM 3 Filtracja żelowa preparatu oksydazy polifenolowej (PPO) oczyszczanego w procesie wysalania siarczanem amonu z wykorzystaniem złoża Sephadex G-50 CEL ĆWICZENIA: Zapoznanie się z przykładową
Oznaczanie aktywności - i β- amylazy słodu metodą kolorymetryczną
 KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Oznaczanie aktywności - i β- amylazy słodu metodą kolorymetryczną ĆWICZENIE 5 OZNACZANIE AKTYWNOŚCI -AMYLAZY SŁODU METODĄ KOLORYMETRYCZNĄ Enzymy
KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Oznaczanie aktywności - i β- amylazy słodu metodą kolorymetryczną ĆWICZENIE 5 OZNACZANIE AKTYWNOŚCI -AMYLAZY SŁODU METODĄ KOLORYMETRYCZNĄ Enzymy
SPRAWOZDANIE Z ĆWICZEŃ Z HIGIENY, TOKSYKOLOGII I BEZPIECZEŃSTWA ŻYWNOŚCI
 Data.. Imię, nazwisko, kierunek, grupa SPRAWOZDANIE Z ĆWICZEŃ Z HIGIENY, TOKSYKOLOGII I BEZPIECZEŃSTWA ŻYWNOŚCI OCENA JAKOŚCI WODY DO PICIA Ćwiczenie 1. Badanie właściwości fizykochemicznych wody Ćwiczenie
Data.. Imię, nazwisko, kierunek, grupa SPRAWOZDANIE Z ĆWICZEŃ Z HIGIENY, TOKSYKOLOGII I BEZPIECZEŃSTWA ŻYWNOŚCI OCENA JAKOŚCI WODY DO PICIA Ćwiczenie 1. Badanie właściwości fizykochemicznych wody Ćwiczenie
fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 Sierpień 2018
 Sierpień 2018 fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 EURx Ltd. 80-297 Gdansk Poland ul. Przyrodnikow 3, NIP 957-07-05-191 KRS
Sierpień 2018 fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 EURx Ltd. 80-297 Gdansk Poland ul. Przyrodnikow 3, NIP 957-07-05-191 KRS
ĆWICZENIE 4. Oczyszczanie ścieków ze związków fosforu
 ĆWICZENIE 4 Oczyszczanie ścieków ze związków fosforu 1. Wprowadzenie Zbyt wysokie stężenia fosforu w wodach powierzchniowych stojących, spiętrzonych lub wolno płynących prowadzą do zwiększonego przyrostu
ĆWICZENIE 4 Oczyszczanie ścieków ze związków fosforu 1. Wprowadzenie Zbyt wysokie stężenia fosforu w wodach powierzchniowych stojących, spiętrzonych lub wolno płynących prowadzą do zwiększonego przyrostu
Oznaczanie aktywności cytotoksycznej chemoterapeutyków wobec komórek nowotworowych
 Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Kultury tkankowe i komórkowe roślin i zwierząt Oznaczanie aktywności cytotoksycznej chemoterapeutyków wobec komórek nowotworowych
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Kultury tkankowe i komórkowe roślin i zwierząt Oznaczanie aktywności cytotoksycznej chemoterapeutyków wobec komórek nowotworowych
Oznaczanie SO 2 w powietrzu atmosferycznym
 Ćwiczenie 6 Oznaczanie SO w powietrzu atmosferycznym Dwutlenek siarki bezwodnik kwasu siarkowego jest najbardziej rozpowszechnionym zanieczyszczeniem gazowym, występującym w powietrzu atmosferycznym. Głównym
Ćwiczenie 6 Oznaczanie SO w powietrzu atmosferycznym Dwutlenek siarki bezwodnik kwasu siarkowego jest najbardziej rozpowszechnionym zanieczyszczeniem gazowym, występującym w powietrzu atmosferycznym. Głównym
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
BIOLOGIA KOMÓRKI. Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli wewnątrzkomórkowych
 BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
Kontrola pożywek mikrobiologicznych. Sekcja Badań Epidemiologicznych
 Kontrola pożywek mikrobiologicznych Sekcja Badań Epidemiologicznych 27.04.2015 Zgodnie z ISO 17025 oraz ISO 15189 jednym z czynników istotnie wpływających na jakość wyników badań w przypadku badań mikrobiologicznych,
Kontrola pożywek mikrobiologicznych Sekcja Badań Epidemiologicznych 27.04.2015 Zgodnie z ISO 17025 oraz ISO 15189 jednym z czynników istotnie wpływających na jakość wyników badań w przypadku badań mikrobiologicznych,
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
ĆWICZENIE B: Oznaczenie zawartości chlorków i chromu (VI) w spoiwach mineralnych
 ĆWICZEIE B: znaczenie zawartości chlorków i chromu (VI) w spoiwach mineralnych Cel ćwiczenia: Celem ćwiczenia jest oznaczenie zawartości rozpuszczalnego w wodzie chromu (VI) w próbce cementu korzystając
ĆWICZEIE B: znaczenie zawartości chlorków i chromu (VI) w spoiwach mineralnych Cel ćwiczenia: Celem ćwiczenia jest oznaczenie zawartości rozpuszczalnego w wodzie chromu (VI) w próbce cementu korzystając
Techniki oznaczania aktywności cytotoksycznej związków chemioterapeutycznych in vitro
 Fizjologiczne techniki badań Techniki oznaczania aktywności cytotoksycznej związków chemioterapeutycznych in vitro Wstęp: Oznaczanie cytotoksyczności związków chemioterapeutycznych wobec komórek w hodowlach
Fizjologiczne techniki badań Techniki oznaczania aktywności cytotoksycznej związków chemioterapeutycznych in vitro Wstęp: Oznaczanie cytotoksyczności związków chemioterapeutycznych wobec komórek w hodowlach
1276:1997 13368 (ATCC
 Działanie bakteriobójcze Środka biobójczego Clinell GAMA Healthcare Ltd. zbadane za pomocą Europejskiego Standardowego Testu według normy BS EN 1276:1997 wobec: Klebsiella pneumoniae NCTC 13368 (ATCC 700603).
Działanie bakteriobójcze Środka biobójczego Clinell GAMA Healthcare Ltd. zbadane za pomocą Europejskiego Standardowego Testu według normy BS EN 1276:1997 wobec: Klebsiella pneumoniae NCTC 13368 (ATCC 700603).
ANALIZA TŁUSZCZÓW WŁAŚCIWYCH CZ II
 KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska ANALIZA TŁUSZCZÓW WŁAŚCIWYCH CZ II ĆWICZENIE 8 ZADANIE 1 HYDROLIZA LIPIDÓW MLEKA ZA POMOCĄ LIPAZY TRZUSTKOWEJ Lipazy (EC 3.1) to enzymy należące
KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska ANALIZA TŁUSZCZÓW WŁAŚCIWYCH CZ II ĆWICZENIE 8 ZADANIE 1 HYDROLIZA LIPIDÓW MLEKA ZA POMOCĄ LIPAZY TRZUSTKOWEJ Lipazy (EC 3.1) to enzymy należące
Odczynnik do izolacji RNA z tkanek zwierzęcych, roślinnych oraz linii komórkowych
 Nr kat.: EM30-100, EM30-200 Wersja zestawu: 1.2015 Odczynnik do izolacji RNA z tkanek zwierzęcych, roślinnych oraz linii komórkowych EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. I. PRZEZNACZENIE
Nr kat.: EM30-100, EM30-200 Wersja zestawu: 1.2015 Odczynnik do izolacji RNA z tkanek zwierzęcych, roślinnych oraz linii komórkowych EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. I. PRZEZNACZENIE
Ćwiczenie 5 Klonowanie DNA w wektorach plazmidowych
 Ćwiczenie 5 Klonowanie DNA w wektorach plazmidowych Celem ćwiczenia jest sklonowanie fragmentu DNA (powielonego techniką PCR i wyizolowanego z żelu agarozowego na poprzednich zajęciach) do wektora plazmidowego
Ćwiczenie 5 Klonowanie DNA w wektorach plazmidowych Celem ćwiczenia jest sklonowanie fragmentu DNA (powielonego techniką PCR i wyizolowanego z żelu agarozowego na poprzednich zajęciach) do wektora plazmidowego
Protokoły do zajęć praktycznych z mikrobiologii ogólnej i żywności dla studentów kierunku: Dietetyka
 Protokoły do zajęć praktycznych z mikrobiologii ogólnej i żywności dla studentów kierunku: Dietetyka Protokół I, zajęcia praktyczne 1. Demonstracja wykonania preparatu barwionego metodą Grama (wykonuje
Protokoły do zajęć praktycznych z mikrobiologii ogólnej i żywności dla studentów kierunku: Dietetyka Protokół I, zajęcia praktyczne 1. Demonstracja wykonania preparatu barwionego metodą Grama (wykonuje
Doktorantka: Żaneta Lewandowska
 Doktorantka: Żaneta Lewandowska Główny opiekun naukowy: Dr hab. Piotr Piszczek, prof. UMK Katedra Chemii Nieorganicznej i Koordynacyjnej, Wydział Chemii Dodatkowy opiekun naukowy: Prof. dr hab. Wiesław
Doktorantka: Żaneta Lewandowska Główny opiekun naukowy: Dr hab. Piotr Piszczek, prof. UMK Katedra Chemii Nieorganicznej i Koordynacyjnej, Wydział Chemii Dodatkowy opiekun naukowy: Prof. dr hab. Wiesław
1. Oznaczanie aktywności lipazy trzustkowej i jej zależności od stężenia enzymu oraz żółci jako modulatora reakcji enzymatycznej.
 ĆWICZENIE OZNACZANIE AKTYWNOŚCI LIPAZY TRZUSTKOWEJ I JEJ ZALEŻNOŚCI OD STĘŻENIA ENZYMU ORAZ ŻÓŁCI JAKO MODULATORA REAKCJI ENZYMATYCZNEJ. INHIBICJA KOMPETYCYJNA DEHYDROGENAZY BURSZTYNIANOWEJ. 1. Oznaczanie
ĆWICZENIE OZNACZANIE AKTYWNOŚCI LIPAZY TRZUSTKOWEJ I JEJ ZALEŻNOŚCI OD STĘŻENIA ENZYMU ORAZ ŻÓŁCI JAKO MODULATORA REAKCJI ENZYMATYCZNEJ. INHIBICJA KOMPETYCYJNA DEHYDROGENAZY BURSZTYNIANOWEJ. 1. Oznaczanie
Zestaw do izolacji genomowego DNA z drożdży
 Nr kat. EM10 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z drożdży EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.blirt.eu 2 Nr kat. EM10 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM10 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z drożdży EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.blirt.eu 2 Nr kat. EM10 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
data ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1
 Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1 Cel: Wyznaczanie klirensu endogennej kreatyniny. Miarą zdolności nerek do usuwania i wydalania
Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1 Cel: Wyznaczanie klirensu endogennej kreatyniny. Miarą zdolności nerek do usuwania i wydalania
Zestaw do izolacji plazmidowego DNA
 Nr kat. EM01 Wersja zestawu: 1.2014 Zestaw do izolacji plazmidowego DNA EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.dnagdansk.com Nr kat. EM01 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM01 Wersja zestawu: 1.2014 Zestaw do izolacji plazmidowego DNA EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.dnagdansk.com Nr kat. EM01 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Zestaw do izolacji genomowego DNA z bakterii
 Nr kat. EM02 Wersja zestawu: 1.2014 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.dnagdansk.com Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw
Nr kat. EM02 Wersja zestawu: 1.2014 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.dnagdansk.com Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika
 PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
Wydziału Biotechnologii i Nauk o Żywności
 Pracownie i laboratoria dydaktyczno-badawcze Wydziału Biotechnologii i Nauk o Żywności rozmieszczone są w czterech instytutach biorących udział w realizacji w/w zadań: Instytut Podstaw Chemii Żywności
Pracownie i laboratoria dydaktyczno-badawcze Wydziału Biotechnologii i Nauk o Żywności rozmieszczone są w czterech instytutach biorących udział w realizacji w/w zadań: Instytut Podstaw Chemii Żywności
Zestaw do izolacji totalnego DNA z bakterii. Nr kat. EM02 Wersja zestawu:
 Zestaw do izolacji totalnego DNA z bakterii Nr kat. EM02 Wersja zestawu: 1.2012 Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME DNA BACTERIA przeznaczony jest do szybkiej i wydajnej izolacji bakteryjnego
Zestaw do izolacji totalnego DNA z bakterii Nr kat. EM02 Wersja zestawu: 1.2012 Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME DNA BACTERIA przeznaczony jest do szybkiej i wydajnej izolacji bakteryjnego
Zestaw do izolacji plazmidowego DNA. Nr kat. EM01 Wersja zestawu:
 Zestaw do izolacji plazmidowego DNA Nr kat. EM01 Wersja zestawu: 1.2012 www.dnagdansk.com Nr kat. EM01 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME PLASMID DNA przeznaczony jest do szybkiej i wydajnej izolacji
Zestaw do izolacji plazmidowego DNA Nr kat. EM01 Wersja zestawu: 1.2012 www.dnagdansk.com Nr kat. EM01 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME PLASMID DNA przeznaczony jest do szybkiej i wydajnej izolacji
VII. Pałeczki Gram-dodatnie: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus - ćwiczenia praktyczne
 VII. Pałeczki Gram-dodatnie: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus - ćwiczenia praktyczne Ćwiczenie 1. Wykonanie barwionych preparatów mikroskopowych preparat barwiony metodą Grama z
VII. Pałeczki Gram-dodatnie: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus - ćwiczenia praktyczne Ćwiczenie 1. Wykonanie barwionych preparatów mikroskopowych preparat barwiony metodą Grama z
HYDROLIZA SOLI. ROZTWORY BUFOROWE
 Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
XIII. Staphylococcus, Micrococcus ćwiczenia praktyczne
 XIII. Staphylococcus, Micrococcus ćwiczenia praktyczne Ćwiczenie 1. Ocena wzrostu szczepów gronkowców na: a. agarze z dodatkiem 5% odwłóknionej krwi baraniej (AK) typ hemolizy morfologia kolonii.. b. podłożu
XIII. Staphylococcus, Micrococcus ćwiczenia praktyczne Ćwiczenie 1. Ocena wzrostu szczepów gronkowców na: a. agarze z dodatkiem 5% odwłóknionej krwi baraniej (AK) typ hemolizy morfologia kolonii.. b. podłożu
ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1)
 ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1) z dnia 6 listopada 2002 r. w sprawie metodyk referencyjnych badania stopnia biodegradacji substancji powierzchniowoczynnych zawartych w produktach, których stosowanie
ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1) z dnia 6 listopada 2002 r. w sprawie metodyk referencyjnych badania stopnia biodegradacji substancji powierzchniowoczynnych zawartych w produktach, których stosowanie
Zestaw przeznaczony jest do całkowitej izolacji RNA z bakterii, drożdży, hodowli komórkowych, tkanek oraz krwi świeżej (nie mrożonej).
 Total RNA Mini Plus Zestaw do izolacji całkowitego RNA. Procedura izolacji nie wymaga użycia chloroformu wersja 0517 25 izolacji, 100 izolacji Nr kat. 036-25, 036-100 Zestaw przeznaczony jest do całkowitej
Total RNA Mini Plus Zestaw do izolacji całkowitego RNA. Procedura izolacji nie wymaga użycia chloroformu wersja 0517 25 izolacji, 100 izolacji Nr kat. 036-25, 036-100 Zestaw przeznaczony jest do całkowitej
1. Demonstracja preparatów bakteryjnych barwionych metodą negatywną ukazujących kształty komórek bakteryjnych.
 Ćwiczenie 1. Mikrobiologia ogólna - Budowa komórki bakteryjnej. Metody barwienia preparatów bakteryjnych. Wzrost drobnoustrojów w warunkach laboratoryjnych. Uzyskiwanie czystej hodowli. Identyfikowanie
Ćwiczenie 1. Mikrobiologia ogólna - Budowa komórki bakteryjnej. Metody barwienia preparatów bakteryjnych. Wzrost drobnoustrojów w warunkach laboratoryjnych. Uzyskiwanie czystej hodowli. Identyfikowanie
III. Fizjologia bakterii i zasady diagnostyki bakteriologicznej
 III. Fizjologia bakterii i zasady diagnostyki bakteriologicznej Ćwiczenie 1. Rodzaje pożywek i ich zastosowanie a. Podłoże stałe - proste Agar zwykły (AZ) b. Podłoża wzbogacone Agar z dodatkiem 5% odwłóknionej
III. Fizjologia bakterii i zasady diagnostyki bakteriologicznej Ćwiczenie 1. Rodzaje pożywek i ich zastosowanie a. Podłoże stałe - proste Agar zwykły (AZ) b. Podłoża wzbogacone Agar z dodatkiem 5% odwłóknionej
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA)
 Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
XIX. Pałeczki Gram-ujemne część I - ćwiczenia praktyczne
 XIX. Pałeczki Gram-ujemne część I - ćwiczenia praktyczne Ćwiczenie 1. Wykonanie preparatu mikroskopowego barwionego metodą Grama Opis preparatu: Ćwiczenie 2. Ocena wzrostu szczepów na podłożach stałych
XIX. Pałeczki Gram-ujemne część I - ćwiczenia praktyczne Ćwiczenie 1. Wykonanie preparatu mikroskopowego barwionego metodą Grama Opis preparatu: Ćwiczenie 2. Ocena wzrostu szczepów na podłożach stałych
IV. Streptococcus, Enterococcus ćwiczenia praktyczne
 IV. Streptococcus, Enterococcus ćwiczenia praktyczne Ćwiczenie 1. Ocena wzrostu szczepów paciorkowców na: a. agarze z dodatkiem 5% odwłóknionej krwi baraniej (AK) typ hemolizy morfologia kolonii... gatunek
IV. Streptococcus, Enterococcus ćwiczenia praktyczne Ćwiczenie 1. Ocena wzrostu szczepów paciorkowców na: a. agarze z dodatkiem 5% odwłóknionej krwi baraniej (AK) typ hemolizy morfologia kolonii... gatunek
Biologia komórki. Skrypt do ćwiczeń dla studentów Bioinformatyki i Biologii Systemów. (część mikrobiologiczna)
 Biologia komórki Skrypt do ćwiczeń dla studentów Bioinformatyki i Biologii Systemów (część mikrobiologiczna) przygotowany przez zespół pracowników Zakładu Genetyki Bakterii INSTYTUT MIKROBIOLOGII WYDZIAŁ
Biologia komórki Skrypt do ćwiczeń dla studentów Bioinformatyki i Biologii Systemów (część mikrobiologiczna) przygotowany przez zespół pracowników Zakładu Genetyki Bakterii INSTYTUT MIKROBIOLOGII WYDZIAŁ
Szczegółowa ocena nasienia
 Szczegółowa ocena nasienia Ricardo Faundez Zakład Rozrodu, Andrologii i Biotechnologii Rozrodu Zwierząt Katedra Chorób Dużych Zwierząt z Kliniką Wydział Medycyny Weterynaryjnej SGGW Ocena ruchu plemników
Szczegółowa ocena nasienia Ricardo Faundez Zakład Rozrodu, Andrologii i Biotechnologii Rozrodu Zwierząt Katedra Chorób Dużych Zwierząt z Kliniką Wydział Medycyny Weterynaryjnej SGGW Ocena ruchu plemników
Ćwiczenie 7 Klonowanie DNA w wektorach plazmidowych
 Ćwiczenie 7 Klonowanie DNA w wektorach plazmidowych Celem ćwiczenia jest sklonowanie fragmentu DNA (powielonego techniką PCR i wyizolowanego z żelu agarozowego na poprzednich zajęciach) do wektora plazmidowego
Ćwiczenie 7 Klonowanie DNA w wektorach plazmidowych Celem ćwiczenia jest sklonowanie fragmentu DNA (powielonego techniką PCR i wyizolowanego z żelu agarozowego na poprzednich zajęciach) do wektora plazmidowego
Plan ćwiczeń wykonywanych w ramach Pracowni Biologii Molekularnej, część II Ekspresja i oczyszczanie białek.
 Pracownia Biologii Molekularnej Część II Plan ćwiczeń wykonywanych w ramach Pracowni Biologii Molekularnej, część II Ekspresja i oczyszczanie białek. Spis treści 1 I spotkanie: Ekspresja białka w komórkach
Pracownia Biologii Molekularnej Część II Plan ćwiczeń wykonywanych w ramach Pracowni Biologii Molekularnej, część II Ekspresja i oczyszczanie białek. Spis treści 1 I spotkanie: Ekspresja białka w komórkach
THAMNOTOXKIT F Procedura testu
 THAMNOTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 LITR) - 5 FIOLEK ZE SKONCENTROWANYMI ROZTWORAMI SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 WLAĆ ZAWARTOŚĆ 5 FIOLEK
THAMNOTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 LITR) - 5 FIOLEK ZE SKONCENTROWANYMI ROZTWORAMI SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 WLAĆ ZAWARTOŚĆ 5 FIOLEK
Gel-Out. 50 izolacji, 250 izolacji. Nr kat , Zestaw do izolacji DNA z żelu agarozowego. wersja 0617
 Gel-Out Zestaw do izolacji DNA z żelu agarozowego. wersja 0617 50 izolacji, 250 izolacji Nr kat. 023-50, 023-250 Pojemność kolumny do izolacji DNA - do 20 µg DNA, minimalna pojemność - 2 µg DNA (przy zawartości
Gel-Out Zestaw do izolacji DNA z żelu agarozowego. wersja 0617 50 izolacji, 250 izolacji Nr kat. 023-50, 023-250 Pojemność kolumny do izolacji DNA - do 20 µg DNA, minimalna pojemność - 2 µg DNA (przy zawartości
BIOLOGIA KOMÓRKI. Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych
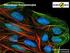 BIOLOGIA KOMÓRKI Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo dużej liczby procesów biochemicznych
BIOLOGIA KOMÓRKI Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo dużej liczby procesów biochemicznych
MATERIAŁY SZKOLENIOWE DLA ZAKŁADÓW HIGIENY WETERYNARYJNEJ W ZAKRESIE LABORATORYJNEJ DIAGNOSTYKI AFRYKAŃSKIEGO POMORU ŚWIŃ
 MATERIAŁY SZKOLENIOWE DLA ZAKŁADÓW HIGIENY WETERYNARYJNEJ W ZAKRESIE LABORATORYJNEJ DIAGNOSTYKI AFRYKAŃSKIEGO POMORU ŚWIŃ Puławy 2013 Opracowanie: Prof. dr hab. Iwona Markowska-Daniel, mgr inż. Kinga Urbaniak,
MATERIAŁY SZKOLENIOWE DLA ZAKŁADÓW HIGIENY WETERYNARYJNEJ W ZAKRESIE LABORATORYJNEJ DIAGNOSTYKI AFRYKAŃSKIEGO POMORU ŚWIŃ Puławy 2013 Opracowanie: Prof. dr hab. Iwona Markowska-Daniel, mgr inż. Kinga Urbaniak,
Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215
 Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215 20 izolacji Nr kat. 895-20D Pojemność kolumny do oczyszczania DNA wynosi 100 µg 1 Skład zestawu Składnik
Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215 20 izolacji Nr kat. 895-20D Pojemność kolumny do oczyszczania DNA wynosi 100 µg 1 Skład zestawu Składnik
Ćwiczenie 1. Technika ważenia oraz wyznaczanie błędów pomiarowych. Ćwiczenie 2. Sprawdzanie pojemności pipety
 II. Wagi i ważenie. Roztwory. Emulsje i koloidy Zagadnienia Rodzaje wag laboratoryjnych i technika ważenia Niepewność pomiarowa. Błąd względny i bezwzględny Roztwory właściwe Stężenie procentowe i molowe.
II. Wagi i ważenie. Roztwory. Emulsje i koloidy Zagadnienia Rodzaje wag laboratoryjnych i technika ważenia Niepewność pomiarowa. Błąd względny i bezwzględny Roztwory właściwe Stężenie procentowe i molowe.
