PODSTAWY BIOLOGII KOMÓRKI. Bankowanie komórek i ocena ich żywotności
|
|
|
- Barbara Mazurek
- 6 lat temu
- Przeglądów:
Transkrypt
1 PODSTAWY BIOLOGII KOMÓRKI
2 Wstęp Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta jest szczególnie przydatna dla zabezpieczenia wyselekcjonowanych linii komórkowych o często unikalnych właściwościach. Bankowanie komórek pozwala również na przerwanie pracy z danym rodzajem komórek na dowolny okres czasu. Zamrożone komórki najczęściej przechowuje się w ciekłym azocie. Zamrażaniu komórek często towarzyszy nieodwracalne uszkodzenie będące wynikiem powstawania dużych kryształków lodu. Zjawisku temu w dużym stopniu zapobiega zamrażanie w obecności krioprotektantów najczęściej glicerolu lub dimetylosulfotlenku (DMSO). Aby uzyskać maksymalny stopień przeżywalności komórek, należy je stosunkowo wolno zamrażać i szybko odmrażać. Zamrażanie nie może jednak być zbyt wolne, gdyż sytuacja taka sprzyja powstawaniu kryształków lodu. Z drugiej strony czas zamrażania musi być wystarczający na zadziałanie środków zabezpieczających (DMSO, glicerol). Optymalna prędkość obniżania temperatury w trakcie zamrażania wynosi 1 C/min. Przeprowadzając mrożenie komórek w zamrażarce programowanej można sterować dynamiką mrożenia indywidualnie dla bankowanej linii komórkowej wykorzystując zoptymalizowane protokoły. Bankowaniu należy poddawać komórki będące w dobrej kondycji, gdyż pomimo najwyższej ostrożności i stosowaniu odpowiednich krioprotektantów, proces ten nie jest dla komórek obojętny i może mu towarzyszyć wzmożona śmiertelność. W celu oceny kondycji komórek, zarówno przed procesem bankowania, jak i po rozmrożeniu komórek, wskazana jest ocena ich żywotności przy użyciu wybranych testów. Każda komórka jest układem termodynamicznie otwartym wymieniającym ze swym otoczeniem materię i energię. Wymiana ta odbywa się poprzez błonę komórkową, której właściwości w dużej mierze decydują o kontrolowaniu przez komórkę swego środowiska, co jest niezbędnym warunkiem koordynacji wewnątrzkomórkowych procesów metabolicznych. Ponieważ wszystkie trwałe uszkodzenia błony komórkowej prowadzą do śmierci komórki, większość testów żywotności (witalności) komórek hodowanych in vitro, nastawiona być powinna na określenie jej integralności. Alternatywnie szereg technik mierzy stan metaboliczny komórki, w ten sposób wskazując na potencjalną zdolność komórki do prawidłowej aktywności metabolicznej, a w konsekwencji do wzrostu i podziału. Testy, które wykorzystują naturalną właściwość błony komórkowej jako bariery dla związków, powinny wykorzystywać związki będące anionami w fizjologicznym ph. Nie wnikają one do żywych komórek ze względu na ujemny ładunek nieuszkodzonej błony, ale po śmierci komórki (gdy błona zostanie trwale uszkodzona i następuje zanik potencjału pomiędzy zewnętrzną a wewnętrzną stroną błony) przenikają do wnętrza komórki barwiąc cytoplazmę lub/i jądro. Najpowszechniej stosowanym barwnikiem z tej grupy jest błękit trypanu (Ryc. 1), który wybarwia komórki martwe na kolor niebieski, ale podobne zastosowanie mogą mieć również zieleń lizaminowa, eozyna Y i erytrozyna B. Ryc.1. Wzór strukturalny błękitu trypanu. 2
3 Podejściem alternatywnym do technik wykorzystujących wyżej wymienione związki jest zastosowanie substancji, które w formie zestryfikowanej swobodnie penetrują nienaruszoną błonę komórkową, natomiast ich de-estryfikacja powoduje wytrącenie w formie wolnej. Prowadzi to do znacznego nagromadzania substancji w cytoplazmie. Przykładem takich substancji jest calceinaam i dwuoctan fluoresceiny. Koncentracja fluoresceiny w komórce możliwa jest wyłącznie gdy: (i) błona komórkowa jest nienaruszona i (ii) w komórce aktywne są enzymy, w tym te z grupy esteraz. Taka komórka widoczna jest w mikroskopie fluorescencyjnym, gdyż fluoresceina w niej zawarta emituje światło zielone w odpowiedzi na wzbudzenie światłem niebieskim. Ocenę żywotności usprawnia jednoczesne uwidocznienie komórek martwych, np. dzięki zastosowaniu barwników w minimalnym stopniu zdolnych do penetracji nienaruszonych błon komórkowych, natomiast akumulujących się w uszkodzonych (martwych) komórkach dzięki ich zdolności do wiązania się z kwasami nukleinowymi. W testach tych stosuje się np. jodek propydyny, oranż akrydyny a przede wszystkim bromek etydyny. Powyższe podejście pozwala na odmienne wybarwienie komórek żywych (na kolor zielony) i martwych (czerwony/pomarańczowy), przez co są one bardzo łatwe do rozróżnienia. Innymi dość powszechnie stosowanymi procedurami analizy żywotności komórek są testy określające aktywność metaboliczną komórek. Powszechnie stosowanym testem z tej grupy jest test MTT, który umożliwia pomiar aktywności przemian energetycznych w mitochondriach. Mierzy on żywotność komórek za pomocą testu redukcji soli tetrazolowej (MTT - substratu rozpuszczalnego w wodzie, o zabarwieniu białym lub żółtym) do nierozpuszczalnego formazanu (o zabarwieniu ciemnoniebieskim). Ilość barwnego zredukowanego MTT jest proporcjonalna do aktywności oksydacyjnej mitochondriów komórki, a w ściśle określonych warunkach doświadczalnych do liczby aktywnych metabolicznie (żywych) komórek w populacji. Sole tetrazolowe są redukowane do formazanu dzięki działaniu dehydrogenazy bursztynianowej, enzymu aktywnego tylko w komórkach o nienaruszonym metabolizmie i łańcuchu oddechowym. Ilość formazanu zostaje obliczona kolorymetrycznie i koreluje z liczbą żywych komórek. Cel ćwiczenia Celem ćwiczenia jest zapoznanie się z podstawową procedurą bankowania komórek, jak i ocena ich żywotności przy użyciu popularnej metody z zastosowaniem błękitu trypanu. Wykonanie ćwiczenia 1. Podzielić się na 4 zespoły. 2. Wykonać pasaż komórek hodowanych w otrzymanym naczyniu: a. ocenić liczebność komórek w hodowli pod mikroskopem odwróconym, jak również obserwując pod światło dno naczynia hodowlanego b. z naczynia zlać płyn hodowlany po czym natychmiast: c. delikatnie zalać komórki ok. 1 ml roztworu PBS, przepłukać je, po czym roztwór usunąć i natychmiast: d. komórki zalać ok. 1 ml roztworu 0.25% trypsyny (trypsynę rozprowadzić dokładnie po całym dnie naczynia) na ok. 10 sekund; e. następnie usunąć nadmiar trypsyny pozostawiając w naczyniu jej niewielką objętość, komórki inkubować w obecności trypsyny od 20 sekund do 2 minut, kontrolując (pod światło stopień odrywania się komórek od podłoża (ewentualnie naczynie wstrząsnąć celem przyspieszenia procesu). 3
4 f. natychmiast po oderwaniu się komórek od podłoża (obserwowanym pod światło lub w mikroskopie odwróconym), komórki zawiesić w 2ml pożywki hodowlanej (MEM + 5% surowicy cielęcej + antybiotyki), w ten sposób inaktywując trypsynę g. uzyskaną zawiesinę przenieść pipetą do probówki, zamknąć i wirować 5 min. przy 1000 obr./min. h. po odwirowaniu nadsącz zlać, pelet zalać 1 ml świeżej pożywki, a komórki dokładnie lecz delikatnie rozpipetować 3. Oznaczyć liczbę i żywotność komórek: a. policzyć (świeżo rozpipetowane!) komórki w komorze Bürkera (wykorzystać 10 μl zawiesiny komórek) b. określić przy pomocy błękitu trypanu żywotność komórek: na wyczyszczone szkiełko podstawowe nakropić 10 μl roztworu błękitu trypanu w PBS i następnie 10 μl zawiesiny komórek (delikatnie wymieszać rozpipetowując); pozostawić na 2 minuty, usunąć ewentualne pęcherzyki powietrza, a następnie przykryć czystym szkiełkiem nakrywkowym policzyć w mikroskopie (w kontraście faz) komórki niezabarwione (żywe) i zabarwione na kolor niebieski (martwe), określić wyjściową żywotność komórek w hodowli (obliczyć % komórek żywych) 4. Przygotowanie komórek do oceny wpływu etanolu na ich żywotność a. Przenieść do osobnej probówki typu eppendorf objętość zawiesiny zawierającą 100 tys. komórek w celu przeprowadzenia inkubacji z alkoholem etylowym. b. Do poszczególnych probówek zaaplikować objętość alkoholu etylowego (o stężeniu 96%) tak, żeby uzyskać ostateczne stężenie wynoszące 5, 10 lub 15% (jedno stężenie na podgrupę). c. W przypadku próby kontrolnej sporządzonej przez jedną z podgrup, proszę nie dodawać alkoholu do zawiesiny komórek. d. Tak przygotowane zawiesiny proszę poddać inkubacji przez 20 min w cieplarce. 5. Przeprowadzić proces bankowania komórek: a. rozpipetować ponownie zawiesinę komórek b. 0,8 ml zawiesiny komórek przenieść do probówki mrożeniowej, dodać 0,1 ml surowicy (FBS) oraz 0,1 ml DMSO (DMSO należy dodawać na końcu) i delikatnie wymieszać c. probówki zamknąć, umieścić pudełku z polistyrenu i przenieść do zamrażarki na okres 1 godziny (uwaga: optymalny czas mrożenia w -80 C wynosi 2 godziny, po czym komórki zwykle są umieszczane w butli z ciekłym azotem) 6. Ocena żywotności komórek inkubowanych z etanolem a. Zawiesinę komórek poddaną inkubacji z alkoholem etylowym rozpipetować delikatnie. Pobrać z niej 10 μl i przeprowadzić test żywotności w sposób analogiczny jak poprzednio. b. Porównując wyniki pomiędzy podgrupami ocenić, jak alkohol etylowy wpływa na żywotność badanych komórek. 7. Odbankowanie komórek: a. probówki z zamrożonymi komórkami rozmrozić (umieścić w zlewce z letnią wodą) b. rozmrożoną zawiesinę przenieść natychmiast do probówki (15 ml) i dodawać kroplami 3 ml świeżej pożywki hodowlanej (po dodaniu każdej kropli delikatnie wstrząsnąć probówką w celu przemieszania) c. zwirować zawiesinę komórek (1000 obrotów na minutę, 5 minut) 4
5 d. delikatnie wyjąć probówki z wirówki, przenieść pod komorę laminarną, zdecydowanym ruchem zlać roztwór pożywki znad osadu (peletu) komórek e. zawiesić pelet komórek w 1 ml świeżej pożywki hodowlanej i dokładnie, ale jednocześnie delikatnie rozpipetować (ok razy) f. oznaczyć żywotność komórek (patrz punkt 3b) Zakres materiału obowiązujący do ćwiczeń Hodowla tkanek, jej rozwój i znaczenie dla rozwoju nauki. Hodowle pierwotne i linie komórkowe. Bankowanie komórek. Testy witalności - rodzaje, zastosowanie, ograniczenia. Proponowana literatura Hodowla komórek i tkanek pod redakcją Stanisławy Stokłosowej, Wydawnictwo Naukowe PWN, Warszawa 2006 Rozdz. 1 str. 2-6 Rozdz. 5 str Rozdz. 6 str Rozdz. 11 str Culture of Animal Cells : A Manual of Basic Technique and Specialized Applications. - Freshney RI, Wiley-Blackwell Rozdz. 19. Cryopreservation str Rozdz. 21. Cytotoxicity str Methods in Molecular Biology, vol. 368: Cryopreservation and Freeze-Drying Protocols, Second Edition. Edited by: J.G. Day and G.N. Stacey Humana Press Inc., Totowa, NJ rozdziały 3, 16,19. (dla zainteresowanych) Mazur P. Freezing of living cells: mechanisms and implications. Am.J.Physiol. 247, 1984 (dla zainteresowanych) 5
PODSTAWY BIOLOGII KOMÓRKI. Bankowanie komórek i ocena ich żywotności
 PODSTAWY BIOLOGII KOMÓRKI Wstęp Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta jest szczególnie
PODSTAWY BIOLOGII KOMÓRKI Wstęp Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta jest szczególnie
BIOLOGIA KOMÓRKI BANKOWANIE KOMÓREK
 BIOLOGIA KOMÓRKI BANKOWANIE KOMÓREK WSTĘP Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta
BIOLOGIA KOMÓRKI BANKOWANIE KOMÓREK WSTĘP Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta
BIOLOGIA KOMÓRKI. Analiza żywotności komórek w warunkach in vitro
 BIOLOGIA KOMÓRKI Analiza żywotności komórek w warunkach in vitro Wstęp Każda komórka jest układem termodynamicznie otwartym wymieniającym ze swym otoczeniem materię i energię. Wymiana ta odbywa się poprzez
BIOLOGIA KOMÓRKI Analiza żywotności komórek w warunkach in vitro Wstęp Każda komórka jest układem termodynamicznie otwartym wymieniającym ze swym otoczeniem materię i energię. Wymiana ta odbywa się poprzez
BIOLOGIA KOMÓRKI. Testy witalności komórek
 BIOLOGIA KOMÓRKI Testy witalności komórek WSTĘP Każda komórka jest układem termodynamicznie otwartym wymieniającym ze swym otoczeniem materię i energię. Wymiana ta odbywa się poprzez błonę komórkową, której
BIOLOGIA KOMÓRKI Testy witalności komórek WSTĘP Każda komórka jest układem termodynamicznie otwartym wymieniającym ze swym otoczeniem materię i energię. Wymiana ta odbywa się poprzez błonę komórkową, której
Technika hodowli komórek leukemicznych
 Fizjologiczne Techniki Badań Technika hodowli komórek leukemicznych Zasady prowadzenia hodowli komórek leukemicznych, pasażowania, mrożenia, rozmrażania i przechowywania komórek leukemicznych Warunki wstępne:
Fizjologiczne Techniki Badań Technika hodowli komórek leukemicznych Zasady prowadzenia hodowli komórek leukemicznych, pasażowania, mrożenia, rozmrażania i przechowywania komórek leukemicznych Warunki wstępne:
Techniki oznaczania aktywności cytotoksycznej związków chemioterapeutycznych in vitro
 Fizjologiczne techniki badań Techniki oznaczania aktywności cytotoksycznej związków chemioterapeutycznych in vitro Wstęp: Oznaczanie cytotoksyczności związków chemioterapeutycznych wobec komórek w hodowlach
Fizjologiczne techniki badań Techniki oznaczania aktywności cytotoksycznej związków chemioterapeutycznych in vitro Wstęp: Oznaczanie cytotoksyczności związków chemioterapeutycznych wobec komórek w hodowlach
BIOLOGIA KOMÓRKI. Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli wewnątrzkomórkowych
 BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
Temat ćwiczenia: Techniki stosowane w badaniach toksyczności in vitro
 Temat ćwiczenia: Techniki stosowane w badaniach toksyczności in vitro Miarą aktywności cytotoksycznej badanej substancji jest określenie stężenia hamującego, IC 50 (ang. inhibitory concentration), dla
Temat ćwiczenia: Techniki stosowane w badaniach toksyczności in vitro Miarą aktywności cytotoksycznej badanej substancji jest określenie stężenia hamującego, IC 50 (ang. inhibitory concentration), dla
BIOLOGIA KOMÓRKI. Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli wewnątrzkomórkowych
 BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK
 BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO-FAZOWYM;
BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO-FAZOWYM;
Komórki macierzyste zastosowania w biotechnologii i medycynie BT Metody identyfikacji i fenotypowania populacji komórek macierzystych
 Metody identyfikacji i fenotypowania populacji komórek macierzystych 1 Wstęp Szpik kostny zawiera hematopoetyczne (HSC) oraz niehematopoetyczne komórki macierzyste (KM). Do niehematopoetycznych KM należą:
Metody identyfikacji i fenotypowania populacji komórek macierzystych 1 Wstęp Szpik kostny zawiera hematopoetyczne (HSC) oraz niehematopoetyczne komórki macierzyste (KM). Do niehematopoetycznych KM należą:
Separacja komórek w gradiencie gęstości PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 231)
 Separacja komórek w gradiencie gęstości PRAKTIKUM Z BIOLOGII KOMÓRKI () Separacja komórek Separacja komórek w gradiencie gęstości W wielu dziedzinach nauk przyrodniczych istnieje potrzeba stosowania określonej
Separacja komórek w gradiencie gęstości PRAKTIKUM Z BIOLOGII KOMÓRKI () Separacja komórek Separacja komórek w gradiencie gęstości W wielu dziedzinach nauk przyrodniczych istnieje potrzeba stosowania określonej
BIOLOGIA KOMÓRKI. Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych
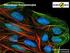 BIOLOGIA KOMÓRKI Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo dużej liczby procesów biochemicznych
BIOLOGIA KOMÓRKI Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo dużej liczby procesów biochemicznych
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna.
 Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
E.coli Transformer Kit
 E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
OSTRACODTOXKIT F Procedura testu
 OSTRACODTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI SKONCENTROWANYCH SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 PRZELAĆ ZAWARTOŚĆ 5 FIOLEK
OSTRACODTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI SKONCENTROWANYCH SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 PRZELAĆ ZAWARTOŚĆ 5 FIOLEK
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI. Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli
 E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
Otrzymany w pkt. 8 osad, zawieszony w 2 ml wody destylowanej rozpipetować do 4 szklanych probówek po ok. 0.5 ml do każdej.
 Kwasy nukleinowe izolacja DNA, wykrywanie składników. Wymagane zagadnienia teoretyczne 1. Struktura, synteza i degradacja nukleotydów purynowych i pirymidynowych. 2. Regulacja syntezy nukleotydów. Podstawowe
Kwasy nukleinowe izolacja DNA, wykrywanie składników. Wymagane zagadnienia teoretyczne 1. Struktura, synteza i degradacja nukleotydów purynowych i pirymidynowych. 2. Regulacja syntezy nukleotydów. Podstawowe
1. Oznaczanie aktywności lipazy trzustkowej i jej zależności od stężenia enzymu oraz żółci jako modulatora reakcji enzymatycznej.
 ĆWICZENIE OZNACZANIE AKTYWNOŚCI LIPAZY TRZUSTKOWEJ I JEJ ZALEŻNOŚCI OD STĘŻENIA ENZYMU ORAZ ŻÓŁCI JAKO MODULATORA REAKCJI ENZYMATYCZNEJ. INHIBICJA KOMPETYCYJNA DEHYDROGENAZY BURSZTYNIANOWEJ. 1. Oznaczanie
ĆWICZENIE OZNACZANIE AKTYWNOŚCI LIPAZY TRZUSTKOWEJ I JEJ ZALEŻNOŚCI OD STĘŻENIA ENZYMU ORAZ ŻÓŁCI JAKO MODULATORA REAKCJI ENZYMATYCZNEJ. INHIBICJA KOMPETYCYJNA DEHYDROGENAZY BURSZTYNIANOWEJ. 1. Oznaczanie
Oznaczanie aktywności cytotoksycznej chemoterapeutyków wobec komórek nowotworowych
 Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Kultury tkankowe i komórkowe roślin i zwierząt Oznaczanie aktywności cytotoksycznej chemoterapeutyków wobec komórek nowotworowych
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Kultury tkankowe i komórkowe roślin i zwierząt Oznaczanie aktywności cytotoksycznej chemoterapeutyków wobec komórek nowotworowych
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii. Biologia komórki nowotworowej: Ćwiczenie B
 Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Biologia komórki nowotworowej: Ćwiczenie B Badanie zmian w budowie błony cytoplazmatycznej komórek wybranych linii nowotworowych
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Biologia komórki nowotworowej: Ćwiczenie B Badanie zmian w budowie błony cytoplazmatycznej komórek wybranych linii nowotworowych
StayRNA bufor zabezpieczający RNA przed degradacją wersja 0215
 StayRNA bufor zabezpieczający RNA przed degradacją wersja 0215 100 ml, 250 ml, 500 ml Nr kat. 038-100, 038-250, 038-500 Nietosyczny roztwór wodny do przechowywania i zabezpieczania różnego rodzaju tkanek
StayRNA bufor zabezpieczający RNA przed degradacją wersja 0215 100 ml, 250 ml, 500 ml Nr kat. 038-100, 038-250, 038-500 Nietosyczny roztwór wodny do przechowywania i zabezpieczania różnego rodzaju tkanek
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN
 ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 Sierpień 2018
 Sierpień 2018 fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 EURx Ltd. 80-297 Gdansk Poland ul. Przyrodnikow 3, NIP 957-07-05-191 KRS
Sierpień 2018 fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 EURx Ltd. 80-297 Gdansk Poland ul. Przyrodnikow 3, NIP 957-07-05-191 KRS
Zestaw do izolacji genomowego DNA z bakterii
 Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Laboratorium 8. Badanie stresu oksydacyjnego jako efektu działania czynników toksycznych
 Laboratorium 8 Badanie stresu oksydacyjnego jako efektu działania czynników toksycznych Literatura zalecana: Jakubowska A., Ocena toksyczności wybranych cieczy jonowych. Rozprawa doktorska, str. 28 31.
Laboratorium 8 Badanie stresu oksydacyjnego jako efektu działania czynników toksycznych Literatura zalecana: Jakubowska A., Ocena toksyczności wybranych cieczy jonowych. Rozprawa doktorska, str. 28 31.
ALGALTOXKIT F Procedura testu
 ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
BIOLOGIA KOMÓRKI ANALIZA AKTYWNOŚCI ENDOCYTARNEJ KOMÓREK
 BIOLOGIA KOMÓRKI ANALIZA AKTYWNOŚCI ENDOCYTARNEJ Wstęp Powszechny w komórkach eukariotycznych proces endocytozy to ustawiczne pobieranie ze środowiska zewnętrznego do wnętrza komórki zarówno płynu, małych
BIOLOGIA KOMÓRKI ANALIZA AKTYWNOŚCI ENDOCYTARNEJ Wstęp Powszechny w komórkach eukariotycznych proces endocytozy to ustawiczne pobieranie ze środowiska zewnętrznego do wnętrza komórki zarówno płynu, małych
badanie moczu Zwierzę Typ cewnika moczowego Rozmiar (jedn. francuskie) * gumy lub dla kocurów polietylenowy Elastyczny winylowy, z czerwonej
 badanie moczu Rozmiary cewników... 139 Rutynowe postępowanie przy badaniu moczu... 140 Ogólne badanie moczu... 141 Badanie osadu moczu... 142 Tabela ph moczu dla kryształów moczu 142 Komórki i wałeczki...
badanie moczu Rozmiary cewników... 139 Rutynowe postępowanie przy badaniu moczu... 140 Ogólne badanie moczu... 141 Badanie osadu moczu... 142 Tabela ph moczu dla kryształów moczu 142 Komórki i wałeczki...
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii. Biologia komórki nowotworowej: Ćwiczenie E
 Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii WSTĘP Biologia komórki nowotworowej: Ćwiczenie E Autofagia w komórkach nowotworowych obserwacje mikroskopowe obecności tzw.
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii WSTĘP Biologia komórki nowotworowej: Ćwiczenie E Autofagia w komórkach nowotworowych obserwacje mikroskopowe obecności tzw.
Genomic Maxi AX Direct
 Genomic Maxi AX Direct Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura bez etapu precypitacji. wersja 0517 10 izolacji Nr kat. 995-10D Pojemność kolumny
Genomic Maxi AX Direct Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura bez etapu precypitacji. wersja 0517 10 izolacji Nr kat. 995-10D Pojemność kolumny
Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616
 Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616 10 izolacji Nr kat. 995-10 Pojemność kolumny do oczyszczania DNA wynosi 500 µg 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616 10 izolacji Nr kat. 995-10 Pojemność kolumny do oczyszczania DNA wynosi 500 µg 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
Novabeads Food DNA Kit
 Novabeads Food DNA Kit Novabeads Food DNA Kit jest nowej generacji narzędziem w technikach biologii molekularnej, umożliwiającym izolację DNA z produktów spożywczych wysoko przetworzonych. Metoda oparta
Novabeads Food DNA Kit Novabeads Food DNA Kit jest nowej generacji narzędziem w technikach biologii molekularnej, umożliwiającym izolację DNA z produktów spożywczych wysoko przetworzonych. Metoda oparta
ĆWICZENIE 5 Barwniki roślinne. Ekstrakcja barwników asymilacyjnych. Rozpuszczalność chlorofilu
 ĆWICZENIE 5 Barwniki roślinne Ekstrakcja barwników asymilacyjnych 400 mg - zhomogenizowany w ciekłym azocie proszek z natki pietruszki 6 ml - etanol 96% 2x probówki plastikowe typu Falcon na 15 ml 5x probówki
ĆWICZENIE 5 Barwniki roślinne Ekstrakcja barwników asymilacyjnych 400 mg - zhomogenizowany w ciekłym azocie proszek z natki pietruszki 6 ml - etanol 96% 2x probówki plastikowe typu Falcon na 15 ml 5x probówki
Genomic Midi AX. 20 izolacji
 Genomic Midi AX Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura z precypitacją DNA. wersja 0517 20 izolacji Nr kat. 895-20 Pojemność kolumny do oczyszczania
Genomic Midi AX Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura z precypitacją DNA. wersja 0517 20 izolacji Nr kat. 895-20 Pojemność kolumny do oczyszczania
Zakład Biologii Molekularnej, Wydział Farmaceutyczny, WUM.
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Ćwiczenie 3 Izolacja i rozdział
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Ćwiczenie 3 Izolacja i rozdział
Odczynnik do izolacji RNA z tkanek zwierzęcych, roślinnych oraz linii komórkowych
 Nr kat.: EM30-100, EM30-200 Wersja zestawu: 1.2015 Odczynnik do izolacji RNA z tkanek zwierzęcych, roślinnych oraz linii komórkowych EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. I. PRZEZNACZENIE
Nr kat.: EM30-100, EM30-200 Wersja zestawu: 1.2015 Odczynnik do izolacji RNA z tkanek zwierzęcych, roślinnych oraz linii komórkowych EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. I. PRZEZNACZENIE
WYKORZYSTANIE TECHNIKI ZAPŁODNIENIA
 WYKORZYSTANIE TECHNIKI ZAPŁODNIENIA IN VITRO DO OCENY JAKOŚCI NASIENIA ŻUBRA P.Pawlak, M.Świątek, K.Braun, M.Giertych, N.Reńska, M.Zajączkowska, M.Zgoła Koło Naukowe Zootechników Sekcja Biotechnologii
WYKORZYSTANIE TECHNIKI ZAPŁODNIENIA IN VITRO DO OCENY JAKOŚCI NASIENIA ŻUBRA P.Pawlak, M.Świątek, K.Braun, M.Giertych, N.Reńska, M.Zajączkowska, M.Zgoła Koło Naukowe Zootechników Sekcja Biotechnologii
Załącznik nr 4 Metodyka pobrania materiału przedstawiona jest w osobnym Instrukcja PZH
 Załącznik nr 4 Metodyka pobrania materiału przedstawiona jest w osobnym Instrukcja PZH 1. Rodzaj materiału klinicznego w zależności od kierunku i metodyki badań wykonywanych przez PZH Poz. Badanie Rodzaj
Załącznik nr 4 Metodyka pobrania materiału przedstawiona jest w osobnym Instrukcja PZH 1. Rodzaj materiału klinicznego w zależności od kierunku i metodyki badań wykonywanych przez PZH Poz. Badanie Rodzaj
Zestaw do izolacji genomowego DNA z drożdży
 Nr kat. EM10 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z drożdży EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.blirt.eu 2 Nr kat. EM10 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM10 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z drożdży EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.blirt.eu 2 Nr kat. EM10 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Zakład Biologii Molekularnej, Wydział Farmaceutyczny, WUM.
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zestaw do wykrywania Chlamydia trachomatis w moczu lub w kulturach komórkowych
 Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
OTRZYMYWANIE EMULSJI I BADANIE ICH WŁAŚCIWOŚCI
 OTRZYMYWANIE EMULSJI I BADANIE ICH WŁAŚCIWOŚCI Odczynniki: wosk pszczeli (4 g) olej parafinowy (9 cm 3 i 6 cm 3 ) oliwa z oliwek (5,5 cm 3 ) boraks (Na 2 B 4 O 7 10H 2 O) (0,2 g) olejek zapachowy (lawendowy
OTRZYMYWANIE EMULSJI I BADANIE ICH WŁAŚCIWOŚCI Odczynniki: wosk pszczeli (4 g) olej parafinowy (9 cm 3 i 6 cm 3 ) oliwa z oliwek (5,5 cm 3 ) boraks (Na 2 B 4 O 7 10H 2 O) (0,2 g) olejek zapachowy (lawendowy
BIOLOGIA KOMÓRKI DLA BIOCHEMIKÓW. Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyŝyciowe organelli komórkowych
 BIOLOGIA KOMÓRKI DLA BIOCHEMIKÓW Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyŝyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo duŝej liczby procesów
BIOLOGIA KOMÓRKI DLA BIOCHEMIKÓW Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyŝyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo duŝej liczby procesów
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215
 Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215 20 izolacji Nr kat. 895-20D Pojemność kolumny do oczyszczania DNA wynosi 100 µg 1 Skład zestawu Składnik
Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215 20 izolacji Nr kat. 895-20D Pojemność kolumny do oczyszczania DNA wynosi 100 µg 1 Skład zestawu Składnik
Technika radioimmunologicznego oznaczania poziomu hormonów (RIA) dr Katarzyna Knapczyk-Stwora
 Technika radioimmunologicznego oznaczania poziomu hormonów (RIA) dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Radioimmunologiczne metody oznaczania hormonów steroidowych
Technika radioimmunologicznego oznaczania poziomu hormonów (RIA) dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Radioimmunologiczne metody oznaczania hormonów steroidowych
AmpliTest Babesia spp. (PCR)
 AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
Izolowanie DNA i RNA z komórek hodowlanych. Ocena jakości uzyskanego materiału
 II ROK KIERUNEK WETERYNARIA UJCM INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH VIII Izolowanie DNA i RNA z komórek hodowlanych. Ocena jakości uzyskanego materiału 2013/2014 2 ĆWICZENIE VIII Preparatyka całkowitego
II ROK KIERUNEK WETERYNARIA UJCM INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH VIII Izolowanie DNA i RNA z komórek hodowlanych. Ocena jakości uzyskanego materiału 2013/2014 2 ĆWICZENIE VIII Preparatyka całkowitego
HODOWLA PERIODYCZNA DROBNOUSTROJÓW
 Cel ćwiczenia: Celem ćwiczenia jest porównanie zdolności rozkładu fenolu lub wybranej jego pochodnej przez szczepy Stenotrophomonas maltophilia KB2 i Pseudomonas sp. CF600 w trakcie prowadzenia hodowli
Cel ćwiczenia: Celem ćwiczenia jest porównanie zdolności rozkładu fenolu lub wybranej jego pochodnej przez szczepy Stenotrophomonas maltophilia KB2 i Pseudomonas sp. CF600 w trakcie prowadzenia hodowli
Szczegółowa ocena nasienia
 Szczegółowa ocena nasienia Ricardo Faundez Zakład Rozrodu, Andrologii i Biotechnologii Rozrodu Zwierząt Katedra Chorób Dużych Zwierząt z Kliniką Wydział Medycyny Weterynaryjnej SGGW Ocena ruchu plemników
Szczegółowa ocena nasienia Ricardo Faundez Zakład Rozrodu, Andrologii i Biotechnologii Rozrodu Zwierząt Katedra Chorób Dużych Zwierząt z Kliniką Wydział Medycyny Weterynaryjnej SGGW Ocena ruchu plemników
Doktorantka: Żaneta Lewandowska
 Doktorantka: Żaneta Lewandowska Główny opiekun naukowy: Dr hab. Piotr Piszczek, prof. UMK Katedra Chemii Nieorganicznej i Koordynacyjnej, Wydział Chemii Dodatkowy opiekun naukowy: Prof. dr hab. Wiesław
Doktorantka: Żaneta Lewandowska Główny opiekun naukowy: Dr hab. Piotr Piszczek, prof. UMK Katedra Chemii Nieorganicznej i Koordynacyjnej, Wydział Chemii Dodatkowy opiekun naukowy: Prof. dr hab. Wiesław
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii. Izolacja mitochondriów z komórek eukariotycznych
 Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Biochemia - laboratorium Izolacja mitochondriów z komórek eukariotycznych Ćwiczenie i instrukcję przygotował: dr inż. Andrzej
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Biochemia - laboratorium Izolacja mitochondriów z komórek eukariotycznych Ćwiczenie i instrukcję przygotował: dr inż. Andrzej
Zestaw do izolacji genomowego DNA z bakterii
 Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
Genomic Mini AX Milk Spin
 Genomic Mini AX Milk Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z próbek mleka. wersja 1017 100 izolacji Nr kat. 059-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg. Produkt
Genomic Mini AX Milk Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z próbek mleka. wersja 1017 100 izolacji Nr kat. 059-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg. Produkt
ĆWICZENIE 1. Aminokwasy
 ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
Zestaw przeznaczony jest do całkowitej izolacji RNA z bakterii, drożdży, hodowli komórkowych, tkanek oraz krwi świeżej (nie mrożonej).
 Total RNA Mini Plus Zestaw do izolacji całkowitego RNA. Procedura izolacji nie wymaga użycia chloroformu wersja 0517 25 izolacji, 100 izolacji Nr kat. 036-25, 036-100 Zestaw przeznaczony jest do całkowitej
Total RNA Mini Plus Zestaw do izolacji całkowitego RNA. Procedura izolacji nie wymaga użycia chloroformu wersja 0517 25 izolacji, 100 izolacji Nr kat. 036-25, 036-100 Zestaw przeznaczony jest do całkowitej
Sporządzanie roztworów buforowych i badanie ich właściwości
 Sporządzanie roztworów buforowych i badanie ich właściwości (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zbadanie właściwości roztworów buforowych. Przygotujemy dwa roztwory buforowe: octanowy
Sporządzanie roztworów buforowych i badanie ich właściwości (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zbadanie właściwości roztworów buforowych. Przygotujemy dwa roztwory buforowe: octanowy
Oznaczanie aktywności - i β- amylazy słodu metodą kolorymetryczną
 KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Oznaczanie aktywności - i β- amylazy słodu metodą kolorymetryczną ĆWICZENIE 5 OZNACZANIE AKTYWNOŚCI -AMYLAZY SŁODU METODĄ KOLORYMETRYCZNĄ Enzymy
KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Oznaczanie aktywności - i β- amylazy słodu metodą kolorymetryczną ĆWICZENIE 5 OZNACZANIE AKTYWNOŚCI -AMYLAZY SŁODU METODĄ KOLORYMETRYCZNĄ Enzymy
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 206, BT 231)
 Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI () Metody immunocytochemiczne... Metody immunocytochemiczne. Barwienie fluorescencyjne
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI () Metody immunocytochemiczne... Metody immunocytochemiczne. Barwienie fluorescencyjne
Próba kontrolna (PK) 1000 l 1000 l
 Ćwiczenie 10. A. Oznaczanie stężenia bilirubiny całkowitej w surowicy krwi. Wymagane zagadnienia teoretyczne 1. Biosynteza hemu - metabolity pośrednie syntezy hemu. 2. Katabolizm hemu - powstawanie barwników
Ćwiczenie 10. A. Oznaczanie stężenia bilirubiny całkowitej w surowicy krwi. Wymagane zagadnienia teoretyczne 1. Biosynteza hemu - metabolity pośrednie syntezy hemu. 2. Katabolizm hemu - powstawanie barwników
KINETYKA HYDROLIZY SACHAROZY
 Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie z wytworzeniem -D-glukozy i -D-fruktozy. Jest to reakcja
Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie z wytworzeniem -D-glukozy i -D-fruktozy. Jest to reakcja
Zestaw do izolacji totalnego DNA z bakterii. Nr kat. EM02 Wersja zestawu:
 Zestaw do izolacji totalnego DNA z bakterii Nr kat. EM02 Wersja zestawu: 1.2012 Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME DNA BACTERIA przeznaczony jest do szybkiej i wydajnej izolacji bakteryjnego
Zestaw do izolacji totalnego DNA z bakterii Nr kat. EM02 Wersja zestawu: 1.2012 Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME DNA BACTERIA przeznaczony jest do szybkiej i wydajnej izolacji bakteryjnego
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 106)
 Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 106) Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 106) Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych
Oznaczanie mocznika w płynach ustrojowych metodą hydrolizy enzymatycznej
 Oznaczanie mocznika w płynach ustrojowych metodą hydrolizy enzymatycznej Wprowadzenie: Większość lądowych organizmów kręgowych część jonów amonowych NH + 4, produktu rozpadu białek, wykorzystuje w biosyntezie
Oznaczanie mocznika w płynach ustrojowych metodą hydrolizy enzymatycznej Wprowadzenie: Większość lądowych organizmów kręgowych część jonów amonowych NH + 4, produktu rozpadu białek, wykorzystuje w biosyntezie
Otrzymywanie i badanie właściwości chemicznych związków wanadu na różnych stopniach utlenienia.
 ĆWICZENIE 6 Otrzymywanie i badanie właściwości chemicznych związków wanadu na różnych stopniach utlenienia. Celem ćwiczenia jest obserwacja barwnych produktów redukcji metawanadanu(v) sodu, NaVO 3 oraz
ĆWICZENIE 6 Otrzymywanie i badanie właściwości chemicznych związków wanadu na różnych stopniach utlenienia. Celem ćwiczenia jest obserwacja barwnych produktów redukcji metawanadanu(v) sodu, NaVO 3 oraz
Genomic Mini AX Plant Spin
 Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych. a. Candida albicans preparat z hodowli barwiony metoda Grama
 XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych a. Candida albicans preparat z hodowli barwiony metoda Grama Opis preparatu: b. Saccharomyces cerevisiae preparat z hodowli
XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych a. Candida albicans preparat z hodowli barwiony metoda Grama Opis preparatu: b. Saccharomyces cerevisiae preparat z hodowli
Zakładanie hodowli komórek nowotworowych in vitro
 Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Kultury tkankowe i komórkowe roślin i zwierząt Zakładanie hodowli komórek nowotworowych in vitro 1. Wstęp Linią komórkową
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Kultury tkankowe i komórkowe roślin i zwierząt Zakładanie hodowli komórek nowotworowych in vitro 1. Wstęp Linią komórkową
Uniwersalny zestaw do izolacji DNA (GeDI)
 Wersja zestawu 1.0 Listopad 2017 Uniwersalny zestaw do izolacji DNA (GeDI) Uniwersalny odczynnik do izolacji całkowitego DNA (GeDI) w zestawie z kolumienkami krzemionkowymi oraz buforami pozwalającymi
Wersja zestawu 1.0 Listopad 2017 Uniwersalny zestaw do izolacji DNA (GeDI) Uniwersalny odczynnik do izolacji całkowitego DNA (GeDI) w zestawie z kolumienkami krzemionkowymi oraz buforami pozwalającymi
Oznaczanie aktywności proteolitycznej trypsyny metodą Ansona
 Oznaczanie aktywności proteolitycznej trypsyny metodą Ansona Wymagane zagadnienia teoretyczne 1. Enzymy proteolityczne, klasyfikacja, rola biologiczna. 2. Enzymy proteolityczne krwi. 3. Wewnątrzkomórkowa
Oznaczanie aktywności proteolitycznej trypsyny metodą Ansona Wymagane zagadnienia teoretyczne 1. Enzymy proteolityczne, klasyfikacja, rola biologiczna. 2. Enzymy proteolityczne krwi. 3. Wewnątrzkomórkowa
data ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1
 Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1 Cel: Wyznaczanie klirensu endogennej kreatyniny. Miarą zdolności nerek do usuwania i wydalania
Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1 Cel: Wyznaczanie klirensu endogennej kreatyniny. Miarą zdolności nerek do usuwania i wydalania
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Inżynieria bioprocesowa na kierunku biotechnologia
 1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Inżynieria bioprocesowa na kierunku biotechnologia 2 Zakład Mikrobiologii UJK Zakres materiału
1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Inżynieria bioprocesowa na kierunku biotechnologia 2 Zakład Mikrobiologii UJK Zakres materiału
CEL ĆWICZENIA: Zapoznanie się z przykładową procedurą odsalania oczyszczanych preparatów enzymatycznych w procesie klasycznej filtracji żelowej.
 LABORATORIUM 3 Filtracja żelowa preparatu oksydazy polifenolowej (PPO) oczyszczanego w procesie wysalania siarczanem amonu z wykorzystaniem złoża Sephadex G-50 CEL ĆWICZENIA: Zapoznanie się z przykładową
LABORATORIUM 3 Filtracja żelowa preparatu oksydazy polifenolowej (PPO) oczyszczanego w procesie wysalania siarczanem amonu z wykorzystaniem złoża Sephadex G-50 CEL ĆWICZENIA: Zapoznanie się z przykładową
BIOLOGIA KOMÓRKI. Techniki generowania heterokariontów
 BIOLOGIA KOMÓRKI Techniki generowania heterokariontów Zjawisko fuzji łączenia dwóch lub więcej komórek w jedną strukturę występuje w przyrodzie w czasie wielu procesów fizjologicznych. Dotyczy ono głównie
BIOLOGIA KOMÓRKI Techniki generowania heterokariontów Zjawisko fuzji łączenia dwóch lub więcej komórek w jedną strukturę występuje w przyrodzie w czasie wielu procesów fizjologicznych. Dotyczy ono głównie
Plasmid Mini AX Gravity
 !"# Plasmid Mini AX Gravity zestaw do izolacji ultraczystego plazmidowego DNA (plazmidy wysokokopijne) wersja 0515/I 100 izolacji Nr kat. 015-100 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
!"# Plasmid Mini AX Gravity zestaw do izolacji ultraczystego plazmidowego DNA (plazmidy wysokokopijne) wersja 0515/I 100 izolacji Nr kat. 015-100 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
ODWADNIANIE OSADÓW PRZY POMOCY WIRÓWKI SEDYMENTACYJNEJ
 ODWADNIANIE OSADÓW PRZY POMOCY WIRÓWKI SEDYMENTACYJNEJ Ćwiczenie nr 3 1. CHARAKTERYSTYKA PROCESU Wirowanie jest procesem sedymentacji uwarunkowanej działaniem siły odśrodkowej przy przyspieszeniu 1500
ODWADNIANIE OSADÓW PRZY POMOCY WIRÓWKI SEDYMENTACYJNEJ Ćwiczenie nr 3 1. CHARAKTERYSTYKA PROCESU Wirowanie jest procesem sedymentacji uwarunkowanej działaniem siły odśrodkowej przy przyspieszeniu 1500
METODY ANALIZY PARAMETRÓW FUNKCJONALNYCH MĘSKICH KOMÓREK ROZRODCZYCH
 METODY ANALIZY PARAMETRÓW FUNKCJONALNYCH MĘSKICH KOMÓREK ROZRODCZYCH 1. Warunki wstępne Przed przystąpieniem do ćwiczeń należy powtórzyć wiadomości dotyczące przebiegu procesu spermatogenezy oraz budowy
METODY ANALIZY PARAMETRÓW FUNKCJONALNYCH MĘSKICH KOMÓREK ROZRODCZYCH 1. Warunki wstępne Przed przystąpieniem do ćwiczeń należy powtórzyć wiadomości dotyczące przebiegu procesu spermatogenezy oraz budowy
BADANIE WŁASNOŚCI KOENZYMÓW OKSYDOREDUKTAZ
 KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska BADANIE WŁASNOŚCI KOENZYMÓW OKSYDOREDUKTAZ ĆWICZENIE 2 Nukleotydy pirydynowe (NAD +, NADP + ) pełnią funkcję koenzymów dehydrogenaz przenosząc jony
KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska BADANIE WŁASNOŚCI KOENZYMÓW OKSYDOREDUKTAZ ĆWICZENIE 2 Nukleotydy pirydynowe (NAD +, NADP + ) pełnią funkcję koenzymów dehydrogenaz przenosząc jony
XLII Liceum Ogólnokształcące im. M. Konopnickiej w Warszawie
 II etap konkursu Piramida - biologia - doświadczenie Imię i Nazwisko członków zespołu: 1.. 2.. Katalaza 3.. Katalaza to enzym umożliwiający rozkład nadtlenku wodoru (H 2 O 2 ). Występuje ona w różnych
II etap konkursu Piramida - biologia - doświadczenie Imię i Nazwisko członków zespołu: 1.. 2.. Katalaza 3.. Katalaza to enzym umożliwiający rozkład nadtlenku wodoru (H 2 O 2 ). Występuje ona w różnych
ĆWICZENIE I - BIAŁKA. Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi.
 ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI? JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI?
 Podstawowe miary masy i objętości stosowane przy oznaczaniu ilości kwasów nukleinowych : 1g (1) 1l (1) 1mg (1g x 10-3 ) 1ml (1l x 10-3 ) 1μg (1g x 10-6 ) 1μl (1l x 10-6 ) 1ng (1g x 10-9 ) 1pg (1g x 10-12
Podstawowe miary masy i objętości stosowane przy oznaczaniu ilości kwasów nukleinowych : 1g (1) 1l (1) 1mg (1g x 10-3 ) 1ml (1l x 10-3 ) 1μg (1g x 10-6 ) 1μl (1l x 10-6 ) 1ng (1g x 10-9 ) 1pg (1g x 10-12
GOSPODARKA ODPADAMI. Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów
 GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
II. Badanie lekowrażliwości drobnoustrojów ćwiczenia praktyczne. Ćwiczenie 1. Oznaczanie lekowrażliwości metodą dyfuzyjno-krążkową
 II. Badanie lekowrażliwości drobnoustrojów ćwiczenia praktyczne Ćwiczenie 1. Oznaczanie lekowrażliwości metodą dyfuzyjno-krążkową Zasada metody: Krążki bibułowe nasycone odpowiednimi ilościami antybiotyków
II. Badanie lekowrażliwości drobnoustrojów ćwiczenia praktyczne Ćwiczenie 1. Oznaczanie lekowrażliwości metodą dyfuzyjno-krążkową Zasada metody: Krążki bibułowe nasycone odpowiednimi ilościami antybiotyków
Wpływ zdeklastrowanego medium hodowlanego RPMI na żywotność i zdolność proliferacji komórek nowotworowych układu hematopoetycznego człowieka.
 Wpływ zdeklastrowanego medium hodowlanego RPMI na żywotność i zdolność proliferacji komórek nowotworowych układu hematopoetycznego człowieka. Anna Och 1,2, Marek Och 1,2, Igor Elkin 3, Zdzisław Oszczęda
Wpływ zdeklastrowanego medium hodowlanego RPMI na żywotność i zdolność proliferacji komórek nowotworowych układu hematopoetycznego człowieka. Anna Och 1,2, Marek Och 1,2, Igor Elkin 3, Zdzisław Oszczęda
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego. Izoterma rozpuszczalności w układzie trójskładnikowym
 Katedra Chemii Fizycznej Uniwersytetu Łódzkiego Izoterma rozpuszczalności w układzie trójskładnikowym ćwiczenie nr 28 Zakres zagadnień obowiązujących do ćwiczenia 1. Stan równowagi układu i rodzaje równowag
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego Izoterma rozpuszczalności w układzie trójskładnikowym ćwiczenie nr 28 Zakres zagadnień obowiązujących do ćwiczenia 1. Stan równowagi układu i rodzaje równowag
SKUTECZNOŚĆ IZOLACJI JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI? JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI?
 SKUTECZNOŚĆ IZOLACJI Wydajność izolacji- ilość otrzymanego kwasu nukleinowego Efektywność izolacji- jakość otrzymanego kwasu nukleinowego w stosunku do ilości Powtarzalność izolacji- zoptymalizowanie procedury
SKUTECZNOŚĆ IZOLACJI Wydajność izolacji- ilość otrzymanego kwasu nukleinowego Efektywność izolacji- jakość otrzymanego kwasu nukleinowego w stosunku do ilości Powtarzalność izolacji- zoptymalizowanie procedury
Ćwiczenie numer 6. Analiza próbek spożywczych na obecność markerów GMO
 Ćwiczenie numer 6 Analiza próbek spożywczych na obecność markerów GMO 1. Informacje wstępne -screening GMO -metoda CTAB -qpcr 2. Izolacja DNA z soi metodą CTAB 3. Oznaczenie ilościowe i jakościowe DNA
Ćwiczenie numer 6 Analiza próbek spożywczych na obecność markerów GMO 1. Informacje wstępne -screening GMO -metoda CTAB -qpcr 2. Izolacja DNA z soi metodą CTAB 3. Oznaczenie ilościowe i jakościowe DNA
Techniki histologiczne barwienie
 Struktury histologiczne są optycznie obiektami fazowymi nie zmieniają ani amplitudy fali światła (obiekty nie są ciemniejsze ani jaśniejsze), ani jej długości (barwa), a jedynie powodują załamanie światła
Struktury histologiczne są optycznie obiektami fazowymi nie zmieniają ani amplitudy fali światła (obiekty nie są ciemniejsze ani jaśniejsze), ani jej długości (barwa), a jedynie powodują załamanie światła
Techniki molekularne ćw. 1 1 z 6
 Techniki molekularne ćw. 1 1 z 6 Instrukcja do ćwiczeń Nr 1. Temat: Izolacja całkowitego DNA z tkanki ssaczej metodą wiązania DNA do kolumny krzemionkowej oraz spektrofotometryczna ocena jego czystości
Techniki molekularne ćw. 1 1 z 6 Instrukcja do ćwiczeń Nr 1. Temat: Izolacja całkowitego DNA z tkanki ssaczej metodą wiązania DNA do kolumny krzemionkowej oraz spektrofotometryczna ocena jego czystości
AmpliTest GMO screening-nos (Real Time PCR)
 AmpliTest GMO screening-nos (Real Time PCR) Zestaw do wykrywania sekwencji DNA terminatora NOS techniką Real Time PCR Nr kat.: GMO03-50 GMO03-100 Wielkość zestawu: 50 reakcji 100 reakcji Objętość pojedynczej
AmpliTest GMO screening-nos (Real Time PCR) Zestaw do wykrywania sekwencji DNA terminatora NOS techniką Real Time PCR Nr kat.: GMO03-50 GMO03-100 Wielkość zestawu: 50 reakcji 100 reakcji Objętość pojedynczej
Analiza dystrybucji komórek nowotworowych w cyklu życiowym z wykorzystaniem cytometrii przepływowej
 Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Biologia komórki nowotworowej: Ćwiczenie A Analiza dystrybucji komórek nowotworowych w cyklu życiowym z wykorzystaniem cytometrii
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Biologia komórki nowotworowej: Ćwiczenie A Analiza dystrybucji komórek nowotworowych w cyklu życiowym z wykorzystaniem cytometrii
BIOLOGIA KOMÓRKI. Ocena końcowa z kursu będzie liczona jako: 20% oceny z ćwiczeń 80% oceny z egzaminu
 BIOLOGIA KOMÓRKI Ocena końcowa z kursu będzie liczona jako: 20% oceny z ćwiczeń 80% oceny z egzaminu Charakterystyka kursu: 30 godzin wykładów 60 godzin ćwiczeń Ćwiczenia - zasady zaliczenia: uczestniczenie
BIOLOGIA KOMÓRKI Ocena końcowa z kursu będzie liczona jako: 20% oceny z ćwiczeń 80% oceny z egzaminu Charakterystyka kursu: 30 godzin wykładów 60 godzin ćwiczeń Ćwiczenia - zasady zaliczenia: uczestniczenie
HYDROLIZA SOLI. ROZTWORY BUFOROWE
 Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
