Zadania treningowe na kolokwium
|
|
|
- Aleksander Grzybowski
- 6 lat temu
- Przeglądów:
Transkrypt
1 Zadania treningowe na kolokwium Stan układu binarnego zawierającego n 1 moli substancji typu 1 i n 2 moli substancji typu 2 parametryzujemy za pomocą stężenia substancji 1: x n 1. Stabilność mieszaniny ze względu na dyfuzję atomów jednej substancji w drugiej przy stałym ciśnieniu p i temperaturze T zadana jest warunkiem: δg T,p > 0 gdzie G T,p potencjał Gibbsa. Załóżmy, że układ podzielił się na dwa obszary α i β (np. dwie fazy) jednorodne ze względu na potencjały chemiczne µ 1 i µ 2 substancji 1 i 2 zawierające n α j i n β j moli substancji j (j 1,2). Potencjał Gibbsa dla tego układu można zapisać jako: G n α 1 µ α 1 + n α 2 µ α 2 + n β 1µ β 1 + n β 2µ β 2. a) Wyznaczyć zmianę δg potencjału Gibbsa wynikającą z przeniesienia δn 1 moli substancji 1 z obszaru α do β oraz δn 2 moli substancji 2 z obszaru β do α i wykazać, że warunkiem koniecznym równowagi jest: µ α j n β j, dla j 1, 2 b) Korzystając z równania Gibbsa- Duhema SdT V dp + i n i dµ i 0 pokazać, że µ1 µ2 0 µ1 µ2 0 µ1 µ2 1
2 c) Pokazać, że µ1 µ2 µ1 µ2 1 x µ1 1 x µ2 x µ1 x µ2 i wysnuć stąd wniosek, że µ j (T, p, n 1, n 2 ) µ j (T, p, x). d) Udowodnić ( 2 ) µ 1 1 ( 1 x ) 2 ( 2 ) µ 1 2 2(1 x) 2 µ1 2. Wyznaczyć molarne ciepło właściwe wzdłuż krzywej parowania: c wsp T s T wsp wiedząc, że molarne ciepło parowania jest równe h, a ciepło właściwe przy stałym ciśnieniu jest równe c p. Odp.: c wsp c p h T Wsk.: zastosować przybliżenie gazu doskonałego do fazy gazowej oraz zaniedbać objętość molarną fazy ciekłej w porównaniu z objętością molarną fazy gazowej. 3. W pobliżu punktu potrójnego amoniaku (NH 3 ) równanie krzywej sublimacji ma postać ln p 27, /T, a równanie krzywej parowania ln p 24, /T, 2
3 gdzie ciśnienie p jest mierzone w paskalach a temperatura T w kelwinach. a) wyznaczyć ciśnienie i temperaturę punktu potrójnego b) Jakie jest ciepło parowania i sublimacji amoniaku w punkcie potrójnym? Wsk.: ad b) poprzednie zadanie. 4. Oszacuj zmianę temperatury topnienia czystej wody pod ciśnieniem p 2 bar w stosunku do temperatury topnienia w warunkach normalnych. W warunkach normalnych liniowe współczynniki zmiany potencjału chemicznego w zależności od zmiany temperatury i ciśnienia wody we wzorze: µ F µ F,0 + β F p + α F T, są dla fazy stałej (F s) i ciekłej (F c) równe odpowiednio α s 44, 8 J/mol/K, α c 69, 9 J/mol/K, β s 1, 973 J/mol/bar, β c 1, 807 J/mol/bar. 5. Energia swobodna Gibbsa dla roztworu dwóch substancji 1 i 2 ma postać: G n 1 µ 0 1(p, T ) + n 2 µ 0 2(p, T ) + RT n 1 ln(x 1 ) + RT n 2 ln(x 2 ) + αnx 1 x 2 gdzie n i oraz x i n i /n, (gdzie n ) - liczba moli oraz ułamki molowe substancji i 1, 2. a) naszkicować molową energię swobodną Gibbsa g(p, T, x 1 ) G/n dla ustalonych p i T (przyjąć µ 0 1 1, 00, µ 0 2 1, 05, RT 0, 8 oraz α 1) w funkcji x 1. b) Znaleźć warunek pojawienia się oraz równowagi dwóch faz α i β roztworu przy zadanym potencjale G. Pokazać, że warunek µ α i µ β i dla i 1, 2 jest równoważny warunkowi ( g i ) (α) p,t ( g i ) (β) p,t dla i 1, 2. 3
4 6. Znaleźć równanie krzywej współistnienia faz α i β z poprzedniego zadania oraz określić temperaturę krytyczną, powyżej której występuje tylko jedna faza. 7. Obliczyć w przybliżeniu molowe ciepło parowania wody w T 0 o jeżeli ciśnienie pary nasyconej nad ciekłą wodą w temperaturze t 1 0 o C wynosi p 1 4, 549 mm Hg, a w t 2 1 o C wynosi p 2 4, 926 mm Hg (powietrze odpompowano z naczynia). 8. Wyznaczyć czynnik struktury dla kryształu blendy cynkowej: sieć Bravais typu f.c.c. z dwoma atomami w bazie połączonymi wektorem bazy b a (1, 1, 1), gdzie a - stała sieci W wyniku drgań termicznych atomy w sieci krystalicznej są przesunięte o przypadkowy wektor δr n względem idealnych położeń sieciowych R n. Zakładając, że δr n podlega rozkładowi Gaussa o wartości średniej < δr n > 0 i < δr 2 n > σ << a (a - stała sieci ) przedyskutować wpływ tych przesunięć na natężenie widma dyfrakcji rentgenowskiej na krysztale. W szczególność rozważyć problem małych i dużych wektorów G. 10. Wykazać, że gęstość powierzchniowa punktów sieciowych na płaszczyżnie sieciowej należącej do rodziny płaszczyzn odległych o d jest równa d/ω 0, gdzie Ω 0 - objętość komórki elementarnej. Znaleźć rodzinę płaszczyzn o największej gęstości punktów sieciowych w a) sieci f.c.c. b) sieci b.c.c 11. W jednowymiarowym modelu ciasnego wiązania hamiltonian elektronu w polu periodycznym zapisujemy w postaci: N Ĥ E A i, A >< i, A i1 +2t( 1 N i, A >< i + 1, A + i 1, A >< i, A ) 2 i1 gdzie i, A > oznacza orbital typu A scentrowany w węźle i jednowymiarowej sieci periodycznej. Naszkicować układ, który można opisać tym 4
5 hamiltonianem. Znaleźć energie i stany własne hamiltonianu zakładając periodyczne warunki brzegowe dla funkcji falowej ψ(i + N) ψ(i). Określić połoźenie minimum i maksimum pasma energii dozwolonych. 5
Równowagi fazowe. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Równowagi fazowe Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Równowaga termodynamiczna Przemianom fazowym towarzyszą procesy, podczas których nie zmienia się skład chemiczny układu, polegają
Równowagi fazowe Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Równowaga termodynamiczna Przemianom fazowym towarzyszą procesy, podczas których nie zmienia się skład chemiczny układu, polegają
Wykład 1. Anna Ptaszek. 5 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Chemia fizyczna - wykład 1. Anna Ptaszek 1 / 36
 Wykład 1 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 5 października 2015 1 / 36 Podstawowe pojęcia Układ termodynamiczny To zbiór niezależnych elementów, które oddziałują ze sobą tworząc integralną
Wykład 1 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 5 października 2015 1 / 36 Podstawowe pojęcia Układ termodynamiczny To zbiór niezależnych elementów, które oddziałują ze sobą tworząc integralną
Warunki izochoryczno-izotermiczne
 WYKŁAD 5 Pojęcie potencjału chemicznego. Układy jednoskładnikowe W zależności od warunków termodynamicznych potencjał chemiczny substancji czystej definiujemy następująco: Warunki izobaryczno-izotermiczne
WYKŁAD 5 Pojęcie potencjału chemicznego. Układy jednoskładnikowe W zależności od warunków termodynamicznych potencjał chemiczny substancji czystej definiujemy następująco: Warunki izobaryczno-izotermiczne
Seria 2, ćwiczenia do wykładu Od eksperymentu do poznania materii
 Seria 2, ćwiczenia do wykładu Od eksperymentu do poznania materii 8.1.21 Zad. 1. Obliczyć ciśnienie potrzebne do przemiany grafitu w diament w temperaturze 25 o C. Objętość właściwa (odwrotność gęstości)
Seria 2, ćwiczenia do wykładu Od eksperymentu do poznania materii 8.1.21 Zad. 1. Obliczyć ciśnienie potrzebne do przemiany grafitu w diament w temperaturze 25 o C. Objętość właściwa (odwrotność gęstości)
Termodynamika techniczna i chemiczna, 2015/16, zadania do kol. 1, zadanie nr 1 1
 Termodynamika techniczna i chemiczna, 2015/16, zadania do kol. 1, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący 1. Obliczyć zmianę entalpii dla izobarycznej (p = 1 bar) reakcji chemicznej zapoczątkowanej
Termodynamika techniczna i chemiczna, 2015/16, zadania do kol. 1, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący 1. Obliczyć zmianę entalpii dla izobarycznej (p = 1 bar) reakcji chemicznej zapoczątkowanej
1. Od czego i w jaki sposób zależy szybkość reakcji chemicznej?
 Tematy opisowe 1. Od czego i w jaki sposób zależy szybkość reakcji chemicznej? 2. Omów pomiar potencjału na granicy faz elektroda/roztwór elektrolitu. Podaj przykład, omów skale potencjału i elektrody
Tematy opisowe 1. Od czego i w jaki sposób zależy szybkość reakcji chemicznej? 2. Omów pomiar potencjału na granicy faz elektroda/roztwór elektrolitu. Podaj przykład, omów skale potencjału i elektrody
Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 2, zadanie nr 1 1
 Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 2, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący Uwaga! Proszę stosować się do następującego sposobu wprowadzania tekstu w ramkach : pola szare
Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 2, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący Uwaga! Proszę stosować się do następującego sposobu wprowadzania tekstu w ramkach : pola szare
powierzchnia rozdziału - dwie fazy ciekłe - jedna faza gazowa - dwa składniki
 Przejścia fazowe. powierzchnia rozdziału - skokowa zmiana niektórych parametrów na granicy faz. kropeki wody w atmosferze - dwie fazy ciekłe - jedna faza gazowa - dwa składniki Przykłady przejść fazowych:
Przejścia fazowe. powierzchnia rozdziału - skokowa zmiana niektórych parametrów na granicy faz. kropeki wody w atmosferze - dwie fazy ciekłe - jedna faza gazowa - dwa składniki Przykłady przejść fazowych:
Fizyka statystyczna Fenomenologia przejść fazowych. P. F. Góra
 Fizyka statystyczna Fenomenologia przejść fazowych P. F. Góra http://th-www.if.uj.edu.pl/zfs/gora/ 2015 Przejście fazowe transformacja układu termodynamicznego z jednej fazy (stanu materii) do innej, dokonywane
Fizyka statystyczna Fenomenologia przejść fazowych P. F. Góra http://th-www.if.uj.edu.pl/zfs/gora/ 2015 Przejście fazowe transformacja układu termodynamicznego z jednej fazy (stanu materii) do innej, dokonywane
1. Kryształy jonowe omówić oddziaływania w kryształach jonowych oraz typy struktur jonowych.
 Tematy opisowe 1. Kryształy jonowe omówić oddziaływania w kryształach jonowych oraz typy struktur jonowych. 2. Dlaczego do kadłubów statków, doków, falochronów i filarów mostów przymocowuje się płyty z
Tematy opisowe 1. Kryształy jonowe omówić oddziaływania w kryształach jonowych oraz typy struktur jonowych. 2. Dlaczego do kadłubów statków, doków, falochronów i filarów mostów przymocowuje się płyty z
Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 1, zadanie nr 1 1
 Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 1, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący Uwaga! Proszę stosować się do następującego sposobu wprowadzania tekstu w ramkach : pola szare
Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 1, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący Uwaga! Proszę stosować się do następującego sposobu wprowadzania tekstu w ramkach : pola szare
Ćwiczenia rachunkowe z termodynamiki technicznej i chemicznej Zalecane zadania kolokwium 1. (2014/15)
 Ćwiczenia rachunkowe z termodynamiki technicznej i chemicznej Zalecane zadania kolokwium 1. (2014/15) (Uwaga! Liczba w nawiasie przy odpowiedzi oznacza numer zadania (zestaw.nr), którego rozwiązanie dostępne
Ćwiczenia rachunkowe z termodynamiki technicznej i chemicznej Zalecane zadania kolokwium 1. (2014/15) (Uwaga! Liczba w nawiasie przy odpowiedzi oznacza numer zadania (zestaw.nr), którego rozwiązanie dostępne
Wykład 4. Przypomnienie z poprzedniego wykładu
 Wykład 4 Przejścia fazowe materii Diagram fazowy Ciepło Procesy termodynamiczne Proces kwazistatyczny Procesy odwracalne i nieodwracalne Pokazy doświadczalne W. Dominik Wydział Fizyki UW Termodynamika
Wykład 4 Przejścia fazowe materii Diagram fazowy Ciepło Procesy termodynamiczne Proces kwazistatyczny Procesy odwracalne i nieodwracalne Pokazy doświadczalne W. Dominik Wydział Fizyki UW Termodynamika
Repeta z wykładu nr 3. Detekcja światła. Struktura krystaliczna. Plan na dzisiaj
 Repeta z wykładu nr 3 Detekcja światła Sebastian Maćkowski Instytut Fizyki Uniwersytet Mikołaja Kopernika Adres poczty elektronicznej: mackowski@fizyka.umk.pl Biuro: 365, telefon: 611-3250 Konsultacje:
Repeta z wykładu nr 3 Detekcja światła Sebastian Maćkowski Instytut Fizyki Uniwersytet Mikołaja Kopernika Adres poczty elektronicznej: mackowski@fizyka.umk.pl Biuro: 365, telefon: 611-3250 Konsultacje:
Prowadzący. http://luberski.w.interia.pl telefon PK: 126282746 Pokój 210A (Katedra Biotechnologii i Chemii Fizycznej C-5)
 Tomasz Lubera dr Tomasz Lubera mail: luberski@interia.pl Prowadzący http://luberski.w.interia.pl telefon PK: 126282746 Pokój 210A (Katedra Biotechnologii i Chemii Fizycznej C-5) Konsultacje: we wtorki
Tomasz Lubera dr Tomasz Lubera mail: luberski@interia.pl Prowadzący http://luberski.w.interia.pl telefon PK: 126282746 Pokój 210A (Katedra Biotechnologii i Chemii Fizycznej C-5) Konsultacje: we wtorki
Termodynamiczny opis przejść fazowych pierwszego rodzaju
 Wykład II Przejścia fazowe 1 Termodynamiczny opis przejść fazowych pierwszego rodzaju Woda występuje w trzech stanach skupienia jako ciecz, jako gaz, czyli para wodna, oraz jako ciało stałe, a więc lód.
Wykład II Przejścia fazowe 1 Termodynamiczny opis przejść fazowych pierwszego rodzaju Woda występuje w trzech stanach skupienia jako ciecz, jako gaz, czyli para wodna, oraz jako ciało stałe, a więc lód.
Krystalizacja. Zarodkowanie
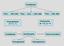 Krystalizacja Ciecz ciało stałe Para ciecz ciało stałe Para ciało stałe Przechłodzenie T = T L - T c Przesycenie p = p g - p z > 0 Krystalizacja Zarodkowanie Rozrost zarodków Homogeniczne Heterogeniczne
Krystalizacja Ciecz ciało stałe Para ciecz ciało stałe Para ciało stałe Przechłodzenie T = T L - T c Przesycenie p = p g - p z > 0 Krystalizacja Zarodkowanie Rozrost zarodków Homogeniczne Heterogeniczne
Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2018/19)
 Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2018/19) Uwaga! Uzyskane wyniki mogą się nieco różnić od podanych w materiałach, ze względu na uaktualnianie wartości zapisanych
Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2018/19) Uwaga! Uzyskane wyniki mogą się nieco różnić od podanych w materiałach, ze względu na uaktualnianie wartości zapisanych
Fizyka, technologia oraz modelowanie wzrostu kryształów
 Fizyka, technologia oraz modelowanie wzrostu kryształów Stanisław Krukowski i Michał Leszczyński Instytut Wysokich Ciśnień PAN 0-4 Warszawa, ul Sokołowska 9/37 tel: 88 80 44 e-mail: stach@unipress.waw.pl,
Fizyka, technologia oraz modelowanie wzrostu kryształów Stanisław Krukowski i Michał Leszczyński Instytut Wysokich Ciśnień PAN 0-4 Warszawa, ul Sokołowska 9/37 tel: 88 80 44 e-mail: stach@unipress.waw.pl,
Model elektronów swobodnych w metalu
 Model elektronów swobodnych w metalu Stany elektronu w nieskończonej trójwymiarowej studni potencjału - dozwolone wartości wektora falowego k Fale stojące - warunki brzegowe znikanie funkcji falowej na
Model elektronów swobodnych w metalu Stany elektronu w nieskończonej trójwymiarowej studni potencjału - dozwolone wartości wektora falowego k Fale stojące - warunki brzegowe znikanie funkcji falowej na
półprzewodniki Plan na dzisiaj Optyka nanostruktur Struktura krystaliczna Dygresja Sebastian Maćkowski
 Plan na dzisiaj Optyka nanostruktur Sebastian Maćkowski Instytut Fizyki Uniwersytet Mikołaja Kopernika Adres poczty elektronicznej: mackowski@fizyka.umk.pl Biuro: 365, telefon: 611-3250 półprzewodniki
Plan na dzisiaj Optyka nanostruktur Sebastian Maćkowski Instytut Fizyki Uniwersytet Mikołaja Kopernika Adres poczty elektronicznej: mackowski@fizyka.umk.pl Biuro: 365, telefon: 611-3250 półprzewodniki
Prężność pary nad roztworem
 Tomasz Lubera Układ: Prężność pary nad roztworem dwuskładnikowy (składniki I i II) dwufazowy (ciecz i gaz) w którym faza ciekła i gazowa to roztwory idealne W stanie równowagi prężności pary składników/układu
Tomasz Lubera Układ: Prężność pary nad roztworem dwuskładnikowy (składniki I i II) dwufazowy (ciecz i gaz) w którym faza ciekła i gazowa to roztwory idealne W stanie równowagi prężności pary składników/układu
Wykład 3. Diagramy fazowe P-v-T dla substancji czystych w trzech stanach. skupienia. skupienia
 Wykład 3 Substancje proste i czyste Przemiany w systemie dwufazowym woda para wodna Diagram T-v dla przejścia fazowego woda para wodna Diagramy T-v i P-v dla wody Punkt krytyczny Temperatura nasycenia
Wykład 3 Substancje proste i czyste Przemiany w systemie dwufazowym woda para wodna Diagram T-v dla przejścia fazowego woda para wodna Diagramy T-v i P-v dla wody Punkt krytyczny Temperatura nasycenia
Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2016/17)
 Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2016/17) Uwaga! Uzyskane wyniki mogą się nieco różnić od podanych w materiałach, ze względu na uaktualnianie wartości zapisanych
Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2016/17) Uwaga! Uzyskane wyniki mogą się nieco różnić od podanych w materiałach, ze względu na uaktualnianie wartości zapisanych
3. Przejścia fazowe pomiędzy trzema stanami skupienia materii:
 Temat: Zmiany stanu skupienia. 1. Energia sieci krystalicznej- wielkość dzięki której można oszacować siły przyciągania w krysztale 2. Energia wiązania sieci krystalicznej- ilość energii potrzebnej do
Temat: Zmiany stanu skupienia. 1. Energia sieci krystalicznej- wielkość dzięki której można oszacować siły przyciągania w krysztale 2. Energia wiązania sieci krystalicznej- ilość energii potrzebnej do
Właściwości koligatywne
 Tomasz Lubera Właściwości koligatywne Grupa zjawisk naturalnych niezależnych od rodzaju substancji rozpuszczonej a jedynie od jej ilości. Należą do nich: obniżenie prężności pary, podwyższenie temperatury
Tomasz Lubera Właściwości koligatywne Grupa zjawisk naturalnych niezależnych od rodzaju substancji rozpuszczonej a jedynie od jej ilości. Należą do nich: obniżenie prężności pary, podwyższenie temperatury
GAZ DOSKONAŁY. Brak oddziaływań między cząsteczkami z wyjątkiem zderzeń idealnie sprężystych.
 TERMODYNAMIKA GAZ DOSKONAŁY Gaz doskonały to abstrakcyjny, matematyczny model gazu, chociaż wiele gazów (azot, tlen) w warunkach normalnych zachowuje się w przybliżeniu jak gaz doskonały. Model ten zakłada:
TERMODYNAMIKA GAZ DOSKONAŁY Gaz doskonały to abstrakcyjny, matematyczny model gazu, chociaż wiele gazów (azot, tlen) w warunkach normalnych zachowuje się w przybliżeniu jak gaz doskonały. Model ten zakłada:
Zadania pochodzą ze zbioru zadań P.W. Atkins, C.A. Trapp, M.P. Cady, C. Giunta, CHEMIA FIZYCZNA Zbiór zadań z rozwiązaniami, PWN, Warszawa 2001
 Zadania pochodzą ze zbioru zadań P.W. Atkins, C.A. Trapp, M.P. Cady, C. Giunta, CHEMIA FIZYCZNA Zbiór zadań z rozwiązaniami, PWN, Warszawa 2001 I zasada termodynamiki - pojęcia podstawowe C2.4 Próbka zawierająca
Zadania pochodzą ze zbioru zadań P.W. Atkins, C.A. Trapp, M.P. Cady, C. Giunta, CHEMIA FIZYCZNA Zbiór zadań z rozwiązaniami, PWN, Warszawa 2001 I zasada termodynamiki - pojęcia podstawowe C2.4 Próbka zawierająca
prof. dr hab. Małgorzata Jóźwiak
 Czy równowaga w przyrodzie i w chemii jest korzystna? prof. dr hab. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga
Czy równowaga w przyrodzie i w chemii jest korzystna? prof. dr hab. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga
S 2, C 2h,D 2h,D 3d,D 4h, D 6h, O h
 Są tylko 32 grupy punktowe, które spełniają ten warunek, Można je pogrupować w 7 typów grup (spośród omówionych 12- tu), które spełniają powyższe własności S 2, C 2h,D 2h,D 3d,D 4h, D 6h, O h nazywają
Są tylko 32 grupy punktowe, które spełniają ten warunek, Można je pogrupować w 7 typów grup (spośród omówionych 12- tu), które spełniają powyższe własności S 2, C 2h,D 2h,D 3d,D 4h, D 6h, O h nazywają
Termodynamika materiałów
 Termodynamika materiałów Plan wykładu 1. Funkcje termodynamiczne, pojemność cieplna. 2. Warunki równowagi termodynamicznej w układach jedno- i wieloskładnikowych, pojęcie potencjału chemicznego. 3. Modele
Termodynamika materiałów Plan wykładu 1. Funkcje termodynamiczne, pojemność cieplna. 2. Warunki równowagi termodynamicznej w układach jedno- i wieloskładnikowych, pojęcie potencjału chemicznego. 3. Modele
Wykład 6. Klasyfikacja przemian fazowych
 Wykład 6 Klasyfikacja przemian fazowych JS Klasyfikacja Ehrenfesta Ehrenfest klasyfikuje przemiany fazowe w oparciu o potencjał chemiczny. nieciągłość Przemiany fazowe pierwszego rodzaju pochodne potencjału
Wykład 6 Klasyfikacja przemian fazowych JS Klasyfikacja Ehrenfesta Ehrenfest klasyfikuje przemiany fazowe w oparciu o potencjał chemiczny. nieciągłość Przemiany fazowe pierwszego rodzaju pochodne potencjału
STRUKTURA KRYSTALICZNA
 PODSTAWY KRYSTALOGRAFII Struktura krystaliczna Wektory translacji sieci Komórka elementarna Komórka elementarna Wignera-Seitza Jednostkowy element struktury Sieci Bravais go 2D Sieci przestrzenne Bravais
PODSTAWY KRYSTALOGRAFII Struktura krystaliczna Wektory translacji sieci Komórka elementarna Komórka elementarna Wignera-Seitza Jednostkowy element struktury Sieci Bravais go 2D Sieci przestrzenne Bravais
chemia wykład 3 Przemiany fazowe
 Przemiany fazowe Przemiany fazowe substancji czystych Wrzenie, krzepnięcie, przemiana grafitu w diament stanowią przykłady przemian fazowych, które zachodzą bez zmiany składu chemicznego. Diagramy fazowe
Przemiany fazowe Przemiany fazowe substancji czystych Wrzenie, krzepnięcie, przemiana grafitu w diament stanowią przykłady przemian fazowych, które zachodzą bez zmiany składu chemicznego. Diagramy fazowe
WŁASNOŚCI CIAŁ STAŁYCH I CIECZY
 WŁASNOŚCI CIAŁ STAŁYCH I CIECZY Polimery Sieć krystaliczna Napięcie powierzchniowe Dyfuzja 2 BUDOWA CIAŁ STAŁYCH Ciała krystaliczne (kryształy): monokryształy, polikryształy Ciała amorficzne (bezpostaciowe)
WŁASNOŚCI CIAŁ STAŁYCH I CIECZY Polimery Sieć krystaliczna Napięcie powierzchniowe Dyfuzja 2 BUDOWA CIAŁ STAŁYCH Ciała krystaliczne (kryształy): monokryształy, polikryształy Ciała amorficzne (bezpostaciowe)
(1) Równanie stanu gazu doskonałego. I zasada termodynamiki: ciepło, praca.
 (1) Równanie stanu gazu doskonałego. I zasada termodynamiki: ciepło, praca. 1. Aby określić dokładną wartość stałej gazowej R, student ogrzał zbiornik o objętości 20,000 l wypełniony 0,25132 g gazowego
(1) Równanie stanu gazu doskonałego. I zasada termodynamiki: ciepło, praca. 1. Aby określić dokładną wartość stałej gazowej R, student ogrzał zbiornik o objętości 20,000 l wypełniony 0,25132 g gazowego
Diagramy fazowe graficzna reprezentacja warunków równowagi
 Diagramy fazowe graficzna reprezentacja warunków równowagi Faza jednorodna część układu, oddzielona od innych części granicami faz, na których zachodzi skokowa zmiana pewnych własności fizycznych. B 0
Diagramy fazowe graficzna reprezentacja warunków równowagi Faza jednorodna część układu, oddzielona od innych części granicami faz, na których zachodzi skokowa zmiana pewnych własności fizycznych. B 0
TERMODYNAMIKA FENOMENOLOGICZNA
 TERMODYNAMIKA FENOMENOLOGICZNA Przedmiotem badań są własności układów makroskopowych w zaleŝności od temperatury. Układ makroskopowy Np. 1 mol substancji - tyle składników ile w 12 gramach węgla C 12 N
TERMODYNAMIKA FENOMENOLOGICZNA Przedmiotem badań są własności układów makroskopowych w zaleŝności od temperatury. Układ makroskopowy Np. 1 mol substancji - tyle składników ile w 12 gramach węgla C 12 N
Wykład 2. Anna Ptaszek. 7 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Chemia fizyczna - wykład 2. Anna Ptaszek 1 / 1
 Wykład 2 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 7 października 2015 1 / 1 Zjawiska koligatywne Rozpuszczenie w wodzie substancji nielotnej powoduje obniżenie prężności pary nasyconej P woda
Wykład 2 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 7 października 2015 1 / 1 Zjawiska koligatywne Rozpuszczenie w wodzie substancji nielotnej powoduje obniżenie prężności pary nasyconej P woda
Badanie zależności temperatury wrzenia wody od ciśnienia
 Ćwiczenie C2 Badanie zależności temperatury wrzenia wody od ciśnienia C2.1. Cel ćwiczenia Celem ćwiczenia jest pomiar zależności temperatury wrzenia wody od ciśnienia (poniżej ciśnienia atmosferycznego),
Ćwiczenie C2 Badanie zależności temperatury wrzenia wody od ciśnienia C2.1. Cel ćwiczenia Celem ćwiczenia jest pomiar zależności temperatury wrzenia wody od ciśnienia (poniżej ciśnienia atmosferycznego),
Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12
 Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12 atomu węgla 12 C. Mol - jest taką ilością danej substancji,
Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12 atomu węgla 12 C. Mol - jest taką ilością danej substancji,
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym
 1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA
 SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
5. Ruch harmoniczny i równanie falowe
 5. Ruch harmoniczny i równanie falowe 5.1. Mamy dwie nieważkie sprężyny o współczynnikach sprężystości, odpowiednio, k 1 i k 2. Wyznaczyć współczynnik sprężystości układu tych dwóch sprężyn w przypadku,
5. Ruch harmoniczny i równanie falowe 5.1. Mamy dwie nieważkie sprężyny o współczynnikach sprężystości, odpowiednio, k 1 i k 2. Wyznaczyć współczynnik sprężystości układu tych dwóch sprężyn w przypadku,
Metody Kinetyki Biomolekularnej in vitro i in vivo
 Metody Kinetyki Biomolekularnej in vitro i in vivo ósma seria zadań 9 listopada 016 Zadanie 1. Wiązanie tlenu przez hemoglobinę - model tertameryczny. Stosując opis stanu wiązania tlenu przez hemoglobinę
Metody Kinetyki Biomolekularnej in vitro i in vivo ósma seria zadań 9 listopada 016 Zadanie 1. Wiązanie tlenu przez hemoglobinę - model tertameryczny. Stosując opis stanu wiązania tlenu przez hemoglobinę
VIII Podkarpacki Konkurs Chemiczny 2015/2016
 III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
Prędkość fazowa i grupowa fali elektromagnetycznej w falowodzie
 napisał Michał Wierzbicki Prędkość fazowa i grupowa fali elektromagnetycznej w falowodzie Prędkość grupowa paczki falowej Paczka falowa jest superpozycją fal o różnej częstości biegnących wzdłuż osi z.
napisał Michał Wierzbicki Prędkość fazowa i grupowa fali elektromagnetycznej w falowodzie Prędkość grupowa paczki falowej Paczka falowa jest superpozycją fal o różnej częstości biegnących wzdłuż osi z.
Zespół kanoniczny N,V, T. acc o n =min {1, exp [ U n U o ] }
![Zespół kanoniczny N,V, T. acc o n =min {1, exp [ U n U o ] } Zespół kanoniczny N,V, T. acc o n =min {1, exp [ U n U o ] }](/thumbs/64/51033976.jpg) Zespół kanoniczny Zespół kanoniczny N,V, T acc o n =min {1, exp [ U n U o ] } Zespół izobaryczno-izotermiczny Zespół izobaryczno-izotermiczny N P T acc o n =min {1, exp [ U n U o ] } acc o n =min {1, exp[
Zespół kanoniczny Zespół kanoniczny N,V, T acc o n =min {1, exp [ U n U o ] } Zespół izobaryczno-izotermiczny Zespół izobaryczno-izotermiczny N P T acc o n =min {1, exp [ U n U o ] } acc o n =min {1, exp[
ZALEŻNOŚĆ CIŚNIENIA PARY NASYCONEJ WODY OD TEM- PERATURY. WYZNACZANIE MOLOWEGO CIEPŁA PARO- WANIA
 ZALEŻNOŚĆ CIŚNIENIA PARY NASYCONEJ WODY OD TEM- PERATURY. WYZNACZANIE MOLOWEGO CIEPŁA PARO- WANIA I. Cel ćwiczenia: zbadanie zależności ciśnienia pary nasyconej wody od temperatury oraz wyznaczenie molowego
ZALEŻNOŚĆ CIŚNIENIA PARY NASYCONEJ WODY OD TEM- PERATURY. WYZNACZANIE MOLOWEGO CIEPŁA PARO- WANIA I. Cel ćwiczenia: zbadanie zależności ciśnienia pary nasyconej wody od temperatury oraz wyznaczenie molowego
Wykład 3. Fizykochemia biopolimerów- wykład 3. Anna Ptaszek. 30 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego
 Wykład 3 - wykład 3 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 30 października 2013 1/56 Warunek równowagi fazowej Jakich układów dotyczy równowaga fazowa? Równowaga fazowa dotyczy układów: jednoskładnikowych
Wykład 3 - wykład 3 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 30 października 2013 1/56 Warunek równowagi fazowej Jakich układów dotyczy równowaga fazowa? Równowaga fazowa dotyczy układów: jednoskładnikowych
Podstawy termodynamiki.
 Podstawy termodynamiki. Termodynamika opisuje ogólne prawa przemian energetycznych w układach makroskopowych. Określa kierunki procesów zachodzących w przyrodzie w sposób samorzutny, jak i stanów końcowych,
Podstawy termodynamiki. Termodynamika opisuje ogólne prawa przemian energetycznych w układach makroskopowych. Określa kierunki procesów zachodzących w przyrodzie w sposób samorzutny, jak i stanów końcowych,
Inżynieria procesów przetwórstwa węgla, zima 15/16
 Inżynieria procesów przetwórstwa węgla, zima 15/16 Ćwiczenia 1 7.10.2015 1. Załóżmy, że balon ma kształt sfery o promieniu 3m. a. Jaka ilość wodoru potrzebna jest do jego wypełnienia, aby na poziomie morza
Inżynieria procesów przetwórstwa węgla, zima 15/16 Ćwiczenia 1 7.10.2015 1. Załóżmy, że balon ma kształt sfery o promieniu 3m. a. Jaka ilość wodoru potrzebna jest do jego wypełnienia, aby na poziomie morza
Temodynamika Roztwór N 2 i Ar (gazów doskonałych) ma wykładnik adiabaty κ = 1.5. Określić molowe udziały składników. 1.7
 Temodynamika Zadania 2016 0 Oblicz: 1 1.1 10 cm na stopy, 60 stóp na metry, 50 ft 2 na metry. 45 m 2 na ft 2 g 40 cm na uncję na stopę sześcienną, na uncję na cal sześcienny 3 60 g cm na funt na stopę
Temodynamika Zadania 2016 0 Oblicz: 1 1.1 10 cm na stopy, 60 stóp na metry, 50 ft 2 na metry. 45 m 2 na ft 2 g 40 cm na uncję na stopę sześcienną, na uncję na cal sześcienny 3 60 g cm na funt na stopę
MATERIA. = m i liczby całkowite. ciała stałe. - kryształy - ciała bezpostaciowe (amorficzne) - ciecze KRYSZTAŁY. Periodyczność
 MATERIA ciała stałe - kryształy - ciała bezpostaciowe (amorficzne) - ciecze - gazy KRYSZTAŁY Periodyczność Kryształ (idealny) struktura zbudowana z powtarzających się w przestrzeni periodycznie identycznych
MATERIA ciała stałe - kryształy - ciała bezpostaciowe (amorficzne) - ciecze - gazy KRYSZTAŁY Periodyczność Kryształ (idealny) struktura zbudowana z powtarzających się w przestrzeni periodycznie identycznych
J. Szantyr - Wykład 3 Równowaga płynu
 J. Szantyr - Wykład 3 Równowaga płynu Siły wewnętrzne wzajemne oddziaływania elementów mas wydzielonego obszaru płynu, siły o charakterze powierzchniowym, znoszące się parami. Siły zewnętrzne wynik oddziaływania
J. Szantyr - Wykład 3 Równowaga płynu Siły wewnętrzne wzajemne oddziaływania elementów mas wydzielonego obszaru płynu, siły o charakterze powierzchniowym, znoszące się parami. Siły zewnętrzne wynik oddziaływania
Temat 27. Termodynamiczne modele blokowe wzrostu kryształów
 Temat 27. Termodynamiczne modele blokowe wzrostu kryształów W modelach blokowych wzrostu kryształów wszystkie zjawiska zachodzące na powierzchni kryształu zostały sprowadzone do przyłączania i odłączania
Temat 27. Termodynamiczne modele blokowe wzrostu kryształów W modelach blokowych wzrostu kryształów wszystkie zjawiska zachodzące na powierzchni kryształu zostały sprowadzone do przyłączania i odłączania
Czy równowaga jest procesem korzystnym? dr hab. prof. nadzw. Małgorzata Jóźwiak
 Czy równowaga jest procesem korzystnym? dr hab. prof. nadzw. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga ciało
Czy równowaga jest procesem korzystnym? dr hab. prof. nadzw. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga ciało
Wykład 1-4. Anna Ptaszek. 6 września Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Fizykochemia biopolimerów - wykład 1-4.
 Wykład 1-4 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 6 września 2016 1 / 68 Podstawowe pojęcia Układ termodynamiczny To zbiór niezależnych elementów, które oddziałują ze sobą tworząc integralną
Wykład 1-4 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 6 września 2016 1 / 68 Podstawowe pojęcia Układ termodynamiczny To zbiór niezależnych elementów, które oddziałują ze sobą tworząc integralną
Podstawowe pojęcia 1
 Tomasz Lubera Półogniwo Podstawowe pojęcia 1 układ złożony z min. dwóch faz pozostających ze sobą w kontakcie, w którym w wyniku zachodzących procesów utleniania lub redukcji ustala się stan równowagi,
Tomasz Lubera Półogniwo Podstawowe pojęcia 1 układ złożony z min. dwóch faz pozostających ze sobą w kontakcie, w którym w wyniku zachodzących procesów utleniania lub redukcji ustala się stan równowagi,
Klasyfikacja przemian fazowych
 Klasyfikacja przemian fazowych Faza- jednorodna pod względem własności część układu, oddzielona od pozostałej częsci układu powierzchnią graniczną, po której przekroczeniu własności zmieniaja się w sposób
Klasyfikacja przemian fazowych Faza- jednorodna pod względem własności część układu, oddzielona od pozostałej częsci układu powierzchnią graniczną, po której przekroczeniu własności zmieniaja się w sposób
Podstawy termodynamiki
 Podstawy termodynamiki Organizm żywy z punktu widzenia termodynamiki Parametry stanu Funkcje stanu: U, H, F, G, S I zasada termodynamiki i prawo Hessa II zasada termodynamiki Kierunek przemian w warunkach
Podstawy termodynamiki Organizm żywy z punktu widzenia termodynamiki Parametry stanu Funkcje stanu: U, H, F, G, S I zasada termodynamiki i prawo Hessa II zasada termodynamiki Kierunek przemian w warunkach
INŻYNIERIA BIOMEDYCZNA
 INŻYNIERIA BIOMEDYCZNA 19.01.2019 1 Stan materii a stan skupienia Stan materii podział z punktu widzenia mikroskopowego (struktury jakie tworzą atomy, cząsteczki, jony) Stan skupienia - forma występowania
INŻYNIERIA BIOMEDYCZNA 19.01.2019 1 Stan materii a stan skupienia Stan materii podział z punktu widzenia mikroskopowego (struktury jakie tworzą atomy, cząsteczki, jony) Stan skupienia - forma występowania
INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH
 INSTYTUT MASZYN I URZĄDZEŃ ENERGETYCZNYCH Politechnika Śląska w Gliwicach INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH WYZNACZANIE WYKRESU RÓWNOWAGI FAZOWEJ (dla stopów dwuskładnikowych) Instrukcja przeznaczona
INSTYTUT MASZYN I URZĄDZEŃ ENERGETYCZNYCH Politechnika Śląska w Gliwicach INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH WYZNACZANIE WYKRESU RÓWNOWAGI FAZOWEJ (dla stopów dwuskładnikowych) Instrukcja przeznaczona
Ćwiczenie 4: Ciepło właściwe monokryształu fcc argonu
 Ćwiczenie 4: Ciepło właściwe monokryształu fcc argonu Tym razem zajmiemy się już problemem bardziej złożonym. Celem ćwiczenia jest wyznaczenie dla monokryształu fcc argonu ciepła właściwego c, tj. ciepła
Ćwiczenie 4: Ciepło właściwe monokryształu fcc argonu Tym razem zajmiemy się już problemem bardziej złożonym. Celem ćwiczenia jest wyznaczenie dla monokryształu fcc argonu ciepła właściwego c, tj. ciepła
Akademickie Centrum Czystej Energii. Ogniwo paliwowe
 Ogniwo paliwowe 1. Zagadnienia elektroliza, prawo Faraday a, pierwiastki galwaniczne, ogniwo paliwowe 2. Opis Główną częścią ogniwa paliwowego PEM (Proton Exchange Membrane) jest membrana złożona z katody
Ogniwo paliwowe 1. Zagadnienia elektroliza, prawo Faraday a, pierwiastki galwaniczne, ogniwo paliwowe 2. Opis Główną częścią ogniwa paliwowego PEM (Proton Exchange Membrane) jest membrana złożona z katody
Funkcja rozkładu Fermiego-Diraca w różnych temperaturach
 Funkcja rozkładu Fermiego-Diraca w różnych temperaturach 1 f FD ( E) = E E F exp + 1 kbt Styczna do krzywej w punkcie f FD (E F )=0,5 przecina oś energii i prostą f FD (E)=1 w punktach odległych o k B
Funkcja rozkładu Fermiego-Diraca w różnych temperaturach 1 f FD ( E) = E E F exp + 1 kbt Styczna do krzywej w punkcie f FD (E F )=0,5 przecina oś energii i prostą f FD (E)=1 w punktach odległych o k B
TERMODYNAMIKA Zajęcia wyrównawcze, Częstochowa, 2009/2010 Ewa Mandowska
 1. Bilans cieplny 2. Przejścia fazowe 3. Równanie stanu gazu doskonałego 4. I zasada termodynamiki 5. Przemiany gazu doskonałego 6. Silnik cieplny 7. II zasada termodynamiki TERMODYNAMIKA Zajęcia wyrównawcze,
1. Bilans cieplny 2. Przejścia fazowe 3. Równanie stanu gazu doskonałego 4. I zasada termodynamiki 5. Przemiany gazu doskonałego 6. Silnik cieplny 7. II zasada termodynamiki TERMODYNAMIKA Zajęcia wyrównawcze,
Janusz Adamowski METODY OBLICZENIOWE FIZYKI Kwantowa wariacyjna metoda Monte Carlo. Problem własny dla stanu podstawowego układu N cząstek
 Janusz Adamowski METODY OBLICZENIOWE FIZYKI 1 Rozdział 20 KWANTOWE METODY MONTE CARLO 20.1 Kwantowa wariacyjna metoda Monte Carlo Problem własny dla stanu podstawowego układu N cząstek (H E 0 )ψ 0 (r)
Janusz Adamowski METODY OBLICZENIOWE FIZYKI 1 Rozdział 20 KWANTOWE METODY MONTE CARLO 20.1 Kwantowa wariacyjna metoda Monte Carlo Problem własny dla stanu podstawowego układu N cząstek (H E 0 )ψ 0 (r)
Ćwiczenia do wykładu Fizyka Statystyczna i Termodynamika
 Ćwiczenia do wykładu Fizyka tatystyczna i ermodynamika Prowadzący dr gata Fronczak Zestaw 5. ermodynamika rzejść fazowych: równanie lausiusa-laeyrona, własności gazu Van der Waalsa 3.1 Rozważ tyowy diagram
Ćwiczenia do wykładu Fizyka tatystyczna i ermodynamika Prowadzący dr gata Fronczak Zestaw 5. ermodynamika rzejść fazowych: równanie lausiusa-laeyrona, własności gazu Van der Waalsa 3.1 Rozważ tyowy diagram
Projekt Inżynier mechanik zawód z przyszłością współfinansowany ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego
 Zajęcia wyrównawcze z fizyki -Zestaw 4 -eoria ermodynamika Równanie stanu gazu doskonałego Izoprzemiany gazowe Energia wewnętrzna gazu doskonałego Praca i ciepło w przemianach gazowych Silniki cieplne
Zajęcia wyrównawcze z fizyki -Zestaw 4 -eoria ermodynamika Równanie stanu gazu doskonałego Izoprzemiany gazowe Energia wewnętrzna gazu doskonałego Praca i ciepło w przemianach gazowych Silniki cieplne
Równowaga. równowaga metastabilna (niepełna) równowaga niestabilna (nietrwała) równowaga stabilna (pełna) brak równowagi rozpraszanie energii
 Równowaga równowaga stabilna (pełna) równowaga metastabilna (niepełna) równowaga niestabilna (nietrwała) brak równowagi rozpraszanie energii energia swobodna Co jest warunkiem równowagi? temperatura W
Równowaga równowaga stabilna (pełna) równowaga metastabilna (niepełna) równowaga niestabilna (nietrwała) brak równowagi rozpraszanie energii energia swobodna Co jest warunkiem równowagi? temperatura W
Równanie gazu doskonałego
 Równanie gazu doskonałego Gaz doskonały to abstrakcyjny model gazu, który zakłada, że gaz jest zbiorem sprężyście zderzających się kulek. Wiele gazów w warunkach normalnych zachowuje się jak gaz doskonały.
Równanie gazu doskonałego Gaz doskonały to abstrakcyjny model gazu, który zakłada, że gaz jest zbiorem sprężyście zderzających się kulek. Wiele gazów w warunkach normalnych zachowuje się jak gaz doskonały.
Roztwory. Homogeniczne jednorodne (jedno-fazowe) mieszaniny dwóch lub więcej składników.
 Roztwory Homogeniczne jednorodne (jedno-fazowe) mieszaniny dwóch lub więcej składników. Własności fizyczne roztworów są związane z równowagę pomiędzy siłami wiążącymi cząsteczki wody i substancji rozpuszczonej.
Roztwory Homogeniczne jednorodne (jedno-fazowe) mieszaniny dwóch lub więcej składników. Własności fizyczne roztworów są związane z równowagę pomiędzy siłami wiążącymi cząsteczki wody i substancji rozpuszczonej.
CIEPLNE I MECHANICZNE WŁASNOŚCI CIAŁ
 CIEPLNE I MECHANICZNE WŁASNOŚCI CIAŁ Ciepło i temperatura Pojemność cieplna i ciepło właściwe Ciepło przemiany Przejścia między stanami Rozszerzalność cieplna Sprężystość ciał Prawo Hooke a Mechaniczne
CIEPLNE I MECHANICZNE WŁASNOŚCI CIAŁ Ciepło i temperatura Pojemność cieplna i ciepło właściwe Ciepło przemiany Przejścia między stanami Rozszerzalność cieplna Sprężystość ciał Prawo Hooke a Mechaniczne
INŻYNIERIA BIOMEDYCZNA
 INŻYNIERIA BIOMEDYCZNA 21.01.2018 1 Stan materii a stan skupienia Stan materii podział z punktu widzenia mikroskopowego (struktury jakie tworzą atomy, cząsteczki, jony) Stan skupienia - forma występowania
INŻYNIERIA BIOMEDYCZNA 21.01.2018 1 Stan materii a stan skupienia Stan materii podział z punktu widzenia mikroskopowego (struktury jakie tworzą atomy, cząsteczki, jony) Stan skupienia - forma występowania
Aby opisać strukturę krystaliczną, konieczne jest określenie jej części składowych: sieci przestrzennej oraz bazy atomowej.
 2. Podstawy krystalografii Podczas naszych zajęć skupimy się przede wszystkim na strukturach krystalicznych. Kryształem nazywamy (def. strukturalna) substancję stałą zbudowaną z atomów, jonów lub cząsteczek
2. Podstawy krystalografii Podczas naszych zajęć skupimy się przede wszystkim na strukturach krystalicznych. Kryształem nazywamy (def. strukturalna) substancję stałą zbudowaną z atomów, jonów lub cząsteczek
Transport jonów: kryształy jonowe
 Transport jonów: kryształy jonowe JONIKA I FOTONIKA MICHAŁ MARZANTOWICZ Jodek srebra AgI W 42 K strukturalne przejście fazowe I rodzaju do fazy α stopiona podsieć kationowa. Fluorek ołowiu PbF 2 zdefektowanie
Transport jonów: kryształy jonowe JONIKA I FOTONIKA MICHAŁ MARZANTOWICZ Jodek srebra AgI W 42 K strukturalne przejście fazowe I rodzaju do fazy α stopiona podsieć kationowa. Fluorek ołowiu PbF 2 zdefektowanie
Wykład 10 Równowaga chemiczna
 Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
Roztwory rzeczywiste (1)
 Roztwory rzeczywiste (1) Również w temp. 298,15K, ale dla CCl 4 () i CH 3 OH (). 2 15 1 5-5 -1-15 Τ S H,2,4,6,8 1 G -2 Chem. Fiz. TCH II/12 1 rzyczyny dodatnich i ujemnych odchyleń od prawa Raoulta konsekwencja
Roztwory rzeczywiste (1) Również w temp. 298,15K, ale dla CCl 4 () i CH 3 OH (). 2 15 1 5-5 -1-15 Τ S H,2,4,6,8 1 G -2 Chem. Fiz. TCH II/12 1 rzyczyny dodatnich i ujemnych odchyleń od prawa Raoulta konsekwencja
BUDOWA KRYSTALICZNA CIAŁ STAŁYCH. Stopień uporządkowania struktury wewnętrznej ciał stałych decyduje o ich podziale
 BUDOWA KRYSTALICZNA CIAŁ STAŁYCH Stopień uporządkowania struktury wewnętrznej ciał stałych decyduje o ich podziale na: kryształy ciała o okresowym regularnym uporządkowaniu atomów, cząsteczek w całej swojej
BUDOWA KRYSTALICZNA CIAŁ STAŁYCH Stopień uporządkowania struktury wewnętrznej ciał stałych decyduje o ich podziale na: kryształy ciała o okresowym regularnym uporządkowaniu atomów, cząsteczek w całej swojej
Ćwiczenia 12 Zadanie 12.4D
 Sylwester Arabas (ćwiczenia do wykładu prof. Hanny Pawłowskiej) Instytut Geofizyki, Wydział Fizyki Uniwersytetu Warszawskiego 26 maja 2011 r. : polecenie / rozwiązanie Wyznaczenie do jakiego poziomu musiałaby
Sylwester Arabas (ćwiczenia do wykładu prof. Hanny Pawłowskiej) Instytut Geofizyki, Wydział Fizyki Uniwersytetu Warszawskiego 26 maja 2011 r. : polecenie / rozwiązanie Wyznaczenie do jakiego poziomu musiałaby
Potencjał pola elektrycznego
 Potencjał pola elektrycznego Pole elektryczne jest polem zachowawczym, czyli praca wykonana przy przesunięciu ładunku pomiędzy dwoma punktami nie zależy od tego po jakiej drodze przesuwamy ładunek. Spróbujemy
Potencjał pola elektrycznego Pole elektryczne jest polem zachowawczym, czyli praca wykonana przy przesunięciu ładunku pomiędzy dwoma punktami nie zależy od tego po jakiej drodze przesuwamy ładunek. Spróbujemy
że w wyniku pomiaru zmiennej dynamicznej A, której odpowiada operator αˆ otrzymana zostanie wartość 2.41?
 TEST. Ortogonalne i znormalizowane funkcje f i f są funkcjami własnymi operatora αˆ, przy czym: α ˆ f =. 05 f i α ˆ f =. 4f. Stan pewnej cząstki opisuje 3 znormalizowana funkcja falowa Ψ = f + f. Jakie
TEST. Ortogonalne i znormalizowane funkcje f i f są funkcjami własnymi operatora αˆ, przy czym: α ˆ f =. 05 f i α ˆ f =. 4f. Stan pewnej cząstki opisuje 3 znormalizowana funkcja falowa Ψ = f + f. Jakie
Termodynamika Część 2
 Termodynamika Część 2 Równanie stanu Równanie stanu gazu doskonałego Równania stanu gazów rzeczywistych rozwinięcie wirialne równanie van der Waalsa hipoteza odpowiedniości stanów inne równania stanu Równanie
Termodynamika Część 2 Równanie stanu Równanie stanu gazu doskonałego Równania stanu gazów rzeczywistych rozwinięcie wirialne równanie van der Waalsa hipoteza odpowiedniości stanów inne równania stanu Równanie
Podstawowe definicje
 Wprowadzenie do równowag fazowych (1) Podstawowe definicje 1) Faza dla danej substancji jej postać charakteryzująca się jednorodnym składem chemicznym i stanem fizycznym. W obrębie fazy niektóre intensywne
Wprowadzenie do równowag fazowych (1) Podstawowe definicje 1) Faza dla danej substancji jej postać charakteryzująca się jednorodnym składem chemicznym i stanem fizycznym. W obrębie fazy niektóre intensywne
Wykład FIZYKA I. 14. Termodynamika fenomenologiczna cz.ii. Dr hab. inż. Władysław Artur Woźniak
 Wykład FIZYKA I 14. Termodynamika fenomenologiczna cz.ii Dr hab. inż. Władysław Artur Woźniak Instytut Fizyki Politechniki Wrocławskiej http://www.if.pwr.wroc.pl/~wozniak/fizyka1.html GAZY DOSKONAŁE Przez
Wykład FIZYKA I 14. Termodynamika fenomenologiczna cz.ii Dr hab. inż. Władysław Artur Woźniak Instytut Fizyki Politechniki Wrocławskiej http://www.if.pwr.wroc.pl/~wozniak/fizyka1.html GAZY DOSKONAŁE Przez
6. ph i ELEKTROLITY. 6. ph i elektrolity
 6. ph i ELEKTROLITY 31 6. ph i elektrolity 6.1. Oblicz ph roztworu zawierającego 0,365 g HCl w 1,0 dm 3 roztworu. Odp 2,00 6.2. Oblicz ph 0,0050 molowego roztworu wodorotlenku baru (α = 1,00). Odp. 12,00
6. ph i ELEKTROLITY 31 6. ph i elektrolity 6.1. Oblicz ph roztworu zawierającego 0,365 g HCl w 1,0 dm 3 roztworu. Odp 2,00 6.2. Oblicz ph 0,0050 molowego roztworu wodorotlenku baru (α = 1,00). Odp. 12,00
Wykład 3 Zjawiska transportu Dyfuzja w gazie, przewodnictwo cieplne, lepkość gazu, przewodnictwo elektryczne
 Wykład 3 Zjawiska transportu Dyfuzja w gazie, przewodnictwo cieplne, lepkość gazu, przewodnictwo elektryczne W3. Zjawiska transportu Zjawiska transportu zachodzą gdy układ dąży do stanu równowagi. W zjawiskach
Wykład 3 Zjawiska transportu Dyfuzja w gazie, przewodnictwo cieplne, lepkość gazu, przewodnictwo elektryczne W3. Zjawiska transportu Zjawiska transportu zachodzą gdy układ dąży do stanu równowagi. W zjawiskach
7. Defekty samoistne Typy defektów Zdefektowanie samoistne w związkach stechiometrycznych
 7. Defekty samoistne 7.1. Typy defektów Zgodnie z trzecią zasadą termodynamiki, tylko w temperaturze 0[K] kryształ może mieć zerową entropię. Oznacza to, że jeśli temperatura jest wyższa niż 0[K] to w
7. Defekty samoistne 7.1. Typy defektów Zgodnie z trzecią zasadą termodynamiki, tylko w temperaturze 0[K] kryształ może mieć zerową entropię. Oznacza to, że jeśli temperatura jest wyższa niż 0[K] to w
Zadanie 1. Zadanie: Odpowiedź: ΔU = 2,8663 10 4 J
 Tomasz Lubera Zadanie: Zadanie 1 Autoklaw zawiera 30 dm 3 azotu o temperaturze 15 o C pod ciśnieniem 1,48 atm. Podczas ogrzewania autoklawu ciśnienie wzrosło do 3800,64 mmhg. Oblicz zmianę energii wewnętrznej
Tomasz Lubera Zadanie: Zadanie 1 Autoklaw zawiera 30 dm 3 azotu o temperaturze 15 o C pod ciśnieniem 1,48 atm. Podczas ogrzewania autoklawu ciśnienie wzrosło do 3800,64 mmhg. Oblicz zmianę energii wewnętrznej
1. PIERWSZA I DRUGA ZASADA TERMODYNAMIKI TERMOCHEMIA
 . PIERWSZA I DRUGA ZASADA ERMODYNAMIKI ERMOCHEMIA Zadania przykładowe.. Jeden mol jednoatomowego gazu doskonałego znajduje się początkowo w warunkach P = 0 Pa i = 300 K. Zmiana ciśnienia do P = 0 Pa nastąpiła:
. PIERWSZA I DRUGA ZASADA ERMODYNAMIKI ERMOCHEMIA Zadania przykładowe.. Jeden mol jednoatomowego gazu doskonałego znajduje się początkowo w warunkach P = 0 Pa i = 300 K. Zmiana ciśnienia do P = 0 Pa nastąpiła:
Inżynieria materiałowa: wykorzystywanie praw termodynamiki a czasem... walka z termodynamiką
 Inżynieria materiałowa: wykorzystywanie praw termodynamiki a czasem... walka z termodynamiką Kilka definicji Faza Definicja Gibbsa = stan materii jednorodny wewnętrznie, nie tylko pod względem składu chemicznego,
Inżynieria materiałowa: wykorzystywanie praw termodynamiki a czasem... walka z termodynamiką Kilka definicji Faza Definicja Gibbsa = stan materii jednorodny wewnętrznie, nie tylko pod względem składu chemicznego,
Modelowanie w ochronie środowiska
 Modelowanie w ochronie środowiska PARAMETRY FIZYKO-CHEMICZNE WPŁYWAJĄCE NA TRWAŁOŚĆ I ROZPRZESTRZENIANIE SIĘ ZWIĄZKÓW CHEMICZNYCH W ŚRODOWISKU NATURALNYM KOMPOENTY ŚRODOWISKA TRWAŁOŚĆ! CZAS PRZEBYWANIA
Modelowanie w ochronie środowiska PARAMETRY FIZYKO-CHEMICZNE WPŁYWAJĄCE NA TRWAŁOŚĆ I ROZPRZESTRZENIANIE SIĘ ZWIĄZKÓW CHEMICZNYCH W ŚRODOWISKU NATURALNYM KOMPOENTY ŚRODOWISKA TRWAŁOŚĆ! CZAS PRZEBYWANIA
4 Przekształcenia pochodnych termodynamicznych
 4 Przekształcenia pochodnych termodynamicznych 4.1 Relacje Maxwella Pierwsza zasada termodynamiki może być zapisana w postaci niezależnej od reprezentacji jako warunek znikania formy Pfaffa: Stąd musi
4 Przekształcenia pochodnych termodynamicznych 4.1 Relacje Maxwella Pierwsza zasada termodynamiki może być zapisana w postaci niezależnej od reprezentacji jako warunek znikania formy Pfaffa: Stąd musi
XIII Konkurs Chemiczny dla Uczniów Szkół Średnich Etap II rozwiązania zadań
 XIII Konkurs Chemiczny dla Uczniów Szkół Średnich Etap II rozwiązania zadań UWAGI OGÓLNE: Za błędy w obliczeniu masy molowej -50% pkt. Za duże błędy rachunkowe -50 % pkt. Jeśli zadanie składało się z kilku
XIII Konkurs Chemiczny dla Uczniów Szkół Średnich Etap II rozwiązania zadań UWAGI OGÓLNE: Za błędy w obliczeniu masy molowej -50% pkt. Za duże błędy rachunkowe -50 % pkt. Jeśli zadanie składało się z kilku
Odwracalność przemiany chemicznej
 Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
Chemia fizyczna. Równowagi fazowe. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Chemia fizyczna Równowagi fazowe. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny SUBSTANCJE CZYSTE SUBSTANCJE CZYSTE RÓWNOWAGI FAZOWE Fazą danej substancji nazywamy postać materii, która charakteryzuje
Chemia fizyczna Równowagi fazowe. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny SUBSTANCJE CZYSTE SUBSTANCJE CZYSTE RÓWNOWAGI FAZOWE Fazą danej substancji nazywamy postać materii, która charakteryzuje
Termodynamika Część 6 Związki i tożsamości termodynamiczne Potencjały termodynamiczne Warunki równowagi termodynamicznej Potencjał chemiczny
 Termodynamika Część 6 Związki i tożsamości termodynamiczne Potencjały termodynamiczne Warunki równowagi termodynamicznej Potencjał chemiczny Janusz Brzychczyk, Instytut Fizyki UJ Związek pomiędzy równaniem
Termodynamika Część 6 Związki i tożsamości termodynamiczne Potencjały termodynamiczne Warunki równowagi termodynamicznej Potencjał chemiczny Janusz Brzychczyk, Instytut Fizyki UJ Związek pomiędzy równaniem
Nazwisko i imię: Zespół: Data: Ćwiczenie nr 25: Interferencja fal akustycznych. Prędkość dźwięku.
 Nazwisko i imię: Zespół: Data: Ćwiczenie nr 25: Interferencja fal akustycznych. Prędkość dźwięku. Cel ćwiczenia: Pomiar prędkości dźwięku w powietrzu oraz w niektórych wybranych gazach przy użyciu rury
Nazwisko i imię: Zespół: Data: Ćwiczenie nr 25: Interferencja fal akustycznych. Prędkość dźwięku. Cel ćwiczenia: Pomiar prędkości dźwięku w powietrzu oraz w niektórych wybranych gazach przy użyciu rury
Zadanie 1. Zadanie: Odpowiedź: ΔU = 2, J
 Tomasz Lubera Zadanie: Zadanie 1 Autoklaw zawiera 30 dm 3 azotu o temperaturze 15 o C pod ciśnieniem 1,48 atm. Podczas ogrzewania autoklawu ciśnienie wzrosło do 3800,64 mmhg. Oblicz zmianę energii wewnętrznej
Tomasz Lubera Zadanie: Zadanie 1 Autoklaw zawiera 30 dm 3 azotu o temperaturze 15 o C pod ciśnieniem 1,48 atm. Podczas ogrzewania autoklawu ciśnienie wzrosło do 3800,64 mmhg. Oblicz zmianę energii wewnętrznej
