Metody izolacji komórek macierzystych
|
|
|
- Aleksandra Kwiatkowska
- 8 lat temu
- Przeglądów:
Transkrypt
1 Ćwiczenie 1. Metody izolacji macierzystych 1
2 Wstęp Komórki macierzyste (KM) dzięki zdolności do samoodnawiania oraz jednocześnie do różnicowania się w komórki ukierunkowane do określonych linii rozwojowych stanowią materiał pożądany z punktu widzenia medycyny regeneracyjnej. Jednym z najważniejszych wyzwań wynikających z wykorzystania KM w medycynie regeneracyjnej jest opracowanie optymalnego protokołu ich izolacji oraz ekspansji. Do metod izolacji KM należą m. in. sortowanie MACS (ang. Magnetic Assisted Cell Sorting) oraz FACS (ang. Fluorescence Activated Cell Sorting), a także w przypadku np. mezenchymalnych KM- zdolność do adhezji do ujemnie naładowanych powierzchni naczyń hodowlanych. W sortowaniu magnetycznym MACS komórki inkubowane są z kuleczkami paramagnetycznymi sprzęgniętymi z przeciwciałami skierowanymi przeciwko określonym antygenom KM. Populacje są następnie izolowane w polu magnetycznym jako dwie subpopulacje: pozytywna oraz negatywna pod względem ekspresji określonego antygenu. Sortowanie MACS wykorzystywane jest głównie jako etap selekcji wstępnej poprzedzający izolację w oparciu o profil wieloantygenowy. W sortowaniu FACS wykorzystuje się przeciwciała wyznakowane barwnymi fluorochromami. Sortery komórkowe (w przeciwieństwie do klasycznych cytometrów przepływowych) powodują rozbicie wiązki laminarnego przepływu cieczy na małe kropelki, zawierające pojedyncze komórki. Następnie komórki naświetlane są zogniskowaną wiązką światła laserowego. Powstałe sygnały mierzone są za pomocą odpowiednich detektorów, przemieniane na impulsy elektryczne, wzmacniane i przesyłane do komputera. W zależności od tego czy komórki wykazują określoną fluorescencję, kropelki są następnie obdarzane określonym ładunkiem. Następnie kropelki te docierają do pola elektrostatycznego, a ich trajektoria jest uginana w zależności od posiadanego ładunku. Dzięki temu możemy wysortować subpopulacje o różnych profilach antygenowych. W tabeli poniżej zawarto porównanie metody izolacji MACS oraz FACS. MACS Sortowanie oparte o właściwości magnetyczne Sortowanie najczęściej w oparciu o jeden marker komórkowy Występowanie markera- selekcja pozytywna Brak markera- deplecja (selekcja negatywna) Stosunkowo niska czystość Metoda wykorzystywana do wzbogacenia przed sortowaniem FACS FACS Sortowanie oparte o właściwości fluorescencyjne Sortowanie najczęściej w oparciu o profil wieloantygenowy Równoczesne występowanie danego markera/ów lub jego/ich brak Wysoka czystość Metoda wykorzystywana do ostatecznego sortowania populacji KM Analiza w cytometrii przepływowej dostarcza informacji na temat wielkości (FSCang. forward scatter) oraz ziarnistości (SSC- ang. side scatter), a także fluorescencji emitowanej przez komórki. Wyniki pomiarów uzyskane w cytometrze przepływowym można przedstawić w postaci dokładnych danych liczbowych, jak również w postaci wykresów. Najczęściej wyniki są prezentowane w postaci histogramów lub cytogramów (wykres na którym komórki są 2
3 odzwierciedlone w postaci kropek, których położenie w układzie współrzędnych jest proporcjonalne do wielkości mierzonego parametru). Wszystkie komórki, które mają taki sam model rozpraszania światła, ukazują się na cytogramie jako pojedyncza kropka. Jedna kropka może zatem reprezentować pojedynczą komórkę lub kilka tysięcy. Jeżeli w badanej próbce oznacza się więcej niż jeden antygen, wówczas używa się dwu lub więcej przeciwciał monoklonalnych wyznakowanych różnymi barwnikami. Sygnały emitowane przez te barwniki mogą zachodzić na siebie, dlatego też należy stosować kompensację w celu prawidłowej analizy sygnałów fluorescencji. Najważniejszym źródłem mezenchymalnych KM (MSC) jest szpik kostny. Komórki te stanowią frakcję adherentną szpiku, którą otrzymuje się poprzez odpłukanie nieadherentnych po 72h od momentu wysiania pełnego szpiku na naczynie hodowlane. Do hodowli pierwotnych dedykowane są naczynia hodowlane typu Primaria wykonane z modyfikowanego polistyrenu, które wzmacniają adhezję do podłoża. Cel doświadczenia: Celem ćwiczenia jest izolacja macierzystych w oparciu o profil antygenowy z zastosowaniem technologii MACS oraz FACS oraz oddziaływań z podłożem hodowlanym (poprzez adhezję). Przebieg doświadczenia: Praca w zespołach trzyosobowych. Na każdy zespół przypadają trzy myszy, które wykorzystane zostaną zgodnie z tabelą zamieszczoną poniżej. Nr myszy Przeznaczenie 1. Założenie hodowli MSC 2 i 3. Izolacja oraz analiza KM metodą MACS oraz FACS 3
4 P. I. Szpik wyizolowany z 1 myszy Izolacja kości udowych oraz piszczelowych Izolacja szpiku kostnego P. II. Szpik wyizolowany z 2 myszy Zawieszenie szpiku w 1ml DMEM/F %FBS Wysianie do naczynia hodowlanego 72h Odpłukanie frakcji nieadherentnej Przefiltrowanie homogennej zawiesiny przez filtr Ø 40µm Liza erytrocytów (1x Lysing Buffer, 6 min., RT) Zawieszenie w 1ml AutoMACS Running Buffer Pasaż MSC P. III. Liczenie Analiza profilu antygenowego MSC technikami cytometrycznymi 50 µl zawiesiny Homogenizacja w buforze RL + 1% Bond Breaker 100 µl zawiesiny Homogenizacja w buforze RL + 1% Bond Breaker 10 µl zawiesiny do probówki cytometrycznej (Próbka niebarwiona) Ćw. 1 Ćw. 2 Ćw. 3 4 x 10 µl zawiesiny do 5 probówek cytometrycznych Barwienia pojedyncze (Próbki kompensacyjne) Komórki CD45+ P. IV. 250 µl zawiesiny Barwienie immunofluorescencyjne Wysortowanie HSC Homogenizacja w buforze RL + 1% Bond Breaker 600 µl zawiesiny Zawieszenie w AutoMACS Running Buffer w gęstości 10 7 / 90 µl buforu Dodanie CD45 MicroBeads 10 µl beadsów/ 10 7 Izolacja frakcji CD45+ oraz CD45- na AutoMACS Pro Separator 300 µl zawiesiny Utrwalanie w 4% r-rze paraformaldehydu (15 min., RT) Identyfikacja rzadkich populacji KM technikami cytometrycznymi Zawieszenie CD45+ w 300 µl, CD45- w 100 µl DMEM/F12+2%FBS 50 µl zawiesiny Homogenizacja w buforze RL + 1% Bond Breaker Komórki CD µl zawiesiny Utrwalanie w 4% r-rze paraformaldehydu (15 min., RT) Identyfikacja rzadkich populacji KM technikami cytometrycznymi 4
5 P. I. Założenie hodowli MSC 1. Z jednej myszy wyizolować z kończyn dolnych kości udowe oraz piszczelowe. Kości umieścić na szalce (60mm) w 5 ml medium DMEM/F Po odcięciu nasad kości, za pomocą strzykawki 1 ml z igłą, wypłukać szpik kostny do nowej szalki (60mm) zawierającej 5 ml medium DMEM/F12. Po zakończeniu wypłukiwania szpiku z kości, rozdrobnić szpik poprzez kilkukrotne wciągnięcie i wyciągnięcie go do/z strzykawki. 3. Otrzymaną zawiesinę przenieść do probówki 15 ml. 4. Probówkę z komórkami zwirować (1800 rpm., 7 min., RT). 5. Zlać nadsącz, natomiast pelet rozpipetować w 1 medium hodowlanego DMEM/F12+10%FBS. 6. Do butelki hodowlanej typu Primaria (25cm 2 ) nalać 4 ml medium hodowlanego DMEM/F12+10%FBS oraz dodać całkowitą objętość zawiesiny. 7. Naczynie hodowlane umieścić w inkubatorze hodowlanym (37 o C, 5% CO2). 8. Po 72h odpłukać frakcję nieadherentną. Dodać 5ml DMEM/F12+10%FBS. 9. Na następnych zajęciach wykonać pasaż. P. II. Przygotowanie mysiego szpiku kostnego do izolacji hematopoetycznych oraz niehematopoetycznych KM metodą sortowania MACS oraz FACS 1. Z dwóch myszy wyizolować z kończyn dolnych kości udowe oraz piszczelowe. Kości umieścić na szalce (60mm) w 5 ml medium DMEM/F Po odcięciu nasad kości, za pomocą strzykawki 1 ml z igłą, wypłukać szpik kostny do nowej szalki (60mm) zawierającej 5 ml medium DMEM/F12. Po zakończeniu wypłukiwania szpiku z kości, rozdrobnić szpik poprzez kilkukrotne wciągnięcie i wyciągnięcie go do/z strzykawki. 3. Otrzymaną zawiesinę przefiltrować przez filtr o średnicy porów 40 µm do probówki o objętości 15 ml. Dopełnić medium do objętości 10 ml. 4. Probówkę z komórkami zwirować (1800 rpm., 7 min., RT). 5. Zlać nadsącz, natomiast pelet rozpipetować w 1 ml Lysing Buffer (1x BD PharmLyse). Dodać 1 ml Lysing Buffer. 6. Lizę erytrocytów prowadzić przez 6 min. w RT. 7. Dopełnić medium do objętości 10 ml. 8. Probówkę z komórkami zwirować (1800 rpm., 7 min., RT). 9. Zlać nadsącz, natomiast pelet rozpipetować w 1 ml AutoMACS Running Buffer. 10. Policzyć komórki w komorze Burkera. UWAGA! Kolejne kroki mają na celu również zabezpieczenie materiału na Ćw 2 i 3! µl zawiesiny przenieść do probówki typu Eppendorf. Dodać 100 µl buforu RL zawierającego 1% Bond Breaker (β-merkaptoetanol). Zworteksować. Homogenizować przy użyciu strzykawki 1 ml z igłą. Przechowywać w -80 o C. (materiał na Ćw. 3) µl zawiesiny przenieść do nowej probówki cytometrycznej. Dodać 200 µl DPBS oraz 500 µl 4% roztworu p-formaldehydu. Utrwalać 15 min. w RT. Dodać 2 ml DPBS. Probówkę 5
6 z komórkami zwirować (1800 rpm., 7 min., RT). Zlać nadsącz, natomiast pelet rozpipetować w 0,5 ml DPBS. Przechowywać w lodówce. (materiał na Ćw. 2) 13. Do 4 probówek cytometrycznych dodać po 100 µl DMEM/F12+2%FBS oraz po 10 µl zawiesiny (próbki kompensacyjne; patrz p. IV.2. ). Probówki z komórkami trzymać na lodzie. P. III. Izolacja frakcji CD45- oraz CD45+ ze szpiku kostnego - Sortowanie MACS: 1. Pozostałą objętość zawiesiny szpiku kostnego (ok. 600 µl) zawiesić w takiej objętości AutoMACS Running Buffer (+4 o C) aby w 90 µl buforu znajdowało się Dodać 10 µl CD45 MicroBeads na każde 10 7, a następnie delikatnie przepipetować. Inkubować 15 min. na lodzie. 3. Przepłukać komórki 1 ml AutoMACS Running Buffer na każde Probówkę z komórkami zwirować (1400rpm, 8 min.). 5. Zawiesić komórki w 1,5 ml AutoMACS Running Buffer. 6. Rozdzielić komórki CD45- od CD45+ przy pomocy AutoMACS Pro Separator (Program Possels). 7. Po separacji komórki zwirować 1800 rpm., 7 min., RT. 8. Pelety CD45+ oraz CD45- zawiesić odpowiednio w 300 µl oraz 100 µl medium DMEM/F12+2%FBS. 9. Przenieść do probówek typu Eppendorf po 50 µl frakcji CD45+ oraz CD45-. Dodać po 100 µl buforu lizującego zawierającego 1% Bond Breaker. Zworteksować. Homogenizować przy użyciu strzykawki 1 ml z igłą. Przechowywać w -80 o C. (materiał na Ćw. 3) µl zawiesiny CD45- przenieść do nowej probówki cytometrycznej. Dodać 450 µl DPBS oraz 500 µl 4% roztworu p-formaldehydu. Utrwalać 15 min. w RT. Dodać 2 ml DPBS. Probówkę z komórkami zwirować (1800 rpm., 7 min., RT). Zlać nadsącz, natomiast pelet rozpipetować w 0,5 ml DPBS. Przechowywać w lodówce. (materiał na Ćw. 2) P. IV. Izolacja frakcji KM hematopoetycznych (HSC) - Sortowanie FACS : 1. Do dwóch probówek cytometrycznych dodawać po 100 µl DMEM/F12 + 2% FBS. 2. Komórki CD45+ (po izolacji MACS) wybarwić immunofluorescencyjnie przeciwciałami wymienionymi w tabeli, zgodnie z poniższym schematem: Nazwa Rodzaj Przeciwciało znakowane fluorescencyjnie Próbki CD45+ CD Panel markerów linii hematopoetycznych (Lin): PE Rat antimouse Ly-6G and Ly-6C; PE Rat anti- mouse CC11b; PE Rat anti- mouse CD45R/B220; PE Rat anti- mouse Ter-119; PE Hamster anti- mouse γδ T- Cell Receptor; PE Hamster anti- mouse TCR β Chain) po 1,5 µl każdego = 9 µl/ próbkę 2. PE/Cy5 anti- mouse Ly-6A/E (Sca-1) = 6 µl/ próbkę 3. FITC Rat anti-mouse CD45 = 10 µl/ próbkę 6
7 CD45+/ CD45+ Próbka niebarwiona Empty Komp./ Szpik kostny po lizie Próbka niebarwiona Empty erytrocytów Komp./ PE Panel markerów linii hematopoetycznych Lin = 2 µl Komp./ PE/Cy5 anti- mouse Ly-6A/E (Sca-1) = 2 µl PE-Cy5 Komp./ FITC FITC Rat anti-mouse CD45 = 2 µl 3. Barwić 20 min., na lodzie, bez dostępu światła. 4. Po zakończeniu barwienia do każdej probówki dodawać po 2 ml DPBS (bez Mg 2+, Ca 2+ ). 5. Probówki z komórkami zwirować (1800 rpm., 7 min., RT). 6. Odciągnąć nadsącz, pelet zawiesić w 400µl DMEM/F12 + 2% FBS, rozpipetować. 7. Wysortować komórki HSC (CD45+/Lin-/Sca-1+) przy użyciu sortera BD FACS Aria III. Zakres materiału, który należy przygotować do ćwiczeń: 1. Zasada działania cytometru przepływowego. 2. Immunobarwienie w celu ich analizy w mikroskopii fluorescencyjnej i cytometrii przepływowej. 3. Cechy charakterystyczne macierzystych. Zalecana literatura: 1. Analysis/Flow-Cytometry/Flow-Cytometry-Technical-Resources.html?icid=fr-flow-4 2. Lin KK, Goodell MA. Detection of hematopoietic stem cells by flow cytometry. Methods Cell Biol. 2011;103: Ratajczak MZ, Zuba-Surma EK, Machalinski B, Kucia M. Bone-marrow-derived stem cells--our key to longevity? J Appl Genet. 2007;48(4): Zuba-Surma EK, Ratajczak MZ. Analytical capabilities of the ImageStream cytometer. Methods Cell Biol. 2011;102:
Komórki macierzyste zastosowania w biotechnologii i medycynie BT Metody identyfikacji i fenotypowania populacji komórek macierzystych
 Metody identyfikacji i fenotypowania populacji komórek macierzystych 1 Wstęp Szpik kostny zawiera hematopoetyczne (HSC) oraz niehematopoetyczne komórki macierzyste (KM). Do niehematopoetycznych KM należą:
Metody identyfikacji i fenotypowania populacji komórek macierzystych 1 Wstęp Szpik kostny zawiera hematopoetyczne (HSC) oraz niehematopoetyczne komórki macierzyste (KM). Do niehematopoetycznych KM należą:
Izolacja komórek szpiku kostnego w celu identyfikacji wybranych populacji komórek macierzystych technikami cytometrycznymi
 Izolacja komórek szpiku kostnego w celu identyfikacji wybranych populacji komórek macierzystych technikami cytometrycznymi PRAKTIKUM Z BIOLOGII KOMÓRKI DLA BIOLOGÓW (BT 216) TEMAT ĆWICZENIA: "Izolacja
Izolacja komórek szpiku kostnego w celu identyfikacji wybranych populacji komórek macierzystych technikami cytometrycznymi PRAKTIKUM Z BIOLOGII KOMÓRKI DLA BIOLOGÓW (BT 216) TEMAT ĆWICZENIA: "Izolacja
Immunologia komórkowa
 Immunologia komórkowa ocena immunofenotypu komórek Mariusz Kaczmarek Immunofenotyp Definicja I Charakterystyczny zbiór antygenów stanowiących elementy różnych struktur komórki, związany z jej różnicowaniem,
Immunologia komórkowa ocena immunofenotypu komórek Mariusz Kaczmarek Immunofenotyp Definicja I Charakterystyczny zbiór antygenów stanowiących elementy różnych struktur komórki, związany z jej różnicowaniem,
Separacja komórek w gradiencie gęstości PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 231)
 Separacja komórek w gradiencie gęstości PRAKTIKUM Z BIOLOGII KOMÓRKI () Separacja komórek Separacja komórek w gradiencie gęstości W wielu dziedzinach nauk przyrodniczych istnieje potrzeba stosowania określonej
Separacja komórek w gradiencie gęstości PRAKTIKUM Z BIOLOGII KOMÓRKI () Separacja komórek Separacja komórek w gradiencie gęstości W wielu dziedzinach nauk przyrodniczych istnieje potrzeba stosowania określonej
Technika hodowli komórek leukemicznych
 Fizjologiczne Techniki Badań Technika hodowli komórek leukemicznych Zasady prowadzenia hodowli komórek leukemicznych, pasażowania, mrożenia, rozmrażania i przechowywania komórek leukemicznych Warunki wstępne:
Fizjologiczne Techniki Badań Technika hodowli komórek leukemicznych Zasady prowadzenia hodowli komórek leukemicznych, pasażowania, mrożenia, rozmrażania i przechowywania komórek leukemicznych Warunki wstępne:
Analiza dystrybucji komórek nowotworowych w cyklu życiowym z wykorzystaniem cytometrii przepływowej
 Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Biologia komórki nowotworowej: Ćwiczenie A Analiza dystrybucji komórek nowotworowych w cyklu życiowym z wykorzystaniem cytometrii
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Biologia komórki nowotworowej: Ćwiczenie A Analiza dystrybucji komórek nowotworowych w cyklu życiowym z wykorzystaniem cytometrii
Wprowadzenie do cytometrii przepływowej: metody znakowania komórek
 Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: metody znakowania komórek Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl Przygotowanie
Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: metody znakowania komórek Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl Przygotowanie
fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 Sierpień 2018
 Sierpień 2018 fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 EURx Ltd. 80-297 Gdansk Poland ul. Przyrodnikow 3, NIP 957-07-05-191 KRS
Sierpień 2018 fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 EURx Ltd. 80-297 Gdansk Poland ul. Przyrodnikow 3, NIP 957-07-05-191 KRS
Novabeads Food DNA Kit
 Novabeads Food DNA Kit Novabeads Food DNA Kit jest nowej generacji narzędziem w technikach biologii molekularnej, umożliwiającym izolację DNA z produktów spożywczych wysoko przetworzonych. Metoda oparta
Novabeads Food DNA Kit Novabeads Food DNA Kit jest nowej generacji narzędziem w technikach biologii molekularnej, umożliwiającym izolację DNA z produktów spożywczych wysoko przetworzonych. Metoda oparta
Zakład Biologii Molekularnej, Wydział Farmaceutyczny, WUM.
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zakład Biologii Molekularnej, Wydział Farmaceutyczny, WUM.
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Ćwiczenie 3 Izolacja i rozdział
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Ćwiczenie 3 Izolacja i rozdział
BIOLOGIA KOMÓRKI BANKOWANIE KOMÓREK
 BIOLOGIA KOMÓRKI BANKOWANIE KOMÓREK WSTĘP Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta
BIOLOGIA KOMÓRKI BANKOWANIE KOMÓREK WSTĘP Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Wprowadzenie do cytometrii przepływowej: co i jak mierzy cytometr
 Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: co i jak mierzy cytometr Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl FLOW = fluid
Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: co i jak mierzy cytometr Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl FLOW = fluid
Wprowadzenie do cytometrii przepływowej: metody znakowania komórek
 Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: metody znakowania komórek Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl Przygotowanie
Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: metody znakowania komórek Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl Przygotowanie
Wprowadzenie do cytometrii przepływowej: co i jak mierzy cytometr
 Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: co i jak mierzy cytometr Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl FLOW = fluid
Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: co i jak mierzy cytometr Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl FLOW = fluid
BIOLOGIA KOMÓRKI. Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli wewnątrzkomórkowych
 BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
Wprowadzenie do cytometrii przepływowej: co i jak mierzy cytometr
 Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: co i jak mierzy cytometr Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl FLOW = fluid
Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: co i jak mierzy cytometr Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl FLOW = fluid
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii. Biologia komórki nowotworowej: Ćwiczenie B
 Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Biologia komórki nowotworowej: Ćwiczenie B Badanie zmian w budowie błony cytoplazmatycznej komórek wybranych linii nowotworowych
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Biologia komórki nowotworowej: Ćwiczenie B Badanie zmian w budowie błony cytoplazmatycznej komórek wybranych linii nowotworowych
Zestaw do wykrywania Chlamydia trachomatis w moczu lub w kulturach komórkowych
 Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN
 ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
Wprowadzenie do cytometrii przepływowej: metody znakowania komórek
 Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: metody znakowania komórek Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl Przygotowanie
Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: metody znakowania komórek Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl Przygotowanie
Sysmex Partec. Cytometria Przepływowa Poznań Szymon Pięta Specjalista ds. Produktu
 Sysmex Partec Cytometria Przepływowa 2016.04.28 Poznań Szymon Pięta Specjalista ds. Produktu Agenda 01 02 03 04 Sysmex Corporation Sysmex Partec Cytometria przepływowa Produkty 05 Przykładowe zastosowania
Sysmex Partec Cytometria Przepływowa 2016.04.28 Poznań Szymon Pięta Specjalista ds. Produktu Agenda 01 02 03 04 Sysmex Corporation Sysmex Partec Cytometria przepływowa Produkty 05 Przykładowe zastosowania
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej
 Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Odczynnik do izolacji RNA z tkanek zwierzęcych, roślinnych oraz linii komórkowych
 Nr kat.: EM30-100, EM30-200 Wersja zestawu: 1.2015 Odczynnik do izolacji RNA z tkanek zwierzęcych, roślinnych oraz linii komórkowych EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. I. PRZEZNACZENIE
Nr kat.: EM30-100, EM30-200 Wersja zestawu: 1.2015 Odczynnik do izolacji RNA z tkanek zwierzęcych, roślinnych oraz linii komórkowych EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. I. PRZEZNACZENIE
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016 Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa farmacjamolekularna@wum.edu.pl
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016 Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa farmacjamolekularna@wum.edu.pl
Uniwersalny zestaw do izolacji DNA (GeDI)
 Wersja zestawu 1.0 Listopad 2017 Uniwersalny zestaw do izolacji DNA (GeDI) Uniwersalny odczynnik do izolacji całkowitego DNA (GeDI) w zestawie z kolumienkami krzemionkowymi oraz buforami pozwalającymi
Wersja zestawu 1.0 Listopad 2017 Uniwersalny zestaw do izolacji DNA (GeDI) Uniwersalny odczynnik do izolacji całkowitego DNA (GeDI) w zestawie z kolumienkami krzemionkowymi oraz buforami pozwalającymi
Politechnika Gdańska Gdańsk, dnia r. Wydział Chemiczny
 Politechnika Gdańska Gdańsk, dnia 25.07.2013r. Wydział Chemiczny ZMIANA TREŚCI SPECYFIKACJI ISTOTNYCH WARUNKÓW ZAMÓWIENIA DO POSTĘPOWANIA ZP/ 301/008/D/13 Dotyczy: postępowania prowadzonego w trybie przetargu
Politechnika Gdańska Gdańsk, dnia 25.07.2013r. Wydział Chemiczny ZMIANA TREŚCI SPECYFIKACJI ISTOTNYCH WARUNKÓW ZAMÓWIENIA DO POSTĘPOWANIA ZP/ 301/008/D/13 Dotyczy: postępowania prowadzonego w trybie przetargu
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 106)
 Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 106) Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 106) Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych
PODSTAWY BIOLOGII KOMÓRKI. Bankowanie komórek i ocena ich żywotności
 PODSTAWY BIOLOGII KOMÓRKI Wstęp Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta jest szczególnie
PODSTAWY BIOLOGII KOMÓRKI Wstęp Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta jest szczególnie
BIOLOGIA KOMÓRKI. Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli wewnątrzkomórkowych
 BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna.
 Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
PODSTAWY BIOLOGII KOMÓRKI. Bankowanie komórek i ocena ich żywotności
 PODSTAWY BIOLOGII KOMÓRKI Wstęp Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta jest szczególnie
PODSTAWY BIOLOGII KOMÓRKI Wstęp Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta jest szczególnie
StayRNA bufor zabezpieczający RNA przed degradacją wersja 0215
 StayRNA bufor zabezpieczający RNA przed degradacją wersja 0215 100 ml, 250 ml, 500 ml Nr kat. 038-100, 038-250, 038-500 Nietosyczny roztwór wodny do przechowywania i zabezpieczania różnego rodzaju tkanek
StayRNA bufor zabezpieczający RNA przed degradacją wersja 0215 100 ml, 250 ml, 500 ml Nr kat. 038-100, 038-250, 038-500 Nietosyczny roztwór wodny do przechowywania i zabezpieczania różnego rodzaju tkanek
Zestaw do izolacji genomowego DNA z drożdży
 Nr kat. EM10 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z drożdży EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.blirt.eu 2 Nr kat. EM10 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM10 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z drożdży EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.blirt.eu 2 Nr kat. EM10 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 206, BT 231)
 Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI () Metody immunocytochemiczne... Metody immunocytochemiczne. Barwienie fluorescencyjne
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI () Metody immunocytochemiczne... Metody immunocytochemiczne. Barwienie fluorescencyjne
Zliczanie pod mikroskopem
 Część VII: Zliczanie komórek MATERIAŁY POMOCNICZE DO WYKŁADÓW Z PODSTAW BIOFIZYKI IIIr. Biotechnologii prof. dr hab. inż. Jan Mazerski ZLICZANIE KOMÓREK Wyznaczenie gęstości zawiesiny komórek jest kluczowym
Część VII: Zliczanie komórek MATERIAŁY POMOCNICZE DO WYKŁADÓW Z PODSTAW BIOFIZYKI IIIr. Biotechnologii prof. dr hab. inż. Jan Mazerski ZLICZANIE KOMÓREK Wyznaczenie gęstości zawiesiny komórek jest kluczowym
BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK
 BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO-FAZOWYM;
BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO-FAZOWYM;
Zestaw do izolacji genomowego DNA z bakterii
 Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Regionalne Centrum Naukowo- Technologiczne. Op. 50szt.
 1 Regionalne Centrum Naukowo- Technologiczne Podzamcze 45 26-060 Chęciny tel. (41) 343 40 50 faks (41) 307 44 76 www.rcnt.pl sekretariat@rcnt.pl Załącznik nr 9 do SIWZ dot.: postępowania o udzielenie zamówienia
1 Regionalne Centrum Naukowo- Technologiczne Podzamcze 45 26-060 Chęciny tel. (41) 343 40 50 faks (41) 307 44 76 www.rcnt.pl sekretariat@rcnt.pl Załącznik nr 9 do SIWZ dot.: postępowania o udzielenie zamówienia
Zestaw do izolacji genomowego DNA z drożdży
 Nr kat. EM10 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z drożdży EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.blirt.eu 2 Nr kat. EM10 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM10 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z drożdży EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.blirt.eu 2 Nr kat. EM10 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
BIOLOGIA KOMÓRKI. Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych
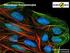 BIOLOGIA KOMÓRKI Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo dużej liczby procesów biochemicznych
BIOLOGIA KOMÓRKI Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo dużej liczby procesów biochemicznych
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA)
 Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
Zestaw do izolacji genomowego DNA z bakterii
 Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Ćwiczenie 5 Klonowanie DNA w wektorach plazmidowych
 Ćwiczenie 5 Klonowanie DNA w wektorach plazmidowych Celem ćwiczenia jest sklonowanie fragmentu DNA (powielonego techniką PCR i wyizolowanego z żelu agarozowego na poprzednich zajęciach) do wektora plazmidowego
Ćwiczenie 5 Klonowanie DNA w wektorach plazmidowych Celem ćwiczenia jest sklonowanie fragmentu DNA (powielonego techniką PCR i wyizolowanego z żelu agarozowego na poprzednich zajęciach) do wektora plazmidowego
E.coli Transformer Kit
 E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
Instrukcja ćwiczeń Biologia molekularna dla II roku Analityki Medycznej. Reakcja odwrotnej transkrypcji. Projektowanie starterów do reakcji PCR.
 INSTRUKCJA Ćwiczenie nr 5 Odczynniki: Sprzęt: 1. 5xNG cdna Buffer 2. 50 µm oligo(dt)20 3. NG dart RT mix l 4. Probówki typu Eppendorf 0,2 ml 5. Woda wolna od RNaz 6. Lód 1. Miniwirówka 2. Termocykler 3.
INSTRUKCJA Ćwiczenie nr 5 Odczynniki: Sprzęt: 1. 5xNG cdna Buffer 2. 50 µm oligo(dt)20 3. NG dart RT mix l 4. Probówki typu Eppendorf 0,2 ml 5. Woda wolna od RNaz 6. Lód 1. Miniwirówka 2. Termocykler 3.
Izolowanie DNA i RNA z komórek hodowlanych. Ocena jakości uzyskanego materiału
 II ROK KIERUNEK WETERYNARIA UJCM INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH VIII Izolowanie DNA i RNA z komórek hodowlanych. Ocena jakości uzyskanego materiału 2013/2014 2 ĆWICZENIE VIII Preparatyka całkowitego
II ROK KIERUNEK WETERYNARIA UJCM INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH VIII Izolowanie DNA i RNA z komórek hodowlanych. Ocena jakości uzyskanego materiału 2013/2014 2 ĆWICZENIE VIII Preparatyka całkowitego
Do identyfikacji i wyliczania komórek CD34+ w próbkach mobilizowanej krwi ludzkiej i próbkach z leukaferezy.
 CD34Count Kit Nr kat. K2370 Wydanie 2. Do identyfikacji i wyliczania komórek CD34+ w próbkach mobilizowanej krwi ludzkiej i próbkach z leukaferezy. Zestaw zawiera odczynniki wystarczające do wykonania
CD34Count Kit Nr kat. K2370 Wydanie 2. Do identyfikacji i wyliczania komórek CD34+ w próbkach mobilizowanej krwi ludzkiej i próbkach z leukaferezy. Zestaw zawiera odczynniki wystarczające do wykonania
CytoCount Nr kat. S 2366 Wydanie z
 CytoCount Nr kat. S 2366 Wydanie z 03.12.03 Przeznaczenie Wstęp Do badań diagnostycznych in vitro. Produkt CytoCount jest przeznaczony do stosowania w cytometrii przepływowej. CytoCount stanowi zawiesinę
CytoCount Nr kat. S 2366 Wydanie z 03.12.03 Przeznaczenie Wstęp Do badań diagnostycznych in vitro. Produkt CytoCount jest przeznaczony do stosowania w cytometrii przepływowej. CytoCount stanowi zawiesinę
Zestaw przeznaczony jest do całkowitej izolacji RNA z bakterii, drożdży, hodowli komórkowych, tkanek oraz krwi świeżej (nie mrożonej).
 Total RNA Mini Plus Zestaw do izolacji całkowitego RNA. Procedura izolacji nie wymaga użycia chloroformu wersja 0517 25 izolacji, 100 izolacji Nr kat. 036-25, 036-100 Zestaw przeznaczony jest do całkowitej
Total RNA Mini Plus Zestaw do izolacji całkowitego RNA. Procedura izolacji nie wymaga użycia chloroformu wersja 0517 25 izolacji, 100 izolacji Nr kat. 036-25, 036-100 Zestaw przeznaczony jest do całkowitej
Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Inżynieria bioprocesowa na kierunku biotechnologia
 1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Inżynieria bioprocesowa na kierunku biotechnologia 2 Zakład Mikrobiologii UJK Zakres materiału
1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Inżynieria bioprocesowa na kierunku biotechnologia 2 Zakład Mikrobiologii UJK Zakres materiału
Zakład Radiobiologii i Immunologii UJK
 1 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Zakład Radiobiologii i Immunologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Biotechnologia
1 Zakład Mikrobiologii i Zakład Radiobiologii i Immunologii UJK Zakład Radiobiologii i Immunologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Biotechnologia
Genomic Mini AX Plant Spin
 Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
Dotyczy zamówienia publicznego ogłoszonego w trybie przetargu nieograniczonego pod nazwą: Dostawa systemów do pozyskiwania osocza bogatopłytkowego
 Piekary Śląskie 28.12.2016 r. Samodzielny Publiczny Wojewódzki Szpital Chirurgii Urazowej im. Dr. Janusza Daaba w Piekarach Śląskich ul. Bytomska 62 41-940 Piekary Śląskie Sekcja d/s zamówień publicznych
Piekary Śląskie 28.12.2016 r. Samodzielny Publiczny Wojewódzki Szpital Chirurgii Urazowej im. Dr. Janusza Daaba w Piekarach Śląskich ul. Bytomska 62 41-940 Piekary Śląskie Sekcja d/s zamówień publicznych
Metody badania ekspresji genów
 Metody badania ekspresji genów dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Metody badania ekspresji genów zamieszczonym w skrypcie pod reakcją A. Lityńskiej i M. Lewandowskiego
Metody badania ekspresji genów dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Metody badania ekspresji genów zamieszczonym w skrypcie pod reakcją A. Lityńskiej i M. Lewandowskiego
Unikalne cechy płytek i szalek IBIDI
 Unikalne cechy płytek i szalek IBIDI Grubość płytki jest kluczowym aspektem jakości obrazowania. Typowa grubość szkiełek nakrywkowych wynosi 0,17 mm (170 µm). Większość obiektywów stosowanych do mikroskopii
Unikalne cechy płytek i szalek IBIDI Grubość płytki jest kluczowym aspektem jakości obrazowania. Typowa grubość szkiełek nakrywkowych wynosi 0,17 mm (170 µm). Większość obiektywów stosowanych do mikroskopii
Wprowadzenie do cytometrii przepływowej: wybór fluorochromów i zasady projektowania doświadczeń
 Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: wybór fluorochromów i zasady projektowania doświadczeń Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl
Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: wybór fluorochromów i zasady projektowania doświadczeń Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl
Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, Warszawa. Zakład Biologii Molekularnej
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa 1 Ćwiczenie 1 Izolacja oraz
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa 1 Ćwiczenie 1 Izolacja oraz
Genomic Mini AX Bacteria+ Spin
 Genomic Mini AX Bacteria+ Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z bakterii Gram-dodatnich. wersja 1017 100 izolacji Nr kat. 060-100MS Pojemność kolumny do oczyszczania DNA wynosi
Genomic Mini AX Bacteria+ Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z bakterii Gram-dodatnich. wersja 1017 100 izolacji Nr kat. 060-100MS Pojemność kolumny do oczyszczania DNA wynosi
Laboratorium Wirusologiczne
 Laboratorium Wirusologiczne Krzysztof Pyrd Pracownia wirusologiczna: Powstanie i wyposażenie całkowicie nowego laboratorium w ramach Zakładu Mikrobiologii WBBiB Profil: laboratorium molekularno-komórkowe
Laboratorium Wirusologiczne Krzysztof Pyrd Pracownia wirusologiczna: Powstanie i wyposażenie całkowicie nowego laboratorium w ramach Zakładu Mikrobiologii WBBiB Profil: laboratorium molekularno-komórkowe
WYPOSAŻENIE LABORATORIÓW CENTRUM NOWYCH TECHNOLOGII UW W APARATURĘ NIEZBĘDNĄ DO PROWADZENIA BADAŃ NA RZECZ PRZEMYSŁU I MEDYCYNY
 WYPOSAŻENIE LABORATORIÓW CENTRUM NOWYCH TECHNOLOGII UW W APARATURĘ NIEZBĘDNĄ DO PROWADZENIA BADAŃ NA RZECZ PRZEMYSŁU I MEDYCYNY PROJEKT REALIZOWANY W RAMACH REGIONALNEGO PROGRAMU OPERACYJNEGO WOJEWÓDZTWA
WYPOSAŻENIE LABORATORIÓW CENTRUM NOWYCH TECHNOLOGII UW W APARATURĘ NIEZBĘDNĄ DO PROWADZENIA BADAŃ NA RZECZ PRZEMYSŁU I MEDYCYNY PROJEKT REALIZOWANY W RAMACH REGIONALNEGO PROGRAMU OPERACYJNEGO WOJEWÓDZTWA
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Spółka z o.o. UCZESTNICY WARSZTATÓW: Lekarze rezydenci i specjaliści, technicy w pracowniach diagnostycznych i histopatologicznych
 e-mail: kawaska@kawaska.pl WARSZTATY: TECHNIKI MIKROSKOPOWE I INFORMATYCZNE W BADANIU PRÓBEK BIOLOGICZNYCH, CZ. 1 Objęte patronatem Polskiego Towarzystwa Patologów pod przewodnictwem Prezes Zarządu Głównego
e-mail: kawaska@kawaska.pl WARSZTATY: TECHNIKI MIKROSKOPOWE I INFORMATYCZNE W BADANIU PRÓBEK BIOLOGICZNYCH, CZ. 1 Objęte patronatem Polskiego Towarzystwa Patologów pod przewodnictwem Prezes Zarządu Głównego
Kemilew Komórki Macierzyste Iwona Kemilew PROCEDURA
 Kemilew Komórki Macierzyste Iwona Kemilew F01 do PR-1/2017 PROCEDURA OGŁOSZENIE DOTYCZY: OGŁOSZENIE O PRZETARGU F-01 przetargu, o którym mowa w art. 70 1-70 5 ustawy z dnia 23 kwietnia 1964 r. Kodeks Cywilny
Kemilew Komórki Macierzyste Iwona Kemilew F01 do PR-1/2017 PROCEDURA OGŁOSZENIE DOTYCZY: OGŁOSZENIE O PRZETARGU F-01 przetargu, o którym mowa w art. 70 1-70 5 ustawy z dnia 23 kwietnia 1964 r. Kodeks Cywilny
Zakup i dostawa odczynników do analiz cytometrycznych wraz z dzierżawą aparatu do wykonywania analiz cytometrycznych.
 Załącznik nr 9 do specyfikacji Zakup i dostawa odczynników do analiz cytometrycznych wraz z dzierżawą aparatu do wykonywania analiz cytometrycznych. CzęśćI: PAKIET 1 I. OPIS PARAMETROW TECNICZNYCH APARATU
Załącznik nr 9 do specyfikacji Zakup i dostawa odczynników do analiz cytometrycznych wraz z dzierżawą aparatu do wykonywania analiz cytometrycznych. CzęśćI: PAKIET 1 I. OPIS PARAMETROW TECNICZNYCH APARATU
TaqNova-RED. Polimeraza DNA RP20R, RP100R
 TaqNova-RED Polimeraza DNA RP20R, RP100R RP20R, RP100R TaqNova-RED Polimeraza DNA Rekombinowana termostabilna polimeraza DNA Taq zawierająca czerwony barwnik, izolowana z Thermus aquaticus, o przybliżonej
TaqNova-RED Polimeraza DNA RP20R, RP100R RP20R, RP100R TaqNova-RED Polimeraza DNA Rekombinowana termostabilna polimeraza DNA Taq zawierająca czerwony barwnik, izolowana z Thermus aquaticus, o przybliżonej
EKSTRAHOWANIE KWASÓW NUKLEINOWYCH JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI? JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI?
 EKSTRAHOWANIE KWASÓW NUKLEINOWYCH Wytrącanie etanolem Rozpuszczenie kwasu nukleinowego w fazie wodnej (met. fenol/chloroform) Wiązanie ze złożem krzemionkowym za pomocą substancji chaotropowych: jodek
EKSTRAHOWANIE KWASÓW NUKLEINOWYCH Wytrącanie etanolem Rozpuszczenie kwasu nukleinowego w fazie wodnej (met. fenol/chloroform) Wiązanie ze złożem krzemionkowym za pomocą substancji chaotropowych: jodek
Doktorantka: Żaneta Lewandowska
 Doktorantka: Żaneta Lewandowska Główny opiekun naukowy: Dr hab. Piotr Piszczek, prof. UMK Katedra Chemii Nieorganicznej i Koordynacyjnej, Wydział Chemii Dodatkowy opiekun naukowy: Prof. dr hab. Wiesław
Doktorantka: Żaneta Lewandowska Główny opiekun naukowy: Dr hab. Piotr Piszczek, prof. UMK Katedra Chemii Nieorganicznej i Koordynacyjnej, Wydział Chemii Dodatkowy opiekun naukowy: Prof. dr hab. Wiesław
ALGALTOXKIT F Procedura testu
 ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
Lp. tydzień wykłady seminaria ćwiczenia
 Lp. tydzień wykłady seminaria ćwiczenia 21.02. Wprowadzeniedozag adnieńzwiązanychzi mmunologią, krótka historiaimmunologii, rozwójukładuimmun ologicznego. 19.02. 20.02. Wprowadzenie do zagadnień z immunologii.
Lp. tydzień wykłady seminaria ćwiczenia 21.02. Wprowadzeniedozag adnieńzwiązanychzi mmunologią, krótka historiaimmunologii, rozwójukładuimmun ologicznego. 19.02. 20.02. Wprowadzenie do zagadnień z immunologii.
Total RNA Zol-Out. 25 izolacji, 100 izolacji
 Total RNA Zol-Out Zestaw do szybkiej izolacji ultraczystego, całkowitego RNA z odczynników opartych na mieszaninie fenolu oraz rodanku lub chlorowodorku guanidyny (TRIzol, TRI Reagent, RNAzol, QIAzol,
Total RNA Zol-Out Zestaw do szybkiej izolacji ultraczystego, całkowitego RNA z odczynników opartych na mieszaninie fenolu oraz rodanku lub chlorowodorku guanidyny (TRIzol, TRI Reagent, RNAzol, QIAzol,
Genomic Midi AX. 20 izolacji
 Genomic Midi AX Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura z precypitacją DNA. wersja 0517 20 izolacji Nr kat. 895-20 Pojemność kolumny do oczyszczania
Genomic Midi AX Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura z precypitacją DNA. wersja 0517 20 izolacji Nr kat. 895-20 Pojemność kolumny do oczyszczania
DEZINTEGRACJA ULTRADŹWIĘKOWA
 DEZINTEGRACJA ULTRADŹWIĘKOWA Ćwiczenie nr 4 Dezintegracja ultradźwiękowa Cel ćwiczenia: Celem ćwiczenia jest zbadanie wpływu ultradźwięków na komórki bakterii Bacillus substilis Wstęp Metody dezintegracji
DEZINTEGRACJA ULTRADŹWIĘKOWA Ćwiczenie nr 4 Dezintegracja ultradźwiękowa Cel ćwiczenia: Celem ćwiczenia jest zbadanie wpływu ultradźwięków na komórki bakterii Bacillus substilis Wstęp Metody dezintegracji
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli
 E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
Szczegółowa ocena nasienia
 Szczegółowa ocena nasienia Ricardo Faundez Zakład Rozrodu, Andrologii i Biotechnologii Rozrodu Zwierząt Katedra Chorób Dużych Zwierząt z Kliniką Wydział Medycyny Weterynaryjnej SGGW Ocena ruchu plemników
Szczegółowa ocena nasienia Ricardo Faundez Zakład Rozrodu, Andrologii i Biotechnologii Rozrodu Zwierząt Katedra Chorób Dużych Zwierząt z Kliniką Wydział Medycyny Weterynaryjnej SGGW Ocena ruchu plemników
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: MOLEKULARNE PODSTAWY BIOTECHNOLOGII
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa ĆWICZENIE 1 IZOLACJA raav Z KOMÓREK PAKUJĄCYCH AAV293
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa ĆWICZENIE 1 IZOLACJA raav Z KOMÓREK PAKUJĄCYCH AAV293
HODOWLA PERIODYCZNA DROBNOUSTROJÓW
 Cel ćwiczenia: Celem ćwiczenia jest porównanie zdolności rozkładu fenolu lub wybranej jego pochodnej przez szczepy Stenotrophomonas maltophilia KB2 i Pseudomonas sp. CF600 w trakcie prowadzenia hodowli
Cel ćwiczenia: Celem ćwiczenia jest porównanie zdolności rozkładu fenolu lub wybranej jego pochodnej przez szczepy Stenotrophomonas maltophilia KB2 i Pseudomonas sp. CF600 w trakcie prowadzenia hodowli
ĆWICZENIE 5 Barwniki roślinne. Ekstrakcja barwników asymilacyjnych. Rozpuszczalność chlorofilu
 ĆWICZENIE 5 Barwniki roślinne Ekstrakcja barwników asymilacyjnych 400 mg - zhomogenizowany w ciekłym azocie proszek z natki pietruszki 6 ml - etanol 96% 2x probówki plastikowe typu Falcon na 15 ml 5x probówki
ĆWICZENIE 5 Barwniki roślinne Ekstrakcja barwników asymilacyjnych 400 mg - zhomogenizowany w ciekłym azocie proszek z natki pietruszki 6 ml - etanol 96% 2x probówki plastikowe typu Falcon na 15 ml 5x probówki
MATERIAŁY SZKOLENIOWE DLA ZAKŁADÓW HIGIENY WETERYNARYJNEJ W ZAKRESIE LABORATORYJNEJ DIAGNOSTYKI AFRYKAŃSKIEGO POMORU ŚWIŃ
 MATERIAŁY SZKOLENIOWE DLA ZAKŁADÓW HIGIENY WETERYNARYJNEJ W ZAKRESIE LABORATORYJNEJ DIAGNOSTYKI AFRYKAŃSKIEGO POMORU ŚWIŃ Puławy 2013 Opracowanie: Prof. dr hab. Iwona Markowska-Daniel, mgr inż. Kinga Urbaniak,
MATERIAŁY SZKOLENIOWE DLA ZAKŁADÓW HIGIENY WETERYNARYJNEJ W ZAKRESIE LABORATORYJNEJ DIAGNOSTYKI AFRYKAŃSKIEGO POMORU ŚWIŃ Puławy 2013 Opracowanie: Prof. dr hab. Iwona Markowska-Daniel, mgr inż. Kinga Urbaniak,
Krwiotworzenie (Hematopoeza)
 Krwiotworzenie (Hematopoeza) Zgadnienia Rozwój układu krwiotwórczego Szpik kostny jako główny narząd krwiotwórczy Metody badania szpiku Krwiotwórcze komórki macierzyste (KKM) Regulacja krwiotworzenia Przeszczepianie
Krwiotworzenie (Hematopoeza) Zgadnienia Rozwój układu krwiotwórczego Szpik kostny jako główny narząd krwiotwórczy Metody badania szpiku Krwiotwórcze komórki macierzyste (KKM) Regulacja krwiotworzenia Przeszczepianie
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI? JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI?
 Podstawowe miary masy i objętości stosowane przy oznaczaniu ilości kwasów nukleinowych : 1g (1) 1l (1) 1mg (1g x 10-3 ) 1ml (1l x 10-3 ) 1μg (1g x 10-6 ) 1μl (1l x 10-6 ) 1ng (1g x 10-9 ) 1pg (1g x 10-12
Podstawowe miary masy i objętości stosowane przy oznaczaniu ilości kwasów nukleinowych : 1g (1) 1l (1) 1mg (1g x 10-3 ) 1ml (1l x 10-3 ) 1μg (1g x 10-6 ) 1μl (1l x 10-6 ) 1ng (1g x 10-9 ) 1pg (1g x 10-12
STANDARDOWE OZNACZANIE IMMUNOFENOTYPU KOMÓREK BIAŁACZKOWYCH W ROZPOZNAWANIU I MONITOROWANIU OSTREJ BIAŁACZKI SZPIKOWEJ (OBS)
 Nowiny Lekarskie 2008, 77, 4, 273 279 JOANNA KOPEĆ-SZLĘZAK, JOLANTA WOŹNIAK STANDARDOWE OZNACZANIE IMMUNOFENOTYPU KOMÓREK BIAŁACZKOWYCH W ROZPOZNAWANIU I MONITOROWANIU OSTREJ BIAŁACZKI SZPIKOWEJ (OBS)
Nowiny Lekarskie 2008, 77, 4, 273 279 JOANNA KOPEĆ-SZLĘZAK, JOLANTA WOŹNIAK STANDARDOWE OZNACZANIE IMMUNOFENOTYPU KOMÓREK BIAŁACZKOWYCH W ROZPOZNAWANIU I MONITOROWANIU OSTREJ BIAŁACZKI SZPIKOWEJ (OBS)
Mikroskopia konfokalna: techniki obrazowania i komputerowa analiza danych.
 Mikroskopia konfokalna: techniki obrazowania i komputerowa analiza danych. Pracownia Mikroskopii Konfokalnej Instytut Biologii Doświadczalnej PAN Jarosław Korczyński, Artur Wolny Spis treści: Co w konfokalu
Mikroskopia konfokalna: techniki obrazowania i komputerowa analiza danych. Pracownia Mikroskopii Konfokalnej Instytut Biologii Doświadczalnej PAN Jarosław Korczyński, Artur Wolny Spis treści: Co w konfokalu
Sherlock AX. 25 izolacji, 100 izolacji
 Sherlock AX Zestaw do izolacji genomowego DNA z materiałów o jego śladowej zawartości (plamy krwi, nasienia i śliny, włosy i sierść, tkanki zakonserwowane w parafinie i formalinie, tkanki świeże, krew
Sherlock AX Zestaw do izolacji genomowego DNA z materiałów o jego śladowej zawartości (plamy krwi, nasienia i śliny, włosy i sierść, tkanki zakonserwowane w parafinie i formalinie, tkanki świeże, krew
SKUTECZNOŚĆ IZOLACJI JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI? JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI?
 SKUTECZNOŚĆ IZOLACJI Wydajność izolacji- ilość otrzymanego kwasu nukleinowego Efektywność izolacji- jakość otrzymanego kwasu nukleinowego w stosunku do ilości Powtarzalność izolacji- zoptymalizowanie procedury
SKUTECZNOŚĆ IZOLACJI Wydajność izolacji- ilość otrzymanego kwasu nukleinowego Efektywność izolacji- jakość otrzymanego kwasu nukleinowego w stosunku do ilości Powtarzalność izolacji- zoptymalizowanie procedury
Zestaw do oczyszczania DNA po reakcjach enzymatycznych
 Cat. No. EM07.1 Wersja: 1.2017 NOWA WERSJA Zestaw do oczyszczania DNA po reakcjach enzymatycznych EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM07.1 I. PRZEZNACZENIE
Cat. No. EM07.1 Wersja: 1.2017 NOWA WERSJA Zestaw do oczyszczania DNA po reakcjach enzymatycznych EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM07.1 I. PRZEZNACZENIE
Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 206, BT 231)
 Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej PRAKTIKUM Z BIOLOGII KOMÓRKI () Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej Immunocytochemia zajmuje się wykrywaniem
Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej PRAKTIKUM Z BIOLOGII KOMÓRKI () Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej Immunocytochemia zajmuje się wykrywaniem
Stanowisko do badania zjawiska tłumienia światła w ośrodkach materialnych
 Stanowisko do badania zjawiska tłumienia światła w ośrodkach materialnych Na rys. 3.1 przedstawiono widok wykorzystywanego w ćwiczeniu stanowiska pomiarowego do badania zjawiska tłumienia światła w ośrodkach
Stanowisko do badania zjawiska tłumienia światła w ośrodkach materialnych Na rys. 3.1 przedstawiono widok wykorzystywanego w ćwiczeniu stanowiska pomiarowego do badania zjawiska tłumienia światła w ośrodkach
Oznaczenie polimorfizmu genetycznego cytochromu CYP2D6: wykrywanie liczby kopii genu
 Ćwiczenie 4 Oznaczenie polimorfizmu genetycznego cytochromu CYP2D6: wykrywanie liczby kopii genu Wstęp CYP2D6 kodowany przez gen występujący w co najmniej w 78 allelicznych formach związanych ze zmniejszoną
Ćwiczenie 4 Oznaczenie polimorfizmu genetycznego cytochromu CYP2D6: wykrywanie liczby kopii genu Wstęp CYP2D6 kodowany przez gen występujący w co najmniej w 78 allelicznych formach związanych ze zmniejszoną
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI. Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
Genomic Mini AX Milk Spin
 Genomic Mini AX Milk Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z próbek mleka. wersja 1017 100 izolacji Nr kat. 059-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg. Produkt
Genomic Mini AX Milk Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z próbek mleka. wersja 1017 100 izolacji Nr kat. 059-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg. Produkt
Do jednego litra medium dodać 10,0 g skrobi ziemniaczanej lub kukurydzianej i mieszać do uzyskania zawiesiny. Sterylizować w autoklawie.
 Ćwiczenie 3. Izolacja laseczek przetrwalnikujących z gleby Cel ćwiczenia: Izolacja i testowanie przydatności biotechnologicznej laseczek z rodzaju Bacillus występujących w glebie. Odczynniki i podłoża:
Ćwiczenie 3. Izolacja laseczek przetrwalnikujących z gleby Cel ćwiczenia: Izolacja i testowanie przydatności biotechnologicznej laseczek z rodzaju Bacillus występujących w glebie. Odczynniki i podłoża:
SYLABUS. Techniki mikroskopowe. Wydział Biologiczno-Rolniczy. Katedra Biochemii i Biologii Komórki. dr Renata Zadrąg-Tęcza
 SYLABUS 1.1. PODSTAWOWE INFORMACJE O PRZEDMIOCIE/MODULE Nazwa przedmiotu/ modułu Kod przedmiotu/ modułu* Wydział (nazwa jednostki prowadzącej kierunek) Nazwa jednostki realizującej przedmiot Kierunek studiów
SYLABUS 1.1. PODSTAWOWE INFORMACJE O PRZEDMIOCIE/MODULE Nazwa przedmiotu/ modułu Kod przedmiotu/ modułu* Wydział (nazwa jednostki prowadzącej kierunek) Nazwa jednostki realizującej przedmiot Kierunek studiów
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika
 PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
ĆWICZENIE 3 DGGE- ELEKTROFOREZA W ŻELU Z GRADIENTEM CZYNNIKA DENATURUJĄCEGO
 ĆWICZENIE 3 DGGE- ELEKTROFOREZA W ŻELU Z GRADIENTEM CZYNNIKA DENATURUJĄCEGO CZĘŚĆ TEORETYCZNA Metody badań i cechy w oparciu o które przeprowadzana jest klasyfikacja i identyfikacja mikroorganizmówh Struktura
ĆWICZENIE 3 DGGE- ELEKTROFOREZA W ŻELU Z GRADIENTEM CZYNNIKA DENATURUJĄCEGO CZĘŚĆ TEORETYCZNA Metody badań i cechy w oparciu o które przeprowadzana jest klasyfikacja i identyfikacja mikroorganizmówh Struktura
Siemianowice Śląskie: OGŁOSZENIE O ZMIANIE OGŁOSZENIA
 1 z 9 Ogłoszenie nr 540170119-N-2019 z dnia 14-08-2019 r. Siemianowice Śląskie: OGŁOSZENIE O ZMIANIE OGŁOSZENIA OGŁOSZENIE DOTYCZY: Ogłoszenia o zamówieniu INFORMACJE O ZMIENIANYM OGŁOSZENIU Numer: 584228-N-2019
1 z 9 Ogłoszenie nr 540170119-N-2019 z dnia 14-08-2019 r. Siemianowice Śląskie: OGŁOSZENIE O ZMIANIE OGŁOSZENIA OGŁOSZENIE DOTYCZY: Ogłoszenia o zamówieniu INFORMACJE O ZMIENIANYM OGŁOSZENIU Numer: 584228-N-2019
FORMULARZ OFERTY POSTĘPOWANIE O UDZIELENIE ZAMÓWIENIA PUBLICZNEGO ZAPYTANIE OFERTOWE NR 3/2016
 Strona1 Załącznik nr do zapytania ofertowego nr /201 miejscowość, data Nazwa oferenta Adres oferenta NIP/Krajowy numer identyfikacyjny REGON* KRS** Adres e -mail Nr tel.: * Dotyczy tylko polskich podmiotów
Strona1 Załącznik nr do zapytania ofertowego nr /201 miejscowość, data Nazwa oferenta Adres oferenta NIP/Krajowy numer identyfikacyjny REGON* KRS** Adres e -mail Nr tel.: * Dotyczy tylko polskich podmiotów
