ĆWICZENIE NR 72B (Teoria)
|
|
|
- Renata Szymańska
- 6 lat temu
- Przeglądów:
Transkrypt
1 * ĆWICZENIE NR 7B (Teoria) N. Mirowska WYZNACZANIE STAŁEJ RYDBERGA I MASY ZREDUKOWANEJ ELEKTRONU ZA POMOCĄ SPEKTROSKOPU Cel ćwiczeia: pozaie zasady działaia spektroskopu oraz metody wyzaczaia stałej Rydberga i zredukowaej masy elektrou. Zagadieia: widma optycze, serie widmowe wodoru, model atomu Bohra, fale de Broglie a, poziomy eergetycze atomu, atomy wodoropodobe. (zob. też ćwiczeia: 7, p.7.1 i, p..1). 7B.1. WPROWADZENIE Substacje pobudzoe do świeceia wysyłają (emitują) charakterystycze dla siebie promieiowaie elektromagetycze, które zawiera w sobie ogromą ilość iformacji o atomach tej substacji. Aby tę iformację uzyskać, ależy wiązkę promieiowaia rozłożyć (rozszczepić p. w pryzmacie) w widmo (spektrum), a astępie przeaalizować w im zależość zmia atężeia promieiowaia od długości fali λ lub od częstości ν. Widma promieiowaia, obejmujące umowy zakres długości fal od ultrafioletu UV (λ m = 5m) do dalekiej podczerwiei IR (λ 3 10 m = m), azywae są widmami optyczymi. Z zakresu widm optyczych wyłączoe jest, ze względu a odmieą aturę, promieiowaie X o długości fal poiżej 10m. Wąski zakres promieiowaia elekromagetyczego (umowie m) rejestroway przez oko ludzkie azywamy światłem. Aby substację, w szczególości atomy substacji, pobudzić do świeceia, ależy jej przekazać odpowiedią ilość eergii. Może to się odbywać kosztem p. pochłoięcia promieiowaia elektromagetyczego przez atom. Promieiowaie elektromagetycze, zgodie z kocepcją M. Placka ( ) rozszerzoą późiej przez A. Eisteia ( ), rozprzestrzeia się, jest pochłaiae (absorbowae) oraz wysyłae (emitowae) w postaci kwatów (miimalych porcji eergii) zwaych też fotoami. Eergia E przypisaa pojedyczemu kwatowi jest proporcjoala do częstotliwości promieiowaia ν: E = hν, gdzie h = 6, [kg m s -1 ] jest stałą, zaą jako stała Placka. Oddziaływaie promieiowaia elektromagetyczego z materią (absorpcja, emisja światła) sprowadza się zatem do oddziaływaia fotoów z cząstkami budującymi tę materię. Cząstka materii w elemetarym akcie absorpcji fotou uzyskuje całą jego eergię hν stając się tzw. cząstką wzbudzoą. W elemetarym akcie emisji wzbudzoa cząstka materii uwalia admiar eergii tj. wypromieiowuje foto o eergii hν. Aby zdać sobie sprawę z wielkości kwatu, obliczmy jego eergię z zależości E = hν. Dla światła czerwoego otrzymujemy 1,8 ev, dla zieloego,5 ev a dla światła 1
2 iebieskiego 3 ev. Są to eergie wystarczające do pobudzeia atomu czy erwu w siatkówce oka. Oko ludzkie jest tak czułe, że reaguje a pojedyczy kwat światła. Gdy patrzymy a zapaloą świecę, do aszego oka wpada około kwatów światła widzialego a sekudę. Gdy robimy zdjęcie, a kliszę fotograficzą pada około 10 1 kwatów ale już około 10 kwatów światła iebieskiego pozostawia a iej ślad. Przechodząc do promieiowaia podczerwoego (cieplego) i jeszcze iżej do fal radiowych stwierdzamy, że kwaty eergii tego promieiowaia są coraz miejsze i trudiej je mierzyć bezpośredio. Skutki ich pojawieia się są atomiast mierzale mogą a przykład spowodować ruch obrotowy cząsteczki lub jej drgaia a w efekcie rozgrzaie ciała. Poza fioletową częścią widma widzialego mamy kwaty o dużej eergii: adfiolet o eergii kilkuastu ev, promieie Roetgea rzędu ev i więcej, promieie γ rzędu milioów ev. Absorpcja wysokoeergetyczego, awet pojedyczego, kwatu może wpłyąć a jądro atomowe, a gey w żywej komórce lub awet zabić taką komórkę. Badaie widm ujawiło licze prawidłowości, których iterpretacja pozwoliła a wyciągięcie daleko idących wiosków o strukturze atomu. Te zakres zagadień jest przedmiotem badań spektroskopii atomowej. W zależości od rodzaju substacji, widma emisyje dzielą się a: liiowe gdy promieiowaie wysyłae jest przez atomy lub joy swobode (gaz jedoatomowy lub para pod iskim ciśieiem), pasmowe gdy promieiują cząsteczki lub ich joy, ciągłe gdy odpowiedziale za widmo są układy skodesowae (kryształy, ciecze, ciała bezpostaciowe, gazy pod bardzo wysokim ciśieiem), zajdujące się w odpowiedio wysokiej temperaturze. Widma emisyje z zakresu długości fal świetlych są postrzegae jako barwe. Emisyje widmo liiowe obserwujemy jako kolorowe liie a czarym tle, węższe lub szersze wielobarwe pasma a czarym tle to widmo pasmowe. Barwy w obrębie poszczególych pasm przechodzą jeda w drugą bez wyraźych graic. Podobie jest w widmie ciągłym z tą różicą, że w widmie ciągłym ie występują obszary czare. Procesem odwrotym do emisji światła jest jego absorpcja (pochłaiaie). Jeżeli wiązkę promieiowaia ciągłego przepuścimy przez warstwę substacji pochłaiającej światło, to uzyskamy charakterystycze dla iej widmo absorpcyje. Widma absorpcyje dzielą się (w zależości od rodzaju substacji) także a liiowe, pasmowe i ciągłe i są obserwowae a tle barwego widma ciągłego jako miej lub bardziej cieme pola odpowiadające zaabsorbowaym długościom fal. Długości fal λ w widmie absorpcyjym i emisyjym tej samej substacji pokrywają się. Skoro każdy pierwiastek (substacja) emituje (lub absorbuje) charakterystycze dla siebie widmo to może o być idetyfikoway a podstawie emitowaego (absorbowaego) światła. Badaie widm optyczych (aaliza spektrala, aaliza widmowa) jest stosukowo prostą i szybką metodą badaia składu substacji i, co ważiejsze, a ogół bardzo czułą. Przykładowo moża podać, że a drodze aalizy spektralej daje się stwierdzić w iezaej próbce materiału obecość p. 1/50 000mg Ca, 1/ mg Na. Z tego względu aaliza spektrala zalazła bardzo szerokie zastosowaie w wielu gałęziach auki i techiki, takich jak: fizyka, chemia, biologia, astrofizyka, metalurgia, ochroa środowiska i wiele iych. Aaliza widmowa przyczyiła się rówież do odkrycia wielu owych, iezaych przedtem pierwiastków. Właśie w te sposób odkryto prawie wszystkie pierwiastki ziem rzadkich, większość gazów szlachetych, a także pierwiastki występujące w skorupie ziemskiej w bardzo małych ilościach (p. id, gal). Optycze widma liiowe pierwiastków ależących do pierwszych trzech grup układu okresowego wykazują wyraźą prawidłowość; poszczególe liie układają się w ciągi staowiące tzw. serie widmowe. Liie serii widmowych zagęszczają się w miarę wzrostu
3 częstości i skupiają się przy graicy serii (graiczej długości fali λ gr ). Prawidłowość tę ajłatwiej było wykryć w widmie atomowego wodoru, który jako ajprostszy atom ma ajprostsze widmo. Widmo liiowe wodoru (rys.7b.1) zawiera w części widzialej pięć liii: H α (czerwoa), H β (iebieska), H γ, H δ i H ε (trzy fioletowe), których atężeie maleje wraz z długością fali λ. Trzy ajbardziej itesywe liie (H α, H β i H γ ) są szczególie dogode do obserwacji. k =3 = =5 =6 =7 IR λ [m] 656,31 86,13 3,05 10, , 01 UV H a H b H g H d H e Rys. 7B.1. Schematycza ilustracja widma wodoru seria Balmera. J. Balmer, szwajcarski fizyk, podał w 1885 r. empiryczy wzór określający długości fal odpowiedich liii w całym wówczas zaym widmie wodoru (1 liii obserwowaych m.i. w widmie iektórych gwiazd). Postać tego wzoru jest astępująca: λ = 36,56 [m] - gdzie: = 3,, 5,... W latach późiejszych adao temu wzorowi ią postać: =RH - λ Ł ł 3 (7B.1) Wielkość R H = 1, [ m -1 ] osi azwę stałej Rydberga dla wodoru, wielkość 1/λ jest to tzw. liczba falowa (ozaczaa rówież symbolem k), która określa ile długości fal mieści się a odciku 1m. Późiejsze badaia widm wodoru pozwoliły wykryć szereg iych serii zajdujących się w części iewidzialej widma promieiowaia, tj. w ultrafiolecie i podczerwiei. Szwedzki fizyk żyjący w latach , J. R. Rydberg, prowadząc badaia ad systematyką widm atomowych wykazał (1890 r.), że liczba falowa każdej liii w dowolej serii widma wodoru daje się przedstawić ogólym wzorem: k 1/λ = R H 1 k p 1 (7B.) gdzie p i k są liczbami całkowitymi, przy czym dla daej serii widmowej p = cost, a k = p + 1, p +, p + 3,, charakteryzując w te sposób poszczególe liie tej serii (rys.7b.). Na przykład ajwiększą długość fali λ max, występującą w daej serii o ustaloej początkowej liczbie p, możemy obliczyć dla k = p + 1, a miimalą długość fali λ gr dla końcowej liczby k. Łatwo też sprawdzić, że dla p = i k = 3,, 5,... wzór Rydberga
4 (7B.) przechodzi we wzór Balmera (7B.1a). Z tego względu, rówaie 7B. azywae jest często wzorem Balmera Rydberga. Obecie zaych jest sześć serii widmowych wodoru, z których każda osi azwę swego odkrywcy (patrz tabela 7B.1). W tabeli podao charakterystycze dla każdej serii długości fal, λ max i λ gr, wyliczoe a podstawie wzoru 7B.1b. Rys. 7 B.Schemat poziomów eergetyczych w atomie wodoru. Liczba kwatowa ozacza umer poziomu eergetyczego.ze względu a zagęszczaie się poziomów eergetyczych wraz ze wzrostem liczby ie uwidoczioo wszystkich serii widmowych oraz poziomów dla > 6.
5 Tabela 7B.1. Serie widmowe atomu wodoru. p. seria k rok odkrycia l max [m] l gr [m] 1 Lymaa,3,, ,50 91,13 Balmera 3,,5, ,11 36,51 3 Paschea,5,6, ,61 80,1 Bracketta 5,6,7, ,08 158,03 5 Pfuda 6,7,8, ,8 78,17 6 Humphreysa 7,8,9, ,19 380,56 Widać, że każda seria widmowa (grupa liii) ma właściwą sobie wartość liczby p, i że poszczególe serie rozpoczyają się od coraz dłuższej fali. Ujęcie teoretycze. Żeby zrozumieć, dlaczego widmo liiowe ma właśie takie uporządkowaie, trzeba zająć się atomową strukturą materii. W tym celu stworzoo wiele modeli budowy atomu. Jedym z ważiejszych był model zapropooway w roku 1913 przez młodego duńskiego fizyka N. Bohra ( ). W modelu tym elektroy krążą wokół ciężkiego i ieruchomego jądra po orbitach, czyli w sposób podoby do tego, w jaki plaety krążą wokół Słońca. Podstawowym i owatorskim założeiem przyjętym przez Bohra było, że momet pędu elektrou ( orbitaly momet pędu elektrou L = p r = mυ r, gdzie p jest pędem elektrou a tej orbicie o promieiu r ) przybiera wartości dae wzorem: h L= lub mυ r =h (7B.3) π gdzie: = 1,, 3,..., h = 6, [kg m s -1 ] - stała Placka, h = h =1, [kg m s -1 ], π m = 9, [kg] masa elektrou, υ prędkość elektrou a tej orbicie. Widać, że momet pędu dla ruchu elektrou po kołowej orbicie jest całkowitą wielokrotością stałej h, czyli że może zmieiać się tylko skokowo. W te sposób zostało wprowadzoe tzw. kwatowaie mometu pędu, tj. przypisaie mu dyskretych wartości. W fizyce klasyczej momet pędu może przyjmować dowole wartości jego wartości mogą zmieiać się w sposób ciągły. Z rówaia (7B.3) wyika, że jest możliwe wyzaczeie m.i. promieia - tej orbity, prędkości i eergii elektrou a orbicie. Oczywiście wartości tych wielkości będą zmieiały się rówież skokowo będą 5
6 skwatowae. Wyliczoy rozmiar pierwszej orbity ( = 1) w iewzbudzoym atomie wodoru, czyli promień tzw. pierwszej orbity bohrowskiej (często ozaczaej symbolem a H ) wyosi 5, [m] i jest zgody z daymi eksperymetalymi, co jest iezaprzeczalym sukcesem teorii Bohra. Teoria Bohra, dziś azywaa starą teorią kwatów, była pierwszą teorią usiłującą zdać sprawę ze zjawisk kwatowych zachodzących w atomie. Krytykowaa była główie za iekosekwecje opisu zjawisk, w którym pojęcia klasycze przeplatały się z kwatowymi. Późiej została oa zastąpioa bardziej kosekwetą teorią, jaką jest mechaika kwatowa. Nowsze badaia pokazały, że w zastosowaiu do mikrocząstek (m.i. elektroów, protoów, jąder atomowych) w ogóle ie mają sesu pojęcia określoego położeia i toru. Także zwyczaja kulka awet bardzo mała (makroskopowa) ie może być uważaa za pierwowzór mikrocząstki. Wraz ze zmiejszaiem się wymiarów zaczyają ujawiać się owe, ie obserwowae w przypadku makrocząstek, właściwości trude do wyjaśieia a grucie fizyki klasyczej. Prawa fizyki klasyczej, w szczególości mechaiki klasyczej, przestały mieć zastosowaia do cząstek lekkich (mikrocząstek), a więc i do zjawisk wewątrzatomowych. Wszystkie mikrocząstki posiadają osobliwe właściwości, które w sposób spójy wyjaśieia mechaika kwatowa. Fracuski fizyk, Louis de Broglie (czyt. broj), doszedł do wiosku (19 r.), że jeżeli światło ma dwoistą aturę, działając jak fala, a iym razem jak cząstki (korpuskuły), wobec tego jest prawdopodobe, że rzeczywiste cząstki też mają taką dwoistą aturę aturę korpuskularo falową. Zapropoował, aby cząstkom materialym przypisać własości falowe, używając do tego reguły kwatowej E = hν = λ hc, czyli takiej samej jak dla fotou. Zobaczmy jak reguła ta łączy ze sobą własości fal i własości cząstek w przypadku kwatów światła czyli iepodzielych porcji eergii. Ze wzoru Eisteia, E = m f c, mamy powiązaie masy fotou poruszającego się z prędkością światła c z jego eergią E. Porówując te dwie zależości otrzymamy wyrażeia a masę m f oraz pęd p fotou: p = m f c = m f = hν c hν hν = c λν = λ h (7B.) Po przekształceiach uzyskamy związek długość fali λ z eergią E i pędem p fotou: h hc h λ = = = (7B.5) p E m c Na podstawie tej zależości widać, że cechy korpuskulare fotou ( m f i c ) wiążą się bezpośredio z jego cechą falową ( λ ). Ruch elektrou wg de Broglie a (lub iej mikrocząstki) związay jest z procesem falowym podobie jak ruch fotou. A więc każdy mikroobiekt (atom, elektro, foto, itp.) staowi twór szczególego rodzaju, łączący w sobie własości zarówo fali jak i cząstki. Długość fali odpowiadająca cząstce o masie m poruszającej się z prędkością υ < c jest rówa h h λ = = (7B.6) p mυ 6 f
7 Jest to rówaie de Broglie a, w którym m jest masą spoczykową cząstki materialej (masą cząstki ieruchomej). Fale opisae tym rówaiem ie są falami elektromagetyczymi, ale falami zupełie owego rodzaju. Nazwao je falami de Broglie a lub falami materii i reprezetują oe cząstki w ujęciu kwatowym. Prędkość i masa (typowe parametry dla cząstek) odoszą się do obrazu korpuskularego υ E mikrocząstki, atomiast długość fali lub częstotliwość promieiowaia ν = = to pojęcia λ h czysto falowe. W wersji uściśloej powia w rówaiu de Broglie a występować masa relatywistycza m r (masa cząstki poruszającej się), a ie spoczykowa. Efekty relatywistycze są zauważale przy bardzo dużych prędkościach i objawiają się m.i. wzrostem masy. Z rówaia (7B.6) widać, że jeśli masa cząstek jest duża to fale materii są krótkie (małe λ) i typowe efekty falowe, takie jak iterferecja i dyfrakcja, ie są zauważale. Możemy też zauważyć (wzór 7B.), że fotoy albo poruszają się z prędkością światła c, albo ie istieją ich pęd i eergia są rówe zeru, gdy c = 0. Zerową prędkość osiągają fotoy jedyie w chwili całkowitej absorpcji, kiedy oddają całą swoją eergię ciału pochłaiającemu. Mówimy wtedy, że uległy oe aihilacji (uicestwieiu). Fotoy są zatem odmiee od cząstek materialych, które mogą i muszą mieć prędkość miejszą od c. Hipoteza de Broglie a spowodowała, że ściśle określoe orbity ustąpiły miejsca matematyczemu opisowi fal. Nie wchodząc w szczegóły tego opisu ozacza to, że ie moża przypisać elektroowi dokładego położeia w jakiejś chwili. Możemy tylko stwierdzić, że prawdopodobieństwo zalezieia elektrou w pewym elemecie przestrzei w pewej chwili jest większe lub miejsze. To prawdopodobieństwo związae jest z kwadratem amplitudy fali, która aturalie jest fukcją miejsca i czasu. Im fala w daym obszarze posiada większą amplitudę, tym większe jest prawdopodobieństwo, że zajduje się tam elektro. Z kolei częstotliwość fali wyzacza określoe stay eergetycze elektrou związaego z jądrem czyli tym samym stay eergetycze całego atomu. Elektro może zmieiać swój sta eergetyczy (swoją eergię) ie w sposób ciągły, lecz tylko skokowo. Ozacza to, że stay eergetycze atomu są skwatowae. Kolejym staom eergetyczym przypisaa jest liczba porządkowa = 1,, 3,..., zwaą główą liczbą kwatową. Tylko tak umerowae stay są dla elektrou eergetyczie dozwoloe, a jeśli ich eergia ie zależy rówież od czasu to są trwałe i wtedy oszą azwę staów stacjoarych. Nieciągłe (skwatowae) stay eergetycze, zwae rówież ieciągłymi poziomami eergii, moża przedstawić graficzie w postaci poziomych liii leżących jeda ad drugą. Tak więc częstotliwości fal wyzaczają dozwoloe stay eergetycze elektrou związaego w atomie, a amplituda fal prawdopodobieństwo, że elektro zajduje się a daym poziomie eergetyczym. Stąd zaś moża przewidzieć częstotliwości ν liii widmowych oraz ich jasość zależą od amplitudy fali. Obliczoe prawdopodobieństwa zalezieia elektrou w pewym obszarze daego atomu zgadzają się z wyikami doświadczalymi. Istieie dyskretych poziomów eergetyczych atomu zostało potwierdzoe za pomocą doświadczeń przeprowadzoych w 191r. przez J. Fracka i G. Hertza. Współcześie przyjmuje się, że cała eergia wewętrza atomu jest skwatowaa tz. zmieia się w sposób dyskrety (skokowy). Eergia wewętrza atomu jest to całkowita eergia jądra i elektroów poruszających się dookoła wspólego środka ciężkości. Najprościej widać to w odosobioym atomie. Przyjmuje się, że jeśli elektro zajduje się z dala od jądra i pozostaje w spoczyku to całkowita eergia rówa jest zeru zerowy poziom eergetyczy. Taka umowa sprawia, że skwatowae wartości eergii atomu są ujeme. Najiższy ze stacjoarych staów eergetyczych E = E 1 azywamy staem 7
8 ormalym lub podstawowym i leży o ajdalej od poziomu zerowego. Stay wyższe, umerowae liczbą kwatową =,3,,..., są zwae staami wzbudzoymi. Eergia potrzeba do usuięcia elektrou z atomu zajdującego się w staie ormalym ( = 1) do puktu ieskończeie dalekiego ( = ), w którym elektro jest ieruchomy (ie działają a iego już żade siły), azywamy eergią joizacji. Obszar, w którym ie działają żade siły jest próżią, a więc proces przeiesieia elektrou z poziomu E 1 do próżi ( E = 0 ) azywamy joizacją atomu. Eergię potrzebą do przeiesieia elektrou z określoego stau stacjoarego E do ieskończoości azywamy eergią joizacji i jest oa rówa eergii wiązaia tego stau. Eergię staów stacjoarych atomu wodoru, czyli całkowitą eergię elektrou przebywającego w tym staie eergetyczym, wyzaczyć moża a podstawie wzoru: gdzie: E = 0 me (7B.7) h = 1,, 3,..., główa liczba kwatowa, h = 6, [kg m s -1 ] stała Placka, e = 1, [C] ładuek elektrou, m = 9, [kg] masa elektrou, ε 0 = 8, [Fm -1 ] przeikalość elektrycza próżi. Jedyą zmieą w tym rówaiu jest liczba kwatowa = 1,,3,...,. Podstawiając = 1, otrzymujemy E 1 =, [ J ] = 13,61 [ev]. Jest to wartość eergii wiązaia elektrou przebywającego w staie podstawowym E 1 atomu wodoru. Eergie wiązaia elektrou zajdującego się w wyższych staach eergetyczych (większa wartość liczby ) wyzacza się a podstawie prostej zależości: 18, ,61 E = [] J = [ ev] (7B.8) Łatwo moża policzyć, że eergia wiązaia elektrou p. w staie eergetyczym E 3 jest miejsza i wyosi 1,51 [ev]. Wzbudzoemu elektroowi wystarczy więc odpowiedio miejsza porcja eergii, aby mógł oderwać się od atomu. Schemat poziomów eergetyczych w atomie wodoru oraz cztery jego emisyje serie widmowe przedstawioo a rys. 7B.. Należy zwrócić uwagę, że wraz ze wzrostem liczby kwatowej umerującej poziomy, odległość między imi szybko maleje ( E ~ 1/ ). Pomiędzy poziomem = 6 a = zagęszczaie się poziomów jest już bardzo duże. Ozacza to, że w tym obszarze zajduje się ieskończeie wielka liczba kwatowo dozwoloych staów eergetyczych. Poziomy eergetycze i odległości między imi są róże dla różych pierwiastków chemiczych, lecz są idetycze dla wszystkich atomów tego samego pierwiastka. Dla tej samej zmiay eergii E, będącej różicą eergii między staem początkowym p i staem końcowym k, zawsze jest taka sama zmiaa częstości promieiowaia. Jeśli duża liczba atomów (układ fizyczy) absorbuje lub emituje promieiowaie elektromagetycze to elektroy w każdym atomie wykoują skoki/przejścia kwatowe: od E do E w procesie absorpcji oraz od E k do E p w procesie emisji światła. Wiązka światła będzie się składać z pewej liczby kwatów, z których każdy będzie miał eergię hν. Eergia wiązki może zatem być rówa hν lub hν lub 3 hν, itd., czyli iymi słowy może składać 8 p k
9 się z 1,, 3, itd. kwatów. W dalszych rozważaiach ograiczymy się do procesów jedokwatowych, a więc dla pojedyczego atomu możliwą zmiaę eergii zapiszemy astępująco: E = E E = E E = hν (7B.9) p k gdzie: p - główa liczba kwatowa początkowego stacjoarego stau eergetyczego, k - główa liczba kwatowa końcowego stacjoarego stau eergetyczego. Towarzyszące tej zmiaie eergii promieiowaie rozprzestrzeia się w postaci jedobarwej (moochromatyczej) fali o długości λ. Jak wiadomo, częstotliwość ν i długość fali λ rozchodzącej się w próżi wiąże zależość ν = c/λ, gdzie c =, [ms -1 ] jest prędkością światła w próżi. Na tej podstawie możemy zapisać: k p lub ν = 1 λ = E E k k E h E hc p p E = E = p p E h E hc k k, (7B.10a). (7B.10b) Wielkość 1/λ = ν/c jest zaą am już liczbą falową k. Podstawiając eergię wyrażoą rówaiem (7B.7) do rówaia (7B.10a) uzyskamy wzór a częstotliwość ν promieiowaia elektromagetyczego p. emitowaego przez atom wodoru. Po prostych przekształceiach otrzymujemy: me ν 1 1 = (7B.11) 3 0 h p k Wyrażeie a liczbę falową przyjmie teraz postać: 1 ν me 1 1 k = = = (7B.1) λ c 3 0 h c p k Stały czyik w rówaiu (7B.1), zależy wyłączie od fudametalych stałych fizyczych, osi azwę stałej Rydberga: me 7 R H = = 1, [m -1 ] (7B.13) 3 0 h c Korzystając z rówaia (7B.13) możemy zapisać liczbę falową, częstotliwość i eergię elektrou w staie w astępujący sposób: 1 1 k = R H, (7B.1a) p k 1 1 ν = R H c, (7B.1b) p k 9
10 E me hc me hc = - = - = - 3 ε0 h hc 0 h c hc RH. (7B.1c) 8 Zauważmy, że jeśli p = 1 (sta podstawowy atomu wodoru) zaś k (atom zjoizoway), to k R H. Wyika stąd, że stała Rydberga wyraża w liczbach falowych eergię wiązaia elektrou w staie podstawowym atomu wodoru. Stała Rydberga opatrzoa ideksem H ozacza stałą dla atomu o liczbie atomowej Z=1, tz. dla jądra o ładuku (+Ze)=(+1e) i elektrou o ładuku (-e), czyli dla atomu wodoru. Gdybyśmy rozważali tzw. atomy wodoropodobe z jądrem o ładuku (+Ze) i jedym elektroem (p. joy He +1, Li +, B +, O +7 ), to powyższe wzory przybrałyby postać: Z me 1 1 k = 3 0 h c p 1 1 = Z RH, (7B.15a) k p k Z me 1 1 = ν 1 1 = Z R 3 H c, (7B.15b) 0 h p k p k Z me 1 hc E = - = - Z R H. (7B.15c) 0 h Łatwo zauważyć, że ze wzrostem liczby atomowej Z astępuje przesuięcie widma w kieruku fal krótszych (ν Z, a λ 1/Z ). Zależość stałej Rydberga od masy jądra. We wszystkich dotychczasowych rozważaiach zakładaliśmy, że jądro atomowe jest ieruchome, a więc prawie cała eergia kietycza atomu związaa jest z ruchem elektrou. Założeie takie było możliwe dzięki temu, że masa protou jest poad 1836 razy większa od masy elektrou. W rzeczywistości jądro ie jest ieruchome i w ścisłych obliczeiach ależy te fakt uwzględić. W tym celu rozpatruje się osobo ruch środka masy układu elektro jądro atomowe i ruch każdej z cząstek wokół wspólego środka ich masy. Przy braku sił zewętrzych ruch środka masy atomu podlega prawom Newtoa. Natomiast ruch dwóch ciał/cząstek względem ich środka masy wygodie jest sprowadzić do zagadieia ruchu jedej cząstki ale o masie rówej tzw. masie zredukowaej µ. Iymi słowy, ruch jedej cząstki zaiedbuje się, a drugiej cząstce przyporządkowuje się masę zredukowaą zamiast jej masy rzeczywistej. Dzięki temu ruch względy układu dwóch cząstek staje się rówoważy ruchowi jedej cząstki o masie µ określoej związkiem: mm m = + lub µ = = (7B.16) µ m M m + M m 1+ M Symbole M i m ozaczają masy rzeczywiste ciał/cząstek, p. M to masa jądra, a m to masa elektrou. Widać, że gdy M lub M >> m to µ m, czyli masa zredukowaa staje się porówywala z masą lżejszej cząstki. W przypadku atomów ajlżejszych, p. izotopów wodoru, masy jąder ie różią się tak drastyczie od masy elektrou, a więc iloraz m/m we wzorze (7B.16) ie jest do pomiięcia. Badaia widm wodoru wzbogacoego w izotop ciężki doprowadziły H.C. Ureya (193 r.) do odkrycia deuteru, którego masa jest tylko 10
11 około razy większa od izotopu lekkiego. Zaobserwowao wyraźe różice (około 10 m) w długościach fal odpowiedich liii widmowych pochodzących od każdego z izotopów. Różice te moża było przypisać właśie wpływowi różych wartości mas zredukowaych wodoru i deuteru. Wcześiejsze rówaia będą opisywały układ atomowy w sposób ścisły, jeśli masę elektrou m zastąpimy masą zredukowaą µ układu elektro-jądro. Uwzględieie ruchu jądra w obliczeiach pozwala precyzyjiej wyzaczyć liczby falowe k promieiowaia, a tym samym długości fal λ. Jeśli dla ieskończeie ciężkiego i ieruchomego jądra ozaczymy stałą Rydberga jako R (we wcześiejszych wzorach R H było właśie rówoważe R ) to dla jądra o masie M stałą Rydberga zapiszemy jako: µ e R R M = = (7B.17) 3 h c m 0 1+ M Jeśli w atomie wodoru uwzględimy ruch jądra, to otrzymamy miimalą wartość stałej Rydberga R M = 1, x 10 7 [m -1 ]. Najbardziej ogóla postać wzoru a liczbę falową promieiowaia to: 1 1 k = Z R M (7B.18) p k Obliczoe według wzoru (7B.18) długości fal (λ=1/k) pozostają w adzwyczaj dobrej zgodości z wartościami uzyskaymi doświadczalie. Zajomość stałej Rydberga dla jedego atomu wodoropodobego pozwala a obliczeie wartości R H dla dowolego atomu wodoropodobego lub dla różych izotopów tego samego pierwiastka, p. wodoru i deuteru. Z kolei, zajomość dokładej wartości stałej Rydberga różych pierwiastków oraz obserwacja widma pozwala a wykrycie obecości daego pierwiastka w substacji pobudzoej do świeceia lub absorbującej promieiowaie. Niezbęda jest do tego rówoczesa zajomość różicy liczb falowych (lub długości fal) dwóch liii spektralych, spowodowaej jedyie różicą mas. Różice w wartościach R M wyzaczoe w te sposób dla różych atomów są iewielkie, a ze wzrostem liczby atomowej Z wartości te szybko zbliżają się do R = [m -1 ]. 7B.. UKŁAD POMIAROWY W skład zestawu pomiarowego wchodzą: spektroskop dwuramiey, spektrala lampa wzorcowa (p. helowa) z zasilaczem, spektrala lampa wodorowa z zasilaczem oraz podstawka pod lampę. Lampę ustawiamy przed szczelią wejściową spektroskopu i prosimy prowadzącego o włączeie zasilacza. Czekamy chwilę aby lampa się rozgrzała. Przez okular spektroskopu (okular z itkami krzyża) obserwujemy obraz barwych liii widmowych (prążków), których położeie odczytujemy a poziomej skali z pokrętłem. Pokrętło to posiada 100 acięć, dzięki czemu dokładość odczytu wyosi 0,01działki. Kręcąc pokrętłem skali aprowadzamy pioowe ramię krzyża a poszczególe prążki widmowe. Szczegółowy opis przygotowaia zestawu pomiarowego do pracy zajduje się w istrukcji roboczej. 11
12 7B.3. ZADANIA DO WYKONANIA A) Pomiary. W doświadczeiu posługujemy się spektroskopem i wykoujemy takie same pomiary jak w ćwiczeiu 7A, a więc ustawiamy (justujemy) spektroskop dwuramiey, wyzaczamy przebieg krzywej dyspersji dla widma wzorcowego (p. rtęci) tj. skalujemy spektroskop, a astępie wyzaczamy długości poszczególych liii widma wodoru. Dla liii H α, H β i H γ obliczamy stałą Rydberga R H ze wzoru (7B.1) lub (7B.), a astępie wartość średią tej stałej. Masę zredukowaą μ elektrou w atomie wodoru wyzaczamy a podstawie wzoru (7B.17), w którym za R H podstawiamy wartość średią stałej Rydberga. Korzystając ze wzoru (7B.1c) obliczymy eergie odpowiadające poziomom eergetyczym atomu wodoru oraz odległości między tymi poziomami. Szczegółowy opis przebiegu pomiarów zajduje się w istrukcji roboczej. B) Opracowaie wyików. 1. Wykreślić krzywą skalowaia spektroskopu tj. zależość λ = ƒ(w), gdzie λ jest długością fali odpowiadającą każdej liii widma wzorcowego a w ozacza położeie tych liii a skali. Krzywa ta powia być gładka, a więc kreśloa staraie przy użyciu krzywika. Omówić wyik graficzy.. Dla każdego z puktów pomiarowych zazaczyć pola iepewości, przyjmując za dokładość długości fali Δλ wartość wskazaą przez prowadzącego. 3. Korzystając z krzywej skalowaia, przyporządkować położeiom x liii widmowych wodoru odpowiadające im długości fal λ, atomiast każdej iepewości położeia Δx - iepewości Δλ.. Dla każdej wartości λ obliczyć stałą Rydberga R H ze wzoru (7B.) lub (7B.1), a astępie, stosując metodę pochodej logarytmiczej, iepewość ΔR H. 5. Wyzaczyć wartość średią stałej R H oraz jej iepewość. 6. Wyzaczyć masę zredukowaą μ elektrou w atomie wodoru ( wzór 7B.17), biorąc do obliczeń wartość średią stałej R H. 7. Obliczyć iepewość Δμ metodą różiczki zupełej. 8. Obliczyć a podstawie wzoru (7B.1c) i średiej wartości stałej Rydberga eergie odpowiadające poziomom eergetyczym atomu wodoru, dla których obserwowao przejścia optycze. Wyzaczyć odległości eergetycze między tymi poziomami. Otrzymae wyiki omówić i aszkicować schemat eergetyczy poziomów zachowując wszelkie proporcje. C) Pytaia kotrole 1. Narysować bieg promiei w spektroskopie i omówić zasadę jego działaia(patrz ćwiczeie 7A).. Hipoteza de Broglie a i model atomu w ujęciu kwatowym. 3. Omówić rodzaje widm i podać waruki ich powstawaia.. Przedstawić serie widmowe wodoru. 5. Wyjaśić zaczeie stałej Rydberga i masy zredukowaej w aalizie widm atomowych. 1
13 Literatura [1] Poprawski R., Salejda W., Ćwiczeia laboratoryje z fizyki, cz. I, OWPWr., Wrocław [] Halliday D., Resick R., Fizyka, PWN, Warszawa 1996 [3] Ege H. A., Wehr M. R., Richards J. A., Wstęp do fizyki atomowej, PWN, Warszawa [] Meyer-Aredt J. R., Wstęp do optyki, PWN, Warszawa [5] Leś Z., Wstęp do spektroskopii atomowej, PWN, Warszawa 197 Kraków. 13
Model Bohra atomu wodoru
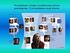
 Model Bohra atomu wodoru Widma liiowe pierwiastków. wodór hel eo tle węgiel azot sód Ŝelazo Aby odpowiedzieć a pytaie dlaczego wodór i ie pierwiastki ie emitują wszystkich częstotliwości fal elektromagetyczych
Model Bohra atomu wodoru Widma liiowe pierwiastków. wodór hel eo tle węgiel azot sód Ŝelazo Aby odpowiedzieć a pytaie dlaczego wodór i ie pierwiastki ie emitują wszystkich częstotliwości fal elektromagetyczych
Projekt Inżynier mechanik zawód z przyszłością współfinansowany ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego
 Zajęcia wyrówawcze z fizyki -Zestaw 5 -Teoria Optyka geometrycza i optyka falowa. Prawo odbicia i prawo załamaia światła, Bieg promiei świetlych w pryzmacie, soczewki i zwierciadła. Zjawisko dyfrakcji
Zajęcia wyrówawcze z fizyki -Zestaw 5 -Teoria Optyka geometrycza i optyka falowa. Prawo odbicia i prawo załamaia światła, Bieg promiei świetlych w pryzmacie, soczewki i zwierciadła. Zjawisko dyfrakcji
Wykład 19: Dr inż. Zbigniew Szklarski. Katedra Elektroniki, paw. C-1, pok
 Wykład 9: Atom Dr iż. Zbigiew Szklarski Katedra Elektroiki, paw. C-, pok.3 szkla@agh.edu.pl http://layer.uci.agh.edu.pl/z.szklarski/ Wczese modele atomu Grecki filozof Demokryt rozpoczął poszukiwaia opisu
Wykład 9: Atom Dr iż. Zbigiew Szklarski Katedra Elektroiki, paw. C-, pok.3 szkla@agh.edu.pl http://layer.uci.agh.edu.pl/z.szklarski/ Wczese modele atomu Grecki filozof Demokryt rozpoczął poszukiwaia opisu
Lekcja Efekt fotoelektryczny str
 Lekcja 18-19. Efekt fotoelektryczy str. 10-109 Nawiązaie do gimazjum Pojęcie fali, fali elektromagetyczej przykłady. Pojęcia opisujące fale (λ, ν, T, c) i związki między imi. Pojęcie prądu i wielkości
Lekcja 18-19. Efekt fotoelektryczy str. 10-109 Nawiązaie do gimazjum Pojęcie fali, fali elektromagetyczej przykłady. Pojęcia opisujące fale (λ, ν, T, c) i związki między imi. Pojęcie prądu i wielkości
PRZYKŁADY ROZWIAZAŃ STACJONARNEGO RÓWNANIA SCHRӦDINGERA. Ruch cząstki nieograniczony z klasycznego punktu widzenia. mamy do rozwiązania równanie 0,,
 PRZYKŁADY ROZWIAZAŃ STACJONARNEGO RÓWNANIA SCHRӦDINGERA Ruch cząstki ieograiczoy z klasyczego puktu widzeia W tym przypadku V = cost, przejmiemy V ( x ) = 0, cząstka porusza się wzdłuż osi x. Rozwiązujemy
PRZYKŁADY ROZWIAZAŃ STACJONARNEGO RÓWNANIA SCHRӦDINGERA Ruch cząstki ieograiczoy z klasyczego puktu widzeia W tym przypadku V = cost, przejmiemy V ( x ) = 0, cząstka porusza się wzdłuż osi x. Rozwiązujemy
ν = c/λ [s -1 = Hz] ν = [cm -1 ] ZASADY ZALICZENIA PRZEDMIOTU MBS c = m/s cos x H = H o E = E o cos x c = λν 1 ν = _ λ
![ν = c/λ [s -1 = Hz] ν = [cm -1 ] ZASADY ZALICZENIA PRZEDMIOTU MBS c = m/s cos x H = H o E = E o cos x c = λν 1 ν = _ λ ν = c/λ [s -1 = Hz] ν = [cm -1 ] ZASADY ZALICZENIA PRZEDMIOTU MBS c = m/s cos x H = H o E = E o cos x c = λν 1 ν = _ λ](/thumbs/91/105360049.jpg) ZASADY ZALICZENIA PRZEDMIOTU MBS LABORATORIUM Z MBS. ROZWIĄZYWANIE WIDM kolokwium NMR 23 kwietia 208 IR maja 208 złożoe czerwca 208 poiedziałek czwartek piątek 9.3 22.3 23.3 26.3 5. 6. 9. 2. 3. H NMR 23.
ZASADY ZALICZENIA PRZEDMIOTU MBS LABORATORIUM Z MBS. ROZWIĄZYWANIE WIDM kolokwium NMR 23 kwietia 208 IR maja 208 złożoe czerwca 208 poiedziałek czwartek piątek 9.3 22.3 23.3 26.3 5. 6. 9. 2. 3. H NMR 23.
BUDOWA I PROMIENIOWANIE ATOMÓW
 BUDOWA I PROMIENIOWANIE ATOMÓW FALE ELEKTROMAGNEYCZNE WIDMO FAL ELEKTROMAGNETYCZNYCH Teoria orpusulara foto hν E hν, p c hc E, E ~ stała Placa h 6,6 0-34 J s J 0,6 9 ev Prędość fal świetlych w próżi c
BUDOWA I PROMIENIOWANIE ATOMÓW FALE ELEKTROMAGNEYCZNE WIDMO FAL ELEKTROMAGNETYCZNYCH Teoria orpusulara foto hν E hν, p c hc E, E ~ stała Placa h 6,6 0-34 J s J 0,6 9 ev Prędość fal świetlych w próżi c
Metrologia: miary dokładności. dr inż. Paweł Zalewski Akademia Morska w Szczecinie
 Metrologia: miary dokładości dr iż. Paweł Zalewski Akademia Morska w Szczeciie Miary dokładości: Najczęściej rozkład pomiarów w serii wokół wartości średiej X jest rozkładem Gaussa: Prawdopodobieństwem,
Metrologia: miary dokładości dr iż. Paweł Zalewski Akademia Morska w Szczeciie Miary dokładości: Najczęściej rozkład pomiarów w serii wokół wartości średiej X jest rozkładem Gaussa: Prawdopodobieństwem,
Fundamentalna tabelka atomu. eureka! to odkryli. p R = nh -
 TEKST TRUDNY Postulat kwatowaia Bohra, czyli założoy ad hoc związek pomiędzy falą de Broglie a a geometryczymi własościami rozważaego problemu, pozwolił bez większych trudości teoretyczie przewidzieć rozmiary
TEKST TRUDNY Postulat kwatowaia Bohra, czyli założoy ad hoc związek pomiędzy falą de Broglie a a geometryczymi własościami rozważaego problemu, pozwolił bez większych trudości teoretyczie przewidzieć rozmiary
Wykład 18: Dr inż. Zbigniew Szklarski. Katedra Elektroniki, paw. C-1, pok
 Wykład 18: Atom Dr iż. Zbigiew Szklarski Katedra Elektroiki, paw. C-1, pok.31 szkla@agh.edu.pl http://layer.uci.agh.edu.pl/z.szklarski/ Wczese modele atomu Grecki filozof Demokryt rozpoczął poszukiwaia
Wykład 18: Atom Dr iż. Zbigiew Szklarski Katedra Elektroiki, paw. C-1, pok.31 szkla@agh.edu.pl http://layer.uci.agh.edu.pl/z.szklarski/ Wczese modele atomu Grecki filozof Demokryt rozpoczął poszukiwaia
INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH Z WYTRZYMAŁOŚCI MATERIAŁÓW
 INSTYTUT MASZYN I URZĄDZEŃ ENERGETYCZNYCH Politechika Śląska w Gliwicach INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH Z WYTRZYMAŁOŚCI MATERIAŁÓW BADANIE ODKSZTAŁCEŃ SPRĘŻYNY ŚRUBOWEJ Opracował: Dr iż. Grzegorz
INSTYTUT MASZYN I URZĄDZEŃ ENERGETYCZNYCH Politechika Śląska w Gliwicach INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH Z WYTRZYMAŁOŚCI MATERIAŁÓW BADANIE ODKSZTAŁCEŃ SPRĘŻYNY ŚRUBOWEJ Opracował: Dr iż. Grzegorz
VII MIĘDZYNARODOWA OLIMPIADA FIZYCZNA (1974). Zad. teoretyczne T3.
 KOOF Szczeci: www.of.szc.pl VII MIĘDZYNAODOWA OLIMPIADA FIZYCZNA (1974). Zad. teoretycze T3. Źródło: Komitet Główy Olimpiady Fizyczej; Olimpiada Fizycza XXIII XXIV, WSiP Warszawa 1977 Autor: Waldemar Gorzkowski
KOOF Szczeci: www.of.szc.pl VII MIĘDZYNAODOWA OLIMPIADA FIZYCZNA (1974). Zad. teoretycze T3. Źródło: Komitet Główy Olimpiady Fizyczej; Olimpiada Fizycza XXIII XXIV, WSiP Warszawa 1977 Autor: Waldemar Gorzkowski
Znajdowanie pozostałych pierwiastków liczby zespolonej, gdy znany jest jeden pierwiastek
 Zajdowaie pozostałych pierwiastków liczby zespoloej, gdy zay jest jede pierwiastek 1 Wprowadzeie Okazuje się, że gdy zamy jede z pierwiastków stopia z liczby zespoloej z, to pozostałe pierwiastki możemy
Zajdowaie pozostałych pierwiastków liczby zespoloej, gdy zay jest jede pierwiastek 1 Wprowadzeie Okazuje się, że gdy zamy jede z pierwiastków stopia z liczby zespoloej z, to pozostałe pierwiastki możemy
u t 1 v u(x,t) - odkształcenie, v - prędkość rozchodzenia się odkształceń (charakterystyczna dla danego ośrodka) Drgania sieci krystalicznej FONONY
 Drgaia sieci krystaliczej FONONY 1. model klasyczy (iekwatowy) a) model ośrodka ciągłego (model Debye a) - przypadek jedowymiarowy - drgaia struy drgaia mogą być podłuże (guma, sprężya) i dwie prostopadłe
Drgaia sieci krystaliczej FONONY 1. model klasyczy (iekwatowy) a) model ośrodka ciągłego (model Debye a) - przypadek jedowymiarowy - drgaia struy drgaia mogą być podłuże (guma, sprężya) i dwie prostopadłe
Wyjaśnienie. linii widmowych atomów. eureka! to odkryli
 TEKST TRUDNY Rodząca się powoli owoczesa mechaika kwatowa odosiła od samego początku bardzo wiele sukcesów. Za każdym razem, gdy fizyka klasycza błędie opisywała jakieś zjawisko lub zupełie ie potrafiła
TEKST TRUDNY Rodząca się powoli owoczesa mechaika kwatowa odosiła od samego początku bardzo wiele sukcesów. Za każdym razem, gdy fizyka klasycza błędie opisywała jakieś zjawisko lub zupełie ie potrafiła
Ćwiczenia nr 5. TEMATYKA: Regresja liniowa dla prostej i płaszczyzny
 TEMATYKA: Regresja liiowa dla prostej i płaszczyzy Ćwiczeia r 5 DEFINICJE: Regresja: metoda statystycza pozwalająca a badaie związku pomiędzy wielkościami daych i przewidywaie a tej podstawie iezaych wartości
TEMATYKA: Regresja liiowa dla prostej i płaszczyzy Ćwiczeia r 5 DEFINICJE: Regresja: metoda statystycza pozwalająca a badaie związku pomiędzy wielkościami daych i przewidywaie a tej podstawie iezaych wartości
PODSTAWY OPRACOWANIA WYNIKÓW POMIARÓW Z ELEMENTAMI ANALIZY NIEPEWNOŚCI POMIAROWYCH
 PODSTAWY OPRACOWANIA WYNIKÓW POMIARÓW Z ELEMENTAMI ANALIZY NIEPEWNOŚCI POMIAROWYCH POMIAR FIZYCZNY Pomiar bezpośredi to doświadczeie, w którym przy pomocy odpowiedich przyrządów mierzymy (tj. porówujemy
PODSTAWY OPRACOWANIA WYNIKÓW POMIARÓW Z ELEMENTAMI ANALIZY NIEPEWNOŚCI POMIAROWYCH POMIAR FIZYCZNY Pomiar bezpośredi to doświadczeie, w którym przy pomocy odpowiedich przyrządów mierzymy (tj. porówujemy
POLITECHNIKA OPOLSKA
 POLITCHIKA OPOLSKA ISTYTUT AUTOMATYKI I IFOMATYKI LABOATOIUM MTOLOII LKTOICZJ 7. KOMPSATOY U P U. KOMPSATOY APIĘCIA STAŁO.. Wstęp... Zasada pomiaru metodą kompesacyją. Metoda kompesacyja pomiaru apięcia
POLITCHIKA OPOLSKA ISTYTUT AUTOMATYKI I IFOMATYKI LABOATOIUM MTOLOII LKTOICZJ 7. KOMPSATOY U P U. KOMPSATOY APIĘCIA STAŁO.. Wstęp... Zasada pomiaru metodą kompesacyją. Metoda kompesacyja pomiaru apięcia
Stwierdzenie 1. Jeżeli ciąg ma granicę, to jest ona określona jednoznacznie (żaden ciąg nie może mieć dwóch różnych granic).
 Materiały dydaktycze Aaliza Matematycza Wykład Ciągi liczbowe i ich graice. Graice ieskończoe. Waruek Cauchyego. Działaia arytmetycze a ciągach. Podstawowe techiki obliczaia graic ciągów. Istieie graic
Materiały dydaktycze Aaliza Matematycza Wykład Ciągi liczbowe i ich graice. Graice ieskończoe. Waruek Cauchyego. Działaia arytmetycze a ciągach. Podstawowe techiki obliczaia graic ciągów. Istieie graic
Stałe : h=6, Js h= 4, eVs 1eV= J nie zależy
 T_atom-All 1 Nazwisko i imię klasa Stałe : h=6,626 10 34 Js h= 4,14 10 15 evs 1eV=1.60217657 10-19 J Zaznacz zjawiska świadczące o falowej naturze światła a) zjawisko fotoelektryczne b) interferencja c)
T_atom-All 1 Nazwisko i imię klasa Stałe : h=6,626 10 34 Js h= 4,14 10 15 evs 1eV=1.60217657 10-19 J Zaznacz zjawiska świadczące o falowej naturze światła a) zjawisko fotoelektryczne b) interferencja c)
Ćwiczenia rachunkowe TEST ZGODNOŚCI χ 2 PEARSONA ROZKŁAD GAUSSA
 Aaliza iepewości pomiarowych w esperymetach fizyczych Ćwiczeia rachuowe TEST ZGODNOŚCI χ PEARSONA ROZKŁAD GAUSSA UWAGA: Na stroie, z tórej pobrałaś/pobrałeś istrucję zajduje się gotowy do załadowaia arusz
Aaliza iepewości pomiarowych w esperymetach fizyczych Ćwiczeia rachuowe TEST ZGODNOŚCI χ PEARSONA ROZKŁAD GAUSSA UWAGA: Na stroie, z tórej pobrałaś/pobrałeś istrucję zajduje się gotowy do załadowaia arusz
41P6 POWTÓRKA FIKCYJNY EGZAMIN MATURALNYZ FIZYKI I ASTRONOMII - V POZIOM PODSTAWOWY
 41P6 POWTÓRKA FIKCYJNY EGZAMIN MATURALNYZ FIZYKI I ASTRONOMII - V Optyka fizyczna POZIOM PODSTAWOWY Dualizm korpuskularno-falowy Atom wodoru. Widma Fizyka jądrowa Teoria względności Rozwiązanie zadań należy
41P6 POWTÓRKA FIKCYJNY EGZAMIN MATURALNYZ FIZYKI I ASTRONOMII - V Optyka fizyczna POZIOM PODSTAWOWY Dualizm korpuskularno-falowy Atom wodoru. Widma Fizyka jądrowa Teoria względności Rozwiązanie zadań należy
WYZNACZANIE WSPÓŁCZYNNIKA ZAŁAMANIA ŚWIATŁA METODĄ SZPILEK I ZA POMOCĄ MIKROSKOPU. Wprowadzenie. = =
 WYZNACZANIE WSPÓŁCZYNNIKA ZAŁAMANIA ŚWIATŁA METODĄ SZPILEK I ZA POMOCĄ MIKROSKOPU Wprowadzeie. Przy przejśiu światła z jedego ośrodka do drugiego występuje zjawisko załamaia zgodie z prawem Selliusa siα
WYZNACZANIE WSPÓŁCZYNNIKA ZAŁAMANIA ŚWIATŁA METODĄ SZPILEK I ZA POMOCĄ MIKROSKOPU Wprowadzeie. Przy przejśiu światła z jedego ośrodka do drugiego występuje zjawisko załamaia zgodie z prawem Selliusa siα
Temat: Promieniowanie atomu wodoru (teoria)
 Temat: Promieniowanie atomu wodoru (teoria) Zgodnie z drugim postulatem Bohra elektron poruszając się po dozwolonej orbicie nie wypromieniowuje energii. Promieniowanie zostaje wyemitowane, gdy elektron
Temat: Promieniowanie atomu wodoru (teoria) Zgodnie z drugim postulatem Bohra elektron poruszając się po dozwolonej orbicie nie wypromieniowuje energii. Promieniowanie zostaje wyemitowane, gdy elektron
Budowa i zasada działania lasera
 Budowa i zasada działaia lasera Budowa atomu Demokryt (460 370 p..e.) materia składa się z iepodzielych elemetów; (atom, gr. atomos - iepodziely). Sta wiedzy o atomie w drugiej połowie XIX stulecia: Atom
Budowa i zasada działaia lasera Budowa atomu Demokryt (460 370 p..e.) materia składa się z iepodzielych elemetów; (atom, gr. atomos - iepodziely). Sta wiedzy o atomie w drugiej połowie XIX stulecia: Atom
p.n.e. Demokryt z Abdery. Wszystko jest zbudowane z niewidzialnych cząstek - atomów (atomos ->niepodzielny)
 O atomie 460-370 p.n.e. Demokryt z Abdery Wszystko jest zbudowane z niewidzialnych cząstek - atomów (atomos ->niepodzielny) 1808 John Dalton teoria atomistyczna 1. Pierwiastki składają się z małych, niepodzielnych
O atomie 460-370 p.n.e. Demokryt z Abdery Wszystko jest zbudowane z niewidzialnych cząstek - atomów (atomos ->niepodzielny) 1808 John Dalton teoria atomistyczna 1. Pierwiastki składają się z małych, niepodzielnych
Modele atomu wodoru. Modele atomu wodoru Thomson'a Rutherford'a Bohr'a
 Modele atomu wodoru Modele atomu wodoru Thomson'a Rutherford'a Bohr'a Demokryt: V w. p.n.e najmniejszy, niepodzielny metodami chemicznymi składnik materii. atomos - niepodzielny Co to jest atom? trochę
Modele atomu wodoru Modele atomu wodoru Thomson'a Rutherford'a Bohr'a Demokryt: V w. p.n.e najmniejszy, niepodzielny metodami chemicznymi składnik materii. atomos - niepodzielny Co to jest atom? trochę
Ćwiczenie nr 14. Porównanie doświadczalnego rozkładu liczby zliczeń w zadanym przedziale czasu z rozkładem Poissona
 Ćwiczeie r 4 Porówaie doświadczalego rozkładu liczby zliczeń w zadaym przedziale czasu z rozkładem Poissoa Studeta obowiązuje zajomość: Podstawowych zagadień z rachuku prawdopodobieństwa, Zajomość rozkładów
Ćwiczeie r 4 Porówaie doświadczalego rozkładu liczby zliczeń w zadaym przedziale czasu z rozkładem Poissoa Studeta obowiązuje zajomość: Podstawowych zagadień z rachuku prawdopodobieństwa, Zajomość rozkładów
Wyznaczanie zależności współczynnika załamania światła od długości fali światła
 Ćwiczenie O3 Wyznaczanie zależności współczynnika załamania światła od długości fali światła O3.1. Cel ćwiczenia Celem ćwiczenia jest zbadanie zależności współczynnika załamania światła od długości fali
Ćwiczenie O3 Wyznaczanie zależności współczynnika załamania światła od długości fali światła O3.1. Cel ćwiczenia Celem ćwiczenia jest zbadanie zależności współczynnika załamania światła od długości fali
Wstęp do astrofizyki I
 Wstęp do astrofizyki I Wykład 3 Tomasz Kwiatkowski 2010-10-20 Tomasz Kwiatkowski, Wstęp do astrofizyki I, Wykład 3 1/22 Plan wykładu Linie widmowe Linie Fraunhofera Prawa Kirchhoffa Analiza widmowa Zjawisko
Wstęp do astrofizyki I Wykład 3 Tomasz Kwiatkowski 2010-10-20 Tomasz Kwiatkowski, Wstęp do astrofizyki I, Wykład 3 1/22 Plan wykładu Linie widmowe Linie Fraunhofera Prawa Kirchhoffa Analiza widmowa Zjawisko
Chemia Teoretyczna I (6).
 Chemia Teoretycza I (6). NajwaŜiejsze rówaia róŝiczkowe drugiego rzędu o stałych współczyikach w chemii i fizyce cząstka w jedowymiarowej studi potecjału Cząstka w jedowymiarowej studi potecjału Przez
Chemia Teoretycza I (6). NajwaŜiejsze rówaia róŝiczkowe drugiego rzędu o stałych współczyikach w chemii i fizyce cząstka w jedowymiarowej studi potecjału Cząstka w jedowymiarowej studi potecjału Przez
I. Podzielność liczb całkowitych
 I Podzielość liczb całkowitych Liczba a = 57 przy dzieleiu przez pewą liczbę dodatią całkowitą b daje iloraz k = 3 i resztę r Zaleźć dzieik b oraz resztę r a = 57 = 3 b + r, 0 r b Stąd 5 r b 8, 3 więc
I Podzielość liczb całkowitych Liczba a = 57 przy dzieleiu przez pewą liczbę dodatią całkowitą b daje iloraz k = 3 i resztę r Zaleźć dzieik b oraz resztę r a = 57 = 3 b + r, 0 r b Stąd 5 r b 8, 3 więc
Promieniowanie atomów wzbudzonych
 Achorage, USA, May 2002 W-27 (Jaroszewicz) 23 slajdy Na podstawie prezetacji prof. J. Rutkowskiego Promieiowaie atomów wzbudzoych Promieiowaie spotaicze Promieiowaie wymuszoe Promieiowaie retgeowskie 3/23-W27
Achorage, USA, May 2002 W-27 (Jaroszewicz) 23 slajdy Na podstawie prezetacji prof. J. Rutkowskiego Promieiowaie atomów wzbudzoych Promieiowaie spotaicze Promieiowaie wymuszoe Promieiowaie retgeowskie 3/23-W27
Podstawowe pojęcia optyki geometrycznej. c prędkość światła w próżni v < c prędkość światła w danym ośrodku
 Optyka geometrycza Podstawowe pojęcia optyki geometryczej Bezwzględy współczyik załamaia c prędkość światła w próżi v < c prędkość światła w daym ośrodku c v > 1 Aksjomaty Światło w ośrodku jedorodym propaguje
Optyka geometrycza Podstawowe pojęcia optyki geometryczej Bezwzględy współczyik załamaia c prędkość światła w próżi v < c prędkość światła w daym ośrodku c v > 1 Aksjomaty Światło w ośrodku jedorodym propaguje
Wykład Budowa atomu 1
 Wykład 30. 11. 2016 Budowa atomu 1 O atomach Trochę historii i wprowadzenie w temat Promieniowanie i widma Doświadczenie Rutherforda i odkrycie jądra atomowego Model atomu wodoru Bohra sukcesy i ograniczenia
Wykład 30. 11. 2016 Budowa atomu 1 O atomach Trochę historii i wprowadzenie w temat Promieniowanie i widma Doświadczenie Rutherforda i odkrycie jądra atomowego Model atomu wodoru Bohra sukcesy i ograniczenia
Jarosław Wróblewski Analiza Matematyczna 1A, zima 2012/13. Ciągi.
 Jarosław Wróblewski Aaliza Matematycza 1A, zima 2012/13 Ciągi. Ćwiczeia 5.11.2012: zad. 140-173 Kolokwium r 5, 6.11.2012: materiał z zad. 1-173 Ćwiczeia 12.11.2012: zad. 174-190 13.11.2012: zajęcia czwartkowe
Jarosław Wróblewski Aaliza Matematycza 1A, zima 2012/13 Ciągi. Ćwiczeia 5.11.2012: zad. 140-173 Kolokwium r 5, 6.11.2012: materiał z zad. 1-173 Ćwiczeia 12.11.2012: zad. 174-190 13.11.2012: zajęcia czwartkowe
Numeryczny opis zjawiska zaniku
 FOTON 8, iosa 05 7 Numeryczy opis zjawiska zaiku Jerzy Giter ydział Fizyki U Postawieie problemu wielu zagadieiach z różych działów fizyki spotykamy się z astępującym problemem: zmiay w czasie t pewej
FOTON 8, iosa 05 7 Numeryczy opis zjawiska zaiku Jerzy Giter ydział Fizyki U Postawieie problemu wielu zagadieiach z różych działów fizyki spotykamy się z astępującym problemem: zmiay w czasie t pewej
ELEMENTY OPTYKI GEOMETRYCZNEJ
 ELEMENTY OPTYKI GEOMETRYCZNEJ Optyka to dział fizyki, zajmujący się badaiem atury światła, początkowo tylko widzialego, a obecie rówież promieiowaia z zakresów podczerwiei i adfioletu. Optyka - geometrycza
ELEMENTY OPTYKI GEOMETRYCZNEJ Optyka to dział fizyki, zajmujący się badaiem atury światła, początkowo tylko widzialego, a obecie rówież promieiowaia z zakresów podczerwiei i adfioletu. Optyka - geometrycza
IV. TEORIA (MODEL) BOHRA ATOMU (1913)
 IV. TEORIA (MODEL) BOHRA ATOMU (1913) Bohr zastanawiał się, jak wyjaśnić strukturę widm liniowych. Elektron musi krążyć, aby zrównoważyć siłę Coulomba (przyciągającą). Skoro krąży to doznaje przyspieszenia
IV. TEORIA (MODEL) BOHRA ATOMU (1913) Bohr zastanawiał się, jak wyjaśnić strukturę widm liniowych. Elektron musi krążyć, aby zrównoważyć siłę Coulomba (przyciągającą). Skoro krąży to doznaje przyspieszenia
INSTRUKCJA NR 06-2 POMIARY TEMPA METABOLIZMU METODĄ TABELARYCZNĄ
 LABORATORIUM OCHRONY ŚRODOWISKA - SYSTEM ZARZĄDZANIA JAKOŚCIĄ - INSTRUKCJA NR 06- POMIARY TEMPA METABOLIZMU METODĄ TABELARYCZNĄ 1. Cel istrukcji Celem istrukcji jest określeie metodyki postępowaia w celu
LABORATORIUM OCHRONY ŚRODOWISKA - SYSTEM ZARZĄDZANIA JAKOŚCIĄ - INSTRUKCJA NR 06- POMIARY TEMPA METABOLIZMU METODĄ TABELARYCZNĄ 1. Cel istrukcji Celem istrukcji jest określeie metodyki postępowaia w celu
BADANIE DRGAŃ WYMUSZONYCH PRZY POMOCY WAHADŁA POHLA
 I PRACOWNIA FIZYCZNA, INSTYTUT FIZYKI UMK, TORUŃ Istrukcja do ćwiczeia r 3 BADANIE DRGAŃ WYMUSZONYCH PRZY POMOCY WAHADŁA POHLA. Cel ćwiczeia Celem ćwiczeia jest pozaie szeregu zjawisk związaych z drgaiami
I PRACOWNIA FIZYCZNA, INSTYTUT FIZYKI UMK, TORUŃ Istrukcja do ćwiczeia r 3 BADANIE DRGAŃ WYMUSZONYCH PRZY POMOCY WAHADŁA POHLA. Cel ćwiczeia Celem ćwiczeia jest pozaie szeregu zjawisk związaych z drgaiami
Roy Jay Glauber, ojciec optyki kwantowej - Nagroda Nobla 2005 Polskie Towarzystwo Fizyczne Oddział Łódzki, 19 grudnia 2005 r.
 Roy Jay Glauber, ojciec optyki kwatowej - Nagroda Nobla 005 Polskie Towarzystwo Fizycze Oddział Łódzki, 19 grudia 005 r. Jarosław Bauer Katedra Fizyki Teoretyczej Uiwersytetu Łódzkiego Ul. Pomorska 149/153,
Roy Jay Glauber, ojciec optyki kwatowej - Nagroda Nobla 005 Polskie Towarzystwo Fizycze Oddział Łódzki, 19 grudia 005 r. Jarosław Bauer Katedra Fizyki Teoretyczej Uiwersytetu Łódzkiego Ul. Pomorska 149/153,
II.1 Serie widmowe wodoru
 II.1 Serie widmowe wodoru Jan Królikowski Fizyka IVBC 1 II.1 Serie widmowe wodoru W obszarze widzialnym wystepują 3 silne linie wodoru: H α (656.3 nm), H β (486.1 nm) i H γ (434.0 nm) oraz szereg linii
II.1 Serie widmowe wodoru Jan Królikowski Fizyka IVBC 1 II.1 Serie widmowe wodoru W obszarze widzialnym wystepują 3 silne linie wodoru: H α (656.3 nm), H β (486.1 nm) i H γ (434.0 nm) oraz szereg linii
Spektroskop, rurki Plückera, cewka Ruhmkorffa, aparat fotogtaficzny, źródło prądu
 Imię i nazwisko ucznia Nazwa i adres szkoły Imię i nazwisko nauczyciela Tytuł eksperymentu Dział fizyki Potrzebne materiały do doświadczeń Kamil Jańczyk i Mateusz Kowalkowski I Liceum Ogólnokształcące
Imię i nazwisko ucznia Nazwa i adres szkoły Imię i nazwisko nauczyciela Tytuł eksperymentu Dział fizyki Potrzebne materiały do doświadczeń Kamil Jańczyk i Mateusz Kowalkowski I Liceum Ogólnokształcące
Prawo odbicia i załamania. Autorzy: Zbigniew Kąkol Piotr Morawski
 Prawo odbicia i załamaia Autorzy: Zbigiew Kąkol Piotr Morawski 207 Prawo odbicia i załamaia Autorzy: Zbigiew Kąkol, Piotr Morawski Jeżeli światło pada a graicę dwóch ośrodków, to ulega zarówo odbiciu a
Prawo odbicia i załamaia Autorzy: Zbigiew Kąkol Piotr Morawski 207 Prawo odbicia i załamaia Autorzy: Zbigiew Kąkol, Piotr Morawski Jeżeli światło pada a graicę dwóch ośrodków, to ulega zarówo odbiciu a
POMIARY WARSZTATOWE. D o u ż y t k u w e w n ę t r z n e g o. Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Ćwiczenia laboratoryjne
 D o u ż y t k u w e w ę t r z e g o Katedra Iżyierii i Aparatury Przemysłu Spożywczego POMIARY WARSZTATOWE Ćwiczeia laboratoryje Opracowaie: Urszula Goik, Maciej Kabziński Kraków, 2015 1 SUWMIARKI Suwmiarka
D o u ż y t k u w e w ę t r z e g o Katedra Iżyierii i Aparatury Przemysłu Spożywczego POMIARY WARSZTATOWE Ćwiczeia laboratoryje Opracowaie: Urszula Goik, Maciej Kabziński Kraków, 2015 1 SUWMIARKI Suwmiarka
Pierwiastki z liczby zespolonej. Autorzy: Agnieszka Kowalik
 Pierwiastki z liczby zespoloej Autorzy: Agieszka Kowalik 09 Pierwiastki z liczby zespoloej Autor: Agieszka Kowalik DEFINICJA Defiicja : Pierwiastek z liczby zespoloej Niech będzie liczbą aturalą. Pierwiastkiem
Pierwiastki z liczby zespoloej Autorzy: Agieszka Kowalik 09 Pierwiastki z liczby zespoloej Autor: Agieszka Kowalik DEFINICJA Defiicja : Pierwiastek z liczby zespoloej Niech będzie liczbą aturalą. Pierwiastkiem
Rysunek 3-23 Hipotetyczne widmo ciągłe atomu Ernesta Rutherforda oraz rzeczywiste widmo emisyjne wodoru w zakresie światła widzialnego
 3.5. Model Bohra-Sommerfelda Przeciw modelowi atomu zaproponowanego przez Ernesta Rutherforda przemawiały także wyniki badań spektroskopowych pierwiastków. Jeśli elektrony, jak wynika z teorii Maxwella,
3.5. Model Bohra-Sommerfelda Przeciw modelowi atomu zaproponowanego przez Ernesta Rutherforda przemawiały także wyniki badań spektroskopowych pierwiastków. Jeśli elektrony, jak wynika z teorii Maxwella,
Jarosław Wróblewski Analiza Matematyczna 1, zima 2016/17
 Egzami, 18.02.2017, godz. 9:00-11:30 Zadaie 1. (22 pukty) W każdym z zadań 1.1-1.10 podaj w postaci uproszczoej kresy zbioru oraz apisz, czy kresy ależą do zbioru (apisz TAK albo NIE, ewetualie T albo
Egzami, 18.02.2017, godz. 9:00-11:30 Zadaie 1. (22 pukty) W każdym z zadań 1.1-1.10 podaj w postaci uproszczoej kresy zbioru oraz apisz, czy kresy ależą do zbioru (apisz TAK albo NIE, ewetualie T albo
Budowa atomów. Budowa atomu wodoru
 05-0- Budowa atomów atom wodoru atomy wieloelektroowe zakaz Pauliego układ okresowy pierwiastków Budowa atomu wodoru atom wodoru składa się z pojedyczego elektrou (-e) związaego z jądrem protoem (+e) przyciągającą
05-0- Budowa atomów atom wodoru atomy wieloelektroowe zakaz Pauliego układ okresowy pierwiastków Budowa atomu wodoru atom wodoru składa się z pojedyczego elektrou (-e) związaego z jądrem protoem (+e) przyciągającą
Efekt Comptona. Efektem Comptona nazywamy zmianę długości fali elektromagnetycznej w wyniku rozpraszania jej na swobodnych elektronach
 Efekt Comptona. Efektem Comptona nazywamy zmianę długości fali elektromagnetycznej w wyniku rozpraszania jej na swobodnych elektronach Efekt Comptona. p f Θ foton elektron p f p e 0 p e Zderzenia fotonów
Efekt Comptona. Efektem Comptona nazywamy zmianę długości fali elektromagnetycznej w wyniku rozpraszania jej na swobodnych elektronach Efekt Comptona. p f Θ foton elektron p f p e 0 p e Zderzenia fotonów
Lista 6. Estymacja punktowa
 Estymacja puktowa Lista 6 Model metoda mometów, rozkład ciągły. Zadaie. Metodą mometów zaleźć estymator iezaego parametru a w populacji jedostajej a odciku [a, a +. Czy jest to estymator ieobciążoy i zgody?
Estymacja puktowa Lista 6 Model metoda mometów, rozkład ciągły. Zadaie. Metodą mometów zaleźć estymator iezaego parametru a w populacji jedostajej a odciku [a, a +. Czy jest to estymator ieobciążoy i zgody?
autor: Włodzimierz Wolczyński rozwiązywał (a)... ARKUSIK 39 ATOM WODORU. PROMIENIOWANIE. WIDMA TEST JEDNOKROTNEGO WYBORU
 autor: Włodzimierz Wolczyński rozwiązywał (a)... ARKUSIK 39 ATOM WODORU. PROMIENIOWANIE. WIDMA Zadanie 1 1 punkt TEST JEDNOKROTNEGO WYBORU Moment pędu elektronu znajdującego się na drugiej orbicie w atomie
autor: Włodzimierz Wolczyński rozwiązywał (a)... ARKUSIK 39 ATOM WODORU. PROMIENIOWANIE. WIDMA Zadanie 1 1 punkt TEST JEDNOKROTNEGO WYBORU Moment pędu elektronu znajdującego się na drugiej orbicie w atomie
Ćw. 20. Pomiary współczynnika załamania światła z pomiarów kąta załamania oraz kąta granicznego
 0 KATEDRA FIZYKI STOSOWANEJ PRACOWNIA FIZYKI Ćw. 0. Pomiary współczyika załamaia światła z pomiarów kąta załamaia oraz kąta graiczego Wprowadzeie Światło widziale jest promieiowaiem elektromagetyczym o
0 KATEDRA FIZYKI STOSOWANEJ PRACOWNIA FIZYKI Ćw. 0. Pomiary współczyika załamaia światła z pomiarów kąta załamaia oraz kąta graiczego Wprowadzeie Światło widziale jest promieiowaiem elektromagetyczym o
ĆWICZENIE 1 WYZNACZANIE DŁUGOŚCI FALI ZA POMOCĄ SPEKTROSKOPU
 ĆWICZENIE WYZNACZANIE DŁUGOŚCI FALI ZA POMOCĄ SPEKTROSKOPU Jeżeli gazy zaczynają świecić, na przykład w wyniku podgrzania, to możemy zaobserwować charakterystyczne kolorowe prążki podczas obserwacji tzw.
ĆWICZENIE WYZNACZANIE DŁUGOŚCI FALI ZA POMOCĄ SPEKTROSKOPU Jeżeli gazy zaczynają świecić, na przykład w wyniku podgrzania, to możemy zaobserwować charakterystyczne kolorowe prążki podczas obserwacji tzw.
Widmo promieniowania elektromagnetycznego
 Widmo promieiowaia elektromagetyczego Czułość oka człowieka Płaska fala elektromagetycza w próżi Ciało doskoale czare Prawo promieiowaia Kirchhoffa: Stosuek zdolości emisyjej do zdolości absorpcyjej jest
Widmo promieiowaia elektromagetyczego Czułość oka człowieka Płaska fala elektromagetycza w próżi Ciało doskoale czare Prawo promieiowaia Kirchhoffa: Stosuek zdolości emisyjej do zdolości absorpcyjej jest
Fizyka 3. Konsultacje: p. 329, Mechatronika
 Fizyka 3 Konsultacje: p. 39, Mechatronika marzan@mech.pw.edu.pl Zaliczenie: 1 sprawdzian 30 pkt 15.1 18 3.0 18.1 1 3.5 1.1 4 4.0 4.1 7 4.5 7.1 30 5.0 http:\\adam.mech.pw.edu.pl\~marzan Program: - elementy
Fizyka 3 Konsultacje: p. 39, Mechatronika marzan@mech.pw.edu.pl Zaliczenie: 1 sprawdzian 30 pkt 15.1 18 3.0 18.1 1 3.5 1.1 4 4.0 4.1 7 4.5 7.1 30 5.0 http:\\adam.mech.pw.edu.pl\~marzan Program: - elementy
Model Bohra budowy atomu wodoru - opis matematyczny
 Model Bohra budowy atomu wodoru - opis matematyczny Uwzględniając postulaty kwantowe Bohra, można obliczyć promienie orbit dozwolonych, energie elektronu na tych orbitach, wartość prędkości elektronu na
Model Bohra budowy atomu wodoru - opis matematyczny Uwzględniając postulaty kwantowe Bohra, można obliczyć promienie orbit dozwolonych, energie elektronu na tych orbitach, wartość prędkości elektronu na
Podstawy opracowania wyników pomiarów z elementami analizy niepewności pomiarowych (w zakresie materiału przedstawionego na wykładzie organizacyjnym)
 Podstawy opracowaia wyików pomiarów z elemetami aalizepewości pomiarowych (w zakresie materiału przedstawioego a wykładzie orgaizacyjym) Pomiary Wyróżiamy dwa rodzaje pomiarów: pomiar bezpośredi, czyli
Podstawy opracowaia wyików pomiarów z elemetami aalizepewości pomiarowych (w zakresie materiału przedstawioego a wykładzie orgaizacyjym) Pomiary Wyróżiamy dwa rodzaje pomiarów: pomiar bezpośredi, czyli
( ) WŁASNOŚCI MACIERZY
 .Kowalski własości macierzy WŁSNOŚC MCERZY Własości iloczyu i traspozycji a) możeie macierzy jest łącze, tz. (C) ()C, dlatego zapis C jest jedozaczy, b) możeie macierzy jest rozdziele względem dodawaia,
.Kowalski własości macierzy WŁSNOŚC MCERZY Własości iloczyu i traspozycji a) możeie macierzy jest łącze, tz. (C) ()C, dlatego zapis C jest jedozaczy, b) możeie macierzy jest rozdziele względem dodawaia,
X i. X = 1 n. i=1. wartość tej statystyki nazywana jest wartością średnią empiryczną i oznaczamy ją symbolem x, przy czym x = 1. (X i X) 2.
 Zagadieia estymacji Puktem wyjścia badaia statystyczego jest wylosowaie z całej populacji pewej skończoej liczby elemetów i zbadaie ich ze względu a zmieą losową cechę X Uzyskae w te sposób wartości x,
Zagadieia estymacji Puktem wyjścia badaia statystyczego jest wylosowaie z całej populacji pewej skończoej liczby elemetów i zbadaie ich ze względu a zmieą losową cechę X Uzyskae w te sposób wartości x,
Jak obliczać podstawowe wskaźniki statystyczne?
 Jak obliczać podstawowe wskaźiki statystycze? Przeprowadzoe egzamiy zewętrze dostarczają iformacji o tym, jak ucziowie w poszczególych latach opaowali umiejętości i wiadomości określoe w stadardach wymagań
Jak obliczać podstawowe wskaźiki statystycze? Przeprowadzoe egzamiy zewętrze dostarczają iformacji o tym, jak ucziowie w poszczególych latach opaowali umiejętości i wiadomości określoe w stadardach wymagań
Model Lesliego. Oznaczmy: 0 m i liczba potomstwa pojawiającego się co jednostkę czasu u osobnika z i-tej grupy wiekowej, i = 1,...
 Model Lesliego Macierze Lesliego i Markowa K. Leśiak Wyodrębiamy w populaci k grup wiekowych. Po każde edostce czasu astępuą arodziy i zgoy oraz starzeie (przechodzeie do astępe grupy wiekowe). Chcemy
Model Lesliego Macierze Lesliego i Markowa K. Leśiak Wyodrębiamy w populaci k grup wiekowych. Po każde edostce czasu astępuą arodziy i zgoy oraz starzeie (przechodzeie do astępe grupy wiekowe). Chcemy
ELEKTROTECHNIKA I ELEKTRONIKA
 UNIWERSYTET TECHNOLOGICZNO-PRZYRODNICZY W BYDGOSZCZY WYDZIAŁ INŻYNIERII MECHANICZNEJ INSTYTUT EKSPLOATACJI MASZYN I TRANSPORTU ZAKŁAD STEROWANIA ELEKTROTECHNIKA I ELEKTRONIKA ĆWICZENIE: E20 BADANIE UKŁADU
UNIWERSYTET TECHNOLOGICZNO-PRZYRODNICZY W BYDGOSZCZY WYDZIAŁ INŻYNIERII MECHANICZNEJ INSTYTUT EKSPLOATACJI MASZYN I TRANSPORTU ZAKŁAD STEROWANIA ELEKTROTECHNIKA I ELEKTRONIKA ĆWICZENIE: E20 BADANIE UKŁADU
Temat: PRAWO SNELLIUSA. WYZNACZANIE WSPÓŁCZYNNIKA ZAŁAMANIA W SZKLE I PLEKSIGLASIE.
 W S E i Z WYDZIAŁ. L A B O R A T O R I U M F I Z Y C Z N E Nr ćwicz. 9 Temat: PRAWO SNELLIUSA. WYZNACZANIE WSPÓŁCZYNNIKA ZAŁAMANIA W SZKLE I PLEKSIGLASIE. Semestr Grupa Zespół Ocea Data / Podpis Warszawa,
W S E i Z WYDZIAŁ. L A B O R A T O R I U M F I Z Y C Z N E Nr ćwicz. 9 Temat: PRAWO SNELLIUSA. WYZNACZANIE WSPÓŁCZYNNIKA ZAŁAMANIA W SZKLE I PLEKSIGLASIE. Semestr Grupa Zespół Ocea Data / Podpis Warszawa,
Charakterystyki liczbowe zmiennych losowych: wartość oczekiwana i wariancja
 Charakterystyki liczbowe zmieych losowych: wartość oczekiwaa i wariacja dr Mariusz Grządziel Wykłady 3 i 4;,8 marca 24 Wartość oczekiwaa zmieej losowej dyskretej Defiicja. Dla zmieej losowej dyskretej
Charakterystyki liczbowe zmieych losowych: wartość oczekiwaa i wariacja dr Mariusz Grządziel Wykłady 3 i 4;,8 marca 24 Wartość oczekiwaa zmieej losowej dyskretej Defiicja. Dla zmieej losowej dyskretej
Rysunek 1: Fale stojące dla struny zamocowanej na obu końcach; węzły są zaznaczone liniami kropkowanymi, a strzałki przerywanymi
 Aaliza fal złożoych Autorzy: Zbigiew Kąkol, Bartek Wiedlocha Przyjrzyjmy się drgaiu poprzeczemu struy. Jeżeli strua zamocowaa a obu końcach zostaie ajpierw wygięta, a astępie puszczoa, to wzdłuż struy
Aaliza fal złożoych Autorzy: Zbigiew Kąkol, Bartek Wiedlocha Przyjrzyjmy się drgaiu poprzeczemu struy. Jeżeli strua zamocowaa a obu końcach zostaie ajpierw wygięta, a astępie puszczoa, to wzdłuż struy
2 n < 2n + 2 n. 2 n = 2. 2 n 2 +3n+2 > 2 0 = 1 = 2. n+2 n 1 n+1 = 2. n+1
 Tekst a iebiesko jest kometarzem lub treścią zadaia. Zadaie 1. Zbadaj mootoiczość i ograiczoość ciągów. a = + 3 + 1 Ciąg jest mootoiczie rosący i ieograiczoy poieważ różica kolejych wyrazów jest dodatia.
Tekst a iebiesko jest kometarzem lub treścią zadaia. Zadaie 1. Zbadaj mootoiczość i ograiczoość ciągów. a = + 3 + 1 Ciąg jest mootoiczie rosący i ieograiczoy poieważ różica kolejych wyrazów jest dodatia.
O pewnych zastosowaniach rachunku różniczkowego funkcji dwóch zmiennych w ekonomii
 O pewych zastosowaiach rachuku różiczkowego fukcji dwóch zmieych w ekoomii 1 Wielkość wytwarzaego dochodu arodowego D zależa jest od wielkości produkcyjego majątku trwałego M i akładów pracy żywej Z Fukcję
O pewych zastosowaiach rachuku różiczkowego fukcji dwóch zmieych w ekoomii 1 Wielkość wytwarzaego dochodu arodowego D zależa jest od wielkości produkcyjego majątku trwałego M i akładów pracy żywej Z Fukcję
2. INNE ROZKŁADY DYSKRETNE
 Ie rozkłady dyskrete 9. INNE ROZKŁADY DYSKRETNE.. Rozkład dwumiaowy - kotyuacja Przypomijmy sobie pojęcie rozkładu dwumiaowego prawdopodobieństwa k sukcesów w próbach Beroulli ego: P k k k k = p q m =
Ie rozkłady dyskrete 9. INNE ROZKŁADY DYSKRETNE.. Rozkład dwumiaowy - kotyuacja Przypomijmy sobie pojęcie rozkładu dwumiaowego prawdopodobieństwa k sukcesów w próbach Beroulli ego: P k k k k = p q m =
Zjawiska kontaktowe. Pojęcia.
 Zjawiska kotaktowe. Pojęcia. Próżia, E vac =0 Φ m W Φ s χ E c µ E v metal półprzewodik W praca przeiesieia elektrou z da pasma przewodictwa do próżi, bez zwiększaia jego eergii kietyczej (którą ma zerową).
Zjawiska kotaktowe. Pojęcia. Próżia, E vac =0 Φ m W Φ s χ E c µ E v metal półprzewodik W praca przeiesieia elektrou z da pasma przewodictwa do próżi, bez zwiększaia jego eergii kietyczej (którą ma zerową).
UKŁADY RÓWNAŃ LINOWYCH
 Ekoeergetyka Matematyka. Wykład 4. UKŁADY RÓWNAŃ LINOWYCH Defiicja (Układ rówań liiowych, rozwiązaie układu rówań) Układem m rówań liiowych z iewiadomymi,,,, gdzie m, azywamy układ rówań postaci: a a a
Ekoeergetyka Matematyka. Wykład 4. UKŁADY RÓWNAŃ LINOWYCH Defiicja (Układ rówań liiowych, rozwiązaie układu rówań) Układem m rówań liiowych z iewiadomymi,,,, gdzie m, azywamy układ rówań postaci: a a a
O liczbach naturalnych, których suma równa się iloczynowi
 O liczbach aturalych, których suma rówa się iloczyowi Lew Kurladczyk i Adrzej Nowicki Toruń UMK, 10 listopada 1998 r. Liczby aturale 1, 2, 3 posiadają szczególą własość. Ich suma rówa się iloczyowi: Podobą
O liczbach aturalych, których suma rówa się iloczyowi Lew Kurladczyk i Adrzej Nowicki Toruń UMK, 10 listopada 1998 r. Liczby aturale 1, 2, 3 posiadają szczególą własość. Ich suma rówa się iloczyowi: Podobą
STATYSTYKA I ANALIZA DANYCH
 TATYTYKA I ANALIZA DANYCH Zad. Z pewej partii włókie weły wylosowao dwie próbki włókie, a w każdej z ich zmierzoo średicę włókie różymi metodami. Otrzymao astępujące wyiki: I próbka: 50; średia średica
TATYTYKA I ANALIZA DANYCH Zad. Z pewej partii włókie weły wylosowao dwie próbki włókie, a w każdej z ich zmierzoo średicę włókie różymi metodami. Otrzymao astępujące wyiki: I próbka: 50; średia średica
Podstawy Fizyki IV Optyka z elementami fizyki współczesnej. wykład 23, Radosław Chrapkiewicz, Filip Ozimek
 Podstawy Fizyki IV Optyka z elemetami fizyki współczesej wykład 23, 21.05.2012 wykład: pokazy: ćwiczeia: Czesław Radzewicz Radosław Chrapkiewicz, Filip Ozimek Erest Groder Wykład 22 - przypomieie ieliiowe
Podstawy Fizyki IV Optyka z elemetami fizyki współczesej wykład 23, 21.05.2012 wykład: pokazy: ćwiczeia: Czesław Radzewicz Radosław Chrapkiewicz, Filip Ozimek Erest Groder Wykład 22 - przypomieie ieliiowe
DYNAMIKA UKŁADU PUNKTÓW MATERIALNYCH
 WYKŁAD 3 DYNAMIKA UKŁADU PUNKTÓW MATERIALNYCH UKŁAD PUNKTÓW MATERIALNYCH zbiór skończoej liczby puktów materialych o zadaej kofiguracji przestrzeej. Obłok Oorta Pas Kupiera Pluto Neptu Ura Satur Jowisz
WYKŁAD 3 DYNAMIKA UKŁADU PUNKTÓW MATERIALNYCH UKŁAD PUNKTÓW MATERIALNYCH zbiór skończoej liczby puktów materialych o zadaej kofiguracji przestrzeej. Obłok Oorta Pas Kupiera Pluto Neptu Ura Satur Jowisz
Stara i nowa teoria kwantowa
 Stara i nowa teoria kwantowa Braki teorii Bohra: - podane jedynie położenia linii, brak natężeń -nie tłumaczy ilości elektronów na poszczególnych orbitach - model działa gorzej dla atomów z więcej niż
Stara i nowa teoria kwantowa Braki teorii Bohra: - podane jedynie położenia linii, brak natężeń -nie tłumaczy ilości elektronów na poszczególnych orbitach - model działa gorzej dla atomów z więcej niż
I kolokwium z Analizy Matematycznej
 I kolokwium z Aalizy Matematyczej 4 XI 0 Grupa A. Korzystając z zasady idukcji matematyczej udowodić ierówość dla wszystkich N. Rozwiązaie:... 4 < + Nierówość zachodzi dla, bo 4
I kolokwium z Aalizy Matematyczej 4 XI 0 Grupa A. Korzystając z zasady idukcji matematyczej udowodić ierówość dla wszystkich N. Rozwiązaie:... 4 < + Nierówość zachodzi dla, bo 4
Niepewności pomiarowe
 Niepewości pomiarowe Obserwacja, doświadczeie, pomiar Obserwacja zjawisk fizyczych polega a badaiu ych zjawisk w warukach auralych oraz a aalizie czyików i waruków, od kórych zjawiska e zależą. Waruki
Niepewości pomiarowe Obserwacja, doświadczeie, pomiar Obserwacja zjawisk fizyczych polega a badaiu ych zjawisk w warukach auralych oraz a aalizie czyików i waruków, od kórych zjawiska e zależą. Waruki
Pracownia Fizyczna ćwiczenie PF-10: Badanie widm emisyjnych za pomocą spektroskopu pryzmatycznego
 Pracownia Fizyczna ćwiczenie PF-10: Badanie widm emisyjnych za pomocą spektroskopu pryzmatycznego Instytut Fizyki im. Mariana Smoluchowskiego Uniwersytet Jagielloński 1 Cel ćwiczenia Celem ćwiczenia jest
Pracownia Fizyczna ćwiczenie PF-10: Badanie widm emisyjnych za pomocą spektroskopu pryzmatycznego Instytut Fizyki im. Mariana Smoluchowskiego Uniwersytet Jagielloński 1 Cel ćwiczenia Celem ćwiczenia jest
Podstawy opracowania wyników pomiarów z elementami analizy niepewności pomiarowych
 Podstawy opracowaia wyików pomiarów z elemetami aalizepewości pomiarowych w zakresie materiału przedstawioego a wykładzie orgaizacyjym Pomiary Wyróżiamy dwa rodzaje pomiarów: pomiar bezpośredi, czyli doświadczeie,
Podstawy opracowaia wyików pomiarów z elemetami aalizepewości pomiarowych w zakresie materiału przedstawioego a wykładzie orgaizacyjym Pomiary Wyróżiamy dwa rodzaje pomiarów: pomiar bezpośredi, czyli doświadczeie,
Politechnika Poznańska
 Politechika Pozańska Temat: Laboratorium z termodyamiki Aaliza składu spali powstałych przy spalaiu paliw gazowych oraz pomiar ich prędkości przepływu za pomocą Dopplerowskiego Aemometru Laserowego (LDA)
Politechika Pozańska Temat: Laboratorium z termodyamiki Aaliza składu spali powstałych przy spalaiu paliw gazowych oraz pomiar ich prędkości przepływu za pomocą Dopplerowskiego Aemometru Laserowego (LDA)
ZAGADNIENIE ESTYMACJI. ESTYMACJA PUNKTOWA I PRZEDZIAŁOWA
 ZAGADNIENIE ESTYMACJI. ESTYMACJA PUNKTOWA I PRZEDZIAŁOWA Mamy populację geeralą i iteresujemy się pewą cechą X jedostek statystyczych, a dokładiej pewą charakterystyką liczbową θ tej cechy (p. średią wartością
ZAGADNIENIE ESTYMACJI. ESTYMACJA PUNKTOWA I PRZEDZIAŁOWA Mamy populację geeralą i iteresujemy się pewą cechą X jedostek statystyczych, a dokładiej pewą charakterystyką liczbową θ tej cechy (p. średią wartością
2. Schemat ideowy układu pomiarowego
 1. Wiadomości ogóle o prostowikach sterowaych Układy prostowikowe sterowae są przekształtikami sterowaymi fazowo. UmoŜliwiają płya regulację średiej wartości apięcia wyprostowaego, a tym samym średiej
1. Wiadomości ogóle o prostowikach sterowaych Układy prostowikowe sterowae są przekształtikami sterowaymi fazowo. UmoŜliwiają płya regulację średiej wartości apięcia wyprostowaego, a tym samym średiej
Analiza spektralna widma gwiezdnego
 Analiza spektralna widma gwiezdnego JG &WJ 13 kwietnia 2007 Wprowadzenie Wprowadzenie- światło- podstawowe źródło informacji Wprowadzenie- światło- podstawowe źródło informacji Wprowadzenie- światło- podstawowe
Analiza spektralna widma gwiezdnego JG &WJ 13 kwietnia 2007 Wprowadzenie Wprowadzenie- światło- podstawowe źródło informacji Wprowadzenie- światło- podstawowe źródło informacji Wprowadzenie- światło- podstawowe
201. a 1 a 2 a 3...a n a 2 1 +a 2 2 +a a 2 n n a 4 1 +a 4 2 +a a 4 n n. a1 + a 2 + a a n 204.
 Liczby rzeczywiste dodatie a 1, a 2, a 3,...a spełiają waruek a 1 +a 2 +a 3 +...+a =. Wpisać w kratkę zak lub i udowodić podaą ierówość bez korzystaia z gotowych twierdzeń (moża korzystać z wcześiejszych
Liczby rzeczywiste dodatie a 1, a 2, a 3,...a spełiają waruek a 1 +a 2 +a 3 +...+a =. Wpisać w kratkę zak lub i udowodić podaą ierówość bez korzystaia z gotowych twierdzeń (moża korzystać z wcześiejszych
Światło fala, czy strumień cząstek?
 1 Światło fala, czy strumień cząstek? Teoria falowa wyjaśnia: Odbicie Załamanie Interferencję Dyfrakcję Polaryzację Efekt fotoelektryczny Efekt Comptona Teoria korpuskularna wyjaśnia: Odbicie Załamanie
1 Światło fala, czy strumień cząstek? Teoria falowa wyjaśnia: Odbicie Załamanie Interferencję Dyfrakcję Polaryzację Efekt fotoelektryczny Efekt Comptona Teoria korpuskularna wyjaśnia: Odbicie Załamanie
Wczesne modele atomu
 Wczesne modele atomu Wczesne modele atomu Demokryt (400 p.n.e.) Grecki filozof Demokryt rozpoczął poszukiwania opisu materii około 2400 lat temu. Postawił pytanie: Czy materia może być podzielona na mniejsze
Wczesne modele atomu Wczesne modele atomu Demokryt (400 p.n.e.) Grecki filozof Demokryt rozpoczął poszukiwania opisu materii około 2400 lat temu. Postawił pytanie: Czy materia może być podzielona na mniejsze
Widmo promieniowania
 Widmo promieniowania Spektroskopia Każde ciało wysyła promieniowanie. Promieniowanie to jest składa się z wiązek o różnych długościach fal. Jeśli wiązka światła pada na pryzmat, ulega ono rozszczepieniu,
Widmo promieniowania Spektroskopia Każde ciało wysyła promieniowanie. Promieniowanie to jest składa się z wiązek o różnych długościach fal. Jeśli wiązka światła pada na pryzmat, ulega ono rozszczepieniu,
Promieniowanie X. Jak powstaje promieniowanie rentgenowskie Budowa lampy rentgenowskiej Widmo ciągłe i charakterystyczne promieniowania X
 Promieniowanie X Jak powstaje promieniowanie rentgenowskie Budowa lampy rentgenowskiej Widmo ciągłe i charakterystyczne promieniowania X Lampa rentgenowska Lampa rentgenowska Promieniowanie rentgenowskie
Promieniowanie X Jak powstaje promieniowanie rentgenowskie Budowa lampy rentgenowskiej Widmo ciągłe i charakterystyczne promieniowania X Lampa rentgenowska Lampa rentgenowska Promieniowanie rentgenowskie
Relacje rekurencyjne. będzie następująco zdefiniowanym ciągiem:
 Relacje rekurecyje Defiicja: Niech =,,,... będzie astępująco zdefiiowaym ciągiem: () = r, = r,..., k = rk, gdzie r, r,..., r k są skalarami, () dla k, = a + a +... + ak k, gdzie a, a,..., ak są skalarami.
Relacje rekurecyje Defiicja: Niech =,,,... będzie astępująco zdefiiowaym ciągiem: () = r, = r,..., k = rk, gdzie r, r,..., r k są skalarami, () dla k, = a + a +... + ak k, gdzie a, a,..., ak są skalarami.
Instrukcja do ćwiczeń laboratoryjnych z przedmiotu: Badania operacyjne. Temat ćwiczenia: Problemy transportowe cd, Problem komiwojażera
 Istrukcja do ćwiczeń laboratoryjych z przedmiotu: Badaia operacyje Temat ćwiczeia: Problemy trasportowe cd Problem komiwojażera Zachodiopomorski Uiwersytet Techologiczy Wydział Iżyierii Mechaiczej i Mechatroiki
Istrukcja do ćwiczeń laboratoryjych z przedmiotu: Badaia operacyje Temat ćwiczeia: Problemy trasportowe cd Problem komiwojażera Zachodiopomorski Uiwersytet Techologiczy Wydział Iżyierii Mechaiczej i Mechatroiki
Kwantowe własności promieniowania, ciało doskonale czarne, zjawisko fotoelektryczne zewnętrzne.
 Kwantowe własności promieniowania, ciało doskonale czarne, zjawisko fotoelektryczne zewnętrzne. DUALIZM ŚWIATŁA fala interferencja, dyfrakcja, polaryzacja,... kwant, foton promieniowanie ciała doskonale
Kwantowe własności promieniowania, ciało doskonale czarne, zjawisko fotoelektryczne zewnętrzne. DUALIZM ŚWIATŁA fala interferencja, dyfrakcja, polaryzacja,... kwant, foton promieniowanie ciała doskonale
Ćwiczenie 10/11. Holografia syntetyczna - płytki strefowe.
 Ćwiczeie 10/11 Holografia sytetycza - płytki strefowe. Wprowadzeie teoretycze W klasyczej holografii optyczej, gdzie hologram powstaje w wyiku rejestracji pola iterferecyjego, rekostruuje się jedyie takie
Ćwiczeie 10/11 Holografia sytetycza - płytki strefowe. Wprowadzeie teoretycze W klasyczej holografii optyczej, gdzie hologram powstaje w wyiku rejestracji pola iterferecyjego, rekostruuje się jedyie takie
O3. BADANIE WIDM ATOMOWYCH
 O3. BADANIE WIDM ATOMOWYCH tekst opracowała: Bożena Janowska-Dmoch Większość źródeł światła emituje promieniowanie elektromagnetyczne złożone z wymieszanych ze sobą fal o wielu częstotliwościach (długościach).
O3. BADANIE WIDM ATOMOWYCH tekst opracowała: Bożena Janowska-Dmoch Większość źródeł światła emituje promieniowanie elektromagnetyczne złożone z wymieszanych ze sobą fal o wielu częstotliwościach (długościach).
Modele atomu wodoru. Modele atomu wodoru Thomson'a Rutherford'a Bohr'a
 Modele atomu wodoru Modele atomu wodoru Thomson'a Rutherford'a Bohr'a Demokryt: V w. p.n.e najmniejszy, niepodzielny metodami chemicznymi składnik materii. atomos - niepodzielny Co to jest atom? trochę
Modele atomu wodoru Modele atomu wodoru Thomson'a Rutherford'a Bohr'a Demokryt: V w. p.n.e najmniejszy, niepodzielny metodami chemicznymi składnik materii. atomos - niepodzielny Co to jest atom? trochę
Parametryzacja rozwiązań układu równań
 Parametryzacja rozwiązań układu rówań Przykład: ozwiąż układy rówań: / 2 2 6 2 5 2 6 2 5 //( / / 2 2 9 2 2 4 4 2 ) / 4 2 2 5 2 4 2 2 Korzystając z postaci schodkowej (środkowa macierz) i stosując podstawiaie
Parametryzacja rozwiązań układu rówań Przykład: ozwiąż układy rówań: / 2 2 6 2 5 2 6 2 5 //( / / 2 2 9 2 2 4 4 2 ) / 4 2 2 5 2 4 2 2 Korzystając z postaci schodkowej (środkowa macierz) i stosując podstawiaie
VII. CZĄSTKI I FALE VII.1. POSTULAT DE BROGLIE'A (1924) De Broglie wysunął postulat fal materii tzn. małym cząstkom przypisał fale.
 VII. CZĄSTKI I FALE VII.1. POSTULAT DE BROGLIE'A (1924) De Broglie wysunął postulat fal materii tzn. małym cząstkom przypisał fale. Światło wykazuje zjawisko dyfrakcyjne. Rys.VII.1.Światło padające na
VII. CZĄSTKI I FALE VII.1. POSTULAT DE BROGLIE'A (1924) De Broglie wysunął postulat fal materii tzn. małym cząstkom przypisał fale. Światło wykazuje zjawisko dyfrakcyjne. Rys.VII.1.Światło padające na
I PRACOWNIA FIZYCZNA, UMK TORUŃ WYZNACZANIE PRZYSPIESZENIA ZIEMSKIEGO ZA POMOCĄ WAHADŁA RÓŻNICOWEGO
 I PRACOWNIA FIZYCZNA, UMK TORUŃ Istrukcja do ćwiczeia r WYZNACZANIE PRZYSPIESZENIA ZIEMSKIEGO ZA POMOCĄ WAHADŁA RÓŻNICOWEGO Istrukcję wykoał Mariusz Piwiński I. Cel ćwiczeia. pozaie ruchu harmoiczeo oraz
I PRACOWNIA FIZYCZNA, UMK TORUŃ Istrukcja do ćwiczeia r WYZNACZANIE PRZYSPIESZENIA ZIEMSKIEGO ZA POMOCĄ WAHADŁA RÓŻNICOWEGO Istrukcję wykoał Mariusz Piwiński I. Cel ćwiczeia. pozaie ruchu harmoiczeo oraz
