C 3 H 7 Cl CH 3 CH 2 CH 2 Cl C 7 H 14 CH 3 CHCH 3. C C H Cl CH 3 OCH 3 H F. Br F IZOMERIA IZOMERY KONSTYTUCYJNE I STEREOIZOMERY CH 3
|
|
|
- Izabela Baran
- 8 lat temu
- Przeglądów:
Transkrypt
1 IZMEIA IZMEY KNSTYTUYJNE I STEEIZMEY BUTAN 3 3 METYLPPAN 3 7 l l 1-LPPAN l LPPAN ETANL 3 3 ETE DIMETYLWY IZMEIA IZMEY KNSTYTUYJNE I STEEIZMEY l l l 2 2 l 2 l 7 14 E-1,2-DILETEN 3 3 Z-1,2-DILETEN 3 trans-1,3-dimetylyklpentan cis-1,3-dimetylyklpentan 3 IZMEY GEMETYZNE IZMEY KNSTYTUYJNE STEEIZMEY IZMEY związki o takim samym wzorze sumarycznym DIASTEEIZMEY stereoizomery nie będące enancjomerami ENANJMEY stereoizomery, między którymi zachodzi relacja przedmiot jego odbicie lustrzane l l IZMEY KNSTYTUYJNE izomery różniące się sposobem połączenia atomów ze sobą STEEIZMEY związki o takiej samej konstytucji; różnią się rozmieszczeniem atomów w przestrzeni Z- i E-2-buten F F DIASTEEIZMEY stereoizomery nie będące enancjomerami ENANJMEY stereoizomery, między którymi zachodzi relacja przedmiot jego odbicie lustrzane cis- i trans-1,4-cykloheksanodiol 1
2 IZMEIA PTYZNA l l IZMEIA PTYZNA l l ś symetrii obrót o kąt n wokół osi n- krotnej powoduje przekształcenie cząsteczki w cząsteczkę identyczną ZĄSTEZKI IALNE I I σ l l 3 lustro Płaszczyzna symetrii płaszczyzna, która przecina przedmiot lub cząsteczkę w ten sposób, że jedna połowa jest odbiciem lustrzanym drugiej połowy. ENANJMEY stereoizomery, między którymi zachodzi relacja przedmiot jego odbicie lustrzane ZĄSTEZKI NIE SĄ IDENTYZNE taki sam wzór sumaryczny STEEIZMEY taka sama konstytucja różne rozmieszczenie atomów przestrzeni IZMEIA PTYZNA ZĄSTEZKA JEST IALNA WTEDY, GDY NIE PSIADA INWESYJNEJ SI SYMETII, tzw. NIEWŁAŚIWEJ PZYZYNY IALNŚI ZĄSTEZEK: * ENTUM STEEGENNE dawniej ASYMETII * Ś IALNA * PŁASZZYZNA IALNA 1960r. ahn, Ingold i Prelog eguły pierwszeństwa podstawników: uniwersalna metoda przypisywania konfiguracji /S każdemu związkowi organicznemu 1. Jeżeli cztery atomy połączone z centrum stereogennym są różne, to pierwszeństwo zależy od liczby atomowej atomu połączonego z centrum stereogennym; im większa liczba atomowa, tym starszy podstawnik; dla izotopów im cięższy tym starszy;np.: I > > l > > 3 2 > 3 > D > > : ZĄSTEZKA IALNA 2. Jeżeli nie można ustalić pierwszeństwa podstawników w oparciu o regułę 1, to należy w analogiczny sposób rozpatrywać następne atomy, np. chlorek sec-butylu l > 3, 3 2 > ZĄSTEZKA AIALNA l (,, ) < (,, ) KNFIGUAJA charakterystyczne dla danego stereoizomeru rozmieszczenie atomów w przestrzeni 4 (S)-2-chlorobutan chlorek (S)-sec-butylu l > 3 2 > 3 > 2
3 eguły pierwszeństwa podstawników: 3. W przypadku podstawników z wiązaniami wielokrotnymi, atomy połączone takim wiązaniem rozpatruje się jako podwojone lub potrojone 2 rozpatrujemy jako 2 >, 2 > (,,) (,,) rozpatrujemy jako > > 2 > > 2 > 1960r. ahn, Ingold i Prelog uporządkowanie podstawników powiązanych z centrum stereogenicznym zgodnie ze starszeństwem > 3 2 > 3 > uniwersalna metoda przypisywania konfiguracji /S każdemu związkowi organicznemu zorientowanie cząsteczki tak, aby podstawnik najmłodszy był najbardziej oddalony od obserwatora zatoczyć łuk od podstawnika najstarszego poprzez średni do młodszego łuk zgodny z ruchem wskazówek zegara konfiguracja łuk niezgodny z ruchem wskazówek zegara konfiguracja S r. Emil Fischer projekcja asymetrycznego atomu węgla na płaszczyźnie uporządkowanie podstawników powiązanych z centrum stereogenicznym zgodnie ze starszeństwem F l l F l parzysta liczba zmian podstawników tak, aby podstawnik najmłodszy zajmował pozycję w dole wzoru > l > F > 1 ZMIANA 2 ZMIANA l S F l ZUTWANIE NA PŁASZZYZNĘ l F l F F l F l l F zatoczyć łuk od podstawnika najstarszego poprzez średni do młodszego łuk niezgodny z ruchem wskazówek zegara konfiguracja S łuk zgodny z ruchem wskazówek zegara konfiguracja F l S 3
4 IZMEIA PTYZNA ENANJMEY 3 ()-2-BUTANL (S)-2-BUTANL Jakub van t off postulował: 1. Związki węgla, posiadające asymetryczny atom węgla są chiralne 2. Pochodne chiralnych związków węgla tracą zdolność skręcania płaszczyzny światła spolaryzowanego wtedy, gdy zanika asymetria wszystkich atomów węgla TEMP. WZENIA GĘSTŚĆ [g/ml] WSPÓŁ. ZAŁ SKĘALNŚĆ WŁ [ α ] 20 = α D c l Gdzie: α skręcalność obserwowana c stężenie roztworu badanego [g/ml] l długość drogi światła [dm] 2 2 ENANJMEY IDENTYZNE WŁAŚIWŚI FIZYZNE I EMIZNE ALE ÓŻNE KIEUNKI SKĘANIA PŁASZYZNY ŚWIATŁA SPLAYZWANEG KŁW 2 3. Związki posiadające asymetryczne atomy węgla nie muszą być chiralne IZMEIA PTYZNA n centrów stereogenicznych 2 n stereoizomerów 3 3 optycznie czynne forma mezo obrot o 180 cholesterol 28 = 256 stereoizomerów identyczne struktury 4
5 IZMEIA PTYZNA IZMEIA PTYZNA n liczba centrów stereogennych 2 n maksymalna liczba stereoizomerów n liczba centrów stereogennych 2 n maksymalna liczba stereoizomerów 3 S S S S 23 3 S l l S 3 3 l l 3 l l 3 S 3 3 S l l 3 ENANJMEY ENANJMEY STUKTUY SĄ IDENTYZNE P BIE 180 mezoachiralna IZMEIA PTYZNA IZMEIA PTYZNA WŁAŚIWŚI FIZYZNE KWASÓW WINWY MIESZANINA AEMIZNA składa się z jednakowych ilości cząsteczek każdego z enancjomerów; jest achiralna KWAS WINWY [ α ] 20 D temp. top. [ ] IĘŻA WŁ. ZPUSZZALNŚĆ w 2 [g/100ml] powstaje na skutek: mechanicznego zmieszania czystych enancjomerów reakcji, np. przyłączanie do wiązań podwójnych halogenowodoru racemizacji enancjomeru AEMAT związek racemiczny różni się właściwościami fizycznymi od enancjomerów; siatka krystaliczna racematu składa się z cząsteczek obu enancjomerów mezo ( ) (+) (±) mezo- 5
6 ALGENPDNE WĘGLWDÓW sp 3 X ALGENKI ALKILWE 3 I jodometan; jodek metylu 2 l 2 = 2 l 3 2 bromek benzylu chlorocykloheksan; chlorek cykloheksylu 3-chloro-1-propen; chlorek allilu AYLWE 3 sp 2 = X ALGENKI bromobenzen p- fluorotoluen l 2- chloronaftalen F F ; l ; ; I WINYLWE 2 = l chloroeten; chlorek winylu bromo-2-penten 3 3 l (E)-2-chloro-2-buten ALGENPDNE WĘGLWDÓW 1 2 l l chlorek 1 chlorek 2 chlorek etylu 2-chloropropan F ; l ; ; I l chlorek 3 chlorek tert-butylu 3 1-bromo-2-metylopropan ALGENPDNE WĘGLWDÓW sp 3 X F ; l ; ; I ALGENPDNE WĘGLWDÓW WŁAŚIWŚI FIZYZNE: F ; l ; ; I +δ δ stan skupienia w temp. pokojowej ciecze; z wyjątkiem 3 l i 3, które są gazami DŁUGŚĆ WIĄZANIA WĘGIEL ALGEN temp. wrzenia: 3 l > 3 > 3 l > 3 F 3 F 3 l 3 3 I 1.39 Å 1.78 Å 1.93 Å 2.14 Å wrażliwe na światło pod wpływem światła często ulegają rozkładowi nie rozpuszczają się w wodzie: chloroalkany lżejsze od wody bromo i jodoalkany cięższe od wody lotne halogenoalkany są lakrymatorami 6
7 ALGENPDNE WĘGLWDÓW F ; l ; ; I ALGENPDNE WĘGLWDÓW F ; l ; ; I TZYMYWANIE TZYMYWANIE EAKJE PZYŁĄZENIA LWA LUB LWWDU D ALKENÓW EAKJE PDSTAWIENIA LWEM ATMU WDU W ALKANA A = 2 + X E 3 A = X S + X 2 X + X hν PZYKŁADY S 4 + l 2 3 l + l hν A = 2 + X E 2 2 X X + 2 S hν + ALGENPDNE WĘGLWDÓW F ; l ; ; I ALGENPDNE WĘGLWDÓW F ; l ; ; I TZYMYWANIE TZYMYWANIE EAKJE WYMIANY LWA EAKJE PDSTAWIENIA GUPY YDKSYLWEJ W ALKLA l + K aceton + Kl + X X Sl 2 l + l + S 2 l + KI aceton I + Kl aceton + KI I + K + Pl 5 l + l + Pl 3 + P P 3 PZYKŁADY ( 3 ) 3 + l ( 3 ) 3 l + 2 l I + P 3 + 3P3 KIEUNEK WYMIANY Sl l + l + S 2 7
8 ALGENPDNE WĘGLWDÓW EAKJE F ; l ; ; I SUBSTYTUJA NUKLEFILWA SZYBKŚĆ I MEANIZM SUBSTYTUJI NUKLEFILWEJ ZALEŻĄ D: 1. EAKJE Z DZYNNIKAMI NUKLEFILWYMI DZAJU I STĘŻENIA NUKLEFILA Nu + X Nu + X BUDWY I STĘŻENIA SUBSTATU ALGENKU ALKILWEG INNY ZYNNIKÓW ZPUSZZALNIKA, TEMPEATUY, ITP. NUKLEFIL PDUKT SUBSTAT ALGENEK ALKILU GUPA DDZĄA JN ALGENKWY SUBSTYTUJA NUKLEFILWA NUKLEFILE cząstki obojętne lub naładowane ujemnie z niewiążącą parą elektronów zdolną do utworzenia wiązania 2,,,, S, S, N SUBSTYTUJA NUKLEFILWA GUPY DDZĄE Atom węgla z cząstkowym ładunkiem dodatnim miejsce ataku nukleofila δ+ δ X l I LEPSZA GUPA DDZĄA elektroujemny atom halogenu polaryzuje wiązanie X N 3, N 2, 2 N N S, S I l 3 2 δ+ δ Nu X Nu + X NUKLEFILWŚĆ GUPY DDZĄA 8
9 SUBSTYTUJA NUKLEFILWA δ+ δ X SUBSTYTUJA NUKLEFILWA JEDNETAPWA, DWUZĄSTEZKWA S N 2 3 l , l - elektroujemny atom halogenu polaryzuje wiązanie X KINETYKA reakcja II rzędu v = k [X] [Nu] heterolityczny rozpad wiązanie X równoczesne pękanie wiązania X i tworzenia wiązania Nu S N 2 MEANIZM proces synchroniczny, jednoetapowy, dwucząsteczkowy pękanie wiązania X i tworzenia wiązania Nu zachodzi kolejno S N 1 proces dwuetapowy, jednocząsteczkowy δ+ δ l δ δ l + l SUBSTYTUJA NUKLEFILWA JEDNETAPWA, DWUZĄSTEZKWA S N 2 SZYBKŚĆ EAKJI S N 2 zależy od: SUBSTYTUJA NUKLEFILWA JEDNETAPWA, DWUZĄSTEZKWA S N 2 SZYBKŚĆ EAKJI S N 2 zależy od: rodzaju grupy odchodzącej SZYBKŚĆ EAKJI S N 2 l I LEPSZA GUPA DDZĄA rodzaju nukleofila budowy reszty alkilowej substratu > 2 > >> SZYBKŚĆ EAKJI S N 2 reakcję spowalniają także wszelkie rozgałęzienia na atomie węgla β rozpuszczalnika N S, S SZYBKŚĆ EAKJI S N 2 I l 3 2 ZPUSZZALNIKI PTNWE alkohole, woda zmniejsza charakter nukleofilowy reagenta NUKLEFILWŚĆ ZPUSZZALNIKI APTNWE DMS, DMF, acetonitryl KZYSTNIEJSZY DLA EAKJI S N 2 9
10 SUBSTYTUJA NUKLEFILWA DWUETAPWA, JEDNZĄSTEZKWA S N 1 SUBSTYTUJA NUKLEFILWA DWUETAPWA, JEDNZĄSTEZKWA S N 1 MEANIZM ( 3 ) 3 l ( 3 ) l - ETAP 1 ( 3 ) 3 l ( 3 ) l - 3 δ+ 3 3 δ l wolno l 3 ETAP szybko ETAP szybko SUBSTYTUJA NUKLEFILWA DWUETAPWA, JEDNZĄSTEZKWA S N 1 KINETYKA reakcja I rzędu Do reakcji biegnących mechanizmem S N 1 należą procesy solwolizy ALGENPDNE WĘGLWDÓW EAKJE F ; l ; ; I v = k [X] SZYBKŚĆ S N 1 zależy od: SZYBKŚĆ EAKJI S N 1 NIE ZALEŻY D STĘŻENIA Nu budowy reszty alkilowej substratu < 2 < < SZYBKŚĆ EAKJI S N 1 rodzaju grupy odchodzącej 2. EAKJE Z ZASADAMI + B + B + X X ZASADA DEYDALGENWANIE SZYBKŚĆ EAKJI S N 1 l I LEPSZA GUPA DDZĄA 10
11 ELIMINAJA E2 proces synchroniczny, jednoetapowy, dwucząsteczkowy EAKJA MEANIZM β α 3 δ δ ELIMINAJA E2 SZYBKŚĆ EAKJI E2 zależy od: stężenia zasady oraz X rodzaju grupy odchodzącej SZYBKŚĆ EAKJI E2 l I LEPSZA GUPA DDZĄA KINETYKA reakcja II rzędu v = k [X] [B] budowy reszty alkilowej substratu < 2 < < SZYBKŚĆ EAKJI E2 temperatury szybkość reakcji E rośnie ze wzrostem temperatury ELIMINAJA E2 SZYBKŚĆ EAKJI E2 zależy od: mocy zasady ELIMINAJA E2 Wymagania steryczne E2 atomy eliminowane wodoru oraz chlorowca muszą leżeć w jednej płaszczyźnie tzn. anti względem siebie ZASADWŚĆ NUKLEFILWŚĆ N 2 > > > > 2 i antiperiplanarne E2 rodzaj zasady SZYBKŚĆ EAKJI E2 ( 3 ) 3 - K + > 3 - Na + E2 i diaksjalne 11
12 ELIMINAJA EGUŁA ZAJEWA w reakcji eliminacji halogenowodoru proton odszczepiany jest w ten sposób, aby powstał bardziej stabilny alken (czyli odrywa się od tego atomu węgla β, który powiązany jest z mniejszą liczbą atomów wodoru) ELIMINAJA E1 proces dwuetapowy, jednocząsteczkowy EAKJA 2 + ( 3) 3l MEANIZM l - 3 B = = buten główny produkt 1-buten ETAP 1 ETAP l 2 wolno l 3 KINETYKA reakcja I rzędu v = k [X] 2 β 3 α 3 szybko S N 2 czy E2 S N 2 czy E Na = 3 (-Na) 2 5 E2 + Nu + X: - 2 S N 2 21% E2 79% ALGENEK :Nu - β α X S N 2 Nu + X: Na = 2 (-Na) S N 2 90% S N 2 E2 E2 10% 12
13 S N 2 czy E Na (-Na) = T S N 2 9% E2 91% Na = 3 (-Na) E2 + E1 100% T E E2 3 S N 2 czy E ( 2 ) ZASADA 1 - E2 85% ( 3 ) 3 40 (-K) 3 ( 2 ) 15 = ( 2 ) E ( 2 ) (-Na) S N 2 15% ( 2 ) 15 = ( 2 ) E2 1% S N 2 S N 2 99% ALGENPDNE WĘGLWDÓW F ; l ; ; I S N 1 czy E1 E1 + EAKJE 3. EAKJE Z AKTYWNYMI METALAMI EAKJA WÜTZ A 3 X wolno β α + X 2 2 X + 2 Na NaX EAKJA GIGNAD A 2 X + Mg 2 MgX 2 2 SYNTEZA EY A X + 2 Li Li + LiX S N Li + ui 2 uli + LiI 2 uli + X + u + LiX 13
14 ALGENPDNE WĘGLWDÓW EAKJE F ; l ; ; I ALGENPDNE WĘGLWDÓW ALGENKI AMATYZNE sp 2 = X F ; l ; ; I WZMNIENIE WIĄZANIA X WYNIKA Z : 4. EAKJE EDUKJI Ni X X mniejszej różnicy elektroujemności pomiędzy atomami sp 2 i X sprzężenia wolnej pary elektronów atomu halogenu z pierścieniem NIEULIWY ALGEN mała reaktywność aromatycznych halogenków w reakcjach S N oraz E ALGENPDNE WĘGLWDÓW ALGENKI AMATYZNE sp 2 = X F ; l ; ; I ALGENPDNE WĘGLWDÓW ALGENKI AMATYZNE sp 2 = X F ; l ; ; I Własności fizyczne bezbarwne, słabo polarne ciecze nierozpuszczalne w wodzie; zazwyczaj o większej gęstości od wody trzymywanie Własności chemiczne reakcja z metalami + Mg eter Mg S Earom reakcja Sandmeyer a S Earom -I mniejsza reaktywność pierścienia +M kieruje podstawniki w pozycje o- i p- N 2 N 2/l N2 + l - ul l N 3/ 2S 4 2N + N2 14
15 EBIYDY I INSEKTYYDY EBIYDY 2 l l l l 3 l + 2 kukurydza, trzcina cukrowa, ananasy bawełna, trzcina cukrowa pomidory, buraki cukrowe, fasola, bawełna EBIYDY 2 l l KWAS 2,4-DILFENKSYTWY dichlorodifenylotrichloroetan DDT l 2 l l KWAS 2,4,5-TILFENKSYTWY l N N N N N atrazyna F3 N N fluorometuron 3 N 2N N2 F3 trifluralin l N N l l S2 N N N 3 l l chlorosulfuron 2,3,6,7-TETALDIBENZDIKSYNA zboża ZWIĄZKI GANIZNE ZAWIEAJĄE W STUKTUZE ATMY TLENU ALKLE ETEY 8 1s2 2s 2 2p 4 okres 2; grupa VI w związkach jest dwuwiążący, z dwoma niewiążącymi parami elektronów drugi w skali elektroujemności Paulinga 3.5 (za fluorem) / = alkil / = alkil ' z węglem tworzy wiązania kowalencyjne, spolaryzowane GUPA KABNYLWA GUPA YDKSYLWA sp 3 FENLE Ar Ar / Ar = aryl / Ar = aryl / Ar = aryl Ar Ar Ar sp 2 15
16 ALKLE NMENKLATUA ALKLE NMENKLATUA nazwa najdłuższego łańcucha zawierającego grupę hydroksylową staje się rdzeniem, do którego dodaje się końcówkę -ol 3 metanol fenylo-2-pentanol ,4-dimetylo-1-pentanol penten-2- ol alkohol tert-butylowy lokant atomu węgla połączonego z grupą hydroksylową jak najniższy 2 2 alkohol benzylowy 1 3 gdy w związku jest więcej grup hydroksylowych przed końcówką ol dodaje się łaciński liczebnik mówiący o ilości grup hydroksylowych, np. diol, -triol, itd ,2-etanodiol glikol etylenowy trans-1,3-cykloheksanodiol 1,3-butanodiol cis-1,3-cyklopentanodiol 22 1,2,3-propanotriol gliceryna 1,2,4,5-cykloheksanotetraol 2-metylo-2-propanol FENLE NMENKLATUA WŁAŚIWŚI FIZYZNE ALKLE zwykle nazywane jako pochodne związku macierzystego l 3 o-chlorofenol FENL 2,4,6-tribromofenol 3 o-krezol m-krezol sp 3 µ = 1.5 D wiązania i są kowalencyjne i spolaryzowane α kąt walencyjny α cząsteczka posiada wypadkowy moment dipolowy cząsteczki alkoholi oddziałują ze sobą wiązaniami wodorowymi 2N 3 WIĄZANIA WDWE p-nitrofenol p-krezol 16
17 WŁAŚIWŚI FIZYZNE ALKLE WŁAŚIWŚI FIZYZNE ALKLE WŁAŚIWŚI YDFILWE WIĄZANIA WDWE kj/mol : g/100ml 2 wysokie temperatury wrzenia M cz t w t w dobra rozpuszczalność w wodzie charakter hydrofilowy WŁAŚIWŚI YDFBWE g/100ml 2 TZYMYWANIE ALKLE TZYMYWANIE ALKLE 1. TZYMYWANIE ALKLI Z ALKENÓW ADDYJA BWDU D ALKENU YDBWANIE ALKENÓW B 2 δ + δ B 2 tzw. ANTYMAKWNIKW B 2 2 / - alkohol niżej rzędowy 1. TZYMYWANIE ALKLI Z ALKENÓW PZYKŁADY 1. g(ac) 2 / TF NaB 4, ,3-dimetylo-2-butanol ,3-dimetylo-1-buten KSYTĘIWANIE ALKENÓW 3 1. (B 3 ) , g( 3 - ) 2 TF NaB 4 - g( 3) 3,3-dimetylo-1-butanol alkohol wyżej rzędowy 17
18 TZYMYWANIE ALKLE TZYMYWANIE ALKLE 1. TZYMYWANIE ALKLI Z ALKENÓW PZYKŁADY 2. TZYMYWANIE ALKLI Z ALGENALKANÓW hydroliza halogenków alkilowych 1. g(ac) 2 / TF 2 2. NaB 4, metylocykloheksanol I l S N + I - - l - metylocykloheksen 1. (B 3 ) , - trans-2-metylocykloheksanol TZYMYWANIE ALKLE WŁAŚIWŚI EMIZNE ALKLE 3 I 3. TZYMYWANIE ALKLI ZE ZWIĄZKÓW KABNYLWY redukcja ketonów ' [] ' []: 2, Ni NaB 4 reakcja przyłączania związków metaloorganicznych do grupy karbonylowej Mg, eter δ δ+ 3 MgI 3 ' l/ ' 2 - Mg + 3 ' +δ +δ A silny kwas δ ZASADA / NUKLEFIL protonowany alkohol kation oksoniowy SN 2 + A + 2 nukleofil protonowany alkohol 2+ dobra grupa odchodząca protonowany eter kation oksoniowy 18
19 ALKLE ALKLE WŁAŚIWŚI EMIZNE WŁAŚIWŚI EMIZNE 1. WŁAŚIWŚI KWASW ZASADWE ALKLI ALKL słaby kwas K a WŁAŚIWŚI KWASW ZASADWE ALKLI K (Na) 2 - Na WDA K a KWASWŚĆ ALKL silniejszy kwas niż AMNIAK ALKL słabszy kwas niż WDA - Na Na ZASADWŚĆ + NaN 2 - Na + + N 3 ALKLE ALKLE WŁAŚIWŚI EMIZNE WŁAŚIWŚI EMIZNE 1. WŁAŚIWŚI KWASW ZASADWE ALKLI EAKJE ALKLI Z KWASAMI NIEGANIZNYMI, np. 2 S 4 1. WŁAŚIWŚI KWASW ZASADWE ALKLI EAKJE ALKLI Z KWASAMI GANIZNYMI, np (2)32 3(2)32 3( 2) 3 2 S N K ESTE E 322=2 + 3( 2) () 3 3 K = [ESTE] [ 2 ] [] [ 2 ] - + 3( 2) ()
20 WŁAŚIWŚI EMIZNE ALKLE WŁAŚIWŚI EMIZNE ALKLE 1. WŁAŚIWŚI KWASW ZASADWE ALKLI EAKJE ALKLI Z KWASAMI ALGENWDAMI, np. l, 2. EAKJE ALKLI Z ALGENKAMI FSFU I SIAKI 3 + P P 3 dla alkoholi 1 i X X X: I,, l 2 X Pl 5 l + Pl Sl 2 l + S 2 + l PZYKŁADY PZYKŁADY l 3 l % 3 3 chlorek tert-butylu ( 3) % (3) bromek izobutylu 2 ( 3) 2 2 Sl 2 2l + S 2 + l 91% chlorek benzylu -10, 4h + P 5 ( 3) P 3 60% bromek izobutylu ALKLE WŁAŚIWŚI EMIZNE 3. EAKJE UTLENIANIA ALKLI dla alkoholi 1 r 3 l Pyr P [] : u, 300 r 3 KMn 4, 2, WYSTĘPWANIE FENLE Urusiole substancje parząca izolowane z toksyn bluszczu gdzie = ( 2) 14 3 ( 2) 7=( 2) 5 3 ( 2) 7= 2=( 2) 2 3 aminokwas tyrozyna [] [] N 3 + dla alkoholi 2 [] 3 żeński hormon płciowy estradiol Y 3 Z N(3) 2 N 2 gdzie Y = l, Z = aureomycyna Y =, Z = terramycyna antybiotyki z rodziny tetracyklin 20
21 TZYMYWANIE FENLE TZYMYWANIE FENLE 1. IZLWANIE FENLI ZE ŹÓDEŁ NATUALNY 3 3. YDLIZA ALGENKÓW AMATYZNY D FENLI EUGENL goździki 3 3 IZEUGENL gałka muszkatołowa TYML mięta, tymianek X X: lub l 10% Na 350, 200 atm - Na + 2 / 2 -Na 3 2. IZLWANIE FENLI ZE SMŁY PGAZWEJ podczas suchej destylacji węgla dla podstawionych halogenków arylowych reakcja niejednoznaczna X 1. Na, 2. 2, 2 + fenol 3 o-, m-, p-krezol o- oraz m-krezol TZYMYWANIE FENLE WŁAŚIWŚI EMIZNE FENLE 4. STAPIANIE SLI AENSULFNWY Z ALKALIAMI 1. WŁAŚIWŚI KWASW ZASADWE FENLI - + S3 Na staly Na Na + 2 / 2 -Na 3 FENLE silniejsze kwasy od alkoholi i wody 5. TZYMYWANIE FENLI PPZEZ SLE DIAZNIWE NaN 2/ l + 2, N2 N 0 2 l - + N 2 6. TZYMYWANIE FENLU METDĄ KUMENWĄ + 3=2 3P 4 SE (3)2 2 powietrze 3 3 KUMEN 3 2S FENL 3 AETN ALE JN FENLANWY + Na Na Na BAK EAKJI JN ALKLANWY pka FENL 9.89 WDA ( 3 )
22 WŁAŚIWŚI EMIZNE FENLE WŁAŚIWŚI EMIZNE FENLE 2. EAKJE ALKILWANIA FENLI 3. EAKJE AYLWANIA FENLI Na S N Na I NaI ANIZL (metoksybenzen) I 3 + l octan fenylu Na Na 3 I 2 3 S N + NaI 3 p-etoksytoluen UWAGA + BAK EAKJI WŁAŚIWŚI EMIZNE FENLE WŁAŚIWŚI EMIZNE FENLE 4. EAKJE S Earom FENLI PDSTAWNIK I DZAJU kieruje następny podstawnik w pozycje o- i p- aktywuje na reakcje S Earom 4. EAKJE S Earom FENLI 2 / 2 2,4,6-tribromofenol EAKTYWNŚĆ W EAKJI S Earom 96% 2S 4 temp. pokoj. kwas o- i p-hydroksybenzenosulfonowy S3 + S 3 20% N N 2 + 2N 2N N 2 N 2 kwas pikrynowy 22
23 WŁAŚIWŚI EMIZNE FENLE ETEY 5. EAKJE UTLENIANIA FENLI Mn VI lub r VI e - - 2e - / = alkil / Ar = aryl ' Ar Ar Ar SYMETYZNE, np. 3 3 NIESYMETYZNE, np. 23 YKLIZNE, np. TETAYDFUAN KSIAN 1,4-DIKSAN NMENKLATUA ETEY nazwy tworzy się zazwyczaj przez podanie po słowie eter nazw dwóch grup w formie przymiotnikowej wg kolejności alfabetycznej ETE ETYLWMETYLWY ETE DIETYLWY 3 ETE tert-butylwfenylwy METKSYETAN ETKSYETAN tert-butksybenzen WŁAŚIWŚI FIZYZNE ETEY wiązania są kowalencyjne i spolaryzowane α kąt walencyjny α 110 cząsteczka posiada wypadkowy moment dipolowy µ = 1.2D; jest słabo polarna temp. wrzenia eterów są zbliżone do temp. wrzenia alkanów o tej samej masie cząsteczkowej IUPA jeżeli jedna z grup nie ma prostej nazwy, to należy związek traktować jako pochodną alkoksylową Mcz 1-butanol eter dietylowy pentan tw 3 3 1,3,5-TIMETKSYBENZEN 2 3 trans-3-etksyykleksanl ETKSYPENTAN cząsteczki eterów o małych podstawnikach są solwatowane przez cząsteczki wody; ale już eter dietylowy jest nierozpuszczalny w wodzie; wyjątek: etery cykliczne ETEY SĄ NIEEAKTYWNE EMIZNIE 23
24 TZYMYWANIE ETEY TZYMYWANIE ETEY 1. SYNTEZA WILLIAMSNA TZYMYWANIA ETEÓW 1. SYNTEZA WILLIAMSNA TZYMYWANIA ETEÓW METDA UNIWESALNA Na lub Ar Na + ' X ' lub Ar ' + X 1 ( 3) 2 Na ( 3) Na SN ( 3) X: l,, I E : 3 > 1 > Na TZYMYWANIE ETEY TZYMYWANIE ETEY 1. SYNTEZA WILLIAMSNA TZYMYWANIA ETEÓW 1. SYNTEZA WILLIAMSNA TZYMYWANIA ETEÓW PZYKŁADY Na Na SN Na 3 2 Na Na ETE BENZYLWETYLWY Na + ETE FENYLWIZBUTYLWY Na Na + ( 3) 2 2 2( 3) 2 NIEULIWY LWIE + Na 24
25 TZYMYWANIE ETEY 2. TZYMYWANIE ETEÓW SYMETYZNY PZEZ DWDNIENIE ALKLI ETEY WŁAŚIWŚI EMIZNE 1. EAKJE AYDLIZY ETEÓW, tzw. rozszczepianie eterów pod działaniem kwasów MNE KWASY: lub I ANINY BADZ DBE NUKLEFILE 3( 2) 2 2 rozc. 2S 4 t < 130 E t >130 3( 2) ( 2) 2 2 SN t <130 ' + X ' + X X + ' ' X + 2 X (2)22 2(2) Ar + X X + Ar 3 ( 2 ) ( 2 ) Ar Ar + X ETEY WŁAŚIWŚI EMIZNE 2. EAKJE AUTKSYDAJI ETEÓW dotyczy eterów z α ETEY YKLIZNE EPKSYDY TZYMYWANIE 1. EAKJA KATALITYZNEG UTLENIANIA ETENU TLENEM (z powietrza) α 2 + n 2 2 2, Ag EAKJA WEWNĄTZZĄSTEZKWEJ S N ALGENYDYN (wobec stężonych zasad) 2 3 l2/2 2 3 S N 2 3 l 25
26 EPKSYDY TZYMYWANIE 3. EAKJA UTLENIANIA ALKENÓW NADKWASAMI E 3 3 l trans-epksybutan tlenek trans-2-butenu 3 3 EPKSYDY EAKJE TWIEANIA PIEŚIENIA 1. EAKJE TWIEANIA PIEŚIENIA KATALIZWANE KWASAMI Nu + + ADDYJA anti- Z 3 3 l Nu Nu - + cis-epksybutan tlenek cis-2-butenu EPKSYDY EAKJE TWIEANIA PIEŚIENIA EPKSYDY EAKJE TWIEANIA PIEŚIENIA 1. EAKJE TWIEANIA PIEŚIENIA KATALIZWANE KWASAMI 2. EAKJE TWIEANIA PIEŚIENIA KATALIZWANE ZASADAMI / bromoetanol 1,2-etanodiol 2 5 / + / etoksyetanol 22 2-fenoksyetanol 26
27 EPKSYDY EAKJE TWIEANIA PIEŚIENIA PÓWNANIE EPKSYDY EAKJE TWIEANIA PIEŚIENIA EPKSYD NIESYMETYZNY /Et Et Et Et 2-ETKSY-2-METYL-1-PPANL Et - /Et Et Et 3 3 Et 2 + Et - 1-ETKSY-2-METYL-2-PPANL ETEY JAK ZPUSZZALNIKI ZWIĄZKI MAGNEZGANIZNE tzw. ZWIĄZKI GIGNADA TZYMYWANIE ZWIĄZKÓW GIGNADA ZPUSZZALNIK X + Mg MgX ZPUSZZALNIK tw 36 TF tw 54 STUKTUA ZWIĄZKÓW GIGNADA X 2 Mg Mg X Et Et Et Et EAKTYWNŚĆ allil, benzyl alkil aryl winyl X I l EAKTYWNŚĆ MgX δ +δ 2 MgX WIĄZANIE KWALENYJNE SPLAYZWANE 27
28 EAKJE ZWIĄZKÓW GIGNADA 1. ULIWY WDÓ 2 MgX MgX() 2 MgX MgX() EAKJE ZWIĄZKÓW GIGNADA 2. PIEWIASTKI l/ 2 MgX MgX Mgl 2 l/ 2 MgX + S 8 2 S MgX 2 2 S + Mgl 2 2 MgX + N MgX(N 2 ) 2 MgX MgX() 2 MgX + I 2 2 I + MgX 2 3. EPKSYDY 2 MgX MgX MgX 2 2 l/ Mgl2 MgX EAKJE ZWIĄZKÓW GIGNADA 4. ZWIĄZKI KABNYLWE +δ δ δ +δ MgX + MgX 3 + / 2 PZYKŁADY 3 + 3Mgl + 3 2Mgl Mgl 3 l 3 Mgl 2 3 l + Mgl Mgl 2 23 EAKJE ZWIĄZKÓW GIGNADA 4. ZWIĄZKI KABNYLWE PDSUMWANIE METANAL 2 = + MgX 2 ALKL 1 ALDEYDY KETNY " + MgX + MgX ' " ' ALKL 2 ALKL Mgl 3 Mgl l 3 + Mgl DWUTLENEK WĘGLA == + MgX KWAS KABKSYLWY 28
29 EAKJE ZWIĄZKÓW GIGNADA ETEY KNWE 5. PDNE KWASWE [x]korona-y + 3Mgl Z Mgl 3 3 l Mgl2 gdzie x - liczba atomów tworzących pierścień y liczba atomów tlenu w pierścieniu gdzie: Z = l, [18]korona-6 dibenzo[18]korona-6 [12]korona-4 [15]korona-5 tt tt. 164 tt. 16 ciecz ETEY KNWE ETEY KNWE średnica niszy nm średnica jonu Na nm jon K + jest kompleksowany średnica jonu K + średnica jonu s nm nm K + Mn 4 - NNAKTYNA selektywnie kompleksuje jony K + selektywny transport jonów potasu przez membrany komórkowe 29
C OH ALKOHOLE ETERY R OH R O R R' O FENOLE. Ar OH NOMENKLATURA ALKOHOLE ZWIĄZKI ORGANICZNE ZAWIERAJĄCE W STRUKTURZE ATOMY TLENU C O C OH CH 3 OH
 ZWIĄZKI GANIZNE ZAWIEAJĄE W STUKTUZE ATMY TLENU 8 1s2 2s 2 2p 4 okres 2; grupa VI w związkach jest dwuwiążący, z dwoma niewiążącymi parami elektronów drugi w skali elektroujemności Paulinga 3.5 (za fluorem)
ZWIĄZKI GANIZNE ZAWIEAJĄE W STUKTUZE ATMY TLENU 8 1s2 2s 2 2p 4 okres 2; grupa VI w związkach jest dwuwiążący, z dwoma niewiążącymi parami elektronów drugi w skali elektroujemności Paulinga 3.5 (za fluorem)
F ; Cl ; Br ; I H H. H Cl. CH3CH C CH2CH3 Br 3-bromo-2-penten. CH 3 Cl C C. F ; Cl ; Br ; I WŁAŚCIWOŚCI FIZYCZNE:
 ALGENPDNE WĘGLWDÓW sp 3 ALGENKI ALKILWE 3 I jodometan; jodek metylu 2 l 2 = 2 l 3 2 bromek benzylu chlorocykloheksan; chlorek cykloheksylu 3-chloro-1-propen; chlorek allilu AYLWE 3 sp 2 = ALGENKI bromobenzen
ALGENPDNE WĘGLWDÓW sp 3 ALGENKI ALKILWE 3 I jodometan; jodek metylu 2 l 2 = 2 l 3 2 bromek benzylu chlorocykloheksan; chlorek cykloheksylu 3-chloro-1-propen; chlorek allilu AYLWE 3 sp 2 = ALGENKI bromobenzen
FENOLE FENOLE FENOLE FENOLE WYSTĘPOWANIE NOMENKLATURA NOMENKLATURA OTRZYMYWANIE 1. IZOLOWANIE FENOLI ZE ŹRÓDEŁ NATURALNYCH H3C
 MEKLATUA FELE MEKLATUA MEKLATUA ZWYZAJWA FELE 7 6 8 3 3 3 X FEL FELE α AFTL β AFTL 5 9 10 4 3 1 2 9-FEATL 2-METYLFEL (o-kezl) 3-METYLFEL (m-kezl) 4-METYLFEL (p-kezl) MEKLATUA YTEMATYZA 2 4-BMFEL (para)
MEKLATUA FELE MEKLATUA MEKLATUA ZWYZAJWA FELE 7 6 8 3 3 3 X FEL FELE α AFTL β AFTL 5 9 10 4 3 1 2 9-FEATL 2-METYLFEL (o-kezl) 3-METYLFEL (m-kezl) 4-METYLFEL (p-kezl) MEKLATUA YTEMATYZA 2 4-BMFEL (para)
Halogenki alkilowe RX
 alogenki alkilowe X Nazewnictwo halogenków alkilowych 1. Znajdź i nazwij łańcuch macierzysty. Tak jak przy nazywaniu alkanów, wybierz najdłuższy łańcuch. Jeżeli w cząsteczce obecne jest wiązanie podwójne
alogenki alkilowe X Nazewnictwo halogenków alkilowych 1. Znajdź i nazwij łańcuch macierzysty. Tak jak przy nazywaniu alkanów, wybierz najdłuższy łańcuch. Jeżeli w cząsteczce obecne jest wiązanie podwójne
Stereochemia Ułożenie atomów w przestrzeni
 Slajd 1 Stereochemia Ułożenie atomów w przestrzeni Slajd 2 Izomery Izomery to różne związki posiadające ten sam wzór sumaryczny izomery izomery konstytucyjne stereoizomery izomery cis-trans izomery zawierające
Slajd 1 Stereochemia Ułożenie atomów w przestrzeni Slajd 2 Izomery Izomery to różne związki posiadające ten sam wzór sumaryczny izomery izomery konstytucyjne stereoizomery izomery cis-trans izomery zawierające
C n H 2n+2 ALKAN. System IUPAC (International Union of Pure and Applied Chemistry) gazy. ciecze NOMENKLATURA ZWIĄZKÓW ORGANICZNYCH
 n 2n+2 ALKAN Wzór sumaryczny Wzór strukturalny Nazwa alkanu prostego Liczba izomerów konstytucyjnych 4 4 metan 1 2 6 3 3 etan 1 3 8 3 2 3 propan 1 4 10 3 ( 2 ) 2 3 butan 2 5 12 3 ( 2 ) 3 3 pentan 3 6 14
n 2n+2 ALKAN Wzór sumaryczny Wzór strukturalny Nazwa alkanu prostego Liczba izomerów konstytucyjnych 4 4 metan 1 2 6 3 3 etan 1 3 8 3 2 3 propan 1 4 10 3 ( 2 ) 2 3 butan 2 5 12 3 ( 2 ) 3 3 pentan 3 6 14
Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO:
 FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
Elementy chemii organicznej
 Elementy chemii organicznej Węglowodory alifatyczne Alkany C n H 2n+2 Alkeny C n H 2n Alkiny C n H 2n-2 Alkany C n H 2n+2 struktura Kekulégo wzór skrócony model Dreidinga metan etan propan butan Nazewnictwo
Elementy chemii organicznej Węglowodory alifatyczne Alkany C n H 2n+2 Alkeny C n H 2n Alkiny C n H 2n-2 Alkany C n H 2n+2 struktura Kekulégo wzór skrócony model Dreidinga metan etan propan butan Nazewnictwo
R-X X = halogen Nazewnictwo: podstawnik halogenowy w szkielecie alkanu lub halogenek alkilu/arylu. F Br H 3 C
 alogenoalkany (by Aleksandra Kołodziejczyk, UG) R-X X = halogen Nazewnictwo: podstawnik halogenowy w szkielecie alkanu lub halogenek alkilu/arylu 3 I jodometan (jodek metylu) F 3 3 fluorocykloheksan (fluorek
alogenoalkany (by Aleksandra Kołodziejczyk, UG) R-X X = halogen Nazewnictwo: podstawnik halogenowy w szkielecie alkanu lub halogenek alkilu/arylu 3 I jodometan (jodek metylu) F 3 3 fluorocykloheksan (fluorek
18 i 19. Substytucja nukleofilowa w halogenkach alkili
 8 i 9. Substytucja nukleofilowa w halogenkach alkili Związki pojadające wiązanie C (sp 3 )-atom o większej elektroujemności od at. C elektroujemny atom sp 3 polarne wiązanie 9.. Typowe reakcje halogenków
8 i 9. Substytucja nukleofilowa w halogenkach alkili Związki pojadające wiązanie C (sp 3 )-atom o większej elektroujemności od at. C elektroujemny atom sp 3 polarne wiązanie 9.. Typowe reakcje halogenków
4. Stereoizomeria. izomery. konstytucyjne różne szkielety węglowe, różne grupy funkcyjne różne położenia gr. funkcyjnych
 4. Stereoizomeria izomery konstytucyjne różne szkielety węglowe, różne grupy funkcyjne różne położenia gr. funkcyjnych stereoizomery zbudowane z takich samych atomów atomy połączone w takiej samej sekwencji
4. Stereoizomeria izomery konstytucyjne różne szkielety węglowe, różne grupy funkcyjne różne położenia gr. funkcyjnych stereoizomery zbudowane z takich samych atomów atomy połączone w takiej samej sekwencji
7-9. Stereoizomeria. izomery. konstytucyjne różne szkielety węglowe, różne grupy funkcyjne różne położenia gr. funkcyjnych
 7-9. Stereoizomeria izomery konstytucyjne różne szkielety węglowe, różne grupy funkcyjne różne położenia gr. funkcyjnych stereoizomery zbudowane z takich samych atomów atomy połączone w takiej samej sekwencji
7-9. Stereoizomeria izomery konstytucyjne różne szkielety węglowe, różne grupy funkcyjne różne położenia gr. funkcyjnych stereoizomery zbudowane z takich samych atomów atomy połączone w takiej samej sekwencji
1. REAKCJA ZE ZWIĄZKAMI POSIADAJĄCYMI KWASOWY ATOM WODORU:
 B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka
 Slajd 1 Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka Slajd 2 Alkeny Węglowodory te zawierają wiązanie podwójne C C wiązanie double podwójne bond the grupa functional funkcyjna group centrum
Slajd 1 Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka Slajd 2 Alkeny Węglowodory te zawierają wiązanie podwójne C C wiązanie double podwójne bond the grupa functional funkcyjna group centrum
C n H 2n+2 ALKAN. System IUPAC (International Union of Pure and Applied Chemistry) SZEREG HOMOLOGICZNY. gazy RÓŻNIĄ SIĘ O GRUPĘ CH 2.
 n 2n+2 ALKAN Wzór sumaryczny Wzór strukturalny Nazwa alkanu prostego Liczba izomerów konstytucyjnych 4 4 metan 1 2 6 3 3 etan 1 3 8 3 2 3 propan 1 4 10 3 ( 2 ) 2 3 butan 2 5 12 3 ( 2 ) 3 3 pentan 3 6 14
n 2n+2 ALKAN Wzór sumaryczny Wzór strukturalny Nazwa alkanu prostego Liczba izomerów konstytucyjnych 4 4 metan 1 2 6 3 3 etan 1 3 8 3 2 3 propan 1 4 10 3 ( 2 ) 2 3 butan 2 5 12 3 ( 2 ) 3 3 pentan 3 6 14
R E A K C J E E L I M I N A C J I
 E A K J E E L I M I N A J I Związki organiczne zawierające dobrą grupę odchodzącą mogą ulegać reakcji eliminacji w wyniku czego powstają alkeny: B - - - - -= + B Grupami odchodzącymi są te same jony lub
E A K J E E L I M I N A J I Związki organiczne zawierające dobrą grupę odchodzącą mogą ulegać reakcji eliminacji w wyniku czego powstają alkeny: B - - - - -= + B Grupami odchodzącymi są te same jony lub
pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 )
 FLUOROWCOPOCODNE alogenki alkilowe- Cl C 2 -C 2 -C 2 -C 3 C 3 -C-C 3 C 2 -C-C 3 pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 ) I C 3 C 3 Cl-C 2 -C=C 2 Cl-C-C=C 2 1 2 3 Allilowe atom fluorowca
FLUOROWCOPOCODNE alogenki alkilowe- Cl C 2 -C 2 -C 2 -C 3 C 3 -C-C 3 C 2 -C-C 3 pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 ) I C 3 C 3 Cl-C 2 -C=C 2 Cl-C-C=C 2 1 2 3 Allilowe atom fluorowca
Alkeny - reaktywność
 11-13. Alkeny - reaktywność 1 6.1. Addycja elektrofilowa - wprowadzenie nukleofil elektrofil elektrofil nukleofil wolno szybko nowe wiązanie utworzone przez elektrony z wiązania nowe wiązanie utworzone
11-13. Alkeny - reaktywność 1 6.1. Addycja elektrofilowa - wprowadzenie nukleofil elektrofil elektrofil nukleofil wolno szybko nowe wiązanie utworzone przez elektrony z wiązania nowe wiązanie utworzone
Otrzymywanie halogenków alkilów
 Otrzymywanie halogenków alkilów 1) Wymiana grupy OH w alkoholach C O H HX 2) reakcja podstawienia alkanów C X H 3 C CH CH 2 HBr C H 3 OH H 3 C CH CH 2 C H 3 Br h + + CH CH 2 3 Cl 2 Cl HCl CH CH 3 3 CH
Otrzymywanie halogenków alkilów 1) Wymiana grupy OH w alkoholach C O H HX 2) reakcja podstawienia alkanów C X H 3 C CH CH 2 HBr C H 3 OH H 3 C CH CH 2 C H 3 Br h + + CH CH 2 3 Cl 2 Cl HCl CH CH 3 3 CH
Chemia organiczna. Mechanizmy reakcji chemicznych. Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego
 Chemia organiczna Mechanizmy reakcji chemicznych Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego 1 homoliza - homolityczny rozpad wiązania w jednym z reagentów; powstają produkty zawierające
Chemia organiczna Mechanizmy reakcji chemicznych Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego 1 homoliza - homolityczny rozpad wiązania w jednym z reagentów; powstają produkty zawierające
ZWIĄZKI MAGNEZOORGANICZNE. Krystyna Dzierzbicka
 ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
Slajd 1. Etery i epoksydy. Slajd 2. Wprowadzenie. Wzór R-O-R, gdzie R tos alkil lub aryl Symetryczne lub asymetryczne Przykłady: CH 3 O CH 3 O CH 3
 Slajd 1 Etery i epoksydy Slajd 2 Wprowadzenie Wzór R--R, gdzie R tos alkil lub aryl Symetryczne lub asymetryczne Przykłady: C 3 C 3 C 3 Slajd 3 Budowa i polarność Wygięta struktura Atom tlenu posiada hybrydyzacjęsp
Slajd 1 Etery i epoksydy Slajd 2 Wprowadzenie Wzór R--R, gdzie R tos alkil lub aryl Symetryczne lub asymetryczne Przykłady: C 3 C 3 C 3 Slajd 3 Budowa i polarność Wygięta struktura Atom tlenu posiada hybrydyzacjęsp
RJC # Alk l a k ny n Ster St eoi er zom eoi er zom y er Slides 1 to 30
 Alkany Stereoizomery Slides 1 to 30 Centrum asymetryczne (stereogeniczne) Atom węgla o hybrydyzacji sp 3 połączony z czterema róŝnymi podstawnikami tworzy centrum asymetryczne (stereogeniczne). Chiralność
Alkany Stereoizomery Slides 1 to 30 Centrum asymetryczne (stereogeniczne) Atom węgla o hybrydyzacji sp 3 połączony z czterema róŝnymi podstawnikami tworzy centrum asymetryczne (stereogeniczne). Chiralność
Addycje Nukleofilowe do Grupy Karbonylowej
 J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
Pochodne węglowodorów, w cząsteczkach których jeden atom H jest zastąpiony grupą hydroksylową (- OH ).
 Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Alkeny. Wzór ogólny alkenów C n H 2n. (Uwaga identyczny wzór ogólny mają cykloakany!!!)
 Alkeny Wzór ogólny alkenów n 2n (Uwaga identyczny wzór ogólny mają cykloakany!!!) Węglowodory nienasycone, zawierające wiązanie podwójne, hybrydyzacja atomow węgla biorących udział w tworzeniu wiązania
Alkeny Wzór ogólny alkenów n 2n (Uwaga identyczny wzór ogólny mają cykloakany!!!) Węglowodory nienasycone, zawierające wiązanie podwójne, hybrydyzacja atomow węgla biorących udział w tworzeniu wiązania
CHEMIA ORGANICZNA. dr hab. Włodzimierz Gałęzowski Wydział Chemii UAM (61)
 EMIA ORGANIZNA dr hab. Włodzimierz Gałęzowski Wydział hemii UAM (61) 829 1477 wlodgal@amu.edu.pl Materiał wymagany na egzaminie: wykłady ćwiczenia szkoła średnia http://staff.amu.edu.pl/~wlodgal Podręczniki
EMIA ORGANIZNA dr hab. Włodzimierz Gałęzowski Wydział hemii UAM (61) 829 1477 wlodgal@amu.edu.pl Materiał wymagany na egzaminie: wykłady ćwiczenia szkoła średnia http://staff.amu.edu.pl/~wlodgal Podręczniki
ALKENY WĘGLOWODORY NIENASYCONE
 Alkeny ALKENY WĘGLOWODORY NIENASYCONE WĘGLOWODORY ALIFATYCZNE SKŁĄDAJĄ SIĘ Z ATOMÓW WĘGLA I WODORU ZAWIERAJĄ JEDNO LUB KILKA WIĄZAŃ PODWÓJNYCH WĘGIEL WĘGIEL ATOM WĘGLA WIĄZANIA PODWÓJNEGO W HYBRYDYZACJI
Alkeny ALKENY WĘGLOWODORY NIENASYCONE WĘGLOWODORY ALIFATYCZNE SKŁĄDAJĄ SIĘ Z ATOMÓW WĘGLA I WODORU ZAWIERAJĄ JEDNO LUB KILKA WIĄZAŃ PODWÓJNYCH WĘGIEL WĘGIEL ATOM WĘGLA WIĄZANIA PODWÓJNEGO W HYBRYDYZACJI
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Stereochemia Jak przedstawiamy cząsteczkę z węglem tetraedrycznym:
 Stereochemia Jak przedstawiamy cząsteczkę z węglem tetraedrycznym: 2 wiązania leżą w płaszczyźnie kartki ( linia prosta ) 1 wiązanie wychodzi do przodu, przed kartkę ( linia pogrubiona ) 1 wiązanie wychodzi
Stereochemia Jak przedstawiamy cząsteczkę z węglem tetraedrycznym: 2 wiązania leżą w płaszczyźnie kartki ( linia prosta ) 1 wiązanie wychodzi do przodu, przed kartkę ( linia pogrubiona ) 1 wiązanie wychodzi
Klasyfikacja i przykłady ETERY
 ETERY I EPKSYZWIĄZKI Klasyfikacja i przykłady ETERY acykliczne R--R cykliczne trójczłonowe czteroczłonowe pięcioczłonowe sześcioczłonowe tlenek etylenu (oksiran) oksetan tetrahydrofuran tetrahydropiran
ETERY I EPKSYZWIĄZKI Klasyfikacja i przykłady ETERY acykliczne R--R cykliczne trójczłonowe czteroczłonowe pięcioczłonowe sześcioczłonowe tlenek etylenu (oksiran) oksetan tetrahydrofuran tetrahydropiran
Zarys Chemii Organicznej
 Zarys hemii Organicznej hemię organiczną definiuje się jako chemię związków węgla. Ogólna liczba znanych związków organicznych przekracza obecnie 18 milionów i wielokrotnie przewyższa liczbę znanych związków
Zarys hemii Organicznej hemię organiczną definiuje się jako chemię związków węgla. Ogólna liczba znanych związków organicznych przekracza obecnie 18 milionów i wielokrotnie przewyższa liczbę znanych związków
Chemia organiczna. Stereochemia. Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego
 Chemia organiczna Stereochemia Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego Chemia organiczna jest nauką, która zajmuje się poszukiwaniem zależności pomiędzy budową cząsteczki a właściwościami
Chemia organiczna Stereochemia Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego Chemia organiczna jest nauką, która zajmuje się poszukiwaniem zależności pomiędzy budową cząsteczki a właściwościami
Zadanie 1. Wskaż grupę związków chemicznych, do której należy węglowodór o gęstości 2,5 normalne). C. alkiny D. areny
 Węglowodory Zadanie 1. Wskaż grupę związków chemicznych, do której należy węglowodór o gęstości 2,5 normalne). (warunki A. alkany B. alkeny C. alkiny D. areny Zadanie 2. Wskaż wzór półstrukturalny węglowodoru
Węglowodory Zadanie 1. Wskaż grupę związków chemicznych, do której należy węglowodór o gęstości 2,5 normalne). (warunki A. alkany B. alkeny C. alkiny D. areny Zadanie 2. Wskaż wzór półstrukturalny węglowodoru
Elementy chemii organicznej
 Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
-pinen (składnik terpentyny)
 ALKENY (OLEFINY) WZÓR SUMARYZNY n 2n - alkeny łańcuchowe; n 2n-2 - alkeny cykliczne (cykloalkeny) etylen (produkcja polietylenu) WŁAŚIWOŚI FIZYZNE -pinen (składnik terpentyny) cis-trikoz-9-en (hormon płciowy
ALKENY (OLEFINY) WZÓR SUMARYZNY n 2n - alkeny łańcuchowe; n 2n-2 - alkeny cykliczne (cykloalkeny) etylen (produkcja polietylenu) WŁAŚIWOŚI FIZYZNE -pinen (składnik terpentyny) cis-trikoz-9-en (hormon płciowy
CHEMIA ORGANICZA - węglowodory. Podział węglowodorów
 EMIA ORGANIZA - węglowodory Podział węglowodorów Najprostsze związki organiczne Alkany są to węglowodory nasycone, w których występują tylko pojedyncze wiązania węgiel węgiel Wszystkie nazwy alkanów charakteryzuje
EMIA ORGANIZA - węglowodory Podział węglowodorów Najprostsze związki organiczne Alkany są to węglowodory nasycone, w których występują tylko pojedyncze wiązania węgiel węgiel Wszystkie nazwy alkanów charakteryzuje
A B C D A B C 4. D A B C D
 1. Kartkówka, 21 października 2015; zestaw Imię i azwisko: Zad. 1. (1 p) Wśród podanych związków,, i D, wszystkie atomy węgla występują w tym samym stanie hybrydyzacji w związkach: i i D 3. i 4. i D Zad.
1. Kartkówka, 21 października 2015; zestaw Imię i azwisko: Zad. 1. (1 p) Wśród podanych związków,, i D, wszystkie atomy węgla występują w tym samym stanie hybrydyzacji w związkach: i i D 3. i 4. i D Zad.
Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr.
 Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr. Typ wiązania w KBr... Typ wiązania w HBr... Zadanie 2. (2 pkt) Oceń poprawność poniższych
Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr. Typ wiązania w KBr... Typ wiązania w HBr... Zadanie 2. (2 pkt) Oceń poprawność poniższych
ZWIĄZKI FOSFOROORGANICZNE
 ZWIĄZKI FSFGANICZNE Związki fosforoorganiczne związki zawierające wiązanie węgiel-fosfor (C-) Wiązanie fosfor-wodór (-H; 77 kcal/mol) jest słabsze niż wiązanie azot-wodór (N-H; 93.4 kcal/mol). Wiązanie
ZWIĄZKI FSFGANICZNE Związki fosforoorganiczne związki zawierające wiązanie węgiel-fosfor (C-) Wiązanie fosfor-wodór (-H; 77 kcal/mol) jest słabsze niż wiązanie azot-wodór (N-H; 93.4 kcal/mol). Wiązanie
CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA. POLIMERYZACJA.
 INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA.
INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA.
Zagadnienia. Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I
 Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Stałe siłowe. Spektroskopia w podczerwieni. Spektrofotometria w podczerwieni otrzymywanie widm
 Spektroskopia w podczerwieni Spektrofotometria w podczerwieni otrzymywanie widm absorpcyjnych substancji o różnych stanach skupienia. Powiązanie widm ze strukturą pozwala na identyfikację związku. Widmo
Spektroskopia w podczerwieni Spektrofotometria w podczerwieni otrzymywanie widm absorpcyjnych substancji o różnych stanach skupienia. Powiązanie widm ze strukturą pozwala na identyfikację związku. Widmo
Podstawy chemii organicznej. T. 1 / Aleksander Kołodziejczyk, Krystyna Dzierzbicka. wyd. 3. Gdańsk, Spis treści
 Podstawy chemii organicznej. T. 1 / Aleksander Kołodziejczyk, Krystyna Dzierzbicka. wyd. 3. Gdańsk, 2015 Spis treści Wstęp 9 1. WIĄZANIA CHEMICZNE 11 1.1. Wprowadzenie 11 1.2. Wiązania chemiczne 13 1.3.
Podstawy chemii organicznej. T. 1 / Aleksander Kołodziejczyk, Krystyna Dzierzbicka. wyd. 3. Gdańsk, 2015 Spis treści Wstęp 9 1. WIĄZANIA CHEMICZNE 11 1.1. Wprowadzenie 11 1.2. Wiązania chemiczne 13 1.3.
Narysuj stereoizomery cis i trans dla 1,2-dibromocyklobutanu. Czy ulegają one wzajemnej przemianie, odpowiedź uzasadnij.
 WERSJA A EGZAMIN z hemii rganicznej I. IZMERIA ZWIĄZKÓW RGANIZNY 1. Narysuj wzory w projekcji konikowej i w projekcji Newmana 1,2-dibromoetanu 1,1-dibromoetanu w konformacji synklinalnej (gauche) w najbardziej
WERSJA A EGZAMIN z hemii rganicznej I. IZMERIA ZWIĄZKÓW RGANIZNY 1. Narysuj wzory w projekcji konikowej i w projekcji Newmana 1,2-dibromoetanu 1,1-dibromoetanu w konformacji synklinalnej (gauche) w najbardziej
węglowodory posiadające wiązanie podwójne (p) C=C a-pinen (składnik terpentyny)
 ALKENY (OLEFINY) węglowodory posiadające wiązanie podwójne (p) = WZÓR SUMARYZNY n 2n - alkeny łańcuchowe; n 2n-2 - alkeny cykliczne (cykloalkeny) etylen (produkcja polietylenu) a-pinen (składnik terpentyny)
ALKENY (OLEFINY) węglowodory posiadające wiązanie podwójne (p) = WZÓR SUMARYZNY n 2n - alkeny łańcuchowe; n 2n-2 - alkeny cykliczne (cykloalkeny) etylen (produkcja polietylenu) a-pinen (składnik terpentyny)
ALDEHYDY, KETONY. I. Wprowadzenie teoretyczne
 ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
CZĄSTECZKI NIE SĄ IDENTYCZNE. CZĄSTECZKA JEST CHIRALNA WTEDY, GDY NIE POSIADA INWERSYJNEJ OSI SYMETRII, tzw. NIEWŁAŚCIWEJ, PRZEMIENNEJ
 IZMEIA PTYZNA l l ZĄTEZKI IALNE I I lustro ENANJMEY stereoizomery, między którymi zachodzi relacja przedmiot jego odbicie lustrzane ZĄTEZKI NIE Ą IDENTYZNE TEEIZMEY taki sam wzór sumaryczny taka sama konstytucja
IZMEIA PTYZNA l l ZĄTEZKI IALNE I I lustro ENANJMEY stereoizomery, między którymi zachodzi relacja przedmiot jego odbicie lustrzane ZĄTEZKI NIE Ą IDENTYZNE TEEIZMEY taki sam wzór sumaryczny taka sama konstytucja
CH 3 OH C 2 H 5 OH H 3 C CH 2 CH 2 OH H 3 C CH CH 3 OH metanol etanol propan-1-ol propan-2-ol H 2 C CH 2 OH OH H 2 C CH CH 2 OH OH OH
 Alkohole Alkohole to związki organiczne, posiadające w cząsteczce przynajmniej jedną hydroksylową grupę funkcyjną ( ). Jeżeli grupa ta jest połączona bezpośrednio z pierścieniem aromatycznym, to taki związek
Alkohole Alkohole to związki organiczne, posiadające w cząsteczce przynajmniej jedną hydroksylową grupę funkcyjną ( ). Jeżeli grupa ta jest połączona bezpośrednio z pierścieniem aromatycznym, to taki związek
CHARAKTERYSTYKA KARBOKSYLANÓW
 AAKTEYSTYKA KABKSYLANÓW 1. GÓLNA AAKTEYSTYKA KWASÓW KABKSYLWY Spośród związków organicznych, które wykazują znaczną kwasowość najważniejsze są kwasy karboksylowe. Związki te zawierają w cząsteczce grupę
AAKTEYSTYKA KABKSYLANÓW 1. GÓLNA AAKTEYSTYKA KWASÓW KABKSYLWY Spośród związków organicznych, które wykazują znaczną kwasowość najważniejsze są kwasy karboksylowe. Związki te zawierają w cząsteczce grupę
Wykład 1. Struktura i wiązania w cząsteczkach organicznych
 Wykład 1. Struktura i wiązania w cząsteczkach organicznych Pierwszy wykład służył przypomnieniu znanych pojęć, zaakcentowaniu które pojęcia są ważne w chemii organicznej. Proszę zwrócić uwagę na zagadnienia
Wykład 1. Struktura i wiązania w cząsteczkach organicznych Pierwszy wykład służył przypomnieniu znanych pojęć, zaakcentowaniu które pojęcia są ważne w chemii organicznej. Proszę zwrócić uwagę na zagadnienia
10. Alkeny wiadomości wstępne
 0. Alkeny wiadomości wstępne 5.. Nazewnictwo Nazwa systematyczna eten propen cyklopenten cykloheksen Nazwa zwyczajowa etylen propylen Wiązanie = w łańcuchu głównym, lokant = najniższy z możliwych -propyloheks--en
0. Alkeny wiadomości wstępne 5.. Nazewnictwo Nazwa systematyczna eten propen cyklopenten cykloheksen Nazwa zwyczajowa etylen propylen Wiązanie = w łańcuchu głównym, lokant = najniższy z możliwych -propyloheks--en
Kryteria oceniania z chemii kl VII
 Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
Rozdział 6. Odpowiedzi i rozwiązania zadań. Chemia organiczna. Zdzisław Głowacki. Zakres podstawowy i rozszerzony
 Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Wykład przygotowany w oparciu o podręczniki:
 Slajd 1 Wykład przygotowany w oparciu o podręczniki: Organic Chemistry 4 th Edition Paula Yurkanis Bruice Slajd 2 Struktura elektronowa wiązanie chemiczne Kwasy i zasady Slajd 3 Chemia organiczna Związki
Slajd 1 Wykład przygotowany w oparciu o podręczniki: Organic Chemistry 4 th Edition Paula Yurkanis Bruice Slajd 2 Struktura elektronowa wiązanie chemiczne Kwasy i zasady Slajd 3 Chemia organiczna Związki
Alkohole i fenole. Opracowanie: Bartłomiej SIEPSIAK klasa 3d Opiekun: p. Teresa Gębicka
 Alkohole i fenole Opracowanie: Bartłomiej SIEPSIAK klasa d Opiekun: p. Teresa Gębicka Budowa alkoholi i fenoli Szereg homologiczny alkoholi Nazewnictwo Podział alkoholi Otrzymywanie alkoholi Właściwości
Alkohole i fenole Opracowanie: Bartłomiej SIEPSIAK klasa d Opiekun: p. Teresa Gębicka Budowa alkoholi i fenoli Szereg homologiczny alkoholi Nazewnictwo Podział alkoholi Otrzymywanie alkoholi Właściwości
Węglowodory poziom rozszerzony
 Węglowodory poziom rozszerzony Zadanie 1. (1 pkt) Źródło: KE 2010 (PR), zad. 21. Narysuj wzór strukturalny lub półstrukturalny (grupowy) węglowodoru, w którego cząsteczce występuje osiem wiązań σ i jedno
Węglowodory poziom rozszerzony Zadanie 1. (1 pkt) Źródło: KE 2010 (PR), zad. 21. Narysuj wzór strukturalny lub półstrukturalny (grupowy) węglowodoru, w którego cząsteczce występuje osiem wiązań σ i jedno
Aminy. - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin
 Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
CHEMIA I GIMNAZJUM WYMAGANIA PODSTAWOWE
 WYMAGANIA PODSTAWOWE wskazuje w środowisku substancje chemiczne nazywa sprzęt i szkło laboratoryjne opisuje podstawowe właściwości substancji będących głównymi składnikami stosowanych na co dzień produktów
WYMAGANIA PODSTAWOWE wskazuje w środowisku substancje chemiczne nazywa sprzęt i szkło laboratoryjne opisuje podstawowe właściwości substancji będących głównymi składnikami stosowanych na co dzień produktów
Chemia organiczna. Alkohole Fenole. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
Izomerię konstytucyjną można podzielić na podgrupy a) izomeria szkieletowa, która polega na różnej budowie szkieletu węglowego cząsteczek Przykład:
 1 1) Informacje ogólne Izomery są to związki, które maja identyczne wzory sumaryczne ale różnią się sposobem lub kolejnością powiązania atomów lub rozmieszczeniem atomów w przestrzeni. rozróżnia się izomerię
1 1) Informacje ogólne Izomery są to związki, które maja identyczne wzory sumaryczne ale różnią się sposobem lub kolejnością powiązania atomów lub rozmieszczeniem atomów w przestrzeni. rozróżnia się izomerię
liczba kwantowa, n kwantowa, l Wanad 3 2 [Ar] 3d 3 4s 2
![liczba kwantowa, n kwantowa, l Wanad 3 2 [Ar] 3d 3 4s 2 liczba kwantowa, n kwantowa, l Wanad 3 2 [Ar] 3d 3 4s 2](/thumbs/65/54124071.jpg) Arkusz odpowiedzi Nr Proponowane rozwiązanie zadani a Liczba niesparowanych elektronów w jonie r 3+ jest (mniejsza / większa) od liczby elektronów niesparowanych w jonie Mn +. Pierwiastkiem, którego jony
Arkusz odpowiedzi Nr Proponowane rozwiązanie zadani a Liczba niesparowanych elektronów w jonie r 3+ jest (mniejsza / większa) od liczby elektronów niesparowanych w jonie Mn +. Pierwiastkiem, którego jony
CHEMIA klasa 1 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery.
 CHEMIA klasa 1 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery. Dział - Substancje i ich przemiany WYMAGANIA PODSTAWOWE stosuje zasady bezpieczeństwa
CHEMIA klasa 1 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery. Dział - Substancje i ich przemiany WYMAGANIA PODSTAWOWE stosuje zasady bezpieczeństwa
Test kompetencji z chemii do liceum. Grupa A.
 Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Izomeria. isos - taki sam meros -części
 Izomeria isos - taki sam meros -części Izomery związki, które zawierają taką samą liczbę i rodzaj atomów w cząsteczce, ale różnią się sposobem ułożenia tych atomów. Mają taki sam wzór sumaryczny. 6 12
Izomeria isos - taki sam meros -części Izomery związki, które zawierają taką samą liczbę i rodzaj atomów w cząsteczce, ale różnią się sposobem ułożenia tych atomów. Mają taki sam wzór sumaryczny. 6 12
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas II LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania
 Cz. I Materiał powtórzeniowy do sprawdzianu dla klas II LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas II LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
Nazwy pierwiastków: ...
 Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Wskaż grupy reakcji, do których można zaliczyć proces opisany w informacji wstępnej. A. I i III B. I i IV C. II i III D. II i IV
 Informacja do zadań 1. i 2. Proces spalania pewnego węglowodoru przebiega według równania: C 4 H 8(g) + 6O 2(g) 4CO 2(g) + 4H 2 O (g) + energia cieplna Zadanie 1. (1 pkt) Procesy chemiczne można zakwalifikować
Informacja do zadań 1. i 2. Proces spalania pewnego węglowodoru przebiega według równania: C 4 H 8(g) + 6O 2(g) 4CO 2(g) + 4H 2 O (g) + energia cieplna Zadanie 1. (1 pkt) Procesy chemiczne można zakwalifikować
Slajd 1. Alkohole i fenole. Cholesterol. Slajd 2. Budowa alkoholi. metanol. metanol. Grupą funkcyjną jest (OH) Tlen posiada hybrydyzacjęsp 3
 Slajd 1 Alkohole i fenole Cholesterol Slajd 2 Budowa alkoholi woda woda metanol metanol Grupą funkcyjną jest () Tlen posiada hybrydyzacjęsp 3 Slajd 3 Podział alkoholi Pierwszorzędowe: grupa połączona jest
Slajd 1 Alkohole i fenole Cholesterol Slajd 2 Budowa alkoholi woda woda metanol metanol Grupą funkcyjną jest () Tlen posiada hybrydyzacjęsp 3 Slajd 3 Podział alkoholi Pierwszorzędowe: grupa połączona jest
1. Katalityczna redukcja węglowodorów zawierających wiązania wielokrotne
 B T E C N L CEMA G RGANCZNA A Synteza 1. Katalityczna redukcja węglowodorów zawierających wiązania wielokrotne C C / Pt C C C C W reakcji tej łańcuch węglowy pozostaje zachowany (nie ulega zmianie jego
B T E C N L CEMA G RGANCZNA A Synteza 1. Katalityczna redukcja węglowodorów zawierających wiązania wielokrotne C C / Pt C C C C W reakcji tej łańcuch węglowy pozostaje zachowany (nie ulega zmianie jego
Slajd 1. Reakcje alkinów
 Slajd 1 Reakcje alkinów Slajd 2 Alkiny to węglowodory zawierające wiązanie potrójne węgiel-węgiel Wzór ogólny: C n H 2n 2 (łańcuchowy); C n H 2n 4 (cykliczny) 1-heksyn terminalny alkin 3-heksyn wewnętrzny
Slajd 1 Reakcje alkinów Slajd 2 Alkiny to węglowodory zawierające wiązanie potrójne węgiel-węgiel Wzór ogólny: C n H 2n 2 (łańcuchowy); C n H 2n 4 (cykliczny) 1-heksyn terminalny alkin 3-heksyn wewnętrzny
1. Określ liczbę wiązań σ i π w cząsteczkach: wody, amoniaku i chloru
 1. Określ liczbę wiązań σ i π w cząsteczkach: wody, amoniaku i chloru 2. Na podstawie struktury cząsteczek wyjaśnij dlaczego N 2 jest bierny a Cl 2 aktywny chemicznie? 3. Które substancje posiadają budowę
1. Określ liczbę wiązań σ i π w cząsteczkach: wody, amoniaku i chloru 2. Na podstawie struktury cząsteczek wyjaśnij dlaczego N 2 jest bierny a Cl 2 aktywny chemicznie? 3. Które substancje posiadają budowę
Grupa karbonylowa. Grupa karbonylowa to grupa funkcyjna, w której atom tlenu połączony jest z atomem węgla podwójnym wiązaniem
 ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
Zadanie 1. (1 pkt). Informacja do zada 2. i 3. Zadanie 2. (1 pkt) { Zadania 2., 3. i 4 s dla poziomu rozszerzonego} zania zania Zadanie 3.
 2. ELEKTRONY W ATOMACH I CZĄSTECZKACH. A1 - POZIOM PODSTAWOWY. Zadanie 1. (1 pkt). Konfigurację elektronową 1s 2 2s 2 2p 6 3s 2 3p 6 mają atomy i jony: A. Mg 2+, Cl -, K +, B. Ar, S 2-, K +, C. Ar, Na
2. ELEKTRONY W ATOMACH I CZĄSTECZKACH. A1 - POZIOM PODSTAWOWY. Zadanie 1. (1 pkt). Konfigurację elektronową 1s 2 2s 2 2p 6 3s 2 3p 6 mają atomy i jony: A. Mg 2+, Cl -, K +, B. Ar, S 2-, K +, C. Ar, Na
11. Reakcje alkoholi, eterów, epoksydów, amin i tioli
 11. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas 1 11.1. Reakcja
11. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas 1 11.1. Reakcja
Wiązania jonowe występują w układach złożonych z atomów skrajnie różniących się elektroujemnością.
 105 Elektronowa teoria wiązania chemicznego Cząsteczki powstają w wyniku połączenia się dwóch lub więcej atomów. Już w początkowym okresie rozwoju chemii podejmowano wysiłki zmierzające do wyjaśnienia
105 Elektronowa teoria wiązania chemicznego Cząsteczki powstają w wyniku połączenia się dwóch lub więcej atomów. Już w początkowym okresie rozwoju chemii podejmowano wysiłki zmierzające do wyjaśnienia
WYMAGANIA EDUKACYJNE z chemii dla klasy siódmej
 Lucyna Krupa Rok szkolny 2017/2018 WYMAGANIA EDUKACYJNE z chemii dla klasy siódmej Wyróżnia się wymagania na: ocenę dopuszczającą ocenę dostateczną (obejmują wymagania na ocenę dopuszczającą) ocenę dobrą
Lucyna Krupa Rok szkolny 2017/2018 WYMAGANIA EDUKACYJNE z chemii dla klasy siódmej Wyróżnia się wymagania na: ocenę dopuszczającą ocenę dostateczną (obejmują wymagania na ocenę dopuszczającą) ocenę dobrą
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas I LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania
 Cz. I Materiał powtórzeniowy do sprawdzianu dla klas I LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas I LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
Reakcje alkoholi, eterów, epoksydów, amin i tioli
 22-24. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas Chemia rganiczna,
22-24. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas Chemia rganiczna,
Slajd 1. Wstęp do chemii organicznej. Nomenklatura, własności fizyczne, struktura. eter. mapa potencjału elektrostatycznego cząsteczki eteru etylowego
 Slajd 1 Wstęp do chemii organicznej Nomenklatura, własności fizyczne, struktura hybrydyzacja sp 3 eter mapa potencjału elektrostatycznego cząsteczki eteru etylowego Slajd 2 Alkany to węglowodory zawierające
Slajd 1 Wstęp do chemii organicznej Nomenklatura, własności fizyczne, struktura hybrydyzacja sp 3 eter mapa potencjału elektrostatycznego cząsteczki eteru etylowego Slajd 2 Alkany to węglowodory zawierające
Wewnętrzna budowa materii
 Atom i układ okresowy Wewnętrzna budowa materii Atom jest zbudowany z jądra atomowego oraz krążących wokół niego elektronów. Na jądro atomowe składają się protony oraz neutrony, zwane wspólnie nukleonami.
Atom i układ okresowy Wewnętrzna budowa materii Atom jest zbudowany z jądra atomowego oraz krążących wokół niego elektronów. Na jądro atomowe składają się protony oraz neutrony, zwane wspólnie nukleonami.
Izomeria. isos - taki sam meros -części
 Izomeria isos - taki sam meros -części Izomery związki, które zawierają taką samą liczbę i rodzaj atomów w cząsteczce, ale różnią się sposobem ułożenia tych atomów. Mają taki sam wzór sumaryczny. 6 12
Izomeria isos - taki sam meros -części Izomery związki, które zawierają taką samą liczbę i rodzaj atomów w cząsteczce, ale różnią się sposobem ułożenia tych atomów. Mają taki sam wzór sumaryczny. 6 12
Zadanie 1. (3 pkt) a) Dokończ poniższe równanie reakcji (stosunek molowy substratów wynosi 1:1).
 Zadanie 1. (3 pkt) a) Dokończ poniższe równanie reakcji (stosunek molowy substratów wynosi 1:1). b) Podaj nazwę systematyczną związku organicznego otrzymanego w tej reakcji. c) Określ, jaką rolę w tej
Zadanie 1. (3 pkt) a) Dokończ poniższe równanie reakcji (stosunek molowy substratów wynosi 1:1). b) Podaj nazwę systematyczną związku organicznego otrzymanego w tej reakcji. c) Określ, jaką rolę w tej
Model wiązania kowalencyjnego cząsteczka H 2
 Model wiązania kowalencyjnego cząsteczka H 2 + Współrzędne elektronu i protonów Orbitale wiążący i antywiążący otrzymane jako kombinacje orbitali atomowych Orbital wiążący duża gęstość ładunku między jądrami
Model wiązania kowalencyjnego cząsteczka H 2 + Współrzędne elektronu i protonów Orbitale wiążący i antywiążący otrzymane jako kombinacje orbitali atomowych Orbital wiążący duża gęstość ładunku między jądrami
Wymagania edukacyjne - chemia klasa VII
 Wymagania edukacyjne - chemia klasa VII OCENA DOPUSZCZAJĄCA [1] opisuje właściwości substancji będących głównymi składnikami produktów stosowanych na co dzień podaje wzór na gęstość i przeprowadza proste
Wymagania edukacyjne - chemia klasa VII OCENA DOPUSZCZAJĄCA [1] opisuje właściwości substancji będących głównymi składnikami produktów stosowanych na co dzień podaje wzór na gęstość i przeprowadza proste
Laboratorium. Podstawowe procesy jednostkowe w technologii chemicznej
 Laboratorium Podstawowe procesy jednostkowe w technologii chemicznej Studia niestacjonarne Ćwiczenie Alkilowanie toluenu chlorkiem tert-butylu 1 PROCESY ALKILOWANIA PIERŚCIENIA AROMATYCZNEGO: ALKILOWANIE
Laboratorium Podstawowe procesy jednostkowe w technologii chemicznej Studia niestacjonarne Ćwiczenie Alkilowanie toluenu chlorkiem tert-butylu 1 PROCESY ALKILOWANIA PIERŚCIENIA AROMATYCZNEGO: ALKILOWANIE
I. Substancje i ich przemiany
 Wymagania edukacyjne na poszczególne oceny szkolne klasa 7 Niepełnosprawność intelektualna oraz obniżenie wymagań i dostosowanie ich do możliwości ucznia I. Substancje i ich przemiany stosuje zasady bezpieczeństwa
Wymagania edukacyjne na poszczególne oceny szkolne klasa 7 Niepełnosprawność intelektualna oraz obniżenie wymagań i dostosowanie ich do możliwości ucznia I. Substancje i ich przemiany stosuje zasady bezpieczeństwa
Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem
 Hospitacja diagnozująca Źródła informacji chemicznej Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem Opracowała: mgr Lilla Zmuda Matyja Arkusz Hospitacji Diagnozującej nr
Hospitacja diagnozująca Źródła informacji chemicznej Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem Opracowała: mgr Lilla Zmuda Matyja Arkusz Hospitacji Diagnozującej nr
Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami
 Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami I. Otrzymywanie halogenowęglowodorów 1. Reakcje halogenacji (substytucji rodnikowej halogenów (Cl, ) na
Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami I. Otrzymywanie halogenowęglowodorów 1. Reakcje halogenacji (substytucji rodnikowej halogenów (Cl, ) na
3. Wprowadzenie do nazewnictwa związków organicznych
 3. Wprowadzenie do nazewnictwa związków organicznych 1 3.1. omologia i izomeria konstytucyjna omologi związki z tej samej klasy, każdy związek różni się od swego poprzednika o jedną grupę metylenową (C
3. Wprowadzenie do nazewnictwa związków organicznych 1 3.1. omologia i izomeria konstytucyjna omologi związki z tej samej klasy, każdy związek różni się od swego poprzednika o jedną grupę metylenową (C
X / \ Y Y Y Z / \ W W ... imię i nazwisko,nazwa szkoły, miasto
 Zadanie 1. (3 pkt) Nadtlenek litu (Li 2 O 2 ) jest ciałem stałym, występującym w temperaturze pokojowej w postaci białych kryształów. Stosowany jest w oczyszczaczach powietrza, gdzie ważna jest waga użytego
Zadanie 1. (3 pkt) Nadtlenek litu (Li 2 O 2 ) jest ciałem stałym, występującym w temperaturze pokojowej w postaci białych kryształów. Stosowany jest w oczyszczaczach powietrza, gdzie ważna jest waga użytego
Najbardziej rozpowszechniony pierwiastek we Wszechświecie, Stanowi główny składnik budujący gwiazdy,
 Położenie pierwiastka w UKŁADZIE OKRESOWYM Nazwa Nazwa łacińska Symbol Liczba atomowa 1 Wodór Hydrogenium Masa atomowa 1,00794 Temperatura topnienia -259,2 C Temperatura wrzenia -252,2 C Gęstość H 0,08988
Położenie pierwiastka w UKŁADZIE OKRESOWYM Nazwa Nazwa łacińska Symbol Liczba atomowa 1 Wodór Hydrogenium Masa atomowa 1,00794 Temperatura topnienia -259,2 C Temperatura wrzenia -252,2 C Gęstość H 0,08988
O MATURZE Z CHEMII ANALIZA TRUDNYCH DLA ZDAJĄCYCH PROBLEMÓW
 O MATURZE Z CHEMII ANALIZA TRUDNYCH DLA ZDAJĄCYCH PROBLEMÓW Jolanta Baldy Wrocław, 2 grudnia 2016 r. Matura 2016 z chemii w liczbach Średni wynik procentowy Województwo dolnośląskie 36% (1981) Województwo
O MATURZE Z CHEMII ANALIZA TRUDNYCH DLA ZDAJĄCYCH PROBLEMÓW Jolanta Baldy Wrocław, 2 grudnia 2016 r. Matura 2016 z chemii w liczbach Średni wynik procentowy Województwo dolnośląskie 36% (1981) Województwo
Zadania powtórkowe do egzaminu maturalnego z chemii Wiązania chemiczne, budowa cząsteczek
 strona 1/11 Zadania powtórkowe do egzaminu maturalnego z chemii Wiązania chemiczne, budowa cząsteczek Monika Gałkiewicz Zad. 1 () Podaj wzory dwóch dowolnych kationów i dwóch dowolnych anionów posiadających
strona 1/11 Zadania powtórkowe do egzaminu maturalnego z chemii Wiązania chemiczne, budowa cząsteczek Monika Gałkiewicz Zad. 1 () Podaj wzory dwóch dowolnych kationów i dwóch dowolnych anionów posiadających
Substytucja nukleofilowa
 Substytucja nukleofilowa Katarzyna strowska eakcja podstawienia nukleofilowego polega na wymianie grupy X związanej z atomem węgla na odczynnik nukleofilowy. Podstawnikiem X jest przeważnie grupa elektronoakceptorowa,
Substytucja nukleofilowa Katarzyna strowska eakcja podstawienia nukleofilowego polega na wymianie grupy X związanej z atomem węgla na odczynnik nukleofilowy. Podstawnikiem X jest przeważnie grupa elektronoakceptorowa,
Podział związków organicznych
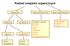 Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
BADANIE WYNIKÓW NAUCZANIA Z CHEMII KLASA I GIMNAZJUM. PYTANIA ZAMKNIĘTE.
 BADANIE WYNIKÓW NAUCZANIA Z CHEMII KLASA I GIMNAZJUM. PYTANIA ZAMKNIĘTE. 1. Którą mieszaninę można rozdzielić na składniki poprzez filtrację; A. Wodę z octem. B. Wodę z kredą. C. Piasek z cukrem D. Wodę
BADANIE WYNIKÓW NAUCZANIA Z CHEMII KLASA I GIMNAZJUM. PYTANIA ZAMKNIĘTE. 1. Którą mieszaninę można rozdzielić na składniki poprzez filtrację; A. Wodę z octem. B. Wodę z kredą. C. Piasek z cukrem D. Wodę
Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup
 Cz. XXV - Kwasy karboksylowe Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup karboksylowych - CH ( - C - H ), atom C w grupie funkcyjnej jest na hybrydyzacji sp 2,
Cz. XXV - Kwasy karboksylowe Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup karboksylowych - CH ( - C - H ), atom C w grupie funkcyjnej jest na hybrydyzacji sp 2,
Wymagania przedmiotowe do podstawy programowej - chemia klasa 7
 Wymagania przedmiotowe do podstawy programowej - chemia klasa 7 I. Substancje i ich właściwości opisuje cechy mieszanin jednorodnych i niejednorodnych, klasyfikuje pierwiastki na metale i niemetale, posługuje
Wymagania przedmiotowe do podstawy programowej - chemia klasa 7 I. Substancje i ich właściwości opisuje cechy mieszanin jednorodnych i niejednorodnych, klasyfikuje pierwiastki na metale i niemetale, posługuje
