ĆWICZENIA Z BIOLOGII MOLEKULARNEJ
|
|
|
- Zuzanna Kowalczyk
- 8 lat temu
- Przeglądów:
Transkrypt
1 UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z BIOLOGII MOLEKULARNEJ dla studentów III roku mikrobiologii LUBLIN 2016 Wersja 1.2 1
2 Spis treści: 1. Izolacja jąder komórkowych i histonów 2. Analiza składu białkowego chromatyny 3. Trawienie DNA chromatyny nukleazą ze Staphylococcus aureus 4. Elektroforetyczna analiza DNA po trawieniu nukleazą ze Staphylococcus aureus 5. Izolacja DNA z nabłonka jamy ustnej 6. Amplifikacja i analiza elektroforetyczna sekwencji minisatelitarnej z uzyskanego DNA 7. Otrzymywanie rybosomów i frakcji cytoplazmatycznej drożdży Saccharomyces cerevisiae 8. Izolacja kwaśnych białek rybosomowych z drożdży 9. Analiza otrzymanych białek metodą SDS/PAGE i immunoblotingu 10. Badanie aktywności enzymatycznej w żelu poliakrylamidowym na przykładzie inwertazy 11. Identyfikacja białek w komórkach ssaczych metodą immunocytochemiczną. 2
3 Izolacja jąder komórkowych i histonów U organizmów eukariotycznych, większość DNA znajduje się w wyspecjalizowanych organellach jądrach komórkowych. DNA jądrowy występuje w postaci kompleksu nukleoproteinowego, zwanego chromatyną. Podstawową jednostką strukturalną chromatyny jest nukleosom. W skład nukleosomu wchodzi tzw. cząstka rdzeniowa (ang. core particle), cząsteczka histonu H1 i fragment DNA o długości ok pz. Cząstkę rdzeniową tworzy kompleks ośmiu histonów (oktamer) zwanych histonami rdzeniowymi (po dwie cząsteczki histonów H2A, H2B, H3 i H4). Wokół oktameru owinięty jest odcinek DNA o długości pz. Pozostałą część stanowi łącznikowy DNA (ang. linker DNA) o długości pz z którym oddziałuje pojedyncza cząsteczka histonu H1. Znanych jest wiele wariantów sekwencyjnych histonu H1, występujących w określonych tkankach lub etapach rozwoju danego organizmu. Na przykład w jądrzastych erytrocytach ptaków zamiast histonu H1 występuje histon H5. Histony mogą podlegać szeregu modyfikacjom potranslacyjnym, np. acetylacji, metylacji, fosforylacji czy ubikwitynacji. Modyfikacje te mają istotne znaczenie w regulacji stopnia upakowania DNA i jego dostępności dla replikacji i transkrypcji np. acetylacja reszt lizyny na N-końcu łańcucha polipeptydowego histonów rdzeniowych zmniejsza ich powinowactwo do DNA, co powoduje rozluźnienie struktury chromatyny i zwiększenie poziomu ekspresji genów. Warto zauważyć, że wpływ modyfikacji potranslacyjnych histonów na stopień kondensacji chromatyny i ekspresję genów nie zależy tylko od rodzaju modyfikacji ale także od miejsca wystąpienia takiej modyfikacji na białku histonowym, np. metylacja reszty lizyny w pozycji 9 łańcucha polipeptydowego histonu H3 powoduje zwiększenie stopnia upakowania chromatyny i wyciszenie ekspresji genów zaś metylacja reszty lizyny w pozycji 4 wpływa na rozluźnienie struktury chromatyny. Wysunięto więc hipotezę kodu histonowego, która zakłada, że istnieją pewne określone wzory modyfikacji histonów odpowiedzialne za zachodzenie konkretnych procesów w komórce. Materiał badawczy do ćwiczeń to linia komórkowa fibroblastów mysich NIH 3T3 lub linia komórkowa wywodząca się z komórek raka szyjki macicy HeLa. Komórki hodowane są na płytkach Petriego (10x14cm) odpowiednio w płynie hodowlanym DMEM i RPMI, w temperaturze 37 0 C i w atmosferze 5% CO 2. Celem ćwiczenia jest otrzymanie preparatów zawierających wszystkie białka jądrowe oraz izolacja histonów z jąder komórek linii NIH 3T3 lub HeLa. Histony oczyszcza się z jąder komórkowych wykorzystując zdolność 3
4 tych białek do rozpuszczania się w kwasach nieorganicznych, np. 0,25M HCl lub 0,2M H 2 SO 4. Materiały i odczynniki 1. Hodowla komórkowa fibroblastów mysich NIH 3T3 lub komórek HeLa o gęstości komórek ok. 90% (trzy płytki Petriego na jeden zespół studentów) 2. Bufor PBS 137 mm NaCl 2,7 mm KCl 10 mm Na 2 HPO 4 2 mm KH 2 PO 4, ph 7,5 3. Bufor do izolacji jąder: 200 mm Tris-HCl, ph 7,5 100 mm NaCl 250 mm sacharoza 1 mm EDTA 0,5% Triton X Bufor próbkowy do elektroforezy białek w żelu poliakrylamidowym SDS-PAGE (4x stężony) 5. 0,25 M HCl 6. Aceton (oziębiony) 7. Zdrapywacz do komórek 8. Homogenizator szklano-teflonowy o pojemności 2 ml 9. Jałowe probówki Eppendorfa o pojemności 1,5 i 2 ml oraz końcówki do pipet. Przed przystąpieniem do wykonania ćwiczenia przygotować blok grzejny o temp C oraz schłodzić wirówkę do temp. 4 0 C 4
5 Wykonanie ćwiczenia Uwaga! Jeśli nie zaznaczono inaczej, poniższe czynności należy wykonywać w temp C Otrzymywanie jąder z fibroblastów mysich NIH 3T3 lub komórek HeLa 1. Trzy płytki Petriego z komórkami fibroblastów mysich o gęstości ok. 90% przenieść na lód i ściągnąć pipetą płyn hodowlany. 2. Przepłukać komórki na każdej płytce 5 ml oziębionego buforu PBS. 3. Po ściągnięciu pipetą buforu PBS zeskrobać komórki fibroblastów z płytek za pomocą specjalnego zdrapywacza do komórek. Zawiesinę komórek spłukać ze wszystkich płytek 3 ml oziębionego PBS i przenieść do dwóch probówek Eppendorfa o poj. 2 ml. 4. Komórki odwirować przy prędkości 2000 rpm przez 5 min. Supernatant odrzucić, a osad z obu probówek zawiesić łącznie w 2 ml buforu do izolacji jąder i inkubować 20 min. w lodzie. 5. Przenieść zawiesinę komórek do homogenizatora szklano-teflonowego i dezintegrować wykonując 40 ruchów teflonowym tłoczkiem (stopień dezintegracji można zweryfikować przy użyciu mikroskopu świetlnego). 6. Uzyskany dezintegrat komórek przenieść do probówki Eppendorfa o poj. 2 ml i odwirować przy prędkości 2000 rpm przez 10 min. 7. Supernatant (zawierający białka cytoplazmatyczne) przenieść do nowej probówki Eppendorfa, oznaczyć w nim stężenie białka metodą Bradford (przepis w załączniku do ćwiczeń), a następnie przygotować próbki do elektroforezy SDS-PAGE zawierające po 15 μg i 30 μg białka (przepis w załączniku do ćwiczeń). Gotowe próbki do analizy metodą SDS-PAGE przechowywać w temp C do kolejnych ćwiczeń. 8. Do osadu jąder dodać 1 ml buforu PBS, kilkukrotnie przepipetować zawartość probówki w celu jej dokładnego wymieszania i odwirować przy 2000 rpm przez 10 min. 9. Po odwirowaniu usunąć z probówki supernatant przy pomocy pipety, a do osadu jąder dodać 1 ml buforu PBS i dokładnie wymieszać ( za pomocą pipety). 5
6 Izolacja białek jądrowych 1. Do probówki Eppendorfa o poj. 1,5 ml przenieść 500 μl zawiesiny jąder i wirować przy prędkości 2000 rpm przez 10 min. 2. Supernatant odrzucić a osad jąder zawiesić w 60 μl buforu próbkowego do elektroforezy SDS-PAGE (1x stężony). 3. Próbki dokładnie wymieszać i inkubować w temp C przez 5 min. W wyniku uwolnienia DNA z jąder zawiesina przyjmuje galaretowatą konsystencję. 4. Po inkubacji próbki odwirować przy prędkości rpm przez 5 min. Supernatant zawierający białka jądrowe przenieść do nowej probówki Eppendorfa i zamrozić. Izolacja histonów z użyciem 0,25 M HCl 1. Do probówki Eppendorfa o poj. 1,5 ml przenieść 500 μl zawiesiny jąder i wirować przy prędkości 2000 rpm przez 10 min. 2. Supernatant odrzucić, a do osadu jąder dodać 50 μl 0,25 M HCl i dokładnie wymieszać. 3. Próbkę pozostawić w temp. pokojowej na 25 min. (ekstrakcja histonów), a następnie odwirować przy prędkości 2000 rpm przez 10 min. 4. Supernatant zawierający histony przenieść do nowej probówki Eppendorfa o poj. 1,5 ml. 5. Do osadu dodać ponownie 50 μl 0,25 M HCl, dokładnie wymieszać i pozostawić na 25 min. w temp. pokojowej (ponowna ekstrakcja w celu zwiększenia wydajności). 6. Próbkę odwirować przy prędkości 2000 rpm przez 10 min. 7. Uzyskane supernatanty, zawierające histony, połączyć. 8. Wytrącać histony z supernatantu przez dodanie 8 objętości (0,8 ml) oziębionego acetonu. Całość pozostawić do kolejnych ćwiczeń (minimum na 24 godziny) w temp. -20 O C. Analiza składu białkowego chromatyny Ćwiczenie ma na celu dokonanie analizy białek jądrowych techniką elektroforezy jednokierunkowej w żelu poliakrylamidowym w warunkach denaturujących SDS-PAGE (metoda Laemmli ego). 6
7 Materiały i odczynniki 1. Aceton (oziębiony) 2. Odczynniki i zestaw do elektroforezy SDS-PAGE (patrz załącznik do ćwiczeń) 3. Preparaty białek jądrowych, cytoplazmatycznych i histonów otrzymane w poprzednim ćwiczeniu Przed przystąpieniem do wykonania ćwiczenia przygotować blok grzejny o temp C oraz schłodzić wirówkę do temp. 4 0 C Wykonanie ćwiczenia 1. rzygotować 13,8 % żel poliakrylamidowy do elektroforezy białek w warunkach denaturujących według przepisu zamieszczonego w załączniku do ćwiczeń. 2. Próbki z wytrąconymi histonami odwirować przy prędkości rpm przez 15 min. w 4 0 C w celu otrzymania osadu białek histonowych. Następnie osad przemyć 1 ml oziębionego acetonu i wysuszyć na powietrzu. Osad białek histonowych zawiesić w 30 μl buforu próbkowego do elektroforezy SDS-PAGE (1x stężony). 3. Próbki zawierające wszystkie białka jądrowe, wyizolowane histony, białka cytoplazmatyczne oraz wzorce białkowe zawieszone w buforze próbkowym do elektroforezy SDS-PAGE ogrzewać przez 3 min. w temp C. Bezpośrednio po ogrzaniu nanosić na żel po 30 μl przygotowanych próbek. Rozdział prowadzić pod napięciem 150V, tak długo, aż barwnik przesunie się do końca żelu separującego. Po rozdziale białka wybarwić błękitem Coomassie (patrz załącznik do ćwiczeń). Interpretacja wyników 1. Porównać skład białkowy preparatów poddawanych elektroforezie. 2. Określić masy cząsteczkowe białek histonowych. 7
8 Trawienie DNA chromatyny nukleazą ze Staphylococcus aureus Nukleaza ze Staphylococcus aureus (MN-aza, nukleaza mikrokokowa) jest stosunkowo niespecyficzną endonukleazą, gdyż tnie zarówno jedno- jak i dwuniciowe kwasy nukleinowe, chociaż bardziej aktywna jest wobec substratów jednoniciowych. Cięcie DNA lub RNA następuje preferencyjnie w regionach bogatych w AT lub AU. Zmieszana z chromatyną MN-aza tnie fragmenty DNA, które nie są chronione przez związanie z białkami. Dlatego też w wyniku działania MN-azy na chromatynę otrzymuje się szereg fragmentów odpowiadających mono- i oligonukleosomom. Enzym ten wykazuje swoją aktywność w obecności jonów Ca 2+. Reakcję trawienia chromatyny przez MN-azę można zahamować stosując odpowiednie stężenie EGTA lub EDTA, które działają jako chelatory jonów dwuwartościowych. Ćwiczenie ma na celu otrzymanie mieszaniny oligonukleosomów w wyniku trawienia chromatyny jąder fibroblastów mysich NIH 3T3 lub komórek HeLa przez niespecyficzną endonukleazę ze Staphylococcus aureus. Materiały i odczynniki 1. Hodowla komórkowa fibroblastów mysich NIH 3T3 lub komórek HeLa o gęstości komórek ok. 90% (trzy płytki Petriego na jeden zespół studentów) 2. Bufor PBS 3. Bufor do izolacji jąder 4. Zdrapywacz do komórek 5. Homogenizator szklano-teflonowy o poj. 2 ml 6. Bufor do cięcia MN-azą: 20 mm Tris-HCl, ph 8,8 5 mm CaCl 2 7. Roztwór MN-azy w H 2 O (300 U/µl). Bezpośrednio przed ćwiczeniami rozcieńczyć MN-azę 240-krotnie (1 µl roztworu MN-azy dodać do 239 µl H 2 O). Uzyskuje się końcowe stężenie 1,25 U/µl mm EDTA 9. 10% SDS 10. Pronaza E roztwór w H 2 O o stężeniu 25 mg/ml 8
9 11. Fenol, ph 7,5-8,0 12. Chloroform M NaCl % etanol (oziębiony) % etanol (oziębiony) 16. Jałowe probówki Eppendorfa o pojemności 1,5 i 2 ml oraz końcówki do pipet. Przed przystąpieniem do wykonania ćwiczenia przygotować blok grzejny o temp C oraz schłodzić wirówkę do temp. 4 0 C Uwaga! Jeśli nie zaznaczono inaczej, poniższe czynności należy wykonywać w temp C Otrzymywanie jąder z fibroblastów mysich NIH 3T3 lub komórek HeLa 1. Trzy płytki Petriego z komórkami fibroblastów mysich o gęstości ok. 90% przenieść na lód i ściągnąć pipetą płyn hodowlany. 2. Przepłukać komórki na każdej płytce 5 ml oziębionego PBS. 3. Po usunięciu PBSu, zeskrobać komórki fibroblastów z płytek za pomocą specjalnego zdrapywacza do komórek. Zawiesinę komórek spłukać ze wszystkich płytek 3 ml oziębionego PBS i przenieść do dwóch probówek Eppendorfa o poj. 2 ml. 4. Komórki odwirować przy prędkości 2000 rpm przez 5 min. Supernatant odrzucić, a osad z obu probówek zawiesić łącznie w 2 ml buforu do izolacji jąder i inkubować 20 min. w lodzie. 5. Przenieść zawiesinę komórek do homogenizatora szklano-teflonowego i dezintegrować wykonując 40 ruchów teflonowym tłoczkiem (stopień dezintegracji można zweryfikować przy użyciu mikroskopu świetlnego). 6. Uzyskany dezintegrat komórek przenieść do probówki Eppendorfa o poj. 2 ml i odwirować przy prędkości 2000 rpm przez 10 min. 7. Po odwirowaniu usunąć z probówki supernatant przy pomocy pipety, a do osadu jąder dodać 1 ml buforu do cięcia MN-azą i dokładnie wymieszać ( za pomocą pipety). 9
10 Trawienie DNA chromatyny MN-azą Uwaga! Wszystkie czynności należy wykonywać z zachowaniem warunków jałowych. Pracę z fenolem wykonywać w rękawicach ochronnych 1. Zawiesinę jąder komórkowych odwirować przy prędkości 2000 rpm przez 10 min. Supernatant odrzucić, a osad jąder zawiesić ponownie w 1 ml buforu do cięcia MN-azą 2. Dodać 5 µl przygotowanego roztworu MN-azy (6,25u) i wymieszać dokładnie zawartość probówki. 3. Bezpośrednio po dodaniu enzymu przenieść 300 µl mieszaniny do nowej probówki Eppendorfa o poj. 1,5 zawierającej 30 µl oziębionego 100 mm EDTA (czas trawienia 0). 4. Pozostałą część mieszaniny inkubować w temp. 37 o C. Po upływie 5 i 10 min. (licząc od czasu 0) inkubacji, przenosić po 300 µl mieszaniny do nowych probówek Eppendorfa zawierających po 30 µl oziębionego 100 mm EDTA. 5. Do tak otrzymanych próbek dodać po 5 µl 10% SDS i 3 µl roztworu pronazy. 6. Inkubować próbki przez 30 min. w temp. 37 o C (trawienie białek jądrowych). Reakcję zatrzymać przez dodanie 34 µl 10% SDS. 7. Do każdej probówki dodać po 400 µl fenolu i wytrząsać całość przez 10 min. (ekstrakcja DNA) po czym odwirować przez 5 min. (jeśli nie zaznaczono inaczej wszystkie wirowania wykonywać przy rpm w 4 0 C) w celu rozdzielenia faz. 8. Górne fazy wodne przenieść do nowych probówek Eppendorfa, dodać po 400 l chloroformu i wytrząsać przez 5 min. (usuwanie resztek fenolu), a potem odwirować przez 5 min. 9. Górne fazy wodne przenieść do nowych probówek Eppendorfa i dodać po 6 l 5M NaCl oraz 800 l oziębionego 96% etanolu. Próbki pozostawić w temp. -20 o C, w celu precypitacji DNA, do kolejnych ćwiczeń. 10
11 Elektroforetyczna analiza DNA po trawieniu nukleazą ze Staphylococcus aureus Ćwiczenie ma na celu dokonanie analizy otrzymanych na poprzednich ćwiczeniach preparatów DNA techniką elektroforezy w żelu agarozowym. Materiały i odczynniki 1. Odczynniki i zestaw do elektroforezy kwasów nukleinowych (patrz załącznik do ćwiczeń) 2. Preparaty DNA otrzymane w trakcie poprzednich ćwiczeń. Wykonanie ćwiczenia 1. Wytrącony na poprzednich ćwiczeniach DNA odwirować przy prędkości rpm przez 15 min. w 4 0 C. Uzyskany osad DNA przemyć 1 ml oziębionego 70% etanolu, po czym odwirować przy rpm przez 5 min. i wysuszyć na powietrzu. 2. Osad DNA rozpuścić w 20 l buforu próbkowego do elektroforezy DNA. 3. Przygotować 80 ml 1% roztworu agarozy w buforze TAE według przepisu zamieszczonego w załączniku do ćwiczeń 4. Na żel agarozowy nanieść otrzymane próbki DNA. Rozdział fragmentów DNA prowadzić przy napięciu 100V dopóki czoło barwnika nie dotrze do 3/4 długości żelu. Po zakończonej elektroforezie obserwować rozdzielone fragmenty DNA pod lampą UV. Obrazem trawienia powinna być drabinka prążków, które odpowiadają fragmentom DNA stanowiącym wielokrotność około 200 par zasad. Interpretacja wyników 1. Porównać obraz elektroforetyczny DNA przed i po trawieniu MN-azą. 2. Określić wielkość fragmentów DNA otrzymanych w wyniku działania MN-azy. 11
12 Analiza zmienności osobniczej DNA w obrębie sekwencji minisatelitarnej Minisatelity to fragmenty DNA składające się z szeregu powtórzeń krótkiej sekwencji o długości kilkudziesięciu nukleotydów. Ilość powtórzeń tej sekwencji jest zmienna osobniczo, wobec czego może być wykorzystywana jako marker zmienności genetycznej. Różnice między allelami bada się z wykorzystaniem w reakcji PCR starterów komplementarnych do sekwencji flankujących region minisatelity. Produkty amplifikacji są następnie nanoszone na żel agarozowy lub, jeśli chcemy precyzyjnie mierzyć długość produktu, poliakrylamidowy i analizowane pod kątem długości. Są to markery kodominujące, co oznacza, że dla heterozygoty w danym locus zobaczymy oba allele. Podczas ćwiczenia zostanie przeanalizowany marker D1S80, którego sekwencja o długości 16 pz może być powtórzona od 14 do 42 razy (najczęściej w populacji występującym allelem jest 24 powtórzeń). Ponadto, marker ten jest heterozygotyczny w 79%. Celem ćwiczenia jest określenie profilu genetycznego charakterystycznego dla DNA każdej osoby. W tym celu z komórek śluzówki policzka zostanie wyizolowane DNA z wykorzystaniem specjalnego firmowego zestawu. Zestaw ten wyposażony jest w kolumienki z membraną krzemionkową, wobec której kwasy nukleinowe wykazują wysokie powinowactwo. Zastosowanie tej technologii pozwala na wygodne przepłukiwanie membrany w celu usunięcia zanieczyszczeń, dzięki czemu uzyskane preparaty DNA charakteryzują się wysoką czystością. Wyekstrahowane DNA wykorzystuje się następnie w reakcji PCR, podczas której amplifikacji podlega tzw. fragment minisatelitarny. Materiały i odczynniki 1. Zestaw do izolacji genomowego DNA z wymazów ( np. Genomic Micro AX Swab Gravity Plus) 2. Startery reakcji PCR 3. Polimeraza Taq 0,5U/ l 4. Bufor dla polimerazy Taq z siarczanem amonu (firmowy) 5. 2 mm mieszanina deoksynukleotydów (dntp) mm MgCl 2 (firmowy) 7. Jałowa dejonizowana woda 12
13 8. Odczynniki i zestaw do elektroforezy kwasów nukleinowych (patrz załącznik do ćwiczeń) 9. Cienkościenne probówki do reakcji PCR o poj. 0,2 ml 10. Jałowe probówki Eppendorfa o pojemności 1,5 i 2 ml oraz końcówki do pipet. Izolacja DNA z nabłonka jamy ustnej 1. Do probówki o poj. 2 ml typu eppendorf dodać 700 µl buforu lizującego L. 2. Otworzyć opakowanie i wyjąć wymazówkę z probówki ochronnej. Uwaga! Koniec wymazówki nie może dotknąć żadnej przypadkowej powierzchni ani innej osoby poza osobą, od której pobierany jest wymaz. 3. Pobrać wymaz przy użyciu wymazówki dołączonej do zestawu. W tym celu pocierać końcem wymazówki obie strony wewnętrznej części policzka przez 5 min. Następnie szczoteczkę z pobraną próbką umieścić w probówce z buforem L, stosując wyrzutnik wymazówki lub odciąć część patyczka wymazowego z pobraną próbką za pomocą nożyczek (szczoteczka wymazówki z pobraną próbką powinna być całkowicie zanurzona w buforze lizującym L). 4. Do próbki dodać 20 µl Proteinazy K i wymieszać przez worteksowanie. Następnie próbkę inkubować 10 min. w temp. 50 C z ciągłym mieszaniem bądź mieszać próbkę podczas inkubacji przez worteksowanie co 2 min. 5. Podczas inkubacji umieścić kolumnę Micro AXD w probówce odbieralnikowej i wstawić ją do statywu. 6. Nanieść na kolumnę 500 µl roztworu równoważącego K1. Odczekać aż do całkowitego przejścia buforu przez kolumnę. 7. Po inkubacji w temp. 50 C, próbkę wymieszać przez worteksowanie przez 2 min. 8. Krótko odwirować próbkę w celu osadzenia całości materiału na dnie probówki. 9. Nanieść próbkę na kolumnę Micro AXD. Poczekać aż roztwór przejdzie przez kolumnę. 10. Dodać na kolumnę Micro AXD 600 µl pierwszego roztworu płuczącego W1. Poczekać aż roztwór przejdzie przez kolumnę. 11. Dodać na kolumnę Micro AXD 500 µl drugiego roztworu płuczącego W2. Poczekać aż roztwór przejdzie przez kolumnę. 12. Dodać do kolumny Micro AXD 60 µl roztworu elucyjnego E i poczekać 5 min. 13
14 13. W tym czasie przygotować probówkę o poj. 1,5 ml typu eppendorf i dodać na jej dno 5 µl buforu zobojętniającego N. 14. Przenieść kolumnę Micro AXD do przygotowanej probówki. 15. Dodać na kolumnę 60 µl roztworu elucyjnego E. Odczekać aż roztwór całkowicie wypłynie do probówki. Następnie krótko zwirować próbkę. 16. Kolumnę Micro AXD usunąć a DNA znajdujące się w probówce przetrzymywać w lodówce do czasu dalszych analiz. 17. Sprawdzić wydajność izolacji oraz czystość preparatu DNA wykorzystując spektrofotometr NanoDrop 2000c. Amplifikacja i analiza elektroforetyczna sekwencji minisatelitarnej z uzyskanego DNA 1. W probówkach do reakcji PCR o poj. 0,2 ml, przygotować 10 µl mieszaniny reakcyjnej o następującym składzie: Woda 4,3 µl Bufor Taq z siarcz. am. 1 µl dntp (2mM) 1 µl MgCl 2 (25 mm) 0,4 µl Starter F (20mM) 0,5 µl Starter R (20mM) 0,5 µl Polimeraza Taq 0,3 µl DNA 2 µl 2. Przygotowaną mieszaninę reakcyjną wstawić do termocyklera i ustawić podany program reakcji: 95 C 2 min. 95 C - 15s 67 C - 30s x30 72 C - 30s 72 C 2 min. 3. Po zakończeniu reakcji PCR, do probówki dodać 5 l buforu do elektroforezy DNA i przeprowadzić rozdział elektroforetyczny powstałych produktów reakcji oraz komercyjnego wzorca DNA w 1% żelu agarozowym (według przepisu zamieszczonego w załączniku do ćwiczeń), ważne, aby przy wylewaniu żelu użyć grzebyków o cienkich ząbkach zwiększa to rozdzielczość rozdziału. Interpretacja wyników - Przeanalizować zmienność genetyczną w grupie. 14
15 Otrzymywanie rybosomów i frakcji cytoplazmatycznej drożdży Saccharomyces cerevisiae Frakcjonowanie komórek to metoda rozdzielania struktur subkomórkowych polegająca na wstępnej dezintegracji oraz poddaniu homogenatu wirowaniu różnicowemu (kilkukrotnemu wirowaniu ze stopniowo wzrastającą siłą odśrodkową) albo wirowaniu w gradiencie sacharozy czy chlorku cezu (poszczególne struktury subkomórkowe osadzają się w roztworze o różnej gęstości). Celem ćwiczenia jest izolacja mikrosomów i frakcji cytoplazmatycznej oraz oczyszczenie rybosomów z drożdży S. cerevisiae techniką wirowania różnicowego. Mikrosomy są pęcherzykami, powstającymi z samozasklepiających się fragmentów gładkiego lub szorstkiego retikulum endoplazmatycznego. W celu uwolnienia rybosomów od błon retikulum endoplazmatycznego stosuje się bufor z dodatkem 1% niejonowego detergentu jakim jest Triton X-100. Tak traktowane rybosomy (tzw. rybosomy surowe) zawierają zasocjowane z nimi białka cytoplazmatyczne, które można usunąć z powierzchni rybosomów za pomocą zbuforowanych roztworów o wysokim stężeniu soli. Materiały i odczynniki 1. Osad zamrożonych komórek drożdży S. cerevisiae 2. Piasek do dezintegracji 3. 2 M Tris 4. 10% roztwór Tritonu X-100 w buforze A 5. Bufor A (do dezintegracji) 50 mm Tris-HCl, ph 7,5 80 mm KCl 12,5 mm MgCl 2 0,5 mm EDTA 1 mm PMSF 6 mm β- MET 15
16 6. Bufor B (do zawieszania rybosomów) 50% glicerol 50 mm Tris-HCl, ph 7,5 80 mm KCl 10 mm MgCl 2 0,5 mm EDTA 5 mm DTT 7. Bufor A z dodatkiem 0,5 M KCl 8. 30% sacharoza w buforze A z dodatkiem 0,5 M KCl 9. Stały siarczan amonu 10. Bufor C (do preparatyki kinaz białkowych) 50 mm Tris HCl, ph 7,5 0,5 mm EDTA 6 mm β- MET 0,5 mm PMSF 11. Odczynnik Bradford Wykonanie ćwiczenia Uwaga! Poniższe czynności należy wykonywać w temp. 4 0 C Dezintegracja komórek drożdży i otrzymywanie ekstraktu bezkomórkowego 1. Osad zamrożonych komórek drożdżowych zważyć. 2. Komórki drożdżowe dezintegrować, ucierając je z piaskiem w moździerzu porcelanowym przez około 15 min. Piasek dodawać stopniowo w ilości wagowej 3 -krotnie większej od masy komórek. Podczas dezintegracji utrzymywać wartość ph w zakresie 7,2 7,5 poprzez dodawanie 2 M Trisu (niebuforowanego). 3. Uzyskany dezintegrat drożdży zawiesić w buforze A i wirować przy 3000 rpm przez 5 min. celem osadzenia piasku i resztek komórek. 4. Uzyskany supernatant wirować przy x g w ciągu 15 min. aby osadzić struktury subkomórkowe (mitochondria, jądra, ściany komórkowe). 5. Tak otrzymany ekstrakt komórkowy (tzw. frakcja S30) podzielić na dwie części. Do jednej części, przy stałym mieszaniu, dodać 10% Tritonu X-100 tak, aby jego 16
17 końcowe stężenie wynosiło 1%, po czym ekstrakt mieszać jeszcze przez 10 min. Drugą część ekstraktu przechowywać w tym czasie w temp. 4 0 C. 6. Obie części wirować przy x g przez 30 min. W wyniku wirowania otrzymuje się frakcję cytoplazmatyczną, tzw. frakcję S100 i frakcję mikrosomalną (z części nietraktowanej Tritonem X-100) oraz rybosomy surowe (z części traktowanej Tritonem X-100). 7. Osady stanowiące frakcję mikrosomalną oraz rybosomy surowe zawiesić w buforze B (za pomocą homogenizatora szklano-teflonowego) i przechowywać do kolejnych ćwiczeń w temp C. 8. W supernatancie stanowiącym frakcję cytoplazmatyczną oznaczyć białko metodą Bradford. a następnie przygotować dwie próbki do elektroforezy SDS/PAGE zawierające po 25 μg białka. Gotowe próbki białkowe przechowywać do kolejnych ćwiczeń w temp C. Oczyszczanie rybosomów 1. Osad rybosomów surowych zawiesić w buforze A z dodatkiem 0,5 M KCl i mieszać w homogenizatorze szklanym przez 15 min. po czym osadzić przez wirowanie przy x g przez 1,5 godz. Czynność tę wykonać dwukrotnie. 2. Uzyskany preparat rybosomów ponownie zawiesić w buforze A z 0,5 M KCl i wirować przez 1cm warstwę zbuforowanego roztworu sacharozy (30% sacharoza w buforze A z dodatkiem 0,5 M KCl) przy x g przez 3 godz. Po osadzeniu, rybosomy zawiesić w buforze B, oznaczyć ich stężenie (przepis patrz załącznik do ćwiczeń) i przechowywać do kolejnych ćwiczeń w temp C. 17
18 Izolacja kwaśnych białek rybosomowych z drożdży Większość białek rybosomowych stanowią małe białka o charakterze zasadowym, których punkt izoelektryczny oscyluje w pobliżu ph 8,5 lub wyższym. Duża podjednostka rybosomów zawiera jednak grupę powierzchniowych białek kwaśnych, tworzących charakterystyczną strukturę zwaną kciukiem, który oddziałuje z czynnikami translacyjnymi podczas syntezy białka. U bakterii kwaśne białka rybosomowe tworzą pentameryczny lub heptameryczny kompleks, złożony, odpowiednio, z dwóch lub trzech dimerów białka L12 oraz pojedynczej cząsteczki białka L10. U Escherichia coli białko L12 nazywane jest L7/L12. Różnica między L7 i L12 polega na potranslacyjnej acetylacji na N-końcu polipeptydu L7. Białko L7/L12 E. coli złożone ze 120 aminokwasów i posiada masę cząsteczkową 12,2 kda. Eukariotyczne białka kwaśne noszą nazwę białek P, ze względu na ich fosforylacyjną modyfikację. Białka te podzielono na dwie grupy. Jedną z nich stanowią dwa małe białka P1 i P2 o masie 11 kda i pi równym 3,0-3,5, będące funkcjonalnymi odpowiednikami bakteryjnego białka L12. U niższych eukariontów takich jak drożdże stwierdzono obecność czterech białek P1/P2. Kwaśne białka drożdży S. cerevisiae nazwano P1A, P1B, P2A i P2B. Ponadto u roślin zidentyfikowano dodatkowo białko P3. Drugą grupę białek P stanowi pojedyncze białko P0 o masie ok. 34 kda, będące odpowiednikiem bakteryjnego białka L10. Na rybosomie białka P tworzą pentameryczny kompleks P0-(P1-P2) 2, który wiąże się, poprzez N-końcowy fragment białka P0, do wysoce konserwatywnego regionu 25S/28S rrna, zwanego centrum GTPazowym. U S. cerevisiae białka z grupy P1/P2 tworzą preferencyjnie dwa heterodimery P1A-P2B i P1B-P2A w których N-końcowe fragmenty białek są odpowiedzialne za dimeryzację i interakcje z białkiem P0, zaś karboksylowe końce są wolne i oddziałują z czynnikami translacyjnymi takimi jak EF-2. Białka z grupy P1/P2 nie są niezbędne dla aktywności translacyjnej rybosomu, natomiast białko P0 jest stabilnym białkiem rdzenia rybosomowego i jest konieczne dla jego funkcjonowania. Delecja genu dla P0 prowadzi do śmierci komórki. Wszystkie białka P charakteryzują się niezwykle konserwatywną C-końcową domeną, zawierającą resztę seryny ulegającą fosforylacyjnej modyfikacji oraz stanowiącą antygen, przeciwko któremu skierowane są przeciwciała u ludzi cierpiących na niektóre choroby autoimmunologiczne (układowy toczeń trzewny) i infekcyjne (choroba serca Chagasa, leiszmanioza). W odróżnieniu od pozostałych składników rybosomu kwaśne białka rybosomowe, zarówno bakteryjne jak i eukariotyczne, występują w postaci wolnej w cytoplazmie. 18
19 U organizmów eukariotycznych, w przeciwieństwie do bakterii, odbywa się ponadto wymiana tych białek między rybosomem a pulą cytoplazmatyczną. Materiały i odczynniki 1. Oczyszczone rybosomy drożdżowe o stężeniu 20 mg/ml 2. Bufor do ekstrakcji kwaśnych białek rybosomowych 20 mm Tris-HCl, ph 7,5 40 mm MgCl 2 6 mm β- MET 1 M NH 4 Cl 3. 96% etanol (oziębiony) 4. Aceton (oziębiony) mm Tris-HCl, ph 7,5 6. Odczynnik Bradford Wykonanie ćwiczenia 1. Kwaśne białka rybosomowe ekstrahować z 2 mg rybosomów oczyszczonych S. cerevisiae o stężeniu 20 mg/ml. Do zawiesiny rybosomów (1 objętość) dodać 1 objętość buforu do ekstrakcji białek kwaśnych i pozostawić na 5 min. w lodzie. 2. Dodać 1 objętość 96% etanolu (oziębionego) i pozostawić na 10 min. w lodzie. 3. Powtórzyć punkt Odwirować przy rpm przez 15 min. w celu osadzenia cząstek rdzeniowych rybosomów ( tj. rybosomów zawierających białka, które nie zostały wyekstrahowane). 5. Supernatant zawierający kwaśne białka rybosomowe przenieść do nowej probówki Eppendorfa, dodać trzykrotną objętość oziębionego acetonu (w celu wytrącenia białek z supernatantu) i pozostawić w temp C przez co najmniej 24 godz. 6. Wytrącone białka osadzić drogą wirowania przy rpm przez 15 min., po czym supernatant odrzucić, a osad kwaśnych białek rybosomowych wysuszyć na powietrzu i zawiesić w 50 µl 25 mm Trisu HCl, ph 7,5. 7. Oznaczyć stężenie białka metodą Bradford (przepis w załączniku do ćwiczeń) 19
20 Analiza otrzymanych białek metodą SDS/PAGE i immunoblotingu Technika immunoblotingu, zwana inaczej techniką western blot, składa się z kilku etapów. Pierwszym etapem jest rozdzielenie mieszaniny białek w żelu poliakrylamidowym. Następnie białka przenoszone są na membranę (w naszym przypadku jest to transfer półsuchy), która niespecyficznie wiąże wszystkie białka. Ostatnim etapem jest detekcja białek przy udziale przeciwciał. Po rozdziale elektroforetycznym w obecności SDS białka są zdenaturowane i wszystkie posiadają ładunek ujemny proporcjonalny do ich masy. Transfer odbywa się zatem w kierunku elektrody dodatniej. Wyróżniamy dwa typy transferu: transfer mokry i półsuchy. Transfer Aby przeprowadzić transfer białek na membranę, należy przygotować kanapkę złożoną z żelu, membrany i bibuły Whatman. W przypadku transferu mokrego, kanapka ułożona jest pionowo pomiędzy dwiema elektrodami, a całość umieszczana jest w aparacie wypełnionym buforem. Transfer mokry stosuje się zwłaszcza w przypadku białek dużych (>100 kda), hydrofoowych lub trudno rozpuszczalnych ze względu na możliwość prowadzenia go nawet przez 24 godziny, bez ryzyka wyparowania buforu. Należy wówczas zapewnić chłodzenie, aby utrzymać temperaturę w granicach C. Transfer mokry przeprowadza się przy stałym napięciu prądu, zwykle V. W przypadku transferu półsuchego kanapka ułożona jest poziomo między elektrodami. Żel i membrana umieszczone są pomiędzy bibułami Whatman nasączonymi buforem. Transfer ten prowadzi się przy stałym natężeniu prądu, wynoszącym zwykle 0,8 1,5 ma/cm 2 membrany. Transfer białek z żelu można przeprowadzić na membrany nitrocelulozowe lub membrany z polifluorku winylidenu (PVDF). Wielkość porów w obu typach membranach waha się od 0,1 μm do 0,45 μm. Membrany nitrocelulozowe są tańsze, wiążą μg białka na cm 2. Membrany te od razu nasącza się buforem do transferu, bez uprzedniego zanurzania ich w metanolu. Membrany PVDF wiążą μg białka na cm 2 i mają dużo większą wytrzymałość mechaniczną niż membrany nitrocelulozowe. Należy pamiętać o wcześniejszym zanurzeniu ich w metanolu i dopiero później w buforze do transferu. 20
21 Blokowanie membran Po transferze wolne miejsca wiązania białek na membranie są blokowane, aby zapobiec niespecyficznemu wiązaniu się przeciwciał do membrany. Do blokowania membran używa się odtłuszczonego mleka lub albuminy z surowicy bydlęcej. Wiązanie przeciwciał Badane białka identyfikuje się przy użyciu wyznakowanych przeciwciał pierwszorzędowych (swoistych dla badanych białek), lub niewyznakowanych przeciwciał pierwszorzędowych i wyznakowanych przeciwciał drugorzędowych (specyficznych dla pierwszorzędowych). Następnie przeprowadza się detekcję przeciwciał związanych z badanymi białkami, której sposób zależy od rodzaju znacznika, jaki dołączony jest do przeciwciał. Detekcja Najczęściej dołączanymi do przeciwciał znacznikami są enzymy: alkaliczna fosfataza i peroksydaza chrzanowa. Wizualizacja tych znaczników może być przeprowadzona kolorymetrycznie (w miejscu związania przeciwciał do białka na membranie powstaje barwny produkt) lub chemiluminescencyjnie (enzym przeprowadza reakcję z wytworzeniem światła, odczytu ilości emitowanego światła można dokonać na dwa sposoby, stosując urządzenie do detekcji chemiluminescencji lub za pomocą kliszy fotograficznej). Ćwiczenie ma na celu dokonanie analizy białek rybosomowych i cytoplazmatycznych techniką SDS-PAGE i immunoblotingu. Przeprowadzimy identyfikację immunologiczną białek P drożdży. W tym celu wykorzystamy niewyznakowane przeciwciała pierwszorzędowe rozpoznające drożdżowe, białka P i przeciwciała drugorzędowe sprzężone z alkaliczną fosfatazą. Materiały i odczynniki 1. Odczynniki i zestaw do elektroforezy SDS-PAGE (patrz załącznik do ćwiczeń). 2. Preparaty mikrosomów, rybosomów surowych, rybosomów oczyszczonych, frakcji cytoplazmatycznej oraz białek P otrzymane na poprzednich ćwiczeniach. 3. Membrana PVDF. 21
22 4. Metanol 5. Bibuła Whatman 3 MM. 6. Bufor Novablot. 7. Czerwień Ponceau. 8. PBS 9. Roztwór blokujący (10 % roztwór mleka odtłuszczonego w PBS). 10. Aparat do pół-suchego transferu białek. 11. Przeciwciała pierwszorzędowe (poliklonalna surowica skierowana przeciwko drożdżowym białkom P) 12. Drugorzędowe przeciwciała sprzężone z alkaliczną fosfatazą 13. Bufor PBS 14. Bufor PBS-T (PBS z 0,1 % Tween 20) 15. Bufor AP 16. NBT (18 mg NBT rozpuścić w 1400 µl DMF i 600 µl wody). Przechowywać w -20 o C. 17. BCiP (8 mg BCiP rozpuścić w 2 ml DMF). Przechowywać w -20 o C. 18. Probówki Falcona o pojemności 15 ml i 50 ml. 19. Pęsety. 20. Rękawiczki nitrylowe. Wykonanie ćwiczenia 1. Przygotować dwa 12 % żele poliakrylamidowe do elektroforezy białek w warunkach denaturujących według przepisu w załączniku do ćwiczeń. 2. Oznaczyć stężenie mikrosomów, rybosomów surowych i oczyszczonych (przepis patrz załącznik do ćwiczeń) 3. Przygotować po dwie próbki białkowe do elektroforezy SDS/PAGE zawierające: a) 25 μg mikrosomów, b) 25 μg rybosomów surowych, c) 25 μg rybosomów oczyszczonych, d) 25 μg białek frakcji cytoplazmatycznej, e) 5μg białek P, e) wzorce białkowe, według przepisu w załączniku do ćwiczeń. 4. Próbki białkowe zawieszone w buforze próbkowym SDS/PAGE nanieść na żele poliakrylamidowe. Rozdział prowadzić pod napięciem 150V tak długo, aż barwnik przesunie się do końca żelu separującego. Po rozdziale, jeden żel poliakrylamidowy wybarwić błękitem Coomassie, (przepis w załączniku do ćwiczeń). 5. Drugi żel poliakrylamidowy przepłukać buforem Novablot a następnie przeprowadzić transfer białek z żelu na membranę PVDF (wcześniej nawilżoną metanolem 22
23 a następnie buforem Novablot), umieszczoną pomiędzy dwiema potrójnymi warstwami bibuły Whatman 3 MM nawilżonej buforem Novablot. Całość umieścić w aparacie do elektrotransferu pomiędzy grafitowymi elektrodami. Transfer białka prowadzić w kierunku anody przy natężeniu prądu 280 ma przez jedną godzinę. 6. Po zakończeniu transferu, membranę PVDF inkubować z 0,02% roztworem czerwieni Ponceau (celem wybarwienia markerów białkowych). Po zaznaczeniu ołówkiem pozycji markerów białkowych, odpłukać barwnik za pomocą buforu PBS. Następnie inkubować membranę w roztworze blokującym, w temp. 4 o C, do kolejnych ćwiczeń. 7. Wylać roztwór blokujący i dodać do membrany 20 ml przeciwciał pierwszorzędowych rozcieńczonych 1:1000, w buforze PBS i pozostawić przez 40 min. na kołysce w temp. pokojowej. 8. Odpłukać przeciwciała roztworem PBST: 4 razy przez 1 min. 9. Na płytkę z membraną wlać 20 ml przeciwciał drugorzędowych rozcieńczonych 1:10000 w 20 ml PBST i pozostawić na kołysce w temperaturze pokojowej na 40 min. (w czasie inkubacji przygotować barwniki do detekcji). 10. Odpłukać przeciwciała roztworem PBST: 4 razy przez 1 min. 11. Przepłukać membranę buforem AP: 2 razy przez 1 min. 12. Przeprowadzić detekcję białek na membranie. W tym celu do probówki Falcona dodać 10,5 ml buforu AP a następnie dodać jednocześnie dwa przygotowane wcześniej barwniki (NBT i BCiP). Wymieszać zawartość probówki Falcona i wylać całość na płytkę z membraną. Pozostawić na kołysce do pojawienia się prążków. Reakcje barwienia przerwać poprzez płukanie membrany wodą dejonizowaną, po czym membranę wysuszyć na powietrzu. Interpretacja wyników 1. Porównać skład białkowy preparatów poddawanych elektroforezie. 2. Określić masy cząsteczkowe białek P. 3. Określić w jakich frakcjach komórkowych występują białka P drożdży. 23
24 Badanie aktywności enzymatycznej w żelu poliakrylamidowym na przykładzie inwertazy Badanie aktywności enzymów w żelu poliakrylamidowym jest często skuteczną metodą identyfikacji enzymów w nieoczyszczonych preparatach białkowych. Badanie aktywności enzymatycznej można przeprowadzać zarówno po rozdziale białek w żelu poliakrylamidowym w warunkach denaturujących jak i po elektroforezie w warunkach natywnych. Wybór metody zależy w dużej mierze od wrażliwości badanego enzymu na obecność SDS. W przypadku niektórych białek, które nie zachowują aktywności enzymatycznej w obecności SDS, można przeprowadzić ich renaturację poprzez usunięcie SDS (np. płucząc żel w roztworze 2,5% tritonu X-100). Jednakże nie ma jednej uniwersalnej, efektywnej metody renaturacji enzymów, toteż aktywność enzymatyczną niektórych białek bada się po przeprowadzeniu elektroforezy w warunkach natywnych. Inwertaza, albo sacharaza (EC ) katalizuje hydrolizę sacharozy będącej disacharydem złożonym z cząsteczki α-d-glukozy i cząsteczki β-d-fruktozy połączonych wiązaniem α1-β2 glikozydowym. Po rozerwaniu wiązania powstaje równomolarna mieszanina cząsteczek glukozy i fruktozy. Inwertaza jest syntetyzowana przez wiele szczepów drożdży i bakterii. Ilość enzymu produkowana przez mikroorganizm waha się znacznie w zależności od gatunku, szczepu, czy dostępnego źródła węgla. Drożdże Saccharomyces cerevisiae wytwarzają zarówno wewnątrz- jak i zewnątrzkomórkową inwertazę. Zewnątrzkomórkowa inwertaza występuje w formie wysoce glikozylowanego homodimeru wydzielanego do przestrzeni periplazmatycznej. Wewnątrzkomórkowa inwertaza również tworzy homodimer ale nie ulega glikozylacji. Inwertaza jest powszechnie stosowana w przemyśle spożywczym do produkcji fruktozy czy w biosensorach do stałego monitorowania poziomu sacharozy. Celem ćwiczenia jest identyfikacja aktywności enzymatycznej inwertazy z drożdży S. cerevisiae po rozdziale w żelu poliakrylamidowym w warunkach denaturujących. Materiały i odczynniki godzinna hodowla drożdży S cerevisiae, szczep W303 (50 ml na zespół studentów) 2. (NH 4 )SO 4 cz. d. a. w postaci stałej mm bufor fosforanowy ph 7, mm bufor fosforanowy ph 7,0 z dodatkiem 30% glicerolu 24
25 5. 10 mm bufor fosforanowy ph 5,8 6. 0,1 M r-r sacharozy w 10 mm buforze fosforanowym ph 5,8 (przygotować bezpośrednio przed użyciem) 7. Chlorek tetrazolu w postaci stałej (chronić przed światłem!!!) 8. 1M NaOH 9. Inwertaza - preparat handlowy (1 mg/ml w 10 mm buforze fosforanowym ph 5,8) przygotować w dniu poprzedzającym ćwiczenia, przechowywać w temp. 4 0 C. 10. Celulozowe węże do dializy 11. Papierki wskaźnikowe ph 5,4 7, % roztwór kwasu octowego 13. Odczynniki i zestaw do elektroforezy białek SDS/PAGE Wykonanie ćwiczenia Wysalanie i dializa białek z płynu pohodowlanego 1. Po ok. 20 godzinach hodowli, gdy OD 600 równa się ok (faza stacjonarna) odwirować komórki przy 3000 rpm przez 10 min. 2. Płyn pohodowlany zlać do cylindra (źródło inwertazy) a osad komórek odrzucić. 3. Zmierzyć objętość płynu pohodowlanego, przelać go do zlewki i pozostawić w lodzie na mieszadle magnetycznym. 4. Białka wytrącać stałym siarczanem amonu przy wysyceniu 0-90% (tabela frakcjonowania siarczanem amonu załącznik do ćwiczeń). Siarczan amonu dodawać stopniowo mieszając przez 1 godz. w temp. 4 0 C. Następnie zawiesinę odwirować przy rpm przez 20 min. 5. Osad wytrąconych białek rozpuścić w µl 10 mm buforu fosforanowego, ph 7,0 i poddać dializie (przepis załącznik do ćwiczeń) wobec 10 mm buforu fosforanowego, ph 7,0 z dodatkiem 30% glicerolu. Po zakończeniu dializy roztwór białek przechowywać w temp C. 25
26 Oznaczanie aktywności inwertazy w żelu 1. Oznaczyć stężenie białka metodą Bradford (przepis załącznik do ćwiczeń). 2. Przygotować 10% żel poliakrylamidowy do elektroforezy białek w warunkach denaturujących (SDS/PAGE) według przepisu w załączniku do ćwiczeń. 3. Przygotować trzy próbki zawierające: 100 µg, 150µg i 200 µg białka w objętości 30 µl i dodać do nich po 10 µl buforu próbkowego do elektroforezy białek w warunkach denaturujących (bezpośrednio przed naniesieniem na żel). Jako wzorzec przygotować dwie próbki zawierające 10 µg i 20µg inwertazy handlowej w objętości 30 µl i dodać do nich po 10 µl buforu próbkowego. Dokładnie wymieszać (uwaga! nie ogrzewać próbek w temperaturze 90 0 C) i nanieść do studzienek w żelu zagęszczającym. 4. Rozdział elektroforetyczny prowadzić pod napięciem 150 V tak długo, aż barwnik przesunie się do końca żelu separującego. 5. Po zakończeniu elektroforezy żel przenieść do małego pojemnika, przepłukać 30 ml wody destylowanej, a następnie 30 ml 10 mm buforu fosforanowego ph 5,8. 6. Następnie żel zalać 30 ml 0,1 M roztworu sacharozy w 10 mm buforze fosforanowym ph 5,8 i inkubować w łaźni wodnej w temp C przez 45 min. Uwaga! Podczas inkubacji należy kontrolować, za pomocą papierków wskaźnikowych, ph r-ru (ph r-ru wzrasta, zwłaszcza w ciągu pierwszych 15 min. inkubacji). W przypadku zmiany ph, zlać roztwór sacharozy i zalać żel kolejną porcją. 7. Po zakończeniu inkubacji, zlać roztwór sacharozy, a żel przepłukać trzy razy wodą destylowaną. 8. Ok. 10 min przed zakończeniem inkubacji przygotować wrzącą łaźnię wodną. Naważyć 50 mg chlorku tetrazolu i rozpuścić w 50 ml 1M NaOH. 9. Gdy roztwór chlorku tetrazolu zaczyna zmieniać barwę (z bezbarwnej na różową), wlać barwnik do naczynia z żelem i umieścić we wrzącej łaźni wodnej. 10. Żel barwić do pojawienia się czerwonych prążków białkowych. 11. Reakcję przerwać przez przeniesienie żelu do roztworu 10 % kwasu octowego. 26
27 Identyfikacja białek w komórkach ssaczych metodą immunocytochemiczną Immunocytochemia (ICC, ang. immunocytochemistry) jest laboratoryjną techniką mikroskopową powszechnie wykorzystywaną w badaniach podstawowych takich dziedzin nauki jak np. biologia komórki czy biologia molekularna. Jednocześnie stanowi ona również potężne narzędzie diagnostyczne stosowane szeroko w medycynie. Zasada metody ICC polega na wykrywaniu in situ w komórce, tkance (immunohistochemia, IHC) konkretnych antygenów (najczęściej są to białka, ale również kwasy nukleinowe i polisacharydy) oraz definiowaniu ich subkomórkowej lokalizacji w oparciu o zastosowanie przeciwciał specyficznie rozpoznających charakterystyczne dla danego antygenu regiony określane jako epitopy. Wysoka specyficzność wiązania antygenu przez przeciwciało jest determinowana unikalną strukturą epitopów danego antygenu rozpoznawaną przez konkretne przeciwciało na zasadzie dopasowania przestrzennego. Wizualizacja powstałych w komórce immunokompleksów (kompleksy przeciwciało-antygen) jest możliwa dzięki znacznikom przyłączonym do przeciwciał. Generalnie wyróżnia się trzy grupy znaczników: 1) enzymy (immunocytochemia właściwa), które przekształcają rozpuszczalny w wodzie substrat w barwny i nierozpuszczalny w wodzie produkt np. peroksydaza chrzanowa (HRP) czy alkaliczna fosfataza (AP) (Rys. 1), Rys. 1 Analiza IHC chromograniny A pokazująca rekcję pozytywną w materiale pobranym z trzustki (prawy panel) oraz reakcję negatywną w kontroli bez użycia przeciwciał anty-chromogranina A (lewy panel). IHC pośrednia z wykorzystaniem pierwszorzędowych monoklonalnych przeciwciał anty-chromogranina A i przeciwciał drugorzędowych wyznakowanych HRP (Fot. Thermo Scientific. Pierce Antibody Products). 27
28 2) fluorofory (immunocytofluorescencja IF) charakteryzujące się emisją światła o innej długości fali niż światło wykorzystane do jego wzbudzenia np. FITC, barwniki z rodziny Alexa Fluor, czy znaczniki nowej generacji tj. kropki kwantowe QDs (ang. qantum dots) (Rys. 2) oraz Rys. 2 Analiza ICC/IF białka HER2 pokazująca rekcję pozytywną w komórkach linii SK-BR-3 (prawy panel) oraz reakcję negatywną w kontroli bez użycia przeciwciał anty-her2 (lewy panel). ICC/IF pośrednia z wykorzystaniem pierwszorzędowych monoklonalnych przeciwciał anty-her2 i przeciwciał drugorzędowych wyznakowanych fluoroforem DyLight 488. Jądra komórkowe wyznakowano barwnikiem DAPI. (Fot. Thermo Scientific. Pierce Antibody Products). 3) białka zawierające metale ciężkie np. ferrytyna czy też same cząsteczki metali ciężkich tj. np. koloidalne złoto w przypadku analiz ultrastrukturalnych w mikroskopii elektronowej. Detekcję antygenu w analizowanym materiale przeprowadza się stosując obserwacje mikroskopowe w określonym typie mikroskopu (świetlny, fluorescencyjny, konfokalny, elektronowy), co warunkowane jest rodzajem znacznika przyłączonego do przeciwciała specyficznie wiążącego badany antygen. Wśród metod immunocytochemicznych wyróżnia się metody bezpośrednie i pośrednie. Immunocytochemia bezpośrednia polega na detekcji analizowanego antygenu w komórce za pomocą wyznakowanego przeciwciała pierwszorzędowego specyficznie wykrywającego dany antygen. Ze względu na zwiększoną czułość częściej stosuje się jednak nieco bardziej skomplikowaną i czasochłonną immunocytochemię pośrednią. W tym przepadku przeciwciało pierwszorzędowe skierowane przeciwko analizowanemu antygenowi jest niewyznakowane i dopiero zastosowanie wyznakowanego przeciwciała drugorzędowego specyficznie rozpoznającego przeciwciało pierwszorzędowe umożliwia wizualizację reakcji (schemat poniżej). 28
29 Ze względu na szeroki wachlarz możliwości jakie stwarzają metody immunocyto- i histochemiczne z powodzeniem stosuje się je w medycznych laboratoriach naukowych jak również w diagnostyce klinicznej. Wykorzystuje się je m.in. do potwierdzenia infekcji wirusowych (np. CMV, HBV, HCV), diagnostyki wrodzonych chorób genetycznych (tj. np. dystrofie mięśniowe, choroby mitochondrialne) i chorób metabolicznych (np. miażdżyca). Immunocytochemia odgrywa również bardzo ważną rolę w diagnostyce nowotworów. Analizując obecność lub poziom ekspresji markerów nowotworowych możliwe jest wstępne określenie typu nowotworu (np. antygen CA rak jajnika, PSA - rak gruczołu krokowego, CEA - rak jelita grubego, ale również żołądka, płuc, S-100 czerniak, ale i diagnostyka nowotworów pochodzenia nerwowego) i różnicowanie nowotworów (np. antygen LCA w różnicowaniu raków i chłoniaków w nowotworach płuc), zdefiniowanie czy nowotwór jest złośliwy czy łagodny (np. ekspresja E-kadheryny, kalretyniny), określenie stadium rozwoju nowotworu, identyfikacja typu komórek w przerzutach i odnalezienie źródła przerzutowania czyli nowotworu pierwotnego (identyfikacja białek filamentów pośrednich FP tj. np. cytokeratyna, wimentyna, nestyna), jak również przewidywanie odpowiedzi na zastosowaną terapię czyli identyfikacja markerów predykcyjnych (np. lek trastuzumab, nazwa handlowa: Herceptin, jest skuteczny w leczeniu raka piersi z przerzutami jedynie przy nadekspresji białka HER2) jak również markerów prognostycznych. IHC wykorzystuje się również przy opracowywaniu leków do testowania ich skuteczności poprzez wykrywanie aktywności lub zmian w poziomie ekspresji molekularnego celu leku w chorobowo zmienionej komórce. Jakkolwiek pojęcie immunohistochemia jest często stosowane zamienne z immunocytochemią warto zdawać sobie sprawę z istniejących między nimi różnic. Zasada obu metod jest taka sama natomiast różnice dotyczą pochodzenia i histologiczno- 29
30 cytologicznej charakterystyki analizowanej próbki (w przypadku ICH mamy do czynienia z materiałem biopsyjnym, pobraną od pacjenta tkanką, natomiast ICC umożliwia analizę komórek pochodzących z płynów ustrojowych lub laboratoryjnych hodowli komórkowych) oraz odpowiedniego przygotowania próbek przed zastosowaniem przeciwciał. Celem ćwiczenia jest praktyczne zapoznanie się z techniką immunocytochemii pośredniej oraz z metodami różnicowego barwienia fluorescencyjnego składników komórek. Materiały i odczynniki 1. Hodowla komórek nowotworowych i prawidłowych na szkiełkach nakrywkowych w oddzielnych małych szalkach Petriego 35 x 10 mm, o gęstości komórek ok. 80% (dwie szalki z komórkami jednego typu na zespół studentów) 2. Bufor PBS: 137 mm NaCl 2,7 mm KCl 10 mm Na 2 HPO 4 2 mm KH 2 PO 4, ph 7, ,5-38% formaldehyd 4. Utrwalacz: 4% formaldehyd (przygotowywany na świeżo w buforze PBS) 5. Odczynnik do permeabilizacji: aceton schłodzony do temp C 6. Bufor blokujący I: 2% BSA w buforze PBS 7. Bufor blokujący II: 6% BSA w buforze PBS 8. Surowica rozpoznająca ludzkie białko ul10 9. Roztwór króliczych przeciwciał pierwszorzędowych rozpoznających ludzkie białko ul10, rozcieńczenie: 1:50 (przygotowywane na świeżo z surowicy w buforze blokującym I) 10. Roztwór przeciwciał drugorzędowych skoniugowanych z fluoroforem Alexa fluor 488, rozpoznających przeciwciała pierwszorzędowe, stężenie 1 µg/ml w buforze blokującym II 11. Barwnik fluorescencyjny Hoechst 33342, stężenie 2 µg/ml w H 2 O 12. Woda MiliQ 30
31 13. Roztwór do zatapiania komórek: komercyjny (Fluka), przed użyciem konieczne ogrzanie w termobloku lub 20 % glicerol w H 2 O 14. Jałowe probówki Eppendorfa o pojemności 1,5 i 2 ml i jałowe końcówki do pipet. 15. Jałowe probówki typu Falcon o poj. 15 ml 16. Pęsety 17. Małe szalki Petriego (35 x 10 mm) do hodowli komórkowych 18. Komory wilgotne (duże szalki Petriego 100 x 15 mm wyłożone bibułą filtracyjną nasączoną w wodzie destylowanej) 19. Szkiełka podstawowe do obserwacji mikroskopowych 20. Termoblok Wykonanie ćwiczenia Wszystkie etapy wykonywać w temperaturze pokojowej, chyba że zaznaczono inaczej. Przy pracy z formaldehydem i barwnikiem Hoechst używać rękawiczek ochronnych. 1. Usunąć pożywkę znad hodowli i przepłukać komórki 1 ml buforu PBS ogrzanym do temp. 37 C. 2. Komórki w szalkach utrwalić na szkiełkach nakrywkowych za pomocą 1 ml 4% roztworu formaldehydu, inkubować w utrwalaczu 10 min. 3. Po usunięciu 4% formaldehydu komórki przepłukać 3 x za pomocą 1 ml buforu PBS. 4. Usunąć bufor PBS i permeabilizować komórki przez 10 min. w 1 ml acetonu schłodzonym do temp. -20 C (plastikowe szalki ulegną zmętnieniu). 5. Po usunięciu acetonu komórki przepłukać 3 x za pomocą 1 ml buforu PBS. 6. Szkiełka nakrywkowe z utrwalonymi i spermeabilizowanymi komórkami przenieść za pomocą pęsety do nowych szalek Petriego. 7. Szalki z komórkami na szkiełkach umieścić w komorach wilgotnych. 8. Na komórki delikatnie nakroplić µl roztworu przeciwciał pierwszorzędowych (anty ul10) i inkubować prze 30 min. w zamkniętych komorach wilgotnych (próba badana). W przypadku preparatów kontrolnych zamiast roztworu przeciwciał pierwszorzędowych użyć buforu blokującego I (kontrola negatywna). 9. Usunąć roztwór przeciwciał i przepłukać komórki 3 x za pomocą 1 ml buforu PBS. 31
ĆWICZENIA Z BIOLOGII MOLEKULARNEJ
 UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z BIOLOGII MOLEKULARNEJ dla studentów III roku mikrobiologii LUBLIN 2017 Wersja 1.3 1 Spis
UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z BIOLOGII MOLEKULARNEJ dla studentów III roku mikrobiologii LUBLIN 2017 Wersja 1.3 1 Spis
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Molekularne podstawy diagnostyki chorób genetycznych - ćwiczenia
 UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ Molekularne podstawy diagnostyki chorób genetycznych - ćwiczenia dla studentów I roku II 0 biotechnologii
UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ Molekularne podstawy diagnostyki chorób genetycznych - ćwiczenia dla studentów I roku II 0 biotechnologii
Metody badania ekspresji genów
 Metody badania ekspresji genów dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Metody badania ekspresji genów zamieszczonym w skrypcie pod reakcją A. Lityńskiej i M. Lewandowskiego
Metody badania ekspresji genów dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Metody badania ekspresji genów zamieszczonym w skrypcie pod reakcją A. Lityńskiej i M. Lewandowskiego
TaqNova-RED. Polimeraza DNA RP20R, RP100R
 TaqNova-RED Polimeraza DNA RP20R, RP100R RP20R, RP100R TaqNova-RED Polimeraza DNA Rekombinowana termostabilna polimeraza DNA Taq zawierająca czerwony barwnik, izolowana z Thermus aquaticus, o przybliżonej
TaqNova-RED Polimeraza DNA RP20R, RP100R RP20R, RP100R TaqNova-RED Polimeraza DNA Rekombinowana termostabilna polimeraza DNA Taq zawierająca czerwony barwnik, izolowana z Thermus aquaticus, o przybliżonej
ĆWICZENIA Z BIOLOGII MOLEKULARNEJ
 UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z BIOLOGII MOLEKULARNEJ dla studentów II roku biologii oraz III roku mikrobiologii i biotechnologii
UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z BIOLOGII MOLEKULARNEJ dla studentów II roku biologii oraz III roku mikrobiologii i biotechnologii
ĆWICZENIA Z BIOLOGII MOLEKULARNEJ
 UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z BIOLOGII MOLEKULARNEJ dla studentów III roku biotechnologii LUBLIN 2016 Wersja 1.4 1 Spis
UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z BIOLOGII MOLEKULARNEJ dla studentów III roku biotechnologii LUBLIN 2016 Wersja 1.4 1 Spis
ĆWICZENIA Z MECHANIZMÓW DZIAŁANIA WYBRANYCH GRUP LEKÓW
 UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z MECHANIZMÓW DZIAŁANIA WYBRANYCH GRUP LEKÓW dla studentów I roku II 0 biotechnologii medycznej
UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z MECHANIZMÓW DZIAŁANIA WYBRANYCH GRUP LEKÓW dla studentów I roku II 0 biotechnologii medycznej
Novabeads Food DNA Kit
 Novabeads Food DNA Kit Novabeads Food DNA Kit jest nowej generacji narzędziem w technikach biologii molekularnej, umożliwiającym izolację DNA z produktów spożywczych wysoko przetworzonych. Metoda oparta
Novabeads Food DNA Kit Novabeads Food DNA Kit jest nowej generacji narzędziem w technikach biologii molekularnej, umożliwiającym izolację DNA z produktów spożywczych wysoko przetworzonych. Metoda oparta
bi ~ Zestaw dydal<tyczny umożliwiający przeprowadzenie izolacji genomowego DNA z bakterii EasyLation Genomie DNA INSTRUI<CJA DLA STUDENTÓW
 Zestaw dydaktyczny EasyLation Genomie DNA Nr kat. DY80 Wersja zestawu: 1.2014 Zestaw dydal
Zestaw dydaktyczny EasyLation Genomie DNA Nr kat. DY80 Wersja zestawu: 1.2014 Zestaw dydal
TaqNovaHS. Polimeraza DNA RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925
 TaqNovaHS RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 TaqNovaHS Polimeraza TaqNovaHS jest mieszaniną termostabilnej polimerazy DNA
TaqNovaHS RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 TaqNovaHS Polimeraza TaqNovaHS jest mieszaniną termostabilnej polimerazy DNA
Genomic Maxi AX Direct
 Genomic Maxi AX Direct Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura bez etapu precypitacji. wersja 0517 10 izolacji Nr kat. 995-10D Pojemność kolumny
Genomic Maxi AX Direct Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura bez etapu precypitacji. wersja 0517 10 izolacji Nr kat. 995-10D Pojemność kolumny
Zestaw do wykrywania Chlamydia trachomatis w moczu lub w kulturach komórkowych
 Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
Genomic Midi AX. 20 izolacji
 Genomic Midi AX Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura z precypitacją DNA. wersja 0517 20 izolacji Nr kat. 895-20 Pojemność kolumny do oczyszczania
Genomic Midi AX Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura z precypitacją DNA. wersja 0517 20 izolacji Nr kat. 895-20 Pojemność kolumny do oczyszczania
Genomic Mini AX Milk Spin
 Genomic Mini AX Milk Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z próbek mleka. wersja 1017 100 izolacji Nr kat. 059-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg. Produkt
Genomic Mini AX Milk Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z próbek mleka. wersja 1017 100 izolacji Nr kat. 059-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg. Produkt
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Ćwiczenie 3 Izolacja i rozdział
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Ćwiczenie 3 Izolacja i rozdział
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna.
 Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616
 Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616 10 izolacji Nr kat. 995-10 Pojemność kolumny do oczyszczania DNA wynosi 500 µg 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616 10 izolacji Nr kat. 995-10 Pojemność kolumny do oczyszczania DNA wynosi 500 µg 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
Genomic Micro AX Swab Gravity Plus
 Genomic Micro AX Swab Gravity Plus Zestaw do izolacji genomowego DNA z wymazów metodą grawitacyjną. W skład zestawu wchodzą wymazówki. wersja 0517 100 izolacji Nr kat. 105-100P Pojemność kolumny do oczyszczania
Genomic Micro AX Swab Gravity Plus Zestaw do izolacji genomowego DNA z wymazów metodą grawitacyjną. W skład zestawu wchodzą wymazówki. wersja 0517 100 izolacji Nr kat. 105-100P Pojemność kolumny do oczyszczania
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016 Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa farmacjamolekularna@wum.edu.pl
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016 Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa farmacjamolekularna@wum.edu.pl
Genomic Mini AX Bacteria+ Spin
 Genomic Mini AX Bacteria+ Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z bakterii Gram-dodatnich. wersja 1017 100 izolacji Nr kat. 060-100MS Pojemność kolumny do oczyszczania DNA wynosi
Genomic Mini AX Bacteria+ Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z bakterii Gram-dodatnich. wersja 1017 100 izolacji Nr kat. 060-100MS Pojemność kolumny do oczyszczania DNA wynosi
Genomic Mini AX Plant Spin
 Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215
 Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215 20 izolacji Nr kat. 895-20D Pojemność kolumny do oczyszczania DNA wynosi 100 µg 1 Skład zestawu Składnik
Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215 20 izolacji Nr kat. 895-20D Pojemność kolumny do oczyszczania DNA wynosi 100 µg 1 Skład zestawu Składnik
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 106)
 Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 106) Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 106) Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN
 ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
Zakład Biologii Molekularnej, Wydział Farmaceutyczny, WUM.
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zestaw do wykrywania Babesia spp. i Theileria spp. w kleszczach, krwi i hodowlach komórkowych
 Nr kat. PK25N Wersja zestawu: 1.2012 Zestaw do wykrywania spp. i Theileria spp. w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Zestaw
Nr kat. PK25N Wersja zestawu: 1.2012 Zestaw do wykrywania spp. i Theileria spp. w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Zestaw
ĆWICZENIA Z BIOLOGII MOLEKULARNEJ
 UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z BIOLOGII MOLEKULARNEJ dla studentów II roku biologii medycznej UMCS LUBLIN 2015 Wersja 1.0
UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z BIOLOGII MOLEKULARNEJ dla studentów II roku biologii medycznej UMCS LUBLIN 2015 Wersja 1.0
Zakład Biologii Molekularnej, Wydział Farmaceutyczny, WUM.
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zestaw do wykrywania Anaplasma phagocytophilum w kleszczach, krwi i hodowlach komórkowych
 Nr kat. PK24N Wersja zestawu: 1.2016 Zestaw do wykrywania phagocytophilum w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Detekcja
Nr kat. PK24N Wersja zestawu: 1.2016 Zestaw do wykrywania phagocytophilum w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Detekcja
Gel-Out. 50 izolacji, 250 izolacji. Nr kat , Zestaw do izolacji DNA z żelu agarozowego. wersja 0617
 Gel-Out Zestaw do izolacji DNA z żelu agarozowego. wersja 0617 50 izolacji, 250 izolacji Nr kat. 023-50, 023-250 Pojemność kolumny do izolacji DNA - do 20 µg DNA, minimalna pojemność - 2 µg DNA (przy zawartości
Gel-Out Zestaw do izolacji DNA z żelu agarozowego. wersja 0617 50 izolacji, 250 izolacji Nr kat. 023-50, 023-250 Pojemność kolumny do izolacji DNA - do 20 µg DNA, minimalna pojemność - 2 µg DNA (przy zawartości
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 206, BT 231)
 Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI () Metody immunocytochemiczne... Metody immunocytochemiczne. Barwienie fluorescencyjne
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI () Metody immunocytochemiczne... Metody immunocytochemiczne. Barwienie fluorescencyjne
Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 206, BT 231)
 Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej PRAKTIKUM Z BIOLOGII KOMÓRKI () Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej Immunocytochemia zajmuje się wykrywaniem
Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej PRAKTIKUM Z BIOLOGII KOMÓRKI () Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej Immunocytochemia zajmuje się wykrywaniem
Zestaw do izolacji genomowego DNA z bakterii
 Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
E.coli Transformer Kit
 E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
Uniwersalny zestaw do izolacji DNA (GeDI)
 Wersja zestawu 1.0 Listopad 2017 Uniwersalny zestaw do izolacji DNA (GeDI) Uniwersalny odczynnik do izolacji całkowitego DNA (GeDI) w zestawie z kolumienkami krzemionkowymi oraz buforami pozwalającymi
Wersja zestawu 1.0 Listopad 2017 Uniwersalny zestaw do izolacji DNA (GeDI) Uniwersalny odczynnik do izolacji całkowitego DNA (GeDI) w zestawie z kolumienkami krzemionkowymi oraz buforami pozwalającymi
Genomic Mini. 50 izolacji, 250 izolacji. Uniwersalny zestaw do izolacji genomowego DNA z różnych materiałów. wersja Nr kat.
 Genomic Mini Uniwersalny zestaw do izolacji genomowego DNA z różnych materiałów. wersja 0517 50 izolacji, 250 izolacji Nr kat. 116-50, 116-250 Zestaw do izolacji DNA z tkanek, bakterii, hodowli komórkowych.
Genomic Mini Uniwersalny zestaw do izolacji genomowego DNA z różnych materiałów. wersja 0517 50 izolacji, 250 izolacji Nr kat. 116-50, 116-250 Zestaw do izolacji DNA z tkanek, bakterii, hodowli komórkowych.
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika
 PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
KINETYKA HYDROLIZY SACHAROZY
 Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie z wytworzeniem -D-glukozy i -D-fruktozy. Jest to reakcja
Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie z wytworzeniem -D-glukozy i -D-fruktozy. Jest to reakcja
Polimeraza Taq (1U/ l) 1-2 U 1 polimeraza Taq jako ostatni składniki mieszaniny końcowa objętość
 Ćwiczenie 6 Technika PCR Celem ćwiczenia jest zastosowanie techniki PCR do amplifikacji fragmentu DNA z bakterii R. leguminosarum bv. trifolii TA1 (RtTA1). Studenci przygotowują reakcję PCR wykorzystując
Ćwiczenie 6 Technika PCR Celem ćwiczenia jest zastosowanie techniki PCR do amplifikacji fragmentu DNA z bakterii R. leguminosarum bv. trifolii TA1 (RtTA1). Studenci przygotowują reakcję PCR wykorzystując
Izolowanie DNA i RNA z komórek hodowlanych. Ocena jakości uzyskanego materiału
 II ROK KIERUNEK WETERYNARIA UJCM INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH VIII Izolowanie DNA i RNA z komórek hodowlanych. Ocena jakości uzyskanego materiału 2013/2014 2 ĆWICZENIE VIII Preparatyka całkowitego
II ROK KIERUNEK WETERYNARIA UJCM INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH VIII Izolowanie DNA i RNA z komórek hodowlanych. Ocena jakości uzyskanego materiału 2013/2014 2 ĆWICZENIE VIII Preparatyka całkowitego
BIOLOGIA KOMÓRKI. Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli wewnątrzkomórkowych
 BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
ĆWICZENIE 1 i 2 Modyfikacja geu wołowej beta-laktoglobuliny przy użyciu metody Overlap Extension PCR (wydłużania nakładających się odcinków)
 ĆWICZENIE 1 i 2 Modyfikacja geu wołowej beta-laktoglobuliny przy użyciu metody Overlap Extension PCR (wydłużania nakładających się odcinków) Celem ćwiczenia jest wprowadzenie mutacji punktowej do genu
ĆWICZENIE 1 i 2 Modyfikacja geu wołowej beta-laktoglobuliny przy użyciu metody Overlap Extension PCR (wydłużania nakładających się odcinków) Celem ćwiczenia jest wprowadzenie mutacji punktowej do genu
ĆWICZENIE 3. Cukry mono i disacharydy
 ĆWICZENIE 3 Cukry mono i disacharydy Reakcja ogólna na węglowodany (Reakcja Molischa) 1 ml 1% roztworu glukozy 1 ml 1% roztworu fruktozy 1 ml 1% roztworu sacharozy 1 ml 1% roztworu skrobi 1 ml wody destylowanej
ĆWICZENIE 3 Cukry mono i disacharydy Reakcja ogólna na węglowodany (Reakcja Molischa) 1 ml 1% roztworu glukozy 1 ml 1% roztworu fruktozy 1 ml 1% roztworu sacharozy 1 ml 1% roztworu skrobi 1 ml wody destylowanej
Zestaw przeznaczony jest do całkowitej izolacji RNA z bakterii, drożdży, hodowli komórkowych, tkanek oraz krwi świeżej (nie mrożonej).
 Total RNA Mini Plus Zestaw do izolacji całkowitego RNA. Procedura izolacji nie wymaga użycia chloroformu wersja 0517 25 izolacji, 100 izolacji Nr kat. 036-25, 036-100 Zestaw przeznaczony jest do całkowitej
Total RNA Mini Plus Zestaw do izolacji całkowitego RNA. Procedura izolacji nie wymaga użycia chloroformu wersja 0517 25 izolacji, 100 izolacji Nr kat. 036-25, 036-100 Zestaw przeznaczony jest do całkowitej
PL B1. UNIWERSYTET PRZYRODNICZY W LUBLINIE, Lublin, PL BUP 26/11
 PL 214501 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 214501 (13) B1 (21) Numer zgłoszenia: 391458 (51) Int.Cl. C12Q 1/68 (2006.01) C12N 15/29 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej
PL 214501 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 214501 (13) B1 (21) Numer zgłoszenia: 391458 (51) Int.Cl. C12Q 1/68 (2006.01) C12N 15/29 (2006.01) Urząd Patentowy Rzeczypospolitej Polskiej
RT31-020, RT , MgCl 2. , random heksamerów X 6
 RT31-020, RT31-100 RT31-020, RT31-100 Zestaw TRANSCRIPTME RNA zawiera wszystkie niezbędne składniki do przeprowadzenia syntezy pierwszej nici cdna na matrycy mrna lub całkowitego RNA. Uzyskany jednoniciowy
RT31-020, RT31-100 RT31-020, RT31-100 Zestaw TRANSCRIPTME RNA zawiera wszystkie niezbędne składniki do przeprowadzenia syntezy pierwszej nici cdna na matrycy mrna lub całkowitego RNA. Uzyskany jednoniciowy
ĆWICZENIE 5 Barwniki roślinne. Ekstrakcja barwników asymilacyjnych. Rozpuszczalność chlorofilu
 ĆWICZENIE 5 Barwniki roślinne Ekstrakcja barwników asymilacyjnych 400 mg - zhomogenizowany w ciekłym azocie proszek z natki pietruszki 6 ml - etanol 96% 2x probówki plastikowe typu Falcon na 15 ml 5x probówki
ĆWICZENIE 5 Barwniki roślinne Ekstrakcja barwników asymilacyjnych 400 mg - zhomogenizowany w ciekłym azocie proszek z natki pietruszki 6 ml - etanol 96% 2x probówki plastikowe typu Falcon na 15 ml 5x probówki
BIOLOGIA KOMÓRKI. Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli wewnątrzkomórkowych
 BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
Zestaw dydaktyczny. genotypowanie szczepów 5taphy/ococcus aureus metodą PCR-RFLP
 2014-07-17 Zestaw dydaktyczny EasyGenotyping PCR-RFLP - S. aureus genotypowanie szczepów 5taphy/ococcus aureus metodą PCR-RFLP Celem ćwiczenia jest przeprowadzenie typowania genetycznego dostarczonych
2014-07-17 Zestaw dydaktyczny EasyGenotyping PCR-RFLP - S. aureus genotypowanie szczepów 5taphy/ococcus aureus metodą PCR-RFLP Celem ćwiczenia jest przeprowadzenie typowania genetycznego dostarczonych
Inżynieria Genetyczna ćw. 3
 Materiały do ćwiczeń z przedmiotu Genetyka z inżynierią genetyczną D - blok Inżynieria Genetyczna ćw. 3 Instytut Genetyki i Biotechnologii, Wydział Biologii, Uniwersytet Warszawski, rok akad. 2018/2019
Materiały do ćwiczeń z przedmiotu Genetyka z inżynierią genetyczną D - blok Inżynieria Genetyczna ćw. 3 Instytut Genetyki i Biotechnologii, Wydział Biologii, Uniwersytet Warszawski, rok akad. 2018/2019
UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ. Biomateriały
 UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ Biomateriały Ćwiczenia dla studentów III roku inżynierii nowoczesnych materiałów LUBLIN 2018 Wersja 1.0
UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ Biomateriały Ćwiczenia dla studentów III roku inżynierii nowoczesnych materiałów LUBLIN 2018 Wersja 1.0
Plasmid Mini. 50 izolacji, 250 izolacji. Zestaw do izolacji plazmidów wysokokopijnych wersja Nr kat ,
 Plasmid Mini Zestaw do izolacji plazmidów wysokokopijnych wersja 1016 50 izolacji, 250 izolacji Nr kat. 020-50, 020-250 Pojemność kolumny do oczyszczania DNA wynosi 20 µg. 1 Skład zestawu Składnik 50 izolacji
Plasmid Mini Zestaw do izolacji plazmidów wysokokopijnych wersja 1016 50 izolacji, 250 izolacji Nr kat. 020-50, 020-250 Pojemność kolumny do oczyszczania DNA wynosi 20 µg. 1 Skład zestawu Składnik 50 izolacji
Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, Warszawa. Zakład Biologii Molekularnej
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa 1 Ćwiczenie 1 Izolacja oraz
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa 1 Ćwiczenie 1 Izolacja oraz
Zestaw do izolacji genomowego DNA z drożdży
 Nr kat. EM10 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z drożdży EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.blirt.eu 2 Nr kat. EM10 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM10 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z drożdży EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.blirt.eu 2 Nr kat. EM10 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Zestaw o zwiększonej wydajności do izolacji plazmidów niskoi wysokokopijnych. Procedura z precypitacją DNA. wersja 0117
 Plasmid Midi AX Zestaw o zwiększonej wydajności do izolacji plazmidów niskoi wysokokopijnych. Procedura z precypitacją DNA. wersja 0117 10 izolacji Nr kat. 092-10 Pojemność kolumny do oczyszczania DNA
Plasmid Midi AX Zestaw o zwiększonej wydajności do izolacji plazmidów niskoi wysokokopijnych. Procedura z precypitacją DNA. wersja 0117 10 izolacji Nr kat. 092-10 Pojemność kolumny do oczyszczania DNA
CEL ĆWICZENIA: Zapoznanie się z przykładową procedurą odsalania oczyszczanych preparatów enzymatycznych w procesie klasycznej filtracji żelowej.
 LABORATORIUM 3 Filtracja żelowa preparatu oksydazy polifenolowej (PPO) oczyszczanego w procesie wysalania siarczanem amonu z wykorzystaniem złoża Sephadex G-50 CEL ĆWICZENIA: Zapoznanie się z przykładową
LABORATORIUM 3 Filtracja żelowa preparatu oksydazy polifenolowej (PPO) oczyszczanego w procesie wysalania siarczanem amonu z wykorzystaniem złoża Sephadex G-50 CEL ĆWICZENIA: Zapoznanie się z przykładową
Próba kontrolna (PK) 1000 l 1000 l
 Ćwiczenie 10. A. Oznaczanie stężenia bilirubiny całkowitej w surowicy krwi. Wymagane zagadnienia teoretyczne 1. Biosynteza hemu - metabolity pośrednie syntezy hemu. 2. Katabolizm hemu - powstawanie barwników
Ćwiczenie 10. A. Oznaczanie stężenia bilirubiny całkowitej w surowicy krwi. Wymagane zagadnienia teoretyczne 1. Biosynteza hemu - metabolity pośrednie syntezy hemu. 2. Katabolizm hemu - powstawanie barwników
BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK
 BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO-FAZOWYM;
BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO-FAZOWYM;
Total RNA Zol-Out. 25 izolacji, 100 izolacji
 Total RNA Zol-Out Zestaw do szybkiej izolacji ultraczystego, całkowitego RNA z odczynników opartych na mieszaninie fenolu oraz rodanku lub chlorowodorku guanidyny (TRIzol, TRI Reagent, RNAzol, QIAzol,
Total RNA Zol-Out Zestaw do szybkiej izolacji ultraczystego, całkowitego RNA z odczynników opartych na mieszaninie fenolu oraz rodanku lub chlorowodorku guanidyny (TRIzol, TRI Reagent, RNAzol, QIAzol,
Ocena jakościowa reakcji antygen - przeciwciało. Mariusz Kaczmarek
 Ocena jakościowa reakcji antygen - przeciwciało Mariusz Kaczmarek Antygeny Immunogenność - zdolność do wzbudzenia przeciwko sobie odpowiedzi odpornościowej swoistej; Antygenowość - zdolność do reagowania
Ocena jakościowa reakcji antygen - przeciwciało Mariusz Kaczmarek Antygeny Immunogenność - zdolność do wzbudzenia przeciwko sobie odpowiedzi odpornościowej swoistej; Antygenowość - zdolność do reagowania
fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 Sierpień 2018
 Sierpień 2018 fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 EURx Ltd. 80-297 Gdansk Poland ul. Przyrodnikow 3, NIP 957-07-05-191 KRS
Sierpień 2018 fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 EURx Ltd. 80-297 Gdansk Poland ul. Przyrodnikow 3, NIP 957-07-05-191 KRS
Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 206, BT 231)
 Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 206, BT 231) Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej Immunocytochemia zajmuje
Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 206, BT 231) Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej Immunocytochemia zajmuje
Ćwiczenie 3. Amplifikacja genu ccr5 Homo sapiens wykrywanie delecji Δ32pz warunkującej oporność na wirusa HIV
 Ćwiczenie 3. Amplifikacja genu ccr5 Homo sapiens wykrywanie delecji Δ32pz warunkującej oporność na wirusa HIV Cel ćwiczenia Określenie podatności na zakażenie wirusem HIV poprzez detekcję homo lub heterozygotyczności
Ćwiczenie 3. Amplifikacja genu ccr5 Homo sapiens wykrywanie delecji Δ32pz warunkującej oporność na wirusa HIV Cel ćwiczenia Określenie podatności na zakażenie wirusem HIV poprzez detekcję homo lub heterozygotyczności
Ćwiczenie 5 Klonowanie DNA w wektorach plazmidowych
 Ćwiczenie 5 Klonowanie DNA w wektorach plazmidowych Celem ćwiczenia jest sklonowanie fragmentu DNA (powielonego techniką PCR i wyizolowanego z żelu agarozowego na poprzednich zajęciach) do wektora plazmidowego
Ćwiczenie 5 Klonowanie DNA w wektorach plazmidowych Celem ćwiczenia jest sklonowanie fragmentu DNA (powielonego techniką PCR i wyizolowanego z żelu agarozowego na poprzednich zajęciach) do wektora plazmidowego
Plasmid Mini AX Gravity
 !"# Plasmid Mini AX Gravity zestaw do izolacji ultraczystego plazmidowego DNA (plazmidy wysokokopijne) wersja 0515/I 100 izolacji Nr kat. 015-100 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
!"# Plasmid Mini AX Gravity zestaw do izolacji ultraczystego plazmidowego DNA (plazmidy wysokokopijne) wersja 0515/I 100 izolacji Nr kat. 015-100 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
BIOLOGIA KOMÓRKI. Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych
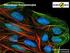 BIOLOGIA KOMÓRKI Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo dużej liczby procesów biochemicznych
BIOLOGIA KOMÓRKI Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo dużej liczby procesów biochemicznych
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Analityka Medyczna 2016
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Analityka Medyczna 2016 Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Analiza
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Analityka Medyczna 2016 Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Analiza
Laboratorium 8. Badanie stresu oksydacyjnego jako efektu działania czynników toksycznych
 Laboratorium 8 Badanie stresu oksydacyjnego jako efektu działania czynników toksycznych Literatura zalecana: Jakubowska A., Ocena toksyczności wybranych cieczy jonowych. Rozprawa doktorska, str. 28 31.
Laboratorium 8 Badanie stresu oksydacyjnego jako efektu działania czynników toksycznych Literatura zalecana: Jakubowska A., Ocena toksyczności wybranych cieczy jonowych. Rozprawa doktorska, str. 28 31.
Ćwiczenie numer 6. Analiza próbek spożywczych na obecność markerów GMO
 Ćwiczenie numer 6 Analiza próbek spożywczych na obecność markerów GMO 1. Informacje wstępne -screening GMO -metoda CTAB -qpcr 2. Izolacja DNA z soi metodą CTAB 3. Oznaczenie ilościowe i jakościowe DNA
Ćwiczenie numer 6 Analiza próbek spożywczych na obecność markerów GMO 1. Informacje wstępne -screening GMO -metoda CTAB -qpcr 2. Izolacja DNA z soi metodą CTAB 3. Oznaczenie ilościowe i jakościowe DNA
Sposób otrzymywania białek o właściwościach immunoregulatorowych. Przedmiotem wynalazku jest sposób otrzymywania fragmentów witellogeniny.
 1 Sposób otrzymywania białek o właściwościach immunoregulatorowych Przedmiotem wynalazku jest sposób otrzymywania fragmentów witellogeniny. Wynalazek może znaleźć zastosowanie w przemyśle spożywczym i
1 Sposób otrzymywania białek o właściwościach immunoregulatorowych Przedmiotem wynalazku jest sposób otrzymywania fragmentów witellogeniny. Wynalazek może znaleźć zastosowanie w przemyśle spożywczym i
Sherlock AX. 25 izolacji, 100 izolacji
 Sherlock AX Zestaw do izolacji genomowego DNA z materiałów o jego śladowej zawartości (plamy krwi, nasienia i śliny, włosy i sierść, tkanki zakonserwowane w parafinie i formalinie, tkanki świeże, krew
Sherlock AX Zestaw do izolacji genomowego DNA z materiałów o jego śladowej zawartości (plamy krwi, nasienia i śliny, włosy i sierść, tkanki zakonserwowane w parafinie i formalinie, tkanki świeże, krew
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli
 E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Otrzymany w pkt. 8 osad, zawieszony w 2 ml wody destylowanej rozpipetować do 4 szklanych probówek po ok. 0.5 ml do każdej.
 Kwasy nukleinowe izolacja DNA, wykrywanie składników. Wymagane zagadnienia teoretyczne 1. Struktura, synteza i degradacja nukleotydów purynowych i pirymidynowych. 2. Regulacja syntezy nukleotydów. Podstawowe
Kwasy nukleinowe izolacja DNA, wykrywanie składników. Wymagane zagadnienia teoretyczne 1. Struktura, synteza i degradacja nukleotydów purynowych i pirymidynowych. 2. Regulacja syntezy nukleotydów. Podstawowe
AmpliTest Babesia spp. (PCR)
 AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
Zestaw do izolacji DNA z wymazów oraz nasienia
 Nr kat. EM06 Wersja zestawu: 1.2014 Zestaw do izolacji DNA z wymazów oraz nasienia EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.dnagdansk.com Nr kat. EM06 I. PRZEZNACZENIE ZESTAWU
Nr kat. EM06 Wersja zestawu: 1.2014 Zestaw do izolacji DNA z wymazów oraz nasienia EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.dnagdansk.com Nr kat. EM06 I. PRZEZNACZENIE ZESTAWU
Genomic Mini AX Body Fluids zestaw do izolacji DNA z płynów ustrojowych wersja 1115
 Genomic Mini AX Body Fluids zestaw do izolacji DNA z płynów ustrojowych wersja 1115 20 izolacji Nr kat. 052-20M tel: +48 58 7351194, fax: +48 58 6228578 info@aabiot.com www.aabiot.com 1 Skład zestawu Składnik
Genomic Mini AX Body Fluids zestaw do izolacji DNA z płynów ustrojowych wersja 1115 20 izolacji Nr kat. 052-20M tel: +48 58 7351194, fax: +48 58 6228578 info@aabiot.com www.aabiot.com 1 Skład zestawu Składnik
Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Inżynieria bioprocesowa na kierunku biotechnologia
 1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Inżynieria bioprocesowa na kierunku biotechnologia 2 Zakład Mikrobiologii UJK Zakres materiału
1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Inżynieria bioprocesowa na kierunku biotechnologia 2 Zakład Mikrobiologii UJK Zakres materiału
Plan ćwiczeń wykonywanych w ramach Pracowni Biologii Molekularnej, część II Ekspresja i oczyszczanie białek.
 Pracownia Biologii Molekularnej Część II Plan ćwiczeń wykonywanych w ramach Pracowni Biologii Molekularnej, część II Ekspresja i oczyszczanie białek. Spis treści 1 I spotkanie: Ekspresja białka w komórkach
Pracownia Biologii Molekularnej Część II Plan ćwiczeń wykonywanych w ramach Pracowni Biologii Molekularnej, część II Ekspresja i oczyszczanie białek. Spis treści 1 I spotkanie: Ekspresja białka w komórkach
Zestaw do izolacji totalnego DNA z bakterii. Nr kat. EM02 Wersja zestawu:
 Zestaw do izolacji totalnego DNA z bakterii Nr kat. EM02 Wersja zestawu: 1.2012 Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME DNA BACTERIA przeznaczony jest do szybkiej i wydajnej izolacji bakteryjnego
Zestaw do izolacji totalnego DNA z bakterii Nr kat. EM02 Wersja zestawu: 1.2012 Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME DNA BACTERIA przeznaczony jest do szybkiej i wydajnej izolacji bakteryjnego
Dr. habil. Anna Salek International Bio-Consulting 1 Germany
 1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
Ćwiczenie 2. Identyfikacja płci z wykorzystaniem genu amelogeniny (AMGXY)
 Ćwiczenie 2. Identyfikacja płci z wykorzystaniem genu amelogeniny (AMGXY) Cel ćwiczenia Amplifikacja fragmentu genu amelogeniny, znajdującego się na chromosomach X i Y, jako celu molekularnego przydatnego
Ćwiczenie 2. Identyfikacja płci z wykorzystaniem genu amelogeniny (AMGXY) Cel ćwiczenia Amplifikacja fragmentu genu amelogeniny, znajdującego się na chromosomach X i Y, jako celu molekularnego przydatnego
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej
 Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
ĆWICZENIE 1. Aminokwasy
 ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
Komórka eukariotyczna
 Komórka eukariotyczna http://pl.wikipedia.org/w/index.php?title=plik:hela_cells_stained_with_hoechst_33258.jpg cytoplazma + jądro komórkowe = protoplazma W cytoplazmie odbywa się: cała przemiana materii,
Komórka eukariotyczna http://pl.wikipedia.org/w/index.php?title=plik:hela_cells_stained_with_hoechst_33258.jpg cytoplazma + jądro komórkowe = protoplazma W cytoplazmie odbywa się: cała przemiana materii,
ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM W WARUNKACH DENATURUJĄCYCH
 ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM W WARUNKACH DENATURUJĄCYCH WPROWADZENIE Elektroforeza od ponad 60 lat pozostaje najczęściej stosowaną metodą izolacji makrocząstek w układach biologicznych
ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM W WARUNKACH DENATURUJĄCYCH WPROWADZENIE Elektroforeza od ponad 60 lat pozostaje najczęściej stosowaną metodą izolacji makrocząstek w układach biologicznych
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA)
 Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
Zestaw do izolacji DNA z krwi świeżej i mrożonej
 Nr kat. EM05 Wersja zestawu: 1.2014 Zestaw do izolacji DNA z krwi świeżej i mrożonej EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.dnagdansk.com Nr kat. EM05 I. PRZEZNACZENIE ZESTAWU
Nr kat. EM05 Wersja zestawu: 1.2014 Zestaw do izolacji DNA z krwi świeżej i mrożonej EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.dnagdansk.com Nr kat. EM05 I. PRZEZNACZENIE ZESTAWU
ĆWICZENIA Z BIOLOGII MOLEKULARNEJ
 UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z BIOLOGII MOLEKULARNEJ dla studentów II roku biologii medycznej UMCS LUBLIN 2016 Wersja 1.1
UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z BIOLOGII MOLEKULARNEJ dla studentów II roku biologii medycznej UMCS LUBLIN 2016 Wersja 1.1
Zestaw do izolacji genomowego DNA z bakterii
 Nr kat. EM02 Wersja zestawu: 1.2014 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.dnagdansk.com Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw
Nr kat. EM02 Wersja zestawu: 1.2014 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zastrzeżonym znakiem towarowym firmy BLIRT S.A. www.dnagdansk.com Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw
Genomic Micro AX Blood Gravity 96-well
 Genomic Micro AX Blood Gravity 96-well Zestaw do izolacji DNA z krwi w formacie płytek na 96 studzienek dedykowany do pracy z pipetą wielokanałową lub automatem typu liquid handler. 960 izolacji Nr kat.
Genomic Micro AX Blood Gravity 96-well Zestaw do izolacji DNA z krwi w formacie płytek na 96 studzienek dedykowany do pracy z pipetą wielokanałową lub automatem typu liquid handler. 960 izolacji Nr kat.
Zestaw do izolacji genomowego DNA z bakterii
 Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
Nr kat. EM02 Wersja: 1.2018 Zestaw do izolacji genomowego DNA z bakterii EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM02 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME
KINETYKA HYDROLIZY SACHAROZY (REAKCJA ENZYMATYCZNA I CHEMICZNA)
 Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY (REAKCJA ENZYMATYCZNA I CHEMICZNA) ĆWICZENIE PRAKTYCZNE I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie
Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY (REAKCJA ENZYMATYCZNA I CHEMICZNA) ĆWICZENIE PRAKTYCZNE I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie
StayRNA bufor zabezpieczający RNA przed degradacją wersja 0215
 StayRNA bufor zabezpieczający RNA przed degradacją wersja 0215 100 ml, 250 ml, 500 ml Nr kat. 038-100, 038-250, 038-500 Nietosyczny roztwór wodny do przechowywania i zabezpieczania różnego rodzaju tkanek
StayRNA bufor zabezpieczający RNA przed degradacją wersja 0215 100 ml, 250 ml, 500 ml Nr kat. 038-100, 038-250, 038-500 Nietosyczny roztwór wodny do przechowywania i zabezpieczania różnego rodzaju tkanek
Zestaw do oczyszczania DNA po reakcjach enzymatycznych. Nr kat. EM03 Wersja zestawu:
 Zestaw do oczyszczania DNA po reakcjach enzymatycznych Nr kat. EM03 Wersja zestawu: 1.2012 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME DNA CLEAN-UP przeznaczony jest do szybkiego i wydajnego oczyszczania
Zestaw do oczyszczania DNA po reakcjach enzymatycznych Nr kat. EM03 Wersja zestawu: 1.2012 I. PRZEZNACZENIE ZESTAWU Zestaw EXTRACTME DNA CLEAN-UP przeznaczony jest do szybkiego i wydajnego oczyszczania
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI. Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
Techniki molekularne ćw. 1 1 z 6
 Techniki molekularne ćw. 1 1 z 6 Instrukcja do ćwiczeń Nr 1. Temat: Izolacja całkowitego DNA z tkanki ssaczej metodą wiązania DNA do kolumny krzemionkowej oraz spektrofotometryczna ocena jego czystości
Techniki molekularne ćw. 1 1 z 6 Instrukcja do ćwiczeń Nr 1. Temat: Izolacja całkowitego DNA z tkanki ssaczej metodą wiązania DNA do kolumny krzemionkowej oraz spektrofotometryczna ocena jego czystości
