Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 206, BT 231)
|
|
|
- Elżbieta Żukowska
- 7 lat temu
- Przeglądów:
Transkrypt
1 Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 206, BT 231)
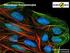
2 Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej Immunocytochemia zajmuje się wykrywaniem i lokalizacją w komórkach (czy też w szerszym rozumieniu w tkankach) substancji o charakterze antygenowym, za pomocą znakowanych przeciwciał. U podstaw metod immunnocytochemicznych leży zjawisko wiązania antygenu przez swoiste i charakterystyczne przeciwciała. Takie wiązanie cechuje wysoka specyficzność, ponieważ cząsteczka przeciwciała rozpoznaje i wiąże antygen (zazwyczaj białko lub jego fragment) o ściśle określonej konfiguracji przestrzennej. Najczęściej stosowanym typem metod immunocytochemicznych są metody pośrednie, które polegają ona na stosowaniu nieznakowanego pierwszorzędowego przeciwciała wykrywającego interesujący badacza antygen, a w następnej kolejności przeciwciała drugorzędowego, które jest znakowane odpowiednim znacznikiem umożliwiającym wizualizację poszukiwanego kompleksu antygenprzeciwciało. Najczęściej stosowanymi znacznikami w tych metodach są fluorochromy lub enzymy. Znacznikami przeciwciał używanych do wykrywania antygenów w preparatach do mikroskopii elektronowej są białka zawierające metal ciężki (ferrytyna) lub metale ciężkie (zazwyczaj złoto koloidalne). Schemat metody immunocytofluorescencji pośredniej Obecnie metody immunocytochemii pośredniej stosuje się na szeroką skalę nie tylko w badaniach podstawowych biologii komórki, biochemii, biologii molekularnej (do wykrywania składników komórek, badania ich funkcji, poznawania procesów zachodzących komórkach w stanach fizjologicznych i patologicznych organizmu), ale także w medycynie i diagnostyce medycznej. Z ich pomocą można m.in. prowadzić diagnostykę obecności wielu wirusów (np. HIV, WZW), diagnostykę chorób tarczycy, ciąży i płodności, uszkodzeń mięśnia sercowego, niedokrwistości, wielu wrodzonych chorób genetycznych i chorób metabolicznych. Metody immunocytochemiczne używane są również w toksykologii i transplantologii. Dla wielu w w/w jednostek chorobowych scharakteryzowano i opisano szereg markerów (do których należą białka pełniące w komórkach różnorodne funkcje, zarówno białka strukturalne jak i funkcjonalne, np. enzymy, hormony, białka receptorowe), których detekcja w badanym materiale stanowi podstawę diagnozy medycznej. Metody immunocytochemiczne są również bardzo często wykorzystywane w diagnostyce nowotworów - określanie typu oraz stopnia zróżnicowania nowotworu cech bardzo ważnych z punktu widzenia prognostyki i wyboru metod leczenia. Jednymi z ważniejszych markerów oceny procesu nowotworzenia oraz rozsiewania komórek nowotworowych w organizmie (przerzuty nowotworowe) są białka budujące filamenty pośrednie. Filamenty pośrednie (FP) to elementy cytoszkieletu stabilizujące komórki i tkanki zwierzęce, a także determinujące lokalizację poszczególnych struktur wewnątrzkomórkowych. FP są zbudowane z wielu (specyficznych tkankowo) skręconych razem białek włóknistych i charakteryzują się dużą wytrzymałością zarówno na stres mechaniczny (zgniatanie, rozciąganie) jak i na działanie substancji chemicznych. Białka FP składają się z globularnej głowy na N-końcu łańcucha polipeptydowego, globularnego ogona 2 BT 206, BT 231
3 na C-końcu i domeny środkowej, która posiada charakter helisy α, umożliwiający dwóm filamentom owinąć się wokół siebie w strukturę superhelisy. Monomery białek FP łączą się ze sobą w dimery dzięki strukturze domeny środkowej, a dwa dimery zestawiają się tworząc dachówkowato ułożony tetrametr. Tetramery łączą się wiązaniami niekowalencyjnymi (koniec do końca i bok do boku) i tworzą ostatecznie helikalne, linopodobne FP. Obecnie, na podstawie homologii sekwencji aminokwasowej domen centralnych oraz struktury drugorzędowej białek, wyróżnia się sześć klas (typów) białek FP: Typ I - kwaśne keratyny - w nabłonkach, Typ II - obojętne/zasadowe keratyny - w nabłonkach, Typ III wimentyny i białka wimentynopodobne: wimentyny - w komórkach mezenchymalnych, desminy - w komórkach mięśniowych, GFP (glejowe białka włókienkowe) - w komórkach glejowych, Typ IV - białka neurowłókienkowe - w neuronach, Typ V laminy (grupa niespecyficzna) białka otoczki jądrowej we wszystkich komórkach jądrzastych, Typ VI - nestyna - w komórkach endodermalnych. W zasadzie każdy typ filamentów pośrednich cytoplazmatycznych jest charakterystyczny dla danej tkanki. Tę właściwość filamentów pośrednich wykorzystuje się przy lokalizacji przerzutów nowotworów. Oznaczając markery specyficzne tkankowo, m. in. białka filamentów pośrednich można wykryć obecność komórek nowotworowych w wycinkach tkankowych, a także oszacować pochodzenie danego nowotworu. Cel ćwiczenia: Wykorzystanie metod immunocytochemii pośredniej do identyfikacji komórek nowotworowych w kokulturach z komórkami prawidłowymi w hodowli in vitro (imitacja skrawków tkankowych z przerzutami komórek nowotworowych). Przebieg ćwiczenia: I. Identyfikacja filamentów pośrednich: cytokeratynowych i wimentynowych, w otrzymanych komórkach metodą pośredniej immunofluorescencji. II. Identyfikacja filamentów cytokeratynowych w otrzymanych komórkach pośrednią metodą immunoenzymatyczną. III. Porównanie przydatności obu metod do wykrywania takiego samego antygenu (cytokeratyny) IV. Oglądanie preparatów immunohistochemicznych z diagnostyki nowotworów w tkankach miękkich (wykrywanie antygenów nowotworowych) 3 BT 206, BT 231
4 Wykonanie ćwiczenia: Praca w dwuosobowych zespołach 1. Oglądnąć (w mikroskopie odwróconym) komórki wysiane na szkiełkach umieszczonych w szalkach hodowlanych. Mogą to być: mysie fibroblasty 3T3 (imitacja prawidłowej tkanki łącznej) mysie fibroblasty 3T3 w kokulturze z mysimi komórkami rakowymi np. trzustki, płuc lub jelita (imitacja prawidłowej tkanki łącznej z przerzutami nowotworowymi) 2. Każdy zespół wybiera do barwienia 4 szalki ze szkiełkami z takimi samymi komórkami (szkiełka tylko komórkami prawidłowymi lub kokulturą komórek prawidłowych i nowotworowych). 3. Dwa szkiełka należy wykorzystać do identyfikacji filamentów pośrednich: cytokeratynowych i wimentynowych metodą pośredniej immunofluorescencji jedno szkiełko należy przeznaczyć do wykrywania poszukiwanego białka metodą immunocytofluorescencji pośredniej (inkubacja utwalonych komórek kolejno z pierwszo- i drugorzędowym przeciwciałem), drugie szkiełko wykorzystać do przeprowadzenia kontroli negatywnej (inkubacja utrwalonych komórek tylko z drugorzędowym, znakowanym fluorescencyjnie przeciwciałem 4. Dwa szkiełka należy wykorzystać do identyfikacja filamentów cytokeratynowych w otrzymanych komórkach pośrednią metodą immunoenzymatyczną jedno szkiełko należy przeznaczyć do wykrywania cytokeratyny metodą immunoenzymatyczną (inkubacja utwalonych komórek kolejno z pierwszo- i drugorzędowym przeciwciałem oraz substratem), drugie szkiełko wykorzystać do przeprowadzenia kontroli negatywnej (bez inkubacji komórek z przeciwciałem przeciw cytokeratynie) I. Identyfikacja filamentów pośrednich: cytokeratynowych i wimentynowych, w otrzymanych komórkach metodą pośredniej immunofluorescencji. 1. Wybrać (każdy zespół) do barwienia 2 szkiełka z takimi samymi komórkami. 2. Zlać pożywkę z szalki znad szkiełek z komórkami i przepłukać dokładnie szkiełka roztworem PBS z jonami Ca 2+,Mg 2+ o temp. 37 C. 3. Zlać PBS i zalać komórki 3,7% roztworem formaldehydu w PBS o temp.37 C i utrwalać komórki przez 15 min w cieplarce. 4. Zlać utrwalacz znad komórek i przepłukać szkiełka 2 razy roztworem PBS. 5. Zlać PBS i zalać komórki 0.1% roztworem Tritonu X-100 i pozostawić na 7 min w temperaturze pokojowej. 6. Zlać Triton X-100 znad komórek i przepłukać szkiełka 3 razy PBS. Jedno szkiełko przeznaczyć do wykrywania poszukiwanego białka metodą immunocytofluorescencji pośredniej ( inkubacja komórek kolejno z pierwszo- i drugorzędowym przeciwciałem), drugie szkiełko z utrwalonymi komórkami pozostawićw PBS (inkubacja tylko z drugorzędowym przeciwciałem- kontrola) 4 BT 206, BT 231
5 7. Zlać PBS i zalać komórki roztworem 3% BSA (albuminy surowicy wołowej) w PBS i inkubować w temperaturze pokojowej około 15 min. 8. Przygotować komory wilgotnościowe do barwienia komórek: Małe szalki szklane umieścić w dużych szalkach wyłożonych wilgotną watą (komory wilgotnościowe), aby krople przeciwciała nie wysychały. 9. Inkubacja komórek z pierwszorzędowym przeciwciałem: Na suchą małą szalkę położyć 1 pasek parafilmu o wielkości około 2cm x 2cm, na środek każdego kawałka parafilmu nakropić 20μl pierwszego przeciwciała (przeciwciało otrzymane od asystenta jedno z poniższych) monoklonalne mysie przeciwciało przeciwko: wimentynie IgM cytokeratynie IgG (Każdy zespół wykonuje barwienie cytokeratyny i wimentyny) 10. Wyjąć szkiełko z utrwalonymi komórkami szalki z roztworu BSA w PBS, osuszyć brzegi szkiełka bibułą i położyć je na parafilmie, tak aby komórki dotykały kropli przeciwciała. Inkubować komórki z pierwszym przeciwciałem 45 min w temperaturze pokojowej. 11. Po inkubacji komórek z przeciwciałem pierwszorzędowym szkiełko umieścić w szalce wypełnionej roztworem PBS i przepłukać starannie 3 razy. 12. Inkubacja komórek z przeciwciałem drugorzędowym znakowanym fluorescencyjnie i z barwnikami fluorescencyjnymi do wybarwienia jąder komórkowych: Na szalkę położyć dwa paski parafilmu o wielkości około 2cm x 2cm i na środek każdego nakropić 20μl mieszaniny barwników (mieszanina barwników otrzymana od asystenta), która zawiera odpowiednio rozcieńczone: a) kozie przeciwciało anty-mysie IgG znakowane Alexa-488 b) przeciwciało anty-mysie IgM znakowane Alexa-546 c) roztwór barwnika Hoechst 33258, o stężeniu 500ng/ml 13. Oba barwione szkiełka z komórkami położyć kolejno na paskach parafilmu tak, aby komórki dotykały kropli mieszaniny barwników i barwić komórki 35 min, w ciemności, w temperaturze pokojowej, w szalkach wyłożonych wilgotną watą. 14. Po zakończonym barwieniu zdjąć każde ze szkiełek z parafilmu i przenieść do szalek z H 2 O destylowaną i wypłukać szkiełka starannie 5 razy. 15. Wyczyścić szkiełko podstawowe i nakropić na nie 2 razy po 10μl H 2 O destylowanej. Na krople wody nałożyć kolejno szkiełka z wybarwionymi komórkami (komórkami do wody), osuszyć brzegi szkiełek bibułą i okleić je lakierem do paznokci. 16. Tak przygotowane preparaty oglądnąć w mikroskopie fluorescencyjnym. Dla struktur barwionych: a) Hoechst 3325 światło wzbudzające: UV (max 352nm), a emisja - światło niebieskie b) Aleksa-Fluor 488: światło wzbudzenia: niebieskie (max 488 nm), a emisja światło zielone c)alexa-fluor 546: światło wzbudzenia: zielone (max 546 nm), a emisja światło czerwone 5 BT 206, BT 231
6 17. Na podstawie obserwacji komórek w wykonanych preparatach należy odpowiedzieć na pytania: Czy otrzymane do barwienia komórki stanowiły populację heterogenną (hodowlę komórek prawidłowych i nowotworowych w kokulturze)? Jeśli tak, to jaki procent populacji stanowią komórki nowotworowe (uwaga: należy skorzystać z dodatkowego barwienia jąder komórkowych)? II. Identyfikacja filamentów cytokeratynowych w otrzymanych komórkach pośrednią metodą immunoenzymatyczną. 1. Wybrać (każdy zespół) do barwienia 2 szkiełka z takimi samymi komórkami. 2. Zlać pożywkę z szalki, w której znajduje się szkiełko i przepłukać dokładnie szkiełko roztworem PBS z jonami Ca 2+,Mg 2+ o temp. 37 C. 3. Zlać PBS i zalać komórki 3,7% roztworem formaldehydu w PBS o temp.37 C i utrwalać komórki przez 15 min w cieplarce. 4. Zlać utrwalacz znad komórek i przepłukać szkiełka 3 razy roztworem PBS. 5. Zlać PBS i zalać komórki 0.1% roztworem Tritonu X-100 i pozostawić na 7 min w temperaturze pokojowej. 6. Zlać Triton X-100 znad komórek i przepłukać szkiełka 2 razy PBS. Zalać komórki 1 ml roztworu 0,1% H 2 O 2 i inkubować komórki przez 5 minut. 7. Zlać wodę utlenioną i przepłukać trzykrotnie PBS 8. Zlać PBS i zalać komórki roztworem 1% BSA (albuminy surowicy wołowej) w PBS i inkubować w temperaturze pokojowej około 10 min. 9. Przygotować komory wilgotnościowe do barwienia komórek: Małe szalki szklane umieścić w dużych szalkach wyłożonych wilgotną watą (komory wilgotnościowe), aby krople przeciwciała nie wysychały. 10. Inkubacja komórek z pierwszorzędowym przeciwciałem: Na suchą małą szalkę położyć 1 pasek parafilmu o wielkości około 2cm x 2cm, na środek kawałka parafilmu nakropić 20μl pierwszego przeciwciała (przeciwciało otrzymane od asystenta monoklonalne mysie przeciwciało przeciwko cytokeratynie). Wyjąć szkiełko z utrwalonymi komórkami szalki z roztworu BSA w PBS, osuszyć brzegi szkiełka bibułą i położyć je na parafilmie, tak aby komórki dotykały kropli przeciwciała. Inkubować komórki z pierwszym przeciwciałem 35 min w temperaturze pokojowej. 11. Po inkubacji komórek z przeciwciałem pierwszorzędowym szkiełko umieścić w szalce wypełnionej roztworem PBS i przepłukać starannie 3 razy. 12. Inkubacja komórek z przeciwciałem drugorzędowym sprzężone z peroksydazą (przeciwciało przeciwko mysim IgG sprzężone z enzymem). 6 BT 206, BT 231
7 Na szalkę położyć pasek parafilmu o wielkości około 2cm x 2cm i na środek nakropić 15 μl roztworu przeciwciała: kozie przeciwciało anty-mysie IgG znakowane HRP (HRP-conjugated anti-mouse IgG antibody) Szkiełka z komórkami położyć na parafilmie tak, aby komórki dotykały kropli przeciwciała i barwić komórki 30 min, w ciemności, w temperaturze pokojowej, w szalkach wyłożonych wilgotną watą. 13. Po zakończonym barwieniu zdjąć każde ze szkiełek z parafilmu i przenieść do szalek z PBS i wypłukać szkiełka starannie 3 razy. 14. Przygotować substrat dla peroksydazy. Pomieszać 0,2 ml CN/DAB Solution (10X) z 1,8 ml buforu Stable Peroxide Substrate Solution (1X). DAB (3,3 diaminobenzydyna), zmieszana z 4CN (4-chloro-1-naftolem) dają w obecności HRP i H 2 O 2 czarny nierozpuszczalny produkt. Miejsca, gdzie związało się przeciwciało drugorzędowe staną się czarne. 15. Inkubować 7-10 minut, aż szkiełko zabarwi się na czarno. 16. Po zakończonym barwieniu wypłukać szkiełka starannie 3 razy PBS. 17. Zalać szkiełka roztworem hematoksyliny inkubować 1 minutę, a następnie przepłukać szkiełka 3 razy wodą z kranu. 18. Wyczyścić szkiełko podstawowe i nakropić na nie 2 razy po 10μl H 2 O. Na krople wody nałożyć kolejno szkiełka z wybarwionymi komórkami (komórkami do wody), osuszyć brzegi szkiełek bibułą i okleić je lakierem do paznokci. 19. Tak przygotowane preparaty oglądnąć w mikroskopie jasnego pola. Temat referatu: Zagadnienia: Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej Typy tkanek ssaków i współdziałanie komórek w tkankach. Przyczyny i mechanizmy powstawania i rozprzestrzeniania nowotworów (przerzuty). Specyficzność tkankowa filamentów pośrednich w komórkach. Metody immunocytochemiczne w diagnostyce nowotworów. Zalecana literatura: B. Alberts i inni. Podstawy Biologii Komórki, PWN 2005; rozdz. 21. B. Alberts et al. Molecular biology of the cell; 5th edition Red. M. Zabel Immunocytochemia, PWN Red. I. Kątnik-Prastowska Immunochemia w biologii medycznej, PWN BT 206, BT 231
Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 206, BT 231)
 Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej PRAKTIKUM Z BIOLOGII KOMÓRKI () Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej Immunocytochemia zajmuje się wykrywaniem
Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej PRAKTIKUM Z BIOLOGII KOMÓRKI () Wykorzystanie metod immunocytochemicznych w diagnostyce medycznej Immunocytochemia zajmuje się wykrywaniem
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 106)
 Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 106) Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 106) Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 206, BT 231)
 Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI () Metody immunocytochemiczne... Metody immunocytochemiczne. Barwienie fluorescencyjne
Metody immunocytochemiczne. Barwienie fluorescencyjne komórek prawidłowych i nowotworowych PRAKTIKUM Z BIOLOGII KOMÓRKI () Metody immunocytochemiczne... Metody immunocytochemiczne. Barwienie fluorescencyjne
BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK
 BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO-FAZOWYM;
BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO-FAZOWYM;
BIOLOGIA KOMÓRKI. Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli wewnątrzkomórkowych
 BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
BIOLOGIA KOMÓRKI. Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli wewnątrzkomórkowych
 BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
BIOLOGIA KOMÓRKI Mikroskopia fluorescencyjna -2 Przyżyciowe barwienia organelli Wstęp Komórki eukariotyczne, w odróżnieniu od komórek prokariotycznych (bakterie, archeony) posiadają wysoce skomplikowaną
BIOLOGIA KOMÓRKI. Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych
 BIOLOGIA KOMÓRKI Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo dużej liczby procesów biochemicznych
BIOLOGIA KOMÓRKI Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyżyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo dużej liczby procesów biochemicznych
PODSTAWY IMMUNOHISTOCHEMII. Determinanty antygenowe (epitopy) Surowice. Antygeny. Otrzymywanie przeciwciał poliklonalnych. poliwalentne monowalentne
 PODSTAWY IMMUNOHISTOCHEMII Antygeny substancje obce dla organizmu, najczęściej o strukturze wielkocząsteczkowej zdolne do wywołania odpowiedzi immunologicznej (tu: produkcji przeciwciał) - IMMUNOGENNOŚĆ
PODSTAWY IMMUNOHISTOCHEMII Antygeny substancje obce dla organizmu, najczęściej o strukturze wielkocząsteczkowej zdolne do wywołania odpowiedzi immunologicznej (tu: produkcji przeciwciał) - IMMUNOGENNOŚĆ
BIOLOGIA KOMÓRKI. Techniki generowania heterokariontów
 BIOLOGIA KOMÓRKI Techniki generowania heterokariontów Zjawisko fuzji łączenia dwóch lub więcej komórek w jedną strukturę występuje w przyrodzie w czasie wielu procesów fizjologicznych. Dotyczy ono głównie
BIOLOGIA KOMÓRKI Techniki generowania heterokariontów Zjawisko fuzji łączenia dwóch lub więcej komórek w jedną strukturę występuje w przyrodzie w czasie wielu procesów fizjologicznych. Dotyczy ono głównie
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA)
 Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
BIOLOGIA KOMÓRKI ANALIZA AKTYWNOŚCI ENDOCYTARNEJ KOMÓREK
 BIOLOGIA KOMÓRKI ANALIZA AKTYWNOŚCI ENDOCYTARNEJ Wstęp Powszechny w komórkach eukariotycznych proces endocytozy to ustawiczne pobieranie ze środowiska zewnętrznego do wnętrza komórki zarówno płynu, małych
BIOLOGIA KOMÓRKI ANALIZA AKTYWNOŚCI ENDOCYTARNEJ Wstęp Powszechny w komórkach eukariotycznych proces endocytozy to ustawiczne pobieranie ze środowiska zewnętrznego do wnętrza komórki zarówno płynu, małych
Molekularne podstawy diagnostyki chorób genetycznych - ćwiczenia
 UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ Molekularne podstawy diagnostyki chorób genetycznych - ćwiczenia dla studentów I roku II 0 biotechnologii
UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ Molekularne podstawy diagnostyki chorób genetycznych - ćwiczenia dla studentów I roku II 0 biotechnologii
Komórki macierzyste zastosowania w biotechnologii i medycynie BT Metody identyfikacji i fenotypowania populacji komórek macierzystych
 Metody identyfikacji i fenotypowania populacji komórek macierzystych 1 Wstęp Szpik kostny zawiera hematopoetyczne (HSC) oraz niehematopoetyczne komórki macierzyste (KM). Do niehematopoetycznych KM należą:
Metody identyfikacji i fenotypowania populacji komórek macierzystych 1 Wstęp Szpik kostny zawiera hematopoetyczne (HSC) oraz niehematopoetyczne komórki macierzyste (KM). Do niehematopoetycznych KM należą:
Substancje o Znaczeniu Biologicznym
 Substancje o Znaczeniu Biologicznym Tłuszcze Jadalne są to tłuszcze, które może spożywać człowiek. Stanowią ważny, wysokoenergetyczny składnik diety. Z chemicznego punktu widzenia głównym składnikiem tłuszczów
Substancje o Znaczeniu Biologicznym Tłuszcze Jadalne są to tłuszcze, które może spożywać człowiek. Stanowią ważny, wysokoenergetyczny składnik diety. Z chemicznego punktu widzenia głównym składnikiem tłuszczów
BIOLOGIA KOMÓRKI DLA BIOCHEMIKÓW. Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyŝyciowe organelli komórkowych
 BIOLOGIA KOMÓRKI DLA BIOCHEMIKÓW Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyŝyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo duŝej liczby procesów
BIOLOGIA KOMÓRKI DLA BIOCHEMIKÓW Podstawy mikroskopii fluorescencyjnej -1 Barwienia przyŝyciowe organelli komórkowych Wstęp Komórka eukariotyczna posiada zdolność przeprowadzenia bardzo duŝej liczby procesów
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej
 Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
BIOLOGIA KOMÓRKI BANKOWANIE KOMÓREK
 BIOLOGIA KOMÓRKI BANKOWANIE KOMÓREK WSTĘP Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta
BIOLOGIA KOMÓRKI BANKOWANIE KOMÓREK WSTĘP Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta
data ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1
 Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1 Cel: Wyznaczanie klirensu endogennej kreatyniny. Miarą zdolności nerek do usuwania i wydalania
Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1 Cel: Wyznaczanie klirensu endogennej kreatyniny. Miarą zdolności nerek do usuwania i wydalania
CYTOSZKIELET CYTOSZKIELET
 CYTOSZKIELET Sieć włókienek białkowych; struktura wysoce dynamiczna Filamenty aktynowe Filamenty pośrednie Mikrotubule Fibroblast CYTOSZKIELET 1 CYTOSZKIELET 7nm 10nm 25nm Filamenty pośrednie ich średnica
CYTOSZKIELET Sieć włókienek białkowych; struktura wysoce dynamiczna Filamenty aktynowe Filamenty pośrednie Mikrotubule Fibroblast CYTOSZKIELET 1 CYTOSZKIELET 7nm 10nm 25nm Filamenty pośrednie ich średnica
Labowe know-how : ELISA
 Labowe know-how : ELISA Test immunoenzymatyczny ELISA (Enzyme-Linked ImmunoSorbent Assay) jest jedną z najpowszechniejszych metod stosowanych w badaniach diagnostycznych i naukowych. Jej zadaniem jest
Labowe know-how : ELISA Test immunoenzymatyczny ELISA (Enzyme-Linked ImmunoSorbent Assay) jest jedną z najpowszechniejszych metod stosowanych w badaniach diagnostycznych i naukowych. Jej zadaniem jest
PODSTAWY IMMUNOHISTOCHEMII. Odpowiedź immunologiczna. Determinanty antygenowe (epitopy) Surowice. Antygeny
 PODSTAWY IMMUNOHISTOCHEMII Odpowiedź immunologiczna zachodzi pomiędzy antygenem, a układem odpornościowym wyróżniamy dwa rodzaje odpowiedzi: humoralną i komórkową Antygeny substancje obce dla organizmu,
PODSTAWY IMMUNOHISTOCHEMII Odpowiedź immunologiczna zachodzi pomiędzy antygenem, a układem odpornościowym wyróżniamy dwa rodzaje odpowiedzi: humoralną i komórkową Antygeny substancje obce dla organizmu,
KARTA KURSU. Kod Punktacja ECTS* 3. Poznanie sposobów i typów hodowli komórek i tkanek zwierzęcych oraz metodyki pracy w warunkach sterylnych.
 Załącznik nr 4 do Zarządzenia Nr.. KARTA KURSU Nazwa Nazwa w j. ang. HODOWLE KOMÓREK I TKANEK CELL AND TISSUE CULTURE Kod Punktacja ECTS* 3 Koordynator dr Anna Barbasz Zespół dydaktyczny dr Anna Barbasz
Załącznik nr 4 do Zarządzenia Nr.. KARTA KURSU Nazwa Nazwa w j. ang. HODOWLE KOMÓREK I TKANEK CELL AND TISSUE CULTURE Kod Punktacja ECTS* 3 Koordynator dr Anna Barbasz Zespół dydaktyczny dr Anna Barbasz
BIOLOGIA KOMÓRKI. Testy witalności komórek
 BIOLOGIA KOMÓRKI Testy witalności komórek WSTĘP Każda komórka jest układem termodynamicznie otwartym wymieniającym ze swym otoczeniem materię i energię. Wymiana ta odbywa się poprzez błonę komórkową, której
BIOLOGIA KOMÓRKI Testy witalności komórek WSTĘP Każda komórka jest układem termodynamicznie otwartym wymieniającym ze swym otoczeniem materię i energię. Wymiana ta odbywa się poprzez błonę komórkową, której
Immunologia komórkowa
 Immunologia komórkowa ocena immunofenotypu komórek Mariusz Kaczmarek Immunofenotyp Definicja I Charakterystyczny zbiór antygenów stanowiących elementy różnych struktur komórki, związany z jej różnicowaniem,
Immunologia komórkowa ocena immunofenotypu komórek Mariusz Kaczmarek Immunofenotyp Definicja I Charakterystyczny zbiór antygenów stanowiących elementy różnych struktur komórki, związany z jej różnicowaniem,
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN
 ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
Separacja komórek w gradiencie gęstości PRAKTIKUM Z BIOLOGII KOMÓRKI (BT 231)
 Separacja komórek w gradiencie gęstości PRAKTIKUM Z BIOLOGII KOMÓRKI () Separacja komórek Separacja komórek w gradiencie gęstości W wielu dziedzinach nauk przyrodniczych istnieje potrzeba stosowania określonej
Separacja komórek w gradiencie gęstości PRAKTIKUM Z BIOLOGII KOMÓRKI () Separacja komórek Separacja komórek w gradiencie gęstości W wielu dziedzinach nauk przyrodniczych istnieje potrzeba stosowania określonej
Ocena jakościowa reakcji antygen - przeciwciało. Mariusz Kaczmarek
 Ocena jakościowa reakcji antygen - przeciwciało Mariusz Kaczmarek Antygeny Immunogenność - zdolność do wzbudzenia przeciwko sobie odpowiedzi odpornościowej swoistej; Antygenowość - zdolność do reagowania
Ocena jakościowa reakcji antygen - przeciwciało Mariusz Kaczmarek Antygeny Immunogenność - zdolność do wzbudzenia przeciwko sobie odpowiedzi odpornościowej swoistej; Antygenowość - zdolność do reagowania
Izolacja komórek szpiku kostnego w celu identyfikacji wybranych populacji komórek macierzystych technikami cytometrycznymi
 Izolacja komórek szpiku kostnego w celu identyfikacji wybranych populacji komórek macierzystych technikami cytometrycznymi PRAKTIKUM Z BIOLOGII KOMÓRKI DLA BIOLOGÓW (BT 216) TEMAT ĆWICZENIA: "Izolacja
Izolacja komórek szpiku kostnego w celu identyfikacji wybranych populacji komórek macierzystych technikami cytometrycznymi PRAKTIKUM Z BIOLOGII KOMÓRKI DLA BIOLOGÓW (BT 216) TEMAT ĆWICZENIA: "Izolacja
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Ćwiczenie 3 Izolacja i rozdział
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Ćwiczenie 3 Izolacja i rozdział
Wprowadzenie do cytometrii przepływowej: metody znakowania komórek
 Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: metody znakowania komórek Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl Przygotowanie
Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: metody znakowania komórek Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl Przygotowanie
Endogenous Transcription Occurs at the 1-Cell Stage in the Mouse Embryo
 Endogenous Transcription Occurs at the 1-Cell Stage in the Mouse Embryo Christine Bouniol, Eric Nguyen, Pascale Debey 1995r Opracowała: Magdalena Barbachowska Wstęp: U większości gatunków zwierząt początek
Endogenous Transcription Occurs at the 1-Cell Stage in the Mouse Embryo Christine Bouniol, Eric Nguyen, Pascale Debey 1995r Opracowała: Magdalena Barbachowska Wstęp: U większości gatunków zwierząt początek
Nanotechnologie w diagnostyce
 Nanotechnologie w diagnostyce Diagnostyka endoskopowa Nanotechnologie mogą być przydatne w diagnostyce niedostępnych miejsc w badaniach endoskopowych. Temu mogą służyć mikrokamery wielkości antybiotyku,
Nanotechnologie w diagnostyce Diagnostyka endoskopowa Nanotechnologie mogą być przydatne w diagnostyce niedostępnych miejsc w badaniach endoskopowych. Temu mogą służyć mikrokamery wielkości antybiotyku,
Wprowadzenie do cytometrii przepływowej: metody znakowania komórek
 Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: metody znakowania komórek Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl Przygotowanie
Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: metody znakowania komórek Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl Przygotowanie
Zawiadomienie o wyborze oferty zostanie zamieszczone na naszej stronie internetowej oraz rozesłane mailowo do Oferentów w dniu r.
 ZAPYTANIE OFERTOWE ROCZNE nr 07/2017/M/CELONKO z dnia 15.02.2017 NA MATERIAŁY ZUŻYWALNE I ODCZYNNIKI DLA FIRMY CELON PHARMA SA Z SIEDZIBĄ W Kiełpinie w ramach programu STRATEGMED II, projektu pod nazwą
ZAPYTANIE OFERTOWE ROCZNE nr 07/2017/M/CELONKO z dnia 15.02.2017 NA MATERIAŁY ZUŻYWALNE I ODCZYNNIKI DLA FIRMY CELON PHARMA SA Z SIEDZIBĄ W Kiełpinie w ramach programu STRATEGMED II, projektu pod nazwą
CYTOSZKIELET CYTOSZKIELET Cytoplazma podstawowa (macierz cytoplazmatyczna) Komórka eukariotyczna. cytoplazma + jądro komórkowe.
 Komórka eukariotyczna cytoplazma + jądro komórkowe (układ wykonawczy) cytoplazma podstawowa (cytozol) Cytoplazma złożony koloid wodny cząsteczek i makrocząsteczek (centrum informacyjne) organelle i kompleksy
Komórka eukariotyczna cytoplazma + jądro komórkowe (układ wykonawczy) cytoplazma podstawowa (cytozol) Cytoplazma złożony koloid wodny cząsteczek i makrocząsteczek (centrum informacyjne) organelle i kompleksy
Materiały pochodzą z Platformy Edukacyjnej Portalu www.szkolnictwo.pl
 Materiały pochodzą z Platformy Edukacyjnej Portalu www.szkolnictwo.pl Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą byd wykorzystywane przez jego Użytkowników
Materiały pochodzą z Platformy Edukacyjnej Portalu www.szkolnictwo.pl Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą byd wykorzystywane przez jego Użytkowników
PODSTAWY BIOLOGII KOMÓRKI. Bankowanie komórek i ocena ich żywotności
 PODSTAWY BIOLOGII KOMÓRKI Wstęp Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta jest szczególnie
PODSTAWY BIOLOGII KOMÓRKI Wstęp Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta jest szczególnie
Techniki histologiczne barwienie
 Struktury histologiczne są optycznie obiektami fazowymi nie zmieniają ani amplitudy fali światła (obiekty nie są ciemniejsze ani jaśniejsze), ani jej długości (barwa), a jedynie powodują załamanie światła
Struktury histologiczne są optycznie obiektami fazowymi nie zmieniają ani amplitudy fali światła (obiekty nie są ciemniejsze ani jaśniejsze), ani jej długości (barwa), a jedynie powodują załamanie światła
Technika fluorescencyjnego oznaczania aktywności enzymów. Wstęp:
 Technika fluorescencyjnego oznaczania aktywności enzymów Wstęp: Wśród technik biologii molekularnej jedną z najczęściej stosowanych jest technika fluorescencyjna. Stosując technikę fluorescencyjną można
Technika fluorescencyjnego oznaczania aktywności enzymów Wstęp: Wśród technik biologii molekularnej jedną z najczęściej stosowanych jest technika fluorescencyjna. Stosując technikę fluorescencyjną można
BIOLOGIA KOMÓRKI. Ocena końcowa z kursu będzie liczona jako: 20% oceny z ćwiczeń 80% oceny z egzaminu
 BIOLOGIA KOMÓRKI Ocena końcowa z kursu będzie liczona jako: 20% oceny z ćwiczeń 80% oceny z egzaminu Charakterystyka kursu: 30 godzin wykładów 60 godzin ćwiczeń Ćwiczenia - zasady zaliczenia: uczestniczenie
BIOLOGIA KOMÓRKI Ocena końcowa z kursu będzie liczona jako: 20% oceny z ćwiczeń 80% oceny z egzaminu Charakterystyka kursu: 30 godzin wykładów 60 godzin ćwiczeń Ćwiczenia - zasady zaliczenia: uczestniczenie
PODSTAWY BIOLOGII KOMÓRKI. Bankowanie komórek i ocena ich żywotności
 PODSTAWY BIOLOGII KOMÓRKI Wstęp Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta jest szczególnie
PODSTAWY BIOLOGII KOMÓRKI Wstęp Jedną z rutynowych metod laboratoryjnych stosowanych we współczesnej biologii jest długotrwałe przechowywanie żywych komórek w obniżonej temperaturze. Metoda ta jest szczególnie
XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych. a. Candida albicans preparat z hodowli barwiony metoda Grama
 XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych a. Candida albicans preparat z hodowli barwiony metoda Grama Opis preparatu: b. Saccharomyces cerevisiae preparat z hodowli
XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych a. Candida albicans preparat z hodowli barwiony metoda Grama Opis preparatu: b. Saccharomyces cerevisiae preparat z hodowli
Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie
 Tkanka mięśniowa Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie Tkanka mięśniowa poprzecznie prążkowana poprzecznie prążkowana serca gładka Tkanka mięśniowa Podstawową własnością
Tkanka mięśniowa Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie Tkanka mięśniowa poprzecznie prążkowana poprzecznie prążkowana serca gładka Tkanka mięśniowa Podstawową własnością
Wprowadzenie do cytometrii przepływowej: metody znakowania komórek
 Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: metody znakowania komórek Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl Przygotowanie
Fakultet: Cytometria zastosowanie w badaniach biologicznych Wprowadzenie do cytometrii przepływowej: metody znakowania komórek Nadzieja Drela Zakład Immunologii WB UW ndrela@biol.uw.edu.pl Przygotowanie
Opis efektów kształcenia dla modułu zajęć
 Nazwa modułu: Strukturalne podstawy biologii komórki Rok akademicki: 2030/2031 Kod: EIB-2-206-BN-s Punkty ECTS: 3 Wydział: Elektrotechniki, Automatyki, Informatyki i Inżynierii Biomedycznej Kierunek: Inżynieria
Nazwa modułu: Strukturalne podstawy biologii komórki Rok akademicki: 2030/2031 Kod: EIB-2-206-BN-s Punkty ECTS: 3 Wydział: Elektrotechniki, Automatyki, Informatyki i Inżynierii Biomedycznej Kierunek: Inżynieria
DNA musi współdziałać z białkami!
 DNA musi współdziałać z białkami! Specyficzność oddziaływań między DNA a białkami wiążącymi DNA zależy od: zmian konformacyjnych wzdłuż cząsteczki DNA zróżnicowania struktury DNA wynikającego z sekwencji
DNA musi współdziałać z białkami! Specyficzność oddziaływań między DNA a białkami wiążącymi DNA zależy od: zmian konformacyjnych wzdłuż cząsteczki DNA zróżnicowania struktury DNA wynikającego z sekwencji
Spółka z o.o. UCZESTNICY WARSZTATÓW: Lekarze rezydenci i specjaliści, technicy w pracowniach diagnostycznych i histopatologicznych
 e-mail: kawaska@kawaska.pl WARSZTATY: TECHNIKI MIKROSKOPOWE I INFORMATYCZNE W BADANIU PRÓBEK BIOLOGICZNYCH, CZ. 1 Objęte patronatem Polskiego Towarzystwa Patologów pod przewodnictwem Prezes Zarządu Głównego
e-mail: kawaska@kawaska.pl WARSZTATY: TECHNIKI MIKROSKOPOWE I INFORMATYCZNE W BADANIU PRÓBEK BIOLOGICZNYCH, CZ. 1 Objęte patronatem Polskiego Towarzystwa Patologów pod przewodnictwem Prezes Zarządu Głównego
Wykazanie obecności oksydoreduktaz w materiale biologicznym
 KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Wykazanie obecności oksydoreduktaz w materiale biologicznym ĆWICZENIE 9 ZADANIE 1 OTRZYMYWANIE PREPARATU ENZYMATYCZNEGO 1. Umyty ziemniak utrzeć
KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Wykazanie obecności oksydoreduktaz w materiale biologicznym ĆWICZENIE 9 ZADANIE 1 OTRZYMYWANIE PREPARATU ENZYMATYCZNEGO 1. Umyty ziemniak utrzeć
TECHNIKA IMMUNOCYTOCHEMICZNA ZASTOSOWANIE W BADANIACH KOMÓREK UKŁADU ROZRODCZEGO
 TECHNIKA IMMUNOCYTOCHEMICZNA ZASTOSOWANIE W BADANIACH KOMÓREK UKŁADU ROZRODCZEGO TECHNIKI IMMUNOHISTOCHEMICZNE W DIAGNOSTYCE ONKOLOGICZNEJ NA PRZYKŁADZIE RAKA SUTKA 1. Wstęp Immunocytochemia zajmuje się
TECHNIKA IMMUNOCYTOCHEMICZNA ZASTOSOWANIE W BADANIACH KOMÓREK UKŁADU ROZRODCZEGO TECHNIKI IMMUNOHISTOCHEMICZNE W DIAGNOSTYCE ONKOLOGICZNEJ NA PRZYKŁADZIE RAKA SUTKA 1. Wstęp Immunocytochemia zajmuje się
etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
 Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
biologia w gimnazjum UKŁAD KRWIONOŚNY CZŁOWIEKA
 biologia w gimnazjum 2 UKŁAD KRWIONOŚNY CZŁOWIEKA SKŁAD KRWI OSOCZE Jest płynną częścią krwi i stanowi 55% jej objętości. Jest podstawowym środowiskiem dla elementów morfotycznych. Zawiera 91% wody, 8%
biologia w gimnazjum 2 UKŁAD KRWIONOŚNY CZŁOWIEKA SKŁAD KRWI OSOCZE Jest płynną częścią krwi i stanowi 55% jej objętości. Jest podstawowym środowiskiem dla elementów morfotycznych. Zawiera 91% wody, 8%
Metody badania ekspresji genów
 Metody badania ekspresji genów dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Metody badania ekspresji genów zamieszczonym w skrypcie pod reakcją A. Lityńskiej i M. Lewandowskiego
Metody badania ekspresji genów dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Metody badania ekspresji genów zamieszczonym w skrypcie pod reakcją A. Lityńskiej i M. Lewandowskiego
1. Barwienie przeglądowe ogólna struktura mózgu i płatów wzrokowych Drosophila
 1. Barwienie przeglądowe ogólna struktura mózgu i płatów wzrokowych Drosophila Drosophila melanogaster - barwienie Richardsona (1% błękit metylenowy w 1% boraksie) Techniki używane w histologii: mikroskopia
1. Barwienie przeglądowe ogólna struktura mózgu i płatów wzrokowych Drosophila Drosophila melanogaster - barwienie Richardsona (1% błękit metylenowy w 1% boraksie) Techniki używane w histologii: mikroskopia
Mikroskopia fluorescencyjna
 Mikroskopia fluorescencyjna Mikroskop fluorescencyjny to mikroskop świetlny, wykorzystujący zjawisko fluorescencji większość z nich to mikroskopy tzw. epi-fluorescencyjne zjawisko fotoluminescencji: fluorescencja
Mikroskopia fluorescencyjna Mikroskop fluorescencyjny to mikroskop świetlny, wykorzystujący zjawisko fluorescencji większość z nich to mikroskopy tzw. epi-fluorescencyjne zjawisko fotoluminescencji: fluorescencja
StayRNA bufor zabezpieczający RNA przed degradacją wersja 0215
 StayRNA bufor zabezpieczający RNA przed degradacją wersja 0215 100 ml, 250 ml, 500 ml Nr kat. 038-100, 038-250, 038-500 Nietosyczny roztwór wodny do przechowywania i zabezpieczania różnego rodzaju tkanek
StayRNA bufor zabezpieczający RNA przed degradacją wersja 0215 100 ml, 250 ml, 500 ml Nr kat. 038-100, 038-250, 038-500 Nietosyczny roztwór wodny do przechowywania i zabezpieczania różnego rodzaju tkanek
Zakład Biologii Molekularnej, Wydział Farmaceutyczny, WUM.
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
BIOLOGIA KOMÓRKI. Analiza żywotności komórek w warunkach in vitro
 BIOLOGIA KOMÓRKI Analiza żywotności komórek w warunkach in vitro Wstęp Każda komórka jest układem termodynamicznie otwartym wymieniającym ze swym otoczeniem materię i energię. Wymiana ta odbywa się poprzez
BIOLOGIA KOMÓRKI Analiza żywotności komórek w warunkach in vitro Wstęp Każda komórka jest układem termodynamicznie otwartym wymieniającym ze swym otoczeniem materię i energię. Wymiana ta odbywa się poprzez
Zakład Biologii Molekularnej, Wydział Farmaceutyczny, WUM.
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: TERAPIA GENOWA Plan ćwiczeń Ćwiczenie 1: Przygotowanie warsztatu terapii genowej 1. Kontrola jakościowa preparatów plazmidowych paav/lacz,
1. Właściwości białek
 1. Właściwości białek a. 1. Cele lekcji i. a) Wiadomości Uczeń zna: Uczeń: właściwości białek, proces denaturacji białek, reakcje charakterystyczne dla białek. ii. b) Umiejętności rozróżnia reakcje charakterystyczne
1. Właściwości białek a. 1. Cele lekcji i. a) Wiadomości Uczeń zna: Uczeń: właściwości białek, proces denaturacji białek, reakcje charakterystyczne dla białek. ii. b) Umiejętności rozróżnia reakcje charakterystyczne
PAŃSTWOWA WYŻSZA SZKOŁA ZAWODOWA W KONINIE. WYDZIAŁ Kultury Fizycznej i Ochrony Zdrowia
 PAŃSTWOWA WYŻSZA SZKOŁA ZAWODOWA W KONINIE WYDZIAŁ Kultury Fizycznej i Ochrony Zdrowia Katedra Morfologicznych i Czynnościowych Podstaw Kultury Fizycznej Kierunek: Wychowanie Fizyczne SYLABUS Nazwa przedmiotu
PAŃSTWOWA WYŻSZA SZKOŁA ZAWODOWA W KONINIE WYDZIAŁ Kultury Fizycznej i Ochrony Zdrowia Katedra Morfologicznych i Czynnościowych Podstaw Kultury Fizycznej Kierunek: Wychowanie Fizyczne SYLABUS Nazwa przedmiotu
Oznaczanie aktywności - i β- amylazy słodu metodą kolorymetryczną
 KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Oznaczanie aktywności - i β- amylazy słodu metodą kolorymetryczną ĆWICZENIE 5 OZNACZANIE AKTYWNOŚCI -AMYLAZY SŁODU METODĄ KOLORYMETRYCZNĄ Enzymy
KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Oznaczanie aktywności - i β- amylazy słodu metodą kolorymetryczną ĆWICZENIE 5 OZNACZANIE AKTYWNOŚCI -AMYLAZY SŁODU METODĄ KOLORYMETRYCZNĄ Enzymy
METODYKA STOSOWANA W ZAKŁADZIE BIOLOGII ROZWOJU ROŚLIN
 METODYKA STOSOWANA W ZAKŁADZIE BIOLOGII ROZWOJU ROŚLIN Immunolokalizacja wybranych białek i polisacharydów Ksyloglukan u Arabidopsis Kaloza w gametofiach mszaków Immunocytochemia białek cytoszkieletu kortykalnego
METODYKA STOSOWANA W ZAKŁADZIE BIOLOGII ROZWOJU ROŚLIN Immunolokalizacja wybranych białek i polisacharydów Ksyloglukan u Arabidopsis Kaloza w gametofiach mszaków Immunocytochemia białek cytoszkieletu kortykalnego
II.1.4) Określenie przedmiotu oraz wielkości lub zakresu zamówienia: 3.1. Przedmiotem zamówienia jest dostawa produktów do żywienia pozajelitowego
 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: bip.usdk.pl Kraków: Dostawa odczynników do oznaczeń immunohistochemicznych Numer ogłoszenia: 391598-2014;
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: bip.usdk.pl Kraków: Dostawa odczynników do oznaczeń immunohistochemicznych Numer ogłoszenia: 391598-2014;
Diagnostyka wirusologiczna w praktyce klinicznej
 Diagnostyka wirusologiczna w praktyce klinicznej Ponad 60% zakażeń w praktyce klinicznej jest wywołana przez wirusy. Rodzaj i jakość materiału diagnostycznego (transport!) oraz interpretacja wyników badań
Diagnostyka wirusologiczna w praktyce klinicznej Ponad 60% zakażeń w praktyce klinicznej jest wywołana przez wirusy. Rodzaj i jakość materiału diagnostycznego (transport!) oraz interpretacja wyników badań
Procedura pobrania i transportu materiału do badania
 Procedura pobrania i transportu materiału do badania A. Do badań cytogenetycznych - hematoonkologia A1. KARIOTYP - żywe komórki A2. FISH - żywe komórki A3. FISH materiał z bloczków parafinowych B. Do badań
Procedura pobrania i transportu materiału do badania A. Do badań cytogenetycznych - hematoonkologia A1. KARIOTYP - żywe komórki A2. FISH - żywe komórki A3. FISH materiał z bloczków parafinowych B. Do badań
JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI? JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI?
 Podstawowe miary masy i objętości stosowane przy oznaczaniu ilości kwasów nukleinowych : 1g (1) 1l (1) 1mg (1g x 10-3 ) 1ml (1l x 10-3 ) 1μg (1g x 10-6 ) 1μl (1l x 10-6 ) 1ng (1g x 10-9 ) 1pg (1g x 10-12
Podstawowe miary masy i objętości stosowane przy oznaczaniu ilości kwasów nukleinowych : 1g (1) 1l (1) 1mg (1g x 10-3 ) 1ml (1l x 10-3 ) 1μg (1g x 10-6 ) 1μl (1l x 10-6 ) 1ng (1g x 10-9 ) 1pg (1g x 10-12
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016 Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa farmacjamolekularna@wum.edu.pl
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016 Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa farmacjamolekularna@wum.edu.pl
ZAMAWIAJĄCY: Nazwa: Celon Pharma SA ul. Ogrodowa 2a, Kiełpin
 ZAPYTANIE OFERTOWE ROCZNE nr 07/2017/M/CELONKO z dnia 15.02.2017r. na odczynniki i materiały zużywalne dla firmy CELON PHARMA SA z siedzibą w Kiełpinie. W ramach programu Opracowanie nowoczesnych biomarkerów
ZAPYTANIE OFERTOWE ROCZNE nr 07/2017/M/CELONKO z dnia 15.02.2017r. na odczynniki i materiały zużywalne dla firmy CELON PHARMA SA z siedzibą w Kiełpinie. W ramach programu Opracowanie nowoczesnych biomarkerów
Ocena ekspresji genu ABCG2 i białka oporności raka piersi (BCRP) jako potencjalnych czynników prognostycznych w raku jelita grubego
 Aleksandra Sałagacka Ocena ekspresji genu ABCG2 i białka oporności raka piersi (BCRP) jako potencjalnych czynników prognostycznych w raku jelita grubego Pracownia Biologii Molekularnej i Farmakogenomiki
Aleksandra Sałagacka Ocena ekspresji genu ABCG2 i białka oporności raka piersi (BCRP) jako potencjalnych czynników prognostycznych w raku jelita grubego Pracownia Biologii Molekularnej i Farmakogenomiki
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii. Biologia komórki nowotworowej: Ćwiczenie B
 Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Biologia komórki nowotworowej: Ćwiczenie B Badanie zmian w budowie błony cytoplazmatycznej komórek wybranych linii nowotworowych
Wydział Chemiczny Politechniki Gdańskiej Katedra Technologii Leków i Biochemii Biologia komórki nowotworowej: Ćwiczenie B Badanie zmian w budowie błony cytoplazmatycznej komórek wybranych linii nowotworowych
Prezentuje: Magdalena Jasińska
 Prezentuje: Magdalena Jasińska W którym momencie w rozwoju embrionalnym myszy rozpoczyna się endogenna transkrypcja? Hipoteza I: Endogenna transkrypcja rozpoczyna się w embrionach będących w stadium 2-komórkowym
Prezentuje: Magdalena Jasińska W którym momencie w rozwoju embrionalnym myszy rozpoczyna się endogenna transkrypcja? Hipoteza I: Endogenna transkrypcja rozpoczyna się w embrionach będących w stadium 2-komórkowym
Wydział Lekarski Uniwersytetu Medycznego we Wrocławiu 4. Kod przedmiotu/modułu
 OPIS PRZEDMIOTU/MODUŁU KSZTAŁCENIA (SYLABUS) Załącznik Nr 4 1. Nazwa przedmiotu/modułu w języku polskim Immunochemia 2. Nazwa przedmiotu/modułu w języku angielskim Immunochemistry 3. Jednostka prowadząca
OPIS PRZEDMIOTU/MODUŁU KSZTAŁCENIA (SYLABUS) Załącznik Nr 4 1. Nazwa przedmiotu/modułu w języku polskim Immunochemia 2. Nazwa przedmiotu/modułu w języku angielskim Immunochemistry 3. Jednostka prowadząca
Z47 BADANIA WŁAŚCIWOŚCI ELEKTROFIZJOLOGICZNYCH BŁON KOMÓRKOWYCH
 Z47 BADANIA WŁAŚCIWOŚCI ELEKTROFIZJOLOGICZNYCH BŁON KOMÓRKOWYCH I. Cel ćwiczenia Celem ćwiczenia jest zapoznanie się z podstawową wiedzą na temat pomiarów elektrofizjologicznych żywych komórek metodą Patch
Z47 BADANIA WŁAŚCIWOŚCI ELEKTROFIZJOLOGICZNYCH BŁON KOMÓRKOWYCH I. Cel ćwiczenia Celem ćwiczenia jest zapoznanie się z podstawową wiedzą na temat pomiarów elektrofizjologicznych żywych komórek metodą Patch
Temat ćwiczenia: Techniki stosowane w badaniach toksyczności in vitro
 Temat ćwiczenia: Techniki stosowane w badaniach toksyczności in vitro Miarą aktywności cytotoksycznej badanej substancji jest określenie stężenia hamującego, IC 50 (ang. inhibitory concentration), dla
Temat ćwiczenia: Techniki stosowane w badaniach toksyczności in vitro Miarą aktywności cytotoksycznej badanej substancji jest określenie stężenia hamującego, IC 50 (ang. inhibitory concentration), dla
Program zajęć z biochemii dla studentów kierunku weterynaria I roku studiów na Wydziale Lekarskim UJ CM w roku akademickim 2013/2014
 Program zajęć z biochemii dla studentów kierunku weterynaria I roku studiów na Wydziale Lekarskim UJ CM w roku akademickim 2013/2014 S E M E S T R II Tydzień 1 24.02-28.02 2 03.03-07.03 3 10.03-14.03 Wykłady
Program zajęć z biochemii dla studentów kierunku weterynaria I roku studiów na Wydziale Lekarskim UJ CM w roku akademickim 2013/2014 S E M E S T R II Tydzień 1 24.02-28.02 2 03.03-07.03 3 10.03-14.03 Wykłady
VI. SCENARIUSZE ZAJĘĆ W CENTRUM NAUKI KOPERNIK W WARSZAWIE
 68 S t r o n a 1.Temat zajęć: VI. SCENARIUSZE ZAJĘĆ W CENTRUM NAUKI KOPERNIK W WARSZAWIE Projekt: Woda w środowisku przyrodniczym w aspekcie lokalnym i globalnym Temat: Tajemnice kropli wody 2. Czas pracy:
68 S t r o n a 1.Temat zajęć: VI. SCENARIUSZE ZAJĘĆ W CENTRUM NAUKI KOPERNIK W WARSZAWIE Projekt: Woda w środowisku przyrodniczym w aspekcie lokalnym i globalnym Temat: Tajemnice kropli wody 2. Czas pracy:
IMMUNOHISTOCHEMICZNA OCENA MERKERÓW PROLIFERACJI KOMÓRKOWEJ W RAKU JELITA GRUBEGO
 IMMUNOHISTOCHEMICZNA OCENA MERKERÓW PROLIFERACJI KOMÓRKOWEJ W RAKU JELITA GRUBEGO EWA STĘPIEŃ ZAKŁAD PATOMORFOLOGII OGÓLNEJ AKADEMII MEDYCZNEJ W BIAŁYMSTOKU KIEROWNIK I OPIEKUN PRACY: Dr KATARZYNA GUZIŃSKA-USTYMOWICZ
IMMUNOHISTOCHEMICZNA OCENA MERKERÓW PROLIFERACJI KOMÓRKOWEJ W RAKU JELITA GRUBEGO EWA STĘPIEŃ ZAKŁAD PATOMORFOLOGII OGÓLNEJ AKADEMII MEDYCZNEJ W BIAŁYMSTOKU KIEROWNIK I OPIEKUN PRACY: Dr KATARZYNA GUZIŃSKA-USTYMOWICZ
Plan studiów obowiązujący od roku akademickiego 2019/2020
 Specjalność: bioanalityka 4 Metody statystyczne w biologii 2 20 20 20 zal. 2 5 2 30 15 15 15 15 zal. 2 6 Analiza bioinformatyczna 3 30 30 30 zal. 3 7 Biologicznie aktywne substancje roślinne 6,5 75 30
Specjalność: bioanalityka 4 Metody statystyczne w biologii 2 20 20 20 zal. 2 5 2 30 15 15 15 15 zal. 2 6 Analiza bioinformatyczna 3 30 30 30 zal. 3 7 Biologicznie aktywne substancje roślinne 6,5 75 30
Do jednego litra medium dodać 10,0 g skrobi ziemniaczanej lub kukurydzianej i mieszać do uzyskania zawiesiny. Sterylizować w autoklawie.
 Ćwiczenie 3. Izolacja laseczek przetrwalnikujących z gleby Cel ćwiczenia: Izolacja i testowanie przydatności biotechnologicznej laseczek z rodzaju Bacillus występujących w glebie. Odczynniki i podłoża:
Ćwiczenie 3. Izolacja laseczek przetrwalnikujących z gleby Cel ćwiczenia: Izolacja i testowanie przydatności biotechnologicznej laseczek z rodzaju Bacillus występujących w glebie. Odczynniki i podłoża:
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Mikroskopia konfokalna: techniki obrazowania i komputerowa analiza danych.
 Mikroskopia konfokalna: techniki obrazowania i komputerowa analiza danych. Pracownia Mikroskopii Konfokalnej Instytut Biologii Doświadczalnej PAN Jarosław Korczyński, Artur Wolny Spis treści: Co w konfokalu
Mikroskopia konfokalna: techniki obrazowania i komputerowa analiza danych. Pracownia Mikroskopii Konfokalnej Instytut Biologii Doświadczalnej PAN Jarosław Korczyński, Artur Wolny Spis treści: Co w konfokalu
SKUTECZNOŚĆ IZOLACJI JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI? JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI?
 SKUTECZNOŚĆ IZOLACJI Wydajność izolacji- ilość otrzymanego kwasu nukleinowego Efektywność izolacji- jakość otrzymanego kwasu nukleinowego w stosunku do ilości Powtarzalność izolacji- zoptymalizowanie procedury
SKUTECZNOŚĆ IZOLACJI Wydajność izolacji- ilość otrzymanego kwasu nukleinowego Efektywność izolacji- jakość otrzymanego kwasu nukleinowego w stosunku do ilości Powtarzalność izolacji- zoptymalizowanie procedury
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Kit for rapid detection Legionella pneumophilla
 Kit for rapid detection Legionella pneumophilla Zestaw do szybkiej detekcji bakterii Legionella w próbkach wody opiera się na wykorzystaniu immunomagnetycznych kulek. Są to cząsteczki superparamagnetyczne,
Kit for rapid detection Legionella pneumophilla Zestaw do szybkiej detekcji bakterii Legionella w próbkach wody opiera się na wykorzystaniu immunomagnetycznych kulek. Są to cząsteczki superparamagnetyczne,
SPEŁNIENIE DRUGIEGO KRYTERIUM OCENY OFERT
 PN/9OL/09/0 Załącznik nr 8 SPEŁNIENIE DRUGIEGO KRYTERIUM OCENY OFERT PRZEDMIOT ZAMÓWIENIA: dostawy odczynników. Kryterium jakości odczynników (pakiety nr: -, 0-, 7) Nr Nazwa Parametry oceniane Wartość
PN/9OL/09/0 Załącznik nr 8 SPEŁNIENIE DRUGIEGO KRYTERIUM OCENY OFERT PRZEDMIOT ZAMÓWIENIA: dostawy odczynników. Kryterium jakości odczynników (pakiety nr: -, 0-, 7) Nr Nazwa Parametry oceniane Wartość
BIOTECHNOLOGIA STUDIA I STOPNIA
 BIOTECHNOLOGIA STUDIA I STOPNIA OPIS ZAKŁADANYCH EFEKTÓW KSZTAŁCENIA 1) Tabela odniesień kierunkowych efektów kształcenia (EKK) do obszarowych efektów kształcenia (EKO) SYMBOL EKK KIERUNKOWE EFEKTY KSZTAŁCENIA
BIOTECHNOLOGIA STUDIA I STOPNIA OPIS ZAKŁADANYCH EFEKTÓW KSZTAŁCENIA 1) Tabela odniesień kierunkowych efektów kształcenia (EKK) do obszarowych efektów kształcenia (EKO) SYMBOL EKK KIERUNKOWE EFEKTY KSZTAŁCENIA
Biologia molekularna
 Biologia molekularna 1. Metryczka Nazwa Wydziału Program kształcenia Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Analityka Medyczna, studia jednolite magisterskie, studia stacjonarne i niestacjonarne
Biologia molekularna 1. Metryczka Nazwa Wydziału Program kształcenia Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Analityka Medyczna, studia jednolite magisterskie, studia stacjonarne i niestacjonarne
Właściwości białek. 1. Cele lekcji. 2. Metoda i forma pracy. a) Wiadomości. b) Umiejętności. c) Postawy
 Właściwości białek 1. Cele lekcji a) Wiadomości Uczeń: zna pojęcia: peptyd, wiązanie peptydowe, białko, wysalanie, koagulacja, peptyzacja, denaturacja, roztwór koloidalny, zol, żel. wie, jakie czynniki
Właściwości białek 1. Cele lekcji a) Wiadomości Uczeń: zna pojęcia: peptyd, wiązanie peptydowe, białko, wysalanie, koagulacja, peptyzacja, denaturacja, roztwór koloidalny, zol, żel. wie, jakie czynniki
EKSTRAHOWANIE KWASÓW NUKLEINOWYCH JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI? JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI?
 EKSTRAHOWANIE KWASÓW NUKLEINOWYCH Wytrącanie etanolem Rozpuszczenie kwasu nukleinowego w fazie wodnej (met. fenol/chloroform) Wiązanie ze złożem krzemionkowym za pomocą substancji chaotropowych: jodek
EKSTRAHOWANIE KWASÓW NUKLEINOWYCH Wytrącanie etanolem Rozpuszczenie kwasu nukleinowego w fazie wodnej (met. fenol/chloroform) Wiązanie ze złożem krzemionkowym za pomocą substancji chaotropowych: jodek
Laboratorium 5. Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna
 Laboratorium 5 Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Szybkość reakcji enzymatycznej zależy przede wszystkim od stężenia substratu
Laboratorium 5 Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Szybkość reakcji enzymatycznej zależy przede wszystkim od stężenia substratu
Wyklady IIIL 2016/ :00-16:30 środa Wprowadzenie do immunologii Prof. dr hab. med. ML Kowalski
 III rok Wydział Lekarski Immunologia ogólna z podstawami immunologii klinicznej i alergologii rok akademicki 2016/17 PROGRAM WYKŁADÓW Nr data godzina dzień tygodnia Wyklady IIIL 2016/2017 tytuł Wykladowca
III rok Wydział Lekarski Immunologia ogólna z podstawami immunologii klinicznej i alergologii rok akademicki 2016/17 PROGRAM WYKŁADÓW Nr data godzina dzień tygodnia Wyklady IIIL 2016/2017 tytuł Wykladowca
[2ZPK/KII] Inżynieria genetyczna w kosmetologii
![[2ZPK/KII] Inżynieria genetyczna w kosmetologii [2ZPK/KII] Inżynieria genetyczna w kosmetologii](/thumbs/98/136385472.jpg) [2ZPK/KII] Inżynieria genetyczna w kosmetologii 1. Ogólne informacje o module Nazwa modułu Kod modułu Nazwa jednostki prowadzącej modułu Nazwa kierunku studiów Forma studiów Profil kształcenia Semestr
[2ZPK/KII] Inżynieria genetyczna w kosmetologii 1. Ogólne informacje o module Nazwa modułu Kod modułu Nazwa jednostki prowadzącej modułu Nazwa kierunku studiów Forma studiów Profil kształcenia Semestr
Materiał tkankowy opracowano z godnie z obowiązującymi standardami.
 STRESZCZENIE WPROWADZENIE: Biopsja cienkoigłowa (BC) jest szybką, tanią metodą w diagnostyce raka piersi (RP) oraz ognisk przerzutowych tego nowotworu. Skuteczność tej metody uzależniona jest od umiejętności
STRESZCZENIE WPROWADZENIE: Biopsja cienkoigłowa (BC) jest szybką, tanią metodą w diagnostyce raka piersi (RP) oraz ognisk przerzutowych tego nowotworu. Skuteczność tej metody uzależniona jest od umiejętności
Krajowy Fundusz na rzecz Dzieci Program zajęć w Instytucie Biologii Doświadczalnej PAN w dniu 2-6.03.2015 r.
 Krajowy Fundusz na rzecz Dzieci Program zajęć w Instytucie Biologii Doświadczalnej PAN w dniu 2-6032015 r Za organizację zajęć odpowiedzialna dr hab Anna Wasik tel 58 92 227 2032014 PREZENTACJA IBD dla
Krajowy Fundusz na rzecz Dzieci Program zajęć w Instytucie Biologii Doświadczalnej PAN w dniu 2-6032015 r Za organizację zajęć odpowiedzialna dr hab Anna Wasik tel 58 92 227 2032014 PREZENTACJA IBD dla
OPIS PRZEDMIOTU ZAMÓWIENIA DLA CZĘŚCI NR 8
 OPIS PRZEDMIOTU ZAMÓWIENIA DLA CZĘŚCI NR 8 1. IIFT: Mozaika: Hep-2/Wątroba(Małpa) - zestaw testowy do badania in vitro autoprzeciwciał przeciwko: jądra komórkowe(ana) w ludzkiej surowicy lub plazmie 10
OPIS PRZEDMIOTU ZAMÓWIENIA DLA CZĘŚCI NR 8 1. IIFT: Mozaika: Hep-2/Wątroba(Małpa) - zestaw testowy do badania in vitro autoprzeciwciał przeciwko: jądra komórkowe(ana) w ludzkiej surowicy lub plazmie 10
Komórka eukariotyczna organizacja
 Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma podstawowa (cytozol) organelle cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma podstawowa (cytozol) organelle cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Komórka eukariotyczna organizacja
 Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma organelle podstawowa (cytozol) cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Komórka eukariotyczna organizacja Centrum informacyjne jądro Układ wykonawczy cytoplazma cytoplazma organelle podstawowa (cytozol) cytoplazma + jądro komórkowe = protoplazma Komórka eukariotyczna organizacja
Technika radioimmunologicznego oznaczania poziomu hormonów (RIA) dr Katarzyna Knapczyk-Stwora
 Technika radioimmunologicznego oznaczania poziomu hormonów (RIA) dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Radioimmunologiczne metody oznaczania hormonów steroidowych
Technika radioimmunologicznego oznaczania poziomu hormonów (RIA) dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Radioimmunologiczne metody oznaczania hormonów steroidowych
października 2013: Elementarz biologii molekularnej. Wykład nr 2 BIOINFORMATYKA rok II
 10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
KARTA KURSU. Kod Punktacja ECTS* 4
 Załącznik nr 4 do Zarządzenia Nr.. KARTA KURSU Nazwa Nazwa w j. ang. Cytologia i genetyka Cytology and Genetics Kod Punktacja ECTS* 4 Koordynator prof. dr hab. Zbigniew Miszalski Zespół dydaktyczny dr
Załącznik nr 4 do Zarządzenia Nr.. KARTA KURSU Nazwa Nazwa w j. ang. Cytologia i genetyka Cytology and Genetics Kod Punktacja ECTS* 4 Koordynator prof. dr hab. Zbigniew Miszalski Zespół dydaktyczny dr
