Przeciwciała monoklonalne przeciw immunologicznym punktom kontroli w leczeniu chorych na nowotwory
|
|
|
- Bartłomiej Bielecki
- 9 lat temu
- Przeglądów:
Transkrypt
1 PRACA PRZEGLĄDOWA Paweł Krawczyk, Kamila Wojas-Krawczyk Katedra i Klinika Pneumonologii, Onkologii i Alergologii Uniwersytetu Medycznego w Lublinie Przeciwciała monoklonalne przeciw immunologicznym punktom kontroli w leczeniu chorych na nowotwory Monoclonal antibodies against immune checkpoints in immunotherapy of cancer patients Adres do korespondencji: Prof. dr hab. n. med. Paweł Krawczyk Katedra i Klinika Pneumonologii, Onkologii i Alergologii Uniwersytetu Medycznego ul. Jaczewskiego 8, Lublin Tel./faks: krapa@poczta.onet.pl STRESZCZENIE Od czasu opracowania przez Milsteina i Koehlera w 1975 roku technologii produkcji przeciwciał monoklonalnych, zastosowano je w niezliczonych eksperymentach naukowych, do celów diagnostycznych i terapeutycznych. W leczeniu chorych na nowotwory przeciwciała monoklonalne, blokujące receptory powierzchniowe nieprawidłowych komórek, pojawiły się pod koniec lat 90. ubiegłego wieku i okazały się niezwykle skuteczne w raku piersi (trastuzumab) lub jelita grubego (cetuksymab, panitumumab). Po upływie dekady nastąpił dynamiczny rozwój immunoterapii przeciwnowotworowej z udziałem przeciwciał monoklonalnych ukierunkowanych na immunologiczne punkty kontroli odpowiedzi odpornościowej. Zastosowanie przeciwciał anty-ctla-4 (ipilimumab), anty-pd-1 (niwolumab, pembrolizumab) lub anty-pd-l1 (MPDL-3280A, MEDI-4736) ma na celu zniesienie anergii efektorowych limfocytów T wywoływanej przez komórki nowotworowe lub prezentujące antygen. Wspomniana anergia występuje wskutek połączenia różnych immunologicznych punktów kontroli (immune checkpoints), które znajdują się na wszystkich komórkach organizmu. Terapie tego rodzaju przynoszą często długotrwałą kontrolę choroby i rozwój swoistej odpowiedzi immunologicznej w takich nowotworach, jak czerniak i niedrobnokomórkowy rak płuca, a nawet rak nerki oraz trzustki. Są zazwyczaj mniej toksyczne od chemioterapii, choć do powikłań leczenia należą nierzadkie zjawiska autoimmunologiczne. Słowa kluczowe: immunoterapia, nowotwory, przeciwciała monoklonalne, immunologiczne punkty kontrolne Onkologia w Praktyce Klinicznej 2015, tom 11, nr 2, Copyright 2015 Via Medica ISSN ABSTRACT Since 1975, when Koehler and Milstein had established the technology for the production of monoclonal antibodies, they were applied in numerous scientific experiments as well as for diagnostic and therapeutic purposes. In the late 90s of the last century, monoclonal antibodies which act by blocking surface receptors on abnormal cells, have proven to be very effective in the treatment of diseases such as breast cancer (trastuzumab) and colorectal cancer (cetuximab, panitumumab). After decade we observe a dynamic development of cancer immunotherapy involving monoclonal antibodies targeting immune checkpoints of immune response. The use of anti-ctla-4 (ipilimumab), anti-pd-1 (niwolumab, pembrolizumab) or anti-pd-l1 (MPDL-3280, MEDI-4736) is intended to remove an anergy effector T cells induced by tumour cells or by antigen presenting cells. This type of therapy often results in long-term disease control and in development of a specific immune response in such malignancies as melanoma, non-small cell lung cancer, kidney and pancreatic cancer. They are generally less toxic than chemotherapy, but the treatment is associated with quite frequent autoimmune phenomena. Key words: immunotherapy, malignancies, monoclonal antibodies, immune checkpoints Onkol. Prak. Klin. 2015; 11, 2:
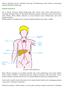
2 Paweł Krawczyk, Kamila Wojas-Krawczyk, Przeciwciała monoklonalne przeciw immunologicznym punktom kontroli w leczeniu chorych na nowotwory Wprowadzenie Klasyczne pojęcie immunoterapii biernej odnosi się do zastosowania przeciwciał monoklonalnych skierowanych przeciwko receptorom powierzchniowym komórek nowotworowych. Pierwsze przeciwciała monoklonalne zastosowano w leczeniu przeciwnowotworowym w latach 90. ubiegłego wieku. Były to rytuksymab (przeciwciało anty-cd20), stosowany w leczeniu chłoniaków nieziarniczych i przewlekłej białaczki limfatycznej B-komórkowej, oraz trastuzumab (przeciwciało anty-her2, human epidermal receptor type 2), wykorzystywany w raku piersi z silną ekspresją antygenu HER2 na komórkach nowotworowych (obecnie przeciwciało stosowane również w terapii chorych na raka żołądka z ekspresją HER2). Podstawowe działanie przeciwciał polega na blokowaniu receptorów dla szlaków przewodzenia wewnątrzkomórkowego, co powoduje zahamowanie proliferacji i apoptozę komórek docelowych. Przeciwciała blokują także homo- lub heterodimeryzację receptorów, która jest często niezbędna do uruchomienia wewnątrzkomórkowej kaskady sygnałowej. Niszczenie komórek nowotworowych w mechanizmie cytotoksyczności komórkowej zależnej od przeciwciał (ADCC, antibody dependent cellular cytotoxicity) lub poprzez aktywację układu dopełniacza jest możliwe w przypadku zastosowania przeciwciał klasy IgG1 (np. cetuksymab, trastuzumab). Obserwuje się także wzrost produkcji autologicznych przeciwciał skierowanych przeciw receptorowi naskórkowego czynnika wzrostu (EGFR, epidermal growth factor receptor) po leczeniu cetuksymabem lub anty- -HER2 po zastosowaniu trastuzumabu. Przeciwciała mysie i chimeryczne (np. ibrytumumab, cetuksymab) charakteryzują się krótszym czasem półtrwania w organizmie i muszą być częściej stosowane oraz częściej mogą powodować działania niepożądane w związku z wprowadzeniem do organizmu obcego białka. Przeciwciała humanizowane (np. trastuzumab) lub ludzkie (np. panitumumab) są bezpieczniejsze i mogą być rzadziej stosowane niż przeciwciała zawierające większy fragment obcego białka [1, 2]. Opis badań klinicznych, które przyczyniły się do rejestracji przeciwciał monoklonalnych w leczeniu przeciwnowotworowym, wykracza poza ramy niniejszego opracowania [3]. Obecnie w chorobach nowotworowych jest zarejestrowanych 21 przeciwciał (większość w hematoonkologii). Dziewięć preparatów zawierających przeciwciała monoklonalne znalazło zastosowanie w terapii nowotworowych guzów litych. Oprócz wymienionego wcześniej trastuzumabu i jego modyfikacji ado-trastuzumabu emtansyny przeciwciałami zarejestrowanymi w różnych wskazaniach są: cetuksymab (anty-egfr) u chorych na raka jelita grubego i odbytnicy bez mutacji w genach RAS oraz regionu głowy i szyi, panitumumab (anty-egfr) u chorych na raka jelita grubego i odbytnicy bez mutacji w genach RAS, bewacyzumab (anty- -VEGF) u chorych na raki jelita grubego i odbytnicy, nerki, niedrobnokomórkowego raka płuca (NDRP) oraz raki piersi, szyjki macicy i jajnika, pertuzumab (anty-her2) u chorych na HER2-dodatniego raka piersi, ramucyrumab (anty-vegfr2) u chorych na raka żołądka [3]. Pozytywne wyniki badań klinicznych III fazy uzyskały: necytumumab (anty-egfr) u chorych na NDRP, ramucyrumab (anty-vegfr2) u chorych na NDRP i dinutuksymab (przeciwciało przeciwko gangliozydom GD2) u chorych na nerwiaka zarodkowego. Wiele spośród wymienionych przeciwciał stosuje się w skojarzeniu z chemioterapią, co prowadzi często do bardzo znamiennego przedłużenia czasu przeżycia wolnego od progresji i całkowitego, nie zabezpieczając jednak od nawrotu choroby rozpoznanej w zaawansowanym stadium. Dlatego też od wymienionych powyżej przeciwciał monoklonalnych (klasyczna immunoterapia bierna) należy wyraźnie odróżnić przeciwciała oddziałujące na immunologiczne punkty kontrolne (rejestrację w różnych wskazaniach uzyskały ipilimumab, niwolumab i pembrolizumab; dwa ostatnie tylko w Stanach Zjednoczonych i Japonii) ze względu na zupełnie odmienny mechanizm działania (zniesienie immunotolerancji), profil toksyczności i skuteczność (przeciwciała te charakteryzują się zdolnością do wywoływania wieloletniej kontroli choroby u niektórych chorych) [3, 4]. Blokada immunologicznych punktów kontroli odpowiedzialnych za hamowanie funkcji limfocytów T jako nowa metoda immunoterapii Najważniejszy sygnał do swoistej aktywacji limfocytów efektorowych zależny jest od rozpoznania przez nie antygenu z wykorzystaniem TCR (T cell receptor). Jednak na powierzchni limfocytów T efektorowych (limfocyty T cytotoksyczne i T pomocnicze), wywołujących odpowiedź przeciwnowotworową znajdują się cząsteczki kostymulujące lub koinhibujące (immune checkpoints). Ligandy dla nich znajdują się na powierzchni komórek prezentujących antygen (APC, antigen presenting cells) i komórek nowotworowych. Połączenie wymienionych cząsteczek i ligandów decyduje o dalszych losach limfocytu. Najważniejszym sygnałem aktywującym limfocyty T efektorowe jest połączenie ich cząsteczki CD28 z cząsteczkami CD80 (B7-1) i CD86 (B7-2) na powierzchni APC lub komórek nowotworowych. Jednak, jeśli partnerem dla CD80 i CD86 jest zamiast CD28 antygen CTLA-4 (cytotoxic T cell antigen 4), to dochodzi do anergii i apoptozy limfocytu. Komórki prezentujące i nowotworowe dysponują również cząsteczkami PD- -L1 (B7-H1) i PD-L2 (B7-DC) (programmed cell death protein ligand 1 and 2), których połączenie z antygenem 77
3 Onkologia w Praktyce Klinicznej 2015, tom 11, nr 2 Rycina 1. Rola cząsteczek B7 w regulacji przeciwnowotworowej odpowiedzi immunologicznej [7, 8] PD-1 (programmed cell death protein 1) na powierzchni limfocytów powoduje zahamowanie ich aktywności. Jak z tego wynika, w mikrośrodowisku guza nowotworowego może istnieć przewaga sygnałów hamujących funkcję limfocytów T efektorowych, co doprowadza do ucieczki komórek nowotworowych spod nadzoru immunologicznego [5, 6]. Rolę cząsteczek kostymulujących i koinhibujących przedstawiono na rycinie 1 i w tabeli 1. Koncepcja immunoterapii z wykorzystaniem przeciwciał przeciw immunologicznym punktom kontrolnym polega na ich zdolności do odwrócenia anergii limfocytów T w środowisku guza. Limfocyty otrzymują wówczas tylko sygnały aktywujące i znowu są zdolne do zniszczenia komórek nowotworowych. Strategia ta okazała się niezwykle skuteczna w przypadku niektórych typów nowotworów i zrewolucjonizowała dotychczasowe metody immunoterapii. Rewolucja ta dokonała się bardzo szybko i po kilkunastu latach od rozpoczęcia badań przeciwciała monoklonalne anty-ctla-4 (ipilimumab, tremelimumab), anty-pd-1 (niwolumab, pembrolizumab) i anty-pd-l1 (MEDI4736, MPDL3280A) są stosowane w rutynowym leczeniu lub przechodzą ostatnie etapy badań klinicznych u pacjentów z różnymi typami nowotworów [5 7]. Przeciwciała anty-ctla-4 CTLA-4 jest negatywnym regulatorem aktywacji limfocytów T. Ponadto połączenie CTLA-4 na dziewiczym limfocycie T z cząsteczkami B7-1 i B7-2 na APC powoduje różnicowanie limfocytów w kierunku komórek regulatorowych (limfocyty Treg odpowiedzialne za stan immunotolerancji). Cząsteczka CTLA-4 występuje przede wszystkim na APC (nie występuje na komórkach nowotworowych) i odgrywa rolę hamującą funkcję limfocytu T efektorowego podczas prezentacji antygenu w węzłach chłonnych z dala od toczącego się procesu nowotworowego. Ipilimumab, blokując CTLA-4, powoduje aktywację limfocytów T, zwiększa ich proliferację i zdolność do infiltrowania przez nie tkanki nowotworowej. Ipilimumab prowadzi również do wzrostu odsetka aktywowanych limfocytów T pomocniczych i cytotoksycznych we krwi obwodowej. W badaniu III fazy MDX skuteczność ipilimumabu w monoterapii (137 chorych) lub w skojarzeniu z immunoterapią za pomocą antygenu gp100 (403 chorych) porównano do skuteczności samej szczepionki gp100 (136 pacjentów) w zaawansowanym czerniaku wcześniej leczonym systemowo z powodu 78
4 Paweł Krawczyk, Kamila Wojas-Krawczyk, Przeciwciała monoklonalne przeciw immunologicznym punktom kontroli w leczeniu chorych na nowotwory Tabela 1. Porównanie immunologicznych punktów kontroli Obecność na komórkach Funkcja Ligandy Mechanizm działania PD-1 Aktywowane limfocyty B i T Aktywowane komórki NK (natural killers) Limfocyty infiltrujące guz (TILs) w różnych typach nowotworów Receptor hamujący Ogranicza aktywność limfocytów T w tkankach obwodowych po zaistnieniu reakcji zapalnej Ogranicza autoreaktywność limfocytów i komórek NK PD-L1 (B7-H1/CD274) PD-L2 (B7-CD/CD273) Interakcja receptora z jego ligandem powoduje aktywację fosfatazy SHP-2 i spadek ekspresji białka Bcl-xL, co skutkuje zahamowaniem aktywności kinazy PI3K/AKT CTLA-4 Aktywowane w początkowej fazie odpowiedzi na antygen limfocyty T efektorowe i regulatorowe Receptor hamujący Reguluje (zmniejsza) aktywację limfocytów T na wczesnym etapie ich różnicowania CD80 (B7.1) CD86 (B7.2) Interakcja receptora z jego ligandem powoduje aktywację fosfatazy SHP-2 i PP2A oraz blokadę ekspresji różnych białek w błonie komórkowej i przepływu jonów Ca 2+, co skutkuje zahamowaniem przekaźnictwa sygnału przez TCR (blokada formowania białek ZAP70) uogólnienia choroby [9]. Ipilimumab stosowano w dawce 3 mg/kg mc. Znamienną korzyść z leczenia obserwowano u osób otrzymujących ipilimumab w porównaniu z pacjentami otrzymującymi tylko szczepionkę gp100. Mediana całkowitego przeżycia u chorych przyjmujących ipilimumab w monoterapii wyniosła 10 miesięcy, a u osób leczonych gp100 nie przekroczyła 6 miesięcy. Odsetek przeżyć 1-rocznych pacjentów leczonych ipilimumabem wyniósł 46%, a 2-letnich 24% [9 11]. Działania niepożądane terapii anty-ctla-4 wynikały głównie z nadmiernej aktywności układu immunologicznego i dotyczyły objawów ze strony układu pokarmowego (biegunki, zapalenie jelita grubego, hepatotoksyczność), skóry (wysypka, świąd), układu neurologicznego (miastenia, neuropatia czuciowa). Poważne działania niepożądane (3. 4. stopień) związane z ipilimumabem (irae, immune-related adverse event) dotyczyły 13% chorych. Profil toksyczności ipilimumabu wiąże się z naturalną funkcją CTLA-4, która polega na wygaszaniu odpowiedzi immunologicznej na własne antygeny i zabezpieczaniu organizmu przed rozwojem chorób autoimmunologicznych. Ma to miejsce w węzłach chłonnych i innych narządach limfatycznych całego organizmu, w związku z tym nasilenie zaburzeń związanych z autoagresją może być silne i mieć charakter uogólniony. W leczeniu niepożądanych działań ipilimumabu skuteczne były glikokortykosteroidy, a budezonid został profilaktycznie zastosowany w celu zmniejszenia nasilenia objawów ze strony przewodu pokarmowego. Mimo że glikokortykosteroidy wywierały efekt przeciwzapalny przeciwny do działania ipilimumabu nie odnotowano obniżenia skuteczności przeciwciała anty-ctla-4 [9 11]. Wyjątkowa skuteczność ipilimumabu zainicjowała wiele badań u chorych na zaawansowanego czerniaka, których wyniki oceniono w ramach metaanalizy (12 badań 1861 chorych). Mediana czasu przeżycia całkowitego chorych wynosiła 11,4 miesiąca, a odsetek pacjentów żyjących dłużej niż 3 lata osiągnął 22%. Po raz pierwszy w historii leczenia zaawansowanego czerniaka stwierdzono tak znaczący odsetek osób, u których uzyskano kontrolę choroby lub nawet jej wyleczenie. Chemioterapia (dakarbazyna), starsze metody immunoterapii i leki ukierunkowane molekularnie (wemurafenib) nie przyniosły aż tak spektakularnego efektu [12]. Obserwacje te potwierdzają wyniki badania CA , w którym porównywano skuteczność skojarzonego leczenia ipilimumabem i dakarbazyną z efektem monoterapii dakarbazyną u chorych na zaawansowanego czerniaka. Wskaźnik 5-letniego przeżycia wyniósł 18,2% u osób poddanych leczeniu skojarzonemu i tylko 8,8% u pacjentów otrzymujących dakarbazynę w monoterapii. Ponadto u chorych stosujących ipilimumab odnotowano 7,5% całkowitych remisji i 42,5% częściowych remisji czerniaka, a w grupie kontrolnej jedynie remisje częściowe choroby u 35% pacjentów [12, 13]. W badaniu III fazy EORTC18071 ipilimumab zastosowano adiuwantowo u chorych na czerniaka po całkowitej resekcji nowotworu, u których stwierdzono wysokie ryzyko nawrotu choroby. Wykazano, że mediana czasu przeżycia wolnego od nawrotu choroby w grupie pacjentów otrzymujących ipilimumab w monoterapii w dawce 10 mg/kg mc. wyniosła 26 miesięcy, a w grupie placebo osiągnęła zaledwie 17 miesięcy, co przełożyło się także na zwiększenie odsetka wyleczeń u chorych poddanych immunoterapii. Jednak niepożądane działania ipilimumabu (3. 4. stopień), manifestujące się zaburzeniami ze strony przewodu pokarmowego (15,9% osób), hepatotoksycznością (10,6%) i zaburzeniami endokryn- 79
5 Onkologia w Praktyce Klinicznej 2015, tom 11, nr 2 Tabela 2. Kryteria oceny odpowiedzi immunologicznej w określaniu skuteczności immunoterapii [17] Rodzaj odpowiedzi ircr irpr irsd irpd Charakterystyka Ustąpienie wszystkich zmian nowotworowych (mierzalnych lub nie), brak nowych zmian nowotworowych stwierdzone w co najmniej dwóch obserwacjach w odstępie 4 tygodni od daty pierwszej dokumentacji remisji. Zmniejszenie o przynajmniej 50% sumy wymiarów wszystkich ocenianych zmian (w tym nowych zmian) w porównaniu z wartością wyjściową, stwierdzone w co najmniej dwóch obserwacjach w odstępach 4 tygodni od daty pierwszej dokumentacji remisji. Częściowej remisji immunologicznej nie wyklucza stwierdzenie nowych zmian w pierwszej ocenie po pełnym leczeniu indukcyjnym. Zmniejszenie o mniej niż 50% lub zwiększenie o mniej niż 25% sumy wymiarów ocenianych zmian. Dopuszczalne jest wykrycie nowych ognisk choroby w pierwszej ocenie po pełnym leczeniu indukcyjnym. Zwiększenie jednej lub większej liczby zmian o więcej niż 25% lub wzrost o więcej niż 25% nowych ognisk stwierdzone przy pierwszej ocenie odpowiedzi. nymi (8,5%), doprowadziły do zaprzestania leczenia tym preparatem u 38,6% chorych. Pięciu pacjentów zmarło z powodu powikłań terapii [14]. Przedkliniczne badania prowadzone na liniach komórkowych raka płuca wykazały, że połączenie leków cytotoksycznych (np. związki platyny i taksoidy) może zwiększać aktywność ipilimumabu i nasilać odpowiedź immunologiczną ze strony limfocytów T. Na podstawie tych obserwacji w badaniu II fazy ipilimumab został zastosowany równocześnie z chemioterapią (karboplatyna i paklitaksel) lub był dołączony do chemioterapii po dwóch pierwszych cyklach u chorych na NDRP, którzy dotychczas nie byli leczeni. W przypadku uzyskania obiektywnych korzyści ipilimumab stosowano w terapii podtrzymującej. Grupę kontrolną stanowili chorzy poddani chemioterapii I linii. U osób, u których ipilimumab był dołączony do trwającej chemioterapii (po dwóch cyklach), zaobserwowano istotne wydłużenie mediany czasu przeżycia wolnego od progresji w porównaniu z pacjentami otrzymujących równocześnie ipilimumab i chemioterapię lub tylko chemioterapię (odpowiednio 5,6 wobec 5,5 wobec 4,6 miesiąca). Wydłużenie całkowitego czasu życia nie było jednak znamienne statystycznie. Większą korzyść z terapii ipilimumabem odnosili chorzy z rozpoznaniem raka płaskonabłonkowego [15, 16]. Obecnie trwa kilka badań klinicznych, w których ipilimumab jest stosowany u chorych na płaskonabłonkowego raka płuca i drobnokomórkowego raka płuca oraz nowotwory nerki, gruczołu krokowego, trzustki i wiele innych. Trwają również badania nad nowymi przeciwciałami anty-ctla-4. Zastosowanie tremelimumabu powodowało trwałe remisje u chorych na czerniaka (badania I i II fazy). Podjęto próby kliniczne zastosowania tremelimumabu u pacjentów z międzybłoniakami opłucnej i innymi nowotworami [4]. Badania kliniczne z zastosowaniem ipilimumabu ujawniły, że kryteria RECIST (Response Evaluation Criteria in Solid Tumours) nie oddają w pełni obecności lub braku korzyści ze stosowania immunoterapii. W związku z tym w 2009 roku Cancer Vaccine Consorcium opracowało kryteria odpowiedzi immunologicznej (irrc, immune-related Response Criteria), które zostały wprowadzone do oceny skuteczności większości rodzajów immunoterapii (w tym do leczenia cytokinami i szczepionkami przeciwnowotworowymi). Kryteria irrc zakładają, że wystąpienie mierzalnej odpowiedzi na immunoterapię może wystąpić później niż w przypadku stosowania chemioterapii, co uzasadnia kontynuowanie immunoterapii nawet po progresji choroby stwierdzonej na podstawie kryteriów RECIST. Ponadto pojawiło się pojęcie klinicznie nieistotnej progresji (np. wystąpienie nowych zmian równocześnie ze zmniejszeniem się zmian obserwowanych wcześniej) [17]. Kryteria oceny odpowiedzi immunologicznej skuteczności immunoterapii scharakteryzowano w tabeli 2. Przeciwciała anty-pd-1 i anty-pd-l1 Cząsteczki PD-1 na powierzchni limfocytów po połączeniu z ligandami PD-L1 i/lub PD-L2 na komórkach docelowych lub APC przekazują główny sygnał do wejścia limfocytów w stan anergii w tkankach obwodowych (ryc. 2). Mechanizm ten ma mniejsze znacznie dla rozwoju immunotolerancji w narządach limfatycznych (np. węzły chłonne), gdzie limfocyty stają się nieaktywne między innymi poprzez połączenie CTLA-4 i CD28 [6]. Spektakularne wyniki leczenia chorych na zaawansowanego czerniaka z wykorzystaniem przeciwciał anty-pd-1 ogłoszono już w 2012 roku. Topalian i wsp. [18] wykazali, że mediana całkowitego czasu przeżycia chorych otrzymujących niwolumab (przeciwciało anty- -PD-1) wyniosła 16,8 miesiąca, a przeżycia 2-letnie zanotowano u 43% pacjentów. Najskuteczniejszą dawką niwolumabu było 3 mg/kg mc. (badano dawki: 0,1 10 mg/kg mc.) W 2014 roku amerykańska Agencja Żywności i Leków (FDA, Food and Drug Administration), na 80
6 Paweł Krawczyk, Kamila Wojas-Krawczyk, Przeciwciała monoklonalne przeciw immunologicznym punktom kontroli w leczeniu chorych na nowotwory Rycina 2. Mechanizm anergii limfocytów T efektorowych oraz działania przeciwciał monoklonalnych anty-pd-1 lub anty-pd-l1 chorych na nowotwory [7, 8] podstawie wyników badania III fazy CheckMate-037, wydała pozytywne rekomendacje dla niwolumabu (anty-pd-1) w leczeniu chorych na zaawansowanego czerniaka po niepowodzeniu stosowania ipilimumabu. Badanie CheckMate-037 obejmowało chorych leczonych uprzednio ipilimumabem zarówno otrzymujących wcześniej wemurafenib (z mutacją V600E w genie BRAF), jak i chorych z prawidłowym stanem (typ dziki) genu BRAF. Chorzy otrzymywali niwolumab w monoterapii (268 chorych) lub byli poddani chemioterapii za pomocą dakarbazyny lub karboplatyny i paklitakselu (102 osób). Całkowity odsetek odpowiedzi u pacjentów leczonych niwolumabem wyniósł 32%, a u chorych poddanych chemioterapii był 3-krotnie niższy (11%). Aż 95% chorych, którzy odpowiedzieli na leczenie niwolumabem, jest wciąż w remisji choroby, co uniemożliwia obliczenie czasu wolnego od progresji i zakończenie badania. Poważne działania niepożądane (3. 4. stopień według klasyfikacji irae) podczas stosowania niwolumabu wystąpiły u 9% chorych (u 2% przerwano terapię leczenia). Profil powikłań był podobny jak w przypadku innych metod leczenia ukierunkowanych na immunologiczne punkty kontroli, jednak toksyczność była zazwyczaj możliwa do opanowania za pomocą glikokortykosteroidów. Nie zanotowano poważnych infekcji płuc ani zgonów związanych z terapią niwolumabem. Różnice w profilu i częstości działań niepożądanych związanych z terapią anty-pd-1 i z terapią anty- -CTLA-4 wydają się zależeć od mechanizmu regulacji odpowiedzi immunologicznej przez te cząsteczki. Do anergii limfocytów T efektorowych w mechanizmie połączenia PD-1 i PD-L1 dochodzi zwykle w tkankach obwodowych i rozwijającym się guzie (ryc. 2). Dlatego też nasilenie działań niepożądanych terapii anty-pd-1 jest mniejsze niż w przypadku stosowania leków anty-ctla-4, gdy dochodzi do pobudzenia autoreaktywnych limfocytów T w węzłach chłonnych i innych narządach limfatycznych (uogólniona reakcja autoimmunologiczna) [3, 18 20]. W badaniu CheckMate-066 niwolumab jest stosowany w I linii terapii u chorych na zaawansowanego czerniaka. W grupie kontrolnej podaje się dakarbazynę. Odsetek przeżyć 1-rocznych u chorych leczonych niwolumabem wyniósł 72,9% (42,1% u pacjentów poddawanych chemioterapii; p < 0,001), a mediana czasu przeżycia wolnego od progresji 5,1 miesiąca (2,2 miesiąca u pacjentów poddawanych chemioterapii) [20, 21]. W badaniu klinicznym I fazy oceniono skuteczność i toksyczność różnych dawek (1, 3 lub 10 mg/kg mc.) niwolumabu u uprzednio leczonych chorych na zaawansowanego NDRP. Odpowiedź na monoterapię niwolumabem odnotowano u 17,7% osób niezależnie od rozpoznania 81
7 Onkologia w Praktyce Klinicznej 2015, tom 11, nr 2 patomorfologicznego. Mediana całkowitego przeżycia wynosiła, odpowiednio, 9,2, 14,9 i 9,2 miesiąca dla poszczególnych dawek niwolumabu. Wskaźniki 2- i 3-letniego przeżycia całkowitego wynosiły, odpowiednio, 42% i 27% leczonych niwolumabem w dawce 3 mg/kg. Na podstawie uzyskanych wyników rozpoczęto badanie II fazy CheckMate-063, w którym niwolumab w dawce 3 mg/kg mc. podano 117 chorym na zaawansowanego raka płaskonabłonkowego, którzy otrzymali więcej niż II linie leczenia systemowego (65% pacjentów otrzymało ponad III linie leczenia). Odsetek odpowiedzi, odsetek chorych żyjących ponad rok i medianę czasu przeżycia całkowitego oszacowano w tym badaniu na 15%, 41% i 8,2 miesiąca. Ponadto 26% pacjentów wykazywało stabilizację choroby w ciągu 6 miesięcy od rozpoczęcia terapii niwolumabem. Poważne działania niepożądane zaobserwowano u 17% chorych (w tym zapalenie płuc u 3,4% osób i biegunki u 2,6% pacjentów). Wyniki badania CheckMate-063 były spektakularne. U chorych na raka płaskonabłonkowego po tak intensywnym leczeniu systemowym nie udawało się dotychczas uzyskać odpowiedzi na kolejne linie terapii, a szacowany czas ich życia nie przekraczał 5 miesięcy. Zakończyły się badania kliniczne nad efektywnością II linii terapii za pomocą niwolumabu u chorych na niedrobnokomórkowego raka płuca. W badaniach III fazy CheckMate-017 oraz CheckMate-057 skuteczność niwolumabu była porównywana z docetakselem u chorych na płaskonabłonkowego i niepłaskonabłonkowego przerzutowego raka płuca. Do badań tych zrekrutowano łącznie 838 pacjentów [22, 23]. Na podstawie wyników badania CheckMate marca 2015 roku FDA wydała pozytywną opinię o możliwości zastosowania niwolumabu w płaskonabłonkowym raku płuca [22]. Spodziewana jest również decyzja w niepłaskonabłonkowym raku płuca. Skuteczność niwolumabu jest oceniana także w I linii leczenia NDRP. W I fazie badań klinicznych wykazano, że monoterapia niwolumabem przedłuża czas wolny od progresji do 15,6 tygodnia niezależnie od rozpoznania patomorfologicznego. Mediana całkowitego czasu życia chorych wyniosła 98,3 tygodnia. Na podstawie uzyskanych wyników rozpoczęły się badania III fazy Check- Mate-026, porównujące skuteczność niwolumabu do dowolnego schematu chemioterapii I linii (495 chorych) oraz I fazy CheckMate-012, w którym efektywność niwolumabu jest porównywana do różnych schematów chemioterapii zawierających również ipilimumab lub bewacyzumab (412 pacjentów z ekspresją PD-L1 na komórkach nowotworowych) [4, 23]. Efekt immunoterapii u chorych na zaawansowanego NDRP w progresji po poprzednich liniach leczenia próbowano wzmocnić, łącząc niwolumab i ipilimumab w dawkach, odpowiednio, 1 mg/kg mc. i 3 mg/kg mc. Roczne przeżycia zaobserwowano u 65% chorych, a mediana czasu przeżycia wolnego od progresji wyniosła 16,1 tygodnia. Niestety leczenie skojarzone było obarczone bardzo dużym ryzykiem wystąpienia poważnych skutków ubocznych. U 37% pacjentów wystąpiło zapalenie płuc, krwioplucie, zapalenie jelita grubego, biegunka lub zapalenie nerek [4, 23]. W raku nerkowokomórkowym dotychczasowe metody immunoterapii rzadko prowadzą do uzyskania oczekiwanych wyników. Podobnie jak w przypadku NDRP, podjęto próbę skojarzonego leczenia niwolumabem i ipilimumabem u 40% chorych stwierdzono obiektywne odpowiedzi, które trwały średnio 18 tygodni. Działania niepożądane odnotowano aż u 89% pacjentów (u 16% leczenie przerwano z powodu toksyczności). Natomiast niwolumab stosowany w monoterapii okazał się skuteczny w leczeniu chorych na raka nerki. W badaniu klinicznym I fazy wykazano częściową odpowiedź na terapię u 29% pacjentów i medianę czasu przeżycia wynoszącą 18 miesięcy. W związku z tym rozpoczęło się badanie III fazy, do którego zrekrutowano 822 chorych na zaawansowanego raka jasnokomórkowego nerki, którzy na drodze randomizacji leczenia otrzymywali niwolumab lub ewerolimus (inhibitor mtor). Trwają badania kliniczne nad możliwością wykorzystania niwolumabu w leczeniu chorych na wiele innych nowotworów (rak żołądka, nowotwory nabłonkowe regionu głowy i szyi, rak pęcherza moczowego po wzmocnieniu odpowiedzi immunologicznej przez wlewki BCG, rak piersi i chłoniak Hodgkina komórki Reed-Sternberga wykazują wysoką ekspresję PD-L1). W ostatnim z wymienionych wskazań u osób uprzednio intensywnie leczonych, po przeprowadzeniu autologicznego przeszczepu komórek macierzystych i w progresji choroby, za pomocą niwolumabu udawało się uzyskać aż 80% obiektywnych odpowiedzi [24, 25]. Podobną skutecznością do niwolumabu charakteryzuje się inne przeciwciało anty-pd-1 pembrolizumab [26]. W badaniu I fazy KEYNOTE-001 wzięło udział 1137 chorych na różne typy nowotworów, w tym na czerniaka (411 osób) i NDRP. Pacjenci otrzymali pembrolizumab w dawce 10 mg/kg mc. (co 2 lub 3 tygodnie) lub 3 mg/kg mc. (co 3 tygodnie). Badanie dotyczące chorych na czerniaka było przeprowadzone zarówno w grupie z losowym doborem pacjentów, jak i bez niego oraz wśród osób wcześniej leczonych ipilimumabem i bez takiej terapii. Łączna analiza wszystkich chorych, u których występowały zmiany mierzalne według kryteriów RECIST (365 osób), wykazała, że u osób wcześniej leczonych ipilimumabem odpowiedź na pembrolizumab wystąpiła w 28% przypadków, mediana czasu do progresji wynosiła 23 tygodnie, a odsetek chorych żyjących dłużej niż rok wynosił 69%. W grupie pacjentów, którzy wcześniej nie otrzymywali ipilimumabu, wskaźniki te wynosiły odpowiednio: 40%, 24 tygodnie i 71%. Poważne działania niepożądane 82
8 Paweł Krawczyk, Kamila Wojas-Krawczyk, Przeciwciała monoklonalne przeciw immunologicznym punktom kontroli w leczeniu chorych na nowotwory Tabela 3. Charakterystyka przeciwciał anty-pd-1 i anty-pd-l1 Cząsteczka Nazwa preparatu Rodzaj przeciwciała Faza badania PD-1 Niwolumab BMS Ludzkie IgG4 III/rejestracja amerykańska (FDA) i japońska u chorych na czerniaka po niepowodzeniu ipilimumabu i w II linii terapii płaskonabłonkowego raka płuca Pembrolizumab MK-3475 Humanizowane IgG4 III/rejestracja FDA w czerniaku po niepowodzeniu ipilimumabu Pidilizumab CT-011 Humanizowane IgG1 II AMP-224 Rekombinowane z fragmentem Fc I koniugowanym z cząsteczką PD-L2 PD-L1 BMS Ludzkie IgG4 I MEDI-4736 Ludzkie IgG1 III MPDL-3280A Ludzkie IgG1 III MSB C Ludzkie IgG1 II FDA (Food and Drug Administration) Agencja Żywności i Leków (3. 4. stopień) występowały rzadko i manifestowały się zapaleniem płuc (0,2%), jelita (0,5%), wątroby (0,2%), nerek (0,5%), przysadki (0,2%) oraz nadczynnością lub niedoczynnością tarczycy (0,4%). Jesienią 2014 roku, na podstawie wyników badania KEYNOTE-001, FDA zarejestrowała pembrolizumab do leczenia chorych na przerzutowego i nieoperacyjnego czerniaka po niepowodzeniu terapii ipilimumabem. Trwają zaawansowane badania, których zadaniem jest wykazanie wyższości terapii pembrolizumabem nad terapią ipilimumabem (KEYNOTE-006 u 645 chorych na przerzutowego lub nieresekcyjnego czerniaka) oraz nad chemioterapią (KEYNOTE-002 u 510 chorych na zaawansowanego czerniaka) [26 28]. W badaniu KEYNOTE-001 pembrolizumab w I i kolejnych liniach otrzymało również 307 chorych na zaawansowanego NDRP. W I linii pembrolizumab stosowano u pacjentów, których komórki nowotworowe wykazywały ekspresję białka PD-L1. W grupie 45 chorych przyjmujących pembrolizumab w I linii leczenia w dawce 10 mg/kg mc. w odstępach 2- (16 osób) lub 3-tygodniowych (23 osób) oraz otrzymujących pembrolizumab w dawce 2 mg/kg mc w odstępach 3-tygodniowych odsetek odpowiedzi wyniósł, odpowiednio, 35%, 27% i 67%. Całkowity odsetek odpowiedzi mierzony kryteriami irrc w całej grupie był równy 36%, mediana czasu wolnego od progresji wynosiła 27 tygodni, a pół roku przeżyło 51% chorych. W drugiej grupie pacjentów poddawanych wcześniej chemioterapii (221 osób) mediana czasu wolnego od progresji wyniosła 10 tygodni, a pół roku przeżyło 26% chorych leczonych pembrolizumabem. Mediana czasu życia dla wszystkich chorych otrzymujących pembrolizumab w I lub w II i kolejnych liniach leczenia wynosiła 8,2 miesiąca [26, 29, 30]. Trwają zaawansowane badania kliniczne mające na celu wykazanie skuteczności pembrolizumabu w monoterapii lub w skojarzeniu z chemioterapią w różnych populacjach chorych na NDRP. Do najważniejszych z nich należy KEYNOTE-010, porównujące skuteczność docetakselu w monoterapii lub w skojarzeniu z pembrolizumabem w II linii leczenia (920 chorych) oraz KEY- NOTE-024, porównujące efektywność I linii z wykorzystaniem pembrolizumabu lub chemioterapii opartej na związkach platyny (300 chorych na uogólnionego NDRP) oraz KEYNOTE-042, mające podobne założenia jak poprzednie badania, ale przeprowadzane u chorych na NDRP w stadium IIIB lub IV z ekspresją PD-L1 na komórkach nowotworowych. Trwają także liczne badania nad możliwością zastosowania pembrolizumabu w innych nowotworach (np. KEYNOTE-012 u chorych na raka regionu głowy i szyi 21% obiektywnych odpowiedzi w wyniku leczenia pembrolizumabem) [31]. Badania przeciwciał anty-pd-l1 (najbardziej zaawansowane z cząsteczkami MEDI-4736 i MPDL3280A, tab. 3) prowadzono w grupach chorych na różne typy nowotworów, w tym NDRP, czerniaka, raka nerkowokomórkowego, raka jelita grubego i odbytnicy (MPDL3280A w skojarzeniu z bewacyzumabem, fluorouracylem i oksaliplatyną lub tylko z bewacyzumabem) [32]. Skuteczność obu substancji oceniano w zależności od ekspresji PD-L1 na komórkach nowotworowych; omówiono ją w części poświęconej czynnikom predykcyjnym (poniżej). Czynniki predykcyjne terapii przeciwciałami anty-pd-1 i anty-pd-l1 Najbardziej oczywistym czynnikiem predykcyjnym terapii przeciwciałami anty-pd-1 i anty-pd-l1 wydaje się ekspresja cząsteczki PD-L1 na powierzchni komórek nowotworowych. Należy jednak pamiętać, 83
9 Onkologia w Praktyce Klinicznej 2015, tom 11, nr 2 że PD-L1 występuje też na komórkach prezentujących antygen, które regulują odpowiedź immunologiczną ze strony limfocytów T efektorowych w węzłach chłonnych. Ponadto regulacja funkcji limfocytów T efektorowych przez APC zależy od kooperacji wielu różnych cząsteczek (np. CD28 i CTLA-4). Dlatego też wydaje się bardzo trudne wyselekcjonowanie jednego czynnika predykcyjnego, którego badanie mogłoby kwalifikować do leczenia anty-pd-1 lub anty-pd-l1. Białko PD-L1 występuje na komórkach większości typów nowotworów. Ansen i wsp. [33] oszacowali, że 32% raków gruczołowych i 30,5% raków płaskonabłonkowych płuca wykazuje ekspresję białka PD-L1, a Daud i wsp. [27] oszacowali, że 71% czerniaków wykazuje ekspresję PD-L1. Natomiast w przypadku nowotworów nerki, tylko 20% wykazuje ekspresję cząsteczki PD-L1. Ekspresja PD-L1 jest oceniana za pomocą barwienia immunohistochemicznego (IHC) z wykorzystaniem różnych klonów przeciwciał oraz protokołów barwienia, zarówno w systemie detekcji manualnym, jak i automatycznym. Ponadto ekspresję oceniano w podścielisku lub na powierzchni komórek nowotworowych. Ekspresję określano także w zależności od siły reakcji IHC (intensywność wybarwienia w 4-stopniowej skali: 0, 1+, 2+, 3+) lub też ze względu na odsetek komórek wykazujących ekspresję PD-L1 (za zmiany PD-L1 pozytywne uznawano te, w których ekspresję wykazywało 1%, 5%, 10% lub 50% komórek nowotworowych) [27, 33]. Obserwowano znaczne różnice w odsetkach odpowiedzi na leczenie przeciwciałami anty-pd-1 lub anty-pd-l1 między grupami pacjentów różniących się ekspresją PD-L1. U chorych na czerniaka oceniono retrospektywnie wpływ ekspresji PD-L1 na możliwość uzyskania odpowiedzi na leczenie niwolumabem i pembrolizumabem. W badaniu I fazy niwolumab wywoływał odpowiedź na terapię u 66% chorych PD-L1-pozytywnych (co najmniej 5% komórek z ekspresją PD-L1) i u 33% chorych niewykazujących ekspresji PD-L1 [28]. W badaniu KEYNOTE-001 pembrolizumab powodował odpowiedź u 49% chorych z ekspresją PD-L1 (1% komórek pozytywnych) i u 13% chorych bez ekspresji. Występowanie ekspresji PD-L1 było korzystnym czynnikiem predykcyjnym dla wydłużenia czasu wolnego od progresji, ale nie wpływało na całkowity czas życia pacjentów. Ze względu na niejednoznaczny wpływ ekspresji PD-L1 na skuteczność leczenia anty-pd-1, w większości trwających obecnie badań u chorych na czerniaka ekspresja PD-L1 nie jest czynnikiem kwalifikującym do terapii [27, 28]. Ze względu na bardzo wysoki odsetek chorych na czerniaka wykazujących ekspresję PD-L1 (wielu pacjentów odnosi korzyść z immunoterapii niezależnie od ekspresji PD-L1), najwięcej uwagi temu czynnikowi predykcyjnemu poświęcono w planowaniu immunoterapii u chorych na NDRP, którzy znacznie rzadziej charakteryzowali się ekspresją PD-L1. Zaobserwowano duże różnice w odsetkach odpowiedzi na leczenie niwolumabem u chorych na NDRP z ekspresją PD-L1 lub bez niej. Należy zauważyć, że osoby bez ekspresji PD- -L1 (z wyjątkiem bardzo małej grupy chorych leczonych niwolumabem w I linii) odnosili podobną korzyść z terapii niwolumabem jak pacjenci z ekspresją tego markera (tab. 4). Dawka pembrolizumabu u chorych na NDRP leczonych w II linii immunoterapią w badaniu KEYNOTE-001 została dostosowana do ekspresji białka PD-L1. Chorzy PD-L1-pozytywni otrzymywali pembrolizumab w dawce 10 mg/kg mc. w odstępach 2- lub 3-tygodniowych, natomiast chorzy PD-L1-negatywni przyjmowali 10 mg/kg mc. co 2 tygodnie. Odsetek odpowiedzi był nieznacznie wyższy w grupie chorych PD-L1-pozytywnych niż PD-L1-negatywnych, ale korzyść z zastosowanej terapii stwierdzono w obu grupach (tab. 4) [29 31]. W niektórych badaniach stosuje się skale stratyfikujące intensywność wybarwienia receptora PD-L1 na powierzchni komórek NDRP [34, 35]. Różnice w odpowiedzi na leczenie inhibitorem MPDL3280A zaobserwowano w grupie chorych PD-L1-pozytywnych w zależności od intensywności wybarwienia tkanek. Najwyższy całkowity odsetek odpowiedzi (83%) stwierdzono u pacjentów z silną ekspresją PD-L1 (IHC 3+), natomiast u wszystkich osób PD-L1-pozytywnych (IHC 1+/2+/3+) odsetek wynosił 31%. Odpowiedź na leczenie obserwowano również u pacjentów bez cech ekspresji PD-L1. Wydaje się, że u chorych na NDRP ekspresja PD-L1 będzie ważnym czynnikiem kwalifikującym do terapii przeciwciałami anty-pd-1 w I linii terapii oraz w przypadku osób leczonych przeciwciałami anty- -PD-L1 niezależnie od linii terapii. Natomiast w II i kolejnych liniach leczenia przeciwciałami anty-pd-1 ten czynnik predykcyjny będzie miał mniejsze znaczenie. Jednak do rutynowego zastosowania w diagnostyce NDRP jest wymagana standaryzacja metod diagnostycznych. W polskich warunkach dużym problemem może być dostęp do materiału tkankowego o odpowiedniej jakości. U wielu chorych z zaawansowanym nowotworem dostępny jest tylko materiał cytologiczny archiwizowany w postaci cytobloków lub na szkiełkach mikroskopowych, który nie nadaje się do diagnostyki ekspresji PD-L1. Materiał tkankowy musi zostać odpowiednio utrwalony i zarchiwizowany, a ponadto często są nim pobrane podczas bronchoskopii drobne wycinki z niską zawartością komórek nowotworowych. Ze względu na trudności diagnostyczne ekspresji PD-L1 poszukuje się innych klinicznych czynników predykcyjnych dla leków anty-pd-1 lub anty-pd- -L1 u chorych na NDRP. Odsetek odpowiedzi na terapię niwolumabem i pembrolizumabem jest podobny u mężczyzn i kobiet, nie zależy od wieku, ale jest nieznacznie wyższy u chorych na raka płaskonabłonkowego płuca 84
10 Paweł Krawczyk, Kamila Wojas-Krawczyk, Przeciwciała monoklonalne przeciw immunologicznym punktom kontroli w leczeniu chorych na nowotwory Tabela 4. Odpowiedź na leczenie przeciwciałami anty-pd-1 i anty-pd-l1 u chorych na niedrobnokomórkowego raka płuca w zależności od ekspresji białka PD-L1 [28 38] Lek Niwolumab Pembrolizumab MPDL3280A MEDI4736 Sposób Błonowe (na komórkach Błonowe i podścieliskowe W komórkach infiltrujących Bd wybarwienia nowotworowych) tkankę nowotworową Rodzaj materiału tkankowego Tkanki archiwalne Tkanki archiwalne i tkanki świeżo pobrane Tkanki archiwalne i świeżo pobrane Tkanki archiwalne i świeżo pobrane Linia leczenia I II i powyżej I II i powyżej I II i powyżej II i powyżej Skala odcięcia Bd (% komórek) Liczba chorych PD-L1(+) Odpowiedź 50% 13% 15% 36% 23% 37% 31% 46% 83% 39% PD-L1(+) Liczba chorych PD-L1( ) Odpowiedź 0% 17% 14% 13% 11% 20% 18% 18% 5% PD-L1( ) Bd brak danych niż u chorych na raka gruczołowego płuca. W badaniu KEYNOTE-001 wykazano, że odsetki odpowiedzi na leczenie pembrolizumabem były wyższe u osób palących tytoń (27% wobec 9% u osób niepalących) oraz u chorych na raka płaskonabłonkowego (32% wobec 16% u chorych na raka niepłaskonabłonkowego). Odsetek odpowiedzi na terapię MPDL3280A u chorych na raka niepłaskonabłonkowego wynosił 21%, a u chorych na raka płaskonabłonkowego osiągnął 27%. Ponadto wyższy odsetek odpowiedzi na leczenie tym przeciwciałem zanotowano u osób palących tytoń lub byłych palaczy (26%) w porównaniu z pacjentami, którzy nigdy nie palili (10%). Wpływ obecności mutacji w genach EGFR i KRAS na skuteczność MPDL3290A nie został udowodniony. Wśród pacjentów bez mutacji w genach EGFR lub KRAS odsetek odpowiedzi stwierdzono, odpowiednio, u 23% i 30% chorych, a w grupie osób z mutacją EGFR lub KRAS u 17% i 10% chorych. Reasumując, żaden z wymienionych czynników klinicznych i molekularnych nie może być w tej chwili brany pod uwagę w kwalifikacji do terapii przeciwciałami anty-pd-1 i anty-pdl-1 [34 36]. Przyszłość immunoterapii chorych na nowotwory Nie ma wątpliwości, że chemioterapia w leczeniu chorych na większość zaawansowanych nowotworów osiągnęła lub zbliża się do pułapu swoich możliwości. Odkrycia mutacji kierujących oraz immunologicznych punktów kontroli spowodowały szybki rozwój metod leczenia ukierunkowanego molekularnie i immunoterapii, które zastępują chemioterapię u niektórych chorych i w niektórych liniach leczenia. Wiele wspomnianych metod terapii jest warunkowo rejestrowana do rutynowego stosowania na podstawie spektakularnych wyników wczesnych badań klinicznych (I lub II fazy). Immunoterapia chorób nowotworowych, zwłaszcza ukierunkowana na immunologiczne punkty kontroli, charakteryzuje się odmienną od chemioterapii toksycznością i zdolnością do wywoływania w niektórych przypadkach długotrwałej kontroli choroby. Odpowiedź na immunoterapię nie jest równie spektakularna, w porównaniu z metodami ukierunkowanymi molekularnie, ale długość jej trwania jest często wielokrotnie większa. Niestety, nie opracowano dotychczas diagnostycznych czynników predykcyjnych dla immunoterapii, które precyzyjnie pozwoliłyby kwalifikować chorych do tego rodzaju leczenia, tak jak ma to miejsce w przypadku terapii ukierunkowanych molekularnie. Piśmiennictwo 1. Wysocki P. Mechanizmy działania przeciwciał monoklonalnych w nowotworach litych. Onkol. Prakt. Klin. 2014; 10: Weiner G.J. Monoclonal antibodies mechanism of action in cancer. Immunol. Res. 2007; 39: Food and Drug Administration; dostęp on-line: 10 marca Clinical trial; dostep on-line: 11 marca Callahan M.K., Postow M.A., Wolchok J.D. CTLA-4 and PD-1 pathway blockade: combinations in the clinic. Front. Oncol. 2015; 15: Postow M.A., Callahan M.K., Wolchok J.D. Immune checkpoint blockade in cancer therapy. J. Clin. Oncol. 2015; 20:
11 Onkologia w Praktyce Klinicznej 2015, tom 11, nr 2 7. Hofmeyer K.A., Ray A., Zang X. The contrasting role of B7-H3. PNAS 2008; 105: Drew M.P. The blockade of immune checkpoints in cancer immunotherapy. Nat. Rev. Cancer. 2012; 12: Dequen P., Lorigan P., Jansen J.P., van Baardewijk M., Ouwens M.J., Kotapati S. Systematic review and network meta-analysis of overall survival comparing 3 mg/kg ipilimumab with alternative therapies in the management of pretreated patients with unresectable stage III or IV melanoma. Oncologist 2012; 17: Graziani G., Tentori L., Navarra P. Ipilimumab: a novel immunostimulatory monoclonal antibody for the treatment of cancer. Pharmacol. Res. 2012; 65: Harmankaya K., Erasim C., Koelblinger C. i wsp. Continuous systemic corticosteroids do not affect the ongoing regression of metastatic melanoma for more than two years following ipilimumab therapy. Med. Oncol. 2011; 28: Schadendorf D., Hodi F.S., Robert C. i wsp. Pooled analysis of long-term survival data from phase II and phase III trials of ipilimumab in metastatic or locally advanced, unresectable melanoma. ECCO-ESMO-ESTRO 2013; abstract 24LBA. 13. Hodi F.S., O Day S.J., McDermott D.F. i wsp. Improved survival with ipilimumab in patients with metastatic melanoma. N. Engl. J. Med. 2010; 10: Eggermont A.M., Chiarion-Sileni V., Grob J.J. i wsp. Ipilimumab versus placebo after complete resection of stage III melanoma: initial efficacy and safety results from the EORTC phase III trial. ASCO Annual Meeting. LBA Lynch T.J., Bondarenko I., Luft A. i wsp. Ipilimumab in combination with paclitaxel and carboplatin as first-line treatment in stage IIIB/IV non-small-cell lung cancer: results from a randomized, double-blind, multicenter phase II study. J. Clin. Oncol. 2012; 30: Tomasini P., Khobta N., Greillier L., Barlesi F. Ipilimumab: its potential in non-small cell lung cancer. Ther. Adv. Med. Oncol. 2012; 4: Wolchok J.D., Hoos A., O Day S. i wsp. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. Clin. Cancer. Res. 2009; 15: Topalian S.L., Drake C.G., Pardoll D.M. Targeting the PD-1/B7-H1(PD-L1) pathway to activate anti-tumor immunity. Curr. Opin. Immunol. 2012; 24: Aris M., Barrio M.M. Combining immunotherapy with oncogene-targeted therapy: a new road for melanoma treatment. Front. Immunol. 2015; 9: Johnson D.B., Peng C., Sosman J.A. Nivolumab in melanoma: latest evidence and clinical potential. Ther. Adv. Med. Oncol. 2015; 7: Luke J.J., Ott P.A. PD-1 pathway inhibitors: the next generation of immunotherapy for advanced melanoma. Oncotarget. 2015; 6: Langer C.J. Emerging immunotherapies in the treatment of non-small cell lung cancer (NSCLC): the role of immune checkpoint inhibitors. Am. J. Clin. Oncol. 2014; 28: Sundar R., Cho B.C., Brahmer J.R., Soo R.A. Nivolumab in NSCLC: latest evidence and clinical potential. Ther. Adv. Med. Oncol. 2015; 7: Escudier B. Emerging immunotherapies for renal cell carcinoma. Ann. Oncol. 2012; 23: Suppl Motzer R.J., Bono P., Hudes G.R. i wsp. A phase 3 comparative study of nivolumab (anti-pd-1, BMS , ONO-4538) versus everolimus in patients with advanced or metastatic renal cell carcinoma (mrcc) previously treated with anti-angiogenic therapy. J. Clin. Oncol. 2013; 31 (Suppl.): TPS Poole R.M. Pembrolizumab: first global approval. Drugs 2014; 74: Daud A.I, Hamid O., Ribas A. i wsp. Antitumor activity of the anti-pd-1 monoclonal antibody MK-3475 in melanoma (MEL): correlation of tumor PD-L1 expression with outcome. AACR 2014; abstract CT Kefford R., Ribas A., Hamid O. i wsp. Clinical efficacy and correlation with tumor PD-L1 expression in patients (pts) with melanoma (MEL) treated with the anti-pd-1 monoclonal antibody MK J. Clin. Oncol. 2014; 32 (Suppl. 5); abstract Garon E.B., Gandhi L., Rizvi N. i wsp. Antitumor activity of pembrolizumab (Pembro, MK-3475) and correlation with programmed death ligand 1 (PD-L1) expression in a pooled analysis of patients with advanced non-small cell lung carcinoma (NSCLC). Ann. Oncol. 2014; 25 (Suppl. 5): abstract LBA Garon E.B., Leighl N.B., Rizvi N.S. i wsp. Safety and clinical activity of MK-3475 in previously treated patients (pts) with non-small cell lung cancer (NSCLC). J. Clin. Oncol. 2014; 32 (Suppl. 5): abstract Gandhi L., Balmanoukian A., Hui R. i wsp. MK-3475 (anti-pd-1 monoclonal antibody) for non-small cell lung cancer (NSCLC): antitumor activity and association with tumor PD-L1 expression. AACR Annual Meeting 2014; abstract CT Brahmer J.R., Horn L., Antonia S.J. i wsp. Nivolumab (anti-pd-1; BMS ; ONO-4538) in patients with non-small cell lung cancer (NSCLC): overall survival and long-term safety in a phase 1 trial. IASLC 15th WCLC 2013; abstract MO Ansen S., Schultheis A.M., Hellmich M. i wsp. PD-L1 expression and genotype in non-small cell lung cancer (NSCLC). J. Clin. Oncol. 2014; 32 (Suppl. 5): abstract Rizvi N.A., Chow L.Q.M., Dirix L.Y. i wsp. Clinical trials of MPDL3280A (anti-pdl1) in patients (pts) with non-small cell lung cancer (NSCLC). J. Clin. Oncol. 2014; 32 (Suppl. 5): abstract TPS Horn L., Herbst R.S., Spiegel D. i wsp. An analysis of the relationship of clinical activity to baseline EGFR status, PD-L1 expression and prior treatment history in patients with non-small cell lung cancer (NSCLC) following PD-L1 blockade with MPDL3280A (anti-pdl1). IASLC 14th WCLC 2011; abstract MO Spigel D.R., Gettinger S.N., Horn L. i wsp. Clinical activity, safety, and biomarkers of MPDL3280A, an engineered PD-L1 antibody in patients with locally advanced or metastatic non-small cell lung cancer (NSCLC). J. Clin. Oncol. 2013; 31 (Suppl.): abstract Antonia S.J., Grosso J.F., Horak C.E. i wsp. Association of tumor PD- -L1 expression and immune biomarkers with clinical activity in patients with non-small cell lung cancer (NSCLC) treated with nivolumab (ANTI-PD-1; BMS ; ONO-4538). IASLC 15th WCLC 2013; P Brahmer J.R, Rizvi N.A., Lutzky J. i wsp. Clinical activity and biomarkers of MEDI4736, an anti-pd-l1 antibody, in patients with NSCLC. J. Clin. Oncol. 2014; 32 (Suppl. 5): abstract
Immunoterapia niedrobnokomórkowego raka płuca. dr n. med. Adam Płużański. Klinika Nowotworów Płuca i Klatki Piersiowej
 Immunoterapia niedrobnokomórkowego raka płuca dr n. med. Adam Płużański Klinika Nowotworów Płuca i Klatki Piersiowej Centrum Onkologii-Instytut im.m Skłodowskiej-Curie w Warszawie Historia prób immunoterapii
Immunoterapia niedrobnokomórkowego raka płuca dr n. med. Adam Płużański Klinika Nowotworów Płuca i Klatki Piersiowej Centrum Onkologii-Instytut im.m Skłodowskiej-Curie w Warszawie Historia prób immunoterapii
Keytruda (pembrolizumab)
 EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
Immunoterapia raka płuca
 Immunoterapia raka płuca Nowa perspektywa leczenia? Dr n. med. Adam Płużański Klinika Nowotworów Płuca i Klatki Piersiowej Centrum Onkologii-Instytut im. M. Skłodowskiej-Curie w Warszawie Medycyna XXI
Immunoterapia raka płuca Nowa perspektywa leczenia? Dr n. med. Adam Płużański Klinika Nowotworów Płuca i Klatki Piersiowej Centrum Onkologii-Instytut im. M. Skłodowskiej-Curie w Warszawie Medycyna XXI
Piotr Potemski. Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi
 Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Obserwowane są samoistne regresje zmian przerzutowych
Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Obserwowane są samoistne regresje zmian przerzutowych
Nowotwór złośliwy oskrzela i płuca
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy oskrzela i płuca Bevacizumab Bewacyzumab w skojarzeniu z chemioterapią opartą na pochodnych platyny jest wskazany w leczeniu pierwszego
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy oskrzela i płuca Bevacizumab Bewacyzumab w skojarzeniu z chemioterapią opartą na pochodnych platyny jest wskazany w leczeniu pierwszego
Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/489091/2018 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest
EMA/489091/2018 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest
Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
Immunoonkologia a przełom w leczeniu raka płuca. (ze szczególnym uwzględnieniem NDRP)
 Immunoonkologia a przełom w leczeniu raka płuca (ze szczególnym uwzględnieniem NDRP) Prof. dr hab. n. med. Janusz Milanowski 1 Dr n. med. Izabela Chmielewska 1 1 Katedra i Klinika Pneumonologii, Onkologii
Immunoonkologia a przełom w leczeniu raka płuca (ze szczególnym uwzględnieniem NDRP) Prof. dr hab. n. med. Janusz Milanowski 1 Dr n. med. Izabela Chmielewska 1 1 Katedra i Klinika Pneumonologii, Onkologii
Rak płuca postępy 2014
 Rak płuca postępy 2014 Dr n. med. Adam Płużański Klinika Nowotworów Płuca i Klatki Piersiowej Centrum Onkologii-Instytut im. M. Skłodowskiej-Curie w Warszawie Onkologia 2014. Warszawa, 21/10/2014 r. Epidemiologia
Rak płuca postępy 2014 Dr n. med. Adam Płużański Klinika Nowotworów Płuca i Klatki Piersiowej Centrum Onkologii-Instytut im. M. Skłodowskiej-Curie w Warszawie Onkologia 2014. Warszawa, 21/10/2014 r. Epidemiologia
zaawansowanym rakiem nerkowokomórkowym, rodzajem raka nerki, u pacjentów, którzy byli wcześniej leczeni lekami przeciwnowotworowymi;
 EMA/303208/2017 EMEA/H/C/003985 Streszczenie EPAR dla ogółu społeczeństwa niwolumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
EMA/303208/2017 EMEA/H/C/003985 Streszczenie EPAR dla ogółu społeczeństwa niwolumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
Immunoterapia w raku płuca. Szpital Kliniczny Przemienienia Pańskiego UM w Poznaniu, Oddział Chemioterapii
 Immunoterapia w raku płuca dr n. med. Katarzyna Stencel 1, lek. Daria Świniuch 1, prof. dr hab.n.med. Rodryg Ramlau 2 1 Szpital Kliniczny Przemienienia Pańskiego UM w Poznaniu, Oddział Chemioterapii 2
Immunoterapia w raku płuca dr n. med. Katarzyna Stencel 1, lek. Daria Świniuch 1, prof. dr hab.n.med. Rodryg Ramlau 2 1 Szpital Kliniczny Przemienienia Pańskiego UM w Poznaniu, Oddział Chemioterapii 2
czerniak (nowotwór skóry), który rozprzestrzenił się lub którego nie można usunąć chirurgicznie;
 EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Rak płuca. Magdalena Knetki-Wróblewska Klinika Nowotworów Płuca i Klatki Piersiowej Centrum Onkologii-Instytut
 Rak płuca Magdalena Knetki-Wróblewska Klinika Nowotworów Płuca i Klatki Piersiowej Centrum Onkologii-Instytut Rak płuca 22 196 tys. nowych zachorowań 23 812 tys. zgonów www.onkologia.org.pl Diagnostyka
Rak płuca Magdalena Knetki-Wróblewska Klinika Nowotworów Płuca i Klatki Piersiowej Centrum Onkologii-Instytut Rak płuca 22 196 tys. nowych zachorowań 23 812 tys. zgonów www.onkologia.org.pl Diagnostyka
RAK PŁUCA 2016 ROK. Maciej Krzakowski
 RAK PŁUCA 2016 ROK Maciej Krzakowski MEDIANA CZASU PRZEŻYCIA CAŁKOWITEGO 12-24/ 12 2-4/ 12 Leczenie objawowe Chemioterapia 1-lekowa DDP Chemioterapia 2-lekowa DDP+VP16/VBL Chemioterapia 2-lekowa DDP+Leki
RAK PŁUCA 2016 ROK Maciej Krzakowski MEDIANA CZASU PRZEŻYCIA CAŁKOWITEGO 12-24/ 12 2-4/ 12 Leczenie objawowe Chemioterapia 1-lekowa DDP Chemioterapia 2-lekowa DDP+VP16/VBL Chemioterapia 2-lekowa DDP+Leki
Immunoterapia chłoniaka Hodgkina Wieslaw Wiktor Jędrzejczak
 Immunoterapia chłoniaka Hodgkina Wieslaw Wiktor Jędrzejczak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawskiego Uniwersytetu Medycznego Discovery of dendritic cell History of Cancer
Immunoterapia chłoniaka Hodgkina Wieslaw Wiktor Jędrzejczak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawskiego Uniwersytetu Medycznego Discovery of dendritic cell History of Cancer
Immunoterapia skojarzona
 Immunoterapia skojarzona Paweł Krawczyk Pracownia Immunologii i Genetyki Katedra i Klinika Pneumonologii, Onkologii i Alergologii Uniwersytet Medyczny w Lublinie Koncepcja łączenia immunoterapii z innymi
Immunoterapia skojarzona Paweł Krawczyk Pracownia Immunologii i Genetyki Katedra i Klinika Pneumonologii, Onkologii i Alergologii Uniwersytet Medyczny w Lublinie Koncepcja łączenia immunoterapii z innymi
U kogo działa immunoterapia? Jak kwalifikować do leczenia? Paweł Krawczyk
 U kogo działa immunoterapia? Jak kwalifikować do leczenia? Paweł Krawczyk Pracownia Immunologii i Genetyki Katedra i Klinika Pneumonologii, Onkologii i Alergologii Uniwersytet Medyczny w Lublinie Sposób
U kogo działa immunoterapia? Jak kwalifikować do leczenia? Paweł Krawczyk Pracownia Immunologii i Genetyki Katedra i Klinika Pneumonologii, Onkologii i Alergologii Uniwersytet Medyczny w Lublinie Sposób
Wydłużenie życia chorych z rakiem płuca - nowe możliwości
 Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego. Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa
 Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa RAK TRZUSTKI U 50% chorych w momencie rozpoznania stwierdza się
Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa RAK TRZUSTKI U 50% chorych w momencie rozpoznania stwierdza się
Nowotwór złośliwy piersi
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy piersi Lapatinib Refundacja z ograniczeniami Lapatinib jest wskazany do leczenia dorosłych pacjentów z rakiem piersi, u których nowotwór
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy piersi Lapatinib Refundacja z ograniczeniami Lapatinib jest wskazany do leczenia dorosłych pacjentów z rakiem piersi, u których nowotwór
Rak piersi. Doniesienia roku Renata Duchnowska Klinika Onkologii Wojskowy Instytut Medyczny w Warszawie
 Rak piersi Doniesienia roku 2014 Renata Duchnowska Klinika Onkologii Wojskowy Instytut Medyczny w Warszawie Miejscowe leczenie Skrócone napromienianie części piersi (accelerated partial breast irradiation;
Rak piersi Doniesienia roku 2014 Renata Duchnowska Klinika Onkologii Wojskowy Instytut Medyczny w Warszawie Miejscowe leczenie Skrócone napromienianie części piersi (accelerated partial breast irradiation;
Wyniki leczenia pembrolizumabem chorych na przerzutowego czerniaka po niepowodzeniu wcześniejszej terapii doświadczenia dwóch ośrodków
 PRACA ORYGINALNA Paweł Rogala 1, Joanna Stępniak 1, Tomasz Świtaj 1, Ewa Kalinka-Warzocha 2, Katarzyna Kozak 1, Hanna Koseła-Paterczyk 1, Piotr Rutkowski 1 1 Klinika Nowotworów Tkanek Miękkich, Kości i
PRACA ORYGINALNA Paweł Rogala 1, Joanna Stępniak 1, Tomasz Świtaj 1, Ewa Kalinka-Warzocha 2, Katarzyna Kozak 1, Hanna Koseła-Paterczyk 1, Piotr Rutkowski 1 1 Klinika Nowotworów Tkanek Miękkich, Kości i
Piotr Potemski. Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi
 Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Lepiej skazać stu niewinnych ludzi, niż jednego
Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Lepiej skazać stu niewinnych ludzi, niż jednego
Piotr Potemski. Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi
 Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Konferencje naukowe a praktyka kliniczna Podstawowe
Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Konferencje naukowe a praktyka kliniczna Podstawowe
Rak płuca. Dr n. med. Adam Płużański Klinika Nowotworów Płuca i Klatki Piersiowej Centrum Onkologii-Instytut im. M. Skłodowskiej-Curie w Warszawie
 Rak płuca Dr n. med. Adam Płużański Klinika Nowotworów Płuca i Klatki Piersiowej Centrum Onkologii-Instytut im. M. Skłodowskiej-Curie w Warszawie Warszawa, 6/10/2015 r. Epidemiologia Na świecie- 1,6 mln
Rak płuca Dr n. med. Adam Płużański Klinika Nowotworów Płuca i Klatki Piersiowej Centrum Onkologii-Instytut im. M. Skłodowskiej-Curie w Warszawie Warszawa, 6/10/2015 r. Epidemiologia Na świecie- 1,6 mln
Odpowiedź na leczenie ipilimumabem u pacjentki z rozpoznaniem uogólnionego czerniaka
 OPIS PRZYPADKU Anika Pękala, Małgorzata Ułańska, Maria Błasińska-Morawiec Oddział Chorób Rozrostowych, Wojewódzki Szpital Specjalistyczny im. M. Kopernika w Łodzi Odpowiedź na leczenie ipilimumabem u pacjentki
OPIS PRZYPADKU Anika Pękala, Małgorzata Ułańska, Maria Błasińska-Morawiec Oddział Chorób Rozrostowych, Wojewódzki Szpital Specjalistyczny im. M. Kopernika w Łodzi Odpowiedź na leczenie ipilimumabem u pacjentki
Komunikat prasowy. Dodatkowe informacje
 Dane na temat czasu przeżycia całkowitego uzyskane w badaniu LUX-Lung 7 bezpośrednio porównującym leki afatynib i gefitynib, przedstawione na ESMO 2016 W badaniu LUX-Lung 7 zaobserwowano mniejsze ryzyko
Dane na temat czasu przeżycia całkowitego uzyskane w badaniu LUX-Lung 7 bezpośrednio porównującym leki afatynib i gefitynib, przedstawione na ESMO 2016 W badaniu LUX-Lung 7 zaobserwowano mniejsze ryzyko
Promotor: prof. dr hab. Katarzyna Bogunia-Kubik Promotor pomocniczy: dr inż. Agnieszka Chrobak
 INSTYTUT IMMUNOLOGII I TERAPII DOŚWIADCZALNEJ IM. LUDWIKA HIRSZFELDA WE WROCŁAWIU POLSKA AKADEMIA NAUK mgr Milena Iwaszko Rola polimorfizmu receptorów z rodziny CD94/NKG2 oraz cząsteczki HLA-E w patogenezie
INSTYTUT IMMUNOLOGII I TERAPII DOŚWIADCZALNEJ IM. LUDWIKA HIRSZFELDA WE WROCŁAWIU POLSKA AKADEMIA NAUK mgr Milena Iwaszko Rola polimorfizmu receptorów z rodziny CD94/NKG2 oraz cząsteczki HLA-E w patogenezie
Stanowisko Rady Przejrzystości nr 262/2013 z dnia 17 grudnia 2013 r. w sprawie oceny leku Perjeta (pertuzumab) we wskazaniu zaawansowanego raka piersi
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 262/2013 z dnia 17 grudnia 2013 r. w sprawie oceny leku Perjeta (pertuzumab) we wskazaniu zaawansowanego raka
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 262/2013 z dnia 17 grudnia 2013 r. w sprawie oceny leku Perjeta (pertuzumab) we wskazaniu zaawansowanego raka
Terapie dla kobiet z zaawansowanym rakiem piersi w Polsce
 Warszawa, 27.01.2016 Seminarium naukowe: Terapie przełomowe w onkologii i hematoonkologii a dostępność do leczenia w Polsce na tle Europy Terapie dla kobiet z zaawansowanym rakiem piersi w Polsce Dr n.
Warszawa, 27.01.2016 Seminarium naukowe: Terapie przełomowe w onkologii i hematoonkologii a dostępność do leczenia w Polsce na tle Europy Terapie dla kobiet z zaawansowanym rakiem piersi w Polsce Dr n.
LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20)
 Dziennik Urzędowy Ministra Zdrowia 511 Poz. 42 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie zaawansowanego
Dziennik Urzędowy Ministra Zdrowia 511 Poz. 42 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie zaawansowanego
Kobimetynib w leczeniu czerniaka z obecnością mutacji BRAF w świetle zmian w programie lekowym
 Kobimetynib w leczeniu czerniaka z obecnością mutacji BRAF w świetle zmian w programie lekowym Piotr Rutkowski Kobimetynib był drugim selektywnym inhibitorem MEK (po trametynibie) zarejestrowanym do leczenia
Kobimetynib w leczeniu czerniaka z obecnością mutacji BRAF w świetle zmian w programie lekowym Piotr Rutkowski Kobimetynib był drugim selektywnym inhibitorem MEK (po trametynibie) zarejestrowanym do leczenia
Immuno-Onkologia 2013 implikacje kliniczne Sympozjum European Society of Medical Oncology
 SPRAWOZDANIA Magdalena Zaborowska-Szmit Klinika Nowotworów Płuca i Klatki Piersiowej, Centrum Onkologii Instytut im. Marii Skłodowskiej-Curie w Warszawie Immuno-Onkologia 2013 implikacje kliniczne Sympozjum
SPRAWOZDANIA Magdalena Zaborowska-Szmit Klinika Nowotworów Płuca i Klatki Piersiowej, Centrum Onkologii Instytut im. Marii Skłodowskiej-Curie w Warszawie Immuno-Onkologia 2013 implikacje kliniczne Sympozjum
Jerzy Błaszczyk. Zachorowania na nowotwory złośliwe we Wrocławiu w latach 1984-2013 30 lat obserwacji epidemii
 Jerzy Błaszczyk Zachorowania na nowotwory złośliwe we Wrocławiu w latach 1984-213 lat obserwacji epidemii Dane w opracowaniu pochodzą z Dolnośląskiego Rejestru Nowotworów. Oparte są na Karcie Zgłoszenia
Jerzy Błaszczyk Zachorowania na nowotwory złośliwe we Wrocławiu w latach 1984-213 lat obserwacji epidemii Dane w opracowaniu pochodzą z Dolnośląskiego Rejestru Nowotworów. Oparte są na Karcie Zgłoszenia
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Pemetrexed Zentiva, przygotowane do publicznej wiadomości
 VI.2 VI.2.1 Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Pemetrexed Zentiva, przygotowane do publicznej wiadomości Omówienie rozpowszechnienia choroby Produkt leczniczy Pemetrexed Zentiva
VI.2 VI.2.1 Podsumowanie planu zarządzania ryzykiem dla produktu leczniczego Pemetrexed Zentiva, przygotowane do publicznej wiadomości Omówienie rozpowszechnienia choroby Produkt leczniczy Pemetrexed Zentiva
Czerniaki. Czerniak, (łac. melanoma malignum) nowotwór złośliwy skóry, błon śluzowych lub błony naczyniowej oka wywodzący się z melanocytów.
 Czerniaki Czerniaki Czerniak, (łac. melanoma malignum) nowotwór złośliwy skóry, błon śluzowych lub błony naczyniowej oka wywodzący się z melanocytów. Zachorowania na czerniaki skóry Liczba zachorowań na
Czerniaki Czerniaki Czerniak, (łac. melanoma malignum) nowotwór złośliwy skóry, błon śluzowych lub błony naczyniowej oka wywodzący się z melanocytów. Zachorowania na czerniaki skóry Liczba zachorowań na
Profilaktyka i leczenie czerniaka. Dr n. med. Jacek Calik
 Profilaktyka i leczenie czerniaka Dr n. med. Jacek Calik Czerniaki Czerniaki są grupą nowotworów o bardzo zróżnicowanej biologii, przebiegu i rokowaniu. Nowotwory wywodzące się z melanocytów. Pochodzenie
Profilaktyka i leczenie czerniaka Dr n. med. Jacek Calik Czerniaki Czerniaki są grupą nowotworów o bardzo zróżnicowanej biologii, przebiegu i rokowaniu. Nowotwory wywodzące się z melanocytów. Pochodzenie
Immunoterapia w praktyce rak nerki
 Immunoterapia w praktyce rak nerki VII Letnia Akademia Onkologiczna dla Dziennikarzy Warszawa 09 sierpień 2018 Piotr Tomczak Uniwersytet Medyczny Poznań Katedra i Klinika Onkologii Leczenie mrcc - zalecenia
Immunoterapia w praktyce rak nerki VII Letnia Akademia Onkologiczna dla Dziennikarzy Warszawa 09 sierpień 2018 Piotr Tomczak Uniwersytet Medyczny Poznań Katedra i Klinika Onkologii Leczenie mrcc - zalecenia
dr n. med. Paweł Nurzyński, prof. dr hab. n. med. Andrzej Deptała Klinika Onkologii i Hematologii, Centralny Szpital Kliniczny MSW w Warszawie
 Ewerolimus w codziennej praktyce klinicznej. Omówienie niemieckiego nieinterwencyjnego badania ewerolimusu w terapii przerzutowego raka nerki po niepowodzeniu leczenia inhibitorami kinaz tyrozynowych Everolimus
Ewerolimus w codziennej praktyce klinicznej. Omówienie niemieckiego nieinterwencyjnego badania ewerolimusu w terapii przerzutowego raka nerki po niepowodzeniu leczenia inhibitorami kinaz tyrozynowych Everolimus
Katalog ryczałtów za diagnostykę w programach lekowych
 Katalog ryczałtów za diagnostykę w programach lekowych Lp. Kod Nazwa świadczenia Ryczałt roczny (punkty) Uwagi 1 2 3 4 5 1 5.08.08.0000001 Diagnostyka w programie leczenia przewlekłego WZW typu B lamiwudyną
Katalog ryczałtów za diagnostykę w programach lekowych Lp. Kod Nazwa świadczenia Ryczałt roczny (punkty) Uwagi 1 2 3 4 5 1 5.08.08.0000001 Diagnostyka w programie leczenia przewlekłego WZW typu B lamiwudyną
Załącznik do rozporządzenia Ministra Zdrowia z dnia 28 października 2011 r.
 Załącznik do rozporządzenia Ministra Zdrowia z dnia 28 października 2011 r. ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu substancji czynnej pemetreksed:
Załącznik do rozporządzenia Ministra Zdrowia z dnia 28 października 2011 r. ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu substancji czynnej pemetreksed:
Katalog ryczałtów za diagnostykę w programach lekowych
 Katalog ryczałtów za diagnostykę w programach lekowych Lp. Kod Nazwa świadczenia Ryczałt roczny (punkty) Uwagi 1 2 3 4 5 1 5.08.08.0000001 Diagnostyka w programie leczenia przewlekłego WZW typu B lamiwudyną
Katalog ryczałtów za diagnostykę w programach lekowych Lp. Kod Nazwa świadczenia Ryczałt roczny (punkty) Uwagi 1 2 3 4 5 1 5.08.08.0000001 Diagnostyka w programie leczenia przewlekłego WZW typu B lamiwudyną
Bariery w dostępie do terapii refundowanych w Polsce na przykładzie raka płuca
 Bariery w dostępie do terapii refundowanych w Polsce na przykładzie raka płuca Prof. dr hab. Joanna Chorostowska-Wynimko Zakład Genetyki i Immunologii Klinicznej Mężczyźni 2013 Zachorowania Zgony Umieralność
Bariery w dostępie do terapii refundowanych w Polsce na przykładzie raka płuca Prof. dr hab. Joanna Chorostowska-Wynimko Zakład Genetyki i Immunologii Klinicznej Mężczyźni 2013 Zachorowania Zgony Umieralność
zaawansowany rak nerki lub rak nerki z przerzutami, w skojarzeniu z interferonem alfa-2a;
 EMA/302947/2017 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/302947/2017 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Terapeutyczne Programy Zdrowotne 2009 Leczenie nowotworów podścieliska przewodu pokarmowego (GIST) Załącznik nr 9
 Załącznik nr 9 Nazwa programu: do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Załącznik nr 9 Nazwa programu: do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20)
 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY 1. Leczenie zaawansowanego raka jelita grubego przy wykorzystaniu substancji
Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY 1. Leczenie zaawansowanego raka jelita grubego przy wykorzystaniu substancji
Znaczenie PFS oraz OS w analizach klinicznych w onkologii
 Znaczenie PFS oraz OS w analizach klinicznych w onkologii experience makes the difference Magdalena Władysiuk, lek. med., MBA Cel terapii w onkologii/hematologii Kontrola rozwoju choroby Kontrola objawów
Znaczenie PFS oraz OS w analizach klinicznych w onkologii experience makes the difference Magdalena Władysiuk, lek. med., MBA Cel terapii w onkologii/hematologii Kontrola rozwoju choroby Kontrola objawów
Rak Płuca. Leczenie Systemowe
 Rak Płuca Leczenie Systemowe Dariusz M. Kowalski Klinika Nowotworów Płuca i Klatki Piersiowej, Centrum Onkologii-Instytut, Warszawa Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa 09.08. 2018 Prezentacja
Rak Płuca Leczenie Systemowe Dariusz M. Kowalski Klinika Nowotworów Płuca i Klatki Piersiowej, Centrum Onkologii-Instytut, Warszawa Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa 09.08. 2018 Prezentacja
Terapeutyczne Programy Zdrowotne 2012 Leczenie nowotworów podścieliska przewodu pokarmowego (GIST) Załącznik nr 8
 Załącznik nr 8 Nazwa programu: do Zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Załącznik nr 8 Nazwa programu: do Zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne raka gruczołowego
Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne raka gruczołowego
S T R E S Z C Z E N I E
 STRESZCZENIE Cel pracy: Celem pracy jest ocena wyników leczenia napromienianiem chorych z rozpoznaniem raka szyjki macicy w Świętokrzyskim Centrum Onkologii, porównanie wyników leczenia chorych napromienianych
STRESZCZENIE Cel pracy: Celem pracy jest ocena wyników leczenia napromienianiem chorych z rozpoznaniem raka szyjki macicy w Świętokrzyskim Centrum Onkologii, porównanie wyników leczenia chorych napromienianych
Personalizacja leczenia w hematoonkologii dziecięcej
 MedTrends 2016 Europejskie Forum Nowoczesnej Ochrony Zdrowia Zabrze, 18-19 marca 2016 r. Personalizacja leczenia w hematoonkologii dziecięcej Prof. dr hab. n. med. Tomasz Szczepański Katedra i Klinika
MedTrends 2016 Europejskie Forum Nowoczesnej Ochrony Zdrowia Zabrze, 18-19 marca 2016 r. Personalizacja leczenia w hematoonkologii dziecięcej Prof. dr hab. n. med. Tomasz Szczepański Katedra i Klinika
OPIS PRZYPADKU. Małgorzata Wachowiak. Wstęp A37
 OPIS PRZYPDKU Małgorzata Wachowiak Kliniczny Oddział Onkologii, Szpital Uniwersytecki im. Karola Marcinkowskiego w Zielonej Górze Przypadek pacjentki z czerniakiem w stadium choroby uogólnionej leczonej
OPIS PRZYPDKU Małgorzata Wachowiak Kliniczny Oddział Onkologii, Szpital Uniwersytecki im. Karola Marcinkowskiego w Zielonej Górze Przypadek pacjentki z czerniakiem w stadium choroby uogólnionej leczonej
Limfocyty powstają w szpiku kostnym, czyli tam gdzie powstają wszystkie komórki krwi. Występują
 Poniższa informacja dotyczy chłoniaka węzłowego B-komórkowego strefy brzeżnej, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który
Poniższa informacja dotyczy chłoniaka węzłowego B-komórkowego strefy brzeżnej, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który
Data rozpoczęcia badania klinicznego i przewidywan y czas jego trwania. Przewidywana liczba uczestników badania klinicznego i kryteria ich rekrutacji
 Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 8 grudnia 2011 r.
 Dziennik Ustaw Nr 269 15678 Poz. 1593 1593 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 8 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na podstawie
Dziennik Ustaw Nr 269 15678 Poz. 1593 1593 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 8 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na podstawie
Azilect fakty Czym jest Azilect? Jak działa Azilect? Kto może skorzystać na leczeniu Azilectem?
 Azilect fakty Czym jest Azilect? Azilect (rasagilina 1mg) jest pierwszym, prawdziwie innowacyjnym lekiem stosowanym w chorobie Parkinsona (PD Parkinson s Disease) wprowadzonym w ostatnich latach. Jest
Azilect fakty Czym jest Azilect? Azilect (rasagilina 1mg) jest pierwszym, prawdziwie innowacyjnym lekiem stosowanym w chorobie Parkinsona (PD Parkinson s Disease) wprowadzonym w ostatnich latach. Jest
Przeciwciała o działaniu immunomodulacyjnym w terapii nowotworów
 Artykuł przeglądowy Review article NOWOTWORY Journal of Oncology 2015, volume 65, number 1, 42 47 DO: 10.5603/NJO.2015.0005 Polskie Towarzystwo Onkologiczne SSN 0029 540X www.nowotwory.viamedica.pl Przeciwciała
Artykuł przeglądowy Review article NOWOTWORY Journal of Oncology 2015, volume 65, number 1, 42 47 DO: 10.5603/NJO.2015.0005 Polskie Towarzystwo Onkologiczne SSN 0029 540X www.nowotwory.viamedica.pl Przeciwciała
Nowe możliwości leczenia ostrej białaczki limfoblastycznej
 Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
prof. Joanna Chorostowska-Wynimko Zakład Genetyki i Immunologii Klinicznej Instytut Gruźlicy i Chorób Płuc w Warszawie
 prof. Joanna Chorostowska-Wynimko Zakład Genetyki i Immunologii Klinicznej Instytut Gruźlicy i Chorób Płuc w Warszawie Sekwencyjność występowania zaburzeń molekularnych w niedrobnokomórkowym raku płuca
prof. Joanna Chorostowska-Wynimko Zakład Genetyki i Immunologii Klinicznej Instytut Gruźlicy i Chorób Płuc w Warszawie Sekwencyjność występowania zaburzeń molekularnych w niedrobnokomórkowym raku płuca
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 825 Poz. 71 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 825 Poz. 71 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Nowotwory głowy i szyi obecne możliwości leczenia oraz immunoterapia
 Nowotwory głowy i szyi obecne możliwości leczenia oraz immunoterapia Bartosz Spławski Klinika Nowotworów Głowy i Szyi Centrum Onkologii Instytut im. Marii Skłodowskiej Curie w Warszawie Kilka słów wstępu
Nowotwory głowy i szyi obecne możliwości leczenia oraz immunoterapia Bartosz Spławski Klinika Nowotworów Głowy i Szyi Centrum Onkologii Instytut im. Marii Skłodowskiej Curie w Warszawie Kilka słów wstępu
Streszczenie wykładu: KONTROLA FUNKCJI REGULATOROWYCH KOMÓREK TREGS FOXP3+ JAKO CEL TERAPII PRZECIWNOWOTWOROWEJ
 Dr Roman Krzysiek, MD, PhD. Streszczenie wykładu: KONTROLA FUNKCJI REGULATOROWYCH KOMÓREK TREGS FOXP3+ JAKO CEL TERAPII PRZECIWNOWOTWOROWEJ Immunoterapia to strategia leczenia przeciwnowotworowego polegająca
Dr Roman Krzysiek, MD, PhD. Streszczenie wykładu: KONTROLA FUNKCJI REGULATOROWYCH KOMÓREK TREGS FOXP3+ JAKO CEL TERAPII PRZECIWNOWOTWOROWEJ Immunoterapia to strategia leczenia przeciwnowotworowego polegająca
Czy immunoterapia nowotworów ma racjonalne podłoże? Maciej Siedlar
 Czy immunoterapia nowotworów ma racjonalne podłoże? Maciej Siedlar Zakład Immunologii Klinicznej Katedra Immunologii Klinicznej i Transplantologii Uniwersytet Jagielloński Collegium Medicum, oraz Uniwersytecki
Czy immunoterapia nowotworów ma racjonalne podłoże? Maciej Siedlar Zakład Immunologii Klinicznej Katedra Immunologii Klinicznej i Transplantologii Uniwersytet Jagielloński Collegium Medicum, oraz Uniwersytecki
Dr hab. n. med. Paweł Blecharz
 BRCA1 zależny rak piersi i jajnika odmienności diagnostyczne i kliniczne (BRCA1 dependent breast and ovarian cancer clinical and diagnostic diversities) Paweł Blecharz Dr hab. n. med. Paweł Blecharz Dr
BRCA1 zależny rak piersi i jajnika odmienności diagnostyczne i kliniczne (BRCA1 dependent breast and ovarian cancer clinical and diagnostic diversities) Paweł Blecharz Dr hab. n. med. Paweł Blecharz Dr
RAK NERKOWO-KOMÓRKOWY UOGÓLNIONE STADIUM PRZEWLEKŁA CHOROBA // DŁUGOŚĆ LECZENIA
 RAK NERKOWO-KOMÓRKOWY PRZEWLEKŁA CHOROBA // DŁUGOŚĆ LECZENIA Maciej Krzakowski Centrum Onkologii-Instytut im. Marii Skłodowskiej-Curie Warszawa 1 SYGNAŁOWE SZLAKI // TERAPEUTYCZNE CELE * Oudard i wsp.
RAK NERKOWO-KOMÓRKOWY PRZEWLEKŁA CHOROBA // DŁUGOŚĆ LECZENIA Maciej Krzakowski Centrum Onkologii-Instytut im. Marii Skłodowskiej-Curie Warszawa 1 SYGNAŁOWE SZLAKI // TERAPEUTYCZNE CELE * Oudard i wsp.
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 731 Poz. 48 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 731 Poz. 48 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Leczenie skojarzone w onkologii. Joanna Streb, Oddział Kliniczny Onkologii Szpitala Uniwersyteckiego
 Leczenie skojarzone w onkologii Joanna Streb, Oddział Kliniczny Onkologii Szpitala Uniwersyteckiego Zastosowanie leczenia skojarzonego w onkologii Chemioradioterapia sekwencyjna lub jednoczasowa: Nowotwory
Leczenie skojarzone w onkologii Joanna Streb, Oddział Kliniczny Onkologii Szpitala Uniwersyteckiego Zastosowanie leczenia skojarzonego w onkologii Chemioradioterapia sekwencyjna lub jednoczasowa: Nowotwory
Data zakończenia badania klinicznego
 Lp. Numer protokołu badania Nazwa sponsora/cro Skład zespołu badawczego Data rozpoczęcia badania klinicznego w ośrodku Data zakończenia badania klinicznego 1 2 3 6 6 12 1. NR001-03 Faza III rejestracyjna
Lp. Numer protokołu badania Nazwa sponsora/cro Skład zespołu badawczego Data rozpoczęcia badania klinicznego w ośrodku Data zakończenia badania klinicznego 1 2 3 6 6 12 1. NR001-03 Faza III rejestracyjna
Lek Avastin stosuje się u osób dorosłych w leczeniu następujących rodzajów nowotworów w skojarzeniu z innymi lekami przeciwnowotworowymi:
 EMA/175824/2015 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/175824/2015 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Data zakończenia badania klinicznego
 Lp. Numer protokołu badania Nazwa sponsora/cro Skład zespołu badawczego Data rozpoczęcia badania klinicznego w ośrodku Data zakończenia badania klinicznego 1 2 3 6 6 12 1. EMRII200037-014 Otwarte, randomizowane,
Lp. Numer protokołu badania Nazwa sponsora/cro Skład zespołu badawczego Data rozpoczęcia badania klinicznego w ośrodku Data zakończenia badania klinicznego 1 2 3 6 6 12 1. EMRII200037-014 Otwarte, randomizowane,
c) poprawa jakości życia chorych z nieziarniczym chłoniakiem typu grudkowego w III i IV stopniu
 Nazwa programu: Terapeutyczne Programy Zdrowotne 2012 Załącznik nr 9 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011r. LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
Nazwa programu: Terapeutyczne Programy Zdrowotne 2012 Załącznik nr 9 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011r. LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU I NINTEDANIBU (ICD- 10 C 34)
 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU I NINTEDANIBU (ICD- 10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne
Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU I NINTEDANIBU (ICD- 10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne
Warszawa, 31.10.2007r.
 Warszawa, 31.10.2007r. Lek Taxotere otrzymuje pozytywną opinię Komitetu ds. Produktów Leczniczych stosowanych u Ludzi (CHMP), zalecającą rejestrację w Unii Europejskiej do leczenia indukcyjnego miejscowo
Warszawa, 31.10.2007r. Lek Taxotere otrzymuje pozytywną opinię Komitetu ds. Produktów Leczniczych stosowanych u Ludzi (CHMP), zalecającą rejestrację w Unii Europejskiej do leczenia indukcyjnego miejscowo
Ocena czynników rokowniczych w raku płaskonabłonkowym przełyku w materiale Kliniki Chirurgii Onkologicznej AM w Gdańsku doniesienie wstępne
 Ocena czynników rokowniczych w raku płaskonabłonkowym przełyku w materiale Kliniki Chirurgii Onkologicznej AM w Gdańsku doniesienie wstępne Świerblewski M. 1, Kopacz A. 1, Jastrzębski T. 1 1 Katedra i
Ocena czynników rokowniczych w raku płaskonabłonkowym przełyku w materiale Kliniki Chirurgii Onkologicznej AM w Gdańsku doniesienie wstępne Świerblewski M. 1, Kopacz A. 1, Jastrzębski T. 1 1 Katedra i
Katarzyna Pogoda Warszawa, 23 marca 2017 roku
 Chemioterapia doustna i podskórne metody podawania leków w raku piersi. Lepsza jakość życia pacjentek Katarzyna Pogoda Warszawa, 23 marca 2017 roku Rak piersi - heterogenna choroba Stopień zaawansowania
Chemioterapia doustna i podskórne metody podawania leków w raku piersi. Lepsza jakość życia pacjentek Katarzyna Pogoda Warszawa, 23 marca 2017 roku Rak piersi - heterogenna choroba Stopień zaawansowania
Data rozpoczęcia badania klinicznego i przewidywan y czas jego trwania. Przewidywana liczba uczestników badania klinicznego i kryteria ich rekrutacji
 Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
Spis treści. Przedmowa Barbara Czerska... 11 Autorzy... 17 Wykaz skrótów... 19
 Przedmowa Barbara Czerska.................................. 11 Autorzy.................................................... 17 Wykaz skrótów.............................................. 19 Rozdział I.
Przedmowa Barbara Czerska.................................. 11 Autorzy.................................................... 17 Wykaz skrótów.............................................. 19 Rozdział I.
Potrójnie ujemne postaci raki piersi, co o nich już wiemy? Katarzyna Pogoda
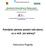 Potrójnie ujemne postaci raki piersi, co o nich już wiemy? Katarzyna Pogoda Biologiczne podtypy raka piersi Przebieg choroby TNBC Biologiczny podtyp o większym ryzyku nawrotu choroby. Rozsiew następuje
Potrójnie ujemne postaci raki piersi, co o nich już wiemy? Katarzyna Pogoda Biologiczne podtypy raka piersi Przebieg choroby TNBC Biologiczny podtyp o większym ryzyku nawrotu choroby. Rozsiew następuje
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
POSTĘPY W LECZENIU PBL
 POSTĘPY W LECZENIU PBL Klinika Chorób Wewnętrznych i Hematologii Wojskowy Instytut Medyczny Prof. dr hab. med. Piotr Rzepecki Terapia przełomowa Pojęcie terapii przełomowych w hematoonkologii zostało wprowadzone
POSTĘPY W LECZENIU PBL Klinika Chorób Wewnętrznych i Hematologii Wojskowy Instytut Medyczny Prof. dr hab. med. Piotr Rzepecki Terapia przełomowa Pojęcie terapii przełomowych w hematoonkologii zostało wprowadzone
Jarosław B. Ćwikła. Wydział Nauk Medycznych Uniwersytet Warmińsko-Mazurski w Olsztynie
 Nowe algorytmy oceny odpowiedzi na leczenie w badaniach strukturalnych, dużo dalej niż klasyczne kryteria RECIST Jarosław B. Ćwikła Wydział Nauk Medycznych Uniwersytet Warmińsko-Mazurski w Olsztynie Radiologiczna
Nowe algorytmy oceny odpowiedzi na leczenie w badaniach strukturalnych, dużo dalej niż klasyczne kryteria RECIST Jarosław B. Ćwikła Wydział Nauk Medycznych Uniwersytet Warmińsko-Mazurski w Olsztynie Radiologiczna
Radioterapia w leczeniu raka pęcherza moczowego - zalecenia
 Radioterapia w leczeniu raka pęcherza moczowego - zalecenia Radioterapia w leczeniu raka pęcherza moczowego może być stosowana łącznie z leczeniem operacyjnym chemioterapią. Na podstawie literatury anglojęzycznej
Radioterapia w leczeniu raka pęcherza moczowego - zalecenia Radioterapia w leczeniu raka pęcherza moczowego może być stosowana łącznie z leczeniem operacyjnym chemioterapią. Na podstawie literatury anglojęzycznej
Wybór najistotniejszych publikacji z roku 2013 Lancet (IF-39)/Lancet Oncology (IF-25)/ Oncologist
 Wybór najistotniejszych publikacji z roku 2013 Lancet (IF-39)/Lancet Oncology (IF-25)/ Oncologist (IF-4) Dr n. med. Lubomir Bodnar Klinika Onkologii, Wojskowego Instytutu Medycznego w Warszawie Warszawa
Wybór najistotniejszych publikacji z roku 2013 Lancet (IF-39)/Lancet Oncology (IF-25)/ Oncologist (IF-4) Dr n. med. Lubomir Bodnar Klinika Onkologii, Wojskowego Instytutu Medycznego w Warszawie Warszawa
Paweł Krawczyk. Finansowanie diagnostyki molekularnej w programach lekowych w Polsce problemy i możliwe rozwiązania
 Finansowanie diagnostyki molekularnej w programach lekowych w Polsce problemy i możliwe rozwiązania Paweł Krawczyk Katedra i Klinika Pneumonologii, Onkologii i Alergologii Pracownia Immunologii i Genetyki
Finansowanie diagnostyki molekularnej w programach lekowych w Polsce problemy i możliwe rozwiązania Paweł Krawczyk Katedra i Klinika Pneumonologii, Onkologii i Alergologii Pracownia Immunologii i Genetyki
Przegląd piśmiennictwa. Aleksandra Łacko Katedra Onkologii UM we Wrocławiu Oddział Chemioterapii USZK
 Przegląd piśmiennictwa Journalof ClinicalOncology Aleksandra Łacko Katedra Onkologii UM we Wrocławiu Oddział Chemioterapii USZK Największe doświadczenie jednego ośrodka z GTN wysokiego ryzyka Retrospektywna
Przegląd piśmiennictwa Journalof ClinicalOncology Aleksandra Łacko Katedra Onkologii UM we Wrocławiu Oddział Chemioterapii USZK Największe doświadczenie jednego ośrodka z GTN wysokiego ryzyka Retrospektywna
NOWE ZWIĄZKI PRZECIWNOWOTWOROWE Z GRUPY INHIBITORÓW KINAZY TYROZYNOWEJ EGFR STOSOWANE W TERAPII CELOWANEJ. Joanna Rozegnał
 NOWE ZWIĄZKI PRZECIWNOWOTWOROWE Z GRUPY INHIBITORÓW KINAZY TYROZYNOWEJ EGFR STOSOWANE W TERAPII CELOWANEJ Joanna Rozegnał TERAPIA CELOWANA: Jedna z najbardziej nowoczesnych metod leczenia nowotworów Skierowana
NOWE ZWIĄZKI PRZECIWNOWOTWOROWE Z GRUPY INHIBITORÓW KINAZY TYROZYNOWEJ EGFR STOSOWANE W TERAPII CELOWANEJ Joanna Rozegnał TERAPIA CELOWANA: Jedna z najbardziej nowoczesnych metod leczenia nowotworów Skierowana
Materiał i metody. Wyniki
 Abstract in Polish Wprowadzenie Selen jest pierwiastkiem śladowym niezbędnym do prawidłowego funkcjonowania organizmu. Selen jest wbudowywany do białek w postaci selenocysteiny tworząc selenobiałka (selenoproteiny).
Abstract in Polish Wprowadzenie Selen jest pierwiastkiem śladowym niezbędnym do prawidłowego funkcjonowania organizmu. Selen jest wbudowywany do białek w postaci selenocysteiny tworząc selenobiałka (selenoproteiny).
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikowania chorych na niedrobnokomórkowego raka płuca do leczenia
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikowania chorych na niedrobnokomórkowego raka płuca do leczenia
Przegląd publikacji z roku 2013 Cancer New England Journal of Medicine Annals of Oncology
 Przegląd publikacji z roku 2013 Cancer New England Journal of Medicine Annals of Oncology Renata Zaucha HOT TOPICS 2014 w Onkologii Ginekologicznej Warszawa Wybrane publikacje 1 Annals of Oncology 2013;
Przegląd publikacji z roku 2013 Cancer New England Journal of Medicine Annals of Oncology Renata Zaucha HOT TOPICS 2014 w Onkologii Ginekologicznej Warszawa Wybrane publikacje 1 Annals of Oncology 2013;
Płynna biopsja Liquid biopsy. Rafał Dziadziuszko Klinika Onkologii i Radioterapii Gdański Uniwersytet Medyczny
 Płynna biopsja Liquid biopsy Rafał Dziadziuszko Klinika Onkologii i Radioterapii Gdański Uniwersytet Medyczny Podstawowe pojęcia Biopsja uzyskanie materiału tkankowego lub komórkowego z guza celem ustalenia
Płynna biopsja Liquid biopsy Rafał Dziadziuszko Klinika Onkologii i Radioterapii Gdański Uniwersytet Medyczny Podstawowe pojęcia Biopsja uzyskanie materiału tkankowego lub komórkowego z guza celem ustalenia
Leczenie interferujące z receptorem czynnika wzrostu naskórka (EGFR) u chorych na raka jelita grubego
 PRACA PRZEGLĄDOWA Marek Z. Wojtukiewicz 1, 2, Piotr Tokajuk 1, 2, Ewa Sierko 1, 2 1 Klinika Onkologii Uniwersytetu Medycznego w Białymstoku 2 Białostockie Centrum Onkologii Leczenie interferujące z receptorem
PRACA PRZEGLĄDOWA Marek Z. Wojtukiewicz 1, 2, Piotr Tokajuk 1, 2, Ewa Sierko 1, 2 1 Klinika Onkologii Uniwersytetu Medycznego w Białymstoku 2 Białostockie Centrum Onkologii Leczenie interferujące z receptorem
Preparat Taxotere (docetaxel) we wlewie dopuszczony w Japonii do stosowania w leczeniu raka prostaty
 Informacja prasowa Warszawa, 15 września 2008r. Preparat Taxotere (docetaxel) we wlewie dopuszczony w Japonii do stosowania w leczeniu raka prostaty Taxotere dopuszczony w Japonii do stosowania w leczeniu
Informacja prasowa Warszawa, 15 września 2008r. Preparat Taxotere (docetaxel) we wlewie dopuszczony w Japonii do stosowania w leczeniu raka prostaty Taxotere dopuszczony w Japonii do stosowania w leczeniu
Odmienności podejścia terapeutycznego w rzadszych podtypach raka jajnika
 Odmienności podejścia terapeutycznego w rzadszych podtypach raka jajnika Rak jajnika: nowe wyzwania diagnostyczno - terapeutyczne Warszawa, 15-16.05.2015 Dagmara Klasa-Mazurkiewicz Gdański Uniwersytet
Odmienności podejścia terapeutycznego w rzadszych podtypach raka jajnika Rak jajnika: nowe wyzwania diagnostyczno - terapeutyczne Warszawa, 15-16.05.2015 Dagmara Klasa-Mazurkiewicz Gdański Uniwersytet
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikowania chorych na niedrobnokomórkowego raka płuca do leczenia
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikowania chorych na niedrobnokomórkowego raka płuca do leczenia
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Czym jest medycyna personalizowana w kontekście wyzwań nowoczesnej onkologii?
 Czym jest medycyna personalizowana w kontekście wyzwań nowoczesnej onkologii? Wykorzystanie nowych technik molekularnych w badaniach nad genetycznymi i epigenetycznymi mechanizmami transformacji nowotworowej
Czym jest medycyna personalizowana w kontekście wyzwań nowoczesnej onkologii? Wykorzystanie nowych technik molekularnych w badaniach nad genetycznymi i epigenetycznymi mechanizmami transformacji nowotworowej
Załącznik do OPZ nr 8
 Załącznik do OPZ nr 8 Lista raportów predefiniowanych Lp. Tytuł raportu Potencjalny użytkownik raportu 1. Lista chorych na raka stercza w zależności od poziomu antygenu PSA (w momencie stwierdzenia choroby)
Załącznik do OPZ nr 8 Lista raportów predefiniowanych Lp. Tytuł raportu Potencjalny użytkownik raportu 1. Lista chorych na raka stercza w zależności od poziomu antygenu PSA (w momencie stwierdzenia choroby)
