Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
|
|
|
- Ryszard Romanowski
- 6 lat temu
- Przeglądów:
Transkrypt
1 EMA/55246/2019 EMEA/H/C/ Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem przeciwnowotworowym stosowanym w leczeniu osób dorosłych z: czerniakiem, rodzajem raka skóry. Opdivo stosuje się w monoterapii lub w skojarzeniu z innym lekiem przeciwnowotworowym o nazwie ipilimumab do leczenia osób dorosłych, u których rak rozprzestrzenił się na inne części ciała lub którego nie można usunąć chirurgicznie. Lek stosuje się również w monoterapii u pacjentów, u których przeprowadzono operację chirurgicznego usunięcia czerniaka, który rozprzestrzenił się na węzły chłonne lub na inne części ciała; rakiem płuca zwanym niedrobnokomórkowym rakiem płuca (NDRP), który rozprzestrzenił się miejscowo lub na inne części ciała. Opdivo stosuje się w monoterapii u pacjentów, którzy wcześniej byli leczeni innymi lekami przeciwnowotworowymi (chemioterapia); zaawansowanym rakiem nerkowokomórkowym, rakiem nerek. Opdivo stosuje się w monoterapii u pacjentów, którzy byli wcześniej leczeni innymi lekami przeciwnowotworowymi. Opdivo stosuje się w skojarzeniu z ipilimumabem (inny lek przeciwnowotworowy) u pacjentów z wcześniej nieleczoną chorobą, w przypadku której ryzyko nasilenia uważa się za umiarkowane lub wysokie; klasycznym chłoniakiem Hodgkina, rakiem limfocytów (rodzaj białych krwinek), jeżeli nie nastąpiła poprawa lub choroba nawróciła po przeprowadzeniu autologicznego przeszczepienia komórek macierzystych (zabieg zastąpienia szpiku kostnego pacjenta jego własnymi komórkami macierzystymi w celu odtworzenia szpiku, który będzie wytwarzał zdrowe komórki krwi). Opdivo stosuje się w monoterapii po leczeniu brentuksymabem z wedotyną (inny lek przeciwnowotworowy); płaskonabłonkowym rakiem głowy i szyi (ang. squamous cell cancer of the head and neck, SCCHN), który nawrócił lub rozprzestrzenił się na inne części organizmu. Lek Opdivo stosuje się w monoterapii u pacjentów, których rak postępuje pomimo terapii opartej na pochodnych platyny; rakiem urotelialnym, rakiem pęcherza i dróg moczowych, który rozprzestrzenił się miejscowo i którego nie można chirurgicznie usunąć lub który rozprzestrzenił się na inne części ciała. Lek stosuje się w monoterapii po niepowodzeniu wcześniejszej terapii opartej na pochodnych platyny. 30 Churchill Place Canary Wharf London E14 5EU United Kingdom Telephone +44 (0) Facsimile +44 (0) Send a question via our website An agency of the European Union European Medicines Agency, Reproduction is authorised provided the source is acknowledged.
2 Opdivo zawiera substancję czynną niwolumab. Jak stosować lek Opdivo Terapię lekiem Opdivo powinien rozpocząć i nadzorować lekarz mający doświadczenie w leczeniu raka. Lek wydawany na receptę. Opdivo podaje się w postaci wlewu dożylnego (kroplówki). Dawka leku oraz częstość podawania zależą od rodzaju schorzenia i od tego, czy lek jest podawany w monoterapii czy w skojarzeniu z ipilimumabem. Lekarz może opóźnić podawanie dawek w przypadku wystąpienia pewnych działań niepożądanych lub całkowicie zaprzestać leczenia, jeśli działania niepożądane są poważne. Więcej informacji o sposobie stosowania leku Opdivo znajduje się w ulotce dla pacjenta lub udzieli ich lekarz lub farmaceuta. Jak działa lek Opdivo Substancja czynna leku Opdivo, niwolumab, jest przeciwciałem monoklonalnym rodzajem białka, które zostało zaprojektowane w taki sposób, aby rozpoznawało receptor (cel) o nazwie PD-1 znajdujący się na określonych komórkach układu odpornościowego, limfocytach T, oraz przyłączało się do niego. Komórki nowotworowe mogą wytwarzać białka (PD-L1 i PD-L2), które przyłączają się do tego receptora i blokują aktywność komórek T, uniemożliwiając im atakowanie nowotworu. Niwolumab, przyłączając się do tego receptora, uniemożliwia białkom PD-L1 i PD-L2 blokowanie komórek T, zwiększając w ten sposób zdolność układu odpornościowego do zabijania komórek nowotworowych. Korzyści ze stosowania leku Opdivo wykazane w badaniach Czerniak Opdivo stosowany w monoterapii oceniano w dwóch badaniach głównych z udziałem osób dorosłych z zaawansowanym czerniakiem, u których nie przeprowadzono zabiegu chirurgicznego. W pierwszym badaniu z udziałem 418 wcześniej nieleczonych pacjentów z zaawansowanym czerniakiem stwierdzono, że czas przeżycia pacjentów leczonych z zastosowaniem Opdivo był dłuższy niż pacjentów, którzy otrzymywali lek przeciwnowotworowy dakarbazynę: po 12 miesiącach przy życiu pozostawało 73% pacjentów leczonych lekiem Opdivo, w porównaniu z 42% pacjentów, którym podawano dakarbazynę. W drugim badaniu uczestniczyło 405 pacjentów z zaawansowanym czerniakiem, u których objawy choroby nasiliły się pomimo wcześniejszego leczenia z zastosowaniem leku przeciwnowotworowego. W tym badaniu pacjenci byli kontrolowani przez co najmniej 6 miesięcy; u około 32% (38 ze 120) pacjentów przyjmujących lek Opdivo wystąpiła odpowiedź na leczenie i nastąpiło zmniejszenie guzów, w porównaniu z około 11% (5 z 47) pacjentów przyjmujących lek wybrany przez badaczy (dakarbazynę lub skojarzenie karboplatyny i paklitakselu). W trzecim badaniu z udziałem 906 osób dorosłych z czerniakiem, u których przeprowadzono zabieg chirurgiczny i u których ryzyko nawrotu raka było wysokie, lek Opdivo porównywano z ipilimumabem. W przypadku pacjentów leczonych lekiem Opdivo czas, jaki upłynął przed nawrotem raka, pojawieniem się nowego czerniaka lub śmiercią pacjenta, wynosił średnio 31 miesięcy, w porównaniu z 24 miesiącami w przypadku pacjentów leczonych ipilimumabem. W czwartym badaniu z udziałem 945 wcześniej nieleczonych dorosłych pacjentów z zaawansowanym czerniakiem oceniano lek Opdivo w skojarzeniu z ipilimumabem, lek Opdivo stosowany w monoterapii i ipilimumab stosowany w monoterapii. Pacjenci, którym podawano lek Opdivo w skojarzeniu z ipilimumabem, pozostawali przy życiu bez nasilenia się choroby przez kolejne 11,5 miesiąca, a pacjenci, którym podawano lek Opdivo w monoterapii przez 6,9 miesiąca. Pacjenci, którym EMA/55246/2019 Strona 2/5
3 podawano ipilimumab w monoterapii, przeżywali 2,9 miesiąca bez nasilenia się choroby. Po 2 latach przy życiu pozostawało więcej pacjentów, u których stosowano lek Opdivo w skojarzeniu z ipilimumabem (64%), niż pacjentów, u których stosowano lek Opdivo w monoterapii (59%) lub ipilimumab w monoterapii (45%). W badaniu uczestniczyli pacjenci, których komórki nowotworowe wytwarzały duże ilości PD-L1, oraz pacjenci, których komórki nowotworowe wytwarzały małe ilości PD- L1. Wydłużenie czasu przeżycia pacjentów bez nasilenia się choroby podczas leczenia lekiem Opdivo w skojarzeniu z ipilimumabem względem leczenia Opdivo w monoterapii zaobserwowano jedynie u pacjentów, których komórki nowotworowe wytwarzały małe ilości PD-L1. NDRP W przypadku niepłaskonabłonkowego NDRP w jednym badaniu głównym uczestniczyły 582 osoby dorosłe, u których doszło do nasilenia się choroby pomimo kilku wcześniejszych terapii. Średni czas przeżycia przy stosowaniu leku Opdivo wynosił około 12,2 miesiąca, w porównaniu z 9,4 przy leczeniu docetakselem. W przypadku płaskonabłonkowego NDRP w badaniu z udziałem 272 osób dorosłych wykazano, że czas przeżycia pacjentów przyjmujących lek Opdivo wynosił około 9,2 miesiąca, w porównaniu z 6,0 miesiąca u pacjentów przyjmujących docetaksel. Dodatkowe informacje uzyskano również z innego badania wskazującego, że Opdivo może wywołać odpowiedź na leczenie u pacjentów z płaskonabłonkowym NDRP, u których wystąpił postęp choroby pomimo kilku wcześniejszych terapii. Zaawansowany rak nerkowokomórkowy Opdivo porównywano z ewerolimusem (inny lek przeciwnowotworowy) w jednym badaniu głównym z udziałem 821 pacjentów z zaawansowanym rakiem nerkowokomórkowym, u których choroba nasiliła się pomimo wcześniejszego leczenia. Pacjenci, którym podawano lek Opdivo, przeżywali średnio 25,0 miesiąca, w porównaniu z 19,6 miesiąca w przypadku pacjentów przyjmujących ewerolimus. W jednym badaniu głównym z udziałem dorosłych pacjentów z wcześniej nieleczonym zaawansowanym rakiem nerkowokomórkowym porównywano leczenie lekiem Opdivo i ipilimumabem z leczeniem sunitynibem, innym lekiem przeciwnowotworowym stosowanym w leczeniu raka nerkowokomórkowego. Wyniki pokazały, że w przypadku pacjentów, u których występuje umiarkowane lub wysokie ryzyko szybkiego postępu raka, czas przeżycia u pacjentów otrzymujących leczenie skojarzone był ogólnie dłuższy niż u pacjentów otrzymujący sunitynib. Po 24 miesiącach przy życiu pozostawało 66,5% pacjentów przyjmujących leczenie skojarzone, w porównaniu z 52,9% w grupie przyjmującej sunitynib. Ponadto odpowiedź na leczenie wystąpiła u 41,6% pacjentów (177 z 423) otrzymujących leczenie skojarzone, w porównaniu z 26,5% pacjentów (112 z 416) otrzymujących sunitynib. Czas przeżycia bez nasilenia się choroby wyniósł 11,6 miesiąca u pacjentów otrzymujących leczenie skojarzone, w porównaniu z 8,4 miesiąca u pacjentów otrzymujących sunitynib. Klasyczny chłoniak Hodgkina Opdivo oceniano w jednym badaniu głównym i w badaniu dodatkowym z udziałem łącznie 95 osób dorosłych z klasycznym chłoniakiem Hodgkina, u których nie wystąpiła odpowiedź na leczenie lub choroba nawróciła po przeprowadzeniu autologicznego przeszczepienia komórek macierzystych i leczeniu brentuksymabem z wedotyną. Lek Opdivo stosowano w monoterapii i nie porównywano go z innymi lekami. Po leczeniu komórki nowotworowe zostały częściowo lub całkowicie usunięte u ok. 66% pacjentów (63 z 95). EMA/55246/2019 Strona 3/5
4 SCCHN Opdivo oceniano w jednym badaniu głównym z udziałem 361 osób dorosłych z SCCHN, u których objawy nowotworu nasiliły się pomimo terapii opartej na pochodnych platyny. Opdivo stosowano w monoterapii i porównywano z innym lekiem przeciwnowotworowym (cetuksymab, metotreksat lub docetaksel) wybranym przez lekarza prowadzącego. Pacjenci, którym podawano lek Opdivo, przeżywali średnio 7,5 miesiąca, w porównaniu z 5,1 miesiąca w przypadku pacjentów przyjmujących inne leki. Rak urotelialny Opdivo oceniano w jednym badaniu głównym z udziałem 270 osób dorosłych z rakiem urotelialnym, u których choroba nasiliła się lub nawróciła pomimo wcześniejszej terapii opartej na pochodnych platyny. Lek Opdivo stosowano w monoterapii i nie porównywano go z innymi lekami. W badaniu odpowiedź na leczenie wystąpiła u 20% pacjentów (54 z 270) i rozmiar nowotworu się zmniejszył. Ryzyko związane ze stosowaniem leku Opdivo Najczęstsze działania niepożądane związane ze stosowaniem leku Opdivo (mogące wystąpić u więcej niż 1 na 10 pacjentów) to: zmęczenie, biegunka, nudności (mdłości), wysypka i świąd, ból stawów, mięśni i kości oraz niedoczynność tarczycy; większość działań niepożądanych ma nasilenie łagodne do umiarkowanego. Inne częste działania niepożądane związane ze stosowaniem leku Opdivo w skojarzeniu z ipilimumabem, które również miały głównie nasilenie łagodne do umiarkowanego, obejmowały gorączkę, problemy z tarczycą, zmniejszenie łaknienia, wymioty, zapalenie jelita grubego, ból brzucha, ból głowy i trudności z oddychaniem. Stosowanie leku Opdivo często powoduje działania niepożądane związane z aktywnością układu odpornościowego w narządach organizmu. Większość z nich ustępuje w następstwie właściwego leczenia lub zaprzestania podawania leku Opdivo. Pełny wykaz działań niepożądanych i ograniczeń związanych ze stosowaniem leku Opdivo znajduje się w ulotce dla pacjenta. Podstawy dopuszczenia do obrotu leku Opdivo w UE Europejska Agencja Leków uznała, że przekonująco wykazano, iż lek Opdivo przynosi korzyści pacjentom z niektórymi zaawansowanymi nowotworami (czerniak, NDRP, rak nerkowokomórkowy lub SCCHN), albo wydłużając czas przeżycia pacjentów, albo wydłużając czas bez nasilenia choroby. W badaniu dotyczącym raka urotelialnego w przypadku niepowodzenia innych rodzajów leczenia pacjenci reagowali na terapię lekiem Opdivo. Badania dotyczące klasycznego chłoniaka Hodgkina obejmowały jedynie małą liczbę pacjentów. Odsetek odpowiedzi zaobserwowany u tych pacjentów, u których inne próby leczenia nie powiodły się i którzy mieli do dyspozycji niewiele innych opcji leczenia, był jednak wysoki. Korzyści ze stosowania leku Opdivo przewyższają działania niepożądane, które uznano za możliwe do kontrolowania przy zastosowaniu odpowiednich środków. W związku z tym Agencja uznała, że korzyści płynące ze stosowania leku Opdivo przewyższają ryzyko i może on być dopuszczony do stosowania w UE. EMA/55246/2019 Strona 4/5
5 Środki podejmowane w celu zapewnienia bezpiecznego i skutecznego stosowania leku Opdivo Firma, która wprowadza lek Opdivo do obrotu, dostarczy lekarzom, którzy będą przepisywać lek Opdivo, zestawy edukacyjne zawierające informacje dotyczące stosowania leku, kontrolowania działań niepożądanych, zwłaszcza związanych z funkcjonowaniem układu odpornościowego, oraz możliwego ryzyka u pacjentów z klasycznym chłoniakiem Hodgkina mających przejść allogeniczne przeszczepienie komórek macierzystych (transplantację komórek macierzystych od dawcy). Firma dostarczy także pacjentom kartę ostrzeżeń zawierającą informacje dotyczące ryzyka związanego z lekiem, jak również instrukcje dotyczące kontaktu z lekarzem w razie wystąpienia objawów. Firma dostarczy również dalsze dane dotyczące długoterminowych korzyści związanych ze stosowaniem leku Opdivo oraz przeprowadzi analizy, aby określić, którzy pacjenci mogą odnieść największe korzyści z leczenia z zastosowaniem tego leku. Ponieważ nie jest jasne, w jakim stopniu ipilimumab przyczynia się do korzyści uzyskanych przy podawaniu w skojarzeniu z Opdivo u pacjentów zaawansowanym rakiem nerkowokomórkowym, firma musi przeprowadzić badanie w celu określenia dokładnego wpływu ipilimumabu oraz możliwości zmniejszenia ryzyka związanego z jego stosowaniem. W celu zapewnienia bezpiecznego i skutecznego stosowania leku Opdivo w Charakterystyce Produktu Leczniczego i w Ulotce dla pacjenta zawarto również zalecenia i środki ostrożności przeznaczone dla personelu medycznego i pacjentów. Tak jak w przypadku wszystkich leków, dane o stosowaniu leku Opdivo są stale monitorowane. Zgłaszane działania niepożądane leku Opdivo są starannie oceniane i podejmowane są wszystkie czynności konieczne do ochrony pacjentów. Inne informacje dotyczące leku Opdivo Lek Opdivo otrzymał pozwolenie na dopuszczenie do obrotu, ważne w całej UE od dnia 19 czerwca 2015 r. Dalsze informacje na temat leku Opdivo znajdują się na stronie internetowej Agencji pod adresem: ema.europa.eu/medicines/human/epar/opdivo. Data ostatniej aktualizacji: EMA/55246/2019 Strona 5/5
Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/489091/2018 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest
EMA/489091/2018 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest
zaawansowanym rakiem nerkowokomórkowym, rodzajem raka nerki, u pacjentów, którzy byli wcześniej leczeni lekami przeciwnowotworowymi;
 EMA/303208/2017 EMEA/H/C/003985 Streszczenie EPAR dla ogółu społeczeństwa niwolumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
EMA/303208/2017 EMEA/H/C/003985 Streszczenie EPAR dla ogółu społeczeństwa niwolumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
Keytruda (pembrolizumab)
 EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
czerniak (nowotwór skóry), który rozprzestrzenił się lub którego nie można usunąć chirurgicznie;
 EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
zaawansowany rak nerki lub rak nerki z przerzutami, w skojarzeniu z interferonem alfa-2a;
 EMA/302947/2017 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/302947/2017 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Lek Avastin stosuje się u osób dorosłych w leczeniu następujących rodzajów nowotworów w skojarzeniu z innymi lekami przeciwnowotworowymi:
 EMA/175824/2015 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/175824/2015 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Simponi jest lekiem o działaniu przeciwzapalnym. Preparat stosuje się w leczeniu następujących chorób u osób dorosłych:
 EMA/411054/2015 EMEA/H/C/000992 Streszczenie EPAR dla ogółu społeczeństwa golimumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego produktu.
EMA/411054/2015 EMEA/H/C/000992 Streszczenie EPAR dla ogółu społeczeństwa golimumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego produktu.
W szpiczaku mnogim, nowotworze pewnego typu białych krwinek zwanych komórkami plazmatycznymi, Revlimid stosuje się:
 EMA/113870/2017 EMEA/H/C/000717 Streszczenie EPAR dla ogółu społeczeństwa lenalidomid Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/113870/2017 EMEA/H/C/000717 Streszczenie EPAR dla ogółu społeczeństwa lenalidomid Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Pradaxa jest lekiem zawierającym substancję czynną eteksylan dabigatranu. Lek jest dostępny w postaci kapsułek (75, 110 i 150 mg).
 EMA/47517/2015 EMEA/H/C/000829 Streszczenie EPAR dla ogółu społeczeństwa eteksylan dabigatranu Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego
EMA/47517/2015 EMEA/H/C/000829 Streszczenie EPAR dla ogółu społeczeństwa eteksylan dabigatranu Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego
ostrym reumatoidalnym zapaleniem stawów (choroba powodująca stan zapalny stawów), gdzie produkt MabThera podaje się dożylnie z metotreksatem;
 EMA/614203/2010 EMEA/H/C/000165 Streszczenie EPAR dla ogółu społeczeństwa rytuksymab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
EMA/614203/2010 EMEA/H/C/000165 Streszczenie EPAR dla ogółu społeczeństwa rytuksymab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
Materiały edukacyjne dla pracowników służby zdrowia i pacjentów stosujących lek przeciwcukrzycowy Suliqua
 19 stycznia 2017 r. EMA/747766/2016 Materiały edukacyjne dla pracowników służby zdrowia i pacjentów stosujących lek Środki mające na celu zmniejszenie ryzyka pomylenia dwóch wstrzykiwaczy o różnej mocy
19 stycznia 2017 r. EMA/747766/2016 Materiały edukacyjne dla pracowników służby zdrowia i pacjentów stosujących lek Środki mające na celu zmniejszenie ryzyka pomylenia dwóch wstrzykiwaczy o różnej mocy
Revolade. eltrombopag. Co to jest Revolade? W jakim celu stosuje się produkt Revolade? Streszczenie EPAR dla ogółu społeczeństwa
 EMA/33466/2016 EMEA/H/C/001110 Streszczenie EPAR dla ogółu społeczeństwa eltrombopag Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
EMA/33466/2016 EMEA/H/C/001110 Streszczenie EPAR dla ogółu społeczeństwa eltrombopag Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13- walentna, adsorbowana)
 EMA/90006/2015 EMEA/H/C/001104 Streszczenie EPAR dla ogółu społeczeństwa szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13- walentna, adsorbowana) Niniejszy dokument jest streszczeniem
EMA/90006/2015 EMEA/H/C/001104 Streszczenie EPAR dla ogółu społeczeństwa szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13- walentna, adsorbowana) Niniejszy dokument jest streszczeniem
Przegląd wiedzy na temat leku Eylea i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/481361/2018 EMEA/H/C/002392 Przegląd wiedzy na temat leku Eylea i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Eylea i w jakim celu się go stosuje Eylea jest lekiem
EMA/481361/2018 EMEA/H/C/002392 Przegląd wiedzy na temat leku Eylea i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Eylea i w jakim celu się go stosuje Eylea jest lekiem
Nowotwór złośliwy oskrzela i płuca
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy oskrzela i płuca Bevacizumab Bewacyzumab w skojarzeniu z chemioterapią opartą na pochodnych platyny jest wskazany w leczeniu pierwszego
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy oskrzela i płuca Bevacizumab Bewacyzumab w skojarzeniu z chemioterapią opartą na pochodnych platyny jest wskazany w leczeniu pierwszego
Zalecenia PRAC dotyczące przesłanek do aktualizacji informacji o produkcie
 22 stycznia 2015 r. EMA/PRAC/63315/2015 Komitet ds. Oceny Ryzyka w ramach Nadzoru nad Bezpieczeństwem Farmakoterapii Zalecenia PRAC dotyczące przesłanek do aktualizacji informacji o produkcie Przyjęte
22 stycznia 2015 r. EMA/PRAC/63315/2015 Komitet ds. Oceny Ryzyka w ramach Nadzoru nad Bezpieczeństwem Farmakoterapii Zalecenia PRAC dotyczące przesłanek do aktualizacji informacji o produkcie Przyjęte
EMA potwierdza zalecenia mające na celu jak największe ograniczenie ryzyka wystąpienia zakażenia mózgu PML w trakcie stosowania leku Tysabri
 25/04/2016 EMA/266665/2016 EMA potwierdza zalecenia mające na celu jak największe ograniczenie ryzyka wystąpienia zakażenia mózgu PML w trakcie stosowania leku Tysabri U pacjentów z grupy zwiększonego
25/04/2016 EMA/266665/2016 EMA potwierdza zalecenia mające na celu jak największe ograniczenie ryzyka wystąpienia zakażenia mózgu PML w trakcie stosowania leku Tysabri U pacjentów z grupy zwiększonego
Ograniczenia stosowania leków zawierających domperidon
 1 września 2014 r. EMA/465179/2014 W dniu 23 kwietnia 2014 r. grupa koordynacyjna ds. procedur wzajemnego uznania i zdecentralizowanej produkty stosowane u ludzi (CMDh) zatwierdziła nowe zalecenia o ograniczeniu
1 września 2014 r. EMA/465179/2014 W dniu 23 kwietnia 2014 r. grupa koordynacyjna ds. procedur wzajemnego uznania i zdecentralizowanej produkty stosowane u ludzi (CMDh) zatwierdziła nowe zalecenia o ograniczeniu
Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń
 15 September 2016 EMA/PRAC/603539/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
15 September 2016 EMA/PRAC/603539/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń
 17 December 2015 EMA/PRAC/835763/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęto w dniach od 30 listopada
17 December 2015 EMA/PRAC/835763/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęto w dniach od 30 listopada
Rysunek. Układ limfatyczny.
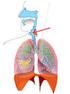 Informacja dotyczy rodzaju chłoniaka nieziarniczego zwanego chłoniakiem z małych limfocytów B. Warto również przeczytać informacje na temat przewlekłej białaczki limfocytowej (CLL), która jest podobnym
Informacja dotyczy rodzaju chłoniaka nieziarniczego zwanego chłoniakiem z małych limfocytów B. Warto również przeczytać informacje na temat przewlekłej białaczki limfocytowej (CLL), która jest podobnym
Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń
 25 January 2018 EMA/PRAC/35597/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
25 January 2018 EMA/PRAC/35597/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
zaburzeniem widzenia spowodowanym obrzękiem plamki wywołanym cukrzycą;
 EMA/677928/2015 EMEA/H/C/002392 Streszczenie EPAR dla ogółu społeczeństwa aflibercept Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/677928/2015 EMEA/H/C/002392 Streszczenie EPAR dla ogółu społeczeństwa aflibercept Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń
 10 November 2016 EMA/PRAC/730052/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
10 November 2016 EMA/PRAC/730052/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
Zalecenia PRAC dotyczące przesłanek do aktualizacji informacji o produkcie
 23 April 2015 EMA/PRAC/273915/2015 Pharmacovigilance Risk Assessment Committee Zalecenia PRAC dotyczące przesłanek do aktualizacji informacji o produkcie Przyjęte na posiedzeniu PRAC w dniach 7 10 kwietnia
23 April 2015 EMA/PRAC/273915/2015 Pharmacovigilance Risk Assessment Committee Zalecenia PRAC dotyczące przesłanek do aktualizacji informacji o produkcie Przyjęte na posiedzeniu PRAC w dniach 7 10 kwietnia
Przewodnik użytkownika raportu internetowego
 Ochrona zdrowia pacjentów zawiera informacje dotyczące elementów składowych danych, układu, interpretacji i funkcji w raporcie internetowym. 1. Elementy składowe danych... 2 2. Dodatkowe informacje dotyczące
Ochrona zdrowia pacjentów zawiera informacje dotyczące elementów składowych danych, układu, interpretacji i funkcji w raporcie internetowym. 1. Elementy składowe danych... 2 2. Dodatkowe informacje dotyczące
Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie
 brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Rysunek. Układ limfatyczny.
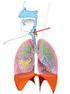 Poniższa informacja dotyczy rodzaju chłoniaka nieziarniczego, zwanego chłoniakiem anaplastycznym z dużych komórek. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest
Poniższa informacja dotyczy rodzaju chłoniaka nieziarniczego, zwanego chłoniakiem anaplastycznym z dużych komórek. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Informacja dotyczy pozawęzłowego chłoniaka strefy brzeżnej systemu MALT (z komórek B), który jest odmianą złośliwego chłoniaka nieziarniczego.
 Chłoniak typu MALT pozawęzłowy chłoniak strefy brzeżnej systemu MALT (z komórek B) Informacja dotyczy pozawęzłowego chłoniaka strefy brzeżnej systemu MALT (z komórek B), który jest odmianą złośliwego chłoniaka
Chłoniak typu MALT pozawęzłowy chłoniak strefy brzeżnej systemu MALT (z komórek B) Informacja dotyczy pozawęzłowego chłoniaka strefy brzeżnej systemu MALT (z komórek B), który jest odmianą złośliwego chłoniaka
Rysunek. Układ Limfatyczny.
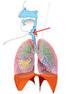 Informacja dotyczy chłoniaka rozlanego z dużych komórek B, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu
Informacja dotyczy chłoniaka rozlanego z dużych komórek B, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu
Rysunek. Układ limfatyczny.
 Informacja dotyczy chłoniaka grudkowego, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu odpornościowego
Informacja dotyczy chłoniaka grudkowego, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu odpornościowego
Europejska Agencja Leków potwierdza zmiany w stosowaniu metoklopramidu
 Europejska Agencja Leków potwierdza zmiany w stosowaniu metoklopramidu Zmiany mają przede wszystkim na celu zmniejszenie ryzyka neurologicznych działań niepożądanych Komitet ds. Produktów Leczniczych Stosowanych
Europejska Agencja Leków potwierdza zmiany w stosowaniu metoklopramidu Zmiany mają przede wszystkim na celu zmniejszenie ryzyka neurologicznych działań niepożądanych Komitet ds. Produktów Leczniczych Stosowanych
Aneks II Zmiany w drukach informacyjnych produktów leczniczych zarejestrowanych w procedurze narodowej
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
KEYTRUDA (pembrolizumab)
 Poradnik dotyczący leku KEYTRUDA (pembrolizumab) Informacja dla Pacjentów Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie.
Poradnik dotyczący leku KEYTRUDA (pembrolizumab) Informacja dla Pacjentów Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie.
Ulotka dołączona do opakowania: informacja dla użytkownika. Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Poradnik dotyczący interpretacji spontanicznych zgłoszeń przypadków podejrzewanych działań niepożądanych leków
 30 styczeń 2017 r. Wydział ds. inspekcji, nadzoru nad bezpieczeństwem stosowania produktów leczniczych u ludzi i komisji EMA/749446/2016 Zmiana nr 1* Poradnik dotyczący interpretacji spontanicznych zgłoszeń
30 styczeń 2017 r. Wydział ds. inspekcji, nadzoru nad bezpieczeństwem stosowania produktów leczniczych u ludzi i komisji EMA/749446/2016 Zmiana nr 1* Poradnik dotyczący interpretacji spontanicznych zgłoszeń
Poniższa informacja dotyczy chłoniaka z komórek płaszcza, stanowiącego odmianę chłoniaka nieziarniczego.
 Chłoniak z komórek płaszcza Poniższa informacja dotyczy chłoniaka z komórek płaszcza, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego,
Chłoniak z komórek płaszcza Poniższa informacja dotyczy chłoniaka z komórek płaszcza, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego,
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Poniższa informacja dotyczy chłoniaka Burkitta, będącego odmianą chłoniaka nieziarniczego.
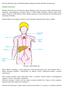 Poniższa informacja dotyczy chłoniaka Burkitta, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu odpornościowego
Poniższa informacja dotyczy chłoniaka Burkitta, będącego odmianą chłoniaka nieziarniczego. Chłoniak nieziarniczy Chłoniak nieziarniczy jest nowotworem układu chłonnego, który jest częścią systemu odpornościowego
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 10 marca 2016 r. Komisja Europejska została poinformowana, że niezależna grupa monitorowania danych dotyczących bezpieczeństwa zaobserwowała w trzech badaniach
Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 10 marca 2016 r. Komisja Europejska została poinformowana, że niezależna grupa monitorowania danych dotyczących bezpieczeństwa zaobserwowała w trzech badaniach
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Rysunek. Układ limfatyczny.
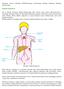 Informacja dotyczy chłoniaka limfoblastycznego stanowiącego odmianę złośliwego chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
Informacja dotyczy chłoniaka limfoblastycznego stanowiącego odmianę złośliwego chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń
 25 February 2016 EMA/PRAC/137769/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
25 February 2016 EMA/PRAC/137769/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Biorąc pod uwagę sprawozdanie komitetu PRAC do raportu PSUR dla dexamethasonu (za wyjątkiem
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Biorąc pod uwagę sprawozdanie komitetu PRAC do raportu PSUR dla dexamethasonu (za wyjątkiem
Limfocyty powstają w szpiku kostnym, czyli tam gdzie powstają wszystkie komórki krwi. Występują
 Informacja dotyczy chłoniaka śródpiersia z dużych komórek B, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
Informacja dotyczy chłoniaka śródpiersia z dużych komórek B, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości
 Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości Omówienie rozpowszechnienia choroby Rosnąca oczekiwana długość życia i starzejące się społeczeństwo
Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości Omówienie rozpowszechnienia choroby Rosnąca oczekiwana długość życia i starzejące się społeczeństwo
PRZEWODNIK DLA FARMACEUTY JAK WYDAWAĆ LEK INSTANYL
 PRZEWODNIK DLA FARMACEUTY JAK WYDAWAĆ LEK INSTANYL WAŻNE INFORMACJE DOTYCZĄCE BEZPIECZEŃSTWA: INSTANYL, AEROZOL DO NOSA LEK STOSOWANY W LECZENIU PRZEBIJAJĄCEGO BÓLU NOWOTWOROWEGO Szanowny Farmaceuto, Należy
PRZEWODNIK DLA FARMACEUTY JAK WYDAWAĆ LEK INSTANYL WAŻNE INFORMACJE DOTYCZĄCE BEZPIECZEŃSTWA: INSTANYL, AEROZOL DO NOSA LEK STOSOWANY W LECZENIU PRZEBIJAJĄCEGO BÓLU NOWOTWOROWEGO Szanowny Farmaceuto, Należy
Przegląd wiedzy na temat leku Metacam i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/CVMP/259397/2006 EMEA/V/C/000033 Przegląd wiedzy na temat leku Metacam i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Metacam i w jakim celu się go stosuje? Metacam
EMA/CVMP/259397/2006 EMEA/V/C/000033 Przegląd wiedzy na temat leku Metacam i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Metacam i w jakim celu się go stosuje? Metacam
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Wnioski naukowe Uwzględniając sprawozdanie oceniające PRAC w sprawie okresowych raportów o bezpieczeństwie (PSUR) dotyczących
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Wnioski naukowe Uwzględniając sprawozdanie oceniające PRAC w sprawie okresowych raportów o bezpieczeństwie (PSUR) dotyczących
Chłoniak z obwodowych komórek T może wystąpić w każdym wieku, najczęściej jednak pojawia się u osób dorosłych, zarówno kobiet jak i mężczyzn.
 Informacja dotyczy chłoniaka z obwodowych komórek T bliżej nieokreślonego, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi
Informacja dotyczy chłoniaka z obwodowych komórek T bliżej nieokreślonego, stanowiącego odmianę chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi
KEYTRUDA (pembrolizumab)
 Poradnik dotyczący leku KEYTRUDA (pembrolizumab) Informacja dla Pacjentów Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie.
Poradnik dotyczący leku KEYTRUDA (pembrolizumab) Informacja dla Pacjentów Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie.
20 września 2013 r. EMA/564255/2013. 7 Westferry Circus Canary Wharf London E14 4HB United Kingdom
 20 września 2013 r. EMA/564255/2013 Zawieszenie pozwolenia na dopuszczenie do obrotu produktu leczniczego Numeta G13%E i wprowadzenie nowych działań służących zminimalizowaniu ryzyka stosowania produktu
20 września 2013 r. EMA/564255/2013 Zawieszenie pozwolenia na dopuszczenie do obrotu produktu leczniczego Numeta G13%E i wprowadzenie nowych działań służących zminimalizowaniu ryzyka stosowania produktu
Leki, zarejestrowane i stosowane aktualnie w krajach UE do leczenia onkologicznego i Stwardnienia Guzowatego.
 Leki, zarejestrowane i stosowane aktualnie w krajach UE do leczenia onkologicznego i Stwardnienia Guzowatego. Afinitor Ewerolumis Streszczenie EPAR dla ogółu społeczeństwa Niniejszy dokument stanowi streszczenie
Leki, zarejestrowane i stosowane aktualnie w krajach UE do leczenia onkologicznego i Stwardnienia Guzowatego. Afinitor Ewerolumis Streszczenie EPAR dla ogółu społeczeństwa Niniejszy dokument stanowi streszczenie
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
Często zadawane pytania (FAQ)
 4 listopada 2011 r. EMA/527628/2011 Dyrekcja W niniejszym dokumencie znajdują się odpowiedzi na najczęściej zadawane pytania otrzymane przez Europejską Agencję Leków Jeśli nie znajdą tu Państwo odpowiedzi
4 listopada 2011 r. EMA/527628/2011 Dyrekcja W niniejszym dokumencie znajdują się odpowiedzi na najczęściej zadawane pytania otrzymane przez Europejską Agencję Leków Jeśli nie znajdą tu Państwo odpowiedzi
Zaobserwowano częstsze przypadki stosowania produktu leczniczego Vistide w niezatwierdzonych wskazaniach i (lub) drogach podawania.
 Komunikat skierowany do fachowych pracowników ochrony zdrowia dotyczący występowania ciężkich działań niepożądanych związanych z stosowaniem produktu leczniczego Vistide (cydofowir) niezgodnie z zapisami
Komunikat skierowany do fachowych pracowników ochrony zdrowia dotyczący występowania ciężkich działań niepożądanych związanych z stosowaniem produktu leczniczego Vistide (cydofowir) niezgodnie z zapisami
Nowe możliwości leczenia ostrej białaczki limfoblastycznej
 Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
Wydłużenie życia chorych z rakiem płuca - nowe możliwości
 Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 7 czerwca 2017 r. Komisja Europejska (KE) otrzymała informację o przypadku zabójczej niewydolności wątroby u pacjenta po zastosowaniu leczenia daklizumabem
Aneks IV Wnioski naukowe 1 Wnioski naukowe W dniu 7 czerwca 2017 r. Komisja Europejska (KE) otrzymała informację o przypadku zabójczej niewydolności wątroby u pacjenta po zastosowaniu leczenia daklizumabem
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
EMA potwierdza zalecenia mające na celu zminimalizowanie ryzyka wystąpienia zakażenia mózgu PML w trakcie stosowania leku Tysabri
 26 lutego 2016 EMA/137488/2016 EMA potwierdza zalecenia mające na celu zminimalizowanie ryzyka wystąpienia zakażenia mózgu PML w trakcie stosowania leku Tysabri W przypadku pacjentów narażonych na większe
26 lutego 2016 EMA/137488/2016 EMA potwierdza zalecenia mające na celu zminimalizowanie ryzyka wystąpienia zakażenia mózgu PML w trakcie stosowania leku Tysabri W przypadku pacjentów narażonych na większe
Wyniki procedur na mocy art. 20 rozporządzenia (WE) nr 726/2004 oraz art. 31 dyrektywy 2001/83/WE
 28 lutego 2013 r. EMA/136606/2013 wer.1 EMEA/H/A-31/1333 EMEA/H/C/000604/A20/45 EMEA/H/C/000622/A20/60 EMEA/H/C/000674/A20/52 Pytania i odpowiedzi dotyczące ponownej oceny monowalentnych i poliwalentnych
28 lutego 2013 r. EMA/136606/2013 wer.1 EMEA/H/A-31/1333 EMEA/H/C/000604/A20/45 EMEA/H/C/000622/A20/60 EMEA/H/C/000674/A20/52 Pytania i odpowiedzi dotyczące ponownej oceny monowalentnych i poliwalentnych
Data rozpoczęcia badania klinicznego i przewidywan y czas jego trwania. Przewidywana liczba uczestników badania klinicznego i kryteria ich rekrutacji
 Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
Białaczka limfatyczna
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
Data rozpoczęcia badania klinicznego i przewidywan y czas jego trwania. Przewidywana liczba uczestników badania klinicznego i kryteria ich rekrutacji
 Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
Ważne informacje nie wyrzucać! Agolek. w leczeniu dużych epizodów depresyjnych u dorosłych. Broszura dla Pacjenta
 Ważne informacje nie wyrzucać! Agolek w leczeniu dużych epizodów depresyjnych u dorosłych Broszura dla Pacjenta 1 Agolek jest lekiem przeciwdepresyjnym, który pomaga leczyć depresję. Aby zoptymalizować
Ważne informacje nie wyrzucać! Agolek w leczeniu dużych epizodów depresyjnych u dorosłych Broszura dla Pacjenta 1 Agolek jest lekiem przeciwdepresyjnym, który pomaga leczyć depresję. Aby zoptymalizować
Data zakończenia badania klinicznego
 Lp. Numer protokołu badania Nazwa sponsora/cro Skład zespołu badawczego Data rozpoczęcia badania klinicznego w ośrodku Data zakończenia badania klinicznego 1 2 3 6 6 12 1. EMRII200037-014 Otwarte, randomizowane,
Lp. Numer protokołu badania Nazwa sponsora/cro Skład zespołu badawczego Data rozpoczęcia badania klinicznego w ośrodku Data zakończenia badania klinicznego 1 2 3 6 6 12 1. EMRII200037-014 Otwarte, randomizowane,
Warszawa, 31.10.2007r.
 Warszawa, 31.10.2007r. Lek Taxotere otrzymuje pozytywną opinię Komitetu ds. Produktów Leczniczych stosowanych u Ludzi (CHMP), zalecającą rejestrację w Unii Europejskiej do leczenia indukcyjnego miejscowo
Warszawa, 31.10.2007r. Lek Taxotere otrzymuje pozytywną opinię Komitetu ds. Produktów Leczniczych stosowanych u Ludzi (CHMP), zalecającą rejestrację w Unii Europejskiej do leczenia indukcyjnego miejscowo
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Annex I. Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia
 Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę.
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę. Aneks III Poprawki do odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę. Aneks III Poprawki do odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Miacalcic, 50 j.m./ml, roztwór do wstrzykiwań Miacalcic, 100 j.m./ml, roztwór do wstrzykiwań Calcitoninum salmonis Należy zapoznać się z treścią
Ulotka dołączona do opakowania: informacja dla pacjenta Miacalcic, 50 j.m./ml, roztwór do wstrzykiwań Miacalcic, 100 j.m./ml, roztwór do wstrzykiwań Calcitoninum salmonis Należy zapoznać się z treścią
Informator dla fachowego personelu medycznego Najczęściej zadawane pytania
 KEYTRUDA (pembrolizumab) Informator dla fachowego personelu medycznego Najczęściej zadawane pytania Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych
KEYTRUDA (pembrolizumab) Informator dla fachowego personelu medycznego Najczęściej zadawane pytania Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Moc Gatunki zwierząt. Postać farmaceutyczna. Samice psów. Enurace 50 Tabletki 50 mg
 ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA I PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC PRODUKTU LECZNICZEGO, GATUNKI ZWIERZĄT, DROGA PODANIA I PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
Aneks III Zmiany Charakterystyki Produktu Leczniczego i ulotki dołączonej do opakowania
 Aneks III Zmiany Charakterystyki Produktu Leczniczego i ulotki dołączonej do opakowania Uwaga: Poniższe zmiany należy dodać do ważnej Charakterystyki Produktu Leczniczego, oznakowania i ulotki dla pacjenta,
Aneks III Zmiany Charakterystyki Produktu Leczniczego i ulotki dołączonej do opakowania Uwaga: Poniższe zmiany należy dodać do ważnej Charakterystyki Produktu Leczniczego, oznakowania i ulotki dla pacjenta,
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Katalog ryczałtów za diagnostykę w programach lekowych
 Katalog ryczałtów za diagnostykę w programach lekowych Lp. Kod Nazwa świadczenia Ryczałt roczny (punkty) Uwagi 1 2 3 4 5 1 5.08.08.0000001 Diagnostyka w programie leczenia przewlekłego WZW typu B lamiwudyną
Katalog ryczałtów za diagnostykę w programach lekowych Lp. Kod Nazwa świadczenia Ryczałt roczny (punkty) Uwagi 1 2 3 4 5 1 5.08.08.0000001 Diagnostyka w programie leczenia przewlekłego WZW typu B lamiwudyną
Katalog ryczałtów za diagnostykę w programach lekowych
 Katalog ryczałtów za diagnostykę w programach lekowych Lp. Kod Nazwa świadczenia Ryczałt roczny (punkty) Uwagi 1 2 3 4 5 1 5.08.08.0000001 Diagnostyka w programie leczenia przewlekłego WZW typu B lamiwudyną
Katalog ryczałtów za diagnostykę w programach lekowych Lp. Kod Nazwa świadczenia Ryczałt roczny (punkty) Uwagi 1 2 3 4 5 1 5.08.08.0000001 Diagnostyka w programie leczenia przewlekłego WZW typu B lamiwudyną
Informator dla fachowego personelu medycznego Najczęściej zadawane pytania
 KEYTRUDA (pembrolizumab) Informator dla fachowego personelu medycznego Najczęściej zadawane pytania Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych
KEYTRUDA (pembrolizumab) Informator dla fachowego personelu medycznego Najczęściej zadawane pytania Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych
Można stosować w połączeniu z chemioterapią, dla poprawienia skuteczności jej działania.
 Zespół lekarzy różnych specjalności uczestniczy w planowaniu leczenia. W przebiegu leczenia chłoniaków nieziarniczych stosuje się szereg metod, do których należą: chemioterapia, radioterapia oraz terapia
Zespół lekarzy różnych specjalności uczestniczy w planowaniu leczenia. W przebiegu leczenia chłoniaków nieziarniczych stosuje się szereg metod, do których należą: chemioterapia, radioterapia oraz terapia
Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń
 1 October 2018 1 EMA/PRAC/621111/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
1 October 2018 1 EMA/PRAC/621111/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Topotecan medac 1 mg/ml koncentrat do sporządzania roztworu do infuzji Topotecanum
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Topotecan medac 1 mg/ml koncentrat do sporządzania roztworu do infuzji Topotecanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Topotecan medac 1 mg/ml koncentrat do sporządzania roztworu do infuzji Topotecanum Należy zapoznać się z treścią ulotki przed zastosowaniem leku. Należy
Pytania i dopowiedzi na temat analizy nie-selektywnych niesteroidowych leków przeciwzapalnych (NLPZ) oraz ryzyka chorób układu sercowo-naczyniowego.
 18 października 2012 EMA/653433/2012 EMEA/H/A-5(3)/1319 Pytania i dopowiedzi na temat analizy nie-selektywnych niesteroidowych leków przeciwzapalnych (NLPZ) oraz ryzyka chorób układu sercowo-naczyniowego.
18 października 2012 EMA/653433/2012 EMEA/H/A-5(3)/1319 Pytania i dopowiedzi na temat analizy nie-selektywnych niesteroidowych leków przeciwzapalnych (NLPZ) oraz ryzyka chorób układu sercowo-naczyniowego.
Często zadawane pytania (FAQ)
 13 lutego 2017 r. EMA/527628/2011 Rev. 1 Dyrekcja W niniejszym dokumencie znajdują się odpowiedzi na najczęściej zadawane pytania otrzymane przez Europejską Agencję Leków (EMA). W przypadku nieznalezienia
13 lutego 2017 r. EMA/527628/2011 Rev. 1 Dyrekcja W niniejszym dokumencie znajdują się odpowiedzi na najczęściej zadawane pytania otrzymane przez Europejską Agencję Leków (EMA). W przypadku nieznalezienia
Ulotka dołączona do opakowania: informacja dla pacjenta Droglycan, 200 mg mg, kapsułki, twarde
 ULOTKA DLA PACJENTA Ulotka dołączona do opakowania: informacja dla pacjenta Droglycan, 200 mg + 250 mg, kapsułki, twarde Chondroityny sodu siarczan + Glukozaminy chlorowodorek Należy uważnie zapoznać się
ULOTKA DLA PACJENTA Ulotka dołączona do opakowania: informacja dla pacjenta Droglycan, 200 mg + 250 mg, kapsułki, twarde Chondroityny sodu siarczan + Glukozaminy chlorowodorek Należy uważnie zapoznać się
Aneks IV. Wnioski naukowe
 Aneks IV Wnioski naukowe 1 Wnioski naukowe Od czasu dopuszczenia produktu Esmya do obrotu zgłoszono cztery przypadki poważnego uszkodzenia wątroby prowadzącego do transplantacji wątroby. Ponadto zgłoszono
Aneks IV Wnioski naukowe 1 Wnioski naukowe Od czasu dopuszczenia produktu Esmya do obrotu zgłoszono cztery przypadki poważnego uszkodzenia wątroby prowadzącego do transplantacji wątroby. Ponadto zgłoszono
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie. Osoby należące do fachowego
