Chemia organiczna. Alkohole Fenole. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
|
|
|
- Weronika Niewiadomska
- 5 lat temu
- Przeglądów:
Transkrypt
1 Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1
2 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów pochodne wody 2
3 terpenoidy węglowodany (-)-borneol (-)-mentol geraniol (1R,2S,5R)-(-)-2-izopropylo- -5-metylocykloheksanol glukoza cholesterol estriol kwas cholowy steroidy 3
4 Alkohole - nomenklatura Nazwę alkoholu tworzymy: przez dodanie końcówki ol do nazwy macierzystego węglowodoru używamy słowa alkohol i przymiotnika określającego rodnik, z którym połączona jest grupa OH obecność grupy OH zaznaczamy przedrostkiem hydroksy- 1-butanol 2-butanol 2-metyl-1-propanol 2-metyl-1- propanol alkohol: butylowy sec-butylowy izobutylowy tert-butylowy 2-propol-1-ol 3-cykloheksan-1-ol 1,2 etanodiol 1,2,3 propanotriol alkohol allilowy glikol etylenowy gliceryna 4
5 Wiązania wodorowe w alkoholach. Grupy OH są silnie spolaryzowane. Tlen jest bardziej elektroujemny od wodoru para elektronów tworząca wiązanie O-H jest przesunięta w stronę atomu tlenu tworzą się częściowe ładunki: dodatni przy atomie wodoru ujemny przy atomie tlenu Powstają dipole, które mogą się wzajemnie przyciągać, gdy są odpowiednio zorientowane względem siebie Najsilniejsze przyciąganie występuje, gdy ułożenie cząsteczek umożliwia zbliżenie atomu wodoru z grupy -OH do atomu tlenu, znajdującego się w drugiej cząsteczce. 5
6 Alkohole - synteza synteza z alkenów przez bezpośrednią hydratację powstanie karbokationu przez przyłączenie protonu przegrupowanie (stabilizacja karbokationu) powstanie jonu alkilooksoniowego odłączenie protonu synteza z alkenów metodą hydroksyrtęciowania 6
7 związki Grignarda Alkohole - synteza Hydroliza halogenków alkilowych Otrzymywanie alkoholi 1 o w reakcji z formaldehydem H H 3 C MgCl + C O H C H 3 H C H O-MgCl HCl -MgCl 2 C H 3 H C H OH Otrzymywanie alkoholi 2 o w reakcji z dowolnym aldehydem H H H HCl C 2 H 5 MgBr + C O C 2 H 5 C O-MgBr C 2 H 5 C OH -MgBrCl H 3 C CH 3 CH 3 7
8 Kwasowe i zasadowe właściwości alkoholi Alkohole są słabszymi kwasami niż woda tworzenie alkoholanów soli z metalami: C 2 H 5 OH + Na C 2 H 5 ONa + ½ H 2 HOH CH 3 OH CH 3 CH 2 OH (CH 3 ) 2 CHOH (CH 3 ) 3 COH pk a 15,7 15,5 15,9 17,1 19,2 kwasowość wzrasta, gdy w pobliżu grupy OH znajdą się podstawniki elektroujemne przyciągają do siebie elektrony ze wszystkich położonych w pobliżu wiązań, w tym elektrony tworzące wiązanie OH pk a t-butanol = 18,0 nanofluoro-t-butanol = 5,4 wzrost kwasowości alkoholi zawierających fluorowce CH 3 CH 2 OH ClCH 2 CH 2 OH CF 3 CH 2 OH pk a 15,9 14,3 12,4 8
9 Kwasowe i zasadowe właściwości alkoholi Alkohole są zasadami przy atomie tlenu w grupie OH znajdują się wolne pary elektronów.. ROH + H + R + OH 2 kation alkilooksoniowy Alkohole (i fenole) reagują z kwasami Lewisa H R OH + ZnCl 2 R O ZnCl - 2 atom tlenu grupy OH dostarcza pary elektronów, tworzącej koordynacyjne wiązanie z cynkiem 9
10 Reakcje alkoholi wymiana jonu wodorowego na inny podstawnik atak silnego elektrofila E silny -onian produkt wiązany elektrofil podstawienia przez zasadę atak słabego elektrofila alkohol sprzężona słaby produkt zasada elektrofil podstawienia 10
11 Reakcje alkoholi wymiana grupy wodorotlenowej na inne podstawniki Reakcja przebiega przez przekształcenie grupy OH w bardziej reaktywne grupy odchodzące np. reakcja z chlorkiem kwasu sulfonowego 1. R-OH + R`SO 2 Cl R-SO 2 R` + HCl chlorek kwasu sulfonowego sulfonian alkilu 2. R-SO 2 R` + Nu - R-Nu + R`SO 3 - anion kwasu sulfonowego 11
12 Reakcje alkoholi wymiana grupy wodorotlenowej na inne podstawniki wymiana grupy OH na atomy chlorowców H + X -, S N 1 lub S N 2 + R-OH R-OH 2 R-X + H 2 O alkohole pierwszorzędowe wg mechanizmu S N 2 alkohole drugorzędowe wg mechanizmu S N 1 lub S N 2 alkohole trzeciorzędowe wg mechanizmu S N 1 12
13 Reakcje alkoholi synteza alkenów z alkoholi dehydratacja alkoholi - reakcja odwrotna do uwodnienia alkenów protonowanie alkoholu powstaje kation alkilooksoniowy: reakcja H + z wolna parą elektronów tlenu grupy OH wytwarzanie karbokationu proces powolny, odwracalny stabilizacja karbokationu poprzez oderwanie protonu (reakcja eliminacji 1,2) 13
14 Reakcje alkoholi utlenianie alkohole pierwszorzędowe utleniane są do kwasów karboksylowych alkohole drugorzędowe utleniane są do ketonów utleniacze: K 2 Cr 2 O 7, Na 2 Cr 2 O 7, CrO 3, KMnO 4, HNO 3, O 2 /kat. otrzymywanie lotnych aldehydów 14
15 Reakcje alkoholi tworzenie acetali i ketali hemiacetal Reakcja z aldehydami reakcja przebiega samorzutnie w obecności kwasów Reakcja z ketonami hemiketal +H 2 O hemiacetal acetal 15 acetale - dietery dioli geminalnych
16 Reakcje wicynalnych dioli Przegrupowanie wewnątrzcząsteczkowe (pinakolinowe) reakcja katalizowana przez silne kwasy eliminacja cząsteczki wody + przegrupowanie szkieletu węglowego produkty: ketony lub aldehydy pinakol pinakolon przekształecenia karbokationów o wyższej energii w karbokationy o energii niższej, w których dodatnio naładowany atom węgla jest połączony z tlenem pinakol - 2,3-dimetylo-2,3-butandiol pinakolon 3,3-dimetylo-2-butanon 16
17 Reaktywność alkoholi Nu - -HOH PCl 3, SOCl 2 H + :B - E + -HOH alkoholany etery -H + alkeny [O] Nu - związki karbonylowe 17
18 Fenole - nomenklatura Fenole: nazwa systematyczna: nazwa węglowodoru + końcówka ol najczęście stosujemy nazwy zwyczajowe 2-metylofenol 3-metylokrezol 4-metylokrezol o-krezol m-krezol p-krezol kwas pikrynowy 2,4,6-trinitrofenol pirokatechina rezorcyna hydrochinon benzeno-1,2-diolo benzeno-1,4-diol benzeno-1,3-diol kwas 3,4,5-trihydroksybenzoesowy kwas galusowy 2-izopropylo-5-metylofenol tymol 18
19 Fenole - nomenklatura Fenole: nazwa systematyczna: nazwa węglowodoru + końcówka ol najczęście stosujemy nazwy zwyczajowe kwas pikrynowy 2,4,6-trinitrofenol Hierarchia ważności grup funkcyjnych kwasy pochodne kwasów aldehydy ketony alkohole aminy etery fluorowcopochodne kwas 3,4,5-trihydroksybenzoesowy kwas galusowy 2-izopropylo-5-metylofenol tymol 19
20 Fenole pochodzenia naturalnego eter fenol tymol karwakrol eugenol (p-cymen-3-ol) (p-cymen-2-ol) (4-allilo-2-metoksyfenol) fenol alkohol kwas salicylowy aldehyd salicylowy alkohol salicylowy (saligenina) 20
21 Fenole L-tyrozyna adriamycyna 21
22 Kwasowe i zasadowe właściwości alkoholi i fenoli Fenole są kwasami silniejszymi niż woda fenolany mogą powstawać bezpośrednio w reakcji: C 6 H 5 OH + NaOH C 6 H 5 ONa + H 2 O Znaczna kwasowość spowodowana jest rezonansową stabilizacją anionów fenoli (delokalizacja pary elektronów) struktury rezonansowe anionu fenolanowego 22
23 Reakcje grupy OH fenoli - alkilowanie etery alkilo-arylowe 23
24 Reakcje fenoli działanie antyoksydacyjne Fenole: duża wrażliwość na utlenianie reakcje o przebiegu rodnikowym Rodniki fenoksylowe - stabilne w wyniku rezonansowej delokalizacji pojedynczego elektronu na pierścieniowych atomach węgla rodnik 2,6-tris(t-butylo)-4-(R)fenoksylowy Rodniki aryloksywe z dużymi podstawnikami w położeniach orto i para są mało reaktywne Trwałe wolne rodniki inhibitory łańcuchowych reakcji rodnikowych antyutleniacze dodawane do wyrobów spożywczych 24
25 Reakcje fenoli podstawienie elektrofilowe Grupa OH fenoli należy do podstawników o najsilniejszym działaniu aktywującym pierścień i kieruje podstawniki elektrofilowe w położenia orto i para. Aktywacja pierścienia i kierunek podstawienia elektrofilowego wynikają z rezonansowego efektu grupy OH (oddawanie elektronów od atomu tlenu do pierscienia) 25
26 Reakcje grupy OH fenoli - utlenianie kwas chinowy rozpowszechniony w przyrodzie, występuje w korze drzewa chinowego, ziarnach kawy, burakach cukrowych, czarnych jagodach i innych roślinach. 26
27 Etery Pochodne: wody dwa atomy wodoru zostały zastąpione przez reszty organiczne: alkoholi jeden atom wodoru (przy OH) zastąpiony resztą organiczną: R i R może być alkilem, arylem lub winylem. Etery zawierające atom węgla sp 2 związany z atomem tlenu są trwałe (w alkoholach grupa OH musi być połączona z węglem sp 3 ) etery: etylowo-winylowy fenylowo-metylowy difenylowy 27
28 Etery występowanie w przyrodzie biedrzeniec anyż aldehyd anyżowy właściwości wykrztuśne właściwości spazmolityczne w obrębie przewodu pokarmowego. środek zapobiegający wzdęciom i ułatwiający trawienie gwajakowiec zwyczajny gwajakol wykrztuśny antyseptyczny środek odkażający (w stomatologii) destylacja z parą wodną eugenol przeciwzapalny przeciwinfekcyjny przeciwbólowy przeciwnowotworowy grzybobójczy 28
29 Etery występowanie w przyrodzie pejotl Oddziałuje agonistycznie na receptory serotoninowe. Jeden z najdłużej znanych ludzkości psychodelików W formie ekstraktu z pejotlu była używana przez m.in. St.I. Witkiewicza i A. Huxley a bieluń dziędzierzawa meskalina skopolamina Blokuje działanie acetylocholiny w receptorze M. Działa depresyjnie na ośrodkowy układ nerwowy Powoduje uspokojenie, senność i otępienie. Wykazuje działanie przeciwwymiotne, przeciwkonwulsyjne. Substancja silnie toksyczna, przedawkowanie może skutkować majaczeniem, dezorientacją, halucynacjami, paraliżem i śmiercią mak lekarski morfina Działanie narkotyczne, przeciwbólowe, przeciwkaszlowe, Działa depresyjnie na ośrodkowy układ nerwowy Nadmierne dawki mogą prowadzić do śpiączki z depresją ośrodka oddechowego (niewydolność oddechowa) 29
30 Etery - otrzymywanie Przemysłowa metoda międzycząsteczkowa dehydratacja etanolu katalizowana stężonym kwasem siarkowym Powstają etery symetryczne z alkoholi 1 o Reakcja zachodzi wg mechanizmu S N 2: etanol etanol protonowany etanol etanol protonowany eter protonowany eter dietylowy
31 Etery - otrzymywanie Reakcja Williamsona reakcja alkilowania alkoholanów lub fenolanów za pomocą pierwszorzędowych odczynników alkilujących Reakcja zachodzi wg mechanizmu S N 2; alkoholan pełni rolę odczynnika nukleofilowego
32 Etery - reaktywność Reakcja z halogenowodorem: 32
33 Etery cykliczne epoksydy otrzymywanie Epoksydy związki cykliczne zawierające w pierścieniu atom tlenu związany z dwoma atomami węgla 33
34 Etery koronowe korony Chemia supramolekularna dział chemii organicznej zajmującej się strukturami złożonymi z wielu podjednostek, które powstają samorzutnie na skutek słabych oddziaływań międzycząsteczkowych takich jak: siły van der Waalsa, słabe wiązania wodorowe, oddziaływaniach p-p i oddziaływaniach elektrostatycznych lub poprzez wzajemne mechaniczne zaplecenie. 34
35 Etery koronowe korony Polietery cykliczne ze względu na kształt wzorów cząsteczek przypominający koronę zostały nazwane koronami. Nomenklatura eterów policyklicznych: rdzeń nazwy korona jest poprzedzona przez liczbą wszystkich atomów tworzących pierścień po myślniku podaje się liczbę atomów tlenu znajdujących się w pierścieniu 35
36 Etery koronowe korony Model czaszowy koronatu potasu kompleksu eteru 18-korona-6 z kationem potasu We wnętrzu każdej korony znajduje się wnęka o określonych rozmiarach, otoczona przez atomy tlenu zdolne do koordynowania kationów. etery koronowe w roztworach kompleksują jony litu 12C4, jony sodu 15C5 oraz jony potasu 18C6. stała trwałości kompleksów wzrasta wraz z dopasowaniem wielkości wnęki eteru koronowego do promienia jonowego kationu w makrocyklicznych kompleksach kation otoczony jest pierścieniem eteru koronowego wolne pary elektronowe, należące do atomów pierścienia eteru koronowego umieszczone są w centrum wnęki w kompleksie każdy donorowy atom tlenu położony jest w jednakowej odległości od kationu Takie uporządkowane położenie ligandów w kompleksach eterów koronowych powoduje wyższą trwałość układów niż w przypadku kompleksów z cząsteczkami liniowymi 36
37 Etery koronowe kryptaryndy Kryptandy mają zdolność do tworzenia kompleksów na skutek strukturalnego dopasowania kationu metalu do wnęki makrocyklicznego układu Na stabilność utworzonych kompleksów wpływa nie tylko rozmiar dziury w związkach makroheterocyklicznych, ale również liczba atomów donorowych i konformacyjna struktura ligandu Kryptandy, które mają optymalne rozmiary w odniesieniu do danego jonu metalu tworzą bardziej stabilne kompleksy niż odpowiednie etery koronowe Efekt makrocykliczny jest większy dla kryptandów niż dla eterów koronowych 37
38 Etery koronowe Wszystkie oddziaływania i transformacje biologiczne są wysoce selektywne. Cechą charakterystyczną tych oddziaływań jest to, że asocjaty rozpoznają się wzajemnie i ignorują innych partnerów. Asocjacja substrat receptor prowadzi do powstania tworu, który można nazwać supercząsteczką. Powstaje on w procesie dwuetapowym, zawierającym: - konstrukcję metodami syntezy organicznej receptora molekularnego zbudowanego z pomocą wiązań kowalencyjnych; - kompleksowanie jednego lub więcej substratów (jonów lub cząsteczek) poprzez oddziaływania międzycząsteczkowe. 38
39 Etery koronowe Oprócz miejsca kompleksującego, w którym wiązany jest substrat, receptor może posiadać grupy reaktywne, zdolne da katalitycznego przekształcenia związanego substratu lub grupy lipofilowe pozwalające mu na przeniknięcie do membrany i do spełnienia funkcji transportowych względem substratu. Receptory biologiczne są w większości przypadków wnękami, a nie tworami wypukłymi. Liczba centrów wiążących powinna być jak największa, zaś dostosowanie kształtu pomiędzy substratem a receptorem jak najlepsze. 39
40 Etery koronowe Wykorzystanie eterów koronowych: do poznania procesu transportu jonów oraz w opracowaniu nowych jonoforów dla potrzeb biologii i medycyny zrozumienia roli kationów w syntezie związków organicznych, a w szczególności w procesie tworzenia się układów o znaczeniu biologicznym zrozumienia procesów samoorganizacji cząsteczek w roztworach, mających fundamentalne znaczenie w syntezie organicznej oraz biochemii w syntezie kationowych i anionowych receptorów molekularnych dla potrzeb medycyny i biologii. 40
41 Jonofory Jonofory nośnikowe kompleksują kation z fazy wodnej znajdując się na granicy faz, jednak pozostając w warstwie lipidowej. Kation jest następnie transportowany przez dwuwarstwę lipidową w postaci kompleksu. Po przeciwnej stronie błony, na granicy faz zachodzi dekompleksowanie kationu, po czym cząsteczka jonoforu wraca, aby wykonać kolejny cykl. 41
42 Jonofory uwaga! walinomycyna nie jest eterem koronowym Jonofor o wysokiej selektywności wiązania kationu potasu K +, który może być transportowany w postaci kompleksu przez błony komórkowe. 42
Chemia organiczna. Alkohole Fenole. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
Chemia organiczna. Alkohole Fenole. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
Pochodne węglowodorów, w cząsteczkach których jeden atom H jest zastąpiony grupą hydroksylową (- OH ).
 Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
RJC E + E H. Slides 1 to 41
 Aromatyczne Substytucje Elektrofilowe E + E H -H E Slides 1 to 41 Aromatyczne Addycje Elektrofilowe...do pierścienia aromatycznego przerywa sprzęŝenie elektronów π i powoduje utratę stabilizacji poprzez
Aromatyczne Substytucje Elektrofilowe E + E H -H E Slides 1 to 41 Aromatyczne Addycje Elektrofilowe...do pierścienia aromatycznego przerywa sprzęŝenie elektronów π i powoduje utratę stabilizacji poprzez
Spis treści 1. Struktura elektronowa związków organicznych 2. Budowa przestrzenna cząsteczek związków organicznych
 Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Otrzymywanie halogenków alkilów
 Otrzymywanie halogenków alkilów 1) Wymiana grupy OH w alkoholach C O H HX 2) reakcja podstawienia alkanów C X H 3 C CH CH 2 HBr C H 3 OH H 3 C CH CH 2 C H 3 Br h + + CH CH 2 3 Cl 2 Cl HCl CH CH 3 3 CH
Otrzymywanie halogenków alkilów 1) Wymiana grupy OH w alkoholach C O H HX 2) reakcja podstawienia alkanów C X H 3 C CH CH 2 HBr C H 3 OH H 3 C CH CH 2 C H 3 Br h + + CH CH 2 3 Cl 2 Cl HCl CH CH 3 3 CH
Slajd 1. Alkohole i fenole. Cholesterol. Slajd 2. Budowa alkoholi. metanol. metanol. Grupą funkcyjną jest (OH) Tlen posiada hybrydyzacjęsp 3
 Slajd 1 Alkohole i fenole Cholesterol Slajd 2 Budowa alkoholi woda woda metanol metanol Grupą funkcyjną jest () Tlen posiada hybrydyzacjęsp 3 Slajd 3 Podział alkoholi Pierwszorzędowe: grupa połączona jest
Slajd 1 Alkohole i fenole Cholesterol Slajd 2 Budowa alkoholi woda woda metanol metanol Grupą funkcyjną jest () Tlen posiada hybrydyzacjęsp 3 Slajd 3 Podział alkoholi Pierwszorzędowe: grupa połączona jest
CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA. POLIMERYZACJA.
 INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA.
INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA.
1. REAKCJA ZE ZWIĄZKAMI POSIADAJĄCYMI KWASOWY ATOM WODORU:
 B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
Podział związków organicznych
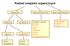 Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Rozdział 6. Odpowiedzi i rozwiązania zadań. Chemia organiczna. Zdzisław Głowacki. Zakres podstawowy i rozszerzony
 Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Materiały dodatkowe alkohole, fenole, etery
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe alkohole, fenole, etery Alkohole i fenole 1 Własności kwasowo-zasadowe alkoholi i fenoli becność grupy H, posiadającej
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe alkohole, fenole, etery Alkohole i fenole 1 Własności kwasowo-zasadowe alkoholi i fenoli becność grupy H, posiadającej
Związki aromatyczne (by Aleksandra Kołodziejczyk, UG)
 Związki aromatyczne (by Aleksandra Kołodziejczyk, UG) 4 stopnie nienasycenia. ak reakcji A Źródła: - piroliza węgla smoła pogazowa; - reforming ropy naftowej Nazewnictwo przedrostek nazwa podstawnika C
Związki aromatyczne (by Aleksandra Kołodziejczyk, UG) 4 stopnie nienasycenia. ak reakcji A Źródła: - piroliza węgla smoła pogazowa; - reforming ropy naftowej Nazewnictwo przedrostek nazwa podstawnika C
CHEMIA 10. Oznaczenia: R - podstawnik węglowodorowy, zwykle alifatyczny (łańcuchowy) X, X 2 - atom lub cząsteczka fluorowca
 INSTYTUT MEDICUS Kurs przygotowawczy na studia medyczne kierunek lekarski, stomatologia, farmacja, analityka medyczna tel. 0501 38 39 55 www.medicus.edu.pl CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE.
INSTYTUT MEDICUS Kurs przygotowawczy na studia medyczne kierunek lekarski, stomatologia, farmacja, analityka medyczna tel. 0501 38 39 55 www.medicus.edu.pl CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE.
11. Reakcje alkoholi, eterów, epoksydów, amin i tioli
 11. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas 1 11.1. Reakcja
11. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas 1 11.1. Reakcja
Alkohole i fenole. Opracowanie: Bartłomiej SIEPSIAK klasa 3d Opiekun: p. Teresa Gębicka
 Alkohole i fenole Opracowanie: Bartłomiej SIEPSIAK klasa d Opiekun: p. Teresa Gębicka Budowa alkoholi i fenoli Szereg homologiczny alkoholi Nazewnictwo Podział alkoholi Otrzymywanie alkoholi Właściwości
Alkohole i fenole Opracowanie: Bartłomiej SIEPSIAK klasa d Opiekun: p. Teresa Gębicka Budowa alkoholi i fenoli Szereg homologiczny alkoholi Nazewnictwo Podział alkoholi Otrzymywanie alkoholi Właściwości
Spis treści. Budowa i nazewnictwo fenoli
 Spis treści 1 Budowa i nazewnictwo fenoli 2 Kwasowość fenoli 2.1 Kwasowość atomów wodoru 2.2 Fenole jako kwasy organiczne. 3 Reakcje fenoli. 3.1 Zastosowanie fenolu Budowa i nazewnictwo fenoli Fenolami
Spis treści 1 Budowa i nazewnictwo fenoli 2 Kwasowość fenoli 2.1 Kwasowość atomów wodoru 2.2 Fenole jako kwasy organiczne. 3 Reakcje fenoli. 3.1 Zastosowanie fenolu Budowa i nazewnictwo fenoli Fenolami
ZWIĄZKI MAGNEZOORGANICZNE. Krystyna Dzierzbicka
 ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
Elementy chemii organicznej
 Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
Slajd 1. Etery i epoksydy. Slajd 2. Wprowadzenie. Wzór R-O-R, gdzie R tos alkil lub aryl Symetryczne lub asymetryczne Przykłady: CH 3 O CH 3 O CH 3
 Slajd 1 Etery i epoksydy Slajd 2 Wprowadzenie Wzór R--R, gdzie R tos alkil lub aryl Symetryczne lub asymetryczne Przykłady: C 3 C 3 C 3 Slajd 3 Budowa i polarność Wygięta struktura Atom tlenu posiada hybrydyzacjęsp
Slajd 1 Etery i epoksydy Slajd 2 Wprowadzenie Wzór R--R, gdzie R tos alkil lub aryl Symetryczne lub asymetryczne Przykłady: C 3 C 3 C 3 Slajd 3 Budowa i polarność Wygięta struktura Atom tlenu posiada hybrydyzacjęsp
Podstawy chemii organicznej. T. 1 / Aleksander Kołodziejczyk, Krystyna Dzierzbicka. wyd. 3. Gdańsk, Spis treści
 Podstawy chemii organicznej. T. 1 / Aleksander Kołodziejczyk, Krystyna Dzierzbicka. wyd. 3. Gdańsk, 2015 Spis treści Wstęp 9 1. WIĄZANIA CHEMICZNE 11 1.1. Wprowadzenie 11 1.2. Wiązania chemiczne 13 1.3.
Podstawy chemii organicznej. T. 1 / Aleksander Kołodziejczyk, Krystyna Dzierzbicka. wyd. 3. Gdańsk, 2015 Spis treści Wstęp 9 1. WIĄZANIA CHEMICZNE 11 1.1. Wprowadzenie 11 1.2. Wiązania chemiczne 13 1.3.
Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka
 Slajd 1 Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka Slajd 2 Alkeny Węglowodory te zawierają wiązanie podwójne C C wiązanie double podwójne bond the grupa functional funkcyjna group centrum
Slajd 1 Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka Slajd 2 Alkeny Węglowodory te zawierają wiązanie podwójne C C wiązanie double podwójne bond the grupa functional funkcyjna group centrum
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Reakcje alkoholi, eterów, epoksydów, amin i tioli
 22-24. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas Chemia rganiczna,
22-24. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas Chemia rganiczna,
Laboratorium. Podstawowe procesy jednostkowe w technologii chemicznej
 Laboratorium Podstawowe procesy jednostkowe w technologii chemicznej Studia niestacjonarne Ćwiczenie Alkilowanie toluenu chlorkiem tert-butylu 1 PROCESY ALKILOWANIA PIERŚCIENIA AROMATYCZNEGO: ALKILOWANIE
Laboratorium Podstawowe procesy jednostkowe w technologii chemicznej Studia niestacjonarne Ćwiczenie Alkilowanie toluenu chlorkiem tert-butylu 1 PROCESY ALKILOWANIA PIERŚCIENIA AROMATYCZNEGO: ALKILOWANIE
pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 )
 FLUOROWCOPOCODNE alogenki alkilowe- Cl C 2 -C 2 -C 2 -C 3 C 3 -C-C 3 C 2 -C-C 3 pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 ) I C 3 C 3 Cl-C 2 -C=C 2 Cl-C-C=C 2 1 2 3 Allilowe atom fluorowca
FLUOROWCOPOCODNE alogenki alkilowe- Cl C 2 -C 2 -C 2 -C 3 C 3 -C-C 3 C 2 -C-C 3 pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 ) I C 3 C 3 Cl-C 2 -C=C 2 Cl-C-C=C 2 1 2 3 Allilowe atom fluorowca
Wykład 8. Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.)
 Wykład 8 Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.) ALKOHOLE I FENOLE Związki o wzorze ogólnym R-OH. W fenolach grupa OH jest bezpośrednio związana z pierścieniem aromatycznum.
Wykład 8 Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.) ALKOHOLE I FENOLE Związki o wzorze ogólnym R-OH. W fenolach grupa OH jest bezpośrednio związana z pierścieniem aromatycznum.
Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO:
 FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
ALKENY WĘGLOWODORY NIENASYCONE
 Alkeny ALKENY WĘGLOWODORY NIENASYCONE WĘGLOWODORY ALIFATYCZNE SKŁĄDAJĄ SIĘ Z ATOMÓW WĘGLA I WODORU ZAWIERAJĄ JEDNO LUB KILKA WIĄZAŃ PODWÓJNYCH WĘGIEL WĘGIEL ATOM WĘGLA WIĄZANIA PODWÓJNEGO W HYBRYDYZACJI
Alkeny ALKENY WĘGLOWODORY NIENASYCONE WĘGLOWODORY ALIFATYCZNE SKŁĄDAJĄ SIĘ Z ATOMÓW WĘGLA I WODORU ZAWIERAJĄ JEDNO LUB KILKA WIĄZAŃ PODWÓJNYCH WĘGIEL WĘGIEL ATOM WĘGLA WIĄZANIA PODWÓJNEGO W HYBRYDYZACJI
Kwasy karboksylowe grupa funkcyjna: -COOH. Wykład 8 1
 Kwasy karboksylowe grupa funkcyjna: -CH Wykład 8 1 1. Reakcje utleniania a) utlenianie alkoholi pierwszorzędowych trzymywanie kwasów CH 3 H 3 C C CH 2 H CH 3 alkohol pierwszorzędowy CH K 2 Cr 2 3 7 H 3
Kwasy karboksylowe grupa funkcyjna: -CH Wykład 8 1 1. Reakcje utleniania a) utlenianie alkoholi pierwszorzędowych trzymywanie kwasów CH 3 H 3 C C CH 2 H CH 3 alkohol pierwszorzędowy CH K 2 Cr 2 3 7 H 3
Chemia organiczna. Mechanizmy reakcji chemicznych. Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego
 Chemia organiczna Mechanizmy reakcji chemicznych Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego 1 homoliza - homolityczny rozpad wiązania w jednym z reagentów; powstają produkty zawierające
Chemia organiczna Mechanizmy reakcji chemicznych Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego 1 homoliza - homolityczny rozpad wiązania w jednym z reagentów; powstają produkty zawierające
Addycje Nukleofilowe do Grupy Karbonylowej
 J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
Mechanizm dehydratacji alkoholi
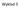 Wykład 5 Mechanizm dehydratacji alkoholi I. Protonowanie II. odszczepienie cząsteczki wody III. odszczepienie protonu Etap 1 Reakcje alkenów Najbardziej reaktywne jest wiązanie podwójne, lub jego sąsiedztwo
Wykład 5 Mechanizm dehydratacji alkoholi I. Protonowanie II. odszczepienie cząsteczki wody III. odszczepienie protonu Etap 1 Reakcje alkenów Najbardziej reaktywne jest wiązanie podwójne, lub jego sąsiedztwo
Spis treści Podstawowe dane Podział alkoholi alifatycznych Nazewnictwo systematyczne alkoholi Izomeria alkoholi Alkohole nasycone monohydroksylowe
 Spis treści Podstawowe dane Podział alkoholi alifatycznych Nazewnictwo systematyczne alkoholi Izomeria alkoholi Alkohole nasycone monohydroksylowe Właściwości fizyczne Otrzymywanie Przemysłowe metody otrzymywania
Spis treści Podstawowe dane Podział alkoholi alifatycznych Nazewnictwo systematyczne alkoholi Izomeria alkoholi Alkohole nasycone monohydroksylowe Właściwości fizyczne Otrzymywanie Przemysłowe metody otrzymywania
CH 3 OH C 2 H 5 OH H 3 C CH 2 CH 2 OH H 3 C CH CH 3 OH metanol etanol propan-1-ol propan-2-ol H 2 C CH 2 OH OH H 2 C CH CH 2 OH OH OH
 Alkohole Alkohole to związki organiczne, posiadające w cząsteczce przynajmniej jedną hydroksylową grupę funkcyjną ( ). Jeżeli grupa ta jest połączona bezpośrednio z pierścieniem aromatycznym, to taki związek
Alkohole Alkohole to związki organiczne, posiadające w cząsteczce przynajmniej jedną hydroksylową grupę funkcyjną ( ). Jeżeli grupa ta jest połączona bezpośrednio z pierścieniem aromatycznym, to taki związek
Zarys Chemii Organicznej
 Zarys hemii Organicznej hemię organiczną definiuje się jako chemię związków węgla. Ogólna liczba znanych związków organicznych przekracza obecnie 18 milionów i wielokrotnie przewyższa liczbę znanych związków
Zarys hemii Organicznej hemię organiczną definiuje się jako chemię związków węgla. Ogólna liczba znanych związków organicznych przekracza obecnie 18 milionów i wielokrotnie przewyższa liczbę znanych związków
Węglowodory aromatyczne (areny) to płaskie cykliczne związki węgla i wodoru. Areny. skondensowane liniowo. skondensowane kątowo
 Spis treści Podstawowe pojęcia Właściwości chemiczne benzenu Wielopierścieniowe węglowodory aromatyczne Homologi benzenu Nazewnictwo związków aromatycznych Występowanie i otrzymywanie arenów Węglowodory
Spis treści Podstawowe pojęcia Właściwości chemiczne benzenu Wielopierścieniowe węglowodory aromatyczne Homologi benzenu Nazewnictwo związków aromatycznych Występowanie i otrzymywanie arenów Węglowodory
Wykład 6. Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.)
 Wykład 6 Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.) Dieny Dieny są alkenami, których cząsteczki zawierają 2 podwójne wiązania C=C. Zasadnicze właściwości dienów są takie jak alkenów.
Wykład 6 Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.) Dieny Dieny są alkenami, których cząsteczki zawierają 2 podwójne wiązania C=C. Zasadnicze właściwości dienów są takie jak alkenów.
18. Reakcje benzenu i jego pochodnych
 18. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień benzenowy
18. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień benzenowy
Slajd 1. Reakcje alkinów
 Slajd 1 Reakcje alkinów Slajd 2 Alkiny to węglowodory zawierające wiązanie potrójne węgiel-węgiel Wzór ogólny: C n H 2n 2 (łańcuchowy); C n H 2n 4 (cykliczny) 1-heksyn terminalny alkin 3-heksyn wewnętrzny
Slajd 1 Reakcje alkinów Slajd 2 Alkiny to węglowodory zawierające wiązanie potrójne węgiel-węgiel Wzór ogólny: C n H 2n 2 (łańcuchowy); C n H 2n 4 (cykliczny) 1-heksyn terminalny alkin 3-heksyn wewnętrzny
2. Właściwości kwasowo-zasadowe związków organicznych
 2. Właściwości owo-zasadowe związków organicznych 1 2.1. Teoria Bronsteda-Lowriego Kwas - indywiduum chemiczne oddające proton Zasada - indywiduum chemiczne przyjmujące proton Proton - kation wodorkowy
2. Właściwości owo-zasadowe związków organicznych 1 2.1. Teoria Bronsteda-Lowriego Kwas - indywiduum chemiczne oddające proton Zasada - indywiduum chemiczne przyjmujące proton Proton - kation wodorkowy
AMINY. nikotyna. tytoń szlachetny. pseudoefedryna (SUDAFED) atropina. muskaryna H 3 C CH 3 O
 AMINY nikotyna H 3 C NH tytoń szlachetny OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN 2 NUKLEOFILOWOŚĆ i ZASADOWOŚĆ AMIN 3 REAKCJA AMIN Z KWASAMI MINERALNYMI I KARBOKSYLOWYMI
AMINY nikotyna H 3 C NH tytoń szlachetny OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN 2 NUKLEOFILOWOŚĆ i ZASADOWOŚĆ AMIN 3 REAKCJA AMIN Z KWASAMI MINERALNYMI I KARBOKSYLOWYMI
18 i 19. Substytucja nukleofilowa w halogenkach alkili
 8 i 9. Substytucja nukleofilowa w halogenkach alkili Związki pojadające wiązanie C (sp 3 )-atom o większej elektroujemności od at. C elektroujemny atom sp 3 polarne wiązanie 9.. Typowe reakcje halogenków
8 i 9. Substytucja nukleofilowa w halogenkach alkili Związki pojadające wiązanie C (sp 3 )-atom o większej elektroujemności od at. C elektroujemny atom sp 3 polarne wiązanie 9.. Typowe reakcje halogenków
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami
 Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami I. Otrzymywanie halogenowęglowodorów 1. Reakcje halogenacji (substytucji rodnikowej halogenów (Cl, ) na
Materiał powtórzeniowy do sprawdzianu - halogenowęglowodory + przykładowe zadania z rozwiązaniami I. Otrzymywanie halogenowęglowodorów 1. Reakcje halogenacji (substytucji rodnikowej halogenów (Cl, ) na
Wewnętrzna budowa materii
 Atom i układ okresowy Wewnętrzna budowa materii Atom jest zbudowany z jądra atomowego oraz krążących wokół niego elektronów. Na jądro atomowe składają się protony oraz neutrony, zwane wspólnie nukleonami.
Atom i układ okresowy Wewnętrzna budowa materii Atom jest zbudowany z jądra atomowego oraz krążących wokół niego elektronów. Na jądro atomowe składają się protony oraz neutrony, zwane wspólnie nukleonami.
C OH ALKOHOLE ETERY R OH R O R R' O FENOLE. Ar OH NOMENKLATURA ALKOHOLE ZWIĄZKI ORGANICZNE ZAWIERAJĄCE W STRUKTURZE ATOMY TLENU C O C OH CH 3 OH
 ZWIĄZKI GANIZNE ZAWIEAJĄE W STUKTUZE ATMY TLENU 8 1s2 2s 2 2p 4 okres 2; grupa VI w związkach jest dwuwiążący, z dwoma niewiążącymi parami elektronów drugi w skali elektroujemności Paulinga 3.5 (za fluorem)
ZWIĄZKI GANIZNE ZAWIEAJĄE W STUKTUZE ATMY TLENU 8 1s2 2s 2 2p 4 okres 2; grupa VI w związkach jest dwuwiążący, z dwoma niewiążącymi parami elektronów drugi w skali elektroujemności Paulinga 3.5 (za fluorem)
WĘGLOWODORY, ALKOHOLE, FENOLE. I. Wprowadzenie teoretyczne
 WĘGLWDRY, ALKHLE, FENLE I. Wprowadzenie teoretyczne Węglowodory Węglowodory są to połączenia organiczne zbudowane z atomów węgla i wodoru. Ze względu na różne sposoby łączenia się atomów węgla w tych związkach
WĘGLWDRY, ALKHLE, FENLE I. Wprowadzenie teoretyczne Węglowodory Węglowodory są to połączenia organiczne zbudowane z atomów węgla i wodoru. Ze względu na różne sposoby łączenia się atomów węgla w tych związkach
PRZYKŁADOWE ZADANIA ALKOHOLE I FENOLE
 PRZYKŁADOWE ZADANIA ALKOHOLE I FENOLE INFORMACJA DO ZADAŃ 864 865 Poniżej przedstawiono cykl reakcji zachodzących z udziałem związków organicznych. 1 2 cykloheksen cykloheksan chlorocykloheksan Zadanie
PRZYKŁADOWE ZADANIA ALKOHOLE I FENOLE INFORMACJA DO ZADAŃ 864 865 Poniżej przedstawiono cykl reakcji zachodzących z udziałem związków organicznych. 1 2 cykloheksen cykloheksan chlorocykloheksan Zadanie
Wykład 5 XII 2018 Żywienie
 Wykład 5 XII 2018 Żywienie Witold Bekas SGGW Chemia organiczna 1828 Wöhler - przypadkowa synteza mocznika izocyjanian amonu NH4NCO związek nieorganiczny mocznik H2NCONH2 związek organiczny obalenie teorii
Wykład 5 XII 2018 Żywienie Witold Bekas SGGW Chemia organiczna 1828 Wöhler - przypadkowa synteza mocznika izocyjanian amonu NH4NCO związek nieorganiczny mocznik H2NCONH2 związek organiczny obalenie teorii
Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup
 Cz. XXV - Kwasy karboksylowe Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup karboksylowych - CH ( - C - H ), atom C w grupie funkcyjnej jest na hybrydyzacji sp 2,
Cz. XXV - Kwasy karboksylowe Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup karboksylowych - CH ( - C - H ), atom C w grupie funkcyjnej jest na hybrydyzacji sp 2,
Reakcje związków karbonylowych zudziałem atomu węgla alfa (C- )
 34-37. eakcje związków karbonylowych zudziałem atomu węgla alfa (C- ) stabilizacja rezonansem (przez delokalizację elektronów), może uczestniczyć w delokalizacji elektronów C- -, podatny na oderwanie ze
34-37. eakcje związków karbonylowych zudziałem atomu węgla alfa (C- ) stabilizacja rezonansem (przez delokalizację elektronów), może uczestniczyć w delokalizacji elektronów C- -, podatny na oderwanie ze
Reakcje benzenu i jego pochodnych
 39-42. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień
39-42. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień
Wykład 19 XII 2018 Żywienie
 Wykład 19 XII 2018 Żywienie Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas
Wykład 19 XII 2018 Żywienie Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas SGGW Witold Bekas
Reakcje chemiczne. Typ reakcji Schemat Przykłady Reakcja syntezy
 Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
1. Katalityczna redukcja węglowodorów zawierających wiązania wielokrotne
 B T E C N L CEMA G RGANCZNA A Synteza 1. Katalityczna redukcja węglowodorów zawierających wiązania wielokrotne C C / Pt C C C C W reakcji tej łańcuch węglowy pozostaje zachowany (nie ulega zmianie jego
B T E C N L CEMA G RGANCZNA A Synteza 1. Katalityczna redukcja węglowodorów zawierających wiązania wielokrotne C C / Pt C C C C W reakcji tej łańcuch węglowy pozostaje zachowany (nie ulega zmianie jego
Fluorowcowęglowodory są to pochodne węglowodorów, gdzie jeden lub więcej atomów wodoru jest podstawione atomem fluorowca. Fluorowcowęglowodory mogą
 Fluorowcowęglowodory są to pochodne węglowodorów, gdzie jeden lub więcej atomów wodoru jest podstawione atomem fluorowca. Fluorowcowęglowodory mogą być alifatyczne i aromatyczne. Grupą funkcyjną dla tych
Fluorowcowęglowodory są to pochodne węglowodorów, gdzie jeden lub więcej atomów wodoru jest podstawione atomem fluorowca. Fluorowcowęglowodory mogą być alifatyczne i aromatyczne. Grupą funkcyjną dla tych
Materiały dodatkowe kwasy i pochodne
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe kwasy i pochodne Kwasy 1. Kwasowość Kwasy karboksylowe są kwasami o stosunkowo niewielkiej mocy. Ich stała dysocjacji
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe kwasy i pochodne Kwasy 1. Kwasowość Kwasy karboksylowe są kwasami o stosunkowo niewielkiej mocy. Ich stała dysocjacji
Mg I. I Mg. Nie można ich jednak otrzymać ze związków, które posiadają grupy chlorowcowe w tak zwanym ustawieniu wicynalnym.
 nformacje do zadań kwalifikacyjnych na "Analizę retrosyntetyczną" Urszula Chrośniak, Marcin Goławski Właściwe zadania znajdują się na stronach 9.-10. Strony 1.-8. zawieraja niezbędne informacje wstępne.
nformacje do zadań kwalifikacyjnych na "Analizę retrosyntetyczną" Urszula Chrośniak, Marcin Goławski Właściwe zadania znajdują się na stronach 9.-10. Strony 1.-8. zawieraja niezbędne informacje wstępne.
Stałe siłowe. Spektroskopia w podczerwieni. Spektrofotometria w podczerwieni otrzymywanie widm
 Spektroskopia w podczerwieni Spektrofotometria w podczerwieni otrzymywanie widm absorpcyjnych substancji o różnych stanach skupienia. Powiązanie widm ze strukturą pozwala na identyfikację związku. Widmo
Spektroskopia w podczerwieni Spektrofotometria w podczerwieni otrzymywanie widm absorpcyjnych substancji o różnych stanach skupienia. Powiązanie widm ze strukturą pozwala na identyfikację związku. Widmo
CHARAKTERYSTYKA KARBOKSYLANÓW
 AAKTEYSTYKA KABKSYLANÓW 1. GÓLNA AAKTEYSTYKA KWASÓW KABKSYLWY Spośród związków organicznych, które wykazują znaczną kwasowość najważniejsze są kwasy karboksylowe. Związki te zawierają w cząsteczce grupę
AAKTEYSTYKA KABKSYLANÓW 1. GÓLNA AAKTEYSTYKA KWASÓW KABKSYLWY Spośród związków organicznych, które wykazują znaczną kwasowość najważniejsze są kwasy karboksylowe. Związki te zawierają w cząsteczce grupę
ALDEHYDY, KETONY. I. Wprowadzenie teoretyczne
 ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
Alkeny - reaktywność
 11-13. Alkeny - reaktywność 1 6.1. Addycja elektrofilowa - wprowadzenie nukleofil elektrofil elektrofil nukleofil wolno szybko nowe wiązanie utworzone przez elektrony z wiązania nowe wiązanie utworzone
11-13. Alkeny - reaktywność 1 6.1. Addycja elektrofilowa - wprowadzenie nukleofil elektrofil elektrofil nukleofil wolno szybko nowe wiązanie utworzone przez elektrony z wiązania nowe wiązanie utworzone
Halogenki alkilowe RX
 alogenki alkilowe X Nazewnictwo halogenków alkilowych 1. Znajdź i nazwij łańcuch macierzysty. Tak jak przy nazywaniu alkanów, wybierz najdłuższy łańcuch. Jeżeli w cząsteczce obecne jest wiązanie podwójne
alogenki alkilowe X Nazewnictwo halogenków alkilowych 1. Znajdź i nazwij łańcuch macierzysty. Tak jak przy nazywaniu alkanów, wybierz najdłuższy łańcuch. Jeżeli w cząsteczce obecne jest wiązanie podwójne
Materiały dodatkowe - węglowodory
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe - węglowodory Alkany 1. Hybrydyzacja atomu węgla Mnogość związków, jakie mogą powstać z udziałem atomów węgla,
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe - węglowodory Alkany 1. Hybrydyzacja atomu węgla Mnogość związków, jakie mogą powstać z udziałem atomów węgla,
Podstawowe pojęcia i prawa chemiczne
 Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
KWASY KARBOKSYLOWE I ICH POCHODNE. R-COOH lub R C gdzie R = H, CH 3 -, C 6 H 5 -, itp.
 KWASY KARBKSYLWE I IH PHDNE I. Wprowadzenie teoretyczne Kwasy karboksylowe Kwasami organicznymi nazywamy związki, w których grupa funkcyjna H zwana grupą karboksylową jest związana z rodnikiem węglowodorowym
KWASY KARBKSYLWE I IH PHDNE I. Wprowadzenie teoretyczne Kwasy karboksylowe Kwasami organicznymi nazywamy związki, w których grupa funkcyjna H zwana grupą karboksylową jest związana z rodnikiem węglowodorowym
Alkohole to związki, w których grupy hydroksylowe przyłączone są do nasyconych atomów węgla o hybrydyzacji sp 3. COH
 Alkohole R Alkohole to związki, w których grupy hydroksylowe przyłączone są do nasyconych atomów węgla o hybrydyzacji sp 3. C Alkohole można uważać za organiczne pochodne wody --, w której jeden z atomów
Alkohole R Alkohole to związki, w których grupy hydroksylowe przyłączone są do nasyconych atomów węgla o hybrydyzacji sp 3. C Alkohole można uważać za organiczne pochodne wody --, w której jeden z atomów
Materiały dodatkowe związki karbonylowe
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe związki karbonylowe 1. Polaryzacja wiązania C= Charakterystyczną cechą związków posiadających grupę karbonylową
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe związki karbonylowe 1. Polaryzacja wiązania C= Charakterystyczną cechą związków posiadających grupę karbonylową
Reakcje związków karbonylowych. Maria Burgieł R R C O. C O + Nu E C
 eakcje związków karbonylowych Maria Burgieł Związki zawierające grupę = nazywamy związkami karbonylowymi. Do najprostszych związków karbonylowych należą aldehydy, w których grupa = jest połączona z jedną
eakcje związków karbonylowych Maria Burgieł Związki zawierające grupę = nazywamy związkami karbonylowymi. Do najprostszych związków karbonylowych należą aldehydy, w których grupa = jest połączona z jedną
Grupa karbonylowa. Grupa karbonylowa to grupa funkcyjna, w której atom tlenu połączony jest z atomem węgla podwójnym wiązaniem
 ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
Wiązania jonowe występują w układach złożonych z atomów skrajnie różniących się elektroujemnością.
 105 Elektronowa teoria wiązania chemicznego Cząsteczki powstają w wyniku połączenia się dwóch lub więcej atomów. Już w początkowym okresie rozwoju chemii podejmowano wysiłki zmierzające do wyjaśnienia
105 Elektronowa teoria wiązania chemicznego Cząsteczki powstają w wyniku połączenia się dwóch lub więcej atomów. Już w początkowym okresie rozwoju chemii podejmowano wysiłki zmierzające do wyjaśnienia
trzeciorzędowe (3 ) (CH 3 ) 3 COH tert-butanol
 ALKOLE I FENOLE ALKOLE - KLASYFIKACJA pierwszorzędowe (1 ) drugorzędowe (2 ) trzeciorzędowe (3 ) allilowe benzylowe CH 2 etanol ( ) 2 CH alkohol izopropylowy ( ) 3 C tert-butanol CH 2 =CHCH 2 alkohol allilowy
ALKOLE I FENOLE ALKOLE - KLASYFIKACJA pierwszorzędowe (1 ) drugorzędowe (2 ) trzeciorzędowe (3 ) allilowe benzylowe CH 2 etanol ( ) 2 CH alkohol izopropylowy ( ) 3 C tert-butanol CH 2 =CHCH 2 alkohol allilowy
Ćwiczenie 3. Otrzymywanie i badanie właściwości chemicznych alkanów, alkenów, alkinów i arenów.
 Ćwiczenie 3. Otrzymywanie i badanie właściwości chemicznych alkanów, alkenów, alkinów i arenów. Wprowadzenie teoretyczne Cel ćwiczeń: Poznanie metod otrzymywania oraz badania właściwości węglowodorów alifatycznych
Ćwiczenie 3. Otrzymywanie i badanie właściwości chemicznych alkanów, alkenów, alkinów i arenów. Wprowadzenie teoretyczne Cel ćwiczeń: Poznanie metod otrzymywania oraz badania właściwości węglowodorów alifatycznych
Alkohole i fenole Grupa funkcyjna OH
 Alkohole i fenole Grupa funkcyjna OH Alkohole - związki posiadające grupę funkcyjną "z prawdziwego zdarzenia" - grupę główną. Wiązanie podwójne (lub potrójne) C-C zaliczane jest do grup funkcyjnych, ale
Alkohole i fenole Grupa funkcyjna OH Alkohole - związki posiadające grupę funkcyjną "z prawdziwego zdarzenia" - grupę główną. Wiązanie podwójne (lub potrójne) C-C zaliczane jest do grup funkcyjnych, ale
WĘGLOWODORY AROMATYCZNE
 WĘGLOWODORY AROMATYCZNE cykliczne węglowodory spełniające warunki aromatyczności: Ale: związki niearomatyczne 1 ZWIĄZKI AROMATYCZNE - przykłady 2 NOMENKLATURA Monocykliczne węglowodory aromatyczne są nazywane
WĘGLOWODORY AROMATYCZNE cykliczne węglowodory spełniające warunki aromatyczności: Ale: związki niearomatyczne 1 ZWIĄZKI AROMATYCZNE - przykłady 2 NOMENKLATURA Monocykliczne węglowodory aromatyczne są nazywane
Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego ĆWICZENIE 5. Związki aromatyczne
 ĆWICENIE 5 wiązki aromatyczne wiązki aromatyczne są związkami pierścieniowymi o płaskich cząsteczkach zawierających zgodnie z regułą uckla (4n2) elektrony π (n=0,1,2, ). Przedstawicielem takich związków
ĆWICENIE 5 wiązki aromatyczne wiązki aromatyczne są związkami pierścieniowymi o płaskich cząsteczkach zawierających zgodnie z regułą uckla (4n2) elektrony π (n=0,1,2, ). Przedstawicielem takich związków
Wykład przygotowany w oparciu o podręczniki:
 Slajd 1 Wykład przygotowany w oparciu o podręczniki: Organic Chemistry 4 th Edition Paula Yurkanis Bruice Slajd 2 Struktura elektronowa wiązanie chemiczne Kwasy i zasady Slajd 3 Chemia organiczna Związki
Slajd 1 Wykład przygotowany w oparciu o podręczniki: Organic Chemistry 4 th Edition Paula Yurkanis Bruice Slajd 2 Struktura elektronowa wiązanie chemiczne Kwasy i zasady Slajd 3 Chemia organiczna Związki
Chemia węgla. Chemia Wydział SiMR, kierunek IPEiH I rok I stopnia studiów, semestr I. Chemia organiczna - podstawy
 hemia Wydział SiMR, kierunek IPEi I rok I stopnia studiów, semestr I dr inż. Leszek iedzicki hemia organiczna - podstawy hemia węgla hemia organiczna to chemia związków węgla. Inne pierwiastki, które zwykle
hemia Wydział SiMR, kierunek IPEi I rok I stopnia studiów, semestr I dr inż. Leszek iedzicki hemia organiczna - podstawy hemia węgla hemia organiczna to chemia związków węgla. Inne pierwiastki, które zwykle
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas II LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania
 Cz. I Materiał powtórzeniowy do sprawdzianu dla klas II LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas II LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
Spis treści. Nazewnictwo kwasów karboksylowych.
 Do tej klasy zaliczamy związki zawierające grupę karboksylową, zapisywaną w skrócie jako COOH. W tej grupie karbonylowy atom węgla jest związany dodatkowo z grupą hydroksylową. Z uwagi na hybrydyzację
Do tej klasy zaliczamy związki zawierające grupę karboksylową, zapisywaną w skrócie jako COOH. W tej grupie karbonylowy atom węgla jest związany dodatkowo z grupą hydroksylową. Z uwagi na hybrydyzację
LCH 1 Zajęcia nr 60 Diagnoza końcowa. Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach:
 LCH 1 Zajęcia nr 60 Diagnoza końcowa Zadanie 1 (3 pkt) Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach: H 3 C CH 2 CH 2 CH 2 CH 2 a) b) W tym celu: a) wybierz odpowiedni
LCH 1 Zajęcia nr 60 Diagnoza końcowa Zadanie 1 (3 pkt) Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach: H 3 C CH 2 CH 2 CH 2 CH 2 a) b) W tym celu: a) wybierz odpowiedni
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas I LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania
 Cz. I Materiał powtórzeniowy do sprawdzianu dla klas I LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas I LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
Chemia organiczna to chemia związków węgla.
 Chemia organiczna to chemia związków węgla. Do tej pory wyizolowano lub zsyntetyzowano kilkanaście milionów związków organicznych. Na dużą różnorodność chemii organicznej mają wpływ: średnia elektroujemność
Chemia organiczna to chemia związków węgla. Do tej pory wyizolowano lub zsyntetyzowano kilkanaście milionów związków organicznych. Na dużą różnorodność chemii organicznej mają wpływ: średnia elektroujemność
Aminy. - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin
 Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Projekt Era inżyniera pewna lokata na przyszłość jest współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
 TEMAT I WYBRANE WŁAŚCIWOŚCI ZWIĄZKÓW NIEORGANICZNYCH. STOPNIE UTLENIENIA. WIĄZANIA CHEMICZNE. WZORY SUMARYCZNE I STRUKTURALNE. TYPY REAKCJI CHEMICZNYCH. ILOŚCIOWA INTERPRETACJA WZORÓW I RÓWNAŃ CHEMICZNYCH
TEMAT I WYBRANE WŁAŚCIWOŚCI ZWIĄZKÓW NIEORGANICZNYCH. STOPNIE UTLENIENIA. WIĄZANIA CHEMICZNE. WZORY SUMARYCZNE I STRUKTURALNE. TYPY REAKCJI CHEMICZNYCH. ILOŚCIOWA INTERPRETACJA WZORÓW I RÓWNAŃ CHEMICZNYCH
1 Marek Żylewski. Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii Organicznej. NO 2 Zn, HCl HNO 3 N H 2. NH 2 Na 2. S x CHO.
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe związki azotowe Związki nitrowe 1. Redukcja związków nitrowych. Grupa nitrowa jest bardzo podatna na działanie
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe związki azotowe Związki nitrowe 1. Redukcja związków nitrowych. Grupa nitrowa jest bardzo podatna na działanie
PODSTAWY CHEMII INŻYNIERIA BIOMEDYCZNA. Wykład 2
 PODSTAWY CEMII INŻYNIERIA BIOMEDYCZNA Wykład Plan wykładu II,III Woda jako rozpuszczalnik Zjawisko dysocjacji Równowaga w roztworach elektrolitów i co z tego wynika Bufory ydroliza soli Roztwory (wodne)-
PODSTAWY CEMII INŻYNIERIA BIOMEDYCZNA Wykład Plan wykładu II,III Woda jako rozpuszczalnik Zjawisko dysocjacji Równowaga w roztworach elektrolitów i co z tego wynika Bufory ydroliza soli Roztwory (wodne)-
Związki chemiczne, wiązania chemiczne, reakcje
 Związki chemiczne, wiązania chemiczne, reakcje Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna
Związki chemiczne, wiązania chemiczne, reakcje Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna
Izomeria. isos - taki sam meros -części
 Izomeria isos - taki sam meros -części Izomery związki, które zawierają taką samą liczbę i rodzaj atomów w cząsteczce, ale różnią się sposobem ułożenia tych atomów. Mają taki sam wzór sumaryczny. 6 12
Izomeria isos - taki sam meros -części Izomery związki, które zawierają taką samą liczbę i rodzaj atomów w cząsteczce, ale różnią się sposobem ułożenia tych atomów. Mają taki sam wzór sumaryczny. 6 12
Zagadnienia. Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I
 Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
ZWIĄZKI FOSFOROORGANICZNE
 ZWIĄZKI FSFGANICZNE Związki fosforoorganiczne związki zawierające wiązanie węgiel-fosfor (C-) Wiązanie fosfor-wodór (-H; 77 kcal/mol) jest słabsze niż wiązanie azot-wodór (N-H; 93.4 kcal/mol). Wiązanie
ZWIĄZKI FSFGANICZNE Związki fosforoorganiczne związki zawierające wiązanie węgiel-fosfor (C-) Wiązanie fosfor-wodór (-H; 77 kcal/mol) jest słabsze niż wiązanie azot-wodór (N-H; 93.4 kcal/mol). Wiązanie
Izomeria. isos - taki sam meros -części
 Izomeria isos - taki sam meros -części Izomery związki, które zawierają taką samą liczbę i rodzaj atomów w cząsteczce, ale różnią się sposobem ułożenia tych atomów. Mają taki sam wzór sumaryczny. 6 12
Izomeria isos - taki sam meros -części Izomery związki, które zawierają taką samą liczbę i rodzaj atomów w cząsteczce, ale różnią się sposobem ułożenia tych atomów. Mają taki sam wzór sumaryczny. 6 12
Chemia - B udownictwo WS TiP
 Chemia - B udownictwo WS TiP dysocjacja elektrolityczna, reakcje w roztworach wodnych, ph wykład nr 2b Teoria dys ocjacji jonowej Elektrolity i nieelektrolity Wpływ polarnej budowy cząsteczki wody na proces
Chemia - B udownictwo WS TiP dysocjacja elektrolityczna, reakcje w roztworach wodnych, ph wykład nr 2b Teoria dys ocjacji jonowej Elektrolity i nieelektrolity Wpływ polarnej budowy cząsteczki wody na proces
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Zdzisław Głowacki Chemia organiczna 2b Zakres podstawowy i rozszerzony Odpowiedzi i rozwiązania zadań Rozdział 5
 Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 5 Errata do piątego rozdziału ćwiczeń: Strona Linia zadanie Jest Powinno być Str. 109 Str.
Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 5 Errata do piątego rozdziału ćwiczeń: Strona Linia zadanie Jest Powinno być Str. 109 Str.
-pinen (składnik terpentyny)
 ALKENY (OLEFINY) WZÓR SUMARYZNY n 2n - alkeny łańcuchowe; n 2n-2 - alkeny cykliczne (cykloalkeny) etylen (produkcja polietylenu) WŁAŚIWOŚI FIZYZNE -pinen (składnik terpentyny) cis-trikoz-9-en (hormon płciowy
ALKENY (OLEFINY) WZÓR SUMARYZNY n 2n - alkeny łańcuchowe; n 2n-2 - alkeny cykliczne (cykloalkeny) etylen (produkcja polietylenu) WŁAŚIWOŚI FIZYZNE -pinen (składnik terpentyny) cis-trikoz-9-en (hormon płciowy
WARSZTATY olimpijskie. Co już było: Atomy i elektrony Cząsteczki i wiązania Stechiometria Gazy, termochemia Równowaga chemiczna Kinetyka
 WARSZTATY olimpijskie Co już było: Atomy i elektrony Cząsteczki i wiązania Stechiometria Gazy, termochemia Równowaga chemiczna inetyka WARSZTATY olimpijskie Co będzie: Data Co robimy 1 XII 2016 wasy i
WARSZTATY olimpijskie Co już było: Atomy i elektrony Cząsteczki i wiązania Stechiometria Gazy, termochemia Równowaga chemiczna inetyka WARSZTATY olimpijskie Co będzie: Data Co robimy 1 XII 2016 wasy i
Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r.
 Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r. Lp. Temat lekcji 1. Szereg homologiczny alkanów. 2. Izomeria konstytucyjna w alkanach. 3.
Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r. Lp. Temat lekcji 1. Szereg homologiczny alkanów. 2. Izomeria konstytucyjna w alkanach. 3.
