C OH ALKOHOLE ETERY R OH R O R R' O FENOLE. Ar OH NOMENKLATURA ALKOHOLE ZWIĄZKI ORGANICZNE ZAWIERAJĄCE W STRUKTURZE ATOMY TLENU C O C OH CH 3 OH
|
|
|
- Danuta Adamska
- 8 lat temu
- Przeglądów:
Transkrypt
1 ZWIĄZKI GANIZNE ZAWIEAJĄE W STUKTUZE ATMY TLENU 8 1s2 2s 2 2p 4 okres 2; grupa VI w związkach jest dwuwiążący, z dwoma niewiążącymi parami elektronów drugi w skali elektroujemności Paulinga 3.5 (za fluorem) z węglem tworzy wiązania kowalencyjne, spolaryzowane GUPA KABNYLWA GUPA YDKSYLWA ALKLE ETEY / = alkil / = alkil ' sp 3 FENLE Ar Ar / Ar = aryl / Ar = aryl / Ar = aryl Ar Ar Ar sp 2 ALKLE NMENKLATUA nazwa najdłuższego łańcucha zawierającego grupę hydroksylową staje się rdzeniem, do którego dodaje się końcówkę -ol 3 metanol ,4-dimetylo-1-pentanol lokant atomu węgla połączonego z grupą hydroksylową jak najniższy penten-2- ol 2 alkohol benzylowy 1 4-fenylo-2-pentanol alkohol tert-butylowy 3 2-metylo-2-propanol 1
2 ALKLE NMENKLATUA gdy w związku jest więcej grup hydroksylowych przed końcówką ol dodaje się łaciński liczebnik mówiący o ilości grup hydroksylowych, np. diol, -triol, itd ,2-etanodiol 1,3-butanodiol glikol etylenowy 22 1,2,3-propanotriol gliceryna trans-1,3-cykloheksanodiol cis-1,3-cyklopentanodiol 1,2,4,5-cykloheksanotetraol FENLE NMENKLATUA zwykle nazywane jako pochodne związku macierzystego l o-chlorofenol Br 3 o-krezol Br FENL Br 2,4,6-tribromofenol 3 m-krezol 2N p-nitrofenol 3 p-krezol WŁAŚIWŚI FIZYZNE ALKLE sp 3 wiązania i są kowalencyjne i spolaryzowane α kąt walencyjny α µ = 1.5 D cząsteczka posiada wypadkowy moment dipolowy cząsteczki alkoholi oddziałują ze sobą wiązaniami wodorowymi WIĄZANIA WDWE 2
3 WŁAŚIWŚI FIZYZNE ALKLE WIĄZANIA WDWE kj/mol : wysokie temperatury wrzenia M cz t w t w dobra rozpuszczalność w wodzie charakter hydrofilowy WŁAŚIWŚI FIZYZNE WŁAŚIWŚI YDFILWE ALKLE g/100ml g/100ml 2 WŁAŚIWŚI YDFBWE TZYMYWANIE ALKLE 1. TZYMYWANIE ALKLI Z ALKENÓW ADDYJA BWDU D ALKENU YDBWANIE ALKENÓW 2 2 / - B 2 B δ B2 + δ tzw. ANTYMAKWNIKW alkohol niżej rzędowy KSYTĘIWANIE ALKENÓW g(3 - )2 TF NaB 4 - g( 3) alkohol wyżej rzędowy 3
4 TZYMYWANIE ALKLE 1. TZYMYWANIE ALKLI Z ALKENÓW PZYKŁADY 1. g(ac) 2 / TF 2 2. NaB 4, ,3-dimetylo-1-buten ,3-dimetylo-2-butanol 3 1. (B 3 ) , ,3-dimetylo-1-butanol TZYMYWANIE ALKLE 1. TZYMYWANIE ALKLI Z ALKENÓW PZYKŁADY 1. g(ac) 2 / TF 2 2. NaB 4, metylocykloheksanol metylocykloheksen 1. (B 3 ) , - 3 trans-2-metylocykloheksanol TZYMYWANIE ALKLE 2. TZYMYWANIE ALKLI Z ALGENALKANÓW hydroliza halogenków alkilowych I Br l S N + I - Br - l - 4
5 TZYMYWANIE ALKLE 3. TZYMYWANIE ALKLI ZE ZWIĄZKÓW KABNYLWY redukcja ketonów ' [] ' []: 2, Ni NaB 4 reakcja przyłączania związków metaloorganicznych do grupy karbonylowej 3 I Mg, eter δ δ+ 3 MgI ' 3 ' - Mg + l/ 2 3 ' WŁAŚIWŚI EMIZNE ALKLE +δ δ +δ ZASADA / NUKLEFIL A + A silny kwas protonowany alkohol kation oksoniowy S N nukleofil protonowany alkohol 2+ dobra grupa odchodząca protonowany eter kation oksoniowy WŁAŚIWŚI EMIZNE ALKLE 1. WŁAŚIWŚI KWASW ZASADWE ALKLI ALKL słaby kwas K a K (Na) 2 - Na WDA K a ALKL słabszy kwas niż WDA - Na Na ALKL silniejszy kwas niż AMNIAK + NaN 2 - Na + + N 3 5
6 WŁAŚIWŚI EMIZNE ALKLE 1. WŁAŚIWŚI KWASW ZASADWE ALKLI KWASWŚĆ ZASADWŚĆ WŁAŚIWŚI EMIZNE ALKLE 1. WŁAŚIWŚI KWASW ZASADWE ALKLI EAKJE ALKLI Z KWASAMI NIEGANIZNYMI, np. 2 S 4 3 ( 2 ) ( 2 ) 3 2 3(2)3 2 S N E 322=2 + 3(2)3 2 2 () (2)3 2 2 ()33 WŁAŚIWŚI EMIZNE ALKLE 1. WŁAŚIWŚI KWASW ZASADWE ALKLI EAKJE ALKLI Z KWASAMI GANIZNYMI, np K ESTE K = [ESTE] [ 2 ] [] [ 2 ] 6
7 WŁAŚIWŚI EMIZNE ALKLE 1. WŁAŚIWŚI KWASW ZASADWE ALKLI EAKJE ALKLI Z KWASAMI ALGENWDAMI, np. l, Br 2 + X X X: I, Br, l 2 X + 2 PZYKŁADY l 3 l % 3 3 chlorek tert-butylu (3)22 + Br 95% ( 3 ) 2 2 Br + 2 bromek pentylu WŁAŚIWŚI EMIZNE ALKLE 2. EAKJE ALKLI Z ALGENKAMI FSFU I SIAKI 3 + PBr 3 3 Br + 3 P 3 dla alkoholi 1 i 2 + Pl 5 l + Pl Sl 2 l + S 2 + l PZYKŁADY 2 Sl 2 2l + S2 + l 91% chlorek benzylu ( 3 ) , 4h + PBr 5 60% ( 3) 2 2 Br + 3P 3 bromek izobutylu WŁAŚIWŚI EMIZNE ALKLE 3. EAKJE UTLENIANIA ALKLI dla alkoholi 1 r 3 l Pyr P [] : u, 300 r 3 KMn 4, 2, [] [] dla alkoholi 2 [] 7
8 FENLE WYSTĘPWANIE Urusiole substancje parząca izolowane z toksyn bluszczu gdzie = ( 2) 14 3 ( 2) 7=( 2) 5 3 ( 2) 7= 2=( 2) 2 3 aminokwas tyrozyna N N 2 żeński hormon płciowy estradiol Y 3 Z N(3) 2 gdzie Y = l, Z = aureomycyna Y =, Z = terramycyna antybiotyki z rodziny tetracyklin TZYMYWANIE FENLE 1. IZLWANIE FENLI ZE ŹÓDEŁ NATUALNY 3 3 EUGENL goździki 3 IZEUGENL gałka muszkatołowa TYML mięta, tymianek 2. IZLWANIE FENLI ZE SMŁY PGAZWEJ podczas suchej destylacji węgla 3 3 fenol 3 o-, m-, p-krezol TZYMYWANIE FENLE 3. YDLIZA ALGENKÓW AMATYZNY D FENLI X 10% Na 350, 200 atm - Na + 2 / 2 -Na 3 X: Br lub l dla podstawionych halogenków arylowych reakcja niejednoznaczna X 1. Na, 2. 2, 2 + o- oraz m-krezol 8
9 TZYMYWANIE FENLE 4. STAPIANIE SLI AENSULFNWY Z ALKALIAMI - + S3 Na staly Na Na + 2 / 2 -Na 3 5. TZYMYWANIE FENLI PPZEZ SLE DIAZNIWE NaN 2/ l N 2, N2 + 2 l N2 6. TZYMYWANIE FENLU METDĄ KUMENWĄ + 3P 4 3=2 SE (3)2 2 powietrze 3 3 KUMEN 3 2S FENL 3 AETN WŁAŚIWŚI EMIZNE FENLE 1. WŁAŚIWŚI KWASW ZASADWE FENLI FENLE silniejsze kwasy od alkoholi i wody JN ALKLANWY JN FENLANWY ALE + Na Na + 2 pka FENL 9.89 WDA ( 3 ) Na BAK EAKJI WŁAŚIWŚI EMIZNE FENLE 2. EAKJE ALKILWANIA FENLI Na S N Na I NaI ANIZL (metoksybenzen) Na 23 Na I 2 3 S N + NaI p-etoksytoluen 9
10 WŁAŚIWŚI EMIZNE FENLE 3. EAKJE AYLWANIA FENLI I 3 + l octan fenylu UWAGA + BAK EAKJI WŁAŚIWŚI EMIZNE FENLE 4. EAKJE S Earom FENLI PDSTAWNIK I DZAJU kieruje następny podstawnik w pozycje o- i p- aktywuje na reakcje S Earom EAKTYWNŚĆ W EAKJI S Earom WŁAŚIWŚI EMIZNE FENLE 4. EAKJE S Earom FENLI Br 2 / 2 Br Br Br 2,4,6-tribromofenol 96% 2 S 4 temp. pokoj. kwas o- i p-hydroksybenzenosulfonowy S3 + S3 20% N N 2 + 2N 2N N2 N 2 kwas pikrynowy 10
11 WŁAŚIWŚI EMIZNE FENLE 5. EAKJE UTLENIANIA FENLI Mn VI lub r VI e - -2e - ETEY / = alkil / Ar = aryl ' Ar Ar Ar SYMETYZNE, np. 3 3 NIESYMETYZNE, np. 23 YKLIZNE, np. TETAYDFUAN KSIAN 1,4-DIKSAN NMENKLATUA ETEY nazwy tworzy się zazwyczaj przez podanie po słowie eter nazw dwóch grup w formie przymiotnikowej wg kolejności alfabetycznej ETE ETYLWMETYLWY ETE DIETYLWY 3 ETE tert-butylwfenylwy METKSYETAN ETKSYETAN tert-butksybenzen IUPA jeżeli jedna z grup nie ma prostej nazwy, to należy związek traktować jako pochodną alkoksylową ,3,5-TIMETKSYBENZEN 23 trans-3-etksyykleksanl 2-ETKSYPENTAN 11
12 WŁAŚIWŚI FIZYZNE ETEY wiązania są kowalencyjne i spolaryzowane α kąt walencyjny α 110 cząsteczka posiada wypadkowy moment dipolowy µ = 1.2D; jest słabo polarna temp. wrzenia eterów są zbliżone do temp. wrzenia alkanów o tej samej masie cząsteczkowej Mcz 1-butanol eter dietylowy pentan tw cząsteczki eterów o małych podstawnikach są solwatowane przez cząsteczki wody; ale już eter dietylowy jest nierozpuszczalny w wodzie; wyjątek: etery cykliczne ETEY SĄ NIEEAKTYWNE EMIZNIE TZYMYWANIE ETEY 1. SYNTEZA WILLIAMSNA TZYMYWANIA ETEÓW METDA UNIWESALNA Na ' lub Ar Na + ' X lub Ar ' + X X: l, Br, I : 3 > 1 > 2 TZYMYWANIE ETEY 1. SYNTEZA WILLIAMSNA TZYMYWANIA ETEÓW 1 ( 3) 2 Na Br SN ( 3 ) (3)2 Br + 32 Na E NaBr 12
13 TZYMYWANIE ETEY 1. SYNTEZA WILLIAMSNA TZYMYWANIA ETEÓW 3 2 2Br + Na SN NaBr Na + Br NIEULIWY LWIE TZYMYWANIE ETEY 1. SYNTEZA WILLIAMSNA TZYMYWANIA ETEÓW PZYKŁADY Na 3 2 Na + 2Br NaBr ETE BENZYLWETYLWY ETE FENYLWIZBUTYLWY Na Na + ( 3) 2 2Br 2(3)2 + NaBr TZYMYWANIE ETEY 2. TZYMYWANIE ETEÓW SYMETYZNY PZEZ DWDNIENIE ALKLI 3(2)22 rozc. 2S 4 t < 130 3(2)222 3( 2) 2 2 SN t <130 E t > (2)22 2(2) ( 2) 2 2 2( 2)
14 ETEY WŁAŚIWŚI EMIZNE 1. EAKJE AYDLIZY ETEÓW, tzw. rozszczepianie eterów pod działaniem kwasów MNE KWASY: Br lub I ANINY BADZ DBE NUKLEFILE ' + X ' + X X + ' ' X + 2 X Ar + X X + Ar Ar Ar + X ETEY WŁAŚIWŚI EMIZNE 2. EAKJE AUTKSYDAJI ETEÓW dotyczy eterów z α α 2 + n ETEY YKLIZNE EPKSYDY TZYMYWANIE 1. EAKJA KATALITYZNEG UTLENIANIA ETENU TLENEM (z powietrza) 2 2 2, Ag EAKJA WEWNĄTZZĄSTEZKWEJ S N ALGENYDYN (wobec stężonych zasad) 2 3 l2/2 2 3 S N 2 3 l 14
15 EPKSYDY TZYMYWANIE 3. EAKJA UTLENIANIA ALKENÓW NADKWASAMI 3 3 l E trans-epksybutan tlenek trans-2-butenu Z 3 3 l cis-epksybutan tlenek cis-2-butenu EPKSYDY EAKJE TWIEANIA PIEŚIENIA 1. EAKJE TWIEANIA PIEŚIENIA KATALIZWANE KWASAMI Nu + + ADDYJA anti- Nu Nu - + EPKSYDY EAKJE TWIEANIA PIEŚIENIA 1. EAKJE TWIEANIA PIEŚIENIA KATALIZWANE KWASAMI Br 2 2 Br / bromoetanol 1,2-etanodiol 2 5 / + / etoksyetanol fenoksyetanol 15
16 EPKSYDY EAKJE TWIEANIA PIEŚIENIA 2. EAKJE TWIEANIA PIEŚIENIA KATALIZWANE ZASADAMI 2 + EPKSYDY EAKJE TWIEANIA PIEŚIENIA PÓWNANIE EPKSYDY EAKJE TWIEANIA PIEŚIENIA EPKSYD NIESYMETYZNY + /Et Et Et Et 2-ETKSY-2-METYL-1-PPANL Et - /Et Et Et 3 3 Et 2 + Et - 1-ETKSY-2-METYL-2-PPANL 16
17 JAK ZPUSZZALNIKI ETEY ZWIĄZKI MAGNEZGANIZNE tzw. ZWIĄZKI GIGNADA TZYMYWANIE ZWIĄZKÓW GIGNADA ZPUSZZALNIK X + Mg MgX ZPUSZZALNIK tw 36 TF tw 54 X EAKTYWNŚĆ allil, benzyl alkil aryl winyl I Br l EAKTYWNŚĆ STUKTUA ZWIĄZKÓW GIGNADA X Et Et 2 Mg Mg X Et Et MgX δ +δ 2 MgX WIĄZANIE KWALENYJNE SPLAYZWANE EAKJE ZWIĄZKÓW GIGNADA 1. ULIWY WDÓ 2 MgX MgX() 2 MgX MgX() 2 MgX + N MgX(N 2 ) 2 MgX MgX() 2 MgX MgX + 17
18 EAKJE ZWIĄZKÓW GIGNADA 2. PIEWIASTKI l/ 2 MgX MgX Mgl 2 l/ 2 MgX + S 8 2 S MgX 2 2 S + Mgl 2 2 MgX + I 2 2 I + MgX 2 3. EPKSYDY MgX 2 2 l/ Mgl2 MgX EAKJE ZWIĄZKÓW GIGNADA 4. ZWIĄZKI KABNYLWE +δ δ δ +δ + MgX MgX 3 + / 2 PZYKŁADY + 3Mgl Mgl 3 l 3 + Mgl Mgl 3 Mgl 23 l 3 + Mgl Mgl 3 Mgl l Mgl EAKJE ZWIĄZKÓW GIGNADA 4. ZWIĄZKI KABNYLWE PDSUMWANIE METANAL 2 = + MgX 2 ALKL 1 ALDEYDY + MgX ' ALKL 2 KETNY " + MgX " ' ALKL 3 DWUTLENEK WĘGLA == + MgX KWAS KABKSYLWY 18
19 EAKJE ZWIĄZKÓW GIGNADA 5. PDNE KWASWE + 3Mgl Z Mgl 3 3 l 3 + Mgl 2 3 gdzie: Z = l, ETEY KNWE [x]korona-y gdzie x - liczba atomów tworzących pierścień y liczba atomów tlenu w pierścieniu [18]korona-6 dibenzo[18]korona-6 [12]korona-4 [15]korona-5 tt tt. 164 tt. 16 ciecz ETEY KNWE średnica niszy nm średnica jonu Na nm średnica jonu K + średnica jonu s nm nm jon K + jest kompleksowany K + Mn 4-19
20 ETEY KNWE NNAKTYNA selektywnie kompleksuje jony K + selektywny transport jonów potasu przez membrany komórkowe 20
FENOLE FENOLE FENOLE FENOLE WYSTĘPOWANIE NOMENKLATURA NOMENKLATURA OTRZYMYWANIE 1. IZOLOWANIE FENOLI ZE ŹRÓDEŁ NATURALNYCH H3C
 MEKLATUA FELE MEKLATUA MEKLATUA ZWYZAJWA FELE 7 6 8 3 3 3 X FEL FELE α AFTL β AFTL 5 9 10 4 3 1 2 9-FEATL 2-METYLFEL (o-kezl) 3-METYLFEL (m-kezl) 4-METYLFEL (p-kezl) MEKLATUA YTEMATYZA 2 4-BMFEL (para)
MEKLATUA FELE MEKLATUA MEKLATUA ZWYZAJWA FELE 7 6 8 3 3 3 X FEL FELE α AFTL β AFTL 5 9 10 4 3 1 2 9-FEATL 2-METYLFEL (o-kezl) 3-METYLFEL (m-kezl) 4-METYLFEL (p-kezl) MEKLATUA YTEMATYZA 2 4-BMFEL (para)
Halogenki alkilowe RX
 alogenki alkilowe X Nazewnictwo halogenków alkilowych 1. Znajdź i nazwij łańcuch macierzysty. Tak jak przy nazywaniu alkanów, wybierz najdłuższy łańcuch. Jeżeli w cząsteczce obecne jest wiązanie podwójne
alogenki alkilowe X Nazewnictwo halogenków alkilowych 1. Znajdź i nazwij łańcuch macierzysty. Tak jak przy nazywaniu alkanów, wybierz najdłuższy łańcuch. Jeżeli w cząsteczce obecne jest wiązanie podwójne
Slajd 1. Etery i epoksydy. Slajd 2. Wprowadzenie. Wzór R-O-R, gdzie R tos alkil lub aryl Symetryczne lub asymetryczne Przykłady: CH 3 O CH 3 O CH 3
 Slajd 1 Etery i epoksydy Slajd 2 Wprowadzenie Wzór R--R, gdzie R tos alkil lub aryl Symetryczne lub asymetryczne Przykłady: C 3 C 3 C 3 Slajd 3 Budowa i polarność Wygięta struktura Atom tlenu posiada hybrydyzacjęsp
Slajd 1 Etery i epoksydy Slajd 2 Wprowadzenie Wzór R--R, gdzie R tos alkil lub aryl Symetryczne lub asymetryczne Przykłady: C 3 C 3 C 3 Slajd 3 Budowa i polarność Wygięta struktura Atom tlenu posiada hybrydyzacjęsp
Slajd 1. Alkohole i fenole. Cholesterol. Slajd 2. Budowa alkoholi. metanol. metanol. Grupą funkcyjną jest (OH) Tlen posiada hybrydyzacjęsp 3
 Slajd 1 Alkohole i fenole Cholesterol Slajd 2 Budowa alkoholi woda woda metanol metanol Grupą funkcyjną jest () Tlen posiada hybrydyzacjęsp 3 Slajd 3 Podział alkoholi Pierwszorzędowe: grupa połączona jest
Slajd 1 Alkohole i fenole Cholesterol Slajd 2 Budowa alkoholi woda woda metanol metanol Grupą funkcyjną jest () Tlen posiada hybrydyzacjęsp 3 Slajd 3 Podział alkoholi Pierwszorzędowe: grupa połączona jest
1. REAKCJA ZE ZWIĄZKAMI POSIADAJĄCYMI KWASOWY ATOM WODORU:
 B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
ZWIĄZKI MAGNEZOORGANICZNE. Krystyna Dzierzbicka
 ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
Alkohole i fenole. Opracowanie: Bartłomiej SIEPSIAK klasa 3d Opiekun: p. Teresa Gębicka
 Alkohole i fenole Opracowanie: Bartłomiej SIEPSIAK klasa d Opiekun: p. Teresa Gębicka Budowa alkoholi i fenoli Szereg homologiczny alkoholi Nazewnictwo Podział alkoholi Otrzymywanie alkoholi Właściwości
Alkohole i fenole Opracowanie: Bartłomiej SIEPSIAK klasa d Opiekun: p. Teresa Gębicka Budowa alkoholi i fenoli Szereg homologiczny alkoholi Nazewnictwo Podział alkoholi Otrzymywanie alkoholi Właściwości
Chemia organiczna. Alkohole Fenole. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
Addycje Nukleofilowe do Grupy Karbonylowej
 J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
Otrzymywanie halogenków alkilów
 Otrzymywanie halogenków alkilów 1) Wymiana grupy OH w alkoholach C O H HX 2) reakcja podstawienia alkanów C X H 3 C CH CH 2 HBr C H 3 OH H 3 C CH CH 2 C H 3 Br h + + CH CH 2 3 Cl 2 Cl HCl CH CH 3 3 CH
Otrzymywanie halogenków alkilów 1) Wymiana grupy OH w alkoholach C O H HX 2) reakcja podstawienia alkanów C X H 3 C CH CH 2 HBr C H 3 OH H 3 C CH CH 2 C H 3 Br h + + CH CH 2 3 Cl 2 Cl HCl CH CH 3 3 CH
Klasyfikacja i przykłady ETERY
 ETERY I EPKSYZWIĄZKI Klasyfikacja i przykłady ETERY acykliczne R--R cykliczne trójczłonowe czteroczłonowe pięcioczłonowe sześcioczłonowe tlenek etylenu (oksiran) oksetan tetrahydrofuran tetrahydropiran
ETERY I EPKSYZWIĄZKI Klasyfikacja i przykłady ETERY acykliczne R--R cykliczne trójczłonowe czteroczłonowe pięcioczłonowe sześcioczłonowe tlenek etylenu (oksiran) oksetan tetrahydrofuran tetrahydropiran
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
ZWIĄZKI FOSFOROORGANICZNE
 ZWIĄZKI FSFGANICZNE Związki fosforoorganiczne związki zawierające wiązanie węgiel-fosfor (C-) Wiązanie fosfor-wodór (-H; 77 kcal/mol) jest słabsze niż wiązanie azot-wodór (N-H; 93.4 kcal/mol). Wiązanie
ZWIĄZKI FSFGANICZNE Związki fosforoorganiczne związki zawierające wiązanie węgiel-fosfor (C-) Wiązanie fosfor-wodór (-H; 77 kcal/mol) jest słabsze niż wiązanie azot-wodór (N-H; 93.4 kcal/mol). Wiązanie
Pochodne węglowodorów, w cząsteczkach których jeden atom H jest zastąpiony grupą hydroksylową (- OH ).
 Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
1. Określ liczbę wiązań σ i π w cząsteczkach: wody, amoniaku i chloru
 1. Określ liczbę wiązań σ i π w cząsteczkach: wody, amoniaku i chloru 2. Na podstawie struktury cząsteczek wyjaśnij dlaczego N 2 jest bierny a Cl 2 aktywny chemicznie? 3. Które substancje posiadają budowę
1. Określ liczbę wiązań σ i π w cząsteczkach: wody, amoniaku i chloru 2. Na podstawie struktury cząsteczek wyjaśnij dlaczego N 2 jest bierny a Cl 2 aktywny chemicznie? 3. Które substancje posiadają budowę
Zadania powtórkowe do egzaminu maturalnego z chemii Wiązania chemiczne, budowa cząsteczek
 strona 1/11 Zadania powtórkowe do egzaminu maturalnego z chemii Wiązania chemiczne, budowa cząsteczek Monika Gałkiewicz Zad. 1 () Podaj wzory dwóch dowolnych kationów i dwóch dowolnych anionów posiadających
strona 1/11 Zadania powtórkowe do egzaminu maturalnego z chemii Wiązania chemiczne, budowa cząsteczek Monika Gałkiewicz Zad. 1 () Podaj wzory dwóch dowolnych kationów i dwóch dowolnych anionów posiadających
Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup
 Cz. XXV - Kwasy karboksylowe Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup karboksylowych - CH ( - C - H ), atom C w grupie funkcyjnej jest na hybrydyzacji sp 2,
Cz. XXV - Kwasy karboksylowe Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup karboksylowych - CH ( - C - H ), atom C w grupie funkcyjnej jest na hybrydyzacji sp 2,
Elementy chemii organicznej
 Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
1. Katalityczna redukcja węglowodorów zawierających wiązania wielokrotne
 B T E C N L CEMA G RGANCZNA A Synteza 1. Katalityczna redukcja węglowodorów zawierających wiązania wielokrotne C C / Pt C C C C W reakcji tej łańcuch węglowy pozostaje zachowany (nie ulega zmianie jego
B T E C N L CEMA G RGANCZNA A Synteza 1. Katalityczna redukcja węglowodorów zawierających wiązania wielokrotne C C / Pt C C C C W reakcji tej łańcuch węglowy pozostaje zachowany (nie ulega zmianie jego
Alkohole to związki, w których grupy hydroksylowe przyłączone są do nasyconych atomów węgla o hybrydyzacji sp 3. COH
 Alkohole R Alkohole to związki, w których grupy hydroksylowe przyłączone są do nasyconych atomów węgla o hybrydyzacji sp 3. C Alkohole można uważać za organiczne pochodne wody --, w której jeden z atomów
Alkohole R Alkohole to związki, w których grupy hydroksylowe przyłączone są do nasyconych atomów węgla o hybrydyzacji sp 3. C Alkohole można uważać za organiczne pochodne wody --, w której jeden z atomów
pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 )
 FLUOROWCOPOCODNE alogenki alkilowe- Cl C 2 -C 2 -C 2 -C 3 C 3 -C-C 3 C 2 -C-C 3 pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 ) I C 3 C 3 Cl-C 2 -C=C 2 Cl-C-C=C 2 1 2 3 Allilowe atom fluorowca
FLUOROWCOPOCODNE alogenki alkilowe- Cl C 2 -C 2 -C 2 -C 3 C 3 -C-C 3 C 2 -C-C 3 pierwszorzędowe drugorzędowe trzeciorzędowe (1 ) (2 ) (3 ) I C 3 C 3 Cl-C 2 -C=C 2 Cl-C-C=C 2 1 2 3 Allilowe atom fluorowca
Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO:
 FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
Grupa karbonylowa. Grupa karbonylowa to grupa funkcyjna, w której atom tlenu połączony jest z atomem węgla podwójnym wiązaniem
 ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
Alkeny. Wzór ogólny alkenów C n H 2n. (Uwaga identyczny wzór ogólny mają cykloakany!!!)
 Alkeny Wzór ogólny alkenów n 2n (Uwaga identyczny wzór ogólny mają cykloakany!!!) Węglowodory nienasycone, zawierające wiązanie podwójne, hybrydyzacja atomow węgla biorących udział w tworzeniu wiązania
Alkeny Wzór ogólny alkenów n 2n (Uwaga identyczny wzór ogólny mają cykloakany!!!) Węglowodory nienasycone, zawierające wiązanie podwójne, hybrydyzacja atomow węgla biorących udział w tworzeniu wiązania
18 i 19. Substytucja nukleofilowa w halogenkach alkili
 8 i 9. Substytucja nukleofilowa w halogenkach alkili Związki pojadające wiązanie C (sp 3 )-atom o większej elektroujemności od at. C elektroujemny atom sp 3 polarne wiązanie 9.. Typowe reakcje halogenków
8 i 9. Substytucja nukleofilowa w halogenkach alkili Związki pojadające wiązanie C (sp 3 )-atom o większej elektroujemności od at. C elektroujemny atom sp 3 polarne wiązanie 9.. Typowe reakcje halogenków
Podział związków organicznych
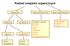 Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Zadanie 1. (1 pkt). Informacja do zada 2. i 3. Zadanie 2. (1 pkt) { Zadania 2., 3. i 4 s dla poziomu rozszerzonego} zania zania Zadanie 3.
 2. ELEKTRONY W ATOMACH I CZĄSTECZKACH. A1 - POZIOM PODSTAWOWY. Zadanie 1. (1 pkt). Konfigurację elektronową 1s 2 2s 2 2p 6 3s 2 3p 6 mają atomy i jony: A. Mg 2+, Cl -, K +, B. Ar, S 2-, K +, C. Ar, Na
2. ELEKTRONY W ATOMACH I CZĄSTECZKACH. A1 - POZIOM PODSTAWOWY. Zadanie 1. (1 pkt). Konfigurację elektronową 1s 2 2s 2 2p 6 3s 2 3p 6 mają atomy i jony: A. Mg 2+, Cl -, K +, B. Ar, S 2-, K +, C. Ar, Na
Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr.
 Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr. Typ wiązania w KBr... Typ wiązania w HBr... Zadanie 2. (2 pkt) Oceń poprawność poniższych
Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr. Typ wiązania w KBr... Typ wiązania w HBr... Zadanie 2. (2 pkt) Oceń poprawność poniższych
Chemia Grudzień Styczeń
 Chemia Grudzień Styczeń Klasa VII IV. Łączenie się atomów. Równania reakcji chemicznych 1. Wiązania kowalencyjne 2. Wiązania jonowe 3. Wpływ rodzaju wiązania na właściwości substancji 4. Elektroujemność
Chemia Grudzień Styczeń Klasa VII IV. Łączenie się atomów. Równania reakcji chemicznych 1. Wiązania kowalencyjne 2. Wiązania jonowe 3. Wpływ rodzaju wiązania na właściwości substancji 4. Elektroujemność
Aminy. - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin
 Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
CH 3 OH C 2 H 5 OH H 3 C CH 2 CH 2 OH H 3 C CH CH 3 OH metanol etanol propan-1-ol propan-2-ol H 2 C CH 2 OH OH H 2 C CH CH 2 OH OH OH
 Alkohole Alkohole to związki organiczne, posiadające w cząsteczce przynajmniej jedną hydroksylową grupę funkcyjną ( ). Jeżeli grupa ta jest połączona bezpośrednio z pierścieniem aromatycznym, to taki związek
Alkohole Alkohole to związki organiczne, posiadające w cząsteczce przynajmniej jedną hydroksylową grupę funkcyjną ( ). Jeżeli grupa ta jest połączona bezpośrednio z pierścieniem aromatycznym, to taki związek
Stałe siłowe. Spektroskopia w podczerwieni. Spektrofotometria w podczerwieni otrzymywanie widm
 Spektroskopia w podczerwieni Spektrofotometria w podczerwieni otrzymywanie widm absorpcyjnych substancji o różnych stanach skupienia. Powiązanie widm ze strukturą pozwala na identyfikację związku. Widmo
Spektroskopia w podczerwieni Spektrofotometria w podczerwieni otrzymywanie widm absorpcyjnych substancji o różnych stanach skupienia. Powiązanie widm ze strukturą pozwala na identyfikację związku. Widmo
Reakcje alkoholi, eterów, epoksydów, amin i tioli
 22-24. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas Chemia rganiczna,
22-24. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas Chemia rganiczna,
Wykład 8. Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.)
 Wykład 8 Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.) ALKOHOLE I FENOLE Związki o wzorze ogólnym R-OH. W fenolach grupa OH jest bezpośrednio związana z pierścieniem aromatycznum.
Wykład 8 Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.) ALKOHOLE I FENOLE Związki o wzorze ogólnym R-OH. W fenolach grupa OH jest bezpośrednio związana z pierścieniem aromatycznum.
CHEMIA klasa 1 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery.
 CHEMIA klasa 1 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery. Dział - Substancje i ich przemiany WYMAGANIA PODSTAWOWE stosuje zasady bezpieczeństwa
CHEMIA klasa 1 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery. Dział - Substancje i ich przemiany WYMAGANIA PODSTAWOWE stosuje zasady bezpieczeństwa
Spis treści 1. Struktura elektronowa związków organicznych 2. Budowa przestrzenna cząsteczek związków organicznych
 Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Izomeria. isos - taki sam meros -części
 Izomeria isos - taki sam meros -części Izomery związki, które zawierają taką samą liczbę i rodzaj atomów w cząsteczce, ale różnią się sposobem ułożenia tych atomów. Mają taki sam wzór sumaryczny. 6 12
Izomeria isos - taki sam meros -części Izomery związki, które zawierają taką samą liczbę i rodzaj atomów w cząsteczce, ale różnią się sposobem ułożenia tych atomów. Mają taki sam wzór sumaryczny. 6 12
Izomeria. isos - taki sam meros -części
 Izomeria isos - taki sam meros -części Izomery związki, które zawierają taką samą liczbę i rodzaj atomów w cząsteczce, ale różnią się sposobem ułożenia tych atomów. Mają taki sam wzór sumaryczny. 6 12
Izomeria isos - taki sam meros -części Izomery związki, które zawierają taką samą liczbę i rodzaj atomów w cząsteczce, ale różnią się sposobem ułożenia tych atomów. Mają taki sam wzór sumaryczny. 6 12
ALDEHYDY, KETONY. I. Wprowadzenie teoretyczne
 ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
CHEMIA I GIMNAZJUM WYMAGANIA PODSTAWOWE
 WYMAGANIA PODSTAWOWE wskazuje w środowisku substancje chemiczne nazywa sprzęt i szkło laboratoryjne opisuje podstawowe właściwości substancji będących głównymi składnikami stosowanych na co dzień produktów
WYMAGANIA PODSTAWOWE wskazuje w środowisku substancje chemiczne nazywa sprzęt i szkło laboratoryjne opisuje podstawowe właściwości substancji będących głównymi składnikami stosowanych na co dzień produktów
11. Reakcje alkoholi, eterów, epoksydów, amin i tioli
 11. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas 1 11.1. Reakcja
11. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas 1 11.1. Reakcja
Wykład przygotowany w oparciu o podręczniki:
 Slajd 1 Wykład przygotowany w oparciu o podręczniki: Organic Chemistry 4 th Edition Paula Yurkanis Bruice Slajd 2 Struktura elektronowa wiązanie chemiczne Kwasy i zasady Slajd 3 Chemia organiczna Związki
Slajd 1 Wykład przygotowany w oparciu o podręczniki: Organic Chemistry 4 th Edition Paula Yurkanis Bruice Slajd 2 Struktura elektronowa wiązanie chemiczne Kwasy i zasady Slajd 3 Chemia organiczna Związki
CHEMIA ORGANICZNA. dr hab. Włodzimierz Gałęzowski Wydział Chemii UAM (61)
 EMIA ORGANIZNA dr hab. Włodzimierz Gałęzowski Wydział hemii UAM (61) 829 1477 wlodgal@amu.edu.pl Materiał wymagany na egzaminie: wykłady ćwiczenia szkoła średnia http://staff.amu.edu.pl/~wlodgal Podręczniki
EMIA ORGANIZNA dr hab. Włodzimierz Gałęzowski Wydział hemii UAM (61) 829 1477 wlodgal@amu.edu.pl Materiał wymagany na egzaminie: wykłady ćwiczenia szkoła średnia http://staff.amu.edu.pl/~wlodgal Podręczniki
CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA. POLIMERYZACJA.
 INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA.
INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA.
Alkeny - reaktywność
 11-13. Alkeny - reaktywność 1 6.1. Addycja elektrofilowa - wprowadzenie nukleofil elektrofil elektrofil nukleofil wolno szybko nowe wiązanie utworzone przez elektrony z wiązania nowe wiązanie utworzone
11-13. Alkeny - reaktywność 1 6.1. Addycja elektrofilowa - wprowadzenie nukleofil elektrofil elektrofil nukleofil wolno szybko nowe wiązanie utworzone przez elektrony z wiązania nowe wiązanie utworzone
Materiały dodatkowe alkohole, fenole, etery
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe alkohole, fenole, etery Alkohole i fenole 1 Własności kwasowo-zasadowe alkoholi i fenoli becność grupy H, posiadającej
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe alkohole, fenole, etery Alkohole i fenole 1 Własności kwasowo-zasadowe alkoholi i fenoli becność grupy H, posiadającej
Wiązania kowalencyjne
 Wiązania kowalencyjne (pierw. o dużej E + pierw. o dużej E), E < 1,8 TERIE WIĄZANIA KWALENCYJNEG Teoria hybrydyzacji orbitali atomowych Teoria orbitali molekularnych Teoria pola ligandów YBRYDYZACJA RBITALI
Wiązania kowalencyjne (pierw. o dużej E + pierw. o dużej E), E < 1,8 TERIE WIĄZANIA KWALENCYJNEG Teoria hybrydyzacji orbitali atomowych Teoria orbitali molekularnych Teoria pola ligandów YBRYDYZACJA RBITALI
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
CZĄSTECZKA. Do opisu wiązań chemicznych stosuje się najczęściej metodę (teorię): metoda wiązań walencyjnych (VB)
 CZĄSTECZKA Stanislao Cannizzaro (1826-1910) cząstki - elementy mikroświata, termin obejmujący zarówno cząstki elementarne, jak i atomy, jony proste i złożone, cząsteczki, rodniki, cząstki koloidowe; cząsteczka
CZĄSTECZKA Stanislao Cannizzaro (1826-1910) cząstki - elementy mikroświata, termin obejmujący zarówno cząstki elementarne, jak i atomy, jony proste i złożone, cząsteczki, rodniki, cząstki koloidowe; cząsteczka
10. Alkeny wiadomości wstępne
 0. Alkeny wiadomości wstępne 5.. Nazewnictwo Nazwa systematyczna eten propen cyklopenten cykloheksen Nazwa zwyczajowa etylen propylen Wiązanie = w łańcuchu głównym, lokant = najniższy z możliwych -propyloheks--en
0. Alkeny wiadomości wstępne 5.. Nazewnictwo Nazwa systematyczna eten propen cyklopenten cykloheksen Nazwa zwyczajowa etylen propylen Wiązanie = w łańcuchu głównym, lokant = najniższy z możliwych -propyloheks--en
Rozdział 6. Odpowiedzi i rozwiązania zadań. Chemia organiczna. Zdzisław Głowacki. Zakres podstawowy i rozszerzony
 Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Inne koncepcje wiązań chemicznych. 1. Jak przewidywac strukturę cząsteczki? 2. Co to jest wiązanie? 3. Jakie są rodzaje wiązań?
 Inne koncepcje wiązań chemicznych 1. Jak przewidywac strukturę cząsteczki? 2. Co to jest wiązanie? 3. Jakie są rodzaje wiązań? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie.
Inne koncepcje wiązań chemicznych 1. Jak przewidywac strukturę cząsteczki? 2. Co to jest wiązanie? 3. Jakie są rodzaje wiązań? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie.
Test diagnostyczny. Dorota Lewandowska, Lidia Wasyłyszyn, Anna Warchoł. Część A (0 5) Standard I
 strona 1/9 Test diagnostyczny Dorota Lewandowska, Lidia Wasyłyszyn, Anna Warchoł Część A (0 5) Standard I 1. Przemianą chemiczną nie jest: A. mętnienie wody wapiennej B. odbarwianie wody bromowej C. dekantacja
strona 1/9 Test diagnostyczny Dorota Lewandowska, Lidia Wasyłyszyn, Anna Warchoł Część A (0 5) Standard I 1. Przemianą chemiczną nie jest: A. mętnienie wody wapiennej B. odbarwianie wody bromowej C. dekantacja
MATERIAŁY POMOCNICZE 1 GDYBY MATURA 2002 BYŁA DZISIAJ CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY ARKUSZ EGZAMINACYJNY I
 MATERIAŁY POMOCNICZE 1 GDYBY MATURA 00 BYŁA DZISIAJ OKRĘ GOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY Informacje ARKUSZ EGZAMINACYJNY I 1. Przy każdym zadaniu podano
MATERIAŁY POMOCNICZE 1 GDYBY MATURA 00 BYŁA DZISIAJ OKRĘ GOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY Informacje ARKUSZ EGZAMINACYJNY I 1. Przy każdym zadaniu podano
Węglowodory aromatyczne (areny) to płaskie cykliczne związki węgla i wodoru. Areny. skondensowane liniowo. skondensowane kątowo
 Spis treści Podstawowe pojęcia Właściwości chemiczne benzenu Wielopierścieniowe węglowodory aromatyczne Homologi benzenu Nazewnictwo związków aromatycznych Występowanie i otrzymywanie arenów Węglowodory
Spis treści Podstawowe pojęcia Właściwości chemiczne benzenu Wielopierścieniowe węglowodory aromatyczne Homologi benzenu Nazewnictwo związków aromatycznych Występowanie i otrzymywanie arenów Węglowodory
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas II LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania
 Cz. I Materiał powtórzeniowy do sprawdzianu dla klas II LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas II LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
Sprawdzian 1. CHEMIA. Przed próbną maturą. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 32. Imię i nazwisko ...
 CHEMIA Przed próbną maturą Sprawdzian 1. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 32 Imię i nazwisko Liczba punktów Procent 2 Zadanie 1. Cząsteczka pewnej substancji chemicznej
CHEMIA Przed próbną maturą Sprawdzian 1. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 32 Imię i nazwisko Liczba punktów Procent 2 Zadanie 1. Cząsteczka pewnej substancji chemicznej
3. Cząsteczki i wiązania
 20161020 3. Cząsteczki i wiązania Elektrony walencyjne Wiązania jonowe i kowalencyjne Wiązanie typu σ i π Hybrydyzacja Przewidywanie kształtu cząsteczek AX n Orbitale zdelokalizowane Cząsteczki związków
20161020 3. Cząsteczki i wiązania Elektrony walencyjne Wiązania jonowe i kowalencyjne Wiązanie typu σ i π Hybrydyzacja Przewidywanie kształtu cząsteczek AX n Orbitale zdelokalizowane Cząsteczki związków
Stereochemia Ułożenie atomów w przestrzeni
 Slajd 1 Stereochemia Ułożenie atomów w przestrzeni Slajd 2 Izomery Izomery to różne związki posiadające ten sam wzór sumaryczny izomery izomery konstytucyjne stereoizomery izomery cis-trans izomery zawierające
Slajd 1 Stereochemia Ułożenie atomów w przestrzeni Slajd 2 Izomery Izomery to różne związki posiadające ten sam wzór sumaryczny izomery izomery konstytucyjne stereoizomery izomery cis-trans izomery zawierające
Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka
 Slajd 1 Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka Slajd 2 Alkeny Węglowodory te zawierają wiązanie podwójne C C wiązanie double podwójne bond the grupa functional funkcyjna group centrum
Slajd 1 Alkeny: Struktura, nazewnictwo, Termodynamika i kinetyka Slajd 2 Alkeny Węglowodory te zawierają wiązanie podwójne C C wiązanie double podwójne bond the grupa functional funkcyjna group centrum
Kryteria oceniania z chemii kl VII
 Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
WYMAGANIA EDUKACYJNE z chemii dla klasy siódmej
 Lucyna Krupa Rok szkolny 2017/2018 WYMAGANIA EDUKACYJNE z chemii dla klasy siódmej Wyróżnia się wymagania na: ocenę dopuszczającą ocenę dostateczną (obejmują wymagania na ocenę dopuszczającą) ocenę dobrą
Lucyna Krupa Rok szkolny 2017/2018 WYMAGANIA EDUKACYJNE z chemii dla klasy siódmej Wyróżnia się wymagania na: ocenę dopuszczającą ocenę dostateczną (obejmują wymagania na ocenę dopuszczającą) ocenę dobrą
CHARAKTERYSTYKA KARBOKSYLANÓW
 AAKTEYSTYKA KABKSYLANÓW 1. GÓLNA AAKTEYSTYKA KWASÓW KABKSYLWY Spośród związków organicznych, które wykazują znaczną kwasowość najważniejsze są kwasy karboksylowe. Związki te zawierają w cząsteczce grupę
AAKTEYSTYKA KABKSYLANÓW 1. GÓLNA AAKTEYSTYKA KWASÓW KABKSYLWY Spośród związków organicznych, które wykazują znaczną kwasowość najważniejsze są kwasy karboksylowe. Związki te zawierają w cząsteczce grupę
Wiązania jonowe występują w układach złożonych z atomów skrajnie różniących się elektroujemnością.
 105 Elektronowa teoria wiązania chemicznego Cząsteczki powstają w wyniku połączenia się dwóch lub więcej atomów. Już w początkowym okresie rozwoju chemii podejmowano wysiłki zmierzające do wyjaśnienia
105 Elektronowa teoria wiązania chemicznego Cząsteczki powstają w wyniku połączenia się dwóch lub więcej atomów. Już w początkowym okresie rozwoju chemii podejmowano wysiłki zmierzające do wyjaśnienia
CZĄSTECZKA. Do opisu wiązań chemicznych stosuje się najczęściej jedną z dwóch metod (teorii): metoda wiązań walencyjnych (VB)
 CZĄSTECZKA Stanislao Cannizzaro (1826-1910) cząstki - elementy mikroświata, termin obejmujący zarówno cząstki elementarne, jak i atomy, jony proste i złożone, cząsteczki, rodniki, cząstki koloidowe; cząsteczka
CZĄSTECZKA Stanislao Cannizzaro (1826-1910) cząstki - elementy mikroświata, termin obejmujący zarówno cząstki elementarne, jak i atomy, jony proste i złożone, cząsteczki, rodniki, cząstki koloidowe; cząsteczka
Spis treści Podstawowe dane Podział alkoholi alifatycznych Nazewnictwo systematyczne alkoholi Izomeria alkoholi Alkohole nasycone monohydroksylowe
 Spis treści Podstawowe dane Podział alkoholi alifatycznych Nazewnictwo systematyczne alkoholi Izomeria alkoholi Alkohole nasycone monohydroksylowe Właściwości fizyczne Otrzymywanie Przemysłowe metody otrzymywania
Spis treści Podstawowe dane Podział alkoholi alifatycznych Nazewnictwo systematyczne alkoholi Izomeria alkoholi Alkohole nasycone monohydroksylowe Właściwości fizyczne Otrzymywanie Przemysłowe metody otrzymywania
Błędy w skrypcie: Chemia organiczna Kurs podstawowy. str. 4 (tytuł podrozdziału 5.2.7.) jest (reakcja Karasha), powinno być (reakcja Kharascha)
 1 Błędy w skrypcie: hemia organiczna Kurs podstawowy str. 4 (tytuł podrozdziału 5.2.7.) jest (reakcja Karasha), powinno być (reakcja Kharascha) str. 13 (1. wiersz od góry) ( 3 () ) str. 13 (12. wiersz
1 Błędy w skrypcie: hemia organiczna Kurs podstawowy str. 4 (tytuł podrozdziału 5.2.7.) jest (reakcja Karasha), powinno być (reakcja Kharascha) str. 13 (1. wiersz od góry) ( 3 () ) str. 13 (12. wiersz
I. Substancje i ich przemiany
 Wymagania edukacyjne na poszczególne oceny szkolne klasa 7 Niepełnosprawność intelektualna oraz obniżenie wymagań i dostosowanie ich do możliwości ucznia I. Substancje i ich przemiany stosuje zasady bezpieczeństwa
Wymagania edukacyjne na poszczególne oceny szkolne klasa 7 Niepełnosprawność intelektualna oraz obniżenie wymagań i dostosowanie ich do możliwości ucznia I. Substancje i ich przemiany stosuje zasady bezpieczeństwa
Wymagania programowe na poszczególne oceny chemia kl. I
 I. Substancje i ich przemiany Wymagania programowe na poszczególne oceny chemia kl. I Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
I. Substancje i ich przemiany Wymagania programowe na poszczególne oceny chemia kl. I Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
Związki aromatyczne (by Aleksandra Kołodziejczyk, UG)
 Związki aromatyczne (by Aleksandra Kołodziejczyk, UG) 4 stopnie nienasycenia. ak reakcji A Źródła: - piroliza węgla smoła pogazowa; - reforming ropy naftowej Nazewnictwo przedrostek nazwa podstawnika C
Związki aromatyczne (by Aleksandra Kołodziejczyk, UG) 4 stopnie nienasycenia. ak reakcji A Źródła: - piroliza węgla smoła pogazowa; - reforming ropy naftowej Nazewnictwo przedrostek nazwa podstawnika C
ALKOHOLE (by Aleksandra Kołodziejczyk, UG)
 ALKLE (by Aleksandra Kołodziejczyk, UG) -: alkohol/fenol/enol Typowy alkohol gr. przy o hybrydyzacji sp 3 Nazewnictwo: alkanol - jak najniższy lokant podstawnika hydroksylowego Alkohole 1, 2, 3 3 2 2 propan-1-ol
ALKLE (by Aleksandra Kołodziejczyk, UG) -: alkohol/fenol/enol Typowy alkohol gr. przy o hybrydyzacji sp 3 Nazewnictwo: alkanol - jak najniższy lokant podstawnika hydroksylowego Alkohole 1, 2, 3 3 2 2 propan-1-ol
Sprawdzian 3. CHEMIA. Przed próbną maturą (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34. Imię i nazwisko ...
 CEMIA Przed próbną maturą 2017 Sprawdzian 3. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34 Imię i nazwisko Liczba punktów Procent 2 Zadanie 1. (0 1) Związki krzemu z wodorem noszą
CEMIA Przed próbną maturą 2017 Sprawdzian 3. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34 Imię i nazwisko Liczba punktów Procent 2 Zadanie 1. (0 1) Związki krzemu z wodorem noszą
Zagadnienia. Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I
 Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
I KSZTAŁCENIA PRAKTYCZNEGO. Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO XV Konkurs Chemii Organicznej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1 (9 pkt) Ciekłą mieszaninę,
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO XV Konkurs Chemii Organicznej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1 (9 pkt) Ciekłą mieszaninę,
-pinen (składnik terpentyny)
 ALKENY (OLEFINY) WZÓR SUMARYZNY n 2n - alkeny łańcuchowe; n 2n-2 - alkeny cykliczne (cykloalkeny) etylen (produkcja polietylenu) WŁAŚIWOŚI FIZYZNE -pinen (składnik terpentyny) cis-trikoz-9-en (hormon płciowy
ALKENY (OLEFINY) WZÓR SUMARYZNY n 2n - alkeny łańcuchowe; n 2n-2 - alkeny cykliczne (cykloalkeny) etylen (produkcja polietylenu) WŁAŚIWOŚI FIZYZNE -pinen (składnik terpentyny) cis-trikoz-9-en (hormon płciowy
δ + δ - δ + R O H RJC R δ + δ - δ - δ + R O R Grupy Funkcyjne δ + O NH 2 R N H H R N Slides 1 to 41
 1 δ + δ + δ + R R X Grupy Funkcyjne δ + δ + R R R δ + R δ + X δ + R N R δ + R δ + R R δ + R δ + N 2 R δ + R N δ + δ + Slides 1 to 41 2 Grupy Funkcyjne Zawierające eteroatomy Grupy funkcyjne mają często
1 δ + δ + δ + R R X Grupy Funkcyjne δ + δ + R R R δ + R δ + X δ + R N R δ + R δ + R R δ + R δ + N 2 R δ + R N δ + δ + Slides 1 to 41 2 Grupy Funkcyjne Zawierające eteroatomy Grupy funkcyjne mają często
3. Cząsteczki i wiązania
 3. Cząsteczki i wiązania Elektrony walencyjne Wiązania jonowe i kowalencyjne Wiązanie typu σ i π Hybrydyzacja Przewidywanie kształtu cząsteczek AX n Orbitale zdelokalizowane Cząsteczki związków organicznych
3. Cząsteczki i wiązania Elektrony walencyjne Wiązania jonowe i kowalencyjne Wiązanie typu σ i π Hybrydyzacja Przewidywanie kształtu cząsteczek AX n Orbitale zdelokalizowane Cząsteczki związków organicznych
CHEMIA. Treści nauczania- wymagania szczegółowe. Substancje i ich właściwości. Uczeń: Wewnętrzna budowa materii. Uczeń:
 CHEMIA Treści nauczania- wymagania szczegółowe Substancje i ich właściwości. Uczeń: Podaje przykłady zastosować chemii w życiu codziennym Nazywa wybrane szkło i sprzęt laboratoryjny oraz określa jego przeznaczenie
CHEMIA Treści nauczania- wymagania szczegółowe Substancje i ich właściwości. Uczeń: Podaje przykłady zastosować chemii w życiu codziennym Nazywa wybrane szkło i sprzęt laboratoryjny oraz określa jego przeznaczenie
Teoria VSEPR. Jak przewidywac strukturę cząsteczki?
 Teoria VSEPR Jak przewidywac strukturę cząsteczki? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie. Rozkład elektronów walencyjnych w cząsteczce (struktura Lewisa) stuktura
Teoria VSEPR Jak przewidywac strukturę cząsteczki? Model VSEPR wiązanie pary elektronowe dzielone między atomy tworzące wiązanie. Rozkład elektronów walencyjnych w cząsteczce (struktura Lewisa) stuktura
I. Substancje i ich przemiany
 NaCoBeZU z chemii dla klasy 7 I. Substancje i ich przemiany 1. Zasady bezpiecznej pracy na lekcjach chemii zaliczam chemię do nauk przyrodniczych stosuję zasady bezpieczeństwa obowiązujące w pracowni chemicznej
NaCoBeZU z chemii dla klasy 7 I. Substancje i ich przemiany 1. Zasady bezpiecznej pracy na lekcjach chemii zaliczam chemię do nauk przyrodniczych stosuję zasady bezpieczeństwa obowiązujące w pracowni chemicznej
 PRACA KONTROLNA Z CHEMII NR 1 - Semestr I 1. (6 pkt) - Krótko napisz, jak rozumiesz następujące pojęcia: a/ liczba atomowa, b/ nuklid, c/ pierwiastek d/ dualizm korpuskularno- falowy e/promieniotwórczość
PRACA KONTROLNA Z CHEMII NR 1 - Semestr I 1. (6 pkt) - Krótko napisz, jak rozumiesz następujące pojęcia: a/ liczba atomowa, b/ nuklid, c/ pierwiastek d/ dualizm korpuskularno- falowy e/promieniotwórczość
Chemia klasa VII Wymagania edukacyjne na poszczególne oceny Semestr II
 Chemia klasa VII Wymagania edukacyjne na poszczególne oceny Semestr II Łączenie się atomów. Równania reakcji Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] Ocena dobra [1 + 2 + 3] Ocena bardzo dobra
Chemia klasa VII Wymagania edukacyjne na poszczególne oceny Semestr II Łączenie się atomów. Równania reakcji Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] Ocena dobra [1 + 2 + 3] Ocena bardzo dobra
ALKOHOLE, FENOLE, ALDEHYDY, KETONY
 LKOHOLE, FENOLE, LDEHYDY, KETONY ZDNIE DOMOWE ZDNIE 1. (2 P.): Poniżej przedstawiono cykl reakcji zachodzących z udziałem związków organicznych. Określ typ każdej reakcji (1. 4.) z powyższego schematu,
LKOHOLE, FENOLE, LDEHYDY, KETONY ZDNIE DOMOWE ZDNIE 1. (2 P.): Poniżej przedstawiono cykl reakcji zachodzących z udziałem związków organicznych. Określ typ każdej reakcji (1. 4.) z powyższego schematu,
UKŁAD OKRESOWY PIERWIASTKÓW
 UKŁAD OKRESOWY PIERWIASTKÓW Michał Sędziwój (1566-1636) Alchemik Sędziwój - Jan Matejko Pierwiastki chemiczne p.n.e. Sb Sn Zn Pb Hg S Ag C Au Fe Cu (11)* do XVII w. As (1250 r.) P (1669 r.) (2) XVIII
UKŁAD OKRESOWY PIERWIASTKÓW Michał Sędziwój (1566-1636) Alchemik Sędziwój - Jan Matejko Pierwiastki chemiczne p.n.e. Sb Sn Zn Pb Hg S Ag C Au Fe Cu (11)* do XVII w. As (1250 r.) P (1669 r.) (2) XVIII
Wymagania edukacyjne - chemia klasa VII
 Wymagania edukacyjne - chemia klasa VII OCENA DOPUSZCZAJĄCA [1] opisuje właściwości substancji będących głównymi składnikami produktów stosowanych na co dzień podaje wzór na gęstość i przeprowadza proste
Wymagania edukacyjne - chemia klasa VII OCENA DOPUSZCZAJĄCA [1] opisuje właściwości substancji będących głównymi składnikami produktów stosowanych na co dzień podaje wzór na gęstość i przeprowadza proste
KRYTERIA OCENIANIA MODEL ODPOWIEDZI
 Materiał ćwiczeniowy z chemii 0 r. KRYTERIA OCENIANIA MODEL ODPOWIEDZI Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Odpowiedzi niezgodne
Materiał ćwiczeniowy z chemii 0 r. KRYTERIA OCENIANIA MODEL ODPOWIEDZI Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Odpowiedzi niezgodne
Sprawdzian 2. CHEMIA. Przed próbną maturą. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34. Imię i nazwisko ...
 CHEMIA Przed próbną maturą Sprawdzian 2. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34 Imię i nazwisko... Liczba punktów Procent 2 Informacja do zadań 1 i 2. Naturalny chlor występuje
CHEMIA Przed próbną maturą Sprawdzian 2. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34 Imię i nazwisko... Liczba punktów Procent 2 Informacja do zadań 1 i 2. Naturalny chlor występuje
Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7
 Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7 W tabeli zostały wyróżnione y z doświadczeń zalecanych do realizacji w szkole podstawowej. Temat w podręczniku Tytuł Typ
Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7 W tabeli zostały wyróżnione y z doświadczeń zalecanych do realizacji w szkole podstawowej. Temat w podręczniku Tytuł Typ
Reakcje benzenu i jego pochodnych
 39-42. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień
39-42. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień
Długość [pm] Energia [kj/mol] C O H wynosi (zarówno w fenolach, jak i alkoholach) około 109 o
![Długość [pm] Energia [kj/mol] C O H wynosi (zarówno w fenolach, jak i alkoholach) około 109 o Długość [pm] Energia [kj/mol] C O H wynosi (zarówno w fenolach, jak i alkoholach) około 109 o](/thumbs/66/55340837.jpg) B I T E N L EMIA G GANIZNA I A Budowa ALKLE zawierające atom TLENU związany z atomem węgla sp 3 mają budowę przestrzenną TETAEDYZNĄ zbliżoną do budowy węglowodorów. Wiązanie węgiel - tlen utworzone jest
B I T E N L EMIA G GANIZNA I A Budowa ALKLE zawierające atom TLENU związany z atomem węgla sp 3 mają budowę przestrzenną TETAEDYZNĄ zbliżoną do budowy węglowodorów. Wiązanie węgiel - tlen utworzone jest
Wymagania programowe na poszczególne oceny z chemii w kl.1. I. Substancje i ich przemiany
 Wymagania programowe na poszczególne oceny z chemii w kl.1 I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego chemia
Wymagania programowe na poszczególne oceny z chemii w kl.1 I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego chemia
WYMAGANIA EDUKACYJNE w klasie III
 WYMAGANIA EDUKACYJNE w klasie III Nr lekcji Temat lekcji Treści nauczania (pismem pogrubionym zostały zaznaczone treści Podstawy Programowej) Węgiel i jego związki z wodorem Wymagania i kryteria ocen Uczeń:
WYMAGANIA EDUKACYJNE w klasie III Nr lekcji Temat lekcji Treści nauczania (pismem pogrubionym zostały zaznaczone treści Podstawy Programowej) Węgiel i jego związki z wodorem Wymagania i kryteria ocen Uczeń:
Podstawowe pojęcia i prawa chemiczne
 Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Kryteria oceniania z chemii kl I Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich
 Kryteria oceniania z chemii kl I Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co dzień
Kryteria oceniania z chemii kl I Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co dzień
Wymagania programowe na poszczególne oceny
 Przedmiot: chemia Klasa: Ia, Ib Nauczyciel: Agata SROKA Wymagania programowe na poszczególne oceny I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady
Przedmiot: chemia Klasa: Ia, Ib Nauczyciel: Agata SROKA Wymagania programowe na poszczególne oceny I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady
MATERIAŁY POMOCNICZE 1 GDYBY MATURA 2002 BYŁA DZISIAJ CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY ARKUSZ EGZAMINACYJNY II
 MATERIAŁY POMOCNICZE 1 GDYBY MATURA 00 BYŁA DZISIAJ OKRĘ GOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY Informacje ARKUSZ EGZAMINACYJNY II 1. Przy każdym zadaniu podano
MATERIAŁY POMOCNICZE 1 GDYBY MATURA 00 BYŁA DZISIAJ OKRĘ GOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY Informacje ARKUSZ EGZAMINACYJNY II 1. Przy każdym zadaniu podano
Wymagania programowe na poszczególne oceny. I. Substancje i ich przemiany. Ocena bardzo dobra. Ocena dostateczna. Ocena dopuszczająca.
 Wymagania programowe na poszczególne oceny I. Substancje i ich przemiany Ocena dopuszczająca Ocena dostateczna Ocena dobra Ocena bardzo dobra [1] [1 + 2] [1 + 2 + 3] [1 + 2 + 3 + 4] 1 zalicza chemię do
Wymagania programowe na poszczególne oceny I. Substancje i ich przemiany Ocena dopuszczająca Ocena dostateczna Ocena dobra Ocena bardzo dobra [1] [1 + 2] [1 + 2 + 3] [1 + 2 + 3 + 4] 1 zalicza chemię do
Węglowodory nienasycone
 AUTORZY SKRYPTU Szymon Michalski OPIEKUN MERYTORYCZNY mgr Adam Makówka Węglowodory nienasycone Alkeny Spis treści: 1.Określenie i wzór ogólny alkenów 2.Szereg homologiczny alkenów 3.Nazewnictwo alkenów
AUTORZY SKRYPTU Szymon Michalski OPIEKUN MERYTORYCZNY mgr Adam Makówka Węglowodory nienasycone Alkeny Spis treści: 1.Określenie i wzór ogólny alkenów 2.Szereg homologiczny alkenów 3.Nazewnictwo alkenów
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas I LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania
 Cz. I Materiał powtórzeniowy do sprawdzianu dla klas I LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
Cz. I Materiał powtórzeniowy do sprawdzianu dla klas I LO - Wiązania chemiczne + przykładowe zadania i proponowane rozwiązania I. Elektroujemność pierwiastków i elektronowa teoria wiązań Lewisa-Kossela
