erozja skał lata KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 min Karkonosze Pielgrzymy (1204 m n.p.m.)
|
|
|
- Mariusz Janik
- 7 lat temu
- Przeglądów:
Transkrypt
1 Kinetyka chemiczna
2 erozja skał Karkonosze Pielgrzymy (1204 m n.p.m.) fermentacja alkoholowa lata min KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 s ms fs
3
4 czynniki wpływające na szybkość reakcji chemicznych stężenie reagentów (lub ciśnienie gazów jeżeli reakcja przebiega w fazie gazowej) temperatura obecność innych substancji katalizatory inhibitory środowisko
5 szybkość reakcji mierzona jest jako zmiana stężenia w czasie dla reakcji A B dla reakcji aa + bb cc + dd r = c t B = c t A r = 1 c c t C = 1 d c t D = 1 a c t A = 1 b c t B jednostka szybkości reakcji szybkość = c t = mol/dm s 3 = mol dm 3 s 1,mol l 1 s 1
6 równanie kinetyczne określa szybkość reakcji jako funkcję stężeń molowych reagentów sumarycznej reakcji k stała szybkości reakcji A + B C r = k [A] [B] wartość k wyznacza się doświadczalnie stała szybkości reakcji zależy od rodzaju reakcji i temperatury, nie zależy zaś od stężenia reagentów równanie kinetyczne wyznacza się doświadczalnie!!!!
7 2 NO + O 2 2NO 2 r = k [NO] 2 [O 2 ] H 2(g) + Br 2(g) 2HBr (g) r = k[h 2][Br 2] ' [Br ] + k [HBr] 2 3 2
8 rząd reakcji suma współczynników potęgowych w równaniu kinetycznym równanie reakcji równanie kinetyczne rząd reakcji 2NO + 2H 2 = N 2 + 2H 2 O r = k [NO] 2 [H 2 ] 3H 2 + N 2 = 2NH 3 r = k [H 2 ] 3 [N 2 ] CH 3/2 3 CHO = CH 4 + CO r = k [CH 3 CHO] 3/2 3 4 ogólnie: r = k [A] x [B] y x = 1 - reakcja jest 1-go rzędu względem A y = 2 - reakcja jest 2-go rzędu względem B x + y = 3, całkowity rząd reakcji wynosi 3
9 wykres zmiany stężenia substratu i produktu w trakcie reakcji czas [min]
10 przykład: izomeryzacja cis-butenu do trans-butenu H 3 C H C A C CH 3 H H 3 C H C B C H CH 3 [A] 0 [B] t stężenie [A] t [B] 0 czas d[b] r = = dt -d[a] dt (r > 0)
11 dane doświadczalne dla reakcji C 4 H 9 Cl (aq) + H 2 O (c) C 4 H 9 OH (aq) + HCl (aq) czas / s [C 4 H 9 Cl] / M r *10-4 / M s ,
12 dane doświadczalne w formie wykresu wyznaczanie szybkości reakcji dla dowolnego czasu jej trwania początkowa chwilowa
13 szybkość reakcji a stechiometria równania dla reakcji: C 4 H 9 Cl (aq) + H 2 O (c) C 4 H 9 OH (aq) + HCl (aq) wyznaczono, że: [C H t Cl] [C H r = 4 9 = 4 9 t OH]
14 szybkości reakcji chemicznej zależy znacznie od czasu okazuje się, że szybkość reakcji zależy od stężenia substratów i produktów Jak pozbyć się tej zależności? dla reakcji (bromu z formaliną) możemy podać dane doświadczalne: Czas [s] [Br 2 ] [mol/dm 3 ] szybkość [mol/s] x 10 5 szybkość/[br 2 ] [s -1 ] x szybkość tej reakcji zależy od czasu i stężenia Br 2, iloraz szybkości i stężenia Br 2 jest wartością stałą. Iloraz ten nazywamy stałą szybkości reakcji chemicznej i oznaczamy literą k. Dla reakcji opisanej danymi w tabeli, możemy napisać: r = d[br 2 ]/dt = k[br 2 ]
15 reakcja 0-go rzędu
16 reakcja rzędu zerowego r = d[a] dt r = k [A] [A] 0 nachylenie = k d[a] dt = k [A] t = [A] 0 kt czas połowicznej przemiany t ½ : t [A] = [A] 0 - kt [A] = ½[A] 0 t 1/ 2 t = 1 / 2 [ A] 0 2k
17 reakcja I-go rzędu
18 reakcja 1-go rzędu r = k[a] oraz r = d[a] dt [A] t d[a] dt = k[a] [A] 0 [A] t = [A] 0 e kt [ A] = A] t [ 0 d[a] [A] [A] t ln = kt [A] 0 t 0 kdt t
19 funkcja liniowa: y = ax + b ln[a] t = -kt + ln[a] 0 ln[a] ln[a] 0 pkt. przecięcia = ln[a] 0 nachylenie = k jeśli wykres ln[a] t od czasu jest linią prostą to reakcja jest 1-go rzędu czas połowicznej przemiany t ½ : 1 [ A] ln [ A] 2 0 = kt1/ 2 ln = kt1/ 2 1/ 2 ln 2 = kt t t 1 / 2 = ln 2 k
20 czas połowicznej przemiany dla reakcji 1-go rzędu [A] t t = 1 / 2 ln k 2 t ½ t ½ t ½ t ½ t
21 rozpad radioaktywny jest typowym przykładem reakcji 1-go rzędu 14 C, 239 Pu, 99 Tc 14 C 14 N β m( t) = m 0 e λt N( t) = N 0 λ stała rozpadu promieniotwórczego t- wiek minerału e λt
22 okres półtrwania 226 Ra 1622 lat 214 Po 1, s 212 Po s Zadanie Oblicz ile procent atomów pierwiastka promieniotwórczego E pozostanie w preparacie po 15 dniach, wiedząc, że okres jego połowicznego rozpadu wynosi τ 1/2 = 5 dni. 1/2 5 dni 50% 10 dni 25% 15 dni 12,5% 1 100% n 2 n- ilość okresów półtrwania
23 czas połowicznego rozpadu niektórych substancji toksycznych dla środowiska
24 reakcja II-go rzędu
25 reakcja 2-go rzędu 2 r = k[a] r = d[a] dt d[a] dt = k[a] 2 [ A ] t d[a] [A = 2 [ A] 0 ] t 0 kdt 1 [A] [ A] t A] [ 0 = kt t 0 1 [A] t 1 [A] 0 = kt
26 funkcja liniowa: y = ax + b 1/[A] t = kt + 1/[A] 0 1/[A] jeśli wykres 1/[A] t od czasu jest linią prostą wtedy reakcja jest 2-go rzędu. 1/[A] 0 nachylenie = k pkt. przecięcia = 1/[A] 0 czas połowicznej przemiany t ½ : 1 1 = kt = kt1/ 2 1 [A] 2 0 [A ] 0 1/ 2 t = 1/ 2 1 k[ A 0 ] 1 [A] 0 t
27 czas połowicznej przemiany dla reakcji 1-go rzędu 1 [A] t t = 1/ 2 k[ A 0 ] t ½ t ½ t ½ t
28 reakcja 2-go rzędu 2NO 2 2NO + O 2
29 2NO 2 2NO + O 2
30 reakcja III-go rzędu
31 Znamy bardzo niewiele reakcji III-go rzędu. Reakcja tego typu oznacza bowiem najczęściej konieczność równoczesnego zderzenia się 3 cząsteczek, co jest mało prawdopodobne. Przykładem reakcji III-go rzędu jest reakcja: 2 NO (g) + Br 2(g) = 2 NOBr (g) r = k[no] 2 [Br 2 ]
32 wyznaczanie rzędu reakcji
33 rząd szybkość c = f(t) t 1/2 0 d[a] dt = k [A] t = [A] 0 kt t 1 / 2 = [ A] 0 2k 1 d[a] dt = k[a] ln [A] t = kt [A] 0 t 1 / 2 = ln 2 k 2 d[a] dt = k[a] 2 1 [A] t = 1 [A] 0 + kt t = 1/ 2 1 k[ A 0 ]
34 jednostki stałej szybkości reakcji zerowego rzędu d[a] dt = k mol 3 dm s pierwszego rzędu drugiego rzędu d[a] = k[a] [ ] 1 s dt d[a] dt = k[a] 2 dm 3 mol s Jednostka stałej szybkości określa rząd reakcji
35 Zadanie Dane poniżej dotyczą następującej reakcji ` A + B C + D Wyznacz rząd reakcji oraz stałą szybkości reakcji. t/h 0 3,15 6,20 10,00 18,30 30,80 [A]/10-2 mol l -1 10,39 8,96 7,76 6,39 3,53 2,07 zerowego rzędu k [ A] 0 [ A] t t = 0,45 0,42 0,40 0,37 0,27 pierwszego rzędu k ln[ A] = 0 drugiego rzędu t ln[ A] 1 1 [ A] [ A] t t 0 k = t 0,05 0,05 0,05 0,06 0,05 reakcja jest pierwszego rzędu! k = 0,05 h -1
36
37 szybkość reakcji a temperatura
38 ze wzrostem temperatury szybkość wszystkich reakcji chemicznych zwiększa się
39 T1 < T2 < T3 t = constans
40
41 r =kf(c) Gdzie we wzorze na szybkość reakcji jest uwzględniony wpływu temperatury? stała szybkość reakcji zależy od T przykład: dla reakcji CH 3 NC CH 3 CN 190 C k 190 = s C k 250 = s -1
42 zależność szybkości reakcji od temperatury dobrze tłumaczy tzw. teoria zderzeń
43 A 2(g) + B 2(g) 2AB (g) różne orientacje w trakcie zderzenia A 2 i B 2
44 zderzenie efektywne produkt przejściowy
45 model zderzeniowy opisujący szybkość reakcji Aby zaszła reakcja cząsteczki muszą się zderzyć (im większe stężenie tym większe prawdopodobieństwo zderzenia cząsteczek, tym większa szybkość reakcji) Zderzenie musi mieć odpowiednią orientację (geometrię) tzw. zderzenie efektywne Zderzenie musi zajść z odpowiednią energią (im większa temperatura tym większa energia cząsteczek, tym zderzenia są efektywniejsze, a więc rośnie szybkość reakcji)
46 Teoria stanu przejściowego (transition state theory) Kompleks aktywny (wysoka energia, nietrwały, rozpada się na? k A + B AB* K k # A + B AB* C szybko wolno K = [AB*]/[A][B] v = k[a][b] v =k # [AB*] k = k # K
47
48
49
50 energia aktywacji
51 Równanie Arrheniusa k = Ae E a / RT A = czynnik częstości zderzeń (L/mol*s) E a = (kj/mol) R = J/mol*K
52 diagram energetyczny reakcji chemicznych E stan przejściowy substraty E a E produkty energia aktywacji E a = E (stan przej) E (substr) ciepło reakcji, energia reakcji E = E (prod) E (substr) reakcja endotermicznej
53 substraty produkt przejściowy produkty
54 stan przejściowy H Oδ + H H Cl δ - E a H 2 O + HCl H H 3 O + + Cl -
55 Jak wyznaczyć energię aktywacji?
56 metoda graficzna k E 1 k a = Ae E a / RT ln = ln A R T nachylenie = -E a /R pkt. przecięcia = lna
57 na podstawie dwóch punktów Zadanie Stała szybkości rozpadu pewnej substancji w temperaturze 24 C (297 K) wynosi 1, dm 3 /(mol s), a w temperaturze 37 C (310 K) 2, dm 3 /(mol s). Oblicz parametry Arrheniusa dla tej reakcji. R=8,314 J/(mol K) Ea 1 ln k = ln A R T ln ln k k 2 1 = = ln ln Ea A R A E R a 1 T1 1 T2 E a k1 R ln k2 = 1 1 T2 T1 2 1,7 10 8,314 ln 2 2,01 10 E a = = 9844, 4J
58 mechanizm reakcji
59 Mechanizm = postęp reakcji chemicznej opisany krok po kroku Mechanizm składa się z jednej lub więcej reakcji elementarnych, które w sumie muszą dać równanie reakcji Substancje tworzone w trakcie reakcji elementarnych a nie będące produktami nazywamy substancjami przejściowymi Pomiary kinetyczne dostarczają informacji o mechanizmie reakcji Proces o najwyższej wartości E a (najwolniejszy proces) nazywany jest etapem determinującym szybkość reakcji
60 znajomość etapu limitującego pozwala określić mechanizm NO 2(g) + CO (g) NO (g) + CO 2(g) Równanie empiryczne szybkość = k [NO 2 ] 2 Mechanizm 1: NO 2(g) + CO (g) NO (g) + CO 2(g) Mechanizm 2: 1: 2 NO 2(g) NO 3 (g) + NO (g) wolno (r.d.s.) 2: NO 3(g) + CO (g) NO 2(g) + CO 2(g) szybko 2 NO 2(g) + NO 3(g) + CO (g) NO 3(g) + NO (g) + NO 2(g) + CO 2(g) NO 2(g) + CO (g) NO (g) + CO 2(g) mechanizm 1 szybkość = k [NO 2 ] [CO] niezgodne z doświadczeniem mechanizm 2 szybkość = k [NO 2 ] 2 zgodne z doświadczeniem
61 mechanizm reakcji k 1 NO + Br 2 NOBr 2 k -1k2 reakcja szybka a więc szybko osiągnięta zostaje równowaga NOBr 2 + NO 2 NOBr reakcja wolna - limitująca slow RLS: r = k 2 [NOBr 2 ][NO] Produkt przejściowy W stanie równowagi: szybkość naprzód = szybkość wstecz k 1 [NO][Br 2 ] = k -1 [NOBr 2 ] lub [NOBr 2 ] = k 1 k -1 [NO][Br 2 ] r = k 1k 2 k -1 [NO] 2 [Br 2 ] = k[no] 2 [Br 2 ]
62 mechanizm (poprzez dimer N 2 O 2 ) NO + NO N 2 O 2 N 2 O 2 + Br 2 slow k 1 fast k 2 2 NOBr etap limitujący r = k 1 [NO][NO] = k 1 [NO] 2 1 1
63 konwersja trans do cis butenu
64 energia potrzebna do tej konwersji energia 233 kj produkt przejściowy 229 kj trans 3.9 kj/mol cis 30.2 kj/mol 26.9 kj/mol trans-buten jest bardziej stabilny od cis-butenu o około 4 kj/mol trans cis to proces endotermiczny
65 reakcje łańcuchowe
66 schemat tworzenia HBr W pierwszym etapie reakcji następuje rozpad cząsteczki Br 2 na 2 Br. propagacja Reakcja rozwija się gdy atomy Br reagują z H 2 tworząc HBr i H. terminacja inicjacja H reagując z cząsteczką Br 2 odtwarza atom Br oraz tworzy cząsteczkę HBr. Reakcja rozwija się dalej. propagacja Procesy niekorzystne (zakańczające ten proces) to np. H + H = H 2, H + Br = HBr Br + Br = Br 2.
67 reakcje wybuchowe to reakcje łańcuchowe eksplozja cieplna ma miejsce gdy rekcja egzotermiczna gwałtownie przyspiesza wraz z temperaturą. reakcja wybuchowa rozgałęziona ma miejsce gdy następuje rozgałęzienie łańcucha. zakres występowania eksplozji w reakcji H 2 z O 2
68 kataliza
69 Aby zwiększyć szybkość reakcji możemy: (1) Zwiększyć stężenie substratów (2) Podnieść temperaturę układu (3) Obniżyć energię aktywacji kataliza Bez katalizatora Z katalizatorem
70 Katalizator Substancja, która przyspiesza reakcję i nie jest zużywana w reakcji, którą katalizuje. Enzym Duża cząsteczka (zwykle białko) katalizująca reakcje biologiczne. Katalizę dzielimy na: Homogeniczną: katalizator stanowi tą samą fazę jak substraty. Heterogeniczną: Katalizator stanowi oddzielną fazę niż substraty.
71 Katalizator zwiększa szybkość reakcji (niewielka jego ilość pozwala zwiększyć szybkość reakcji dla dużej ilości reagentów) nie jest zużywany w katalizowanej reakcji (nie występuje w równaniu stechiometrycznym) nie zmienia stanu równowagi (stałej równowagi) katalizowanej reakcji
72 przykłady procesów katalitycznych Rozkład wody utlenionej przebiega powoli: 2 H 2 O 2 (aq) 2 H 2 O (l) + O 2 (g) Mechanizm: Dodatek KI przyspiesza reakcję step 1: H 2 O 2 (aq) + I (aq) H 2 O (l) + IO (aq) etap limitujący step 2: H 2 O 2 (aq) + IO (aq) H 2 O (l) + O 2 (g) + I (aq) szybko 2 H 2 O 2 (aq) 2 H 2 O (l) + O 2 (g) Szybkość reakcji = k [H 2 O 2 ] [I ]
73 podobny efekt wywołują jony Br - bez katalizatora z katalizatorem Energia
74 kataliza heterogeniczna C 2 H 4(g) + H 2(g) C 2 H 6(g) H = -136 kj/mol Reakcja przebiega powoli Obecność metali (Ni, Pt or Pd) przyspiesza reakcję
75 uwodornienie etenu
76 mechanizm: H 2 + C 2 H 4 + Pd H H H H H H H C H H C C H H C H C 2 H 6 + Pd
77 katalizator samochodowy
78 adsorpcja i kataliza Mechanizm Langmuira-Hinshelwooda (LH) r = kθ A Θ B Mechanizm Eleya-Rideala (ER) r = kθ A p B
79 Enzymy katalizatory biologiczne najczęściej enzymy są białkami o masie cząsteczkowej od 10 4 do 10 6 amu nitrogenaza
80
81
82 rozkład katalityczny N 2 O 2N 2 O 2N 2 + O H = 163 kj mol C = X = 1 C 0 exp( kt C 1 C0 E R k A e T = a s ) konwersja N2O 1,2 1,0 0,8 0,6 0,4 0,2 dane eksperymentalne model X = 1 e t s A e E a R T 0, T /K reakcja pierwszego rzędu
83 przykład pytania egzaminacyjnego: Zależność szybkości reakcji (k) od temperatury (T) opisuje następujące równanie (w którym A jest stałą, Ea oznacza energię aktywacji): A) k = A exp{ea/(rt)} B) ln (k) = ln(a) - Ea/(RT) C) ln (k) = Ea/(RT) - ln(a) B) k = A ln {Ea/(RT)} E) k = A ln{rt/ea}
fermentacja alkoholowa erozja skał lata dni KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 min Karkonosze Pielgrzymy (1204 m n.p.m.)
 Kinetyka chemiczna lata erozja skał Karkonosze Pielgrzymy (1204 m n.p.m.) fermentacja alkoholowa dni min KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 s ms fs http://www2.warwick.ac.uk/fac/sci/chemistry/research/stavros/stavrosgroup/overview/
Kinetyka chemiczna lata erozja skał Karkonosze Pielgrzymy (1204 m n.p.m.) fermentacja alkoholowa dni min KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 s ms fs http://www2.warwick.ac.uk/fac/sci/chemistry/research/stavros/stavrosgroup/overview/
KI + Pb(NO 3 ) 2 PbI 2 + KNO 3. fermentacja alkoholowa
 Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
KI + Pb(NO 3 ) 2 PbI 2 + KNO 3. fermentacja alkoholowa
 Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
Kinetyka chemiczna KI + Pb(NO 3 ) 2 PbI 2 + KNO 3 fermentacja alkoholowa czynniki wpływaj ywające na szybkość reakcji chemicznych stęż ężenie reagentów w (lub ciśnienie gazów w jeżeli eli reakcja przebiega
Kinetyka. energia swobodna, G. postęp reakcji. stan 1 stan 2. kinetyka
 Kinetyka postęp reakcji energia swobodna, G termodynamika kinetyka termodynamika stan 1 stan 2 Kinetyka Stawia dwa pytania: 1) Jak szybko biegną reakcje? 2) W jaki sposób przebiegają reakcje? 1) Jak szybko
Kinetyka postęp reakcji energia swobodna, G termodynamika kinetyka termodynamika stan 1 stan 2 Kinetyka Stawia dwa pytania: 1) Jak szybko biegną reakcje? 2) W jaki sposób przebiegają reakcje? 1) Jak szybko
Kinetyka. Kinetyka. Stawia dwa pytania: 1)Jak szybko biegną reakcje? 2) W jaki sposób przebiegają reakcje? energia swobodna, G. postęp reakcji.
 Kinetyka energia swobodna, G termodynamika stan 1 kinetyka termodynamika stan 2 postęp reakcji 1 Kinetyka Stawia dwa pytania: 1)Jak szybko biegną reakcje? 2) W jaki sposób przebiegają reakcje? 2 Jak szybko
Kinetyka energia swobodna, G termodynamika stan 1 kinetyka termodynamika stan 2 postęp reakcji 1 Kinetyka Stawia dwa pytania: 1)Jak szybko biegną reakcje? 2) W jaki sposób przebiegają reakcje? 2 Jak szybko
Inżynieria Biomedyczna
 1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
Inżynieria Biomedyczna
 1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
1.Obliczyć przy jakim stężeniu kwasu octowego stopień dysocjacji osiągnie wartość 3.%, jeżeli wiadomo, że stopień dysocjacji 15.%-wego roztworu (d=1.2 g/cm 3 ) w 2. Do 1 cm 3 2% (d=1.2 g/cm 3 ) roztworu
Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ
 Wprowadzenie Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ opracowanie: Barbara Stypuła Celem ćwiczenia jest poznanie roli katalizatora w procesach chemicznych oraz prostego sposobu wyznaczenia wpływu
Wprowadzenie Ćwiczenie IX KATALITYCZNY ROZKŁAD WODY UTLENIONEJ opracowanie: Barbara Stypuła Celem ćwiczenia jest poznanie roli katalizatora w procesach chemicznych oraz prostego sposobu wyznaczenia wpływu
Kinetyka reakcji chemicznych. Dr Mariola Samsonowicz
 Kinetyka reakcji chemicznych Dr Mariola Samsonowicz 1 Czym zajmuje się kinetyka chemiczna? Badaniem szybkości reakcji chemicznych poprzez analizę eksperymentalną i teoretyczną. Zdefiniowanie równania kinetycznego
Kinetyka reakcji chemicznych Dr Mariola Samsonowicz 1 Czym zajmuje się kinetyka chemiczna? Badaniem szybkości reakcji chemicznych poprzez analizę eksperymentalną i teoretyczną. Zdefiniowanie równania kinetycznego
Kinetyka i równowaga reakcji chemicznej
 Kinetyka i równowaga reakcji chemicznej W przebiegu reakcji chemicznych interesujące są dwa aspekty zachodzących przemian: 1. rodzaj substratów i otrzymanych z nich produktów, 2. szybkość, z jaką substraty
Kinetyka i równowaga reakcji chemicznej W przebiegu reakcji chemicznych interesujące są dwa aspekty zachodzących przemian: 1. rodzaj substratów i otrzymanych z nich produktów, 2. szybkość, z jaką substraty
PRACOWNIA CHEMII. Kinetyka reakcji chemicznych (Fiz1)
 PRACOWNIA CHEMII Ćwiczenia laboratoryjne dla studentów II roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Kinetyka reakcji chemicznych
PRACOWNIA CHEMII Ćwiczenia laboratoryjne dla studentów II roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Kinetyka reakcji chemicznych
Ćwiczenie 14. Maria Bełtowska-Brzezinska KINETYKA REAKCJI ENZYMATYCZNYCH
 Ćwiczenie 14 aria Bełtowska-Brzezinska KINETYKA REAKCJI ENZYATYCZNYCH Zagadnienia: Podstawowe pojęcia kinetyki chemicznej (szybkość reakcji, reakcje elementarne, rząd reakcji). Równania kinetyczne prostych
Ćwiczenie 14 aria Bełtowska-Brzezinska KINETYKA REAKCJI ENZYATYCZNYCH Zagadnienia: Podstawowe pojęcia kinetyki chemicznej (szybkość reakcji, reakcje elementarne, rząd reakcji). Równania kinetyczne prostych
Odwracalność przemiany chemicznej
 Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
Kinetyka chemiczna jest działem fizykochemii zajmującym się szybkością i mechanizmem reakcji chemicznych w różnych warunkach. a RT.
 Ćwiczenie 12, 13. Kinetyka chemiczna. Kinetyka chemiczna jest działem fizykochemii zajmującym się szybkością i mechanizmem reakcji chemicznych w różnych warunkach. Szybkość reakcji chemicznej jest związana
Ćwiczenie 12, 13. Kinetyka chemiczna. Kinetyka chemiczna jest działem fizykochemii zajmującym się szybkością i mechanizmem reakcji chemicznych w różnych warunkach. Szybkość reakcji chemicznej jest związana
Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu
 Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu Ćw. 4 Kinetyka reakcji chemicznych Zagadnienia do przygotowania: Szybkość reakcji chemicznej, zależność szybkości reakcji chemicznej
Przedmiot: Chemia budowlana Zakład Materiałoznawstwa i Technologii Betonu Ćw. 4 Kinetyka reakcji chemicznych Zagadnienia do przygotowania: Szybkość reakcji chemicznej, zależność szybkości reakcji chemicznej
relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
 1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
Wykład 4. Anna Ptaszek. 27 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Chemia fizyczna - wykład 4. Anna Ptaszek 1 / 31
 Wykład 4 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 27 października 2015 1 / 31 Podstawy kinetyki chemicznej pochodna funkcji i jej interpretacja, pojęcie szybkości i prędkości, stechiometria
Wykład 4 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 27 października 2015 1 / 31 Podstawy kinetyki chemicznej pochodna funkcji i jej interpretacja, pojęcie szybkości i prędkości, stechiometria
Dysocjacja kwasów i zasad. ponieważ stężenie wody w rozcieńczonym roztworze jest stałe to:
 Stała równowagi dysocjacji: Dysocjacja kwasów i zasad HX H 2 O H 3 O X - K a [ H 3O [ X [ HX [ H O 2 ponieważ stężenie wody w rozcieńczonym roztworze jest stałe to: K a [ H 3 O [ X [ HX Dla słabych kwasów
Stała równowagi dysocjacji: Dysocjacja kwasów i zasad HX H 2 O H 3 O X - K a [ H 3O [ X [ HX [ H O 2 ponieważ stężenie wody w rozcieńczonym roztworze jest stałe to: K a [ H 3 O [ X [ HX Dla słabych kwasów
ZADANIE 1 W temperaturze 700 K gazowa mieszanina dwutlenku węgla i wodoru reaguje z wytworzeniem pary wodnej i tlenku węgla. Stała równowagi reakcji
 ZADANIE 1 W temperaturze 700 K gazowa mieszanina dwutlenku węgla i wodoru reaguje z wytworzeniem pary wodnej i tlenku węgla. Stała równowagi reakcji w tej temperaturze wynosi K p = 0,11. Reaktor został
ZADANIE 1 W temperaturze 700 K gazowa mieszanina dwutlenku węgla i wodoru reaguje z wytworzeniem pary wodnej i tlenku węgla. Stała równowagi reakcji w tej temperaturze wynosi K p = 0,11. Reaktor został
Chemia fizyczna 2 - wykład
 Chemia fizyczna 2 - wykład Dr hab. inż. Aneta Pobudkowska-Mirecka Konsultacje: środa 12.15 14.00 (p.149) Chemia Fizyczna 2 - wykład Chemia kwantowa (prof. dr hab. Andrzej Sporzyński) Procesy (dr hab. inż.
Chemia fizyczna 2 - wykład Dr hab. inż. Aneta Pobudkowska-Mirecka Konsultacje: środa 12.15 14.00 (p.149) Chemia Fizyczna 2 - wykład Chemia kwantowa (prof. dr hab. Andrzej Sporzyński) Procesy (dr hab. inż.
Wykład 4. Anna Ptaszek. 9 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Chemia fizyczna - wykład 4. Anna Ptaszek 1 / 29
 Wykład 4 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 9 października 2015 1 / 29 Podstawy kinetyki chemicznej pochodna funkcji i jej interpretacja, pojęcie szybkości i prędkości, stechiometria
Wykład 4 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 9 października 2015 1 / 29 Podstawy kinetyki chemicznej pochodna funkcji i jej interpretacja, pojęcie szybkości i prędkości, stechiometria
Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych
 Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych I. Reakcje egzoenergetyczne i endoenergetyczne 1. Układ i otoczenie Układ - ogół substancji
Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych I. Reakcje egzoenergetyczne i endoenergetyczne 1. Układ i otoczenie Układ - ogół substancji
CZYNNIKI WPŁYWAJĄCE NA SZYBKOŚĆ REAKCJI CHEMICZNYCH. ILOŚCIOWE ZBADANIE SZYBKOŚCI ROZPADU NADTLENKU WODORU.
 CZYNNIKI WPŁYWAJĄCE NA SZYBKOŚĆ REAKCJI CHEMICZNYCH. ILOŚCIOWE ZBADANIE SZYBKOŚCI ROZPADU NADTLENKU WODORU. Projekt zrealizowany w ramach Mazowieckiego programu stypendialnego dla uczniów szczególnie uzdolnionych
CZYNNIKI WPŁYWAJĄCE NA SZYBKOŚĆ REAKCJI CHEMICZNYCH. ILOŚCIOWE ZBADANIE SZYBKOŚCI ROZPADU NADTLENKU WODORU. Projekt zrealizowany w ramach Mazowieckiego programu stypendialnego dla uczniów szczególnie uzdolnionych
Chemia ogólna nieorganiczna Wykład XII Kinetyka i statyka chemiczna
 Chemia ogólna nieorganiczna Wykład 10 14 XII 2016 Kinetyka i statyka chemiczna Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od
Chemia ogólna nieorganiczna Wykład 10 14 XII 2016 Kinetyka i statyka chemiczna Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od
Wykład 21 XI 2018 Żywienie
 Wykład 21 XI 2018 Żywienie Witold Bekas SGGW Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od warunków przebiegu reakcji pomaga
Wykład 21 XI 2018 Żywienie Witold Bekas SGGW Elementy kinetyki i statyki chemicznej bada drogi przemiany substratów w produkty szybkość(v) reakcji chem. i zależność od warunków przebiegu reakcji pomaga
Jak mierzyć i jak liczyć efekty cieplne reakcji?
 Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia Zdolność do wykonywania pracy lub do produkowania ciepła Praca objętościowa praca siła odległość 06_73 P F A W F h N m J P F A Area A ciśnienie
Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia Zdolność do wykonywania pracy lub do produkowania ciepła Praca objętościowa praca siła odległość 06_73 P F A W F h N m J P F A Area A ciśnienie
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA
 SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym
 1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych
 Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych 1. Równanie kinetyczne, szybkość reakcji, rząd i cząsteczkowość reakcji. Zmiana szybkości reakcji na skutek zmiany
Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych 1. Równanie kinetyczne, szybkość reakcji, rząd i cząsteczkowość reakcji. Zmiana szybkości reakcji na skutek zmiany
Kataliza heterogenna (heterogeniczna)
 Kataliza heterogenna (heterogeniczna) ma miejsce, gdy katalizator i reagenty znajdują się w różnych fazach. Substraty osadzają się na powierzchni katalizatora (adsorpcja) i reagują ze sobą. Następnie gotowy
Kataliza heterogenna (heterogeniczna) ma miejsce, gdy katalizator i reagenty znajdują się w różnych fazach. Substraty osadzają się na powierzchni katalizatora (adsorpcja) i reagują ze sobą. Następnie gotowy
KATALITYCZNY ROZKŁAD WODY UTLENIONEJ
 Dorota Warmińska, Maciej Śmiechowski Katedra Chemii Fizycznej, Wydział Chemiczny, Politechnika Gdańska KATALITYCZNY ROZKŁAD WODY UTLENIONEJ Wstęp teoretyczny Kataliza homo- i heterogeniczna Zwiększenie
Dorota Warmińska, Maciej Śmiechowski Katedra Chemii Fizycznej, Wydział Chemiczny, Politechnika Gdańska KATALITYCZNY ROZKŁAD WODY UTLENIONEJ Wstęp teoretyczny Kataliza homo- i heterogeniczna Zwiększenie
3. Badanie kinetyki enzymów
 3. Badanie kinetyki enzymów Przy stałym stężeniu enzymu, a przy zmieniającym się początkowym stężeniu substratu, zmiany szybkości reakcji katalizy, wyrażonej jako liczba moli substratu przetworzonego w
3. Badanie kinetyki enzymów Przy stałym stężeniu enzymu, a przy zmieniającym się początkowym stężeniu substratu, zmiany szybkości reakcji katalizy, wyrażonej jako liczba moli substratu przetworzonego w
ĆWICZENIE NR 11 KINETYKA WYMIANY IZOTOPOWEJ W UKŁADZIE HOMOGENICZNYM
 ĆWICZENIE NR 11 KINETYKA WYMIANY IZOTOPOWEJ W UKŁADZIE HOMOGENICZNYM Podstawy fizyczne Przez reakcję wymiany izotopowej rozumie się taką reakcję chemiczną, w czasie której izotopowe atomy określonego pierwiastka
ĆWICZENIE NR 11 KINETYKA WYMIANY IZOTOPOWEJ W UKŁADZIE HOMOGENICZNYM Podstawy fizyczne Przez reakcję wymiany izotopowej rozumie się taką reakcję chemiczną, w czasie której izotopowe atomy określonego pierwiastka
VIII Podkarpacki Konkurs Chemiczny 2015/2016
 III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
Równowaga to stan w którym nie obserwuje się zmian wraz z upływem czasu
 Równowaa chemiczna Równowaa to stan w którym nie obserwuje się zmian wraz z upływem czasu Reakcja chemiczna osiąa stan równowai dy stężenia substratów i produktów nie uleają zmianie pozostają stałe. ozornie
Równowaa chemiczna Równowaa to stan w którym nie obserwuje się zmian wraz z upływem czasu Reakcja chemiczna osiąa stan równowai dy stężenia substratów i produktów nie uleają zmianie pozostają stałe. ozornie
Podział reakcji chemicznych. 5. Reakcje chemiczne
 014-11-6 5. Reakcje chemiczne a. Rodzaje reakcji b. Równania reakcji - stechiometria c. Wydajność reakcji d. Teoria zderzeń aktywnych e. Szybkość reakcji chemicznych - rodzaj substratów - stężenie substratów
014-11-6 5. Reakcje chemiczne a. Rodzaje reakcji b. Równania reakcji - stechiometria c. Wydajność reakcji d. Teoria zderzeń aktywnych e. Szybkość reakcji chemicznych - rodzaj substratów - stężenie substratów
Reakcje enzymatyczne. Co to jest enzym? Grupy katalityczne enzymu. Model Michaelisa-Mentena. Hamowanie reakcji enzymatycznych. Reakcje enzymatyczne
 Reakcje enzymatyczne Enzym białko katalizujące reakcje chemiczne w układach biologicznych (przyśpieszają reakcje przynajmniej 0 6 raza) 878, Wilhelm uehne, użył po raz pierwszy określenia enzym (w zaczynie)
Reakcje enzymatyczne Enzym białko katalizujące reakcje chemiczne w układach biologicznych (przyśpieszają reakcje przynajmniej 0 6 raza) 878, Wilhelm uehne, użył po raz pierwszy określenia enzym (w zaczynie)
1 Kinetyka reakcji chemicznych
 Podstawy obliczeń chemicznych 1 1 Kinetyka reakcji chemicznych Szybkość reakcji chemicznej definiuje się jako ubytek stężenia substratu lub wzrost stężenia produktu w jednostce czasu. ν = c [ ] 2 c 1 mol
Podstawy obliczeń chemicznych 1 1 Kinetyka reakcji chemicznych Szybkość reakcji chemicznej definiuje się jako ubytek stężenia substratu lub wzrost stężenia produktu w jednostce czasu. ν = c [ ] 2 c 1 mol
Pojęcia podstawowe 1
 Tomasz Lubera Pojęcia podsawowe aa + bb + dd + pp + rr + ss + Kineyka chemiczna dział chemii fizycznej zajmujący się przebiegiem reakcji chemicznych w czasie, ich mechanizmami oraz wpływem różnych czynników
Tomasz Lubera Pojęcia podsawowe aa + bb + dd + pp + rr + ss + Kineyka chemiczna dział chemii fizycznej zajmujący się przebiegiem reakcji chemicznych w czasie, ich mechanizmami oraz wpływem różnych czynników
c t x v KINETYKA CHEMICZNA
 KINETYKA CHEMICZNA Prawa termodynamiki chemicznej pozwalają nam przewidzieć tylko możliwy kierunek przemian w układzie reagentów oraz ilość poszczególnych składników znajdujących się w układzie w momencie
KINETYKA CHEMICZNA Prawa termodynamiki chemicznej pozwalają nam przewidzieć tylko możliwy kierunek przemian w układzie reagentów oraz ilość poszczególnych składników znajdujących się w układzie w momencie
Podstawy kinetyki i termodynamiki chemicznej. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Podstawy kinetyki i termodynamiki chemicznej Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Układ i otoczenie Układem - część środowiska, która stanowi przedmiot naszych badań pojęcie abstrakcyjne,
Podstawy kinetyki i termodynamiki chemicznej Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Układ i otoczenie Układem - część środowiska, która stanowi przedmiot naszych badań pojęcie abstrakcyjne,
Ćwiczenie 8 Wyznaczanie stałej szybkości reakcji utleniania jonów tiosiarczanowych
 CHEMI FIZYCZN Ćwiczenie 8 Wyznaczanie stałej szybkości reakcji utleniania jonów tiosiarczanowych W ćwiczeniu przeprowadzana jest reakcja utleniania jonów tiosiarczanowych za pomocą jonów żelaza(iii). Przebieg
CHEMI FIZYCZN Ćwiczenie 8 Wyznaczanie stałej szybkości reakcji utleniania jonów tiosiarczanowych W ćwiczeniu przeprowadzana jest reakcja utleniania jonów tiosiarczanowych za pomocą jonów żelaza(iii). Przebieg
Kinetyka reakcji chemicznych
 Kinetya reacji chemicznych Metody doświadczalne Reacje powolne (> s) do analizy Reacje szybie ( -3 s) detetor v x x t tx/v Reacje b. szybie ( -4-4 s) (fotochemiczne) wzbudzenie analiza Szybość reacji aa
Kinetya reacji chemicznych Metody doświadczalne Reacje powolne (> s) do analizy Reacje szybie ( -3 s) detetor v x x t tx/v Reacje b. szybie ( -4-4 s) (fotochemiczne) wzbudzenie analiza Szybość reacji aa
Enzymologia I. Kinetyka - program Gepasi. Uniwersytet Warszawski Wydział Biologii Zakład Regulacji Metabolizmu
 Enzymologia I Kinetyka - program Gepasi Uniwersytet Warszawski Wydział Biologii Zakład Regulacji Metabolizmu I zasada + II zasada termodynamiki zmiana entalpii i entropii może zostać wyrażona ilościowo
Enzymologia I Kinetyka - program Gepasi Uniwersytet Warszawski Wydział Biologii Zakład Regulacji Metabolizmu I zasada + II zasada termodynamiki zmiana entalpii i entropii może zostać wyrażona ilościowo
TERMOCHEMIA. TERMOCHEMIA: dział chemii, który bada efekty cieplne towarzyszące reakcjom chemicznym w oparciu o zasady termodynamiki.
 1 TERMOCHEMIA TERMOCHEMIA: dział chemii, który bada efekty cieplne towarzyszące reakcjom chemicznym w oparciu o zasady termodynamiki. TERMODYNAMIKA: opis układu w stanach o ustalonych i niezmiennych w
1 TERMOCHEMIA TERMOCHEMIA: dział chemii, który bada efekty cieplne towarzyszące reakcjom chemicznym w oparciu o zasady termodynamiki. TERMODYNAMIKA: opis układu w stanach o ustalonych i niezmiennych w
Terminy. Omówienie kolokwium I. Poprawa kolokwium I. Poprawa kolokwium II g. 15, s g. 15, s g. 15, s.
 Tomasz Lubera Omówienie kolokwium I 14.05 g. 15, s. 402 Poprawa kolokwium I 21.05 g. 15, s. 402 Poprawa kolokwium II 28.05 g. 15, s. 402 Terminy Ćwiczenia rachunkowe z chemii fizycznej - Kolokwium II 2
Tomasz Lubera Omówienie kolokwium I 14.05 g. 15, s. 402 Poprawa kolokwium I 21.05 g. 15, s. 402 Poprawa kolokwium II 28.05 g. 15, s. 402 Terminy Ćwiczenia rachunkowe z chemii fizycznej - Kolokwium II 2
Chemia fizyczna (2013/2014) kinetyka chemiczna
 Chemia fizyczna (01/014) kinetyka chemiczna Zadanie 1. Dla reakcji rozkładu N O 5 4NO +O w roztworze CCl 4, w warunkach T,V=const w temperaturze 45 o C otrzymano następującą zależność stężenia N O 5 (A)
Chemia fizyczna (01/014) kinetyka chemiczna Zadanie 1. Dla reakcji rozkładu N O 5 4NO +O w roztworze CCl 4, w warunkach T,V=const w temperaturze 45 o C otrzymano następującą zależność stężenia N O 5 (A)
Badanie kinetyki katalitycznego rozkładu H 2 O 2
 Badanie kinetyki katalitycznego rozkładu H 2 O 2 (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zapoznanie się z prawami kinetyki chemicznej, sposobem wyznaczenia stałej szybkości i rzędu reakcji
Badanie kinetyki katalitycznego rozkładu H 2 O 2 (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zapoznanie się z prawami kinetyki chemicznej, sposobem wyznaczenia stałej szybkości i rzędu reakcji
Jak mierzyć i jak liczyć efekty cieplne reakcji?
 Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia Zdolność do wykonywania pracy lub produkowania ciepła Praca objętościowa praca siła odległość 06_73 P F A W F h N m J P F A Area A ciśnienie siła/powierzchnia
Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia Zdolność do wykonywania pracy lub produkowania ciepła Praca objętościowa praca siła odległość 06_73 P F A W F h N m J P F A Area A ciśnienie siła/powierzchnia
Wyznaczanie stałej szybkości reakcji wymiany jonowej
 Wyznaczanie stałej szybkości reakcji wymiany jonowej Ćwiczenie laboratoryjne nr 4 Elementy termodynamiki i kinetyki procesowej Anna Ptaszek Elementy kinetyki chemicznej Pojęcie szybkości reakcji Pojęcie
Wyznaczanie stałej szybkości reakcji wymiany jonowej Ćwiczenie laboratoryjne nr 4 Elementy termodynamiki i kinetyki procesowej Anna Ptaszek Elementy kinetyki chemicznej Pojęcie szybkości reakcji Pojęcie
VI Podkarpacki Konkurs Chemiczny 2013/2014
 VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
Laboratorium 5. Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna
 Laboratorium 5 Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Szybkość reakcji enzymatycznej zależy przede wszystkim od stężenia substratu
Laboratorium 5 Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Szybkość reakcji enzymatycznej zależy przede wszystkim od stężenia substratu
Wykład 10 Równowaga chemiczna
 Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
Chemia - laboratorium
 Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Chemia - laboratorium Wydział Geologii, Geofizyki i Ochrony Środowiska Studia stacjonarne, Rok I, Semestr zimowy 013/14 Dr hab. inż. Tomasz Brylewski e-mail: brylew@agh.edu.pl tel. 1-617-59 Katedra Fizykochemii
Materiały do zajęć dokształcających z chemii nieorganicznej i fizycznej. Część IV - Elementy termodynamiki i kinetyki chemicznej
 Materiały do zajęć dokształcających z chemii nieorganicznej i fizycznej Część IV - Elementy termodynamiki i kinetyki chemicznej Wydział Chemii UAM Poznań 2011 POJĘCIA CIA PODSTAWOWE UKŁAD AD pewna część
Materiały do zajęć dokształcających z chemii nieorganicznej i fizycznej Część IV - Elementy termodynamiki i kinetyki chemicznej Wydział Chemii UAM Poznań 2011 POJĘCIA CIA PODSTAWOWE UKŁAD AD pewna część
a. Dobierz współczynniki w powyższym schemacie tak, aby stał się równaniem reakcji chemicznej.
 Zadanie 1. Nitrogliceryna (C 3 H 5 N 3 O 9 ) jest środkiem wybuchowym. Jej rozkład można opisać następującym schematem: C 3 H 5 N 3 O 9 (c) N 2 (g) + CO 2 (g) + H 2 O (g) + O 2 (g) H rozkładu = - 385 kj/mol
Zadanie 1. Nitrogliceryna (C 3 H 5 N 3 O 9 ) jest środkiem wybuchowym. Jej rozkład można opisać następującym schematem: C 3 H 5 N 3 O 9 (c) N 2 (g) + CO 2 (g) + H 2 O (g) + O 2 (g) H rozkładu = - 385 kj/mol
TYPY REAKCJI CHEMICZNYCH
 1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
Model odpowiedzi i schemat oceniania arkusza I
 Model odpowiedzi i schemat oceniania arkusza I Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Gdy do jednego polecenia zdający poda dwie
Model odpowiedzi i schemat oceniania arkusza I Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Gdy do jednego polecenia zdający poda dwie
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I ... ... czas trwania: 90 min Nazwa szkoły
 V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
Wzory sumaryczne i strukturalne związków
 Wzory sumaryczne i strukturalne związków H S H 3 PO 4 SO CH 4 H SO 4 OHC H 5 NH Wzory sumaryczne i strukturalne związków H SO 4 CuSO 4 siarczanvi miedziii K SO 4 siarczanvi potasu Fe SO 4 3 siarczanvi
Wzory sumaryczne i strukturalne związków H S H 3 PO 4 SO CH 4 H SO 4 OHC H 5 NH Wzory sumaryczne i strukturalne związków H SO 4 CuSO 4 siarczanvi miedziii K SO 4 siarczanvi potasu Fe SO 4 3 siarczanvi
X / \ Y Y Y Z / \ W W ... imię i nazwisko,nazwa szkoły, miasto
 Zadanie 1. (3 pkt) Nadtlenek litu (Li 2 O 2 ) jest ciałem stałym, występującym w temperaturze pokojowej w postaci białych kryształów. Stosowany jest w oczyszczaczach powietrza, gdzie ważna jest waga użytego
Zadanie 1. (3 pkt) Nadtlenek litu (Li 2 O 2 ) jest ciałem stałym, występującym w temperaturze pokojowej w postaci białych kryształów. Stosowany jest w oczyszczaczach powietrza, gdzie ważna jest waga użytego
I piętro p. 131 A, 138
 CHEMIA NIEORGANICZNA Dr hab. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I piętro p. 131 A, 138 WYKŁAD - 4 RÓWNOWAGA Termochemia i termodynamika funkcje termodynamiczne, prawa termodynamiki,
CHEMIA NIEORGANICZNA Dr hab. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I piętro p. 131 A, 138 WYKŁAD - 4 RÓWNOWAGA Termochemia i termodynamika funkcje termodynamiczne, prawa termodynamiki,
ogromna liczba małych cząsteczek, doskonale elastycznych, poruszających się we wszystkich kierunkach, tory prostoliniowe, kierunek ruchu zmienia się
 CHEMIA NIEORGANICZNA Dr hab. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I pietro p. 138 WYKŁAD - STAN GAZOWY i CHEMIA GAZÓW kinetyczna teoria gazów ogromna liczba małych cząsteczek, doskonale
CHEMIA NIEORGANICZNA Dr hab. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I pietro p. 138 WYKŁAD - STAN GAZOWY i CHEMIA GAZÓW kinetyczna teoria gazów ogromna liczba małych cząsteczek, doskonale
a) 1 mol b) 0,5 mola c) 1,7 mola d) potrzebna jest znajomość objętości zbiornika, aby można było przeprowadzić obliczenia
 1. Oblicz wartość stałej równowagi reakcji: 2HI H 2 + I 2 w temperaturze 600K, jeśli wiesz, że stężenia reagentów w stanie równowagi wynosiły: [HI]=0,2 mol/dm 3 ; [H 2 ]=0,02 mol/dm 3 ; [I 2 ]=0,024 mol/dm
1. Oblicz wartość stałej równowagi reakcji: 2HI H 2 + I 2 w temperaturze 600K, jeśli wiesz, że stężenia reagentów w stanie równowagi wynosiły: [HI]=0,2 mol/dm 3 ; [H 2 ]=0,02 mol/dm 3 ; [I 2 ]=0,024 mol/dm
Podstawy termodynamiki
 Podstawy termodynamiki Organizm żywy z punktu widzenia termodynamiki Parametry stanu Funkcje stanu: U, H, F, G, S I zasada termodynamiki i prawo Hessa II zasada termodynamiki Kierunek przemian w warunkach
Podstawy termodynamiki Organizm żywy z punktu widzenia termodynamiki Parametry stanu Funkcje stanu: U, H, F, G, S I zasada termodynamiki i prawo Hessa II zasada termodynamiki Kierunek przemian w warunkach
KINETYKA INWERSJI SACHAROZY
 Dorota Warmińska, Maciej Śmiechowski Katedra Chemii Fizycznej, Wydział Chemiczny, Politechnika Gdańska KINETYKA INWERSJI SACHAROZY Wstęp teoretyczny Kataliza kwasowo-zasadowa Kataliza kwasowo-zasadowa
Dorota Warmińska, Maciej Śmiechowski Katedra Chemii Fizycznej, Wydział Chemiczny, Politechnika Gdańska KINETYKA INWERSJI SACHAROZY Wstęp teoretyczny Kataliza kwasowo-zasadowa Kataliza kwasowo-zasadowa
LABORATORIUM Z KATALIZY HOMOGENICZNEJ I HETEROGENICZNEJ WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI UTLENIANIA POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY
 POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA FIZYKOCHEMII I TECHNOLOGII POLIMERÓW WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI UTLENIANIA JONÓW TIOSIARCZANOWYCH Miejsce ćwiczenia: Zakład Chemii Fizycznej, sala
POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA FIZYKOCHEMII I TECHNOLOGII POLIMERÓW WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI UTLENIANIA JONÓW TIOSIARCZANOWYCH Miejsce ćwiczenia: Zakład Chemii Fizycznej, sala
Aby zwiększyć szybkość reakcji możemy: (1) Zwiększyć stężenie substratów (2) Podnieść temperaturę (3) Obniżyć energię aktywacji kataliza
 kataliza Aby zwiększyć szybkość reakcji możemy: (1) Zwiększyć stężenie substratów (2) Podnieść temperaturę (3) Obniżyć energię aktywacji kataliza Bez katalizatora Z katalizatorem Katalizator Substancja,
kataliza Aby zwiększyć szybkość reakcji możemy: (1) Zwiększyć stężenie substratów (2) Podnieść temperaturę (3) Obniżyć energię aktywacji kataliza Bez katalizatora Z katalizatorem Katalizator Substancja,
Układ Graficzny przygotowano na podstawie materiałów egzaminacyjnych CKE
 Układ Graficzny przygotowano na podstawie materiałów egzaminacyjnych CKE WPISUJE ZDAJĄCY KOD KOD PESEL PESEL Miejsce na naklejkę z kodem EGZAMIN MATURALNY Z CHEMII (KINETYKA I RÓWNOWAGA CHEMICZNA - A)
Układ Graficzny przygotowano na podstawie materiałów egzaminacyjnych CKE WPISUJE ZDAJĄCY KOD KOD PESEL PESEL Miejsce na naklejkę z kodem EGZAMIN MATURALNY Z CHEMII (KINETYKA I RÓWNOWAGA CHEMICZNA - A)
Definicja szybkości reakcji
 Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany. v zas zmiana stężenia potrzebny do zajśia
Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany. v zas zmiana stężenia potrzebny do zajśia
EFEKT SOLNY BRÖNSTEDA
 EFEKT SLNY RÖNSTED Pojęcie eektu solnego zostało wprowadzone przez rönsteda w celu wytłumaczenia wpływu obojętnego elektrolitu na szybkość reakcji zachodzących między jonami. Założył on, że reakcja pomiędzy
EFEKT SLNY RÖNSTED Pojęcie eektu solnego zostało wprowadzone przez rönsteda w celu wytłumaczenia wpływu obojętnego elektrolitu na szybkość reakcji zachodzących między jonami. Założył on, że reakcja pomiędzy
WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI I ENERGII AKTYWACJI
 Ćwiczenie nr 4 WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI I ENERGII AKTYWACJI I. Cel ćwiczenia Celem ćwiczenia jest wyznaczenie stałej szybkości reakcji zmydlania estru etylowego w dwóch różnych temperaturach,
Ćwiczenie nr 4 WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI I ENERGII AKTYWACJI I. Cel ćwiczenia Celem ćwiczenia jest wyznaczenie stałej szybkości reakcji zmydlania estru etylowego w dwóch różnych temperaturach,
imię i nazwisko, nazwa szkoły, miejscowość Zadania I etapu Konkursu Chemicznego Trzech Wydziałów PŁ V edycja
 Zadanie 1 (2 pkt.) Zmieszano 80 cm 3 roztworu CH3COOH o stężeniu 5% wag. i gęstości 1,006 g/cm 3 oraz 70 cm 3 roztworu CH3COOK o stężeniu 0,5 mol/dm 3. Obliczyć ph powstałego roztworu. Jak zmieni się ph
Zadanie 1 (2 pkt.) Zmieszano 80 cm 3 roztworu CH3COOH o stężeniu 5% wag. i gęstości 1,006 g/cm 3 oraz 70 cm 3 roztworu CH3COOK o stężeniu 0,5 mol/dm 3. Obliczyć ph powstałego roztworu. Jak zmieni się ph
Procentowa zawartość sodu (w molu tej soli są dwa mole sodu) wynosi:
 Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Definicja szybkości reakcji
 Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany. v zas zmiana stężenia potrzebny do zajśia
Definija szybkośi reakji Szybkość reakji definiuje się jako stosunek zmiany stężenia substratów lub produktów reakji do zasu potrzebnego do zajśia tej zmiany. v zas zmiana stężenia potrzebny do zajśia
EGZAMIN MATURALNY Z CHEMII
 1 ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE DO MOMENTU ROZPOCZĘCIA EGZAMINU! EGZAMIN MATURALNY Z CHEMII MCH P1 MARZEC ROK 2012 POZIOM podstawowy Czas pracy 120 minut Instrukcja dla zdającego 1. Sprawdź,
1 ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE DO MOMENTU ROZPOCZĘCIA EGZAMINU! EGZAMIN MATURALNY Z CHEMII MCH P1 MARZEC ROK 2012 POZIOM podstawowy Czas pracy 120 minut Instrukcja dla zdającego 1. Sprawdź,
1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego:
 1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego: 2. Określ w którą stronę przesunie się równowaga reakcji rozkładu
1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego: 2. Określ w którą stronę przesunie się równowaga reakcji rozkładu
Za poprawną metodę Za poprawne obliczenia wraz z podaniem zmiany ph
 Zadanie 1 ( pkt.) Zmieszano 80 cm roztworu CHCH o stężeniu 5% wag. i gęstości 1,006 g/cm oraz 70 cm roztworu CHCK o stężeniu 0,5 mol/dm. bliczyć ph powstałego roztworu. Jak zmieni się ph roztworu po wprowadzeniu
Zadanie 1 ( pkt.) Zmieszano 80 cm roztworu CHCH o stężeniu 5% wag. i gęstości 1,006 g/cm oraz 70 cm roztworu CHCK o stężeniu 0,5 mol/dm. bliczyć ph powstałego roztworu. Jak zmieni się ph roztworu po wprowadzeniu
Węglowodory poziom podstawowy
 Węglowodory poziom podstawowy Zadanie 1. (2 pkt) Źródło: CKE 2010 (PP), zad. 19. W wyniku całkowitego spalenia 1 mola cząsteczek węglowodoru X powstały 2 mole cząsteczek wody i 3 mole cząsteczek tlenku
Węglowodory poziom podstawowy Zadanie 1. (2 pkt) Źródło: CKE 2010 (PP), zad. 19. W wyniku całkowitego spalenia 1 mola cząsteczek węglowodoru X powstały 2 mole cząsteczek wody i 3 mole cząsteczek tlenku
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
PRÓBNY EGZAMIN MATURALNY Z CHEMII
 Wpisuje zdający przed rozpoczęciem pracy PESEL ZDAJĄ CEGO Miejsce na nalepkę z kodem szkoły Instrukcja dla zdającego PRÓBNY EGZAMIN MATURALNY Z CHEMII Arkusz II (dla poziomu rozszerzonego) Czas pracy 120
Wpisuje zdający przed rozpoczęciem pracy PESEL ZDAJĄ CEGO Miejsce na nalepkę z kodem szkoły Instrukcja dla zdającego PRÓBNY EGZAMIN MATURALNY Z CHEMII Arkusz II (dla poziomu rozszerzonego) Czas pracy 120
Termochemia elementy termodynamiki
 Termochemia elementy termodynamiki Termochemia nauka zajmująca się badaniem efektów cieplnych reakcji chemicznych Zasada zachowania energii Energia całkowita jest sumą energii kinetycznej i potencjalnej.
Termochemia elementy termodynamiki Termochemia nauka zajmująca się badaniem efektów cieplnych reakcji chemicznych Zasada zachowania energii Energia całkowita jest sumą energii kinetycznej i potencjalnej.
BIOTECHNOLOGIA. Materiały do ćwiczeń rachunkowych z chemii fizycznej kinetyka chemiczna, 2014/15
 BIOTECHNOLOGIA Materiały do ćwiczeń rachunkowych z chemii fizycznej kinetyka chemiczna, 014/15 Zadanie 1. (*) W temperaturze 45 o C badano reakcję rozkładu tlenku azotu (V) w roztworze CCl4 (T, V = const.)
BIOTECHNOLOGIA Materiały do ćwiczeń rachunkowych z chemii fizycznej kinetyka chemiczna, 014/15 Zadanie 1. (*) W temperaturze 45 o C badano reakcję rozkładu tlenku azotu (V) w roztworze CCl4 (T, V = const.)
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II
 TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 2014/2015. Etap wojewódzki
 Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 04/05 Etap wojewódzki Klucz odpowiedzi i schemat punktowania Część I. Test jednokrotnego wyboru z jedną poprawną odpowiedzią
Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 04/05 Etap wojewódzki Klucz odpowiedzi i schemat punktowania Część I. Test jednokrotnego wyboru z jedną poprawną odpowiedzią
Termochemia efekty energetyczne reakcji
 Termochemia efekty energetyczne reakcji 1. Podstawowe pojęcia termodynamiki chemicznej a) Układ i otoczenie Układ, to wyodrębniony obszar materii, oddzielony od otoczenia wyraźnymi granicami (np. reagenty
Termochemia efekty energetyczne reakcji 1. Podstawowe pojęcia termodynamiki chemicznej a) Układ i otoczenie Układ, to wyodrębniony obszar materii, oddzielony od otoczenia wyraźnymi granicami (np. reagenty
III Podkarpacki Konkurs Chemiczny 2010/2011. ETAP I r. Godz Zadanie 1
 III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
c. Oblicz wydajność reakcji rozkładu 200 g nitrogliceryny, jeśli otrzymano w niej 6,55 g tlenu.
 Zadanie 1. Nitrogliceryna (C 3H 5N 3O 9) jest środkiem wybuchowym. Jej rozkład można opisać następującym schematem: 4 C 3 H 5 N 3 O 9 (c) 6 N 2 (g) + 12 CO 2 (g) + 10 H 2 O (g) + 1 O 2 (g) H rozkładu =
Zadanie 1. Nitrogliceryna (C 3H 5N 3O 9) jest środkiem wybuchowym. Jej rozkład można opisać następującym schematem: 4 C 3 H 5 N 3 O 9 (c) 6 N 2 (g) + 12 CO 2 (g) + 10 H 2 O (g) + 1 O 2 (g) H rozkładu =
MODEL ODPOWIEDZI I SCHEMAT OCENIANIA ARKUSZA II
 MDEL DPWIEDZI I SEMAT ENIANIA ARKUSZA II. Zdający otrzymuje punkty tylko za całkowicie prawidłową odpowiedź.. Gdy do jednego polecenia są dwie odpowiedzi (jedna prawidłowa, druga nieprawidłowa), to zdający
MDEL DPWIEDZI I SEMAT ENIANIA ARKUSZA II. Zdający otrzymuje punkty tylko za całkowicie prawidłową odpowiedź.. Gdy do jednego polecenia są dwie odpowiedzi (jedna prawidłowa, druga nieprawidłowa), to zdający
Wpływ wybranych czynników na efektywność procesu
 POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA TECHNOLOGII CHEMICZNEJ ORGANICZNEJ I PETROCHEMII INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH: Wpływ wybranych czynników na efektywność procesu Laboratorium z przedmiotu:
POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA TECHNOLOGII CHEMICZNEJ ORGANICZNEJ I PETROCHEMII INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH: Wpływ wybranych czynników na efektywność procesu Laboratorium z przedmiotu:
Przemiany/Reakcje chemiczne
 Przemiany/Reakcje chemiczne Przemiany/Reakcje chemiczne Reakcje chemiczne są to takie przemiany, w wyniku których z jednych substancji powstają inne substancje, o zupełnie odmiennych właściwościach fizycznych
Przemiany/Reakcje chemiczne Przemiany/Reakcje chemiczne Reakcje chemiczne są to takie przemiany, w wyniku których z jednych substancji powstają inne substancje, o zupełnie odmiennych właściwościach fizycznych
POLITECHNIKA POZNAŃSKA ZAKŁAD CHEMII FIZYCZNEJ ĆWICZENIA PRACOWNI CHEMII FIZYCZNEJ
 POLITECHNIA POZNAŃSA ZAŁAD CHEMII FIZYCZNEJ ATALIZA HOMOGENICZNA WSTĘP ataliza: Jest to zjawisko przyspieszenia reakcji w obecności katalizatora. atalizator to substancja, która choć uczestniczy w reakcji
POLITECHNIA POZNAŃSA ZAŁAD CHEMII FIZYCZNEJ ATALIZA HOMOGENICZNA WSTĘP ataliza: Jest to zjawisko przyspieszenia reakcji w obecności katalizatora. atalizator to substancja, która choć uczestniczy w reakcji
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Podstawy kinetyki i termodynamiki chemicznej. Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego
 Podstawy kinetyki i termodynamiki chemicznej Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego Termodynamika chemiczna i kinetyka reakcji chemicznych Termodynamika - odpowiada na pytanie czy
Podstawy kinetyki i termodynamiki chemicznej Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego Termodynamika chemiczna i kinetyka reakcji chemicznych Termodynamika - odpowiada na pytanie czy
Kinetyka. Szybkość reakcji. Szybkość reakcji. Szybkość reakcji
 Korozja konstrukcji stalowych dr inż. Leszek Niedzicki Kinetyka Szybki rozkład związków organicznych (wysokoenergetycznych) lub synteza wody z wodoru i tlenu. 2 Reakcja może trwać nano-mikrosekundy lub
Korozja konstrukcji stalowych dr inż. Leszek Niedzicki Kinetyka Szybki rozkład związków organicznych (wysokoenergetycznych) lub synteza wody z wodoru i tlenu. 2 Reakcja może trwać nano-mikrosekundy lub
Wskaż grupy reakcji, do których można zaliczyć proces opisany w informacji wstępnej. A. I i III B. I i IV C. II i III D. II i IV
 Informacja do zadań 1. i 2. Proces spalania pewnego węglowodoru przebiega według równania: C 4 H 8(g) + 6O 2(g) 4CO 2(g) + 4H 2 O (g) + energia cieplna Zadanie 1. (1 pkt) Procesy chemiczne można zakwalifikować
Informacja do zadań 1. i 2. Proces spalania pewnego węglowodoru przebiega według równania: C 4 H 8(g) + 6O 2(g) 4CO 2(g) + 4H 2 O (g) + energia cieplna Zadanie 1. (1 pkt) Procesy chemiczne można zakwalifikować
Test diagnostyczny. Dorota Lewandowska, Lidia Wasyłyszyn, Anna Warchoł. Część A (0 5) Standard I
 strona 1/9 Test diagnostyczny Dorota Lewandowska, Lidia Wasyłyszyn, Anna Warchoł Część A (0 5) Standard I 1. Przemianą chemiczną nie jest: A. mętnienie wody wapiennej B. odbarwianie wody bromowej C. dekantacja
strona 1/9 Test diagnostyczny Dorota Lewandowska, Lidia Wasyłyszyn, Anna Warchoł Część A (0 5) Standard I 1. Przemianą chemiczną nie jest: A. mętnienie wody wapiennej B. odbarwianie wody bromowej C. dekantacja
Sprawdzian 1. CHEMIA. Przed próbną maturą (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 30. Imię i nazwisko ...
 CHEMIA Przed próbną maturą 2017 Sprawdzian 1. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 30 Imię i nazwisko... Liczba punktów Procent 2 Zadanie 1. Chlor i brom rozpuszczają się
CHEMIA Przed próbną maturą 2017 Sprawdzian 1. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 30 Imię i nazwisko... Liczba punktów Procent 2 Zadanie 1. Chlor i brom rozpuszczają się
Wykład z Chemii Ogólnej i Nieorganicznej
 Wykład z Chemii Ogólnej i Nieorganicznej Część 5 ELEMENTY STATYKI CHEMICZNEJ Katedra i Zakład Chemii Fizycznej Collegium Medicum w Bydgoszczy Uniwersytet Mikołaja Kopernika w Toruniu Prof. dr hab. n.chem.
Wykład z Chemii Ogólnej i Nieorganicznej Część 5 ELEMENTY STATYKI CHEMICZNEJ Katedra i Zakład Chemii Fizycznej Collegium Medicum w Bydgoszczy Uniwersytet Mikołaja Kopernika w Toruniu Prof. dr hab. n.chem.
Przemiany substancji
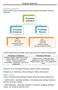 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
