Wykład 9. Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.)
|
|
|
- Patrycja Kaczor
- 7 lat temu
- Przeglądów:
Transkrypt
1 Wykład 9 Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.)
2 Reakcje fenoli c.d. 4. Substytucja w pierścieniu. a) Nitrowanie b) sulfonowanie
3 Reakcje fenoli c) Halogenowanie d) alkilowanie metodą Friedla-Craftsa
4 Reakcje fenoli e) acylowanie metodą Friedla-Craftsa (przegrupowanie Friesa) f) Nitrozowanie
5 Ad. 1. Kwasowość fenoli. Fenole są zatem mocniejszymi kwasami od wody ale słabszymi niż kwasy karboksylowe. Są także znacznie silniejszymi kwasami od alkoholi. Różna kwasowość alkoholi i fenoli jest związana z różną trwałością substratów i produktów dysocjacji tych związków. dysocjacja alkoholu dysocjacja fenolu jon fenolanowy Rezonans stabilizuje cząsteczkę jonu fenolanowego, przez co jest ona trwalsza od cząsteczki fenolu.
6 Ad.2. w roztworze zasadowym, fenol istnieje w postaci jonów fenolanowych Jon fenolanowy działa jak odczynniki nukleofilowy W/w reakcje tworzenia eterów są typowymi reakcjami substytucji nukleofilowej. Ad. 3. Grupa OH w alkoholach i fenolach jest grupą trudno odchodzącą. Wymiana na inne podstawniki w reakcjach wymagających odejścia anionu OH - nie jest możliwa do przeprowadzenia. Wymiana grupy OH - na inny podstawnik jest możliwa tylko po uprzednim przekształceniu tej grupy w inne łatwo odchodzące ugrupowanie. Ad. 4. Grupa fenolowa silnie aktywuje pierścień w reakcjach substytucji elektrofilowej.
7 Podsumowanie: 1. Fenole są znacznie silniejszymi kwasami od alkoholi. 2. Estry fenoli powstają tylko w reakcjach z najbardziej reaktywnymi pochodnymi kwasów, tj. chlorkami kwasowymi. 3. Alkohole utleniają się do aldehydów, ketonów lub kwasów karboksylowych a fenole do chinonów. 4. Fenole ulegają polikondensacji i polimeryzacji. 5. Reakcja powstawania soli.
8 ETERY I EPOKSYDY Etery są związkami o wzorze ogólnym: R-O-R Ar-O-R lub Ar-O-Ar Nazwę eteru tworzy się zwykle w ten sposób, że po słowie eter dodaje się w kolejności alfabetycznej nazwy 2 grup, które są przyłączone do atomu O. R-O- grupa alkoksylowa CH 3 -O- metoksy CH 3 CH 2 -O- etoksy
9 Jeżeli jedna z grup nie ma prostej budowy związek traktuje się jako pochodną alkoksylową. Najprostszy eter arylowo-alkilowy
10 Budowa i właściwości fizyczne eterów Kąt C-O-C w cząsteczce eteru nie ma wartości 180 o i dlatego momenty dipolowe 2 wiązań C-O nie kompensują się. W efekcie etery wykazują niewielkie momenty dipolowe. Z powodu obecności atomu O w cząsteczkach etery mogą tworzyć wiązania wodorowe z innymi związkami zawierającymi atomy H, np. z H 2 O Polarność i zdolność do tworzenia wiązań wodorowych z innymi związkami sprawiają, że etery są bardzo dobrymi rozpuszczalnikami dla wielu substancji organicznych.
11 Właściwości chemiczne eterów Cechą wspólną dla wszystkich eterów jest ich zasadowość, wynikająca z obecności wolnych par elektronowych przy atomie O. 1. z silnymi kwasami protonowymi etery tworzą sole oksoniowe. Sole oksoniowe są nietrwałe. Znacznie trwalsze są związki koordynacyjne eterów z silnymi kwasami Lewisa, np. BF 3 Tetra trifluorku boru 2. z atomami metali w związkach metaloorgancznych etery tworzą silne wiązania koordynacyjne, np. w roztworach eterowych, związki Grignarda występują w postaci kompleksów.
12 3. rozpad eterów pod wpływem kwasów, np. pod wpływem kwasu HI następuje rozerwanie C-O
13 Wybrane metody otrzymywania eterów 1. dehydratacja alkoholi (za pomocą stęż. H 2 SO 4 ) 2. reakcje alkoholanów lub fenolanów z fluorowcopochodnymi (metoda Williamsona)
14 Epoksydy Epoksydy (epitlenki) są związkami zawierającymi w cząsteczce pierścień trójczłonowy Związki te są eterami ale trójczłonowy pierścień nadaje mu specyficzne własności. Najprostszym przedstawicielem epoksydów jest tlenek etylenu. Na skalę przemysłową otrzymuje się go w procesie katalitycznego utleniania etylenu tlenem z powietrza:
15 Do najważniejszych zastosowań tlenku etylenu należy otrzymywanie glikolu etylenowego i glikoli polietylenowych Carbowax Otrzymywanie epoksydów 1. z halogenohydryn 2. utlenianie wiązań C=C za pomocą nadkwasów Utlenianie do oksiranu a następnie otwarcie pierścienia oksiranowego prowadzi do glikoli z grupami OH w położeniu trans względem siebie. Metoda dostarcza mieszaniny racemicznej glikoli.
16 Reakcje epoksydów Epoksydy są bardzo reaktywne, ze względu na łatwość otwierania się silnie naprężonego pierścienia trójczłonowego. Ponieważ atomy w pierścieniu epoksydowym nie mogą być rozmieszczone tak aby zapewnić maksymalne nakładanie się orbitali, wiązania są słabsze niż w zwykłym eterze a cząsteczka mniej trwała. 1. rozszczepienie katalizowane przez kwas
17 2. rozszczepienie katalizowane przez zasadę. reakcja ze związkami Grignarda Dioksyny związki o bardzo dużej szkodliwości dla zdrowia. Dioksyny są produktem ubocznym lub produktem rozkładu trichlorofenoli.
18 2,3,7,8-tetrachlorodibenzodioksyna Związek ten stanowi również zanieczyszczenie preparatu chwastobójczego o nazwie 2,4,5-T (kwasu trichlorofenoksyoctowego), same się wytwarzają, a nie ulegają rozkładowi, b.mała ilość powoduje śmierć. tetrahydrofuran (chromatografia) dioksan (rozpuszczalnik)
19 ALDEHYDY I KETONY Aldehydy i ketony
20 Aldehyd benzoesowy zapach migdałów glikozyd amigdaliny C 20 H 27 NO 11 + H 2 O C6H5CHO + C6H12O6 + HCN aldehyd anyżowy wanilina muskon kozioł piżmowy (musk- piżmo) kamfora, menton, geranon, cytronenon Aldehydy są związkami o wzorze ogólnym R-CHO Struktura grupy karbonylowej: Wszystkie atomy grupy karbonylowej leżą też w jednej płaszczyznie.
21 Reaktywne miejsca w cząsteczkach aldehydu ketonu
22 Konsekwencją są reakcje: 1. przyłączenia (addycji) wg schematu 2. przy węglu α w związku ze zjawiskiem tautomerii keto-enolowej
23 Otrzymywanie aldehydów i ketonów ALDEHYDY 1. Utlenianie alkoholi I rz. 2. Utlenianie metylowych pochodnych benzenu
24 3. Redukcja chlorków kwasowych (reakcja Rosenmunda) 4. Synteza Reimera-Tiemanna (formylowanie fenoli)
25 KETONY: 1.Utlenianie alkoholi II rz. 2.z chlorków kwasowych ze związkami metaloorganicznymi
26 3. dekarboksylacja soli wapniowych 4.acylowanie metodą Friedla-Craftsa
27 Mechanizm acylowania metodą Friedla-Craftsa Jon acyliowy Metody specyficzne: 1. Formylowanie alkenów (reakcja oxo ) 2. Przyłączenie wody do węglowodorów acetylenowych (metoda Kuczerowa)
28 Reakcje aldehydów i ketonów 1. Utlenianie i redukcja Utlenianie aldehydów i ketonów (utlenianie wiązania C-H grupy aldehydowej) np. utlenianie aldehydu kwasem chromowym Odczynnik Tollensa (lustro srebrne) Odczynnik Fehlinga (CuSO 4 + AgOH + winian glinowo-potasowy)
29 Redukcja aldehydów i ketonów redukcja do alkoholi reduktory: H/Pt, LiAlH 4, NaBH 4, metale: Na, Mg, Zn, alkoholany glinowe
30 redukcja do węglowodorów (redukcja Clemmensena) redukcja Wolfa-Kiżnera
31 Samoutlenianie i redukcja (reakcja Cannizarro) Reakcja zachodzi dla aldehydów nie zawierających atomów H w pozycji α (dla furfuralu, aldehydu benzoesowego, glioksalu) mechanizm: (zgodny ze schematem addycji nukleofilowej)
32 2. Addycja nukleofilowa Reakcje nukleofilowe: 2a) Przyłączenie wody 2b) Addycja cyjanowodoru (cyjanohydryny) 2c) Addycja wodorosiarczynu sodowego
33 2d) Addycja pochodnych amoniaku
34 3. Addycja związków Grignarda 4. Addycja alkoholi (tworzenie acetali)
35 5. Kondensacja (uwidacznia się reaktywność węgli α) 5a. kondensacja aldolowa
36 6. Reakcja podstawienia Polimeryzacja aldehydów Polega na addycji kolejnych spolaryzowanych cząsteczek z gr. C=O. Polimeryzacja formaldehydu:
37 Polimeryzacja aldehydu octowego
38 Metody przemysłowe i zastosowanie aldehydów i ketonów Aldehyd mrówkowy (formaldehyd) Aldehyd octowy Aldehyd benzoesowy chloral (aldehyd trichlorooctowy) bardzo reaktywny akroleina aceton Podsumawianie wiadomości o aldehydach i ketonach 1 o Aldehydy ulegają reakcji Tollensa i Fehlinga 2 o Aldehydy utleniają się do kwasów o tej samej liczbei atomów C w łańcuchu głównym 3 o aldehydy łatwo ulegają polimeryzacji (ketony bardzo rzadko) 4 o ketony nie tworzą prostych związków z amoniakiem
39 KWASY KARBOKSYLOWE Alifatyczne kwasy karboksylowe tzw. tłuszczowe mają ogólny wzór: CnH2n+1COOH Szereg homologiczny kwasów alifatycznych 1. HCOOH kw. metanowy (mrówkowy) 2. CH 3 COOH kw. etanowy (octowy) 3. CH 3 CH 2 COOH kw. propanowy (propionowy) 4. CH 3 CH 2 CH 2 COOH kw. butanowy (masłowy) 5. CH 3 (CH 2 ) 3 COOH kw.pentanowy (walerianowy) 6. CH 3 (CH 2 ) 4 COOH kw. heksanowy (kapronowy) 7. CH 3 (CH 2 ) 5 COOH kw. heptanowy (enanowy) 8. CH 3 (CH 2 ) 6 COOH kw. oktanowy (kaprylowy) 9. CH 3 (CH 2 ) 7 COOH kw. nonanowy (pelargonowy) 10. CH 3 (CH 2 ) 9 COOH kw. dekanowy (kaprynowy) 11. CH 3 (CH 2 ) 10 COOH kw. undekanowy (undecylowy) 12. CH 3 (CH 2 ) 11 COOH kw. dodekanowy (laurynowy) 16. CH 3 (CH 2 ) 14 COOH kw. heksadekanowy (palmitynowy) 17. CH 3 (CH 2 ) 15 COOH kw. heptadekanowy (margarynowy) 18. CH 3 (CH 2 ) 16 COOH kw. oktadekanowy (stearynowy)
40 Nazewnictwo kwasów Nazwa zwyczajowa
41 Izomeria związana z położeniem grupy COOH pojawia się od kwasu butanowego. n-butanowy, masłowy 2-propanokarboksylowy, izomasłowy n-pentanowy, walerianowy 3-metylobutanowy, izowalerianowy 2,2-dimetylopropanowy, piwalonowy, trimetylooctowy 2-metylobutanowy, 2-butano-karboksylowy
42 Metody otrzymywania kwasów karboksylowych Utlenianie alkoholi do aldehydów a następnie do kwasów Utlenianie ketonów Hydroliza nitryli Metoda wykorzystywana jest głównie do otrzymywania kwasów aromatycznych Utlenianie węglowodorów ze związków Grignarda z suchym lodem Reakcję można zacząć od chlorku alkilu
43 Utlenianie węglowodorów ze związków Grignarda z suchym lodem Reakcję można zacząć od chlorku alkilu
44 Hydroliza nitryli
45 Budowa grupy karboksylowej Grupa karboksylowa jest płaska (rentgenografia, dyfrakcja elektronów). W niezdysocjowanej cząsteczce kwasu, w grupie karboksylowej istnieją 2 wiązania o różnej długości. Natomiast w anionach kwasów karboksylowych, wiązania C-O mają jednakową długość. Do kwasu karboksylowego i jego anionu można narysować po 2 struktury:
46 Zarówno cząsteczka kwasu jak i anion są hybrydami rezonansowymi, ale znacznie bardziej stabilne są równoważne struktury III i IV. Kwasowość kwasów karboksylowych jest następstwem silnej stabilizacji ich anionów przez rezonans. Ładunek ujemny w jonie karboksylowym jest zlokalizowany w równym stopniu na obu atomach tlenu:
47 Atom C grupy karboksylowej jest w stanie hybrydyzacji sp 2 (3 wiązania w jednej płaszczyźnie). Pozostały orbital p nakłada się z orbitalami p atomów O, tworząc orbital zdelokalizowany, w którym elektrony przynależą równoważnie do 3 jąder. Z tego powodu elektrony są silnie związane i anion jest trwalszy. Wpływ grupy karboksylowej na reakcje podstawienia w pierścieniu aromatycznym Grupa karboksylowa dezaktywuje pierścień i skierowuje podstawniki elektrofilowe
48 Reakcje chemiczne kwasów karboksylowych 1 o wymiana wodoru (sole) 2 o podstawienie grupy hydroksylowej (estry, amidy, halogenki kwasowe) 3 o reakcje w obrębie grupy karbonylowej 4 o wymiana grupy karboksylowej 5 o reakcje w obrębie rodnika alkilowego Ad.1. Sole powstają w reakcji metali lub zasad z kwasami: RCOOH + NaOH RCOONa + H 2 O Sole sodowe wyższych kwasów tłuszczowych są mydłami: C 15 H 31 COOH + NaOH C 15 H 31 COONa + H 2 O
49 Ad. 2. podstawienie grupy hydroksylowej (estry, amidy, halogenki kwasowe) W wyniku tej reakcji powstają chlorki kwasowe, bezwodniki, estry amidy. Charakter zasadowy grup podstawiających grupę OH. I Cl II RCOO III OR IV NH 2 (bardzo słaba zasada) Cechą charakterystyczną związków acylowych jest substytucja nukleofilowa, podczas której grupa Cl, RCOO, OR, NH 2 zostaje zastąpiona inną grupą o charakterze zasadowym. Związki acylowe wykazują pewne podobieństwa do aldehydów i ketonów. Występuje tu jednak istotna różnica: addycja (aldehydy i ketony) substytucja (związek acylowy)
50 Metody otrzymywania chlorków kwasowych 3 R-COOH + PCl 3 3 R-COCl + H 3 PO 3 R-COOH + PCl 5 R-COCl + POCl 3 + HCl R-COOH + SOCl 2 R-COCl + SO 2 + HCl chlorek tionylu R-COOH + SO 2 Cl 2 R-COCl + SO 3 + HCl chlorek sulfurylu Reaktywność chlorków kwasowych wyraża się w przemianach zachodzących przy karbonylowym atomie C oraz w ego bezpośrednim sąsiedztwie.
51 Substytucja nukleofilowa w chlorkach kwasowych a) przemiana w kwasy i ich pochodne b) redukcja do aldehydów (reakcja Rosemunda) c) acylowanie metoda Friedla-Craftsa d) reakcje ze związkami Grignarda Aby zapobiec reakcji II stosuje się słabszy odczynniki Grignarda CH 3 CdCl nie reagujący z ketonami.
52 II. Metody otrzymywania bezwodników kwasowych teoretycznie: bezwodnik octowy bezwodnik mieszany Praktyczne metody otrzymywania bezwodników chlorek z ketonu, otrzymywanego z bromków bromokwasów przemysłowa metoda otrzymywania bezwodnika octowego (z acetylenu)
53 Jest to reakcja typu kondensacji aldolowej, której pierwszym etapem jest utworzenie karbokationu z bezwodnika pod wpływem obecnego w układzie anionu kwasu octowego. Karboanion przyłącza się następnie do grupy karboksylowej aldehydu, po czym następuje szereg przemian, prowadzących do powstania kwasu cynamonowego. Powstały produkt będący zestryfikowanym przy grupie OH kwasem 2-fenylo-2-hydroksypropionowym ulega następnie eliminacji z wydzieleniem cząsteczki Ch3COOH i utworzeniem kwasu cynamonowego.
54 ESTRY 1. Metody otrzymywania estrów RCOOH + HOR RCOOR + H 2 O (estryfikacja)
55 2. Z chlorków kwasowych RCOCl + HOR RCOOR + HCl 3. Z bezwodników kwasowych (RCO) 2 O + HOR RCOOR + RCOOH
56 4. transestryfikacja (alkoholiza estrów) Metoda jest szeroko stosowana w przemyśle, np. przy produkcji elany TMD (tereftalan dimetylu) Transestryfikacja jest procesem odwracalnym, z wyjątkiem trans estryfikacji dioli (glikoli) gdyż powstający w reakcji keton nie jest zdolny do reakcji z estrem. gliceryna octan izopropylu trioctan gliceryny
57 6. Reakcja Tiszczenki dysproporcjonowanie aldehydów do alkoholi i kwasów, które reagując ze sobą wydzielają się w formie estrów (w środowisku bezwodnym) pewne analogie do reakcji Cannizarro i Meerweina, Pandorfa i Verleya. np. 7. octan winylu otrzymuje się przez przyłączenie kwasu karboksylowego do acetylenu
58 8. estryfikacja wewnątrzcząsteczkowa (z hydroksykwasów tworzą się laktony) Sól γ-hydroksykwasu β-lakton Estry są mniej reaktywne od chlorków i bezwodników kwasowych. Zmniejszenie reaktywności grupy karboksylowej estrów jest wynikiem sprzężenia wolnej pary elektronów eterowego atomu O z wiązaniem podwójnym C=O. Sprzężenie to utrudnia powstanie ładunku dodatniego na acylowym at. C.
59 Mechanizm estryfikacji:
60 Hydroliza estrów W środowisku zasadowym, nukleofilem atakującym acylowy at.c jest anion OH - (reakcja słabo odwracalna) W środowisku kwasowym, nukleofilem atakującym acylowy at.c jest cząsteczka wody.
61 Inne przykłady podstawienie nukleofilowego w estrach 1) Amonoliza RCOOR +NH 3 RCONH 2 + R OH np. CH 3 COOC 2 H 5 + NH 3 CH 3 CONH 2 acetamid 2) Trans estryfikacja alkoholiza) RCOOR +R OH RCOOR + R OH 3) Reakcje ze zw. Grignarda RCOOR +2 R MgX
62 Redukcja do alkoholi
63 Amidy kwasowe Metody otrzymywania amidów kwasowych. 1.Teoretyczna. RCOOH + NH 3 RCONH 2 +H 2 O 2. RCOOH + R NH 2 RCONH 2 + R OH 3. RCOCl + NH 3 RCONH 2 + HCl 4. (RCO) 2 O + NH 3 RCONH 2 + RCOOH 5. RCOOR +NH 3 RCONH 2 + R OH 6. RCOONH 4 RCONH 2 + H 2 O Przemysłowa metoda otrzymywania kaprolaktamu (surowca do syntezy włókien poliamidowych) polega na przegrupowaniu Beckmana oksym cykloheksanolu. Mocznik otrzymuje się z CO 2 i NH 3. Mocznik jest diamidem kwasu węglowego zastosowanie: nawóz oraz produkcja żywic mocznikowoformaldehydowych
64 KWASY WIELOKARBOKSYLOWE W przyrodzie rozpowszechnione są kwasy dikarboksylowe, zawierające 2 grupy COOH. Z wyjątkiem kwasu szczawiowego kwasy di karboksylowe mają wzór ogólny: COOH-C n H 2n -COOH Szereg homologiczny kwasów di karboksylowych HOOC-COOH kwas szczawiowy HOOC-CH 2 -COOH kw. malonowy (kw. metanodikarboksylowy) HOOC-(CH 2 ) 2 -COOH kw. bursztynowy (kw. 1,2- etanodikarboksylowy) HOOC-(CH 2 ) 3 -COOH kw. glutarowy (kw. 1,3- propanodikarboksylowy) HOOC-(CH 2 ) 4 -COOH kw. adypinowy (kw. 1,4-butanodikarboksylowy) HOOC-(CH 2 ) 5 -COOH kw. pimelinowy (kw. 1,5- pentanodikarboksylowy) HOOC-(CH 2 ) 6 -COOH kw. korkowy (kw. 1,6-heksanodikarboksylowy) HOOC-(CH 2 ) 7 -COOH kw. azelainowy (1,7-heptanodikarboksylowy) HOOC-(CH 2 ) 8 -COOH kw. sebacynowy (1,8-oktanodikarboksylowy)
65 Właściwości kwasów dikarboksylowych Mają takie same właściwości jak kwasy monokarboksylowe. Pochodne kwasów powstają stopniowo, tzn. najpierw podstawia się jedna, a potem druga grupa karboksylowa.
66 Hydroksykwasy Najprostszymi przedstawicielami kwasów zawierających grupę OH w łańcuchu bocznym są: Kw. glikolowy (hydroksyoctowy) winogrona Kw. mlekowy (α-hydroksy-propionowy) mięśnie, kiszonki Rozróżnia się kwasy α, β i γ. Otrzymywanie α-hydroksykwasów 1 o przez częściowe utlenienie glikoli 2 o z chlorowcokwasów 3 o z aldehydów, poprzez cyjanohydryny CH3CHCOOH OH - kwas mlekowy
67 Hydroksykwasy podczas ogrzewania tracą cząsteczkę wody. α-hydroksykwasy tracąc wodę tworzą laktydy. β-hydroksykwasy tracąc wodę dają kwasy nienasycone γ- hydroksykwasy, tracąc wodę, tworzą laktony (wewnętrzne estry) Cechą charakterystyczną hydroksykwasów (oprócz kwasu glikolowego) jest izomeria optyczna, związana z obecnością asymetrycznego atomu C w cząsteczce. Kwas mlekowy występuje w odmianach: dwóch optycznie czynnych i racemicznej. Wśród aromatycznych hydroksykwasów najważniejszy jest kwas salicylowy (o-hydroksybenzoesowy). Otrzymuje się go metodą Kolbego z fenolanu sodu Kwas salicylowy stanowi podstawę szeregu ważnych środków leczniczych (salicylany) Aspiryna (polopiryna)- Kwas acetylosalicylowy Reakcja Kolbego
68 Ketonokwasy Najprostszym przedstawicielem jest kwas pirogronowy. Można go otrzymać : 1 o w wyniku utleniania hydroksykwasów 2o wprowadzając grupę karboksylową do związku acetylenowego Jest ważnym produktem metabolizmu. Najważniejszym przedstawicielem β-ketonokwasów jest kwas acetylooctowy. (jest nietrwały, w niewielkich ilościach w moczu osób chorych na cukrzycę).
69 Związki heterocykliczne
70 Związki o pierścieniu pięcioczłonowym
71
72 Metody otrzymywania pirolu, furanu i tiofenu
73 Reakcje substytucji elektrofilowej pirolu, furanu i tiofenu
74 Występowanie związków heterocyklicznych -Węglowodany są to związki heterocykliczne -Chlorofil zielony barwnik liści -Hemina czerwony barwnik krwi -Tworzą centra reakcyjne w wielu enzymach i koenzymach -Podstawowy element budowy kwasów nukleionowych
75
76
77 Związki o pierścieniu sześcioczłonowym pirydyna
78 Otrzymywanie pirydyny
79 Reakcje pirydyny substytucja elektrofilowa Pirydyna jest znacznie mniej reaktywna od pirolu, ze względu na konfigurację elektronową atomu azotu, jest dużo mocniejszą zasadą niż pirol, w reakcjach substytucji elektrofilowej przypomina silnie zdezaktywowane pochodne benzenu, ulega substytucji elektrofilowej tylko w drastycznych warunkach
80 Substytucja nukleofilowa Bardzo duża reaktywność w reakcjach substytucji nukleofilowej, szczególnie w pozycjach 2 i 4
Spis treści 1. Struktura elektronowa związków organicznych 2. Budowa przestrzenna cząsteczek związków organicznych
 Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup
 Cz. XXV - Kwasy karboksylowe Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup karboksylowych - CH ( - C - H ), atom C w grupie funkcyjnej jest na hybrydyzacji sp 2,
Cz. XXV - Kwasy karboksylowe Def. Kwasy karboksylowe to związki, których cząsteczki zawierają jedną lub więcej grup karboksylowych - CH ( - C - H ), atom C w grupie funkcyjnej jest na hybrydyzacji sp 2,
Materiały dodatkowe kwasy i pochodne
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe kwasy i pochodne Kwasy 1. Kwasowość Kwasy karboksylowe są kwasami o stosunkowo niewielkiej mocy. Ich stała dysocjacji
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe kwasy i pochodne Kwasy 1. Kwasowość Kwasy karboksylowe są kwasami o stosunkowo niewielkiej mocy. Ich stała dysocjacji
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
18. Reakcje benzenu i jego pochodnych
 18. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień benzenowy
18. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień benzenowy
Elementy chemii organicznej
 Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
Kwasy karboksylowe grupa funkcyjna: -COOH. Wykład 8 1
 Kwasy karboksylowe grupa funkcyjna: -CH Wykład 8 1 1. Reakcje utleniania a) utlenianie alkoholi pierwszorzędowych trzymywanie kwasów CH 3 H 3 C C CH 2 H CH 3 alkohol pierwszorzędowy CH K 2 Cr 2 3 7 H 3
Kwasy karboksylowe grupa funkcyjna: -CH Wykład 8 1 1. Reakcje utleniania a) utlenianie alkoholi pierwszorzędowych trzymywanie kwasów CH 3 H 3 C C CH 2 H CH 3 alkohol pierwszorzędowy CH K 2 Cr 2 3 7 H 3
14. Reakcje kwasów karboksylowych i ich pochodnych
 14. Reakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór R N R R grupa karbonylowa atom (, N lub Cl) o
14. Reakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór R N R R grupa karbonylowa atom (, N lub Cl) o
Podstawowe pojęcia i prawa chemiczne
 Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Spis treści. Nazewnictwo kwasów karboksylowych.
 Do tej klasy zaliczamy związki zawierające grupę karboksylową, zapisywaną w skrócie jako COOH. W tej grupie karbonylowy atom węgla jest związany dodatkowo z grupą hydroksylową. Z uwagi na hybrydyzację
Do tej klasy zaliczamy związki zawierające grupę karboksylową, zapisywaną w skrócie jako COOH. W tej grupie karbonylowy atom węgla jest związany dodatkowo z grupą hydroksylową. Z uwagi na hybrydyzację
Reakcje kwasów karboksylowych i ich pochodnych
 27-29. eakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór N grupa karbonylowa atom (, N lub Cl) o większej
27-29. eakcje kwasów karboksylowych i ich pochodnych nazwa ogólna kwas karboksylowy bezwodnik kwasowy chlorek kwasowy ester amid 1 amid 2 amid 3 nitryl wzór N grupa karbonylowa atom (, N lub Cl) o większej
Grupa karbonylowa. Grupa karbonylowa to grupa funkcyjna, w której atom tlenu połączony jest z atomem węgla podwójnym wiązaniem
 ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA. POLIMERYZACJA.
 INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA.
INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA.
Reakcje benzenu i jego pochodnych
 39-42. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień
39-42. Reakcje benzenu i jego pochodnych 1 18.1. Nazewnictwo mono-podstawionych benzenów nazwa podstawnika - przedrostek przed słowem benzen wiele nazw zwyczajowych (pokazane wybrane związki) pierścień
KWASY KARBOKSYLOWE I ICH POCHODNE. R-COOH lub R C gdzie R = H, CH 3 -, C 6 H 5 -, itp.
 KWASY KARBKSYLWE I IH PHDNE I. Wprowadzenie teoretyczne Kwasy karboksylowe Kwasami organicznymi nazywamy związki, w których grupa funkcyjna H zwana grupą karboksylową jest związana z rodnikiem węglowodorowym
KWASY KARBKSYLWE I IH PHDNE I. Wprowadzenie teoretyczne Kwasy karboksylowe Kwasami organicznymi nazywamy związki, w których grupa funkcyjna H zwana grupą karboksylową jest związana z rodnikiem węglowodorowym
Rozdział 6. Odpowiedzi i rozwiązania zadań. Chemia organiczna. Zdzisław Głowacki. Zakres podstawowy i rozszerzony
 Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Zdzisław Głowacki Chemia organiczna Zakres podstawowy i rozszerzony 2b Odpowiedzi i rozwiązania zadań Rozdział 6 Oficyna Wydawnicza TUTOR Wydanie I. Toruń 2013 r. Podpowiedzi Aldehydy i ketony Zadanie
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Aminy. - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin
 Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Pochodne węglowodorów, w cząsteczkach których jeden atom H jest zastąpiony grupą hydroksylową (- OH ).
 Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
HCOOH kwas metanowy ( mrówkowy ) CH 3. COOH kwas etanowy ( octowy ) CH 2
 Kwasy karboksylowe, Ar Nazewnictwo: Kwasy, które są pochodnymi alkanów o otwartych łańcuchach, są nazywane w sposób systematyczny przez dodanie nazwy kwas i dodanie końcówki owy do alkanu - kwas alkanowy
Kwasy karboksylowe, Ar Nazewnictwo: Kwasy, które są pochodnymi alkanów o otwartych łańcuchach, są nazywane w sposób systematyczny przez dodanie nazwy kwas i dodanie końcówki owy do alkanu - kwas alkanowy
Addycje Nukleofilowe do Grupy Karbonylowej
 J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
1. REAKCJA ZE ZWIĄZKAMI POSIADAJĄCYMI KWASOWY ATOM WODORU:
 B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
RJC E + E H. Slides 1 to 41
 Aromatyczne Substytucje Elektrofilowe E + E H -H E Slides 1 to 41 Aromatyczne Addycje Elektrofilowe...do pierścienia aromatycznego przerywa sprzęŝenie elektronów π i powoduje utratę stabilizacji poprzez
Aromatyczne Substytucje Elektrofilowe E + E H -H E Slides 1 to 41 Aromatyczne Addycje Elektrofilowe...do pierścienia aromatycznego przerywa sprzęŝenie elektronów π i powoduje utratę stabilizacji poprzez
Wykład 6. Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.)
 Wykład 6 Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.) Dieny Dieny są alkenami, których cząsteczki zawierają 2 podwójne wiązania C=C. Zasadnicze właściwości dienów są takie jak alkenów.
Wykład 6 Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.) Dieny Dieny są alkenami, których cząsteczki zawierają 2 podwójne wiązania C=C. Zasadnicze właściwości dienów są takie jak alkenów.
Kwasy karboksylowe. 1. Cele lekcji. 2. Metoda i forma pracy. 3. Środki dydaktyczne. 4. Przebieg lekcji. a) Wiadomości.
 Kwasy karboksylowe 1. Cele lekcji a) Wiadomości Uczeń zna budowę kwasów karboksylowych, nazewnictwo kwasów karboksylowych, podział kwasów karboksylowych, sposoby otrzymywania kwasów karboksylowych, właściwości
Kwasy karboksylowe 1. Cele lekcji a) Wiadomości Uczeń zna budowę kwasów karboksylowych, nazewnictwo kwasów karboksylowych, podział kwasów karboksylowych, sposoby otrzymywania kwasów karboksylowych, właściwości
11. Reakcje alkoholi, eterów, epoksydów, amin i tioli
 11. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas 1 11.1. Reakcja
11. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas 1 11.1. Reakcja
KARTA KURSU. Kod Punktacja ECTS* 4
 KARTA KURSU Nazwa Nazwa w j. ang. Chemia organiczna Organic chemistry Kod Punktacja ECTS* 4 Koordynator dr Waldemar Tejchman Zespół dydaktyczny dr Waldemar Tejchman Opis kursu (cele kształcenia) Celem
KARTA KURSU Nazwa Nazwa w j. ang. Chemia organiczna Organic chemistry Kod Punktacja ECTS* 4 Koordynator dr Waldemar Tejchman Zespół dydaktyczny dr Waldemar Tejchman Opis kursu (cele kształcenia) Celem
CHEMIA 10. Oznaczenia: R - podstawnik węglowodorowy, zwykle alifatyczny (łańcuchowy) X, X 2 - atom lub cząsteczka fluorowca
 INSTYTUT MEDICUS Kurs przygotowawczy na studia medyczne kierunek lekarski, stomatologia, farmacja, analityka medyczna tel. 0501 38 39 55 www.medicus.edu.pl CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE.
INSTYTUT MEDICUS Kurs przygotowawczy na studia medyczne kierunek lekarski, stomatologia, farmacja, analityka medyczna tel. 0501 38 39 55 www.medicus.edu.pl CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE.
Związki aromatyczne (by Aleksandra Kołodziejczyk, UG)
 Związki aromatyczne (by Aleksandra Kołodziejczyk, UG) 4 stopnie nienasycenia. ak reakcji A Źródła: - piroliza węgla smoła pogazowa; - reforming ropy naftowej Nazewnictwo przedrostek nazwa podstawnika C
Związki aromatyczne (by Aleksandra Kołodziejczyk, UG) 4 stopnie nienasycenia. ak reakcji A Źródła: - piroliza węgla smoła pogazowa; - reforming ropy naftowej Nazewnictwo przedrostek nazwa podstawnika C
Chemia organiczna. Zagadnienia i przykładowe pytania do kolokwiów dla Biotechnologii (I rok)
 Chemia organiczna Zagadnienia i przykładowe pytania do kolokwiów dla Biotechnologii (I rok) Zakład Chemii Organicznej Wydział Chemii Uniwersytet Wrocławski 2005 Lista zagadnień: Kolokwium I...3 Kolokwium
Chemia organiczna Zagadnienia i przykładowe pytania do kolokwiów dla Biotechnologii (I rok) Zakład Chemii Organicznej Wydział Chemii Uniwersytet Wrocławski 2005 Lista zagadnień: Kolokwium I...3 Kolokwium
Mechanizm dehydratacji alkoholi
 Wykład 5 Mechanizm dehydratacji alkoholi I. Protonowanie II. odszczepienie cząsteczki wody III. odszczepienie protonu Etap 1 Reakcje alkenów Najbardziej reaktywne jest wiązanie podwójne, lub jego sąsiedztwo
Wykład 5 Mechanizm dehydratacji alkoholi I. Protonowanie II. odszczepienie cząsteczki wody III. odszczepienie protonu Etap 1 Reakcje alkenów Najbardziej reaktywne jest wiązanie podwójne, lub jego sąsiedztwo
ZWIĄZKI MAGNEZOORGANICZNE. Krystyna Dzierzbicka
 ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
ZWIĄZKI MAGNEZRGANIZNE Krystyna Dzierzbicka Związki metaloorganiczne, do których zaliczamy między innymi magnezo- i litoorganiczne są związkami posiadającymi bezpośrednie wiązanie węgiel-metal (np. Na,
Zadanie: 2 (4 pkt) Napisz, uzgodnij i opisz równania reakcji, które zaszły w probówkach:
 Zadanie: 1 (1 pkt) Aby otrzymać ester o wzorze CH 3 CH 2 COOCH 3 należy jako substratów użyć: a) Kwasu etanowego i metanolu b) Kwasu etanowego i etanolu c) Kwasu metanowego i etanolu d) Kwasu propanowego
Zadanie: 1 (1 pkt) Aby otrzymać ester o wzorze CH 3 CH 2 COOCH 3 należy jako substratów użyć: a) Kwasu etanowego i metanolu b) Kwasu etanowego i etanolu c) Kwasu metanowego i etanolu d) Kwasu propanowego
Fluorowcowęglowodory są to pochodne węglowodorów, gdzie jeden lub więcej atomów wodoru jest podstawione atomem fluorowca. Fluorowcowęglowodory mogą
 Fluorowcowęglowodory są to pochodne węglowodorów, gdzie jeden lub więcej atomów wodoru jest podstawione atomem fluorowca. Fluorowcowęglowodory mogą być alifatyczne i aromatyczne. Grupą funkcyjną dla tych
Fluorowcowęglowodory są to pochodne węglowodorów, gdzie jeden lub więcej atomów wodoru jest podstawione atomem fluorowca. Fluorowcowęglowodory mogą być alifatyczne i aromatyczne. Grupą funkcyjną dla tych
LCH 1 Zajęcia nr 60 Diagnoza końcowa. Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach:
 LCH 1 Zajęcia nr 60 Diagnoza końcowa Zadanie 1 (3 pkt) Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach: H 3 C CH 2 CH 2 CH 2 CH 2 a) b) W tym celu: a) wybierz odpowiedni
LCH 1 Zajęcia nr 60 Diagnoza końcowa Zadanie 1 (3 pkt) Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach: H 3 C CH 2 CH 2 CH 2 CH 2 a) b) W tym celu: a) wybierz odpowiedni
l. at C Wzór sumaryczny pół strukturalny Nazwa systematyczna Nazwa zwyczajowa 1 HCOOH
 KWASY KARBOKSYLOWE Temat: Szereg homologiczny kwasów karboksylowych 1) Występowanie kwasów karboksylowych 2) Podział kwasów karboksylowych 3) Wzory i nazwy kwasów karboksylowych Ad.1 - kwas octowy - kwas
KWASY KARBOKSYLOWE Temat: Szereg homologiczny kwasów karboksylowych 1) Występowanie kwasów karboksylowych 2) Podział kwasów karboksylowych 3) Wzory i nazwy kwasów karboksylowych Ad.1 - kwas octowy - kwas
Program wykładu Chemia Organiczna I
 Program wykładu Chemia Organiczna I Semestr III - 2016/2017 r. poziom A i B Wtorek 17:30-18:15 (B, sala 338), czwartek 14:30 15:15 (A i B, aula) oraz piątek 11:30 13:00 (A i B, aula), prof. dr hab. R.
Program wykładu Chemia Organiczna I Semestr III - 2016/2017 r. poziom A i B Wtorek 17:30-18:15 (B, sala 338), czwartek 14:30 15:15 (A i B, aula) oraz piątek 11:30 13:00 (A i B, aula), prof. dr hab. R.
Aleksander Kołodziejczyk Krystyna Dzierzbicka CHEMII. organicznej Tom 2
 Aleksander Kołodziejczyk Krystyna Dzierzbicka CHEMII organicznej Tom 2 Gdansk 2014 PRZEWODNICZĄCY KOMITETU REDAKCYJNEGO WYDAWNICTWA POLITECHNIKI GDAŃSKIEJ Janusz T. Cieśliński RECENZENT Elżbieta Luboch
Aleksander Kołodziejczyk Krystyna Dzierzbicka CHEMII organicznej Tom 2 Gdansk 2014 PRZEWODNICZĄCY KOMITETU REDAKCYJNEGO WYDAWNICTWA POLITECHNIKI GDAŃSKIEJ Janusz T. Cieśliński RECENZENT Elżbieta Luboch
Węglowodory aromatyczne (areny) to płaskie cykliczne związki węgla i wodoru. Areny. skondensowane liniowo. skondensowane kątowo
 Spis treści Podstawowe pojęcia Właściwości chemiczne benzenu Wielopierścieniowe węglowodory aromatyczne Homologi benzenu Nazewnictwo związków aromatycznych Występowanie i otrzymywanie arenów Węglowodory
Spis treści Podstawowe pojęcia Właściwości chemiczne benzenu Wielopierścieniowe węglowodory aromatyczne Homologi benzenu Nazewnictwo związków aromatycznych Występowanie i otrzymywanie arenów Węglowodory
Slajd 1. Związki aromatyczne
 Slajd 1 Związki aromatyczne Slajd 2 Reguły aromatyczności 1. Związek musi posiadać cykliczną chmurę elektronową ponad i pod płaszczyzną cząsteczki 2. Chmura elektronów π musi zawierać nieparzystą liczbę
Slajd 1 Związki aromatyczne Slajd 2 Reguły aromatyczności 1. Związek musi posiadać cykliczną chmurę elektronową ponad i pod płaszczyzną cząsteczki 2. Chmura elektronów π musi zawierać nieparzystą liczbę
Zagadnienia. Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I
 Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
PRZYKŁADOWE ZADANIA KWASY
 PRZYKŁADOWE ZADANIA KWASY Zadanie 1014 (3 pkt) Pr.XII/2004 A2 Określ typ podanych niżej reakcji: I. C 17 H 33 COOH + Br 2 C 17 H 33 Br 2 COOH Al 2O 3, temp II. C 2 H 5 OH C 2 H 4 + H 2 O hγ III. CH 4 +
PRZYKŁADOWE ZADANIA KWASY Zadanie 1014 (3 pkt) Pr.XII/2004 A2 Określ typ podanych niżej reakcji: I. C 17 H 33 COOH + Br 2 C 17 H 33 Br 2 COOH Al 2O 3, temp II. C 2 H 5 OH C 2 H 4 + H 2 O hγ III. CH 4 +
Podstawy chemii organicznej. T. 2 / Aleksander Kołodzieczyk, Krystyna Dzierzbicka. Gdańsk, Spis treści
 Podstawy chemii organicznej. T. 2 / Aleksander Kołodzieczyk, Krystyna Dzierzbicka. Gdańsk, 2013 Spis treści 14. ZWIĄZKI KARBONYLOWE 11 14.1. Budowa grupy karbonylowej 11 14.2. Reaktywność związków karbonylowych
Podstawy chemii organicznej. T. 2 / Aleksander Kołodzieczyk, Krystyna Dzierzbicka. Gdańsk, 2013 Spis treści 14. ZWIĄZKI KARBONYLOWE 11 14.1. Budowa grupy karbonylowej 11 14.2. Reaktywność związków karbonylowych
Podstawy chemii organicznej. T. 1 / Aleksander Kołodziejczyk, Krystyna Dzierzbicka. wyd. 3. Gdańsk, Spis treści
 Podstawy chemii organicznej. T. 1 / Aleksander Kołodziejczyk, Krystyna Dzierzbicka. wyd. 3. Gdańsk, 2015 Spis treści Wstęp 9 1. WIĄZANIA CHEMICZNE 11 1.1. Wprowadzenie 11 1.2. Wiązania chemiczne 13 1.3.
Podstawy chemii organicznej. T. 1 / Aleksander Kołodziejczyk, Krystyna Dzierzbicka. wyd. 3. Gdańsk, 2015 Spis treści Wstęp 9 1. WIĄZANIA CHEMICZNE 11 1.1. Wprowadzenie 11 1.2. Wiązania chemiczne 13 1.3.
Podział związków organicznych
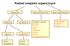 Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Mg I. I Mg. Nie można ich jednak otrzymać ze związków, które posiadają grupy chlorowcowe w tak zwanym ustawieniu wicynalnym.
 nformacje do zadań kwalifikacyjnych na "Analizę retrosyntetyczną" Urszula Chrośniak, Marcin Goławski Właściwe zadania znajdują się na stronach 9.-10. Strony 1.-8. zawieraja niezbędne informacje wstępne.
nformacje do zadań kwalifikacyjnych na "Analizę retrosyntetyczną" Urszula Chrośniak, Marcin Goławski Właściwe zadania znajdują się na stronach 9.-10. Strony 1.-8. zawieraja niezbędne informacje wstępne.
Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy. Dział Zakres treści
 Anna Kulaszewicz Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy lp. Dział Temat Zakres treści 1 Zapoznanie z przedmiotowym systemem oceniania i wymaganiami edukacyjnymi z
Anna Kulaszewicz Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy lp. Dział Temat Zakres treści 1 Zapoznanie z przedmiotowym systemem oceniania i wymaganiami edukacyjnymi z
Kwasy karboksylowe C O OH OH C CH 2 H OH CH 2 C CH 3 C OH C OH C OH. propionowy. mrówkowy. akrylowy. octowy. masłowy metakrylowy.
 Kwasy karboksylowe Największą kwasowość spośród związków organicznych wykazują kwasy karboksylowe. Związki te zawierają w cząsteczce grupę karboksylową H, połączoną albo z grupą alkilową R (RH) albo grupą
Kwasy karboksylowe Największą kwasowość spośród związków organicznych wykazują kwasy karboksylowe. Związki te zawierają w cząsteczce grupę karboksylową H, połączoną albo z grupą alkilową R (RH) albo grupą
ALDEHYDY, KETONY. I. Wprowadzenie teoretyczne
 ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
Krystyna Dzierzbicka
 Krystyna Dzierzbicka Aldehydy i ketony są pochodnymi węglowodorów zawierającymi grupę karbonylową =. Aldehydy związki zawierające grupę formylową (-) połączoną z atomem węgla: R(Ar)-, R reszta alkilowa;
Krystyna Dzierzbicka Aldehydy i ketony są pochodnymi węglowodorów zawierającymi grupę karbonylową =. Aldehydy związki zawierające grupę formylową (-) połączoną z atomem węgla: R(Ar)-, R reszta alkilowa;
Chemia organiczna. Alkohole Fenole. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
Chemia organiczna Alkohole Fenole Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 Związki zawierające grupę OH alkohole enole fenol sp 3 sp 2 alkohole nienasycone, aromatyczne sp 2 pochodne alkanów
Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r.
 Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r. Lp. Temat lekcji 1. Szereg homologiczny alkanów. 2. Izomeria konstytucyjna w alkanach. 3.
Plan wynikowy z chemii dla klasy II Liceum profilowanego i Technikum III Liceum ogólnokształcącego. 2003/2004 r. Lp. Temat lekcji 1. Szereg homologiczny alkanów. 2. Izomeria konstytucyjna w alkanach. 3.
Kwasy karboksylowe to jednofunkcyjne pochodne węglowodorów o grupie funkcyjnej -COOH zwanej grupą karboksylową.
 Spis treści: Charakterystyka grupy karboksylowej Podział kwasów karboksylowych Nazewnictwo kwasy monokarboksylowe alifatyczne nasycone kwasy monokarboksylowe alifatyczne nienasycone kwasy dikarboksylowe
Spis treści: Charakterystyka grupy karboksylowej Podział kwasów karboksylowych Nazewnictwo kwasy monokarboksylowe alifatyczne nasycone kwasy monokarboksylowe alifatyczne nienasycone kwasy dikarboksylowe
Politechnika Krakowska im. Tadeusza Kościuszki. Karta przedmiotu. obowiązuje studentów rozpoczynających studia w roku akademickim 2013/2014
 Politechnika Krakowska im. Tadeusza Kościuszki Karta przedmiotu obowiązuje studentów rozpoczynających studia w roku akademickim 2013/2014 Wydział Inżynierii i Technologii Chemicznej Kierunek studiów: Inżynieria
Politechnika Krakowska im. Tadeusza Kościuszki Karta przedmiotu obowiązuje studentów rozpoczynających studia w roku akademickim 2013/2014 Wydział Inżynierii i Technologii Chemicznej Kierunek studiów: Inżynieria
Reakcje związków karbonylowych zudziałem atomu węgla alfa (C- )
 34-37. eakcje związków karbonylowych zudziałem atomu węgla alfa (C- ) stabilizacja rezonansem (przez delokalizację elektronów), może uczestniczyć w delokalizacji elektronów C- -, podatny na oderwanie ze
34-37. eakcje związków karbonylowych zudziałem atomu węgla alfa (C- ) stabilizacja rezonansem (przez delokalizację elektronów), może uczestniczyć w delokalizacji elektronów C- -, podatny na oderwanie ze
Reakcje alkoholi, eterów, epoksydów, amin i tioli
 22-24. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas Chemia rganiczna,
22-24. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas Chemia rganiczna,
Materiały dodatkowe alkohole, fenole, etery
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe alkohole, fenole, etery Alkohole i fenole 1 Własności kwasowo-zasadowe alkoholi i fenoli becność grupy H, posiadającej
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe alkohole, fenole, etery Alkohole i fenole 1 Własności kwasowo-zasadowe alkoholi i fenoli becność grupy H, posiadającej
ĆWICZENIE 1 ANALIZA JAKOŚCIOWA ZWIĄZKÓW ORGANICZNYCH
 ĆWICZENIE 1 ANALIZA JAKOŚCIOWA ZWIĄZKÓW ORGANICZNYCH Wstęp merytoryczny Potwierdzenia tożsamości związku organicznego dokonuje się na podstawie danych fizykochemicznych (temperatura topnienia lub wrzenia,
ĆWICZENIE 1 ANALIZA JAKOŚCIOWA ZWIĄZKÓW ORGANICZNYCH Wstęp merytoryczny Potwierdzenia tożsamości związku organicznego dokonuje się na podstawie danych fizykochemicznych (temperatura topnienia lub wrzenia,
Wyróżnione wymagania programowe odpowiadają wymaganiom ogólnym i szczegółowym zawartym w treściach nauczania podstawy programowej.
 Wymagania programowe z chemii na poszczególne oceny. IV etap edukacyjny - przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. Podręcznika dla liceum
Wymagania programowe z chemii na poszczególne oceny. IV etap edukacyjny - przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. Podręcznika dla liceum
Ocena dobra [ ] Uczeń:
![Ocena dobra [ ] Uczeń: Ocena dobra [ ] Uczeń:](/thumbs/67/57994710.jpg) Chemia - klasa III Wymagania edukacyjne 1.Węglowodory Ocena dopuszczająca [1] definiuje pojęcia: węglowodory, alkany, alkeny, alkiny, szereg homologiczny, grupa alkilowa, reakcje podstawiania (substytucji),
Chemia - klasa III Wymagania edukacyjne 1.Węglowodory Ocena dopuszczająca [1] definiuje pojęcia: węglowodory, alkany, alkeny, alkiny, szereg homologiczny, grupa alkilowa, reakcje podstawiania (substytucji),
Wymagania edukacyjne niezbędne do uzyskania oceny klasyfikacyjnej z chemii klasa trzecia -chemia organiczna
 Wymagania edukacyjne niezbędne do uzyskania oceny klasyfikacyjnej z chemii klasa trzecia -chemia organiczna 1. Chemia organiczna jako chemia związków węgla Ocena dopuszczająca Ocena dostateczna Ocena dobra
Wymagania edukacyjne niezbędne do uzyskania oceny klasyfikacyjnej z chemii klasa trzecia -chemia organiczna 1. Chemia organiczna jako chemia związków węgla Ocena dopuszczająca Ocena dostateczna Ocena dobra
1. Chemia organiczna jako chemia związków węgla. 2. Węglowodory
 Propozycje wymagań programowych na poszczególne oceny przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
Propozycje wymagań programowych na poszczególne oceny przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
CHEMIA KLASA Chemia organiczna jako chemia związków węgla. 2. Węglowodory
 CHEMIA KLASA 3 Wymagania programowe na poszczególne oceny przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
CHEMIA KLASA 3 Wymagania programowe na poszczególne oceny przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
Wyróżnione wymagania programowe odpowiadają wymaganiom ogólnym i szczegółowym zawartym w treściach nauczania podstawy programowej.
 Propozycje wymagań programowych na poszczególne oceny (IV etap edukacyjny) przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum
Propozycje wymagań programowych na poszczególne oceny (IV etap edukacyjny) przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum
Substytucje Nukleofilowe w Pochodnych Karbonylowych
 J 1 Substytucje kleofilowe w Pochodnych Karbonylowych Y Y Y Slides 1 to 21 J 2 Addycje vs Podstawienia Ładunek δ zlokalizowany na atomie węgla w grupy karbonylowej powoduje, Ŝe e atak nukleofila moŝe doprowadzić
J 1 Substytucje kleofilowe w Pochodnych Karbonylowych Y Y Y Slides 1 to 21 J 2 Addycje vs Podstawienia Ładunek δ zlokalizowany na atomie węgla w grupy karbonylowej powoduje, Ŝe e atak nukleofila moŝe doprowadzić
Ocena dobra [ ] Uczeń:
![Ocena dobra [ ] Uczeń: Ocena dobra [ ] Uczeń:](/thumbs/55/35935976.jpg) KLASA III A Wymagania edukacyjne na poszczególne oceny przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
KLASA III A Wymagania edukacyjne na poszczególne oceny przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
Wyróżnione wymagania programowe odpowiadają wymaganiom ogólnym i szczegółowym zawartym w treściach nauczania podstawy programowej.
 Wymagania na poszczególne oceny (IV etap edukacyjny) przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego i
Wymagania na poszczególne oceny (IV etap edukacyjny) przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego i
CHEMIA KLASA III LICEUM OGÓLNOKSZTAŁCĄCEGO - wymagania edukacyjne. zakres rozszerzony
 CHEMIA KLASA III LICEUM OGÓLNOKSZTAŁCĄCEGO - wymagania edukacyjne. zakres rozszerzony Wymagania na poszczególne oceny zostały sformułowane dla każdego działu. Mają one charakter spiralny, co oznacza, ze
CHEMIA KLASA III LICEUM OGÓLNOKSZTAŁCĄCEGO - wymagania edukacyjne. zakres rozszerzony Wymagania na poszczególne oceny zostały sformułowane dla każdego działu. Mają one charakter spiralny, co oznacza, ze
Chemia organiczna. T. 1 / Robert Thornton Morrison, Robert Neilson Boyd. wyd. 5, dodr. 6. Warszawa, Spis treści
 Chemia organiczna. T. 1 / Robert Thornton Morrison, Robert Neilson Boyd. wyd. 5, dodr. 6. Warszawa, 2012 Spis treści Część I. Podstawy 1. Struktura i właściwości związków organicznych 22 1.1. Chemia organiczna
Chemia organiczna. T. 1 / Robert Thornton Morrison, Robert Neilson Boyd. wyd. 5, dodr. 6. Warszawa, 2012 Spis treści Część I. Podstawy 1. Struktura i właściwości związków organicznych 22 1.1. Chemia organiczna
Metody fosforylacji. Schemat 1. Powstawanie trifosforanu nukleozydu
 Metody fosforylacji Fosforylacja jest procesem przenoszenia reszty fosforanowej do nukleofilowego atomu dowolnego związku chemicznego. Najczęściej fosforylację przeprowadza się na atomie tlenu grupy hydroksylowej
Metody fosforylacji Fosforylacja jest procesem przenoszenia reszty fosforanowej do nukleofilowego atomu dowolnego związku chemicznego. Najczęściej fosforylację przeprowadza się na atomie tlenu grupy hydroksylowej
REAKCJE W CHEMII ORGANICZNEJ
 Katedra Biochemii ul. Akademicka 12, 20-033 Lublin tel. 081 445 66 08 www.biochwet.up.lublin.pl REAKCJE W CHEMII ORGANICZNEJ I. Reakcje utleniania na przykładzie różnych związków organicznych. 1. Utlenienie
Katedra Biochemii ul. Akademicka 12, 20-033 Lublin tel. 081 445 66 08 www.biochwet.up.lublin.pl REAKCJE W CHEMII ORGANICZNEJ I. Reakcje utleniania na przykładzie różnych związków organicznych. 1. Utlenienie
WYMAGANIA PROGRAMOWE Z CHEMII DLA KLAS TRZECICH ZAKRES ROZSZERZONY
 WYMAGANIA PROGRAMOWE Z CHEMII DLA KLAS TRZECICH ZAKRES ROZSZERZONY Opracowano na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
WYMAGANIA PROGRAMOWE Z CHEMII DLA KLAS TRZECICH ZAKRES ROZSZERZONY Opracowano na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
Wyróżnione wymagania programowe odpowiadają wymaganiom ogólnym i szczegółowym zawartym w treściach nauczania podstawy programowej.
 Wymagania programowe na poszczególne oceny (IV etap edukacyjny) przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
Wymagania programowe na poszczególne oceny (IV etap edukacyjny) przygotowane na podstawie treści zawartych w podstawie programowej, programie nauczania oraz w części 2. podręcznika dla liceum ogólnokształcącego
Materiały dodatkowe związki karbonylowe
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe związki karbonylowe 1. Polaryzacja wiązania C= Charakterystyczną cechą związków posiadających grupę karbonylową
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe związki karbonylowe 1. Polaryzacja wiązania C= Charakterystyczną cechą związków posiadających grupę karbonylową
AMINY. nikotyna. tytoń szlachetny. pseudoefedryna (SUDAFED) atropina. muskaryna H 3 C CH 3 O
 AMINY nikotyna H 3 C NH tytoń szlachetny OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN 2 NUKLEOFILOWOŚĆ i ZASADOWOŚĆ AMIN 3 REAKCJA AMIN Z KWASAMI MINERALNYMI I KARBOKSYLOWYMI
AMINY nikotyna H 3 C NH tytoń szlachetny OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN 2 NUKLEOFILOWOŚĆ i ZASADOWOŚĆ AMIN 3 REAKCJA AMIN Z KWASAMI MINERALNYMI I KARBOKSYLOWYMI
WYMAGANIA EDUKACYJNE NA POSZCZEGÓLNE OCENY DLA KLASY III LO To jest chemia 2. Chemia organiczna, zakres rozszerzony.
 WYMAGANIA EDUKACYJNE NA POSZCZEGÓLNE OCENY DLA KLASY III LO To jest chemia 2. Chemia organiczna, zakres rozszerzony. Wyróżnione wymagania programowe odpowiadają wymaganiom ogólnym i szczegółowym zawartym
WYMAGANIA EDUKACYJNE NA POSZCZEGÓLNE OCENY DLA KLASY III LO To jest chemia 2. Chemia organiczna, zakres rozszerzony. Wyróżnione wymagania programowe odpowiadają wymaganiom ogólnym i szczegółowym zawartym
Slajd 1. Etery i epoksydy. Slajd 2. Wprowadzenie. Wzór R-O-R, gdzie R tos alkil lub aryl Symetryczne lub asymetryczne Przykłady: CH 3 O CH 3 O CH 3
 Slajd 1 Etery i epoksydy Slajd 2 Wprowadzenie Wzór R--R, gdzie R tos alkil lub aryl Symetryczne lub asymetryczne Przykłady: C 3 C 3 C 3 Slajd 3 Budowa i polarność Wygięta struktura Atom tlenu posiada hybrydyzacjęsp
Slajd 1 Etery i epoksydy Slajd 2 Wprowadzenie Wzór R--R, gdzie R tos alkil lub aryl Symetryczne lub asymetryczne Przykłady: C 3 C 3 C 3 Slajd 3 Budowa i polarność Wygięta struktura Atom tlenu posiada hybrydyzacjęsp
Chemia organiczna. T. 2 / Robert Thornton Morrison, Robert Neilson Boyd. wyd. 5, 3 dodr. Warszawa, Spis treści
 Chemia organiczna. T. 2 / Robert Thornton Morrison, Robert Neilson Boyd. wyd. 5, 3 dodr. Warszawa, 2010 Spis treści Część II. Zagadnienia wybrane 25. Halogenki arylów. Substytucja nukleofilowa w pierścieniu
Chemia organiczna. T. 2 / Robert Thornton Morrison, Robert Neilson Boyd. wyd. 5, 3 dodr. Warszawa, 2010 Spis treści Część II. Zagadnienia wybrane 25. Halogenki arylów. Substytucja nukleofilowa w pierścieniu
Reakcje chemiczne. Typ reakcji Schemat Przykłady Reakcja syntezy
 Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
Reakcje chemiczne Literatura: L. Jones, P. Atkins Chemia ogólna. Cząsteczki, materia, reakcje. Lesław Huppenthal, Alicja Kościelecka, Zbigniew Wojtczak Chemia ogólna i analityczna dla studentów biologii.
WĘGLOWODORY AROMATYCZNE
 WĘGLOWODORY AROMATYCZNE cykliczne węglowodory spełniające warunki aromatyczności: Ale: związki niearomatyczne 1 ZWIĄZKI AROMATYCZNE - przykłady 2 NOMENKLATURA Monocykliczne węglowodory aromatyczne są nazywane
WĘGLOWODORY AROMATYCZNE cykliczne węglowodory spełniające warunki aromatyczności: Ale: związki niearomatyczne 1 ZWIĄZKI AROMATYCZNE - przykłady 2 NOMENKLATURA Monocykliczne węglowodory aromatyczne są nazywane
Otrzymywanie halogenków alkilów
 Otrzymywanie halogenków alkilów 1) Wymiana grupy OH w alkoholach C O H HX 2) reakcja podstawienia alkanów C X H 3 C CH CH 2 HBr C H 3 OH H 3 C CH CH 2 C H 3 Br h + + CH CH 2 3 Cl 2 Cl HCl CH CH 3 3 CH
Otrzymywanie halogenków alkilów 1) Wymiana grupy OH w alkoholach C O H HX 2) reakcja podstawienia alkanów C X H 3 C CH CH 2 HBr C H 3 OH H 3 C CH CH 2 C H 3 Br h + + CH CH 2 3 Cl 2 Cl HCl CH CH 3 3 CH
1 Marek Żylewski. Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii Organicznej. NO 2 Zn, HCl HNO 3 N H 2. NH 2 Na 2. S x CHO.
 Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe związki azotowe Związki nitrowe 1. Redukcja związków nitrowych. Grupa nitrowa jest bardzo podatna na działanie
Uniwersytet Jagielloński, Collegium Medicum, Katedra Chemii rganicznej Materiały dodatkowe związki azotowe Związki nitrowe 1. Redukcja związków nitrowych. Grupa nitrowa jest bardzo podatna na działanie
CHEMIA KLASA III LICEUM OGÓLNOKSZTAŁCĄCE ZAKRES ROZSZERZONY SZKOŁY BENEDYKTA
 CHEMIA KLASA III 2016-09-01 LICEUM OGÓLNOKSZTAŁCĄCE ZAKRES ROZSZERZONY SZKOŁY BENEDYKTA Treści nauczania Tom III podręcznika Ciekawi świata wyd. Operon I. WĘGLOWODORY 1. Chemia organiczna jako chemia związków
CHEMIA KLASA III 2016-09-01 LICEUM OGÓLNOKSZTAŁCĄCE ZAKRES ROZSZERZONY SZKOŁY BENEDYKTA Treści nauczania Tom III podręcznika Ciekawi świata wyd. Operon I. WĘGLOWODORY 1. Chemia organiczna jako chemia związków
Zadanie 2. (0 1) Uzupełnij schemat reakcji estryfikacji. Wybierz spośród podanych wzór kwasu karboksylowego A albo B oraz wzór alkoholu 1 albo 2.
 Zadanie 1. (0 1) W celu odróżnienia kwasu oleinowego od stopionego kwasu palmitynowego wykonano doświadczenie, którego przebieg przedstawiono na schemacie. W probówce I wybrany odczynnik zmienił zabarwienie.
Zadanie 1. (0 1) W celu odróżnienia kwasu oleinowego od stopionego kwasu palmitynowego wykonano doświadczenie, którego przebieg przedstawiono na schemacie. W probówce I wybrany odczynnik zmienił zabarwienie.
Wykład 8. Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.)
 Wykład 8 Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.) ALKOHOLE I FENOLE Związki o wzorze ogólnym R-OH. W fenolach grupa OH jest bezpośrednio związana z pierścieniem aromatycznum.
Wykład 8 Korzystałem z : R. Morrison, R. Boyd: Chemia organiczna (wyd. ang.) ALKOHOLE I FENOLE Związki o wzorze ogólnym R-OH. W fenolach grupa OH jest bezpośrednio związana z pierścieniem aromatycznum.
Węglowodory nomenklatura Pochodne chlorowcowe węglowodorów
 Węglowodory nomenklatura 1. Alkany: a) otrzymywanie metodą Wurtza, ze związków Gringarda, z halogenków alkilów, przez elektrolizę soli kwasów karboksylowych. b) Własności: halogenowanie, spalanie, piroliza,
Węglowodory nomenklatura 1. Alkany: a) otrzymywanie metodą Wurtza, ze związków Gringarda, z halogenków alkilów, przez elektrolizę soli kwasów karboksylowych. b) Własności: halogenowanie, spalanie, piroliza,
Chemia organiczna. Mechanizmy reakcji chemicznych. Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego
 Chemia organiczna Mechanizmy reakcji chemicznych Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego 1 homoliza - homolityczny rozpad wiązania w jednym z reagentów; powstają produkty zawierające
Chemia organiczna Mechanizmy reakcji chemicznych Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego 1 homoliza - homolityczny rozpad wiązania w jednym z reagentów; powstają produkty zawierające
Kwasy organiczne. 1. Narysuj wzory półstrukturalne poniższych kwasów:
 Kwasy organiczne 1. arysuj wzory półstrukturalne poniższych kwasów: a. glicerynowy b. cytrynowy c. szczawiooctowy d. bursztynowy e. cynamonowy f. akrylowy g. jabłkowy h. walerianowy i. fosfoenolopirogronowy
Kwasy organiczne 1. arysuj wzory półstrukturalne poniższych kwasów: a. glicerynowy b. cytrynowy c. szczawiooctowy d. bursztynowy e. cynamonowy f. akrylowy g. jabłkowy h. walerianowy i. fosfoenolopirogronowy
Pochodne węglowodorów
 Literka.pl Pochodne węglowodorów Data dodania: 2010-01-12 15:53:16 Autor: Janina Tofel-Bykowa Sprawdzian wiadomości i umiejętności z chemii organicznej w kl. III gimnazjum. I Dokończ zdanie: 1. Nazwa grupy
Literka.pl Pochodne węglowodorów Data dodania: 2010-01-12 15:53:16 Autor: Janina Tofel-Bykowa Sprawdzian wiadomości i umiejętności z chemii organicznej w kl. III gimnazjum. I Dokończ zdanie: 1. Nazwa grupy
CHARAKTERYSTYKA KARBOKSYLANÓW
 AAKTEYSTYKA KABKSYLANÓW 1. GÓLNA AAKTEYSTYKA KWASÓW KABKSYLWY Spośród związków organicznych, które wykazują znaczną kwasowość najważniejsze są kwasy karboksylowe. Związki te zawierają w cząsteczce grupę
AAKTEYSTYKA KABKSYLANÓW 1. GÓLNA AAKTEYSTYKA KWASÓW KABKSYLWY Spośród związków organicznych, które wykazują znaczną kwasowość najważniejsze są kwasy karboksylowe. Związki te zawierają w cząsteczce grupę
I KSZTAŁCENIA PRAKTYCZNEGO. Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO XV Konkurs Chemii Organicznej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1 (9 pkt) Ciekłą mieszaninę,
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO XV Konkurs Chemii Organicznej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1 (9 pkt) Ciekłą mieszaninę,
Właściwości chemiczne nukleozydów pirymidynowych i purynowych
 Właściwości chemiczne nukleozydów pirymidynowych i purynowych Właściwości nukleozydów są ściśle powiązane z elementami strukturalnymi ich budowy. Zasada azotowa obecna w nukleozydach może być poddawana
Właściwości chemiczne nukleozydów pirymidynowych i purynowych Właściwości nukleozydów są ściśle powiązane z elementami strukturalnymi ich budowy. Zasada azotowa obecna w nukleozydach może być poddawana
CH 3 OH C 2 H 5 OH H 3 C CH 2 CH 2 OH H 3 C CH CH 3 OH metanol etanol propan-1-ol propan-2-ol H 2 C CH 2 OH OH H 2 C CH CH 2 OH OH OH
 Alkohole Alkohole to związki organiczne, posiadające w cząsteczce przynajmniej jedną hydroksylową grupę funkcyjną ( ). Jeżeli grupa ta jest połączona bezpośrednio z pierścieniem aromatycznym, to taki związek
Alkohole Alkohole to związki organiczne, posiadające w cząsteczce przynajmniej jedną hydroksylową grupę funkcyjną ( ). Jeżeli grupa ta jest połączona bezpośrednio z pierścieniem aromatycznym, to taki związek
X / \ Y Y Y Z / \ W W ... imię i nazwisko,nazwa szkoły, miasto
 Zadanie 1. (3 pkt) Nadtlenek litu (Li 2 O 2 ) jest ciałem stałym, występującym w temperaturze pokojowej w postaci białych kryształów. Stosowany jest w oczyszczaczach powietrza, gdzie ważna jest waga użytego
Zadanie 1. (3 pkt) Nadtlenek litu (Li 2 O 2 ) jest ciałem stałym, występującym w temperaturze pokojowej w postaci białych kryształów. Stosowany jest w oczyszczaczach powietrza, gdzie ważna jest waga użytego
Kwas HA i odpowiadająca mu zasada A stanowią sprzężoną parę (podobnie zasada B i kwas BH + ):
 Spis treści 1 Kwasy i zasady 2 Rola rozpuszczalnika 3 Dysocjacja wody 4 Słabe kwasy i zasady 5 Skala ph 6 Oblicznie ph słabego kwasu 7 Obliczanie ph słabej zasady 8 Przykłady obliczeń 81 Zadanie 1 811
Spis treści 1 Kwasy i zasady 2 Rola rozpuszczalnika 3 Dysocjacja wody 4 Słabe kwasy i zasady 5 Skala ph 6 Oblicznie ph słabego kwasu 7 Obliczanie ph słabej zasady 8 Przykłady obliczeń 81 Zadanie 1 811
Rozwiązania. dla produktu MN dla M = 3 dla N = 1. Stałą równowagi obliczamy z następującego wzoru:
 Rozwiązania Zadanie 1 Efekt cieplny rozpuszczania 272 g Ca SO 4 wynosi: 136 g Ca SO 4 to masa 1 mola 272 g Ca SO 4 to 2 mole. Odpowiedź: Ciepło rozpuszczania odnosi się do 1 mola substancji, stąd 2x(-20,2
Rozwiązania Zadanie 1 Efekt cieplny rozpuszczania 272 g Ca SO 4 wynosi: 136 g Ca SO 4 to masa 1 mola 272 g Ca SO 4 to 2 mole. Odpowiedź: Ciepło rozpuszczania odnosi się do 1 mola substancji, stąd 2x(-20,2
Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO:
 FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
FLUOROWCOPOCHODNE Halogenki alkilowe- atom fluorowca jest związany z atomem węgla o hybrydyzacji sp 3 KLASYFIKACJA ZE WZGLĘDU NA BUDOWĘ FRAGMENTU ALKILOWEGO: Cl CH 2 -CH 2 -CH 2 -CH 3 CH 3 -CH-CH 3 pierwszorzędowe
Wymagania edukacyjne z chemii oraz sposoby sprawdzania wiedzy i umiejętności
 Wymagania edukacyjne z chemii oraz sposoby sprawdzania wiedzy i umiejętności Kwasy Wymagania edukacyjne z podstawy programowej - klasa VIII Uczeń: definiuje pojęcie kwasy zgodnie z teorią Arrheniusa opisuje
Wymagania edukacyjne z chemii oraz sposoby sprawdzania wiedzy i umiejętności Kwasy Wymagania edukacyjne z podstawy programowej - klasa VIII Uczeń: definiuje pojęcie kwasy zgodnie z teorią Arrheniusa opisuje
Laboratorium. Podstawowe procesy jednostkowe w technologii chemicznej
 Laboratorium Podstawowe procesy jednostkowe w technologii chemicznej Studia niestacjonarne Ćwiczenie Alkilowanie toluenu chlorkiem tert-butylu 1 PROCESY ALKILOWANIA PIERŚCIENIA AROMATYCZNEGO: ALKILOWANIE
Laboratorium Podstawowe procesy jednostkowe w technologii chemicznej Studia niestacjonarne Ćwiczenie Alkilowanie toluenu chlorkiem tert-butylu 1 PROCESY ALKILOWANIA PIERŚCIENIA AROMATYCZNEGO: ALKILOWANIE
