BBL Lowenstein-Jensen Medium BBL Lowenstein-Jensen Medium with 5% Sodium Chloride
|
|
|
- Kamila Amelia Pietrzak
- 8 lat temu
- Przeglądów:
Transkrypt
1 I II BBL Lowenstein-Jensen Medium BBL Lowenstein-Jensen Medium with 5% Sodium Chloride wersja 08 Styczeń 2007 PROCEDURY KONTROLI JAKOŚCI WPROWADZENIE Podłoże Lowenstein-Jensen Medium służy do izolacji i hodowli prątków. Podłoże w głębokich probówkach służy do półilościowego badania reakcji wytwarzania katalazy, przydatnego w klasyfikacji prątków. PROCEDURA KONTROLI DZIAŁANIA A. Procedura przygotowania inokulum 1. Zaszczepić na skośnych podłożach Lowenstein-Jensen hodowle macierzyste odpowiednich szczepów prątków, używając sterylnych pałeczek. 2. Inkubować probówki z poluzowanymi nakrętkami w atmosferze tlenowej wzbogaconej dwutlenkiem węgla, w temperaturze 35 ± 2 C, aż do uzyskania intensywnego wzrostu (zwykle po 2 3 tygodniach). 3. Zebrać wyhodowane kultury za pomocą sterylnego zaostrzonego aplikatora. Delikatnie zbierać komórki z powierzchni podłoża, uważając, by nie zagarnąć podłoża razem z zebranym materiałem komórkowym. a. W przypadku szczepu Mycobacterium tuberculosis ATCC 25177: (1) Przenieść hodowlę do 5,0 ml pożywki Middlebrook 7H9 Broth with Glycerol w sterylnej szklanej probówce z zakrętką zawierającej sterylne paciorki szklane. (2) Dobrze odwirować (przez kilka minut), tak aby zawiesina nie zawierała dużych zgrupowań. (3) Porównać zawiesinę ze wzorcem nefelometrycznym McFarland nr 1. Zawiesina powinna być bardziej mętna niż wzorzec. (4) Umieścić probówkę w statywie i pozostawić na 2 3 h w temperaturze pokojowej, aby większe cząstki osiadły na dnie. (5) Przenieść supernatant do sterylnego pojemnika. (6) Skorygować zmętnienie zawiesiny do wzorca McFarland nr 1, powoli dodając sterylną pożywkę Middlebrook 7H9 Broth with Glycerol. Dokładnie wstrząsnąć. (7) Przed użyciem rozcieńczyć do 10 5 CFU/mL. Dobrze wymieszać i wykonać posiew pożywki testowej za pomocą ezy kalibrowanej (0,01 ml). b. W przypadku wszystkich innych szczepów prątków: (1) Przenieść hodowlę do sterylnej 50 ml zakręcanej probówki do wirówek, zawierającej od 8 do 12 sterylnych paciorków szklanych (o średnicy 2 mm) i 5 ml rozcieńczalnika do hodowli prątków przygotowanego w następujący sposób: Wymieszać następujące składniki w butelce o pojemności 1 L i skorygować ph do 6,7 7,0 1N wodorotlenkiem sodu: albumina surowicy wołowej (bez kwasów tłuszczowych)...1,0 g Polysorbate ,1 ml Woda oczyszczona ml Poddać sterylizacji, przesączając przez błonę (filtr 0,2 µ). Stosując technikę aseptyczną, rozlać po 5,5 ml do sterylnych probówek z zakrętkami. (2) Za pomocą aplikatora wytworzyć emulsję hodowli prątków na ściankach bocznych zakręcanej probówki do wirówek. Wymieszać hodowlę z rozcieńczalnikiem. (3) Zakręcić probówkę i wirować przez około 10 min, aż do wytworzenia zawiesiny bakterii niezawierającej dużych zgrupowań. (4) Dodać 15 ml sterylnego rozcieńczalnika do hodowli prątków i dokładnie wymieszać. 1
2 (5) Porównać zawiesinę ze wzorcem nefelometrycznym McFarland nr 1. Zawiesina powinna być bardziej mętna niż wzorzec. (6) Umieścić probówkę w statywie i pozostawić na 2 3 h w temperaturze pokojowej, aby większe cząstki osiadły na dnie. (7) Odessać supernatant i przenieść do sterylnego pojemnika. Zawiesina musi być bardziej mętna od wzorca McFarland nr 1 i nie może zawierać dużych cząstek. Jeśli nadal obecne są duże cząstki, wymieszać zawiesinę i pozostawić bez ruchu na 1 h. Przenieść supernatant do sterylnego pojemnika. (8) Skorygować zmętnienie zawiesiny do wzorca McFarland nr 1, powoli dodając sterylny rozcieńczalnik do prątków. Dokładnie wstrząsnąć. (9) Rozlać porcje zawiesiny do fiolek przystosowanych do zamrażania, opatrzonych etykietami z nazwą drobnoustrojów i datą sporządzenia. (10) Zamrozić zawiesiny, umieszczając fiolki w chłodziarce niskotemperaturowej, w temperaturze 60 C. Fiolki można przechować przez okres maks. 6 miesięcy. (11) Gdy będzie potrzebna, wyjąć zamrożoną fiolkę z chłodziarki i szybko rozmrozić zawartość, umieszczając probówkę w łaźni wodnej o temperaturze 30 do 35 C. Przed użyciem rozcieńczyć do 10 5 CFU/mL. Dobrze wymieszać i wykonać posiew pożywki testowej za pomocą ezy kalibrowanej (0,01 ml). B. Procedury testowania podłoża Lowenstein-Jensen Medium Deeps (Podłoże Lowenstein-Jensen Medium w głębokich probówkach) 1. Wykonać posiew hodowli przygotowanych w sposób opisany powyżej na powierzchniach przylegających za pomocą sterylnej jednorazowej ezy 0,01 ml. 2. Inkubować probówki z poluzowanymi zakrętkami, w temperaturze 35 ± 2 C, w atmosferze tlenowej wzbogaconej dwutlenkiem węgla. 3. Po 14 dniach inkubacji dodać do każdej hodowli 1,0 ml mieszanki Polysorbate 80 z nadtlenkiem wodoru, przygotowanej w następujący sposób: a. Nadtlenek wodoru 30%. Przechowywać w chłodziarce. b. Roztwór 10% Polysorbate 80 przygotowany w następujący sposób: (1) Zmieszać 10 ml Polysorbate 80 z 90 ml oczyszczonej wody. (2) Sterylizować przez 10 min w autoklawie, w temperaturze 121 C. (3) Przechowywać w chłodziarce. c. Bezpośrednio przed badaniem wymieszać oba roztwory w równych proporcjach. 4. Pozostawić hodowle stojące w pozycji pionowej na 5 min w temperaturze pokojowej. 5. Zmierzyć wysokość (w mm) kolumny pęcherzyków nad powierzchnią podłoża. 6. Oczekiwane wyniki Kolumna pęcherzyków wyższa niż 45 mm. *Mycobacterium kansasii, grupa I ATCC Mycobacterium scrofulaceum, grupa II ATCC Mycobacterium fortuitum, grupa IV ATCC 6841 Kolumna pęcherzyków niższa niż 45 mm. *Mycobacterium tuberculosis H37Ra ATCC Mycobacterium intracellulare, grupa III ATCC *Szczep zalecany do przeprowadzania kontroli jakości przez użytkownika. Lowenstein-Jensen Medium Slants and Bottles (Lowenstein-Jensen Medium jako podłoże skośne w probówkach i podłoże w butelkach) 1. Podłoża zaszczepić reprezentatywnymi próbkami wymienionych szczepów. a. Za pomocą jednorazowych ez kalibrowanych (0,01 ml) wykonać posiew hodowli prątków przygotowanych zgodnie z powyższą procedurą na podłożach skośnych lub w butelkach. b. Inkubować pojemniki z poluzowanymi zakrętkami, w temperaturze 35 ± 2 C, w atmosferze tlenowej wzbogaconej dwutlenkiem węgla. 2
3 III 2. Po 7, 14 i 21 dniach skontrolować probówki lub butelki, oceniając stopień wzrostu, zabarwienie i selektywność. 3. Oczekiwane wyniki a. Dla podłoża Lowenstein-Jensen Medium Gatunki kontrolne CLSI (szczepy wzorcowe ATCC) *Mycobacterium tuberculosis... Wzrost H37Ra (25177) *Mycobacterium kansasii,... Wzrost grupa I (12478) *Mycobacterium scrofulaceum,... Wzrost grupa II (19981) *Mycobacterium intracellulare,... Wzrost grupa III (13950) *Mycobacterium fortuitum,... Wzrost grupa IV (6841) b. Dla podłoża Lowenstein-Jensen Medium with 5% Sodium Chloride *Mycobacterium fortuitum... Wzrost ATCC 6841 *Mycobacterium kanasii... Brak wzrostu ATCC *Szczep zalecany do przeprowadzania kontroli jakości przez użytkownika. DODATKOWA KONTROLA JAKOŚCI 1. Zbadać probówki lub butelki, zgodnie z opisem w punkcie Pogorszenie jakości produktu. 2. Wzrokowo skontrolować reprezentatywne probówki lub butelki, aby upewnić się, że ewentualne wady fizyczne nie będą miały wpływu na ich użycie. 3. Metodą potencjometryczną określić ph w temperaturze pokojowej, aby upewnić się, że odczyn jest zgodny ze specyfikacją i wynosi 7,0 ± 0,2. 4. Inkubować niezaszczepione reprezentatywne próbki i butelki w temperaturze C oraz C, a po 7 i 14 dniach zbadać w kierunku skażenia mikrobiologicznego. INFORMACJE O PRODUKCIE IV PRZEZNACZENIE Podłoże Lowenstein-Jensen Medium służy do hodowli Mycobacterium tuberculosis oraz innych gatunków prątków. V STRESZCZENIE I WYJAŚNIENIA Lowenstein pierwotnie opracował podłoże do hodowli prątków zawierające czerwień Kongo i zieleń malachitową barwniki częściowo hamujące wzrost innych bakterii. 1,2 Barwniki te były również używane w podobny sposób przez innych badaczy, w szczególności Sonnenscheina 3 i Hohna. 4 W Stanach Zjednoczonych popularne było podłoże zawierające fiolet metylowy, opracowane przez Corpera 5 i Petroffa 6, a także podłoże Petragnaniego zawierające zieleń malachitową. Obecna formuła, opracowana przez Jensena 7, charakteryzuje się nieznacznie zmodyfikowaną zawartością cytrynianów i fosforanów oraz zwiększonym stężeniem zieleni malachitowej i nie zawiera czerwieni Kongo. Gotowe podłoża BBL Lowenstein-Jensen Medium mają postać probówek z podłożem skośnym stosowanych w hodowli gatunków Mycobacterium, butelek używanych w sytuacji, gdy potrzebna jest większa powierzchnia podłoża, oraz głębokich probówek z podłożem służących do przeprowadzania półilościowych badań katalazy. Ta ostatnia procedura została opracowana przez Wayne a 8 i jest przydatna w klasyfikacji prątków. Ponadto dostępne jest podłoże z dodatkiem 5% chlorku sodu, gdyż tolerancja na chlorek sodu w stężeniu 5% jest charakterystyczna dla niektórych szczepów prątków (np. M. fortuitum i M. chelonae subsp. abscessus). 9 Na podłożu zawierającym NaCl wzrasta także większość szczepów szybko wzrastających, wolno wzrastające M. triviale i niektóre szczepy M. flavescens. Niezdolność M. chelonae subsp. chelonae do wzrostu pomaga w odróżnieniu tego szczepu od innych należących do kompleksu M. fortuitum (np. M. chelonae subsp. abscessus). 9,10 3
4 VI ZASADY PROCEDURY Lowenstein-Jensen Medium Base ma stosunkowo prosty skład, który wymaga uzupełnienia, tak aby sprzyjał wzrostowi prątków. Przed zagęszczeniem do podłoża dodawana jest mieszanka glicerolu i jaj. Substancje te są źródłem kwasów tłuszczowych i białek metabolizowanych przez prątki. W wyniku koagulacji albumin jaj podczas sterylizacji powstaje stałe podłoże hodowlane. VII ODCZYNNIKI Lowenstein-Jensen Medium Przybliżony skład* w przeliczeniu na jeden 600 ml wody oczyszczonej Dwuwodorofosforan potasu... 2,5 g Siarczan (VI) magnezu... 0,24 g Cytrynian sodu... 0,6 g L-asparagina... 3,6 g Mąka ziemniaczana... 30,0 g Zieleń malachitowa... 0,4 g Glicerol... 12,0 ml Jaja (pełne) ,0 ml *Skorygowany i (lub) uzupełniony zgodnie z wymaganiami mającymi na celu spełnienie kryteriów wydajności. Podłoże Lowenstein-Jensen Medium with 5% Sodium Chloride zawiera powyższe składniki oraz dodatkowo 80 g chlorku sodu na 600 ml. Ostrzeżenia i środki ostrożności Do stosowania w diagnostyce in vitro. Probówki i butelki z ciasno dopasowanymi zatyczkami należy otwierać ostrożnie, aby uniknąć obrażeń spowodowanych pęknięciem szkła. W próbkach klinicznych mogą być obecne drobnoustroje chorobotwórcze, w tym wirusy zapalenia wątroby i wirus HIV. Podczas pracy ze wszelkimi materiałami skażonymi krwią i innymi płynami ustrojowymi należy przestrzegać Standardowych środków ostrożności oraz wytycznych obowiązujących w danej placówce. Używane gotowe probówki, pojemniki na próbki oraz inne materiały skażone należy przed wyrzuceniem poddać sterylizacji w autoklawie. Podczas pracy z próbkami klinicznymi, w przebiegu których nie są wytwarzane aerozole, np. przy przygotowywaniu rozmazów kwasoopornych, należy przestrzegać zasad postępowania i procedur oraz stosować wyposażenie ochronne właściwe dla poziomu 2 bezpieczeństwa biologicznego (Biosafety Level 2). Wszystkie czynności, w wyniku których powstają aerozole, należy przeprowadzać w szafce ochronnej o I lub II klasie bezpieczeństwa biologicznego. W przypadku prac laboratoryjnych związanych z reprodukowaniem i obróbką hodowli M. tuberculosis i M. bovis obowiązkowe jest przestrzeganie zasad i użycie wyposażenia ochronnego właściwego dla poziomu 3 bezpieczeństwa biologicznego (Biosafety Level 3). Również badania próbek pochodzenia zwierzęcego wymagają zastosowania procedur specjalnych. 13 Instrukcje przechowywania Otrzymane probówki i butelki umieścić i przechowywać w ciemnym miejscu, w temperaturze 2 8 C. Unikać zamrażania i przegrzewania. Otwierać dopiero bezpośrednio przed użyciem. Do minimum ograniczać kontakt ze światłem. W pożywkach przechowywanych do momentu użycia, zgodnie z instrukcjami podanymi na etykiecie, można wykonywać posiewy do dnia określonego terminem ważności, a następnie prowadzić inkubację przez zalecany czas. Przed posiewem ogrzać podłoże do temperatury pokojowej. Pogorszenie jakości produktu Nie używać probówek lub butelek, jeżeli są widoczne oznaki skażenia mikrobiologicznego, odbarwienia, wyschnięcia lub inne, świadczące o pogorszeniu jakości. VIII POBIERANIE PRÓBEK I POSTĘPOWANIE Z NIMI Dostępne są różne techniki postępowania z próbkami umożliwiającymi uzyskanie hodowli. Szczegółowe informacje można znaleźć w literaturze przedmiotu. 15,16 Próbki należy pobrać 4
5 przed podaniem środków przeciwbakteryjnych. Próbki powinny zostać niezwłocznie dostarczone do laboratorium. IX PROCEDURA Dostarczane materiały Lowenstein-Jensen Medium lub Lowenstein-Jensen Medium with 5% Sodium Chloride Materiały wymagane, ale niedostarczane Pomocnicze pożywki hodowlane, odczynniki, szczepy do kontroli jakości i wyposażenie laboratoryjne zgodnie z wymaganiami. Procedura testowa Stosować techniki aseptyczne. Procedury testowe są identyczne z zalecanymi przez Ośrodki Kontroli i Zapobiegania Chorobom (CDC) do pierwszej izolacji z próbek zawierających prątki. 10 Zalecane jest użycie wodorotlenku N-acetylo-L-cysteino sodowego (NALC-NaOH) w charakterze delikatnego, lecz skutecznego środka roztwarzającego i odkażającego. Odczynniki te zawarte są w zestawie BBL MycoPrep Mycobacterial Specimen Digestion/Decontamination Kit. Szczegółowe instrukcje odkażania i prowadzenia hodowli można znaleźć w odpowiednim 10, piśmiennictwie. Po zaszczepieniu pojemniki testowe należy przechowywać w miejscu osłoniętym przed światłem, w odpowiednim systemie zapewniającym atmosferę tlenową o podwyższonej zawartości dwutlenku węgla. Probówki z posiewem na podłożach skośnych i butelki inkubować w temperaturze 35 ± 2 C. Podłoża w probówkach i butelkach należy inkubować w płaszczyźnie poziomej, aż do wchłonięcia inokulum. Przez pierwsze 3 tygodnie zakrętki probówek i butelek powinny być poluzowane, co umożliwi obieg dwutlenku węgla i zainicjowanie wzrostu. Później probówki należy zakręcić, aby zapobiec odwodnieniu; raz w tygodniu na krótko rozszczelniać. Jeśli ilość dostępnego miejsca jest ograniczona, probówki można postawić pionowo. UWAGA: Hodowle ze zmian skórnych, co do których podejrzewa się, że zawierają bakterie M. marinum lub M. ulcerans, należy w celu pierwszej izolacji inkubować w temperaturze C; hodowle, w których podejrzewa się obecność bakterii M. avium lub M. xenopi, wzrastają optymalnie w temperaturze C. 10 Duplikat hodowli inkubować w temperaturze C. Poniżej przedstawiono zalecaną procedurę półilościowego badania katalazy przy użyciu probówek z podłożem Lowenstein-Jensen Medium: Na powierzchni podłoża wykonać posiew 0,1 ml 7-dniowej hodowli na bulionie lub jednej ezy kolonii aktywnie wzrastającej na podłożu skośnym w probówce. Wykonać w ten sposób posiew każdego ze szczepów kontrolnych. Dodatkowo wykonać w probówkach posiew kontrolnych hodowli intensywnie wytwarzającej katalazę, np. M. kansasii, oraz szczepu mało intensywnie wytwarzających enzym, np. M. intracellulare. 2. Przez 2 tygodnie inkubować z poluzowaną zatyczką w temperaturze 35 ± 2 C. 3. Przygotować mieszankę Polysorbate 80 z nadtlenkiem wodoru, mieszając w równych proporcjach: a. wysterylizowany w autoklawie 10% roztwór Polysorbate 80 w wodzie destylowanej lub 1 ml sterylnego Polysorbate 80 rozcieńczony w 9 ml wody destylowanej; b. nadtlenek wodoru (30%). 4. Do każdej hodowli dodać 1 ml mieszanki Polysorbate 80 z nadtlenkiem. Po 5 min zanotować wysokość (w mm) kolumny pęcherzyków. Poniżej przedstawiono zalecaną procedurę badania tolerancji na chlorek sodu: 10,17 1. Sporządzić zawiesinę hodowli pochodnej aktywnie wzrastającej w pożywce Middlebrook 7H9 Broth o zmętnieniu równym wzorcowi McFarland nr Wykonać posiew 0,1 ml znormalizowanej hodowli na skośne podłoże Lowenstein-Jensen Medium with 5% Sodium Chloride. W podobny sposób wykonać posiew na skośnym podłożu niezawierającym NaCl (probówka kontroli wzrostu). 3. Inkubować z poluzowanymi zatyczkami w atmosferze wzbogaconej CO 2, początkowo na statywie w pozycji poziomej, przez 1 tydzień, w temperaturze C w przypadku szczepów szybko wzrastających lub 35 ± 2 C w przypadku szczepów wolno wzrastających. 5
6 4. Co tydzień kontrolować wzrost. W razie potrzeby kontynuować inkubację przez następnie trzy tygodnie. Kontrola jakości przez użytkownika Zobacz Procedury kontroli jakości. Muszą być spełnione wymagania dotyczące kontroli jakości określone w odpowiednich przepisach lokalnych i/lub krajowych albo warunkach akredytacji; konieczne jest ponadto przestrzeganie standardowych wewnętrznych procedur kontroli jakości danego laboratorium. Zaleca się skorzystanie z odpowiednich wytycznych CLSI lub przepisów CLIA w celu ustalenia właściwych zasad kontroli jakości. X WYNIKI Hodowle należy obserwować przez 5 7 dni od posiewu, a potem raz w tygodniu, maksymalnie przez 8 tygodni. Zanotować spostrzeżenia: 1. Liczbę dni, po jakiej kolonie stały się widoczne makroskopowo. Szczepy szybko wzrastające tworzą dojrzałe kolonie przed upływem 7 dni; dojrzałe kolonie szczepów wolno wzrastających powstają po więcej niż 7 dniach. 2. Odbarwienie Białe, śmietankowe lub błyszczące niechromogenne (NC) Cytrynowe, żółte, pomarańczowe, czerwone chromogenne (Ch) Na wybarwionych wymazach mogą pojawiać się laseczki kwasooporne. Do czasu przeprowadzenia ostatecznych testów należy je w dokumentacji identyfikować wyłącznie jako laseczki kwasooporne. Butelki można zbadać, odwracając je na stoliku przedmiotowym mikroskopu operacyjnego. Zbadać przy powiększeniu 10-60x, przepuszczając światło. Szybko przeskanować przy powiększeniu 10-20x w celu stwierdzenia obecności kolonii. Większe powiększenia (30-60x) są przydatne do obserwacji morfologii kolonii (kolonie nitkowate, przypominające serpentyny). Na podstawie wyników półilościowego badania katalazy większość prątków można zaliczyć do dwóch grup. 8,10,16 1. Kolumna pęcherzyków wyższa niż 45 mm. M. chelonae M. fortuitum M. gordonae M. kansasii (istotne klinicznie) M. scrofulaceum 2. Kolumna pęcherzyków niższa niż 45 mm. M. avium M. bovis M. gastri M. haemophilum M. intracellulare M. kansasii (nieistotne klinicznie) M. malmoense M. marinum M. tuberculosis M. xenopi Obecność lub brak wzrostu w probówce z podłożem zawierającym 5% NaCl pomaga w zróżnicowaniu wyizolowanych szczepów prątków. Wynik testu tolerancji na sól jest dodatni, gdy na podłożu kontrolnym pojawiają się liczne kolonie, a na podłożu zawierającym 5% NaCl wzrasta więcej niż 50 kolonii. 10,17 Pojawienie się kolonii na podłożu kontrolnym, którym jednak nie towarzyszy wzrost na podłożu testowym po 4 tygodniach inkubacji, stanowią podstawę do uznania wyniku za ujemny. 10,16,17 XI OGRANICZENIA PROCEDURY Do identyfikacji niezbędne są czyste kultury drobnoustrojów. W celu ostatecznej identyfikacji należy przeprowadzić badania morfologiczne, biochemiczne i/lub serologiczne. Szczegółowe informacje i opisy zalecanych procedur można znaleźć w stosownej literaturze. 15,16,19 6
7 XII CHARAKTERYSTYKA WYNIKÓW Lowenstein-Jensen Medium W badaniu przeprowadzonym przez Palaciego i in. wykonano posiew 85 próbek pochodzących z dróg oddechowych na skośnym podłożu Lowenstein-Jensen (LJ) i w próbówkach BBL MGIT, stosując standardowe procedury. Dwadzieścia pięć (25) próbek dało wynik dodatni w teście na obecność M. tuberculosis. Czułość hodowli na podłożach LJ i MGIT była taka sama i wynosiła 96,1% (25 z 26 hodowli dodatnich). Mimo że czas, po którym możliwe było wykrycie prątków, był wyraźnie krótszy w przypadku probówek MGIT, między obydwiema metodami nie wystąpiła wyraźna różnica w czułości wykrywania M. tuberculosis. 20 Lowenstein-Jensen Medium Deeps Wszystkie partie podłoża Lowenstein-Jensen Medium Deeps są fabrycznie testowane pod kątem określonych właściwości. Próbki testowane są przy użyciu szczepów M. fortuitum ATCC 6841, M. intracellulare ATCC 13950, M. kansasii ATCC 12478, M. scrofulaceum ATCC i M. tuberculosis ATCC poprzez wykonanie posiewów 0,2 ml zawiesin Middlebrook 7H9 Broth. Probówki są inkubowane z poluzowanymi zatyczkami przez 3 tygodnie w temperaturze C. Przygotowywana jest mieszanina Polysorbate 80 z nadtlenkiem wodoru. Do każdej hodowli dodawany jest 1 ml takiej mieszaniny. Po 5 min zapisywana jest wysokość (w mm) kolumny pęcherzyków. Za dodatni wynik testu na reakcję wytwarzania katalazy uznaje się kolumnę pęcherzyków o wysokości przekraczającej 45 mm. Za wynik ujemny uznawana jest kolumna pęcherzyków niższa niż 45 mm. Dodatni wynik testu na reakcję wytwarzania katalazy jest charakterystyczny dla M. fortuitum, M. kansasii i M. scrofulaceum. Ujemny wynik testu jest charakterystyczny dla M. intracellulare and M. tuberculosis. Lowenstein-Jensen Medium with 5% Sodium Chloride Wszystkie partie podłoża Lowenstein-Jensen Medium with 5% Sodium Chloride są fabrycznie testowane pod kątem określonych właściwości. Próbki są testowane przy użyciu zawiesin komórek szczepów M. fortuitum ATCC 6841 i M. kansasii ATCC rozcieńczonych do CFU w pożywce BBL Middlebrook 7H9 Broth. Probówki inkubowane są przez 7 14 dni z poluzowanymi zatyczkami w temperaturze C, w atmosferze wzbogaconej CO 2. W przypadku M. fortuitum obserwowany jest umiarkowany lub intensywny wzrost. Wzrost M. kansasii jest hamowany. XIII DOSTĘPNOŚĆ Nr kat. Opis BBL Lowenstein-Jensen Medium Mycoflask, opakowanie 10 butelek BBL Lowenstein-Jensen Medium Mycoflask, pudełko 100 butelek BBL Lowenstein-Jensen Medium Slants, opakowanie 10 probówek o rozmiarze A BBL Lowenstein-Jensen Medium Slants, pudełko 100 probówek o rozmiarze A BBL Lowenstein-Jensen Medium Slants, opakowanie 10 probówek o rozmiarze C BBL Lowenstein-Jensen Medium Slants, pudełko 100 probówek o rozmiarze C BBL Lowenstein-Jensen Medium Deeps, opakowanie 10 probówek o rozmiarze A BBL Lowenstein-Jensen Medium, butelka o poj. 1 uncji (29,6 ml), pudełko 100 butelek BBL Lowenstein-Jensen Medium with 5% Sodium Chloride Slants, opakowanie 10 probówek o rozmiarze C XIV REFERENCES NK içïéåëíéáåibknvpnkaáéw~åüíìåöçéêqìäéêâéää~òáääéå~ìëçéãëíê~ãéåçéå_äìíékwéåíê~äääk_~âíéêáçäk m~ê~ëáíéåâçkfåñéâíáçåëâêkeóök^äíkflêáöknomwnotk OK içïéåëíéáåibknvppkaéêâìäíìêéääék~åüéïéáëîçåqìäéêâéää~âíéêáéåáåjáäåü~ìñj~ä~åüáíöêìåbáå~üêäççéåk ^ååkfåëíkm~ëíéìêkrmwnsnk PK pçååéåëåüéáåknvpmkaíëåükíáéê~êíòéktéüåëåüêkpuwnnrk QK eçüåigknvpnkaéêwjbáå~üêäççéåòìêhìäíìêçéëqìäéêâéäjä~òáäìëkwéåíê~äääk_~âíéêáçäkm~ê~ëáíéåâçkfåñéâíáçåëâêk eóök^äíkfklêáöknonwquujrmsk RK `çêééêiekgknvnvkqüéåìäíáî~íáçåçñêéåéåíäóáëçä~íéç~åçä~äçê~íçêóëíê~áåëçñüìã~åíìäéêåäéä~åáääáçå~êíáñáåá~ä ãéçá~k^ãkoéîkqìäéêåkpwqsnjqtok SK méíêçññipk^knvnukgkfåñkaáëkopwostk TK géåëéåihk^knvpokoáåòìåüíìåöìåçqóééåäéëíáããìåöîçåqìäéêâéää~òáääéåí~ããéåkwéåíê~äääk_~âíéêáçäk m~ê~ëáíéåâçkfåñéâíáçåëâêkeóök^äíkflêáöknorwooojopvk UK t~óåéiikdknvsokqïçî~êáéíáéëçñjóåçä~åíéêáìãâ~å~ëááïáíüçáññéêéåíåäáåáå~äëáöåáñáå~ååék^ãkoéîkoéëékaáëk USWSRNJSRSK VK páäåçñisk^kiok`kdçççi~åçjkjkcäçóçknvunkfçéåíáñáå~íáçåçñåäáåáå~äëáöåáñáå~åíjóåçä~åíéêáìãñçêíìáíìã ÅçãéäÉñáëçä~íÉëKgK`äáåKjáÅêçÄáçäKNQWSUSJSVNK 7
8 NMK héåíimkqki~åçdkmkhìäáå~knvurkmìääáåüé~äíüãóåçä~åíéêáçäçöów~öìáçéñçêíüéäéîéäfffä~äçê~íçêókrpaeepk `ÉåíÉêëÑçêaáëÉ~ëÉ`çåíêçäI^íä~åí~K NNKk~íáçå~ä`çããáííÉÉÑçê`äáåáÅ~äi~Äçê~íçêópí~åÇ~êÇëKOMMNK^ééêçîÉÇdìáÇÉäáåÉjOVJ^OKmêçíÉÅíáçåçÑä~Äçê~íçêó ïçêâéêëñêçãçååìé~íáçå~ääó~åèìáêéçáåñéåíáçåëioåçéçkk``ipit~óåéim~k NOKd~êåÉêIgKpKNVVSKeçëéáí~äfåÑÉÅíáçå`çåíêçämê~ÅíáÅÉë^Çîáëçêó`çããáííÉÉIrKpKaÉé~êíãÉåíçÑeÉ~äíÜ~åÇeìã~å péêîáåéëi`éåíéêëñçêaáëé~ëé`çåíêçä~åçmêéîéåíáçåkdìáçéäáåéñçêáëçä~íáçåéêéå~ìíáçåëáåüçëéáí~äëkfåñéåík `çåíêçäeçëéáí~äbéáçéãáçäkntwrpjumk NPKrKpKaÉé~êíãÉåíçÑeÉ~äíÜ~åÇeìã~åpÉêîáÅÉëKNVVVK_áçë~ÑÉíóáåãáÅêçÄáçäçÖáÅ~ä~åÇÄáçãÉÇáÅ~ää~Äçê~íçêáÉëI eepmìääáå~íáçåe`a`fiqíüéçkrkpkdçîéêåãéåímêáåíáåölññáåéit~ëüáåöíçåiak`k NQKaáêÉÅíáîÉOMMMLRQLb`çÑíÜÉbìêçéÉ~åm~êäá~ãÉåí~åÇçÑíÜÉ`çìåÅáäçÑNUpÉéíÉãÄÉêOMMMçåíÜÉéêçíÉÅíáçåçÑ ïçêâéêëñêçãêáëâëêéä~íéçíçéñéçëìêéíçäáçäçöáå~ä~öéåíë~íïçêâeëéîéåíüáåçáîáçì~äçáêéåíáîéïáíüáåíüé ãé~åáåöçñ^êíáåäénsenfçñaáêéåíáîéuvlpvnlbb`fklññáåá~ägçìêå~äiosointlnmlommmiékmmonjmmqrk NRK jìêê~óimkokibkgk_~êçåigkekgçêöéåëéåijk^kmñ~ääéê~åçokekvçäâéåeéçkfkommpkj~åì~äçñåäáåáå~äãáåêçäáçäçöói UíÜÉÇK^ãÉêáÅ~åpçÅáÉíóÑçêjáÅêçÄáçäçÖóIt~ëÜáåÖíçåIaK`K NSK cçêäéëi_k^kiakckp~üãi~åç^kpktéáëëñéäçkommok_~áäéócpåçíídëçá~öåçëíáåãáåêçäáçäçöóinníüéçkjçëäóifååkipík içìáëk NTK fëéåäéêöiekeéçkfkommqk`äáåáå~äãáåêçäáçäçöóéêçåéçìêéëü~åçäççâiîçäknio~åçpioåçéçk^ãéêáå~åpçåáéíóñçê jáåêçäáçäçöóit~ëüáåöíçåiak`k NUK `~êåçåüimkikiokhkbååëijk^kpçìäçääéi~åçokgkt~ää~åéigêknvvqk`ìãáíéåüns^ii~äçê~íçêóçá~öåçëáëçñíüé ãóåçä~åíéêáçëéëk`ççêçáå~íáåöéçki^kpktéáëëñéäçk^ãéêáå~åpçåáéíóñçêjáåêçäáçäçöóit~ëüáåöíçåiak`k NVK eçäíigkdkikkokhêáéöimkek^kpåé~íüigkqkpí~äéói~åçpkqktáääá~ãëeéçkfknvvqk_éêöéódëj~åì~ä»çñçéíéêãáå~íáîé Ä~ÅíÉêáçäçÖóIVíÜÉÇKtáääá~ãëCtáäâáåëI_~äíáãçêÉK OMK m~ä~åáijkipkvkjkiréâáiakkkp~íçijk^ka~páäî~qéääáëijk`ìêåáçi~åçbk^kjkpáäî~knvvskbî~äì~íáçåçñ jóåçä~åíéêá~dêçïíüfåçáå~íçêqìäéçñêéåçîéêó~åççêìöëìëåééíáäáäáíóíéëíáåöçñjóåçä~åíéêáìãíìäéêåìäçëáë áëçä~íéëñêçãêéëéáê~íçêóëééåáãéåëkgk`äáåkjáåêçäáçäkpqwtsojtsqk _ÉÅíçåIaáÅâáåëçå~åÇ`çãé~åó _bkbuiáãáíéç TiçîÉíçå`áêÅäÉ _~óhn~lçipü~ååçåfåçìëíêá~äbëí~íé pé~êâëij~êóä~åçonnrorp^ pü~ååçåi`çìåíó`ä~êéifêéä~åç UMMJSPUJUSSP qéäwprpjsnjqtjovjom c~ñwprpjsnjqtjorjqs ^q``áë~íê~çéã~êâçñíüé^ãéêáå~åqóéé`ìäíìêé`çääéåíáçåk _ai_aiçöçi iijdfqijóåçñä~ëâ~åçjóåçmêéé~êéíê~çéã~êâëçñ_éåíçåiaáåâáåëçå~åç`çãé~åók«ommt_a 8
== i=jáççäéäêççâ=tev=_êçíü=ïáíü=däóåéêçä==
 == i=jáççäéäêççâ=tev=_êçíü=ïáíü=däóåéêçä== Wersja 9 Grudzień 2006 PROCEDURY KONTROLI JAKOŚCI I II WPROWADZENIE Bulion z glicerolem Middlebrook 7H9 Broth with Glycerol jest nieselektywną pożywką do hodowli
== i=jáççäéäêççâ=tev=_êçíü=ïáíü=däóåéêçä== Wersja 9 Grudzień 2006 PROCEDURY KONTROLI JAKOŚCI I II WPROWADZENIE Bulion z glicerolem Middlebrook 7H9 Broth with Glycerol jest nieselektywną pożywką do hodowli
BBL Middlebrook 7H9 Broth with Glycerol
 BBL Middlebrook 7H9 Broth with Glycerol Wersja 12 październik 2015 PROCEDURY KONTROLI JAKOŚCI (Opcjonalnie) I II WPROWADZENIE Bulion z glicerolem Middlebrook 7H9 Broth with Glycerol jest nieselektywną
BBL Middlebrook 7H9 Broth with Glycerol Wersja 12 październik 2015 PROCEDURY KONTROLI JAKOŚCI (Opcjonalnie) I II WPROWADZENIE Bulion z glicerolem Middlebrook 7H9 Broth with Glycerol jest nieselektywną
BBL Lowenstein-Jensen Medium BBL Lowenstein-Jensen Medium with 5% Sodium Chloride
 I II BBL Lowenstein-Jensen Medium BBL Lowenstein-Jensen Medium with 5% Sodium Chloride wersja 11 Październik 2015 PROCEDURY KONTROLI JAKOŚCI (Opcjonalnie) WPROWADZENIE Podłoże Lowenstein-Jensen Medium
I II BBL Lowenstein-Jensen Medium BBL Lowenstein-Jensen Medium with 5% Sodium Chloride wersja 11 Październik 2015 PROCEDURY KONTROLI JAKOŚCI (Opcjonalnie) WPROWADZENIE Podłoże Lowenstein-Jensen Medium
BBL Lowenstein-Jensen Medium + PACT
 BBL Lowenstein-Jensen Medium + PACT Zob. słownik symboli na końcu ulotki. PRZEZNACZENIE Podłoże BBL Lowenstein-Jensen Medium + PACT służy do hodowli Mycobacterium tuberculosis oraz innych gatunków prątków.
BBL Lowenstein-Jensen Medium + PACT Zob. słownik symboli na końcu ulotki. PRZEZNACZENIE Podłoże BBL Lowenstein-Jensen Medium + PACT służy do hodowli Mycobacterium tuberculosis oraz innych gatunków prątków.
BBL STONEBRINK TB MEDIUM + PACT
 BBL STONEBRINK TB MEDIUM + PACT Zobacz objaśnienie symboli na końcu ulotki. UMNNSSV OMMPLMT Polski PRZEZNACZENIE Pożywka BBL Stonebrink TB Medium + PACT jest przeznaczona do prowadzenia hodowli Mycobacterium
BBL STONEBRINK TB MEDIUM + PACT Zobacz objaśnienie symboli na końcu ulotki. UMNNSSV OMMPLMT Polski PRZEZNACZENIE Pożywka BBL Stonebrink TB Medium + PACT jest przeznaczona do prowadzenia hodowli Mycobacterium
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli
 E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
E.coli Transformer Zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli Wersja 0211 6x40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników do przygotowania sześciu
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna.
 Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
Saccharomyces Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Saccharomyces cerevisiae. Metoda chemiczna. wersja 0916 6 x 20 transformacji Nr kat. 4010-120 Zestaw zawiera
E.coli Transformer Kit
 E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
E.coli Transformer Kit zestaw do przygotowywania i transformacji komórek kompetentnych Escherichia coli. Metoda chemiczna. wersja 1117 6 x 40 transformacji Nr kat. 4020-240 Zestaw zawiera komplet odczynników
ALGALTOXKIT F Procedura testu
 ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
X. Diagnostyka mikrobiologiczna bakterii chorobotwórczych z rodzaju: Corynebacterium, Mycobacterium, Borrelia, Treponema, Neisseria
 X. Diagnostyka mikrobiologiczna bakterii chorobotwórczych z rodzaju: Corynebacterium, Mycobacterium, Borrelia, Treponema, Neisseria Maczugowce (rodzaj Corynebacterium) Ćwiczenie 1. Wykonanie preparatu
X. Diagnostyka mikrobiologiczna bakterii chorobotwórczych z rodzaju: Corynebacterium, Mycobacterium, Borrelia, Treponema, Neisseria Maczugowce (rodzaj Corynebacterium) Ćwiczenie 1. Wykonanie preparatu
Kontrola pożywek mikrobiologicznych. Sekcja Badań Epidemiologicznych
 Kontrola pożywek mikrobiologicznych Sekcja Badań Epidemiologicznych 27.04.2015 Zgodnie z ISO 17025 oraz ISO 15189 jednym z czynników istotnie wpływających na jakość wyników badań w przypadku badań mikrobiologicznych,
Kontrola pożywek mikrobiologicznych Sekcja Badań Epidemiologicznych 27.04.2015 Zgodnie z ISO 17025 oraz ISO 15189 jednym z czynników istotnie wpływających na jakość wyników badań w przypadku badań mikrobiologicznych,
woda do 1000 ml ph=6,9-7,1. Po sterylizacji dodać nystatynę (końcowe stężenie ok. 50 μg/ml). Agar z wyciągiem glebowym i ekstraktem drożdżowym (YS)
 Ćwiczenie 1, 2, 3, 4 Skrining ze środowiska naturalnego: selekcja promieniowców zdolnych do produkcji antybiotyków. Testowanie zdolności do syntezy antybiotyków przez wyselekcjonowane szczepy promieniowców
Ćwiczenie 1, 2, 3, 4 Skrining ze środowiska naturalnego: selekcja promieniowców zdolnych do produkcji antybiotyków. Testowanie zdolności do syntezy antybiotyków przez wyselekcjonowane szczepy promieniowców
Ćwiczenie 4-5 Mikrobiologiczne kryteria oceny sanitarnej wody
 ĆWICZENIA Z GOSPODARKI ENERGETYCZNEJ, WODNEJ I ŚCIEKOWEJ CZĘŚĆ MIKROBIOLOGICZNA Ćwiczenie 4-5 Mikrobiologiczne kryteria oceny sanitarnej wody Część teoretyczna: 1. Kryteria jakości sanitarnej wody przeznaczonej
ĆWICZENIA Z GOSPODARKI ENERGETYCZNEJ, WODNEJ I ŚCIEKOWEJ CZĘŚĆ MIKROBIOLOGICZNA Ćwiczenie 4-5 Mikrobiologiczne kryteria oceny sanitarnej wody Część teoretyczna: 1. Kryteria jakości sanitarnej wody przeznaczonej
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN
 ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
ĆWICZENIE I - BIAŁKA. Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi.
 ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
B BACTEC MGIT 960 SIRE Kits
 B BACTEC MGIT 960 SIRE Kits do badania wrażliwości Mycobacterium tuberculosis na działanie czynników przeciwbakteryjnych 8008200(04) 2016-10 Polski PRZEZNACZENIE Zestaw BD BACTEC MGIT 960 SIRE jest to
B BACTEC MGIT 960 SIRE Kits do badania wrażliwości Mycobacterium tuberculosis na działanie czynników przeciwbakteryjnych 8008200(04) 2016-10 Polski PRZEZNACZENIE Zestaw BD BACTEC MGIT 960 SIRE jest to
Ocena skuteczności procesów sterylizacji za pomocą wskaźników biologicznych r.
 Ocena skuteczności procesów sterylizacji za pomocą wskaźników biologicznych 27.04.2015 r. Wstęp Sterylizacja to proces, w wyniku którego zostają zniszczone lub usunięte wszystkie drobnoustroje, zarówno
Ocena skuteczności procesów sterylizacji za pomocą wskaźników biologicznych 27.04.2015 r. Wstęp Sterylizacja to proces, w wyniku którego zostają zniszczone lub usunięte wszystkie drobnoustroje, zarówno
QMS Quality in Microbiology Scheme Wydanie 14 Data wydania: czerwiec 2018
 Przyjęcie i przechowywanie Po otrzymaniu materiału do badań należy zapisać datę otrzymania, a następnie przechowywać w lodówce w temperaturze 2-8 º C do momentu przeprowadzenia badania. Materiał do badań
Przyjęcie i przechowywanie Po otrzymaniu materiału do badań należy zapisać datę otrzymania, a następnie przechowywać w lodówce w temperaturze 2-8 º C do momentu przeprowadzenia badania. Materiał do badań
II. OZNACZANIE LICZBY BAKTERII Z GRUPY COLI I BAKTERII Z GRUPY COLI TYP FEKALNY METODĄ PŁYTKOWĄ W ŻYWNOŚCI I INNYCH PRODUKTACH wg PN-ISO 4832: 2007
 Katedra i Zakład Mikrobiologii i Wirusologii Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Mikrobiologia ogólna Biotechnologia medyczna II rok / I o Temat: Żywność jako środowisko życia mikroorganizmów.
Katedra i Zakład Mikrobiologii i Wirusologii Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Mikrobiologia ogólna Biotechnologia medyczna II rok / I o Temat: Żywność jako środowisko życia mikroorganizmów.
Załącznik nr 4 Metodyka pobrania materiału przedstawiona jest w osobnym Instrukcja PZH
 Załącznik nr 4 Metodyka pobrania materiału przedstawiona jest w osobnym Instrukcja PZH 1. Rodzaj materiału klinicznego w zależności od kierunku i metodyki badań wykonywanych przez PZH Poz. Badanie Rodzaj
Załącznik nr 4 Metodyka pobrania materiału przedstawiona jest w osobnym Instrukcja PZH 1. Rodzaj materiału klinicznego w zależności od kierunku i metodyki badań wykonywanych przez PZH Poz. Badanie Rodzaj
XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych. a. Candida albicans preparat z hodowli barwiony metoda Grama
 XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych a. Candida albicans preparat z hodowli barwiony metoda Grama Opis preparatu: b. Saccharomyces cerevisiae preparat z hodowli
XXV. Grzyby cz I. Ćwiczenie 1. Wykonanie i obserwacja preparatów mikroskopowych a. Candida albicans preparat z hodowli barwiony metoda Grama Opis preparatu: b. Saccharomyces cerevisiae preparat z hodowli
OSTRACODTOXKIT F Procedura testu
 OSTRACODTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI SKONCENTROWANYCH SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 PRZELAĆ ZAWARTOŚĆ 5 FIOLEK
OSTRACODTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI SKONCENTROWANYCH SOLI - DESTYLOWANA (lub dejonizowana) WODA 2 PRZELAĆ ZAWARTOŚĆ 5 FIOLEK
1276:1997 13368 (ATCC
 Działanie bakteriobójcze Środka biobójczego Clinell GAMA Healthcare Ltd. zbadane za pomocą Europejskiego Standardowego Testu według normy BS EN 1276:1997 wobec: Klebsiella pneumoniae NCTC 13368 (ATCC 700603).
Działanie bakteriobójcze Środka biobójczego Clinell GAMA Healthcare Ltd. zbadane za pomocą Europejskiego Standardowego Testu według normy BS EN 1276:1997 wobec: Klebsiella pneumoniae NCTC 13368 (ATCC 700603).
liczba godzin 2 MIKROBIOLOGIA KOSMETOLOGICZNA dla studentów II roku, studiów I st. kierunku KOSMETOLOGIA półpłynne stałe
 MIKROBIOLOGIA KOSMETOLOGICZNA dla studentów II roku, studiów I st. kierunku KOSMETOLOGIA Ćwiczenie 6 i 7 6 Fizjologia drobnoustrojów Wymagania metaboliczne bakterii. Rodzaje podłóż mikrobiologicznych.
MIKROBIOLOGIA KOSMETOLOGICZNA dla studentów II roku, studiów I st. kierunku KOSMETOLOGIA Ćwiczenie 6 i 7 6 Fizjologia drobnoustrojów Wymagania metaboliczne bakterii. Rodzaje podłóż mikrobiologicznych.
Genomic Maxi AX Direct
 Genomic Maxi AX Direct Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura bez etapu precypitacji. wersja 0517 10 izolacji Nr kat. 995-10D Pojemność kolumny
Genomic Maxi AX Direct Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura bez etapu precypitacji. wersja 0517 10 izolacji Nr kat. 995-10D Pojemność kolumny
RAPORT Z BADAŃ 164/Z/20110825/D/JOGA. Dostarczony materiał: próbki tworzyw sztucznych. Ilość próbek: 1. Rodzaj próbek: tworzywo
 Blirt S.A. 80-172 Gdańsk, ul. Trzy Lipy 3/1.38 RAPORT Z BADAŃ Dział DNA-Gdańsk Nr zlecenia 164/Z/20110825/D/JOGA NAZWA I ADRES KLIENTA GROUND-Therm spółka z o.o. ul. Stepowa 30 44-105 Gliwice Tytuł zlecenia:
Blirt S.A. 80-172 Gdańsk, ul. Trzy Lipy 3/1.38 RAPORT Z BADAŃ Dział DNA-Gdańsk Nr zlecenia 164/Z/20110825/D/JOGA NAZWA I ADRES KLIENTA GROUND-Therm spółka z o.o. ul. Stepowa 30 44-105 Gliwice Tytuł zlecenia:
Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Mikrobiologia na kierunku chemia kosmetyczna
 1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Mikrobiologia na kierunku chemia kosmetyczna 2 Zakład Mikrobiologii UJK Zakres materiału (zagadnienia)
1 Zakład Mikrobiologii UJK Instrukcje do ćwiczeń oraz zakres materiału realizowanego na wykładach z przedmiotu Mikrobiologia na kierunku chemia kosmetyczna 2 Zakład Mikrobiologii UJK Zakres materiału (zagadnienia)
Interpretacja wyników analiz ilości i obecności drobnoustrojów zgodnie z zasadami badań mikrobiologicznych żywności i pasz?
 Wydział Biotechnologii i Nauk o Żywności Seminarium STC 2018 Interpretacja wyników analiz ilości i obecności drobnoustrojów zgodnie z zasadami badań mikrobiologicznych żywności i pasz? Dr inż. Agnieszka
Wydział Biotechnologii i Nauk o Żywności Seminarium STC 2018 Interpretacja wyników analiz ilości i obecności drobnoustrojów zgodnie z zasadami badań mikrobiologicznych żywności i pasz? Dr inż. Agnieszka
IV. Streptococcus, Enterococcus ćwiczenia praktyczne
 IV. Streptococcus, Enterococcus ćwiczenia praktyczne Ćwiczenie 1. Ocena wzrostu szczepów paciorkowców na: a. agarze z dodatkiem 5% odwłóknionej krwi baraniej (AK) typ hemolizy morfologia kolonii... gatunek
IV. Streptococcus, Enterococcus ćwiczenia praktyczne Ćwiczenie 1. Ocena wzrostu szczepów paciorkowców na: a. agarze z dodatkiem 5% odwłóknionej krwi baraniej (AK) typ hemolizy morfologia kolonii... gatunek
VII. Pałeczki Gram-dodatnie: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus - ćwiczenia praktyczne
 VII. Pałeczki Gram-dodatnie: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus - ćwiczenia praktyczne Ćwiczenie 1. Wykonanie barwionych preparatów mikroskopowych preparat barwiony metodą Grama z
VII. Pałeczki Gram-dodatnie: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus - ćwiczenia praktyczne Ćwiczenie 1. Wykonanie barwionych preparatów mikroskopowych preparat barwiony metodą Grama z
INSTRUKCJA OBSŁUGI. Drobnoustroje Epower PRZEZNACZENIE POSTAĆ I SKŁADNIKI SPECYFIKACJA I DZIAŁANIE
 INSTRUKCJA OBSŁUGI Drobnoustroje Epower PRZEZNACZENIE Drobnoustroje Epower to liofilizowane, ilościowe preparaty drobnoustrojów do stosowania w laboratoriach przemysłowych dla celów kontroli jakości. Certyfikowany
INSTRUKCJA OBSŁUGI Drobnoustroje Epower PRZEZNACZENIE Drobnoustroje Epower to liofilizowane, ilościowe preparaty drobnoustrojów do stosowania w laboratoriach przemysłowych dla celów kontroli jakości. Certyfikowany
INSTRUKCJA UŻYTKOWANIA
 INSTRUKCJA UŻYTKOWANIA Certyfikowany materiał referencyjny Epower PRZEZNACZENIE Certyfikowany materiał referencyjny Epower zawiera liofilizowane, standaryzowane ilościowo preparaty mikroorganizmów, które
INSTRUKCJA UŻYTKOWANIA Certyfikowany materiał referencyjny Epower PRZEZNACZENIE Certyfikowany materiał referencyjny Epower zawiera liofilizowane, standaryzowane ilościowo preparaty mikroorganizmów, które
ZAŁĄCZNIK NR 1. Cena jedn. brutto. netto
 PAKIET NR 1 Odczynniki hematologiczne do aparatu ABX MICROS 60 Lp. Nazwa/postać/stężenie Opakowanie Ilość do 1. Roztwór roboczy ( diluent) /8-866/ 1 opakowanie 7 = 20 l. 2. Roztwór roboczy ( diluent) /8-866/
PAKIET NR 1 Odczynniki hematologiczne do aparatu ABX MICROS 60 Lp. Nazwa/postać/stężenie Opakowanie Ilość do 1. Roztwór roboczy ( diluent) /8-866/ 1 opakowanie 7 = 20 l. 2. Roztwór roboczy ( diluent) /8-866/
INSTRUKCJA OBSŁUGI. Certyfikowany materiał referencyjny Epower PRZEZNACZENIE PODSUMOWANIE I HISTORIA POSTAĆ I SKŁADNIKI
 INSTRUKCJA OBSŁUGI Certyfikowany materiał referencyjny Epower PRZEZNACZENIE Certyfikowany materiał referencyjny (CRM) Epower to liofilizowane, ilościowe preparaty drobnoustrojów do stosowania w laboratoriach
INSTRUKCJA OBSŁUGI Certyfikowany materiał referencyjny Epower PRZEZNACZENIE Certyfikowany materiał referencyjny (CRM) Epower to liofilizowane, ilościowe preparaty drobnoustrojów do stosowania w laboratoriach
ĆWICZENIE 1. Aminokwasy
 ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
XIII. Staphylococcus, Micrococcus ćwiczenia praktyczne
 XIII. Staphylococcus, Micrococcus ćwiczenia praktyczne Ćwiczenie 1. Ocena wzrostu szczepów gronkowców na: a. agarze z dodatkiem 5% odwłóknionej krwi baraniej (AK) typ hemolizy morfologia kolonii.. b. podłożu
XIII. Staphylococcus, Micrococcus ćwiczenia praktyczne Ćwiczenie 1. Ocena wzrostu szczepów gronkowców na: a. agarze z dodatkiem 5% odwłóknionej krwi baraniej (AK) typ hemolizy morfologia kolonii.. b. podłożu
Załącznik A do siwz. OPIS PRZEDMIOTU ZAMÓWIENIA CZĘŚĆ I podłoża. Szczegółowy opis/zastosowanie
 OPIS PRZEDMIOTU ZAMÓWIENIA CZĘŚĆ I podłoża LP Nazwa Szczegółowy opis/zastosowanie Jednostka miary Ilość 5 1 Agar odżywczy C 2 3 Bulion z acetamidem Agar z mocznikiem wg Chrystiansena 4 Bulion LPB Eijkman
OPIS PRZEDMIOTU ZAMÓWIENIA CZĘŚĆ I podłoża LP Nazwa Szczegółowy opis/zastosowanie Jednostka miary Ilość 5 1 Agar odżywczy C 2 3 Bulion z acetamidem Agar z mocznikiem wg Chrystiansena 4 Bulion LPB Eijkman
Do jednego litra medium dodać 10,0 g skrobi ziemniaczanej lub kukurydzianej i mieszać do uzyskania zawiesiny. Sterylizować w autoklawie.
 Ćwiczenie 3. Izolacja laseczek przetrwalnikujących z gleby Cel ćwiczenia: Izolacja i testowanie przydatności biotechnologicznej laseczek z rodzaju Bacillus występujących w glebie. Odczynniki i podłoża:
Ćwiczenie 3. Izolacja laseczek przetrwalnikujących z gleby Cel ćwiczenia: Izolacja i testowanie przydatności biotechnologicznej laseczek z rodzaju Bacillus występujących w glebie. Odczynniki i podłoża:
Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215
 Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215 20 izolacji Nr kat. 895-20D Pojemność kolumny do oczyszczania DNA wynosi 100 µg 1 Skład zestawu Składnik
Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215 20 izolacji Nr kat. 895-20D Pojemność kolumny do oczyszczania DNA wynosi 100 µg 1 Skład zestawu Składnik
Otrzymany w pkt. 8 osad, zawieszony w 2 ml wody destylowanej rozpipetować do 4 szklanych probówek po ok. 0.5 ml do każdej.
 Kwasy nukleinowe izolacja DNA, wykrywanie składników. Wymagane zagadnienia teoretyczne 1. Struktura, synteza i degradacja nukleotydów purynowych i pirymidynowych. 2. Regulacja syntezy nukleotydów. Podstawowe
Kwasy nukleinowe izolacja DNA, wykrywanie składników. Wymagane zagadnienia teoretyczne 1. Struktura, synteza i degradacja nukleotydów purynowych i pirymidynowych. 2. Regulacja syntezy nukleotydów. Podstawowe
data ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1
 Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1 Cel: Wyznaczanie klirensu endogennej kreatyniny. Miarą zdolności nerek do usuwania i wydalania
Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1 Cel: Wyznaczanie klirensu endogennej kreatyniny. Miarą zdolności nerek do usuwania i wydalania
Genomic Mini AX Plant Spin
 Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
HODOWLA PERIODYCZNA DROBNOUSTROJÓW
 Cel ćwiczenia: Celem ćwiczenia jest porównanie zdolności rozkładu fenolu lub wybranej jego pochodnej przez szczepy Stenotrophomonas maltophilia KB2 i Pseudomonas sp. CF600 w trakcie prowadzenia hodowli
Cel ćwiczenia: Celem ćwiczenia jest porównanie zdolności rozkładu fenolu lub wybranej jego pochodnej przez szczepy Stenotrophomonas maltophilia KB2 i Pseudomonas sp. CF600 w trakcie prowadzenia hodowli
Oznaczanie SO 2 w powietrzu atmosferycznym
 Ćwiczenie 6 Oznaczanie SO w powietrzu atmosferycznym Dwutlenek siarki bezwodnik kwasu siarkowego jest najbardziej rozpowszechnionym zanieczyszczeniem gazowym, występującym w powietrzu atmosferycznym. Głównym
Ćwiczenie 6 Oznaczanie SO w powietrzu atmosferycznym Dwutlenek siarki bezwodnik kwasu siarkowego jest najbardziej rozpowszechnionym zanieczyszczeniem gazowym, występującym w powietrzu atmosferycznym. Głównym
Formularz asortymentowo - cenowy. j.m. Ilość Wielkość opakowania
 ( Oznaczenie Wykonawcy) Część nr 1 odczynniki chemiczne l.p. Asortyment według specyfikacji Nazwa handlowa, producent Numer katalogowy Formularz asortymentowo - cenowy j.m. Ilość Wielkość opakowania Cena
( Oznaczenie Wykonawcy) Część nr 1 odczynniki chemiczne l.p. Asortyment według specyfikacji Nazwa handlowa, producent Numer katalogowy Formularz asortymentowo - cenowy j.m. Ilość Wielkość opakowania Cena
ROTA-ADENO Virus Combo Test Device
 Kod produktu: 8.04.73.0.0020 ROTA-ADENO Virus Combo Test Device Tylko do diagnostyki in vitro Przechowywać w 2-30 C ZASTOSOWANIE Wykrywanie antygenów Rotawirusów i Adenowirusów w próbkach kału. WSTĘP Rotawirusy
Kod produktu: 8.04.73.0.0020 ROTA-ADENO Virus Combo Test Device Tylko do diagnostyki in vitro Przechowywać w 2-30 C ZASTOSOWANIE Wykrywanie antygenów Rotawirusów i Adenowirusów w próbkach kału. WSTĘP Rotawirusy
Dyrektywa 98/79/WE. Polskie Normy zharmonizowane opublikowane do 31.12.2013 Wykaz norm z dyrektywy znajduje się również na www.pkn.
 Dyrektywa 98/79/WE Załącznik nr 23 Załącznik nr 23 Polskie Normy zharmonizowane opublikowane do 31.12.2013 Wykaz norm z dyrektywy znajduje się również na www.pkn.pl Według Dziennika Urzędowego UE (2013/C
Dyrektywa 98/79/WE Załącznik nr 23 Załącznik nr 23 Polskie Normy zharmonizowane opublikowane do 31.12.2013 Wykaz norm z dyrektywy znajduje się również na www.pkn.pl Według Dziennika Urzędowego UE (2013/C
Zapisz równanie zachodzącej reakcji. Wskaż pierwiastki, związki chemiczne, substraty i produkty reakcji.
 test nr 2 Termin zaliczenia zadań: IIIa - 29 października 2015 III b - 28 października 2015 zad.1 Reakcja rozkładu tlenku rtęci(ii) 1. Narysuj schemat doświadczenia, sporządź spis użytych odczynników,
test nr 2 Termin zaliczenia zadań: IIIa - 29 października 2015 III b - 28 października 2015 zad.1 Reakcja rozkładu tlenku rtęci(ii) 1. Narysuj schemat doświadczenia, sporządź spis użytych odczynników,
INSTRUKCJA UŻYTKOWANIA
 INSTRUKCJA UŻYTKOWANIA EZ-Hydro Shot Microorganisms PRZEZNACZENIE EZ-Hydro Shot są liofilizowanymi, preparatami ilościowymi mikroorganizmów w laboratoriach przemysłowych, służące do kontroli jakości. Te
INSTRUKCJA UŻYTKOWANIA EZ-Hydro Shot Microorganisms PRZEZNACZENIE EZ-Hydro Shot są liofilizowanymi, preparatami ilościowymi mikroorganizmów w laboratoriach przemysłowych, służące do kontroli jakości. Te
1. Rodzaj materiału klinicznego w zależności od kierunku i metodyki badań
 Zalecenia dotyczące pobierania, przechowywania i transportu materiałów klinicznych przeznaczonych do badań diagnostycznych w Pracowni Diagnostycznej Laboratorium Zakładu Badania Wirusów Grypy (obowiązuje
Zalecenia dotyczące pobierania, przechowywania i transportu materiałów klinicznych przeznaczonych do badań diagnostycznych w Pracowni Diagnostycznej Laboratorium Zakładu Badania Wirusów Grypy (obowiązuje
Genomic Mini AX Bacteria+ Spin
 Genomic Mini AX Bacteria+ Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z bakterii Gram-dodatnich. wersja 1017 100 izolacji Nr kat. 060-100MS Pojemność kolumny do oczyszczania DNA wynosi
Genomic Mini AX Bacteria+ Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z bakterii Gram-dodatnich. wersja 1017 100 izolacji Nr kat. 060-100MS Pojemność kolumny do oczyszczania DNA wynosi
KALKULACJA CENY OFERTY Część I - podłoża i dodatki do podłoży. Jednostka miary. op. = 500g 4. op. = 500g 4. op. = 500g 7
 AGZ.272.38.2012 Załącznik 5 do siwz KALKULACJA CENY OFERTY Część I - podłoża i dodatki do podłoży L.p. Przedmiot zamówienia Szczegółowy opis Jednostka miary Ilość Cena jednostkowa brutto [zł]** wartość
AGZ.272.38.2012 Załącznik 5 do siwz KALKULACJA CENY OFERTY Część I - podłoża i dodatki do podłoży L.p. Przedmiot zamówienia Szczegółowy opis Jednostka miary Ilość Cena jednostkowa brutto [zł]** wartość
III. Fizjologia bakterii i zasady diagnostyki bakteriologicznej
 III. Fizjologia bakterii i zasady diagnostyki bakteriologicznej Ćwiczenie 1. Rodzaje pożywek i ich zastosowanie a. Podłoże stałe - proste Agar zwykły (AZ) b. Podłoża wzbogacone Agar z dodatkiem 5% odwłóknionej
III. Fizjologia bakterii i zasady diagnostyki bakteriologicznej Ćwiczenie 1. Rodzaje pożywek i ich zastosowanie a. Podłoże stałe - proste Agar zwykły (AZ) b. Podłoża wzbogacone Agar z dodatkiem 5% odwłóknionej
HYDROLIZA SOLI. ROZTWORY BUFOROWE
 Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
ĆWICZENIE NR 3 BADANIE MIKROBIOLOGICZNEGO UTLENIENIA AMONIAKU DO AZOTYNÓW ZA POMOCĄ BAKTERII NITROSOMONAS sp.
 ĆWICZENIE NR 3 BADANIE MIKROBIOLOGICZNEGO UTLENIENIA AMONIAKU DO AZOTYNÓW ZA POMOCĄ BAKTERII NITROSOMONAS sp. Uwaga: Ze względu na laboratoryjny charakter zajęć oraz kontakt z materiałem biologicznym,
ĆWICZENIE NR 3 BADANIE MIKROBIOLOGICZNEGO UTLENIENIA AMONIAKU DO AZOTYNÓW ZA POMOCĄ BAKTERII NITROSOMONAS sp. Uwaga: Ze względu na laboratoryjny charakter zajęć oraz kontakt z materiałem biologicznym,
PL B1. UNIWERSYTET EKONOMICZNY W POZNANIU, Poznań, PL BUP 26/15. RENATA DOBRUCKA, Poznań, PL JOLANTA DŁUGASZEWSKA, Poznań, PL
 PL 224647 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 224647 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 408574 (22) Data zgłoszenia: 16.06.2014 (51) Int.Cl.
PL 224647 B1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 224647 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 408574 (22) Data zgłoszenia: 16.06.2014 (51) Int.Cl.
SPRAWOZDANIE Z BADAŃ MIKROBIOLOGICZNYCH Nr 20006/11859/09
 SPRAWOZDANIE MOŻE BYĆ POWIELANE TYLKO W CAŁOŚCI. INNA FORMA KOPIOWANIA WYMAGA PISEMNEJ ZGODY LABORATORIUM. SPRAWOZDANIE Z BADAŃ MIKROBIOLOGICZNYCH Nr 20006/11859/09 BADANIA WŁASNOŚCI PRZECIWDROBNOUSTROJOWYCH
SPRAWOZDANIE MOŻE BYĆ POWIELANE TYLKO W CAŁOŚCI. INNA FORMA KOPIOWANIA WYMAGA PISEMNEJ ZGODY LABORATORIUM. SPRAWOZDANIE Z BADAŃ MIKROBIOLOGICZNYCH Nr 20006/11859/09 BADANIA WŁASNOŚCI PRZECIWDROBNOUSTROJOWYCH
VII. Fizjologia bakterii - ćwiczenia praktyczne
 VII. Fizjologia bakterii - ćwiczenia praktyczne Ćwiczenie 1. Rodzaje pożywek i ich zastosowanie a. Podłoże stałe - proste Agar zwykły (AZ) b. Podłoża wzbogacone Agar z dodatkiem 5% odwłóknionej krwi baraniej
VII. Fizjologia bakterii - ćwiczenia praktyczne Ćwiczenie 1. Rodzaje pożywek i ich zastosowanie a. Podłoże stałe - proste Agar zwykły (AZ) b. Podłoża wzbogacone Agar z dodatkiem 5% odwłóknionej krwi baraniej
1. Rodzaj materiału klinicznego w zależności od kierunku i metodyki badań
 Zalecenia dotyczące pobierania, przechowywania i transportu materiałów klinicznych przeznaczonych do badań diagnostycznych w Laboratorium Zakładu Badania Wirusów Grypy, Krajowy Ośrodek ds. Grypy (obowiązuje
Zalecenia dotyczące pobierania, przechowywania i transportu materiałów klinicznych przeznaczonych do badań diagnostycznych w Laboratorium Zakładu Badania Wirusów Grypy, Krajowy Ośrodek ds. Grypy (obowiązuje
II. Badanie lekowrażliwości drobnoustrojów ćwiczenia praktyczne. Ćwiczenie 1. Oznaczanie lekowrażliwości metodą dyfuzyjno-krążkową
 II. Badanie lekowrażliwości drobnoustrojów ćwiczenia praktyczne Ćwiczenie 1. Oznaczanie lekowrażliwości metodą dyfuzyjno-krążkową Zasada metody: Krążki bibułowe nasycone odpowiednimi ilościami antybiotyków
II. Badanie lekowrażliwości drobnoustrojów ćwiczenia praktyczne Ćwiczenie 1. Oznaczanie lekowrażliwości metodą dyfuzyjno-krążkową Zasada metody: Krążki bibułowe nasycone odpowiednimi ilościami antybiotyków
Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616
 Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616 10 izolacji Nr kat. 995-10 Pojemność kolumny do oczyszczania DNA wynosi 500 µg 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616 10 izolacji Nr kat. 995-10 Pojemność kolumny do oczyszczania DNA wynosi 500 µg 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
Komunikat Komisji w ramach wdrażania dyrektywy 98/79/WE. (Publikacja tytułów i odniesień do norm zharmonizowanych na mocy dyrektywy) (2010/C 183/04)
 7.7.2010 Dziennik Urzędowy Unii Europejskiej C 183/45 Komunikat Komisji w ramach wdrażania dyrektywy 98/79/WE (Tekst mający znaczenie dla EOG) (Publikacja tytułów i odniesień do norm zharmonizowanych na
7.7.2010 Dziennik Urzędowy Unii Europejskiej C 183/45 Komunikat Komisji w ramach wdrażania dyrektywy 98/79/WE (Tekst mający znaczenie dla EOG) (Publikacja tytułów i odniesień do norm zharmonizowanych na
Zestaw SIT Szybki Identyfikacyjny Test Szczepów Salmonella Enteritidis i Typhimurium
 Zestaw SIT Szybki Identyfikacyjny Test Szczepów Salmonella Enteritidis i Typhimurium W związku z wprowadzeniem w 2011 roku przez Komisję UE zmian w rozporządzeniach nr 2160/3003 i 2073/2005 w odniesieniu
Zestaw SIT Szybki Identyfikacyjny Test Szczepów Salmonella Enteritidis i Typhimurium W związku z wprowadzeniem w 2011 roku przez Komisję UE zmian w rozporządzeniach nr 2160/3003 i 2073/2005 w odniesieniu
G-VI. Węgiel i jego związki z wodorem. Pochodne węglowodorów
 G-VI. Węgiel i jego związki z wodorem. Pochodne węglowodorów Odczynnik Postać Piktogram GHS Hasło Zwroty H Mg wiórki NIEBEZPIECZEŃSTWO H228, H252, H261 etanol UWAGA H226 heksan NIEBEZPIECZEŃSTWO H225,
G-VI. Węgiel i jego związki z wodorem. Pochodne węglowodorów Odczynnik Postać Piktogram GHS Hasło Zwroty H Mg wiórki NIEBEZPIECZEŃSTWO H228, H252, H261 etanol UWAGA H226 heksan NIEBEZPIECZEŃSTWO H225,
Doktorantka: Żaneta Lewandowska
 Doktorantka: Żaneta Lewandowska Główny opiekun naukowy: Dr hab. Piotr Piszczek, prof. UMK Katedra Chemii Nieorganicznej i Koordynacyjnej, Wydział Chemii Dodatkowy opiekun naukowy: Prof. dr hab. Wiesław
Doktorantka: Żaneta Lewandowska Główny opiekun naukowy: Dr hab. Piotr Piszczek, prof. UMK Katedra Chemii Nieorganicznej i Koordynacyjnej, Wydział Chemii Dodatkowy opiekun naukowy: Prof. dr hab. Wiesław
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika
 PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
Protokół: Reakcje charakterystyczne cukrowców
 Protokół: Reakcje charakterystyczne cukrowców 1. Rekcja na obecność cukrów: próba Molischa z -naftolem Jest to najbardziej ogólna reakcja na cukrowce, tak wolne jak i związane. Ujemny jej wynik wyklucza
Protokół: Reakcje charakterystyczne cukrowców 1. Rekcja na obecność cukrów: próba Molischa z -naftolem Jest to najbardziej ogólna reakcja na cukrowce, tak wolne jak i związane. Ujemny jej wynik wyklucza
OPIS PRZEDMIOTU ZAMÓWIENIA ARKUSZ KALKULACYJNY OKREŚLAJĄCY CENĘ OFERTY. zestaw 4
 . Pieczęć nagłówkowa ZAŁĄCZNIK NR 1A.1 DO SIWZ Data... OPIS PRZEDMIOTU ZAMÓWIENIA ARKUSZ KALKULACYJNY OKREŚLAJĄCY CENĘ OFERTY Część nr 1 Odczynniki do hodowli komórkowych Wartość 1 Zestaw uzupełniający
. Pieczęć nagłówkowa ZAŁĄCZNIK NR 1A.1 DO SIWZ Data... OPIS PRZEDMIOTU ZAMÓWIENIA ARKUSZ KALKULACYJNY OKREŚLAJĄCY CENĘ OFERTY Część nr 1 Odczynniki do hodowli komórkowych Wartość 1 Zestaw uzupełniający
Technika hodowli komórek leukemicznych
 Fizjologiczne Techniki Badań Technika hodowli komórek leukemicznych Zasady prowadzenia hodowli komórek leukemicznych, pasażowania, mrożenia, rozmrażania i przechowywania komórek leukemicznych Warunki wstępne:
Fizjologiczne Techniki Badań Technika hodowli komórek leukemicznych Zasady prowadzenia hodowli komórek leukemicznych, pasażowania, mrożenia, rozmrażania i przechowywania komórek leukemicznych Warunki wstępne:
EZ-CFU TM One Step Microorganisms
 EZ-CFU TM One Step Microorganisms OPIS PRODUKTU EZ-CFU TM One Step są liofilizowanymi preparatami szczepów referencyjnych przeznaczonymi do przeprowadzania kontroli w laboratoriach mikrobiologicznych.
EZ-CFU TM One Step Microorganisms OPIS PRODUKTU EZ-CFU TM One Step są liofilizowanymi preparatami szczepów referencyjnych przeznaczonymi do przeprowadzania kontroli w laboratoriach mikrobiologicznych.
OTRZYMYWANIE EMULSJI I BADANIE ICH WŁAŚCIWOŚCI
 OTRZYMYWANIE EMULSJI I BADANIE ICH WŁAŚCIWOŚCI Odczynniki: wosk pszczeli (4 g) olej parafinowy (9 cm 3 i 6 cm 3 ) oliwa z oliwek (5,5 cm 3 ) boraks (Na 2 B 4 O 7 10H 2 O) (0,2 g) olejek zapachowy (lawendowy
OTRZYMYWANIE EMULSJI I BADANIE ICH WŁAŚCIWOŚCI Odczynniki: wosk pszczeli (4 g) olej parafinowy (9 cm 3 i 6 cm 3 ) oliwa z oliwek (5,5 cm 3 ) boraks (Na 2 B 4 O 7 10H 2 O) (0,2 g) olejek zapachowy (lawendowy
badanie moczu Zwierzę Typ cewnika moczowego Rozmiar (jedn. francuskie) * gumy lub dla kocurów polietylenowy Elastyczny winylowy, z czerwonej
 badanie moczu Rozmiary cewników... 139 Rutynowe postępowanie przy badaniu moczu... 140 Ogólne badanie moczu... 141 Badanie osadu moczu... 142 Tabela ph moczu dla kryształów moczu 142 Komórki i wałeczki...
badanie moczu Rozmiary cewników... 139 Rutynowe postępowanie przy badaniu moczu... 140 Ogólne badanie moczu... 141 Badanie osadu moczu... 142 Tabela ph moczu dla kryształów moczu 142 Komórki i wałeczki...
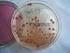
Temat: Analiza sanitarna wody
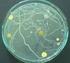 Katedra i Zakład Mikrobiologii i Wirusologii Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Diagnostyka mikrobiologiczna Analityka medyczna III rok Instrukcja do ćwiczeń Temat: Analiza sanitarna
Katedra i Zakład Mikrobiologii i Wirusologii Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Diagnostyka mikrobiologiczna Analityka medyczna III rok Instrukcja do ćwiczeń Temat: Analiza sanitarna
1. Oznaczanie aktywności lipazy trzustkowej i jej zależności od stężenia enzymu oraz żółci jako modulatora reakcji enzymatycznej.
 ĆWICZENIE OZNACZANIE AKTYWNOŚCI LIPAZY TRZUSTKOWEJ I JEJ ZALEŻNOŚCI OD STĘŻENIA ENZYMU ORAZ ŻÓŁCI JAKO MODULATORA REAKCJI ENZYMATYCZNEJ. INHIBICJA KOMPETYCYJNA DEHYDROGENAZY BURSZTYNIANOWEJ. 1. Oznaczanie
ĆWICZENIE OZNACZANIE AKTYWNOŚCI LIPAZY TRZUSTKOWEJ I JEJ ZALEŻNOŚCI OD STĘŻENIA ENZYMU ORAZ ŻÓŁCI JAKO MODULATORA REAKCJI ENZYMATYCZNEJ. INHIBICJA KOMPETYCYJNA DEHYDROGENAZY BURSZTYNIANOWEJ. 1. Oznaczanie
ZALECENIE POBIERANIE, TRANSPORT I PRZECHOWYWANIE PRÓBKI KRWI DO BADANIA WIRUSOLOGICZNEGO/ BAKTERIOLOGICZNEGO
 PRÓBKI KRWI / BAKTERIOLOGICZNEGO 1. Do jałowej probówki pobrać jałowo krew NA SKRZEP 3 4 ml krwi żylnej. Uwaga: W trakcie pobierania krwi nie trzeba być na czczo 5. Próbkę krwi dostarczyć do badania w
PRÓBKI KRWI / BAKTERIOLOGICZNEGO 1. Do jałowej probówki pobrać jałowo krew NA SKRZEP 3 4 ml krwi żylnej. Uwaga: W trakcie pobierania krwi nie trzeba być na czczo 5. Próbkę krwi dostarczyć do badania w
Genomic Mini AX Milk Spin
 Genomic Mini AX Milk Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z próbek mleka. wersja 1017 100 izolacji Nr kat. 059-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg. Produkt
Genomic Mini AX Milk Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z próbek mleka. wersja 1017 100 izolacji Nr kat. 059-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg. Produkt
RT31-020, RT , MgCl 2. , random heksamerów X 6
 RT31-020, RT31-100 RT31-020, RT31-100 Zestaw TRANSCRIPTME RNA zawiera wszystkie niezbędne składniki do przeprowadzenia syntezy pierwszej nici cdna na matrycy mrna lub całkowitego RNA. Uzyskany jednoniciowy
RT31-020, RT31-100 RT31-020, RT31-100 Zestaw TRANSCRIPTME RNA zawiera wszystkie niezbędne składniki do przeprowadzenia syntezy pierwszej nici cdna na matrycy mrna lub całkowitego RNA. Uzyskany jednoniciowy
Ćwiczenie 1. Technika ważenia oraz wyznaczanie błędów pomiarowych. Ćwiczenie 2. Sprawdzanie pojemności pipety
 II. Wagi i ważenie. Roztwory. Emulsje i koloidy Zagadnienia Rodzaje wag laboratoryjnych i technika ważenia Niepewność pomiarowa. Błąd względny i bezwzględny Roztwory właściwe Stężenie procentowe i molowe.
II. Wagi i ważenie. Roztwory. Emulsje i koloidy Zagadnienia Rodzaje wag laboratoryjnych i technika ważenia Niepewność pomiarowa. Błąd względny i bezwzględny Roztwory właściwe Stężenie procentowe i molowe.
Zestaw do wykrywania Chlamydia trachomatis w moczu lub w kulturach komórkowych
 Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
X. Pałeczki Gram-dodatnie. Rodzaje: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus
 X. Pałeczki Gram-dodatnie. Rodzaje: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus Gramujemne pałeczki auksotroficzne. Rodzaj: Haemophilus, Brucella, Legionella Ćwiczenie 1. Wykonanie preparatu
X. Pałeczki Gram-dodatnie. Rodzaje: Corynebacterium, Listeria, Erysipelothtix, Lactobacillus Gramujemne pałeczki auksotroficzne. Rodzaj: Haemophilus, Brucella, Legionella Ćwiczenie 1. Wykonanie preparatu
AmpliTest Babesia spp. (PCR)
 AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
KOAGULOLOGIA. Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice.
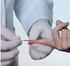 KOAGULOLOGIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi.
KOAGULOLOGIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi.
OGŁOSZENIE O ZAMÓWIENIU
 S.P.S.G. i CH.P DAG. 2011. 4. 2015. ACH Poniatowa 19 listopada 2015r. OGŁOSZENIE O ZAMÓWIENIU I. NAZWA ORAZ ADRES ZAMAWIAJĄCEGO. Samodzielne Publiczne Sanatorium Gruźlicy i Chorób Płuc w Poniatowej ul.fabryczna
S.P.S.G. i CH.P DAG. 2011. 4. 2015. ACH Poniatowa 19 listopada 2015r. OGŁOSZENIE O ZAMÓWIENIU I. NAZWA ORAZ ADRES ZAMAWIAJĄCEGO. Samodzielne Publiczne Sanatorium Gruźlicy i Chorób Płuc w Poniatowej ul.fabryczna
Ćwiczenie 4. Identyfikacja wybranych cukrów w oparciu o niektóre reakcje charakterystyczne
 Klasyczna Analiza Jakościowa Organiczna, Ćw. 4 - Identyfikacja wybranych cukrów Ćwiczenie 4 Identyfikacja wybranych cukrów w oparciu o niektóre reakcje charakterystyczne Zagadnienia teoretyczne: 1. Budowa
Klasyczna Analiza Jakościowa Organiczna, Ćw. 4 - Identyfikacja wybranych cukrów Ćwiczenie 4 Identyfikacja wybranych cukrów w oparciu o niektóre reakcje charakterystyczne Zagadnienia teoretyczne: 1. Budowa
Dostawy
 Strona 1 z 5 Dostawy - 347310-2019 24/07/2019 S141 - - Dostawy - Dodatkowe informacje - Procedura otwarta I. II. VI. VII. Polska-Wałbrzych: Odczynniki laboratoryjne 2019/S 141-347310 Sprostowanie Ogłoszenie
Strona 1 z 5 Dostawy - 347310-2019 24/07/2019 S141 - - Dostawy - Dodatkowe informacje - Procedura otwarta I. II. VI. VII. Polska-Wałbrzych: Odczynniki laboratoryjne 2019/S 141-347310 Sprostowanie Ogłoszenie
Laboratorium 3 Toksykologia żywności
 Laboratorium 3 Toksykologia żywności Literatura zalecana: Orzeł D., Biernat J. (red.) 2012. Wybrane zagadnienia z toksykologii żywności. Wydawnictwo Uniwersytetu Przyrodniczego we Wrocławiu. Wrocław. Str.:
Laboratorium 3 Toksykologia żywności Literatura zalecana: Orzeł D., Biernat J. (red.) 2012. Wybrane zagadnienia z toksykologii żywności. Wydawnictwo Uniwersytetu Przyrodniczego we Wrocławiu. Wrocław. Str.:
Genomic Midi AX. 20 izolacji
 Genomic Midi AX Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura z precypitacją DNA. wersja 0517 20 izolacji Nr kat. 895-20 Pojemność kolumny do oczyszczania
Genomic Midi AX Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura z precypitacją DNA. wersja 0517 20 izolacji Nr kat. 895-20 Pojemność kolumny do oczyszczania
GRUPA I Lp Nazwa Jm Ilość Cena jedn netto 1. Columbia agar z 5 %krwią baranią
 GRUPA I Lp Nazwa Jm Ilość Cena jedn netto 1. Columbia agar z 5 %krwią baranią 2. Agar Colubmia CNA 3. Podłoże chromogenne do posiewu moczu ze wstępną identyfikacją i oceną bakteriurii 4. Podłoże MaConkey
GRUPA I Lp Nazwa Jm Ilość Cena jedn netto 1. Columbia agar z 5 %krwią baranią 2. Agar Colubmia CNA 3. Podłoże chromogenne do posiewu moczu ze wstępną identyfikacją i oceną bakteriurii 4. Podłoże MaConkey
SPRAWOZDANIE Z BADAŃ MIKROBIOLOGICZNYCH Nr 20005/11858/09
 SPRAWOZDANIE MOŻE BYĆ POWIELANE TYLKO W CAŁOŚCI. INNA FORMA KOPIOWANIA WYMAGA PISEMNEJ ZGODY LABORATORIUM. SPRAWOZDANIE Z BADAŃ MIKROBIOLOGICZNYCH Nr 20005/11858/09 BADANIA WŁASNOŚCI PRZECIWDROBNOUSTROJOWYCH
SPRAWOZDANIE MOŻE BYĆ POWIELANE TYLKO W CAŁOŚCI. INNA FORMA KOPIOWANIA WYMAGA PISEMNEJ ZGODY LABORATORIUM. SPRAWOZDANIE Z BADAŃ MIKROBIOLOGICZNYCH Nr 20005/11858/09 BADANIA WŁASNOŚCI PRZECIWDROBNOUSTROJOWYCH
Omówienie wytycznych normy PN-EN ISO 11731:2017 dla laboratoriów
 Omówienie wytycznych normy PN-EN ISO 11731:2017 dla laboratoriów Opracowanie przygotowane przez Firmę Doradczą ISOTOP s.c. przy współpracy z mikrobiologiem Panią Anną Kozłowską. www.isotop.pl WYDANIE I
Omówienie wytycznych normy PN-EN ISO 11731:2017 dla laboratoriów Opracowanie przygotowane przez Firmę Doradczą ISOTOP s.c. przy współpracy z mikrobiologiem Panią Anną Kozłowską. www.isotop.pl WYDANIE I
EZ-Accu Shot TM Microorganisms
 EZ-Accu Shot TM Microorganisms OPIS PRODUKTU EZ-Accu Shot TM Microorganisms są to preparaty liofilizowanych mikroorganizmów dające
EZ-Accu Shot TM Microorganisms OPIS PRODUKTU EZ-Accu Shot TM Microorganisms są to preparaty liofilizowanych mikroorganizmów dające
B. ULOTKA INFORMACYJNA
 B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
Piotr Chojnacki 1. Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą reakcji charakterystycznych.
 SPRAWOZDANIE: REAKCJE CHARAKTERYSTYCZNE WYBRANYCH ANIONÓW. Imię Nazwisko Klasa Data Uwagi prowadzącego 1.Wykrywanie obecności jonu chlorkowego Cl - : Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą
SPRAWOZDANIE: REAKCJE CHARAKTERYSTYCZNE WYBRANYCH ANIONÓW. Imię Nazwisko Klasa Data Uwagi prowadzącego 1.Wykrywanie obecności jonu chlorkowego Cl - : Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą
fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 Sierpień 2018
 Sierpień 2018 fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 EURx Ltd. 80-297 Gdansk Poland ul. Przyrodnikow 3, NIP 957-07-05-191 KRS
Sierpień 2018 fix RNA Roztwór do przechowywania i ochrony przed degradacją próbek przeznaczonych do izolacji RNA kat. nr. E0280 EURx Ltd. 80-297 Gdansk Poland ul. Przyrodnikow 3, NIP 957-07-05-191 KRS
Ćwiczenie 1 Morfologia I fizjologia bakterii
 Ćwiczenie 1 Morfologia I fizjologia bakterii 1. Barwienie złożone - metoda Grama Przygotowanie preparatu: odtłuszczone szkiełko podstawowe, nałożenie bakterii ( z hodowli płynnej 1-2 oczka ezy lub ze stałej
Ćwiczenie 1 Morfologia I fizjologia bakterii 1. Barwienie złożone - metoda Grama Przygotowanie preparatu: odtłuszczone szkiełko podstawowe, nałożenie bakterii ( z hodowli płynnej 1-2 oczka ezy lub ze stałej
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
Zestaw SIT InHaVi Szybki Identyfikacyjny Test Szczepów Salmonella Infantis, Hadar oraz Virchow
 Zestaw SIT InHaVi Szybki Identyfikacyjny Test Szczepów Salmonella Infantis, Hadar oraz Virchow W związku z wprowadzeniem w 2011 roku przez Komisję UE zmian w rozporządzeniach nr 2160/3003 i 200/2010 w
Zestaw SIT InHaVi Szybki Identyfikacyjny Test Szczepów Salmonella Infantis, Hadar oraz Virchow W związku z wprowadzeniem w 2011 roku przez Komisję UE zmian w rozporządzeniach nr 2160/3003 i 200/2010 w
Wprowadzenie. Obliczanie miana wirusa i redukcja wirusa
 Ocena skuteczności systemów dekontaminacji Ecoquest w redukcji mian Norowirusa u myszy Wykonane przez Dr Lela Riley, RADIL LLC, Columbia MO 18 listopada 28 r. Wprowadzenie Członkami grupy Norowirusa są
Ocena skuteczności systemów dekontaminacji Ecoquest w redukcji mian Norowirusa u myszy Wykonane przez Dr Lela Riley, RADIL LLC, Columbia MO 18 listopada 28 r. Wprowadzenie Członkami grupy Norowirusa są
CZĘŚĆ 1 TEST KASETKOWY DO WYKRYWANIA KALPROTEKTYNY I LAKTOFERYNY W KALE. 73/PNP/SW/2018 Załącznik nr 1 do SIWZ formularz asortymentowo cenowy
 formularz asortymentowo cenowy CZĘŚĆ TEST KASETKOWY DO WYKRYWANIA KALPROTEKTYNY I LAKTOFERYNY W KALE Ilość sztuk na 36 za sztukę Immunochromatograficzny, nieinwazyjny szybki test do jakościowego wykrycia
formularz asortymentowo cenowy CZĘŚĆ TEST KASETKOWY DO WYKRYWANIA KALPROTEKTYNY I LAKTOFERYNY W KALE Ilość sztuk na 36 za sztukę Immunochromatograficzny, nieinwazyjny szybki test do jakościowego wykrycia
GOSPODARKA ODPADAMI. Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów
 GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE: Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
GOSPODARKA ODPADAMI Ćwiczenie nr 5 Oznaczanie metodą kolumnową wskaźników zanieczyszczeń wymywanych z odpadów I. WPROWADZENIE: Nieodpowiednie składowanie odpadków na wysypiskach stwarza możliwość wymywania
