Hiperbaria. GWAŁTOWNY wzrost ciśnienia. POWOLNY wzrost ciśnienia. od sekund... od milisekund do sekund. działanie fali uderzeniowej NURKOWANIE
|
|
|
- Teresa Majewska
- 4 lat temu
- Przeglądów:
Transkrypt
1 Hiperbaria GWAŁTOWNY wzrost ciśnienia POWOLNY wzrost ciśnienia od milisekund do sekund od sekund... działanie fali uderzeniowej NURKOWANIE
2 Definicja i podział nurkowań Pojęciem nurkowanie określa się całokształt przedsięwzięć organizacyjnych, technicznych i zabezpieczających, związanych z przebywaniem nurka pod zwiększonym ciśnieniem, najczęściej w środowisku wodnym, zapewniających bezpieczne wykonanie określonych prac (zadań) i bezpieczny powrót nurka do warunków ciśnienia atmosferycznego.
3 Definicja i podział nurkowań W praktyce, do nurkowania zalicza się każdy rodzaj pływania pod wodą związany z bezpośrednim oddziaływaniem na organizm nadciśnienia pod postacią dodatkowego, w stosunku do atmosferycznego, ciśnienia hydrostatycznego, wywieranego przez słup wody, bądź jego ekwiwalentu, albowiem termin nurkowanie obejmuje również suche ekspozycje w urządzeniach ciśnieniowych, takich jak komory dekompresyjne, dzwony nurkowe, itp.
4 Definicja i podział nurkowań Ze względu na głębokość, nurkowania można podzielić na: płytkie - do 20 mh 2 O; średniogłębokie - od 20 do 45 (60) mh 2 O; głębokie - ponad 45 (60) mh 2 O.
5 Definicja i podział nurkowań Ze względu na przeznaczenie, nurkowania dzieli się na: szkoleniowe - realizowane na kursach szkolenia nurków i/lub personelu obsługi celem nabycia określonej kwalifikacji nurkowej; robocze - prowadzone celem wykonania określonej pracy (zadania); treningowe - prowadzone w celu utrzymania kondycji psychofizycznej oraz podtrzymania lub udoskonalenia umiejętności zawodowych; eksperymentalne - prowadzone w warunkach rzeczywistych lub symulowanych (baseny, komory dekompresyjne, habitaty itp.) w celu badań medycznych, prób sprzętu, badań nowej techniki nurkowej, nowych technologii nurkowań lub prac podwodnych.
6 Definicja i podział nurkowań Ze względu na czas przebywania nurka pod wodą, nurkowania dzieli się na (Przepisy nurkowań saturowanych 1995): standardowe (krótkotrwałe) - nurek przebywa na głębokości lub pod ciśnieniem przez czasokres, w którym nie występuje pełne nasycenie tkanek organizmu gazami obojętnymi i powrót do warunków normobarii możliwy jest po odbyciu dekompresji wg sposobu przewidzianego dla tego typu nurkowania
7 Definicja i podział nurkowań Ze względu na czas przebywania nurka pod wodą, nurkowania dzieli się na (Przepisy nurkowań saturowanych 1995): saturowane (długotrwałe) - przebywanie nurka w warunkach podwyższonego ciśnienia w kompleksie hiperbarycznym, połączone z wykonywaniem określonej pracy (zadania) pod wodą (przejście z kompleksu hiperbarycznego do wody i z powrotem) w czasie równym lub większym od czasu pełnego nasycenia tkanek organizmu gazami obojętnymi, a następnie powrót do warunków normobarii powietrznej wg sposobu dekompresji, przewidzianego dla tego rodzaju nurkowania.
8 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Ciśnienie jest to parametr fizyczny, określający wartość siły, wywieranej przez gaz (mieszaninę gazową) na jednostkę powierzchni. W układzie SI jednostką ciśnienia jest 1 paskal (Pa), odpowiadający sile 1 niutona oddziaływującej na powierzchnię 1 metra kwadratowego (N/m 2 ). Terminem nadciśnienie określa się stan, w którym ciśnienie otoczenia przewyższa normalnie oddziaływujące na organizm ciśnienie atmosferyczne, którego wartość na poziomie morza odpowiada 1 atmosferze (atm), to jest ,5 Pa. Aby pozostać w zgodzie z wymogiem stosowania jednostek układu SI, ciśnienie podczas nurkowań podaje się w megapaskalach (MPa). Przy obliczaniu ciśnienia odpowiadającego danej głębokości przyjmuje się, że ciśnienie 0,1 MPa (a właściwie 0,098 MPa) odpowiada głębokości zanurzenia równej 10 m. Wynika z tego, że: 1 msw = 0,1 at = 10 kpa = 0,01 MPa = 0,1 bar
9 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Wartość nadciśnienia wyrazić można w odniesieniu do ciśnienia atmosferycznego na poziomie morza stosuje się wtedy symbol atn, bądź też w stosunku do próżni posługując się pojęciem atmosfery absolutnej (ata). Ciśnienie otaczające zanurzonego nurka, czyli ciśnienie absolutne, jest sumą ciśnienia hydrostatycznego (nadciśnienia) i ciśnienia atmosferycznego: ata = atn + atm czyli, dla przykładu, ciśnienie absolutne na głębokości 55 m wynosi: lub P ata = 5,5 atn + 1 atm = 6,5 ata (0,65 MPa) P ata = [55 mh 2 O x 0,1] + 1 = 6,5 ata (0,65 MPa)
10 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Na powierzchni: 760 mmhg ~ 1 atm = 1, at = N/m 2 = Pa = 14,69 psi czyli na powierzchnię ciała wynoszącą 1,5-1,8 m 2 działa ciśnienie o sile ton! a w czasie zanurzania oddziaływujący na organizm słup ciśnienia hydrostatycznego rośnie o 1 kg/cm 2 na każde 10 m zanurzenia (o 1 atn)
11 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Zwiększone ciśnienie otoczenia (hydrostatyczne) musi zostać zrównoważone!! dotyczy przestrzeni gazowych!! Tkanki uwodnione są praktycznie nieściśliwe; wzrost ciśnienia o 1 ata zmniejsza ich objętość jedynie o 0,01%
12 Zwiększone ciśnienie otoczenia (hydrostatyczne) musi zostać zrównoważone!! dotyczy przestrzeni gazowych!! Tkanki uwodnione są praktycznie nieściśliwe; wzrost ciśnienia o 1 ata zmniejsza objętość o 0,01%
13 Układ oddechowy CZĘSTOŚCI ODDECHU - szczególnie widoczny podczas wysiłku - W PORÓWNANIU Z POWIERZCHNIĄ RETENCJA CO 2 PRZESTRZENI MARTWEJ
14 Gęstość czynnika oddechowego Wzrasta proporcjonalnie do cisnienia, w związku z czym wentylacja minutowa spada : (dotyczy powietrza) 0 m. = 100% 10 m. = 72% 20 m. = 60 % 30 m. = 51 % Na większych głębokościach (ponad 50 m.) konieczność użycia mieszanin o mniejszej gęstości!
15 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Zwiększone ciśnienie, jakie działa na organizm podczas nurkowania sprawia, że właściwości fizyczne gazów nabierają szczególnego znaczenia biologicznego. Nie wyrównanie podczas nurkowania ciśnienia prowadzi do różnych zaburzeń i chorób nurkowych. Podobnie, zmieniona w hiperbarii rozpuszczalność gazów w płynach i wzrost ich gęstości powoduje, że gazy obojętne pod względem chemicznym nie są obojętne fizjologicznie.
16 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Gazy w hiperbarii: ciśnienia rozpuszczalności w cieczach gęstości ciśnienia parcjalnego składników mieszaniny objętości
17 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Zachowanie się gazów opisuje teoria kinetyczna. Jeżeli założymy, że gaz składa się z cząsteczek znikomo małych w porównaniu z odległościami pomiędzy nimi, ich ilość jest stała, cząsteczki poruszają się ruchem jednostajnym prostoliniowym, ich zderzenia są sprężyste, ruch jest jednakowo prawdopodobny w każdym kierunku, a prędkość cząsteczek jest wprost proporcjonalna do temperatury, to stan gazu opisać można równaniem: PV = 2 T 3 nc gdzie: P - ciśnienie gazu V - objętość gazu T - temperatura bezwzględna ( o K) n - liczba cząsteczek gazu w jednostce objętości C - stała
18 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii W związku z tym, że prawa strona równania jest dla określonych warunków stała, zapisać można: a po przekształceniu do postaci: m gdzie: n = µ m - liczba gramów gazu µ - masa gazu w 1 molu R - stała gazowa (8,31 otrzymuje się równanie Clapeyrona. PV T = const. PV = nrt lub PV = m RT µ J ) mol K
19 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Przemianę izotermiczną opisuje prawo Boyle a-mariotte a: w stałej temperaturze iloczyn objętości danej masy gazu i jego ciśnienia jest wielkością stałą. Zależność tą przedstawia równanie: jeżeli T = const., to PV = const. lub V = 1 1 P2V gdzie: P - ciśnienie gazu P 1 - ciśnienie początkowe gazu P 2 - ciśnienie końcowe gazu P 2 V - objętość gazu V 1 - objętość początkowa gazu V 2 - objętość końcowa gazu Z powyższego wynika, że podczas sprężania gazu lub mieszaniny gazowej wzrostowi ciśnienia towarzyszy zmniejszanie jego objętości, natomiast podczas rozprężania spadkowi ciśnienia towarzyszy zwiększanie objętości gazu. Wynikiem zaburzenia zdolności wyrównywania ciśnień w przestrzeniach powietrznych jest indukowane ciśnieniem uszkodzenie tkanek - tzw. uraz ciśnieniowy (barotrauma).
20 Zuzycie czynnika oddechowego (butla 12 l. 0.2 Mpa = 2400 l. powietrza) Głębokość Wentylacja Czas 0 m. 25 l. 96 min. 10 m. 50 l. 48 min. 30 m. 100 l. 24 min. 70 m. 200 l. 12 min.
21 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Przemianę izobaryczną opisuje prawo Gay-Lussaca: objętość określonej masy gazu pod stałym ciśnieniem jest wprost proporcjonalna do jego temperatury bezwzględnej. Zależność opisuje równanie: V T V T 1 2 = lub 1 2 V t = V 0 T 273 gdzie: V t - objętość gazu po ogrzaniu V 0 - objętość gazu przed ogrzaniem T - różnica temperatur (T[ o K] = t [ o C])
22 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Przemianę izochoryczną opisuje prawo Charles a: ciśnienie określonej masy gazu przy ogrzewaniu w stałej objętości jest wprost proporcjonalne do jego temperatury bezwzględnej. Opisać to można równaniem: P T P T 1 2 = lub gdzie: P t - ciśnienie gazu po ogrzaniu P 0 - ciśnienie gazu przed ogrzaniem T - różnica temperatur 2 2 Pt = 273 P0 T
23 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Zachowanie się gazu w mieszaninach określa prawo Daltona: w mieszaninie gazowej ciśnienie wywierane przez każdy gaz jest niezależne od ciśnień cząstkowych (parcjalnych) innych gazów; ciśnienie cząstkowe składnika mieszaniny gazowej to umowna wielkość ciśnienia, jakie wywierałby dany składnik, gdyby sam wypełniał objętość tej mieszaniny. Powyższe prawo opisać można równaniem: P = n Pgi i= 1 gdzie: P - ciśnienie całkowite mieszaniny gazowej P g - ciśnienie cząstkowe gazu składowego mieszaniny n - ilość gazów składowych w mieszaninie
24 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Równanie opisujące prawo Daltona ma kardynalne znaczenie w fizjopatologii nurkowania, gdyż po jego przekształceniu wyprowadzić można kilka wzorów, niezbędnych podczas planowania nurkowania, a szczególnie nurkowań mieszaninowych. Ciśnienie cząstkowe (parcjalne) oblicza się wg wzoru: P g = P R g 100 lub P = Fi P [ ata] g g gdzie: R g - procentowy udział objętościowy składnika gazowego mieszaniny Fi g - ułamek dziesiętny procentowej zawartości gazu w mieszaninie
25 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Zawartość procentową składnika gazowego w mieszaninie oddechowej wyliczyć można wg wzoru: Pg 100 Pg Rg = lub Fig = [%] P P Prawo Daltona jest istotne z punktu widzenia uwzględnienia toksycznych skutków działania gazów pod zwiększonym ciśnieniem, zarówno podczas różnych typów nurkowań, jak i leczenia hiperbarią tlenową. W praktyce nurkowej korzysta się z prawa Daltona, dobierając składy mieszanin oddechowych w taki sposób, aby uniknąć toksycznego wpływu gazów składowych (głównie tlenu i azotu) na organizm nurka.
26 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Rozpuszczalność gazów w cieczach zależy od ciśnienia, rodzaju gazu, rodzaju cieczy i od temperatury. Wpływ ciśnienia na rozpuszczalność gazów określa prawo Henry ego: stężenie rozpuszczonego gazu znajdującego się w równowadze z fazą gazową jest wprost proporcjonalne do ciśnienia wywieranego przez ten gaz. A więc, jeśli wzrasta ciśnienie gazu na styku z cieczą, to wzrasta ilość rozpuszczonego w tej cieczy gazu. Zależność tą określa równanie: jeżeli T = const., to C = K P gdzie: C - stężenie gazu K - współczynnik rozpuszczalności gazu P - ciśnienie gazu Z wcześniejszego wynika, że obniżenie ciśnienia (dekompresja) powoduje zakłócenie równowagi układu gaz-ciecz. Jeżeli ciecz znajduje się w stanie znacznego przesycenia gazem obojętnym, wytworzy się w niej faza gazowa pod postacią pęcherzyków gazowych - zjawisko, które leży u podstaw patogenezy choroby dekompresyjnej (DCS - ang. decompression sickness).
27 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Prawo Henry ego odnosi się do rozpuszczalności gazu w tkance wodnej, np. we krwi. W przypadku tkanek bogatych w związki tłuszczowe ilość rozpuszczonego w nich gazu będzie większa w stosunku do tkanek wodnych, a dzięki pośrednictwu układu krążenia gaz będzie rozpuszczał się tak długo, aż ustali się równowaga pomiędzy fazą wodną i tłuszczową.
28 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Stan równowagi opisuje prawo podziału Nernsta: jeżeli do układu zawierającego dwie nie mieszające się ciecze dodamy substancji, która się w nich rozpuszcza, to stosunek stężeń substancji rozpuszczonej w obu cieczach będzie wartością stałą w określonej temperaturze. Zależność tą można opisać równaniem: c c 1 2 = Κ gdzie: c 1, c 2 stężenia molowe danej substancji w cieczy (1) i (2) K współczynnik podziału Im współczynnik podziału olej/woda jest mniejszy, tym krócej trwa ustalanie się stanu równowagi pomiędzy tkanką tłuszczową a otoczeniem, zachodzące przy zmianie ciśnienia. Współczynnik podziału rzutuje na przebieg dekompresji i jest jednym z parametrów, charakteryzujących działanie narkotyczne gazów obojętnych.
29 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Do podstawowych zjawisk fizycznych, dotyczących oddziaływania środowiska gazowego w hiperbarii należy również dyfuzja. Dyfuzję gazów określa się jako bierny transfer gazu z przestrzeni o wyższym ciśnieniu parcjalnym do przestrzeni o ciśnieniu niższym, którego jedyną przyczyną jest różnica ciśnień cząstkowych pomiędzy tymi przestrzeniami. Samoistnemu procesowi wyrównywania ciśnienia towarzyszy spadek wolnej energii. Przebieg procesu dyfuzji gazów opisuje prawo Grahama: szybkość dyfuzji jest wprost proporcjonalna do ciśnienia i temperatury gazu, a odwrotnie proporcjonalna do pierwiastka kwadratowego jego ciężaru cząsteczkowego. Zależność tą określa równanie: jeżeli p V = 1 1 p2 V 2, to u u M M gdzie: ū 1, ū 2 średnie prędkości poruszania się cząsteczek m 1, m 2 M 1, M 2 masy molowe cząsteczek m 1, m 2 1 = 2 2 1
30 Fizyczne podstawy oddziaływania środowiska gazowego w hiperbarii Dyfuzja gazów w organizmie: Odległość dyfuzyjna Pole powierzchni dyfuzji Temperatura Grubość bariery (błony) dyfuzyjnej Rozpuszczalność danego gazu w wodzie w tłuszczach Czas ekspozycji Częstotliwość oddychania Ciśnienie parcjalne gazu Prędkość przepływu krwi Zapotrzebowanie metaboliczne tkanek
31 Gazy nurkowe i sztuczne mieszaniny oddechowe tlen do 6 mh 2 O; powietrze do 50 mh 2 O; nitroks do 50 mh 2 O; helioks do 300 mh 2 O; trimiks do 200 mh 2 O; hydrelioks od (200) mh 2 O do (700) mh 2 O.
32 Gazy nurkowe i sztuczne mieszaniny oddechowe Tlen (O 2 ) gaz życia, jest niezbędnym składnikiem każdej mieszaniny oddechowej. W stanie wolnym jest gazem bezbarwnym, bezwonnym i pozbawionym smaku. Przyjmuje się, że podczas nurkowania jego ciśnienie parcjalne nie powinno być niższe niż 0,02 (0,016) MPa ze względu na zagrożenie niedotlenieniem, natomiast ciśnienia cząstkowe wyższe od atmosferycznego, szczególnie zaś przekraczające 0,04 MPa i stosowane długotrwale, wywierają szkodliwe działanie na organizm (zwłaszcza na płuca i centralny układ nerwowy).
33 Gazy nurkowe i sztuczne mieszaniny oddechowe Azot (N 2 ) główny składnik powietrza, w stanie wolnym jest bezbarwny, bezwonny i pozbawiony smaku. W normobarii jest gazem fizjologicznie obojętnym, jednak pod zwiększonym ciśnieniem rozpuszcza się w tkankach i może działać toksycznie na centralny układ nerwowy, powodując objawy tzw. narkozy azotowej, a pęcherzyki gazowe powstające podczas szybkiej dekompresji nurka oddychającego powietrzem lub mieszaniną zawierającą azot, wypełnione głównie tym gazem, są przyczyną DCS.
34 Gazy nurkowe i sztuczne mieszaniny oddechowe Hel (He) podobnie, jak tlen i azot, jest bezbarwny, bezwonny i pozbawiony smaku. Ponadto prawie nie wykazuje on działania narkotycznego, jest nietoksyczny i lekki. Szybka dyfuzja helu pozwala znacznie skrócić czas dekompresji, a niska gęstość zmniejszyć wydatnie opory oddechowe. Hel odznacza się bardzo wysoką przewodnością cieplną.
35 Gazy nurkowe i sztuczne mieszaniny oddechowe Wodór (H 2 ) gaz o najniższym ciężarze cząsteczkowym i gęstości, wykorzystywany jest w nurkowaniach eksperymentalnych. Podobnie jak hel powoduje wychłodzenie organizmu ze względu na dużą przewodność cieplną, a ponadto w mieszaninach z tlenem jest wybuchowy. Objawy narkotyczne daje dopiero przy nieosiągalnych obecnie dla nurka głębokościach, gdzie ciśnienie parcjalne wodoru przekroczyłoby 25 ata. Oprócz wyżej wymienionych, prowadzone są obecnie badania nad wykorzystaniem w pracach podwodnych innych gazów szlachetnych, jak argon, ksenon i krypton, jednak na dzień dzisiejszy nie stosuje się mieszanin oddechowych, opartych na tych gazach.
36 Gazy nurkowe i sztuczne mieszaniny oddechowe Właściwości fizyczne O 2 N 2 He H 2 Ciężar cząsteczkowy (atomowy) Gęstość [g/l] 1,329 1,251 0,178 0,09 Rozpuszczalność: 37 o C H 2 O [ml/cm 3 ] 0,023 0,013 0,008 0, o C olej [ml/cm 3 ] 0,112 0,067 0,015 0,04 Współczynnik podziału 4,86 5,2 1,7 3,0 olej/woda
37 Środowisko pracy nurka i jego wpływ na organizm nurka Oddziaływanie środowiska, w jakim nurek zmuszony jest wykonywać swoją pracę, ma bezpośredni wpływ stresujący na jego organizm. Niekorzystne oddziaływania środowiska można podzielić na: fizyczne; biologiczno-chemiczne; psychiczne; zależne od techniki nurkowej.
38 Środowisko pracy nurka i jego wpływ na organizm nurka Oddziaływania fizyczne: wymiana cieplna (wychłodzenie), oddziaływanie ciśnienia hydrostatycznego zmiany w oddychaniu i krążeniu, wahania ciśnienia w tzw. przestrzeniach powietrznych organizmu, zmieniona mechanika oddychania, efekty toksyczne oddziaływania gazów w warunkach hiperbarii, zmiany wysycenia organizmu rozpuszczonymi gazami w mechanizmie sprężania/dekompresji. Oddziaływania biologiczno-chemiczne: zanieczyszczenia komunalne, zanieczyszczenia przemysłowe.
39 Środowisko pracy nurka i jego wpływ na organizm nurka Oddziaływania psychiczne: kontakt fizyczny ze środowiskiem wodnym, lęki, fobie. Oddziaływania zależne od techniki nurkowej: urządzenia ciśnieniowe, eksploatacja sprzętu nurkowego, uwarunkowania higieniczne.
40 Wzrost diurezy Nieważkość Róznica ciśnieñ dzialających na baroreceptory (przy pionowej pozycji ciała) - diureza immersyjna ochłodzenie ciała metabolizmu
41 Układ krążenia Choroba dekompresyjna... tętna - diving reflex RR - pojemnosci wyrzutowej i minutowej serca
Prawa gazowe- Tomasz Żabierek
 Prawa gazowe- Tomasz Żabierek Zachowanie gazów czystych i mieszanin tlenowo azotowych w zakresie użytecznych ciśnień i temperatur można dla większości przypadków z wystarczającą dokładnością opisywać równaniem
Prawa gazowe- Tomasz Żabierek Zachowanie gazów czystych i mieszanin tlenowo azotowych w zakresie użytecznych ciśnień i temperatur można dla większości przypadków z wystarczającą dokładnością opisywać równaniem
Płetwonurek KDP/CMAS ** (P2)
 Płetwonurek KDP/CMAS ** (P2) WWW.CMAS.PL Płetwonurek KDP/CMAS ** (P2) KDP CMAS 2013 1 Zagadnienia Ciśnienie Zależność pomiędzy ciśnieniem, objętością i temperaturą Ciśnienie w mieszaninach gazów Rozpuszczalność
Płetwonurek KDP/CMAS ** (P2) WWW.CMAS.PL Płetwonurek KDP/CMAS ** (P2) KDP CMAS 2013 1 Zagadnienia Ciśnienie Zależność pomiędzy ciśnieniem, objętością i temperaturą Ciśnienie w mieszaninach gazów Rozpuszczalność
Podstawowe prawa opisujące właściwości gazów zostały wyprowadzone dla gazu modelowego, nazywanego gazem doskonałym (idealnym).
 Spis treści 1 Stan gazowy 2 Gaz doskonały 21 Definicja mikroskopowa 22 Definicja makroskopowa (termodynamiczna) 3 Prawa gazowe 31 Prawo Boyle a-mariotte a 32 Prawo Gay-Lussaca 33 Prawo Charlesa 34 Prawo
Spis treści 1 Stan gazowy 2 Gaz doskonały 21 Definicja mikroskopowa 22 Definicja makroskopowa (termodynamiczna) 3 Prawa gazowe 31 Prawo Boyle a-mariotte a 32 Prawo Gay-Lussaca 33 Prawo Charlesa 34 Prawo
Podstawowe prawa fizyki nurkowania
 Podstawowe prawa fizyki nurkowania Ciśnienie Ciśnieniem (p) nazywamy stosunek siły (F) działającej na jakąś powierzchnię do wielkości tej powierzchni (S) P = F/S Jednostki ciśnienia : paskal (SI) - 1 Pa
Podstawowe prawa fizyki nurkowania Ciśnienie Ciśnieniem (p) nazywamy stosunek siły (F) działającej na jakąś powierzchnię do wielkości tej powierzchni (S) P = F/S Jednostki ciśnienia : paskal (SI) - 1 Pa
GAZ DOSKONAŁY. Brak oddziaływań między cząsteczkami z wyjątkiem zderzeń idealnie sprężystych.
 TERMODYNAMIKA GAZ DOSKONAŁY Gaz doskonały to abstrakcyjny, matematyczny model gazu, chociaż wiele gazów (azot, tlen) w warunkach normalnych zachowuje się w przybliżeniu jak gaz doskonały. Model ten zakłada:
TERMODYNAMIKA GAZ DOSKONAŁY Gaz doskonały to abstrakcyjny, matematyczny model gazu, chociaż wiele gazów (azot, tlen) w warunkach normalnych zachowuje się w przybliżeniu jak gaz doskonały. Model ten zakłada:
GAZ DOSKONAŁY W TERMODYNAMICE TO POJĘCIE RÓŻNE OD GAZU DOSKONAŁEGO W HYDROMECHANICE (ten jest nielepki)
 Właściwości gazów GAZ DOSKONAŁY Równanie stanu to zależność funkcji stanu od jednoczesnych wartości parametrów koniecznych do określenia stanów równowagi trwałej. Jest to zwykle jednowartościowa i ciągła
Właściwości gazów GAZ DOSKONAŁY Równanie stanu to zależność funkcji stanu od jednoczesnych wartości parametrów koniecznych do określenia stanów równowagi trwałej. Jest to zwykle jednowartościowa i ciągła
Statyka Cieczy i Gazów. Temat : Podstawy teorii kinetyczno-molekularnej budowy ciał
 Statyka Cieczy i Gazów Temat : Podstawy teorii kinetyczno-molekularnej budowy ciał 1. Podstawowe założenia teorii kinetyczno-molekularnej budowy ciał: Ciała zbudowane są z cząsteczek. Pomiędzy cząsteczkami
Statyka Cieczy i Gazów Temat : Podstawy teorii kinetyczno-molekularnej budowy ciał 1. Podstawowe założenia teorii kinetyczno-molekularnej budowy ciał: Ciała zbudowane są z cząsteczek. Pomiędzy cząsteczkami
Wykład 2. Anna Ptaszek. 7 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Chemia fizyczna - wykład 2. Anna Ptaszek 1 / 1
 Wykład 2 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 7 października 2015 1 / 1 Zjawiska koligatywne Rozpuszczenie w wodzie substancji nielotnej powoduje obniżenie prężności pary nasyconej P woda
Wykład 2 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 7 października 2015 1 / 1 Zjawiska koligatywne Rozpuszczenie w wodzie substancji nielotnej powoduje obniżenie prężności pary nasyconej P woda
Spojrzenie poprzez okienko tlenowe
 Spojrzenie poprzez okienko tlenowe Marcin Krysiński Na postawie : Looking thru the oxygen window B.R.Wienke, T.R.O Leary Advance Diver Magazine 18/2004 s.76 1 Wstęp... 3 Opis mechanizmu... 3 Wpływ ciśnienia
Spojrzenie poprzez okienko tlenowe Marcin Krysiński Na postawie : Looking thru the oxygen window B.R.Wienke, T.R.O Leary Advance Diver Magazine 18/2004 s.76 1 Wstęp... 3 Opis mechanizmu... 3 Wpływ ciśnienia
Doświadczenie B O Y L E
 Wprowadzenie teoretyczne Doświadczenie Równanie Clapeyrona opisuje gaz doskonały. Z dobrym przybliżeniem opisuje także gazy rzeczywiste rozrzedzone. p V = n R T Z równania Clapeyrona wynika prawo Boyle'a-Mario
Wprowadzenie teoretyczne Doświadczenie Równanie Clapeyrona opisuje gaz doskonały. Z dobrym przybliżeniem opisuje także gazy rzeczywiste rozrzedzone. p V = n R T Z równania Clapeyrona wynika prawo Boyle'a-Mario
Równanie gazu doskonałego
 Równanie gazu doskonałego Gaz doskonały to abstrakcyjny model gazu, który zakłada, że gaz jest zbiorem sprężyście zderzających się kulek. Wiele gazów w warunkach normalnych zachowuje się jak gaz doskonały.
Równanie gazu doskonałego Gaz doskonały to abstrakcyjny model gazu, który zakłada, że gaz jest zbiorem sprężyście zderzających się kulek. Wiele gazów w warunkach normalnych zachowuje się jak gaz doskonały.
ogromna liczba małych cząsteczek, doskonale elastycznych, poruszających się we wszystkich kierunkach, tory prostoliniowe, kierunek ruchu zmienia się
 CHEMIA NIEORGANICZNA Dr hab. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I pietro p. 138 WYKŁAD - STAN GAZOWY i CHEMIA GAZÓW kinetyczna teoria gazów ogromna liczba małych cząsteczek, doskonale
CHEMIA NIEORGANICZNA Dr hab. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I pietro p. 138 WYKŁAD - STAN GAZOWY i CHEMIA GAZÓW kinetyczna teoria gazów ogromna liczba małych cząsteczek, doskonale
Podstawy Procesów i Konstrukcji Inżynierskich. Teoria kinetyczna INZYNIERIAMATERIALOWAPL. Kierunek Wyróżniony przez PKA
 Podstawy Procesów i Konstrukcji Inżynierskich Teoria kinetyczna Kierunek Wyróżniony rzez PKA 1 Termodynamika klasyczna Pierwsza zasada termodynamiki to rosta zasada zachowania energii, czyli ogólna reguła
Podstawy Procesów i Konstrukcji Inżynierskich Teoria kinetyczna Kierunek Wyróżniony rzez PKA 1 Termodynamika klasyczna Pierwsza zasada termodynamiki to rosta zasada zachowania energii, czyli ogólna reguła
WYKŁAD 2 TERMODYNAMIKA. Termodynamika opiera się na czterech obserwacjach fenomenologicznych zwanych zasadami
 WYKŁAD 2 TERMODYNAMIKA Termodynamika opiera się na czterech obserwacjach fenomenologicznych zwanych zasadami Zasada zerowa Kiedy obiekt gorący znajduje się w kontakcie cieplnym z obiektem zimnym następuje
WYKŁAD 2 TERMODYNAMIKA Termodynamika opiera się na czterech obserwacjach fenomenologicznych zwanych zasadami Zasada zerowa Kiedy obiekt gorący znajduje się w kontakcie cieplnym z obiektem zimnym następuje
3. Przyrost temperatury gazu wynosi 20 C. Ile jest równy ten przyrost w kelwinach?
 1. Która z podanych niżej par wielkości fizycznych ma takie same jednostki? a) energia i entropia b) ciśnienie i entalpia c) praca i entalpia d) ciepło i temperatura 2. 1 kj nie jest jednostką a) entropii
1. Która z podanych niżej par wielkości fizycznych ma takie same jednostki? a) energia i entropia b) ciśnienie i entalpia c) praca i entalpia d) ciepło i temperatura 2. 1 kj nie jest jednostką a) entropii
Warunki izochoryczno-izotermiczne
 WYKŁAD 5 Pojęcie potencjału chemicznego. Układy jednoskładnikowe W zależności od warunków termodynamicznych potencjał chemiczny substancji czystej definiujemy następująco: Warunki izobaryczno-izotermiczne
WYKŁAD 5 Pojęcie potencjału chemicznego. Układy jednoskładnikowe W zależności od warunków termodynamicznych potencjał chemiczny substancji czystej definiujemy następująco: Warunki izobaryczno-izotermiczne
DRUGA ZASADA TERMODYNAMIKI
 DRUGA ZASADA TERMODYNAMIKI Procesy odwracalne i nieodwracalne termodynamicznie, samorzutne i niesamorzutne Proces nazywamy termodynamicznie odwracalnym, jeśli bez spowodowania zmian w otoczeniu możliwy
DRUGA ZASADA TERMODYNAMIKI Procesy odwracalne i nieodwracalne termodynamicznie, samorzutne i niesamorzutne Proces nazywamy termodynamicznie odwracalnym, jeśli bez spowodowania zmian w otoczeniu możliwy
Czy równowaga jest procesem korzystnym? dr hab. prof. nadzw. Małgorzata Jóźwiak
 Czy równowaga jest procesem korzystnym? dr hab. prof. nadzw. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga ciało
Czy równowaga jest procesem korzystnym? dr hab. prof. nadzw. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga ciało
Oddychanie mieszaninami oddechowymi pod zwiększonym ciśnieniem (PPT3) dr n. med. Maciej Konarski PTMiTH
 Oddychanie mieszaninami oddechowymi pod zwiększonym ciśnieniem (PPT3) dr n. med. Maciej Konarski PTMiTH Podział nurkowań Ze względu na osiąganą przez nurka głębokość zanurzenia, nurkowania można podzielić
Oddychanie mieszaninami oddechowymi pod zwiększonym ciśnieniem (PPT3) dr n. med. Maciej Konarski PTMiTH Podział nurkowań Ze względu na osiąganą przez nurka głębokość zanurzenia, nurkowania można podzielić
prof. dr hab. Małgorzata Jóźwiak
 Czy równowaga w przyrodzie i w chemii jest korzystna? prof. dr hab. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga
Czy równowaga w przyrodzie i w chemii jest korzystna? prof. dr hab. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga
KRYTERIA OCEN Z FIZYKI DLA KLASY I GIMNAZJUM
 KRYTERIA OCEN Z FIZYKI DLA KLASY I GIMNAZJUM WŁASNOŚCI MATERII - Uczeń nie opanował wiedzy i umiejętności niezbędnych w dalszej nauce. - Wie, że substancja występuje w trzech stanach skupienia. - Wie,
KRYTERIA OCEN Z FIZYKI DLA KLASY I GIMNAZJUM WŁASNOŚCI MATERII - Uczeń nie opanował wiedzy i umiejętności niezbędnych w dalszej nauce. - Wie, że substancja występuje w trzech stanach skupienia. - Wie,
Wstęp do Geofizyki. Hanna Pawłowska Instytut Geofizyki, Wydział Fizyki, Uniwersytet Warszawski
 Wstęp do Geofizyki Hanna Pawłowska Instytut Geofizyki, Wydział Fizyki, Uniwersytet Warszawski Wykład 3 Wstęp do Geofizyki - Fizyka atmosfery 2 /43 Powietrze opisuje się równaniem stanu gazu doskonałego,
Wstęp do Geofizyki Hanna Pawłowska Instytut Geofizyki, Wydział Fizyki, Uniwersytet Warszawski Wykład 3 Wstęp do Geofizyki - Fizyka atmosfery 2 /43 Powietrze opisuje się równaniem stanu gazu doskonałego,
Oddziaływania. Wszystkie oddziaływania są wzajemne jeżeli jedno ciało działa na drugie, to drugie ciało oddziałuje na pierwsze.
 Siły w przyrodzie Oddziaływania Wszystkie oddziaływania są wzajemne jeżeli jedno ciało działa na drugie, to drugie ciało oddziałuje na pierwsze. Występujące w przyrodzie rodzaje oddziaływań dzielimy na:
Siły w przyrodzie Oddziaływania Wszystkie oddziaływania są wzajemne jeżeli jedno ciało działa na drugie, to drugie ciało oddziałuje na pierwsze. Występujące w przyrodzie rodzaje oddziaływań dzielimy na:
Wykład 1. Anna Ptaszek. 5 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Chemia fizyczna - wykład 1. Anna Ptaszek 1 / 36
 Wykład 1 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 5 października 2015 1 / 36 Podstawowe pojęcia Układ termodynamiczny To zbiór niezależnych elementów, które oddziałują ze sobą tworząc integralną
Wykład 1 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 5 października 2015 1 / 36 Podstawowe pojęcia Układ termodynamiczny To zbiór niezależnych elementów, które oddziałują ze sobą tworząc integralną
= = Budowa materii. Stany skupienia materii. Ilość materii (substancji) n - ilość moli, N liczba molekuł (atomów, cząstek), N A
 Budowa materii Stany skupienia materii Ciało stałe Ciecz Ciała lotne (gazy i pary) Ilość materii (substancji) n N = = N A m M N A = 6,023 10 mol 23 1 n - ilość moli, N liczba molekuł (atomów, cząstek),
Budowa materii Stany skupienia materii Ciało stałe Ciecz Ciała lotne (gazy i pary) Ilość materii (substancji) n N = = N A m M N A = 6,023 10 mol 23 1 n - ilość moli, N liczba molekuł (atomów, cząstek),
Wykład 7: Przekazywanie energii elementy termodynamiki
 Wykład 7: Przekazywanie energii elementy termodynamiki dr inż. Zbigniew Szklarski szkla@agh.edu.pl http://layer.uci.agh.edu.pl/z.szklarski/ emperatura Fenomenologicznie wielkość informująca o tym jak ciepłe/zimne
Wykład 7: Przekazywanie energii elementy termodynamiki dr inż. Zbigniew Szklarski szkla@agh.edu.pl http://layer.uci.agh.edu.pl/z.szklarski/ emperatura Fenomenologicznie wielkość informująca o tym jak ciepłe/zimne
Termodynamika Termodynamika
 Termodynamika 1. Wiśniewski S.: Termodynamika techniczna, WNT, Warszawa 1980, 1987, 1993. 2. Jarosiński J., Wiejacki Z., Wiśniewski S.: Termodynamika, skrypt PŁ. Łódź 1993. 3. Zbiór zadań z termodynamiki
Termodynamika 1. Wiśniewski S.: Termodynamika techniczna, WNT, Warszawa 1980, 1987, 1993. 2. Jarosiński J., Wiejacki Z., Wiśniewski S.: Termodynamika, skrypt PŁ. Łódź 1993. 3. Zbiór zadań z termodynamiki
Wykład 6. Klasyfikacja przemian fazowych
 Wykład 6 Klasyfikacja przemian fazowych JS Klasyfikacja Ehrenfesta Ehrenfest klasyfikuje przemiany fazowe w oparciu o potencjał chemiczny. nieciągłość Przemiany fazowe pierwszego rodzaju pochodne potencjału
Wykład 6 Klasyfikacja przemian fazowych JS Klasyfikacja Ehrenfesta Ehrenfest klasyfikuje przemiany fazowe w oparciu o potencjał chemiczny. nieciągłość Przemiany fazowe pierwszego rodzaju pochodne potencjału
Projekt Inżynier mechanik zawód z przyszłością współfinansowany ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego
 Zajęcia wyrównawcze z fizyki -Zestaw 4 -eoria ermodynamika Równanie stanu gazu doskonałego Izoprzemiany gazowe Energia wewnętrzna gazu doskonałego Praca i ciepło w przemianach gazowych Silniki cieplne
Zajęcia wyrównawcze z fizyki -Zestaw 4 -eoria ermodynamika Równanie stanu gazu doskonałego Izoprzemiany gazowe Energia wewnętrzna gazu doskonałego Praca i ciepło w przemianach gazowych Silniki cieplne
Wykład 3. Fizykochemia biopolimerów- wykład 3. Anna Ptaszek. 30 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego
 Wykład 3 - wykład 3 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 30 października 2013 1/56 Warunek równowagi fazowej Jakich układów dotyczy równowaga fazowa? Równowaga fazowa dotyczy układów: jednoskładnikowych
Wykład 3 - wykład 3 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 30 października 2013 1/56 Warunek równowagi fazowej Jakich układów dotyczy równowaga fazowa? Równowaga fazowa dotyczy układów: jednoskładnikowych
a. Dobierz współczynniki w powyższym schemacie tak, aby stał się równaniem reakcji chemicznej.
 Zadanie 1. Nitrogliceryna (C 3 H 5 N 3 O 9 ) jest środkiem wybuchowym. Jej rozkład można opisać następującym schematem: C 3 H 5 N 3 O 9 (c) N 2 (g) + CO 2 (g) + H 2 O (g) + O 2 (g) H rozkładu = - 385 kj/mol
Zadanie 1. Nitrogliceryna (C 3 H 5 N 3 O 9 ) jest środkiem wybuchowym. Jej rozkład można opisać następującym schematem: C 3 H 5 N 3 O 9 (c) N 2 (g) + CO 2 (g) + H 2 O (g) + O 2 (g) H rozkładu = - 385 kj/mol
Kinetyczna teoria gazów Termodynamika. dr Mikołaj Szopa Wykład
 Kinetyczna teoria gazów Termodynamika dr Mikołaj Szopa Wykład 7.11.015 Kinetyczna teoria gazów Kinetyczna teoria gazów. Termodynamika Termodynamika klasyczna opisuje tylko wielkości makroskopowe takie
Kinetyczna teoria gazów Termodynamika dr Mikołaj Szopa Wykład 7.11.015 Kinetyczna teoria gazów Kinetyczna teoria gazów. Termodynamika Termodynamika klasyczna opisuje tylko wielkości makroskopowe takie
DRUGA ZASADA TERMODYNAMIKI
 DRUGA ZASADA TERMODYNAMIKI Procesy odwracalne i nieodwracalne termodynamicznie, samorzutne i niesamorzutne Proces nazywamy termodynamicznie odwracalnym, jeśli bez spowodowania zmian w otoczeniu możliwy
DRUGA ZASADA TERMODYNAMIKI Procesy odwracalne i nieodwracalne termodynamicznie, samorzutne i niesamorzutne Proces nazywamy termodynamicznie odwracalnym, jeśli bez spowodowania zmian w otoczeniu możliwy
Seminarium 4 Obliczenia z wykorzystaniem przekształcania wzorów fizykochemicznych
 Seminarium 4 Obliczenia z wykorzystaniem przekształcania wzorów fizykochemicznych Zad. 1 Przekształć w odpowiedni sposób podane poniżej wzory aby wyliczyć: a) a lub m 2 b) m zred h E a 8ma E osc h 4 2
Seminarium 4 Obliczenia z wykorzystaniem przekształcania wzorów fizykochemicznych Zad. 1 Przekształć w odpowiedni sposób podane poniżej wzory aby wyliczyć: a) a lub m 2 b) m zred h E a 8ma E osc h 4 2
Wykład FIZYKA I. 14. Termodynamika fenomenologiczna cz.ii. Dr hab. inż. Władysław Artur Woźniak
 Wykład FIZYKA I 14. Termodynamika fenomenologiczna cz.ii Dr hab. inż. Władysław Artur Woźniak Instytut Fizyki Politechniki Wrocławskiej http://www.if.pwr.wroc.pl/~wozniak/fizyka1.html GAZY DOSKONAŁE Przez
Wykład FIZYKA I 14. Termodynamika fenomenologiczna cz.ii Dr hab. inż. Władysław Artur Woźniak Instytut Fizyki Politechniki Wrocławskiej http://www.if.pwr.wroc.pl/~wozniak/fizyka1.html GAZY DOSKONAŁE Przez
TERMODYNAMIKA Zajęcia wyrównawcze, Częstochowa, 2009/2010 Ewa Mandowska
 1. Bilans cieplny 2. Przejścia fazowe 3. Równanie stanu gazu doskonałego 4. I zasada termodynamiki 5. Przemiany gazu doskonałego 6. Silnik cieplny 7. II zasada termodynamiki TERMODYNAMIKA Zajęcia wyrównawcze,
1. Bilans cieplny 2. Przejścia fazowe 3. Równanie stanu gazu doskonałego 4. I zasada termodynamiki 5. Przemiany gazu doskonałego 6. Silnik cieplny 7. II zasada termodynamiki TERMODYNAMIKA Zajęcia wyrównawcze,
Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12
 Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12 atomu węgla 12 C. Mol - jest taką ilością danej substancji,
Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12 atomu węgla 12 C. Mol - jest taką ilością danej substancji,
Gazy stosowane w nurkowaniu
 Robert Drzewiecki Gazy stosowane w nurkowaniu Tlen Tlen jest gazem bezbarwnym, bezwonnym, bezsmakowym, jego liczba atomowa wynosi 8 a masa atomowa 16. W warunkach normalnych występuje w postaci dwuatomowej
Robert Drzewiecki Gazy stosowane w nurkowaniu Tlen Tlen jest gazem bezbarwnym, bezwonnym, bezsmakowym, jego liczba atomowa wynosi 8 a masa atomowa 16. W warunkach normalnych występuje w postaci dwuatomowej
TERMODYNAMIKA. przykłady zastosowań. I.Mańkowski I LO w Lęborku
 TERMODYNAMIKA przykłady zastosowań I.Mańkowski I LO w Lęborku 2016 UKŁAD TERMODYNAMICZNY Dla przykładu układ termodynamiczny stanowią zamknięty cylinder z ruchomym tłokiem, w którym znajduje się gaz tak
TERMODYNAMIKA przykłady zastosowań I.Mańkowski I LO w Lęborku 2016 UKŁAD TERMODYNAMICZNY Dla przykładu układ termodynamiczny stanowią zamknięty cylinder z ruchomym tłokiem, w którym znajduje się gaz tak
Sonochemia. Schemat 1. Strefy reakcji. Rodzaje efektów sonochemicznych. Oscylujący pęcherzyk gazu. Woda w stanie nadkrytycznym?
 Schemat 1 Strefy reakcji Rodzaje efektów sonochemicznych Oscylujący pęcherzyk gazu Woda w stanie nadkrytycznym? Roztwór Znaczne gradienty ciśnienia Duże siły hydrodynamiczne Efekty mechanochemiczne Reakcje
Schemat 1 Strefy reakcji Rodzaje efektów sonochemicznych Oscylujący pęcherzyk gazu Woda w stanie nadkrytycznym? Roztwór Znaczne gradienty ciśnienia Duże siły hydrodynamiczne Efekty mechanochemiczne Reakcje
4. 1 bar jest dokładnie równy a) Pa b) 100 Tr c) 1 at d) 1 Atm e) 1000 niutonów na metr kwadratowy f) 0,1 MPa
 1. Adiatermiczny wymiennik ciepła to wymiennik, w którym a) ciepło płynie od czynnika o niższej temperaturze do czynnika o wyższej temperaturze b) nie ma strat ciepła na rzecz otoczenia c) czynniki wymieniające
1. Adiatermiczny wymiennik ciepła to wymiennik, w którym a) ciepło płynie od czynnika o niższej temperaturze do czynnika o wyższej temperaturze b) nie ma strat ciepła na rzecz otoczenia c) czynniki wymieniające
TERMODYNAMIKA I TERMOCHEMIA
 TERMODYNAMIKA I TERMOCHEMIA Termodynamika - opisuje zmiany energii towarzyszące przemianom chemicznym; dział fizyki zajmujący się zjawiskami cieplnymi. Termochemia - dział chemii zajmujący się efektami
TERMODYNAMIKA I TERMOCHEMIA Termodynamika - opisuje zmiany energii towarzyszące przemianom chemicznym; dział fizyki zajmujący się zjawiskami cieplnymi. Termochemia - dział chemii zajmujący się efektami
Wykład 10 Równowaga chemiczna
 Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
1. 1 J/(kg K) nie jest jednostką a) entropii właściwej b) indywidualnej stałej gazowej c) ciepła właściwego d) pracy jednostkowej
 1. 1 J/(kg K) nie jest jednostką a) entropii właściwej b) indywidualnej stałej gazowej c) ciepła właściwego d) pracy jednostkowej 2. 1 kmol każdej substancji charakteryzuje się taką samą a) masą b) objętością
1. 1 J/(kg K) nie jest jednostką a) entropii właściwej b) indywidualnej stałej gazowej c) ciepła właściwego d) pracy jednostkowej 2. 1 kmol każdej substancji charakteryzuje się taką samą a) masą b) objętością
Zadanie 1. Zadanie: Odpowiedź: ΔU = 2,8663 10 4 J
 Tomasz Lubera Zadanie: Zadanie 1 Autoklaw zawiera 30 dm 3 azotu o temperaturze 15 o C pod ciśnieniem 1,48 atm. Podczas ogrzewania autoklawu ciśnienie wzrosło do 3800,64 mmhg. Oblicz zmianę energii wewnętrznej
Tomasz Lubera Zadanie: Zadanie 1 Autoklaw zawiera 30 dm 3 azotu o temperaturze 15 o C pod ciśnieniem 1,48 atm. Podczas ogrzewania autoklawu ciśnienie wzrosło do 3800,64 mmhg. Oblicz zmianę energii wewnętrznej
relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
 1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
Równowagi fazowe. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Równowagi fazowe Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Równowaga termodynamiczna Przemianom fazowym towarzyszą procesy, podczas których nie zmienia się skład chemiczny układu, polegają
Równowagi fazowe Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Równowaga termodynamiczna Przemianom fazowym towarzyszą procesy, podczas których nie zmienia się skład chemiczny układu, polegają
Układ termodynamiczny Parametry układu termodynamicznego Proces termodynamiczny Układ izolowany Układ zamknięty Stan równowagi termodynamicznej
 termodynamika - podstawowe pojęcia Układ termodynamiczny - wyodrębniona część otaczającego nas świata. Parametry układu termodynamicznego - wielkości fizyczne, za pomocą których opisujemy stan układu termodynamicznego,
termodynamika - podstawowe pojęcia Układ termodynamiczny - wyodrębniona część otaczającego nas świata. Parametry układu termodynamicznego - wielkości fizyczne, za pomocą których opisujemy stan układu termodynamicznego,
ZALEŻNOŚĆ CIŚNIENIA PARY NASYCONEJ WODY OD TEM- PERATURY. WYZNACZANIE MOLOWEGO CIEPŁA PARO- WANIA
 ZALEŻNOŚĆ CIŚNIENIA PARY NASYCONEJ WODY OD TEM- PERATURY. WYZNACZANIE MOLOWEGO CIEPŁA PARO- WANIA I. Cel ćwiczenia: zbadanie zależności ciśnienia pary nasyconej wody od temperatury oraz wyznaczenie molowego
ZALEŻNOŚĆ CIŚNIENIA PARY NASYCONEJ WODY OD TEM- PERATURY. WYZNACZANIE MOLOWEGO CIEPŁA PARO- WANIA I. Cel ćwiczenia: zbadanie zależności ciśnienia pary nasyconej wody od temperatury oraz wyznaczenie molowego
Stany skupienia materii
 Stany skupienia materii Ciała stałe Ciecze Płyny Gazy Plazma 1 Stany skupienia materii Ciała stałe - ustalony kształt i objętość - uporządkowanie dalekiego zasięgu - oddziaływania harmoniczne Ciecze -
Stany skupienia materii Ciała stałe Ciecze Płyny Gazy Plazma 1 Stany skupienia materii Ciała stałe - ustalony kształt i objętość - uporządkowanie dalekiego zasięgu - oddziaływania harmoniczne Ciecze -
Temperatura jest wspólną własnością dwóch ciał, które pozostają ze sobą w równowadze termicznej.
 1 Ciepło jest sposobem przekazywania energii z jednego ciała do drugiego. Ciepło przepływa pod wpływem różnicy temperatur. Jeżeli ciepło nie przepływa mówimy o stanie równowagi termicznej. Zerowa zasada
1 Ciepło jest sposobem przekazywania energii z jednego ciała do drugiego. Ciepło przepływa pod wpływem różnicy temperatur. Jeżeli ciepło nie przepływa mówimy o stanie równowagi termicznej. Zerowa zasada
Wykład 4. Przypomnienie z poprzedniego wykładu
 Wykład 4 Przejścia fazowe materii Diagram fazowy Ciepło Procesy termodynamiczne Proces kwazistatyczny Procesy odwracalne i nieodwracalne Pokazy doświadczalne W. Dominik Wydział Fizyki UW Termodynamika
Wykład 4 Przejścia fazowe materii Diagram fazowy Ciepło Procesy termodynamiczne Proces kwazistatyczny Procesy odwracalne i nieodwracalne Pokazy doświadczalne W. Dominik Wydział Fizyki UW Termodynamika
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA
 SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały pomocnicze do laboratorium z przedmiotu Metody i Narzędzia Symulacji Komputerowej
 Materiały pomocnicze do laboratorium z przedmiotu Metody i Narzędzia Symulacji Komputerowej w Systemach Technicznych Symulacja prosta dyszy pomiarowej Bendemanna Opracował: dr inż. Andrzej J. Zmysłowski
Materiały pomocnicze do laboratorium z przedmiotu Metody i Narzędzia Symulacji Komputerowej w Systemach Technicznych Symulacja prosta dyszy pomiarowej Bendemanna Opracował: dr inż. Andrzej J. Zmysłowski
Gas calculations. Skrócona instrukcja obsługi
 Gas calculations Skrócona instrukcja obsługi! UWAGA! Powyższy program jest jedynie przykładem i w żadnym przypadku nie powinien być wykorzystywany w praktyce. Użytkownik ponosi pełną odpowiedzialność za
Gas calculations Skrócona instrukcja obsługi! UWAGA! Powyższy program jest jedynie przykładem i w żadnym przypadku nie powinien być wykorzystywany w praktyce. Użytkownik ponosi pełną odpowiedzialność za
Wykład 3. Diagramy fazowe P-v-T dla substancji czystych w trzech stanach. skupienia. skupienia
 Wykład 3 Substancje proste i czyste Przemiany w systemie dwufazowym woda para wodna Diagram T-v dla przejścia fazowego woda para wodna Diagramy T-v i P-v dla wody Punkt krytyczny Temperatura nasycenia
Wykład 3 Substancje proste i czyste Przemiany w systemie dwufazowym woda para wodna Diagram T-v dla przejścia fazowego woda para wodna Diagramy T-v i P-v dla wody Punkt krytyczny Temperatura nasycenia
Zadanie 1. Zadanie: Odpowiedź: ΔU = 2, J
 Tomasz Lubera Zadanie: Zadanie 1 Autoklaw zawiera 30 dm 3 azotu o temperaturze 15 o C pod ciśnieniem 1,48 atm. Podczas ogrzewania autoklawu ciśnienie wzrosło do 3800,64 mmhg. Oblicz zmianę energii wewnętrznej
Tomasz Lubera Zadanie: Zadanie 1 Autoklaw zawiera 30 dm 3 azotu o temperaturze 15 o C pod ciśnieniem 1,48 atm. Podczas ogrzewania autoklawu ciśnienie wzrosło do 3800,64 mmhg. Oblicz zmianę energii wewnętrznej
Termodynamika. Energia wewnętrzna ciał
 ermodynamika Energia wewnętrzna ciał Cząsteczki ciał stałych, cieczy i gazów znajdują się w nieustannym ruchu oddziałując ze sobą. Sumę energii kinetycznej oraz potencjalnej oddziałujących cząsteczek nazywamy
ermodynamika Energia wewnętrzna ciał Cząsteczki ciał stałych, cieczy i gazów znajdują się w nieustannym ruchu oddziałując ze sobą. Sumę energii kinetycznej oraz potencjalnej oddziałujących cząsteczek nazywamy
Rodzaj/forma zadania. Max liczba pkt. zamknięte 1 1 p. poprawna odpowiedź. zamknięte 1 1 p. poprawne odpowiedzi. zamknięte 1 1 p. poprawne odpowiedzi
 KARTOTEKA TESTU I SCHEMAT OCENIANIA - gimnazjum - etap rejonowy Nr zada Cele ogólne nia 1 I. Wykorzystanie wielkości fizycznych 2 I. Wykorzystanie wielkości fizycznych 3 III. Wskazywanie w otaczającej
KARTOTEKA TESTU I SCHEMAT OCENIANIA - gimnazjum - etap rejonowy Nr zada Cele ogólne nia 1 I. Wykorzystanie wielkości fizycznych 2 I. Wykorzystanie wielkości fizycznych 3 III. Wskazywanie w otaczającej
WYKŁAD 7. Diagramy fazowe Dwuskładnikowe układy doskonałe
 WYKŁAD 7 Diagramy fazowe Dwuskładnikowe układy doskonałe JS Reguła Gibssa. Układy dwuskładnikowe Reguła faz Gibbsa określa liczbę stopni swobody układu w równowadze termodynamicznej: układy dwuskładnikowe
WYKŁAD 7 Diagramy fazowe Dwuskładnikowe układy doskonałe JS Reguła Gibssa. Układy dwuskładnikowe Reguła faz Gibbsa określa liczbę stopni swobody układu w równowadze termodynamicznej: układy dwuskładnikowe
4. Przyrost temperatury gazu wynosi 20 C. W kelwinach przyrost ten jest równy
 1. Która z podanych niżej par wielkości fizycznych ma takie same jednostki? a) energia i entropia b) ciśnienie i entalpia c) praca i entalpia d) ciepło i temperatura 2. 1 bar jest dokładnie równy a) 10000
1. Która z podanych niżej par wielkości fizycznych ma takie same jednostki? a) energia i entropia b) ciśnienie i entalpia c) praca i entalpia d) ciepło i temperatura 2. 1 bar jest dokładnie równy a) 10000
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE
 PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
prawa gazowe Model gazu doskonałego Temperatura bezwzględna tościowa i entalpia owy Standardowe entalpie tworzenia i spalania 4. Stechiometria 1 tość
 5. Gazy, termochemia Doświadczalne rawa gazowe Model gazu doskonałego emeratura bezwzględna Układ i otoczenie Energia wewnętrzna, raca objęto tościowa i entalia Prawo Hessa i cykl kołowy owy Standardowe
5. Gazy, termochemia Doświadczalne rawa gazowe Model gazu doskonałego emeratura bezwzględna Układ i otoczenie Energia wewnętrzna, raca objęto tościowa i entalia Prawo Hessa i cykl kołowy owy Standardowe
Termodynamika Część 2
 Termodynamika Część 2 Równanie stanu Równanie stanu gazu doskonałego Równania stanu gazów rzeczywistych rozwinięcie wirialne równanie van der Waalsa hipoteza odpowiedniości stanów inne równania stanu Równanie
Termodynamika Część 2 Równanie stanu Równanie stanu gazu doskonałego Równania stanu gazów rzeczywistych rozwinięcie wirialne równanie van der Waalsa hipoteza odpowiedniości stanów inne równania stanu Równanie
dr inż. Beata Brożek-Płuska LABORATORIUM LASEROWEJ SPEKTROSKOPII MOLEKULARNEJ Politechnika Łódzka Międzyresortowy Instytut Techniki Radiacyjnej
 dr inż. Beata Brożek-Płuska LABORATORIUM LASEROWEJ SPEKTROSKOPII MOLEKULARNEJ Politechnika Łódzka Międzyresortowy Instytut Techniki Radiacyjnej 93-590 Łódź Wróblewskiego 15 tel:(48-42) 6313162, 6313162,
dr inż. Beata Brożek-Płuska LABORATORIUM LASEROWEJ SPEKTROSKOPII MOLEKULARNEJ Politechnika Łódzka Międzyresortowy Instytut Techniki Radiacyjnej 93-590 Łódź Wróblewskiego 15 tel:(48-42) 6313162, 6313162,
Opracował: dr inż. Tadeusz Lemek
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
c. Oblicz wydajność reakcji rozkładu 200 g nitrogliceryny, jeśli otrzymano w niej 6,55 g tlenu.
 Zadanie 1. Nitrogliceryna (C 3H 5N 3O 9) jest środkiem wybuchowym. Jej rozkład można opisać następującym schematem: 4 C 3 H 5 N 3 O 9 (c) 6 N 2 (g) + 12 CO 2 (g) + 10 H 2 O (g) + 1 O 2 (g) H rozkładu =
Zadanie 1. Nitrogliceryna (C 3H 5N 3O 9) jest środkiem wybuchowym. Jej rozkład można opisać następującym schematem: 4 C 3 H 5 N 3 O 9 (c) 6 N 2 (g) + 12 CO 2 (g) + 10 H 2 O (g) + 1 O 2 (g) H rozkładu =
Ćwiczenie 2. Charakteryzacja niskotemperaturowego czujnika tlenu. (na prawach rękopisu)
 Ćwiczenie 2. Charakteryzacja niskotemperaturowego czujnika tlenu (na prawach rękopisu) W analityce procesowej istotne jest określenie stężeń rozpuszczonych w cieczach gazów. Gazy rozpuszczają się w cieczach
Ćwiczenie 2. Charakteryzacja niskotemperaturowego czujnika tlenu (na prawach rękopisu) W analityce procesowej istotne jest określenie stężeń rozpuszczonych w cieczach gazów. Gazy rozpuszczają się w cieczach
WYMAGANIA EDUKACYJNE Z FIZYKI
 WYMAGANIA EDUKACYJNE Z FIZYKI KLASA I Budowa materii Wymagania na stopień dopuszczający obejmują treści niezbędne dla dalszego kształcenia oraz użyteczne w pozaszkolnej działalności ucznia. Uczeń: rozróżnia
WYMAGANIA EDUKACYJNE Z FIZYKI KLASA I Budowa materii Wymagania na stopień dopuszczający obejmują treści niezbędne dla dalszego kształcenia oraz użyteczne w pozaszkolnej działalności ucznia. Uczeń: rozróżnia
Fizyka 14. Janusz Andrzejewski
 Fizyka 14 Janusz Andrzejewski Egzaminy Egzaminy odbywają się w salach 3 oraz 314 budynek A1 w godzinach od 13.15 do 15.00 I termin 4 luty 013 poniedziałek II termin 1 luty 013 wtorek Na wykład zapisanych
Fizyka 14 Janusz Andrzejewski Egzaminy Egzaminy odbywają się w salach 3 oraz 314 budynek A1 w godzinach od 13.15 do 15.00 I termin 4 luty 013 poniedziałek II termin 1 luty 013 wtorek Na wykład zapisanych
Wykład Praca (1.1) c Całka liniowa definiuje pracę wykonaną w kierunku działania siły. Reinhard Kulessa 1
 1.6 Praca Wykład 2 Praca zdefiniowana jest jako ilość energii dostarczanej przez siłę działającą na pewnej drodze i matematycznie jest zapisana jako: W = c r F r ds (1.1) ds F θ c Całka liniowa definiuje
1.6 Praca Wykład 2 Praca zdefiniowana jest jako ilość energii dostarczanej przez siłę działającą na pewnej drodze i matematycznie jest zapisana jako: W = c r F r ds (1.1) ds F θ c Całka liniowa definiuje
p atmosferyczne =po p(h) p(h) = p atmosferyczne + p hydrostatyczne (h) p hydrostatyczne
 Cykl wykładów 2007 dla kandydatów na stopnie P1 i P2 Zbigniew Niedzielski na podstawie prezentacji Witka Trybały Podstawy fizyki nurkowania Witold Trybała Odmienne warunki środowiska wodnego Wysokie i
Cykl wykładów 2007 dla kandydatów na stopnie P1 i P2 Zbigniew Niedzielski na podstawie prezentacji Witka Trybały Podstawy fizyki nurkowania Witold Trybała Odmienne warunki środowiska wodnego Wysokie i
(1) Równanie stanu gazu doskonałego. I zasada termodynamiki: ciepło, praca.
 (1) Równanie stanu gazu doskonałego. I zasada termodynamiki: ciepło, praca. 1. Aby określić dokładną wartość stałej gazowej R, student ogrzał zbiornik o objętości 20,000 l wypełniony 0,25132 g gazowego
(1) Równanie stanu gazu doskonałego. I zasada termodynamiki: ciepło, praca. 1. Aby określić dokładną wartość stałej gazowej R, student ogrzał zbiornik o objętości 20,000 l wypełniony 0,25132 g gazowego
Prawo Henry'ego (1801 r.)
 Robert Rudner Katedra Anestezjologii, Intensywnej Terapii i Medycyny Ratunkowej Śląskiego Uniwersytetu Medycznego w Katowicach Co to jest Low Flow Anestezja? Jakie zalety posiada stosowanie niskich przepływów?
Robert Rudner Katedra Anestezjologii, Intensywnej Terapii i Medycyny Ratunkowej Śląskiego Uniwersytetu Medycznego w Katowicach Co to jest Low Flow Anestezja? Jakie zalety posiada stosowanie niskich przepływów?
Wykład 6: Przekazywanie energii elementy termodynamiki
 Wykład 6: Przekazywanie energii elementy termodynamiki dr inż. Zbigniew Szklarski szkla@agh.edu.pl http://layer.uci.agh.edu.pl/z.szklarski/ Temperatura Fenomenologicznie wielkość informująca o tym jak
Wykład 6: Przekazywanie energii elementy termodynamiki dr inż. Zbigniew Szklarski szkla@agh.edu.pl http://layer.uci.agh.edu.pl/z.szklarski/ Temperatura Fenomenologicznie wielkość informująca o tym jak
Ciśnienie definiujemy jako stosunek siły parcia działającej na jednostkę powierzchni do wielkości tej powierzchni.
 Ciśnienie i gęstość płynów Autorzy: Zbigniew Kąkol, Bartek Wiendlocha Powszechnie przyjęty jest podział materii na ciała stałe i płyny. Pod pojęciem substancji, która może płynąć rozumiemy zarówno ciecze
Ciśnienie i gęstość płynów Autorzy: Zbigniew Kąkol, Bartek Wiendlocha Powszechnie przyjęty jest podział materii na ciała stałe i płyny. Pod pojęciem substancji, która może płynąć rozumiemy zarówno ciecze
Wykład 6: Przekazywanie energii elementy termodynamiki
 Wykład 6: Przekazywanie energii elementy termodynamiki dr inż. Zbigniew Szklarski szkla@agh.edu.pl http://layer.uci.agh.edu.pl/z.szklarski/ Temperatura Fenomenologicznie wielkość informująca o tym jak
Wykład 6: Przekazywanie energii elementy termodynamiki dr inż. Zbigniew Szklarski szkla@agh.edu.pl http://layer.uci.agh.edu.pl/z.szklarski/ Temperatura Fenomenologicznie wielkość informująca o tym jak
MECHANIKA PŁYNÓW Płyn
 MECHANIKA PŁYNÓW Płyn - Każda substancja, która może płynąć, tj. pod wpływem znikomo małych sił dowolnie zmieniać swój kształt w zależności od naczynia, w którym się znajduje, oraz może swobodnie się przemieszczać
MECHANIKA PŁYNÓW Płyn - Każda substancja, która może płynąć, tj. pod wpływem znikomo małych sił dowolnie zmieniać swój kształt w zależności od naczynia, w którym się znajduje, oraz może swobodnie się przemieszczać
Termiczne odgazowanie wody zasilającej kotły parowe.
 Termiczne odgazowanie wody zasilającej kotły parowe. Krzysztof Szałucki 1. Wstęp Jeżeli szklankę napełnimy zimną wodą surową i pozostawimy ją w ciepłym miejscu, to po chwili - nie dłuższej niż ta, którą
Termiczne odgazowanie wody zasilającej kotły parowe. Krzysztof Szałucki 1. Wstęp Jeżeli szklankę napełnimy zimną wodą surową i pozostawimy ją w ciepłym miejscu, to po chwili - nie dłuższej niż ta, którą
Odwracalność przemiany chemicznej
 Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
Odruch nurkowania 1 / 7. Jak zmienia się tętno w trakcie nurkowania?
 Odruch nurkowania Jak zmienia się tętno w trakcie nurkowania? Nurkujące zwierzęta dużo czasu spędzają pod wodą. Aby to było możliwe, potrzebują wystarczających zapasów tlenu, który - jak wiemy - dociera
Odruch nurkowania Jak zmienia się tętno w trakcie nurkowania? Nurkujące zwierzęta dużo czasu spędzają pod wodą. Aby to było możliwe, potrzebują wystarczających zapasów tlenu, który - jak wiemy - dociera
09 - Dobór siłownika i zaworu. - Opór przepływu w przewodzie - Dobór rozmiaru zaworu - Dobór rozmiaru siłownika
 - Dobór siłownika i zaworu - Opór przepływu w przewodzie - Dobór rozmiaru zaworu - Dobór rozmiaru siłownika OPÓR PRZEPŁYWU W ZAWORZE Objętościowy współczynnik przepływu Qn Przepływ oblicza się jako stosunek
- Dobór siłownika i zaworu - Opór przepływu w przewodzie - Dobór rozmiaru zaworu - Dobór rozmiaru siłownika OPÓR PRZEPŁYWU W ZAWORZE Objętościowy współczynnik przepływu Qn Przepływ oblicza się jako stosunek
I. Właściwości wody: II. Stany skupienia wody. Na dnie zbiornika wodnego jest zawsze temperatura 4 O C (największa gęstość wody).
 I. Właściwości wody: bezbarwna bezwonna bez smaku dobry rozpuszczalnik temp. topnienia 0 O C temp. wrzenia 100 O C (pod ciśnieniem 1013 hpa) największa gęstość przy temp. 4 O C Na dnie zbiornika wodnego
I. Właściwości wody: bezbarwna bezwonna bez smaku dobry rozpuszczalnik temp. topnienia 0 O C temp. wrzenia 100 O C (pod ciśnieniem 1013 hpa) największa gęstość przy temp. 4 O C Na dnie zbiornika wodnego
Modelowanie w ochronie środowiska
 Modelowanie w ochronie środowiska PARAMETRY FIZYKO-CHEMICZNE WPŁYWAJĄCE NA TRWAŁOŚĆ I ROZPRZESTRZENIANIE SIĘ ZWIĄZKÓW CHEMICZNYCH W ŚRODOWISKU NATURALNYM KOMPOENTY ŚRODOWISKA TRWAŁOŚĆ! CZAS PRZEBYWANIA
Modelowanie w ochronie środowiska PARAMETRY FIZYKO-CHEMICZNE WPŁYWAJĄCE NA TRWAŁOŚĆ I ROZPRZESTRZENIANIE SIĘ ZWIĄZKÓW CHEMICZNYCH W ŚRODOWISKU NATURALNYM KOMPOENTY ŚRODOWISKA TRWAŁOŚĆ! CZAS PRZEBYWANIA
termodynamika fenomenologiczna
 termodynamika termodynamika fenomenologiczna własności termiczne ciał makroskopowych uogólnienie licznych badań doświadczalnych opis makro i mikro rezygnacja z przyczynowości znaczenie praktyczne p układ
termodynamika termodynamika fenomenologiczna własności termiczne ciał makroskopowych uogólnienie licznych badań doświadczalnych opis makro i mikro rezygnacja z przyczynowości znaczenie praktyczne p układ
Zastosowania Równania Bernoullego - zadania
 Zadanie 1 Przez zwężkę o średnicy D = 0,2 m, d = 0,05 m przepływa woda o temperaturze t = 50 C. Obliczyć jakie ciśnienie musi panować w przekroju 1-1, aby w przekroju 2-2 nie wystąpiło zjawisko kawitacji,
Zadanie 1 Przez zwężkę o średnicy D = 0,2 m, d = 0,05 m przepływa woda o temperaturze t = 50 C. Obliczyć jakie ciśnienie musi panować w przekroju 1-1, aby w przekroju 2-2 nie wystąpiło zjawisko kawitacji,
Wykład FIZYKA I. 15. Termodynamika statystyczna. Dr hab. inż. Władysław Artur Woźniak
 Wykład FIZYKA I 15. Termodynamika statystyczna Dr hab. inż. Władysław Artur Woźniak Instytut Fizyki Politechniki Wrocławskiej http://www.if.pwr.wroc.pl/~wozniak/fizyka1.html TERMODYNAMIKA KLASYCZNA I TEORIA
Wykład FIZYKA I 15. Termodynamika statystyczna Dr hab. inż. Władysław Artur Woźniak Instytut Fizyki Politechniki Wrocławskiej http://www.if.pwr.wroc.pl/~wozniak/fizyka1.html TERMODYNAMIKA KLASYCZNA I TEORIA
Kryteria oceniania z chemii kl VII
 Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
Kryteria oceniania z chemii kl VII Ocena dopuszczająca -stosuje zasady BHP w pracowni -nazywa sprzęt laboratoryjny i szkło oraz określa ich przeznaczenie -opisuje właściwości substancji używanych na co
01 - Podstawowe prawa pneumatyki
 - Podstawowe prawa pneumatyki - Ciśnienie i próżnia - Prawo Boyle a - Mariotte a - Prawo Gay - Lussac a - Właściwości przepływu - Współczynniki "C" i " b" - Współczynnik Kv - Przepływ nominalny Q.Nn CŚNENE
- Podstawowe prawa pneumatyki - Ciśnienie i próżnia - Prawo Boyle a - Mariotte a - Prawo Gay - Lussac a - Właściwości przepływu - Współczynniki "C" i " b" - Współczynnik Kv - Przepływ nominalny Q.Nn CŚNENE
dr Dariusz Wyrzykowski ćwiczenia rachunkowe semestr I
 Podstawowe prawa i pojęcia chemiczne. Fizyczne prawa gazowe. Zad. 1. Ile cząsteczek wody znajduje się w 0,12 mola uwodnionego azotanu(v) ceru Ce(NO 3 ) 2 6H 2 O? Zad. 2. W wyniku reakcji 40,12 g rtęci
Podstawowe prawa i pojęcia chemiczne. Fizyczne prawa gazowe. Zad. 1. Ile cząsteczek wody znajduje się w 0,12 mola uwodnionego azotanu(v) ceru Ce(NO 3 ) 2 6H 2 O? Zad. 2. W wyniku reakcji 40,12 g rtęci
3.1. Równowagi fazowe układach jednoskładnikowych 3.2. Termodynamika równowag fazowych 3.3. Równowagi fazowe układach dwuskładnikowych 3.4.
 Równowagi fazowe w układach jedno- i wieloskładnikowych jedno- lub wielofazowych 3.1. Równowagi fazowe układach jednoskładnikowych 3.2. Termodynamika równowag fazowych 3.3. Równowagi fazowe układach dwuskładnikowych
Równowagi fazowe w układach jedno- i wieloskładnikowych jedno- lub wielofazowych 3.1. Równowagi fazowe układach jednoskładnikowych 3.2. Termodynamika równowag fazowych 3.3. Równowagi fazowe układach dwuskładnikowych
Pomiar ciśnienia krwi metodą osłuchową Korotkowa
 Ćw. M 11 Pomiar ciśnienia krwi metodą osłuchową Korotkowa Zagadnienia: Oddziaływania międzycząsteczkowe. Siły Van der Waalsa. Zjawisko lepkości. Równanie Newtona dla płynięcia cieczy. Współczynniki lepkości;
Ćw. M 11 Pomiar ciśnienia krwi metodą osłuchową Korotkowa Zagadnienia: Oddziaływania międzycząsteczkowe. Siły Van der Waalsa. Zjawisko lepkości. Równanie Newtona dla płynięcia cieczy. Współczynniki lepkości;
Spis treści. 2. Przygotowanie fizyczne do nurkowania technicznego... 89 2.1. Trening wydolnościowy i wytrzymałościowy... 89
 Od wydawcy..................................................... 9 Wstęp............................................................ 11 Podziękowania.................................................. 15
Od wydawcy..................................................... 9 Wstęp............................................................ 11 Podziękowania.................................................. 15
UKŁAD ODDECHOWY
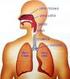 Zadanie 1. (1 pkt). Na rysunku przedstawiono pęcherzyki płucne oplecione siecią naczyń krwionośnych. Określ znaczenie gęstej sieci naczyń krwionośnych oplatających pęcherzyki płucne.... Zadanie 2. (2 pkt)
Zadanie 1. (1 pkt). Na rysunku przedstawiono pęcherzyki płucne oplecione siecią naczyń krwionośnych. Określ znaczenie gęstej sieci naczyń krwionośnych oplatających pęcherzyki płucne.... Zadanie 2. (2 pkt)
Powtórzenie wiadomości z klasy I. Cząsteczkowa budowa materii. Ciśnienie, prawo Pascala - obliczenia.
 Powtórzenie wiadomości z klasy I Cząsteczkowa budowa materii. Ciśnienie, prawo Pascala - obliczenia. Atomy i cząsteczki 1. Materia składa się z cząsteczek zbudowanych z atomów. 2. Atomy są bardzo małe,
Powtórzenie wiadomości z klasy I Cząsteczkowa budowa materii. Ciśnienie, prawo Pascala - obliczenia. Atomy i cząsteczki 1. Materia składa się z cząsteczek zbudowanych z atomów. 2. Atomy są bardzo małe,
Ćwiczenie 9. Podstawy fizjologii wysiłku fizycznego
 Ćwiczenie 9 Podstawy fizjologii wysiłku fizycznego Zagadnienia teoretyczne 1. Kryteria oceny wydolności fizycznej organizmu. 2. Bezpośredni pomiar pochłoniętego tlenu - spirometr Krogha. 3. Pułap tlenowy
Ćwiczenie 9 Podstawy fizjologii wysiłku fizycznego Zagadnienia teoretyczne 1. Kryteria oceny wydolności fizycznej organizmu. 2. Bezpośredni pomiar pochłoniętego tlenu - spirometr Krogha. 3. Pułap tlenowy
Inżynieria procesów przetwórstwa węgla, zima 15/16
 Inżynieria procesów przetwórstwa węgla, zima 15/16 Ćwiczenia 1 7.10.2015 1. Załóżmy, że balon ma kształt sfery o promieniu 3m. a. Jaka ilość wodoru potrzebna jest do jego wypełnienia, aby na poziomie morza
Inżynieria procesów przetwórstwa węgla, zima 15/16 Ćwiczenia 1 7.10.2015 1. Załóżmy, że balon ma kształt sfery o promieniu 3m. a. Jaka ilość wodoru potrzebna jest do jego wypełnienia, aby na poziomie morza
autor: Włodzimierz Wolczyński rozwiązywał (a)... ARKUSIK 18 TERMODYNAMIKA 1. GAZY
 autor: Włodzimierz Wolczyński rozwiązywał (a)... ARKUSIK 18 TERMODYNAMIKA 1. GAZY Rozwiązanie zadań należy zapisać w wyznaczonych miejscach pod treścią zadania Zadanie 1 1 punkt TEST JEDNOKROTNEGO WYBORU
autor: Włodzimierz Wolczyński rozwiązywał (a)... ARKUSIK 18 TERMODYNAMIKA 1. GAZY Rozwiązanie zadań należy zapisać w wyznaczonych miejscach pod treścią zadania Zadanie 1 1 punkt TEST JEDNOKROTNEGO WYBORU
Temodynamika Roztwór N 2 i Ar (gazów doskonałych) ma wykładnik adiabaty κ = 1.5. Określić molowe udziały składników. 1.7
 Temodynamika Zadania 2016 0 Oblicz: 1 1.1 10 cm na stopy, 60 stóp na metry, 50 ft 2 na metry. 45 m 2 na ft 2 g 40 cm na uncję na stopę sześcienną, na uncję na cal sześcienny 3 60 g cm na funt na stopę
Temodynamika Zadania 2016 0 Oblicz: 1 1.1 10 cm na stopy, 60 stóp na metry, 50 ft 2 na metry. 45 m 2 na ft 2 g 40 cm na uncję na stopę sześcienną, na uncję na cal sześcienny 3 60 g cm na funt na stopę
