Struktura elektronowa σ-kompleksu benzenu z centrum aktywnym Fe IV O cytochromu P450
|
|
|
- Dominik Lewicki
- 6 lat temu
- Przeglądów:
Transkrypt
1 Struktura elektronowa σ-kompleksu benzenu z centrum aktywnym Fe IV O cytochromu P450 Modelowanie metodami DFT, CASSCF i CASPT2 Andrzej Niedziela 1 1 Wydział Chemii Uniwersytet Jagielloński /Seminarium zakładowe
2 Plan seminarium 1 Wprowadzenie Problemy w modelowaniu Charakterystyka białka Etapy modelowania 2 Zastosowane metody chemii kwantowej DFT CASSCF CASPT2 3 Modelowanie FeO/FeO + Szczegóły numeryczne Struktura elektronowa Wyniki 4 Podsumowanie Osiagnięte cele Dalsze plany
3 Problem w modelowaniu Problemy zwiazane z modelowaniem układów z pierwiastkami grupy przejściowej: degeneracja termów atomowych separacja konfiguracji elektronowych stabilizacja orbitali 3d względem 4s preferencja wysoko spinowej powłoki 3d differential correlation effect valence valence valence core core core
4 Problem w modelowaniu Problemy zwiazane z modelowaniem układów z pierwiastkami grupy przejściowej: degeneracja termów atomowych separacja konfiguracji elektronowych stabilizacja orbitali 3d względem 4s preferencja wysoko spinowej powłoki 3d differential correlation effect valence valence valence core core core
5 Problem w modelowaniu Problemy zwiazane z modelowaniem układów z pierwiastkami grupy przejściowej: degeneracja termów atomowych separacja konfiguracji elektronowych stabilizacja orbitali 3d względem 4s preferencja wysoko spinowej powłoki 3d differential correlation effect valence valence valence core core core
6 Charakterystyka białka Właściwości, które wykazuja białka z superrodziny Cytochromów P450 umieszczaja je w centrum zainteresowań chemii teoretycznej: aktywacja wiazania C-H model w projektowaniu mimetycznym detoksyfikacja biosynteza metabolizm leków rola w chemii mózgu rozpowszechniony w naturze Cpd I krótko żyjacy
7 Etapy modelowania Etap I: tlenek żelaza(iii) FeO + A. Fiedler, D. Schröder J.F. Harrison Etap II: σ-kompleks benzen-feo Karolina Kwapień K. Yoshizawa, Y. Shiota Etap III: σ-kompleks CpdI-benzen Mariusz Radoń S.P. de Visser, Sason Shaik
8 Etapy modelowania Etap I: tlenek żelaza(iii) FeO + A. Fiedler, D. Schröder J.F. Harrison Etap II: σ-kompleks benzen-feo Karolina Kwapień K. Yoshizawa, Y. Shiota Etap III: σ-kompleks CpdI-benzen Mariusz Radoń S.P. de Visser, Sason Shaik
9 Etapy modelowania Etap I: tlenek żelaza(iii) FeO + A. Fiedler, D. Schröder J.F. Harrison Etap II: σ-kompleks benzen-feo Karolina Kwapień K. Yoshizawa, Y. Shiota Etap III: σ-kompleks CpdI-benzen Mariusz Radoń S.P. de Visser, Sason Shaik
10 DFT Density Funtional Theory Teoria funkcjonałów gęstości, której podstawy stworzyli Hohenberg i Kohn. Natomiast Kohn i Sham zaproponowali praktyczna realizację obliczeń. w metodzie tej: ψ 0 ρ 0 (1) ale tylko dla stanów niezdegenerowanych! dla stanów zdegenerowanych: ψ 0 ρ 0 (2) zależność wyników od stosowanych funkcjonałów
11 DFT Density Funtional Theory Teoria funkcjonałów gęstości, której podstawy stworzyli Hohenberg i Kohn. Natomiast Kohn i Sham zaproponowali praktyczna realizację obliczeń. w metodzie tej: ψ 0 ρ 0 (1) ale tylko dla stanów niezdegenerowanych! dla stanów zdegenerowanych: ψ 0 ρ 0 (2) zależność wyników od stosowanych funkcjonałów
12 DFT Density Funtional Theory Teoria funkcjonałów gęstości, której podstawy stworzyli Hohenberg i Kohn. Natomiast Kohn i Sham zaproponowali praktyczna realizację obliczeń. w metodzie tej: ψ 0 ρ 0 (1) ale tylko dla stanów niezdegenerowanych! dla stanów zdegenerowanych: ψ 0 ρ 0 (2) zależność wyników od stosowanych funkcjonałów
13 DFT Density Funtional Theory Teoria funkcjonałów gęstości, której podstawy stworzyli Hohenberg i Kohn. Natomiast Kohn i Sham zaproponowali praktyczna realizację obliczeń. w metodzie tej: ψ 0 ρ 0 (1) ale tylko dla stanów niezdegenerowanych! dla stanów zdegenerowanych: ψ 0 ρ 0 (2) zależność wyników od stosowanych funkcjonałów
14 CASSCF Complete Active Space SCF Metoda pola samouzgodnionego dla kompletnej przestrzeni aktywnej. wariant wielokonfiguracyjnej metody pola samouzgodnionego wybór przestrzeni aktywnej, na której buduje się pełne MCSCF silna zależność energii od wyboru przestrzeni aktywnej uwzględnienie korelacji statycznej
15 CASPT2 CAS Perturbation Theory of the Second Order Metoda perturbacyjna drugiego rzędu względem energii dla kompletnej przestrzeni aktywnej. wariant wieloreferencyjnego rachunku zaburzeń pozwala przybliżyć korelację dynamiczna funkcja CASSCF stanowi funkcje referencyjna uwzględnia poprawki do energii do drugiego rzędu
16 Efekt podwójnej powłoki (ang. double shell effect) Efekt korelacyjny dotyczacy pierwiastków grup przejściowych szczególnie istotny dla układów z dużym obsadzeniem orbitalu typu d wymaga uwzględnienia drugiej powłoki typu d korelacja na poziomie atomowym (atomic correlation effect) utrzymuje się na poziomie CASPT2 (zmiana liczby obsadzeń orbitalu 3d, przeniesienie ładunku)
17 Zastosowane programy Gaussian: funkcjonał: B3LYP baza: 6-311G** Molcas: symetria: C 2 baza na Fe: ANO-rcc...7s6p5d3f2g1h. baza na O: ANO-rcc...4s3p2d1f. Molden Turbomol
18 Nakładanie Orbitali
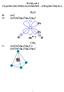
19 Rozważane konfiguracje
20 Rozważane konfiguracje
21 Rozważane konfiguracje
22 Energie jonizacji Energia jonizacji [ev] DFT 8,9 Exp. 8,9 ±0, 16 DFT 7,93 Energia jonizacji [ev] 12in9 12in14 12in10 12in15 CASSCF 6,82 7,24 6,82 7,36 CASPT2 7,98 8,39 7,97 8,18
23 Różnica energii sekstet kwartet Energia [ev] DFT 1,0 Exp.??? DFT 0,76 Energia [ev] 12in9 12in14 12in10 12in15 CASSCF 0,95 0,70 0,77 0,22 CASPT2 0,63 0,64 0,63 0,76
24 Osiagnięte cel Etap I (tlenek żelaza(iii) FeO + ): znaleziono stabilne przestrzenie aktywne zoptymalizowano geometrie i orbitale molekularne porównano DFT, CASSCF i CASPT2 zbadano wpływ podwójnej powłoki Etap II (σ-kompleks benzen-feo): zoptymalizowane geometrie znaleziona przestrzeń aktywna końcowe próby w małych bazach problemy ze struktura rodnikowa
25 Osiagnięte cel Etap I (tlenek żelaza(iii) FeO + ): znaleziono stabilne przestrzenie aktywne zoptymalizowano geometrie i orbitale molekularne porównano DFT, CASSCF i CASPT2 zbadano wpływ podwójnej powłoki Etap II (σ-kompleks benzen-feo): zoptymalizowane geometrie znaleziona przestrzeń aktywna końcowe próby w małych bazach problemy ze struktura rodnikowa
26 Dalsze plany Etap II (σ-kompleks benzen-feo): próba znalezienia struktury rodnikowej wyrzutowanie mniejszej bazy na większa wykonanie obliczeń dla dużej bazy Etap III (σ-kompleks CpdI-benzen): optymalizacja geometrii znalezienie przestrzeni aktywnej próby znalezienia obu struktur (kationowej i rodnikowej) obliczenia w dużej bazie
27 Dalsze plany Etap II (σ-kompleks benzen-feo): próba znalezienia struktury rodnikowej wyrzutowanie mniejszej bazy na większa wykonanie obliczeń dla dużej bazy Etap III (σ-kompleks CpdI-benzen): optymalizacja geometrii znalezienie przestrzeni aktywnej próby znalezienia obu struktur (kationowej i rodnikowej) obliczenia w dużej bazie
28 Dziękuję za uwagę
29 Harrison, J. F. Chem. Rev. 2000, 100, 2 Glukhovtsev, M. N.; Bach, R. D.; Nagel, C. J. J. Phys. Chem. A 1997, 101, 3 Fredler, A.; Schröder, D.; Shaik, S.; Schwarz, H. J. Am. Chem. Soc. 1994, 116, 23 Yoshizawa, K.; Shiota, Y.; Yamabe, T. J. Am. Chem. Soc. 1998, 121, 1 Shaik, S.; Kumar, D.; de Visser, S. P; Altun, A.; Thiel, W. Chem. Rev 2005, 105, 6 Pierloot, K. Mol. Phys. 2003, 101, 13 de Visser, S. P.; Shaik, S. J. Am. Chem. Soc. 2003, 125, 25 Andersson, K.; Malmqvist, P.; Roos, B. O. J. Chem. Phys. 1992, 96, 2
Rozwój i zastosowanie wieloreferencyjnych metod sprzężonych klasterów w opisie stanów podstawowych i wzbudzonych układów atomowych i molekularnych
 Rozwój i zastosowanie wieloreferencyjnych metod sprzężonych klasterów w opisie stanów podstawowych i wzbudzonych układów atomowych i molekularnych Justyna Cembrzyńska Zakład Mechaniki Kwantowej Uniwersytet
Rozwój i zastosowanie wieloreferencyjnych metod sprzężonych klasterów w opisie stanów podstawowych i wzbudzonych układów atomowych i molekularnych Justyna Cembrzyńska Zakład Mechaniki Kwantowej Uniwersytet
Modelowanie molekularne
 Modelowanie molekularne metodami chemii kwantowej Dr hab. Artur Michalak Zakład Chemii Teoretycznej Wydział Chemii UJ Wykład 4 http://www.chemia.uj.edu.pl/~michalak/mmod2007/ Podstawowe idee i metody chemii
Modelowanie molekularne metodami chemii kwantowej Dr hab. Artur Michalak Zakład Chemii Teoretycznej Wydział Chemii UJ Wykład 4 http://www.chemia.uj.edu.pl/~michalak/mmod2007/ Podstawowe idee i metody chemii
Wstęp do Optyki i Fizyki Materii Skondensowanej
 Wstęp do Optyki i Fizyki Materii Skondensowanej Część I: Optyka, wykład 9 wykład: Piotr Fita pokazy: Andrzej Wysmołek ćwiczenia: Anna Grochola, Barbara Piętka Wydział Fizyki Uniwersytet Warszawski 2014/15
Wstęp do Optyki i Fizyki Materii Skondensowanej Część I: Optyka, wykład 9 wykład: Piotr Fita pokazy: Andrzej Wysmołek ćwiczenia: Anna Grochola, Barbara Piętka Wydział Fizyki Uniwersytet Warszawski 2014/15
Podstawy chemii obliczeniowej
 Podstawy chemii obliczeniowej Anna Kaczmarek Kędziera Katedra Chemii Materiałów, Adsorpcji i Katalizy Wydział Chemii UMK, Toruń Elementy chemii obliczeniowej i bioinformatyki 2015 Plan wykładu 15 godzin
Podstawy chemii obliczeniowej Anna Kaczmarek Kędziera Katedra Chemii Materiałów, Adsorpcji i Katalizy Wydział Chemii UMK, Toruń Elementy chemii obliczeniowej i bioinformatyki 2015 Plan wykładu 15 godzin
Ćwiczenie 4: Modelowanie reakcji chemicznych. Stan przejściowy.
 Ćwiczenie 4: Modelowanie reakcji chemicznych. Stan przejściowy. Celem ćwiczenia jest wymodelowanie przebiegu reakcji chemicznej podstawienia nukleofilowego zachodzącego zgodnie z mechanizmem SN2. Wprowadzenie:
Ćwiczenie 4: Modelowanie reakcji chemicznych. Stan przejściowy. Celem ćwiczenia jest wymodelowanie przebiegu reakcji chemicznej podstawienia nukleofilowego zachodzącego zgodnie z mechanizmem SN2. Wprowadzenie:
Wykład 5: Cząsteczki dwuatomowe
 Wykład 5: Cząsteczki dwuatomowe Wiązania jonowe i kowalencyjne Ograniczenia teorii Lewisa Orbitale cząsteczkowe Kombinacja liniowa orbitali atomowych Orbitale dwucentrowe Schematy nakładania orbitali Diagramy
Wykład 5: Cząsteczki dwuatomowe Wiązania jonowe i kowalencyjne Ograniczenia teorii Lewisa Orbitale cząsteczkowe Kombinacja liniowa orbitali atomowych Orbitale dwucentrowe Schematy nakładania orbitali Diagramy
Elementy chemii obliczeniowej i bioinformatyki Zagadnienia na egzamin
 Elementy chemii obliczeniowej i bioinformatyki Zagadnienia na egzamin 1. Zapisz konfigurację elektronową dla atomu helu (dwa elektrony) i wyjaśnij, dlaczego cząsteczka wodoru jest stabilna, a cząsteczka
Elementy chemii obliczeniowej i bioinformatyki Zagadnienia na egzamin 1. Zapisz konfigurację elektronową dla atomu helu (dwa elektrony) i wyjaśnij, dlaczego cząsteczka wodoru jest stabilna, a cząsteczka
Modelowanie molekularne
 Ck08 Modelowanie molekularne metodami chemii kwantowej Dr hab. Artur Michalak Zakład Chemii Teoretycznej Wydział Chemii UJ Wykład 10 http://www.chemia.uj.edu.pl/~michalak/mmod2007/ Podstawowe idee i metody
Ck08 Modelowanie molekularne metodami chemii kwantowej Dr hab. Artur Michalak Zakład Chemii Teoretycznej Wydział Chemii UJ Wykład 10 http://www.chemia.uj.edu.pl/~michalak/mmod2007/ Podstawowe idee i metody
Modelowanie molekularne
 Modelowanie molekularne metodami chemii kwantowej Dr hab. Artur Michalak Zakład Chemii Teoretycznej Wydział Chemii UJ Wykład 4 http://www.chemia.uj.edu.pl/~michalak/mmod2007/ Podstawowe idee i metody chemii
Modelowanie molekularne metodami chemii kwantowej Dr hab. Artur Michalak Zakład Chemii Teoretycznej Wydział Chemii UJ Wykład 4 http://www.chemia.uj.edu.pl/~michalak/mmod2007/ Podstawowe idee i metody chemii
Teoria Orbitali Molekularnych. tworzenie wiązań chemicznych
 Teoria Orbitali Molekularnych tworzenie wiązań chemicznych Zbliżanie się atomów aż do momentu nałożenia się ich orbitali H a +H b H a H b Wykres obrazujący zależność energii od odległości atomów długość
Teoria Orbitali Molekularnych tworzenie wiązań chemicznych Zbliżanie się atomów aż do momentu nałożenia się ich orbitali H a +H b H a H b Wykres obrazujący zależność energii od odległości atomów długość
Budowa atomów. Atomy wieloelektronowe Układ okresowy pierwiastków
 Budowa atomów Atomy wieloelektronowe Układ okresowy pierwiastków Model atomu Bohra atom zjonizowany (ciągłe wartości energii) stany wzbudzone jądro Energia (ev) elektron orbita stan podstawowy Poziomy
Budowa atomów Atomy wieloelektronowe Układ okresowy pierwiastków Model atomu Bohra atom zjonizowany (ciągłe wartości energii) stany wzbudzone jądro Energia (ev) elektron orbita stan podstawowy Poziomy
Geometria cząsteczek wieloatomowych. Hybrydyzacja orbitali atomowych.
 Geometria cząsteczek wieloatomowych. Hybrydyzacja orbitali atomowych. Geometria cząsteczek Geometria cząsteczek decyduje zarówno o ich właściwościach fizycznych jak i chemicznych, np. temperaturze wrzenia,
Geometria cząsteczek wieloatomowych. Hybrydyzacja orbitali atomowych. Geometria cząsteczek Geometria cząsteczek decyduje zarówno o ich właściwościach fizycznych jak i chemicznych, np. temperaturze wrzenia,
Uniwersytet Śląski w Katowicach str. 1 Wydział Matematyki, Fizyki i Chemii
 Uniwersytet Śląski w Katowicach str. 1 Kierunek i poziom studiów: Chemia, pierwszy poziom Sylabus modułu: Chemia kwantowa 021 Nazwa wariantu modułu (opcjonalnie): 1. Informacje ogólne koordynator modułu
Uniwersytet Śląski w Katowicach str. 1 Kierunek i poziom studiów: Chemia, pierwszy poziom Sylabus modułu: Chemia kwantowa 021 Nazwa wariantu modułu (opcjonalnie): 1. Informacje ogólne koordynator modułu
Termodynamika i właściwości fizyczne stopów - zastosowanie w przemyśle
 Termodynamika i właściwości fizyczne stopów - zastosowanie w przemyśle Marcela Trybuła Władysław Gąsior Alain Pasturel Noel Jakse Plan: 1. Materiał badawczy 2. Eksperyment Metodologia 3. Teoria Metodologia
Termodynamika i właściwości fizyczne stopów - zastosowanie w przemyśle Marcela Trybuła Władysław Gąsior Alain Pasturel Noel Jakse Plan: 1. Materiał badawczy 2. Eksperyment Metodologia 3. Teoria Metodologia
KARTA PRZEDMIOTU. Informacje ogólne WYDZIAŁ MATEMATYCZNO-PRZYRODNICZY. SZKOŁA NAUK ŚCISŁYCH UNIWERSYTET KARDYNAŁA STEFANA WYSZYŃSKIEGO W WARSZAWIE
 1 2 4 5 6 7 8 8.0 Kod przedmiotu Nazwa przedmiotu Jednostka Punkty ECTS Język wykładowy polski Poziom przedmiotu podstawowy K_W01 2 wiedza Symbole efektów kształcenia K_U01 2 umiejętności K_K01 11 kompetencje
1 2 4 5 6 7 8 8.0 Kod przedmiotu Nazwa przedmiotu Jednostka Punkty ECTS Język wykładowy polski Poziom przedmiotu podstawowy K_W01 2 wiedza Symbole efektów kształcenia K_U01 2 umiejętności K_K01 11 kompetencje
Modelowanie molekularne
 Ck08 Modelowanie molekularne metodami chemii kwantowej Dr hab. Artur Michalak Zakład Chemii Teoretycznej Wydział Chemii UJ Wykład 2 http://www.chemia.uj.edu.pl/~michalak/mmod2007/ Podstawowe idee i metody
Ck08 Modelowanie molekularne metodami chemii kwantowej Dr hab. Artur Michalak Zakład Chemii Teoretycznej Wydział Chemii UJ Wykład 2 http://www.chemia.uj.edu.pl/~michalak/mmod2007/ Podstawowe idee i metody
Ćwiczenie 3. Spektroskopia elektronowa. Etylen. Trypletowe przejścia elektronowe *
 Ćwiczenie 3 Spektroskopia elektronowa. Etylen. Trypletowe przejścia elektronowe * 1 Ćwiczenie 3 Spektroskopia elektronowa. Etylen. Trypletowe przejścia elektronowe * I. Narysuj etylen a) Wybierz Default
Ćwiczenie 3 Spektroskopia elektronowa. Etylen. Trypletowe przejścia elektronowe * 1 Ćwiczenie 3 Spektroskopia elektronowa. Etylen. Trypletowe przejścia elektronowe * I. Narysuj etylen a) Wybierz Default
Atomy wieloelektronowe
 Wiązania atomowe Atomy wieloelektronowe, obsadzanie stanów elektronowych, układ poziomów energii. Przykładowe konfiguracje elektronów, gazy szlachetne, litowce, chlorowce, układ okresowy pierwiastków,
Wiązania atomowe Atomy wieloelektronowe, obsadzanie stanów elektronowych, układ poziomów energii. Przykładowe konfiguracje elektronów, gazy szlachetne, litowce, chlorowce, układ okresowy pierwiastków,
WYKŁAD 3 CZĄSTECZKI WIELOATOMOWE ZWIĄZKI WĘGLA
 WYKŁAD 3 ZĄSTEZKI WIELOATOMOWE ZWIĄZKI WĘGLA O : (s) O: (s) (s) (p z ) (p x ) (p y ) px py s 90 o? s 4 : (s) (s) (p x ) (p y ) (s) (s) (p x ) (p y ) (p z ) s pz px py s so : (s) s s.orbital MOLEKULARNY
WYKŁAD 3 ZĄSTEZKI WIELOATOMOWE ZWIĄZKI WĘGLA O : (s) O: (s) (s) (p z ) (p x ) (p y ) px py s 90 o? s 4 : (s) (s) (p x ) (p y ) (s) (s) (p x ) (p y ) (p z ) s pz px py s so : (s) s s.orbital MOLEKULARNY
Modelowanie molekularne
 Ck08 Modelowanie molekularne metodami chemii kwantowej Dr hab. Artur Michalak Zakład Chemii Teoretycznej Wydział Chemii UJ Wykład 7 http://www.chemia.uj.edu.pl/~michalak/mmod2007/ Podstawowe idee i metody
Ck08 Modelowanie molekularne metodami chemii kwantowej Dr hab. Artur Michalak Zakład Chemii Teoretycznej Wydział Chemii UJ Wykład 7 http://www.chemia.uj.edu.pl/~michalak/mmod2007/ Podstawowe idee i metody
Uniwersytet Śląski w Katowicach str. 1 Wydział Matematyki, Fizyki i Chemii
 Uniwersytet Śląski w Katowicach str. 1 Kierunek i poziom studiów: Chemia, drugi Sylabus modułu: Chemia teoretyczna (023) 1. Informacje ogólne koordynator modułu dr hab. Monika Musiał, prof. UŚ rok akademicki
Uniwersytet Śląski w Katowicach str. 1 Kierunek i poziom studiów: Chemia, drugi Sylabus modułu: Chemia teoretyczna (023) 1. Informacje ogólne koordynator modułu dr hab. Monika Musiał, prof. UŚ rok akademicki
9. Bazy funkcyjne. Mariusz Radoń r.
 24.03.2017 r. Bazy funkcyjne (1/2) W większości metod chemii kwantowej posługujemy się orbitalami molekularnymi (MO). Orbitale są przedstawiane jako liniowe kombinacje funkcji bazy: ϕ i ( r) = s C ai χ
24.03.2017 r. Bazy funkcyjne (1/2) W większości metod chemii kwantowej posługujemy się orbitalami molekularnymi (MO). Orbitale są przedstawiane jako liniowe kombinacje funkcji bazy: ϕ i ( r) = s C ai χ
Opis korelacji elektronowej w dużych układach molekularnych. Implementacja metodologii LT-AO-MP2
 Opis korelacji elektronowej w dużych układach molekularnych. metodologii Jakub Sumera Krzysztof Kowalczyk 7 stycznia 2009 roku Spis treści Wstęp 1 Wstęp 2 3 4 Plan pracy Wstęp implementacja AO MP2 kwadratowo
Opis korelacji elektronowej w dużych układach molekularnych. metodologii Jakub Sumera Krzysztof Kowalczyk 7 stycznia 2009 roku Spis treści Wstęp 1 Wstęp 2 3 4 Plan pracy Wstęp implementacja AO MP2 kwadratowo
c) prawdopodobieństwo znalezienia cząstki między x=1.0 a x=1.5 jest równe
 TEST 1. Ortogonalne i znormalizowane funkcje f 1 i f są funkcjami własnymi operatora, przy czym: f 1 =1.05 f 1 i f =.41 f. Stan pewnej cząstki opisuje znormalizowana funkcja 1 3 falowa = f1 f. Jakie jest
TEST 1. Ortogonalne i znormalizowane funkcje f 1 i f są funkcjami własnymi operatora, przy czym: f 1 =1.05 f 1 i f =.41 f. Stan pewnej cząstki opisuje znormalizowana funkcja 1 3 falowa = f1 f. Jakie jest
Wykład 16: Atomy wieloelektronowe
 Wykład 16: Atomy wieloelektronowe Funkcje falowe Kolejność zapełniania orbitali Energia elektronów Konfiguracja elektronowa Reguła Hunda i zakaz Pauliego Efektywna liczba atomowa Reguły Slatera Wydział
Wykład 16: Atomy wieloelektronowe Funkcje falowe Kolejność zapełniania orbitali Energia elektronów Konfiguracja elektronowa Reguła Hunda i zakaz Pauliego Efektywna liczba atomowa Reguły Slatera Wydział
że w wyniku pomiaru zmiennej dynamicznej A, której odpowiada operator αˆ otrzymana zostanie wartość 2.41?
 TEST. Ortogonalne i znormalizowane funkcje f i f są funkcjami własnymi operatora αˆ, przy czym: α ˆ f =. 05 f i α ˆ f =. 4f. Stan pewnej cząstki opisuje 3 znormalizowana funkcja falowa Ψ = f + f. Jakie
TEST. Ortogonalne i znormalizowane funkcje f i f są funkcjami własnymi operatora αˆ, przy czym: α ˆ f =. 05 f i α ˆ f =. 4f. Stan pewnej cząstki opisuje 3 znormalizowana funkcja falowa Ψ = f + f. Jakie
Stara i nowa teoria kwantowa
 Stara i nowa teoria kwantowa Braki teorii Bohra: - podane jedynie położenia linii, brak natężeń -nie tłumaczy ilości elektronów na poszczególnych orbitach - model działa gorzej dla atomów z więcej niż
Stara i nowa teoria kwantowa Braki teorii Bohra: - podane jedynie położenia linii, brak natężeń -nie tłumaczy ilości elektronów na poszczególnych orbitach - model działa gorzej dla atomów z więcej niż
Rzędy wiązań chemicznych
 Seminarium Magisterskie Rzędy wiązań chemicznych w ujęciu Teorii Komunikacji Opracowanie Dariusz Szczepanik Promotor Dr hab. Janusz Mrozek Rzędy wiązań chemicznych w ujęciu Teorii Komunikacji Plan prezentacji
Seminarium Magisterskie Rzędy wiązań chemicznych w ujęciu Teorii Komunikacji Opracowanie Dariusz Szczepanik Promotor Dr hab. Janusz Mrozek Rzędy wiązań chemicznych w ujęciu Teorii Komunikacji Plan prezentacji
Metody obliczeniowe ab initio w fizyce struktur atomowych. Wykład 1: Wstęp
 Metody obliczeniowe ab initio w fizyce struktur atomowych. Wykład 1: Wstęp dr inż. Paweł Scharoch, dr Jerzy Peisert Instytut Fizyki Politechniki Wrocławskiej, 03.02.2005r. Streszczenie: wyjaśnienie pojęcia
Metody obliczeniowe ab initio w fizyce struktur atomowych. Wykład 1: Wstęp dr inż. Paweł Scharoch, dr Jerzy Peisert Instytut Fizyki Politechniki Wrocławskiej, 03.02.2005r. Streszczenie: wyjaśnienie pojęcia
Liczby kwantowe n, l, m l = 0 l =1 l = 2 l = 3
 Liczby kwantowe Rozwiązaniem równania Schrödingera są pewne funkcje własne, które można scharakteryzować przy pomocy zestawu trzech liczb kwantowych n, l, m. Liczby kwantowe nie mogą być dowolne, muszą
Liczby kwantowe Rozwiązaniem równania Schrödingera są pewne funkcje własne, które można scharakteryzować przy pomocy zestawu trzech liczb kwantowych n, l, m. Liczby kwantowe nie mogą być dowolne, muszą
H H 2.5 < H H CH 3 N O O H C N ŁADUNEK FORMALNY. 2.5 dla atomu węgla C C 2.5 H 2.1. Li 1.0. liczba e - walencyjnych w atomie wolnym C 2.5 H 2.
 .5 dla atomu węgla ŁADUNEK RMALNY pierwiastek o mniejszej elektroujemności od węgla
.5 dla atomu węgla ŁADUNEK RMALNY pierwiastek o mniejszej elektroujemności od węgla
Różne typy wiązań mają ta sama przyczynę: energia powstającej stabilnej cząsteczki jest mniejsza niż sumaryczna energia tworzących ją, oddalonych
 Wiązania atomowe Atomy wieloelektronowe, obsadzanie stanów elektronowych, układ poziomów energii. Przykładowe konfiguracje elektronów, gazy szlachetne, litowce, chlorowce, układ okresowy pierwiastków,
Wiązania atomowe Atomy wieloelektronowe, obsadzanie stanów elektronowych, układ poziomów energii. Przykładowe konfiguracje elektronów, gazy szlachetne, litowce, chlorowce, układ okresowy pierwiastków,
WIĄZANIA. Co sprawia, że ciała stałe istnieją i są stabilne? PRZYCIĄGANIE ODPYCHANIE
 WIĄZANIA Co sprawia, że ciała stałe istnieją i są stabilne? PRZYCIĄGANIE ODPYCHANIE Przyciąganie Wynika z elektrostatycznego oddziaływania między elektronami a dodatnimi jądrami atomowymi. Może to być
WIĄZANIA Co sprawia, że ciała stałe istnieją i są stabilne? PRZYCIĄGANIE ODPYCHANIE Przyciąganie Wynika z elektrostatycznego oddziaływania między elektronami a dodatnimi jądrami atomowymi. Może to być
Lokalizacja Orbitali Molekularnych
 Lokalizacja Orbitali Molekularnych Regionalnie Zlokalizowane Orbitale Molekularne Marek Giebułtowski Seminarium magisterskie w Zakładzie Chemii Teoretycznej UJ Spis Treści 1 Przegład Metod Lokalizacyjnych
Lokalizacja Orbitali Molekularnych Regionalnie Zlokalizowane Orbitale Molekularne Marek Giebułtowski Seminarium magisterskie w Zakładzie Chemii Teoretycznej UJ Spis Treści 1 Przegład Metod Lokalizacyjnych
Hierarchia baz gaussowskich (5)
 Hierarchia baz gaussowskich (5) Bazy split-valence czyli VDZ, VTZ, etc. (np. bazy Pople a 6-31G, 6-311G, etc) Bazy split-valence spolaryzowane VDZP, VTZP, etc. Bazy bazy Dunninga (konsystentne korelacyjnie)
Hierarchia baz gaussowskich (5) Bazy split-valence czyli VDZ, VTZ, etc. (np. bazy Pople a 6-31G, 6-311G, etc) Bazy split-valence spolaryzowane VDZP, VTZP, etc. Bazy bazy Dunninga (konsystentne korelacyjnie)
Wstęp do Optyki i Fizyki Materii Skondensowanej
 Wstęp do Optyki i Fizyki Materii Skondensowanej Część I: Optyka, wykład 10 wykład: Piotr Fita pokazy: Andrzej Wysmołek ćwiczenia: Paweł Kowalczyk, Barbara Piętka Wydział Fizyki Uniwersytet Warszawski 2015/16
Wstęp do Optyki i Fizyki Materii Skondensowanej Część I: Optyka, wykład 10 wykład: Piotr Fita pokazy: Andrzej Wysmołek ćwiczenia: Paweł Kowalczyk, Barbara Piętka Wydział Fizyki Uniwersytet Warszawski 2015/16
Kontakt. Badania naukowe:
 Kontakt - tel.: 032 359 12 86 - email: awozniakowski@o2.pl - wydział: Informatyki i Nauki o Materiałach - instytut: Nauki o Materiałach - zakład/katedra: Modelowania materiałów - opiekun naukowy: dr hab.
Kontakt - tel.: 032 359 12 86 - email: awozniakowski@o2.pl - wydział: Informatyki i Nauki o Materiałach - instytut: Nauki o Materiałach - zakład/katedra: Modelowania materiałów - opiekun naukowy: dr hab.
Spis treści. Metoda VSEPR. Reguły określania struktury cząsteczek. Ustalanie struktury przestrzennej
 Spis treści 1 Metoda VSEPR 2 Reguły określania struktury cząsteczek 3 Ustalanie struktury przestrzennej 4 Typy geometrii cząsteczek przykłady 41 Przykład 1 określanie struktury BCl 3 42 Przykład 2 określanie
Spis treści 1 Metoda VSEPR 2 Reguły określania struktury cząsteczek 3 Ustalanie struktury przestrzennej 4 Typy geometrii cząsteczek przykłady 41 Przykład 1 określanie struktury BCl 3 42 Przykład 2 określanie
Teoria funkcjona lu g Density Functional Theory (DFT)
 Teoria funkcjona lu g estości Density Functional Theory (DFT) Cz eść slajdów tego wyk ladu pochodzi z wyk ladu wyg loszonego przez dra Lukasza Rajchela w Interdyscyplinarnym Centrum Modelowania Matematycznego
Teoria funkcjona lu g estości Density Functional Theory (DFT) Cz eść slajdów tego wyk ladu pochodzi z wyk ladu wyg loszonego przez dra Lukasza Rajchela w Interdyscyplinarnym Centrum Modelowania Matematycznego
ELEKTRONOWE. Streszczenie. - IP i EA. IP and EA
 * ELEKTRONOWE Streszczenie - IP i EA IP and EA * - 206 1. Wstęp Prognozowanie regioselektywności [4+2]π-elektronowych cykloaddycji na gruncie teorii PMO (Perturbations Molecular Orbital Theory) [1 3] wymaga
* ELEKTRONOWE Streszczenie - IP i EA IP and EA * - 206 1. Wstęp Prognozowanie regioselektywności [4+2]π-elektronowych cykloaddycji na gruncie teorii PMO (Perturbations Molecular Orbital Theory) [1 3] wymaga
Elektronowa struktura atomu
 Elektronowa struktura atomu Model atomu Bohra oparty na teorii klasycznych oddziaływań elektrostatycznych Elektrony mogą przebywać tylko w określonych stanach, zwanych stacjonarnymi, o określonej energii
Elektronowa struktura atomu Model atomu Bohra oparty na teorii klasycznych oddziaływań elektrostatycznych Elektrony mogą przebywać tylko w określonych stanach, zwanych stacjonarnymi, o określonej energii
Grupa Moniki Musiał. Uniwersytet Śląski Instytut Chemii Zakład Chemii Teoretycznej
 Wieloreferencyjna metoda sprzężonych klasterów w dwuwalencyjnych sektorach przestrzeni Focka oraz metoda równań ruchu w zastosowaniu do opisu stanów wzbudzonych Grupa Moniki Musiał Uniwersytet Śląski Instytut
Wieloreferencyjna metoda sprzężonych klasterów w dwuwalencyjnych sektorach przestrzeni Focka oraz metoda równań ruchu w zastosowaniu do opisu stanów wzbudzonych Grupa Moniki Musiał Uniwersytet Śląski Instytut
Wiązania chemiczne. Związek klasyfikacji ciał krystalicznych z charakterem wiązań atomowych. 5 typów wiązań
 Wiązania chemiczne Związek klasyfikacji ciał krystalicznych z charakterem wiązań atomowych 5 typów wiązań wodorowe A - H - A, jonowe ( np. KCl ) molekularne (pomiędzy atomami gazów szlachetnych i małymi
Wiązania chemiczne Związek klasyfikacji ciał krystalicznych z charakterem wiązań atomowych 5 typów wiązań wodorowe A - H - A, jonowe ( np. KCl ) molekularne (pomiędzy atomami gazów szlachetnych i małymi
3. Cząsteczki i wiązania
 3. Cząsteczki i wiązania Elektrony walencyjne Wiązania jonowe i kowalencyjne Wiązanie typu σ i π Hybrydyzacja Przewidywanie kształtu cząsteczek AX n Orbitale zdelokalizowane Cząsteczki związków organicznych
3. Cząsteczki i wiązania Elektrony walencyjne Wiązania jonowe i kowalencyjne Wiązanie typu σ i π Hybrydyzacja Przewidywanie kształtu cząsteczek AX n Orbitale zdelokalizowane Cząsteczki związków organicznych
Stany skupienia materii
 Stany skupienia materii Ciała stałe - ustalony kształt i objętość - uporządkowanie dalekiego zasięgu - oddziaływania harmoniczne Ciecze -słabo ściśliwe - uporządkowanie bliskiego zasięgu -tworzą powierzchnię
Stany skupienia materii Ciała stałe - ustalony kształt i objętość - uporządkowanie dalekiego zasięgu - oddziaływania harmoniczne Ciecze -słabo ściśliwe - uporządkowanie bliskiego zasięgu -tworzą powierzchnię
1 i 2. Struktura elektronowa atomów, tworzenie wiązań chemicznych
 1 i 2. Struktura elektronowa atomów, tworzenie wiązań chemicznych 1 1.1. Struktura elektronowa atomów Rozkład elektronów na pierwszych czterech powłokach elektronowych 1. powłoka 2. powłoka 3. powłoka
1 i 2. Struktura elektronowa atomów, tworzenie wiązań chemicznych 1 1.1. Struktura elektronowa atomów Rozkład elektronów na pierwszych czterech powłokach elektronowych 1. powłoka 2. powłoka 3. powłoka
Układ okresowy. Przewidywania teorii kwantowej
 Przewidywania teorii kwantowej Chemia kwantowa - podsumowanie Cząstka w pudle Atom wodoru Równanie Schroedingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - podsumowanie rozwiązanie Cząstka w pudle
Przewidywania teorii kwantowej Chemia kwantowa - podsumowanie Cząstka w pudle Atom wodoru Równanie Schroedingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - podsumowanie rozwiązanie Cząstka w pudle
Konwersatorium 1. Zagadnienia na konwersatorium
 Konwersatorium 1 Zagadnienia na konwersatorium 1. Omów reguły zapełniania powłok elektronowych. 2. Podaj konfiguracje elektronowe dla atomów Cu, Ag, Au, Pd, Pt, Cr, Mo, W. 3. Wyjaśnij dlaczego występują
Konwersatorium 1 Zagadnienia na konwersatorium 1. Omów reguły zapełniania powłok elektronowych. 2. Podaj konfiguracje elektronowe dla atomów Cu, Ag, Au, Pd, Pt, Cr, Mo, W. 3. Wyjaśnij dlaczego występują
Rozdział 22 METODA FUNKCJONAŁÓW GĘSTOŚCI Wstęp. Janusz Adamowski METODY OBLICZENIOWE FIZYKI 1
 Janusz Adamowski METODY OBLICZENIOWE FIZYKI 1 Rozdział 22 METODA FUNKCJONAŁÓW GĘSTOŚCI 22.1 Wstęp Definiujemy dla gazu elektronowego operatory anihilacji ψ σ (r) i kreacji ψ σ(r) pola fermionowego ψ σ
Janusz Adamowski METODY OBLICZENIOWE FIZYKI 1 Rozdział 22 METODA FUNKCJONAŁÓW GĘSTOŚCI 22.1 Wstęp Definiujemy dla gazu elektronowego operatory anihilacji ψ σ (r) i kreacji ψ σ(r) pola fermionowego ψ σ
Ćwiczenie # 1. Plik wejściowy dla czasteczki N 2. Omówienie elementów pliku wejściowego
 Ćwiczenie # 1. Obliczenia metoda Hartree-Focka dla czasteczek N 2 i O 2 Wykonamy dziś obliczenia energii elektronowej dla cząsteczek N 2 i O 2 metodą Hartree-Focka (HF). Dla zamkniętopowłokowej cząsteczki
Ćwiczenie # 1. Obliczenia metoda Hartree-Focka dla czasteczek N 2 i O 2 Wykonamy dziś obliczenia energii elektronowej dla cząsteczek N 2 i O 2 metodą Hartree-Focka (HF). Dla zamkniętopowłokowej cząsteczki
Dotyczy to zarówno istniejących już związków, jak i związków, których jeszcze dotąd nie otrzymano.
 Chemia teoretyczna to dział chemii zaliczany do chemii fizycznej, zajmujący się zagadnieniami związanymi z wiedzą chemiczną od strony teoretycznej, tj. bez wykonywania eksperymentów na stole laboratoryjnym.
Chemia teoretyczna to dział chemii zaliczany do chemii fizycznej, zajmujący się zagadnieniami związanymi z wiedzą chemiczną od strony teoretycznej, tj. bez wykonywania eksperymentów na stole laboratoryjnym.
Czy poprawki ZPV do stałych ekranowania zależą od konformacji? Przypadek dimetoksymetanu
 Czy poprawki ZPV do stałych ekranowania zależą od konformacji? Przypadek dimetoksymetanu Wojciech Migda Wydział Chemii, Uniwersytet Jagielloński, Kraków Bronowice, 1-2 XII 2004 Zero-Point Vibrational Corrections
Czy poprawki ZPV do stałych ekranowania zależą od konformacji? Przypadek dimetoksymetanu Wojciech Migda Wydział Chemii, Uniwersytet Jagielloński, Kraków Bronowice, 1-2 XII 2004 Zero-Point Vibrational Corrections
WYDZIAŁ CHEMICZNY Katedra Chemii Nieorganicznej. Chemia teoretyczna. laboratorium komputerowe. Andrzej Okuniewski, Aleksander Herman
 WYDZIAŁ CHEMICZNY Katedra Chemii Nieorganicznej Chemia teoretyczna laboratorium komputerowe Andrzej Okuniewski, Aleksander Herman Gdańsk 2017 Wybrane wielkości Prędkość światła: c = 299792458 m s 3,00
WYDZIAŁ CHEMICZNY Katedra Chemii Nieorganicznej Chemia teoretyczna laboratorium komputerowe Andrzej Okuniewski, Aleksander Herman Gdańsk 2017 Wybrane wielkości Prędkość światła: c = 299792458 m s 3,00
1. Przesłanki doświadczalne mechaniki kwantowej.
 1 Pytania egzaminacyjne: 1. Przesłanki doświadczalne mechaniki kwantowej. 2. Efekt fotoelektryczny- interpretacja Einsteina. 3. Efekt fotoelektryczny: jak skorelowana jest liczba wybijanych elektronów
1 Pytania egzaminacyjne: 1. Przesłanki doświadczalne mechaniki kwantowej. 2. Efekt fotoelektryczny- interpretacja Einsteina. 3. Efekt fotoelektryczny: jak skorelowana jest liczba wybijanych elektronów
Struktura elektronowa czasteczek. przybliżenie Borna-Oppenheimera. równania Schrödingera dla elektronów przy ustalonym po lożeniu jader
 Notatki do wyk ladu VII Struktura elektronowa czasteczek przybliżenie Borna-Oppenheimera rozwiazanie równania Schrödingera dla elektronów przy ustalonym po lożeniu jader przybliżenie jednoelektronowe metoda
Notatki do wyk ladu VII Struktura elektronowa czasteczek przybliżenie Borna-Oppenheimera rozwiazanie równania Schrödingera dla elektronów przy ustalonym po lożeniu jader przybliżenie jednoelektronowe metoda
Teorie wiązania chemicznego i podstawowe zasady mechaniki kwantowej Zjawiska, które zapowiadały nadejście nowej ery w fizyce i przybliżały
 WYKŁAD 1 Teorie wiązania chemicznego i podstawowe zasady mechaniki kwantowej Zjawiska, które zapowiadały nadejście nowej ery w fizyce i przybliżały sformułowanie praw fizyki kwantowej: promieniowanie katodowe
WYKŁAD 1 Teorie wiązania chemicznego i podstawowe zasady mechaniki kwantowej Zjawiska, które zapowiadały nadejście nowej ery w fizyce i przybliżały sformułowanie praw fizyki kwantowej: promieniowanie katodowe
Orbitale typu σ i typu π
 Orbitale typu σ i typu π Dwa odpowiadające sobie orbitale sąsiednich atomów tworzą kombinacje: wiążącą i antywiążącą. W rezultacie mogą powstać orbitale o rozkładzie przestrzennym dwojakiego typu: σ -
Orbitale typu σ i typu π Dwa odpowiadające sobie orbitale sąsiednich atomów tworzą kombinacje: wiążącą i antywiążącą. W rezultacie mogą powstać orbitale o rozkładzie przestrzennym dwojakiego typu: σ -
Teoria funkcjonału gęstości
 Teoria funkcjonału gęstości Łukasz Rajchel Interdyscyplinarne Centrum Modelowania Matematycznego i Komputerowego Uniwersytet Warszawski lrajchel1981@gmail.com Wykład dostępny w sieci: http://tiger.chem.uw.edu.pl/staff/lrajchel/
Teoria funkcjonału gęstości Łukasz Rajchel Interdyscyplinarne Centrum Modelowania Matematycznego i Komputerowego Uniwersytet Warszawski lrajchel1981@gmail.com Wykład dostępny w sieci: http://tiger.chem.uw.edu.pl/staff/lrajchel/
CHEMIA 1. INSTYTUT MEDICUS Kurs przygotowawczy na studia medyczne kierunek lekarski, stomatologia, farmacja, analityka medyczna ATOM.
 INSTYTUT MEDICUS Kurs przygotowawczy na studia medyczne kierunek lekarski, stomatologia, farmacja, analityka medyczna tel. 0501 38 39 55 www.medicus.edu.pl CHEMIA 1 ATOM Budowa atomu - jądro, zawierające
INSTYTUT MEDICUS Kurs przygotowawczy na studia medyczne kierunek lekarski, stomatologia, farmacja, analityka medyczna tel. 0501 38 39 55 www.medicus.edu.pl CHEMIA 1 ATOM Budowa atomu - jądro, zawierające
Teoretyczne badania reakcji odwodornienia borazanu katalizowanych przez kompleksy oparte na palladzie
 Teoretyczne badania reakcji odwodornienia borazanu katalizowanych przez kompleksy oparte na palladzie Monika Parafiniuk Praca wykonywana pod opieką dr Mariusza Mitoraja Cele pracy i plan prezentacji Cel
Teoretyczne badania reakcji odwodornienia borazanu katalizowanych przez kompleksy oparte na palladzie Monika Parafiniuk Praca wykonywana pod opieką dr Mariusza Mitoraja Cele pracy i plan prezentacji Cel
Wiązania kowalencyjne
 Wiązania kowalencyjne (pierw. o dużej E + pierw. o dużej E), E < 1,8 TERIE WIĄZANIA KWALENCYJNEG Teoria hybrydyzacji orbitali atomowych Teoria orbitali molekularnych Teoria pola ligandów YBRYDYZACJA RBITALI
Wiązania kowalencyjne (pierw. o dużej E + pierw. o dużej E), E < 1,8 TERIE WIĄZANIA KWALENCYJNEG Teoria hybrydyzacji orbitali atomowych Teoria orbitali molekularnych Teoria pola ligandów YBRYDYZACJA RBITALI
Inżynieria Biomedyczna. Wykład XII
 Inżynieria Biomedyczna Wykład XII Plan Wiązania chemiczne Teoria Lewisa Teoria orbitali molekularnych Homojądrowe cząsteczki dwuatomowe Heterojądrowe cząsteczki dwuatomowe Elektroujemność Hybrydyzacja
Inżynieria Biomedyczna Wykład XII Plan Wiązania chemiczne Teoria Lewisa Teoria orbitali molekularnych Homojądrowe cząsteczki dwuatomowe Heterojądrowe cząsteczki dwuatomowe Elektroujemność Hybrydyzacja
Program Obliczeń Wielkich Wyzwań Nauki i Techniki (POWIEW)
 Program Obliczeń Wielkich Wyzwań Nauki i Techniki (POWIEW) Maciej Cytowski, Maciej Filocha, Maciej E. Marchwiany, Maciej Szpindler Interdyscyplinarne Centrum Modelowania Matematycznego i Komputerowego
Program Obliczeń Wielkich Wyzwań Nauki i Techniki (POWIEW) Maciej Cytowski, Maciej Filocha, Maciej E. Marchwiany, Maciej Szpindler Interdyscyplinarne Centrum Modelowania Matematycznego i Komputerowego
Zastosowanie metody LDA do obliczeń stanów elektronowych wybranych układów nanoskopowych
 Uniwersytet Jagielloński Wydział Fizyki, Astronomii i Informatyki Stosowanej Instytut Fizyki im. Mariana Smoluchowskiego Zakład Teorii Materii Skondensowanej i Nanofizyki Magdalena Birowska Karolina Milowska
Uniwersytet Jagielloński Wydział Fizyki, Astronomii i Informatyki Stosowanej Instytut Fizyki im. Mariana Smoluchowskiego Zakład Teorii Materii Skondensowanej i Nanofizyki Magdalena Birowska Karolina Milowska
1,2 1,2. WYMAGANIA WSTĘPNE W ZAKRESIE WIEDZY, UMIEJĘTNOŚCI I INNYCH KOMPETENCJI 1. Brak
 Zał. nr 4 do ZW 33/01 WYDZIAŁ Podstawowych Problemów Techniki KARTA PRZEDMIOTU Nazwa w języku polskim Podstawy Chemii Ogólnej Nazwa w języku angielskim General Chemistry Kierunek studiów (jeśli dotyczy):
Zał. nr 4 do ZW 33/01 WYDZIAŁ Podstawowych Problemów Techniki KARTA PRZEDMIOTU Nazwa w języku polskim Podstawy Chemii Ogólnej Nazwa w języku angielskim General Chemistry Kierunek studiów (jeśli dotyczy):
Kraków, 16 grudnia 2014
 Prof. dr hab. Artur Michalak Zakład Chemii Teoretycznej Wydział Chemii Uniwersytet Jagielloński ul. R. Ingardena 3, 30-060 Kraków tel. +48-12-663-2217 fax. +48-12-634-0515 e-mail: michalak@chemia.uj.edu.pl
Prof. dr hab. Artur Michalak Zakład Chemii Teoretycznej Wydział Chemii Uniwersytet Jagielloński ul. R. Ingardena 3, 30-060 Kraków tel. +48-12-663-2217 fax. +48-12-634-0515 e-mail: michalak@chemia.uj.edu.pl
Symbol termu: edu (sumy ca lkowitego orbitalnego momentu edu i ca lkowitego spinu) Przyk lad: 2 P 3. kwantowa
 Notatki do wyk ladu VI (z 18.11.2013) Symbol termu: 2S+1 L (1) L -liczba kwantowa ca lkowitego orbitalnego momentu pedu Duże litery S, P, D, F, itd. dla L=0, 1, 2, 3, itd. 2S+1 - multipletowość; S - liczba
Notatki do wyk ladu VI (z 18.11.2013) Symbol termu: 2S+1 L (1) L -liczba kwantowa ca lkowitego orbitalnego momentu pedu Duże litery S, P, D, F, itd. dla L=0, 1, 2, 3, itd. 2S+1 - multipletowość; S - liczba
Sugerowana literatura: Podręczniki chemii ogólnej i/lub nieorganicznej Encyklopedie i leksykony
 1. Przemiany materii i reguły rządzące zapisywaniem równań reakcji chemicznych. - przemian fizyczna a przemiana chemiczna - rodzaje reakcji chemicznych (reakcje syntezy, analizy, rozkładu ; reakcje egzoi
1. Przemiany materii i reguły rządzące zapisywaniem równań reakcji chemicznych. - przemian fizyczna a przemiana chemiczna - rodzaje reakcji chemicznych (reakcje syntezy, analizy, rozkładu ; reakcje egzoi
Rezonansowe rozpraszanie ramanowskie. kontinuum stanów niezwiązanych na przykładzie dimeru glinu. Mariusz Radoń. Kraków,
 Rezonasowe rozpraszanie ramanowskie z udziałem kontinuum stanów niezwiązanych na przykładzie dimeru glinu Kraków, 11.05.2005 Dimer glinu, Al 2 : Skomplikowana struktura stanów elektronowych, wątpliwości
Rezonasowe rozpraszanie ramanowskie z udziałem kontinuum stanów niezwiązanych na przykładzie dimeru glinu Kraków, 11.05.2005 Dimer glinu, Al 2 : Skomplikowana struktura stanów elektronowych, wątpliwości
Fizyka atomowa r. akad. 2012/2013
 r. akad. 2012/2013 wykład VII - VIII Podstawy Procesów i Konstrukcji Inżynierskich Fizyka atomowa Zakład Biofizyki 1 Spin elektronu Elektrony posiadają własny moment pędu L s. nazwany spinem. Wartość spinu
r. akad. 2012/2013 wykład VII - VIII Podstawy Procesów i Konstrukcji Inżynierskich Fizyka atomowa Zakład Biofizyki 1 Spin elektronu Elektrony posiadają własny moment pędu L s. nazwany spinem. Wartość spinu
Teoria funkcjona lu g
 Notatki do wyk ladu XI Teoria funkcjona lu g estości Density Functional Theory - DFT Czy znajomość funkcji falowej jest niezb edna? Ψ(1,, 3,..., N) dla uk ladu N-elektronowego zależy od 4N zmiennych (dla
Notatki do wyk ladu XI Teoria funkcjona lu g estości Density Functional Theory - DFT Czy znajomość funkcji falowej jest niezb edna? Ψ(1,, 3,..., N) dla uk ladu N-elektronowego zależy od 4N zmiennych (dla
Właściwości chemiczne i fizyczne pierwiastków powtarzają się w pewnym cyklu (zebrane w grupy 2, 8, 8, 18, 18, 32 pierwiastków).
 Właściwości chemiczne i fizyczne pierwiastków powtarzają się w pewnym cyklu (zebrane w grupy 2, 8, 8, 18, 18, 32 pierwiastków). 1925r. postulat Pauliego: Na jednej orbicie może znajdować się nie więcej
Właściwości chemiczne i fizyczne pierwiastków powtarzają się w pewnym cyklu (zebrane w grupy 2, 8, 8, 18, 18, 32 pierwiastków). 1925r. postulat Pauliego: Na jednej orbicie może znajdować się nie więcej
Kierunek i poziom studiów: Chemia. Drugi. Sylabus modułu: Chemia kwantowa i modelowanie molekularne (0310-CH-S2-B-062)
 Uniwersytet Śląski w Katowicach str. 1 Kierunek i poziom studiów: Chemia. Drugi. Sylabus modułu: Chemia kwantowa i modelowanie molekularne (0310-CH-S2-B-062) 1. Informacje ogólne koordynator modułu dr
Uniwersytet Śląski w Katowicach str. 1 Kierunek i poziom studiów: Chemia. Drugi. Sylabus modułu: Chemia kwantowa i modelowanie molekularne (0310-CH-S2-B-062) 1. Informacje ogólne koordynator modułu dr
Zasady obsadzania poziomów
 Zasady obsadzania poziomów Model atomu Bohra Model kwantowy atomu Fala stojąca Liczby kwantowe -główna liczba kwantowa (n = 1,2,3...) kwantuje energię elektronu (numer orbity) -poboczna liczba kwantowa
Zasady obsadzania poziomów Model atomu Bohra Model kwantowy atomu Fala stojąca Liczby kwantowe -główna liczba kwantowa (n = 1,2,3...) kwantuje energię elektronu (numer orbity) -poboczna liczba kwantowa
Kwantowo-chemiczne badania struktur kompleksów neonikotyny z jonami miedzi (II) oraz cynku (II)
 Wydział Chemii Kwantowo-chemiczne badania struktur kompleksów neonikotyny z jonami miedzi (II) oraz cynku (II) Mgr Wojciech Jankowski Pracownia Chemii Kwantowej Wydział Chemii UAM w.jankowski@amu.edu.pl
Wydział Chemii Kwantowo-chemiczne badania struktur kompleksów neonikotyny z jonami miedzi (II) oraz cynku (II) Mgr Wojciech Jankowski Pracownia Chemii Kwantowej Wydział Chemii UAM w.jankowski@amu.edu.pl
Wykład 3: Atomy wieloelektronowe
 Wykład 3: Atomy wieloelektronowe Funkcje falowe Kolejność zapełniania orbitali Energia elektronów Konfiguracja elektronowa Reguła Hunda i zakaz Pauliego Efektywna liczba atomowa Reguły Slatera Wydział
Wykład 3: Atomy wieloelektronowe Funkcje falowe Kolejność zapełniania orbitali Energia elektronów Konfiguracja elektronowa Reguła Hunda i zakaz Pauliego Efektywna liczba atomowa Reguły Slatera Wydział
Temat Ocena dopuszczająca Ocena dostateczna Ocena dobra Ocena bardzo dobra Ocena celująca. Uczeń:
 Chemia - klasa I (część 2) Wymagania edukacyjne Temat Ocena dopuszczająca Ocena dostateczna Ocena dobra Ocena bardzo dobra Ocena celująca Dział 1. Chemia nieorganiczna Lekcja organizacyjna. Zapoznanie
Chemia - klasa I (część 2) Wymagania edukacyjne Temat Ocena dopuszczająca Ocena dostateczna Ocena dobra Ocena bardzo dobra Ocena celująca Dział 1. Chemia nieorganiczna Lekcja organizacyjna. Zapoznanie
Chemia I Semestr I (1 )
 1/ 6 Inżyniera Materiałowa Chemia I Semestr I (1 ) Osoba odpowiedzialna za przedmiot: dr inż. Maciej Walewski. 2/ 6 Wykład Program 1. Atomy i cząsteczki: Materia, masa, energia. Cząstki elementarne. Atom,
1/ 6 Inżyniera Materiałowa Chemia I Semestr I (1 ) Osoba odpowiedzialna za przedmiot: dr inż. Maciej Walewski. 2/ 6 Wykład Program 1. Atomy i cząsteczki: Materia, masa, energia. Cząstki elementarne. Atom,
Chemia bionieorganiczna / Rosette M. Roat-Malone ; red. nauk. Barbara Becker. Warszawa, Spis treści
 Chemia bionieorganiczna / Rosette M. Roat-Malone ; red. nauk. Barbara Becker. Warszawa, 2010 Spis treści Przedmowa IX 1. WYBRANE ZAGADNIENIA CHEMII NIEORGANICZNEJ 1 1.1. Wprowadzenie 1 1.2. Niezbędne pierwiastki
Chemia bionieorganiczna / Rosette M. Roat-Malone ; red. nauk. Barbara Becker. Warszawa, 2010 Spis treści Przedmowa IX 1. WYBRANE ZAGADNIENIA CHEMII NIEORGANICZNEJ 1 1.1. Wprowadzenie 1 1.2. Niezbędne pierwiastki
Atom wodoru w mechanice kwantowej. Równanie Schrödingera
 Fizyka atomowa Atom wodoru w mechanice kwantowej Moment pędu Funkcje falowe atomu wodoru Spin Liczby kwantowe Poprawki do równania Schrödingera: struktura subtelna i nadsubtelna; przesunięcie Lamba Zakaz
Fizyka atomowa Atom wodoru w mechanice kwantowej Moment pędu Funkcje falowe atomu wodoru Spin Liczby kwantowe Poprawki do równania Schrödingera: struktura subtelna i nadsubtelna; przesunięcie Lamba Zakaz
Ocena aromatyczności cząsteczek w oparciu o orbitale rzędów wiązań
 Seminarium Zakładu Chemii Teoretycznej i Zakładu Metod Obliczeniowych Chemii Ocena aromatyczności cząsteczek w oparciu o orbitale rzędów wiązań dr Dariusz Szczepanik Zakład Chemii Teoretycznej Kraków 2015
Seminarium Zakładu Chemii Teoretycznej i Zakładu Metod Obliczeniowych Chemii Ocena aromatyczności cząsteczek w oparciu o orbitale rzędów wiązań dr Dariusz Szczepanik Zakład Chemii Teoretycznej Kraków 2015
RJC. Wiązania Chemiczne & Slides 1 to 39
 Wiązania Chemiczne & Struktura Cząsteczki Teoria Orbitali & ybrydyzacja Slides 1 to 39 Układ okresowy pierwiastków Siły występujące w cząsteczce związku organicznego Atomy w cząsteczce związku organicznego
Wiązania Chemiczne & Struktura Cząsteczki Teoria Orbitali & ybrydyzacja Slides 1 to 39 Układ okresowy pierwiastków Siły występujące w cząsteczce związku organicznego Atomy w cząsteczce związku organicznego
S. Baran - Podstawy fizyki materii skondensowanej Wiązania chemiczne w ciałach stałych. Wiązania chemiczne w ciałach stałych
 Wiązania chemiczne w ciałach stałych Wiązania chemiczne w ciałach stałych typ kowalencyjne jonowe metaliczne Van der Waalsa wodorowe siła* silne silne silne pochodzenie uwspólnienie e- (pary e-) przez
Wiązania chemiczne w ciałach stałych Wiązania chemiczne w ciałach stałych typ kowalencyjne jonowe metaliczne Van der Waalsa wodorowe siła* silne silne silne pochodzenie uwspólnienie e- (pary e-) przez
Pasmowa teoria przewodnictwa. Anna Pietnoczka
 Pasmowa teoria przewodnictwa elektrycznego Anna Pietnoczka Wpływ rodzaju wiązań na przewodność próbki: Wiązanie jonowe - izolatory Wiązanie metaliczne - przewodniki Wiązanie kowalencyjne - półprzewodniki
Pasmowa teoria przewodnictwa elektrycznego Anna Pietnoczka Wpływ rodzaju wiązań na przewodność próbki: Wiązanie jonowe - izolatory Wiązanie metaliczne - przewodniki Wiązanie kowalencyjne - półprzewodniki
TEORIA PASMOWA CIAŁ STAŁYCH
 TEORIA PASMOWA CIAŁ STAŁYCH Skolektywizowane elektrony w metalu Weźmy pod uwagę pewną ilość atomów jakiegoś metalu, np. sodu. Pojedynczy atom sodu zawiera 11 elektronów o konfiguracji 1s 2 2s 2 2p 6 3s
TEORIA PASMOWA CIAŁ STAŁYCH Skolektywizowane elektrony w metalu Weźmy pod uwagę pewną ilość atomów jakiegoś metalu, np. sodu. Pojedynczy atom sodu zawiera 11 elektronów o konfiguracji 1s 2 2s 2 2p 6 3s
TEORIA FUNKCJONA LÓW. (Density Functional Theory - DFT) Monika Musia l
 TEORIA FUNKCJONA LÓW GȨSTOŚCI (Density Functional Theory - DFT) Monika Musia l PRZEDMIOT BADAŃ Uk lad N elektronów + K j ader atomowych Przybliżenie Borna-Oppenheimera Zamiast funkcji falowej Ψ(r 1,σ 1,r
TEORIA FUNKCJONA LÓW GȨSTOŚCI (Density Functional Theory - DFT) Monika Musia l PRZEDMIOT BADAŃ Uk lad N elektronów + K j ader atomowych Przybliżenie Borna-Oppenheimera Zamiast funkcji falowej Ψ(r 1,σ 1,r
Oddziaływania w magnetykach
 9 Oddziaływania w magnetykach Zjawiska dia- i paramagnetyzmu są odpowiedzią indywidualnych (nieskorelowanych) jonów dia- i paramagnetycznych na działanie pola magnetycznego. Z drugiej strony spontaniczne
9 Oddziaływania w magnetykach Zjawiska dia- i paramagnetyzmu są odpowiedzią indywidualnych (nieskorelowanych) jonów dia- i paramagnetycznych na działanie pola magnetycznego. Z drugiej strony spontaniczne
Układ okresowy. Przewidywania teorii kwantowej
 Przewidywania teorii kwantowej 1 Chemia kwantowa - podsumowanie Cząstka w pudle Atom wodoru Równanie Schroedingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - podsumowanie rozwiązanie Cząstka w pudle
Przewidywania teorii kwantowej 1 Chemia kwantowa - podsumowanie Cząstka w pudle Atom wodoru Równanie Schroedingera H ˆ = ˆ T e Hˆ = Tˆ e + Vˆ e j Chemia kwantowa - podsumowanie rozwiązanie Cząstka w pudle
Liczby kwantowe elektronu w atomie wodoru
 Liczby kwantowe elektronu w atomie wodoru Efekt Zeemana Atom wodoru wg mechaniki kwantowej ms = magnetyczna liczba spinowa ms = -1/2, do pełnego opisu stanu elektronu potrzebna jest ta liczba własność
Liczby kwantowe elektronu w atomie wodoru Efekt Zeemana Atom wodoru wg mechaniki kwantowej ms = magnetyczna liczba spinowa ms = -1/2, do pełnego opisu stanu elektronu potrzebna jest ta liczba własność
Małe, średnie i... nano. Modelowanie molekularne w Opolu (i nie tylko) Teobald Kupka, Małgorzata A. Broda
 Małe, średnie i... nano. Modelowanie molekularne w Opolu (i nie tylko) Badania podstawowe wspomagane obliczeniami w WCSS Teobald Kupka, Małgorzata A. Broda Uniwersytet Opolski, Wydział Chemii, Opole e-mail:
Małe, średnie i... nano. Modelowanie molekularne w Opolu (i nie tylko) Badania podstawowe wspomagane obliczeniami w WCSS Teobald Kupka, Małgorzata A. Broda Uniwersytet Opolski, Wydział Chemii, Opole e-mail:
TEORIA ORBITALI MOLEKULARNYCH (MO) dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
 TERIA RBITALI MLEKULARNYCH (M) Metoda (teoria) orbitali molekularnych (M) podstawy metody M - F. Hund, R.S. Mulliken Teoria M zakłada, że zachowanie się elektronu w cząsteczce opisuje orbital molekularny
TERIA RBITALI MLEKULARNYCH (M) Metoda (teoria) orbitali molekularnych (M) podstawy metody M - F. Hund, R.S. Mulliken Teoria M zakłada, że zachowanie się elektronu w cząsteczce opisuje orbital molekularny
Transport elektronów w biomolekułach
 Transport elektronów w biomolekułach Równanie Arrheniusa, energia aktywacji Większość reakcji chemicznych zachodzi ze stałą szybkości (k) zaleŝną od temperatury (T) i energii aktywacji ( G*) tej reakcji,
Transport elektronów w biomolekułach Równanie Arrheniusa, energia aktywacji Większość reakcji chemicznych zachodzi ze stałą szybkości (k) zaleŝną od temperatury (T) i energii aktywacji ( G*) tej reakcji,
BUDOWA ATOMU cd. MECHANIKA KWANTOWA
 BUDOWA ATOMU cd. ajmuje się opisem ruchu cąstek elementarnch, układ można opiswać posługując się współrędnmi określającmi położenie bądź pęd, współrędne określa się pewnm prbliżeniem, np. współrędną dokładnością
BUDOWA ATOMU cd. ajmuje się opisem ruchu cąstek elementarnch, układ można opiswać posługując się współrędnmi określającmi położenie bądź pęd, współrędne określa się pewnm prbliżeniem, np. współrędną dokładnością
Wstęp do Optyki i Fizyki Materii Skondensowanej
 Wstęp do Optyki i Fizyki Materii Skondensowanej Część I: Optyka, wykład 8 wykład: Piotr Fita pokazy: Andrzej Wysmołek ćwiczenia: Aneta Drabińska, Barbara Piętka, Paweł Kowalczyk Wydział Fizyki Uniwersytet
Wstęp do Optyki i Fizyki Materii Skondensowanej Część I: Optyka, wykład 8 wykład: Piotr Fita pokazy: Andrzej Wysmołek ćwiczenia: Aneta Drabińska, Barbara Piętka, Paweł Kowalczyk Wydział Fizyki Uniwersytet
Notatki do wyk ladu V (z ) Metoda Hartree-Focka (Hartree ego-focka)
 Notatki do wyk ladu V (z 03.11.014) Metoda Hartree-Focka (Hartree ego-focka) Metoda wariacyjna, w której przyjmuje sie, że przybliżona funkcja falowa, opisujaca stan uk ladu n-elektronowego ma postać wyznacznika
Notatki do wyk ladu V (z 03.11.014) Metoda Hartree-Focka (Hartree ego-focka) Metoda wariacyjna, w której przyjmuje sie, że przybliżona funkcja falowa, opisujaca stan uk ladu n-elektronowego ma postać wyznacznika
Chemia Ogólna wykład 1
 Chemia Ogólna wykład 1 Materia związki chemiczne cząsteczka http://scholaris.pl/ obojętne elektrycznie indywiduum chemiczne, złożone z więcej niż jednego atomu, które są ze sobą trwale połączone wiązaniami
Chemia Ogólna wykład 1 Materia związki chemiczne cząsteczka http://scholaris.pl/ obojętne elektrycznie indywiduum chemiczne, złożone z więcej niż jednego atomu, które są ze sobą trwale połączone wiązaniami
Wpływ heterocyklicznego ugrupowania na natywną konformację naturalnych peptydów
 Wpływ heterocyklicznego ugrupowania na natywną konformację naturalnych peptydów Monika Staś, Dawid Siodłak, Małgorzata Broda mstas@uni.opole.pl Zakład Chemii Fizycznej i Modelowania Molekularnego Wydział
Wpływ heterocyklicznego ugrupowania na natywną konformację naturalnych peptydów Monika Staś, Dawid Siodłak, Małgorzata Broda mstas@uni.opole.pl Zakład Chemii Fizycznej i Modelowania Molekularnego Wydział
3. Cząsteczki i wiązania
 20161020 3. Cząsteczki i wiązania Elektrony walencyjne Wiązania jonowe i kowalencyjne Wiązanie typu σ i π Hybrydyzacja Przewidywanie kształtu cząsteczek AX n Orbitale zdelokalizowane Cząsteczki związków
20161020 3. Cząsteczki i wiązania Elektrony walencyjne Wiązania jonowe i kowalencyjne Wiązanie typu σ i π Hybrydyzacja Przewidywanie kształtu cząsteczek AX n Orbitale zdelokalizowane Cząsteczki związków
EWA PIĘTA. Streszczenie pracy doktorskiej
 EWA PIĘTA Spektroskopowa analiza struktur molekularnych i procesu adsorpcji fosfinowych pochodnych pirydyny, potencjalnych inhibitorów aminopeptydazy N Streszczenie pracy doktorskiej wykonanej na Wydziale
EWA PIĘTA Spektroskopowa analiza struktur molekularnych i procesu adsorpcji fosfinowych pochodnych pirydyny, potencjalnych inhibitorów aminopeptydazy N Streszczenie pracy doktorskiej wykonanej na Wydziale
