Transformacja plazmoblastyczna i pozaszpikowa progresja szpiczaka plazmocytowego u chorych leczonych talidomidem
|
|
|
- Ludwik Wieczorek
- 6 lat temu
- Przeglądów:
Transkrypt
1 PRACA ORYGINALNA Original Article Acta Haematologica Polonica 2011, 42, Nr 4, str MARIA KRAJ, BERNADETA CEGLAREK, MONIKA CHEŁSTOWSKA, TOMASZ SZPILA, RENATA HAGEDORNA-TRONINA, RYSZARD POGŁÓD, EWA MENDEK-CZAJKOWSKA, KRZYSZTOF WARZOCHA, RENATA MARYNIAK, BARBARA KRUK Transformacja plazmoblastyczna i pozaszpikowa progresja szpiczaka plazmocytowego u chorych leczonych talidomidem Plasmablastic transformation and extramedullary disease progression in multiple myeloma patients treated with thalidomide Instytut Hematologii i Transfuzjologii w Warszawie Dyrektor: Prof. dr hab. med. Krzysztof Warzocha STRESZCZENIE Badaniom poddano 93 chorych na szpiczaka plazmocytowego leczonych talidomidem. Pozaszpikową progresję choroby w trakcie leczenia talidomidem stwierdzono u 7 chorych (7,5%), a u 1 chorego bez związku z takim leczeniem. W 4 przypadkach plazmoblastyczne nowotworowe nacieki pozaszpikowe, w tym 2 o obrazie chłoniaka plazmoblastycznego, obejmowały tkanki miękkie o róŝnych lokalizacjach nie mające związku z układem kostnym (skóra, tkanka podskórna, ściana klatki piersiowej, przykręgosłupowo), w 1 przypadku węzły chłonne, w 1 przypadku takŝe trzustkę i ośrodkowy układ nerwowy; a w 3 przypadkach była to białaczka plazmocytowa. Mediana czasu do agresywnej pozaszpikowej progresji choroby wynosiła 6 miesiecy od rozpoczęcia leczenia talidomidem, 16 miesięcy od ustalenia rozpoznania szpiczaka plazmocytowego, a mediana czasu przeŝycia od wystąpienia progresji pozaszpikowej 2 miesiące. Nasze obserwacje sugerują, Ŝe talidomid wpływa początkowo na bardziej dojrzałe plazmocytowe komórki nowotworowe, zmniejszając ich ilość w szpiku i powoduje, Ŝe względnie niedojrzałe komórki szpiczakowe wymykają się ze środowiska szpiku. W pracy przedyskutowano takŝe występowanie drugiego pierwotnego nowotworu u chorych leczonych lekami immunomodulującymi. SŁOWA KLUCZOWE: Szpiczak plazmocytowy Talidomid Pozaszpikowa progresja Drugi pierwotny nowotwór SUMMARY The survey was carried out on 93 multiple myeloma patients treated with thalidomide. In 7 patients (7,5%) extramedullary disease developed during the thalidomide treatment and in 1 patient with no relation to thalidomide treatment. All patients examined developed anaplastic and plasmablastic extramedullary disease (including 2 cases with a feature of plasmablastic lymphoma) of various sites, including skin, subcutaneous tissue, chest wall not attached to bone, paraspinal, lymph nodes, pancreas, central nervous system, cerebrospinal fluid and in 3 cases it was plasma cell leukemia. The median time to aggressive extramedullary progression of disease was 6 months from the onset of thalidomide therapy and 18 months from multiple myeloma diagnosis. The median survival from the extramedullary progression was 2 months. Our observations suggest that thalidomide is effective in initially reducing a more mature plasma cell compartment confined to the bone marrow, and allows a relatively immature myeloma cell compartment to escape the marrow microenvironment. Risk of subsequent primary malignancies in patients with multiple myeloma treated with immunomodulatory agents was also discussed in the paper. KEY WORDS: Multiple myeloma Thalidomide Extramedullary progression Second primary malignancy WSTĘP Aktualnie zainteresowanie budzi zwiększona w ostatnich latach częstotliwość występowania lokalizacji pozaszpikowej rozrostu plazmocytowego u chorych na szpiczaka plazmocytowego [1]. Istnieją kontrowersje na temat czy nowe leki talidomid, lenalidomid, bortezomib, a takŝe wysokodawkowa
2 690 M. KRAJ i wsp. chemioterapia z autotransplantacją komórek macierzystych zwiększają ryzyko rozrostu pozaszpikowego [2] i wystąpienia drugiego pierwotnego nowotworu [3 8]. Talidomid jest czynnikiem antyangiogennym i immunomodulującym. Stosując go u chorych z oporną na leczenie postacią szpiczaka, lub w przypadku nawrotu tego nowotworu, moŝna spodziewać się odpowiedzi na leczenie u 25 64% chorych [9 16]. Jednak skuteczność talidomidu u chorych, u których szpiczak umiejscowiony jest w tkankach miękkich, pozostaje kwestią sporną [17]. Bladé i wsp. [18] oraz Rosiňol i wsp. [19] wykazali, Ŝe u chorych z pozaszpikowym umiejscowieniem szpiczaka odpowiedź na leczenie była zła (0 vs 59%, p=0,0006). Podobnie Pour i wsp. [20] podkreślają bardzo złe rokowanie u chorych na szpiczaka z rozrostem pozaszpikowym, nawet leczonych nowymi lekami. Przeciwnie, Biagi i wsp. [21] opisali przypadki trzech chorych z pozaszpikową wznową szpiczaka po allogenicznym przeszczepie szpiku, którzy odpowiedzieli na leczenie talidomidem, podczas gdy Trojan i wsp. [22] obserwowali prawie całkowitą regresję pozaszpikowej masy szpiczaka dzięki zastosowaniu talidomidu w przypadku opornej na leczenie postaci szpiczaka. RównieŜ Katodritou i wsp. [23] opublikowali dane dowodzące skuteczności leczenia połączeniem talidomidu z deksametazonem w przypadku leczenia szpiczaka zlokalizowanego w zatoce jamistej. Pojawienie się pozaszpikowych lokalizacji szpiczaka w kontekście stosowania leczenia talidomidem ma duŝe znaczenie, aczkolwiek w chwili obecnej doniesienia te są rzadkie [19, 24 27]. Avigdor i wsp. [24] opisali pozaszpikowy postęp choroby pomimo dobrej odpowiedzi ze strony zmian w obrębie szpiku u chorych ze szpiczakiem plazmocytowym leczonym talidomidem. Opisywano równieŝ nacieki plazmocytowe w wątrobie jako wyraz nawrotu w przypadku szpiczaka plazmocytowego leczonego talidomidem [25]. Saba i wsp. [26] opisali przypadki 6 chorych z agresywną pozaszpikową postacią choroby, która pojawiła się po leczeniu talidomidem. U wszystkich tych chorych stwierdzano szpiczaka plazmocytowego w stadium III i wszyscy oni rozwinęli po leczeniu talidomidem zmiany anaplastyczne w lokalizacjach pozaszpikowych, w tym w obrębie skóry, opony twardej, zatok czołowych, ściany klatki piersiowej, mięśnia lędźwiowego oraz płuc. W Klinice Hematologii Instytutu Hematologii i Transfuzjologii w Warszawie spośród pierwszych 32 chorych na szpiczaka plazmocytowego, których leczono talidomidem [15] u 3 wystąpiła pozaszpikowa progresja i było to tematem pierwszych publikacji [28, 29]. W niniejszej pracy przedstawiamy przypadki 8 chorych, którzy rozwinęli objawy pozaszpikowej proliferacji nowotworowej. Dane te były wcześniej przedstawiane na zjazdach naukowych oraz opublikowane w formie streszczeń [30, 31]. MATERIAŁ I METODY Badaniom poddano 93 chorych na szpiczaka plazmocytowego leczonych talidomidem do 2010 r. Pozaszpikową progresję choroby w trakcie leczenia talidomidem stwierdzono u 7 chorych. Przedmiotem szczegółowej analizy jest tych 7 przypadków a mianowicie: przypadek 1 z blastycznymi naciekami plazmocytowymi w węźle chłonnym, przypadek 2 z naciekami plazmoblastycznymi w tkankach miękkich okolicy nadłopatkowej, nadobojczykowej, bocznej szyi, przypadek 3 z naciekami szpiczakowymi, nie mającymi związku z układem kostnym w tkankach miękkich ściany klatki piersiowej i białaczką?, przypadek 4 z guzkami skórnymi z naciekami szpiczaka w tkance podskórnej, przypadek 5 z białaczką plazmocytową i guzkami skórnymi, przypadek 6 z białaczką plazmocytową i przypadek 7 takŝe z białaczką plazmocytową. Przypadek 8 stanowi chory na szpiczaka plazmocytowego z progresją pozaszpikową o charakterze chłoniaka plazmoblastycznego, który uprzednio nie był leczony talidomidem. Wystąpienie odpowiedzi na leczenie talidomidem uznawano u chorych, u których doszło do obni- Ŝenia wyjściowego stęŝenia białka monoklonalnego w surowicy o co najmniej 50%, obniŝenia stęŝenia białka Bence Jonesa w moczu o ponad 90% i redukcji odsetka plazmocytów w szpiku o co najmniej 50%.
3 Transformacja plazmoblastyczna 691 WYNIKI BADAŃ W tabelach 1 3 zestawiono wyniki badań kliniczno-laboratoryjnych poszczególnych chorych. Przypadek pierwszy to chory (lat 54) od roku 2004 na szpiczaka plazmocytowego IgGκ. Leczenie według schematów VAD i EDAP dały częściową remisję. Chory otrzymywał talidomid w dawce mg/d od kwietnia do sierpnia 2006 kiedy wystąpiło powiększenie podŝuchwowych węzłów chłonnych spowodowane naciekiem blastycznych plazmocytów CD38 +, CD20, CD3, CD79a, CD56, cyklina D1 z wysokim 90% MIB1, plazmocytozą w szpiku 0,5%, białkiem M-2,63 g/dl. W listopadzie 2006 roku wystąpiła progresja choroby z białkiem M 4,9 g/dl i w styczniu 2007 zgon. Tabela 1. Wyniki badań chorych na szpiczaka plazmocytowego w chwili progresji pozaszpikowej choroby Table 1. Results of study in multiple myeloma patients at the time of extramedullary progression Chory Płeć Wiek (lata) Plazmocyty w szpiku (%) Białko M g/dl Osteoliza Niewydolność nerek 1. M 54 0,5 IgGκ 3, M IgAλ 4,2 + Ca BJλ 1,3g/24h 3. M IgGλ 1, M 60 IgGκ 6, K IgAλ BJλ 1-13g/24h M 71 2/3 anaplastyczny 1/3 plazmocyty 80% BJλ 3,25g/24h + Ca + 7. M IgGκ 4, M IgAκ 1,57 W przypadku drugim, chory (lat 43) na szpiczaka plazmocytowego IgAλ III A otrzymywał talidomid w dawce 100 mg/d (8 cykli CTD) od grudnia 2008 roku do września 2009 z częściową odpowiedzią. We wrześniu 2009 roku wystąpiła progresja choroby z postępem osteolizy, wzrostem białka M 4,36 g/dl, β 2M 6,7 mg/l, plazmocytozą w szpiku 98%, guzami w tkankach miękkich klatki piersiowej złoŝonymi z anaplastycznych komórek z wyraźnymi kwasochłonnymi jąderkami i duŝych komórek jednojądrowych lub z wielopłatowymi jądrami. Te VsCD38c + komórki były PAX + /, CD38, CD138, CD56, LCA, CD20, CD79a z 10% MIB1. Obraz odpowiadał rozpoznaniu chłoniaka plazmoblastycznego (Ryc.1). Leczenie PAD, MP, EDAP było nieskuteczne; chory zmarł w styczniu 2010 roku. W trzecim przypadku, chorego (lat 60) na szpiczaka plazmocytowego IgGκ od grudnia 2001 roku leczono według programów VAD, VMCP, VBAP, a następnie talidomidem (CTD od maja do sierpnia 2006 roku) bez odpowiedzi. W styczniu 2007 nastąpiła progresja choroby ze skórnymi guzami szpiczakowymi złoŝonymi z atypowych plazmocytów. W czwartym przypadku, u chorego (lat 62) na szpiczaka plazmocytowego IgGλ ( w szpiku 90% plazmocytów, IgGλ 6,7 g/dl, osteoliza) talidomid (4 cykle CTD od grudnia 2008 roku do kwietnia 2009 roku) spowodował częściową remisję. W kwietniu 2009 roku wystąpiła pozaszpikowa progresja choroby z guzami w tkankach miękkich klatki piersiowej, leczona według schematu PAD (bortezomib, adriblastyna, deksametazon). W czerwcu 2009 roku nastąpiły dalsza pozaszpikowa progresja choroby (Ig- Gλ 0,9 g/dl, WBC /l, niewydolność nerek) i zgon. W piątym przypadku, u chorej (lat 57) na szpiczaka plazmocytowego leczonej talidomidem (6 cykli CTD od stycznia do sierpnia 2009 roku) z częściową odpowiedzią, w ósmym miesiącu leczenia wystąpiła białaczka plazmocytowa o gwałtownym przebiegu (we krwi 4, /l komórek plazmatycznych CD38 ++, CD138 +, CD56 +,CD49 +, CD29 +, CD126 +, CD11a, CD18 ; w szpiku 70% komórek blastycznych o identycznym immunofenotypie) ze skórnymi guzami szpiczakowymi, niewydolnością nerek i 1,0 g/dl 13 g/24 godz. białka Bence Jonesa typu lambda w moczu.
4 692 M. KRAJ i wsp. Tabela 2. Leczenie i czas przeŝycia chorych na szpiczaka plazmocytowego, u których wystąpiła progresja pozaszpikowa choroby Table 2. Treatment and survival of multiple myeloma patients with extramedullary progression Przypadek Leczenie 1. VAD, EDAP, Talidomid mg/d 2. CTD, PAD, EDAP, MP, Rtx Odpowiedź na Talidomid Miejsce nacieków pozaszpikowych Czas do pozaszpikowej progresji (miesiące) od rozpoczęcia leczenia Talidomidem od rozpoznania szpiczaka Czas przeŝycia od progresji pozaszpikowej (miesiące) + Węzły chłonne Tm ok. nadłopatkowej, nadobojczykowej, szyi, przymostkowej 3. CTD, PAD, Rtx + Tm klatki piersiowej, przykręgosłupowo, guz Th VAD, VMCP, + Guzki podskórne VBAP, Rtx, CTD, CD 5. CTD, PAD + Białaczka plazmocytowa, Guzki podskórne VAD, M, VMBCP, Talidomid mg/d 7. VAD,EDAP, Rtx, Talidomid mg/d 8. VAD, 60 Co, VCD, EDAP, CTD, VMBCP ± Białaczka plazmocytowa + Białaczka plazmocytowa Tm pośladków, ramienia, uda, przykręgosłupowo trzustka, OUN Objaśnienia skrótów: VAD winkrystyna, adriblastyna, deksametazon; EDAP etopozyd, deksametazon, arabinozyd cytozyny, cisplatyna; CTD cyklofosfamid, talidomid, deksametazon; PAD bortezomib, adriblastyna, deksametazon; VCD bortezomib, cyklofosfamid, deksametazon; VMCP winkrystyna, melfalan, cyklofosfamid, prednizon; VBAP winkrystyna, BCNU, adriblastyna, prednizon; VMBCP winkrystyna, melfalan, BCNU, cyklofosfamid, prednizon; CD cyklofosfamid, deksametazon; MP melfalan, prednizon; Rtx, 60 Co napromienianie; OUN ośrodkowy układ nerwowy, Tm tkanki miękkie. W szóstym przypadku, u pacjenta (lat 71) z chorobą lekkiego łańcucha lambda od kwietnia 2005 roku, leczenie VAD, melfalan, VMBCP powodowało jedynie stabilizację choroby. Od marca do sierpnia 2006 roku leczono go talidomidem mg/d. W szóstym miesiącu leczenia wystąpiła białaczka plazmocytowa (we krwi komórki plazmatyczne o fenotypie CD38 ++, CD138 +, CD56 stanowiły 26% krwinek białych), hiperkalcemia, niewydolność nerek i w moczu BJλ 3,25 g/dl. Szpik był częściowo aplastyczny a częściowo bogatokomórkowy z naciekami plazmocytów CD138 + do 80%. W siódmym przypadku, u chorego (lat 50) na szpiczaka plazmocytowego IgGκ naciekającym Th3 od czerwca 2004 roku nie osiągnięto remisji leczeniem laminektomią, napromienianiem kręgosłupa, VAD i EDAP. Talidomid, w dawce mg/d chory otrzymywał od maja do listopada 2006 roku. Po 2 miesiącach leczenia plazmocytoza w szpiku zmniejszyła się z 93% do 4%, białko M z 4,7 g/dl do 2,0 g/dl. W listopadzie 2006 r. wystąpiła białaczka plazmocytowa (we krwi komórki plazmatyczne CD138 +, CD56 +, stanowiły 40% krwinek białych, w szpiku plazmocyty 83%.
5 Transformacja plazmoblastyczna 693 Tabela 3. Charakterystyka histopatologiczna i immunologiczna komórek nowotworowych progresji pozaszpikowej szpiczaka Table 3. Histopathological and immunological characteristic of neoplastic cells in extramedullary multiple myeloma progression Przypadek Charakterystyka komórek nowotworowych 1 Powiększony węzeł chłonny zawierał rozlane nacieki z blastycznych plazmocytów CD38 +, które zacierały jego prawidłową strukturę. Komórki CD38 + cechował bardzo wysoki wskaźnik proliferacyjny-mib-1 90%. Były one CD20, CD3, CD79a, CD56 i nie wykazywały cykliny D1. 2 Guz okolicy nadłopatkowej zawierał utkanie nowotworu z duŝych anaplastycznych komórek z wyraźnymi kwasochłonnymi jąderkami i wśród nich nielicznymi bardzo duŝymi komórkami jednojadrowymi lub z wielo-płatowymi jądrami. Te VsCD38c +, komórki były PAX±, CD38, CD138, CD56, LCA, CD20, CD79a, i w 10% komórek MIB-1 chłoniak plazmoblastyczny (Ryc. 1) 4 W badanym wycinku guzka skóry w tkance podskórnej stwierdzono masywny naciek z atypowych komórek szpiczaka. 5 Białaczka plazmocytowa: Krew-krwinki białe 26, /l, komórki plazmatyczne o fenotypie CD38 +, CD138 +, CD56 +, CD54 +, CD49 +, CD29 +, CD126 +, CD11, CD18 stanowiły 20% 4, /l. Szpik-komórki blastyczne 70% o fenotypie jak komórki we krwi. 6 Białaczka plazmocytowa: Krew-komórki plazmatyczne CD38 ++, CD138 +, CD56 stanowiły 26% krwinek białych. 7 Białaczka plazmocytowa: Krew-komórki plazmatyczne o fenotypie CD138 +, CD56 +, CD54 +, CD126 +, CD49 +, CD11a, CD19 stanowiły 40% krwinek białych 1, /l. 8 W wycinkach guzów pośladka i ramienia stwierdzono masywne nacieki z duŝych komórek o morfologii centroblastów i immunoblastów. Wśród nich obecne były równieŝ atypowe plazmocyty. Komórki te były: CD138 +, CD38 +, VsCD38c +, MUM1 +, CD79a, CD56 chłoniak plazmoblastyczny. Przypadek 8 U 45-letniego męŝczyzny w czerwcu 2009 r. ustalono rozpoznanie szpiczaka plazmocytowego na podstawie plazmocytozy w szpiku 15% w trepanobiopsji, obecności w surowicy białka monoklonalnego IgAκ w stęŝeniu 1,0 g/dl, patologicznego, na tle nacieku plazmocytowego, złamania kręgu L-4 (ale bez zmian osteoliycznych w przeglądowym badaniu radiologicznym kośća, hiperkalcemii i białkomoczu). Zastosowano leczenie wg programu VAD (winkrystyna, adriblastyna, deksametazon) i napromienianie okolicy Th12-L4 dawką 3000 cgy. Po 3 cyklach VAD wystąpiła zakrzepica Ŝył głębokich. W grudniu 2009 r. stwierdzono nacieki nowotworowe w tkance podskórnej obu pośladków i ramienia złoŝone z duŝych komórek o morfologii centroblastów i immunoblastów, a wśród nich takŝe atypowych plazmocytów. Komórki te były CD138 +, CD38 +, VsCD38c +, MUM1 +, CD79, CD56. Obraz odpowiadał rozpoznaniu chłoniaka plazmoblastycznego. W tym czasie liczba plazmocytów w szpiku wynosiła 25%, a stęŝenie IgAκ w surowicy 1,57 g/dl. Włączono leczenie wg programu VCD (bortezomib, cyklofosfamid, deksametazon). Po trzecim cyklu CVD uzyskano częściową remisję, a w czasie trwania piątego cyklu VCD wystąpiła progresja rozrostu ze wzrostem liczby atypowych komórek plazmatycznych w szpiku do 100%, naciekami w tkankach przykręgosłupowych, guzem plazmocytowym trzustki, wzrostem aktywności dehydrogenazy mleczanowej (LDH) w surowicy do 1000 U/l. Włączono leczenie wg programu EDAP i po jego czterech cyklach wystąpiła remisja - białko IgAκ wykrywalne tylko w immunofiksacji surowicy, w trepanobiopsji szpiku nacieki szpiczaka 1 3%. Po piątym cyklu EDAP w sierpniu 2010 r. przeprowadzono kolekcję komórek macierzystych hematopoezy. Kolejna progresja choroby we wrześniu 2010 r. objawiała się naciekami nowotworowymi w tkankach miękkich uda (2 guzki o Ø 2 3 cm), szyi i okolicy nadobojczykowej (pakiet węzłowy wielkości 6 8 cm), ośrodkowym układzie nerwowym (OUN). W badaniu CT i rezonansie magnetycznym głowy stwierdzono zmiany naciekowe w płatach potylicznych i ciemieniowym. W płynie mózgowo-rdzeniowym pleocytoza wyno-
6 694 M. KRAJ i wsp. Ryc. 1A. Chłoniak plazmoblastyczny, duŝe komórki przypominają immunoblasty (barwienie H+E, duŝe powiększenie) Fig. 1A. Plasmablastic lymphoma, large cells resembling immunoblasts (H+E staining, high magnification) siła 146 komórek/µl, z obecnością 90% komórek o fenotypie plazmocytów. Stosowano leczenie wg programu CTD (cyklofosfamid, talidomid, deksametazon), a następnie VMBCP oraz dokanałowo metotreksat, cytosar, depocyt, deksametazon z krótkotrwałą poprawą wyraŝającą się takŝe zmniejszeniem pleocytozy w płynie mózgowo-rdzeniowym do 4 komórek/µl. Chory zmarł w grudniu 2010 r. wśród objawów narastającej progresji pozaszpikowej choroby zwłaszcza w obrębie OUN z wysokimi wartościami LDH, CRP 332 mg/l, β2m w surowicy, ale z białkiem IgAκ wykrywalnym tylko w immunofiksacji w surowicy, bez białkomoczu i bez osteolizy. DYSKUSJA Spośród 93 chorych otrzymujących w naszym ośrodku talidomid z powodu szpiczaka plazmocytowego [15, 30, 31] u siedmiu rozwinęły się objawy proliferacji pozaszpikowej. W jednym przypadku, opisanym uprzednio [29], było to zajęcie węzłów chłonnych przez nacieki blastycznych komórek plazmatycznych, w 4 przypadkach zajęcie tkanek miękkich o róŝnych lokalizacjach nie mających związku z układem kostnym, a w 3 przypadkach pozaszpikowy przebieg choroby przyjął postać białaczki plazmocytowej. Mediana czasu od rozpoczęcia leczenia talidomidem do wystąpienia pozaszpikowej progresji wynosiła 6 miesięcy (zakres 5 9 miesięcy), a od rozpoznania szpiczaka plazmocytowego 16 miesięcy (zakres: 5 72 miesiące). W przypadku opisanych przez Sabę i wsp. [26] 6 chorych, u których po leczeniu talidomidem doszło do rozwoju anaplastycznej formy pozaszpikowej szpiczaka plazmocytowego, mediana czasu do progresji do pozaszpikowej formy choroby sięgnęła 11,5 miesiąca (zakres: 2 24 miesiące).
7 Transformacja plazmoblastyczna 695 Ryc. 1B. Dodatni odczyn Vs38c w komórkach chłoniaka Fig. 1B. Positive staining with Vs38s in the lymphoma cells W przypadku chorego opisanego jako przypadek pierwszy progresja choroby podczas leczenia talidomidem objawiła się jako naciek węzłów chłonnych, składający się z komórek CD38 + CD138 + oraz jako nasilenie osteolizy, przebiegające bez wzrostu stęŝenia białka M i odsetka komórek plazmatycznych w szpiku. Szpiczak węzłów chłonnych jest bardzo rzadką postacią choroby [32 34]. Rosiňol i wsp. [19] równieŝ opisują brak odpowiedzi lub progresję choroby u pacjentów z nawrotowym szpiczakiem, leczonym talidomidem. W przedstawionej przez nich serii chorych odpowiedź serologiczną (tj. zmniejszenie stęŝenia białka M) obserwowano u czterech chorych z naciekami szpiczakowymi w tkankach miękkich, ale odpowiedź ta w Ŝadnym przypadku nie wiązała się ze zmniejszeniem masy zmian pozaszpikowych. Jeden chory wolny od zmian pozaszpikowych w momencie włączenia leczenia talidomidem rozwinął zmiany pozagałkowe oraz liczne zmiany w tkankach miękkich, w trakcie utrzymywania się odpowiedzi serologicznej, a drugi chory, u którego nie obserwowano podwyŝszonego stęŝenia białka M, rozwinął zmianę w rejonie przedmostkowym wkrótce po rozpoczęciu leczenia talidomidem. Co więcej, jeden chory z długotrwałą odpowiedzią na leczenie talidomidem doznał nawrotu choroby pod postacią licznych złamań patologicznych kości długich, spowodowanych obecnością rozległych zmian osteolitycznych, pomimo iŝ nie obserwowano u niego podwyŝszenia stęŝenia białka M. Anagnostopoulos i wsp. [35] stwierdzili, Ŝe w trakcie leczenia talidomidem nawrót choroby moŝe przebiegać ze wzrostem odsetka komórek plazmatycznych w szpiku i jednocześnie bez wzrostu stęŝenia białka M. W naszej pracy uwzględniono takŝe przypadek 8 chorego na szpiczaka plazmocytowego, u którego pozaszpikowy rozsiew nowotworowy wystąpił w siódmym miesiącu od rozpoznania szpiczaka po uprzednio przeprowadzonym leczeniu według programu VAD (winkrystyna, adriblastyna, deksametazon) i napromienianiu Co 60 plazmocytowej masy nowotworowej naciekającej krąg L4. Ten przypadek
8 696 M. KRAJ i wsp. 8. oraz drugi opisany w pracy jako przypadek 2. odpowiadają chłoniakowi plazmoblastycznemu. Chłoniak plazmoblastyczny jest szczególnym wariantem chłoniaka rozlanego z duŝych komórek B, zamieszczonym w klasyfikacji WHO 2008 jako odrębna jednostka [36]. Pojawia się de novo w lokalizacjach pozawęzłowych, a takŝe u chorych z nowotworowymi proliferacjami plazmocytowymi między innymi w przebiegu szpiczaka plazmocytowego i wtedy uwaŝa się, Ŝe jest to wyraz transformacji plazmoblastycznej szpiczaka. Chłoniak plazmoblastyczny moŝe sprawiać trudności diagnostyczne, poniewaŝ fenotyp B komórek jest słabo wyraŝony lub nieobecny (CD20 ) mimo, Ŝe komórki przypominają immunoblasty. Określenie właściwego fenotypu komórek chłoniaka wymaga stosowania kilku przeciwciał znakujących plazmocyty Vs38c, CD38, CD138, poniewaŝ w jednym przypadku moŝe być ekspresja Vs38c, w drugim CD38 i CD138 lub teŝ wszystkich trzech. W około 70% przypadków moŝna wykazać w komórkach chłoniaka cytoplazmatyczną ekspresję immunoglobulin, najczęściej IgG kappa lub lambda. W przypadku 8. progresji pozaszpikowej choroby towarzyszył wzrost aktywności dehydrogenazy mleczanowej w surowicy do powyŝej 1000 U/L. Uprzednie badania wykazały, Ŝe wysokie poziomy LDH w surowicy są związane z pozakostną chorobą, niezwykle agresywnym przebiegiem i krótkim przeŝyciem [37]. W przypadku 8. zwraca uwagę fakt niskiego stęŝenia białka monoklonalnego IgAκ w surowicy nawet do wykrywalnego jedynie w immunofiksacji i brak białka w moczu mimo rozległych i wieloogniskowych nacieków nowotworowych w tkankach miękkich, trzustce i centralnym układzie nerwowym. Nasuwa się podobieństwo z zespołem LEPP. Dawson i wsp. [38] opisali 3 chorych z nawrotem pozaszpikowym szpiczaka związanym z przesunięciem syntezy i wydzielania pełnocząsteczkowych immunoglobulin do syntezy tylko łańcuchów lekkich. Ten zespół nazwany light chain escape from plateau phase (LEPP) charakteryzował się nawrotem z mnogimi pozaszpikowymi naciekami plazmoblastycznymi, wysokimi stęŝeniami β2m, LDH w surowicy, niewydolnością nerek i agresywnym, cięŝkim przebiegiem klinicznym. Sugerowano, Ŝe LEPP wynika z klonalnej selekcji i ekspansji prekursorów, które utraciły zdolność do syntezy całej cząsteczki immunoglobulinowej podczas gdy nabyły niezaleŝność od komórek zrębu szpiku i zdolność do rozsiewu poza szpikiem. Zwraca uwagę młody wiek naszych chorych z pozaszpikowym rozsiewem i transformacją plazmoblastyczną: w przypadku 2 43 lata, w przypadku 8 45 lat. Bladé i wsp. [39] w opisie 72 chorych na szpiczaka plazmocytowego w wieku poniŝej 40 roku Ŝycia zwracają uwagę na duŝą częstotliwość zajęcia procesem chorobowym tkanek pozaszpikowych. W świeŝym przeglądzie 3600 chorych na szpiczaka w Taiwan National Cancer Registry [42] częstotliwość pozaszpikowego zajęcia procesem chorobowym była znamiennie wyŝsza u chorych w wieku poniŝej 55 lat. Białaczka plazmocytowa jest rzadką i najbardziej agresywną formą szpiczaka plazmocytowego. Występuje u około 2% chorych. MoŜe pojawiać się w przebiegu wcześniej rozpoznanego szpiczaka plazmocytowego (wtórna białaczka plazmocytowa) lub bywa rozpoznawana jako pierwotna postać choroby. Rozpoznanie opiera się na stwierdzeniu obecności plazmocytów w krwi obwodowej w ilości większej niŝ /L lub plazmocytozy powyŝej 20% wszystkich krwinek białych. Białaczka plazmocytowa ma zazwyczaj bardzo agresywny przebieg i jest oporna na chemioterapię. Z tego powodu rokowanie jest bardzo złe, a mediana przeŝycia sięga 8 12 miesięcy w przypadku postaci pierwotnej i 2 miesięcy w przypadku postaci wtórnej [41], nawet w przypadku zastosowania nowoczesnej terapii bortezomibem [42, 43]. W przypadku opisanych przez nas trzech chorych z wtórną białaczką plazmocytową przeŝycie od momentu postawienia tego rozpoznania nie przekroczyło 2 miesięcy. Alexandrescu i wsp. [27] opisali przypadek szpiczaka plazmocytowego, opornego na wielolekowe schematy chemioterapeutyczne oraz immunomodulujące leczenie talidomidem. U wspomnianego chorego, pomimo uzyskania krótkotrwałej częściowej remisji, postęp choroby zwiększył się, wystąpiła obwodowa plazmocytoza odpowiadająca wtórnej białaczce plazmocytowej i w następstwie skórna postać szpiczaka. MoŜliwe przyczyny pojawienia się agresywnej pozaszpikowej postaci choroby w trakcie leczenia talidomidem nie są jasne; rozwaŝa się selektywne hamowanie klonów dojrzałych komórek plazmatycz-
9 Transformacja plazmoblastyczna 697 nych i ewoluowanie klonów [26]. Sugerowano rozliczne mechanizmy działania talidomidu w przypadku szpiczaka plazmocytowego, w tym działania w obrębie mikrośrodowiska samego nowotworu takie jak antyangiogeneza, bezpośrednie hamowanie wzrostu komórek szpiczaka oraz modulowanie molekuł odpowiedzialnych za adhezję [44]. Talidomid blokuje adhezję komórek szpiczaka do komórek zrębu w szpiku. Prowadzi to do zahamowania produkcji interleukiny (IL-6) i innych cytokin przez komórki zrębu. Cytokiny te są niezbędne dla wzrostu i przeŝycia komórek szpiczaka. Z drugiej strony, ze względu na zmiany przylegania komórek oraz na interakcje w obrębie mikrośrodowiska szpiku, złośliwe komórki plazmatyczne mogą rozwijać oporność na leczenie i rozwijać tendencje do rozsiewu oraz naciekania otaczających tkanek [27]. ZróŜnicowana ekspresja molekuł CD56 na powierzchni nowotworowych komórek plazmatycznych, którą obserwowaliśmy u naszych chorych, tj. dodatnia ekspresja CD56 u chorych opisanych jako przypadki 5 i 7 i brak ekspresji u chorych opisanych jako przypadki 1, 2, 6 i 8 podwaŝa zasadność hipotezy przedstawionej przez Alexandrescu i wsp. [27], dotyczącej roli tej cząsteczki w procesie rozsiewu komórek szpiczaka i pozostaje w zgodzie z naszymi wcześniejszymi obserwacjami [45]. Talidomid nie jest jedynym czynnikiem mogącym mieć wpływ na występowanie pozaszpikowej progresji szpiczaka plazmocytowego. W ostatnich latach odnotowano wysoką częstotliwość nowotworów pozaszpikowych po wysokodawkowym leczeniu i transplantacji autologicznych (ASCT) i allogenicznych komórek macierzystych [46 50]. Niektóre badania wskazują, Ŝe częstotliwość progresji pozaszpikowej szpiczaka jest większa w ostatnich latach w erze nowych leków immunomodulujących i bortezomibu niŝ w latach dziewięćdziesiątych [1, 20]. W ocenie częstotliwości występowania pozaszpikowej proliferacji plazmocytowej waŝne jest sprecyzowanie jej rozumienia. Według ostatnich poglądów [2] aby móc uznać za pozaszpikową proliferację plazmocytową nowotworowe nacieki plazmocytowe nie mogą wywodzić się z jakiejkolwiek kości. Zatem masy nowotworowe wyrastające z kości i szerzące się w tkankach miękkich nie są uwaŝane jako pozaszpikowe. Pour i wsp. [20] przeprowadzili analizę 226 kolejnych chorych z nawrotem szpiczaka, którzy uprzednio w latach leczeni byli talidomidem (33%), bortezomibem (38%), lenalidomidem (5%) i ASCT (42%) i stwierdzili, Ŝe u 32 chorych (14%) nawrót pozaszpikowy dotyczył tkanek miękkich i nie miał związku z układem kostnym, a mediana czasu przeŝycia tych chorych od wystąpienia nawrotu wynosiła 4 miesiące. Jo i wsp. [51] wśród 415 chorych na szpiczaka plazmocytowego leczonych w latach u 31 (7,5%) stwierdzili pozaszpikową progresję choroby (de novo secondary extramedullary plasmacytoma). 24 z tych 31 chorych otrzymywało w pierwszej linii leczenie według VAD, a 22 chorych przebyło następnie pojedynczą lub tandemową ASCT. Mediana przeŝycia od wystąpienia progresji pozaszpikowej wynosiła 5,1 miesiąca. Detweiler i wsp. [2] w Mayo Clinic, USA poddali badaniom 174 chorych z nawrotowym, opornym szpiczakiem, którzy byli włączeni do próby klinicznej II fazy oceniającej skuteczność pomalidomidu plus niskie dawki deksametazonu. U 16 chorych stwierdzono pozaszpikowe nacieki plazmocytowe przed włączeniem do próby u 3 chorych były obecne w czasie rozpoznania szpiczaka, a u 13 (7,5%) wystąpiły w czasie leczenia szpiczaka. Wszyscy chorzy z pozaszpikową chorobą byli uprzednio leczeni lekami immunomodulującymi (talidomid, lenalidomid) a 10 chorych takŝe bortezomibem. Średni czas od rozpoczęcia leczenia lekami immunomodulującymi do wystąpienia pozaszpikowej progresji wynosił 24 miesiące. Miejsca rozsiewu pozaszpikowego to tkanki miękkie okolicy skroniowej, mięśnie (1 chory z 10 róŝnymi polami zajęcia, 1 chory z 5 zajętymi mięśniami) ściana klatki piersiowej (nacieki nie mające związku z układem kostnym), masy nowotworowe w jamie brzusznej, miednicy, tkanka podskórna, śledziona, śródpiersie, płyn w opłucnej, wątroba. Leczenie pomalidomidem (2 4 mg/dobę) i deksametazonem 40 mg jeden raz na tydzień spowodowało wśród 13 chorych z pozaszpikową chorobą u 2 chorych całkowitą remisję z całkowitym zniknięciem pozaszpikowej masy nowotworowej i u 2 chorych częściową remisję z > 50% redukcją masy nowotworowej pozaszpikowej. Całkowite przeŝycie od włą-
10 698 M. KRAJ i wsp. czenia do próby klinicznej było znamiennie krótsze u chorych z pozaszpikową progresją w porównaniu do chorych bez progresji pozaszpikowej, mediana 16 miesięcy versus nie osiągnięta (p=0.002). Pomalidomid stwarza pewną nadzieję dla chorych z pozaszpikowym rozrostem plazmocytowym, gdyŝ dotychczas nie ma skutecznego leczenia nawet przy zastosowaniu nowych leków mimo pojedynczych doniesień o skuteczności bortezomibu [52, 53]. W naszym przypadku 8 doszło do progresji pozaszpikowej w trakcie leczenia bortezomibem, cyklofosfamidem i deksametazonem. W świetle narastających dowodów mogących świadczyć o wpływie stosowanego w ostatnich latach leczenia, ASCT i biologicznego [54], na występowanie rozsiewu pozaszpikowego choroby, Varettoni i wsp. [1] oceniali częstotliwość występowania pozaszpikowego rozrostu plazmocytowego w duŝej kohorcie chorych na szpiczaka plazmocytowego zdiagnozowanego w okresie ostatnich 40 lat i dokonali oceny zmienności w czasie. Poddano analizie 1003 chorych na szpiczaka rozpoznanego i leczonego w ośrodku hematologicznym Uniwersytetu w Padwie w okresie od 1971 do 2007 r. badając częstotliwość występowania pozaszpikowej choroby w trzech okresach odpowiadających stosowaniu róŝnych metod leczniczych: stosowaniu chemioterapii w konwencjonalnych dawkach, stosowaniu wysokodawkowej terapii i ASCT jako leczenia pierwszej linii u chorych poniŝej 65 roku Ŝyciu i wprowadzenie nowych leków immunomodulujących i bortezomibu. Średni czas obserwacji wynosił 30 miesięcy co odpowiada 3850 osobo-lat. Spośród 1003 chorych u 132 (13%) stwierdzono pozaszpikowy rozrost plazmocytowy: u 76 chorych (7%) obecny juŝ w chwili rozpoznania szpiczaka i u 56 (6%) chorych występujący w przebiegu choroby w czasie leczenia, średnio po 19 miesiącach od rozpoznania szpiczaka. Wykazano, Ŝe częstotliwość lokalizacji pozaszpikowych rozrostu plazmocytowego wzrosła podczas obserwacji z 6, osobo-lat w okresie do 15, osobo-lat w okresie (p=0,055), do 48,4 1000/osobo-lat w okresie (P=0.03). W analizie wielowariantowej nie obserwowano, aby na ryzyko progresji pozaszpikowej miało wpływ uprzednio stosowane leczenie ASCT, bortezomib, lub talidomid/ lenalidomid. Autorzy sugerują, Ŝe przyczyną wzrostu częstotliwości występowania progresji pozaszpikowej jest lepsze wykrywanie radiologiczne (PET/CT, MRI) ognisk pozaszpikowego rozrostu i wydłuŝenie przeŝycia chorych na szpiczaka w ostatnich latach. Ostatnio grupa francuska zwróciła uwagę na problem występowania drugiego pierwotnego nowotworu u chorych leczonych podtrzymująco lenalidomidem. W badaniu IFM chorych na szpiczaka plazmocytowego poniŝej 65 r.ŝ. z nie postępującą chorobą po pierwszej linii leczenia wysokodawkowego randomizowano do otrzymywania konsolidacji lenalidomidem (25 mg/d, 21 dni/miesiąc, przez 2 miesiące), a następnie podtrzymująco, albo placebo, albo lenalidomid (10 do 15 mg/d) aŝ do nawrotu. Od VII 2006 do VIII 2008 włączono do badania 614 chorych (307 otrzymywało placebo, 307 otrzymywało lenalidomid). W lipcu 2010 r. próbę odślepiono i przeprowadzono końcową analizę ze średnią czasu obserwacji 34 miesiące od randomizacji i 44 miesiące od rozpoznania szpiczaka. Konsolidacja lenalidomidem poprawiła VGPR (p<0.0001). Leczenie podtrzymujące lenalidomidem poprawiło u chorych przeŝycie wolne od progresji (PFS) i jego mediana wyniosła 42 miesiące, w porównaniu do mediany PFS 24 miesiące u chorych otrzymujących placebo (p<10 8 ).Jednak u wielu chorych wystąpił drugi nowotwór ostra białaczka szpikowa, zespół mielodysplastyczny, ostra białaczka limfoblastyczna, chłoniak Hodgkina i nowotwory lite. W grupie otrzymującej placebo drugi nowotwór wystąpił u 6 chorych, a w grupie otrzymującej leczenie podtrzymujące lenalidomidem u 25 chorych (Attal i wsp. wykład w czasie 16 th Congress of the European Hematology Association, Londyn, czerwiec 2011) [3]. W badaniu amerykańskim III fazy CALGB ECOG BMT-CNT oceniającym lenalidomid versus placebo w leczeniu podtrzymującym u chorych na szpiczaka po pojedynczej ASCT, obejmującym 460 randomizowanych chorych ze średnim czasem obserwacji 17,6 miesiąca podobnie jak w badaniu francuskim w grupie leczonych podtrzymująco lenalidomidem mediana czasu do progresji wynosiła 43,5 miesięcy, a w grupie otrzymującej placebo 21,5 miesięcy. Nie eksponowano problemu występowania drugiego pierwotnego nowotworu, ale sugerowano uwzględnianie takiej moŝliwości w dalszej obserwacji (Mc. Carthy i wsp. prezentacja na 13th International Myeloma Workshop ParyŜ maj 2011) [4].
11 Transformacja plazmoblastyczna 699 Analiza występowania drugiego pierwotnego nowotworu u chorych z nawrotowym opornym szpiczakiem plazmocytowym leczonym lenalidomidem i deksametazonem w próbach klinicznych MM 009/010, które były podstawą rejestracji lenalidomidu w tym wskazaniu wykazała, Ŝe ryzyko było podobne u chorych leczonych lenalidomidem i deksametazonem u 6 chorych nowotwory lite i u 2 zespół mielodysplastyczny, co u chorych otrzymujących tylko placebo i deksametazon u 2 chorych nowotwory lite. Nie stwierdzono ostrej białaczki szpikowej i nowotworów B-komórkowych [7]. We włoskim badaniu III fazy MM-015 [5] oceniającym skuteczność i bezpieczeństwo ciągłego leczenia lenalidomidem, w indukcji (melfalan, prednison i lenalidomid), a następnie w podtrzymywaniu remisji(mpr-r) versus melfalan i prednison (MP) lub melfalan, prednison i lenalidomid (MPR) u niekwalifikujących się do ASCT chorych powyŝej 65 r.ŝ. z medianą czasu obserwacji 25 miesięcy raportowano ogółem 12 przypadków wystąpienia drugiego nowotworu (4/150 w ramieniu MPR R [IR =1.40], 6/152 w MPR [IR=2,05] i 2/153 w MP [IR=0,67] włączając 2 przypadki zespołu mielodysplastycznego w MPR-R i 2 przypadki ostrej białaczki szpikowej w kaŝdym z ramion MPR-R i MPR). W grupach MPR/MPR-R versus grupa MP częstotliwość występowania ostrej białaczki szpikowej i zespołu mielodysplastycznego wynosiła odpowiednio 3,6% versus 0,7%, a mediana PFS dla MPR-R versus MP wynosiła odpowiednio 31 miesięcy versus 13 miesięcy co sugeruje, Ŝe profil ryzyko drugiego nowotworu, a korzyść pozostaje na korzyść stosowania leczenia podtrzymującego lenalidomidem. W wielu innych aktualnie prowadzonych badaniach z zastosowaniem lenalidomidu w leczeniu chorych na szpiczaka obserwowane są pojedyncze przypadki wystąpienia drugiego nowotworu [5]. Biorąc pod uwagę związek starzenia się z rozwojem nowotworów i świeŝymi zainteresowaniami odnośnie potencjalnego wzrostu ryzyka wystąpienia drugiego pierwotnego nowotworu u chorych na szpiczaka z długotrwałą ekspozycją na lenalidomid Morgan i wsp. [6] porównali częstotliwość wystąpienia drugiego nowotworu w 11 badaniach dotyczących lenalidomidu, sponsorowanych przez producenta leku firmę Celgene (n=3839), ze spodziewaną podstawową częstotliwością występowania nowotworów inwazyjnych opartą na danych Rejestru Nowotworów USA z lat (US Surveillance, Epidemiology and End Results (SEER) Cancer Registries). Średnia czasu stosowania lenalidomidu dla wszystkich badań wynosiła 5 miesięcy; 313 (8,2%) chorych otrzymywało lenalidomid powyŝej 24 miesięcy. W grupie wszystkich chorych zidentyfikowano 57 drugich nowotworów u 56 chorych w 8 przypadkach zespół mielodysplastyczny, w 1 ostrą białaczkę szpikową, w 2 chłoniaka B komórkowego, w 46 nowotwory lite korespondujące do wskaźników IR (incidence rate) 2,15 i SIR (standardized incidence ratio) 0,77. Nie raportowano nowotworów B-komórkowych u chorych stosujących lenalidomid powyŝej 24 miesięcy. Wskaźniki częstotliwości, (IRs) były porównywalne z IR danych SEER (1,3 2,2/osobo-lat dla osób w wieku lat) co przemawiało za wnioskiem, Ŝe leczenie nawrotowego, opornego szpiczaka oparte na lenalidomidzie, włączając jego trwanie powyŝej 24 miesięcy nie zwiększało znamiennie IR drugich nowotworów w porównaniu do IR dla inwazyjnych nowotworów raportowanych przez SEER. Szwedzkie badania populacyjne [8] oceniające ryzyko wystąpienia późniejszych pierwotnych nowotworów u chorych na szpiczaka plazmocytowego przed i po wprowadzeniu nowych terapii obejmujące wszystkich chorych (n= 9926) zdiagnozowanych w Szwecji w latach wykazały zwiększone ryzyko występowania ostrej białaczki szpikowej (SIR =7,6), innej białaczki szpikowej łącznie z zespołem mielodysplastycznym (SIR= 21,7) i nowotworów skóry nie będących czerniakiem (SIR = 2,2). Wyniki były bardzo podobne w analizach obejmujących chorych zdiagnozowanych przed versus po 1995 r. sugerując, Ŝe wysokodawkowe leczenie/asct nie wpływa na krótkookresowe ryzyko wtórnych nowotworów natomiast konieczny jest dłuŝszy czas obserwacji dla dokładniejszego określenia ryzyka w erze leków immunomodulujących.
12 700 M. KRAJ i wsp. PIŚMIENNICTWO 1. Varettoni M, Corso A, Pica G i wsp. Incidence, presenting features and outcome of extramedullary disease in multiple myeloma: a longitudinal study on 1003 consecutive patients. Ann Oncol 2010; 21: Detweiler Short K, Rajkumar SV, Buadi F i wsp. Increased incidence of extramedullary plasmacytomas in patients with multiple myeloma in the era of novel therapy and effect of pomalidomide on extramedullary disease. Blood 2010; 116: 1256 (abstract 3047). 3. Attal M, Olivier P, Cances Lawers V i wsp. Maintenance treatment with lenalidomide after transplantation for myeloma: analysis of secondary malignancies within the IFM trial. Haematologica 2011; 96 Suppl 1: S McCarthy P, Owzar K, Anderson K i wsp. Phase III Intergroup study of lenalidomide versus placebo maintenance therapy following single autologous stem cell transplant (ASCT) for multiple myeloma: CALGB ECOG BMT CTN Haematologica 2011; 96 Suppl 1: S Palumbo A, Bringhen S, Zweegman S i wsp. Secondary malignancies in elderly myeloma patients. Haematologica 2011; 96 Suppl 1: S Morgan G, Durie B, San Miguel J i wsp. Retrospective analysis of the long term safety of lenalidomide ± dexamethasone in relapsed/refractory multiple myeloma patients: analysis of pooled data and incidence rates of second primary malignancy. Haematologica 2011; 96 Suppl 1: S24-S Richardson P, Orłowski R, San Miguel J i wsp. Risk of second primary malignancies in relapsed / refractory multiple myeloma patients treated with lenalidomide and dexamethasone: analysis of MM-009/010 second primary malignancies incidence rate. Haematologica 2011; 96 Suppl 1: S Mailankody S, Pfeiffer R, Kristinsson S i wsp. Risk of subsequent primary malignancies in patients with multiple myeloma before and after the introduction of novel therapies: a population based study in Sweden. Haematologica 2011; 96 Suppl 1: S Singhal S, Metha J, Desikan R i wsp. Antitumor activity of thalidomide in refractory multiple myeloma. N Engl J Med 1999; 341: Juliusson G, Celsing F, Turesson I i wsp. Frequent good partial remissions from thalidomide including best response ever in patients with advanced refractory and relapsed myeloma. Br J Haematol 2000; 109: Rajkumar SV, Blood E, Vesole D i wsp. Phase III clinical trial of thalidomide plus dexamethasone compared with dexamethasone alone in newly diagnosed multiple myeloma: a clinical trial coordinated by the Eastern Cooperative Oncology Group. J Clin Oncol 2006; 24: Barlogie B, Desikan R, Eddelmon P i wsp. Extended survival in advanced and refractory multiple myeloma after single agent thalidomide: identification of prognostic factors in a phase 2 study of 169 patients. Blood 2001; 98: Kumar S, Gertz MA, Dispenzieri A i wsp. Response rate, durability of response and survival after thalidomide therapy for relapsed multiple myeloma. Mayo Clin Proc 2003; 78: Glasmacher A, Hahn C, Hoffman F i wsp. A systematic review of phase II trials of thalidomide monotherapy in patients with relapsed or refractory multiple myeloma. Br J Haematol 2005; 132: Warzocha K, Kraj M, Pogłód R i wsp. Efficacy and safety of thalidomide in the treatment of multiple myeloma. 1. Book of abstracts The Sixth Multidisciplinary Conference on Drug Research, Przemyśl- Krasiczyn, May 2008 page Acta Poloniae Pharmaceutica 2008; 65: Palumbo A, Facon T, Sonneveld P i wsp. Thalidomide for treatment of multiple myeloma: 10 years later. Blood 2008; 111: Myers B, Grimley C, Crouch D, Dolan G. Lack of response to thalidomide in plasmacytomas. Br J Haematol 2001; 115: Bladé J, Perales M, Rosiňol L i wsp. Thalidomide in multiple myeloma: lack of response of soft tissue plasmacytomas. Br J Haematol 2001; 13: Rosiňol L, Cibeira MT, Bladé J i wsp. Extramedullary myeloma escapes the effect of thalidomide. Haematologica 2004; 89: Pour L, Sandecka V, Kaisarova P i wsp. Extramedullary relapsed multiple myeloma has extremely poor prognosis even in the era of the new drugs. Haematologica 2010; 95: Suppl 2: (abstract 959). 21. Biagi JJ, Mileshkin L, Grigg AP i wsp. Efficacy of thalidomide therapy for extramedullary relapse of myeloma following allogeneic transplantation. Bone Marrow Transplant 2001; 42: Trojan A, Anagnostara A, Jost L. Thalidomide: near complete regression of extramedullary bulk in refractory multiple myeloma. Swiss Med Wkly 2001; 131: Katodritou E, Speletas M, Pouli A i wsp. Successful treatment of extramedullary plasmacytoma of the cavernous sinus using a combination of intermediate dose of thalidomide and dexamethasone. Acta Haematol 2007; 117: Avigdor A, Raanani P, Levi i wsp. Extramedullary progression despite a good response in the bone marrow in patients treated with thalidomide in multiple myeloma. Leuk Lymphoma 2001; 42:
13 Transformacja plazmoblastyczna del Giglio Auro, Weinschenker P, Burgos Manhani i wsp. Hepatic plasmacytosis as a manifestation of relapse in multiple myeloma treated with thalidomide. Southern Medical Journal 2005; 98: Saba S, Epstein A, Niesvizky R, Coleman M. Development of high-grade B-cell neoplasms following thalidomide therapy. Haematologica 2005; 90 (s1): Alexandrescu DT, Koulova L, Wiemik PH. Unusual cutaneous involvement during plasma cell leukaemia phase in a multiple myeloma patient after treatment with thalidomide: a case report and review of the literature. Clin Exp Dermatol 2005; 30: Kraj M, Szpila T, Chełstowska M i wsp. Development of extramedullary myeloma manifestations following thalidomide therapy. 1. Acta Haematol Pol 2007; 38: Haematologica 2007; 92 (s 2): Kraj M, Pogłód R, Szpila T i wsp. Development of extramedullary myeloma manifestations following thalidomide therapy. Nowotwory J Oncol 2010; 60: 13e-16e. htp:// / files/pdf/2010 plik_kraj pdf 30. Kraj M, Pogłód R, Ceglarek B, Tronina R, Warzocha K. Development of high-grade B cell neoplasms and extramedullary myeloma manifestations following thalidomide therapy. Haematologica 2010; 95 Suppl 2: 590 (abstract 1480). 31. Kraj M, Pogłód R, Ceglarek B, Tronina R, Warzocha K. Pozaszpikowa progresja szpiczaka plazmocytowego w następstwie leczenia talidomidem. Onkologia w praktyce klinicznej 2010; 6 supl. B: B35-B Menke DM, Horny HP, Griesser H i wsp. Primary lymph node plasmacytomas (plasmacytic lymphomas). Am J Clin Pathol 2001; 115: Kochbati S, Ben Dahmen F, Boussema F et al. Plasmocytic lymphoma/multiple myeloma. Association or transformation? Tunis Med 2002; 80: Kraj M, Pogłód R, Sokołowska U. Szpiczak plazmocytowy węzłów chłonnych i jego postać uogólniona opis przypadku. Acta Haematol Pol 2006; 37 (s1): Anagnostopoulos A, Hamilos G, Grigoraki V i wsp. Discordant response or progression in patients with refractory myeloma treated with thalidomide based regimens. Hematology J 2003; 4 (s1): S236a. 36. Stein H, Harris NL, Campo E. Plasmablastic lymphoma. In Swerdłow SH, Campo E, Harris NL i wsp. (red.) WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon IARC Press pp Barlogie B, Smallwood L, Smith T, Alexanian R. High serum levels of lactic dehydrogenase indentify a high-grade lymphoma-like myeloma. Ann Intern Med 1989; 110 (7): Dawson MA, Patil S, Spencer A. Extramedullary relapse of multiple myeloma associated with a shift in secretion from intact immunoglobulin to light chains. Haematologica 2007; 92: Bladé J, Kyle RA, Greipp P. Presenting features and prognosis in 72 patients with multiple myeloma who were younger than 40 years. Br J Haematol 1996; 93: Huang S, Yao M, Tang JLi i wsp. Epidemiology of multiple myeloma in Taiwan. Cancer 2007; 110: Kraj M, Pogłód R, Kopeć-Szlęzak J i wsp. Plasma cell leukemia: clinical and immunophenotypic characteristics, treatment and survival. Nowotwory J Oncol 2011; 61 No 3: [33e-45e]. 42. Musto P, Rossini F, Gay F i wsp. Efficacy and safety of bortezomib in patients with plasma cell leukemia. Cancer 2007; 109: Kraj M, Pogłód R, Szpila T, Warzocha K. The efficacy and safety of PAD regimen (bortezomib, doxorubicin, dexamethasone) in the treatment of plasma cell leukemia. Haematologica 2008; 93 (s1): Nowotwory J Oncol 2009; 59: Hideshima T, Chauhan D, Podar K i wsp. Novel therapies targeting the myeloma cell and its bone marrow environment. Semin Oncol 2001; 28: Kraj M, Sokołowska U, Kopeć-Szlęzak J i wsp. Clinicopathological correlates of plasma cells CD56 (NCAM) expression in multiple myeloma. Leuk Lymphoma 2008; 49: Chong G, Byrnes G, Szer J, Grigg A. Extramedullary relapse after allogeneic bone marrow transplantation for hematologic malignancy. Bone Marrow Transplant 2000; 26: Alegre A, Granda A, Martinez-Chamorro C i wsp. Different patterns of relapse after autologous peripheral blood stem cell transplantation in multiple myeloma: clinical results of 280 cases from the Spanish Registry. Haematologica 2002; 87: Zeiser R, Deschler B, Bertz H i wsp. Extramedullary vs medullary relapse after autologous or allogeneic hematopoietic stem cell transplantation in multiple myeloma and its correlation to clinical outcome. Bone Marrow Transplant 2004: 34: Terpos E, Rezvani K, Basu S i wsp. Plasmacytoma relapse in the absence of systemic progression post-high-dose therapy for multiple myeloma. Eur J Haematol 2005; 75: Pèrez-Simón JA, Sureda A, Fermández-Aviles F i wsp. Reduced intensity conditioning allogeneic transplantation is associated with a high-incidence of extramedullary relapses in multiple myeloma patients. Leukemia 2006; 20: Jo J, Yoo C, Park S i wsp. De novo extramedullary plasmacytoma during the course of multiple myeloma, a Korean single center experience. Haematologica 2010; 95 Suppl 2: 590 (abstract 1479).
14 702 M. KRAJ i wsp. 52. Patriarca F, Prosdocimo S, Tomadini V i wsp. Efficacy of bortezomib therapy for extramedullary relapse of myeloma after autologous and non-myeloablative allogeneic transplantation. Haematologica 2005; 90 (2): Rosinol L, Cibeira MT, Uriburu C i wsp. Bortezomib: an effective agent in extramedullary disease in multiple myeloma. Eur J Haematol 2006; 76 (5): Raanani P, Shpilberg O, Ben-Bassat I. Extramedullary and targeted therapies for haematological malignancies is the association real? Ann Oncol 2007; 18: Praca wpłynęła do Redakcji r. i została zakwalifikowana do druku r Adres Autora: Prof. dr hab. n. med. Maria Kraj Instytut Hematologii i Transfuzjologii ul. Indiry Gandhi Warszawa mkraj@ihit.waw.pl
Opis przypadków Cases report
 NOWOTWORY Journal of Oncology 2010 volume 60 Number 1 37 41 Opis przypadków Cases report Pozaszpikowa progresja szpiczaka plazmocytowego w następstwie leczenia talidomidem Maria Kraj, Ryszard Pogłód, Tomasz
NOWOTWORY Journal of Oncology 2010 volume 60 Number 1 37 41 Opis przypadków Cases report Pozaszpikowa progresja szpiczaka plazmocytowego w następstwie leczenia talidomidem Maria Kraj, Ryszard Pogłód, Tomasz
Leki immunomodulujące-przełom w leczeniu nowotworów hematologicznych
 Leki immunomodulujące-przełom w leczeniu nowotworów hematologicznych Jadwiga Dwilewicz-Trojaczek Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa
Leki immunomodulujące-przełom w leczeniu nowotworów hematologicznych Jadwiga Dwilewicz-Trojaczek Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa
Szpiczak plazmocytowy. Grzegorz Helbig Klinika Hematologii i Transplantacji Szpiku Śląski Uniwersytet Medyczny w Katowicach
 Szpiczak plazmocytowy Grzegorz Helbig Klinika Hematologii i Transplantacji Szpiku Śląski Uniwersytet Medyczny w Katowicach MM - epidemiologia 90% przypadków rozpoznaje się powyżej 50 r.ż., Mediana wieku
Szpiczak plazmocytowy Grzegorz Helbig Klinika Hematologii i Transplantacji Szpiku Śląski Uniwersytet Medyczny w Katowicach MM - epidemiologia 90% przypadków rozpoznaje się powyżej 50 r.ż., Mediana wieku
Międzynarodowe standardy leczenia szpiczaka plazmocytowego w roku 2014
 Międzynarodowe standardy leczenia szpiczaka plazmocytowego w roku 2014 Wiesław Wiktor Jędrzejczak, Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawskiego Uniwersytetu Medycznego Tak
Międzynarodowe standardy leczenia szpiczaka plazmocytowego w roku 2014 Wiesław Wiktor Jędrzejczak, Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawskiego Uniwersytetu Medycznego Tak
Trzykrotna remisja uzyskiwana leczeniem bortezomibem u chorej z dziesięcioletnim przebiegiem szpiczaka plazmocytowego
 NOWOTWORY Journal of Oncology 2009 volume 59 Number 3 198 202 Trzykrotna remisja uzyskiwana leczeniem bortezomibem u chorej z dziesięcioletnim przebiegiem szpiczaka plazmocytowego Maria Kraj, Ryszard Pogłód,
NOWOTWORY Journal of Oncology 2009 volume 59 Number 3 198 202 Trzykrotna remisja uzyskiwana leczeniem bortezomibem u chorej z dziesięcioletnim przebiegiem szpiczaka plazmocytowego Maria Kraj, Ryszard Pogłód,
Nowe podejście w leczeniu szpiczaka plazmocytowego
 Nowe podejście w leczeniu szpiczaka plazmocytowego Krzysztof Giannopoulos Centrum Onkologii Ziemi Lubelskiej Uniwersytet Medyczny w Lublinie Model przebiegu szpiczaka mnogiego 10 Choroba bezobjawowa Choroba
Nowe podejście w leczeniu szpiczaka plazmocytowego Krzysztof Giannopoulos Centrum Onkologii Ziemi Lubelskiej Uniwersytet Medyczny w Lublinie Model przebiegu szpiczaka mnogiego 10 Choroba bezobjawowa Choroba
Cel programu: 1. wydłużenie czasu przeżycia chorych na szpiczaka mnogiego ( plazmocytowego), 2. uzyskanie remisji choroby, 3. poprawa jakości życia.
 Nazwa programu LECZENIE OPORNYCH POSTACI SZPICZAKA MNOGIEGO (PLAZMOCYTOWEGO) ICD 10 C 90.0 szpiczak mnogi Dziedzina medycyny: hematologia. Cel programu: 1. wydłużenie czasu przeżycia chorych na szpiczaka
Nazwa programu LECZENIE OPORNYCH POSTACI SZPICZAKA MNOGIEGO (PLAZMOCYTOWEGO) ICD 10 C 90.0 szpiczak mnogi Dziedzina medycyny: hematologia. Cel programu: 1. wydłużenie czasu przeżycia chorych na szpiczaka
Terapeutyczne Programy Zdrowotne 2009 Leczenie opornych postaci szpiczaka mnogiego (plazmocytowego)
 Załącznik nr 28 do zarządzenia Nr 98/2008/DGL Prezesa NFZ z dnia 27 października 2008 roku Nazwa programu: LECZENIE OPORNYCH POSTACI SZPICZAKA MNOGIEGO (PLAZMOCYTOWEGO) ICD-10 C 90.0 szpiczak mnogi Dziedzina
Załącznik nr 28 do zarządzenia Nr 98/2008/DGL Prezesa NFZ z dnia 27 października 2008 roku Nazwa programu: LECZENIE OPORNYCH POSTACI SZPICZAKA MNOGIEGO (PLAZMOCYTOWEGO) ICD-10 C 90.0 szpiczak mnogi Dziedzina
Dr n. med. Norbert Grząśko w imieniu Polskiej Grupy Szpiczakowej Lublin, 12.04.2008
 Ocena skuteczności i bezpieczeństwa leczenia układem CTD (cyklofosfamid, talidomid, deksametazon) u chorych na szpiczaka plazmocytowego aktualizacja danych Dr n. med. Norbert Grząśko w imieniu Polskiej
Ocena skuteczności i bezpieczeństwa leczenia układem CTD (cyklofosfamid, talidomid, deksametazon) u chorych na szpiczaka plazmocytowego aktualizacja danych Dr n. med. Norbert Grząśko w imieniu Polskiej
Bortezomib w II linii leczenia szpiczaka plazmocytowego po nieskutecznej terapii talidomidem
 OPIS PRZYPADKU Hematologia 2015, tom 6, supl. A, 31 35 DOI: 10.5603/Hem.2015.0007 Copyright 2015 Via Medica ISSN 2081 0768 Bortezomib w II linii leczenia szpiczaka plazmocytowego po nieskutecznej terapii
OPIS PRZYPADKU Hematologia 2015, tom 6, supl. A, 31 35 DOI: 10.5603/Hem.2015.0007 Copyright 2015 Via Medica ISSN 2081 0768 Bortezomib w II linii leczenia szpiczaka plazmocytowego po nieskutecznej terapii
Skuteczność i bezpieczeństwo leczenia białaczki plazmocytowej według programu PAD (bortezomib + doksorubicyna + deksametazon)
 NOWOTWORY Journal of Oncology 2009 volume 59 Number 5 357 367 Skuteczność i bezpieczeństwo leczenia białaczki plazmocytowej według programu PAD (bortezomib doksorubicyna deksametazon) Maria Kraj, Ryszard
NOWOTWORY Journal of Oncology 2009 volume 59 Number 5 357 367 Skuteczność i bezpieczeństwo leczenia białaczki plazmocytowej według programu PAD (bortezomib doksorubicyna deksametazon) Maria Kraj, Ryszard
CHŁONIAKI ZŁOŚLIWE U DZIECI
 Prof. dr hab.med. Jacek Wachowiak CHŁONIAKI ZŁOŚLIWE PODZIAŁ CHŁONIAKI ZŁOŚLIWE 1. CHŁONIAKI NIEZIARNICZE 2. CHOROBA HODGKINA (ZIARNICA ZŁOŚLIWA) EPIDEMIOLOGIA - OK. 10% NOWOTWORÓW Klinika Onkologii, Hematologii
Prof. dr hab.med. Jacek Wachowiak CHŁONIAKI ZŁOŚLIWE PODZIAŁ CHŁONIAKI ZŁOŚLIWE 1. CHŁONIAKI NIEZIARNICZE 2. CHOROBA HODGKINA (ZIARNICA ZŁOŚLIWA) EPIDEMIOLOGIA - OK. 10% NOWOTWORÓW Klinika Onkologii, Hematologii
Terapeutyczne Programy Zdrowotne 2012 Leczenie opornych postaci szpiczaka mnogiego (plazmocytowego)
 Załącznik nr 25 do zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE OPORNYCH POSTACI SZPICZAKA MNOGIEGO (PLAZMOCYTOWEGO) ICD-10 C 90.0 szpiczak mnogi Dziedzina
Załącznik nr 25 do zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE OPORNYCH POSTACI SZPICZAKA MNOGIEGO (PLAZMOCYTOWEGO) ICD-10 C 90.0 szpiczak mnogi Dziedzina
LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0)
 Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
Skuteczność minimalnej dawki lenalidomidu w leczeniu nawrotowej postaci szpiczaka plazmocytowego
 OPIS PRZYPADKU Hematologia 2011, tom 2, nr 1, 204 208 Copyright 2011 Via Medica ISSN 2081 0768 Skuteczność minimalnej dawki lenalidomidu w leczeniu nawrotowej postaci szpiczaka plazmocytowego Effectiveness
OPIS PRZYPADKU Hematologia 2011, tom 2, nr 1, 204 208 Copyright 2011 Via Medica ISSN 2081 0768 Skuteczność minimalnej dawki lenalidomidu w leczeniu nawrotowej postaci szpiczaka plazmocytowego Effectiveness
Terapeutyczne Programy Zdrowotne 2009 Leczenie opornych postaci szpiczaka mnogiego (plazmocytowego)
 Załącznik nr 17 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE OPORNYCH POSTACI SZPICZAKA MNOGIEGO (PLAZMOCYTOWEGO) ICD-10 C 90.0 szpiczak mnogi Dziedzina medycyny:
Załącznik nr 17 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE OPORNYCH POSTACI SZPICZAKA MNOGIEGO (PLAZMOCYTOWEGO) ICD-10 C 90.0 szpiczak mnogi Dziedzina medycyny:
Rola leczenia podtrzymującego w terapii szpiczaka plazmocytowego
 PRACA POGLĄDOWA Hematologia 2011, tom 2, nr 3, 256 265 Copyright 2011 Via Medica ISSN 2081 0768 Rola leczenia podtrzymującego w terapii szpiczaka plazmocytowego Role of maintenance therapy in the treatment
PRACA POGLĄDOWA Hematologia 2011, tom 2, nr 3, 256 265 Copyright 2011 Via Medica ISSN 2081 0768 Rola leczenia podtrzymującego w terapii szpiczaka plazmocytowego Role of maintenance therapy in the treatment
Konwencjonalna chemioterapia i długie przeżycia chorych na szpiczaka plazmocytowego
 NOWOTWORY Journal of Oncology 2010 volume 60 Number 4 318 326 Konwencjonalna chemioterapia i długie przeżycia chorych na szpiczaka plazmocytowego Maria Kraj, Ryszard Pogłód, Urszula Sokołowska, Barbara
NOWOTWORY Journal of Oncology 2010 volume 60 Number 4 318 326 Konwencjonalna chemioterapia i długie przeżycia chorych na szpiczaka plazmocytowego Maria Kraj, Ryszard Pogłód, Urszula Sokołowska, Barbara
Szpiczak plazmocytowy: najważniejsze doniesienia z ASH Krzysztof Jamroziak
 Szpiczak plazmocytowy: najważniejsze doniesienia z ASH 216 Krzysztof Jamroziak Szpiczak plazmocytowy Nowotworowa proliferacja komórek plazmatycznych głównie w szpiku kostnym zapadalność w Europie 4-5/1,
Szpiczak plazmocytowy: najważniejsze doniesienia z ASH 216 Krzysztof Jamroziak Szpiczak plazmocytowy Nowotworowa proliferacja komórek plazmatycznych głównie w szpiku kostnym zapadalność w Europie 4-5/1,
LECZENIE SZPICZAKA PLAZMATYCZNO KOMÓRKOWEGO (PLAZMOCYTOWEGO) (ICD-10 C 90)
 Załącznik B.13. LECZENIE SZPICZAKA PLAZMATYCZNO KOMÓRKOWEGO (PLAZMOCYTOWEGO) (ICD-10 C 90) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia bortezomibem 1.1 Leczenie bortezomibem nowo zdiagnozowanych
Załącznik B.13. LECZENIE SZPICZAKA PLAZMATYCZNO KOMÓRKOWEGO (PLAZMOCYTOWEGO) (ICD-10 C 90) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia bortezomibem 1.1 Leczenie bortezomibem nowo zdiagnozowanych
Bendamustyna w leczeniu opornych postaci szpiczaka mnogiego
 Bendamustyna w leczeniu opornych postaci szpiczaka mnogiego Iwona Hus, Joanna Mańko Klinika Hematonkologii i Transplantacji Szpiku Uniwersytetu Medycznego w Lublinie Nałęczów 22 listopada 2008 Bendamustyna
Bendamustyna w leczeniu opornych postaci szpiczaka mnogiego Iwona Hus, Joanna Mańko Klinika Hematonkologii i Transplantacji Szpiku Uniwersytetu Medycznego w Lublinie Nałęczów 22 listopada 2008 Bendamustyna
Nowe leki w terapii szpiczaka mnogiego
 PRACA POGLĄDOWA Review Article Acta Haematologica Polonica 2010, 41, Nr 3, str. 417 422 HALINA URBAŃSKA-RYŚ Nowe leki w terapii szpiczaka mnogiego Novel drugs in multiple myeloma therapy Klinika Hematologii
PRACA POGLĄDOWA Review Article Acta Haematologica Polonica 2010, 41, Nr 3, str. 417 422 HALINA URBAŃSKA-RYŚ Nowe leki w terapii szpiczaka mnogiego Novel drugs in multiple myeloma therapy Klinika Hematologii
Znaczenie PFS oraz OS w analizach klinicznych w onkologii
 Znaczenie PFS oraz OS w analizach klinicznych w onkologii experience makes the difference Magdalena Władysiuk, lek. med., MBA Cel terapii w onkologii/hematologii Kontrola rozwoju choroby Kontrola objawów
Znaczenie PFS oraz OS w analizach klinicznych w onkologii experience makes the difference Magdalena Władysiuk, lek. med., MBA Cel terapii w onkologii/hematologii Kontrola rozwoju choroby Kontrola objawów
LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0)
 Załącznik B.54. LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0) ŚWIADCZENIOBIORCY 1. Leczenie lenalidomidem chorych na opornego lub nawrotowego szpiczaka plazmocytowego.
Załącznik B.54. LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0) ŚWIADCZENIOBIORCY 1. Leczenie lenalidomidem chorych na opornego lub nawrotowego szpiczaka plazmocytowego.
Rak piersi. Doniesienia roku Renata Duchnowska Klinika Onkologii Wojskowy Instytut Medyczny w Warszawie
 Rak piersi Doniesienia roku 2014 Renata Duchnowska Klinika Onkologii Wojskowy Instytut Medyczny w Warszawie Miejscowe leczenie Skrócone napromienianie części piersi (accelerated partial breast irradiation;
Rak piersi Doniesienia roku 2014 Renata Duchnowska Klinika Onkologii Wojskowy Instytut Medyczny w Warszawie Miejscowe leczenie Skrócone napromienianie części piersi (accelerated partial breast irradiation;
Nowe możliwości leczenia ostrej białaczki limfoblastycznej
 Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
Nowe możliwości leczenia ostrej białaczki limfoblastycznej Dr hab. med. Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Warszawa, 17.12.15
Maciej Korpysz. Zakład Diagnostyki Biochemicznej UM Lublin Dział Diagnostyki Laboratoryjnej Samodzielny Publiczny Szpital Kliniczny Nr 1 w Lublinie
 Nowe możliwości oceny białka monoklonalnego za pomocą oznaczeń par ciężki-lekki łańcuch immunoglobulin (test Hevylite) u chorych z dyskrazjami plazmocytowymi. Maciej Korpysz Zakład Diagnostyki Biochemicznej
Nowe możliwości oceny białka monoklonalnego za pomocą oznaczeń par ciężki-lekki łańcuch immunoglobulin (test Hevylite) u chorych z dyskrazjami plazmocytowymi. Maciej Korpysz Zakład Diagnostyki Biochemicznej
Ocena immunologiczna i genetyczna białaczkowych komórek macierzystych
 Karolina Klara Radomska Ocena immunologiczna i genetyczna białaczkowych komórek macierzystych Streszczenie Wstęp Ostre białaczki szpikowe (Acute Myeloid Leukemia, AML) to grupa nowotworów mieloidalnych,
Karolina Klara Radomska Ocena immunologiczna i genetyczna białaczkowych komórek macierzystych Streszczenie Wstęp Ostre białaczki szpikowe (Acute Myeloid Leukemia, AML) to grupa nowotworów mieloidalnych,
NON-HODGKIN S LYMPHOMA
 NON-HODGKIN S LYMPHOMA Klinika Hematologii, Nowotworów Krwi i Transplantacji Szpiku We Wrocławiu Aleksandra Bogucka-Fedorczuk DEFINICJA Chłoniaki Non-Hodgkin (NHL) to heterogeniczna grupa nowotworów charakteryzująca
NON-HODGKIN S LYMPHOMA Klinika Hematologii, Nowotworów Krwi i Transplantacji Szpiku We Wrocławiu Aleksandra Bogucka-Fedorczuk DEFINICJA Chłoniaki Non-Hodgkin (NHL) to heterogeniczna grupa nowotworów charakteryzująca
Analysis of infectious complications inf children with acute lymphoblastic leukemia treated in Voivodship Children's Hospital in Olsztyn
 Analiza powikłań infekcyjnych u dzieci z ostrą białaczką limfoblastyczną leczonych w Wojewódzkim Specjalistycznym Szpitalu Dziecięcym w Olsztynie Analysis of infectious complications inf children with
Analiza powikłań infekcyjnych u dzieci z ostrą białaczką limfoblastyczną leczonych w Wojewódzkim Specjalistycznym Szpitalu Dziecięcym w Olsztynie Analysis of infectious complications inf children with
OPIS PRZYPADKU. Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych, Warszawski Uniwersytet Medyczny, Warszawa
 OPIS PRZYPADKU Hematologia 2015, tom 6, supl. A, 7 11 DOI: 10.5603/Hem.2015.0002 Copyright 2015 Via Medica ISSN 2081 0768 Bortezomib w skojarzeniu z melfalanem i deksametazonem w leczeniu I linii u chorego
OPIS PRZYPADKU Hematologia 2015, tom 6, supl. A, 7 11 DOI: 10.5603/Hem.2015.0002 Copyright 2015 Via Medica ISSN 2081 0768 Bortezomib w skojarzeniu z melfalanem i deksametazonem w leczeniu I linii u chorego
CZYNNIKI WPŁYWAJĄCE NA PRZEŻYCIE CHORYCH NA CHŁONIAKI ZŁOŚLIWE
 CZYNNIKI WPŁYWAJĄCE NA PRZEŻYCIE CHORYCH NA CHŁONIAKI ZŁOŚLIWE Jan Walewski, Centrum Onkologii Instytut im. Marii Skłodowskiej-Curie, Warszawa Grzegorz Harańczyk, StatSoft Polska Sp. z o.o. W latach 1997
CZYNNIKI WPŁYWAJĄCE NA PRZEŻYCIE CHORYCH NA CHŁONIAKI ZŁOŚLIWE Jan Walewski, Centrum Onkologii Instytut im. Marii Skłodowskiej-Curie, Warszawa Grzegorz Harańczyk, StatSoft Polska Sp. z o.o. W latach 1997
Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego. Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa
 Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa RAK TRZUSTKI U 50% chorych w momencie rozpoznania stwierdza się
Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa RAK TRZUSTKI U 50% chorych w momencie rozpoznania stwierdza się
WCZESNE OBJAWY CHOROBY NOWOTWOROWEJ U DZIECI
 WCZESNE OBJAWY CHOROBY NOWOTWOROWEJ U DZIECI Elżbieta Adamkiewicz-Drożyńska Katedra i Klinika Pediatrii, Hematologii i Onkologii Początki choroby nowotworowej u dzieci Kumulacja wielu zmian genetycznych
WCZESNE OBJAWY CHOROBY NOWOTWOROWEJ U DZIECI Elżbieta Adamkiewicz-Drożyńska Katedra i Klinika Pediatrii, Hematologii i Onkologii Początki choroby nowotworowej u dzieci Kumulacja wielu zmian genetycznych
Warszawa, 16-17.03.201217.03.2012 PLRG / PALG 16-17.03.2012
 Przegląd badań klinicznych PLRG Konferencja PLRG i PALG Warszawa, 16-17.03.201217.03.2012 Janusz Szczepanik CRO Quantum Satis 1 Badania kliniczne PLRG PLRG R-CVP/CHOP (PLRG4) HOVON 68 CLL Watch and Wait
Przegląd badań klinicznych PLRG Konferencja PLRG i PALG Warszawa, 16-17.03.201217.03.2012 Janusz Szczepanik CRO Quantum Satis 1 Badania kliniczne PLRG PLRG R-CVP/CHOP (PLRG4) HOVON 68 CLL Watch and Wait
Obiecujące kierunki w leczeniu chorób hematologicznych
 AKADEMIA DZIENNIKARZY MEDYCZNYCH Obiecujące kierunki w leczeniu chorób hematologicznych Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny
AKADEMIA DZIENNIKARZY MEDYCZNYCH Obiecujące kierunki w leczeniu chorób hematologicznych Grzegorz W. Basak Katedra i Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny
CHARAKTERYSTYKA HISTOPATOLOGICZNA, CYTOLOGICZNA I IMMUNOFENOTYPOWA NOWOTWORÓW WYWODZĄCYCH SIĘ Z KOMÓREK PLAZMATYCZNYCH
 CHARAKTERYSTYKA HISTOPATOLOGICZNA, CYTOLOGICZNA I IMMUNOFENOTYPOWA NOWOTWORÓW WYWODZĄCYCH SIĘ Z KOMÓREK PLAZMATYCZNYCH Grzegorz Rymkiewicz Zakład Patologii Centrum Onkologii-Instytut Im. M. Skłodowskiej-Curie
CHARAKTERYSTYKA HISTOPATOLOGICZNA, CYTOLOGICZNA I IMMUNOFENOTYPOWA NOWOTWORÓW WYWODZĄCYCH SIĘ Z KOMÓREK PLAZMATYCZNYCH Grzegorz Rymkiewicz Zakład Patologii Centrum Onkologii-Instytut Im. M. Skłodowskiej-Curie
Leczenie podtrzymujące w szpiczaku mnogim
 PRACA POGLĄDOWA Review Article Acta Haematologica Polonica 2011, 42, Nr 3, str. 381 387 HALINA URBAŃSKA-RYŚ Leczenie podtrzymujące w szpiczaku mnogim Maintenance therapy in multiple myeloma Z Katedry i
PRACA POGLĄDOWA Review Article Acta Haematologica Polonica 2011, 42, Nr 3, str. 381 387 HALINA URBAŃSKA-RYŚ Leczenie podtrzymujące w szpiczaku mnogim Maintenance therapy in multiple myeloma Z Katedry i
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
Białaczka plazmocytowa
 PRACA ORYGINALNA Original Article Acta Haematologica Polonica 2011, 42, Nr 2, str. 285 294 MARIA KRAJ Białaczka plazmocytowa Plasma cell leukemia Instytut Hematologii i Transfuzjologii w Warszawie Dyrektor:
PRACA ORYGINALNA Original Article Acta Haematologica Polonica 2011, 42, Nr 2, str. 285 294 MARIA KRAJ Białaczka plazmocytowa Plasma cell leukemia Instytut Hematologii i Transfuzjologii w Warszawie Dyrektor:
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 143/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 143/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Autologiczna transplantacja komórek krwiotwórczych u chorych na szpiczaka plazmocytowego w dobie nowych terapii
 50(3) September 2019 130 134 DOI: 10.2478/ahp-2019-0021 PRACA POGLĄDOWA/REVIEW ARTICLE journal homepage: https://content.sciendo.com/ahp Autologiczna transplantacja komórek krwiotwórczych u chorych na
50(3) September 2019 130 134 DOI: 10.2478/ahp-2019-0021 PRACA POGLĄDOWA/REVIEW ARTICLE journal homepage: https://content.sciendo.com/ahp Autologiczna transplantacja komórek krwiotwórczych u chorych na
Szpiczak plazmocytowy
 Szpiczak plazmocytowy Onkologia 2017 podsumowanie roku Grzegorz Charliński Oddział Hematologii Specjalistyczny Szpital Miejski im. Mikołaja Kopernika w Toruniu Zachorowania na SzP w Polsce ok. 1800 nowych
Szpiczak plazmocytowy Onkologia 2017 podsumowanie roku Grzegorz Charliński Oddział Hematologii Specjalistyczny Szpital Miejski im. Mikołaja Kopernika w Toruniu Zachorowania na SzP w Polsce ok. 1800 nowych
Czy wiemy jak u chorych na raka gruczołu krokowego optymalnie stosować leczenie systemowe w skojarzeniu z leczeniem miejscowym?
 Czy wiemy jak u chorych na raka gruczołu krokowego optymalnie stosować leczenie systemowe w skojarzeniu z leczeniem miejscowym? Piotr Potemski Klinika Chemioterapii Nowotworów Katedry Onkologii Uniwersytet
Czy wiemy jak u chorych na raka gruczołu krokowego optymalnie stosować leczenie systemowe w skojarzeniu z leczeniem miejscowym? Piotr Potemski Klinika Chemioterapii Nowotworów Katedry Onkologii Uniwersytet
Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008.
 załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
Prognostyczne i terapeutyczne znaczenie badań cytogenetycznych u chorych na szpiczaka mnogiego
 Prognostyczne i terapeutyczne znaczenie badań cytogenetycznych u chorych na szpiczaka mnogiego Ewa Wawrzyniak Katedra i Klinika Hematologii Uniwersytet Medyczny w Łodzi Polska Grupa Szpiczakowa Lublin
Prognostyczne i terapeutyczne znaczenie badań cytogenetycznych u chorych na szpiczaka mnogiego Ewa Wawrzyniak Katedra i Klinika Hematologii Uniwersytet Medyczny w Łodzi Polska Grupa Szpiczakowa Lublin
Szpiczak plazmocytowy
 Szpiczak plazmocytowy Krzysztof Jamroziak Konferencja Onkologia 2018 podsumowanie roku 11.12.2018 Podano daty pierwszych rejestracji na świecie lub datę publikacji istotnych doniesień dotyczących Transplantacje
Szpiczak plazmocytowy Krzysztof Jamroziak Konferencja Onkologia 2018 podsumowanie roku 11.12.2018 Podano daty pierwszych rejestracji na świecie lub datę publikacji istotnych doniesień dotyczących Transplantacje
Oznaczenie Hevylite polega na rozpoznaniu epitopów pomiędzy stałymi regionami ciężkich i lekkich łańcuchów. lg oznacza lgg, A lub M.
 Unikatowy test do dokładnego oznaczania kompletnych cząsteczek immunoglobulin. Hevylite umożliwia lepsze monitorowanie pacjentów ze szpiczakiem mnogim. Łańcuch lekki κ Łańcuch lekki λ docelowy epitop dla
Unikatowy test do dokładnego oznaczania kompletnych cząsteczek immunoglobulin. Hevylite umożliwia lepsze monitorowanie pacjentów ze szpiczakiem mnogim. Łańcuch lekki κ Łańcuch lekki λ docelowy epitop dla
BEZOBJAWOWY SZPICZAK PLAZMOCYTOWY
 CZĘŚĆ III. KLINICZNA 9. BEZOBJAWOWY SZPICZAK PLAZMOCYTOWY Iwona Hus Definicja i epidemiologia Bezobjawowy szpiczak plazmocytowy (asymptomatic multiple myeloma AMM), określany inaczej jako tlący (smouldering
CZĘŚĆ III. KLINICZNA 9. BEZOBJAWOWY SZPICZAK PLAZMOCYTOWY Iwona Hus Definicja i epidemiologia Bezobjawowy szpiczak plazmocytowy (asymptomatic multiple myeloma AMM), określany inaczej jako tlący (smouldering
Polskie doświadczenia kliniczne z bendamustyną
 Polskie doświadczenia kliniczne z bendamustyną Iwona Hus Klinika Hematoonkologii i Transplantacji Szpiku UM w Lublinie XXIII Zjazd PTHiT Wrocław 2009 Bendamustyna w leczeniu PBL monoterapia Efficacy of
Polskie doświadczenia kliniczne z bendamustyną Iwona Hus Klinika Hematoonkologii i Transplantacji Szpiku UM w Lublinie XXIII Zjazd PTHiT Wrocław 2009 Bendamustyna w leczeniu PBL monoterapia Efficacy of
Rola przeszczepienia krwiotwórczych komórek macierzystych w leczeniu chorych na szpiczaka plazmocytowego
 PRACA POGLĄDOWA Hematologia 2011, tom 2, nr 2, 131 139 Copyright 2011 Via Medica ISSN 2081 0768 Rola przeszczepienia krwiotwórczych komórek macierzystych w leczeniu chorych na szpiczaka plazmocytowego
PRACA POGLĄDOWA Hematologia 2011, tom 2, nr 2, 131 139 Copyright 2011 Via Medica ISSN 2081 0768 Rola przeszczepienia krwiotwórczych komórek macierzystych w leczeniu chorych na szpiczaka plazmocytowego
Nowotwory układu chłonnego
 Nowotwory układu chłonnego Redakcja: Krzysztof Warzocha, Monika Prochorec-Sobieszek, Ewa Lech-Marańda Zespół autorski: Sebastian Giebel, Krzysztof Jamroziak, Przemysław Juszczyński, Ewa Kalinka-Warzocha,
Nowotwory układu chłonnego Redakcja: Krzysztof Warzocha, Monika Prochorec-Sobieszek, Ewa Lech-Marańda Zespół autorski: Sebastian Giebel, Krzysztof Jamroziak, Przemysław Juszczyński, Ewa Kalinka-Warzocha,
ASH 2018: Immunomodulacja - fundamentem leczenia szpiczaka plazmocytowego
 ASH 2018: Immunomodulacja - fundamentem leczenia szpiczaka plazmocytowego dr hab. n. med. Aleksandra Butrym, Zakład Profilaktyki i Leczenia Chorób Nowotworowych, Uniwersytetu Medycznego we Wrocławiu Oddział
ASH 2018: Immunomodulacja - fundamentem leczenia szpiczaka plazmocytowego dr hab. n. med. Aleksandra Butrym, Zakład Profilaktyki i Leczenia Chorób Nowotworowych, Uniwersytetu Medycznego we Wrocławiu Oddział
Choroby krwi i układu krwiotwórczego najnowsze doniesienia z EHA
 Choroby krwi i układu krwiotwórczego najnowsze doniesienia z EHA Krzysztof Giannopoulos Centrum Onkologii Ziemi Lubelskiej Uniwersytet Medyczny w Lublinie XXI zjazd Europejskiego Towarzystwa Hematologicznego
Choroby krwi i układu krwiotwórczego najnowsze doniesienia z EHA Krzysztof Giannopoulos Centrum Onkologii Ziemi Lubelskiej Uniwersytet Medyczny w Lublinie XXI zjazd Europejskiego Towarzystwa Hematologicznego
Zespoły mielodysplastyczne
 Zespoły mielodysplastyczne J A D W I G A D W I L E W I C Z - T R O J A C Z E K K L I N I K A H E M ATO LO G I I, O N KO LO G I I I C H O R Ó B W E W N Ę T R Z N YC H WA R S Z AW S K I U N I W E R S Y T
Zespoły mielodysplastyczne J A D W I G A D W I L E W I C Z - T R O J A C Z E K K L I N I K A H E M ATO LO G I I, O N KO LO G I I I C H O R Ó B W E W N Ę T R Z N YC H WA R S Z AW S K I U N I W E R S Y T
Skuteczność, tolerancja i powikłania towarzyszące leczeniu za pomocą VMP u pacjentów ze szpiczakiem plazmocytowym
 OPIS PRZYPADKU Hematologia 2015, tom 6, supl. A, 24 30 DOI: 10.5603/Hem.2015.0006 Copyright 2015 Via Medica ISSN 2081 0768 Skuteczność, tolerancja i powikłania towarzyszące leczeniu za pomocą VMP u pacjentów
OPIS PRZYPADKU Hematologia 2015, tom 6, supl. A, 24 30 DOI: 10.5603/Hem.2015.0006 Copyright 2015 Via Medica ISSN 2081 0768 Skuteczność, tolerancja i powikłania towarzyszące leczeniu za pomocą VMP u pacjentów
S T R E S Z C Z E N I E
 STRESZCZENIE Cel pracy: Celem pracy jest ocena wyników leczenia napromienianiem chorych z rozpoznaniem raka szyjki macicy w Świętokrzyskim Centrum Onkologii, porównanie wyników leczenia chorych napromienianych
STRESZCZENIE Cel pracy: Celem pracy jest ocena wyników leczenia napromienianiem chorych z rozpoznaniem raka szyjki macicy w Świętokrzyskim Centrum Onkologii, porównanie wyników leczenia chorych napromienianych
Skuteczność i bezpieczeństwo bortezomibu (Velcade) w leczeniu nawrotowej i opornej postaci szpiczaka plazmocytowego. Doniesienie wstępne
 NOWOTWORY Journal of Oncology 2007 volume 57 Number 2 160 169 Skuteczność i bezpieczeństwo bortezomibu (Velcade) w leczeniu nawrotowej i opornej postaci szpiczaka plazmocytowego. Doniesienie wstępne Krzysztof
NOWOTWORY Journal of Oncology 2007 volume 57 Number 2 160 169 Skuteczność i bezpieczeństwo bortezomibu (Velcade) w leczeniu nawrotowej i opornej postaci szpiczaka plazmocytowego. Doniesienie wstępne Krzysztof
Aktualne miejsce bortezomibu w leczeniu szpiczaka mnogiego
 Współczesna Onkologia (2008) vol. 12; 9 (415 420) Szpiczak mnogi (SzM) pozostaje nieuleczalnym nowotworem układu chłonnego. Zastosowanie nowych leków w terapii tej choroby, w tym inhibitora proteasomu
Współczesna Onkologia (2008) vol. 12; 9 (415 420) Szpiczak mnogi (SzM) pozostaje nieuleczalnym nowotworem układu chłonnego. Zastosowanie nowych leków w terapii tej choroby, w tym inhibitora proteasomu
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Przewlekła białaczka limfocytowa
 Przewlekła białaczka limfocytowa Ewa Lech-Marańda Klinika Hematologii Instytutu Hematologii i Transfuzjologii Klinika Hematologii i Transfuzjologii CMKP Przewlekła białaczka limfocytowa (CLL) Początek
Przewlekła białaczka limfocytowa Ewa Lech-Marańda Klinika Hematologii Instytutu Hematologii i Transfuzjologii Klinika Hematologii i Transfuzjologii CMKP Przewlekła białaczka limfocytowa (CLL) Początek
Rekomendacja nr 88/2012 z dnia 29 października 2012 r. Prezesa Agencji Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 88/2012 z dnia 29 października 2012 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 88/2012 z dnia 29 października 2012 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Hematoonkologia w liczbach. Dr n med. Urszula Wojciechowska
 Hematoonkologia w liczbach Dr n med. Urszula Wojciechowska Nowotwory hematologiczne wg Międzynarodowej Statystycznej Klasyfikacji Chorób i Problemów Zdrowotnych (rew 10) C81 -Chłoniak Hodkina C82-C85+C96
Hematoonkologia w liczbach Dr n med. Urszula Wojciechowska Nowotwory hematologiczne wg Międzynarodowej Statystycznej Klasyfikacji Chorób i Problemów Zdrowotnych (rew 10) C81 -Chłoniak Hodkina C82-C85+C96
Leczenie zaawansowanych (nieresekcyjnych i/lub przerzutowych) GIST Nieoperacyjny lub rozsiany GIST jest oporny na konwencjonalną chemioterapię.
 Leczenie zaawansowanych (nieresekcyjnych i/lub przerzutowych) GIST Nieoperacyjny lub rozsiany GIST jest oporny na konwencjonalną chemioterapię. Rola radioterapii nie jest ostatecznie ustalona. Dotychczasowe
Leczenie zaawansowanych (nieresekcyjnych i/lub przerzutowych) GIST Nieoperacyjny lub rozsiany GIST jest oporny na konwencjonalną chemioterapię. Rola radioterapii nie jest ostatecznie ustalona. Dotychczasowe
Leczenie chorych na szpiczaka mnogiego poniżej 65. 70. roku życia oraz rola terapii podtrzymującej po przeszczepieniu komórek macierzystych
 Leczenie chorych na szpiczaka mnogiego poniżej 65. 70. roku życia oraz rola terapii podtrzymującej po przeszczepieniu komórek macierzystych Treatment of patients with multiple myeloma than 65 70 years
Leczenie chorych na szpiczaka mnogiego poniżej 65. 70. roku życia oraz rola terapii podtrzymującej po przeszczepieniu komórek macierzystych Treatment of patients with multiple myeloma than 65 70 years
Lek. Dominika Kulej. Przebieg kliniczny a wyjściowy status białek oporności wielolekowej w leczeniu ostrej białaczki limfoblastycznej u dzieci
 Lek. Dominika Kulej Katedra i Hematologii Dziecięcej Uniwersytetu Medycznego im. Piastów Śląskich we Wrocławiu Przebieg kliniczny a wyjściowy status białek oporności wielolekowej w leczeniu ostrej białaczki
Lek. Dominika Kulej Katedra i Hematologii Dziecięcej Uniwersytetu Medycznego im. Piastów Śląskich we Wrocławiu Przebieg kliniczny a wyjściowy status białek oporności wielolekowej w leczeniu ostrej białaczki
PROTOKÓŁ BADANIA BGD
 PROTOKÓŁ BADANIA BGD TYTUŁ Badanie obserwacyjne dotyczące zastosowania bendamustyny w połączeniu z gemcytabiną i deksametazonem (BGD) w leczeniu chorych na chłoniaka Hodgkina w fazie oporności lub nawrotu
PROTOKÓŁ BADANIA BGD TYTUŁ Badanie obserwacyjne dotyczące zastosowania bendamustyny w połączeniu z gemcytabiną i deksametazonem (BGD) w leczeniu chorych na chłoniaka Hodgkina w fazie oporności lub nawrotu
Informacja prasowa. Ruszył drugi cykl spotkań edukacyjnych dla chorych na szpiczaka mnogiego
 Informacja prasowa Ruszył drugi cykl spotkań edukacyjnych dla chorych na szpiczaka mnogiego Warszawa, 28 października Chorzy na szpiczaka mnogiego w Polsce oraz ich bliscy mają możliwość uczestniczenia
Informacja prasowa Ruszył drugi cykl spotkań edukacyjnych dla chorych na szpiczaka mnogiego Warszawa, 28 października Chorzy na szpiczaka mnogiego w Polsce oraz ich bliscy mają możliwość uczestniczenia
Personalizacja leczenia w hematoonkologii dziecięcej
 MedTrends 2016 Europejskie Forum Nowoczesnej Ochrony Zdrowia Zabrze, 18-19 marca 2016 r. Personalizacja leczenia w hematoonkologii dziecięcej Prof. dr hab. n. med. Tomasz Szczepański Katedra i Klinika
MedTrends 2016 Europejskie Forum Nowoczesnej Ochrony Zdrowia Zabrze, 18-19 marca 2016 r. Personalizacja leczenia w hematoonkologii dziecięcej Prof. dr hab. n. med. Tomasz Szczepański Katedra i Klinika
Leki o silnych właściwościach immunomodulujących talidomid, lenalidomid i pomalidomid w leczeniu szpiczaka mnogiego
 Współczesna Onkologia (2009) vol. 13; 5 (265 275) Szpiczak mnogi (multiple myeloma MM) jest nieuleczalnym nowotworem złośliwym, charakteryzującym się naciekiem szpiku kostnego przez patologiczne komórki
Współczesna Onkologia (2009) vol. 13; 5 (265 275) Szpiczak mnogi (multiple myeloma MM) jest nieuleczalnym nowotworem złośliwym, charakteryzującym się naciekiem szpiku kostnego przez patologiczne komórki
czerniak (nowotwór skóry), który rozprzestrzenił się lub którego nie można usunąć chirurgicznie;
 EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Terapia nawrotowego i opornego szpiczaka plazmocytowego
 PRACA POGLĄDOWA Hematologia 2011, tom 2, nr 1, 116 130 Copyright 2011 Via Medica ISSN 2081 0768 Terapia nawrotowego i opornego szpiczaka plazmocytowego Therapy of relapsed and refractory plasma cell myeloma
PRACA POGLĄDOWA Hematologia 2011, tom 2, nr 1, 116 130 Copyright 2011 Via Medica ISSN 2081 0768 Terapia nawrotowego i opornego szpiczaka plazmocytowego Therapy of relapsed and refractory plasma cell myeloma
CHOROBY ROZROSTOWE UKŁADU KRWIOTWÓRCZEGO BIAŁACZKI WIEKU DZIECIĘCEGO
 CHOROBY ROZROSTOWE UKŁADU KRWIOTWÓRCZEGO BIAŁACZKI WIEKU DZIECIĘCEGO ZWIĘKSZONE RYZYKO WYSTĄPIENIA BIAŁACZKI Zakażenia wirusowe Promieniowanie jonizujące Związki chemiczne (benzen- ANLL) Środki alkilujące
CHOROBY ROZROSTOWE UKŁADU KRWIOTWÓRCZEGO BIAŁACZKI WIEKU DZIECIĘCEGO ZWIĘKSZONE RYZYKO WYSTĄPIENIA BIAŁACZKI Zakażenia wirusowe Promieniowanie jonizujące Związki chemiczne (benzen- ANLL) Środki alkilujące
Zastosowanie bortezomibu w I linii leczenia chorych na szpiczaka plazmocytowego i niewydolność nerek
 OPIS PRZYPADKU Hematologia 2015, tom 6, supl. A, 1 6 DOI: 10.5603/Hem.2015.0001 Copyright 2015 Via Medica ISSN 2081 0768 Zastosowanie bortezomibu w I linii leczenia chorych na szpiczaka plazmocytowego
OPIS PRZYPADKU Hematologia 2015, tom 6, supl. A, 1 6 DOI: 10.5603/Hem.2015.0001 Copyright 2015 Via Medica ISSN 2081 0768 Zastosowanie bortezomibu w I linii leczenia chorych na szpiczaka plazmocytowego
Terapeutyczne Programy Zdrowotne 2012 Leczenie glejaków mózgu Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r.
 Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE GLEJAKÓW MÓZGU ICD-10 C71 nowotwór złośliwy mózgu Dziedzina medycyny: Onkologia kliniczna,
Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE GLEJAKÓW MÓZGU ICD-10 C71 nowotwór złośliwy mózgu Dziedzina medycyny: Onkologia kliniczna,
Lek. Krzysztof Forgacz. Oddział Onkologiczny Miedziowego Centrum Zdrowia w Lubinie
 UNIWERSYTET MEDYCZNY IM. PIASTÓW ŚLĄSKICH WE WROCŁAWIU Lek. Krzysztof Forgacz Oddział Onkologiczny Miedziowego Centrum Zdrowia w Lubinie Chemioterapia drugiej linii zaawansowanego raka jelita grubego czynniki
UNIWERSYTET MEDYCZNY IM. PIASTÓW ŚLĄSKICH WE WROCŁAWIU Lek. Krzysztof Forgacz Oddział Onkologiczny Miedziowego Centrum Zdrowia w Lubinie Chemioterapia drugiej linii zaawansowanego raka jelita grubego czynniki
Białaczka limfatyczna
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
Badanie Kliniczne. Streszczenie. Wprowadzenie. Clinical Lymphoma, Myeloma & Leukemia, grudzień 2010 1
 Wpływ czasu trwania terapii lenalidomidem z deksametazonem na przeżywalność pacjentów z nawrotowym lub opornym na leczenie szpiczakiem mnogim leczonych lenalidomidem z deksametazonem Jesús F. San-Miguel,
Wpływ czasu trwania terapii lenalidomidem z deksametazonem na przeżywalność pacjentów z nawrotowym lub opornym na leczenie szpiczakiem mnogim leczonych lenalidomidem z deksametazonem Jesús F. San-Miguel,
LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20)
 Dziennik Urzędowy Ministra Zdrowia 511 Poz. 42 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie zaawansowanego
Dziennik Urzędowy Ministra Zdrowia 511 Poz. 42 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie zaawansowanego
BADANIA RADIOLOGICZNE, TOMOGRAFIA KOMPUTEROWA, REZONANS MAGNETYCZNY W DIAGNOSTYCE
 BADANIA RADIOLOGICZNE, TOMOGRAFIA KOMPUTEROWA, REZONANS MAGNETYCZNY W DIAGNOSTYCE SZPICZAKA MNOGIEGO Bartosz Białczyk Ośrodek Diagnostyki, Terapii i Telemedycyny KSS im. Jana Pawła II Szpiczak mnogi multiple
BADANIA RADIOLOGICZNE, TOMOGRAFIA KOMPUTEROWA, REZONANS MAGNETYCZNY W DIAGNOSTYCE SZPICZAKA MNOGIEGO Bartosz Białczyk Ośrodek Diagnostyki, Terapii i Telemedycyny KSS im. Jana Pawła II Szpiczak mnogi multiple
Radioterapia radykalna i paliatywna w szpiczaku plazmocytowym. Dr n. med. Katarzyna Pudełek
 Radioterapia radykalna i paliatywna w szpiczaku plazmocytowym Dr n. med. Katarzyna Pudełek Rola radioterapii w szpiczaku plazmocytowym Radykalna radioterapia szpiczaka odosobnionego kostnego i pozakostnego
Radioterapia radykalna i paliatywna w szpiczaku plazmocytowym Dr n. med. Katarzyna Pudełek Rola radioterapii w szpiczaku plazmocytowym Radykalna radioterapia szpiczaka odosobnionego kostnego i pozakostnego
Kliniczna wartość ilościowych oznaczeń wolnych lekkich łańcuchów immunoglobulinowych w surowicy chorych na szpiczaka plazmocytowego
 NOWOTWORY Journal of Oncology 2011 volume 61 Number 4 355 362 Kliniczna wartość ilościowych oznaczeń wolnych lekkich łańcuchów immunoglobulinowych w surowicy chorych na szpiczaka plazmocytowego Maria Kraj,
NOWOTWORY Journal of Oncology 2011 volume 61 Number 4 355 362 Kliniczna wartość ilościowych oznaczeń wolnych lekkich łańcuchów immunoglobulinowych w surowicy chorych na szpiczaka plazmocytowego Maria Kraj,
Typ histopatologiczny
 Typ histopatologiczny Wiek Stopieo zróżnicowania nowotworu Typ I (hormonozależny) Adenocarcinoma Adenoacanthoma Naciekanie przestrzeni naczyniowych Wielkośd guza Typ II (hormononiezależny) Serous papillary
Typ histopatologiczny Wiek Stopieo zróżnicowania nowotworu Typ I (hormonozależny) Adenocarcinoma Adenoacanthoma Naciekanie przestrzeni naczyniowych Wielkośd guza Typ II (hormononiezależny) Serous papillary
Postępy w diagnostyce szpiczaka plazmocytowego
 Postępy w diagnostyce szpiczaka plazmocytowego dr med. Artur Jurczyszyn - Katedra i Klinika Hematologii CM UJ w Krakowie Henry Bence Jones Sarah Newbury destrukcja kości udowych w wyniku patologicznych
Postępy w diagnostyce szpiczaka plazmocytowego dr med. Artur Jurczyszyn - Katedra i Klinika Hematologii CM UJ w Krakowie Henry Bence Jones Sarah Newbury destrukcja kości udowych w wyniku patologicznych
LECZENIE KOBIET Z ROZSIANYM, HORMONOZALEŻNYM, HER2 UJEMNYM RAKIEM PIERSI. Maria Litwiniuk Warszawa 28 maja 2019
 LECZENIE KOBIET Z ROZSIANYM, HORMONOZALEŻNYM, HER2 UJEMNYM RAKIEM PIERSI Maria Litwiniuk Warszawa 28 maja 2019 Konflikt interesów Wykłady sponsorowane dla firm: Teva, AstraZeneca, Pfizer, Roche Sponorowanie
LECZENIE KOBIET Z ROZSIANYM, HORMONOZALEŻNYM, HER2 UJEMNYM RAKIEM PIERSI Maria Litwiniuk Warszawa 28 maja 2019 Konflikt interesów Wykłady sponsorowane dla firm: Teva, AstraZeneca, Pfizer, Roche Sponorowanie
Keytruda (pembrolizumab)
 EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
Rak trzustki cele terapeutyczne. Sekwencja leczenia.
 Rak trzustki cele terapeutyczne. Sekwencja leczenia. Leszek Kraj Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Samodzielny Publiczny Centralny Szpital Kliniczny W
Rak trzustki cele terapeutyczne. Sekwencja leczenia. Leszek Kraj Klinika Hematologii, Onkologii i Chorób Wewnętrznych Warszawski Uniwersytet Medyczny Samodzielny Publiczny Centralny Szpital Kliniczny W
This copy is for personal use only - distribution prohibited.
 - - - - - Streszczenie Szpiczak mnogi. Praktyczne aspekty diagnostyki i leczenia Multiple myeloma. Practical aspects regarding diagnosis and treatment dr hab. n. med. Andrzej Pluta Oddział Hematoonkologii,
- - - - - Streszczenie Szpiczak mnogi. Praktyczne aspekty diagnostyki i leczenia Multiple myeloma. Practical aspects regarding diagnosis and treatment dr hab. n. med. Andrzej Pluta Oddział Hematoonkologii,
c) poprawa jakości życia chorych z nieziarniczym chłoniakiem typu grudkowego w III i IV stopniu
 Nazwa programu: Terapeutyczne Programy Zdrowotne 2012 Załącznik nr 9 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011r. LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
Nazwa programu: Terapeutyczne Programy Zdrowotne 2012 Załącznik nr 9 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011r. LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
Efektywna kontrola chorych po leczeniu nowotworów jąder
 Efektywna kontrola chorych po leczeniu nowotworów jąder Marzena Wełnicka-Jaśkiewicz Klinika Onkologii i Radioterapii Gdańskiego Uniwersytetu Medycznego Efektywna kontrola ścisła obserwacja po leczeniu
Efektywna kontrola chorych po leczeniu nowotworów jąder Marzena Wełnicka-Jaśkiewicz Klinika Onkologii i Radioterapii Gdańskiego Uniwersytetu Medycznego Efektywna kontrola ścisła obserwacja po leczeniu
Unikatowy test do dokładnego oznaczania kompletnych cząsteczek immunoglobulin.
 Unikatowy test do dokładnego oznaczania kompletnych cząsteczek immunoglobulin. Testy Hevylite pozwalają na lepsze monitorowanie pacjentów ze szpiczakiem mnogim. Spis treści 1 Analiza par łańcuchów ciężki/lekki
Unikatowy test do dokładnego oznaczania kompletnych cząsteczek immunoglobulin. Testy Hevylite pozwalają na lepsze monitorowanie pacjentów ze szpiczakiem mnogim. Spis treści 1 Analiza par łańcuchów ciężki/lekki
Rysunek. Układ limfatyczny.
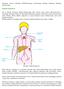 Informacja dotyczy chłoniaka limfoblastycznego stanowiącego odmianę złośliwego chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
Informacja dotyczy chłoniaka limfoblastycznego stanowiącego odmianę złośliwego chłoniaka nieziarniczego. Chłoniak nieziarniczy Jest to choroba rozrostowa układu limfatycznego, który stanowi część systemu
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU
Piotr Potemski. Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi
 Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Obserwowane są samoistne regresje zmian przerzutowych
Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Obserwowane są samoistne regresje zmian przerzutowych
Problemy kostne u chorych ze szpiczakiem mnogim doświadczenia własne
 Problemy kostne u chorych ze szpiczakiem mnogim doświadczenia własne dr n.med. Piotr Wojciechowski Szpiczak Mnogi Szpiczak Mnogi (MM) jest najczęstszą przyczyną pierwotnych nowotworów kości u dorosłych.
Problemy kostne u chorych ze szpiczakiem mnogim doświadczenia własne dr n.med. Piotr Wojciechowski Szpiczak Mnogi Szpiczak Mnogi (MM) jest najczęstszą przyczyną pierwotnych nowotworów kości u dorosłych.
Rola i zakres limfadenektomii w raku pęcherza moczowego
 Tomasz Borkowski Department of Urology Medical University of Warsaw Rola i zakres limfadenektomii w raku pęcherza moczowego VII Pomorskie spotkanie Uroonkologiczne Rak pęcherza moczowego Henry Gray (1825
Tomasz Borkowski Department of Urology Medical University of Warsaw Rola i zakres limfadenektomii w raku pęcherza moczowego VII Pomorskie spotkanie Uroonkologiczne Rak pęcherza moczowego Henry Gray (1825
Uniwersytet Przyrodniczy we Wrocławiu. Wydział Medycyny Weterynaryjnej. Katedra Biochemii, Farmakologii i Toksykologii.
 Uniwersytet Przyrodniczy we Wrocławiu Wydział Medycyny Weterynaryjnej Katedra Biochemii, Farmakologii i Toksykologii Aleksandra Pawlak CHARAKTERYSTYKA FENOTYPOWA KOMÓREK CHŁONIAKÓW I BIAŁACZEK PSÓW ORAZ
Uniwersytet Przyrodniczy we Wrocławiu Wydział Medycyny Weterynaryjnej Katedra Biochemii, Farmakologii i Toksykologii Aleksandra Pawlak CHARAKTERYSTYKA FENOTYPOWA KOMÓREK CHŁONIAKÓW I BIAŁACZEK PSÓW ORAZ
This article appeared in a journal published by Elsevier. The attached copy is furnished to the author for internal non-commercial research and
 This article appeared in a journal published by Elsevier. The attached copy is furnished to the author for internal non-commercial research and education use, including for instruction at the authors institution
This article appeared in a journal published by Elsevier. The attached copy is furnished to the author for internal non-commercial research and education use, including for instruction at the authors institution
PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ I OSTRĄ BIAŁACZKĘ SZPIKOWĄ
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka szpikowa OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ I OSTRĄ BIAŁACZKĘ SZPIKOWĄ Dasatinib Dasatinib jest wskazany do leczenia dorosłych pacjentów z:
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka szpikowa OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ I OSTRĄ BIAŁACZKĘ SZPIKOWĄ Dasatinib Dasatinib jest wskazany do leczenia dorosłych pacjentów z:
