Równowagi w układach jedno- i dwuskładnikowych
|
|
|
- Amelia Czerwińska
- 5 lat temu
- Przeglądów:
Transkrypt
1 Równowagi w układach jedno- i dwuskładnikowych Równowaga faz i równanie Clausiusa-Claeyrona Rozatrzmy cykl Carnota na oziomych odcinkach izoterm i CD, odowiadających równowadze ciecz-ara ewnej substancji. T kr Na odcinku układ (ciecz + ara obiera cieło Q otrzebne do odarowania części cieczy. Na odcinku CD układ oddaje cieło Q ciecz ( D C T T- T ara ( Na odcinkach C i D: Q. Przejście C wybieramy tak, aby cieło wydzielone rzy schłodzeniu o T sowodowało odarowanie cieczy zwiększając nieco objętość układu w stanie C. Odowiednio w rzejściu D. n (V V V Zmiana entroii w całym cyklu wynosi zero. Zatem: Q Q S S + S T T T skąd wynika: Q Q T Q ( T Różnica Q Q stanowi racę w cyklu: Q Q W n (V V, gdzie V i V są, odowiednio, objętościami molowymi cieczy i ary; n jest liczbą moli. Wstawiając to wyrażenie i odstawiając jednocześnie: Q n H otrzymujemy: n ( V V T n H T T T H ( V V d H a w granicy: dt T ( V V Równanie C-C odaje związek między zmianą ciśnienia i odowiadającą temu zmianą temeratury z zachowaniem równowagi dwu faz. Stosuje się do dowolnej rzemiany fazowej: arowania (jak owyżej, tonienia, sublimacji. Pozwala n.
2 obliczyć zmianę temeratury wrzenia lub zmianę temeratury krzenięcia wskutek zmiany ciśnienia. Równanie C-C można rzedstawić w ostaci nieco uroszczonej zaniedbując objętość właściwą cieczy (lub ciała stałego w orównaniu z odowiednią objętością ary ( V ara-ciecz V P V C V P, oraz rzyjmując, że ara stosuje się (w rzybliżeniu do r-nia stanu gazu doskonałego, tj. objętość molowa ary: RT V P Podstawiając ten związek arametrów stanu do r-nia C-C otrzymamy: d dt a o scałkowaniu: H RT ar H ar H ln + const. C e R T RT Tę wykładniczą zależność ciśnienia ary nasyconej od temeratury objaśnia w rosty sosób rozkład oltzmanna (. nast. strona. ar Przykład Jakie ciśnienie jest otrzebne do obniżenia temeratury tonienia lodu o stoień? Niech lód, woda. Z gęstości lodu (w C: d.967 g/cm 3 oraz wody: d.9998 g/cm 3 otrzymujemy objętości molowe: V (8 g/d 9.63 cm 3, V (8 g/d 8. cm 3, a stąd V V.63 cm 3. Z kolei cieło tonienia lodu: H kj/kg 6. kj/mol. Podstawiając te wartości do r-nia C-C otrzymujemy: H 7.35 Pa/K 35 atm/k T T V V ( więc lód toi się w temeraturze - C doiero od ciśnieniem 35 atmosfer. Przykład Pod jakim ciśnieniem będzie wrzeć woda o temeraturze 95 ºC? Cieło arowania wody: cal/g cal/g 56 J/g 56 8 J/mol 468 J/mol4,68 kj/mol. 468 ln 76 mm Hg Wyznaczając stąd ciśnienie, dostajemy: 636 mm Hg.
3 Prężność ary nad cieczą. Ciecz znajdująca się w oróżnionym z owietrza ojemniku w warunkach izotermicznych aruje do osiągnięcia równowagi między szybkością arowania i jednoczesnego skralania. Ciśnienie ary nasyconej w określonej temeraturze rężność ary. Zależność rężności ar cieczy od temeratury. (arrow 455 Zależność log( od /T dla niektórych cieczy (arrow 458 Od cieczy odrywają się tylko takie cząsteczki, które mają energię kinetyczną (E wystarczającą do okonania międzycząsteczkowych sił rzyciągania. Liczba takich cząsteczek stanowi ułamek ogólnej liczby cząsteczek cieczy, wynikający z rozkładu oltzmanna. Prężność ary, roorcjonalna do liczby takich oderwanych cząsteczek (dla gazu: n kt, owinna więc sełniać zależność: N e lub: ln + const ( E > E E kt Zależności (T oraz log(t dla różnych cieczy rzedstawiają rysunki owyżej, oraz szczegółowy wykres dla wody oniżej. E RT 3
4 Ciśnienie nasyconej ary wodnej w zależności od temeratury kr. 5 Pa, T kr K 374 C, d kr.3 g/cm ( 5 Pa temeratura ( o C log ( - - cieło arowania (- C e E RT log ( logc E.3R T E 4 J/kg (omiar bezośr.: 56 J/kg /T
5 Reguła Troutona Iloraz cieła arowania cieczy w normalnej temeraturze wrzenia rzez temeraturę wrzenia ( entroia arowania ma stałą wartość i wynosi: S ar H T wrz ar cal mol deg J 88 mol deg Zależność ta jest dobrze sełniana rzez ciecze, w których nie wystęuje asocjacja cząsteczek, szczególnie gdy nie wystęują wiązania wodorowe. ciecz t wrz (ºC S ar H ar /T wrz (cal/mol K Hel Wodór n-utan Metan Eter etylowy Czterochlorek węgla enzen 8..8 Chloroform 6.5. Siarkowodór Rtęć moniak Woda 6. 5
6 Naięcie owierzchniowe γ W S woda (ºC C H 5 OH (ºC C 6 H 6 (ºC Hg (ºC 7.7 mn/m.3 mn/m 8.9 mn/m 48 mn/m Naięcie owierzchniowe maleje ze wzrostem temeratury i zależy od krzywizny owierzchni cieczy. Ta zależność ma nastęujące objaśnienie. Rozważmy rzejście dn moli ary znad łaskiej owierzchni cieczy, gdzie rężność ary jest, nad owierzchnię zakrzywioną nad którą rężność ary może być inna (. Obie owierzchnie cieczy ozostają w stanie równowagi z własną arą. (dg dr Temu rzejściu towarzyszy zmiana entalii swobodnej całego układu: dg dn RT ln dn RT ln dn RT ln (* Ponieważ ara ozostaje w równowadze z cieczą, w naczyniu ubytek ary zostanie uzuełniony rzez odarowanie dn moli cieczy, zaś w naczyniu skroli się dodatkowe dn moli ary. Jednak w zwiększa się rzy tym owierzchnia kroli, a zatem jej energia owierzchniowa (co nie wystęuje na łaskiej owierzchni cieczy w. Energia dg nadana dn molom cząsteczek ary wyrażona wzorem (* stanowi więc wzrost energii owierzchniowej kroli. Mamy więc: ( ( dg γ ds γ 4π r + dr 4π r 8π γ r dr Jednocześnie dla kroli zachodzi związek: 4π dm r dr ρ dn µ ρ µ masa cząsteczkowa, ρ gęstość cieczy 6
7 Podstawiamy stąd dr do orzedniego równania i otrzymujemy: µ dg 8πγr dn 4πr ρ γµ dn ρr a o rzyrównaniu tego wyrażenia do (* dostajemy wzór: ln γµ rρrt który wyraża wzrost rężności ary nad owierzchnią zakrzywioną cieczy. Dla wody owyższy wzór rzewiduje: r (cm r (Å / Dane te wskazują na duży wzrost rężności ary nad owierzchnią małych kroelek. Ten wzrost rężności ary oznacza intensywne arowanie cieczy z kroli, które utrudnia skralanie. Wzrasta rzy tym rola kondensacji cieczy na yłach i skuiskach jonów. Efekty te wynikają z dużej energii owierzchniowej substancji silnie rozdrobnionych. Energia owierzchniowa może stanowić ważny czynnik w zjawiskach z udziałem cieczy i ary. Również krystalizacja z roztworu może rowadzić do różnych struktur krystalicznych w zależności od energii owierzchniowej kryształu. Dobrze znany rzykład: tlenek tytanu TiO w dużych kryształach (>nm ma inną strukturę krystaliczną (rutyl, a inną gdy wystęuje w ostaci kryształów nanometrowych (anataz. nataz ma energię owierzchniową mniejszą (+.4 J/m niż rutyl (+. J/m, dlatego anataz jest energetycznie korzystniejszy gdy owierzchnia całkowita nanokryształów jest kilkaset m /gram. 7
8 Płyny w warunkach od- i nadkrytycznych suercritical fluid Diagram fazowy ojedynczej substancji (dla wody unkt otrójny ma arametry: T. C, P 6 Pa Ciecz lub gaz osiągają stan nadkrytyczny (SCF suercritical fluid, gdy temeratura i ciśnienie rzekraczają arametry krytyczne. Temeratura, o rzekroczeniu której substancja może znajdować się tylko w stanie gazowym nazywana jest temeraturą krytyczną, a ciśnieniem krytycznym jest ciśnienie ary nasyconej w temeraturze krytycznej. Płyny w stanie nadkrytycznym nie skralają się wskutek odniesienie ciśnienia ani nie rzechodzą w stan gazowy orzez odwyższenie temeratury. Po rzekroczeniu unktu krytycznego zanika granica między stanem ciekłym i gazowym, a łyn osiada właściwości ośrednie omiędzy właściwościami cieczy i gazu (tabela. Porzez zmianę temeratury lub ciśnienia można zmieniać właściwości fizykochemiczne cieczy w stanie nadkrytycznym. Tabela. ciecz w war. norm. łyn w stanie nadkrytycznym gaz w war. norm. gęstość [kg m -3 ] - 8 lekość [Pa s] wsółczynnik dyfuzji [m s - ] Woda w stanie odkrytycznym (subcritical water: 5 o C < T < 374 o C i > kr, a określenie "woda w stanie nadkrytycznym" odnosi się do wody o wartościach temeratury oraz ciśnienia wyższych niż krytyczne. Interesującym zastosowaniem CO w stanie nadkrytycznym jest ekstrakcja kofeiny z zielonych ziaren kawy, stosowana w rodukcji kawy bezkofeinowej. Jest to technologia b. czysta, nie ozostawiająca w rzerabianym materiale żadnych ozostałości. Wodę w stanie odkrytycznym stosuje się w tzw. syntezie hydrotermalnej (nanokrystaliczny TiO. 8
9 Reguła faz (Gibbsa Faza część układu jednorodna od względem fizycznym i oddzielona od reszty układu wyraźną granicą (faza ciekła, stała, gazowa, koloidalna,... Parametry intensywne charakteryzują układ niezależnie od jego wielkości. Są to:, T,,, 3,.... ara wody + ara jodu W układzie złożonym z s składników liczba niezależnych wartości ułamków molowych w jednej fazie wynosi: (s- ułamków molowych (s-ty ułamek wynika z ozostałych na mocy równości: s. Zatem w f fazach wynosi: f (s-. Do tego należy dodać dwa arametry ciśnienie i temeraturę odnoszące się do całości układu. Parametrów stanu jest więc: f ( s + Jednak w stanie równowagi liczba niezależnych arametrów odlega dodatkowemu ograniczeniu. Warunkiem równowagi termodynamicznej jest równość otencjałów chemicznych każdego składnika w oszczególnych fazach. W układzie s składników w f fazach muszą więc być sełnione równości: µ µ ( ( ( s ( ( ( s (3 (3... µ µ µ µ µ µ µ (3 s... µ... µ... µ Układy wieloskładnikowe ( f ( f ( f s Liczba równań, które muszą być sełnione wynosi s (f-. Zatem liczba niezależnych arametrów intensywnych - stoni swobody - wynosi: ( ( jod F f s + s f s f + woda + jod s f3 s liczba składników f liczba faz 9
10 Układy jednoskładnikowe Ułamki molowe (jedynego składnika w każdej z faz: ( (. Zmienne intensywne arametry stanu: tylko, T. W układzie jednoskładnikowym mogą istnieć:. Jedna faza. Wówczas F, co na wykresie fazowym odowiada n. wodzie w fazie lodu rzy różnych wartościach dwu arametrów i T, które można zmieniać niezależnie i jednocześnie.. Dwie fazy. Wówczas F, co odowiada zależnościom temeratur tonienia i wrzenia od ciśnienia. Możliwa jest zmiana jedynego swobodnego arametru, ozostałe dostosują się same. Zmiany i T odlegają rzy tym r-niu C-C. Podobnie zmiana temeratury sowoduje jednoznacznie określoną zmianę wszystkich ozostałych arametrów intensywnych. Wzrost temeratury układu ciecz-ara sowoduje zwiększenie ilości substancji w fazie ary i taki wzrost ciśnienia ary, że jedyny składnik tego układu nadal ozostanie w równowadze między obiema fazami. 3. Trzy fazy. Wówczas F i stan taki nie oddaje się żadnym zmianom; o zmianie lub T natychmiast znika jedna z faz. Taki stan (unkt otrójny istnieje tylko w ściśle określonych warunkach. Dla wody: t.98 ºC, 4.58 mm Hg. Wykresy fazowe wody w szerokich zakresach ciśnienia i temeratury
11 Układy dwuskładnikowe (roztwory Konwencja: rozuszczalnik, substancja rozuszczona Ciśnienie arcjalne (rężność ary nasyconej i-tego składnika roztworu jest: i i ułamek molowy składnika w roztworze, i i Jest to rawo Raoulta: i rężność ary nad czystym składnikiem rężność ary danego składnika nad roztworem jest roorcjonalna do ułamka molowego tego składnika w roztworze Roztwory sełniające rawo Raoulta określane są jako doskonałe. Roztwory substancji nielotnych W rzyadku roztworu substancji nielotnej ( z rawa Raoulta wynika, że: ( + względne obniżenie ciśnienia ary rozuszczalnika nad roztworem jest równe ułamkowi molowemu substancji rozuszczonej (nielotnej Obniżenie ciśnienia ary rozuszczalnika nad roztworem jest skutkiem związania części molekuł rozuszczalnika z substancją rozuszczoną. Ten efekt rowadzi do obniżenia aktywności rozuszczalnika, olegającej na zmniejszeniu jego efektywności.
12 Przykład zastosowanie rawa Raoulta do wyznaczania mas cząsteczkowych W g eteru etylowego rozuszczono g (nielotnego benzaldehydu. W temeraturze 5 ºC rężność ary eteru nad roztworem wynosi 337. mm Hg, zaś rężność ary nad czystym eterem w tej temeraturze wynosi 36.7 mm Hg. Obliczyć masę cząsteczkową benzaldehydu M. n n + n m M m M m + M rzy czym: M 74. g (eter Znając względne obniżenie ciśnienia ary otrzymujemy: M 6 g. Obniżenie rężności ary nad roztworem owoduje również: odwyższenie temeratury wrzenia, obniżenie temeratury krzenięcia roztworu w orównaniu z czystym rozuszczalnikiem. Efekty te rzedstawia wykres fazowy czystego rozuszczalnika i roztworu. H Z równania C-C: T RT ciało stałe ciecz rozuszcz. roztworu wynika: H wrz Twrz RT (T temeratura wrzenia ara a nastęnie: H RT wrz T wrz T krz < T wrz > T Efekty te są odstawą ebuliometrii i kriometrii, służących głównie do wyznaczania mas cząsteczkowych. Pochodną rawa Raoulta jest rawo Henry ego: dla roztworów rozcieńczonych rężność ary substancji rozuszczonej jest roorcjonalna do jej stężenia (zamiast ułamka molowego w roztworze.
13 Równowaga ciecz-ara w układzie dwuskładnikowym W układzie dwuskładnikowym rężność ary nad roztworem: + Z rawa Raoulta oraz ze związku: + wynika: ( + + ( + ciśnienie ary + skład roztworu ułamek molowy benzenu w cieczy Prężność ary nad roztworem doskonałym jest liniową funkcją składu roztworu. Wykresy rężności ary w funkcji składu roztworów rzeczywistych mogą wykazywać minimum lub maksimum na wykresie sumarycznej rężności ary: 3
14 4 W stanie równowagi ułamki molowe obu składników w fazie ary ( wynoszą: c + + ( ( c + + ( ( Podzielenie stronami daje równanie: ( ( ( ( c c (**** Ułamek molowy składnika w fazie ary ( jest inny niż w fazie cieczy (c. Para jest wzbogacona w składnik bardziej lotny. Równowagi ciecz-ara w układach dwuskładnikowych rzedstawiane są na odwójnych wykresach odających oddzielnie zależność ciśnienia całkowitego ary od ułamków molowych w fazie cieczy i oddzielnie zależność ciśnienia ary od ułamków molowych w fazie ary.
15 Powyższy wykres wynika z nastęujących obliczeń. W równaniu (**** rzyjmujemy: benzen, toluen i odstawiamy: ( c t ( t Wynika stąd wzór: b ( b ( b ( c b ( b ( c ( c b z którego dla określonej wartości b (c można wyznaczyć b (. b o t Przykład Z wykresu odczytujemy: mieszanina o ułamku molowym benzenu.33 (zaś toluenu.67 w temeraturze ºC ma ciśnienie ary 4 mm Hg. Przy tym ciśnieniu ara zawiera ułamek molowy benzenu ok..64, znacznie większy niż w cieczy. Z wzoru dla b 77 mmhg, t mmhg otrzymujemy: b ( b ( a stąd: b (.646 (zaś t (.354 W arze nad cieczą w tych warunkach jest ułamek molowy benzenu.646, zaś toluenu.354. Wynik obliczenia jest zgodny z odczytem z wykresu. Wykresy te są odawane dla jednej temeratury, zazwyczaj lub 5 ºC, niższej od temeratury wrzenia każdego ze składników. 5
16 Wykresy temeratura wrzenia-skład i roces destylacji Praktyczne znaczenie mają wykresy zależności temeratury wrzenia mieszaniny dwuskładnikowej od składu fazy ciekłej i od składu ary. a Destylacja jednostoniowa daje wynik zilustrowany na wykresie odcinkami a-a. Mieszanina zawierająca b.4 benzenu ( t.76 wrze w temeraturze ºC. W tej temeraturze w równowadze z wrzącą cieczą ozostaje ara o składzie b.44 (oraz t.56. Ta ara ulega skroleniu w chłodnicy i w rezultacie otrzymujemy destylat wzbogacony w benzen (ale nie czysty benzen. Destylacja oczątkowej mieszaniny rowadzi do jej zubożenia w składnik bardziej lotny; stan wrzenia rzesuwa się (strzałka, temeratura wrzenia od stałym ciśnieniem (n. atmosferycznym rośnie, a wzbogacenie destylatu maleje. 6
17 Destylacja frakcyjna Ma zastosowanie rzemysłowe do ciągłej destylacji mieszaniny o niewiele zmieniającym się składzie. Kolumny do destylacji frakcyjnej laboratoryjnej i rzemysłowej. Twrzenia ara ciecz ułamek molowy jednego ze składników (w cieczy 7
18 Roztwory niedoskonałe Destylacja rowadzi tylko do mieszaniny o składzie odowiadającym minimum temeratury wrzenia. ar.-8-5 Fermentacja % EtOH; destylacja azeotro o T wrz const., z 89% mol lub 96% wag. EtOH Dalsze odwodnienie: destylacja z dodatkiem benzenu daje 99.8% wag. EtOH (+ ślady benzenu ar.-8-7 Składnik T.w. azeotrou, ºC Składnik w % wag. często sotykane azeotroy z wodą alkohol etylowy 78,5 95,6 kwas azotowy 68, kwas siarkowy ,3 chlorowodór,4 inne azeotroy etanol-benzen 68, 3% : 68% chloroform-aceton 64,7 8% : % 8 or. chem. 47
TERMODYNAMIKA TECHNICZNA I CHEMICZNA
 TERMODYNAMIKA TECHNICZNA I CHEMICZNA WYKŁAD IX RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO STAŁE-CIECZ (krystalizacja) ADSORPCJA KRYSTALIZACJA, ADSORPCJA 1 RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO STAŁE-CIECZ (krystalizacja)
TERMODYNAMIKA TECHNICZNA I CHEMICZNA WYKŁAD IX RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO STAŁE-CIECZ (krystalizacja) ADSORPCJA KRYSTALIZACJA, ADSORPCJA 1 RÓWNOWAGA FAZOWA W UKŁADZIE CIAŁO STAŁE-CIECZ (krystalizacja)
Ćwiczenia do wykładu Fizyka Statystyczna i Termodynamika
 Ćwiczenia do wykładu Fizyka tatystyczna i ermodynamika Prowadzący dr gata Fronczak Zestaw 5. ermodynamika rzejść fazowych: równanie lausiusa-laeyrona, własności gazu Van der Waalsa 3.1 Rozważ tyowy diagram
Ćwiczenia do wykładu Fizyka tatystyczna i ermodynamika Prowadzący dr gata Fronczak Zestaw 5. ermodynamika rzejść fazowych: równanie lausiusa-laeyrona, własności gazu Van der Waalsa 3.1 Rozważ tyowy diagram
Stany materii. Masa i rozmiary cząstek. Masa i rozmiary cząstek. m n mol. n = Gaz doskonały. N A = 6.022x10 23
 Stany materii Masa i rozmiary cząstek Masą atomową ierwiastka chemicznego nazywamy stosunek masy atomu tego ierwiastka do masy / atomu węgla C ( C - izoto węgla o liczbie masowej ). Masą cząsteczkową nazywamy
Stany materii Masa i rozmiary cząstek Masą atomową ierwiastka chemicznego nazywamy stosunek masy atomu tego ierwiastka do masy / atomu węgla C ( C - izoto węgla o liczbie masowej ). Masą cząsteczkową nazywamy
Warunki izochoryczno-izotermiczne
 WYKŁAD 5 Pojęcie potencjału chemicznego. Układy jednoskładnikowe W zależności od warunków termodynamicznych potencjał chemiczny substancji czystej definiujemy następująco: Warunki izobaryczno-izotermiczne
WYKŁAD 5 Pojęcie potencjału chemicznego. Układy jednoskładnikowe W zależności od warunków termodynamicznych potencjał chemiczny substancji czystej definiujemy następująco: Warunki izobaryczno-izotermiczne
Wykład 1. Anna Ptaszek. 5 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Chemia fizyczna - wykład 1. Anna Ptaszek 1 / 36
 Wykład 1 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 5 października 2015 1 / 36 Podstawowe pojęcia Układ termodynamiczny To zbiór niezależnych elementów, które oddziałują ze sobą tworząc integralną
Wykład 1 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 5 października 2015 1 / 36 Podstawowe pojęcia Układ termodynamiczny To zbiór niezależnych elementów, które oddziałują ze sobą tworząc integralną
Podstawy Procesów i Konstrukcji Inżynierskich. Teoria kinetyczna INZYNIERIAMATERIALOWAPL. Kierunek Wyróżniony przez PKA
 Podstawy Procesów i Konstrukcji Inżynierskich Teoria kinetyczna Kierunek Wyróżniony rzez PKA 1 Termodynamika klasyczna Pierwsza zasada termodynamiki to rosta zasada zachowania energii, czyli ogólna reguła
Podstawy Procesów i Konstrukcji Inżynierskich Teoria kinetyczna Kierunek Wyróżniony rzez PKA 1 Termodynamika klasyczna Pierwsza zasada termodynamiki to rosta zasada zachowania energii, czyli ogólna reguła
Ć W I C Z E N I E N R C-5
 INSTYTUT FIZYKI WYDZIAŁ INŻYNIERII PRODUKCJI I TECHNOLOGII ATERIAŁÓW POLITECHNIKA CZĘSTOCHOWSKA PRACOWNIA ECHANIKI I CIEPŁA Ć W I C Z E N I E N R C-5 WYZNACZANIE CIEPŁA PAROWANIA WODY ETODĄ KALORYETRYCZNĄ
INSTYTUT FIZYKI WYDZIAŁ INŻYNIERII PRODUKCJI I TECHNOLOGII ATERIAŁÓW POLITECHNIKA CZĘSTOCHOWSKA PRACOWNIA ECHANIKI I CIEPŁA Ć W I C Z E N I E N R C-5 WYZNACZANIE CIEPŁA PAROWANIA WODY ETODĄ KALORYETRYCZNĄ
Wykład 6. Klasyfikacja przemian fazowych
 Wykład 6 Klasyfikacja przemian fazowych JS Klasyfikacja Ehrenfesta Ehrenfest klasyfikuje przemiany fazowe w oparciu o potencjał chemiczny. nieciągłość Przemiany fazowe pierwszego rodzaju pochodne potencjału
Wykład 6 Klasyfikacja przemian fazowych JS Klasyfikacja Ehrenfesta Ehrenfest klasyfikuje przemiany fazowe w oparciu o potencjał chemiczny. nieciągłość Przemiany fazowe pierwszego rodzaju pochodne potencjału
Równowagi fazowe. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Równowagi fazowe Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Równowaga termodynamiczna Przemianom fazowym towarzyszą procesy, podczas których nie zmienia się skład chemiczny układu, polegają
Równowagi fazowe Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Równowaga termodynamiczna Przemianom fazowym towarzyszą procesy, podczas których nie zmienia się skład chemiczny układu, polegają
chemia wykład 3 Przemiany fazowe
 Przemiany fazowe Przemiany fazowe substancji czystych Wrzenie, krzepnięcie, przemiana grafitu w diament stanowią przykłady przemian fazowych, które zachodzą bez zmiany składu chemicznego. Diagramy fazowe
Przemiany fazowe Przemiany fazowe substancji czystych Wrzenie, krzepnięcie, przemiana grafitu w diament stanowią przykłady przemian fazowych, które zachodzą bez zmiany składu chemicznego. Diagramy fazowe
10. FALE, ELEMENTY TERMODYNAMIKI I HYDRODY- NAMIKI.
 0. FALE, ELEMENY ERMODYNAMIKI I HYDRODY- NAMIKI. 0.9. Podstawy termodynamiki i raw gazowych. Podstawowe ojęcia Gaz doskonały: - cząsteczki są unktami materialnymi, - nie oddziałują ze sobą siłami międzycząsteczkowymi,
0. FALE, ELEMENY ERMODYNAMIKI I HYDRODY- NAMIKI. 0.9. Podstawy termodynamiki i raw gazowych. Podstawowe ojęcia Gaz doskonały: - cząsteczki są unktami materialnymi, - nie oddziałują ze sobą siłami międzycząsteczkowymi,
Wykład 8. Równowaga fazowa Roztwory rzeczywiste
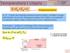
 Wykład 8 Równowaga fazowa Roztwory rzeczywiste Roztwory doskonałe Porównanie roztworów doskonałych i Roztwory Doskonałe rzeczywistych Roztwory Rzeczywiste Spełniają prawo Raoulta Mieszanie w warunkach
Wykład 8 Równowaga fazowa Roztwory rzeczywiste Roztwory doskonałe Porównanie roztworów doskonałych i Roztwory Doskonałe rzeczywistych Roztwory Rzeczywiste Spełniają prawo Raoulta Mieszanie w warunkach
TERMODYNAMIKA. Przedstaw cykl przemian na wykresie poniższym w układach współrzędnych przedstawionych poniżej III
 Włodzimierz Wolczyński 44 POWÓRKA 6 ERMODYNAMKA Zadanie 1 Przedstaw cykl rzemian na wykresie oniższym w układach wsółrzędnych rzedstawionych oniżej Uzuełnij tabelkę wisując nazwę rzemian i symbole: >0,
Włodzimierz Wolczyński 44 POWÓRKA 6 ERMODYNAMKA Zadanie 1 Przedstaw cykl rzemian na wykresie oniższym w układach wsółrzędnych rzedstawionych oniżej Uzuełnij tabelkę wisując nazwę rzemian i symbole: >0,
Jest to zasada zachowania energii w termodynamice - równoważność pracy i ciepła. Rozważmy proces adiabatyczny sprężania gazu od V 1 do V 2 :
 I zasada termodynamiki. Jest to zasada zachowania energii w termodynamice - równoważność racy i cieła. ozważmy roces adiabatyczny srężania gazu od do : dw, ad - wykonanie racy owoduje rzyrost energii wewnętrznej
I zasada termodynamiki. Jest to zasada zachowania energii w termodynamice - równoważność racy i cieła. ozważmy roces adiabatyczny srężania gazu od do : dw, ad - wykonanie racy owoduje rzyrost energii wewnętrznej
Termodynamika 1. Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
 Termodynamika Projekt wsółfinansowany rzez Unię Euroejską w ramach Euroejskiego Funduszu Sołecznego Układ termodynamiczny Układ termodynamiczny to ciało lub zbiór rozważanych ciał, w którym obok innych
Termodynamika Projekt wsółfinansowany rzez Unię Euroejską w ramach Euroejskiego Funduszu Sołecznego Układ termodynamiczny Układ termodynamiczny to ciało lub zbiór rozważanych ciał, w którym obok innych
prawa gazowe Model gazu doskonałego Temperatura bezwzględna tościowa i entalpia owy Standardowe entalpie tworzenia i spalania 4. Stechiometria 1 tość
 5. Gazy, termochemia Doświadczalne rawa gazowe Model gazu doskonałego emeratura bezwzględna Układ i otoczenie Energia wewnętrzna, raca objęto tościowa i entalia Prawo Hessa i cykl kołowy owy Standardowe
5. Gazy, termochemia Doświadczalne rawa gazowe Model gazu doskonałego emeratura bezwzględna Układ i otoczenie Energia wewnętrzna, raca objęto tościowa i entalia Prawo Hessa i cykl kołowy owy Standardowe
Entalpia swobodna (potencjał termodynamiczny)
 Entalia swobodna otencjał termodynamiczny. Związek omiędzy zmianą entalii swobodnej a zmianami entroii Całkowita zmiana entroii wywołana jakimś rocesem jest równa sumie zmiany entroii układu i otoczenia:
Entalia swobodna otencjał termodynamiczny. Związek omiędzy zmianą entalii swobodnej a zmianami entroii Całkowita zmiana entroii wywołana jakimś rocesem jest równa sumie zmiany entroii układu i otoczenia:
Para pozostająca w równowadze z roztworem jest bogatsza w ten składnik, którego dodanie do roztworu zwiększa sumaryczną prężność pary nad nim.
 RÓWNOWAGA CIECZ-PARA DLA UKŁADÓW DWUSKŁADNIKOWYCH: 1) Zgodnie z regułą faz Gibbsa układ dwuskładnikowy osiąga największą liczbę stopni swobody (f max ), gdy znajduje się w nim najmniejsza możliwa liczba
RÓWNOWAGA CIECZ-PARA DLA UKŁADÓW DWUSKŁADNIKOWYCH: 1) Zgodnie z regułą faz Gibbsa układ dwuskładnikowy osiąga największą liczbę stopni swobody (f max ), gdy znajduje się w nim najmniejsza możliwa liczba
Termodynamiczny opis przejść fazowych pierwszego rodzaju
 Wykład II Przejścia fazowe 1 Termodynamiczny opis przejść fazowych pierwszego rodzaju Woda występuje w trzech stanach skupienia jako ciecz, jako gaz, czyli para wodna, oraz jako ciało stałe, a więc lód.
Wykład II Przejścia fazowe 1 Termodynamiczny opis przejść fazowych pierwszego rodzaju Woda występuje w trzech stanach skupienia jako ciecz, jako gaz, czyli para wodna, oraz jako ciało stałe, a więc lód.
POLITECHNIKA POZNAŃSKA ZAKŁAD CHEMII FIZYCZNEJ ĆWICZENIA PRACOWNI CHEMII FIZYCZNEJ
 NAPIĘCIE POWIERZCHNIOWE ROZTWORU WSTĘP Naięcie owierzchniowe jest zjawiskiem wystęującym na granicy faz. Cząstka znajdująca się wewnątrz fazy odlega jednakowym oddziaływaniom ze wszystkich stron, a wyadkowa
NAPIĘCIE POWIERZCHNIOWE ROZTWORU WSTĘP Naięcie owierzchniowe jest zjawiskiem wystęującym na granicy faz. Cząstka znajdująca się wewnątrz fazy odlega jednakowym oddziaływaniom ze wszystkich stron, a wyadkowa
Wykład 4 Gaz doskonały, gaz półdoskonały i gaz rzeczywisty Równanie stanu gazu doskonałego uniwersalna stała gazowa i stała gazowa Odstępstwa gazów
 Wykład 4 Gaz doskonały, gaz ółdoskonały i gaz rzeczywisty Równanie stanu gazu doskonałego uniwersalna stała gazowa i stała gazowa Odstęstwa gazów rzeczywistych od gazu doskonałego: stoień ściśliwości Z
Wykład 4 Gaz doskonały, gaz ółdoskonały i gaz rzeczywisty Równanie stanu gazu doskonałego uniwersalna stała gazowa i stała gazowa Odstęstwa gazów rzeczywistych od gazu doskonałego: stoień ściśliwości Z
= T. = dt. Q = T (d - to nie jest różniczka, tylko wyrażenie różniczkowe); z I zasady termodynamiki: przy stałej objętości. = dt.
 ieło właściwe gazów definicja emiryczna: Q = (na jednostkę masy) T ojemność cielna = m ieło właściwe zależy od rocesu: Q rzy stałym ciśnieniu = T dq = dt rzy stałej objętości Q = T (d - to nie jest różniczka,
ieło właściwe gazów definicja emiryczna: Q = (na jednostkę masy) T ojemność cielna = m ieło właściwe zależy od rocesu: Q rzy stałym ciśnieniu = T dq = dt rzy stałej objętości Q = T (d - to nie jest różniczka,
Wykład 4. Przypomnienie z poprzedniego wykładu
 Wykład 4 Przejścia fazowe materii Diagram fazowy Ciepło Procesy termodynamiczne Proces kwazistatyczny Procesy odwracalne i nieodwracalne Pokazy doświadczalne W. Dominik Wydział Fizyki UW Termodynamika
Wykład 4 Przejścia fazowe materii Diagram fazowy Ciepło Procesy termodynamiczne Proces kwazistatyczny Procesy odwracalne i nieodwracalne Pokazy doświadczalne W. Dominik Wydział Fizyki UW Termodynamika
Wykład 1-4. Anna Ptaszek. 6 września Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Fizykochemia biopolimerów - wykład 1-4.
 Wykład 1-4 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 6 września 2016 1 / 68 Podstawowe pojęcia Układ termodynamiczny To zbiór niezależnych elementów, które oddziałują ze sobą tworząc integralną
Wykład 1-4 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 6 września 2016 1 / 68 Podstawowe pojęcia Układ termodynamiczny To zbiór niezależnych elementów, które oddziałują ze sobą tworząc integralną
powierzchnia rozdziału - dwie fazy ciekłe - jedna faza gazowa - dwa składniki
 Przejścia fazowe. powierzchnia rozdziału - skokowa zmiana niektórych parametrów na granicy faz. kropeki wody w atmosferze - dwie fazy ciekłe - jedna faza gazowa - dwa składniki Przykłady przejść fazowych:
Przejścia fazowe. powierzchnia rozdziału - skokowa zmiana niektórych parametrów na granicy faz. kropeki wody w atmosferze - dwie fazy ciekłe - jedna faza gazowa - dwa składniki Przykłady przejść fazowych:
Wykład 2. Anna Ptaszek. 7 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Chemia fizyczna - wykład 2. Anna Ptaszek 1 / 1
 Wykład 2 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 7 października 2015 1 / 1 Zjawiska koligatywne Rozpuszczenie w wodzie substancji nielotnej powoduje obniżenie prężności pary nasyconej P woda
Wykład 2 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 7 października 2015 1 / 1 Zjawiska koligatywne Rozpuszczenie w wodzie substancji nielotnej powoduje obniżenie prężności pary nasyconej P woda
WYKŁAD 7. Diagramy fazowe Dwuskładnikowe układy doskonałe
 WYKŁAD 7 Diagramy fazowe Dwuskładnikowe układy doskonałe JS Reguła Gibssa. Układy dwuskładnikowe Reguła faz Gibbsa określa liczbę stopni swobody układu w równowadze termodynamicznej: układy dwuskładnikowe
WYKŁAD 7 Diagramy fazowe Dwuskładnikowe układy doskonałe JS Reguła Gibssa. Układy dwuskładnikowe Reguła faz Gibbsa określa liczbę stopni swobody układu w równowadze termodynamicznej: układy dwuskładnikowe
Roztwory rzeczywiste (1)
 Roztwory rzeczywiste (1) Również w temp. 298,15K, ale dla CCl 4 () i CH 3 OH (). 2 15 1 5-5 -1-15 Τ S H,2,4,6,8 1 G -2 Chem. Fiz. TCH II/12 1 rzyczyny dodatnich i ujemnych odchyleń od prawa Raoulta konsekwencja
Roztwory rzeczywiste (1) Również w temp. 298,15K, ale dla CCl 4 () i CH 3 OH (). 2 15 1 5-5 -1-15 Τ S H,2,4,6,8 1 G -2 Chem. Fiz. TCH II/12 1 rzyczyny dodatnich i ujemnych odchyleń od prawa Raoulta konsekwencja
16 GAZY CZ. I PRZEMIANY.RÓWNANIE CLAPEYRONA
 Włodzimierz Wolczyński 16 GAZY CZ. PRZEMANY.RÓWNANE CLAPEYRONA Podstawowy wzór teorii kinetyczno-molekularnej gazów N ilość cząsteczek gazu 2 3 ś. Równanie stanu gazu doskonałego ż ciśnienie, objętość,
Włodzimierz Wolczyński 16 GAZY CZ. PRZEMANY.RÓWNANE CLAPEYRONA Podstawowy wzór teorii kinetyczno-molekularnej gazów N ilość cząsteczek gazu 2 3 ś. Równanie stanu gazu doskonałego ż ciśnienie, objętość,
= 2 + f(n-1) - n(f-1) = n f
 WYKŁAD H. H. Równowagi fazowe H.. Równowagi fazowe dla substancji czystych H.. Równowaga ciecz-ara w układach dwuskładnikowych H.. Równowaga ciecz-ciecz w układach dwuskładnikowych H.4. Równowaga ciecz-ciało
WYKŁAD H. H. Równowagi fazowe H.. Równowagi fazowe dla substancji czystych H.. Równowaga ciecz-ara w układach dwuskładnikowych H.. Równowaga ciecz-ciecz w układach dwuskładnikowych H.4. Równowaga ciecz-ciało
Wykład 3. Fizykochemia biopolimerów- wykład 3. Anna Ptaszek. 30 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego
 Wykład 3 - wykład 3 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 30 października 2013 1/56 Warunek równowagi fazowej Jakich układów dotyczy równowaga fazowa? Równowaga fazowa dotyczy układów: jednoskładnikowych
Wykład 3 - wykład 3 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 30 października 2013 1/56 Warunek równowagi fazowej Jakich układów dotyczy równowaga fazowa? Równowaga fazowa dotyczy układów: jednoskładnikowych
D. II ZASADA TERMODYNAMIKI
 WYKŁAD D,E D. II zasada termodynamiki E. Konsekwencje zasad termodynamiki D. II ZAADA ERMODYNAMIKI D.1. ełnienie I Zasady ermodynamiki jest warunkiem koniecznym zachodzenia jakiegokolwiek rocesu w rzyrodzie.
WYKŁAD D,E D. II zasada termodynamiki E. Konsekwencje zasad termodynamiki D. II ZAADA ERMODYNAMIKI D.1. ełnienie I Zasady ermodynamiki jest warunkiem koniecznym zachodzenia jakiegokolwiek rocesu w rzyrodzie.
Prężność pary nad roztworem
 Tomasz Lubera Układ: Prężność pary nad roztworem dwuskładnikowy (składniki I i II) dwufazowy (ciecz i gaz) w którym faza ciekła i gazowa to roztwory idealne W stanie równowagi prężności pary składników/układu
Tomasz Lubera Układ: Prężność pary nad roztworem dwuskładnikowy (składniki I i II) dwufazowy (ciecz i gaz) w którym faza ciekła i gazowa to roztwory idealne W stanie równowagi prężności pary składników/układu
Wykład 3. Prawo Pascala
 018-10-18 Wykład 3 Prawo Pascala Pływanie ciał Ściśliwość gazów, cieczy i ciał stałych Przemiany gazowe Równanie stanu gazu doskonałego Równanie stanu gazu van der Waalsa Przejścia fazowe materii W. Dominik
018-10-18 Wykład 3 Prawo Pascala Pływanie ciał Ściśliwość gazów, cieczy i ciał stałych Przemiany gazowe Równanie stanu gazu doskonałego Równanie stanu gazu van der Waalsa Przejścia fazowe materii W. Dominik
TERMODYNAMIKA PROCESOWA I TECHNICZNA
 ERMODYNAMIKA PROCESOWA I ECHNICZNA Wykład II Podstawowe definicje cd. Podstawowe idealizacje termodynamiczne I i II Zasada termodynamiki Proste rzemiany termodynamiczne Prof. Antoni Kozioł, Wydział Chemiczny
ERMODYNAMIKA PROCESOWA I ECHNICZNA Wykład II Podstawowe definicje cd. Podstawowe idealizacje termodynamiczne I i II Zasada termodynamiki Proste rzemiany termodynamiczne Prof. Antoni Kozioł, Wydział Chemiczny
prof. dr hab. Małgorzata Jóźwiak
 Czy równowaga w przyrodzie i w chemii jest korzystna? prof. dr hab. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga
Czy równowaga w przyrodzie i w chemii jest korzystna? prof. dr hab. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga
Podstawy Obliczeń Chemicznych
 Podstawy Obliczeń Chemicznych Korekta i uzuełnienia z dnia 0.10.009 Autor rozdziału: Łukasz Ponikiewski Rozdział. Prawa Gazowe.1. Warunki normalne.1.1. Objętość molowa gazów rawo Avogadro.1.. Stała gazowa..
Podstawy Obliczeń Chemicznych Korekta i uzuełnienia z dnia 0.10.009 Autor rozdziału: Łukasz Ponikiewski Rozdział. Prawa Gazowe.1. Warunki normalne.1.1. Objętość molowa gazów rawo Avogadro.1.. Stała gazowa..
Doświadczenie Joule a i jego konsekwencje Ciepło, pojemność cieplna sens i obliczanie Praca sens i obliczanie
 Pierwsza zasada termodynamiki 2.2.1. Doświadczenie Joule a i jego konsekwencje 2.2.2. ieło, ojemność cielna sens i obliczanie 2.2.3. Praca sens i obliczanie 2.2.4. Energia wewnętrzna oraz entalia 2.2.5.
Pierwsza zasada termodynamiki 2.2.1. Doświadczenie Joule a i jego konsekwencje 2.2.2. ieło, ojemność cielna sens i obliczanie 2.2.3. Praca sens i obliczanie 2.2.4. Energia wewnętrzna oraz entalia 2.2.5.
ZEROWA ZASADA TERMODYNAMIKI
 ERMODYNAMIKA Zerowa zasada termodynamiki Pomiar temeratury i skale temeratur Równanie stanu gazu doskonałego Cieło i temeratura Pojemność cielna i cieło właściwe Cieło rzemiany Przemiany termodynamiczne
ERMODYNAMIKA Zerowa zasada termodynamiki Pomiar temeratury i skale temeratur Równanie stanu gazu doskonałego Cieło i temeratura Pojemność cielna i cieło właściwe Cieło rzemiany Przemiany termodynamiczne
Równanie gazu doskonałego
 Równanie gazu doskonałego Gaz doskonały to abstrakcyjny model gazu, który zakłada, że gaz jest zbiorem sprężyście zderzających się kulek. Wiele gazów w warunkach normalnych zachowuje się jak gaz doskonały.
Równanie gazu doskonałego Gaz doskonały to abstrakcyjny model gazu, który zakłada, że gaz jest zbiorem sprężyście zderzających się kulek. Wiele gazów w warunkach normalnych zachowuje się jak gaz doskonały.
11. Termodynamika. Wybór i opracowanie zadań od 11.1 do Bogusław Kusz.
 ermodynamia Wybór i oracowanie zadań od do 5 - Bogusław Kusz W zamniętej butelce o objętości 5cm znajduje się owietrze o temeraturze t 7 C i ciśnieniu hpa Po ewnym czasie słońce ogrzało butelę do temeratury
ermodynamia Wybór i oracowanie zadań od do 5 - Bogusław Kusz W zamniętej butelce o objętości 5cm znajduje się owietrze o temeraturze t 7 C i ciśnieniu hpa Po ewnym czasie słońce ogrzało butelę do temeratury
Badanie równowag ciecz para w układach dwuskładnikowych
 Wprowadzenie Badanie równowag ciecz para w układach dwuskładnikowych Rozważmy równowagę ciecz para w układzie zawierającym dwie ciecze A i B całkowicie mieszające się ze sobą. Zgodnie z regułą faz Gibbsa,
Wprowadzenie Badanie równowag ciecz para w układach dwuskładnikowych Rozważmy równowagę ciecz para w układzie zawierającym dwie ciecze A i B całkowicie mieszające się ze sobą. Zgodnie z regułą faz Gibbsa,
Prowadzący. http://luberski.w.interia.pl telefon PK: 126282746 Pokój 210A (Katedra Biotechnologii i Chemii Fizycznej C-5)
 Tomasz Lubera dr Tomasz Lubera mail: luberski@interia.pl Prowadzący http://luberski.w.interia.pl telefon PK: 126282746 Pokój 210A (Katedra Biotechnologii i Chemii Fizycznej C-5) Konsultacje: we wtorki
Tomasz Lubera dr Tomasz Lubera mail: luberski@interia.pl Prowadzący http://luberski.w.interia.pl telefon PK: 126282746 Pokój 210A (Katedra Biotechnologii i Chemii Fizycznej C-5) Konsultacje: we wtorki
Temperatura i ciepło E=E K +E P +U. Q=c m T=c m(t K -T P ) Q=c przem m. Fizyka 1 Wróbel Wojciech
 emeratura i cieło E=E K +E P +U Energia wewnętrzna [J] - ieło jest energią rzekazywaną między układem a jego otoczeniem na skutek istniejącej między nimi różnicy temeratur na sosób cielny rzez chaotyczne
emeratura i cieło E=E K +E P +U Energia wewnętrzna [J] - ieło jest energią rzekazywaną między układem a jego otoczeniem na skutek istniejącej między nimi różnicy temeratur na sosób cielny rzez chaotyczne
Podstawowe definicje
 Wprowadzenie do równowag fazowych (1) Podstawowe definicje 1) Faza dla danej substancji jej postać charakteryzująca się jednorodnym składem chemicznym i stanem fizycznym. W obrębie fazy niektóre intensywne
Wprowadzenie do równowag fazowych (1) Podstawowe definicje 1) Faza dla danej substancji jej postać charakteryzująca się jednorodnym składem chemicznym i stanem fizycznym. W obrębie fazy niektóre intensywne
II zasada termodynamiki.
 II zasada termodynamiki. Według I zasady termodynamiki nie jest do omyślenia roces, w którym energia wewnętrzna układu doznałaby zmiany innej, niż wynosi suma algebraiczna energii wymienionych z otoczeniem.
II zasada termodynamiki. Według I zasady termodynamiki nie jest do omyślenia roces, w którym energia wewnętrzna układu doznałaby zmiany innej, niż wynosi suma algebraiczna energii wymienionych z otoczeniem.
TERMODYNAMIKA. Termodynamika jest to dział nauk przyrodniczych zajmujący się własnościami
 TERMODYNAMIKA Termodynamika jest to dział nauk rzyrodniczych zajmujący się własnościami energetycznymi ciał. Przy badaniu i objaśnianiu własności układów fizycznych termodynamika osługuje się ojęciami
TERMODYNAMIKA Termodynamika jest to dział nauk rzyrodniczych zajmujący się własnościami energetycznymi ciał. Przy badaniu i objaśnianiu własności układów fizycznych termodynamika osługuje się ojęciami
Podstawowe definicje
 Wprowadzenie do równowag fazowych () odstawowe definicje Faza dla danej substancji jej postać charakteryzująca się jednorodnym składem chemicznym i stanem fizycznym. W obrę bie fazy niektóre intensywne
Wprowadzenie do równowag fazowych () odstawowe definicje Faza dla danej substancji jej postać charakteryzująca się jednorodnym składem chemicznym i stanem fizycznym. W obrę bie fazy niektóre intensywne
Seria 2, ćwiczenia do wykładu Od eksperymentu do poznania materii
 Seria 2, ćwiczenia do wykładu Od eksperymentu do poznania materii 8.1.21 Zad. 1. Obliczyć ciśnienie potrzebne do przemiany grafitu w diament w temperaturze 25 o C. Objętość właściwa (odwrotność gęstości)
Seria 2, ćwiczenia do wykładu Od eksperymentu do poznania materii 8.1.21 Zad. 1. Obliczyć ciśnienie potrzebne do przemiany grafitu w diament w temperaturze 25 o C. Objętość właściwa (odwrotność gęstości)
WYKŁAD 2_2. 1.Entropia definicja termodynamiczna. przemiana nieodwracalna. Sumaryczny zapis obu tych relacji
 .Entroia definicja termodynamiczna. d d rzemiana odwracaa rzemiana nieodwracaa umaryczny zais obu tych relacji Q d el WYKŁAD _ rzykład a Obliczyć zmianę entroii, gdy 5 moli wodoru rozręŝa się odwracaie
.Entroia definicja termodynamiczna. d d rzemiana odwracaa rzemiana nieodwracaa umaryczny zais obu tych relacji Q d el WYKŁAD _ rzykład a Obliczyć zmianę entroii, gdy 5 moli wodoru rozręŝa się odwracaie
GAZ DOSKONAŁY. Brak oddziaływań między cząsteczkami z wyjątkiem zderzeń idealnie sprężystych.
 TERMODYNAMIKA GAZ DOSKONAŁY Gaz doskonały to abstrakcyjny, matematyczny model gazu, chociaż wiele gazów (azot, tlen) w warunkach normalnych zachowuje się w przybliżeniu jak gaz doskonały. Model ten zakłada:
TERMODYNAMIKA GAZ DOSKONAŁY Gaz doskonały to abstrakcyjny, matematyczny model gazu, chociaż wiele gazów (azot, tlen) w warunkach normalnych zachowuje się w przybliżeniu jak gaz doskonały. Model ten zakłada:
Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2018/19)
 Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2018/19) Uwaga! Uzyskane wyniki mogą się nieco różnić od podanych w materiałach, ze względu na uaktualnianie wartości zapisanych
Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2018/19) Uwaga! Uzyskane wyniki mogą się nieco różnić od podanych w materiałach, ze względu na uaktualnianie wartości zapisanych
Seminarium 4 Obliczenia z wykorzystaniem przekształcania wzorów fizykochemicznych
 Seminarium 4 Obliczenia z wykorzystaniem przekształcania wzorów fizykochemicznych Zad. 1 Przekształć w odpowiedni sposób podane poniżej wzory aby wyliczyć: a) a lub m 2 b) m zred h E a 8ma E osc h 4 2
Seminarium 4 Obliczenia z wykorzystaniem przekształcania wzorów fizykochemicznych Zad. 1 Przekształć w odpowiedni sposób podane poniżej wzory aby wyliczyć: a) a lub m 2 b) m zred h E a 8ma E osc h 4 2
Pomiar wilgotności względnej powietrza
 Katedra Silników Salinowych i Pojazdów ATH ZAKŁAD TERMODYNAMIKI Pomiar wilgotności względnej owietrza - 1 - Wstę teoretyczny Skład gazu wilgotnego. Gazem wilgotnym nazywamy mieszaninę gazów, z których
Katedra Silników Salinowych i Pojazdów ATH ZAKŁAD TERMODYNAMIKI Pomiar wilgotności względnej owietrza - 1 - Wstę teoretyczny Skład gazu wilgotnego. Gazem wilgotnym nazywamy mieszaninę gazów, z których
Fizyka statystyczna Fenomenologia przejść fazowych. P. F. Góra
 Fizyka statystyczna Fenomenologia przejść fazowych P. F. Góra http://th-www.if.uj.edu.pl/zfs/gora/ 2015 Przejście fazowe transformacja układu termodynamicznego z jednej fazy (stanu materii) do innej, dokonywane
Fizyka statystyczna Fenomenologia przejść fazowych P. F. Góra http://th-www.if.uj.edu.pl/zfs/gora/ 2015 Przejście fazowe transformacja układu termodynamicznego z jednej fazy (stanu materii) do innej, dokonywane
Termodynamika fenomenologiczna i statystyczna
 Termodynamika fenomenologiczna i statystyczna Termodynamika fenomenologiczna zajmuje się zwykle badaniem makroskoowych układów termodynamicznych złożonych z bardzo dużej ilości obiektów mikroskoowych.
Termodynamika fenomenologiczna i statystyczna Termodynamika fenomenologiczna zajmuje się zwykle badaniem makroskoowych układów termodynamicznych złożonych z bardzo dużej ilości obiektów mikroskoowych.
Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 2, zadanie nr 1 1
 Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 2, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący Uwaga! Proszę stosować się do następującego sposobu wprowadzania tekstu w ramkach : pola szare
Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 2, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący Uwaga! Proszę stosować się do następującego sposobu wprowadzania tekstu w ramkach : pola szare
Analiza termiczna Krzywe stygnięcia
 Analiza termiczna Krzywe stygnięcia 0 0,2 0,4 0,6 0,8 1,0 T a e j n s x p b t c o f g h k l p d i m y z q u v r w α T B T A T E T k P = const Chem. Fiz. TCH II/10 1 Rozpatrując stygnięcie wzdłuż kolejnych
Analiza termiczna Krzywe stygnięcia 0 0,2 0,4 0,6 0,8 1,0 T a e j n s x p b t c o f g h k l p d i m y z q u v r w α T B T A T E T k P = const Chem. Fiz. TCH II/10 1 Rozpatrując stygnięcie wzdłuż kolejnych
). Uzyskanie temperatur rzędu pojedynczych kalwinów wymaga użycia helu ( Tw
 WFiIS PRACOWNIA FIZYCZNA I i II Imię i nazwisko: 1 2 TEMAT: ROK GRUPA ZESPÓŁ NR ĆWICZENIA Data wykonania: Data oddania: Zwrot do orawy: Data oddania: Data zliczenia: OCENA Cel ćwiczenia Zaoznanie się z
WFiIS PRACOWNIA FIZYCZNA I i II Imię i nazwisko: 1 2 TEMAT: ROK GRUPA ZESPÓŁ NR ĆWICZENIA Data wykonania: Data oddania: Zwrot do orawy: Data oddania: Data zliczenia: OCENA Cel ćwiczenia Zaoznanie się z
Podstawowe prawa opisujące właściwości gazów zostały wyprowadzone dla gazu modelowego, nazywanego gazem doskonałym (idealnym).
 Spis treści 1 Stan gazowy 2 Gaz doskonały 21 Definicja mikroskopowa 22 Definicja makroskopowa (termodynamiczna) 3 Prawa gazowe 31 Prawo Boyle a-mariotte a 32 Prawo Gay-Lussaca 33 Prawo Charlesa 34 Prawo
Spis treści 1 Stan gazowy 2 Gaz doskonały 21 Definicja mikroskopowa 22 Definicja makroskopowa (termodynamiczna) 3 Prawa gazowe 31 Prawo Boyle a-mariotte a 32 Prawo Gay-Lussaca 33 Prawo Charlesa 34 Prawo
Ćwiczenie nr 3. Wyznaczanie współczynnika Joule a-thomsona wybranych gazów rzeczywistych.
 Termodynamika II ćwiczenia laboratoryjne Ćwiczenie nr 3 Temat: Wyznaczanie wsółczynnika Joule a-tomsona wybranyc gazów rzeczywistyc. Miejsce ćwiczeń: Laboratorium Tecnologii Gazowyc Politecniki Poznańskiej
Termodynamika II ćwiczenia laboratoryjne Ćwiczenie nr 3 Temat: Wyznaczanie wsółczynnika Joule a-tomsona wybranyc gazów rzeczywistyc. Miejsce ćwiczeń: Laboratorium Tecnologii Gazowyc Politecniki Poznańskiej
INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH
 INSTYTUT MASZYN I URZĄDZEŃ ENERGETYCZNYCH Politechnika Śląska w Gliwicach INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH WYZNACZANIE WYKRESU RÓWNOWAGI FAZOWEJ (dla stopów dwuskładnikowych) Instrukcja przeznaczona
INSTYTUT MASZYN I URZĄDZEŃ ENERGETYCZNYCH Politechnika Śląska w Gliwicach INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH WYZNACZANIE WYKRESU RÓWNOWAGI FAZOWEJ (dla stopów dwuskładnikowych) Instrukcja przeznaczona
Ćwiczenia rachunkowe z termodynamiki technicznej i chemicznej Zalecane zadania kolokwium 1. (2014/15)
 Ćwiczenia rachunkowe z termodynamiki technicznej i chemicznej Zalecane zadania kolokwium 1. (2014/15) (Uwaga! Liczba w nawiasie przy odpowiedzi oznacza numer zadania (zestaw.nr), którego rozwiązanie dostępne
Ćwiczenia rachunkowe z termodynamiki technicznej i chemicznej Zalecane zadania kolokwium 1. (2014/15) (Uwaga! Liczba w nawiasie przy odpowiedzi oznacza numer zadania (zestaw.nr), którego rozwiązanie dostępne
Zadania treningowe na kolokwium
 Zadania treningowe na kolokwium 3.12.2010 1. Stan układu binarnego zawierającego n 1 moli substancji typu 1 i n 2 moli substancji typu 2 parametryzujemy za pomocą stężenia substancji 1: x n 1. Stabilność
Zadania treningowe na kolokwium 3.12.2010 1. Stan układu binarnego zawierającego n 1 moli substancji typu 1 i n 2 moli substancji typu 2 parametryzujemy za pomocą stężenia substancji 1: x n 1. Stabilność
ZALEŻNOŚĆ CIŚNIENIA PARY NASYCONEJ WODY OD TEM- PERATURY. WYZNACZANIE MOLOWEGO CIEPŁA PARO- WANIA
 ZALEŻNOŚĆ CIŚNIENIA PARY NASYCONEJ WODY OD TEM- PERATURY. WYZNACZANIE MOLOWEGO CIEPŁA PARO- WANIA I. Cel ćwiczenia: zbadanie zależności ciśnienia pary nasyconej wody od temperatury oraz wyznaczenie molowego
ZALEŻNOŚĆ CIŚNIENIA PARY NASYCONEJ WODY OD TEM- PERATURY. WYZNACZANIE MOLOWEGO CIEPŁA PARO- WANIA I. Cel ćwiczenia: zbadanie zależności ciśnienia pary nasyconej wody od temperatury oraz wyznaczenie molowego
Odwracalność przemiany chemicznej
 Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
Projekt Inżynier mechanik zawód z przyszłością współfinansowany ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego
 Zajęcia wyrównawcze z fizyki -Zestaw 4 -eoria ermodynamika Równanie stanu gazu doskonałego Izoprzemiany gazowe Energia wewnętrzna gazu doskonałego Praca i ciepło w przemianach gazowych Silniki cieplne
Zajęcia wyrównawcze z fizyki -Zestaw 4 -eoria ermodynamika Równanie stanu gazu doskonałego Izoprzemiany gazowe Energia wewnętrzna gazu doskonałego Praca i ciepło w przemianach gazowych Silniki cieplne
3. Przejścia fazowe pomiędzy trzema stanami skupienia materii:
 Temat: Zmiany stanu skupienia. 1. Energia sieci krystalicznej- wielkość dzięki której można oszacować siły przyciągania w krysztale 2. Energia wiązania sieci krystalicznej- ilość energii potrzebnej do
Temat: Zmiany stanu skupienia. 1. Energia sieci krystalicznej- wielkość dzięki której można oszacować siły przyciągania w krysztale 2. Energia wiązania sieci krystalicznej- ilość energii potrzebnej do
Wykład 8B. Układy o ograniczonej mieszalności
 Wykład 8B Układy o ograniczonej mieszalności Układy o ograniczonej mieszalności Jeżeli dla pewnego składu entalpia swobodna mieszania ( Gmiesz> 0) jest dodatnia, to mieszanie nie jest procesem samorzutnym
Wykład 8B Układy o ograniczonej mieszalności Układy o ograniczonej mieszalności Jeżeli dla pewnego składu entalpia swobodna mieszania ( Gmiesz> 0) jest dodatnia, to mieszanie nie jest procesem samorzutnym
Wykład 2. Przemiany termodynamiczne
 Wykład Przemiany termodynamiczne Przemiany odwracalne: Przemiany nieodwracalne:. izobaryczna = const 7. dławienie. izotermiczna = const 8. mieszanie. izochoryczna = const 9. tarcie 4. adiabatyczna = const
Wykład Przemiany termodynamiczne Przemiany odwracalne: Przemiany nieodwracalne:. izobaryczna = const 7. dławienie. izotermiczna = const 8. mieszanie. izochoryczna = const 9. tarcie 4. adiabatyczna = const
relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
 1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2016/17)
 Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2016/17) Uwaga! Uzyskane wyniki mogą się nieco różnić od podanych w materiałach, ze względu na uaktualnianie wartości zapisanych
Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2016/17) Uwaga! Uzyskane wyniki mogą się nieco różnić od podanych w materiałach, ze względu na uaktualnianie wartości zapisanych
Termodynamika równowag fazowych w układach dwuskładnikowych
 Termodynamika równowag fazowych w układach dwuskładnikowych 3.3.1. Równowaga ciecz-para: skład pary nad roztworem, prawo Roulta, Henry ego, destylacja baryczna oraz termiczna 3.3.2. Równowaga ciecz-ciecz
Termodynamika równowag fazowych w układach dwuskładnikowych 3.3.1. Równowaga ciecz-para: skład pary nad roztworem, prawo Roulta, Henry ego, destylacja baryczna oraz termiczna 3.3.2. Równowaga ciecz-ciecz
Czy równowaga jest procesem korzystnym? dr hab. prof. nadzw. Małgorzata Jóźwiak
 Czy równowaga jest procesem korzystnym? dr hab. prof. nadzw. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga ciało
Czy równowaga jest procesem korzystnym? dr hab. prof. nadzw. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga ciało
Termodynamika 2. Projekt współfinansowany przez Unię Europejską w ramach Europejskiego Funduszu Społecznego
 ermodynamika Projekt wsółfinansowany rzez Unię Euroejską w ramach Euroejskiego Funduszu Sołecznego Siik ciey siikach (maszynach) cieych cieło zamieniane jest na racę. Elementami siika są: źródło cieła
ermodynamika Projekt wsółfinansowany rzez Unię Euroejską w ramach Euroejskiego Funduszu Sołecznego Siik ciey siikach (maszynach) cieych cieło zamieniane jest na racę. Elementami siika są: źródło cieła
PROCESY JEDNOSTKOWE W TECHNOLOGIACH ŚRODOWISKOWYCH DESTYLACJA
 KIiChŚ PROCESY JEDNOSTKOWE W TECHNOLOGIACH ŚRODOWISKOWYCH Ćwiczenie nr 5 DESTYLACJA Cel ćwiczenia Doświadczalne wyznaczenie krzywych równowagi ciecz-para dla układu woda-kwas octowy. Wprowadzenie Destylacja
KIiChŚ PROCESY JEDNOSTKOWE W TECHNOLOGIACH ŚRODOWISKOWYCH Ćwiczenie nr 5 DESTYLACJA Cel ćwiczenia Doświadczalne wyznaczenie krzywych równowagi ciecz-para dla układu woda-kwas octowy. Wprowadzenie Destylacja
Roztwory rzeczywiste (1)
 Roztwory rzeczywiste (1) Również w temp. 298,15K, ale dla CCl 4 () i CH 3 OH (). 2 15 1 5-5 -1-15 Τ S H,2,4,6,8 1 G -2 Chem. Fiz. TCH II/12 1 Roztwory rzeczywiste (2) Tym razem dla (CH 3 ) 2 CO () i CHCl
Roztwory rzeczywiste (1) Również w temp. 298,15K, ale dla CCl 4 () i CH 3 OH (). 2 15 1 5-5 -1-15 Τ S H,2,4,6,8 1 G -2 Chem. Fiz. TCH II/12 1 Roztwory rzeczywiste (2) Tym razem dla (CH 3 ) 2 CO () i CHCl
Wykład 3. Diagramy fazowe P-v-T dla substancji czystych w trzech stanach. skupienia. skupienia
 Wykład 3 Substancje proste i czyste Przemiany w systemie dwufazowym woda para wodna Diagram T-v dla przejścia fazowego woda para wodna Diagramy T-v i P-v dla wody Punkt krytyczny Temperatura nasycenia
Wykład 3 Substancje proste i czyste Przemiany w systemie dwufazowym woda para wodna Diagram T-v dla przejścia fazowego woda para wodna Diagramy T-v i P-v dla wody Punkt krytyczny Temperatura nasycenia
Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12
 Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12 atomu węgla 12 C. Mol - jest taką ilością danej substancji,
Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12 atomu węgla 12 C. Mol - jest taką ilością danej substancji,
WARUNKI RÓWNOWAGI UKŁADU TERMODYNAMICZNEGO
 WARUNKI RÓWNOWAGI UKŁADU ERMODYNAMICZNEGO Proces termodynamiczny zachodzi doóty, doóki układ nie osiągnie stanu równowagi. W stanie równowagi odowiedni otencjał termodynamiczny układu osiąga minimum, odczas
WARUNKI RÓWNOWAGI UKŁADU ERMODYNAMICZNEGO Proces termodynamiczny zachodzi doóty, doóki układ nie osiągnie stanu równowagi. W stanie równowagi odowiedni otencjał termodynamiczny układu osiąga minimum, odczas
TERMODYNAMIKA OGNIWA GALWANICZNEGO
 Ćwiczenie nr 3 ERMODYNAMIKA OGNIWA GALWANICZNEGO I. Cel ćwiczenia Celem ćwiczenia jest wyznaczenie zmian funkcji termodynamicznych dla reakcji biegnącej w ogniwie Clarka. II. Zagadnienia wrowadzające 1.
Ćwiczenie nr 3 ERMODYNAMIKA OGNIWA GALWANICZNEGO I. Cel ćwiczenia Celem ćwiczenia jest wyznaczenie zmian funkcji termodynamicznych dla reakcji biegnącej w ogniwie Clarka. II. Zagadnienia wrowadzające 1.
Chemia fizyczna. Równowagi fazowe. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Chemia fizyczna Równowagi fazowe. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny SUBSTANCJE CZYSTE SUBSTANCJE CZYSTE RÓWNOWAGI FAZOWE Fazą danej substancji nazywamy postać materii, która charakteryzuje
Chemia fizyczna Równowagi fazowe. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny SUBSTANCJE CZYSTE SUBSTANCJE CZYSTE RÓWNOWAGI FAZOWE Fazą danej substancji nazywamy postać materii, która charakteryzuje
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów ierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach rojektu Era inżyniera ewna lokata na rzyszłość Oracowała: mgr inż.
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów ierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach rojektu Era inżyniera ewna lokata na rzyszłość Oracowała: mgr inż.
Diagramy fazowe graficzna reprezentacja warunków równowagi
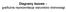 Diagramy fazowe graficzna reprezentacja warunków równowagi Faza jednorodna część układu, oddzielona od innych części granicami faz, na których zachodzi skokowa zmiana pewnych własności fizycznych. B 0
Diagramy fazowe graficzna reprezentacja warunków równowagi Faza jednorodna część układu, oddzielona od innych części granicami faz, na których zachodzi skokowa zmiana pewnych własności fizycznych. B 0
Właściwości koligatywne
 Tomasz Lubera Właściwości koligatywne Grupa zjawisk naturalnych niezależnych od rodzaju substancji rozpuszczonej a jedynie od jej ilości. Należą do nich: obniżenie prężności pary, podwyższenie temperatury
Tomasz Lubera Właściwości koligatywne Grupa zjawisk naturalnych niezależnych od rodzaju substancji rozpuszczonej a jedynie od jej ilości. Należą do nich: obniżenie prężności pary, podwyższenie temperatury
ĆWICZENIE 22 WYZNACZANIE CIEPŁA PAROWANIA WODY W TEMPERETATURZE WRZENIA
 ĆWICZENIE 22 WYZNACZANIE CIEPŁA PAROWANIA WODY W TEMPERETATURZE WRZENIA Aby parowanie cieczy zachodziło w stałej temperaturze należy dostarczyć jej określoną ilość ciepła w jednostce czasu. Wielkość równą
ĆWICZENIE 22 WYZNACZANIE CIEPŁA PAROWANIA WODY W TEMPERETATURZE WRZENIA Aby parowanie cieczy zachodziło w stałej temperaturze należy dostarczyć jej określoną ilość ciepła w jednostce czasu. Wielkość równą
Śr Kin Ruchu Postępowego. V n R T R T. 3 3 R 3 E R T T k T, 2 N 2 B
 Termodynamika Podstawowy wzór kinetyczno-molekularnej teorii budowy materii W oarciu o założenia dotyczące właściwości gazu doskonałego (molekuły to unkty materialne ozostające w ciągłym termicznym ruchu,
Termodynamika Podstawowy wzór kinetyczno-molekularnej teorii budowy materii W oarciu o założenia dotyczące właściwości gazu doskonałego (molekuły to unkty materialne ozostające w ciągłym termicznym ruchu,
ZADANIA Z CHEMII Efekty energetyczne reakcji chemicznej - prawo Hessa
 Prawo zachowania energii: ZADANIA Z CHEMII Efekty energetyczne reakcji chemicznej - prawo Hessa Ogólny zasób energii jest niezmienny. Jeżeli zwiększa się zasób energii wybranego układu, to wyłącznie kosztem
Prawo zachowania energii: ZADANIA Z CHEMII Efekty energetyczne reakcji chemicznej - prawo Hessa Ogólny zasób energii jest niezmienny. Jeżeli zwiększa się zasób energii wybranego układu, to wyłącznie kosztem
Roztwory. Homogeniczne jednorodne (jedno-fazowe) mieszaniny dwóch lub więcej składników.
 Roztwory Homogeniczne jednorodne (jedno-fazowe) mieszaniny dwóch lub więcej składników. Własności fizyczne roztworów są związane z równowagę pomiędzy siłami wiążącymi cząsteczki wody i substancji rozpuszczonej.
Roztwory Homogeniczne jednorodne (jedno-fazowe) mieszaniny dwóch lub więcej składników. Własności fizyczne roztworów są związane z równowagę pomiędzy siłami wiążącymi cząsteczki wody i substancji rozpuszczonej.
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego
 Katedra Chemii Fizycznej Uniwersytetu Łódzkiego Zastosowanie destylacji z parą wodną do oznaczania masy cząsteczkowej cieczy niemieszającej się z wodą opracował prof. B. Pałecz ćwiczenie nr 35 Zakres zagadnień
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego Zastosowanie destylacji z parą wodną do oznaczania masy cząsteczkowej cieczy niemieszającej się z wodą opracował prof. B. Pałecz ćwiczenie nr 35 Zakres zagadnień
POLITECHNIKA POZNAŃSKA ZAKŁAD CHEMII FIZYCZNEJ ĆWICZENIA PRACOWNI CHEMII FIZYCZNEJ
 WSTĘP ADSORPCJA NA GRANICY FAZ: CIAŁO STAŁE CIECZ. WYZNACZANIE IZOTERMY ADSORPCJI NA WĘGLU AKTYWNYM Adsorcja jako zjawisko owierzchniowe związana jest z istnieniem niewysyconych sił międzycząsteczkowych
WSTĘP ADSORPCJA NA GRANICY FAZ: CIAŁO STAŁE CIECZ. WYZNACZANIE IZOTERMY ADSORPCJI NA WĘGLU AKTYWNYM Adsorcja jako zjawisko owierzchniowe związana jest z istnieniem niewysyconych sił międzycząsteczkowych
CHEMIA FIZYCZNA ZTiM
 CHEMIA FIZYCZNA ZTiM Semestr zimowy 2016/2017 Dr hab. inż. Dorota Warmińska 1. Chemia fizyczna. Termodynamika. Podstawowe pojęcia stosowane w termodynamice. Układ i otoczenie. Przegroda adiabatyczna i
CHEMIA FIZYCZNA ZTiM Semestr zimowy 2016/2017 Dr hab. inż. Dorota Warmińska 1. Chemia fizyczna. Termodynamika. Podstawowe pojęcia stosowane w termodynamice. Układ i otoczenie. Przegroda adiabatyczna i
Mini-quiz 0 Mini-quiz 1
 rawda fałsz Mini-quiz 0.Wielkości ekstensywne to: a rędkość kątowa b masa układu c ilość cząstek d temeratura e całkowity moment magnetyczny.. Układy otwarte: a mogą wymieniać energię z otoczeniem b mogą
rawda fałsz Mini-quiz 0.Wielkości ekstensywne to: a rędkość kątowa b masa układu c ilość cząstek d temeratura e całkowity moment magnetyczny.. Układy otwarte: a mogą wymieniać energię z otoczeniem b mogą
Kalorymetria paliw gazowych
 Katedra Termodynamiki, Teorii Maszyn i Urządzeń Cielnych W9/K2 Miernictwo energetyczne laboratorium Kalorymetria aliw gazowych Instrukcja do ćwiczenia nr 7 Oracowała: dr inż. Elżbieta Wróblewska Wrocław,
Katedra Termodynamiki, Teorii Maszyn i Urządzeń Cielnych W9/K2 Miernictwo energetyczne laboratorium Kalorymetria aliw gazowych Instrukcja do ćwiczenia nr 7 Oracowała: dr inż. Elżbieta Wróblewska Wrocław,
OH OH CH 3. n bezw = 8,54 : 102 = 0,084 mol (niedomiar kwasu) m ASA = 0, = 12,06 g (100% wydajność) W = 10,9 : 12,06 = 0,904 czyli 90,4%
 Zadania I etau onkursu hemicznego Trzech Wydziałów PŁ III edycja Zadanie 1. ( kt) Asirynę czyli kwas acetylosalicylowy można otrzymać w reakcji kwasu salicylowego z bezwodnikiem kwasu etanowego (octowego).
Zadania I etau onkursu hemicznego Trzech Wydziałów PŁ III edycja Zadanie 1. ( kt) Asirynę czyli kwas acetylosalicylowy można otrzymać w reakcji kwasu salicylowego z bezwodnikiem kwasu etanowego (octowego).
Wykład 7. Energia wewnętrzna jednoatomowego gazu doskonałego wynosi: 3 R . 2. Ciepło molowe przy stałym ciśnieniu obliczymy dzięki zależności: nrt
 W. Dominik Wydział Fizyki UW ermodynamika 08/09 /7 Wykład 7 Zasada ekwiartycji energii Stonie swobody ruchu cząsteczek ieło właściwe ciał stałych ównanie adiabaty w modelu kinetyczno-molekularnym g.d.
W. Dominik Wydział Fizyki UW ermodynamika 08/09 /7 Wykład 7 Zasada ekwiartycji energii Stonie swobody ruchu cząsteczek ieło właściwe ciał stałych ównanie adiabaty w modelu kinetyczno-molekularnym g.d.
Wykład 10 Równowaga chemiczna
 Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
WYKŁAD 14 PROSTOPADŁA FALA UDERZENIOWA
 WYKŁAD 4 PROSTOPADŁA FALA UDERZENIOWA PROSTOPADŁA FALA UDERZENIOWA. ADIABATA HUGONIOTA. S 0 normal shock wave S Gazodynamika doszcza istnienie silnych nieciągłości w rzeływach gaz. Najrostszym rzyadkiem
WYKŁAD 4 PROSTOPADŁA FALA UDERZENIOWA PROSTOPADŁA FALA UDERZENIOWA. ADIABATA HUGONIOTA. S 0 normal shock wave S Gazodynamika doszcza istnienie silnych nieciągłości w rzeływach gaz. Najrostszym rzyadkiem
WYKŁAD 1 WPROWADZENIE DO STATYKI PŁYNÓW 1/23
 WYKŁAD 1 WPROWADZENIE DO STATYKI PŁYNÓW 1/23 RÓWNOWAGA SIŁ Siła owierzchniowa FS nds Siła objętościowa FV f dv Warunek konieczny równowagi łynu F F 0 S Całkowa ostać warunku równowagi łynu V nds f dv 0
WYKŁAD 1 WPROWADZENIE DO STATYKI PŁYNÓW 1/23 RÓWNOWAGA SIŁ Siła owierzchniowa FS nds Siła objętościowa FV f dv Warunek konieczny równowagi łynu F F 0 S Całkowa ostać warunku równowagi łynu V nds f dv 0
WYZNACZANIE WIELKOŚCI KAPPA κ
 Politechnika Warszawska Wydział Fizyki Laboratorium Fizyki I P Bogna Politechnika Frejlak Warszawska WYZNACZANIE WIELKOŚCI KAPPA κ = c c 6 6 1. Podstawy fizyczne Gazem doskonałym nazywamy wyidealizowaną
Politechnika Warszawska Wydział Fizyki Laboratorium Fizyki I P Bogna Politechnika Frejlak Warszawska WYZNACZANIE WIELKOŚCI KAPPA κ = c c 6 6 1. Podstawy fizyczne Gazem doskonałym nazywamy wyidealizowaną
