X + hv X* X + ciepło + hv. Ze względu na czynnik, który wywołuje to promieniowanie, luminescencję dzielimy na:
|
|
|
- Edward Kucharski
- 7 lat temu
- Przeglądów:
Transkrypt
1 Imię i Nazwisko Studenta Data Ocena Podpis Prowadzącego FLUORYMETRIA Na ćwiczeniach obowiązuje materiał zawarty w podręczniku: R. Kocjan Chemia analityczna. Podręcznik dla studentów. Analiza instrumentalna. Tom rozdz (str. 1-3); (str ) Luminescencja to zjawisko emisji promieniowania elektromagnetycznego, która następuje w czasie nie krótszym niż s od chwili zaabsorbowaniu energii przez atomy lub cząsteczki danej substancji. X + hv X* X + ciepło + hv Ze względu na czynnik, który wywołuje to promieniowanie, luminescencję dzielimy na: - fotoluminescencję - wywołana absorpcją fotonów w zakresie UV-VIS (fluorescencja i fosforescencja). - chemiluminescencję - wytworzona w trakcie niektórych reakcji chemicznych - bioluminescencję - rodzaj chemiluminescencji, wywołana w wyniku procesów biochemicznych zachodzących w organizmach żywych np. przez świetliki. Występuje również u wielu bakterii, grzybów, niektórych pierwotniaków oraz organizmów głębinowych - elektroluminescencję - powstaje na skutek zderzeń cząsteczek obdarzonych ładunkiem elektrycznym z luminoforem - tryboluminescencję - luminescencja wywołana poprzez tarcie, zginanie, ściskanie - rentgenoluminescencję - wywołana promieniowaniem rentgenowskim - radioluminescencję świecenie pod wpływem promieniowania α, β, γ - sonoluminescencję - wywołana ultradźwiękami - termoluminescencję - wywołana przez ogrzewanie substancji, która wcześniej została pobudzona przez światło. 1
2 Najbardziej intensywną fluorescencję wykazują cząsteczki o płaskiej, usztywnionej strukturze, zawierające pierścienie aromatyczne, np. chinolina, indol czy naftalen. N H N chinolina indol naftalen Najczęściej związkami fluorescencyjnymi są: 1. Związki aromatyczne i heterocykliczne, polimery (np. wielopierścieniowe węglowodory aromatyczne).. Niektóre barwniki (np. fluoresceina, rodamina, chlorofil). 3. Związki biologiczne: a) aromatyczne aminokwasy (np. tyrozyna, tryptofan) b) zasady nukleinowe (np. cytozyna, uracyl) w DNA i RNA c) niektóre witaminy i hormony (np. tiamina, adrenalina). 4. Luminofory nieorganiczne (np. siarczki cynku i kadmu). Charakteryzuje je wysoka wydajność świetlna. Luminofory siarczkowe są dobrymi elektroluminoforami, rentgenoluminoforami oraz katodoluminoforami. Fizyczne podstawy luminescencji Każda cząsteczka posiada charakterystyczny dla siebie układ poziomów energetycznych elektronowych, oscylacyjnych i rotacyjnych. W wyniku absorpcji promieniowania ultrafioletowego lub widzialnego cząsteczka przechodzi do jednego ze stanów wzbudzonych, a następnie dąży do osiągnięcia stanu równowagi, czyli stanu, w którym energia całkowita przyjmuje wartość minimalną (emisja energii). Procesy absorpcji i emisji energii przedstawia się schematycznie na tzw. diagramie przejść energetycznych Jabłońskiego - ryc. 1.
3 Ryc. 1. Diagram Jabłońskiego. W większości cząsteczek, w stanie podstawowym, elektrony są sparowane (zajmują ten sam orbital a ich spiny są przeciwne). Jest to tzw. stan singletowy S 0. Absorpcja energii może spowodować przeniesienie elektronu na poziom o wyższej energii bez zmiany jego spinu (singletowy stan wzbudzony). Dezaktywacja tego stanu może następować na różne sposoby. Cząsteczka w stanie wzbudzonym (czas życia w tym stanie wynosi s) może ulec bezpromienistej konwersji wewnętrznej (relaksacji oscylacyjnej) z utratą energii oscylacyjnej do najniższego poziomu oscylacyjnego S 1 na wzbudzonym poziomie elektronowym. Wyemitowany wtedy foton przy przejściu z tego stanu do stanu podstawowego S 0 ma energię mniejszą niż foton wzbudzający. Widmo emisyjne związane z tym przejściem przesunięte jest więc w stronę fal dłuższych stosunku do widma absorpcji (tzw. przesunięcie Stokesa), a zjawisko to nazywa się zjawiskiem fluorescencji. Po relaksacji oscylacyjnej, wzbudzona cząsteczka, może także wykonać tzw. przejście międzysystemowe (interkombinacyjne) ze wzbudzonego stanu singletowego do wzbudzonego stanu tripletowego T 1 (elektrony nie są sparowane, ich spiny są równoległe) i dopiero później do stanu podstawowego S 0. Przejście między stanami T 1 i S 0, jako stanami o różnej multipletowości, jest tzw. przejściem wzbronionym, statystycznie mało prawdopodobnym. Cząsteczka przez względnie długi czas przebywa stanie wzbudzonym (czas życia cząsteczki w stanie trypletowym jest dłuższy niż w stanie singletowym i trwa od 10-4 do 10 4 s), następnie łamiąc multipletową regułę wyboru, emituje foton i wraca do podstawowego stanu elektronowego S 0. To zjawisko nazywamy fosforescencją. Fosforescencja jest zjawiskiem bardziej rozciągniętym w czasie i o mniejszej intensywności niż fluorescencja. 3
4 Dla małych stężeń substancji natężenie fluorescencji I f jest wprost proporcjonalne do stężenia substancji: I f = K I p a c l gdzie: K - stała aparaturowa I p - natężenie promieniowania padającego (wzbudzającego) a - współczynnik absorpcji promieniowania wzbudzającego c - stężenie substancji oznaczanej l - grubość warstwy roztworu W roztworach rozcieńczonych intensywność fluorescencji jest więc liniową funkcją stężenia luminoforu. Gdy stężenie substancji oznaczanej przekroczy jednak pewną granicę, fluorescencja przestaje być liniową funkcją stężenia a nawet może maleć. Jest to zjawisko zwane zjawiskiem gaszenia stężeniowego. Tłumaczy je teoria asocjacji stężeniowej, która zakłada, że cząsteczki zasocjowane mimo tego, że pochłaniają energię, nie są zdolne do jej emisji. Zjawisko to ilustruje poniższy wykres ryc.. Ryc.. Zależność I f w funkcji stężenia chlorowodorku chininy (zakres stężeń od 10 do 100 μg/ml związku w 0,1 mol/l H SO 4 ). Kuweta l=1 cm. 4
5 Układ pomiarowy Przyrządy stosowane w pomiarach fluorescencyjnych noszą nazwę fluorymetrów i spektrofluorymetrów (służą do otrzymywania pełnych widm fluorescencyjnych). Podstawowy układ pomiarowy przedstawia ryc. 3. Próbka Detektor Ryc. 3. Schemat fluorymetru. Fluorymetr zbudowany jest z następujących elementów: 1. Źródło promieniowania wzbudzającego S - żarówka wolframowa lub lampa wolframowo-halogenowa, stosowane w zakresie światła widzialnego ( nm) - lampy deuterowe lub łukowe lampy ksenonowe, stosowane w zakresie nadfioletu ( nm) - lasery atomowe, jonowe i barwnikowe.. Monochromatory M1 i M - pryzmaty i siatki dyfrakcyjne w spektrofluorymetrach - filtry we fluorymetrach Służą one do wyboru wiązki światła o danej długości fali z widma niemonochromatycznego. Stosowane są dwa monochromatory (filtry). Pierwszy (M 1 ) służy do wybrania określonej długości fali światła padającego na próbkę, czyli światła wzbudzającego. 5
6 Drugi (M ) monochromatyzuje światło emitowane przez próbkę. Umieszczony jest on zwykle za próbką pod kątem90 w stosunku do światła padającego na próbkę, dochodzi więc do niego tylko promieniowanie emitowane a nie wzbudzające. 3. Próbka Przygotowuje się ją najczęściej w postaci roztworu i umieszcza w kuwecie o grubości 1 cm. Jeżeli pomiary prowadzimy w zakresie UV używamy kuwet kwarcowych, jeżeli pracujemy w zakresie VIS stosujemy kuwety ze szkła lub plastiku. 4. Detektory Do detekcji promieniowania w zakresie UV-VIS stosuje się fotopowielacze lub detektory wielokanałowe typu diode-array. 5. Rejestratory i komputery Służą do rejestracji danych i sterowania procesem pomiarowym. Zastosowanie i właściwości metod fluorymetrycznych Metody fluorymetryczne stosuje się do oznaczania śladowych ilości substancji wykazujących fluorescencję. Zaletą metod fluorymetrycznych jest: a) możliwość oznaczania związków nieorganicznych oraz organicznych b) duża czułość - jest możliwe oznaczanie substancji organicznych i nieorganicznych o stężeniach 0,01 ppm b) duża precyzja (rozrzut wyników nie większy niż ±1%) c) duża dokładność d) duża selektywność - np. poprzez możliwość doboru długości fali promieniowania wzbudzającego oraz emitowanego e) charakteryzuje się razy niższą dolną granicą wykrywalności niż spektrofotometria absorpcyjna f) dopuszczalność zastosowania w badaniach biologicznych i biochemicznych g) możliwość oznaczania związków niefluoryzujących przez tworzenie fluoryzujących kompleksów 6
7 FLUORYMETRYCZNE OZNACZENIE NISKICH STĘŻEŃ CHLOROWODORKU CHININY (M m = 360,9) PRZY UŻYCIU FLUORYMETRU JENWAY 685 Fluorymetria jest instrumentalną metodą analityczną, która wykorzystuje zjawisko emisji promieniowania fluorescencyjnego do oznaczania ilościowego składników. Należy do najczulszych metod instrumentalnej analizy ilościowej. Celem ćwiczenia jest zapoznanie studentów z techniką pomiarów fluorymetrycznych, w szczególności, pokaz zastosowania tej metody do oznaczania ilościowego chlorowodorku chininy w roztworze kwasu siarkowego. OH H N CH N Chinina Chinina jest znaną substancją leczniczą o działaniu przeciwgorączkowym, przeciwzapalnym, przeciwbólowym i przeciwmalarycznym, a fluorescencję tego związku określa i warunkuje obecność płaskiego układu sprzężonych wiązań podwójnych pierścienia chinolinowego. 7
8 Dobór kuwet do badań fluorymetrycznych Do badań fluorymetrycznych muszą być stosowane specjalne kuwety spełniające następujące warunki: a. Muszą mieć przezroczyste wszystkie ścianki boczne pomiar promieniowania emisyjnego jest prostopadły do kierunku promieniowania wzbudzającego. b. Przepuszczalność kuwet musi obejmować zakres długości promieniowania wzbudzającego i emitowanego przez badaną próbkę. Poniżej ryc. 4, przedstawiono zakresy przepuszczalności typowych kuwet pomiarowych. 1 3 Ryc. 4. Widma absorpcyjne pustych kuwet: 1 ze specjalnego tworzywa do pomiarów fluorymetrycznych (kolor niebieski) ze szkła (kolor czerwony) 3 kwarcowa (kolor zielony) Z ryc. 4 widać, że pełną przepuszczalność w zakresie nm ma tylko kuweta kwarcowa, kuwety szklana i z tworzywa są przepuszczalne dla λ 300 nm i tylko w tym zakresie długości mogą być stosowane. 8
9 Dobór długości promieniowania wzbudzającego λ ex i analitycznego λ em przy pomiarach fluorymetrycznych Podstawowym problemem w badaniach fluorymetrycznych jest dobór długości filtrów pomiarowych: wzbudzającego λ ex oraz analitycznego λ em. Właściwy ich dobór pozwala na otrzymanie maksymalnego natężenia promieniowania emitowanego przez badaną próbkę. Filtr wzbudzający dobiera się na podstawie położenia maksimum długofalowego pasma absorpcyjnego dla chininy to λ max 346 nm ryc. 5. Filtr analityczny można wstępnie dobrać wiedząc, że jego długość jest kilkadziesiąt nm większa od długości filtra wzbudzającego (promieniowanie emitowane przez próbkę jest bardziej długofalowe od promieniowania wzbudzającego). λ max = 346 nm Ryc. 5. Widmo roztworu chlorowodorku chininy (c =10µg/ml, c m =,771x10-5 mol/l) w roztworze H SO 4 o stężeniu 0,1 mol/l. Kuweta kwarcowa (l=1 cm). Temperatura t= 0 0 C. Widmo wykonane na spektrofotometrze UV/VIS Lambda 5 (PerkinElmer). 9
10 Najlepszą i zalecaną metodą doboru filtrów jest wykonanie widm -D i 3-D na spektrofluorymetrze. Ryc. 6 i 7 przedstawiają takie właśnie widma zarejestrowane dla chlorowodorku chininy z zaznaczonymi wartościami λ ex i λ em (to współrzędne położenia maksimum najsilniejszego piku emisyjnego). λ ex = 340 nm λ em = 457nm 600 EX(nm) EM(nm) 600 Ryc. 6. Widmo 3-D chininy: mieszanina roztworów: 5ml 0,1 μg/ml chlorowodorku chininy w 0,1 mol/l H SO 4 i 5 ml H O. Na osi Y jednostka RFU (Relative Fluorescence Unit). Kuweta kwarcowa l=1 cm. Widmo wykonane na spektrofluorymetrze Hitachi F
11 λ ex = 340 nm λ em = 457 nm Ryc. 7. Widmo -D chininy: mieszanina roztworów: 5 ml 0,1 μg/ml chlorowodorku chininy w 0,1 mol/l H SO 4 i 5 ml H O. Kuweta kwarcowa l = 1 cm. Widmo wykonane na spektrofluorymetrze Hitachi F4500. Z otrzymanych widm widać, że najsilniejszą emisję promieniowania fluorescencyjnego otrzymuje się dla pary długości fal: λ ex = 340 nm i λ em = 457nm. Widmo emisyjne zarejestrowane dla optymalnego wzbudzenia długością λ ex = 340 nm przedstawia ryc. 8. CYP_Krzywa(EM) λ em = 457nm nm Ryc. 8. Widmo emisyjne roztworu: mieszanina 5ml 0,1 μg/ml chlorowodorku chininy w 0,1 mol/l H SO 4 i 5 ml H O. Wzbudzenie promieniowaniem o długości λ ex = 340 nm. Na osi Y jednostka RFU. Kuweta kwarcowa l=1 cm. Widmo wykonane na spektrofluorymetrze Hitachi F
12 Przygotowanie roztworów 1. Roztwór odnośnikowy H SO 4 o stężeniu c = 0,1 mol/l i roztwór podstawowy chlorowodorku chininy o stężeniu c =100 μg/ml w roztworze H SO 4 o stężeniu c = 0,1 mol/l jest przygotowany przez asystenta.. W celu wykonania krzywej wzorcowej, z roztworu podstawowego chlorowodorku chininy o stężeniu c = 100μg/ml, studenci przygotowują 10 roztworów wzorcowych o stężeniach od 1,, 3 do 10 μg/ml. Do rozcieńczania używany jest roztwór H SO 4 o stężeniu c = 0,1 mol/l. 3. Roztwory z o nieznanym stężeniu chlorowodorku chininy przygotowuje asystent. Należy je rozcieńczyć do 100 ml za pomocą roztworu H SO 4 o stężeniu c = 0,1 mol/l Wykonanie pomiarów I f (natężenie fluorescencji) badanych roztworów Pomiary są wykonywane na fluorymetrze Jenway 685. Jego przedni panel przedstawia poniższy rysunek ryc. 9. Ryc. 9. Panel pomiarowy fluorymetru Jenway 685. Funkcje przycisków przedstawia ryc
13 Ryc. 10. Funkcje przycisków panelu fluorymetru Jenway Włączyć fluorymetr i odczekać 15 minut.. Z menu głównego przejść do menu MEASURE SETUP wybierając wcześniej SETUP w menu głównym. Wyświetlony zostanie poniższy ekran: Przed przeprowadzeniem jakichkolwiek pomiarów należy upewnić się, że zamontowano odpowiedni filtr wzbudzający i emisyjny. EXIT pozwala użytkownikowi na powrót do poprzedniego menu METHOD ID używany do nadawania numerów poszczególnym metodom 13
14 NAME - wpisana przez użytkownika nazwa metody 3. Za pomocą kursorów po prawej stronie panelu ustawić odpowiednie wartości w nm dla filtra wzbudzającego (EXCITATION) i analitycznego (EMMISION). Do rejestracji fluorescencji użyć filtrów o najbardziej zbliżonych do ustalonych wcześniej długości: wzbudzający λ ex = 350 nm, filtr analityczny λ em = 470 nm. Wybrać jedną z możliwych jednostek pomiarowych: RFU, ppm, U/mL, mu/l, U/L, μm/l, mm/l, M/L, μg/ml, mg/dl, g/dl, ng/l, μg/l, g/l, %, ppb. W przeprowadzanym ćwiczeniu wybraną jednostką jest RFU (Relative Fluorescent Unit). 4. Wrócić do menu głównego po wciśnięciu EXIT i po przejściu w tryb pomiarowy umieścić próbkę w uchwycie kuwet w komorze próbek, zamknąć pokrywę. 5. Podświetlić na ekranie opcję READ i wcisnąć przycisk ENTER. 6. W trakcie pomiaru wyświetlany będzie komunikat Reading Po zakończeniu pomiaru podana zostanie wartość I f w jednostkach RFU z dokładnością ustawioną w menu MEASURE SETUP. 8. Wynik pomiaru zapisać lub wydrukować. 9. Przeprowadzić kolejne pomiary używając opcji READ. Wykonać trzy serie pomiarów I f dla roztworów wzorcowych i otrzymanego zadania. Wyniki zapisać w poniższej tabeli I i obliczyć wartości średnie I f. 14
15 Lp. Stężenie (μg/ml) Natężenie promieniowania fluorescencyjnego I f w jednostkach RFU (x i) Zadanie (z) I pomiar II pomiar III pomiar Wartość średnia I f w jednostkach RFU (y i ) Tabela I. Tabela otrzymanych wyników I f dla roztworów wzorcowych i zadania. a. Narysować wykres wartości I f w funkcji stężenia. b. Na oś rzędnych wykresu nanieść wartość średnią dla zadania i odczytać graficznie oznaczaną wartość stężenia dla zadania. c. Otrzymane wyniki wartości średnich I f przenieść do poniższej tabeli i wykonać odpowiednie obliczenia. 15
16 Lp. Stężenie Wartość średnia (μg/ml) (x i) pomiarów w RFU (y i ) x i y i x i y i Σx i = Σy i = Σx i = Σy i = Σx i y i = Tabela II. Tabela obliczeniowa. Na podstawie wyników zebranych w tabeli II, zakładając zależność liniową y = bx + a, obliczyć według poniższych wzorów wartości współczynnika kierunkowego b, wyrazu wolnego a, oraz błędy tych współczynników S b i S a b n x y x y i i i i n x x a yi b x i n i i 1 S b n yi b xi yi a n n x x i i y i S a 1 n S b x i 16
17 d. Obliczyć granicę wykrywalności LOD (Limit of Detection) i granicę oznaczalności LOQ (Limit of Quantification) wg poniższych wzorów: LOD = 3,3 S a /b LOQ = 3 LOD e. Znając współczynniki a i b oraz wartość średnią fluorescencji zadania, z odwrócenia funkcji liniowej y = (bx + a), oblicz zawartość chlorowodorku chininy w zadaniu. Porównaj wynik z odczytem graficznym
18 ZADANIE Wyznaczenie granicy wykrywalności (LOD) i oznaczalności (LOQ) chlorowodorku chininy metodą spektroskopii UV/VIS W celu wyznaczenia granicy wykrywalności (LOD) i oznaczalności (LOQ) chlorowodorku chininy metodą spektroskopii UV/VIS przygotowano serię roztworów chlorowodorku chininy o stężeniach z zakresu od 1 do 10 µg/ml, zmienianych skokowo co 1 µg/ml. Zbiór tych widm przedstawia ryc Ryc. 11. Zbiór widm chlorowodorku chininy w roztworze H SO 4 o stężeniu 0,1 mol/l. Kuweta kwarcowa l=1 cm. Widma wykonane na spektrofotometrze UV/VIS Lambda 5 (PerkinElmer). Wyniki zebrane są w tabeli III. 18
19 Nr widma Stężenie chininy (µg/ml) Absorbancja roztworu A ( λ max = 50,14 nm) 0,0 0, ,0 0,0878,0 0, ,0 0,84 4 4,0 0, ,0 0, ,0 0, ,0 0, ,0 0, ,0 0, ,0 0,735 Tab. III. Zależność absorbancji A (λ = 50,14 nm) roztworu chininy w kwasie siarkowym (c= 0,1 mol/l) w funkcji stężenia chininy. Kuweta kwarcowa l=1 cm. Wyniki zależności absorbancji ( λ = 50,14 nm) w funkcji stężenia chininy są przedstawione na ryc
20 absorbancja A, λ=50,14 nm 0,80 y = 0,0738x + 0,0058 R² = 0,998 0,70 0,60 0,50 0,40 0,30 0,0 0,10 0, stężenie μg/ml Ryc. 1. Wykres zależności absorbancji A (λ = 50,14 nm) roztworu chininy w kwasie siarkowym ( c= 0,1 mol/l) w funkcji stężenia chininy. Kuweta kwarcowa l=1 cm. Na podstawie wyników w tabeli III, analogicznie jak w metodzie fluorymetrycznej, oblicz LOD i LOQ metodą spektrofotometryczną. Do obliczeń wykorzystaj arkusz kalkulacyjny EXCEL opis i wizualizacja przykładowych obliczeń dla pomiarów fluorymetrycznych przedstawiona jest poniżej. Wyniki porównaj z odpowiednimi wynikami uzyskanymi metodą fluorymetryczną. 0
21 Zastosowanie arkusza EXCEL i funkcji REGLINP do obliczeń 1. Wprowadzić do arkusza EXCEL, w postaci dwóch sąsiadujących kolumn, zebrane dane pomiarowe X i i Y i ( X i stężenie, Y i - wartość I f ).. Obok wprowadzonych danych zaznaczyć sześć komórek leżących obok siebie w trzech wierszach i dwóch kolumnach. 3. Z paska zadań wybrać: FORMUŁY WIĘCEJ FUNKCJI STATYSTYCZNE REGLINP 4. W oknie wprowadzania parametrów należy podać parametry funkcji. 5. W wierszu znane_y zaznaczyć zakres komórek zawierających wartości Y i 6. W wierszu znane_x zaznaczyć zakres komórek zawierających wartości X i 7. W wierszu STAŁA wpisać wartość logiczną PRAWDA 8. W wierszu STATYSTYKA wpisać wartość logiczną PRAWDA 9. Po zamknięciu okna wprowadzania parametrów kliknąć OK 10. Kliknąć wskaźnikiem myszy na pasek formuł znajdujący się nad arkuszem tak, aby pojawił się tam i zaczął mrugać kursor tekstowy. 11. Trzymając jednocześnie wciśnięte Ctrl i Shift wcisnąć Enter w sześciu zaznaczonych komórkach w kroku pojawią się obliczone metodą najmniejszych kwadratów wartości: b, a, S b, S a,, R i R xy patrz ryc
22 Ryc. 13. Wizualizacja rachunków wykonanych w arkuszu kalkulacyjnym EXCEL dla pomiarów fluorymetrycznych.
Techniki analityczne. Podział technik analitycznych. Metody spektroskopowe. Spektroskopia elektronowa
 Podział technik analitycznych Techniki analityczne Techniki elektrochemiczne: pehametria, selektywne elektrody membranowe, polarografia i metody pokrewne (woltamperometria, chronowoltamperometria inwersyjna
Podział technik analitycznych Techniki analityczne Techniki elektrochemiczne: pehametria, selektywne elektrody membranowe, polarografia i metody pokrewne (woltamperometria, chronowoltamperometria inwersyjna
rodzaje luminescencji (czym wywołana?)
 metody emisyjne luminescencja - świecenie atomów lub cząsteczek, które nie jest wywołane głównie przez wysoką temperaturę generalnie świecenie zimnych cząsteczek rodzaje luminescencji (czym wywołana?)
metody emisyjne luminescencja - świecenie atomów lub cząsteczek, które nie jest wywołane głównie przez wysoką temperaturę generalnie świecenie zimnych cząsteczek rodzaje luminescencji (czym wywołana?)
POLITECHNIKA GDAŃSKA
 PLITECHIKA GDAŃSKA WYDZIAŁ CHEMICZY KATEDRA TECHLGII CHEMICZEJ Ćwiczenia laboratoryjne CHEMIA I TECHLGIA MATERIAŁÓW BARWYCH SPEKTRFLURYMETRIA GDAŃSK RK 2011 1. Cel ćwiczenia Celem ćwiczenia jest zapoznanie
PLITECHIKA GDAŃSKA WYDZIAŁ CHEMICZY KATEDRA TECHLGII CHEMICZEJ Ćwiczenia laboratoryjne CHEMIA I TECHLGIA MATERIAŁÓW BARWYCH SPEKTRFLURYMETRIA GDAŃSK RK 2011 1. Cel ćwiczenia Celem ćwiczenia jest zapoznanie
IR II. 12. Oznaczanie chloroformu w tetrachloroetylenie metodą spektrofotometrii w podczerwieni
 IR II 12. Oznaczanie chloroformu w tetrachloroetylenie metodą spektrofotometrii w podczerwieni Promieniowanie podczerwone ma naturę elektromagnetyczną i jego absorpcja przez materię podlega tym samym prawom,
IR II 12. Oznaczanie chloroformu w tetrachloroetylenie metodą spektrofotometrii w podczerwieni Promieniowanie podczerwone ma naturę elektromagnetyczną i jego absorpcja przez materię podlega tym samym prawom,
OZNACZANIE ŻELAZA METODĄ SPEKTROFOTOMETRII UV/VIS
 OZNACZANIE ŻELAZA METODĄ SPEKTROFOTOMETRII UV/VIS Zagadnienia teoretyczne. Spektrofotometria jest techniką instrumentalną, w której do celów analitycznych wykorzystuje się przejścia energetyczne zachodzące
OZNACZANIE ŻELAZA METODĄ SPEKTROFOTOMETRII UV/VIS Zagadnienia teoretyczne. Spektrofotometria jest techniką instrumentalną, w której do celów analitycznych wykorzystuje się przejścia energetyczne zachodzące
Instrukcje opracowane przez: dr inż. Urszulę Kucharską dr hab. inż. Joannę Leszczyńską
 Instrukcje opracowane przez: dr inż. Urszulę Kucharską dr hab. inż. Joannę Leszczyńską Strona tytułowa skryptu w którym zamieszczona jest treść ćwiczenia SPEKTROFLUORYMETRYCZNA METODA
Instrukcje opracowane przez: dr inż. Urszulę Kucharską dr hab. inż. Joannę Leszczyńską Strona tytułowa skryptu w którym zamieszczona jest treść ćwiczenia SPEKTROFLUORYMETRYCZNA METODA
ĆWICZENIE 3 LUMINOFORY ORGANICZNE I NIEORGANICZNE.
 Laboratorium specjalizacyjne A ĆWICZENIE 3 LUMINOFORY ORGANICZNE I NIEORGANICZNE. Zagadnienia: Podział luminoforów: fluorofory oraz fosfory Luminofory organiczne i nieorganiczne Różnorodność stanów wzbudzonych
Laboratorium specjalizacyjne A ĆWICZENIE 3 LUMINOFORY ORGANICZNE I NIEORGANICZNE. Zagadnienia: Podział luminoforów: fluorofory oraz fosfory Luminofory organiczne i nieorganiczne Różnorodność stanów wzbudzonych
PRACOWNIA CHEMII. Wygaszanie fluorescencji (Fiz4)
 PRACOWNIA CHEMII Ćwiczenia laboratoryjne dla studentów II roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Wygaszanie fluorescencji
PRACOWNIA CHEMII Ćwiczenia laboratoryjne dla studentów II roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Wygaszanie fluorescencji
Cel ćwiczenia: Celem ćwiczenia jest zapoznanie z właściwościami optycznymi tkanek i wybranych chromoforów.
 Wydział PPT Laboratorium PODSTAWY BIOFOTONIKI Ćwiczenie nr 1 Zastosowania spektroskopii Cel ćwiczenia: Celem ćwiczenia jest zapoznanie z właściwościami optycznymi tkanek i wybranych chromoforów. 1. Wprowadzenie
Wydział PPT Laboratorium PODSTAWY BIOFOTONIKI Ćwiczenie nr 1 Zastosowania spektroskopii Cel ćwiczenia: Celem ćwiczenia jest zapoznanie z właściwościami optycznymi tkanek i wybranych chromoforów. 1. Wprowadzenie
ĆWICZENIE 3 LUMINOFORY ORAZ ZJAWISKA WYGASZANIA LUMINESCENCJI
 Laboratorium specjalizacyjne Chemia sądowa ĆWICZENIE 3 LUMINOFORY ORAZ ZJAWISKA WYGASZANIA LUMINESCENCJI Zagadnienia: Podział luminoforów: fluorofory oraz fosfory Luminofory organiczne i nieorganiczne
Laboratorium specjalizacyjne Chemia sądowa ĆWICZENIE 3 LUMINOFORY ORAZ ZJAWISKA WYGASZANIA LUMINESCENCJI Zagadnienia: Podział luminoforów: fluorofory oraz fosfory Luminofory organiczne i nieorganiczne
Katedra Fizyki i Biofizyki instrukcje do ćwiczeń laboratoryjnych dla kierunku Lekarskiego
 Ćw. M8 Zjawisko absorpcji i emisji światła w analityce. Pomiar widm absorpcji i stężenia ryboflawiny w roztworach wodnych za pomocą spektrofotometru. Wyznaczanie stężeń substancji w roztworze metodą fluorescencyjną.
Ćw. M8 Zjawisko absorpcji i emisji światła w analityce. Pomiar widm absorpcji i stężenia ryboflawiny w roztworach wodnych za pomocą spektrofotometru. Wyznaczanie stężeń substancji w roztworze metodą fluorescencyjną.
Spektroskopia emisyjna. Fluorescencja i Fosforescencja
 Spektroskopia emisyjna Fluorescencja i Fosforescencja Reguły wyboru przejścia między termami cząsteczkowymi =0, 1 S=0 g u g g u u + + - - + - Reguła Francka-Condona Najbardziej prawdopodobne są przejścia
Spektroskopia emisyjna Fluorescencja i Fosforescencja Reguły wyboru przejścia między termami cząsteczkowymi =0, 1 S=0 g u g g u u + + - - + - Reguła Francka-Condona Najbardziej prawdopodobne są przejścia
E (2) nazywa się absorbancją.
 1/6 Celem ćwiczenia jest poznanie zjawiska absorpcji światła przez roztwory, pomiar widma absorpcji przy pomocy spektrofotometru oraz wyliczenie stężenia badanego roztworu. Promieniowanie elektromagnetyczne,
1/6 Celem ćwiczenia jest poznanie zjawiska absorpcji światła przez roztwory, pomiar widma absorpcji przy pomocy spektrofotometru oraz wyliczenie stężenia badanego roztworu. Promieniowanie elektromagnetyczne,
Metody spektroskopowe:
 Katedra Chemii Analitycznej Metody spektroskopowe: Absorpcyjna Spektrometria Atomowa Fotometria Płomieniowa Gdańsk, 2010 Opracowała: mgr inż. Monika Kosikowska 1 1. Wprowadzenie Spektroskopia to dziedzina
Katedra Chemii Analitycznej Metody spektroskopowe: Absorpcyjna Spektrometria Atomowa Fotometria Płomieniowa Gdańsk, 2010 Opracowała: mgr inż. Monika Kosikowska 1 1. Wprowadzenie Spektroskopia to dziedzina
SPEKTROMETRIA FLUORESCENCYJNA CZĄSTECZKOWA. Spektrofluorymetryczne oznaczanie Al w postaci chelatowego kompleksu glinu z moryną.
 SPEKTROMETRIA FLUORESCENCYJNA CZĄSTECZKOWA Spektrofluorymetryczne oznaczanie Al w postaci chelatowego kompleksu glinu z moryną. Dr Dorota Sieńko, Zakład Chemii Analitycznej i Analizy Instrumentalnej, Wydział
SPEKTROMETRIA FLUORESCENCYJNA CZĄSTECZKOWA Spektrofluorymetryczne oznaczanie Al w postaci chelatowego kompleksu glinu z moryną. Dr Dorota Sieńko, Zakład Chemii Analitycznej i Analizy Instrumentalnej, Wydział
SPEKTROMETRIA FLUORESCENCYJNA CZĄSTECZKOWA. Spektrofluorymetryczne oznaczanie ryboflawiny.
 SPEKTROMETRIA FLUORESCENCYJNA CZĄSTECZKOWA Spektrofluorymetryczne oznaczanie ryboflawiny. Dr Dorota Sieńko, Zakład Chemii Analitycznej i Analizy Instrumentalnej, Wydział Chemii UMCS w Lublinie A. Cel ćwiczenia:
SPEKTROMETRIA FLUORESCENCYJNA CZĄSTECZKOWA Spektrofluorymetryczne oznaczanie ryboflawiny. Dr Dorota Sieńko, Zakład Chemii Analitycznej i Analizy Instrumentalnej, Wydział Chemii UMCS w Lublinie A. Cel ćwiczenia:
PRACOWNIA PODSTAW BIOFIZYKI
 PRACOWNIA PODSTAW BIOFIZYKI Ćwiczenia laboratoryjne dla studentów III roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Badanie wygaszania fluorescencji SPQ przez jony chloru
PRACOWNIA PODSTAW BIOFIZYKI Ćwiczenia laboratoryjne dla studentów III roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Badanie wygaszania fluorescencji SPQ przez jony chloru
SPEKTROFOTOMETRIA UV-Vis. - długość fali [nm, m], - częstość drgań [Hz; 1 Hz = 1 cykl/s]
![SPEKTROFOTOMETRIA UV-Vis. - długość fali [nm, m], - częstość drgań [Hz; 1 Hz = 1 cykl/s] SPEKTROFOTOMETRIA UV-Vis. - długość fali [nm, m], - częstość drgań [Hz; 1 Hz = 1 cykl/s]](/thumbs/32/15622407.jpg) SPEKTROFOTOMETRIA UV-Vis Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. Spektrofotometria w zakresie nadfioletu (UV) i promieniowania widzialnego (Vis) jest jedną
SPEKTROFOTOMETRIA UV-Vis Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. Spektrofotometria w zakresie nadfioletu (UV) i promieniowania widzialnego (Vis) jest jedną
Jan Drzymała ANALIZA INSTRUMENTALNA SPEKTROSKOPIA W ŚWIETLE WIDZIALNYM I PODCZERWONYM
 Jan Drzymała ANALIZA INSTRUMENTALNA SPEKTROSKOPIA W ŚWIETLE WIDZIALNYM I PODCZERWONYM Światło słoneczne jest mieszaniną fal o różnej długości i różnego natężenia. Tylko część promieniowania elektromagnetycznego
Jan Drzymała ANALIZA INSTRUMENTALNA SPEKTROSKOPIA W ŚWIETLE WIDZIALNYM I PODCZERWONYM Światło słoneczne jest mieszaniną fal o różnej długości i różnego natężenia. Tylko część promieniowania elektromagnetycznego
JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI? JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI?
 Podstawowe miary masy i objętości stosowane przy oznaczaniu ilości kwasów nukleinowych : 1g (1) 1l (1) 1mg (1g x 10-3 ) 1ml (1l x 10-3 ) 1μg (1g x 10-6 ) 1μl (1l x 10-6 ) 1ng (1g x 10-9 ) 1pg (1g x 10-12
Podstawowe miary masy i objętości stosowane przy oznaczaniu ilości kwasów nukleinowych : 1g (1) 1l (1) 1mg (1g x 10-3 ) 1ml (1l x 10-3 ) 1μg (1g x 10-6 ) 1μl (1l x 10-6 ) 1ng (1g x 10-9 ) 1pg (1g x 10-12
Kierunek: TOWAROZNAWSTWO, sem.iii ĆWICZENIE 8
 Kierunek: TWARZAWSTW, sem.iii ĆWICZEIE 8 Spektrofotometryczna metoda oznaczania histaminy w produktach spożywczych (P-90A-86786) 1. WSTĘP 1.1. CEL ĆWICZEIA Celem ćwiczenia jest zapoznanie studentów z jedną
Kierunek: TWARZAWSTW, sem.iii ĆWICZEIE 8 Spektrofotometryczna metoda oznaczania histaminy w produktach spożywczych (P-90A-86786) 1. WSTĘP 1.1. CEL ĆWICZEIA Celem ćwiczenia jest zapoznanie studentów z jedną
Widmo promieniowania
 Widmo promieniowania Spektroskopia Każde ciało wysyła promieniowanie. Promieniowanie to jest składa się z wiązek o różnych długościach fal. Jeśli wiązka światła pada na pryzmat, ulega ono rozszczepieniu,
Widmo promieniowania Spektroskopia Każde ciało wysyła promieniowanie. Promieniowanie to jest składa się z wiązek o różnych długościach fal. Jeśli wiązka światła pada na pryzmat, ulega ono rozszczepieniu,
Materiał obowiązujący do ćwiczeń z analizy instrumentalnej II rok OAM
 Materiał obowiązujący do ćwiczeń z analizy instrumentalnej II rok OAM Ćwiczenie 1 Zastosowanie statystyki do oceny metod ilościowych Błąd gruby, systematyczny, przypadkowy, dokładność, precyzja, przedział
Materiał obowiązujący do ćwiczeń z analizy instrumentalnej II rok OAM Ćwiczenie 1 Zastosowanie statystyki do oceny metod ilościowych Błąd gruby, systematyczny, przypadkowy, dokładność, precyzja, przedział
Spektroskopia molekularna. Ćwiczenie nr 1. Widma absorpcyjne błękitu tymolowego
 Spektroskopia molekularna Ćwiczenie nr 1 Widma absorpcyjne błękitu tymolowego Doświadczenie to ma na celu zaznajomienie uczestników ćwiczeń ze sposobem wykonywania pomiarów metodą spektrofotometryczną
Spektroskopia molekularna Ćwiczenie nr 1 Widma absorpcyjne błękitu tymolowego Doświadczenie to ma na celu zaznajomienie uczestników ćwiczeń ze sposobem wykonywania pomiarów metodą spektrofotometryczną
ELEMENTY ANALIZY INSTRUMENTALNEJ. SPEKTROFOTOMETRII podstawy teoretyczne
 ELEMENTY ANALZY NSTRUMENTALNEJ Ćwiczenie 3 Temat: Spektrofotometria UV/ViS SPEKTROFOTOMETR podstawy teoretyczne SPEKTROFOTOMETRA jest techniką instrumentalną, w której do celów analitycznych wykorzystuje
ELEMENTY ANALZY NSTRUMENTALNEJ Ćwiczenie 3 Temat: Spektrofotometria UV/ViS SPEKTROFOTOMETR podstawy teoretyczne SPEKTROFOTOMETRA jest techniką instrumentalną, w której do celów analitycznych wykorzystuje
Spektrofotometryczne wyznaczanie stałej dysocjacji czerwieni fenolowej
 Spektrofotometryczne wyznaczanie stałej dysocjacji czerwieni fenolowej Metoda: Spektrofotometria UV-Vis Cel ćwiczenia: Celem ćwiczenia jest zapoznanie studenta z fotometryczną metodą badania stanów równowagi
Spektrofotometryczne wyznaczanie stałej dysocjacji czerwieni fenolowej Metoda: Spektrofotometria UV-Vis Cel ćwiczenia: Celem ćwiczenia jest zapoznanie studenta z fotometryczną metodą badania stanów równowagi
PRACOWNIA PODSTAW BIOFIZYKI
 PRACOWNIA PODSTAW BIOFIZYKI Ćwiczenia laboratoryjne dla studentów III roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Pomiary zaników fluorescencji wybranych barwników (PB16)
PRACOWNIA PODSTAW BIOFIZYKI Ćwiczenia laboratoryjne dla studentów III roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Pomiary zaników fluorescencji wybranych barwników (PB16)
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego. Spektrofotometryczne oznaczanie stężenia jonów żelaza(iii) opiekun mgr K. Łudzik
 Katedra Chemii Fizycznej Uniwersytetu Łódzkiego Spektrofotometryczne oznaczanie stężenia jonów żelaza(iii) opiekun mgr K. Łudzik ćwiczenie nr 26 Zakres zagadnień obowiązujących do ćwiczenia 1. Prawo Lamberta
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego Spektrofotometryczne oznaczanie stężenia jonów żelaza(iii) opiekun mgr K. Łudzik ćwiczenie nr 26 Zakres zagadnień obowiązujących do ćwiczenia 1. Prawo Lamberta
Ćwiczenie 363. Polaryzacja światła sprawdzanie prawa Malusa. Początkowa wartość kąta 0..
 Nazwisko... Data... Nr na liście... Imię... Wydział... Dzień tyg.... Godzina... Polaryzacja światła sprawdzanie prawa Malusa Początkowa wartość kąta 0.. 1 25 49 2 26 50 3 27 51 4 28 52 5 29 53 6 30 54
Nazwisko... Data... Nr na liście... Imię... Wydział... Dzień tyg.... Godzina... Polaryzacja światła sprawdzanie prawa Malusa Początkowa wartość kąta 0.. 1 25 49 2 26 50 3 27 51 4 28 52 5 29 53 6 30 54
ANALIZA INSTRUMENTALNA
 ANALIZA INSTRUMENTALNA TECHNOLOGIA CHEMICZNA STUDIA NIESTACJONARNE Sala 522 ul. Piotrowo 3 Studenci podzieleni są na cztery zespoły laboratoryjne. Zjazd 5 przeznaczony jest na ewentualne poprawy! Możliwe
ANALIZA INSTRUMENTALNA TECHNOLOGIA CHEMICZNA STUDIA NIESTACJONARNE Sala 522 ul. Piotrowo 3 Studenci podzieleni są na cztery zespoły laboratoryjne. Zjazd 5 przeznaczony jest na ewentualne poprawy! Możliwe
PRODUKTY CHEMICZNE Ćwiczenie nr 3 Oznaczanie zawartości oksygenatów w paliwach metodą FTIR
 PRODUKTY CHEMICZNE Ćwiczenie nr 3 Oznaczanie zawartości oksygenatów w paliwach metodą FTIR WSTĘP Metody spektroskopowe Spektroskopia bada i teoretycznie wyjaśnia oddziaływania pomiędzy materią będącą zbiorowiskiem
PRODUKTY CHEMICZNE Ćwiczenie nr 3 Oznaczanie zawartości oksygenatów w paliwach metodą FTIR WSTĘP Metody spektroskopowe Spektroskopia bada i teoretycznie wyjaśnia oddziaływania pomiędzy materią będącą zbiorowiskiem
1. PRZYGOTOWANIE ROZTWORÓW KOMPLEKSUJĄCYCH
 1. PRZYGOTOWANIE ROZTWORÓW KOMPLEKSUJĄCYCH 1.1. przygotowanie 20 g 20% roztworu KSCN w wodzie destylowanej 1.1.1. odważenie 4 g stałego KSCN w stożkowej kolbie ze szlifem 1.1.2. odważenie 16 g wody destylowanej
1. PRZYGOTOWANIE ROZTWORÓW KOMPLEKSUJĄCYCH 1.1. przygotowanie 20 g 20% roztworu KSCN w wodzie destylowanej 1.1.1. odważenie 4 g stałego KSCN w stożkowej kolbie ze szlifem 1.1.2. odważenie 16 g wody destylowanej
ĆWICZENIE 2 WYZNACZANIE WYDAJNOŚCI KWANTOWYCH ORAZ CZASÓW ZANIKU LUMINESCENCJI ZWIĄZKÓW W ROZTWORZE ORAZ CIELE STAŁYM, CZ. II.
 Laboratorium specjalizacyjne Chemia sądowa ĆWICZENIE 2 WYZNACZANIE WYDAJNOŚCI KWANTOWYCH ORAZ CZASÓW ZANIKU LUMINESCENCJI ZWIĄZKÓW W ROZTWORZE ORAZ CIELE STAŁYM, CZ. II. Zagadnienia: Zjawiska fosforescencji
Laboratorium specjalizacyjne Chemia sądowa ĆWICZENIE 2 WYZNACZANIE WYDAJNOŚCI KWANTOWYCH ORAZ CZASÓW ZANIKU LUMINESCENCJI ZWIĄZKÓW W ROZTWORZE ORAZ CIELE STAŁYM, CZ. II. Zagadnienia: Zjawiska fosforescencji
ANALIZA SPEKTRALNA I POMIARY SPEKTROFOTOMETRYCZNE. Instrukcja wykonawcza
 ĆWICZENIE 72A ANALIZA SPEKTRALNA I POMIARY SPEKTROFOTOMETRYCZNE 1. Wykaz przyrządów Spektroskop Lampy spektralne Spektrofotometr SPEKOL Filtry optyczne Suwmiarka Instrukcja wykonawcza 2. Cel ćwiczenia
ĆWICZENIE 72A ANALIZA SPEKTRALNA I POMIARY SPEKTROFOTOMETRYCZNE 1. Wykaz przyrządów Spektroskop Lampy spektralne Spektrofotometr SPEKOL Filtry optyczne Suwmiarka Instrukcja wykonawcza 2. Cel ćwiczenia
Ćwiczenie 1. Zagadnienia: spektroskopia absorpcyjna, prawa absorpcji, budowa i działanie. Wstęp. Część teoretyczna.
 Ćwiczenie 1 Metodyka poprawnych i dokładnych pomiarów absorbancji, wyznaczenie małych wartości absorbancji. Czynniki wpływające na mierzone widma absorpcji i wartości absorbancji dla wybranych długości
Ćwiczenie 1 Metodyka poprawnych i dokładnych pomiarów absorbancji, wyznaczenie małych wartości absorbancji. Czynniki wpływające na mierzone widma absorpcji i wartości absorbancji dla wybranych długości
Spektroskopowe metody identyfikacji związków organicznych
 Spektroskopowe metody identyfikacji związków organicznych Wstęp Spektroskopia jest metodą analityczną zajmującą się analizą widm powstających w wyniku oddziaływania promieniowania elektromagnetycznego
Spektroskopowe metody identyfikacji związków organicznych Wstęp Spektroskopia jest metodą analityczną zajmującą się analizą widm powstających w wyniku oddziaływania promieniowania elektromagnetycznego
EKSTRAHOWANIE KWASÓW NUKLEINOWYCH JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI? JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI?
 EKSTRAHOWANIE KWASÓW NUKLEINOWYCH Wytrącanie etanolem Rozpuszczenie kwasu nukleinowego w fazie wodnej (met. fenol/chloroform) Wiązanie ze złożem krzemionkowym za pomocą substancji chaotropowych: jodek
EKSTRAHOWANIE KWASÓW NUKLEINOWYCH Wytrącanie etanolem Rozpuszczenie kwasu nukleinowego w fazie wodnej (met. fenol/chloroform) Wiązanie ze złożem krzemionkowym za pomocą substancji chaotropowych: jodek
2. Metody, których podstawą są widma atomowe 32
 Spis treści 5 Spis treści Przedmowa do wydania czwartego 11 Przedmowa do wydania trzeciego 13 1. Wiadomości ogólne z metod spektroskopowych 15 1.1. Podstawowe wielkości metod spektroskopowych 15 1.2. Rola
Spis treści 5 Spis treści Przedmowa do wydania czwartego 11 Przedmowa do wydania trzeciego 13 1. Wiadomości ogólne z metod spektroskopowych 15 1.1. Podstawowe wielkości metod spektroskopowych 15 1.2. Rola
PRACOWNIA CHEMII. Równowaga chemiczna (Fiz2)
 PRACOWNIA CHEMII Ćwiczenia laboratoryjne dla studentów II roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Równowaga chemiczna (Fiz2)
PRACOWNIA CHEMII Ćwiczenia laboratoryjne dla studentów II roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Równowaga chemiczna (Fiz2)
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego. Wyznaczanie stałej szybkości i rzędu reakcji metodą graficzną. opiekun mgr K.
 Katedra Chemii Fizycznej Uniwersytetu Łódzkiego Wyznaczanie stałej szybkości i rzędu reakcji metodą graficzną opiekun mgr K. Łudzik ćwiczenie nr 27 Zakres zagadnień obowiązujących do ćwiczenia 1. Zastosowanie
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego Wyznaczanie stałej szybkości i rzędu reakcji metodą graficzną opiekun mgr K. Łudzik ćwiczenie nr 27 Zakres zagadnień obowiązujących do ćwiczenia 1. Zastosowanie
Stałe : h=6, Js h= 4, eVs 1eV= J nie zależy
 T_atom-All 1 Nazwisko i imię klasa Stałe : h=6,626 10 34 Js h= 4,14 10 15 evs 1eV=1.60217657 10-19 J Zaznacz zjawiska świadczące o falowej naturze światła a) zjawisko fotoelektryczne b) interferencja c)
T_atom-All 1 Nazwisko i imię klasa Stałe : h=6,626 10 34 Js h= 4,14 10 15 evs 1eV=1.60217657 10-19 J Zaznacz zjawiska świadczące o falowej naturze światła a) zjawisko fotoelektryczne b) interferencja c)
Zakresy promieniowania. Światło o widzialne. długość fali, λ. podczerwień. ultrafiolet. Wektor pola elektrycznego. Wektor pola magnetycznego TV AM/FM
 Światło o widzialne Zakresy promieniowania ultrafiolet podczerwień Wektor pola elektrycznego Wektor pola magnetycznego TV AM/FM długość fali, λ Podział fal elektromagnetycznych Promieniowanie X Fale wolnozmiennesieci
Światło o widzialne Zakresy promieniowania ultrafiolet podczerwień Wektor pola elektrycznego Wektor pola magnetycznego TV AM/FM długość fali, λ Podział fal elektromagnetycznych Promieniowanie X Fale wolnozmiennesieci
ĆWICZENIE Nr 4 LABORATORIUM FIZYKI KRYSZTAŁÓW STAŁYCH. Badanie krawędzi absorpcji podstawowej w kryształach półprzewodników POLITECHNIKA ŁÓDZKA
 POLITECHNIKA ŁÓDZKA INSTYTUT FIZYKI LABORATORIUM FIZYKI KRYSZTAŁÓW STAŁYCH ĆWICZENIE Nr 4 Badanie krawędzi absorpcji podstawowej w kryształach półprzewodników I. Cześć doświadczalna. 1. Uruchomić Spekol
POLITECHNIKA ŁÓDZKA INSTYTUT FIZYKI LABORATORIUM FIZYKI KRYSZTAŁÓW STAŁYCH ĆWICZENIE Nr 4 Badanie krawędzi absorpcji podstawowej w kryształach półprzewodników I. Cześć doświadczalna. 1. Uruchomić Spekol
WYZNACZANIE ODLEGŁOŚCI KRYTYCZNEJ POMIĘDZY CZĄSTECZKAMI DONORA I AKCEPTORA W PROCESIE REZONANSOWEGO PRZENIESIENIA ENERGII (FRET)
 Ćwiczenie 9 WYZNACZANIE ODLEGŁOŚCI KRYTYCZNEJ POMIĘDZY CZĄSTECZKAMI DONORA I AKCEPTORA W PROCESIE REZONANSOWEGO PRZENIESIENIA ENERGII (FRET) Zagadnienia: procesy dezaktywacji stanów elektronowo wzbudzonych
Ćwiczenie 9 WYZNACZANIE ODLEGŁOŚCI KRYTYCZNEJ POMIĘDZY CZĄSTECZKAMI DONORA I AKCEPTORA W PROCESIE REZONANSOWEGO PRZENIESIENIA ENERGII (FRET) Zagadnienia: procesy dezaktywacji stanów elektronowo wzbudzonych
Analiza spektralna i pomiary spektrofotometryczne
 Analiza spektralna i pomiary spektrofotometryczne Zagadnienia: 1. Absorbcja światła. 2. Współrzędne trójchromatyczne barwy, Prawa Gassmana. 3. Trójkąt barw. Trójkąt nasyceń. 4. Rozpraszanie światła. 5.
Analiza spektralna i pomiary spektrofotometryczne Zagadnienia: 1. Absorbcja światła. 2. Współrzędne trójchromatyczne barwy, Prawa Gassmana. 3. Trójkąt barw. Trójkąt nasyceń. 4. Rozpraszanie światła. 5.
Opracował dr inż. Tadeusz Janiak
 Opracował dr inż. Tadeusz Janiak 1 Uwagi dla wykonujących ilościowe oznaczanie metodami spektrofotometrycznymi 3. 3.1. Ilościowe oznaczanie w metodach spektrofotometrycznych Ilościowe określenie zawartości
Opracował dr inż. Tadeusz Janiak 1 Uwagi dla wykonujących ilościowe oznaczanie metodami spektrofotometrycznymi 3. 3.1. Ilościowe oznaczanie w metodach spektrofotometrycznych Ilościowe określenie zawartości
Spektroskopia molekularna. Spektroskopia w podczerwieni
 Spektroskopia molekularna Ćwiczenie nr 4 Spektroskopia w podczerwieni Spektroskopia w podczerwieni (IR) jest spektroskopią absorpcyjną, która polega na pomiarach promieniowania elektromagnetycznego pochłanianego
Spektroskopia molekularna Ćwiczenie nr 4 Spektroskopia w podczerwieni Spektroskopia w podczerwieni (IR) jest spektroskopią absorpcyjną, która polega na pomiarach promieniowania elektromagnetycznego pochłanianego
Atomowa spektrometria absorpcyjna i emisyjna
 Nowoczesne techniki analityczne w analizie żywności Zajęcia laboratoryjne Atomowa spektrometria absorpcyjna i emisyjna Cel ćwiczenia: Celem ćwiczenia jest oznaczenie zawartości sodu, potasu i magnezu w
Nowoczesne techniki analityczne w analizie żywności Zajęcia laboratoryjne Atomowa spektrometria absorpcyjna i emisyjna Cel ćwiczenia: Celem ćwiczenia jest oznaczenie zawartości sodu, potasu i magnezu w
METODYKA POMIARÓW WIDM FLUORESCENCJI (WF) NA MPF-3 (PERKIN-HITACHI)
 METODYKA POMIARÓW WIDM FLUORESCENCJI (WF) NA MPF-3 (PERKIN-HITACHI) (Uzupełnieniem do niniejszej metodyki jest instrukcja obsługi spektrofluorymetru MPF-3, która znajduje się do wglądu u prof. dr hab.
METODYKA POMIARÓW WIDM FLUORESCENCJI (WF) NA MPF-3 (PERKIN-HITACHI) (Uzupełnieniem do niniejszej metodyki jest instrukcja obsługi spektrofluorymetru MPF-3, która znajduje się do wglądu u prof. dr hab.
Pracownia Spektroskopii Molekularnej A Wydział Chemii Uniwersytetu Warszawskiego. Semestr zimowy 2010/2011. Widma fluorescencyjne chininy
 Pracownia Spektroskopii Molekularnej A Wydział Chemii Uniwersytetu Warszawskiego. Semestr zimowy 2010/2011 Widma fluorescencyjne chininy Cel Celem ćwiczenia jest zapoznanie się ze zjawiskiem fluorescencji
Pracownia Spektroskopii Molekularnej A Wydział Chemii Uniwersytetu Warszawskiego. Semestr zimowy 2010/2011 Widma fluorescencyjne chininy Cel Celem ćwiczenia jest zapoznanie się ze zjawiskiem fluorescencji
Kolorymetryczne oznaczanie stężenia Fe 3+ metodą rodankową
 Kolorymetryczne oznaczanie stężenia Fe 3+ metodą rodankową (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zapoznanie się z podstawami spektrofotometrii absorpcyjnej w świetle widzialnym (kolorymetrią)
Kolorymetryczne oznaczanie stężenia Fe 3+ metodą rodankową (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zapoznanie się z podstawami spektrofotometrii absorpcyjnej w świetle widzialnym (kolorymetrią)
POLICJA KUJAWSKO-POMORSKA WYBRANE ZJAWISKA OPTYKI W BADANIACH KRYMINALISTYCZNYCH
 POLICJA KUJAWSKO-POMORSKA Źródło: http://www.kujawsko-pomorska.policja.gov.pl/kb/dzialania-policji/kryminalistyka/aktualnosci/arciwmlb/2545,wybrane-zjawi SKA-OPTYKI-W-BADANIACH-KRYMINALISTYCZNYCH.html
POLICJA KUJAWSKO-POMORSKA Źródło: http://www.kujawsko-pomorska.policja.gov.pl/kb/dzialania-policji/kryminalistyka/aktualnosci/arciwmlb/2545,wybrane-zjawi SKA-OPTYKI-W-BADANIACH-KRYMINALISTYCZNYCH.html
Metody optyczne w medycynie
 Metody optyczne w medycynie Podstawy oddziaływania światła z materią E i E t E t = E i e κ ( L) i( n 1)( L) c e c zmiana amplitudy (absorpcja) zmiana fazy (dyspersja) Tylko światło pochłonięte może wywołać
Metody optyczne w medycynie Podstawy oddziaływania światła z materią E i E t E t = E i e κ ( L) i( n 1)( L) c e c zmiana amplitudy (absorpcja) zmiana fazy (dyspersja) Tylko światło pochłonięte może wywołać
Ćwiczenie 31. Zagadnienia: spektroskopia absorpcyjna, prawa absorpcji, budowa i działanie. Wstęp
 Ćwiczenie 31 Metodyka poprawnych i dokładnych pomiarów widm absorbancji w zakresie UV-VIS. Wpływ monochromatyczności promieniowania i innych parametrów pomiarowych na kształt widm absorpcji i wartości
Ćwiczenie 31 Metodyka poprawnych i dokładnych pomiarów widm absorbancji w zakresie UV-VIS. Wpływ monochromatyczności promieniowania i innych parametrów pomiarowych na kształt widm absorpcji i wartości
ĆWICZENIE NR 3 POMIARY SPEKTROFOTOMETRYCZNE
 ĆWICZENIE NR 3 POMIARY SPEKTROFOTOMETRYCZNE Cel ćwiczenia Poznanie podstawowej metody określania biochemicznych parametrów płynów ustrojowych oraz wymagań technicznych stawianych urządzeniu pomiarowemu.
ĆWICZENIE NR 3 POMIARY SPEKTROFOTOMETRYCZNE Cel ćwiczenia Poznanie podstawowej metody określania biochemicznych parametrów płynów ustrojowych oraz wymagań technicznych stawianych urządzeniu pomiarowemu.
Oznaczanie żelaza i miedzi metodą miareczkowania spektrofotometrycznego
 Oznaczanie żelaza i miedzi metodą miareczkowania spektrofotometrycznego Oznaczanie dwóch kationów obok siebie metodą miareczkowania spektrofotometrycznego (bez maskowania) jest możliwe, gdy spełnione są
Oznaczanie żelaza i miedzi metodą miareczkowania spektrofotometrycznego Oznaczanie dwóch kationów obok siebie metodą miareczkowania spektrofotometrycznego (bez maskowania) jest możliwe, gdy spełnione są
spektropolarymetrami;
 Ćwiczenie 12 Badanie własności uzyskanych białek: pomiary dichroizmu kołowego Niejednakowa absorpcja prawego i lewego, kołowo spolaryzowanego promieniowania nazywa się dichroizmem kołowym (ang. circular
Ćwiczenie 12 Badanie własności uzyskanych białek: pomiary dichroizmu kołowego Niejednakowa absorpcja prawego i lewego, kołowo spolaryzowanego promieniowania nazywa się dichroizmem kołowym (ang. circular
Instrukcja do ćwiczeń
 Instrukcja do ćwiczeń Badania identyfikacyjno - porównawcze materiałów kryjących na dokumencie I. Cel ćwiczenia Zapoznanie studentów z możliwością zastosowania spektrometrii IR, spektrofotometrii UV-Vis
Instrukcja do ćwiczeń Badania identyfikacyjno - porównawcze materiałów kryjących na dokumencie I. Cel ćwiczenia Zapoznanie studentów z możliwością zastosowania spektrometrii IR, spektrofotometrii UV-Vis
Ćwiczenie 3 ANALIZA JAKOŚCIOWA PALIW ZA POMOCĄ SPEKTROFOTOMETRII FTIR (Fourier Transform Infrared Spectroscopy)
 POLITECHNIKA ŁÓDZKA WYDZIAŁ INśYNIERII PROCESOWEJ I OCHRONY ŚRODOWISKA KATEDRA TERMODYNAMIKI PROCESOWEJ K-106 LABORATORIUM KONWENCJONALNYCH ŹRÓDEŁ ENERGII I PROCESÓW SPALANIA Ćwiczenie 3 ANALIZA JAKOŚCIOWA
POLITECHNIKA ŁÓDZKA WYDZIAŁ INśYNIERII PROCESOWEJ I OCHRONY ŚRODOWISKA KATEDRA TERMODYNAMIKI PROCESOWEJ K-106 LABORATORIUM KONWENCJONALNYCH ŹRÓDEŁ ENERGII I PROCESÓW SPALANIA Ćwiczenie 3 ANALIZA JAKOŚCIOWA
SPEKTROFOTOMETRYCZNA ANALIZA
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 8 SPEKTROFOTOMETRYCZNA ANALIZA LUDZKIEJ HEMOGLOBINY I. WSTĘP TEORETYCZNY Hemoglobina (Hb) jest białkiem złożonym z grupy prostetycznej
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 8 SPEKTROFOTOMETRYCZNA ANALIZA LUDZKIEJ HEMOGLOBINY I. WSTĘP TEORETYCZNY Hemoglobina (Hb) jest białkiem złożonym z grupy prostetycznej
SF5. Spektroskopia absorpcyjna i emisyjna cząsteczek organicznych
 SF5 Spektroskopia absorpcyjna i emisyjna cząsteczek organicznych Każda cząsteczka ma charakterystyczny dla siebie układ poziomów energetycznych elektronowych, oscylacyjnych i rotacyjnych, przy czym tych
SF5 Spektroskopia absorpcyjna i emisyjna cząsteczek organicznych Każda cząsteczka ma charakterystyczny dla siebie układ poziomów energetycznych elektronowych, oscylacyjnych i rotacyjnych, przy czym tych
SPEKTROSKOPIA RENTGENOWSKA. Demonstracja instrukcja wykonawcza. goniometr
 ĆWICZENIE 105 SPEKTROSKOPIA RENTGENOWSKA Demonstracja instrukcja wykonawcza 1 Wykaz przyrządów a. Urządzenie RTG z anodą wolframową. b. Goniometr z kryształem analizującym LiF. c. Detektor promieniowania
ĆWICZENIE 105 SPEKTROSKOPIA RENTGENOWSKA Demonstracja instrukcja wykonawcza 1 Wykaz przyrządów a. Urządzenie RTG z anodą wolframową. b. Goniometr z kryształem analizującym LiF. c. Detektor promieniowania
Wpływ ilości modyfikatora na współczynnik retencji w technice wysokosprawnej chromatografii cieczowej
 Wpływ ilości modyfikatora na współczynnik retencji w technice wysokosprawnej chromatografii cieczowej WPROWADZENIE Wysokosprawna chromatografia cieczowa (HPLC) jest uniwersalną techniką analityczną, stosowaną
Wpływ ilości modyfikatora na współczynnik retencji w technice wysokosprawnej chromatografii cieczowej WPROWADZENIE Wysokosprawna chromatografia cieczowa (HPLC) jest uniwersalną techniką analityczną, stosowaną
Lekcja 81. Temat: Widma fal.
 Temat: Widma fal. Lekcja 81 WIDMO FAL ELEKTROMAGNETCZNYCH Fale elektromagnetyczne można podzielić ze względu na częstotliwość lub długość, taki podział nazywa się widmem fal elektromagnetycznych. Obejmuje
Temat: Widma fal. Lekcja 81 WIDMO FAL ELEKTROMAGNETCZNYCH Fale elektromagnetyczne można podzielić ze względu na częstotliwość lub długość, taki podział nazywa się widmem fal elektromagnetycznych. Obejmuje
Ćwiczenie nr 1 Oznaczanie składu substancji metodą niskorozdzielczej analizy fluorescencyjnej
 Ćwiczenie nr 1 Oznaczanie składu substancji metodą niskorozdzielczej analizy fluorescencyjnej Wydział Fizyki, 2009 r. I Cel ćwiczenia Celem ćwiczenia jest: Zapoznanie się ze zjawiskiem fluorescencji rentgenowskiej
Ćwiczenie nr 1 Oznaczanie składu substancji metodą niskorozdzielczej analizy fluorescencyjnej Wydział Fizyki, 2009 r. I Cel ćwiczenia Celem ćwiczenia jest: Zapoznanie się ze zjawiskiem fluorescencji rentgenowskiej
Dobór warunków dla poprawnego pomiaru widm emisji i wydajności kwantowych emisji
 Dobór warunków dla poprawnego pomiaru widm emisji i wydajności kwantowych emisji Badania emisyjne są niezwykle cennym źródłem danych o właściwościach cząsteczek i kompleksów (różnego rodzaju), które one
Dobór warunków dla poprawnego pomiaru widm emisji i wydajności kwantowych emisji Badania emisyjne są niezwykle cennym źródłem danych o właściwościach cząsteczek i kompleksów (różnego rodzaju), które one
Jak korzystać z Excela?
 1 Jak korzystać z Excela? 1. Dane liczbowe, wprowadzone (zaimportowane) do arkusza kalkulacyjnego w Excelu mogą przyjmować różne kategorie, np. ogólne, liczbowe, walutowe, księgowe, naukowe, itd. Jeśli
1 Jak korzystać z Excela? 1. Dane liczbowe, wprowadzone (zaimportowane) do arkusza kalkulacyjnego w Excelu mogą przyjmować różne kategorie, np. ogólne, liczbowe, walutowe, księgowe, naukowe, itd. Jeśli
JAK WYZNACZA SIĘ PARAMETRY WALIDACYJNE
 JAK WYZNACZA SIĘ PARAMETRY WALIDACYJNE 1 Granica wykrywalności i granica oznaczalności Dr inż. Piotr KONIECZKA Katedra Chemii Analitycznej Wydział Chemiczny Politechnika Gdańska ul. G. Narutowicza 11/12
JAK WYZNACZA SIĘ PARAMETRY WALIDACYJNE 1 Granica wykrywalności i granica oznaczalności Dr inż. Piotr KONIECZKA Katedra Chemii Analitycznej Wydział Chemiczny Politechnika Gdańska ul. G. Narutowicza 11/12
Monochromatyzacja promieniowania molibdenowej lampy rentgenowskiej
 Uniwersytet Śląski Instytut Chemii Zakładu Krystalografii ul. Bankowa 14, pok. 133, 40 006 Katowice tel. (032)359 1503, e-mail: izajen@wp.pl, opracowanie: dr Izabela Jendrzejewska Laboratorium z Krystalografii
Uniwersytet Śląski Instytut Chemii Zakładu Krystalografii ul. Bankowa 14, pok. 133, 40 006 Katowice tel. (032)359 1503, e-mail: izajen@wp.pl, opracowanie: dr Izabela Jendrzejewska Laboratorium z Krystalografii
Ćwiczenie 30. Zagadnienia: spektroskopia absorpcyjna w zakresie UV-VIS, prawa absorpcji, budowa i. Wstęp
 Ćwiczenie 30 Metodyka poprawnych i dokładnych pomiarów absorbancji w zakresie UV- VS, wyznaczenie małych wartości absorbancji. Czynniki wpływające na mierzone widma absorpcji i wartości absorbancji dla
Ćwiczenie 30 Metodyka poprawnych i dokładnych pomiarów absorbancji w zakresie UV- VS, wyznaczenie małych wartości absorbancji. Czynniki wpływające na mierzone widma absorpcji i wartości absorbancji dla
I. PROMIENIOWANIE CIEPLNE
 I. PROMIENIOWANIE CIEPLNE - lata '90 XIX wieku WSTĘP Widmo promieniowania elektromagnetycznego zakres "pokrycia" różnymi rodzajami fal elektromagnetycznych promieniowania zawartego w danej wiązce. rys.i.1.
I. PROMIENIOWANIE CIEPLNE - lata '90 XIX wieku WSTĘP Widmo promieniowania elektromagnetycznego zakres "pokrycia" różnymi rodzajami fal elektromagnetycznych promieniowania zawartego w danej wiązce. rys.i.1.
SPEKTROMETRIA CIEKŁOSCYNTYLACYJNA
 SPEKTROMETRIA CIEKŁOSCYNTYLACYJNA Metoda detekcji promieniowania jądrowego (α, β, γ) Konwersja energii promieniowania jądrowego na promieniowanie w zakresie widzialnym. Zalety metody: Geometria 4π Duża
SPEKTROMETRIA CIEKŁOSCYNTYLACYJNA Metoda detekcji promieniowania jądrowego (α, β, γ) Konwersja energii promieniowania jądrowego na promieniowanie w zakresie widzialnym. Zalety metody: Geometria 4π Duża
Ćw. 5 Absorpcjometria I
 Ćw. 5 Absorpcjometria I Absorpcja promieniowania elektromagnetycznego z obszaru widzialnego i nadfioletowego przez atomy i cząsteczki powoduje zmianę ich stanu elektronowego. Zjawiska te moŝna badać za
Ćw. 5 Absorpcjometria I Absorpcja promieniowania elektromagnetycznego z obszaru widzialnego i nadfioletowego przez atomy i cząsteczki powoduje zmianę ich stanu elektronowego. Zjawiska te moŝna badać za
autor: Włodzimierz Wolczyński rozwiązywał (a)... ARKUSIK 39 ATOM WODORU. PROMIENIOWANIE. WIDMA TEST JEDNOKROTNEGO WYBORU
 autor: Włodzimierz Wolczyński rozwiązywał (a)... ARKUSIK 39 ATOM WODORU. PROMIENIOWANIE. WIDMA Zadanie 1 1 punkt TEST JEDNOKROTNEGO WYBORU Moment pędu elektronu znajdującego się na drugiej orbicie w atomie
autor: Włodzimierz Wolczyński rozwiązywał (a)... ARKUSIK 39 ATOM WODORU. PROMIENIOWANIE. WIDMA Zadanie 1 1 punkt TEST JEDNOKROTNEGO WYBORU Moment pędu elektronu znajdującego się na drugiej orbicie w atomie
Skręcenie wektora polaryzacji w ośrodku optycznie czynnym
 WFiIS PRACOWNIA FIZYCZNA I i II Imię i nazwisko: 1.. TEMAT: ROK GRUPA ZESPÓŁ NR ĆWICZENIA ata wykonania: ata oddania: Zwrot do poprawy: ata oddania: ata zliczenia: OCENA Cel ćwiczenia: Celem ćwiczenia
WFiIS PRACOWNIA FIZYCZNA I i II Imię i nazwisko: 1.. TEMAT: ROK GRUPA ZESPÓŁ NR ĆWICZENIA ata wykonania: ata oddania: Zwrot do poprawy: ata oddania: ata zliczenia: OCENA Cel ćwiczenia: Celem ćwiczenia
Ćwiczenie nr 2 : Badanie licznika proporcjonalnego fotonów X
 Ćwiczenie nr 2 : Badanie licznika proporcjonalnego fotonów X Oskar Gawlik, Jacek Grela 16 lutego 2009 1 Podstawy teoretyczne 1.1 Liczniki proporcjonalne Wydajność detekcji promieniowania elektromagnetycznego
Ćwiczenie nr 2 : Badanie licznika proporcjonalnego fotonów X Oskar Gawlik, Jacek Grela 16 lutego 2009 1 Podstawy teoretyczne 1.1 Liczniki proporcjonalne Wydajność detekcji promieniowania elektromagnetycznego
ZASTOSOWANIE MIKROSYSTEMÓW W MEDYCYNIE LABORATORIUM. Ćwiczenie nr 4 MIKROCYTOMETR DO BADANIA KOMÓREK BIOLOGICZNYCH
 ZASTOSOWANIE MIKROSYSTEMÓW W MEDYCYNIE LABORATORIUM Ćwiczenie nr 4 MIKROCYTOMETR DO BADANIA KOMÓREK BIOLOGICZNYCH Cel ćwiczenia: Celem ćwiczenia jest zapoznanie się z budową i warunkami działania mikrocytometru
ZASTOSOWANIE MIKROSYSTEMÓW W MEDYCYNIE LABORATORIUM Ćwiczenie nr 4 MIKROCYTOMETR DO BADANIA KOMÓREK BIOLOGICZNYCH Cel ćwiczenia: Celem ćwiczenia jest zapoznanie się z budową i warunkami działania mikrocytometru
Fizykochemiczne metody w kryminalistyce. Wykład 7
 Fizykochemiczne metody w kryminalistyce Wykład 7 Stosowane metody badawcze: 1. Klasyczna metoda analityczna jakościowa i ilościowa 2. badania rentgenostrukturalne 3. Badania spektroskopowe 4. Metody chromatograficzne
Fizykochemiczne metody w kryminalistyce Wykład 7 Stosowane metody badawcze: 1. Klasyczna metoda analityczna jakościowa i ilościowa 2. badania rentgenostrukturalne 3. Badania spektroskopowe 4. Metody chromatograficzne
ANALITYKA W KONTROLI JAKOŚCI
 ANALITYKA W KONTROLI JAKOŚCI ANALIZA ŚLADÓW METODA ICP-OES Optyczna spektroskopia emisyjna ze wzbudzeniem w indukcyjnie sprzężonej plazmie WYKŁAD 4 Rodzaje widm i mechanizm ich powstania PODSTAWY SPEKTROSKOPII
ANALITYKA W KONTROLI JAKOŚCI ANALIZA ŚLADÓW METODA ICP-OES Optyczna spektroskopia emisyjna ze wzbudzeniem w indukcyjnie sprzężonej plazmie WYKŁAD 4 Rodzaje widm i mechanizm ich powstania PODSTAWY SPEKTROSKOPII
Ćw. 11 wersja testowa Wyznaczanie odległości krytycznej R 0 rezonansowego przeniesienia energii (FRET)
 Ćw. 11 wersja testowa Wyznaczanie odległości krytycznej R 0 rezonansowego przeniesienia energii (FRET) Wstęp W wyniku absorpcji promieniowania elektromagnetycznego o odpowiedniej długości fali (najczęściej
Ćw. 11 wersja testowa Wyznaczanie odległości krytycznej R 0 rezonansowego przeniesienia energii (FRET) Wstęp W wyniku absorpcji promieniowania elektromagnetycznego o odpowiedniej długości fali (najczęściej
BADANIE WYMUSZONEJ AKTYWNOŚCI OPTYCZNEJ. Instrukcja wykonawcza
 ĆWICZENIE 89 BADANIE WYMUSZONEJ AKTYWNOŚCI OPTYCZNEJ Instrukcja wykonawcza 1. Wykaz przyrządów Polarymetr Lampa sodowa Solenoid Źródło napięcia stałego o wydajności prądowej min. 5A Amperomierz prądu stałego
ĆWICZENIE 89 BADANIE WYMUSZONEJ AKTYWNOŚCI OPTYCZNEJ Instrukcja wykonawcza 1. Wykaz przyrządów Polarymetr Lampa sodowa Solenoid Źródło napięcia stałego o wydajności prądowej min. 5A Amperomierz prądu stałego
Opis programu Konwersja MPF Spis treści
 Opis programu Konwersja MPF Spis treści Ogólne informacje o programie...2 Co to jest KonwersjaMPF...2 Okno programu...2 Podstawowe operacje...3 Wczytywanie danych...3 Przegląd wyników...3 Dodawanie widm
Opis programu Konwersja MPF Spis treści Ogólne informacje o programie...2 Co to jest KonwersjaMPF...2 Okno programu...2 Podstawowe operacje...3 Wczytywanie danych...3 Przegląd wyników...3 Dodawanie widm
Kwantowe własności promieniowania, ciało doskonale czarne, zjawisko fotoelektryczne zewnętrzne.
 Kwantowe własności promieniowania, ciało doskonale czarne, zjawisko fotoelektryczne zewnętrzne. DUALIZM ŚWIATŁA fala interferencja, dyfrakcja, polaryzacja,... kwant, foton promieniowanie ciała doskonale
Kwantowe własności promieniowania, ciało doskonale czarne, zjawisko fotoelektryczne zewnętrzne. DUALIZM ŚWIATŁA fala interferencja, dyfrakcja, polaryzacja,... kwant, foton promieniowanie ciała doskonale
Instrukcja do ćwiczeń laboratoryjnych
 UNIWERSYTET GDAŃSKI WYDZIAŁ CHEMII Pracownia studencka Katedra Analizy Środowiska Instrukcja do ćwiczeń laboratoryjnych Ćwiczenie nr 2 ZASTOSOWANIE SPEKTROFOTOMETRII W NADFIOLECIE I ŚWIETLE WIDZIALNYM
UNIWERSYTET GDAŃSKI WYDZIAŁ CHEMII Pracownia studencka Katedra Analizy Środowiska Instrukcja do ćwiczeń laboratoryjnych Ćwiczenie nr 2 ZASTOSOWANIE SPEKTROFOTOMETRII W NADFIOLECIE I ŚWIETLE WIDZIALNYM
PROMIENIOWANIE RENTGENOWSKIE
 PROMIENIOWANIE RENTGENOWSKIE 1. Zagadnienia teoretyczne Promieniowanie rentgenowskie, poziomy energetyczne w atomie, stała Planck a i metody wyznaczania jej wartości, struktura krystalograficzna, dyfrakcyjne
PROMIENIOWANIE RENTGENOWSKIE 1. Zagadnienia teoretyczne Promieniowanie rentgenowskie, poziomy energetyczne w atomie, stała Planck a i metody wyznaczania jej wartości, struktura krystalograficzna, dyfrakcyjne
Zakres wymagań przedmiotu Analiza instrumentalna
 Część A. Zakres wymagań przedmiotu Analiza instrumentalna Obowiązuje znajomość instrumentalnych metod analizy ilościowej i jakościowej (spektrofotometrii absorpcyjnej i emisyjnej, spektroskopii magnetycznego
Część A. Zakres wymagań przedmiotu Analiza instrumentalna Obowiązuje znajomość instrumentalnych metod analizy ilościowej i jakościowej (spektrofotometrii absorpcyjnej i emisyjnej, spektroskopii magnetycznego
JAK PROSTO I SKUTECZNIE WYKORZYSTAĆ ARKUSZ KALKULACYJNY DO OBLICZENIA PARAMETRÓW PROSTEJ METODĄ NAJMNIEJSZYCH KWADRATÓW
 JAK PROSTO I SKUTECZNIE WYKORZYSTAĆ ARKUSZ KALKULACYJNY DO OBLICZENIA PARAMETRÓW PROSTEJ METODĄ NAJMNIEJSZYCH KWADRATÓW Z tego dokumentu dowiesz się jak wykorzystać wbudowane funkcje arkusza kalkulacyjnego
JAK PROSTO I SKUTECZNIE WYKORZYSTAĆ ARKUSZ KALKULACYJNY DO OBLICZENIA PARAMETRÓW PROSTEJ METODĄ NAJMNIEJSZYCH KWADRATÓW Z tego dokumentu dowiesz się jak wykorzystać wbudowane funkcje arkusza kalkulacyjnego
3. Zależność energii kwantów γ od kąta rozproszenia w zjawisku Comptona
 3. Zależność energii kwantów γ od kąta rozproszenia w zjawisku Comptona I. Przedmiotem zadania zjawisko Comptona. II. Celem zadania jest doświadczalne sprawdzenie zależności energii kwantów γ od kąta rozproszenia
3. Zależność energii kwantów γ od kąta rozproszenia w zjawisku Comptona I. Przedmiotem zadania zjawisko Comptona. II. Celem zadania jest doświadczalne sprawdzenie zależności energii kwantów γ od kąta rozproszenia
Efekt fotoelektryczny
 Ćwiczenie 82 Efekt fotoelektryczny Cel ćwiczenia Celem ćwiczenia jest obserwacja efektu fotoelektrycznego: wybijania elektronów z metalu przez światło o różnej częstości (barwie). Pomiar energii kinetycznej
Ćwiczenie 82 Efekt fotoelektryczny Cel ćwiczenia Celem ćwiczenia jest obserwacja efektu fotoelektrycznego: wybijania elektronów z metalu przez światło o różnej częstości (barwie). Pomiar energii kinetycznej
Spektrofotometria ( SPF I, SPF II ) Spektralna analiza emisyjna ( S ) Fotometria Płomieniowa ( FP )
 Spektrofotometria ( SPF I, SPF II ) 1. Rodzaje energii opisujące całkowity stan energetyczny cząsteczki. 2. Długości fal promieniowania elektromagnetycznego odpowiadające zakresom: UV, VIS i IR. 3. Energia
Spektrofotometria ( SPF I, SPF II ) 1. Rodzaje energii opisujące całkowity stan energetyczny cząsteczki. 2. Długości fal promieniowania elektromagnetycznego odpowiadające zakresom: UV, VIS i IR. 3. Energia
WPŁYW ILOŚCI MODYFIKATORA NA WSPÓŁCZYNNIK RETENCJI W TECHNICE WYSOKOSPRAWNEJ CHROMATOGRAFII CIECZOWEJ
 WPŁYW ILOŚCI MODYFIKATORA NA WSPÓŁCZYNNIK RETENCJI W TECHNICE WYSOKOSPRAWNEJ CHROMATOGRAFII CIECZOWEJ Wprowadzenie Wysokosprawna chromatografia cieczowa (HPLC) jest uniwersalną technika analityczną, stosowaną
WPŁYW ILOŚCI MODYFIKATORA NA WSPÓŁCZYNNIK RETENCJI W TECHNICE WYSOKOSPRAWNEJ CHROMATOGRAFII CIECZOWEJ Wprowadzenie Wysokosprawna chromatografia cieczowa (HPLC) jest uniwersalną technika analityczną, stosowaną
Ćwiczenie 11. Interakcja światła z materią. Spektrofluorymetryczne oznaczanie zawartości chininy
 Ćwiczenie 11. Interakcja światła z materią. Spektrofluorymetryczne oznaczanie zawartości chininy Zjawisko emitowania przez niektóre związki chemiczne promieniowania w zakresie widzialnym, wzbudzonego pod
Ćwiczenie 11. Interakcja światła z materią. Spektrofluorymetryczne oznaczanie zawartości chininy Zjawisko emitowania przez niektóre związki chemiczne promieniowania w zakresie widzialnym, wzbudzonego pod
Doświadczenie nr 6 Pomiar energii promieniowania gamma metodą absorpcji elektronów komptonowskich.
 Doświadczenie nr 6 Pomiar energii promieniowania gamma metodą absorpcji elektronów komptonowskich.. 1. 3. 4. 1. Pojemnik z licznikami cylindrycznymi pracującymi w koincydencji oraz z uchwytem na warstwy
Doświadczenie nr 6 Pomiar energii promieniowania gamma metodą absorpcji elektronów komptonowskich.. 1. 3. 4. 1. Pojemnik z licznikami cylindrycznymi pracującymi w koincydencji oraz z uchwytem na warstwy
SPEKTROSKOPIA SPEKTROMETRIA
 SPEKTROSKOPIA Spektroskopia to dziedzina nauki, która obejmuje metody badania materii przy użyciu promieniowania elektromagnetycznego, które może być w danym układzie wytworzone (emisja) lub może z tym
SPEKTROSKOPIA Spektroskopia to dziedzina nauki, która obejmuje metody badania materii przy użyciu promieniowania elektromagnetycznego, które może być w danym układzie wytworzone (emisja) lub może z tym
OZNACZANIE STĘŻENIA BARWNIKÓW W WODZIE METODĄ UV-VIS
 OZNACZANE STĘŻENA BARWNKÓW W WODZE METODĄ UV-VS. SPEKTROFOTOMETRA UV-Vis Spektrofotometria w zakresie nadfioletu (ang. ultra-violet UV) i promieniowania widzialnego (ang. visible- Vis), czyli spektrofotometria
OZNACZANE STĘŻENA BARWNKÓW W WODZE METODĄ UV-VS. SPEKTROFOTOMETRA UV-Vis Spektrofotometria w zakresie nadfioletu (ang. ultra-violet UV) i promieniowania widzialnego (ang. visible- Vis), czyli spektrofotometria
IR I 11. IDENTYFIKACJA GRUP FUNKCYJNYCH W WIDMACH IR
 IR I 11. IDENTYFIKACJA GRUP FUNKCYJNYCH W WIDMACH IR Celem ćwiczenia jest zapoznanie się z techniką wykonywania widm związków w postaci pastylek wykonanych z bromku potasu oraz interpretacja otrzymanych
IR I 11. IDENTYFIKACJA GRUP FUNKCYJNYCH W WIDMACH IR Celem ćwiczenia jest zapoznanie się z techniką wykonywania widm związków w postaci pastylek wykonanych z bromku potasu oraz interpretacja otrzymanych
Wyznaczanie wydajności kwantowej luminescencji oraz czasu zaniku luminescencji związku koordynacyjnego
 Instrukcja do ćwiczeń Wyznaczanie wydajności kwantowej luminescencji oraz czasu zaniku luminescencji związku koordynacyjnego I. Cel ćwiczenia Celem ćwiczenia jest zapoznanie studentów z metodyką pomiarów
Instrukcja do ćwiczeń Wyznaczanie wydajności kwantowej luminescencji oraz czasu zaniku luminescencji związku koordynacyjnego I. Cel ćwiczenia Celem ćwiczenia jest zapoznanie studentów z metodyką pomiarów
4.Arkusz kalkulacyjny Calc
 4.Arkusz kalkulacyjny Calc 4.1. Okno programu Calc Arkusz kalkulacyjny Calc jest zawarty w bezpłatnym pakiecie OpenOffice.org 2.4. Można go uruchomić, podobnie jak inne aplikacje tego środowiska, wybierając
4.Arkusz kalkulacyjny Calc 4.1. Okno programu Calc Arkusz kalkulacyjny Calc jest zawarty w bezpłatnym pakiecie OpenOffice.org 2.4. Można go uruchomić, podobnie jak inne aplikacje tego środowiska, wybierając
PRZEWODNOŚĆ ROZTWORÓW ELEKTROLITÓW
 PRZEWODNOŚĆ ROZTWORÓW ELEKTROLITÓW Cel ćwiczenia Celem ćwiczenia jest wyznaczenie przewodności elektrolitycznej κ i molowej elektrolitu mocnego (HCl) i słabego (CH3COOH), graficzne wyznaczenie wartości
PRZEWODNOŚĆ ROZTWORÓW ELEKTROLITÓW Cel ćwiczenia Celem ćwiczenia jest wyznaczenie przewodności elektrolitycznej κ i molowej elektrolitu mocnego (HCl) i słabego (CH3COOH), graficzne wyznaczenie wartości
( x) Równanie regresji liniowej ma postać. By obliczyć współczynniki a i b należy posłużyć się następującymi wzorami 1 : Gdzie:
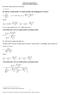 ma postać y = ax + b Równanie regresji liniowej By obliczyć współczynniki a i b należy posłużyć się następującymi wzorami 1 : xy b = a = b lub x Gdzie: xy = też a = x = ( b ) i to dane empiryczne, a ilość
ma postać y = ax + b Równanie regresji liniowej By obliczyć współczynniki a i b należy posłużyć się następującymi wzorami 1 : xy b = a = b lub x Gdzie: xy = też a = x = ( b ) i to dane empiryczne, a ilość
