ĆWICZENIE III. ELEKTROFOREZA W ŻELU POLIAKRYLAMIDOWYM (ANG. POLYACRYLAMIDE GEL ELECTROPHORESIS - PAGE)
|
|
|
- Anatol Stachowiak
- 8 lat temu
- Przeglądów:
Transkrypt
1 ĆWICZENIE III. ELEKTROFOREZA W ŻELU POLIAKRYLAMIDOWYM (ANG. POLYACRYLAMIDE GEL ELECTROPHORESIS - PAGE) ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM W WARUNKACH DENATURUJĄCYCH (SDS-PAGE) DETEKCJA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM ELEKTROFOREZA POLIAKRYLAMIDOWA BIAŁEK W WARUNKACH NATYWNYCH (ELEKTROFOREZA NATYWNA) Elektroforeza pozwala na rozdzielanie białek ze względu na ich gęstość ładunku, w tym przypadku ruchliwość elektroforetyczna składników próbki zależy zarówno od ładunku molekuł, jak i ich masy. Bufory użyte podczas elektroforezy natywnej pozwalają na utrzymanie białek w stanie niedenaturowanym. Enzymy po elektroforezie zachowują swoją aktywność. Elektroforeza natywna jest używana głównie do określenia czystości białek np. oznaczenia czystości preparatyki enzymów. W elektroforezie natywnej białek używa się nieciągłego systemu buforowego. Stosowane są dwa żele zagęszczający o niższym stężeniu akrylamidów i niższym ph, oraz rozdzielający o mniejszych porach (wyższe stężenie akrylamidów) i wyższe ph. Rozwiązanie to, stosowane także w żelach denaturujących, umożliwia uzyskanie zagęszczenia preparatu na styku żeli i migracji białek w żelu rozdzielającym w postaci ostrych prążków. ELEKTROFOREZA POLIAKRYLAMIDOWA BIAŁEK W WARUNKACH DENATURUJĄCYCH (SDS-PAGE) Elektroforeza w żelu poliakrylamidowym jest użyteczną i powszechnie stosowaną metodą rozdzielania i charakterystyki białek. Jest to stosunkowo prosta i szybka technika. Na jednym żelu można przeprowadzić jednocześnie analizę wielu próbek, a rozdzielone białka można skutecznie wykrywać w żelu np. metodami barwienia, immunoprecypitacji czy autoradiografii. Można więc stosować tę technikę na przykład przy analizie białek we frakcjach zbieranych w trakcie rozdzielania na kolumnie chromatograficznej. W SDS-PAGE stwarza się warunki, w których wszystkie składniki próbki mają ten sam ładunek; ich ruchliwość jest więc jedynie funkcją mas cząsteczkowych (SDS-PAGE). Użycie anionowego detergentu soli sodowej kwasu dodecylosiarkowego (SDS ang. Sodium Dodecyl 1
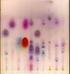
2 Sulfate) pozwala na rozdzielenie elektroforetytczne białek zgodnie z ich masą cząsteczkową. Przed i w trakcie elektroforezy białka ulegają dysocjacji i denaturacji w obecności SDS, który łączy się z białkami specyficznie w stosunku masowym 4,1:1. Zapewnia to przejęcie przez białko ujemnego ładunku elektrycznego netto o stałej gęstości bez względu na jego długość. Dla całkowitego rozwinięcia polipeptydu i zapewnienia mu pierwszorzędowej struktury, niezbędne jest dodatkowo zniszczenie mostków dwusiarczkowych (β-merkaptoetanol lub ditiotretiol). Opłaszczenie białka przez SDS oraz redukcja mostków dwusiarczkowych pozwalają na separację białek w żelu poliakrylamidowym ze względu na ich wielkość, a zatem pośrednio masę cząsteczkową. Szybkość migracji w SDS-PAGE nie jest determinowana przez ładunek elektryczny białka zależny od ph i konformacji białka. Dzięki możliwości rozdzielenia białek na podstawie ich wielkości możemy oznaczyć masę cząsteczkową nieznanego białka, porównując jego położenie w żelu w stosunku do innych białek (tzw. białek wzorcowych) po zakończonej migracji i wybarwieniu. BARWIENIE I DOKUMENTACJA Ukończenie rozdzielania elektroforetycznego nie kończy procedury. Większość białek i kwasów nukleinowych nie jest widoczna w świetle białym. Niezbędne jest ich wybarwienie (wizualizacja) w żelach lub na membranach, tak aby uzyskać informację o dystansie ich migracji i ich ilości w prążku. Stosowanych jest wiele metod wizualizacji żeli i membran. Białka najczęściej wybarwia się stosując naturalne barwniki, takie jak błękit kumassi (ang. Coomassie Brilant Blue) czy czerń amidową. Barwnik dodawany jest zwykle do roztworu utrwalającego położenie białka w żelu (denaturacja i unieruchomienie molekuł), po czym nadmiar barwnika jest wymywany. Pozostaje tylko barwnik związany z białkami. Czułość takiej detekcji białek jest stosunkowo dobra. Można w ten sposób znaleźć 1 μg białka w prążku. Znacznie bardziej czułą metodą jest barwienie srebrem. Metoda ta pozwala oznaczyć 10 ng białka w prążku. Przy pomocy srebra można również wybarwić kwasy nukleinowe oraz oligonukleotydy, a czułość detekcji zbliżona jest również do 10 ng DNA na prążek. Rys. 4. Przykładowe rozdzielenie białek w żelu poliakrylamidowym przedstawiono na rysunku. Żel barwiono Coomassie Brilliant Blue R
3 Najprostszą formą dokumentacji rozdzielonych w procesie elektroforezy w żelach poliakrylamidowych składników jest ich wysuszenie pomiędzy warstwą bibuły i celofanu lub pomiędzy dwoma warstwami celofanu. Wysuszony w ten sposób żel można przechowywać dowolnie długo bez widocznego uszczerbku w jakości tego dokumentu. Żele poliakrylamidowe przygotowane na folii można suszyć bez okrywania celofanem. Trudności pojawiają się wtedy, gdy trzeba wysuszyć żel o zawartości akrylamidu powyżej 15%. Odwodnienie żelu powoduje silne jego obkurczenie i w rezultacie pękanie. Można temu przeciwdziałać wypierając z żelu wodę przez dodanie glicerolu. Żele takie pozostają jednak nieco lepkie i muszą być okryte folią. Żele agarozowe nie poddają się jednak tej formie dokumentowania. Najprostszym sposobem utrwalenia informacji zawartej w żelu agarozowym jest sporządzenie jego fotografii lub skanu. Technikę tę można zastosować również do żeli poliakrylamidowych. Od kilku lat do dokumentacji rozdziałów elektroforetycznych stosuje się z powodzeniem kamery cyfrowe, a uzyskany obraz przechowywany jest w formie elektronicznej w pamięci komputera lub na innych nośnikach pamięci. Kamery cyfrowe pozwalają na uzyskanie i przetworzenie obrazu żeli i membran wizualizowanych barwieniem, z zastosowaniem znaczników fluorescencyjnych. CZĘŚĆ EKSPERYMENTALNA Materiały Aparat do elektroforezy (moduł elektrody + ramka zewnętrzna + mini tank + pokrywa) Zasilacz prądu stałego Pipety automatyczne Probówki typu Eppendorff 0,5 ml Łopatka do usuwania żelu z płytki Naczynia do wybarwiania żeli Odczynniki chemiczne Marker białek firmy Life Technologies Próbki standardów białek Próbki mleka Bufor redukujący z SDS do barwienia i denaturacji próbek (62,5 mm Tris-HCl ph 6,8; 25% glicerol; 2% SDS; 0,05% błękit bromofenylowy; 2-merkaptoetanol 5%) 3
4 Bufor glicynowy do elektroforezy SDS-PAGE ( Tris-base; glicyna; SDS) Roztwór barwiący (100 ml) 50 ml metanolu 10 ml lodowatego kwasu octowego 0.25 g Coomassie blue R ml wody Roztwór odbarwiający (1000 ml) 300 ml metanolu 100 ml lodowatego kwasu octowego 600 ml wody Czułość: do 0.1 μg Zaletą metody jest prostota wykonania i niezawodność. Wadą jest niewielka relatywnie czułość. Wymagane środki ostrożności W trakcie wykonywania ćwiczenia student powinien nosić odzież ochronną. Roztworów nie należy wdychać i pipetować ustami. Identyfikacja zagrożeń (Klasyfikacja zgodnie z dyrektywami UE 67/548/EWG lub 1999/45/WE): 2-merkaptoetanol - T, N Produkt toksyczny, Produkt niebezpieczny dla środowiska R23/24/25, R38, R41, R43, R48/22, R50/53 Pierwsza pomoc: - w razie kontaktu ze skórą: spłukać dużą ilością wody. - w razie kontaktu z oczami: przepłukać dużą ilością wody, przy szeroko otwartej powiece. - jeżeli osoba poszkodowana oddycha, przenieść na świeże powietrze. Jeżeli osoba poszkodowana nie oddycha, zastosować sztuczne oddychanie. Zasięgnąć porady medycznej. - w przypadku wystąpienia podrażnień skontaktować się z lekarzem. - w razie spożycia: przepłukać usta wodą. Dokładne instrukcje postępowania są zawarte w dołączonych kartach charakterystyk substancji. 4
5 Wykonanie Rozdzielanie elektroforetyczne białek w żelu poliakrylamidowym: 1. W celu wykonania rozdzielenia elektroforetycznego należy umocować żel (znajdujący się pomiędzy szybkami) w ramce wewnętrznej z zaciskami, tak żeby okienko do wprowadzania próbek znajdowało się od wewnętrznej strony górnej części aparatu. Krawędź szybki z przekładkami powinna znajdować się na równi z krawędzią górnej części aparatu. Niestaranne przymocowanie szybek z żelem do aparatu może powodować przelewanie buforu elektroforetycznego z górnej części aparatu do dolnej oraz może być przyczyną nierównego rozdzielenia elektroforetycznego. 2. Po przeciwnej stronie aparatu należy w analogiczny sposób zamontować drugi żel lub samą szybkę, stanowiącą w drugim przypadku zaporę dla buforu znajdującego się w górnej komorze. Górną część aparatu z przymocowanymi żelami należy umieścić w dolnej komorze (mini tank). 3. Następnie należy nalać bufor elektroforetyczny do obydwu komór, w taki sposób, aby bufor ten dochodził do górnej i dolnej krawędzi żelu, wypełnił studzienki, umożliwiając w ten sposób przepływ prądu (obwód zamknięty). 4. Stosowne ilości próbki należy zmieszać z odpowiednią ilością buforu denaturującego do nanoszenia białek (najczęściej 4:1, czyli np. 40 μl próbki i 10 μl buforu do nanoszenia). Bufor ten powoduje denaturację białek, nadaje białkom wypadkowy ładunek ujemny, obciąża próbkę, dzięki czemu łatwo można ją nanieść do studzienek żelu oraz zawiera barwnik umożliwiający kontrolę postępu elektroforezy. 5. Podłączyć elektrody do zasilacza. 6. Włączyć zasilacz i ustawić napięcie o wartości 200 V w czasie 35 minut. 7. Po zakończonej elektroforezie białek, odłączyć aparat do elektroforezy od prądu i wyciągnąć ramkę wewnętrzną z żelami. 8. Wyciągnąć żele z ramki wewnętrznej. 9. Delikatnie odrzucić mniejszą szybkę. 10. Za pomocą łopatki zsunąć żel z płytki szklanej i umieścić żel w roztworze barwiącym. 11. Żel w roztworze barwiącym inkubować przy delikatnym kołysaniu przez min lub dłużej w celu zwiększenia czułości detekcji. 12. Zlać roztwór barwiący (można wykorzystać do kolejnych barwień), odmyć resztki roztworu barwiącego wodą destylowaną, zalać roztworem odbarwiającym. 5
6 13. Inkubować 2-16 h przy delikatnym kołysaniu. Wymiana roztworu odbarwiającego przyspiesza i poprawia jakość detekcji. 14. Umieścić żel w wodzie. Żele mogą być przechowywane przez czas praktycznie nieokreślony w wodzie bez utraty intensywności prążków, ale przy dłuższym przechowywaniu w wodzie pęcznieją. Aby zapobiec pęcznieniu można dolać 20 glicerolu. Przechowywanie w buforze odbarwiającym prowadzi do osłabienia intensywności prążków. 15. W celu trwałej archiwizacji żel przełożyć do przezroczystej folii i zeskanować. Przyspieszenie odbarwiania: - częsta zmiana buforu - inkubacja w temperaturze do 45 C - dodanie kawałka gąbki pochłaniającego kumarynę. Sprawozdanie W sprawozdaniu z wykonanych ćwiczeń należy umieścić krótki wstęp teoretyczny, zawierający informacje o podstawowej technice elektroforezy, jak również, informacje o innych modyfikacjach tej metody oraz o metodach barwienia białek w żelach poliakrylamidowych. Podać cel ćwiczenia i opisać poszczególne jego etapy. Przeprowadzić analizę żelu (umieścić zdjęcie żelu wraz z opisem). Zmierzyć drogę migracji poszczególnych białek wzorcowych. Wykonać wykres zależności drogi migracji od logarytmu masy cząsteczkowej białek wzorcowych. Odczytać wartość masy cząsteczkowej nieznanego białka. Przeprowadzić dyskusję wyników i podać wnioski. Literatura 1. "Techniki elektromigracyjne - teoria i praktyka" [Red.] Buszewski B., Dziubakiewicz E., Szumski M., Wydawnictwo Malamut, Warszawa 2012, ISBN Berg J.M, Tymoczko J.L, Stryer L. (2005) Biochemia. (według V wyd. amerykańskiego) Wydawnictwo Naukowe PWN, Warszawa. 3. Jóźwiak Z., Bartosz G. Biofizyka. Wybrane zagadnienia wraz z ćwiczeniami. PWN (2007) 4. (Przepisy i porady) 6
ELEKTROFOREZA ŻELOWA KOLAGENU
 ELEKTROFOREZA ŻELOWA KOLAGENU I. PRZYGOTOWANIE ŻELU POLIAKRYLAMIDOWEGO DO ELEKTROFOREZY BIAŁEK W WARUNKACH DENATURUJĄCYCH (SDS-PAGE) Żele poliakrylamidowe do elektroforezy wytwarza się poprzez wolnorodnikową
ELEKTROFOREZA ŻELOWA KOLAGENU I. PRZYGOTOWANIE ŻELU POLIAKRYLAMIDOWEGO DO ELEKTROFOREZY BIAŁEK W WARUNKACH DENATURUJĄCYCH (SDS-PAGE) Żele poliakrylamidowe do elektroforezy wytwarza się poprzez wolnorodnikową
ĆWICZENIE II. PRZYGOTOWANIE ŻELU POLIAKRYLAMIDOWEGO DO ELEKTROFOREZY BIAŁEK W WARUNKACH DENATURUJĄCYCH (SDS-PAGE)
 ĆWICZENIE II. ELEKTROFOREZA W ŻELU POLIAKRYLAMIDOWYM (ANG. POLYACRYLAMIDE GEL ELECTROPHORESIS - PAGE) PRZYGOTOWANIE ŻELU POLIAKRYLAMIDOWEGO DO ELEKTROFOREZY BIAŁEK W WARUNKACH DENATURUJĄCYCH (SDS-PAGE)
ĆWICZENIE II. ELEKTROFOREZA W ŻELU POLIAKRYLAMIDOWYM (ANG. POLYACRYLAMIDE GEL ELECTROPHORESIS - PAGE) PRZYGOTOWANIE ŻELU POLIAKRYLAMIDOWEGO DO ELEKTROFOREZY BIAŁEK W WARUNKACH DENATURUJĄCYCH (SDS-PAGE)
ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM W WARUNKACH DENATURUJĄCYCH
 ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM W WARUNKACH DENATURUJĄCYCH WPROWADZENIE Elektroforeza od ponad 60 lat pozostaje najczęściej stosowaną metodą izolacji makrocząstek w układach biologicznych
ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM W WARUNKACH DENATURUJĄCYCH WPROWADZENIE Elektroforeza od ponad 60 lat pozostaje najczęściej stosowaną metodą izolacji makrocząstek w układach biologicznych
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016 Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa farmacjamolekularna@wum.edu.pl
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Farmacja 2016 Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa farmacjamolekularna@wum.edu.pl
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Ćwiczenie 3 Izolacja i rozdział
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa Ćwiczenie 3 Izolacja i rozdział
Metody badania ekspresji genów
 Metody badania ekspresji genów dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Metody badania ekspresji genów zamieszczonym w skrypcie pod reakcją A. Lityńskiej i M. Lewandowskiego
Metody badania ekspresji genów dr Katarzyna Knapczyk-Stwora Warunki wstępne: Proszę zapoznać się z tematem Metody badania ekspresji genów zamieszczonym w skrypcie pod reakcją A. Lityńskiej i M. Lewandowskiego
ELEKTROFORETYCZNY ROZDZIAŁ
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 2 ELEKTROFORETYCZNY ROZDZIAŁ BIAŁEK I. WSTĘP TEORETYCZNY Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej,
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 2 ELEKTROFORETYCZNY ROZDZIAŁ BIAŁEK I. WSTĘP TEORETYCZNY Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej,
BADANIE WŁASCIWOSCI FIZYKOCHEMICZNYCH KWASÓW NUKLEINOWYCH
 BADANIE WŁASCIWOSCI FIZYKOCHEMICZNYCH KWASÓW NUKLEINOWYCH ROZPUSZCZALNOŚĆ KWASÓW NUKLEINOWYCH Kwasy nukleinowe mają charakter polianionowy, wynikający z bogactwa reszt fosforanowych w ich strukturze, dzięki
BADANIE WŁASCIWOSCI FIZYKOCHEMICZNYCH KWASÓW NUKLEINOWYCH ROZPUSZCZALNOŚĆ KWASÓW NUKLEINOWYCH Kwasy nukleinowe mają charakter polianionowy, wynikający z bogactwa reszt fosforanowych w ich strukturze, dzięki
ĆWICZENIE I. ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH. µ = ν / E ELEKTROFOREZA
 ĆWICZENIE I. ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH ELEKTROFOREZA Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej, zachodzącym pod wpływem przyłożonej zewnętrznie różnicy potencjałów
ĆWICZENIE I. ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH ELEKTROFOREZA Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej, zachodzącym pod wpływem przyłożonej zewnętrznie różnicy potencjałów
NA ŻELU POLIAKRYLAMIDOWYM
 Z48 ELEKTROFOREZA BIAŁEK NA ŻELU POLIAKRYLAMIDOWYM Terminem elektroforeza określa się zjawisko migracji cząstek lub cząsteczek w polu elektrycznym w zależności od posiadanego ładunku. Elektroforeza jako
Z48 ELEKTROFOREZA BIAŁEK NA ŻELU POLIAKRYLAMIDOWYM Terminem elektroforeza określa się zjawisko migracji cząstek lub cząsteczek w polu elektrycznym w zależności od posiadanego ładunku. Elektroforeza jako
ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH
 ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH Instrukcja wykonana w Katedrze Chemii Środowiska ELEKTROFOREZA Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej, zachodzącym pod wpływem
ELEKTROFOREZA ŻELOWA BARWNIKÓW SPOŻYWCZYCH Instrukcja wykonana w Katedrze Chemii Środowiska ELEKTROFOREZA Elektroforeza jest ruchem fazy rozproszonej względem fazy rozpraszanej, zachodzącym pod wpływem
Elektroforeza kwasów nukleinowych
 Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA ze stosunkowo wysoką czułością (po odpowiednim
Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA ze stosunkowo wysoką czułością (po odpowiednim
ELEKTROFOREZA. Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM
 Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM Zadania: 1. Wykonać elektroforezę poziomą wybranych barwników w żelu agarozowym przy trzech różnych wartościach ph roztworów buforowych.
Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM Zadania: 1. Wykonać elektroforezę poziomą wybranych barwników w żelu agarozowym przy trzech różnych wartościach ph roztworów buforowych.
Multipol Standard. Aparat do jednoczesnego wylewania do 6 żeli poliakrylamidowych. Instrukcja Obsługi. Numer katalogowy:
 Multipol Standard Aparat do jednoczesnego wylewania do 6 żeli poliakrylamidowych Instrukcja Obsługi Numer katalogowy: 101-150 Aby uzys k ać pomoc techniczną : T 22 668 71 47 Spis treści 1. Informacje ogólne
Multipol Standard Aparat do jednoczesnego wylewania do 6 żeli poliakrylamidowych Instrukcja Obsługi Numer katalogowy: 101-150 Aby uzys k ać pomoc techniczną : T 22 668 71 47 Spis treści 1. Informacje ogólne
Elektroforeza kwasów nukleinowych
 Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA i jest stosunkowo czuła (po odpowiednim wybarwieniu
Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA i jest stosunkowo czuła (po odpowiednim wybarwieniu
Elektroforeza kwasów nukleinowych
 Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA ze stosunkowo wysoką czułością (po odpowiednim
Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA ze stosunkowo wysoką czułością (po odpowiednim
ĆWICZENIE 1 i 2 Modyfikacja geu wołowej beta-laktoglobuliny przy użyciu metody Overlap Extension PCR (wydłużania nakładających się odcinków)
 ĆWICZENIE 1 i 2 Modyfikacja geu wołowej beta-laktoglobuliny przy użyciu metody Overlap Extension PCR (wydłużania nakładających się odcinków) Celem ćwiczenia jest wprowadzenie mutacji punktowej do genu
ĆWICZENIE 1 i 2 Modyfikacja geu wołowej beta-laktoglobuliny przy użyciu metody Overlap Extension PCR (wydłużania nakładających się odcinków) Celem ćwiczenia jest wprowadzenie mutacji punktowej do genu
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa IZOLACJA DNA Z HODOWLI KOMÓRKOWEJ.
CEL ĆWICZENIA: Zapoznanie się z przykładową procedurą odsalania oczyszczanych preparatów enzymatycznych w procesie klasycznej filtracji żelowej.
 LABORATORIUM 3 Filtracja żelowa preparatu oksydazy polifenolowej (PPO) oczyszczanego w procesie wysalania siarczanem amonu z wykorzystaniem złoża Sephadex G-50 CEL ĆWICZENIA: Zapoznanie się z przykładową
LABORATORIUM 3 Filtracja żelowa preparatu oksydazy polifenolowej (PPO) oczyszczanego w procesie wysalania siarczanem amonu z wykorzystaniem złoża Sephadex G-50 CEL ĆWICZENIA: Zapoznanie się z przykładową
Spis treści. Definicja
 Spis treści 1 Definicja 2 Podstawy fizyczne 3 Czynniki wpływające na przebieg elektroforezy 4 Etapy planowania i wykonania elektroforezy 5 Wybór nośnika elektroforetycznego 5.1 Główne rodzaje nośników
Spis treści 1 Definicja 2 Podstawy fizyczne 3 Czynniki wpływające na przebieg elektroforezy 4 Etapy planowania i wykonania elektroforezy 5 Wybór nośnika elektroforetycznego 5.1 Główne rodzaje nośników
K05 Instrukcja wykonania ćwiczenia
 Katedra Chemii Fizycznej Uniwersytetu Łódzkiego K05 Instrukcja wykonania ćwiczenia Wyznaczanie punktu izoelektrycznego żelatyny metodą wiskozymetryczną Zakres zagadnień obowiązujących do ćwiczenia 1. Układy
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego K05 Instrukcja wykonania ćwiczenia Wyznaczanie punktu izoelektrycznego żelatyny metodą wiskozymetryczną Zakres zagadnień obowiązujących do ćwiczenia 1. Układy
ĆWICZENIE 3 DGGE- ELEKTROFOREZA W ŻELU Z GRADIENTEM CZYNNIKA DENATURUJĄCEGO
 ĆWICZENIE 3 DGGE- ELEKTROFOREZA W ŻELU Z GRADIENTEM CZYNNIKA DENATURUJĄCEGO CZĘŚĆ TEORETYCZNA Metody badań i cechy w oparciu o które przeprowadzana jest klasyfikacja i identyfikacja mikroorganizmówh Struktura
ĆWICZENIE 3 DGGE- ELEKTROFOREZA W ŻELU Z GRADIENTEM CZYNNIKA DENATURUJĄCEGO CZĘŚĆ TEORETYCZNA Metody badań i cechy w oparciu o które przeprowadzana jest klasyfikacja i identyfikacja mikroorganizmówh Struktura
Western Blot. Praktyczny poradnik.
 Western Blot. Praktyczny poradnik. Western Blot jest techniką powszechnie stosowaną w biologii molekularnej w różnych laboratoriach na całym świecie. W przeciwieństwie do hybrydyzacji Southern i Northern,
Western Blot. Praktyczny poradnik. Western Blot jest techniką powszechnie stosowaną w biologii molekularnej w różnych laboratoriach na całym świecie. W przeciwieństwie do hybrydyzacji Southern i Northern,
TaqNova-RED. Polimeraza DNA RP20R, RP100R
 TaqNova-RED Polimeraza DNA RP20R, RP100R RP20R, RP100R TaqNova-RED Polimeraza DNA Rekombinowana termostabilna polimeraza DNA Taq zawierająca czerwony barwnik, izolowana z Thermus aquaticus, o przybliżonej
TaqNova-RED Polimeraza DNA RP20R, RP100R RP20R, RP100R TaqNova-RED Polimeraza DNA Rekombinowana termostabilna polimeraza DNA Taq zawierająca czerwony barwnik, izolowana z Thermus aquaticus, o przybliżonej
MINIPOL 2. Zestaw do minielektroforezy płytowej w jednym lub dwóch żelach poliakrylamidowych. Instrukcja Obsługi. Numer katalogowy:
 MINIPOL 2 Zestaw do minielektroforezy płytowej w jednym lub dwóch żelach poliakrylamidowych Instrukcja Obsługi Numer katalogowy: 103-100 Aby uzys k ać pomoc techniczną : T 22 668 71 47 Spis treści 1. Informacje
MINIPOL 2 Zestaw do minielektroforezy płytowej w jednym lub dwóch żelach poliakrylamidowych Instrukcja Obsługi Numer katalogowy: 103-100 Aby uzys k ać pomoc techniczną : T 22 668 71 47 Spis treści 1. Informacje
ANALIZA I OCZYSZCZANIE BIAŁEK
 Ćwiczenie 3 ANALIZA I CZYSZCZANIE BIAŁEK Część doświadczalna obejmuje: rozdział białek zawartych w surowicy krwi metodą elektroforezy w żelu agarozowym rozdział hemoglobiny od chromianu potasu metodą sączenia
Ćwiczenie 3 ANALIZA I CZYSZCZANIE BIAŁEK Część doświadczalna obejmuje: rozdział białek zawartych w surowicy krwi metodą elektroforezy w żelu agarozowym rozdział hemoglobiny od chromianu potasu metodą sączenia
- oznaczenia naukowo-badawcze. - jedna z podstawowych technik. - oznaczenia laboratoryjnodiagnostyczne. Elektroforeza. badawczych.
 Elektroforeza - jedna z podstawowych technik badawczych - oznaczenia naukowo-badawcze - oznaczenia laboratoryjnodiagnostyczne Annals of the New York Academy of Sciences 928:54-64 (2001) 2001 New York
Elektroforeza - jedna z podstawowych technik badawczych - oznaczenia naukowo-badawcze - oznaczenia laboratoryjnodiagnostyczne Annals of the New York Academy of Sciences 928:54-64 (2001) 2001 New York
Próba kontrolna (PK) 1000 l 1000 l
 Ćwiczenie 10. A. Oznaczanie stężenia bilirubiny całkowitej w surowicy krwi. Wymagane zagadnienia teoretyczne 1. Biosynteza hemu - metabolity pośrednie syntezy hemu. 2. Katabolizm hemu - powstawanie barwników
Ćwiczenie 10. A. Oznaczanie stężenia bilirubiny całkowitej w surowicy krwi. Wymagane zagadnienia teoretyczne 1. Biosynteza hemu - metabolity pośrednie syntezy hemu. 2. Katabolizm hemu - powstawanie barwników
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA
 Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Zakład Biologii Molekularnej Materiały do ćwiczeń z przedmiotu: BIOLOGIA MOLEKULARNA Zakład Biologii Molekularnej Wydział Farmaceutyczny, WUM ul. Banacha 1, 02-097 Warszawa tel. 22 572 0735, 606448502
Deproteinizacja jako niezbędny etap przygotowania próbek biologicznych
 Deproteinizacja jako niezbędny etap przygotowania próbek biologicznych Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. 1. Wstęp Określenie próbka biologiczna jest
Deproteinizacja jako niezbędny etap przygotowania próbek biologicznych Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. 1. Wstęp Określenie próbka biologiczna jest
1. Wprowadzenie teoretyczne Co to jest elektroforeza Parametry elektryczne Podstawowe informacje na temat białek...
 ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM Spis treści 1. Wprowadzenie teoretyczne... 2 1.1. Co to jest elektroforeza... 2 1.2. Parametry elektryczne... 2 1.3. Podstawowe informacje na temat białek...
ELEKTROFOREZA BIAŁEK W ŻELU POLIAKRYLAMIDOWYM Spis treści 1. Wprowadzenie teoretyczne... 2 1.1. Co to jest elektroforeza... 2 1.2. Parametry elektryczne... 2 1.3. Podstawowe informacje na temat białek...
Elektroforeza kwasów nukleinowych
 Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA i jest stosunkowo czuła (po odpowiednim wybarwieniu
Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA i jest stosunkowo czuła (po odpowiednim wybarwieniu
bi ~ Zestaw dydal<tyczny umożliwiający przeprowadzenie izolacji genomowego DNA z bakterii EasyLation Genomie DNA INSTRUI<CJA DLA STUDENTÓW
 Zestaw dydaktyczny EasyLation Genomie DNA Nr kat. DY80 Wersja zestawu: 1.2014 Zestaw dydal
Zestaw dydaktyczny EasyLation Genomie DNA Nr kat. DY80 Wersja zestawu: 1.2014 Zestaw dydal
Laboratorium 5. Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna
 Laboratorium 5 Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Szybkość reakcji enzymatycznej zależy przede wszystkim od stężenia substratu
Laboratorium 5 Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Szybkość reakcji enzymatycznej zależy przede wszystkim od stężenia substratu
PARAMETRY TECHNICZNE I ILOŚCIOWE PRZEDMIOTU NINIEJSZEGO POSTĘPOWANIA
 Znak sprawy: 13/G/2016 Załącznik nr 2 PARAMETRY TECHNICZNE I ILOŚCIOWE PRZEDMIOTU NINIEJSZEGO POSTĘPOWANIA 1. [APARAT DO AUTOMATYCZNEJ IZOLACJI KWASÓW NUKLEINOWYCH] MagCore HF16Plus szt.1 / NIE 1 Automatyczna
Znak sprawy: 13/G/2016 Załącznik nr 2 PARAMETRY TECHNICZNE I ILOŚCIOWE PRZEDMIOTU NINIEJSZEGO POSTĘPOWANIA 1. [APARAT DO AUTOMATYCZNEJ IZOLACJI KWASÓW NUKLEINOWYCH] MagCore HF16Plus szt.1 / NIE 1 Automatyczna
Zakład Chemii Organicznej, Wydział Chemii UMCS Strona 1
 PREPARAT NR 1 O H 2 SO 4 COOH + HO t. wrz., 1 godz. O OCTAN IZOAMYLU Stechiometria reakcji Kwas octowy lodowaty Alkohol izoamylowy Kwas siarkowy 1.5 ekwiwalenta 1 ekwiwalentów 0,01 ekwiwalenta Dane do
PREPARAT NR 1 O H 2 SO 4 COOH + HO t. wrz., 1 godz. O OCTAN IZOAMYLU Stechiometria reakcji Kwas octowy lodowaty Alkohol izoamylowy Kwas siarkowy 1.5 ekwiwalenta 1 ekwiwalentów 0,01 ekwiwalenta Dane do
SubDNA. Zestaw do elektroforezy horyzontalnej w żelu agarozowym z chłodzeniem* Instrukcja Obsługi
 * SubDNA Zestaw do elektroforezy horyzontalnej w żelu agarozowym z chłodzeniem* Instrukcja Obsługi Numer katalogowy: 130-100 Numer katalogowy: 131-100* Aby uzys k ać pomoc techniczną (+48) 22 668 71 47
* SubDNA Zestaw do elektroforezy horyzontalnej w żelu agarozowym z chłodzeniem* Instrukcja Obsługi Numer katalogowy: 130-100 Numer katalogowy: 131-100* Aby uzys k ać pomoc techniczną (+48) 22 668 71 47
Elementy enzymologii i biochemii białek. Skrypt dla studentów biologii i biotechnologii
 Elementy enzymologii i biochemii białek Skrypt dla studentów biologii i biotechnologii NR 166 Danuta Wojcieszyńska, Urszula Guzik Elementy enzymologii i biochemii białek Skrypt dla studentów biologii i
Elementy enzymologii i biochemii białek Skrypt dla studentów biologii i biotechnologii NR 166 Danuta Wojcieszyńska, Urszula Guzik Elementy enzymologii i biochemii białek Skrypt dla studentów biologii i
PROJEKT WSPÓŁFINANSOWANY PRZEZ UNIĘ EUROPEJSKĄ Z EUROPEJSKIEGO FUNDUSZU ROZWOJU REGIONALNEGO 1 z 7
 Poznań, dnia 28.04.2014 r. BioVentures Institute Spółka z ograniczoną odpowiedzialnością ul. Promienista 83 60 141 Poznań Zapytanie ofertowe nr 01/2014 Projekt Nowa technologia wytwarzania szczepionek
Poznań, dnia 28.04.2014 r. BioVentures Institute Spółka z ograniczoną odpowiedzialnością ul. Promienista 83 60 141 Poznań Zapytanie ofertowe nr 01/2014 Projekt Nowa technologia wytwarzania szczepionek
HYDROLIZA SOLI. ROZTWORY BUFOROWE
 Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
Ćwiczenie 9 semestr 2 HYDROLIZA SOLI. ROZTWORY BUFOROWE Obowiązujące zagadnienia: Hydroliza soli-anionowa, kationowa, teoria jonowa Arrheniusa, moc kwasów i zasad, równania hydrolizy soli, hydroliza wieloetapowa,
Genetyczne modyfikowanie organizmów Kierunek OCHRONA ŚRODOWISKA, II rok semestr letni 2015/16
 Genetyczne modyfikowanie organizmów Kierunek OCHRONA ŚRODOWISKA, II rok semestr letni 2015/16 Ćwiczenie 3 Identyfikacja genetycznie modyfikowanych roślin w produktach spożywczych - jakościowe badanie obecności
Genetyczne modyfikowanie organizmów Kierunek OCHRONA ŚRODOWISKA, II rok semestr letni 2015/16 Ćwiczenie 3 Identyfikacja genetycznie modyfikowanych roślin w produktach spożywczych - jakościowe badanie obecności
ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1)
 ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1) z dnia 6 listopada 2002 r. w sprawie metodyk referencyjnych badania stopnia biodegradacji substancji powierzchniowoczynnych zawartych w produktach, których stosowanie
ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1) z dnia 6 listopada 2002 r. w sprawie metodyk referencyjnych badania stopnia biodegradacji substancji powierzchniowoczynnych zawartych w produktach, których stosowanie
część I Zestaw do elektroforezy białek dla Instytutu Genetyki i Mikrobiologii Uniwersytetu Wrocławskiego kod CPV 38500000-0 1 SZT.
 część I Zestaw do elektroforezy białek dla Instytutu Genetyki i Mikrobiologii Uniwersytetu Wrocławskiego kod CPV 38500000-0 Aparat do elektroforezy na żelach poliakrylamidowych z modułem do transferu na
część I Zestaw do elektroforezy białek dla Instytutu Genetyki i Mikrobiologii Uniwersytetu Wrocławskiego kod CPV 38500000-0 Aparat do elektroforezy na żelach poliakrylamidowych z modułem do transferu na
Elektroforeza kapilarna oznaczanie benzoesanu sodu w próbkach wodnych + +
 Elektroforeza kapilarna oznaczanie benzoesanu sodu w próbkach wodnych Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. 1. Wstęp Zjawisko elektroforezy polega na poruszaniu
Elektroforeza kapilarna oznaczanie benzoesanu sodu w próbkach wodnych Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. 1. Wstęp Zjawisko elektroforezy polega na poruszaniu
Sporządzanie roztworów buforowych i badanie ich właściwości
 Sporządzanie roztworów buforowych i badanie ich właściwości (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zbadanie właściwości roztworów buforowych. Przygotujemy dwa roztwory buforowe: octanowy
Sporządzanie roztworów buforowych i badanie ich właściwości (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zbadanie właściwości roztworów buforowych. Przygotujemy dwa roztwory buforowe: octanowy
Zestaw do wykrywania Chlamydia trachomatis w moczu lub w kulturach komórkowych
 Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
ELEKTROFOREZA DWUWYMIAROWA 2-DE BIAŁEK
 ELEKTROFOREZA DWUWYMIAROWA 2-DE BIAŁEK WPROWADZENIE Dwuwymiarowa elektroforeza żelowa jest metodą znaną od lat 70-tych ubiegłego wieku. Obecnie jest powszechnie stosowaną metodą rozdziału pozwalającą na
ELEKTROFOREZA DWUWYMIAROWA 2-DE BIAŁEK WPROWADZENIE Dwuwymiarowa elektroforeza żelowa jest metodą znaną od lat 70-tych ubiegłego wieku. Obecnie jest powszechnie stosowaną metodą rozdziału pozwalającą na
Elektroforeza kwasów nukleinowych
 Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA i jest stosunkowo czuła (po odpowiednim wybarwieniu
Elektroforeza kwasów nukleinowych Elektroforeza jest podstawową techniką wizualizacji kwasów nukleinowych pozwala bezpośrednio identyfikować cząsteczki DNA i jest stosunkowo czuła (po odpowiednim wybarwieniu
Plan ćwiczeń wykonywanych w ramach Pracowni Biologii Molekularnej, część II Ekspresja i oczyszczanie białek.
 Pracownia Biologii Molekularnej Część II Plan ćwiczeń wykonywanych w ramach Pracowni Biologii Molekularnej, część II Ekspresja i oczyszczanie białek. Spis treści 1 I spotkanie: Ekspresja białka w komórkach
Pracownia Biologii Molekularnej Część II Plan ćwiczeń wykonywanych w ramach Pracowni Biologii Molekularnej, część II Ekspresja i oczyszczanie białek. Spis treści 1 I spotkanie: Ekspresja białka w komórkach
Wyścigi w polu elektrycznym
 Wyścigi w polu elektrycznym - czyli słów kilka o nowoczesnych technikach elektromigracyjnych Paweł Kubalczyk Katedra Chemii Środowiska Wydział Chemii UŁ Mieszaniny Mieszanina to układ dwóch lub więcej
Wyścigi w polu elektrycznym - czyli słów kilka o nowoczesnych technikach elektromigracyjnych Paweł Kubalczyk Katedra Chemii Środowiska Wydział Chemii UŁ Mieszaniny Mieszanina to układ dwóch lub więcej
Laboratorium z bionanostruktur. Prowadzący: mgr inż. Jan Procek Konsultacje: WT D- 1 8A
 Laboratorium z bionanostruktur Prowadzący: mgr inż. Jan Procek Konsultacje: WT 9.00-10.00 D- 1 8A Regulamin Studenci są dopuszczeni do wykonywania ćwiczenia jeżeli posiadają: Buty na płaskim obcasie, Fartuchy,
Laboratorium z bionanostruktur Prowadzący: mgr inż. Jan Procek Konsultacje: WT 9.00-10.00 D- 1 8A Regulamin Studenci są dopuszczeni do wykonywania ćwiczenia jeżeli posiadają: Buty na płaskim obcasie, Fartuchy,
AmpliTest Babesia spp. (PCR)
 AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
1 ekwiwalent 6 ekwiwalentów 0,62 ekwiwalentu
 PREPARAT NR 31 Stechiometria reakcji Metanol Kwas siarkowy(vi) stężony OH MeOH, H OCH 3 2 SO 4 t. wrz., 3 godz. 1 ekwiwalent 6 ekwiwalentów 0,62 ekwiwalentu 2-METOKSYNAFTALEN Dane do obliczeń Związek molowa
PREPARAT NR 31 Stechiometria reakcji Metanol Kwas siarkowy(vi) stężony OH MeOH, H OCH 3 2 SO 4 t. wrz., 3 godz. 1 ekwiwalent 6 ekwiwalentów 0,62 ekwiwalentu 2-METOKSYNAFTALEN Dane do obliczeń Związek molowa
Gel-Out. 50 izolacji, 250 izolacji. Nr kat , Zestaw do izolacji DNA z żelu agarozowego. wersja 0617
 Gel-Out Zestaw do izolacji DNA z żelu agarozowego. wersja 0617 50 izolacji, 250 izolacji Nr kat. 023-50, 023-250 Pojemność kolumny do izolacji DNA - do 20 µg DNA, minimalna pojemność - 2 µg DNA (przy zawartości
Gel-Out Zestaw do izolacji DNA z żelu agarozowego. wersja 0617 50 izolacji, 250 izolacji Nr kat. 023-50, 023-250 Pojemność kolumny do izolacji DNA - do 20 µg DNA, minimalna pojemność - 2 µg DNA (przy zawartości
1 ekwiwalent 4 ekwiwalenty 5 ekwiwalentów
 PREPARAT NR 9 NH 2 NH 2 HCOOH 100 o C, 1 godz. N N H BENZIMIDAZOL Stechiometria reakcji Kwas mrówkowy Amoniak (25% m/m w wodzie) 1 ekwiwalent 4 ekwiwalenty 5 ekwiwalentów Dane do obliczeń Związek molowa
PREPARAT NR 9 NH 2 NH 2 HCOOH 100 o C, 1 godz. N N H BENZIMIDAZOL Stechiometria reakcji Kwas mrówkowy Amoniak (25% m/m w wodzie) 1 ekwiwalent 4 ekwiwalenty 5 ekwiwalentów Dane do obliczeń Związek molowa
Spis treści. Aparatura
 Spis treści Aparatura I. Podstawowe wyposażenie laboratoryjne... 13 I.I. Probówki i naczynia laboratoryjne... 13 I.II. Pipety... 17 I.II.I. Rodzaje pipet automatycznych... 17 I.II.II. Techniki pipetowania...
Spis treści Aparatura I. Podstawowe wyposażenie laboratoryjne... 13 I.I. Probówki i naczynia laboratoryjne... 13 I.II. Pipety... 17 I.II.I. Rodzaje pipet automatycznych... 17 I.II.II. Techniki pipetowania...
Kolor i stan skupienia: czerwone ciało stałe. Analiza NMR: Zakład Chemii Organicznej, Wydział Chemii UMCS Strona 1
 PREPARAT NR 22 HO OH ZnCl 2 (bezw.) HO O O FLUORESCEINA 180210 o C, 40 min COOH Stechiometria reakcji ZnCl 2 bezw. 1 ekwiwalent 2.5 ekwiwalenta 0.5 ekwiwalenta Dane do obliczeń Związek molowa (g/mol) Gęstość
PREPARAT NR 22 HO OH ZnCl 2 (bezw.) HO O O FLUORESCEINA 180210 o C, 40 min COOH Stechiometria reakcji ZnCl 2 bezw. 1 ekwiwalent 2.5 ekwiwalenta 0.5 ekwiwalenta Dane do obliczeń Związek molowa (g/mol) Gęstość
CHROMATOGRAFIA BARWNIKÓW ROŚLINNYCH
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 1 CHROMATOGRAFIA BARWNIKÓW ROŚLINNYCH I. Wiadomości teoretyczne W wielu dziedzinach nauki i techniki spotykamy się z problemem
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 1 CHROMATOGRAFIA BARWNIKÓW ROŚLINNYCH I. Wiadomości teoretyczne W wielu dziedzinach nauki i techniki spotykamy się z problemem
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN
 ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
1 ekwiwalent 2 ekwiwalenty 2 krople
 PREPARAT NR 5 COOH OH H 2 SO 4 COOH O ASPIRYNA 50-60 o C, 30 min. O Stechiometria reakcji Kwas salicylowy bezwodny Bezwodnik kwasu octowego Kwas siarkowy stęż. 1 ekwiwalent 2 ekwiwalenty 2 krople Dane
PREPARAT NR 5 COOH OH H 2 SO 4 COOH O ASPIRYNA 50-60 o C, 30 min. O Stechiometria reakcji Kwas salicylowy bezwodny Bezwodnik kwasu octowego Kwas siarkowy stęż. 1 ekwiwalent 2 ekwiwalenty 2 krople Dane
Zakład Chemii Organicznej, Wydział Chemii UMCS Strona 1
 PREPARAT NR 6 NaO 3 S Oranż 2-naftolu NH 2 + OH 5 o C N N OH SO 3 H Stechiometria reakcji 2-Naftol Kwas sulfanilowy Azotan III sodu 1 ekwiwalent 1 ekwiwalent 1 ekwiwalent Dane do obliczeń Związek molowa
PREPARAT NR 6 NaO 3 S Oranż 2-naftolu NH 2 + OH 5 o C N N OH SO 3 H Stechiometria reakcji 2-Naftol Kwas sulfanilowy Azotan III sodu 1 ekwiwalent 1 ekwiwalent 1 ekwiwalent Dane do obliczeń Związek molowa
PEHAMETRIA I ROZTWORY BUFOROWE
 4. PEHAMETRIA I ROZTWORY BUFOROWE 1. Sporządzanie i oznaczanie buforu octanowego Pehametria jest analizą instrumentalną, słuŝącą do potencjometrycznego bezpośredniego pomiaru wskaźnika stęŝenia jonów H
4. PEHAMETRIA I ROZTWORY BUFOROWE 1. Sporządzanie i oznaczanie buforu octanowego Pehametria jest analizą instrumentalną, słuŝącą do potencjometrycznego bezpośredniego pomiaru wskaźnika stęŝenia jonów H
Kuratorium Oświaty w Lublinie ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2016/2017 ETAP TRZECI
 Kuratorium Oświaty w Lublinie.. Imię i nazwisko ucznia Pełna nazwa szkoły Liczba punktów ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2016/2017 ETAP TRZECI Instrukcja dla ucznia
Kuratorium Oświaty w Lublinie.. Imię i nazwisko ucznia Pełna nazwa szkoły Liczba punktów ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2016/2017 ETAP TRZECI Instrukcja dla ucznia
Genomic Mini AX Milk Spin
 Genomic Mini AX Milk Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z próbek mleka. wersja 1017 100 izolacji Nr kat. 059-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg. Produkt
Genomic Mini AX Milk Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z próbek mleka. wersja 1017 100 izolacji Nr kat. 059-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg. Produkt
1 ekwiwalent 2.5 ekwiwalenta 0.5 ekwiwalenta
 PREPARAT NR 10 HO OH ZnCl 2 (bezw.) HO O O FLUORESCEINA 180-210 o C, 40 min COOH Stechiometria reakcji ZnCl 2 bezw. 1 ekwiwalent 2.5 ekwiwalenta 0.5 ekwiwalenta Dane do obliczeń Związek molowa (g/mol)
PREPARAT NR 10 HO OH ZnCl 2 (bezw.) HO O O FLUORESCEINA 180-210 o C, 40 min COOH Stechiometria reakcji ZnCl 2 bezw. 1 ekwiwalent 2.5 ekwiwalenta 0.5 ekwiwalenta Dane do obliczeń Związek molowa (g/mol)
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
OZNACZANIE ZAWARTOŚCI MANGANU W GLEBIE
 OZNACZANIE ZAWARTOŚCI MANGANU W GLEBIE WPROWADZENIE Przyswajalność pierwiastków przez rośliny zależy od procesów zachodzących między fazą stałą i ciekłą gleby oraz korzeniami roślin. Pod względem stopnia
OZNACZANIE ZAWARTOŚCI MANGANU W GLEBIE WPROWADZENIE Przyswajalność pierwiastków przez rośliny zależy od procesów zachodzących między fazą stałą i ciekłą gleby oraz korzeniami roślin. Pod względem stopnia
1 ekwiwalent 1 ekwiwalent
 PREPARAT NR 1 1,1 -BINAFTYLO-2,2 -DIOL FeCl 3 *6H 2 O H 2 O, t. wrz. Stechiometria reakcji Chlorek żelaza(iii) sześciowodny 1 ekwiwalent 1 ekwiwalent Dane do obliczeń Związek molowa (g/mol) Gęstość (g/ml)
PREPARAT NR 1 1,1 -BINAFTYLO-2,2 -DIOL FeCl 3 *6H 2 O H 2 O, t. wrz. Stechiometria reakcji Chlorek żelaza(iii) sześciowodny 1 ekwiwalent 1 ekwiwalent Dane do obliczeń Związek molowa (g/mol) Gęstość (g/ml)
Zestaw dydaktyczny. genotypowanie szczepów 5taphy/ococcus aureus metodą PCR-RFLP
 2014-07-17 Zestaw dydaktyczny EasyGenotyping PCR-RFLP - S. aureus genotypowanie szczepów 5taphy/ococcus aureus metodą PCR-RFLP Celem ćwiczenia jest przeprowadzenie typowania genetycznego dostarczonych
2014-07-17 Zestaw dydaktyczny EasyGenotyping PCR-RFLP - S. aureus genotypowanie szczepów 5taphy/ococcus aureus metodą PCR-RFLP Celem ćwiczenia jest przeprowadzenie typowania genetycznego dostarczonych
Wpływ ilości modyfikatora na współczynnik retencji w technice wysokosprawnej chromatografii cieczowej
 Wpływ ilości modyfikatora na współczynnik retencji w technice wysokosprawnej chromatografii cieczowej WPROWADZENIE Wysokosprawna chromatografia cieczowa (HPLC) jest uniwersalną techniką analityczną, stosowaną
Wpływ ilości modyfikatora na współczynnik retencji w technice wysokosprawnej chromatografii cieczowej WPROWADZENIE Wysokosprawna chromatografia cieczowa (HPLC) jest uniwersalną techniką analityczną, stosowaną
CHROMATOGRAFIA ADSORPCYJNA I PODZIAŁOWA. 1. Rozdział barwników roślinnych metodą chromatografii adsorpcyjnej (techniką kolumnową)
 Ćwiczenie nr 7 CHROMATOGRAFIA ADSORPCYJNA I PODZIAŁOWA 1. Rozdział barwników roślinnych metodą chromatografii adsorpcyjnej (techniką kolumnową) Zasada: Barwniki roślinne charakteryzują się różnym powinowactwem
Ćwiczenie nr 7 CHROMATOGRAFIA ADSORPCYJNA I PODZIAŁOWA 1. Rozdział barwników roślinnych metodą chromatografii adsorpcyjnej (techniką kolumnową) Zasada: Barwniki roślinne charakteryzują się różnym powinowactwem
GeneMATRIX Agarose-Out DNA Purification Kit
 Wersja zestawu 7.1 Kwiecień 2019 GeneMATRIX Agarose-Out DNA Purification Kit Uniwersalny zestaw do izolacji DNA z żeli agarozowych kat. nr. E3540 EURx Ltd. 80-297 Gdansk Poland ul. Przyrodnikow 3, NIP
Wersja zestawu 7.1 Kwiecień 2019 GeneMATRIX Agarose-Out DNA Purification Kit Uniwersalny zestaw do izolacji DNA z żeli agarozowych kat. nr. E3540 EURx Ltd. 80-297 Gdansk Poland ul. Przyrodnikow 3, NIP
BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK
 BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO-FAZOWYM;
BIOLOGIA KOMÓRKI KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO- FAZOWYM; BARWIENIA CYTOCHEMICZNE KOMÓREK KOMÓRKI EUKARIOTYCZNE W MIKROSKOPIE ŚWIETLNYM JASNEGO POLA I KONTRASTOWO-FAZOWYM;
LABORATORIUM Z KATALIZY HOMOGENICZNEJ I HETEROGENICZNEJ WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI UTLENIANIA POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY
 POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA FIZYKOCHEMII I TECHNOLOGII POLIMERÓW WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI UTLENIANIA JONÓW TIOSIARCZANOWYCH Miejsce ćwiczenia: Zakład Chemii Fizycznej, sala
POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA FIZYKOCHEMII I TECHNOLOGII POLIMERÓW WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI UTLENIANIA JONÓW TIOSIARCZANOWYCH Miejsce ćwiczenia: Zakład Chemii Fizycznej, sala
BIOTECHNOLOGIA. Zajęcia prowadzone przez Zakład Biologii Molekularnej i Zakład Regulacji Metabolizmu
 BIOTECHNOLOGIA Zajęcia prowadzone przez Zakład Biologii Molekularnej i Zakład Regulacji Metabolizmu Materiały do ćwiczeń dla studentów kierunku Biotechnologia w roku akademickim 2009/2010 opracowane przez
BIOTECHNOLOGIA Zajęcia prowadzone przez Zakład Biologii Molekularnej i Zakład Regulacji Metabolizmu Materiały do ćwiczeń dla studentów kierunku Biotechnologia w roku akademickim 2009/2010 opracowane przez
Zakład Chemii Organicznej, Wydział Chemii UMCS Strona 1
 PREPARAT NR 20 KWAS 2JODOBENZOESOWY NH 2 NaNO 2, HCl Woda, < 5 o C, 15 min N 2 Cl KI Woda, < 5 o C, potem 50 o C, 20 min I Stechiometria reakcji Kwas antranilowy Azotyn sodu Kwas solny stężony 1 ekwiwalent
PREPARAT NR 20 KWAS 2JODOBENZOESOWY NH 2 NaNO 2, HCl Woda, < 5 o C, 15 min N 2 Cl KI Woda, < 5 o C, potem 50 o C, 20 min I Stechiometria reakcji Kwas antranilowy Azotyn sodu Kwas solny stężony 1 ekwiwalent
OCENA CZYSTOŚCI WODY NA PODSTAWIE POMIARÓW PRZEWODNICTWA. OZNACZANIE STĘŻENIA WODOROTLENKU SODU METODĄ MIARECZKOWANIA KONDUKTOMETRYCZNEGO
 OCENA CZYSTOŚCI WODY NA PODSTAWIE POMIAÓW PZEWODNICTWA. OZNACZANIE STĘŻENIA WODOOTLENKU SODU METODĄ MIAECZKOWANIA KONDUKTOMETYCZNEGO Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu
OCENA CZYSTOŚCI WODY NA PODSTAWIE POMIAÓW PZEWODNICTWA. OZNACZANIE STĘŻENIA WODOOTLENKU SODU METODĄ MIAECZKOWANIA KONDUKTOMETYCZNEGO Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu
ĆWICZENIA Z BIOLOGII MOLEKULARNEJ
 UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z BIOLOGII MOLEKULARNEJ (załącznik do ćwiczeń) dla studentów II roku biologii oraz III roku
UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ ĆWICZENIA Z BIOLOGII MOLEKULARNEJ (załącznik do ćwiczeń) dla studentów II roku biologii oraz III roku
A4.05 Instrukcja wykonania ćwiczenia
 Katedra Chemii Fizycznej Uniwersytetu Łódzkiego A4.05 nstrukcja wykonania ćwiczenia Wyznaczanie współczynników aktywności soli trudno rozpuszczalnej metodą pomiaru rozpuszczalności Zakres zagadnień obowiązujących
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego A4.05 nstrukcja wykonania ćwiczenia Wyznaczanie współczynników aktywności soli trudno rozpuszczalnej metodą pomiaru rozpuszczalności Zakres zagadnień obowiązujących
Zastosowanie chromatografii do analizy białek i kwasów nukleinowych
 Zastosowanie chromatografii do analizy białek i kwasów nukleinowych γράφειν dr inż. Marek Orłowski χρῶμα Politechnika Wrocławska Wydział Chemiczny Wydziałowy Zakład Biochemii Każdy żywy organizm składa
Zastosowanie chromatografii do analizy białek i kwasów nukleinowych γράφειν dr inż. Marek Orłowski χρῶμα Politechnika Wrocławska Wydział Chemiczny Wydziałowy Zakład Biochemii Każdy żywy organizm składa
ODCZYNNIKI. KALIBRATORY i SUROWICE KONTROLNE**
 Załącznik nr 2 do SIWZ Wykonawca:... Samodzielny Publiczny Zespół... Zakładów Opieki Zdrowotnej w Kozienicach... ul. Al. Wł. Sikorskiego 10 tel.:/fax:... 26-900 Kozienice tel.:/fax: (48) 38 28 800/ (48)
Załącznik nr 2 do SIWZ Wykonawca:... Samodzielny Publiczny Zespół... Zakładów Opieki Zdrowotnej w Kozienicach... ul. Al. Wł. Sikorskiego 10 tel.:/fax:... 26-900 Kozienice tel.:/fax: (48) 38 28 800/ (48)
Genomic Mini AX Plant Spin
 Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
Oznaczanie mocznika w płynach ustrojowych metodą hydrolizy enzymatycznej
 Oznaczanie mocznika w płynach ustrojowych metodą hydrolizy enzymatycznej Wprowadzenie: Większość lądowych organizmów kręgowych część jonów amonowych NH + 4, produktu rozpadu białek, wykorzystuje w biosyntezie
Oznaczanie mocznika w płynach ustrojowych metodą hydrolizy enzymatycznej Wprowadzenie: Większość lądowych organizmów kręgowych część jonów amonowych NH + 4, produktu rozpadu białek, wykorzystuje w biosyntezie
Ilościowa analiza mieszaniny alkoholi techniką GC/FID
 Ilościowa analiza mieszaniny alkoholi techniką GC/FID WPROWADZENIE Pojęcie chromatografii obejmuje grupę metod separacji substancji, w których występują diw siły: siła powodująca ruch cząsteczek w określonym
Ilościowa analiza mieszaniny alkoholi techniką GC/FID WPROWADZENIE Pojęcie chromatografii obejmuje grupę metod separacji substancji, w których występują diw siły: siła powodująca ruch cząsteczek w określonym
CE1. Elektroforeza kapilarna dobór warunków rozdzielania CE2. Elektroforeza kapilarna oznaczanie homocysteiny w próbkach wodnych + +
 CE1. Elektroforeza kapilarna dobór warunków rozdzielania CE2. Elektroforeza kapilarna oznaczanie homocysteiny w próbkach wodnych Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu
CE1. Elektroforeza kapilarna dobór warunków rozdzielania CE2. Elektroforeza kapilarna oznaczanie homocysteiny w próbkach wodnych Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu
Zestaw do wykrywania Anaplasma phagocytophilum w kleszczach, krwi i hodowlach komórkowych
 Nr kat. PK24N Wersja zestawu: 1.2016 Zestaw do wykrywania phagocytophilum w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Detekcja
Nr kat. PK24N Wersja zestawu: 1.2016 Zestaw do wykrywania phagocytophilum w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Detekcja
UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ. Biomateriały
 UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ Biomateriały Ćwiczenia dla studentów III roku inżynierii nowoczesnych materiałów LUBLIN 2018 Wersja 1.0
UNIWERSYTET MARII CURIE-SKŁODOWSKIEJ WYDZIAŁ BIOLOGII I BIOTECHNOLOGII ZAKŁAD BIOLOGII MOLEKULARNEJ Biomateriały Ćwiczenia dla studentów III roku inżynierii nowoczesnych materiałów LUBLIN 2018 Wersja 1.0
ĆWICZENIE 1. Aminokwasy
 ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
ĆWICZENIE 1 Aminokwasy Przygotować 5 (lub więcej) 1% roztworów poszczególnych aminokwasów i białka jaja kurzego i dla każdego z nich wykonać wszystkie reakcje charakterystyczne. Reakcja ksantoproteinowa
Utylizacja i neutralizacja odpadów Międzywydziałowe Studia Ochrony Środowiska
 Utylizacja i neutralizacja odpadów Międzywydziałowe Studia Ochrony Środowiska Instrukcja do Ćwiczenia 14 Zastosowanie metod membranowych w oczyszczaniu ścieków Opracowała dr Elżbieta Megiel Celem ćwiczenia
Utylizacja i neutralizacja odpadów Międzywydziałowe Studia Ochrony Środowiska Instrukcja do Ćwiczenia 14 Zastosowanie metod membranowych w oczyszczaniu ścieków Opracowała dr Elżbieta Megiel Celem ćwiczenia
Zakład Chemii Organicznej, Wydział Chemii UMCS Strona 1
 PREPARAT NR 31 Stechiometria reakcji Metanol Kwas siarkowy(vi) stężony OH MeOH, H OCH 3 2 SO 4 t. wrz., 3 godz. 1 ekwiwalent 6 ekwiwalentów 0,62 ekwiwalentu 2-METOKSYNAFTALEN Dane do obliczeń Związek molowa
PREPARAT NR 31 Stechiometria reakcji Metanol Kwas siarkowy(vi) stężony OH MeOH, H OCH 3 2 SO 4 t. wrz., 3 godz. 1 ekwiwalent 6 ekwiwalentów 0,62 ekwiwalentu 2-METOKSYNAFTALEN Dane do obliczeń Związek molowa
WYZNACZANIE ROZMIARÓW
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 6 WYZNACZANIE ROZMIARÓW MAKROCZĄSTECZEK I. WSTĘP TEORETYCZNY Procesy zachodzące między atomami lub cząsteczkami w skali molekularnej
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 6 WYZNACZANIE ROZMIARÓW MAKROCZĄSTECZEK I. WSTĘP TEORETYCZNY Procesy zachodzące między atomami lub cząsteczkami w skali molekularnej
i biochemii białek Elementy Skrypt dla studentów biologii i biotechnologii Danuta Wojcieszyńska, Urszula Guzik Elementy enzymologii i biochemii białek
 Danuta Wojcieszyńska, Urszula Guzik CENA 20 ZŁ (+ VAT) ISSN 1644-0552 ISBN 978-83-8012-446-2 Elementy enzymologii i biochemii białek Więcej o książce Danuta Wojcieszyńska, Urszula Guzik Elementy enzymologii
Danuta Wojcieszyńska, Urszula Guzik CENA 20 ZŁ (+ VAT) ISSN 1644-0552 ISBN 978-83-8012-446-2 Elementy enzymologii i biochemii białek Więcej o książce Danuta Wojcieszyńska, Urszula Guzik Elementy enzymologii
Genomic Mini AX Bacteria+ Spin
 Genomic Mini AX Bacteria+ Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z bakterii Gram-dodatnich. wersja 1017 100 izolacji Nr kat. 060-100MS Pojemność kolumny do oczyszczania DNA wynosi
Genomic Mini AX Bacteria+ Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z bakterii Gram-dodatnich. wersja 1017 100 izolacji Nr kat. 060-100MS Pojemność kolumny do oczyszczania DNA wynosi
Genomic Micro AX Blood Gravity 96-well
 Genomic Micro AX Blood Gravity 96-well Zestaw do izolacji DNA z krwi w formacie płytek na 96 studzienek dedykowany do pracy z pipetą wielokanałową lub automatem typu liquid handler. 960 izolacji Nr kat.
Genomic Micro AX Blood Gravity 96-well Zestaw do izolacji DNA z krwi w formacie płytek na 96 studzienek dedykowany do pracy z pipetą wielokanałową lub automatem typu liquid handler. 960 izolacji Nr kat.
Zestaw do wykrywania Babesia spp. i Theileria spp. w kleszczach, krwi i hodowlach komórkowych
 Nr kat. PK25N Wersja zestawu: 1.2012 Zestaw do wykrywania spp. i Theileria spp. w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Zestaw
Nr kat. PK25N Wersja zestawu: 1.2012 Zestaw do wykrywania spp. i Theileria spp. w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Zestaw
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2017 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2016 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2016 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616
 Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616 10 izolacji Nr kat. 995-10 Pojemność kolumny do oczyszczania DNA wynosi 500 µg 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616 10 izolacji Nr kat. 995-10 Pojemność kolumny do oczyszczania DNA wynosi 500 µg 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
TRANSPORT NIEELEKTROLITÓW PRZEZ BŁONY WYZNACZANIE WSPÓŁCZYNNIKA PRZEPUSZCZALNOŚCI
 Ćwiczenie nr 7 TRANSPORT NIEELEKTROLITÓW PRZEZ BŁONY WYZNACZANIE WSPÓŁCZYNNIKA PRZEPUSZCZALNOŚCI Celem ćwiczenia jest zapoznanie się z podstawami teorii procesów transportu nieelektrolitów przez błony.
Ćwiczenie nr 7 TRANSPORT NIEELEKTROLITÓW PRZEZ BŁONY WYZNACZANIE WSPÓŁCZYNNIKA PRZEPUSZCZALNOŚCI Celem ćwiczenia jest zapoznanie się z podstawami teorii procesów transportu nieelektrolitów przez błony.
LABORATORIUM Z KATALIZY HOMOGENICZNEJ I HETEROGENICZNEJ PREPARATYKA KATALIZATORA POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY
 POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA FIZYKOCHEMII I TECHNOLOGII POLIMERÓW PREPARATYKA KATALIZATORA Miejsce ćwiczenia: Zakład Chemii Fizycznej, sala 109 LABORATORIUM Z KATALIZY HOMOGENICZNEJ I
POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA FIZYKOCHEMII I TECHNOLOGII POLIMERÓW PREPARATYKA KATALIZATORA Miejsce ćwiczenia: Zakład Chemii Fizycznej, sala 109 LABORATORIUM Z KATALIZY HOMOGENICZNEJ I
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
