TEST Chemia. odpowiedzi i rozwiązania dostępne na
|
|
|
- Dominika Lisowska
- 8 lat temu
- Przeglądów:
Transkrypt
1 TEST 2011 EGZAMIN WSTĘPNY DO SZKÓŁ ASPIRANTÓW PAŃSTWOWEJ STRAŻY POŻARNEJ I CENTRALNEJ SZKOŁY PAŃSTWOWEJ STRAŻY POŻARNEJ KSZTAŁCĄCYCH W ZAWODZIE TECHNIK POŻARNICTWA Centralna Szkoła Państwowej Straży Pożarnej w Częstochowie (CSPSP CZĘSTOCHOWA) Szkoła Aspirantów Państwowej Straży Pożarnej w Krakowie (SAPSP KRAKÓW) Szkoła Aspirantów Państwowej Straży Pożarnej w Poznaniu (SAPSP POZNAŃ) Chemia Zadanie 1. Wskaż zdanie prawdziwe A. Liczba masowa A, to suma liczby protonów i liczby elektronów B. Liczbę protonów wchodzących w skład jądra atomu określonego pierwiastka nazywamy liczba atomową i oznaczamy literą Z C. Masa atomowa jest to masa jednego mola danej substancji D. Wszystkie atomy tego samego pierwiastka różniące się liczbą protonów nazywamy izotopami. Zadanie 2. Spośród wymienionych substancji wybierz grupę zawierającą wyłącznie związki chemiczne A. siarka, woda, marmur, aluminium B. krzemionka, chlorek sodu, cukier, powietrze C. woda wapienna, cynk, rtęć, piasek D. węglan wapnia, tlenek sodu, chlorek sodu, etanol Zadanie 3. Aby wykryć wiązanie peptydowe w białkach można przeprowadzić reakcję A. Trommera B. ksantoproteinową C. biuretową D. bromowania Zadanie 4. Poniżej przedstawiono wzory węglowodorów oznaczonych od I do IV Wskaż odpowiedź, w której podano numery pary izomerów A. I i II B. I i IV C. II i III D. II i IV
2 Zadanie 5. Wybierz pierwiastek, który w warunkach normalnych jest ciałem stałym A. Azot B. Brom C. Potas D. Rtęć Zadanie 6. Ile moli produktów powstanie w wyniku spalania dwóch moli etanu zgodnie z poniższym równaniem C 2H 6 + 5/2O 2 2CO + 3H 2O A. 10 moli B. 12 moli C. 5 moli D. 7 moli Zadanie 7. Chlor może tworzyć wiązania A. kowalencyjne i kowalencyjne spolaryzowane B. jonowe i kowalencyjne spolaryzowane C. kowalencyjne i jonowe D. kowalencyjne spolaryzowane, jonowe i kowalencyjne Zadanie 8. Liczba wiązań chemicznych, jakie może tworzyć atom pierwiastka zależy od A. liczby elektronów w atomie B. liczby elektronów walencyjnych C. liczby neutronów w jądrze D. liczby protonów w jądrze Zadanie 9. Wybierz równanie przedstawiające reakcję całkowitego zobojętnienia wodorotlenku wapnia kwasem siarkowym(vi) A. Ca(OH) 2 + H 2SO 3 CaSO 3 + 2H 2O B. Ca(OH) 2 + H 2SO 4 CaSO 4 + 2H 2O C. Ca(OH) 2 + 2H 2SO 3 Ca(HSO 3) 2 + 2H 2O D. Ca(OH) 2 + H 2SO 4 Ca(HSO 4) 2 + 2H 2O Zadanie 10. W tabeli podano temperatury topnienia i wrzenia różnych węglowodorów pod normalnym ciśnieniem Węglowodór Temperatura topnienia t t C Temperatura wrzenia t w C Benzen 5,5 80,0 Butan -138,2-0,5 Heksan -95,5 68,7 Pentan -128,7 36,0 Na podstawie danych z tabeli wskaż węglowodór, który w temperaturze 20 C jest gazem. A. benzen B. butan C. heksan D. pentan
3 Zadanie 11. Związek o wzorze: CH 3NH-CH 2CH 3 może reagować z A. HCl B. C 6H 5Cl C. NaOH D. NaCl Zadanie 12. Azotany (V) są powszechnie używane w rolnictwie jako nawozy. Jaka jest zawartość procentowa azotu w saletrze amonowej (NH 4NO 3)? (M N - 14u, MO - 16 u, M H - 1u) A. 17,5% B. 35% C. 60% D. 42% Zadanie 13. Sporządzono 140g nasyconego roztworu KNO 3 w temperaturze 30 C, a następnie obniżono temperaturę do 10 C. Ile soli wykrystalizowało z roztworu? Rozpuszczalność KNO 3 w temperaturze 30 C wynosi 40g/100g wody, w temperaturze 10 C jest równa 20g/100g wody A. 10 g B. 30 g C. 20 g D. 15 g Zadanie 14. Która reakcja nie jest procesem utleniania i redukcji? A. Mg + 2HCl MgCl 2 + H 2 B. 2HgO 2Hg + O 2 C. PbS + 4H 2O 2 PbSO 4 + 4H 2O D. Ca(OH) 2 + N 2O 5 Ca(NO 3) 2 + H 2O Zadanie 15. W reakcji 1 mola pewnego alkoholu z metalicznym sodem wydzieliło się 22,4 dm 3 wodoru (w przeliczeniu na warunki normalne). Alkoholem tym był A. etanol B. glicerol C. etanodiol D. metanol Zadanie 16. Która grupa kwasów stanowi wyłącznie kwasy dwuprotonowe? A. HCl,HNO 3,HBr,H 4P 2O 7 B. HNO 2, H 3PO 3, H 2S 2O 3 C. H 2S, H 2SO 3, H 2SO 4, H 2CrO 4 D. H 2S, H 2Cr 2O 7, HCl
4 Zadanie 17. Wybierz zestaw, w którym poprawnie podano obserwowane zabarwienia papierków wskaźnikowych. C 2H 5OH CH 3COOH C 2H 5ONa A. żółty czerwony czerwony B. czerwony żółty niebieski C. żółty czerwony niebieski D. czerwony czerwony żółty Zadanie 18. Do odkażania wody w basenach często używany jest chlor, który po dodaniu do wody wchodzi z nią w reakcję chemiczną opisaną równaniem: Cl 2(g) + H 2 O HCl (aq) + HClO (aq) Określ, do jakiego typu reakcji należy przedstawiony powyżej proces. A. utlenianie B. redukcja C. utlenianie i redukcja D. dysproporcjonowanie Zadanie 19. Oranż metylowy przybiera zabarwienie czerwone w roztworach A. NaCl, H 2O, K 2SO 4 B. CH 3COOH, HCOOH, H 2SO 3 C. CaCO 3, Na 2S, CH 3COONa D. NaOH, KOH, NH 3, H 2O Zadanie 20. Do 100 cm 3 roztworu kwasu solnego o stężeniu 0.5 mol dm -3 rozcieńczono wodą do objętości 500cm 3. Stężenie otrzymanego roztworu wynosi: A. 0.1 mol dm -3 B mol dm -3 C mol dm -3 D mol dm -3 Zadanie 21. Kwas ortofosforowy(v) może tworzyć trzy rodzaje soli. Zaznacz, stosunek molowy, w jakim należy zmieszać kwas ortofosforowy(v) z wodorotlenkiem potasu, aby powstał wodorofosforan(v) potasu A. 1:1 B. 1:2 C. 1:3 D. 2:3 Zadanie 22. Stężenie molowe wodnego roztworu propanolu o stężeniu 3% wagowych i gęstości 1kg/dm 3 wynosi A. 0,5 mol/dm 3 B. 1 mol/dm 3 C. 0,05 mol/dm 3 D. 0,01 mol/dm 3
5 Zadanie 23. Podczas pracy pewnego ogniwa zachodzi reakcja, którą można przedstawić sumarycznym równaniem Zn+Pb 2+ Zn 2+ + Pb Wybierz równanie opisujące proces katodowy A. Pb Pb e - B. Pb e- Pb C. Zn Zn e - D. Zn e - Zn Zadanie 24. Stopień dysocjacji roztworu kwasu etanowego (octowego) o stężeniu 0,05 mol/dm 3 w temperaturze 20 C wynosi 2%. Stężenie jonów H + w tym roztworze wynosi A. 0,001 mol/dm 3 B. 0,025 mol/dm 3 C. 0,1 mol/dm 3 D. 0,4 mol/dm 3 Zadanie 25. Izobary to atomy, w których jądrach znajduje się taka sama liczba nukleonów (protonów i neutronów) Wybierz zestaw, w którym przedstawiono izobary A. 18Ar, 19K B K, 20Ca C K, 19K D O, 16S
6 Fizyka Zadanie 1. Prawo załamania światła przechodzącego przez granicę dwu ośrodków określa, że A. kąt padania strumienia światłą jest równy kątowi załamania B. stosunek sinusa kąta padania do sinusa kąta załamania ma wartość stałą C. suma kątów padania i załamania jest równa 45 D. kąt załamania zmienia się proporcjonalnie do zmiany kąta padania Zadanie 2. Na siatkówce ludzkiego oka powstaje obraz A. rzeczywisty i prosty B. rzeczywisty i odwrócony C. pozorny i odwrócony D. pozorny i prosty Zadanie 3. Przenikalność elektryczna próżni w układzie jednostek SI wyrażona jest w A. C2 Nm 2 B. Nm 2 C 2 C. NC 2 m 2 D. C2 m 2 N Zadanie 4. Pewna stacja radiowa nadaje na częstotliwości fali 100MHz. Okres tych fal ma wartość A. 0, s B. 0, s C. 0, s D. 0,01 Zadanie 5. Kąt o jaki obraca się Ziemia wokół własnej osi w ciągu jednej godziny wynosi około A. około 90 B. około 30 C. około 15 D. około 0,07 Zadanie 6. Co się dzieje z kątem załamania promienia świetlnego, jeśli kąt padania na granicę dwóch ośrodków przezroczystych wzrasta? A. Kąt załamania maleje B. Kąt załamania nie zmienia się C. Kąt załamania także wzrasta wprost proporcjonalnie do kąta padania D. Kąt załamania wzrasta, lecz nie tyle samo co kąt padania
7 Zadanie 7. Średnia moc silnika samochodu poruszającego się ze stałą prędkością o wartości 72 km h Siła ciągu silnika tego samochodu ma wartość A. 0,56 kn B. 2 kn C. 800 kn D. 2880kN wynosi 40kW. Zadanie 8. Pierwszą prędkość kosmiczną liczoną dla odległości równej długości równika możemy wyznaczyć z zależności A. V 1 = B. V 1 = G M R 2 g R 2 C. V 1 = g R D. V 1 = g R Zadanie 9. Ciało wykonujące drgania harmoniczne znalazło się w pewnym momencie w maksymalnym wychyleniu. W tym momencie A. całkowita energia mechaniczna jest równa energii kinetycznej B. całkowita energia mechaniczna jest równa energii sprężystości C. zarówno energia kinetyczna, jak i energia potencjalna są równe zeru D. jego energia kinetyczna jest równa równa energii potencjalnej sprężystości Zadanie 10. Silnik cieplny o sprawności 20% pracuje miedzy temperaturami, których różnica wynosi 80 C. Temperatura chłodnicy tego silnika wynosi około A. 0 B. 47 C. 320 D. 400 Zadanie 11. Ogniskowa soczewki szklanej płasko-wypukłej o promieniu krzywizny 10 cm (współczynnik załamania światłą w szkle ma wartość 1,5) wynosi A. 5cm B. 10cm C. 15cm D. 20cm Zadanie 12. Łyżwiarz poruszający się z prędkością początkową o wartości 10m/s zatrzymał się po przebyciu odległości 25m. Zakładając, że jego ruch możemy traktować jako jednostajnie opóźniony możemy powiedzieć, że współczynnik tarcia łyżew o lód ma wartość około A. 0,02 B. 0,05 C. 0,2 D. 1,25
8 Zadanie 13. W odległości 5,1km od okrętu stojącego na morzu eksplodowała bomba lotnicza. Prędkość dźwięku w powietrzu wynosi 340m/s, a w wodzie 1500m/s. Czas, po którym hydrolokator usłyszał dźwięk eksplozji rozchodzący się pod wodą, w porównaniu z czasem, po którym usłyszał dźwięk eksplozji sygnalista znajdujący się na okręcie jest około A. 3,34 razy krótszy B. 4,4 razy krótszy C. 4,4 razy dłuższy D. 15 razy dłuższy Zadanie 14. Piłka spada swobodnie z wysokości 2m. Podczas zderzenia z ziemią piłka ta traci 1/4 swojej energii. Po odbiciu poleci na wysokość A. 0,5m B. 0,75m C. 1m D. 1,5m Zadanie 15. Rurka Meldego odwrócona jest do góry dnem. Jeśli ciśnienie atmosferyczne zwiększy się, to słupek rtęci A. podniesienie się do góry B. przesunie się w dół C. pozostanie w miejscu D. częściowo wyleci z rurki Zadanie 16. Zjawisko samoindukcji jest to A. powstanie napięcia w obwodzie na skutek zmiany natężenia prądu w tym obwodzie B. powstanie pola magnetycznego na skutek zmiany pola elektrycznego C. powstanie napięcia w obwodzie pod wpływem ziemskiego pola magnetycznego D. powstanie pola elektrycznego na skutek prądu płynącego w przewodniku Zadanie 17. Źródłem energii Słońca jest A. energia masy, ściskanej siłami grawitacji i zamienianej stopniowo w energię promienistą B. reakcja rozszczepienia jąder ciężkich pierwiastków (jak w elektrowni jądrowej) C. reakcje syntezy jąder wodoru i jego izotopów D. promieniowanie powstające w wyniku przejść elektronów pomiędzy orbitami atomów pierwiastków, występujących w Słońcu Zadanie 18. Tor ruchu pocisku wystrzelonego ukośnie do poziomu jest częścią A. okręgu B. paraboli C. hiperboli D. elipsy
9 Zadanie 19. Pojemność elektryczna kondensatora płaskiego nie zależy od A. pola powierzchni okładek B. odległości między okładkami C. napięcia między okładkami D. grubości izolatora znajdującego sie między okładkami Zadanie Jądro 27CO jest promieniotwórcze i przekształca się w jądro 28Ni emitując A. cząstkę alfa B. pozyton C. neutron D. elektron Zadanie 21. Aby czterokrotnie zwiększyć częstotliwość drgań struny gitary, należy nacisnąć ją palcem w miejscu powodującym skrócenie drgającej części struny o A. 1/5 długości B. 3/4 długości C. 1/4 długości D. 1/2 długości Zadanie 22. Ile razy w ciągu sekundy zmienia kierunek prąd elektryczny w prądnicy, której wirnik obraca się z częstotliwością 3000 obr/min między dwoma biegunami elektromagnesu? A. 10 B. 100 C D Zadanie 23. Jeśli przyjmiemy, że przyśpieszenie ziemskie wynosi 10m/s 2, to ciało rzucone w próżni, pionowo do góry, z prędkością początkową 72 km/h, osiągnie maksymalną wysokość po czasie równym A. 2 s B. 4 s C. 7,2 s D. 14,4 s
10 Zadanie 24. Na podstawie wykresu można stwierdzić, że A. p 1 = p 3, V 1 = V 2 B. T 2 = T 3, p 1 = p 2 C. V 1 = V 2, p 1 = p 2 D. T 1 = T 2, V 2 = V 3 Zadanie 25. Ciało drga ruchem harmonicznym o okresie drgań równym 3s. Od momentu przejścia przez położenie równowagi do chwili oddalenia się na odległość równą połowie amplitudy mija (czas) A. 3/8 s B. 3/4 s C. 1/4 s D. 3/2 s
Nazwy pierwiastków: ...
 Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
TEST Chemia 2017
 TEST 2017 EGZAMIN WSTĘPNY DO SZKÓŁ ASPIRANTÓW PAŃSTWOWEJ STRAŻY POŻARNEJ I CENTRALNEJ SZKOŁY PAŃSTWOWEJ STRAŻY POŻARNEJ KSZTAŁCĄCYCH W ZAWODZIE TECHNIK POŻARNICTWA Centralna Szkoła Państwowej Straży Pożarnej
TEST 2017 EGZAMIN WSTĘPNY DO SZKÓŁ ASPIRANTÓW PAŃSTWOWEJ STRAŻY POŻARNEJ I CENTRALNEJ SZKOŁY PAŃSTWOWEJ STRAŻY POŻARNEJ KSZTAŁCĄCYCH W ZAWODZIE TECHNIK POŻARNICTWA Centralna Szkoła Państwowej Straży Pożarnej
X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO X Konkurs Chemii Nieorganicznej i Ogólnej rok szkolny 2011/12 Imię i nazwisko Szkoła Klasa Nauczyciel Uzyskane punkty Zadanie 1. (10
VI Podkarpacki Konkurs Chemiczny 2013/2014
 VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
 PRACA KONTROLNA Z CHEMII NR 1 - Semestr I 1. (6 pkt) - Krótko napisz, jak rozumiesz następujące pojęcia: a/ liczba atomowa, b/ nuklid, c/ pierwiastek d/ dualizm korpuskularno- falowy e/promieniotwórczość
PRACA KONTROLNA Z CHEMII NR 1 - Semestr I 1. (6 pkt) - Krótko napisz, jak rozumiesz następujące pojęcia: a/ liczba atomowa, b/ nuklid, c/ pierwiastek d/ dualizm korpuskularno- falowy e/promieniotwórczość
MAŁOPOLSKI KONKURS CHEMICZNY
 Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu 8 października 2018 r. Etap I (szkolny) Wypełnia Szkolna
Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu 8 października 2018 r. Etap I (szkolny) Wypełnia Szkolna
XV Wojewódzki Konkurs z Chemii
 XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie) Kod ucznia Suma punktów Witamy Cię na trzecim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 6 marca 2015 r. zawody III stopnia (wojewódzkie) Kod ucznia Suma punktów Witamy Cię na trzecim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO kod Uzyskane punkty..... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII... DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2011/2012 eliminacje wojewódzkie
I Etap szkolny 16 listopada Imię i nazwisko ucznia: Arkusz zawiera 19 zadań. Liczba punktów możliwych do uzyskania: 39 pkt.
 XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego I Etap szkolny 16 listopada 2017
XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego I Etap szkolny 16 listopada 2017
WOJEWÓDZKI KONKURS CHEMICZNY
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 1.03.2019 R. 1. Test konkursowy zawiera 11 zadań. Są to zadania otwarte. Na ich rozwiązanie
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 1.03.2019 R. 1. Test konkursowy zawiera 11 zadań. Są to zadania otwarte. Na ich rozwiązanie
PODSTAWY STECHIOMETRII
 PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
PODSTAWY STECHIOMETRII 1. Obliczyć bezwzględne masy atomów, których względne masy atomowe wynoszą: a) 7, b) 35. 2. Obliczyć masę próbki wody zawierającej 3,01 10 24 cząsteczek. 3. Która z wymienionych
XXI KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY 2013/2014
 IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 24 maja 2014 Im. Jana Kasprowicza INOWROCŁAW XXI KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 24 maja 2014 Im. Jana Kasprowicza INOWROCŁAW XXI KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
EGZAMIN MATURALNY Z CHEMII
 1 ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE DO MOMENTU ROZPOCZĘCIA EGZAMINU! EGZAMIN MATURALNY Z CHEMII MCH P1 MARZEC ROK 2012 POZIOM podstawowy Czas pracy 120 minut Instrukcja dla zdającego 1. Sprawdź,
1 ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE DO MOMENTU ROZPOCZĘCIA EGZAMINU! EGZAMIN MATURALNY Z CHEMII MCH P1 MARZEC ROK 2012 POZIOM podstawowy Czas pracy 120 minut Instrukcja dla zdającego 1. Sprawdź,
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018. Eliminacje szkolne
 ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018 Eliminacje szkolne Podczas rozwiązywania zadań
ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW 2017/2018 Eliminacje szkolne Podczas rozwiązywania zadań
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW. Eliminacje rejonowe II stopień
 POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
MAŁOPOLSKI KONKURS CHEMICZNY
 Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 24 października 2018 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 Maksymalna liczba 1 2 1 6 4 9 2 Liczba
Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 24 października 2018 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 Maksymalna liczba 1 2 1 6 4 9 2 Liczba
Odpowiedź:. Oblicz stężenie procentowe tlenu w wodzie deszczowej, wiedząc, że 1 dm 3 tej wody zawiera 0,055g tlenu. (d wody = 1 g/cm 3 )
 PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I ... ... czas trwania: 90 min Nazwa szkoły
 V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
KONKURS CHEMICZNY DLA GIMNAZJUM ETAP WOJEWÓDZKI
 KONKURS HEMIZNY L GIMNZJUM ETP WOJEWÓZKI 2004 / 2005rok Zadanie 1. [1 pkt] Z podanych atomów pierwiastków wybierz ten, dla którego suma liczby protonów i liczby neutronów jest równa 38. 64 39 38 26 38
KONKURS HEMIZNY L GIMNZJUM ETP WOJEWÓZKI 2004 / 2005rok Zadanie 1. [1 pkt] Z podanych atomów pierwiastków wybierz ten, dla którego suma liczby protonów i liczby neutronów jest równa 38. 64 39 38 26 38
KONKURS CHEMICZNY DLA UCZNIÓW SZKOŁY PODSTAWOWEJ ROK SZKOLNY 2018/2019 ETAP REJONOWY
 Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa Szkoły KONKURS CHEMICZNY Uzyskane punkty DLA UCZNIÓW SZKOŁY PODSTAWOWEJ Informacje: ROK
Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa Szkoły KONKURS CHEMICZNY Uzyskane punkty DLA UCZNIÓW SZKOŁY PODSTAWOWEJ Informacje: ROK
1. Podstawowe prawa i pojęcia chemiczne
 1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
TEST Chemia. odpowiedzi i rozwiązania dostępne na
 TEST 2016 EGZAMIN WSTĘPNY DO SZKÓŁ ASPIRANTÓW PAŃSTWOWEJ STRAŻY POŻARNEJ I CENTRALNEJ SZKOŁY PAŃSTWOWEJ STRAŻY POŻARNEJ KSZTAŁCĄCYCH W ZAWODZIE TECHNIK POŻARNICTWA Centralna Szkoła Państwowej Straży Pożarnej
TEST 2016 EGZAMIN WSTĘPNY DO SZKÓŁ ASPIRANTÓW PAŃSTWOWEJ STRAŻY POŻARNEJ I CENTRALNEJ SZKOŁY PAŃSTWOWEJ STRAŻY POŻARNEJ KSZTAŁCĄCYCH W ZAWODZIE TECHNIK POŻARNICTWA Centralna Szkoła Państwowej Straży Pożarnej
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA
 SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów szkół podstawowych województwa śląskiego w roku szkolnym 2018/2019
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów szkół podstawowych województwa śląskiego w roku szkolnym 2018/2019 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów możliwa
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów szkół podstawowych województwa śląskiego w roku szkolnym 2018/2019 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów możliwa
g % ,3%
 PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE. STECHIOMETRIA 1. Obliczyć ile moli stanowi: a) 2,5 g Na; b) 54 g Cl 2 ; c) 16,5 g N 2 O 5 ; d) 160 g CuSO 4 5H 2 O? 2. Jaka jest masa: a) 2,4 mola Na; b) 0,25 mola
PRÓBNY EGZAMIN MATURALNY Z CHEMII
 ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE DO MOMENTU ROZPOCZĘCIA EGZAMINU! Miejsce na naklejkę MCH-P1_1P-091 PRÓBNY EGZAMIN MATURALNY Z CHEMII STYCZEŃ ROK 2009 POZIOM PODSTAWOWY Czas pracy 120 minut
ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE DO MOMENTU ROZPOCZĘCIA EGZAMINU! Miejsce na naklejkę MCH-P1_1P-091 PRÓBNY EGZAMIN MATURALNY Z CHEMII STYCZEŃ ROK 2009 POZIOM PODSTAWOWY Czas pracy 120 minut
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego. II Etap - 18 stycznia 2016
 XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
KONKURS CHEMICZNY ETAP WOJEWÓDZKI 2010/2011
 KOD UCZNIA. INSTRUKCJA DLA UCZNIA Czas trwania konkursu 90 minut. 1. Przeczytaj uważnie instrukcje i postaraj się prawidłowo odpowiedzieć na wszystkie pytania. 2. Przed tobą test składający się z 18 zadań:
KOD UCZNIA. INSTRUKCJA DLA UCZNIA Czas trwania konkursu 90 minut. 1. Przeczytaj uważnie instrukcje i postaraj się prawidłowo odpowiedzieć na wszystkie pytania. 2. Przed tobą test składający się z 18 zadań:
MARATON WIEDZY CHEMIA CZ. II
 MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
WOJEWÓDZKI KONKURS CHEMICZNY
 Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 30.10.2018 r. 1. Test konkursowy zawiera 22 zadania. Są to zadania
Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 30.10.2018 r. 1. Test konkursowy zawiera 22 zadania. Są to zadania
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII
 KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin: 16.03. 2010 r. godz. 10 00 Czas pracy: 90 minut ETAP III Ilość punktów za rozwiązanie zadań Część I Część II Część III numer zadania numer
KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin: 16.03. 2010 r. godz. 10 00 Czas pracy: 90 minut ETAP III Ilość punktów za rozwiązanie zadań Część I Część II Część III numer zadania numer
PRÓBNY EGZAMIN MATURALNY Z CHEMII
 ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE DO MOMENTU ROZPOCZĘCIA EGZAMINU! Miejsce na naklejkę KOD ZDAJĄCEGO Wypełnia zespół nadzorujący PESEL ZDAJĄCEGO MCH-P1_4P-091 PRÓBNY EGZAMIN MATURALNY Z CHEMII
ARKUSZ ZAWIERA INFORMACJE PRAWNIE CHRONIONE DO MOMENTU ROZPOCZĘCIA EGZAMINU! Miejsce na naklejkę KOD ZDAJĄCEGO Wypełnia zespół nadzorujący PESEL ZDAJĄCEGO MCH-P1_4P-091 PRÓBNY EGZAMIN MATURALNY Z CHEMII
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE
 PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
PODSTAWOWE POJĘCIA I PRAWA CHEMICZNE Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Jaka jest średnia masa atomowa miedzi stanowiącej mieszaninę izotopów,
2. Podczas spalania 2 objętości pewnego gazu z 4 objętościami H 2 otrzymano 1 objętość N 2 i 4 objętości H 2O. Jaki gaz uległ spalaniu?
 1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
Chemia nieorganiczna Zadanie Poziom: podstawowy
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks
 Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
Główne zagadnienia: - mol, stechiometria reakcji, pisanie równań reakcji w sposób jonowy - stężenia, przygotowywanie roztworów - ph - reakcje redoks 1. Która z próbek o takich samych masach zawiera najwięcej
2.4. ZADANIA STECHIOMETRIA. 1. Ile moli stanowi:
 2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
2.4. ZADANIA 1. Ile moli stanowi: STECHIOMETRIA a/ 52 g CaCO 3 b/ 2,5 tony Fe(OH) 3 2. Ile g stanowi: a/ 4,5 mmol ZnSO 4 b/ 10 kmol wody 3. Obl. % skład Fe 2 (SO 4 ) 3 6H 2 O 4. Obl. % zawartość tlenu
Część I. TEST WYBORU 18 punktów
 Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.
![Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.](/thumbs/100/143872318.jpg) Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
VIII Podkarpacki Konkurs Chemiczny 2015/2016
 III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap rejonowy rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap rejonowy rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW. Eliminacje rejonowe II stopień
 POUFNE Pieczątka szkoły 17 stycznia 2018 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko Szkoła (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2017/2018 Eliminacje
POUFNE Pieczątka szkoły 17 stycznia 2018 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko Szkoła (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2017/2018 Eliminacje
6. ph i ELEKTROLITY. 6. ph i elektrolity
 6. ph i ELEKTROLITY 31 6. ph i elektrolity 6.1. Oblicz ph roztworu zawierającego 0,365 g HCl w 1,0 dm 3 roztworu. Odp 2,00 6.2. Oblicz ph 0,0050 molowego roztworu wodorotlenku baru (α = 1,00). Odp. 12,00
6. ph i ELEKTROLITY 31 6. ph i elektrolity 6.1. Oblicz ph roztworu zawierającego 0,365 g HCl w 1,0 dm 3 roztworu. Odp 2,00 6.2. Oblicz ph 0,0050 molowego roztworu wodorotlenku baru (α = 1,00). Odp. 12,00
Zadanie 4. Mrówczan metylu ma taki sam wzór sumaryczny jak: A. octan etylu. C. kwas mrówkowy. B. octan metylu. D. kwas octowy.
 Pieczęć KONKURS CHEMICZNY dla uczniów gimnazjów województwa lubuskiego 3 marca 2011 r. zawody III stopnia (wojewódzkie) Witamy Cię na trzecim etapie Konkursu Chemicznego. Przed przystąpieniem do rozwiązywania
Pieczęć KONKURS CHEMICZNY dla uczniów gimnazjów województwa lubuskiego 3 marca 2011 r. zawody III stopnia (wojewódzkie) Witamy Cię na trzecim etapie Konkursu Chemicznego. Przed przystąpieniem do rozwiązywania
ARKUSZ 1 POWTÓRZENIE DO EGZAMINU Z CHEMII
 ARKUSZ 1 POWTÓRZENIE DO EGZAMINU Z CHEMII Zadanie 1. Na rysunku przedstawiono fragment układu okresowego pierwiastków. Dokoocz zdania tak aby były prawdziwe. Wiązanie jonowe występuje w związku chemicznym
ARKUSZ 1 POWTÓRZENIE DO EGZAMINU Z CHEMII Zadanie 1. Na rysunku przedstawiono fragment układu okresowego pierwiastków. Dokoocz zdania tak aby były prawdziwe. Wiązanie jonowe występuje w związku chemicznym
11) Stan energetyczny elektronu w atomie kwantowanym jest zespołem : a dwóch liczb kwantowych b + czterech liczb kwantowych c nie jest kwantowany
 PYTANIA EGZAMINACYJNE Z CHEMII OGÓLNEJ I Podstawowe pojęcia chemiczne 1) Pierwiastkiem nazywamy : a zbiór atomów o tej samej liczbie masowej b + zbiór atomów o tej samej liczbie atomowej c zbiór atomów
PYTANIA EGZAMINACYJNE Z CHEMII OGÓLNEJ I Podstawowe pojęcia chemiczne 1) Pierwiastkiem nazywamy : a zbiór atomów o tej samej liczbie masowej b + zbiór atomów o tej samej liczbie atomowej c zbiór atomów
Test kompetencji z chemii do liceum. Grupa A.
 Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap szkolny rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap szkolny rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
Przemiany substancji
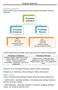 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2012/2013
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2012/2013 KOD UCZNIA etap: data: czas pracy: szkolny 28 listopada 2012 r. 90 minut Informacje dla ucznia
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2012/2013 KOD UCZNIA etap: data: czas pracy: szkolny 28 listopada 2012 r. 90 minut Informacje dla ucznia
III Podkarpacki Konkurs Chemiczny 2010/2011. ETAP I r. Godz Zadanie 1
 III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów dotychczasowych gimnazjów województwa śląskiego w roku szkolnym 2017/2018
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów dotychczasowych gimnazjów województwa śląskiego w roku szkolnym 2017/2018 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów dotychczasowych gimnazjów województwa śląskiego w roku szkolnym 2017/2018 PRZYKŁADOWE ROZWIĄZANIA ZADAŃ I SCHEMAT PUNKTOWANIA Maksymalna liczba punktów
WOJEWÓDZKI KONKURS CHEMICZNY
 Kod ucznia Liczba punktów WOJWÓDZKI KONKURS CHMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2014/2015 16 STYCZNIA 2015 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte. Na ich rozwiązanie
Kod ucznia Liczba punktów WOJWÓDZKI KONKURS CHMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2014/2015 16 STYCZNIA 2015 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte. Na ich rozwiązanie
Kuratorium Oświaty w Lublinie
 Kuratorium Oświaty w Lublinie KOD UCZNIA ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 ETAP WOJEWÓDZKI Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
Kuratorium Oświaty w Lublinie KOD UCZNIA ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 ETAP WOJEWÓDZKI Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
PRZEDMIOTOWY KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM. SCHEMAT OCENIANIA etap wojewódzki
 PRZEDMIOTOWY KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM SCHEMAT OCENIANIA etap wojewódzki 1. Ogólne zasady oceniania Uczeń otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom
PRZEDMIOTOWY KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM SCHEMAT OCENIANIA etap wojewódzki 1. Ogólne zasady oceniania Uczeń otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom
2. Procenty i stężenia procentowe
 2. PROCENTY I STĘŻENIA PROCENTOWE 11 2. Procenty i stężenia procentowe 2.1. Oblicz 15 % od liczb: a. 360, b. 2,8 10 5, c. 0.024, d. 1,8 10 6, e. 10 Odp. a. 54, b. 4,2 10 4, c. 3,6 10 3, d. 2,7 10 7, e.
2. PROCENTY I STĘŻENIA PROCENTOWE 11 2. Procenty i stężenia procentowe 2.1. Oblicz 15 % od liczb: a. 360, b. 2,8 10 5, c. 0.024, d. 1,8 10 6, e. 10 Odp. a. 54, b. 4,2 10 4, c. 3,6 10 3, d. 2,7 10 7, e.
Zadania dodatkowe z konwersatorium z podstaw chemii Semestr letni, rok akademicki 2012/2013
 Zadania dodatkowe z konwersatorium z podstaw chemii Semestr letni, rok akademicki 2012/2013 Gazy. Jednostki ciśnienia. Podstawowe prawa gazowe 1. Jakie ciśnienie będzie panowało w oponie napompowanej w
Zadania dodatkowe z konwersatorium z podstaw chemii Semestr letni, rok akademicki 2012/2013 Gazy. Jednostki ciśnienia. Podstawowe prawa gazowe 1. Jakie ciśnienie będzie panowało w oponie napompowanej w
Obliczenia chemiczne. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Obliczenia chemiczne Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 STĘŻENIA ROZTWORÓW Stężenia procentowe Procent masowo-masowy (wagowo-wagowy) (% m/m) (% w/w) liczba gramów substancji rozpuszczonej
Obliczenia chemiczne Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny 1 STĘŻENIA ROZTWORÓW Stężenia procentowe Procent masowo-masowy (wagowo-wagowy) (% m/m) (% w/w) liczba gramów substancji rozpuszczonej
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2018/2019 ETAP REJONOWY
 Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa szkoły KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2018/2019 ETAP REJONOWY Uzyskane
Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa szkoły KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2018/2019 ETAP REJONOWY Uzyskane
Kuratorium Oświaty w Lublinie
 Kuratorium Oświaty w Lublinie ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 KOD UCZNIA ETAP OKRĘGOWY Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
Kuratorium Oświaty w Lublinie ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 KOD UCZNIA ETAP OKRĘGOWY Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów. 07 marca 2019 r. zawody III stopnia (wojewódzkie)
 Kod ucznia Suma punktów Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 07 marca 2019 r. zawody III stopnia (wojewódzkie) Witamy Cię na trzecim etapie konkursu chemicznego. Podczas
Kod ucznia Suma punktów Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 07 marca 2019 r. zawody III stopnia (wojewódzkie) Witamy Cię na trzecim etapie konkursu chemicznego. Podczas
DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2013/2014 STOPIEŃ WOJEWÓDZKI
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2013/2014 10.03.2014 1. Test konkursowy zawiera 20 zadań. Są to zadania zamknięte i otwarte. Na ich rozwiązanie
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2013/2014 10.03.2014 1. Test konkursowy zawiera 20 zadań. Są to zadania zamknięte i otwarte. Na ich rozwiązanie
KONKURS CHEMICZNY ROK PRZED MATURĄ
 WYDZIAŁ CHEMII UMCS POLSKIE TOWARZYSTWO CHEMICZNE ODDZIAŁ LUBELSKI DORADCA METODYCZNY DS. NAUCZANIA CHEMII W LUBLINIE LUBELSKIE SAMORZĄDOWE CENTRUM DOSKONALENIA NAUCZYCIELI ODDZIAŁ W ZAMOŚCIU KONKURS CHEMICZNY
WYDZIAŁ CHEMII UMCS POLSKIE TOWARZYSTWO CHEMICZNE ODDZIAŁ LUBELSKI DORADCA METODYCZNY DS. NAUCZANIA CHEMII W LUBLINIE LUBELSKIE SAMORZĄDOWE CENTRUM DOSKONALENIA NAUCZYCIELI ODDZIAŁ W ZAMOŚCIU KONKURS CHEMICZNY
Powiatowy Konkurs Chemiczny dla Gimnazjalistów Młody Chemik. Drogi gimnazjalisto!
 KOD UCZNIA:.. Powiatowy Konkurs Chemiczny dla Gimnazjalistów Młody Chemik Drogi gimnazjalisto! 1. Przed Tobą zestaw 22 zadań konkursowych, za rozwiązanie których możesz uzyskać 35 punktów. 2. Na rozwiązanie
KOD UCZNIA:.. Powiatowy Konkurs Chemiczny dla Gimnazjalistów Młody Chemik Drogi gimnazjalisto! 1. Przed Tobą zestaw 22 zadań konkursowych, za rozwiązanie których możesz uzyskać 35 punktów. 2. Na rozwiązanie
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru
 1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Chemia Grudzień Styczeń
 Chemia Grudzień Styczeń Klasa VII IV. Łączenie się atomów. Równania reakcji chemicznych 1. Wiązania kowalencyjne 2. Wiązania jonowe 3. Wpływ rodzaju wiązania na właściwości substancji 4. Elektroujemność
Chemia Grudzień Styczeń Klasa VII IV. Łączenie się atomów. Równania reakcji chemicznych 1. Wiązania kowalencyjne 2. Wiązania jonowe 3. Wpływ rodzaju wiązania na właściwości substancji 4. Elektroujemność
MAŁOPOLSKI KONKURS CHEMICZNY. dla uczniów szkół podstawowych. 25 października 2019 r. Etap I (szkolny)
 Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 25 października 2019 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 8 9 10 Maksymalna 2 2 2 1 4 1 2 1
Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 25 października 2019 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 8 9 10 Maksymalna 2 2 2 1 4 1 2 1
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
Kod ucznia Liczba punktów A X B C X
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 18 STYCZNIA 2016 R. 1. Test konkursowy zawiera 19 zadań. Są to zadania zamknięte i otwarte. Na ich
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 18 STYCZNIA 2016 R. 1. Test konkursowy zawiera 19 zadań. Są to zadania zamknięte i otwarte. Na ich
Nazwy pierwiastków: A +Fe 2(SO 4) 3. Wzory związków: A B D. Równania reakcji:
 Zadanie 1. [0-3 pkt] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Suma protonów i elektronów anionu X 2- jest równa 34. II. Stosunek masowy
Zadanie 1. [0-3 pkt] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Suma protonów i elektronów anionu X 2- jest równa 34. II. Stosunek masowy
TEST Chemia. odpowiedzi i rozwiązania dostępne na
 TEST 2004 EGZAMIN WSTĘPNY DO SZKÓŁ ASPIRANTÓW PAŃSTWOWEJ STRAŻY POŻARNEJ I CENTRALNEJ SZKOŁY PAŃSTWOWEJ STRAŻY POŻARNEJ KSZTAŁCĄCYCH W ZAWODZIE TECHNIK POŻARNICTWA Centralna Szkoła Państwowej Straży Pożarnej
TEST 2004 EGZAMIN WSTĘPNY DO SZKÓŁ ASPIRANTÓW PAŃSTWOWEJ STRAŻY POŻARNEJ I CENTRALNEJ SZKOŁY PAŃSTWOWEJ STRAŻY POŻARNEJ KSZTAŁCĄCYCH W ZAWODZIE TECHNIK POŻARNICTWA Centralna Szkoła Państwowej Straży Pożarnej
Szkolny konkurs chemiczny Grupa B. Czas pracy 80 minut
 Szkolny konkurs chemiczny Grupa B Czas pracy 80 minut Piła 1 czerwca 2017 1 Zadanie 1. (0 3) Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie: elektrony rozmieszczone
Szkolny konkurs chemiczny Grupa B Czas pracy 80 minut Piła 1 czerwca 2017 1 Zadanie 1. (0 3) Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie: elektrony rozmieszczone
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap rejonowy rok szkolny 2011/2012 wylosowany numer uczestnika konkursu Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap rejonowy rok szkolny 2011/2012 wylosowany numer uczestnika konkursu Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII
 KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin 20.01.2010 r. godz. 9 00 Czas pracy: 90 minut ETAP II Ilość punktów za rozwiązanie zadań Część I Część II Ilość punktów za zadanie Ilość punktów
KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin 20.01.2010 r. godz. 9 00 Czas pracy: 90 minut ETAP II Ilość punktów za rozwiązanie zadań Część I Część II Ilość punktów za zadanie Ilość punktów
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW. Eliminacje rejonowe II stopień
 POUFNE Pieczątka szkoły 10 stycznia 2017 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko Szkoła (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2016/2017 Eliminacje
POUFNE Pieczątka szkoły 10 stycznia 2017 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko Szkoła (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2016/2017 Eliminacje
Zadanie 2. [3 pkt.] Podaj wzory trzech związków o budowie jonowej, w których wszystkie kationy i aniony tworzące te związki mają po 18 elektronów.
![Zadanie 2. [3 pkt.] Podaj wzory trzech związków o budowie jonowej, w których wszystkie kationy i aniony tworzące te związki mają po 18 elektronów. Zadanie 2. [3 pkt.] Podaj wzory trzech związków o budowie jonowej, w których wszystkie kationy i aniony tworzące te związki mają po 18 elektronów.](/thumbs/99/142182583.jpg) 2 Zadanie 1. [2 pkt.] Uzupełnij poniższe zdania. Podkreśl właściwe określenie spośród wymienionych w każdym nawiasie. Elektroujemność aktywnych metali jest (wyższa/niższa) od elektroujemności aktywnych
2 Zadanie 1. [2 pkt.] Uzupełnij poniższe zdania. Podkreśl właściwe określenie spośród wymienionych w każdym nawiasie. Elektroujemność aktywnych metali jest (wyższa/niższa) od elektroujemności aktywnych
EGZAMIN MATURALNY Z CHEMII
 Miejsce na naklejkę z kodem (Wpisuje zdający przed rozpoczęciem pracy) KOD ZDAJĄCEGO MCH-W1D1P-021 EGZAMIN MATURALNY Z CHEMII Instrukcja dla zdającego Czas pracy 90 minut 1. Proszę sprawdzić, czy arkusz
Miejsce na naklejkę z kodem (Wpisuje zdający przed rozpoczęciem pracy) KOD ZDAJĄCEGO MCH-W1D1P-021 EGZAMIN MATURALNY Z CHEMII Instrukcja dla zdającego Czas pracy 90 minut 1. Proszę sprawdzić, czy arkusz
Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem
 Hospitacja diagnozująca Źródła informacji chemicznej Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem Opracowała: mgr Lilla Zmuda Matyja Arkusz Hospitacji Diagnozującej nr
Hospitacja diagnozująca Źródła informacji chemicznej Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem Opracowała: mgr Lilla Zmuda Matyja Arkusz Hospitacji Diagnozującej nr
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII
 KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin: 12 marzec 2008 r. godz. 10 00 Czas pracy: 90 minut ETAP III Ilość punktów za rozwiązanie zadań Część I Część II Część III Numer zadania 1
KOD UCZNIA... WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII Termin: 12 marzec 2008 r. godz. 10 00 Czas pracy: 90 minut ETAP III Ilość punktów za rozwiązanie zadań Część I Część II Część III Numer zadania 1
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2010/2011
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2010/2011 KOD UCZNIA Etap: Data: Czas pracy: szkolny 22 listopad 2010 90 minut Informacje dla ucznia:
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2010/2011 KOD UCZNIA Etap: Data: Czas pracy: szkolny 22 listopad 2010 90 minut Informacje dla ucznia:
TEST 2014. Chemia. odpowiedzi i rozwiązania dostępne na www.testysapsp.pl
 TEST 2014 EGZAMIN WSTĘPNY DO SZKÓŁ ASPIRANTÓW PAŃSTWOWEJ STRAŻY POŻARNEJ I CENTRALNEJ SZKOŁY PAŃSTWOWEJ STRAŻY POŻARNEJ KSZTAŁCĄCYCH W ZAWODZIE TECHNIK POŻARNICTWA Centralna Szkoła Państwowej Straży Pożarnej
TEST 2014 EGZAMIN WSTĘPNY DO SZKÓŁ ASPIRANTÓW PAŃSTWOWEJ STRAŻY POŻARNEJ I CENTRALNEJ SZKOŁY PAŃSTWOWEJ STRAŻY POŻARNEJ KSZTAŁCĄCYCH W ZAWODZIE TECHNIK POŻARNICTWA Centralna Szkoła Państwowej Straży Pożarnej
VII Podkarpacki Konkurs Chemiczny 2014/2015
 II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
WOJEWÓDZKI KONKURS CHEMICZNY
 Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2017/2018 15.11.2017 R. 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte.
Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2017/2018 15.11.2017 R. 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte.
Sprawdzian 2. CHEMIA. Przed próbną maturą. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34. Imię i nazwisko ...
 CHEMIA Przed próbną maturą Sprawdzian 2. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34 Imię i nazwisko... Liczba punktów Procent 2 Informacja do zadań 1 i 2. Naturalny chlor występuje
CHEMIA Przed próbną maturą Sprawdzian 2. (poziom rozszerzony) Czas pracy: 90 minut Maksymalna liczba punktów: 34 Imię i nazwisko... Liczba punktów Procent 2 Informacja do zadań 1 i 2. Naturalny chlor występuje
Konkurs przedmiotowy z chemii dla uczniów szkół podstawowych
 Kod ucznia Konkurs przedmiotowy z chemii dla uczniów szkół podstawowych Suma punktów 13 marca 2019 r. zawody III stopnia (wojewódzkie) Witamy Cię na trzecim etapie konkursu chemicznego. Podczas rozwiązywania
Kod ucznia Konkurs przedmiotowy z chemii dla uczniów szkół podstawowych Suma punktów 13 marca 2019 r. zawody III stopnia (wojewódzkie) Witamy Cię na trzecim etapie konkursu chemicznego. Podczas rozwiązywania
Pożarnicza Strona Firemana
 Test egzaminacyjny na Dzienne Studium w Szkołach Aspirantów PSP 2004 rok Fizyka 1. Ciało o masie 2 kg, pod działaniem siły 5 N, porusza się z przyśpieszeniem równym: a. 0,4 m/s 2 b. 2,5 m/s 2 c. 10 m/s
Test egzaminacyjny na Dzienne Studium w Szkołach Aspirantów PSP 2004 rok Fizyka 1. Ciało o masie 2 kg, pod działaniem siły 5 N, porusza się z przyśpieszeniem równym: a. 0,4 m/s 2 b. 2,5 m/s 2 c. 10 m/s
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów. 07 marca 2019 r. zawody III stopnia (wojewódzkie) Schemat punktowania zadań
 Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 07 marca 2019 r. zawody III stopnia (wojewódzkie) Schemat punktowania zadań Maksymalna liczba punktów 40. 90% 36 pkt. Uwaga! 1. Wszystkie
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 07 marca 2019 r. zawody III stopnia (wojewódzkie) Schemat punktowania zadań Maksymalna liczba punktów 40. 90% 36 pkt. Uwaga! 1. Wszystkie
MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA
 MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA Zadanie Odpowiedzi Uwagi a) za uzupełnienie tabeli: Symbol pierwiastka Konfiguracja elektronowa w stanie podstawowym Liczba elektronów walencyjnych S b) za uzupełnienie
MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA Zadanie Odpowiedzi Uwagi a) za uzupełnienie tabeli: Symbol pierwiastka Konfiguracja elektronowa w stanie podstawowym Liczba elektronów walencyjnych S b) za uzupełnienie
WOJEWÓDZKI KONKURS CHEMICZNY
 WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013 STOPIEŃ WOJEWÓDZKI KOD UCZNIA. INSTRUKCJA DLA UCZNIA Czas trwania konkursu 90 minut. 1.Przeczytaj uważnie instrukcje i postaraj
WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013 STOPIEŃ WOJEWÓDZKI KOD UCZNIA. INSTRUKCJA DLA UCZNIA Czas trwania konkursu 90 minut. 1.Przeczytaj uważnie instrukcje i postaraj
Zadanie: 1 (1 pkt) Oblicz stężenie molowe jonów OH w roztworze otrzymanym przez rozpuszczenie 12g NaOH w wodzie i rozcieńczonego do 250cm 3
 Zadanie: 1 (1 pkt) Oblicz stężenie molowe jonów OH w roztworze otrzymanym przez rozpuszczenie 12g NaOH w wodzie i rozcieńczonego do 250cm 3 Zadanie: 2 (1 pkt) Do 20cm 3 20% roztworu kwasu solnego o gęstości
Zadanie: 1 (1 pkt) Oblicz stężenie molowe jonów OH w roztworze otrzymanym przez rozpuszczenie 12g NaOH w wodzie i rozcieńczonego do 250cm 3 Zadanie: 2 (1 pkt) Do 20cm 3 20% roztworu kwasu solnego o gęstości
Model odpowiedzi i schemat oceniania arkusza I
 Model odpowiedzi i schemat oceniania arkusza I Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Gdy do jednego polecenia zdający poda dwie
Model odpowiedzi i schemat oceniania arkusza I Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Gdy do jednego polecenia zdający poda dwie
Dysocjacja elektrolityczna, przewodność elektryczna roztworów
 tester woda destylowana tester Ćwiczenie 1a woda wodociągowa tester 5% roztwór cukru tester 0,1 M HCl tester 0,1 M CH 3 COOH tester 0,1 M tester 0,1 M NH 4 OH tester 0,1 M NaCl Dysocjacja elektrolityczna,
tester woda destylowana tester Ćwiczenie 1a woda wodociągowa tester 5% roztwór cukru tester 0,1 M HCl tester 0,1 M CH 3 COOH tester 0,1 M tester 0,1 M NH 4 OH tester 0,1 M NaCl Dysocjacja elektrolityczna,
Przykładowy zestaw zadań z chemii Odpowiedzi i schemat punktowania poziom podstawowy
 ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM PODSTAWOWY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania zadań, uwzględniające
ODPOWIEDZI I SCHEMAT PUNKTOWANIA POZIOM PODSTAWOWY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Poprawne rozwiązania zadań, uwzględniające
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
XI Ogólnopolski Podkarpacki Konkurs Chemiczny 2018/2019. ETAP I r. Godz Zadanie 1 (10 pkt)
 XI Ogólnopolski Podkarpacki Konkurs Chemiczny 2018/2019 ETAP I 9.11.2018 r. Godz. 10.00-12.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. KOPKCh 27 Zadanie 1 (10 pkt) 1. W atomie glinu ( 1Al)
XI Ogólnopolski Podkarpacki Konkurs Chemiczny 2018/2019 ETAP I 9.11.2018 r. Godz. 10.00-12.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. KOPKCh 27 Zadanie 1 (10 pkt) 1. W atomie glinu ( 1Al)
