Chemia Grudzień Styczeń
|
|
|
- Teresa Czyż
- 6 lat temu
- Przeglądów:
Transkrypt
1 Chemia Grudzień Styczeń Klasa VII IV. Łączenie się atomów. Równania reakcji chemicznych 1. Wiązania kowalencyjne 2. Wiązania jonowe 3. Wpływ rodzaju wiązania na właściwości substancji 4. Elektroujemność pierwiastków. Skala elektroujemności według Paulinga 5. Znaczenie wartościowości pierwiastków chemicznych przy ustalaniu wzorów i nazw związków chemicznych 6. Prawo stałości składu związków chemicznych. (Prawo Prousta) 7. Prawo zachowania masy 8. Równania reakcji chemicznych 9. Obliczenia stechiometryczne - obliczanie masy cząsteczkowej związku - obliczanie zawartości % pierwiastków w związkach chemicznych. - stosunek masowy (wagowy) pierwiastków w związkach chemicznych. - zadania na zastosowanie prawa zachowania masy - zadania na zastosowanie prawa stałości składu.
2 Zadania do rozwiązania z ćwiczeń dla kl. VII wyd. Nowa Era Wiązania kowalencyjne Zad. 1 str. 64 Zaznacz poprawne uzupełnienia zdań, tak aby powstały prawdziwe informacje. Podczas tworzenia się wiązania kowalencyjnego atomy łączą się za pomocą A / B. Dążą wówczas do uzyskania C / D lub E / F elektronowego, aby mieć konfigurację elektronową najbliższego G / H. Zad. 2 str. 64 Uzupełnij tabelę oraz odpowiedz na pytanie. Nazwa pierwiastka chlor fosfor siarka wodór Symbol pierwiastka Liczba elektronów walencyjnych Symbol chemiczny gazu szlachetnego, do którego konfiguracji elektronowej dąży atom Elektroujemność Zad. 3 str. 65 Uzupełnij tabelę. Wzór sumaryczny związku HCl NH 3 H 2 S CO 2 Wzór elektronowy związku Różnica elektroujemności Przesunięcie wspólnej pary elektronowej bliżej atomu
3 Zad. 4 str. 65 woda * fluor * tlenek węgla (IV) * tlen * amoniak * jodowodór * azot * chlor niespolaryzowane Wiązanie kowalencyjne spolaryzowane Uzasadnienie: W substancjach... występują wiązania kowalencyjne niespolaryzowane, ponieważ.... Natomiast w substancjach... występują wiązania kowalencyjne spolaryzowane ponieważ.... Wiązania jonowe Zad. 5 str. 66 Podkreśl wzory substancji, w których występuje wiązanie jonowe. H 2 CaCl 2 HBr O 2 NaCl CO 2 PH 3 F 2 H 2 S K 2 O Zad. 8 str. 66 Uzupełnij tabele. a) Symbol chemiczny jonu Liczba protonów neutronów elektronów Ładunek jonu S b) Nazwa związku chlorek sodu Symbole pierwiastków w związku chemicznym Liczba elektronów walencyjnych oddanych przyjętych Symbole jonów Wzór sumaryczny związku Na NaCl Cl Cl - siarczek magnezu
4 Znaczenie wartościowości pierwiastków przy ustalaniu wzorów chemicznych Zad. 13 st. 68 a) Oceń prawdziwość podanych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, lub F - jeśli jest fałszywe. 1. W przypadku wiązania kowalencyjnego wartościowość to liczba wiązań, za P F pomocą których atomy łączą się ze sobą. 2. Wartościowość pierwiastków chemicznych grup głównych jest zawsze równa P F numerowi grupy. 3. Wartościowość siarki w siarczkach wynosi II, a chloru w chlorkach I. P F 4. Pierwiastki chemiczne w stanie wolnym nie mają wartościowości. P F b) Wpisz w kratki wartościowość pierwiastków chemicznych w związkach o podanych wzorach sumarycznych. Na 2 O AlCl 3 BaS CH 4 CrO 3 ZnCl 2 PH 3 I 2 O 5 PbO 2 Zad. 14 str. 69 Dopisz brakujące wartościowości pierwiastków oraz indeksy stechiometryczne, tak Aby powstał poprawny wzór sumaryczny związku. I IV VI I II K O Sn Cl S O Na S Ca Cl II III I II III Fe O Al S Ag O H S Fe Cl Zad. 16 str. 69 Uzupełnij tabelę. Zapis Sposób odczytywania Liczba atomów każdego z pierwiastków chemicznych N 2 jedna cząsteczka azotu dwa atomy azotu 7 N trzy cząsteczki azotu 2 As 2 O 3
5 Zad. 17 str. 69 Napisz nazwy systematyczne lub wzory sumaryczne związków chemicznych o podanych wzorach lub nazwach. Jeżeli pierwiastek chemiczny ma więcej niż jedną wartościowość, należy to uwzględnić w nazwie. Li 2 O - Cl 2 O - ZnS - FeO - Cu 2 O - chlorek magnezu - tlenek żelaza (III) - siarczek potasu - tlenek chloru (III) - chlorek sodu - Prawo stałości składu Zad. 23 str. 71 Nazwa systematyczna związku Tlenek azotu (I) Tlenek azotu (V) Wzór sumaryczny NO Zawartość procentowa azotu tlenu 30,34 % N azot 14,007 15P fosfor 8O tlen 15,999 16S siarka
6 Zad. 24 str.72 Oblicz stosunek mas pierwiastków chemicznych w tlenku strontu wiedząc, że powstał on Z 88 g strontu i 16 g tlenu. Krok 1 Przeczytaj treść zadania i wpisz dane i szukane. Krok 2 Oblicz stosunek masy strontu do masy tlenu w SrO. Krok 3 Napisz odpowiedź. Zad. 25 str.72 Oblicz skład procentowy pierwiastków w związku chemicznym o wzorze sumarycznym K 2 Cr 2 O 7. Podaj wynik z dokładnością do jednego miejsca po przecinku. Zad.25,26 str. 72 Zad. 30 str. 73 Równania reakcji chemicznych
7 Zad. 26 str.72 W pewnym tlenku siarki zawartość procentowa tlenu wynosi 60%. Oblicz stosunek masowy siarki do tlenu w tym związku chemicznym i napisz wzór sumaryczny tego tlenku. Zad. 30 str.73 W reakcji chemicznej, w której uzyto 8g wapnia i 18g tlenu, powstał tlenek wapnia. Sprawdź, czy pierwiastki chemiczne przereagowały całkowicie.
8 Zad. 33 str. 75 Uzupełnij równania reakcji chemicznych, wpisując odpowiedni symbol pierwiastka Chemicznego lub wzór cząsteczki. Następnie zaznacz reakcje syntezy. a) 4 + O 2 2Ag 2 O b) 2 Mg + 2 MgO c) CuO + H 2 Cu + d) 2 + CO 2 2 MgO + C Zad.34 str. 75 Wpisz brakującą wartość współczynnika stechiometrycznego w każdej reakcji chemicznej. Następnie podkreśl reakcje analizy. a) N 2 + O 2 NO b) 2 HgO Hg + O 2 c) 2 Ag 2 O Ag + O 2 d) 2 Fe + Cl 2 2 FeCl 3 Zad. 35 str. 75 Uzgodnij współczynniki stechiometryczne w podanych równaniach reakcji chemicznych. Następnie zaznacz reakcje wymiany. a) N 2 + H 2 NH 3 b) CO + O 2 CO 2 c) Fe 3 O 4 + Al Al 2 O 3 + Fe d) Na + HCl NaCl + H 2 e) P 4 O 10 + H 2 O H 3 PO 4 f) NH 3 + O 2 NO + H 2 O Zad.36 str. 75 Napisz i uzgodnij równania reakcji chemicznych przedstawionych za pomocą zapisu słownego.
9 a) wodór + chlor chlorowodór b) tlenek miedzi(ii) + węgiel miedź + tlenek węgla(iv) c) chlorek srebra(i) srebro + chlor d) siarka + tlen tlenek siarki(iv) Zad. 37c str. 76 Napisz i uzgodnij równania reakcji chemicznych oznaczonych na schemacie cyframi (1-4). Napisz nazwy systematyczne wybranych związków chemicznych HgO O 2 CO CO 2 C + MgO HgO - CO 2 - CO - MgO Prawo zachowania masy Zad. 42 str. 79 Krok 1 Przeczytaj treść zadania i wypisz dane i szukane Krok 2 Napisz przebieg reakcji chemicznej Krok 3 Wykonaj obliczenia
10 Krok 4 Napisz odpowiedzi Zad.43 str. 79 W wyniku reakcji spalania magnezu w tlenie powstało 0,1 g tlenku magnezu. Oblicz masę Każdego z substratów tej reakcji chemicznej, jeśli masa tlenu stanowiła 2/3 masy magnezu użytego w tej reakcji chemicznej. Krok 1 Przeczytaj treść zadania i wpisz dane i szukane. Krok 2 Napisz przebieg reakcji chemicznej Krok 3 Oblicz masę Mg. Krok 4 Oblicz masę O 2 Krok 5 Napisz odpowiedź Obliczenia stechiometryczne Zad. 45 str. 80 Napisz nazwy substratów w reakcjach chemicznych przedstawionych za pomocą równań, a następnie określ najprostszy stosunek masowy, w jakim reagują ze sobą. Przykład: C + O 2 CO 2 Substraty: węgiel, tlen Stosunek masowy: 12 : 32 = 3 : 8 a) Mg + I 2 MgI 2 Stosunek masowy: Substraty: : b) CuO + H 2 Cu + H 2 O Substraty: : c) 2 H 2 + O 2 2 H 2 O Substraty: : d) N H 2 2 NH 3
11 Substraty: : Zad. 47 str. 81 Uzupełnij zdania odpowiednimi wartościami liczbowymi i zapisz równania opisanych reakcji chemicznych. a) W wyniku spalenia 4,6 g sodu w chlorze można uzyskać maksymalnie g chlorku sodu. Równanie reakcji chemicznej: b) W wyniku rozkładu termicznego 4,34 g tlenku rtęci(ii) można uzyskać 0,32 g tlenu oraz g rtęci. Równanie reakcji chemicznej: c) W wyniku reakcji g magnezu z 3,2 g tlenu powstaje g tlenku magnezu. Równanie reakcji chemicznej: Zad.48 str. 81 Przeprowadzono reakcję otrzymywania siarczku żelaza(ii). Zaznacz punkt podający takie masy substratów, które przereagują ze sobą całkowicie. A. 5 g żelaza i 6 g siarki C. 5,6 g żelaza i 3,2 g siarki B. 6 g żelaza i 5 g siarki D. 5,6 g żelaza i 32 g siarki
12
I II I II III II. I. Wartościowość pierwiastków chemicznych. oznacza się cyfrą rzymską. tlenek żelaza (III) C IV O II 2
 I. Wartościowość pierwiastków chemicznych oznacza się cyfrą rzymską tlenek żelaza (III) C IV II 2 oznacza liczbę wiązań za pomocą, których atomy łączą się ze sobą H wodór jest I wartościowy od atomu wodoru
I. Wartościowość pierwiastków chemicznych oznacza się cyfrą rzymską tlenek żelaza (III) C IV II 2 oznacza liczbę wiązań za pomocą, których atomy łączą się ze sobą H wodór jest I wartościowy od atomu wodoru
BUDOWA ATOMU 1. Wymień 3 korzyści płynące z zastosowania pierwiastków promieniotwórczych. 2. Dokończ reakcję i nazwij powstałe pierwiastki:
 BUDOWA ATOMU 1. Wymień 3 korzyści płynące z zastosowania pierwiastków promieniotwórczych. 2. Dokończ reakcję i nazwij powstałe pierwiastki: 235 4 92 U + 2 He 198. 79 Au + ß - 3. Spośród atomów wybierz
BUDOWA ATOMU 1. Wymień 3 korzyści płynące z zastosowania pierwiastków promieniotwórczych. 2. Dokończ reakcję i nazwij powstałe pierwiastki: 235 4 92 U + 2 He 198. 79 Au + ß - 3. Spośród atomów wybierz
1. Określ liczbę wiązań σ i π w cząsteczkach: wody, amoniaku i chloru
 1. Określ liczbę wiązań σ i π w cząsteczkach: wody, amoniaku i chloru 2. Na podstawie struktury cząsteczek wyjaśnij dlaczego N 2 jest bierny a Cl 2 aktywny chemicznie? 3. Które substancje posiadają budowę
1. Określ liczbę wiązań σ i π w cząsteczkach: wody, amoniaku i chloru 2. Na podstawie struktury cząsteczek wyjaśnij dlaczego N 2 jest bierny a Cl 2 aktywny chemicznie? 3. Które substancje posiadają budowę
Układ okresowy pierwiastków chemicznych, budowa atomu. Na podstawie fragmentu układu okresowego pierwiastków odpowiedz na pytania:
 Układ okresowy pierwiastków chemicznych, budowa atomu zestaw I Na podstawie fragmentu układu okresowego pierwiastków odpowiedz na pytania: Zad 1 (0-1pkt)Wskaż nazwę pierwiastka, który leży w drugiej grupie
Układ okresowy pierwiastków chemicznych, budowa atomu zestaw I Na podstawie fragmentu układu okresowego pierwiastków odpowiedz na pytania: Zad 1 (0-1pkt)Wskaż nazwę pierwiastka, który leży w drugiej grupie
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Nazwy pierwiastków: ...
 Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Zadanie 1. [ 3 pkt.] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Atom pierwiastka X w reakcjach chemicznych może tworzyć jon zawierający 20
Zadanie 1. (1 pkt). Informacja do zada 2. i 3. Zadanie 2. (1 pkt) { Zadania 2., 3. i 4 s dla poziomu rozszerzonego} zania zania Zadanie 3.
 2. ELEKTRONY W ATOMACH I CZĄSTECZKACH. A1 - POZIOM PODSTAWOWY. Zadanie 1. (1 pkt). Konfigurację elektronową 1s 2 2s 2 2p 6 3s 2 3p 6 mają atomy i jony: A. Mg 2+, Cl -, K +, B. Ar, S 2-, K +, C. Ar, Na
2. ELEKTRONY W ATOMACH I CZĄSTECZKACH. A1 - POZIOM PODSTAWOWY. Zadanie 1. (1 pkt). Konfigurację elektronową 1s 2 2s 2 2p 6 3s 2 3p 6 mają atomy i jony: A. Mg 2+, Cl -, K +, B. Ar, S 2-, K +, C. Ar, Na
Procentowa zawartość sodu (w molu tej soli są dwa mole sodu) wynosi:
 Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
Stechiometria Każdą reakcję chemiczną można zapisać równaniem, które jest jakościową i ilościową charakterystyką tej reakcji. Określa ono bowiem, jakie pierwiastki lub związki biorą udział w danej reakcji
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I ... ... czas trwania: 90 min Nazwa szkoły
 V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
V KONKURS CHEMICZNY 23.X. 2007r. DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚWIĘTOKRZYSKIEGO Etap I...... Imię i nazwisko ucznia ilość pkt.... czas trwania: 90 min Nazwa szkoły... maksymalna ilość punk. 33 Imię
MARATON WIEDZY CHEMIA CZ. II
 MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
MARATON WIEDZY CHEMIA CZ. II 1. Podaj liczbę elektronów, nukleonów, protonów i neuronów zawartych w następujących atomach: a), b) 2. Podaj liczbę elektronów, nukleonów, protonów i neutronów zawartych w
Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7
 Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7 W tabeli zostały wyróżnione y z doświadczeń zalecanych do realizacji w szkole podstawowej. Temat w podręczniku Tytuł Typ
Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7 W tabeli zostały wyróżnione y z doświadczeń zalecanych do realizacji w szkole podstawowej. Temat w podręczniku Tytuł Typ
Wymagania programowe na poszczególne oceny chemia kl. I
 I. Substancje i ich przemiany Wymagania programowe na poszczególne oceny chemia kl. I Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
I. Substancje i ich przemiany Wymagania programowe na poszczególne oceny chemia kl. I Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
Obliczenia chemiczne
 strona 1/8 Obliczenia chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Wagowe stosunki stechiometryczne w związkach chemicznych i reakcjach chemicznych masa atomowa
strona 1/8 Obliczenia chemiczne Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn Treść podstawy programowej: Wagowe stosunki stechiometryczne w związkach chemicznych i reakcjach chemicznych masa atomowa
KONKURS CHEMICZNY DLA UCZNIÓW SZKOŁY PODSTAWOWEJ ROK SZKOLNY 2018/2019 ETAP REJONOWY
 Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa Szkoły KONKURS CHEMICZNY Uzyskane punkty DLA UCZNIÓW SZKOŁY PODSTAWOWEJ Informacje: ROK
Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa Szkoły KONKURS CHEMICZNY Uzyskane punkty DLA UCZNIÓW SZKOŁY PODSTAWOWEJ Informacje: ROK
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 24 stycznia 2018 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW. Eliminacje szkolne I stopień
 POUFNE Pieczątka szkoły 9 listopada 2015 r. Imię Czas pracy 60 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje szkolne I stopień Informacje: 1. Przeczytaj uważnie
POUFNE Pieczątka szkoły 9 listopada 2015 r. Imię Czas pracy 60 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje szkolne I stopień Informacje: 1. Przeczytaj uważnie
 PRACA KONTROLNA Z CHEMII NR 1 - Semestr I 1. (6 pkt) - Krótko napisz, jak rozumiesz następujące pojęcia: a/ liczba atomowa, b/ nuklid, c/ pierwiastek d/ dualizm korpuskularno- falowy e/promieniotwórczość
PRACA KONTROLNA Z CHEMII NR 1 - Semestr I 1. (6 pkt) - Krótko napisz, jak rozumiesz następujące pojęcia: a/ liczba atomowa, b/ nuklid, c/ pierwiastek d/ dualizm korpuskularno- falowy e/promieniotwórczość
Anna Grych Test z budowy atomu i wiązań chemicznych
 Anna Grych Test z budowy atomu i wiązań chemicznych 1. Uzupełnij tabelkę wpisując odpowiednie dane: Nazwa atomu Liczba nukleonów protonów neutronów elektronów X -... 4 2 Y -... 88 138 Z -... 238 92 W -...
Anna Grych Test z budowy atomu i wiązań chemicznych 1. Uzupełnij tabelkę wpisując odpowiednie dane: Nazwa atomu Liczba nukleonów protonów neutronów elektronów X -... 4 2 Y -... 88 138 Z -... 238 92 W -...
2. Podczas spalania 2 objętości pewnego gazu z 4 objętościami H 2 otrzymano 1 objętość N 2 i 4 objętości H 2O. Jaki gaz uległ spalaniu?
 1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
1. Oblicz, ilu moli HCl należy użyć, aby poniższe związki przeprowadzić w sole: a) 0,2 mola KOH b) 3 mole NH 3 H 2O c) 0,2 mola Ca(OH) 2 d) 0,5 mola Al(OH) 3 2. Podczas spalania 2 objętości pewnego gazu
WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2015/2016 CHEMIA
 WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2015/2016 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu wpisz swój kod ustalony
WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2015/2016 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu wpisz swój kod ustalony
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2018/2019 ETAP REJONOWY
 Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa szkoły KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2018/2019 ETAP REJONOWY Uzyskane
Wpisuje uczeń po otrzymaniu zadań Kod ucznia Wpisać po rozkodowaniu pracy Imię Nazwisko Czas pracy: 90 minut Nazwa szkoły KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2018/2019 ETAP REJONOWY Uzyskane
Wymagania programowe na poszczególne oceny z chemii w kl.1. I. Substancje i ich przemiany
 Wymagania programowe na poszczególne oceny z chemii w kl.1 I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego chemia
Wymagania programowe na poszczególne oceny z chemii w kl.1 I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego chemia
WOJEWÓDZKI KONKURS CHEMICZNY
 WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013 STOPIEŃ SZKOLNY 16.11.2012 KOD UCZNIA. INSTRUKCJA DLA UCZNIA Czas trwania konkursu 90 minut. 1.Przeczytaj uważnie instrukcje
WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2012/2013 STOPIEŃ SZKOLNY 16.11.2012 KOD UCZNIA. INSTRUKCJA DLA UCZNIA Czas trwania konkursu 90 minut. 1.Przeczytaj uważnie instrukcje
Instrukcja dla uczestnika. II etap Konkursu. U z u p e ł n i j s w o j e d a n e p r z e d r o z p o c z ę c i e m r o z w i ą z y w a n i a z a d a ń
 III edycja rok szkolny 2017/2018 Uzupełnia Organizator Konkursu Instrukcja dla uczestnika II etap Konkursu Liczba uzyskanych punktów 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś zawiera 12 stron.
III edycja rok szkolny 2017/2018 Uzupełnia Organizator Konkursu Instrukcja dla uczestnika II etap Konkursu Liczba uzyskanych punktów 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś zawiera 12 stron.
BADANIE WYNIKÓW NAUCZANIA Z CHEMII KLASA I GIMNAZJUM. PYTANIA ZAMKNIĘTE.
 BADANIE WYNIKÓW NAUCZANIA Z CHEMII KLASA I GIMNAZJUM. PYTANIA ZAMKNIĘTE. 1. Którą mieszaninę można rozdzielić na składniki poprzez filtrację; A. Wodę z octem. B. Wodę z kredą. C. Piasek z cukrem D. Wodę
BADANIE WYNIKÓW NAUCZANIA Z CHEMII KLASA I GIMNAZJUM. PYTANIA ZAMKNIĘTE. 1. Którą mieszaninę można rozdzielić na składniki poprzez filtrację; A. Wodę z octem. B. Wodę z kredą. C. Piasek z cukrem D. Wodę
Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr.
 Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr. Typ wiązania w KBr... Typ wiązania w HBr... Zadanie 2. (2 pkt) Oceń poprawność poniższych
Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr. Typ wiązania w KBr... Typ wiązania w HBr... Zadanie 2. (2 pkt) Oceń poprawność poniższych
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.
![Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami.](/thumbs/100/143872318.jpg) Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
Zadanie 1. [ 3 pkt.] Uzupełnij zdania, wpisując brakującą informację z odpowiednimi jednostkami. I. Gęstość propanu w warunkach normalnych wynosi II. Jeżeli stężenie procentowe nasyconego roztworu pewnej
Na rysunku przedstawiono fragment układu okresowego pierwiastków.
 Na rysunku przedstawiono fragment układu okresowego pierwiastków. Zadanie 1 (0 1) W poniższych zdaniach podano informacje o pierwiastkach i ich tlenkach. Które to tlenki? Wybierz je spośród podanych A
Na rysunku przedstawiono fragment układu okresowego pierwiastków. Zadanie 1 (0 1) W poniższych zdaniach podano informacje o pierwiastkach i ich tlenkach. Które to tlenki? Wybierz je spośród podanych A
WOJEWÓDZKI KONKURS CHEMICZNY
 Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2017/2018 15.11.2017 R. 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte.
Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW W ROKU SZKOLNYM 2017/2018 15.11.2017 R. 1. Test konkursowy zawiera 26 zadań. Są to zadania zamknięte i otwarte.
MAŁOPOLSKI KONKURS CHEMICZNY. dla uczniów szkół podstawowych. 25 października 2019 r. Etap I (szkolny)
 Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 25 października 2019 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 8 9 10 Maksymalna 2 2 2 1 4 1 2 1
Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów szkół podstawowych 25 października 2019 r. Etap I (szkolny) Wypełnia Komisja Etapu Szkolnego Zadanie 1 2 3 4 5 6 7 8 9 10 Maksymalna 2 2 2 1 4 1 2 1
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Fragmenty Działu 7 z Tomu 1 REAKCJE UTLENIANIA I REDUKCJI
 Fragmenty Działu 7 z Tomu 1 REAKCJE UTLENIANIA I REDUKCJI Zadanie 726 (1 pkt.) V/2006/A1 Konfigurację elektronową atomu glinu w stanie podstawowym można przedstawić następująco: 1s 2 2s 2 2p 6 3s 2 3p
Fragmenty Działu 7 z Tomu 1 REAKCJE UTLENIANIA I REDUKCJI Zadanie 726 (1 pkt.) V/2006/A1 Konfigurację elektronową atomu glinu w stanie podstawowym można przedstawić następująco: 1s 2 2s 2 2p 6 3s 2 3p
Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej
 Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej Nauczyciel: Marta Zielonka Temat w podręczniku Substancje i ich przemiany 1. Zasady bezpiecznej pracy
Realizacja wymagań szczegółowych podstawy programowej z chemii dla klasy siódmej szkoły podstawowej Nauczyciel: Marta Zielonka Temat w podręczniku Substancje i ich przemiany 1. Zasady bezpiecznej pracy
VI Podkarpacki Konkurs Chemiczny 2013/2014
 VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
VI Podkarpacki Konkurs Chemiczny 01/01 ETAP I 1.11.01 r. Godz. 10.00-1.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Znając liczbę masową pierwiastka można określić liczbę:
Nazwy pierwiastków: A +Fe 2(SO 4) 3. Wzory związków: A B D. Równania reakcji:
 Zadanie 1. [0-3 pkt] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Suma protonów i elektronów anionu X 2- jest równa 34. II. Stosunek masowy
Zadanie 1. [0-3 pkt] Na podstawie podanych informacji ustal nazwy pierwiastków X, Y, Z i zapisz je we wskazanych miejscach. I. Suma protonów i elektronów anionu X 2- jest równa 34. II. Stosunek masowy
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 16 stycznia 2015 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem
 Hospitacja diagnozująca Źródła informacji chemicznej Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem Opracowała: mgr Lilla Zmuda Matyja Arkusz Hospitacji Diagnozującej nr
Hospitacja diagnozująca Źródła informacji chemicznej Cel główny: Uczeń posiada umiejętność czytania tekstów kultury ze zrozumieniem Opracowała: mgr Lilla Zmuda Matyja Arkusz Hospitacji Diagnozującej nr
Kod ucznia Liczba punktów A X B C X
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 18 STYCZNIA 2016 R. 1. Test konkursowy zawiera 19 zadań. Są to zadania zamknięte i otwarte. Na ich
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2015/2016 18 STYCZNIA 2016 R. 1. Test konkursowy zawiera 19 zadań. Są to zadania zamknięte i otwarte. Na ich
Wewnętrzna budowa materii - zadania
 Poniższe zadania rozwiąż na podstawie układu okresowego. Zadanie 1 Oceń poprawność poniższych zdań, wpisując P, gdy zdanie jest prawdziwe oraz F kiedy ono jest fałszywe. Stwierdzenie Atom potasu posiada
Poniższe zadania rozwiąż na podstawie układu okresowego. Zadanie 1 Oceń poprawność poniższych zdań, wpisując P, gdy zdanie jest prawdziwe oraz F kiedy ono jest fałszywe. Stwierdzenie Atom potasu posiada
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap szkolny rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW WOJEWÓDZTWO WIELKOPOLSKIE Etap szkolny rok szkolny 2009/2010 Dane dotyczące ucznia (wypełnia Komisja Konkursowa po rozkodowaniu prac) wylosowany numer uczestnika
Wymagania przedmiotowe do podstawy programowej - chemia klasa 7
 Wymagania przedmiotowe do podstawy programowej - chemia klasa 7 I. Substancje i ich właściwości opisuje cechy mieszanin jednorodnych i niejednorodnych, klasyfikuje pierwiastki na metale i niemetale, posługuje
Wymagania przedmiotowe do podstawy programowej - chemia klasa 7 I. Substancje i ich właściwości opisuje cechy mieszanin jednorodnych i niejednorodnych, klasyfikuje pierwiastki na metale i niemetale, posługuje
Zadania powtórkowe do egzaminu maturalnego z chemii Wiązania chemiczne, budowa cząsteczek
 strona 1/11 Zadania powtórkowe do egzaminu maturalnego z chemii Wiązania chemiczne, budowa cząsteczek Monika Gałkiewicz Zad. 1 () Podaj wzory dwóch dowolnych kationów i dwóch dowolnych anionów posiadających
strona 1/11 Zadania powtórkowe do egzaminu maturalnego z chemii Wiązania chemiczne, budowa cząsteczek Monika Gałkiewicz Zad. 1 () Podaj wzory dwóch dowolnych kationów i dwóch dowolnych anionów posiadających
Chemia nieorganiczna Zadanie Poziom: podstawowy
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Jednostki Ukadu SI. Jednostki uzupełniające używane w układzie SI Kąt płaski radian rad Kąt bryłowy steradian sr
 Jednostki Ukadu SI Wielkość Nazwa Symbol Długość metr m Masa kilogram kg Czas sekunda s Natężenie prądu elektrycznego amper A Temperatura termodynamiczna kelwin K Ilość materii mol mol Światłość kandela
Jednostki Ukadu SI Wielkość Nazwa Symbol Długość metr m Masa kilogram kg Czas sekunda s Natężenie prądu elektrycznego amper A Temperatura termodynamiczna kelwin K Ilość materii mol mol Światłość kandela
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW
 POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
POUFNE Pieczątka szkoły 16 styczeń 2010 r. Kod ucznia Wpisuje uczeń po otrzymaniu zadań Imię Wpisać po rozkodowaniu pracy Czas pracy 90 minut Nazwisko KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY
WYPEŁNIA KOMISJA KONKURSOWA
 WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2018/2019 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu
WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2018/2019 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu
Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej
 Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej Temat w podręczniku Substancje i ich przemiany 1. Zasady
Realizacja wymagań szczegółowych podstawy programowej w poszczególnych tematach podręcznika Chemia Nowej Ery dla klasy siódmej szkoły podstawowej Temat w podręczniku Substancje i ich przemiany 1. Zasady
Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.
![Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów. Zadanie 2. [2 pkt.] Podaj symbole dwóch kationów i dwóch anionów, dobierając wszystkie jony tak, aby zawierały taką samą liczbę elektronów.](/thumbs/97/131732752.jpg) 2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
2 Zadanie 1. [1 pkt] Pewien pierwiastek X tworzy cząsteczki X 2. Stwierdzono, że cząsteczki te mogą mieć różne masy cząsteczkowe. Wyjaśnij, dlaczego cząsteczki o tym samym wzorze mogą mieć różne masy cząsteczkowe.
I. Substancje i ich przemiany
 NaCoBeZU z chemii dla klasy 1 I. Substancje i ich przemiany 1. Pracownia chemiczna podstawowe szkło i sprzęt laboratoryjny. Przepisy BHP i regulamin pracowni chemicznej zaliczam chemię do nauk przyrodniczych
NaCoBeZU z chemii dla klasy 1 I. Substancje i ich przemiany 1. Pracownia chemiczna podstawowe szkło i sprzęt laboratoryjny. Przepisy BHP i regulamin pracowni chemicznej zaliczam chemię do nauk przyrodniczych
Test sprawdzający z chemii do klasy I LO i technikum z działu Budowa atomu i wiązania chemiczne
 Anna Grych Test sprawdzający z chemii do klasy I LO i technikum z działu Budowa atomu i wiązania chemiczne Informacja do zadań -7 75 Dany jest pierwiastek 33 As. Zadanie. ( pkt) Uzupełnij poniższą tabelkę.
Anna Grych Test sprawdzający z chemii do klasy I LO i technikum z działu Budowa atomu i wiązania chemiczne Informacja do zadań -7 75 Dany jest pierwiastek 33 As. Zadanie. ( pkt) Uzupełnij poniższą tabelkę.
Wewnętrzna budowa materii
 Atom i układ okresowy Wewnętrzna budowa materii Atom jest zbudowany z jądra atomowego oraz krążących wokół niego elektronów. Na jądro atomowe składają się protony oraz neutrony, zwane wspólnie nukleonami.
Atom i układ okresowy Wewnętrzna budowa materii Atom jest zbudowany z jądra atomowego oraz krążących wokół niego elektronów. Na jądro atomowe składają się protony oraz neutrony, zwane wspólnie nukleonami.
Wymagania edukacyjne na poszczególne oceny: I. Substancje i ich przemiany
 Wymagania edukacyjne na poszczególne oceny: I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego chemia jest nauką stosuje
Wymagania edukacyjne na poszczególne oceny: I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego chemia jest nauką stosuje
Wymagania programowe na poszczególne oceny w klasie pierwszej. I. Substancje i ich przemiany
 Wymagania programowe na poszczególne oceny w klasie pierwszej I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
Wymagania programowe na poszczególne oceny w klasie pierwszej I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
Wymagania edukacyjne na poszczególne oceny - klasa I a, I b, I c, I d. I. Substancje i ich przemiany. Ocena dopuszczająca [1]
![Wymagania edukacyjne na poszczególne oceny - klasa I a, I b, I c, I d. I. Substancje i ich przemiany. Ocena dopuszczająca [1] Wymagania edukacyjne na poszczególne oceny - klasa I a, I b, I c, I d. I. Substancje i ich przemiany. Ocena dopuszczająca [1]](/thumbs/100/147928509.jpg) Wymagania edukacyjne na poszczególne oceny - klasa I a, I b, I c, I d. I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego
Wymagania edukacyjne na poszczególne oceny - klasa I a, I b, I c, I d. I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia, dlaczego
Wojewódzki Konkurs Przedmiotowy. dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2013/2014
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2013/2014 KOD UCZNIA Etap: Data: Czas pracy: szkolny 22 listopada 2013 90 minut Informacje dla ucznia
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2013/2014 KOD UCZNIA Etap: Data: Czas pracy: szkolny 22 listopada 2013 90 minut Informacje dla ucznia
Wymagania programowe na poszczególne oceny z chemii dla klasy 1 gimnazjum. I. Substancje i ich przemiany
 Wymagania programowe na poszczególne oceny z chemii dla klasy 1 gimnazjum I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia,
Wymagania programowe na poszczególne oceny z chemii dla klasy 1 gimnazjum I. Substancje i ich przemiany Ocena dopuszczająca [1] Ocena dostateczna [1 + 2] zalicza chemię do nauk przyrodniczych wyjaśnia,
Wymagania edukacyjne z chemii dla klasy I oparte na Programie nauczania Chemia Nowej Ery
 Wymagania edukacyjne z chemii dla klasy I oparte na Programie nauczania Chemia Nowej Ery I. Substancje i ich przemiany Poziom wymagań Konieczny Podstawowy Rozszerzający Dopełniający zalicza chemię do nauk
Wymagania edukacyjne z chemii dla klasy I oparte na Programie nauczania Chemia Nowej Ery I. Substancje i ich przemiany Poziom wymagań Konieczny Podstawowy Rozszerzający Dopełniający zalicza chemię do nauk
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 2018/2019 ETAP SZKOLNY
 Imię Nazwisko Czas pracy: 60 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 208/209 ETAP SZKOLNY Informacje:. Sprawdź, czy otrzymałeś/aś łącznie 7 stron. Ewentualny brak zgłoś przewodniczącemu
Imię Nazwisko Czas pracy: 60 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM ROK SZKOLNY 208/209 ETAP SZKOLNY Informacje:. Sprawdź, czy otrzymałeś/aś łącznie 7 stron. Ewentualny brak zgłoś przewodniczącemu
WOJEWÓDZKI KONKURS CHEMICZNY
 Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 30.10.2018 r. 1. Test konkursowy zawiera 22 zadania. Są to zadania
Pieczątka szkoły Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW W ROKU SZKOLNYM 2018/2019 30.10.2018 r. 1. Test konkursowy zawiera 22 zadania. Są to zadania
Maksymalna liczba punktów: 40. Czas rozwiązywania zadań: 90 minut.
 Pieczęć KONKURS CHEMICZNY dla uczniów gimnazjów województwa lubuskiego 20 stycznia 2011 r. zawody II stopnia (rejonowe) Witamy Cię na drugim etapie Konkursu Chemicznego. Przed przystąpieniem do rozwiązywania
Pieczęć KONKURS CHEMICZNY dla uczniów gimnazjów województwa lubuskiego 20 stycznia 2011 r. zawody II stopnia (rejonowe) Witamy Cię na drugim etapie Konkursu Chemicznego. Przed przystąpieniem do rozwiązywania
nazywa wybrane elementy szkła i sprzętu laboratoryjnego oraz określa ich przeznaczenie (4)
 Wymagania na poszczególne oceny z chemii w klasie I Uczeń: I. Substancje i ich właściwości stosuje zasady bezpieczeństwa obowiązujące w pracowni chemicznej (2) zalicza chemię do nauk przyrodniczych (2)
Wymagania na poszczególne oceny z chemii w klasie I Uczeń: I. Substancje i ich właściwości stosuje zasady bezpieczeństwa obowiązujące w pracowni chemicznej (2) zalicza chemię do nauk przyrodniczych (2)
Klasa 1 Wymagania programowe na poszczególne oceny. I. Substancje i ich przemiany
 Klasa 1 Wymagania programowe na poszczególne oceny I. Substancje i ich przemiany Ocena niedostateczna Uczeń nie potrafi: Nazwać wybranych elementów szkła i sprzętu laboratoryjnego; Nie potrafi opisać właściwości
Klasa 1 Wymagania programowe na poszczególne oceny I. Substancje i ich przemiany Ocena niedostateczna Uczeń nie potrafi: Nazwać wybranych elementów szkła i sprzętu laboratoryjnego; Nie potrafi opisać właściwości
Z CHEMII W KLASIE I GIMNAZJUM. Program nauczania chemii w gimnazjum Autorzy: Teresa Kulawik, Maria Litwin
 WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne Z CHEMII W KLASIE I GIMNAZJUM Program nauczania chemii w gimnazjum Autorzy: Teresa Kulawik, Maria Litwin Program realizowany przy pomocy podręcznika
WYMAGANIA EDUKACYJNE na poszczególne oceny śródroczne i roczne Z CHEMII W KLASIE I GIMNAZJUM Program nauczania chemii w gimnazjum Autorzy: Teresa Kulawik, Maria Litwin Program realizowany przy pomocy podręcznika
3. Jaka jest masa atomowa pierwiastka E w następujących związkach? Który to pierwiastek? EO o masie cząsteczkowej 28 [u]
![3. Jaka jest masa atomowa pierwiastka E w następujących związkach? Który to pierwiastek? EO o masie cząsteczkowej 28 [u] 3. Jaka jest masa atomowa pierwiastka E w następujących związkach? Który to pierwiastek? EO o masie cząsteczkowej 28 [u]](/thumbs/58/41892324.jpg) 1. Masa cząsteczkowa tlenku dwuwartościowego metalu wynosi 56 [u]. Masa atomowa tlenu wynosi 16 [u]. Ustal jaki to metal i podaj jego nazwę. Napisz wzór sumaryczny tego tlenku. 2. Ile razy masa atomowa
1. Masa cząsteczkowa tlenku dwuwartościowego metalu wynosi 56 [u]. Masa atomowa tlenu wynosi 16 [u]. Ustal jaki to metal i podaj jego nazwę. Napisz wzór sumaryczny tego tlenku. 2. Ile razy masa atomowa
I. Substancje i ich przemiany
 Wymagania edukacyjne na poszczególne oceny szkolne klasa 7 Niepełnosprawność intelektualna oraz obniżenie wymagań i dostosowanie ich do możliwości ucznia I. Substancje i ich przemiany stosuje zasady bezpieczeństwa
Wymagania edukacyjne na poszczególne oceny szkolne klasa 7 Niepełnosprawność intelektualna oraz obniżenie wymagań i dostosowanie ich do możliwości ucznia I. Substancje i ich przemiany stosuje zasady bezpieczeństwa
Część I. TEST WYBORU 18 punktów
 Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
Część I TEST WYBORU 18 punktów Test zawiera zadania, w których podano propozycje czterech odpowiedzi: A), B), C), D). Tylko jedna odpowiedź jest prawidłowa. Prawidłową odpowiedź zaznacz znakiem X. W razie
XV Wojewódzki Konkurs z Chemii
 XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego II Etap powiatowy 16 styczeń 2018
CHEMIA klasa 1 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery.
 CHEMIA klasa 1 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery. Dział - Substancje i ich przemiany WYMAGANIA PODSTAWOWE stosuje zasady bezpieczeństwa
CHEMIA klasa 1 Wymagania programowe na poszczególne oceny do Programu nauczania chemii w gimnazjum. Chemia Nowej Ery. Dział - Substancje i ich przemiany WYMAGANIA PODSTAWOWE stosuje zasady bezpieczeństwa
TYPY REAKCJI CHEMICZNYCH
 1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
1 REAKCJA CHEMICZNA: TYPY REAKCJI CHEMICZNYCH REAKCJĄ CHEMICZNĄ NAZYWAMY PROCES, W WYNIKU KTÓREGO Z JEDNYCH SUBSTANCJI POWSTAJĄ NOWE (PRODUKTY) O INNYCH WŁAŚCIWOŚCIACH NIŻ SUBSTANCJE WYJŚCIOWE (SUBSTRATY)
VII Podkarpacki Konkurs Chemiczny 2014/2015
 II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
II Podkarpacki Konkurs Chemiczny 2014/2015 ETAP I 12.11.2014 r. Godz. 10.00-12.00 KOPKCh Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 1. Który z podanych zestawów zawiera wyłącznie
WYPEŁNIA KOMISJA KONKURSOWA
 WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2017/2018 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu
WOJEWÓDZKI KONKURS PRZEDMIOTOWY DLA UCZNIÓW DOTYCHCZASOWYCH GIMNAZJÓW WOJEWÓDZTWA ŚLĄSKIEGO W ROKU SZKOLNYM 2017/2018 CHEMIA Informacje dla ucznia 1. Na stronie tytułowej arkusza w wyznaczonym miejscu
SCENARIUSZ LEKCJI prowadzonej pod kątem hospitacji diagnozującej w klasie pierwszej gimnazjum
 Literka.pl Atom i cząsteczka Data dodania: 2010-05-31 11:51:50 Autor: Anna Piwowarczyk Podsumowanie wiadomości o wewnętrznej budowie materii. SCENARIUSZ LEKCJI prowadzonej pod kątem hospitacji diagnozującej
Literka.pl Atom i cząsteczka Data dodania: 2010-05-31 11:51:50 Autor: Anna Piwowarczyk Podsumowanie wiadomości o wewnętrznej budowie materii. SCENARIUSZ LEKCJI prowadzonej pod kątem hospitacji diagnozującej
Test diagnostyczny. Dorota Lewandowska, Lidia Wasyłyszyn, Anna Warchoł. Część A (0 5) Standard I
 strona 1/9 Test diagnostyczny Dorota Lewandowska, Lidia Wasyłyszyn, Anna Warchoł Część A (0 5) Standard I 1. Przemianą chemiczną nie jest: A. mętnienie wody wapiennej B. odbarwianie wody bromowej C. dekantacja
strona 1/9 Test diagnostyczny Dorota Lewandowska, Lidia Wasyłyszyn, Anna Warchoł Część A (0 5) Standard I 1. Przemianą chemiczną nie jest: A. mętnienie wody wapiennej B. odbarwianie wody bromowej C. dekantacja
Temat 1: Budowa atomu zadania
 Budowa atomu Zadanie 1. (0-1) Dany jest atom sodu Temat 1: Budowa atomu zadania 23 11 Na. Uzupełnij poniższą tabelkę. Liczba masowa Liczba powłok elektronowych Ładunek jądra Liczba nukleonów Zadanie 2.
Budowa atomu Zadanie 1. (0-1) Dany jest atom sodu Temat 1: Budowa atomu zadania 23 11 Na. Uzupełnij poniższą tabelkę. Liczba masowa Liczba powłok elektronowych Ładunek jądra Liczba nukleonów Zadanie 2.
Świat chemii cz. 1, rok szkolny 2016/17 Opis założonych osiągnięć ucznia
 Świat chemii cz. 1, rok szkolny 2016/17 Opis założonych osiągnięć ucznia Osiągnięcia podstawowe Rodzaje i przemiany materii wymienia powtarzające się elementy podręcznika i wskazuje rolę, jaką odgrywają;
Świat chemii cz. 1, rok szkolny 2016/17 Opis założonych osiągnięć ucznia Osiągnięcia podstawowe Rodzaje i przemiany materii wymienia powtarzające się elementy podręcznika i wskazuje rolę, jaką odgrywają;
b) Podaj liczbę moli chloru cząsteczkowego, która całkowicie przereaguje z jednym molem glinu.
 Informacja do zadań 1 i 2 Chlorek glinu otrzymuje się w reakcji glinu z chlorowodorem lub działając chlorem na glin. Związek ten tworzy kryształy, rozpuszczalne w wodzie zakwaszonej kwasem solnym. Z roztworów
Informacja do zadań 1 i 2 Chlorek glinu otrzymuje się w reakcji glinu z chlorowodorem lub działając chlorem na glin. Związek ten tworzy kryształy, rozpuszczalne w wodzie zakwaszonej kwasem solnym. Z roztworów
MAŁOPOLSKI KONKURS CHEMICZNY
 Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu 8 października 2018 r. Etap I (szkolny) Wypełnia Szkolna
Kod ucznia MAŁOPOLSKI KONKURS CHEMICZNY dla uczniów dotychczasowych gimnazjów i klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu 8 października 2018 r. Etap I (szkolny) Wypełnia Szkolna
DZIA 3. CZENIE SIÊ ATOMÓW
 DZIA 3. CZENIE SIÊ ATOMÓW 1./3 Wyjaœnij, w jaki sposób powstaje: a) wi¹zanie jonowe b) wi¹zanie atomowe 2./3 Na podstawie po³o enia w uk³adzie okresowym pierwiastków: chloru i litu ustal, ile elektronów
DZIA 3. CZENIE SIÊ ATOMÓW 1./3 Wyjaœnij, w jaki sposób powstaje: a) wi¹zanie jonowe b) wi¹zanie atomowe 2./3 Na podstawie po³o enia w uk³adzie okresowym pierwiastków: chloru i litu ustal, ile elektronów
III Podkarpacki Konkurs Chemiczny 2010/2011. ETAP I r. Godz Zadanie 1
 III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
III Podkarpacki Konkurs Chemiczny 2010/2011 KOPKCh ETAP I 22.10.2010 r. Godz. 10.00-12.00 Zadanie 1 1. Jon Al 3+ zbudowany jest z 14 neutronów oraz z: a) 16 protonów i 13 elektronów b) 10 protonów i 13
WYMAGANIA EDUKACYJNE z chemii dla klasy siódmej
 Lucyna Krupa Rok szkolny 2017/2018 WYMAGANIA EDUKACYJNE z chemii dla klasy siódmej Wyróżnia się wymagania na: ocenę dopuszczającą ocenę dostateczną (obejmują wymagania na ocenę dopuszczającą) ocenę dobrą
Lucyna Krupa Rok szkolny 2017/2018 WYMAGANIA EDUKACYJNE z chemii dla klasy siódmej Wyróżnia się wymagania na: ocenę dopuszczającą ocenę dostateczną (obejmują wymagania na ocenę dopuszczającą) ocenę dobrą
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Szczegółowy opis treści programowych obowiązujących na etapie szkolnym konkursu przedmiotowego z chemii 2018/2019
 Szczegółowy opis treści programowych obowiązujących na etapie szkolnym konkursu przedmiotowego z chemii 2018/2019 I. Eliminacje szkolne (60 minut, liczba punktów: 30). Wymagania szczegółowe. Cele kształcenia
Szczegółowy opis treści programowych obowiązujących na etapie szkolnym konkursu przedmiotowego z chemii 2018/2019 I. Eliminacje szkolne (60 minut, liczba punktów: 30). Wymagania szczegółowe. Cele kształcenia
1. Podstawowe prawa i pojęcia chemiczne
 1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
1. PODSTAWOWE PRAWA I POJĘCIA CHEMICZNE 5 1. Podstawowe prawa i pojęcia chemiczne 1.1. Wyraź w gramach masę: a. jednego atomu żelaza, b. jednej cząsteczki kwasu siarkowego. Odp. 9,3 10 23 g; 1,6 10 22
Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 2014/2015. Etap wojewódzki
 Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 04/05 Etap wojewódzki Klucz odpowiedzi i schemat punktowania Część I. Test jednokrotnego wyboru z jedną poprawną odpowiedzią
Konkurs Chemiczny dla gimnazjalistów województwa zachodniopomorskiego w roku szkolnym 04/05 Etap wojewódzki Klucz odpowiedzi i schemat punktowania Część I. Test jednokrotnego wyboru z jedną poprawną odpowiedzią
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW. Eliminacje rejonowe II stopień
 POUFNE Pieczątka szkoły 17 stycznia 2018 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko Szkoła (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2017/2018 Eliminacje
POUFNE Pieczątka szkoły 17 stycznia 2018 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko Szkoła (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2017/2018 Eliminacje
Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów. 07 marca 2019 r. zawody III stopnia (wojewódzkie)
 Kod ucznia Suma punktów Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 07 marca 2019 r. zawody III stopnia (wojewódzkie) Witamy Cię na trzecim etapie konkursu chemicznego. Podczas
Kod ucznia Suma punktów Konkurs przedmiotowy z chemii dla uczniów dotychczasowych gimnazjów 07 marca 2019 r. zawody III stopnia (wojewódzkie) Witamy Cię na trzecim etapie konkursu chemicznego. Podczas
Przemiany substancji
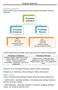 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Wymagania programowe na poszczególne oceny
 Przedmiot: chemia Klasa: Ia, Ib Nauczyciel: Agata SROKA Wymagania programowe na poszczególne oceny I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady
Przedmiot: chemia Klasa: Ia, Ib Nauczyciel: Agata SROKA Wymagania programowe na poszczególne oceny I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady
I Etap szkolny 16 listopada Imię i nazwisko ucznia: Arkusz zawiera 19 zadań. Liczba punktów możliwych do uzyskania: 39 pkt.
 XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego I Etap szkolny 16 listopada 2017
XV Wojewódzki Konkurs z Chemii dla uczniów dotychczasowych gimnazjów oraz klas dotychczasowych gimnazjów prowadzonych w szkołach innego typu województwa świętokrzyskiego I Etap szkolny 16 listopada 2017
Plan i kartoteka testu sprawdzającego wiadomości i umiejętności uczniów
 Plan i kartoteka testu sprawdzającego wiadomości i umiejętności uczniów Dział: Reakcje chemiczne. Podstawy obliczeń chemicznych. Kl. I LO Nr programu DKOS-4015-33-02 Nr zad. Sprawdzane wiadomości iumiejętności
Plan i kartoteka testu sprawdzającego wiadomości i umiejętności uczniów Dział: Reakcje chemiczne. Podstawy obliczeń chemicznych. Kl. I LO Nr programu DKOS-4015-33-02 Nr zad. Sprawdzane wiadomości iumiejętności
WYMAGANIA EDUKACYJNE
 SZKOŁA PODSTAWOWA W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie 7 Szkoły Podstawowej str. 1 Wymagania edukacyjne
SZKOŁA PODSTAWOWA W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie 7 Szkoły Podstawowej str. 1 Wymagania edukacyjne
Wojewódzki Konkurs Chemiczny dla uczniów gimnazjów województwa wielkopolskiego
 Kod ucznia Data urodzenia ucznia Dzień miesiąc rok Wojewódzki Konkurs Chemiczny dla uczniów gimnazjów ETAP SZKOLNY Rok szkolny 2014/2015 Instrukcja dla ucznia 1. Sprawdź, czy test zawiera 10 stron. Ewentualny
Kod ucznia Data urodzenia ucznia Dzień miesiąc rok Wojewódzki Konkurs Chemiczny dla uczniów gimnazjów ETAP SZKOLNY Rok szkolny 2014/2015 Instrukcja dla ucznia 1. Sprawdź, czy test zawiera 10 stron. Ewentualny
KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW. Eliminacje rejonowe II stopień
 POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
POUFNE Pieczątka szkoły 28 stycznia 2016 r. Kod ucznia (wypełnia uczeń) Imię i nazwisko (wypełnia komisja) Czas pracy 90 minut KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 Eliminacje rejonowe
Zn + S ZnS Utleniacz:... Reduktor:...
 Zadanie: 1 Spaliny wydostające się z rur wydechowych samochodów zawierają znaczne ilości tlenku węgla(ii) i tlenku azotu(ii). Gazy te są bardzo toksyczne i dlatego w aktualnie produkowanych samochodach
Zadanie: 1 Spaliny wydostające się z rur wydechowych samochodów zawierają znaczne ilości tlenku węgla(ii) i tlenku azotu(ii). Gazy te są bardzo toksyczne i dlatego w aktualnie produkowanych samochodach
CHEMIA I GIMNAZJUM WYMAGANIA PODSTAWOWE
 WYMAGANIA PODSTAWOWE wskazuje w środowisku substancje chemiczne nazywa sprzęt i szkło laboratoryjne opisuje podstawowe właściwości substancji będących głównymi składnikami stosowanych na co dzień produktów
WYMAGANIA PODSTAWOWE wskazuje w środowisku substancje chemiczne nazywa sprzęt i szkło laboratoryjne opisuje podstawowe właściwości substancji będących głównymi składnikami stosowanych na co dzień produktów
Wymagania programowe na poszczególne oceny chemia
 Wymagania programowe na poszczególne oceny chemia I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni j nazywa
Wymagania programowe na poszczególne oceny chemia I. Substancje i ich przemiany Ocena dopuszczająca [1] zalicza chemię do nauk przyrodniczych stosuje zasady bezpieczeństwa obowiązujące w pracowni j nazywa
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego. I Etap szkolny - 23 listopada 2016
 XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego I Etap szkolny - 23 listopada 2016 Kod ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego I Etap szkolny - 23 listopada 2016 Kod ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
KONKURS PRZEDMIOTOWY Z CHEMII
 Pieczęć KONKURS PRZEDMIOTOWY Z CHEMII dla uczniów gimnazjów województwa lubuskiego 26 stycznia 2012 r. zawody II stopnia (rejonowe) Witamy Cię na drugim etapie Konkursu Chemicznego. Przed przystąpieniem
Pieczęć KONKURS PRZEDMIOTOWY Z CHEMII dla uczniów gimnazjów województwa lubuskiego 26 stycznia 2012 r. zawody II stopnia (rejonowe) Witamy Cię na drugim etapie Konkursu Chemicznego. Przed przystąpieniem
Opracował: dr inż. Tadeusz Lemek
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
