Rola białek w chorobach neurodegeneracyjnych The role of proteins in neurodegenerative disease
|
|
|
- Bronisława Kozieł
- 9 lat temu
- Przeglądów:
Transkrypt
1 Postepy Hig Med Dosw (online), 2012; 66: e-issn Review Received: Accepted: Published: Rola białek w chorobach neurodegeneracyjnych The role of proteins in neurodegenerative disease Aleksandra Szwed, Katarzyna Miłowska Katedra Biofizyki Ogólnej, Uniwersytet Łódzki Streszczenie Obecnie wydaje się, że wszystkie choroby neurodegeneracyjne są związane z patologią i akumulacją białek. Białka to podstawowe składniki, zarówno strukturalne jak i funkcjonalne, każdej komórki, a ich funkcje związane są z ich składem aminokwasowym i ze strukturą przestrzenną. Prawidłowe ich funkcjonowanie jest więc konieczne dla poprawnego działania całego systemu, którym jest organizm. W przypadku zaburzeń struktury przestrzennej białek, może dochodzić do rozwoju procesów patologicznych. Akumulacja patologicznych białek jest toksyczna dla komórek nerwowych i jest przyczyną neurodegeneracji. Do tego typu chorób neurodegeneracyjnych zaliczamy m.in. choroby: Parkinsona, taupatie, Alzheimera, prionowe. W przypadku choroby Parkinsona toksyczny wpływ na neurony ma a-synukleina. Patologia białka tau jest swoista dla taupatii, białek prionowych dla chorób prionowych. Natomiast w przypadku choroby Alzheimera jest to b-amyloid. Wszystkie białka odpowiedzialne za proces patologiczny występują w stanie fizjologicznym w organizmie. Obszar mózgu objęty procesem chorobotwórczym oraz objawy kliniczne są charakterystyczne dla danej choroby. Szczegółowe poznanie mechanizmów powstawania choroby jest ważnym elementem w opracowaniu efektywnych metod leczenia. Słowa kluczowe: choroby neurodegeneracyjne a-synukleina białka tau białka prionowe b-amyloid Key words: Full-text PDF: Summary All neurodegenerative diseases are related to pathology and accumulation of proteins. Proteins are basic structural and functional components of each cell and their functions are associated with their amino acid composition and spatial structure. The proper functioning of protein is necessary for the proper operation of the body system. In the case of disorders of proteins spatial structure, the development of pathological processes may occur. Accumulation of abnormal proteins is toxic to nerve cells and causes neurodegeneration. Different disorders are characterized by abnormalities of various proteins. This type of neurodegenerative diseases includes Parkinson s disease, tauopathies, Alzheimer s disease, and prion diseases. Parkinson s disease is characterized by toxicity of a-synuclein. The pathology of tau protein is specific for tauopathies, prion protein for prion diseases. In the case of Alzheimer s disease it is b-amyloid. All proteins responsible for the pathology are present in the physiological state in the organism. Damage to the area of the brain covered by the pathological process and the clinical symptoms are characteristic for a particular type of disease. Detailed knowledge of the mechanisms of the disease can be an important element in the development of effective ways of treatment. neurodegenerative diseases a-synuclein tau proteins prion proteins b-amyloid Postepy Hig Med Dosw (online), 2012;
2 Postepy Hig Med Dosw (online), 2012; tom 66: Word count: 4348 Tables: Figures: 5 References: 55 Adres autorki: Wykaz skrótów: dr Katarzyna Miłowska, Katedra Biofizyki Ogólnej, Uniwersytet Łódzki, ul. Pomorska 141/143, Łódź; milowska@biol.uni.lodz.pl Ab b-amyloid; AADC dekarboksylaza aromatycznych L-aminokwasów; AD choroba Alzheimera; ALS stwardnienie zanikowe boczne; AS a-synukleina; APOE apolipoproteina E; APP białko prekursora b-amyloidu; BACE g-sekretaza; CBD zwyrodnienie korowo-podstawne; Cdk5 cyklinozależna kinaza; CJD choroba Creutzfeldta-Jakoba; icjd jatrogenna postać choroby Creutzfeldta-Jakoba; scjd sporadyczna postać choroby Creutzfeldta-Jakoba; vcjd wariant choroby Creutzfeldta-Jakoba; CNS ośrodkowy układ nerwowy; DA dopamina; DAT transporter dopaminy; DLB otępienie z ciałami Lewy ego; DOPAC kwas 3,4-dihydroksyoctowy; FFI śmiertelna rodzinna bezsenność; FTD otępienie czołowo-skroniowe; GPI glikozylofosfatydyloinozytol; GSK3b kinaza syntazy glikogenu 3b; GSS choroba Gerstmanna-Sträusslera-Scheinkera; LB ciała Lewy ego; L-DOPA L-3,4- dihydroksyfenyloalanina; MAP-tau białko tau; MARK kinaza regulująca powinowactwo; MBDs domeny wiążące mikrotubule; MAS zanik wieloukładowy; NAC niebędący białkiem b-amyloidowy składnik blaszek starczych; NFT splątki neurofibrylarne; PD choroba Parkinsona; PHF helikalnie[?] zwinięte sparowane włókienka; PNS obwodowy system nerwowy; PrD choroby prionowe; PRNP gen kodujący białko prionowe; PrP c prawidłowe białko prionowe; PrP Sc patologiczne białko prionowe; PSP postępujące porażenie nadjądrowe; S/T/Y seryna/ treonina/tyrozyna; TH hydroksylaza tyrozynowa; TSE pasażowalne encefalopatie gąbczaste; UPS system ubikwityna-proteasom; VMAT2 pęcherzykowy transporter monoamin. Znaczenie struktury przestrzennej białek w neurodegeneracji Białka o nieprawidłowej strukturze przestrzennej i mechanizmy zapobiegające ich gromadzeniu Struktura przestrzenna jest swoistą cechą danego białka i determinuje jego funkcje w organizmie. Strukturę tę białko uzyskuje w procesie fałdowania [14,47]. Prawidłowy przebieg procesu fałdowania wymaga przyjęcia przez białko jednej, określonej, swoistej konformacji o możliwie najniższej energii, zapewniającej stabilność cząsteczki. Zwijanie łańcucha polipeptydowego zapobiega niekorzystnym interakcjom między białkami. Dzieje się tak dzięki maskowaniu części sekwencji aminokwasowych, zdolnych do nieswoistych reakcji. Nieprawidłowy przebieg tego procesu prowadzi do wytworzenia zdegenerowanych białek. Gromadzenie się takiej postaci w neuronach powoduje ich agregację. W konsekwencji powstają blaszki starcze, splątki neurofibrylarne, ciałka Picka, ciałka Lewy ego i inne patologiczne zmiany w budowie neuronów [31,34,47]. Niewłaściwy przebieg procesu fałdowania może być wynikiem mutacji genu kodującego białko, jego potranslacyjnej obróbki, urazu, niedokrwienia, czy stresu oksydacyjnego [14,42,47]. Każda komórka, aby prawidłowo funkcjonować musi zawierać mechanizmy chroniące ją przed negatywnymi skutkami powstawania oraz gromadzenia się białek o nieprawidłowej konformacji. Ważną rolę odgrywają tutaj białka opiekuńcze (chaperony) [14,18,47]. Są one pierwszymi strukturami odpowiedzialnymi za przyjęcie przez białko prawidłowej struktury przestrzennej. Chaperony wiążą się 188 z nowo powstającym białkiem, zapobiegając błędnemu zwijaniu się łańcucha polipeptydowego. Promują tym samym przyjęcie najbardziej korzystnej energetycznie, stabilnej struktury przestrzennej, umożliwiającej prawidłowe funkcjonowanie białka. Rola białek opiekuńczych na tym się jednak nie kończy. Biorą one również udział w: wyłapywaniu źle sfałdowanych białek, ułatwianiu ich ponownego, poprawnego zwinięcia, translokacji nowo powstałych białek do miejsca ich przeznaczenia, tworzeniu oligomerów białkowych oraz obronie komórki przed następstwami stresu [27,47]. Mimo obecności białek opiekuńczych, zdarzyć się może, że proces fałdowania łańcucha polipeptydowego, przebiegnie nieprawidłowo. W takim wypadku rozpoczyna swoją działalność system ubikwityna-proteasom (UPS). Ubikwityna, białko bardzo konserwatywne ewolucyjnie, występuje m.in. w cytoplazmie oraz jądrze komórkowym. Jej funkcja polega na rozpoznawaniu, a następnie znakowaniu zdegenerowanych białek. Tak oznaczone białka trafiają do struktur, zwanych proteasomami. To właśnie w proteasomach, dzięki obecności proteaz, zachodzi właściwa degradacja łańcucha polipeptydowego. W warunkach prawidłowych, właśnie w ten sposób dochodzi do eliminacji białek z komórki. Odkładanie patologicznych białek zaczyna się, gdy UPS jest zaburzony [14,47]. Agregacja patologicznych białek i ich neurotoksyczność Patologiczne zmiany obserwowane w neuronach są wynikiem agregacji zdegenerowanych postaci białek. Patologiczne białka nabywają skłonności do agregacji,
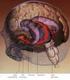
3 Szwed A. i Miłowska K. Rola białek w chorobach neurodegeneracyjnych Ryc. 1. Schemat agregacji białka o nieprawidłowej strukturze gdy w komórce znajduje się ich wystarczająca ilość. Taka sytuacja zdarza się, gdy system kontroli białek zawiedzie (ryc. 1). Powstają wtedy agregaty białkowe, które mogą mieć różny skład i umiejscowienie w neuronie [34,47]. Zwykle zbudowane są one ze struktur białkowych, zawierających strukturę b-harmonijki, zwanych amyloidem. Ich cechą charakterystyczną jest oporność na działanie enzymów proteolitycznych oraz nierozpuszczalność [34,41]. Ważnym elementem podczas tworzenia agregatów białkowych jest wytworzenie jądra agregacji. Wokół zbudowanego z oligomerów białkowych jądra agregują monomery peptydowe, w wyniku czego powstają w pierwszym rzędzie protofilamenty, a następnie coraz większe struktury włókienkowe. Cały proces, zachodzący w uporządkowany sposób, jest dla komórki niekorzystny ze względów energetycznych [14]. Skutkiem tego zjawiska jest zaburzenie funkcji komórki, co w konsekwencji prowadzi do jej śmierci [14,47]. Jak się więc wydaje, zaburzenia w procesie fałdowania oraz eliminacji jego produktów, mogą mieć istotne znaczenie w patogenezie chorób neurodegeneracyjnych [14,47]. W ostatnich latach pojawiło się wiele prac wykazujących, że odpowiedzialne za neurodegenerację są nie tylko złogi białkowe [14]. Są one przypuszczalnie nieaktywne lub ich rola polega na izolacji zdegenerowanych białek. Zapobiega to wzajemnemu oddziaływaniu między tymi białkami a składnikami komórki. Neurotoksyczne dla komórki mogą być z kolei, powstające podczas agregacji, pośrednie formy strukturalne, takie jak rozpuszczalne oligomery białkowe oraz protofibryle. Prawdopodobnie zaburzają one funkcję kanałów jonowych i powodują wzrost przepuszczalności błon komórkowych oraz działają na struktury komórkowe czy też zakłócają wewnątrzkomórkowe szlaki sygnałowe. Prawidłowo funkcjonujący organizm w wyniku apoptozy eliminuje komórki zawierające patologiczne białka. Jest to mechanizm pozwalający na uśmiercenie uszkodzonej komórki bez wpływu na sąsiednie komórki oraz bez wywołania stanu zapalnego [14]. Białka odpowiedzialne za choroby neurodegeneracyjne a-synukleina w chorobie Parkinsona Choroba Parkinsona (PD), to choroba neurodegeneracyjna dotykająca 2 3% populacji po 65 roku życia, znacznie Ryc. 2. Struktura molekularna oraz charakterystyka funkcjonalna α-synukleiny częściej występująca w postaci sporadycznej niż rodzinnej [5,13,33,36]. Najbardziej charakterystycznymi objawami klinicznymi dla tej choroby są: sztywność mięśni, bradykinezja, drżenie spoczynkowe oraz zaburzenia postawy ciała. Pojawienie się objawów jest wynikiem degeneracji neuronów dopaminergicznych, w części zbitej istoty czarnej oraz neuronów monoaminergicznych w pniu mózgu [26,41,45]. W obszarach mózgu objętych procesem patologicznym obserwuje się, poza utratą neuronów dopaminergicznych, glejozę oraz występowanie ciał Lewy ego (LB). LB są to eozynofilne złogi obecne w cytoplazmie komórek nerwowych złożone głównie z a-synukleiny [33,47]. a-synukleina (AS) jest 140-aminokwasowym białkiem występującym głównie w zakończeniach presynaptycznych neuronów. W stanie fizjologicznym, natywna a-synukleina, jest niepofałdowana, dobrze rozpuszczalna oraz termostabilna [46]. Struktura pierwszorzędowa a-synukleiny charakteryzuje się obecnością trzech regionów (ryc. 2): regionu N-końcowego (aminokwasy 1-60) zawierającego cztery 11-aminokwasowe powtórzenia, ze stałym motywem KTKEGV. Domena ta zaangażowana jest w wiązanie lipidów. W wyniku przyłączenia lipidu AS przyjmuje, w znacznej części, konformację a-helisy, która jest niezbędna do jej prawidłowego funkcjonowania. Ponadto w obrębie domeny N-końcowej znajdują się trzy punktowe mutacje związane z występowaniem dziedziczonego autosomalnie dominująco parkinsonizmu rodzinnego; regionu (aminokwasy 61 95) składającego się z silnie hydrofobowej, amyloidogennej sekwencji NAC (non- -Ab-component of AD amyloid) oraz trzech 11-aminokwasowych powtórzeń, ze stałym motywem KTKEGV. Prawdopodobnie to właśnie ta domena jest odpowiedzialna za agregację a-synukleiny; regionu C-końcowego (aminokwasy ) bogatego w prolinę, kwas asparaginowy oraz kwas glutaminowy. Region ten odgrywa ważną rolę w zapobieganiu agregacji włókienek AS, skutkom stresu oksydacyjnego oraz wykazuje aktywność chaperonową [6,11,16,32,46]. Pomimo dobrze poznanej budowy a-synukleiny, jej funkcja w organizmie nie została do końca wyjaśniona. Wydaje się, że ma ona swój udział w plastyczności synaptycznej, syntezie i uwolnieniu neuroprzekaźników, regulacji transportu pęcherzykowego oraz w utrzymaniu homeostazy dopaminy [11,37,43]. Jaki natomiast jest jej związek z chorobą Parkinsona? 189
4 Postepy Hig Med Dosw (online), 2012; tom 66: Istnieje wyraźny związek pomiędzy występowaniem mutacji punktowych w N-końcowym regionie AS, a parkinsonizmem rodzinnym. Mutacje zmiany sensu A30P, E46K, A53T, są dziedziczone autosomalnie dominująco i zawsze skutkują zmianami patologicznymi w istocie czarnej. Jest to jednak rzadko występująca postać choroby Parkinsona [39,55]. Przyczyna sporadycznego parkinsonizmu, występującego z większą częstotliwością jest niewyjaśniona. Czy są podstawy by szukać związku pomiędzy a-synukleiną, a degeneracją neuronów dopaminergicznych? Funkcją neuronów dopaminergicznych jest synteza i uwalnianie dopaminy. Dopamina (DA) jest neuroprzekaźnikiem z grupy katecholamin. Jej główna rola w układzie pozapiramidowym, to kontrola ruchu, napięcia mięśni i koordynacji. Dopamina jest syntetyzowana dwuetapowo w cytosolu z tyrozyny. Enzymami biorącymi udział w tej rekcji są: hydroksylaza tyrozynowa (TH) i dekarboksylaza aromatycznych L-aminokwasów (AADC). W pierwszym etapie TH przekształca tyrozynę do L-3,4- dihydroksyfenyloalaniny (L-DOPA). Następnie, w reakcji katalizowanej przez AADC, z L-DOPA powstaje dopamina [11,49]. Zsyntetyzowana w cytosolu dopamina, przez pęcherzykowy transporter monoamin (VMAT2), jest natychmiast transportowana do wnętrza pęcherzyków synaptycznych. Stąd w wyniku egzocytozy uwalniana jest do przestrzeni synaptycznej, gdzie wychwytywana jest przez transporter dopaminy (DAT). DAT transportuje DA z powrotem do cytosolu. Z udziałem VMAT2 jest ona ponownie pakowana do pęcherzyków, a następnie degradowana [10]. Degradacja dopaminy przez oksydazę monoaminową oraz dehydrogenazę aldehydową do nietoksycznego kwasu 3,4-dihydroksyfenylooctowego (DOPAC) i nadtlenku wodoru (H 2 O 2 ) lub jej transport do wnętrza lizosomów również się zdarza, jeśli jej ilość w cytoplazmie przekracza normę. W przypadku, gdy w cytoplazmie znajduje się nadmiar DA, w warunkach fizjologicznego ph oraz w obecności O 2, dochodzi do spontanicznego utleniania. Powstają wówczas toksyczne dla komórki rodniki hydroksylowe, anionorodniki ponadtlenkowe oraz chinony. Wynika z tego, że każde zaburzenie homeostazy dopaminy może mieć negatywny wpływ na neurony dopaminergiczne [7]. Jednym z czynników odpowiedzialnych za utrzymanie homeostazy dopaminy jest AS. Stąd wniosek, że AS ma funkcje ograniczone tylko do obszaru neuronów dopaminergicznych, a więc jest niezbędna do ich prawidłowego funkcjonowania [49]. Jak sugerują badania, a-synukleina ma zdolność do zmniejszania stopnia ufosforylowania TH. Dzięki zmianie stopnia fosforylacji, AS może się wiązać z hydroksylazą tyrozynową, hamując w ten sposób jej aktywność. Wynikałoby z tego, że a-synukleina wpływa pośrednio na biosyntezę dopaminy przez regulację ekspresji aktywności TH [11,49]. AS wpływa również na pęcherzykowy transporter monoamin, który jest odpowiedzialny za transport dopaminy do pęcherzyków synaptycznych. We wnętrzu pęcherzyków panuje ph niższe od ph w cytosolu, co zapobiega utlenianiu dopaminy. W przypadku kiedy dochodzi do nadekspresji AS, ilość VMAT2 maleje, co prowadzi do niekorzystnej akumulacji DA w cytoplazmie [7,11]. Ma ona również swój negatywny wpływ na transporter dopaminy, odpowiedzialny za regulację stężenia DA w przestrzeni synaptycznej [35]. Wynika z tego, że odpowiednie stężenie a-synukleiny w istocie czarnej jest 190 niezbędne do prawidłowego funkcjonowania układu ruchu. Każde zaburzenie jej stężenia wpływa niekorzystnie na neurony dopaminergiczne, a więc również jej agregacja [11]. W stanie fizjologicznym a-synukleina występuje w postaci niesfałdowanych monomerów lub w przypadku związania z lipidami, a-helisy. Monomery a-synukleiny, przyjmując strukturę b-kartki, stają się zdolne do agregacji. W wyniku ich agregacji powstają oligomery, tworzące następnie fibryle, będące głównymi składnikami ciał Lewy ego. Istnieje też przypuszczenie, że pewne produkty metabolizmu dopaminy mogą wchodzić w interakcje z AS. Co więcej, że mają one zdolność do stabilizowania włókienek a-synukleiny oraz hamują proces mający na celu przywrócenie jej prawidłowej struktury. Wynikałoby z tego, że nadmiar DA w cytoplazmie neuronów, sprzyja tworzeniu agregatów białkowych [10]. a-synukleina to tylko jedna z przyczyn choroby Parkinsona. Istnieje wiele innych czynników, nie do końca wyjaśnionych, składających się na etiologię tej choroby. W pracach naukowych proponuje się wpływ zarówno środowiska, wieku, uwarunkowań genetycznych, jak i innych czynników. Wydaje się jednak, że najistotniejsza rola przypada właśnie a-synukleinie [26]. Taupatie Taupatie to wspólna nazwa grupy chorób związanych z patologią białka tau. Należą tu m.in. choroba Alzheimera (AD), postępujące porażenie nadjądrowe (PSP), zwyrodnienie korowo-podstawne (CBD) oraz otępienie czołowo- -skroniowe (FTD) [9,20]. Charakterystyczną cechą wyżej wymienionych chorób jest neurodegeneracja swoistych obszarów mózgu, która związana jest z występowaniem patologicznych złogów białka tau [3,44]. W przypadku AD neurodegeneracja zaczyna się w strukturach układu limbicznego, ciele migdałowatym oraz w jądrze Meynerta. Następnie proces ten obejmuje korę mózgową i jądra podstawy. Zmiany patologiczne w tych obszarach wywołują objawy charakterystyczne dla choroby Alzheimera czyli zaburzenia pamięci, uwagi, mowy, orientacji wzrokowo-przestrzennej oraz praksję. Jedną z przyczyn tych zmian jest odkładanie się nieprawidłowego białka tau w postaci splątków neurofibrylarnych (NFT) lub plak neurotycznych [21]. Drugą z przyczyn jest agregacja b-amyloidu, która zostanie omówiona w następnym rozdziale. Postępujące porażenie nadjądrowe oraz zwyrodnienie korowo-podstawne są to choroby wchodzące w skład tzw. zespołu parkinsonizm-plus. Charakterystycznymi objawami PSP są m.in.: zaburzenie pionowych ruchów gałek ocznych (szczególnie ku dołowi), spowolnienie ruchów skokowych gałek, zaburzenia odruchów podstawnych, dodatnie objawy piramidowe, sztywność, zespół rzekomoopuszkowy, poszerzenie układu komorowego oraz neurodegeneracja w obrębie pnia mózgu. Ponadto jest to szybko postępująca choroba doprowadzająca do śmierci już po kilku latach [54]. Natomiast w przebiegu zwyrodnienia korowo-podstawnego (CBD) obserwuje się: asymetryczny zanik korowo-podkorowy, osłabienie metabolizmu w obszarze czołowo-ciemieniowo-skroniowym oraz w jądrach podstawy, objawy pozapiramidowe charakteryzujące się początkową asymetrią, uczucie
5 Szwed A. i Miłowska K. Rola białek w chorobach neurodegeneracyjnych obcości kończyny powiązane z jej apraksją, mioklonie, zaburzenia czucia. Mogą występować również, aczkolwiek rzadko, zaburzenia ruchów pionowych gałek ocznych, zespół rzekomoopuszkowy oraz zaburzenia funkcji podstawowych. Przyczyną degeneracji neuronów w PSP i CBD jest agregacja białka tau, w neuronach i komórkach gleju, w postaci splątków neurofibrylarnych. W obszarach patologicznie zmienionych obserwuje się występowanie achromatycznych, balonowato rozdętych neuronów (komórek Picka) oraz zasadochłonne wtręty w astrogleju [24]. Choroba Picka, warianty czołowy i skroniowy otępienia czołowo-skroniowego, otępienie czołowo-skroniowe z parkinsonizmem czy afazja pierwotnie postępująca (PPA) to przykłady chorób należących do zespołu otępień czołowo- -skroniowych. Wśród tej grupy schorzeń wyróżnia się taupatie związane z mutacjami genu kodującego białko tau. Charakterystycznymi objawami dla tej grupy są: zanik płatów czołowych i przedniej części płatów skroniowych, zmiany w obszarze wzgórza, układu limbicznego i prążkowia, występowanie splątków neurofibrylarnych i ciałek Picka oraz w 25% przypadków komórek Picka. U osób chorych obserwuje się m.in. utratę świadomości osobistej i społecznej, agresywne zachowanie, okazywanie popędu seksualnego, zaburzenia koncentracji oraz zaburzenia mowy, a w późniejszym okresie zespół pozapiramidowy z akinezją, drżenie i sztywność [38]. Poza wyżej wymienionymi przykładami do taupatii zaliczamy również otępienie z ziarnami argentofilnymi, zwyrodnienie korowo-podstawne, encefalopatię bokserską, zespół Downa, zanik wieloukładowy oraz wiele innych. Ich wspólną cechą jest występowanie patologicznego zmienionego białka tau, które jest zdolne do agregacji. W zależności od obszaru mózgu dotkniętego procesem chorobotwórczym można wyróżnić inną taupatię [3,44]. Białko tau (MAP-tau), należące do rodziny białek związanych z mikrotubulami (MAP), zostało odkryte w 1975 roku. Jego główna rola związana jest ze składaniem i stabilizacją mikrotubul, co ma istotne znaczenie dla prawidłowego funkcjonowania cytoszkieletu. Ekspresja tego cytoplazmatycznego białka, zachodzi głównie w komórkach nerwowych. MAP-tau jest zaangażowane w transport aksonalny postępujący, w związku z czym to właśnie w aksonach obserwuje się jego największą koncentrację [20,28]. Białko tau jest kodowane przez gen znajdujący się na 17 chromosomie człowieka. Składa się on z co najmniej 16 eksonów, a w wyniku jego ekspresji, w ośrodkowym systemie nerwowym (CNS), może powstawać nawet sześć różnych izoform MAP-tau [51]. Powstawanie izoform jest wynikiem potranskrypcyjnego alternatywnego składania eksonów 2, 3 i 10. Stosunek ilościowy izoform zmienia się podczas rozwoju. Wydaje się również, że różne neurony mają inne izoformy białka tau [20]. W strukturze białka tau można wyróżnić cztery regiony: region N-końcowy, kodowany przez eksony 1 5, przy czym eksony 2 i 3 kodują wstawki w tym regionie. W zależności od liczby wstawek, wyróżniamy izorformy: 0N (brak wstawek), 1N (jedna wstawka kodowana przez ekson 2), 2N (dwie wstawki kodowane przez eksony 2 i 3). Należy tu również zaznaczyć, że ekson 2 może występować samodzielnie, natomiast występowanie eksonu 3 jest uzależnione od występowania eksonu 2. Ekson 4A, którego ekspresja ograniczona jest do obwodowego systemu nerwowego (PNS), koduje białko zwane big tau, o masie ~100 kda; region bogaty w prolinę, kodowany przez ekson 7 i pierwszą połowę eksonu 9; region odpowiedzialny za wiązanie białka tau z mikrotubulami, kodowany przez eksony Zawierają 3 lub 4 powtórzenia aminokwasowe, będące domenami wiążącymi mikrotubule (MBDs). Domeny te zawierają stały motyw KXGS, w którym seryna może ulegać fosforylacji. Liczba powtórzeń zależy od obecności 10 eksonu. Jeżeli jest on obecny, powstaje izoforma 4R, zawierająca cztery powtórzenia. Jeśli go brak, mamy do czynienia z izoformą 3R; region C-końcowy, kodowany przez ekson 13 [20,28]. Ważną rolę w zachowaniu prawidłowego funkcjonowania białka tau pełni stosunek izoformy 4R do 3R. Ze względu na to, że izoforma 4R w porównaniu do 3R, wykazuje większe powinowactwo do mikrotubul, zmiany stosunku 4R/3R zaburzają prawidłowe funkcjonowanie białka tau. Stąd wniosek, że rolę w neurodegeneracji może odgrywać również alternatywny splicing, od którego zależy powstawanie tych dwóch izoform [44]. Na stopień złożoności izoform, wpływają dodatkowo ich potranslacyjne modyfikacje. Do tych modyfikacji zaliczamy m.in: fosforylację, glikozylację, ubikwitynację, deaminację oraz oksydację [20]. W fizjologicznym stanie, wszystkie wyżej wymienione procesy mają na celu regulację zdolności wiązania się białka tau do mikrotubul. Największe znaczenie przypisuje się jednak procesowi fosforylacji [44]. Ma to związek z odkryciem, że głównym składnikiem helikalnie zwiniętych sparowanych włókienek (PHF) jest hiperufosforylowane MAP-tau [51]. Za stopień fosforylacji białka tau odpowiadają kinazy i fosfatazy. Kilka z nich zostało powiązanych z zaburzoną fosforylacją MAP-tau. Do grupy tych enzymów zaliczamy m.in.: kinazę regulującą powinowactwo MARK (microtubul affinity regulating kinase), cyklinozależną kinazę 5 (Cdk5), kinazę syntazy glikogenu 3b (GSK3b) oraz fosfatazę białkową 2A [44]. Kinazy katalizują przyłączenie grupy fosforanowej podczas reakcji estryfikacji, do jednego z trzech aminokwasów: seryny (S), treoniny (T) lub tyrozyny (Y), występujących w cząsteczce MAP-tau. W najdłuższej izoformie białka tau, występującej w CNS, znajduje się aż 85 możliwych miejsc fosforylacji [20,28]. W chwili zaburzenia równowagi pomiędzy kinazami, a fosfatazami dochodzi do hiperfosforylacji MAP-tau. Nieprawidłowości te mogą być związane ze zwiększoną aktywnością kinaz lub też z obniżoną aktywnością fosfataz, odpowiedzialnych za defosforylację [51]. Wysoki stopień fosforylacji cząsteczki MAP-tau wpływa na zmniejszenie jej powinowactwa do mikrotubul, uniemożliwiając proces prawidłowego ich składania. Skutkiem tego jest zaburzenie stabilności cytoszkieletu. Ufosforylowane białko tau ma również zdolność do wiązania się z mikrotubulami, w miejscach przeznaczonych dla kinezyn, czego konsekwencją jest zaburzenie transportu aksonalnego [20,28]. Ponadto, jak zaznaczono wcześniej, hiperufosforylowane białko tau jest głównym składnikiem PHF. Natomiast agregacja PHF prowadzi do powstania splątków neurofibrylarnych (ryc. 3), charakterystycznych złogów białkowych m.in. dla choroby Alzheimera 191
6 Postepy Hig Med Dosw (online), 2012; tom 66: Ryc. 3. Schemat agregacji białka tau Ryc. 4. Schemat powstawania blaszek starczych [28]. Należy jednak zaznaczyć, że nie są to jedyne postaci agregatów, w powstaniu których odgrywa rolę hiperufosforylowane białko tau. Ma ono również swój udział w formowaniu ciałek Picka [44]. Uważa się, że proces agregacji MAP-tau jest wieloetapowy. W pierwszym etapie ulega procesowi fosforylacji i odłączenia od mikrotubul. Następnie hiperufosforylowane MAP-tau przemieszcza się do obszaru somatodendrytycznego, gdzie dochodzi jeszcze do fosforylacji oraz zmian strukturalnych. W konsekwencji prowadzi to do jego agregacji w postaci splątków neurofibrylarnych. Wykazano, że fosforylacja w odpowiednich miejscach (Ser396 i Ser404) jest związana ze zwiększeniem skłonności do formowania PHF. Występujące w aksonach i dendrytach agregaty białka tau noszą nazwę nici neuropilowych. Mechanizmy toksycznego wpływu agregatów białka tau na neurony nie są do końca poznane. Spekuluje się jednak, że nie same agregaty są toksyczne, a postaci pośrednie prowadzące do ich powstania, takie jak np. oligomery. Prawdą jest jednak, że nieprawidłowe funkcjonowanie białka tau skutkuje najpierw zaburzeniami funkcji neuronu, a w konsekwencji jego śmiercią. W przypadku taupatii białko tau jest głównym, lecz prawdopodobnie nie jedynym czynnikiem warunkującym chorobę [44]. b-amyloid a choroba Alzheimera Choroba Alzheimera (AD) jest najczęstszą przyczyną demencji. W 2006 roku cierpiało na nią aż 26,6 mln ludzi na całym świecie. Około 15% wszystkich przypadków AD to postać rodzinna, związana z mutacjami genów APP, PSEN1 i PSEN2. Natomiast pozostałe 85% przypadków to postać sporadyczna. Do czynników ryzyka związanych z występowaniem sporadycznej postaci AD należy polimorfizm genu APOE (apolipoproteiny E). Obecność allelu e4 zwiększa ryzyko wystąpienia choroby trzykrotnie u heterozygot i aż 15-krotnie u homozygot [8,38]. Dzięki szczegółowym badaniom nad AD udało się powiązać jej patogenezę z białkiem tau i b-amyloidem (Ab) [8]. 192 Wydaje się, że neurodegeneracja w AD jest procesem kaskadowym, a swoją rolę odgrywają w niej: zewnątrzkomórkowa agregacja b-amyloidu w postaci blaszek starczych, hiperfosforylacja i wewnątrzkomórkowa agregacja białka tau w postaci splątków neurofibrylarnych oraz stres oksydacyjny [19]. W poprzednim rozdziale omówiono rolę MAP-tau, jako jednego z czynników etiologicznych AD. Zmiany związane z patologią b-amyloidu i jego agregacją dotyczą tych samych obszarów mózgu, co w przypadku białka tau. Ab jest aminokwasowym peptydem, uwalnianym z większego białka prekursora b-amyloidu (APP) [38,48]. APP jest białkiem transbłonowym, najczęściej występującym w jednej z trzech izoform: APP695, APP751, APP770. Powstawanie izoform o długości 695, 751 i 770 aminokwasów jest wynikiem alternatywnego splicingu genu APP. Natomiast proteoliza białka, będącego produktem tego genu, może zachodzić jedną z dwóch alternatywnych dróg [29]. W sposób amyloidogenny, b-sekretaza (BACE) hydrolizuje łańcuch polipeptydowy APP770 po 671 aminokwasie. W rezultacie zostaje uwolniony duży fragment rozpuszczalnego b-sapp. Pozostały zakotwiczony w błonie peptyd o długości 99 aminokwasów (C99) ulega dalszej hydrolizie przez kompleks g-sekretazy [19,29]. W prawidłowych warunkach w wyniku tego procesu powstaje głównie Ab40 oraz w mniejszym stopniu Ab42 [15]. W sposób nieamyloidogenny bierze udział a- i g-sekretaza. Następstwem działania a-sekretazy jest uwolnienie rozpuszczalnego a-sapp i pozostawienie związanego z błoną fragmentu składającego się z 83 reszt aminokwasowych (C83). C83 jest następnie poddany działaniu kompleksu g-sekretazy, w wyniku czego powstają peptydy p3 [29]. Prawidłowo uwalnia się z komórki b-amyloidu 90% Ab40, a pozostałe 10% to Ab42. Ab40 wydaje się mieć znaczenie w późniejszych fazach choroby Alzheimera. Złożony z 42 reszt aminokwasowych b-amyloid, jest ważnym czynnikiem w patogenezie AD. W porównaniu z Ab40 jest on bardziej podatny na agregację. W związku z tym to właśnie Ab42 jest głównym składnikiem blaszek starczych. Toksyczność złogów Ab objawia się głównie: uszkodzeniami synapsy, zaburzeniami homeostazy jonów wapnia, stresem oksydacyjnym oraz indukcją
7 Szwed A. i Miłowska K. Rola białek w chorobach neurodegeneracyjnych apoptozy [19,50]. Proces powstawania blaszek starczych schematycznie przedstawiono na ryc. 4. Szczegółowe badania dotyczące patogenezy AD dostarczają dowodów potwierdzających hipotezę kaskady amyloidowej [19]. Według tej hipotezy zaburzenia równowagi pomiędzy tworzeniem, a degradacją b-amyloidu są źródłem zmian patologicznych w mózgu. Wynika z tego, że pierwotnym zdarzeniem w patogenezie AD jest odkładnie się Ab w postaci blaszek starczych, natomiast pozostałe zmiany mają charakter wtórny [8]. Choroby prionowe Choroby prionowe (PrD) czy też pasażowalne encefalopatie gąbczaste (TSE) znalazły się w centrum zainteresowania naukowców ze względu na ryzyko przenoszenia się ich ze zwierząt na ludzi. Co ciekawe, okazało się, że czynnikiem infekcyjnym w przypadku tych chorób są białka zwane prionami. Za odkrycie tych białkowych cząstek infekcyjnych S. Prusiner w 1997 roku otrzymał Nagrodę Nobla. Choroby prionowe to grupa stosunkowo rzadko występujących, śmiertelnych chorób. Ponadto są to choroby, które możemy zaliczyć zarówno do grupy chorób neurodegeneracyjnych jak i zakaźnych [22,30]. Toczący się w obszarze mózgu proces chorobotwórczy objawia się pewnymi zmianami w jego strukturze, tj. utratą neuronów, powstawaniem złogów patologicznego białka prionowego, wakuolizacją oraz proliferacją astrocytów. Wyżej wymienione zmiany skutkują powstaniem obrazu histopatologicznego przypominającego gąbkę [53]. Do PrD zaliczamy: chorobę Creutzfeldta-Jakoba (CJD), śmiertelną rodzinną bezsenność (FFI), chorobę Gerstmanna-Sträusslera-Scheinkera (GSS) oraz kuru. Należy jednak zaznaczyć, że spośród wymienionych chorób najczęściej występującą jest sporadyczna postać CJD (scjd) [23,52]. Choroby prionowe można podzielić na sporadyczne, dziedziczne i nabyte. Do pierwszej grupy zaliczamy sporadyczną postać choroby Creutzfeldta-Jakoba. scjd dotyczy zwykle osób w wieku lat. Charakteryzuje się postępującą demencją, ataksją oraz zaburzeniami widzenia i zachowania, a także objawami pozapiramidowymi i miokloniami. Wśród chorób dziedziczonych autosomalnie dominująco, związanych z mutacją w genie PRNP wyróżniamy: rodzinną postać CJD, śmiertelną rodzinną bezsenność oraz chorobę Gerstmanna-Sträusslera-Scheinkera [22]. Z rodzinną CJD powiązano ponad 10 mutacji typu substytucji lub insercji w sekwencjach oktapeptydowych. Objawy w tej postaci CJD są podobne jak w przypadku scjd. Natomiast rodzinna postać CJD dotyczy zazwyczaj osób poniżej 55 roku życia, a zgon następuje od jednego roku do pięciu lat [30]. Choroba Gerstmanna-Sträusslera-Scheinkera (GSS) objawia się przede wszystkim postępującym zespołem móżdżkowym. Inne objawy to m.in. demencja oraz porażenie rzekomoopuszkowe [17]. Choroba pojawia się zazwyczaj pomiędzy 50 a 60 rokiem życia i trwa 5 6 lat. Śmiertelna bezsenność rodzinna (FFI) może się zacząć rozwijać między 20 a 60 rokiem życia. W przypadku tej choroby śmierć następuje po około 15 miesiącach [22]. Objawami charakterystycznymi dla FFI są: zmiany rytmu dobowego, bezsenność, dysregulacja autonomicznego układu nerwowego, demencja oraz mioklonie [17]. Do grupy nabytych PrD zaliczamy również jatrogenną CJD (icjd), kuru oraz wariant CJD (vcjd). Jatrogenna, czyli inaczej przepasażowana CJD jest wynikiem zarażenia prionami. Do zainfekowania dochodzi najczęściej w wyniku spożycia mięsa zwierząt chorych. Objawy wynikające z postępu choroby są podobne do objawów przy scjd [22]. Ponadto icjd charakteryzuje się długim okresem inkubacji, od 1,5 roku do nawet 18 lat [17]. Kuru, to choroba zakaźna występująca tylko u członków plemienia Fore w Papui Nowej Gwinei. Przekazywanie tej choroby w transmisji horyzontalnej miało prawdopodobnie związek z rytuałami kanibalistycznymi. Kuru najczęściej dotyczyło kobiet i dzieci powyżej 4 lat. W zależności od drogi zarażenia różni się okresem inkubacji, który może trwać nawet do kilkudziesięciu lat. Objawami charakterystycznymi dla kuru są: zaburzenia równowagi, intensywne drżenie, dyzartria oraz dysfagia. Ostatnim przykładem choroby nabytej jest tzw. wariant CJD. vcjd jest skutkiem spożycia przez człowieka mięsa bydła chorego na bydlęcą encefalopatię gąbczastą (BSE), tzw. chorobą szalonych krów. W przebiegu tej choroby typowymi objawami są: depresja, lęk, agresywność, zaburzenia urojeniowe, demencja, mioklonie, drżenie, objawy móżdżkowe i piramidowe. vcjd w przeciwieństwie do scjd dotyka zazwyczaj osób poniżej 40 roku życia, a śmierć następuje po około 14 miesiącach [17,22,40]. Choroby prionowe są charakteryzowane przez obecność u osób chorych patologicznego białka prionowego PrP Sc. Białko takie powstaje w wyniku zmian konformacyjnych fizjologicznie występującego PrP C [23,52]. Prawidłowe białko prionowe (PrP C ), jest umiejscowione na powierzchni błony komórkowej i związane z nią poprzez C-końcowy fragment glikozylofosfatydyloinozytolu (GPI). Jest syntetyzowane przez komórki ssaków, ptaków, a także owadów, drożdży i grzybów nitkowych. PrP C jest obecne głównie na neuronach mózgu i rdzenia kręgowego, w mniejszym stopniu na komórkach gleju oraz innych komórkach poza centralnym układem nerwowym, m.in. leukocytach oraz niedojrzałych immunocytach [52,53]. Funkcja tego białka jak dotąd nie została poznana [25]. Biosynteza PrP C zachodzi w sposób analogiczny do innych białek. W wyniku procesów najpierw transkrypcji oraz translacji, a następnie modyfikacji potranslacyjnych powstaje funkcjonalne, dojrzałe 208-aminokwasowe białko, które jest translokowane na powierzchnię komórki. PrP C jest glikoproteiną i na N-końcu ma dołączone dwa łańcuchy oligosacharydowe [30,52]. W prawidłowo działającej komórce białka o zaburzonej konformacji są degradowane przez proteinazy w lizosomach [53]. Patologiczne białko prionowe od fizjologicznego różni się strukturą drugorzędową. W pierwszym przypadku jest to b-kartka, w drugim zaś a-helisa. Ma to wpływ na strukturę przestrzenną oraz właściwości obu izoform. Nie ma natomiast różnicy w sekwencji aminokwasowej [47]. W przypadku PrP Sc przewaga domen b-kartki skutkuje równoległym ułożeniem łańcuchów aminokwasowych. Cząsteczka przyjmuje postać liniową, co sprawia, że jest ona oporna na działanie czynników enzymatycznych i fizykochemicznych. PrP Sc, w przeciwieństwie do PrP C, jest nierozpuszczalne i częściowo oporne na działanie proteinazy K, przez co niemożliwa jest jego degradacja. Co więcej, PrP Sc jest również odporne na działanie promieni UV, wysokiej temperatury oraz na standardową sterylizację [2,53]. Najważniejszą cechą PrP Sc jest jego zdolność do agregacji. 193
8 Postepy Hig Med Dosw (online), 2012; tom 66: Ryc. 5. Schemat obrazujący hipotezę infekcyjności prionów Ma to zasadnicze znaczenie w patogenezie chorób prionowych. Patologiczne białko prionowe odkłada się w postaci płytek lub włókienek amyloidowych w centralnym układzie nerwowym osób chorych. Twory te działają toksycznie na komórki, wewnątrz których się znajdują [53]. Choroby prionowe to choroby charakteryzujące się szybkim postępem. W przebiegu tych chorób można wyróżnić trzy fazy: infekcji i replikacji w obwodowym układzie nerwowym, neuroinwazji, neurodegeneracji. W pierwszej fazie dochodzi do replikacji prionów. Proces ten zachodzi głównie w tkankach limfoidalnych, m.in. śledzionie i węzłach chłonnych. Następnie dochodzi do tzw. transmigracji czynnika zakaźnego z miejsc replikacji do ośrodkowego układu nerwowego. To właśnie w obrębie ośrodkowego układu nerwowego dochodzi do nieodwracalnych zmian neurodegeneracyjnych, konsekwencją czego jest śmierć osobnika [2]. Interesujące wydaje się to, że pojawienie się w organizmie PrP Sc nie indukuje odpowiedzi immunologicznej [53]. Skąd infekcyjność białek prionowych? Hipoteza dotycząca prionów zakłada, że zmienione konformacyjnie, patologiczne białko, katalizuje reakcję przejścia fizjologicznego białka w patologiczne (ryc. 5) [4,40]. Ze względu na to, iż gen kodujący to białko (PRNP) występuje nie tylko u ludzi, ale także u wszystkich innych kręgowców, choroby prionowe mogą być przenoszone międzygatunkowo [30,53]. Źródła PrD mogą być egzo- lub endogenne. W przypadku tych pierwszych, czynnik zakaźny, czyli w tym wypadku PrP Sc, dostaje się do organizmu najczęściej drogą oralną lub poprzez transfuzje krwi. Gdy mówimy o endogennych PrD, mamy na myśli te związane z mutacjami spontanicznymi w komórkach gospodarza [53]. Inne przykłady chorób neurodegeneracyjnych Do grupy chorób związanych z akumulacją patologicznych białek poza wyżej wymienionymi zalicza się jeszcze m.in. chorobę Huntingtona (HD) i stwardnienie zanikowe boczne (ALS) [14,41]. Choroba Huntingtona, to choroba dziedziczona autosomalnie dominująco. Przyczyną degeneracji neuronów jest pierwotnie mutacja w genie huntingtyny. Mutacja ta polega na zwiększeniu liczby powtórzeń CAG, kodujących glutaminę; we fragmencie N-końcowym białka pojawia się ciąg powtórzeń glutaminy [41]. Huntingtyna w warunkach fizjologicznych jest białkiem obecnym w cytoplazmie nie tylko neuronów, ale także innych komórek. Białko to prawdopodobnie bierze udział w transporcie aksonalnym, aczkolwiek jego dokładna funkcja nie została poznana. Ekspresja patologicznej huntingtyny prowadzi do pojawienia się wewnątrzjądrowych oraz cytoplazmatycznych wtrętów w neuronach, szczególnie kory mózgu [1,12]. Stwardnienie zanikowe boczne jest postępującą śmiertelną chorobą wywołaną przez mutację w genie kodującym dysmutazę ponadtlenkową. Proces degeneracyjny obejmuje dolne neurony motoryczne rdzenia kręgowego oraz górne neurony motoryczne kory mózgowej. W związku z tym postępujący proces patologiczny skutkuje zaburzeniami ruchowymi [14,41]. Warto podkreślić, że szczegółowe badania dotyczące mechanizmów odpowiedzialnych za powstawanie tych chorób oraz zrozumienie toksycznego wpływu nieprawidłowych białek na neurony, może dać podstawy do opracowania efektywnych metod leczenia [47]. Piśmiennictwo [1] Agorogiannis E.I., Agorogiannis G.I., Papadimitriou A., Hadjigeorgiou G.M.: Protein missfolding in neurodegenerative diseases. Neuropathol. Appl. Neurobiol., 2004; 30: [2] Aguzzi A., Heikenwalder M., Miele G.: Progress and problems in the biology, diagnostics, and therapeutics of prion diseases. J. Clin. Invest., 2004; 114: [3] Avila J.: Tau aggregation into fibrillar polymers: taupathies. FEBS Lett., 2000; 476: [4] Baskakov I.V., Breydo L.: Converting the prion protein: what makes the protein infectious. Biochim. Biophys. Acta, 2007; 1772: [5] Bate C., Gentleman S., Williams A.: a-synuclein induced synapse damage is enhanced by amyloid-b1-42. Mol. Neurodegener., 2010; 5: 55 [6] Binolfi A., Rodriguez E.E., Valensin D., D Amelio N., Ippoliti E., Obal G., Duran R., Magistrato A., Pritsch O., Zweckstetter M., Valensin G., Carloni P., Quintanar L., Griesinger C., Fernández C.O.: Bioinorganic chemistry of Parkinson s disease: structural determinants for the copper-mediated amyloid formation of alpha-synuclein. Inorg. Chem., 2010; 49: [7] Bisaglia M., Mammi S., Bubacco L.: Kinetic and structural analysis of the early oxidation products of dopamine: analysis of the interactions with a-synuclein. J. Biol. Chem., 2007; 282:
9 Szwed A. i Miłowska K. Rola białek w chorobach neurodegeneracyjnych [8] Blennow K., de Leon M.J., Zetterberg H.: Alzheimer s disease. Lancet, 2006; 368: [9] Bulic B., Pickhardt M., Mandelkow E.M., Mandelkow E.: Tau protein and tau aggregation inhibitors. Neuropharmacology, 2010; 59: [10] Caudle W.M., Colebrooke R.E., Emson P.C., Miller G.W.: Altered vesicular dopamine storage in Parkinson s disease: a premature demise. Trends Neurosci., 2008; 31: [11] Cheng F., Vivacqua G., Yu S.: The role of alpha-synuclein in neurotransmission and synaptic plasticity. J. Chem. Neuroanat., 2011; 42: [12] Davies S., Ramsden D.B.: Huntington s disease. Mol. Pathol., 2001; 54: [13] Di Monte D.A., Lavasani M., Manning-Bog A.B.: Environmental factors in Parkinson s disease. Neurotoxicology, 2002; 23: [14] Dziewulska D., Rafałowska J.: Rola zaburzeń przestrzennej budowy białek w patomechanizmie chorób układu pozapiramidowego. Neurol. Neurochir. Pol., 2005; 39: [15] Findeis M.A.: The role of amyloid b peptide 42 in Alzheimer s disease. Pharmacol. Ther., 2007; 116: [16] Fink A.L.: The aggregation and fibrillation of a-synuclein. Acc. Chem. Res., 2006; 39: [17] Gelpi E., Kovacs G.G.: Prion diseases: a primer for general pathologists. Diagn. Histopathol., 2011; 17: [18] Gregersen N., Bolund L., Bross P.: Protein misfolding, aggregation, and degradation in disease. Methods Mol. Biol., 2005; 232: 3 16 [19] Hampel H., Shen Y., Walsh D.M., Aisen P., Shaw L.M., Zetterberg H., Trojanowski J.Q., Blennow K.: Biological markers of amyloid b- -related mechanisms in Alzheimer s disease. Exp. Neurol., 2010; 223: [20] Hernández F., Avila J.: Tauopathies. Cell. Mol. Life Sci., 2007; 64: [21] Heutink P.: Untangling tau-related dementia. Hum. Mol. Genet., 2000; 9: [22] Hirsch N.: Prion diseases. Anaesth. Intens. Care Med., 2010; 11: [23] Hu W., Kieseier B., Frohman E., Eagar T.N., Rosenberg R.N., Hartung H.P., Stüve O.: Prion proteins: physiological functions and role in neurological disorders. J. Neurol. Sci., 2008; 264: 1 8 [24] Jamrozik Z., Sławek J., Budrewicz S., Janik P., Friedman A., Rudzińska M., Kuźma M., Koszewicz M., Bogucki A., Gajos A.: Zwyrodnienie korowo-podstawne analiza kliniczna 17 chorych ze szczególnym uwzględnieniem objawów początkowych. Neurol. Neurochir. Pol., 2008; 42(Suppl. 1): S61 S66 [25] Kaski D., Mead S.: Prion diseases. Medicine, 2009; 37: [26] Kim S., Seo J.H., Suh Y.H.: a-synuclein, Parkinson s disease, and Alzheimer s disease. Parkinsonism Relat. Disord., 2004: 10(Suppl. 1): S9 S13 [27] Longshaw V.M., Nicoll W.S., Botha M., Ludewig M.H., Shonhai A., Stephens L.L., Blatch G.L.: Getting practical with molecular chaperones. Biotechnol. Int., 2006; 18: [28] Martin L., Latypova X., Terro F.: Post-translational modifications of tau protein: implications for Alzheimer s disease. Neurochem. Int., 2011; 58: [29] Marzolo M.P., Bu G.: Lipoprotein receptors and cholesterol in APP trafficking and proteolytic processing, implications for Alzheimer s disease. Semin. Cell Dev. Biol., 2009; 20: [30] Mastrianni J.A.: Prion diseases. Clin. Neurosci. Res., 2004; 3: [31] Miller N., Limited B.: The misfolding diseases unfold. beremans.com/pdf/the_misfolding_diseases_unfold.pdf ( ) [32] Milowska K., Malachowska M., Gabryelak T.: PAMAM G4 dendrimers affect the aggregation of a-synuclein. Int. J. Biol. Macromol., 2011; 48: [33] Moran L.B., Croisier E., Duke D.C., Kalaitzakis M.E., Roncaroli F., Deprez M., Dexter D.T., Pearce R.K., Graeber M.B.: Analysis of alpha-synuclein, dopamine and parkin pathways in neuropathologically confirmed parkinsonian nigra, Acta Neuropathol., 2007: 113: [34] Nalepa I.: O wspólnych korzeniach chorób neurodegeneracyjnych. ( ) [35] Oaks A.W., Sidhu A.: Synuclein modulation of monoamine transporters. FEBS Lett., 2011; 585: [36] Orr C.F., Rowe D.B., Halliday G.M.: An inflammatory review of Parkinson s disease. Prog. Neurobiol., 2002; 68: [37] Perez R.G., Hastings T.G.: Could a loss of a-synuclein function put dopaminergic neurons at risk? J. Neurochem., 2004; 89: [38] Pokryszko-Dragan A., Zagrajek M.M., Słotwiński K.: Taupatie choroby zwyrodnieniowe ośrodkowego układu nerwowego związane z patologią białka tau. Postępy Hig. Med. Dośw., 2005; 59: [39] Polymeropoulos M.H., Lavedan C., Leroy E., Ide S.E., Dehejia A., Dutra A., Pike B., Root H., Rubenstein J., Boyer R., Stenroos E.S., Chandrasekharappa S., Athanassiadou A., Papapetropoulos T., Johnson W.G., Lazzarini A.M., Duvoisin R.C., Di Iorio G., Golbe L.I., Nussbaum R.L.: Mutation in the a-synuclein gene identified in families with Parkinson s disease. Science, 1997: 276: [40] Riesner D.: Molecular basis of prion diseases. J. Neurovirol., 2002; 8(Suppl. 2): 8 20 [41] Ross C., Poirier M.: Protein aggregation and neurodegenerative disease. Nat. Med., 2004; 10(Suppl.): S10 S17 [42] Sokołowska D., Wendorff J.: Rola wolnych rodników w patogenezie chorób neurodegeneracyjnych. Studia Medyczne, 2009; 16: [43] Solecka J., Adamczyk A., Strosznajder J.B.: Alpha-synuclein in physiology and pathology of the brain. Postępy Biol. Kom., 2005; 2: [44] Spires-Jones T.L., Stoothoff W.H., de Calignon A., Jones P.B., Hyman B.T.: Tau pathophysiology in neurodegeneration: a tangled issue. Trends Neurosci., 2009; 32: [45] Sulzer D.: Multiple hit hypotheses for dopamine neuron loss in Parkinson s disease. Trends Neurosci., 2007; 30: [46] Tashiro M., Kojima M., Kihara H., Kasai K., Kamiyoshihara T., Uéda K., Shimotakahara S.: Characterization of fibrillation process of a- -synuclein at the initial stage. Biochem. Bioph. Res. Commun., 2008; 369: [47] Taylor J.P., Hardy J., Fischbeck K.H.: Toxic proteins in neurodegenerative disease. Science, 2002; 296: [48] Turner P.R., O Connor K., Tate W.P., Abraham W.C.: Roles of amyloid precursor protein and its fragments in regulating neural activity, plasticity and memory. Prog. Neurobiol., 2003; 70: 1 32 [49] Venda L.L., Cragg S.J., Buchman V.L., Wade-Martins R.: a-synuclein and dopamine at the crossroads of Parkinson s disease. Trends Neurosci., 2010; 33: [50] Verdile G., Fuller S., Atwood C.S., Laws S.M., Gandy S.E., Martins R.N.: The role of beta amyloid in Alzheimer s disease: still a cause of everything or the only one who got caught? Pharmacol. Res., 2004; 50: [51] Wang J.Z., Liu F.: Microtubule-associated protein tau in development, degeneration and protection of neurons. Prog. Neurobiol., 2008; 85: [52] Westergard L., Christensen H.M., Harris D.A.: The cellular prion protein (PrP C ): it s physiological function and role in disease. Biochim. Biophys. Acta, 2007; 1772: [53] Wierzbicka A., Deptuła W.: Rola układu odpornościowego w patogenezie chorób prionowych. Postępy Hig. Med. Dośw., 2008; 62: [54] Wierzbiński P., Szpilewska M., Gmiński B., Kuśmierek M., Florkowski A., Gałecki P.: Zespół depresyjny jako objaw postępującego porażenia nadjądrowego. Opis przypadku. Psych. Psychoter., 2010; 6: 3 10 [55] Zarranz J.J., Alegre J., Gómez-Esteban J.C., Lezcano E., Ros R., Ampuero I., Vidal L., Hoenicka J., Rodriguez O., Atarés B., Llorens V., Gomez Tortosa E., del Ser T., Munoz D.G., de Yebenes J.G.: The new mutation, E46K, of a-synuclein causes Parkinson and Lewy body dementia. Ann. Neurol., 2004; 55: Autorki deklarują brak potencjalnych konfliktów interesów. 195
BIOLOGICZNE MECHANIZMY ZACHOWANIA II JĄDRA PODSTAWY KRESOMÓZGOWIA I KONTROLA RUCHOWA
 BIOLOGICZNE MECHANIZMY ZACHOWANIA II JĄDRA PODSTAWY KRESOMÓZGOWIA I KONTROLA RUCHOWA MECHANIZMY KONTROLI RUCHOWEJ SYSTEMY ZSTĘPUJĄCE Korowe ośrodki motoryczne Kora motoryczna (planowanie, inicjacja i kierowanie
BIOLOGICZNE MECHANIZMY ZACHOWANIA II JĄDRA PODSTAWY KRESOMÓZGOWIA I KONTROLA RUCHOWA MECHANIZMY KONTROLI RUCHOWEJ SYSTEMY ZSTĘPUJĄCE Korowe ośrodki motoryczne Kora motoryczna (planowanie, inicjacja i kierowanie
Priony. co dobrego mówią nam drożdże? Takao Ishikawa Zakład Biologii Molekularnej Uniwersytet Warszawski
 Priony co dobrego mówią nam drożdże? Takao Ishikawa Zakład Biologii Molekularnej Uniwersytet Warszawski Choroba Kreutzfeldta-Jakoba Pierwsze opisy pochodzą z lat 30. XX wieku Zakaźna choroba, często rodzinna
Priony co dobrego mówią nam drożdże? Takao Ishikawa Zakład Biologii Molekularnej Uniwersytet Warszawski Choroba Kreutzfeldta-Jakoba Pierwsze opisy pochodzą z lat 30. XX wieku Zakaźna choroba, często rodzinna
BIOLOGICZNE MECHANIZMY ZACHOWANIA II JĄDRA PODSTAWY KRESOMÓZGOWIA I KONTROLA RUCHOWA
 BIOLOGICZNE MECHANIZMY ZACHOWANIA II JĄDRA PODSTAWY KRESOMÓZGOWIA I KONTROLA RUCHOWA MECHANIZMY KONTROLI RUCHOWEJ SYSTEMY ZSTĘPUJĄCE Korowe ośrodki motoryczne Kora motoryczna (planowanie, inicjacja i kierowanie
BIOLOGICZNE MECHANIZMY ZACHOWANIA II JĄDRA PODSTAWY KRESOMÓZGOWIA I KONTROLA RUCHOWA MECHANIZMY KONTROLI RUCHOWEJ SYSTEMY ZSTĘPUJĄCE Korowe ośrodki motoryczne Kora motoryczna (planowanie, inicjacja i kierowanie
PRIONY. Anna Majewska Katedra i Zakład Mikrobiologii Lekarskiej WUM 2016
 PRIONY Anna Majewska Katedra i Zakład Mikrobiologii Lekarskiej WUM 2016 PRIONY (ang. proteinaceous infectious particle) czyli białkowa cząstka zakaźna Termin priony po raz pierwszy użyty w XX w. jako określenie
PRIONY Anna Majewska Katedra i Zakład Mikrobiologii Lekarskiej WUM 2016 PRIONY (ang. proteinaceous infectious particle) czyli białkowa cząstka zakaźna Termin priony po raz pierwszy użyty w XX w. jako określenie
Ośrodkowy układ nerwowy. Zmiany morfologiczne i funkcjonalne.
 Ośrodkowy układ nerwowy. Zmiany morfologiczne i funkcjonalne. Prof. dr hab. med. Monika Puzianowska-Kuznicka Zakład Geriatrii i Gerontologii, Centrum Medyczne Kształcenia Podyplomowego Zespół Kliniczno-Badawczy
Ośrodkowy układ nerwowy. Zmiany morfologiczne i funkcjonalne. Prof. dr hab. med. Monika Puzianowska-Kuznicka Zakład Geriatrii i Gerontologii, Centrum Medyczne Kształcenia Podyplomowego Zespół Kliniczno-Badawczy
Wybrane techniki badania białek -proteomika funkcjonalna
 Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu np. w porównaniu z analizą trankryptomu:
Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu np. w porównaniu z analizą trankryptomu:
Dr. habil. Anna Salek International Bio-Consulting 1 Germany
 1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
CZĘSTOŚĆ WYSTĘPOWANIA OTĘPIEŃ
 CZĘSTOŚĆ WYSTĘPOWANIA OTĘPIEŃ Według raportu WHO z 2010 roku ilość osób z otępieniem na świecie wynosi 35,5 miliona, W Polsce oceniono w 2014 roku, że dotyczy ponad 500 000 osób z różnymi rodzajami otępienia,
CZĘSTOŚĆ WYSTĘPOWANIA OTĘPIEŃ Według raportu WHO z 2010 roku ilość osób z otępieniem na świecie wynosi 35,5 miliona, W Polsce oceniono w 2014 roku, że dotyczy ponad 500 000 osób z różnymi rodzajami otępienia,
Zespoły neurodegeneracyjne. Dr n. med. Marcin Wełnicki III Klinika Chorób Wewnętrznych i Kardiologii II WL Warszawskiego Uniwersytetu Medycznego
 Zespoły neurodegeneracyjne Dr n. med. Marcin Wełnicki III Klinika Chorób Wewnętrznych i Kardiologii II WL Warszawskiego Uniwersytetu Medycznego Neurodegeneracja Choroby przewlekłe, postępujące, prowadzące
Zespoły neurodegeneracyjne Dr n. med. Marcin Wełnicki III Klinika Chorób Wewnętrznych i Kardiologii II WL Warszawskiego Uniwersytetu Medycznego Neurodegeneracja Choroby przewlekłe, postępujące, prowadzące
Wiadomości naukowe o chorobie Huntingtona. Prostym językiem. Napisane przez naukowców. Dla globalnej społeczności HD.
 Wiadomości naukowe o chorobie Huntingtona. Prostym językiem. Napisane przez naukowców. Dla globalnej społeczności HD. Słownik agregaty grudki białka tworzące się wewnątrz komórek, występują w chorobie
Wiadomości naukowe o chorobie Huntingtona. Prostym językiem. Napisane przez naukowców. Dla globalnej społeczności HD. Słownik agregaty grudki białka tworzące się wewnątrz komórek, występują w chorobie
PRIONY. Anna Majewska Katedra i Zakład Mikrobiologii Lekarskiej WUM 2016
 PRIONY Anna Majewska Katedra i Zakład Mikrobiologii Lekarskiej WUM 2016 PRIONY (ang. proteinaceous infectious particle) czyli białkowa cząstka zakaźna Termin priony po raz pierwszy użyty w XX w. jako określenie
PRIONY Anna Majewska Katedra i Zakład Mikrobiologii Lekarskiej WUM 2016 PRIONY (ang. proteinaceous infectious particle) czyli białkowa cząstka zakaźna Termin priony po raz pierwszy użyty w XX w. jako określenie
Antyoksydanty pokarmowe a korzyści zdrowotne. dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW
 Antyoksydanty pokarmowe a korzyści zdrowotne dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW Warszawa, dn. 14.12.2016 wolne rodniki uszkodzone cząsteczki chemiczne w postaci wysoce
Antyoksydanty pokarmowe a korzyści zdrowotne dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW Warszawa, dn. 14.12.2016 wolne rodniki uszkodzone cząsteczki chemiczne w postaci wysoce
etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
 Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
Badanie oddziaływania polihistydynowych cyklopeptydów z jonami Cu 2+ i Zn 2+ w aspekcie projektowania mimetyków SOD
 Wydział Farmaceutyczny z Oddziałem Analityki Medycznej Badanie oddziaływania polihistydynowych cyklopeptydów z jonami Cu 2+ i Zn 2+ w aspekcie projektowania mimetyków SOD Aleksandra Kotynia PRACA DOKTORSKA
Wydział Farmaceutyczny z Oddziałem Analityki Medycznej Badanie oddziaływania polihistydynowych cyklopeptydów z jonami Cu 2+ i Zn 2+ w aspekcie projektowania mimetyków SOD Aleksandra Kotynia PRACA DOKTORSKA
ROLA WAPNIA W FIZJOLOGII KOMÓRKI
 ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
SEMINARIUM 8:
 SEMINARIUM 8: 24.11. 2016 Mikroelementy i pierwiastki śladowe, definicje, udział w metabolizmie ustroju reakcje biochemiczne zależne od aktywacji/inhibicji przy udziale mikroelementów i pierwiastków śladowych,
SEMINARIUM 8: 24.11. 2016 Mikroelementy i pierwiastki śladowe, definicje, udział w metabolizmie ustroju reakcje biochemiczne zależne od aktywacji/inhibicji przy udziale mikroelementów i pierwiastków śladowych,
Choroby neurodegeneracyjne. Zjawisko stresu
 Choroby neurodegeneracyjne. Zjawisko stresu Wykład Prof. dr hab. Ewa Szczepańska-Sadowska Uwaga: wykład autorski do bezpośredniego wykorzystania, bez możliwości rozpowszechniania i powielania DEFINICJA
Choroby neurodegeneracyjne. Zjawisko stresu Wykład Prof. dr hab. Ewa Szczepańska-Sadowska Uwaga: wykład autorski do bezpośredniego wykorzystania, bez możliwości rozpowszechniania i powielania DEFINICJA
biologia w gimnazjum OBWODOWY UKŁAD NERWOWY
 biologia w gimnazjum 2 OBWODOWY UKŁAD NERWOWY BUDOWA KOMÓRKI NERWOWEJ KIERUNEK PRZEWODZENIA IMPULSU NEROWEGO DENDRYT ZAKOŃCZENIA AKSONU CIAŁO KOMÓRKI JĄDRO KOMÓRKOWE AKSON OSŁONKA MIELINOWA Komórka nerwowa
biologia w gimnazjum 2 OBWODOWY UKŁAD NERWOWY BUDOWA KOMÓRKI NERWOWEJ KIERUNEK PRZEWODZENIA IMPULSU NEROWEGO DENDRYT ZAKOŃCZENIA AKSONU CIAŁO KOMÓRKI JĄDRO KOMÓRKOWE AKSON OSŁONKA MIELINOWA Komórka nerwowa
października 2013: Elementarz biologii molekularnej. Wykład nr 2 BIOINFORMATYKA rok II
 10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
The influence of N-methylation on conformational properties of peptides with Aib residue. Roksana Wałęsa, Aneta Buczek, Małgorzata Broda
 The influence of N-methylation on conformational properties of peptides with ib residue. Roksana Wałęsa, neta Buczek, Małgorzata Broda Konformacje peptydów w W W w 2 Budowa białek 3 Modyfikacje peptydów
The influence of N-methylation on conformational properties of peptides with ib residue. Roksana Wałęsa, neta Buczek, Małgorzata Broda Konformacje peptydów w W W w 2 Budowa białek 3 Modyfikacje peptydów
OPTYMALNY POZIOM SPOŻYCIA BIAŁKA ZALECANY CZŁOWIEKOWI JANUSZ KELLER STUDIUM PODYPLOMOWE 2011
 OPTYMALNY POZIOM SPOŻYCIA BIAŁKA ZALECANY CZŁOWIEKOWI JANUSZ KELLER STUDIUM PODYPLOMOWE 2011 DLACZEGO DOROSŁY CZŁOWIEK (O STAŁEJ MASIE BIAŁKOWEJ CIAŁA) MUSI SPOŻYWAĆ BIAŁKO? NIEUSTAJĄCA WYMIANA BIAŁEK
OPTYMALNY POZIOM SPOŻYCIA BIAŁKA ZALECANY CZŁOWIEKOWI JANUSZ KELLER STUDIUM PODYPLOMOWE 2011 DLACZEGO DOROSŁY CZŁOWIEK (O STAŁEJ MASIE BIAŁKOWEJ CIAŁA) MUSI SPOŻYWAĆ BIAŁKO? NIEUSTAJĄCA WYMIANA BIAŁEK
Jednostka chorobowa. Czas analizy [dni roboczych] Literatura Gen. Cena [PLN] Badany Gen. Materiał biologiczny. Chorobowa
![Jednostka chorobowa. Czas analizy [dni roboczych] Literatura Gen. Cena [PLN] Badany Gen. Materiał biologiczny. Chorobowa Jednostka chorobowa. Czas analizy [dni roboczych] Literatura Gen. Cena [PLN] Badany Gen. Materiał biologiczny. Chorobowa](/thumbs/25/6058649.jpg) Jednostka chorobowa Jednostka Oznaczenie Chorobowa testu OMIM TM Badany Gen Literatura Gen OMIM TM Opis/cel badania Zakres analizy Materiał biologiczny Czas analizy [dni roboczych] Cena [PLN] ALZHEIMERA
Jednostka chorobowa Jednostka Oznaczenie Chorobowa testu OMIM TM Badany Gen Literatura Gen OMIM TM Opis/cel badania Zakres analizy Materiał biologiczny Czas analizy [dni roboczych] Cena [PLN] ALZHEIMERA
Wybrane techniki badania białek -proteomika funkcjonalna
 Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu w porównaniu z analizą trankryptomu:
Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu w porównaniu z analizą trankryptomu:
Fizjologia człowieka
 Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Bioinformatyka wykład 9
 Bioinformatyka wykład 9 14.XII.21 białkowa bioinformatyka strukturalna krzysztof_pawlowski@sggw.pl 211-1-17 1 Plan wykładu struktury białek dlaczego? struktury białek geometria i fizyka modyfikacje kowalencyjne
Bioinformatyka wykład 9 14.XII.21 białkowa bioinformatyka strukturalna krzysztof_pawlowski@sggw.pl 211-1-17 1 Plan wykładu struktury białek dlaczego? struktury białek geometria i fizyka modyfikacje kowalencyjne
Przegląd budowy i funkcji białek
 Przegląd budowy i funkcji białek Co piszą o białkach? Wyraz wprowadzony przez Jönsa J. Berzeliusa w 1883 r. w celu podkreślenia znaczenia tej grupy związków. Termin pochodzi od greckiego słowa proteios,
Przegląd budowy i funkcji białek Co piszą o białkach? Wyraz wprowadzony przez Jönsa J. Berzeliusa w 1883 r. w celu podkreślenia znaczenia tej grupy związków. Termin pochodzi od greckiego słowa proteios,
STRESZCZENIE PRACY DOKTORSKIEJ
 mgr Bartłomiej Rospond POSZUKIWANIE NEUROBIOLOGICZNEGO MECHANIZMU UZALEŻNIENIA OD POKARMU - WPŁYW CUKRÓW I TŁUSZCZÓW NA EKSPRESJĘ RECEPTORÓW DOPAMINOWYCH D 2 W GRZBIETOWYM PRĄŻKOWIU U SZCZURÓW STRESZCZENIE
mgr Bartłomiej Rospond POSZUKIWANIE NEUROBIOLOGICZNEGO MECHANIZMU UZALEŻNIENIA OD POKARMU - WPŁYW CUKRÓW I TŁUSZCZÓW NA EKSPRESJĘ RECEPTORÓW DOPAMINOWYCH D 2 W GRZBIETOWYM PRĄŻKOWIU U SZCZURÓW STRESZCZENIE
Do moich badań wybrałam przede wszystkim linię kostniakomięsaka 143B ze względu na jej wysoki potencjał przerzutowania. Do wykonania pracy
 Streszczenie Choroby nowotworowe stanowią bardzo ważny problem zdrowotny na świecie. Dlatego, medycyna dąży do znalezienia nowych skutecznych leków, ale również rozwiązań do walki z nowotworami. Głównym
Streszczenie Choroby nowotworowe stanowią bardzo ważny problem zdrowotny na świecie. Dlatego, medycyna dąży do znalezienia nowych skutecznych leków, ale również rozwiązań do walki z nowotworami. Głównym
CYTOSZKIELET CYTOSZKIELET Cytoplazma podstawowa (macierz cytoplazmatyczna) Komórka eukariotyczna. cytoplazma + jądro komórkowe.
 Komórka eukariotyczna cytoplazma + jądro komórkowe (układ wykonawczy) cytoplazma podstawowa (cytozol) Cytoplazma złożony koloid wodny cząsteczek i makrocząsteczek (centrum informacyjne) organelle i kompleksy
Komórka eukariotyczna cytoplazma + jądro komórkowe (układ wykonawczy) cytoplazma podstawowa (cytozol) Cytoplazma złożony koloid wodny cząsteczek i makrocząsteczek (centrum informacyjne) organelle i kompleksy
Instytut Sportu. Biochemiczne wskaźniki przetrenowania. Zakład Biochemii. mgr Konrad Witek
 Instytut Sportu Zakład Biochemii Biochemiczne wskaźniki przetrenowania Przetrenowanie (overtraining)- długotrwałe pogorszenie się dyspozycji sportowej zawodnika, na skutek kumulowania się skutków stosowania
Instytut Sportu Zakład Biochemii Biochemiczne wskaźniki przetrenowania Przetrenowanie (overtraining)- długotrwałe pogorszenie się dyspozycji sportowej zawodnika, na skutek kumulowania się skutków stosowania
Nukleotydy w układach biologicznych
 Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
Tematy seminariów z Neurologii dla V roku Kierunku Lekarskiego realizowane w Klinice Neurochirurgii:
 Tematyka zajęć i zaliczenie z Neurologii - plik pdf do pobrania Neurochirurgia Do zajęć seminaryjnych student jest zobowiązany przygotować wiedzę teoretyczną zgodnie ze słowami kluczowymi do danego tematu.
Tematyka zajęć i zaliczenie z Neurologii - plik pdf do pobrania Neurochirurgia Do zajęć seminaryjnych student jest zobowiązany przygotować wiedzę teoretyczną zgodnie ze słowami kluczowymi do danego tematu.
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU. Czym są choroby prionowe?
 SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU Czym są choroby prionowe? SPIS TREŚCI: I. Wprowadzenie. II. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. III. Karty pracy.
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU Czym są choroby prionowe? SPIS TREŚCI: I. Wprowadzenie. II. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. III. Karty pracy.
Profil metaboliczny róŝnych organów ciała
 Profil metaboliczny róŝnych organów ciała Uwaga: tkanka tłuszczowa (adipose tissue) NIE wykorzystuje glicerolu do biosyntezy triacylogliceroli Endo-, para-, i autokrynna droga przekazu informacji biologicznej.
Profil metaboliczny róŝnych organów ciała Uwaga: tkanka tłuszczowa (adipose tissue) NIE wykorzystuje glicerolu do biosyntezy triacylogliceroli Endo-, para-, i autokrynna droga przekazu informacji biologicznej.
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU
 SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU Czy priony zawsze są szkodliwe? SPIS TREŚCI: Wprowadzenie. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. Karty pracy. 1.
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU Czy priony zawsze są szkodliwe? SPIS TREŚCI: Wprowadzenie. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. Karty pracy. 1.
Objawy zwiastujące początek otępień. Tomasz Sobów, dr hab. Profesor Uniwersytetu Medycznego w Łodzi Zakład Psychologii Lekarskiej, UMed Łódź
 Objawy zwiastujące początek otępień Tomasz Sobów, dr hab. Profesor Uniwersytetu Medycznego w Łodzi Zakład Psychologii Lekarskiej, UMed Łódź Przedkliniczne stadia otępienia: AD Przedkliniczne stadia chorób
Objawy zwiastujące początek otępień Tomasz Sobów, dr hab. Profesor Uniwersytetu Medycznego w Łodzi Zakład Psychologii Lekarskiej, UMed Łódź Przedkliniczne stadia otępienia: AD Przedkliniczne stadia chorób
ZAJĘCIA 1. uczenie się i pamięć mechanizmy komórkowe. dr Marek Binder Zakład Psychofizjologii
 ZAJĘCIA 1 uczenie się i pamięć mechanizmy komórkowe dr Marek Binder Zakład Psychofizjologii problem engramu dwa aspekty poziom systemowy które części mózgu odpowiadają za pamięć gdzie tworzy się engram?
ZAJĘCIA 1 uczenie się i pamięć mechanizmy komórkowe dr Marek Binder Zakład Psychofizjologii problem engramu dwa aspekty poziom systemowy które części mózgu odpowiadają za pamięć gdzie tworzy się engram?
The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna
 Streszczenie rozprawy doktorskiej pt. The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna mgr Tomasz Turowski, promotor prof. dr hab.
Streszczenie rozprawy doktorskiej pt. The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna mgr Tomasz Turowski, promotor prof. dr hab.
Źródła energii dla mięśni. mgr. Joanna Misiorowska
 Źródła energii dla mięśni mgr. Joanna Misiorowska Skąd ta energia? Skurcz włókna mięśniowego wymaga nakładu energii w postaci ATP W zależności od czasu pracy mięśni, ATP może być uzyskiwany z różnych źródeł
Źródła energii dla mięśni mgr. Joanna Misiorowska Skąd ta energia? Skurcz włókna mięśniowego wymaga nakładu energii w postaci ATP W zależności od czasu pracy mięśni, ATP może być uzyskiwany z różnych źródeł
Jakie białka takie zdrowie
 NAUKA 2/2006 33-44 JACEK KUŹNICKI 1, 2, BEATA TKACZ 1, AGNIESZKA ZIEMKA 1 3 Jakie białka takie zdrowie Wykład rozpoczął się od opisu odwiedzin Instytutu przez matkę, której starszy syn choruje na dystrofię
NAUKA 2/2006 33-44 JACEK KUŹNICKI 1, 2, BEATA TKACZ 1, AGNIESZKA ZIEMKA 1 3 Jakie białka takie zdrowie Wykład rozpoczął się od opisu odwiedzin Instytutu przez matkę, której starszy syn choruje na dystrofię
Analiza mutacji p.d36n i p.n318s oraz polimorfizmu p.s474x genu lipazy lipoproteinowej u chorych z hipercholesterolemią rodzinną.
 Analiza mutacji p.d36n i p.n318s oraz polimorfizmu p.s474x genu lipazy lipoproteinowej u chorych z hipercholesterolemią rodzinną. Monika śuk opiekun: prof. dr hab. n. med. Janusz Limon Katedra i Zakład
Analiza mutacji p.d36n i p.n318s oraz polimorfizmu p.s474x genu lipazy lipoproteinowej u chorych z hipercholesterolemią rodzinną. Monika śuk opiekun: prof. dr hab. n. med. Janusz Limon Katedra i Zakład
Przemiana materii i energii - Biologia.net.pl
 Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
Transport przez błony
 Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Właściwości błony komórkowej
 płynność asymetria Właściwości błony komórkowej selektywna przepuszczalność Płynność i stan fazowy - ruchy rotacyjne: obrotowe wokół długiej osi cząsteczki - ruchy fleksyjne zginanie łańcucha alifatycznego
płynność asymetria Właściwości błony komórkowej selektywna przepuszczalność Płynność i stan fazowy - ruchy rotacyjne: obrotowe wokół długiej osi cząsteczki - ruchy fleksyjne zginanie łańcucha alifatycznego
Nowoczesne systemy ekspresji genów
 Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
Geny, a funkcjonowanie organizmu
 Geny, a funkcjonowanie organizmu Wprowadzenie do genów letalnych Geny kodują Białka Kwasy rybonukleinowe 1 Geny Występują zwykle w 2 kopiach Kopia pochodząca od matki Kopia pochodząca od ojca Ekspresji
Geny, a funkcjonowanie organizmu Wprowadzenie do genów letalnych Geny kodują Białka Kwasy rybonukleinowe 1 Geny Występują zwykle w 2 kopiach Kopia pochodząca od matki Kopia pochodząca od ojca Ekspresji
Układ limbiczny. Przetwarzanie informacji przez mózg. kognitywistyka III. Jacek Salamon Tomasz Starczewski
 Jacek Salamon Tomasz Starczewski Przetwarzanie informacji przez mózg kognitywistyka III Co to takiego? Inaczej układ rąbkowy lub układ brzeżny. Jest zbiorczą nazwą dla różnych struktur korowych i podkorowych.
Jacek Salamon Tomasz Starczewski Przetwarzanie informacji przez mózg kognitywistyka III Co to takiego? Inaczej układ rąbkowy lub układ brzeżny. Jest zbiorczą nazwą dla różnych struktur korowych i podkorowych.
Konspekt do zajęć z przedmiotu Genetyka dla kierunku Położnictwo dr Anna Skorczyk-Werner Katedra i Zakład Genetyki Medycznej
 Seminarium 1 część 1 Konspekt do zajęć z przedmiotu Genetyka dla kierunku Położnictwo dr Anna Skorczyk-Werner Katedra i Zakład Genetyki Medycznej Genom człowieka Genomem nazywamy całkowitą ilość DNA jaka
Seminarium 1 część 1 Konspekt do zajęć z przedmiotu Genetyka dla kierunku Położnictwo dr Anna Skorczyk-Werner Katedra i Zakład Genetyki Medycznej Genom człowieka Genomem nazywamy całkowitą ilość DNA jaka
Struktura i właściwości biofizyczne polipeptydów z wydłuŝonym ciągiem glutaminowym. Marta Narczyk
 Struktura i właściwości biofizyczne polipeptydów z wydłuŝonym ciągiem glutaminowym Marta Narczyk Choroby konformacyjne ang: protein folding diseases Zmiany struktury przestrzennej białka powodują utratę
Struktura i właściwości biofizyczne polipeptydów z wydłuŝonym ciągiem glutaminowym Marta Narczyk Choroby konformacyjne ang: protein folding diseases Zmiany struktury przestrzennej białka powodują utratę
Nowe terapie choroby Huntingtona. Grzegorz Witkowski Katowice 2014
 Nowe terapie choroby Huntingtona Grzegorz Witkowski Katowice 2014 Terapie modyfikujące przebieg choroby Zahamowanie produkcji nieprawidłowej huntingtyny Leki oparte o palce cynkowe Małe interferujące RNA
Nowe terapie choroby Huntingtona Grzegorz Witkowski Katowice 2014 Terapie modyfikujące przebieg choroby Zahamowanie produkcji nieprawidłowej huntingtyny Leki oparte o palce cynkowe Małe interferujące RNA
Materiały pochodzą z Platformy Edukacyjnej Portalu www.szkolnictwo.pl
 Materiały pochodzą z Platformy Edukacyjnej Portalu www.szkolnictwo.pl Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą byd wykorzystywane przez jego Użytkowników
Materiały pochodzą z Platformy Edukacyjnej Portalu www.szkolnictwo.pl Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą byd wykorzystywane przez jego Użytkowników
Wykład 14 Biosynteza białek
 BIOCHEMIA Kierunek: Technologia Żywności i Żywienie Człowieka semestr III Wykład 14 Biosynteza białek WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH MATERIAŁÓW OPAKOWANIOWYCH
BIOCHEMIA Kierunek: Technologia Żywności i Żywienie Człowieka semestr III Wykład 14 Biosynteza białek WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH MATERIAŁÓW OPAKOWANIOWYCH
Kluczowe znaczenie ma rozumienie procesu klinicznego jako kontinuum zdarzeń
 Lek Anna Teresa Filipek-Gliszczyńska Ocena znaczenia biomarkerów w płynie mózgowo-rdzeniowym w prognozowaniu konwersji subiektywnych i łagodnych zaburzeń poznawczych do pełnoobjawowej choroby Alzheimera
Lek Anna Teresa Filipek-Gliszczyńska Ocena znaczenia biomarkerów w płynie mózgowo-rdzeniowym w prognozowaniu konwersji subiektywnych i łagodnych zaburzeń poznawczych do pełnoobjawowej choroby Alzheimera
SLAJD 1: Wykorzystywanie fal gamma w leczeniu Alzheimera
 SLAJD 1: Wykorzystywanie fal gamma w leczeniu Alzheimera SLAJD 2: Choroba Alzheimera https://opiekanadchorym.pl/osoby-chore-przewlekle/choroba-alzheimera/charakterys tyka-objawy-i-leczenie-choroby-alzheimera/
SLAJD 1: Wykorzystywanie fal gamma w leczeniu Alzheimera SLAJD 2: Choroba Alzheimera https://opiekanadchorym.pl/osoby-chore-przewlekle/choroba-alzheimera/charakterys tyka-objawy-i-leczenie-choroby-alzheimera/
Zakaźne choroby mózgu
 Wiadomości naukowe o chorobie Huntingtona. Prostym językiem. Napisane przez naukowców. Dla globalnej społeczności HD. Powinniśmy martwić się inwazją huntingtyny? Eksperymenty laboratoryjne: białko choroby
Wiadomości naukowe o chorobie Huntingtona. Prostym językiem. Napisane przez naukowców. Dla globalnej społeczności HD. Powinniśmy martwić się inwazją huntingtyny? Eksperymenty laboratoryjne: białko choroby
PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz.i): wprowadzenie (komórki, receptory, rozwój odporności nabytej)
 PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz.i): wprowadzenie (komórki, receptory, rozwój odporności nabytej) Nadzieja Drela ndrela@biol.uw.edu.pl Konspekt do wykładu
PODSTAWY IMMUNOLOGII Komórki i cząsteczki biorące udział w odporności nabytej (cz.i): wprowadzenie (komórki, receptory, rozwój odporności nabytej) Nadzieja Drela ndrela@biol.uw.edu.pl Konspekt do wykładu
THE UNFOLDED PROTEIN RESPONSE
 THE UNFOLDED PROTEIN RESPONSE Anna Czarnecka Źródło: Intercellular signaling from the endoplasmatic reticulum to the nucleus: the unfolded protein response in yeast and mammals Ch. Patil & P. Walter The
THE UNFOLDED PROTEIN RESPONSE Anna Czarnecka Źródło: Intercellular signaling from the endoplasmatic reticulum to the nucleus: the unfolded protein response in yeast and mammals Ch. Patil & P. Walter The
wykład dla studentów II roku biotechnologii Andrzej Wierzbicki
 Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 4 Jak działają geny?
Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 4 Jak działają geny?
Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu
 Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu Neuron jest podstawową jednostką przetwarzania informacji w mózgu. Sygnał biegnie w nim w kierunku od dendrytów, poprzez akson, do synaps. Neuron
Budowa i zróżnicowanie neuronów - elektrofizjologia neuronu Neuron jest podstawową jednostką przetwarzania informacji w mózgu. Sygnał biegnie w nim w kierunku od dendrytów, poprzez akson, do synaps. Neuron
BIOLOGICZNE MECHANIZMY ZACHOWANIA I UKŁADY WYKONAWCZE SYSTEM MOTORYCZNY. SYSTEMY ZSTĘPUJĄCE Korowe ośrodki motoryczne
 BIOLOGICZNE MECHANIZMY ZACHOWANIA I UKŁADY WYKONAWCZE SYSTEM MOTORYCZNY SYSTEMY ZSTĘPUJĄCE Korowe ośrodki motoryczne Kora motoryczna (planowanie, inicjacja i kierowanie ruchami dowolnymi) Ośrodki pnia
BIOLOGICZNE MECHANIZMY ZACHOWANIA I UKŁADY WYKONAWCZE SYSTEM MOTORYCZNY SYSTEMY ZSTĘPUJĄCE Korowe ośrodki motoryczne Kora motoryczna (planowanie, inicjacja i kierowanie ruchami dowolnymi) Ośrodki pnia
Sen i czuwanie rozdział 9. Zaburzenia mechanizmów kontroli ruchowej rozdział 8
 Sen i czuwanie rozdział 9 Zaburzenia mechanizmów kontroli ruchowej rozdział 8 SEN I CZUWANIE SEN I RYTMY OKOŁODOBOWE FAZY SNU CHARAKTERYSTYKA INDUKOWANIE SNU MECHANIZM I STRUKTURY MÓZGOWE RYTMY OKOŁODOBOWE
Sen i czuwanie rozdział 9 Zaburzenia mechanizmów kontroli ruchowej rozdział 8 SEN I CZUWANIE SEN I RYTMY OKOŁODOBOWE FAZY SNU CHARAKTERYSTYKA INDUKOWANIE SNU MECHANIZM I STRUKTURY MÓZGOWE RYTMY OKOŁODOBOWE
Informacje. W sprawach organizacyjnych Slajdy z wykładów
 Biochemia Informacje W sprawach organizacyjnych malgorzata.dutkiewicz@wum.edu.pl Slajdy z wykładów www.takao.pl W sprawach merytorycznych Takao Ishikawa (takao@biol.uw.edu.pl) Kiedy? Co? Kto? 24 lutego
Biochemia Informacje W sprawach organizacyjnych malgorzata.dutkiewicz@wum.edu.pl Slajdy z wykładów www.takao.pl W sprawach merytorycznych Takao Ishikawa (takao@biol.uw.edu.pl) Kiedy? Co? Kto? 24 lutego
wykład dla studentów II roku biotechnologii Andrzej Wierzbicki
 Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 5 Droga od genu do
Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 5 Droga od genu do
wykład dla studentów II roku biotechnologii Andrzej Wierzbicki
 Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ 1. Gen to odcinek DNA odpowiedzialny
Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ 1. Gen to odcinek DNA odpowiedzialny
Niebezpieczni współpracownicy?
 Niebezpieczni współpracownicy? Toksyczny wpływ leków znieczulenia ogólnego na ośrodkowy układ nerwowy. European Journal of Anaesthesiology 2007 M. Perouansky Opracował: lek. Rafał Sobański Toksyczne działanie
Niebezpieczni współpracownicy? Toksyczny wpływ leków znieczulenia ogólnego na ośrodkowy układ nerwowy. European Journal of Anaesthesiology 2007 M. Perouansky Opracował: lek. Rafał Sobański Toksyczne działanie
MECHANIZMY WZROSTU i ROZWOJU ROŚLIN
 MECHANIZMY WZROSTU i ROZWOJU ROŚLIN Jaka jest rola kinaz MA (generalnie)? Do czego służy roślinom (lub generalnie) fosfolipaza D? Czy u roślin występują hormony peptydowe? Wymień znane Ci rodzaje receptorów
MECHANIZMY WZROSTU i ROZWOJU ROŚLIN Jaka jest rola kinaz MA (generalnie)? Do czego służy roślinom (lub generalnie) fosfolipaza D? Czy u roślin występują hormony peptydowe? Wymień znane Ci rodzaje receptorów
Geny i działania na nich
 Metody bioinformatyki Geny i działania na nich prof. dr hab. Jan Mulawka Trzy królestwa w biologii Prokaryota organizmy, których komórki nie zawierają jądra, np. bakterie Eukaryota - organizmy, których
Metody bioinformatyki Geny i działania na nich prof. dr hab. Jan Mulawka Trzy królestwa w biologii Prokaryota organizmy, których komórki nie zawierają jądra, np. bakterie Eukaryota - organizmy, których
BADANIA GENETYCZNE W HODOWLI KOTÓW: CHOROBA SPICHRZENIOWA GLIKOGENU TYPU IV (GLYCOGEN STORAGE DISEASE TYPE IV - GSD IV)
 BADANIA GENETYCZNE W HODOWLI KOTÓW: OBOWIĄZKOWE CHOROBA SPICHRZENIOWA GLIKOGENU TYPU IV (NFO) GANGLIOZYDOZA (KOR, BUR) ZALECANE RDZENIOWY ZANIK MIĘŚNI (MCO) NIEDOBÓR KINAZY PIROGRONIANOWEJ (ABY, SOM) POSTĘPUJĄCY
BADANIA GENETYCZNE W HODOWLI KOTÓW: OBOWIĄZKOWE CHOROBA SPICHRZENIOWA GLIKOGENU TYPU IV (NFO) GANGLIOZYDOZA (KOR, BUR) ZALECANE RDZENIOWY ZANIK MIĘŚNI (MCO) NIEDOBÓR KINAZY PIROGRONIANOWEJ (ABY, SOM) POSTĘPUJĄCY
Neurologia dla studentów wydziału pielęgniarstwa. Bożena Adamkiewicz Andrzej Głąbiński Andrzej Klimek
 Neurologia dla studentów wydziału pielęgniarstwa Bożena Adamkiewicz Andrzej Głąbiński Andrzej Klimek Spis treści Wstęp... 7 Część I. Wiadomości ogólne... 9 1. Podstawy struktury i funkcji układu nerwowego...
Neurologia dla studentów wydziału pielęgniarstwa Bożena Adamkiewicz Andrzej Głąbiński Andrzej Klimek Spis treści Wstęp... 7 Część I. Wiadomości ogólne... 9 1. Podstawy struktury i funkcji układu nerwowego...
// // Zastosowanie pól magnetycznych w medycynie. Wydanie drugie. Autor: Aleksander Sieroń.
 // // Zastosowanie pól magnetycznych w medycynie. Wydanie drugie. Autor: Aleksander Sieroń. Prof. Aleksander Sieroń jest specjalistą z zakresu chorób wewnętrznych, kardiologii i medycyny fizykalnej. Kieruje
// // Zastosowanie pól magnetycznych w medycynie. Wydanie drugie. Autor: Aleksander Sieroń. Prof. Aleksander Sieroń jest specjalistą z zakresu chorób wewnętrznych, kardiologii i medycyny fizykalnej. Kieruje
Zawartość. Wstęp 1. Historia wirusologii. 2. Klasyfikacja wirusów
 Zawartość 139585 Wstęp 1. Historia wirusologii 2. Klasyfikacja wirusów 3. Struktura cząstek wirusowych 3.1. Metody określania struktury cząstek wirusowych 3.2. Budowa cząstek wirusowych o strukturze helikalnej
Zawartość 139585 Wstęp 1. Historia wirusologii 2. Klasyfikacja wirusów 3. Struktura cząstek wirusowych 3.1. Metody określania struktury cząstek wirusowych 3.2. Budowa cząstek wirusowych o strukturze helikalnej
Mechanizmy chorób dziedzicznych
 Mechanizmy chorób dziedzicznych Podział chorób dziedzicznych Choroby jednogenowe Autosomalne Dominujące achondroplazja, neurofibromatoza Recesywne fenyloketonuria, mukowiscydioza Sprzężone z płcią Dominujące
Mechanizmy chorób dziedzicznych Podział chorób dziedzicznych Choroby jednogenowe Autosomalne Dominujące achondroplazja, neurofibromatoza Recesywne fenyloketonuria, mukowiscydioza Sprzężone z płcią Dominujące
Bezpośrednia embriogeneza somatyczna
 Bezpośrednia embriogeneza somatyczna Zarodki somatyczne formują się bezpośrednio tylko z tych komórek roślinnych, które są kompetentne już w momencie izolowania z rośliny macierzystej, czyli z proembriogenicznie
Bezpośrednia embriogeneza somatyczna Zarodki somatyczne formują się bezpośrednio tylko z tych komórek roślinnych, które są kompetentne już w momencie izolowania z rośliny macierzystej, czyli z proembriogenicznie
Wykład 9: HUMAN GENOME PROJECT HUMAN GENOME PROJECT
 Wykład 9: Polimorfizm pojedynczego nukleotydu (SNP) odrębność genetyczna, która czyni każdego z nas jednostką unikatową Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej HUMAN GENOME
Wykład 9: Polimorfizm pojedynczego nukleotydu (SNP) odrębność genetyczna, która czyni każdego z nas jednostką unikatową Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej HUMAN GENOME
ZAJĘCIA 1. uczenie się i pamięć mechanizmy komórkowe. dr Marek Binder Zakład Psychofizjologii
 ZAJĘCIA 1 uczenie się i pamięć mechanizmy komórkowe dr Marek Binder Zakład Psychofizjologii problem engramu dwa aspekty poziom systemowy które części mózgu odpowiadają za pamięć gdzie tworzy się engram?
ZAJĘCIA 1 uczenie się i pamięć mechanizmy komórkowe dr Marek Binder Zakład Psychofizjologii problem engramu dwa aspekty poziom systemowy które części mózgu odpowiadają za pamięć gdzie tworzy się engram?
POTRZEBY DZIECKA Z PROBLEMAMI -DYSTROFIA MIĘŚNIOWA DUCHENNE A NEUROLOGICZNYMI W SZKOLE
 POTRZEBY DZIECKA Z PROBLEMAMI NEUROLOGICZNYMI W SZKOLE -DYSTROFIA MIĘŚNIOWA DUCHENNE A Klinika Neurologii Rozwojowej Gdański Uniwersytet Medyczny Ewa Pilarska Dystrofie mięśniowe to grupa przewlekłych
POTRZEBY DZIECKA Z PROBLEMAMI NEUROLOGICZNYMI W SZKOLE -DYSTROFIA MIĘŚNIOWA DUCHENNE A Klinika Neurologii Rozwojowej Gdański Uniwersytet Medyczny Ewa Pilarska Dystrofie mięśniowe to grupa przewlekłych
TATA box. Enhancery. CGCG ekson intron ekson intron ekson CZĘŚĆ KODUJĄCA GENU TERMINATOR. Elementy regulatorowe
 Promotory genu Promotor bliski leży w odległości do 40 pz od miejsca startu transkrypcji, zawiera kasetę TATA. Kaseta TATA to silnie konserwowana sekwencja TATAAAA, występująca w większości promotorów
Promotory genu Promotor bliski leży w odległości do 40 pz od miejsca startu transkrypcji, zawiera kasetę TATA. Kaseta TATA to silnie konserwowana sekwencja TATAAAA, występująca w większości promotorów
Spis treści. 1. Wiadomości wstępne Skład chemiczny i funkcje komórki Przedmowa do wydania czternastego... 13
 Przedmowa do wydania czternastego... 13 Częściej stosowane skróty... 15 1. Wiadomości wstępne... 19 1.1. Rys historyczny i pojęcia podstawowe... 19 1.2. Znaczenie biochemii w naukach rolniczych... 22 2.
Przedmowa do wydania czternastego... 13 Częściej stosowane skróty... 15 1. Wiadomości wstępne... 19 1.1. Rys historyczny i pojęcia podstawowe... 19 1.2. Znaczenie biochemii w naukach rolniczych... 22 2.
Program zajęć z biochemii dla studentów kierunku weterynaria I roku studiów na Wydziale Lekarskim UJ CM w roku akademickim 2013/2014
 Program zajęć z biochemii dla studentów kierunku weterynaria I roku studiów na Wydziale Lekarskim UJ CM w roku akademickim 2013/2014 S E M E S T R II Tydzień 1 24.02-28.02 2 03.03-07.03 3 10.03-14.03 Wykłady
Program zajęć z biochemii dla studentów kierunku weterynaria I roku studiów na Wydziale Lekarskim UJ CM w roku akademickim 2013/2014 S E M E S T R II Tydzień 1 24.02-28.02 2 03.03-07.03 3 10.03-14.03 Wykłady
Politechnika Łódzka Instytut Biochemii Technicznej
 Prof. dr hab. inż. Grzegorz Bujacz Politechnika Łódzka Instytut Biochemii Technicznej Łódź, 10 maja 2013 rok. Recenzja pracy habilitacyjnej dr Elżbiety Jankowskiej na temat " Badanie peptydów i białek
Prof. dr hab. inż. Grzegorz Bujacz Politechnika Łódzka Instytut Biochemii Technicznej Łódź, 10 maja 2013 rok. Recenzja pracy habilitacyjnej dr Elżbiety Jankowskiej na temat " Badanie peptydów i białek
Potencjał spoczynkowy i czynnościowy
 Potencjał spoczynkowy i czynnościowy Marcin Koculak Biologiczne mechanizmy zachowania https://backyardbrains.com/ Powtórka budowy komórki 2 Istota prądu Prąd jest uporządkowanym ruchem cząstek posiadających
Potencjał spoczynkowy i czynnościowy Marcin Koculak Biologiczne mechanizmy zachowania https://backyardbrains.com/ Powtórka budowy komórki 2 Istota prądu Prąd jest uporządkowanym ruchem cząstek posiadających
Adres do korespondencji: Arkadiusz Kazula, ul. Portowa 18/4, 27-600 Sandomierz, tel. 600 950 923, e-mail: kazula.gen@wp.pl
 Choroby prionowe charakterystyka, diagnostyka i terapia chorób prionowych Arkadiusz Kazula 1, Ewa Kazula 2 1 Zakład Chorób Zwierząt Instytutu Weterynarii PAN 2 Apteka Prywatna, Tarnobrzeg Adres do korespondencji:
Choroby prionowe charakterystyka, diagnostyka i terapia chorób prionowych Arkadiusz Kazula 1, Ewa Kazula 2 1 Zakład Chorób Zwierząt Instytutu Weterynarii PAN 2 Apteka Prywatna, Tarnobrzeg Adres do korespondencji:
Tkanka nerwowa. Komórki: komórki nerwowe (neurony) sygnalizacja komórki neurogleju (glejowe) ochrona, wspomaganie
 Komórki: komórki nerwowe (neurony) sygnalizacja komórki neurogleju (glejowe) ochrona, wspomaganie Tkanka nerwowa Substancja międzykomórkowa: prawie nieobecna (blaszki podstawne) pobudliwość przewodnictwo
Komórki: komórki nerwowe (neurony) sygnalizacja komórki neurogleju (glejowe) ochrona, wspomaganie Tkanka nerwowa Substancja międzykomórkowa: prawie nieobecna (blaszki podstawne) pobudliwość przewodnictwo
CHOROBY NOWOTWOROWE. Twór składający się z patologicznych komórek
 CHOROBY NOWOTWOROWE Twór składający się z patologicznych komórek Powstały w wyniku wielostopniowej przemiany zwanej onkogenezą lub karcinogenezą Morfologicznie ma strukturę zbliżoną do tkanki prawidłowej,
CHOROBY NOWOTWOROWE Twór składający się z patologicznych komórek Powstały w wyniku wielostopniowej przemiany zwanej onkogenezą lub karcinogenezą Morfologicznie ma strukturę zbliżoną do tkanki prawidłowej,
Ruch zwiększa recykling komórkowy Natura i wychowanie
 Wiadomości naukowe o chorobie Huntingtona. Prostym językiem. Napisane przez naukowców. Dla globalnej społeczności HD. Ruch zwiększa recykling komórkowy Ćwiczenia potęgują recykling komórkowy u myszy. Czy
Wiadomości naukowe o chorobie Huntingtona. Prostym językiem. Napisane przez naukowców. Dla globalnej społeczności HD. Ruch zwiększa recykling komórkowy Ćwiczenia potęgują recykling komórkowy u myszy. Czy
starszych na półkuli zachodniej. Typową cechą choroby jest heterogenny przebieg
 STRESZCZENIE Przewlekła białaczka limfocytowa (PBL) jest najczęstszą białaczką ludzi starszych na półkuli zachodniej. Typową cechą choroby jest heterogenny przebieg kliniczny, zróżnicowane rokowanie. Etiologia
STRESZCZENIE Przewlekła białaczka limfocytowa (PBL) jest najczęstszą białaczką ludzi starszych na półkuli zachodniej. Typową cechą choroby jest heterogenny przebieg kliniczny, zróżnicowane rokowanie. Etiologia
Vibramoov. neurorehabilitacja chodu przy użyciu zogniskowanej wibracji
 Vibramoov neurorehabilitacja chodu przy użyciu zogniskowanej wibracji VIBRAMOOV PRZEPROWADZA PACJENTA PRZEZ CAŁY PROCES REHABILITACJI Dzięki zaawansowanym, zróżnicowanym protokołom Vibramoov, terapeuci
Vibramoov neurorehabilitacja chodu przy użyciu zogniskowanej wibracji VIBRAMOOV PRZEPROWADZA PACJENTA PRZEZ CAŁY PROCES REHABILITACJI Dzięki zaawansowanym, zróżnicowanym protokołom Vibramoov, terapeuci
protos (gr.) pierwszy protein/proteins (ang.)
 Białka 1 protos (gr.) pierwszy protein/proteins (ang.) cząsteczki życia materiał budulcowy materii ożywionej oraz wirusów wielkocząsteczkowe biopolimery o masie od kilku tysięcy do kilku milionów jednostek
Białka 1 protos (gr.) pierwszy protein/proteins (ang.) cząsteczki życia materiał budulcowy materii ożywionej oraz wirusów wielkocząsteczkowe biopolimery o masie od kilku tysięcy do kilku milionów jednostek
Błona komórkowa grubość od 50 do 100 A. Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne
 Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
Błona komórkowa grubość od 50 do 100 A Istnieje pewna różnica potencjałów, po obu stronach błony, czyli na błonie panuje pewne napięcie elektryczne, zwane napięciem na błonie. Różnica potencjałów to ok.
KURS PATOFIZJOLOGII WYDZIAŁ LEKARSKI
 KURS PATOFIZJOLOGII WYDZIAŁ LEKARSKI CELE KSZTAŁCENIA Patologia ogólna łączy wiedzę z zakresu podstawowych nauk lekarskich. Stanowi pomost pomiędzy kształceniem przed klinicznym i klinicznym. Ułatwia zrozumienie
KURS PATOFIZJOLOGII WYDZIAŁ LEKARSKI CELE KSZTAŁCENIA Patologia ogólna łączy wiedzę z zakresu podstawowych nauk lekarskich. Stanowi pomost pomiędzy kształceniem przed klinicznym i klinicznym. Ułatwia zrozumienie
Opis zakładanych efektów kształcenia na studiach podyplomowych. Efekty kształcenia dla studiów podyplomowych WIEDZA
 Opis zakładanych efektów kształcenia na studiach podyplomowych Nazwa studiów: NEUROLOGOPEDIA Z ELEMENTAMI AUDIOLOGII I FONIATRII Typ studiów: kwalifikacyjne/doskonalące Symbol Efekty kształcenia dla studiów
Opis zakładanych efektów kształcenia na studiach podyplomowych Nazwa studiów: NEUROLOGOPEDIA Z ELEMENTAMI AUDIOLOGII I FONIATRII Typ studiów: kwalifikacyjne/doskonalące Symbol Efekty kształcenia dla studiów
MUTACJE GENETYCZNE. Wykonane przez Malwinę Krasnodębską kl III A
 MUTACJE GENETYCZNE Wykonane przez Malwinę Krasnodębską kl III A Mutacje - rodzaje - opis Mutacje genowe powstają na skutek wymiany wypadnięcia lub dodatnia jednego albo kilku nukleotydów. Zmiany w liczbie
MUTACJE GENETYCZNE Wykonane przez Malwinę Krasnodębską kl III A Mutacje - rodzaje - opis Mutacje genowe powstają na skutek wymiany wypadnięcia lub dodatnia jednego albo kilku nukleotydów. Zmiany w liczbie
Translacja i proteom komórki
 Translacja i proteom komórki 1. Kod genetyczny 2. Budowa rybosomów 3. Inicjacja translacji 4. Elongacja translacji 5. Terminacja translacji 6. Potranslacyjne zmiany polipeptydów 7. Translacja a retikulum
Translacja i proteom komórki 1. Kod genetyczny 2. Budowa rybosomów 3. Inicjacja translacji 4. Elongacja translacji 5. Terminacja translacji 6. Potranslacyjne zmiany polipeptydów 7. Translacja a retikulum
Składniki diety a stabilność struktury DNA
 Składniki diety a stabilność struktury DNA 1 DNA jedyna makrocząsteczka, której synteza jest ściśle kontrolowana, a powstałe błędy są naprawiane DNA jedyna makrocząsteczka naprawiana in vivo Replikacja
Składniki diety a stabilność struktury DNA 1 DNA jedyna makrocząsteczka, której synteza jest ściśle kontrolowana, a powstałe błędy są naprawiane DNA jedyna makrocząsteczka naprawiana in vivo Replikacja
Choroby peroksysomalne
 148 PRACE POGLĄDOWE / REVIEWS Choroby peroksysomalne Peroxisomal disorders Teresa Joanna Stradomska Pediatr Pol 2010; 85 (2): 148 155 2010 by Polskie Towarzystwo Pediatryczne Otrzymano/Received: 29.10.2009
148 PRACE POGLĄDOWE / REVIEWS Choroby peroksysomalne Peroxisomal disorders Teresa Joanna Stradomska Pediatr Pol 2010; 85 (2): 148 155 2010 by Polskie Towarzystwo Pediatryczne Otrzymano/Received: 29.10.2009
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej
 Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Multimedial Unit of Dept. of Anatomy JU
 Multimedial Unit of Dept. of Anatomy JU Ośrodkowy układ nerwowy zaczyna się rozwijać na początku 3. tygodnia w postaci płytki nerwowej, położonej w pośrodkowo-grzbietowej okolicy, ku przodowi od węzła
Multimedial Unit of Dept. of Anatomy JU Ośrodkowy układ nerwowy zaczyna się rozwijać na początku 3. tygodnia w postaci płytki nerwowej, położonej w pośrodkowo-grzbietowej okolicy, ku przodowi od węzła
INTERPRETACJA WYNIKÓW BADAŃ MOLEKULARNYCH W CHOROBIE HUNTINGTONA
 XX Międzynarodowa konferencja Polskie Stowarzyszenie Choroby Huntingtona Warszawa, 17-18- 19 kwietnia 2015 r. Metody badań i leczenie choroby Huntingtona - aktualności INTERPRETACJA WYNIKÓW BADAŃ MOLEKULARNYCH
XX Międzynarodowa konferencja Polskie Stowarzyszenie Choroby Huntingtona Warszawa, 17-18- 19 kwietnia 2015 r. Metody badań i leczenie choroby Huntingtona - aktualności INTERPRETACJA WYNIKÓW BADAŃ MOLEKULARNYCH
spis treści Część i: Podstawy neuroanatomii i neurofizjologii... 15 Cele rozdziałów... 16 Słowa kluczowe... 16
 spis treści Część i: Podstawy neuroanatomii i neurofizjologii... 15 Cele rozdziałów... 16 Słowa kluczowe... 16 1. Rozwój i podział układu nerwowego Janusz Moryś... 17 1.1. Rozwój rdzenia kręgowego... 17
spis treści Część i: Podstawy neuroanatomii i neurofizjologii... 15 Cele rozdziałów... 16 Słowa kluczowe... 16 1. Rozwój i podział układu nerwowego Janusz Moryś... 17 1.1. Rozwój rdzenia kręgowego... 17
GIMNAZJUM SPRAWDZIANY SUKCES W NAUCE
 GIMNAZJUM SPRAWDZIANY BIOLOGIA klasa III SUKCES W NAUCE II GENETYKA CZŁOWIEKA Zadanie 1. Cechy organizmu są warunkowane przez allele dominujące i recesywne. Uzupełnij tabelę, wykorzystując poniższe określenia,
GIMNAZJUM SPRAWDZIANY BIOLOGIA klasa III SUKCES W NAUCE II GENETYKA CZŁOWIEKA Zadanie 1. Cechy organizmu są warunkowane przez allele dominujące i recesywne. Uzupełnij tabelę, wykorzystując poniższe określenia,
