WŁAŚCIWOŚCI KWASOWO-ZASADOWE ZWIĄZKÓW ORGANICZNYCH; BADANIE ROZPUSZCZALNOŚCI ZWIĄZKÓW
|
|
|
- Eleonora Olejnik
- 8 lat temu
- Przeglądów:
Transkrypt
1 PLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDA CHEMII GANICZNEJ, BIGANICZNEJ I BITECHNLGII Instrukcja do ćwiczeń laboratoryjnych WŁAŚCIWŚCI KWASWZASADWE ZWIĄZKÓW GANICZNYCH; BADANIE ZPUSZCZALNŚCI ZWIĄZKÓW dla kierunku Biotechnologia Instrukcję przygotowali pracownicy i doktoranci Katedry prowadzący: mgr inż. Anna Byczek mgr inż. Ewelina Pilny Gliwice
2 Badanie rozpuszczalności związków Ustalenie rozpuszczalności związku organicznego w wybranych rozpuszczalnikach dostarcza wstępnych informacji na temat charakteru badanego związku, ponieważ rozpuszczalność jest ściśle powiązana z budową i obecnością określonych grup funkcyjnych. Wstępne testy na rozpuszczalność pozwalają uzyskać informacje o kwasowym, zasadowym lub obojętnym charakterze badanego związku. Stanowią one podstawę do zaliczenia związku organicznego do odpowiedniej grupy rozpuszczalności, w obrębie której przeprowadzić można dalsze testy z wykorzystaniem reakcji charakterystycznych dla poszczególnych grup funkcyjnych. Do przeprowadzenia prób rozpuszczalności stosuje się następujące rozpuszczalniki, podane w kolejności ich użycia: woda eter dietylowy 5% wodny roztwór NaH 5% wodny roztwór NaHC 3 5% wodny roztwór HCl stężony kwas siarkowy 85% kwas fosforowy Zastosowanie tak wybranych rozpuszczalników ma swoje logiczne uzasadnienie. Woda ze względu na swą polarność jest dobrym rozpuszczalnikiem związków o wyraźnie polarnym charakterze cząsteczek, w których udział części niepolarnej (najczęściej węglowodorowej) nie jest duży. Zła rozpuszczalność związku w eterze świadczy o jego silnej polarności. Po przeprowadzeniu testu rozpuszczalności w wodzie i eterze sprawdzenie rozpuszczalności w wodnych roztworach HCl i NaH pozwala ustalić, czy badana substancja jest lepiej rozpuszczalna w wodnych roztworach kwasu lub zasady, a tym samym, czy zawiera grupy funkcyjne kwasowe lub zasadowe (Tabela 3). Zastosowanie silnego kwasu, jakim jest stężony kwas siarkowy, daje możliwość rozróżnienia związków będących słabymi zasadami (np. alkohole, etery) bądź ulegającymi w warunkach przeprowadzonego testu reakcjom chemicznym od związków nie ulegających w tych warunkach protonowaniu i innym widocznym przemianom (węglowodory alifatyczne). Proces rozpuszczania w stężonym kwasie siarkowym może być procesem złożonym. Zewnętrznym przejawem takiej reakcji może być rozgrzewanie się roztworu, wydzielanie 1
3 gazów, ściemnienie lub zesmolenie próbki. Uznaje się, że związek jest rozpuszczalny w danym rozpuszczalniku wtedy, gdy tworzy z nim homogeniczną ciecz. Wynik testu jest także pozytywny, jeżeli badana substancja ulega przemianie w rozpuszczalniku (dotyczy to zwłaszcza stosowania stężonego kwasu siarkowego) do produktów o odmiennych właściwościach niż związek wyjściowy. 1. Wykonanie prób rozpuszczalności Do przeprowadzenia prób rozpuszczalności przyjmuje się umownie następujące proporcje: 0,1 g substancji stałej (sproszkowanej) lub 0,2 cm 3 cieczy oraz 3 cm 3 rozpuszczalnika. Jeżeli badany związek jest ciałem stałym należy go dokładnie rozdrobnić np. w moździerzu. W przypadku cieczy próbkę odmierza się za pomocą pipety. Próbki umieszcza się w małych probówkach. Dodaje się odpowiedniego rozpuszczalnika i po zatkaniu probówki korkiem wstrząsa i obserwuje efekt. 2. Podział związków organicznych na grupy rozpuszczalności W tabeli 1 podano ogólny podział związków na grupy, w zależności od efektu rozpuszczenia w podanych rozpuszczalnikach. I Związki rozpuszczalne eterze i wodzie Szeregi homologiczne (niższe człony) 1.Alkohole 2.Aldehydy 3.Ketony 4.Kwasy 5.Estry 6.Fenole 7.Bezwodniki 8.Amidy 9.Nitryle 10.Fenole polihydroksylowe II Związki rozpuszczalne w wodzie, lecz nierozpuszczal ne w eterze 1.Kwasy polikarboksylowe i hydroksykwasy 2.Glikole, alkohole polihydroksylowe, polihydroksyaldehydy i ketony (cukry) 3.Niektóre amidy, aminokwasy, związki dwui poliamidowe, aminoalkohole 4.Kwasy sulfonowe 5.Sole Tabela 1. Podział związków organicznych na grupy rozpuszczalności III Związki rozpuszczalne w roztworze NaH 1.Kwasy 2.Fenole 3.Imidy 4.Niektóre I i IIrzędowe nitrozwiązki; oksymy 5.Tiole, tiofenole 6.Kwasy sulfonowe, kwasy sulfonowe, kwasy aminosulfonowe, sulfonamidy 7.Niektóre dwuketony i ßketoestry IV Związki rozpuszczalne w 5% roztworze kwasu solnego 1.Aminy Irzędowe 2.IIrzędowe aminy alifatyczne, aminy arylowoalkilowe 3.IIIrzędowe aminy alifatyczne, niektóre IIIrzędowe aryloalkiloaminy 4.Hydrazyny V Związki zawierające N lub S rozpuszczalne tylko stężonym H 2 S 4 1.Węglowodory nienasycone 2.Niektóre alkilowane węglowodory aromatyczne 3.Alkohole 4.Aldehydy 5.Ketony 6.Estry 7.Bezwodniki 8.Etery i acetale 9.Laktony 10.Chlorki kwasowe VI Związki zawierające N lub S nierozpuszczalne w stężonym H 2 S 4 1.Węglowodory nasycone. 2.Cykloalkany 3.Węglowodory aromatyczne 4.Pochodne chlorowcowe węglowodorów 1,2 i 3 5.Etery dwuarylowe VII Związki zawierające N lub S nie znajdujące się w grupach IIV 1.Związki nitrowe (IIIrzędowe) 2.Amidy i pochodne aldehydów i ketonów 3.Nitryle 4.Aminy z podstawnikami arylowymi 5.Związki azo, nitrozo, hydrazo i inne pośrednie redukcji nitrozwiązków 6.Sulfony, sulfonamidy, pochodne amin IIrzędowych, siarczki, siarczany i inne związki siarki 2
4 Kolejność wykonania prób podano w tabeli 2. Próby wykonuje się w kolejności od lewej kolumny (woda) do prawej (H 3 P 4 ). Tabela 2. Kolejność wykonywania prób dla ustalenia przynależności do grup rozpuszczalności Grupa Woda Eter NaH NaHC 3 HCl H 2 S 4 H 3 P 4 I II III A III B IV V A V B VI VII Efekt pozytywny () pozwala na zakwalifikowanie związku do danej grupy rozpuszczalności i dalsze przeprowadzenie testów na grupy funkcyjne. Niekiedy użyteczne jest sprawdzenie innych rozpuszczalników, zwłaszcza dla pierwszych czterech grup rozpuszczalności. Przykładowo stwierdzenie wydzielania się C 2 w reakcji z NaHC 3 dla związku zaliczonego do pierwszej grupy rozpuszczalności świadczyć może o obecności grupy karboksylowej; związek zaliczony do grupy trzeciej może zawierać także grupy aminowe i rozpuszczać się w 5% roztworze HCl. 3. Próba rozpuszczalności w wodzie i eterze Wykonanie próby: Do 0,1 g substancji stałej i 0,2 cm 3 cieczy umieszczonej w probówce dodaje się 3 cm 3 wody (eteru) porcjami po 1 cm 3, za każdym razem wstrząsając zawartość probówki i obserwując efekt. Należy zbadać ph roztworu wodnego. mówienie: GUPA I Związki rozpuszczalne w wodzie i eterze Woda jest rozpuszczalnikiem polarnym i będą się w niej rozpuszczać związki zawierające polarne grupy funkcyjne i stosunkowo krótkie hydrofobowe fragmenty (łańcuchy węglowodorowe), przy czym wpływ części polarnej i niepolarnej jest stosunkowo wyrównany. Jeżeli związek jest rozpuszczalny w wodzie i eterze to można sądzić, że: a) jest to związek niejonowy lub jonizuje w niewielkim stopniu b) posiada do pięciu atomów węgla w cząsteczce 3
5 c) zawiera polarna grupę, zdolna do tworzenia wiązań wodorowych d) zawiera nie więcej niż jedną grupę polarną Do związków takich zalicza się zawierające do pięciu atomów w cząsteczce: Alkohole H Amidy NH 2 Estry 1 Aminy Nitryle N ksymy Aldehydy Kwasy 2 NH NH 2 1 N H N 1 H H Fenole Ar H Estry pierścieniowe (nr. tetrahydrofuran) Fenole polihydroksylowe (np. hydrochinon) Ketokwasy gdzie: alkil, Ar aryl (np. podstawnik fenylowy) Umownie przyjęta proporcja wody (eteru) i badanej próbki decyduje niejednokrotnie o przynależności związku do pierwszej lub dalszych grup rozpuszczalności, a granica podziału nie jest ostra. Często związki tego samego szeregu homologicznego zawierające przecież te same grupy funkcyjne są klasyfikowane do różnych grup. 3.2 GUPA II Związki rozpuszczalne w wodzie, a nierozpuszczalne w eterze Należą do nich związki o przeważającym wpływie polarnej części cząsteczki, co, sprzyjając rozpuszczaniu w wodzie, ogranicza rozpuszczalność w eterze. Mogą to być: funkcyjne: a) związki jonowe (sole) b) związki zawierające więcej niż jedną grupę polarną, przy czym na każdą grupę polarną wypada nie więcej niż cztery atomy węgla Z reguły nierozpuszczalne w eterze są związki zawierające niżej wymienione grupy Kway polikarboksylowe HC CH Sole Na 4
6 Glikole Aminoalkohole H N H 2 H H Polihydroksyaldehydy (aldozy) Kwasy sulfonowe S 3 H Polihydroksyketony (ketozy) Aminokwasy NH 3 H H H H H Substancje stałe należące do tej grupy należy zbadać ze względu na zachowanie wobec wodnego roztworu HCl i NaH. Hydroliza soli organicznych kwasów lub zasad może prowadzić do wydzielania osadu. 4. Próba rozpuszczalności w roztworze 5% NaH i NaHC 3 Wykonanie próby: Do probówki wprowadza się 0,1 g badanej substancji stałej lub 0,2 cm 3 cieczy i dodaje stopniowo 3 cm 3 roztworu NaH. Jeżeli substancja nie uległa rozpuszczeniu przenosi się za pomocą pipetki część warstwy wodnej do innej probówki i stopniowo dodaje 5% HCl, aż do odczynu kwaśnego. Powstanie osadu lub zmętnienie świadczy o obecności związku o charakterze kwasowym. Podobnie przeprowadza się test na rozpuszczalność w roztworze NaHC 3. W tym wypadku należy zwracać szczególną uwagę na wydzielanie się pęcherzyków C 2. mówienie: 4.1. GUPA III Związki nierozpuszczalne w wodzie, lecz rozpuszczalne w 5% roztworze NaH Do tej grupy należą związki, które posiadają wystarczająco silny charakter kwasowy, by ulec reakcji z wodnym roztworem NaH (patrz Tabela 3.) Część związków rozpuszcza się także w 5% roztworze NaHC 3 ; poniżej wymieniono typy związków należące do tej grupy, z podziałem na dwie części: grupę IIIA i IIIB. Pouczające jest porównanie w tabeli 3 stałych pk a dla kwasów karboksylowych (45), kwasu węglowego (6,35), fenoli (911) i wody (16). Z tych danych oraz reguły, że każdy kwas reagować będzie z zasadą, która jest w tabeli uszeregowana niżej (wyższa wartość pk a ) 5
7 wynika, iż reakcja: CH HC 3 C H 2 C 3 będzie przesunięta w prawo (z wydzieleniem C 2 ), natomiast reakcja: ArH HC 3 Ar H 2 C 3 nie jest obserwowana GUPA IIIA Związki rozpuszczalne w roztworze NaH i NaHC 3 Należą do nich: kwasy karboksylowe kwasy sulfinowe (ArS 2 H) kwasy sulfonowe (ArS 3 H) fenole z grupami elektronoakceptorowymi (2,4dinitrofenol, 2,4,6trinitrofenol, 2,4,6tribromofenol) GUPA IIIB Związki rozpuszczalne w roztworze NaH i nierozpuszczalne w roztworze NaHC 3 Do grupy tej należą związki, dla których wartość pk a jest wyższa niż kwasu węglowego, a niższa niż wody. Przykłady związków podano poniżej: Związki nitrowe I i IIgo rzędu N 2 Fenole Ar H Sulfonamidy Tiofenole Ar SH Ar S NH 2 Imidy Ar S NH βdiketony NH Tiole SH βketoestry 6
8 5. Próba rozpuszczalności w 5% roztworze HCl Wykonanie próby: Do 0,1 g stałej substancji lub 0,2 cm 3 cieczy dodaje się porcjami 3 cm 3 kwasu. Niektóre zasady organiczne tworzą chlorowodorki rozpuszczalne w wodzie, lecz wytrącające się wobec nadmiaru kwasu. ozpuszczenie badanej próbki w którymkolwiek momencie świadczy o pozytywnym wyniku testu. Jeżeli próbka nie uległa całkowitemu rozpuszczeniu należy pipetką pobrać część wodnego roztworu do innej probówki i powoli neutralizować 5% wodnym roztworem NaH. Wydzielenie osadu lub emulsji świadczy o pozytywnym wyniku testu. mówienie: GUPA IV Związki rozpuszczalne w 5% roztworze HCl Większość związków rozpuszczalnych w roztworze HCl zawiera w cząsteczce zasadowy atom azotu (atom posiadający wolną parę elektronową). Są to aminy alifatyczne wszystkich rzędów, pierwszorzędowe aminy aromatyczne (grupy arylowe zmniejszają zasadowość azotu), aminy alifatycznoaromatyczne, aminy alicykliczne. Niektóre związki zawierające tlen (piron) mogą tworzyć już z 5% roztworem kwasu solnego sole oksoniowe i są w nim rozpuszczalne. Nierozpuszczalne w wodzie amidy niepodstawionej i jednopodstawione są także nierozpuszczalne. Natomiast niektóre amidy dwupodstawione mogą ulegać rozpuszczeniu. Niżej wymieniono niektóre typy związków: Aminy alifatyczne NH NH 2 1 N Aminy aromatyczne Ar NH 2 Hydrazyny H N NH 2 Niektóre związki heterocykliczne z atomem azotu (pirydyna) 2 1 Niektóre związki heterocykliczne z atomem tlenu (piron) N Niektóre związki zawierające grupy aminowe nie ulegają rozpuszczeniu w roztworze 7
9 HCl, z uwagi na tworzenie wewnętrznych soli. Przykładem jest kwas paminobenzenosulfonowy: H 3 N S 3 Podobny typ soli tworzą aminokwasy: NH 3 jednakże osłabienie zasadowego charakteru grupy aminowej jest w tym przypadku mniejsze (aminokwasy rozpuszczają się w roztworze HCl). 6. Próbka rozpuszczalności w stężonym kwasie siarkowym i 85% kwasie fosforowym Wykonanie próby: W suchej probówce umieszcza się 3 cm 3 czystego stężonego kwasu siarkowego i dodaje 0,1 g substancji stałej lub 0,2 cm 3 cieczy. Jeżeli związek nie rozpuszcza się natychmiast należy delikatnie wstrząsać probówką, obserwując uważnie, czy nie zachodzi zmiana barwy próbki, zesmolenie, wydzielanie produktów gazowych. Należy wyraźnie rozróżnić nierozpuszczalność produktu reakcji od rozpuszczalności badanego związku. Dlatego reakcja badanego związku z kwasem siarkowym nawet połączona z wytrąceniem osadu jest podstawą do uznania związku za rozpuszczalny. Podobnie wykonuje się próbę rozpuszczalności w kwasie fosforowym, jedynie przy pozytywnym wyniku rozpuszczenia w stężonym H 2 S 4. mówienie: 6.1. GUPA V Związki nie zawierające azotu i siarki, nierozpuszczalne w wodzie oraz poszczególnych kwasach alkaliach, rozpuszczalne w kwasie siarkowym Liczną grupą związków należących do V grupy rozpuszczalności są związki zawierające tlen. Ich rozpuszczalność spowodowana jest zasadowym charakterem atomów tlenu, mogących tworzyć jony oksoniowe. Często rozcieńczenie rozpuszczonej próbki przez ostrożne wprowadzenie jej do wody 8
10 powoduje wydzielanie związku w postaci niezmienionej. W wielu wypadkach jony oksoniowe mogą jednak ulegać dalszym przemianom. Do V grupy rozpuszczalności należą także węglowodory nienasycone, ulegające rozpuszczeniu wskutek tworzenia wodorosiarczanów alkilowych oraz węglowodory polialkiloaromatyczne i etery alkilowoarylowe, ulegające sulfonowaniu. Do V grupy rozpuszczalności należy najwięcej klas związków, z tego względu korzystne jest wykonanie dodatkowego badania rozpuszczalności w 85% kwasie fosforowym. W kwasie fosforowym rozpuszczają się: Alkohole H Aldehydy Ketony acykliczne Metyloketony H Estry (poniżej 9 atomów węgla) Etery (poniżej 7 atomów węgla) 1 1 Ponadto do V grupy rozpuszczalności należą związki rozpuszczalne wyłącznie w stężonym kwasie siarkowym: Węglowodory nienasycony Węglowodory polialkiloaromatyczne 1 Chlorki kwasowe Cl Etery alkiloarylowe Ar Bezwodniki Ketony 6.2. GUPA VI Związki nie zawierające azotu i siarki, nie odpowiadające warunkom rozpuszczalności dla grup IV Do tej grupy zalicza się: węglowodory nasycone (oktan, cykloheksan) węglowodory aromatyczne (toluen, naftalen) chlorowcopochodne węglowodorów (bromobenzen, 1chlorobutan) etery diarylowe (eter difenylowy) 9
11 6.3. GUPA VII Związki zawierające azot lub siarkę, nie odpowiadające warunkom rozpuszczalności grup IV Klasy związków zostały wymienione w tabeli 1. Do grupy tej należy szereg związków, w których występujące atomy azotu lub siarki nie posiadają lub posiadają znacznie ograniczone właściwości zasadowe. Tabela 3. Wartość pk a dla różnych rodzajów kwasów Kwas Zasada Przybliżona wartość pk a (w odniesieniu do wody) H 2 N N 2 12 ArN 2 H ArN 2 11 HCl 4 Cl 4 10 HJ J 10 CNH CN 10 H 2 S 4 HS 4 8 H Ar ArS 3 H ArS 3 HCl Cl ArH 2 ArH SH 2 SH 7,4 Ar H 7 6,5 6 10
12 Ar H Ar 4 H 3 CH 2 2 CHH 2 CH 2 H 2 3,5 3 CH 2 CHH CH 2 H 2 Ar NH 2 H 3 H 2 1,74 HN 3 N 4 1,4 2 HS 4 S 4 1,99 HF F HNN N 2 3,29 ArNH 2 ArN ArNH 3 ArNH 2 CH C 4 5 HCCH 2 CH 5 H 2 C 3 HC 3 6,35 H 2 S HS 7 ArSH ArS 8 CH 3 CCH 2 CCH 3 9 NH 3 9,24 ArH Ar 9 11 NH 4 CH 2 N NH NH 3 HC 3 2 NH 2 CH 3 CCH 2 CC 2 H 5 3 N NH 2 C NH ,33 11 SH S 12 NCCH 2 CN 11
13 C 2 H 5 CCH 2 CC 2 H 5 13 CH 3 S 2 CH 2 S 2 CH H 2 H CH 3 H CH 3 16 CH 2 H 2 CHH CH 2 2 CH 18 C 4 H 9 C CH C 4 H 9 C C 18,5 3 CH 3 C 19 ArCCH 2 CCH CCH 2 24,5 CH 2 CN CNH 2 CNH 25 HC CH HC C ArHN 2 ArHN Ar 3 CH Ar 3 C 31,5 Ar 2 CH 2 Ar 2 CH 33 CH 3 SCH 2 33,5 NH 3 NH 2 34 ArCH 3 ArCH 2 35 CH 2 =CH 2 CH 2 =CH 36,5 C 6 H 6 C 6 H 5 37 cykloc 3 H 6 cykloc 3 H 5 39 CH 4 CH 3 40 C 2 H 6 C 2 H 5 42 (CH 3 ) 3 CH (CH 3 ) 3 C 44 cykloc 6 H 12 cykloc 6 H
14 dpady Przed utylizacją, odpady należy zneutralizować poprzez połączenie zlewek z 5% HCl ze zlewkami z 5% NaH. Zlewki po stężonym H 2 S 4 neutralizujemy przy pomocy 5% wodnego roztworu wodorowęglanu sodu. Następnie całość wylewa się do kanalizacji pod dygestorium. dpady zawierające aceton oraz eter dietylowy należy wlać do pojemników na odpady organiczne płynne niezawierające fluorowców (oznaczone symbolem ) lub zawierające fluorowce (oznaczone symbolem F). Pojemniki te znajdują się pod dygestorium. Proszę DKŁADNIE zapoznać się z instrukcją laboratoryjną oraz: umieć wyjaśnić pojęcia występujące w instrukcji, np. pka, polarność, rzędowość znać wzory sumaryczne związków wymienionych w instrukcji potrafić napisać poprawne reakcje chemiczne opisane w instrukcji Na zajęcia należy przynieść: ręczniki papierowe (jedne na sekcję) ściereczkę do rąk (najlepiej każdy swoją) płyn do mycia naczyń (jeden na sekcję) rękawiczki nitrylowe bądź winylowe (po 2 pary na osobę) wydrukowaną Kartę wykonania ćwiczeń, po 5 egzemplarzy na osobę Literatura: 1. A.I. Vogle, Preparatyka organiczna, WNT, Warszawa, p.z. pod red. T. Kierśnicki, Preparatyka organiczna cz. 1, S.U. 1485, Gliwice, J. McMurry, Chemia organiczna, WNT, Warszawa, C. Willis, M. Willis, Synteza organiczna, W.U.J., Kraków,
15 Karta wykonania ćwiczenia Właściwości kwasowozasadowe związków organicznych. Badanie rozpuszczalności związków. Nazwisko i imię Grupa lab. Prowadzący ćwiczenie Próba Woda Wynik próby * pis zachowania próbki Grupa rozp. ** Związek Skład atomowy Eter dietylowy 5% NaH 5% HCl stężony H 2 S 4 SUMA PUNKTÓW * pozytywny (); negatywny ( ); nie dotyczy ** na podstawie wyników z wszystkich przeprowadzonych prób 14
POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA CHEMII ORGANICZNEJ, BIOORGANICZNEJ I BIOTECHNOLOGII
 POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA CHEMII ORGANICZNEJ, BIOORGANICZNEJ I BIOTECHNOLOGII Instrukcja do ćwiczeń laboratoryjnych WŁAŚCIWOŚCI KWASOWOZASADOWE ZWIĄZKÓW ORGANICZNYCH; BADANIE ROZPUSZCZALNOŚCI
POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA CHEMII ORGANICZNEJ, BIOORGANICZNEJ I BIOTECHNOLOGII Instrukcja do ćwiczeń laboratoryjnych WŁAŚCIWOŚCI KWASOWOZASADOWE ZWIĄZKÓW ORGANICZNYCH; BADANIE ROZPUSZCZALNOŚCI
Ćwiczenie 1 Analiza związków organicznych. Badanie grupy rozpuszczalności
 Ćwiczenie 1 Analiza związków organicznych Badanie grupy rozpuszczalności el: Przeprowadzenie toku analitycznego pozwalającego na określenie grupy rozpuszczalności związku organicznego. 1. WSTĘP hemik organik
Ćwiczenie 1 Analiza związków organicznych Badanie grupy rozpuszczalności el: Przeprowadzenie toku analitycznego pozwalającego na określenie grupy rozpuszczalności związku organicznego. 1. WSTĘP hemik organik
Identyfikacja płomieniowa tworzyw sztucznych Iloczyny rozpuszczalności trudno rozpuszczalnych związków w wodzie w temperaturze pokojowej
 Jeśli ktoś jest w posiadaniu tablic chemicznych, to bardzo prosilibyśmy, aby nam je nadesłał (na adres któregoś z administratorów, najlepiej w formie pliku *.doc; *.pdf; *.jpg) - na pewno je zamieścimy.
Jeśli ktoś jest w posiadaniu tablic chemicznych, to bardzo prosilibyśmy, aby nam je nadesłał (na adres któregoś z administratorów, najlepiej w formie pliku *.doc; *.pdf; *.jpg) - na pewno je zamieścimy.
ĆWICZENIE 4 ELEMENTARNA ANALIZA JAKOŚCIOWA ZWIĄZKÓW ORGANICZNYCH
 ĆWICZENIE ELEMENTARNA ANALIZA JAKOŚCIOWA ZWIĄZKÓW ORGANICZNYCH Celem ćwiczenia jest identyfikacja związku organicznego ustalenie nazwy i wzoru (sumarycznego i strukturalnego). 1. Próby wstępne demonstracja
ĆWICZENIE ELEMENTARNA ANALIZA JAKOŚCIOWA ZWIĄZKÓW ORGANICZNYCH Celem ćwiczenia jest identyfikacja związku organicznego ustalenie nazwy i wzoru (sumarycznego i strukturalnego). 1. Próby wstępne demonstracja
Spis treści 1. Struktura elektronowa związków organicznych 2. Budowa przestrzenna cząsteczek związków organicznych
 Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Ćwiczenie 1. Ćwiczenie Temat: Podstawowe reakcje nieorganiczne. Obliczenia stechiometryczne.
 PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR LETNI) OCHRONA ŚRODOWISKA Literatura zalecana 1. P. Szlachcic, J. Szymońska, B. Jarosz, E. Drozdek, O. Michalski, A. Wisła-Świder, Chemia I: Skrypt do
PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR LETNI) OCHRONA ŚRODOWISKA Literatura zalecana 1. P. Szlachcic, J. Szymońska, B. Jarosz, E. Drozdek, O. Michalski, A. Wisła-Świder, Chemia I: Skrypt do
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej
 Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
Zagadnienia z chemii na egzamin wstępny kierunek Technik Farmaceutyczny Szkoła Policealna im. J. Romanowskiej 1) Podstawowe prawa i pojęcia chemiczne 2) Roztwory (zadania rachunkowe zbiór zadań Pazdro
KWASY KARBOKSYLOWE I ICH POCHODNE. R-COOH lub R C gdzie R = H, CH 3 -, C 6 H 5 -, itp.
 KWASY KARBKSYLWE I IH PHDNE I. Wprowadzenie teoretyczne Kwasy karboksylowe Kwasami organicznymi nazywamy związki, w których grupa funkcyjna H zwana grupą karboksylową jest związana z rodnikiem węglowodorowym
KWASY KARBKSYLWE I IH PHDNE I. Wprowadzenie teoretyczne Kwasy karboksylowe Kwasami organicznymi nazywamy związki, w których grupa funkcyjna H zwana grupą karboksylową jest związana z rodnikiem węglowodorowym
PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR LETNI) OCHRONA ŚRODOWISKA
 PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR LETNI) OCHRONA ŚRODOWISKA Ćwiczenie 1 (Karta pracy - 1a, 1b, 1c, 1d, 1e) 1. Organizacja ćwiczeń. Regulamin pracowni chemicznej i przepisy BHP (Literatura
PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR LETNI) OCHRONA ŚRODOWISKA Ćwiczenie 1 (Karta pracy - 1a, 1b, 1c, 1d, 1e) 1. Organizacja ćwiczeń. Regulamin pracowni chemicznej i przepisy BHP (Literatura
Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy. Dział Zakres treści
 Anna Kulaszewicz Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy lp. Dział Temat Zakres treści 1 Zapoznanie z przedmiotowym systemem oceniania i wymaganiami edukacyjnymi z
Anna Kulaszewicz Plan dydaktyczny z chemii klasa: 2TRA 1 godzina tygodniowo- zakres podstawowy lp. Dział Temat Zakres treści 1 Zapoznanie z przedmiotowym systemem oceniania i wymaganiami edukacyjnymi z
Kwasy karboksylowe grupa funkcyjna: -COOH. Wykład 8 1
 Kwasy karboksylowe grupa funkcyjna: -CH Wykład 8 1 1. Reakcje utleniania a) utlenianie alkoholi pierwszorzędowych trzymywanie kwasów CH 3 H 3 C C CH 2 H CH 3 alkohol pierwszorzędowy CH K 2 Cr 2 3 7 H 3
Kwasy karboksylowe grupa funkcyjna: -CH Wykład 8 1 1. Reakcje utleniania a) utlenianie alkoholi pierwszorzędowych trzymywanie kwasów CH 3 H 3 C C CH 2 H CH 3 alkohol pierwszorzędowy CH K 2 Cr 2 3 7 H 3
Pochodne węglowodorów, w cząsteczkach których jeden atom H jest zastąpiony grupą hydroksylową (- OH ).
 Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
Cz. XXII - Alkohole monohydroksylowe Pochodne węglowodorów, w cząsteczkach których jeden atom jest zastąpiony grupą hydroksylową (- ). 1. Klasyfikacja alkoholi monohydroksylowych i rodzaje izomerii, rzędowość
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego. II Etap - 18 stycznia 2016
 XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
XIV Konkurs Chemiczny dla uczniów gimnazjum województwa świętokrzyskiego II Etap - 18 stycznia 2016 Nazwisko i imię ucznia: Liczba uzyskanych punktów: Drogi Uczniu, przeczytaj uważnie instrukcję i postaraj
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
ROLNICTWO. Ćwiczenie 1
 PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR ZIMOWY) ROLNICTWO Ćwiczenie 1 1. Organizacja ćwiczeń. Regulamin pracowni chemicznej i przepisy BHP (Literatura zalecana, pozycja 1, rozdz. 1.1.). Zasady
PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR ZIMOWY) ROLNICTWO Ćwiczenie 1 1. Organizacja ćwiczeń. Regulamin pracowni chemicznej i przepisy BHP (Literatura zalecana, pozycja 1, rozdz. 1.1.). Zasady
ĆWICZENIE 8 ELEMENTARNA ANALIZA JAKOŚCIOWA
 ĆWICZENIE 8 ELEMENTARNA ANALIZA JAKOŚCIOWA Celem ćwiczenia jest oznaczenie jakie organicznego. pierwiastki wchodzą w skład danego związku Szkło: 2 probówki do spaleń, szpachelka porcelanowa, parowniczki,
ĆWICZENIE 8 ELEMENTARNA ANALIZA JAKOŚCIOWA Celem ćwiczenia jest oznaczenie jakie organicznego. pierwiastki wchodzą w skład danego związku Szkło: 2 probówki do spaleń, szpachelka porcelanowa, parowniczki,
Zadanie: 1 (3 pkt) Metanoamina (metyloamina) rozpuszcza się w wodzie, a także reaguje z nią.
 Zadanie: 1 (3 pkt) Metanoamina (metyloamina) rozpuszcza się w wodzie, a także reaguje z nią. Napisz, posługując się wzorami grupowymi (półstrukturalnymi) związków organicznych, równanie reakcji metanoaminy
Zadanie: 1 (3 pkt) Metanoamina (metyloamina) rozpuszcza się w wodzie, a także reaguje z nią. Napisz, posługując się wzorami grupowymi (półstrukturalnymi) związków organicznych, równanie reakcji metanoaminy
ĆWICZENIE I - BIAŁKA. Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi.
 ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
ĆWICZENIE I - BIAŁKA Celem ćwiczenia jest zapoznanie się z właściwościami fizykochemicznymi białek i ich reakcjami charakterystycznymi. Odczynniki: - wodny 1% roztwór siarczanu(vi) miedzi(ii), - 10% wodny
Test kompetencji z chemii do liceum. Grupa A.
 Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Test kompetencji z chemii do liceum. Grupa A. 1. Atomy to: A- niepodzielne cząstki pierwiastka B- ujemne cząstki materii C- dodatnie cząstki materii D- najmniejsze cząstki pierwiastka, zachowujące jego
Treść podstawy programowej
 CHEMIA ZR Ramowy rozkład materiału w kolejnych tomach podręczników I. Atomy, cząsteczki i stechiometria chemiczna Tom I 1. Masa atomowa I.2. 2. Izotopy I.1., I.3. 3. Reakcje jądrowe I.4. 4. Okres półtrwania
CHEMIA ZR Ramowy rozkład materiału w kolejnych tomach podręczników I. Atomy, cząsteczki i stechiometria chemiczna Tom I 1. Masa atomowa I.2. 2. Izotopy I.1., I.3. 3. Reakcje jądrowe I.4. 4. Okres półtrwania
MIKROANALIZY WĘGLOWODORY. W1 Utlenianie węglowodorów nadmanganianem potasu w środowisku kwaśnym (w temp. pokojowej) RÓWNANIA REAKCJI: OBSERWACJE:
 MIKROANALIZY imię i nazwisko Rubryki odpowiednio opisane (lekko przyciemnione) należy wypełniać przed rozpoczęciem zajęć. Opisując obserwacje reakcji należy wyraźnie napisać co się zmienia lub nie. Jeśli
MIKROANALIZY imię i nazwisko Rubryki odpowiednio opisane (lekko przyciemnione) należy wypełniać przed rozpoczęciem zajęć. Opisując obserwacje reakcji należy wyraźnie napisać co się zmienia lub nie. Jeśli
Podstawowe pojęcia i prawa chemiczne
 Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
Podstawowe pojęcia i prawa chemiczne Pierwiastki, nazewnictwo i symbole. Budowa atomu, izotopy. Przemiany promieniotwórcze, okres półtrwania. Układ okresowy. Właściwości pierwiastków a ich położenie w
ODNAWIALNE ŹRÓDŁA ENERGII I GOSPODARKA ODPADAMI STUDIA STACJONARNE
 PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR ZIMOWY) ODNAWIALNE ŹRÓDŁA ENERGII I GOSPODARKA ODPADAMI STUDIA STACJONARNE Ćwiczenie 1 (Karty pracy laboratoryjnej: 1a, 1b, 1d, 1e) 1. Organizacja ćwiczeń.
PROGRAM ĆWICZEŃ LABORATORYJNYCH Z CHEMII (SEMESTR ZIMOWY) ODNAWIALNE ŹRÓDŁA ENERGII I GOSPODARKA ODPADAMI STUDIA STACJONARNE Ćwiczenie 1 (Karty pracy laboratoryjnej: 1a, 1b, 1d, 1e) 1. Organizacja ćwiczeń.
1. REAKCJA ZE ZWIĄZKAMI POSIADAJĄCYMI KWASOWY ATOM WODORU:
 B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
B I T E C N L CEMIA G GANICZNA I A Własności chemiczne Związki magnezoorganiczne wykazują wysoką reaktywność. eagują samorzutnie z wieloma związkami dając produkty należące do różnych klas związków organicznych.
LCH 1 Zajęcia nr 60 Diagnoza końcowa. Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach:
 LCH 1 Zajęcia nr 60 Diagnoza końcowa Zadanie 1 (3 pkt) Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach: H 3 C CH 2 CH 2 CH 2 CH 2 a) b) W tym celu: a) wybierz odpowiedni
LCH 1 Zajęcia nr 60 Diagnoza końcowa Zadanie 1 (3 pkt) Zaprojektuj jedno doświadczenie pozwalające na odróżnienie dwóch węglowodorów o wzorach: H 3 C CH 2 CH 2 CH 2 CH 2 a) b) W tym celu: a) wybierz odpowiedni
Zagadnienia. Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I
 Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Nr zajęć Data Zagadnienia Budowa atomu a. rozmieszczenie elektronów na orbitalach Z = 1-40; I 9.10.2012. b. określenie liczby cząstek elementarnych na podstawie zapisu A z E, również dla jonów; c. określenie
Ćwiczenie 3. Otrzymywanie i badanie właściwości chemicznych alkanów, alkenów, alkinów i arenów.
 Ćwiczenie 3. Otrzymywanie i badanie właściwości chemicznych alkanów, alkenów, alkinów i arenów. Wprowadzenie teoretyczne Cel ćwiczeń: Poznanie metod otrzymywania oraz badania właściwości węglowodorów alifatycznych
Ćwiczenie 3. Otrzymywanie i badanie właściwości chemicznych alkanów, alkenów, alkinów i arenów. Wprowadzenie teoretyczne Cel ćwiczeń: Poznanie metod otrzymywania oraz badania właściwości węglowodorów alifatycznych
MATERIAŁY POMOCNICZE 1 GDYBY MATURA 2002 BYŁA DZISIAJ CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY ARKUSZ EGZAMINACYJNY I
 MATERIAŁY POMOCNICZE 1 GDYBY MATURA 00 BYŁA DZISIAJ OKRĘ GOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY Informacje ARKUSZ EGZAMINACYJNY I 1. Przy każdym zadaniu podano
MATERIAŁY POMOCNICZE 1 GDYBY MATURA 00 BYŁA DZISIAJ OKRĘ GOWA K O M I S J A EGZAMINACYJNA w KRAKOWIE CHEMIA ZESTAW EGZAMINACYJNY PIERWSZY Informacje ARKUSZ EGZAMINACYJNY I 1. Przy każdym zadaniu podano
Elementy chemii organicznej
 Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
Elementy chemii organicznej węglowodory alifatyczne węglowodory aromatyczne halogenopochodne węglowodorów alkohole etery aldehydy i ketony kwasy karboksylowe estry aminy Alkany C n H 2n+2 struktura Kekulégo
Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr.
 Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr. Typ wiązania w KBr... Typ wiązania w HBr... Zadanie 2. (2 pkt) Oceń poprawność poniższych
Zadanie 1. (2 pkt) Określ, na podstawie różnicy elektroujemności pierwiastków, typ wiązania w związkach: KBr i HBr. Typ wiązania w KBr... Typ wiązania w HBr... Zadanie 2. (2 pkt) Oceń poprawność poniższych
IDENTYFIKACJA JAKOŚCIOWA NIEZNANEGO ZWIĄZKU ORGANICZNEGO
 IDENTYFIKACJA JAKOŚCIOWA NIEZNANEGO ZWIĄZKU ORGANICZNEGO Schemat raportu końcowego w ramach ćwiczeń laboratoryjnych z przedmiotu Badanie struktury związków organicznych 1. Symbol kodujący identyfikowaną
IDENTYFIKACJA JAKOŚCIOWA NIEZNANEGO ZWIĄZKU ORGANICZNEGO Schemat raportu końcowego w ramach ćwiczeń laboratoryjnych z przedmiotu Badanie struktury związków organicznych 1. Symbol kodujący identyfikowaną
RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW.
 RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW. Zagadnienia: Zjawisko dysocjacji: stała i stopień dysocjacji Elektrolity słabe i mocne Efekt wspólnego jonu Reakcje strącania osadów Iloczyn rozpuszczalności Odczynnik
RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW. Zagadnienia: Zjawisko dysocjacji: stała i stopień dysocjacji Elektrolity słabe i mocne Efekt wspólnego jonu Reakcje strącania osadów Iloczyn rozpuszczalności Odczynnik
Jak analizować widmo IR?
 Jak analizować widmo IR? Literatura: W. Zieliński, A. Rajca, Metody spektroskopowe i ich zastosowanie do identyfikacji związków organicznych. WNT. R. M. Silverstein, F. X. Webster, D. J. Kiemle, Spektroskopowe
Jak analizować widmo IR? Literatura: W. Zieliński, A. Rajca, Metody spektroskopowe i ich zastosowanie do identyfikacji związków organicznych. WNT. R. M. Silverstein, F. X. Webster, D. J. Kiemle, Spektroskopowe
Zadanie 2. (0 1) Uzupełnij schemat reakcji estryfikacji. Wybierz spośród podanych wzór kwasu karboksylowego A albo B oraz wzór alkoholu 1 albo 2.
 Zadanie 1. (0 1) W celu odróżnienia kwasu oleinowego od stopionego kwasu palmitynowego wykonano doświadczenie, którego przebieg przedstawiono na schemacie. W probówce I wybrany odczynnik zmienił zabarwienie.
Zadanie 1. (0 1) W celu odróżnienia kwasu oleinowego od stopionego kwasu palmitynowego wykonano doświadczenie, którego przebieg przedstawiono na schemacie. W probówce I wybrany odczynnik zmienił zabarwienie.
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp W przypadku trudno rozpuszczalnej soli, mimo osiągnięcia stanu nasycenia, jej stężenie w roztworze jest bardzo małe i przyjmuje się, że ta
WĘGLOWODORY, ALKOHOLE, FENOLE. I. Wprowadzenie teoretyczne
 WĘGLWDRY, ALKHLE, FENLE I. Wprowadzenie teoretyczne Węglowodory Węglowodory są to połączenia organiczne zbudowane z atomów węgla i wodoru. Ze względu na różne sposoby łączenia się atomów węgla w tych związkach
WĘGLWDRY, ALKHLE, FENLE I. Wprowadzenie teoretyczne Węglowodory Węglowodory są to połączenia organiczne zbudowane z atomów węgla i wodoru. Ze względu na różne sposoby łączenia się atomów węgla w tych związkach
ALDEHYDY, KETONY. I. Wprowadzenie teoretyczne
 ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
ALDEYDY, KETNY I. Wprowadzenie teoretyczne Aldehydy i ketony są produktami utlenienia alkoholi. Aldehydy są produktami utlenienia alkoholi pierwszorzędowych, a ketony produktami utlenienia alkoholi drugorzędowych.
Ćwiczenie 5. Badanie właściwości chemicznych aldehydów, ketonów i kwasów karboksylowych. Synteza kwasu sulfanilowego.
 Ćwiczenie 5. Badanie właściwości chemicznych aldehydów, ketonów i kwasów karboksylowych. Synteza kwasu sulfanilowego. Wprowadzenie teoretyczne Cel ćwiczeń: Zapoznanie studentów z właściwościami chemicznymi
Ćwiczenie 5. Badanie właściwości chemicznych aldehydów, ketonów i kwasów karboksylowych. Synteza kwasu sulfanilowego. Wprowadzenie teoretyczne Cel ćwiczeń: Zapoznanie studentów z właściwościami chemicznymi
HYDROLIZA SOLI. 1. Hydroliza soli mocnej zasady i słabego kwasu. Przykładem jest octan sodu, dla którego reakcja hydrolizy przebiega następująco:
 HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA
 MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA Zadanie Odpowiedzi Uwagi a) za uzupełnienie tabeli: Symbol pierwiastka Konfiguracja elektronowa w stanie podstawowym Liczba elektronów walencyjnych S b) za uzupełnienie
MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA Zadanie Odpowiedzi Uwagi a) za uzupełnienie tabeli: Symbol pierwiastka Konfiguracja elektronowa w stanie podstawowym Liczba elektronów walencyjnych S b) za uzupełnienie
Grupa karbonylowa. Grupa karbonylowa to grupa funkcyjna, w której atom tlenu połączony jest z atomem węgla podwójnym wiązaniem
 ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
ALDEHYDY I KETNY Spis treści Grupa karbonylowa Aldehydy i ketony Aldehydy Nazewnictwo trzymywanie Właściwości chemiczne Aldehydy nienasycone Aldehydy aromatyczne Ketony Nazewnictwo trzymywanie Właściwości
Chemia nieorganiczna Zadanie Poziom: podstawowy
 Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Zadanie 1 2 3 4 5 6 7 8 9 10 (Nazwisko i imię) Punkty Razem pkt % Chemia nieorganiczna Zadanie 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Poziom: podstawowy Punkty Zadanie 1. (1 pkt.) W podanym
Szanowne koleżanki i koledzy nauczyciele chemii!
 Szanowne koleżanki i koledzy nauczyciele chemii! Chciałabym podzielić się z Wami moimi spostrzeżeniami dotyczącymi poziomu wiedzy z chemii uczniów rozpoczynających naukę w Liceum Ogólnokształcącym. Co
Szanowne koleżanki i koledzy nauczyciele chemii! Chciałabym podzielić się z Wami moimi spostrzeżeniami dotyczącymi poziomu wiedzy z chemii uczniów rozpoczynających naukę w Liceum Ogólnokształcącym. Co
Skala ocen: ndst 0 20, dst , dst , db , db , bdb Informacja:
 Kolokwium III Autorzy: A. Berlicka, E. Dudziak Imię i nazwisko Kierunek studiów azwisko prowadzącego Data Wersja B czas: 60 minut Skala ocen: ndst 0 20, dst 20.5 24, dst 24.5 28, db 28.5 32, db 32.5 36,
Kolokwium III Autorzy: A. Berlicka, E. Dudziak Imię i nazwisko Kierunek studiów azwisko prowadzącego Data Wersja B czas: 60 minut Skala ocen: ndst 0 20, dst 20.5 24, dst 24.5 28, db 28.5 32, db 32.5 36,
Proseminarium identyfikacji związków organicznych
 Proseminarium identyfikacji związków organicznych pracował: Wojciech Augustyniak Dr Wojciech Augustyniak Pracownia Peptydów Gmach Chemii p. 230 (tel. wew. 509) Gmach Radiochemii p. 118, 122, 165, 169 (wew.
Proseminarium identyfikacji związków organicznych pracował: Wojciech Augustyniak Dr Wojciech Augustyniak Pracownia Peptydów Gmach Chemii p. 230 (tel. wew. 509) Gmach Radiochemii p. 118, 122, 165, 169 (wew.
KARTA KURSU. Kod Punktacja ECTS* 4
 KARTA KURSU Nazwa Nazwa w j. ang. Chemia organiczna Organic chemistry Kod Punktacja ECTS* 4 Koordynator dr Waldemar Tejchman Zespół dydaktyczny dr Waldemar Tejchman Opis kursu (cele kształcenia) Celem
KARTA KURSU Nazwa Nazwa w j. ang. Chemia organiczna Organic chemistry Kod Punktacja ECTS* 4 Koordynator dr Waldemar Tejchman Zespół dydaktyczny dr Waldemar Tejchman Opis kursu (cele kształcenia) Celem
WYMAGANIA EDUKACYJNE
 GIMNAZJUM NR 2 W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie II gimnazjum str. 1 Wymagania edukacyjne niezbędne do
GIMNAZJUM NR 2 W RYCZOWIE WYMAGANIA EDUKACYJNE niezbędne do uzyskania poszczególnych śródrocznych i rocznych ocen klasyfikacyjnych z CHEMII w klasie II gimnazjum str. 1 Wymagania edukacyjne niezbędne do
CHEMIA PIĘKNA W Y D A W N I C T W O N A U K O W E P W N i
 CHEMIA PIĘKNA W Y D A W N I C T W O N A U K O W E P W N i M arcin J! lifcl CHEMIA PIĘKNA WYDAWNICTWO NAUKOWE PWN WARSZAWA 2012 Spis treści Przedmowa... IX 1. RYS HISTORYCZNY... 1 2. CHEMIA OGÓLNA... 4
CHEMIA PIĘKNA W Y D A W N I C T W O N A U K O W E P W N i M arcin J! lifcl CHEMIA PIĘKNA WYDAWNICTWO NAUKOWE PWN WARSZAWA 2012 Spis treści Przedmowa... IX 1. RYS HISTORYCZNY... 1 2. CHEMIA OGÓLNA... 4
Addycje Nukleofilowe do Grupy Karbonylowej
 J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
Reakcje związków karbonylowych zudziałem atomu węgla alfa (C- )
 34-37. eakcje związków karbonylowych zudziałem atomu węgla alfa (C- ) stabilizacja rezonansem (przez delokalizację elektronów), może uczestniczyć w delokalizacji elektronów C- -, podatny na oderwanie ze
34-37. eakcje związków karbonylowych zudziałem atomu węgla alfa (C- ) stabilizacja rezonansem (przez delokalizację elektronów), może uczestniczyć w delokalizacji elektronów C- -, podatny na oderwanie ze
etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
 Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
WARSZTATY olimpijskie. Co już było: Atomy i elektrony Cząsteczki i wiązania Stechiometria Gazy, termochemia Równowaga chemiczna Kinetyka
 WARSZTATY olimpijskie Co już było: Atomy i elektrony Cząsteczki i wiązania Stechiometria Gazy, termochemia Równowaga chemiczna inetyka WARSZTATY olimpijskie Co będzie: Data Co robimy 1 XII 2016 wasy i
WARSZTATY olimpijskie Co już było: Atomy i elektrony Cząsteczki i wiązania Stechiometria Gazy, termochemia Równowaga chemiczna inetyka WARSZTATY olimpijskie Co będzie: Data Co robimy 1 XII 2016 wasy i
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab
 SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
SZCZEGÓŁOWE KRYTERIA OCENIANIA Z CHEMII DLA KLASY II GIMNAZJUM Nauczyciel Katarzyna Kurczab CZĄSTECZKA I RÓWNANIE REKCJI CHEMICZNEJ potrafi powiedzieć co to jest: wiązanie chemiczne, wiązanie jonowe, wiązanie
MECHANIZMY REAKCJI CHEMICZNYCH. REAKCJE CHARAKTERYSTYCZNE GRUP FUNKCYJNYCH ZWIĄZKÓW ORGANICZNYCH
 Ćwiczenie 2 semestr 2 MECHANIZMY REAKCJI CHEMICZNYCH. REAKCJE CHARAKTERYSTYCZNE GRUP FUNKCYJNYCH ZWIĄZKÓW ORGANICZNYCH Obowiązujące zagadnienia: Związki organiczne klasyfikacja, grupy funkcyjne, reakcje
Ćwiczenie 2 semestr 2 MECHANIZMY REAKCJI CHEMICZNYCH. REAKCJE CHARAKTERYSTYCZNE GRUP FUNKCYJNYCH ZWIĄZKÓW ORGANICZNYCH Obowiązujące zagadnienia: Związki organiczne klasyfikacja, grupy funkcyjne, reakcje
WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 STOPIEŃ WOJEWÓDZKI 9 MARCA 2018 R.
 Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
Kod ucznia Liczba punktów WOJEWÓDZKI KONKURS CHEMICZNY DLA UCZNIÓW GIMNAZJUM W ROKU SZKOLNYM 2017/2018 9 MARCA 2018 R. 1. Test konkursowy zawiera 12 zadań. Na ich rozwiązanie masz 90 minut. Sprawdź, czy
STRUKTURA A WŁAŚCIWOŚCI CHEMICZNE I FIZYCZNE PIERWIASTKÓW I ZWIĄZKÓW CHEMICZNYCH
 11 STRUKTURA A WŁAŚCIWOŚCI CHEMICZNE I FIZYCZNE PIERWIASTKÓW I ZWIĄZKÓW CHEMICZNYCH CEL ĆWICZENIA Zapoznanie z właściwościami chemicznymi i fizycznymi substancji chemicznych w zależności od ich formy krystalicznej
11 STRUKTURA A WŁAŚCIWOŚCI CHEMICZNE I FIZYCZNE PIERWIASTKÓW I ZWIĄZKÓW CHEMICZNYCH CEL ĆWICZENIA Zapoznanie z właściwościami chemicznymi i fizycznymi substancji chemicznych w zależności od ich formy krystalicznej
Beata Mendak fakultety z chemii II tura PYTANIA Z KLASY PIERWSZEJ
 Beata Mendak fakultety z chemii II tura Test rozwiązywany na zajęciach wymaga powtórzenia stężenia procentowego i rozpuszczalności. Podaję również pytania do naszej zaplanowanej wcześniej MEGA POWTÓRKI
Beata Mendak fakultety z chemii II tura Test rozwiązywany na zajęciach wymaga powtórzenia stężenia procentowego i rozpuszczalności. Podaję również pytania do naszej zaplanowanej wcześniej MEGA POWTÓRKI
Ćwiczenie 4. Identyfikacja wybranych cukrów w oparciu o niektóre reakcje charakterystyczne
 Klasyczna Analiza Jakościowa Organiczna, Ćw. 4 - Identyfikacja wybranych cukrów Ćwiczenie 4 Identyfikacja wybranych cukrów w oparciu o niektóre reakcje charakterystyczne Zagadnienia teoretyczne: 1. Budowa
Klasyczna Analiza Jakościowa Organiczna, Ćw. 4 - Identyfikacja wybranych cukrów Ćwiczenie 4 Identyfikacja wybranych cukrów w oparciu o niektóre reakcje charakterystyczne Zagadnienia teoretyczne: 1. Budowa
AMINY. nikotyna. tytoń szlachetny. pseudoefedryna (SUDAFED) atropina. muskaryna H 3 C CH 3 O
 AMINY nikotyna H 3 C NH tytoń szlachetny OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN 2 NUKLEOFILOWOŚĆ i ZASADOWOŚĆ AMIN 3 REAKCJA AMIN Z KWASAMI MINERALNYMI I KARBOKSYLOWYMI
AMINY nikotyna H 3 C NH tytoń szlachetny OH CH 3 O OH pseudoefedryna (SUDAFED) O N atropina muskaryna 1 KLASYFIKACJA AMIN 2 NUKLEOFILOWOŚĆ i ZASADOWOŚĆ AMIN 3 REAKCJA AMIN Z KWASAMI MINERALNYMI I KARBOKSYLOWYMI
Ćwiczenie 6 Aminokwasy
 Ćwiczenie 6 Aminokwasy Aminokwasy są to związki dwufunkcyjne, których cząsteczki zawierają grupy karboksylowe i aminowe: grupa aminowa:nh 2 grupa karboksylowa COOH Nomenklatura aminokwasów: Naturalne aminokwasy
Ćwiczenie 6 Aminokwasy Aminokwasy są to związki dwufunkcyjne, których cząsteczki zawierają grupy karboksylowe i aminowe: grupa aminowa:nh 2 grupa karboksylowa COOH Nomenklatura aminokwasów: Naturalne aminokwasy
Piotr Chojnacki 1. Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą reakcji charakterystycznych.
 SPRAWOZDANIE: REAKCJE CHARAKTERYSTYCZNE WYBRANYCH ANIONÓW. Imię Nazwisko Klasa Data Uwagi prowadzącego 1.Wykrywanie obecności jonu chlorkowego Cl - : Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą
SPRAWOZDANIE: REAKCJE CHARAKTERYSTYCZNE WYBRANYCH ANIONÓW. Imię Nazwisko Klasa Data Uwagi prowadzącego 1.Wykrywanie obecności jonu chlorkowego Cl - : Cel: Celem ćwiczenia jest wykrycie jonu Cl -- za pomocą
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe)
 Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Konkurs przedmiotowy z chemii dla uczniów gimnazjów 13 stycznia 2017 r. zawody II stopnia (rejonowe) Kod ucznia Suma punktów Witamy Cię na drugim etapie konkursu chemicznego. Podczas konkursu możesz korzystać
Br Br. Br Br OH 2 OH NH NH 2 2. Zakład Chemii Organicznej: kopiowanie zabronione
 Kolokwium III Autorzy: A. Berlicka, M. Cebrat, E. Dudziak, A. Kluczyk, Imię i nazwisko Kierunek studiów azwisko prowadzącego Data Wersja A czas: 45 minut Skala ocen: ndst 0 20, dst 20.5 24, dst 24.5 28,
Kolokwium III Autorzy: A. Berlicka, M. Cebrat, E. Dudziak, A. Kluczyk, Imię i nazwisko Kierunek studiów azwisko prowadzącego Data Wersja A czas: 45 minut Skala ocen: ndst 0 20, dst 20.5 24, dst 24.5 28,
HYDROLIZA SOLI. Przykładem jest octan sodu, dla którego reakcja hydrolizy przebiega następująco:
 HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
HYDROLIZA SOLI Hydroliza to reakcja chemiczna zachodząca między jonami słabo zdysocjowanej wody i jonami dobrze zdysocjowanej soli słabego kwasu lub słabej zasady. Reakcji hydrolizy mogą ulegać następujące
Wodorotlenki. n to liczba grup wodorotlenowych w cząsteczce wodorotlenku (równa wartościowości M)
 Wodorotlenki Definicja - Wodorotlenkami nazywamy związki chemiczne, zbudowane z kationu metalu (zazwyczaj) (M) i anionu wodorotlenowego (OH - ) Ogólny wzór wodorotlenków: M(OH) n M oznacza symbol metalu.
Wodorotlenki Definicja - Wodorotlenkami nazywamy związki chemiczne, zbudowane z kationu metalu (zazwyczaj) (M) i anionu wodorotlenowego (OH - ) Ogólny wzór wodorotlenków: M(OH) n M oznacza symbol metalu.
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW
 WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
WPŁYW SUBSTANCJI TOWARZYSZĄCYCH NA ROZPUSZCZALNOŚĆ OSADÓW Wstęp Mianem rozpuszczalności określamy maksymalną ilość danej substancji (w gramach lub molach), jaką w danej temperaturze można rozpuścić w określonej
Aminy. - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin
 Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Aminy - Budowa i klasyfikacja amin - Nazewnictwo i izomeria amin - Otrzymywanie amin - Właściwości amin Budowa i klasyfikacja amin Aminy pochodne amoniaku (NH 3 ), w cząsteczce którego jeden lub kilka
Wymagania programowe na poszczególne oceny chemia kl. II Gimnazjum Rok szkolny 2015/2016 Wewnętrzna budowa materii
 Wymagania programowe na poszczególne oceny chemia kl. II Gimnazjum Rok szkolny 2015/2016 Wewnętrzna budowa materii Dopuszczający (K) Dostateczny(P) Dobry(R) Bardzo dobry (D) Celujący (W) Uczeń : - wie,
Wymagania programowe na poszczególne oceny chemia kl. II Gimnazjum Rok szkolny 2015/2016 Wewnętrzna budowa materii Dopuszczający (K) Dostateczny(P) Dobry(R) Bardzo dobry (D) Celujący (W) Uczeń : - wie,
CHEMIA 10. Oznaczenia: R - podstawnik węglowodorowy, zwykle alifatyczny (łańcuchowy) X, X 2 - atom lub cząsteczka fluorowca
 INSTYTUT MEDICUS Kurs przygotowawczy na studia medyczne kierunek lekarski, stomatologia, farmacja, analityka medyczna tel. 0501 38 39 55 www.medicus.edu.pl CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE.
INSTYTUT MEDICUS Kurs przygotowawczy na studia medyczne kierunek lekarski, stomatologia, farmacja, analityka medyczna tel. 0501 38 39 55 www.medicus.edu.pl CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE.
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II
 TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA. POLIMERYZACJA.
 INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA.
INSTYTUT MEDICUS Kurs przygotowawczy do matury i rekrutacji na studia medyczne Rok 2017/2018 www.medicus.edu.pl tel. 501 38 39 55 CHEMIA 10 WĘGLOWODORY I ICH FLUOROWCOPOCHODNE. ALKOHOLE I FENOLE. IZOMERIA.
Analiza Organiczna. Jan Kowalski grupa B dwójka 7(A) Własności fizykochemiczne badanego związku. Zmierzona temperatura topnienia (1)
 Przykład sprawozdania z analizy w nawiasach (czerwonym kolorem) podano numery odnośników zawierających uwagi dotyczące kolejnych podpunktów sprawozdania Jan Kowalski grupa B dwójka 7(A) analiza Wynik przeprowadzonej
Przykład sprawozdania z analizy w nawiasach (czerwonym kolorem) podano numery odnośników zawierających uwagi dotyczące kolejnych podpunktów sprawozdania Jan Kowalski grupa B dwójka 7(A) analiza Wynik przeprowadzonej
XXII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY 2014/2015
 IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 23 maja 2015 Im. Jana Kasprowicza INOWROCŁAW XXII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 23 maja 2015 Im. Jana Kasprowicza INOWROCŁAW XXII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
Odpowiedź:. Oblicz stężenie procentowe tlenu w wodzie deszczowej, wiedząc, że 1 dm 3 tej wody zawiera 0,055g tlenu. (d wody = 1 g/cm 3 )
 PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
PRZYKŁADOWE ZADANIA Z DZIAŁÓW 9 14 (stężenia molowe, procentowe, przeliczanie stężeń, rozcieńczanie i zatężanie roztworów, zastosowanie stężeń do obliczeń w oparciu o reakcje chemiczne, rozpuszczalność)
Metodyka postępowania
 - 1 - Metodyka postępowania Opracowanie metodyki postępowania i określenie niezbędnych metod analitycznych przy ustalaniu składu wybranych substancji odpadowych, w tym nie opisanych odczynników chemicznych
- 1 - Metodyka postępowania Opracowanie metodyki postępowania i określenie niezbędnych metod analitycznych przy ustalaniu składu wybranych substancji odpadowych, w tym nie opisanych odczynników chemicznych
Kuratorium Oświaty w Lublinie
 Kuratorium Oświaty w Lublinie KOD UCZNIA ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 ETAP WOJEWÓDZKI Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
Kuratorium Oświaty w Lublinie KOD UCZNIA ZESTAW ZADAŃ KONKURSOWYCH Z CHEMII DLA UCZNIÓW GIMNAZJÓW ROK SZKOLNY 2015/2016 ETAP WOJEWÓDZKI Instrukcja dla ucznia 1. Zestaw konkursowy zawiera 12 zadań. 2. Przed
Substancje powierzchniowo czynne 24.10.2013
 Substancje powierzchniowo czynne 24.10.2013 Budowa spc (surfaktant, tensyd) - są to cząsteczki amfifilowe ogon część hydrofobowa zwykle długi łańcuch alifatyczny (węglowodorowy) głowa część hydrofilowa
Substancje powierzchniowo czynne 24.10.2013 Budowa spc (surfaktant, tensyd) - są to cząsteczki amfifilowe ogon część hydrofobowa zwykle długi łańcuch alifatyczny (węglowodorowy) głowa część hydrofilowa
WYMAGANIA NA POSZCZEGÓLNE OCENY Z CHEMII DLA KLASY II. mgr Marta Warecka Lenart
 WYMAGANIA NA POSZCZEGÓLNE OCENY Z CHEMII DLA KLASY II mgr Marta Warecka Lenart (program nauczania chemii Chemia Nowej Ery autorstwa T.Kulawik i M.Litwin) Ocenę dopuszczający otrzymuje uczeń, który w 75%
WYMAGANIA NA POSZCZEGÓLNE OCENY Z CHEMII DLA KLASY II mgr Marta Warecka Lenart (program nauczania chemii Chemia Nowej Ery autorstwa T.Kulawik i M.Litwin) Ocenę dopuszczający otrzymuje uczeń, który w 75%
Stałe siłowe. Spektroskopia w podczerwieni. Spektrofotometria w podczerwieni otrzymywanie widm
 Spektroskopia w podczerwieni Spektrofotometria w podczerwieni otrzymywanie widm absorpcyjnych substancji o różnych stanach skupienia. Powiązanie widm ze strukturą pozwala na identyfikację związku. Widmo
Spektroskopia w podczerwieni Spektrofotometria w podczerwieni otrzymywanie widm absorpcyjnych substancji o różnych stanach skupienia. Powiązanie widm ze strukturą pozwala na identyfikację związku. Widmo
OCENIANIE ARKUSZA POZIOM PODSTAWOWY
 Próbny egzamin maturalny z chemii OCENIANIE ARKUSZA POZIOM PODSTAWOWY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Odpowiedzi niezgodne
Próbny egzamin maturalny z chemii OCENIANIE ARKUSZA POZIOM PODSTAWOWY Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające poleceniom zawartym w zadaniach. Odpowiedzi niezgodne
CHEMII POZIOM ROZSZERZONY
 CHEMII PZIM RZSZERZNY zadanianumer Kryteria oceniania czekiwana odpowiedź Za narysowanie klatkowego modelu konfiguracji elektronów walencyjnych: (4s ) (4p 3 ) Uwagi Zwroty strzałek na podpowłoce 4p mogą
CHEMII PZIM RZSZERZNY zadanianumer Kryteria oceniania czekiwana odpowiedź Za narysowanie klatkowego modelu konfiguracji elektronów walencyjnych: (4s ) (4p 3 ) Uwagi Zwroty strzałek na podpowłoce 4p mogą
fenol ninhydryna difenyloamina kwas octowy Określ ph amin: n-butyloamina dietyloamina difenyloamina anilina N,N-dimetyloanilina
 REAKCJE PROBÓWKOWE 5. Aminy, aminokwasy, białka imię i nazwisko data nr str. Rubryki oznaczone po prawej stronie ciemnym prostokątem należy wypełniać przed zajęciami. W reakcjach obowiązują wzory strukturalne
REAKCJE PROBÓWKOWE 5. Aminy, aminokwasy, białka imię i nazwisko data nr str. Rubryki oznaczone po prawej stronie ciemnym prostokątem należy wypełniać przed zajęciami. W reakcjach obowiązują wzory strukturalne
Podział związków organicznych
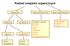 Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Podział związków organicznych węglowodory związki jednofunkcyjne związki wielofunkcyjne alifatyczne nasycone aromatyczne nienasycone halogenki alkilowe alkohole fenole etery aldehydy ketony aminy kwasy
Chemia Nowej Ery Wymagania programowe na poszczególne oceny dla klasy II
 Chemia Nowej Ery Wymagania programowe na poszczególne oceny dla klasy II Szczegółowe kryteria oceniania po pierwszym półroczu klasy II: III. Woda i roztwory wodne charakteryzuje rodzaje wód występujących
Chemia Nowej Ery Wymagania programowe na poszczególne oceny dla klasy II Szczegółowe kryteria oceniania po pierwszym półroczu klasy II: III. Woda i roztwory wodne charakteryzuje rodzaje wód występujących
relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
 1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM. Chemia Poziom rozszerzony
 KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM Chemia Poziom rozszerzony Listopad 2014 W niniejszym schemacie oceniania zadań otwartych są prezentowane przykładowe poprawne odpowiedzi. W tego typu
KRYTERIA OCENIANIA ODPOWIEDZI Próbna Matura z OPERONEM Chemia Poziom rozszerzony Listopad 2014 W niniejszym schemacie oceniania zadań otwartych są prezentowane przykładowe poprawne odpowiedzi. W tego typu
Politechnika Krakowska im. Tadeusza Kościuszki. Karta przedmiotu. obowiązuje studentów rozpoczynających studia w roku akademickim 2013/2014
 Politechnika Krakowska im. Tadeusza Kościuszki Karta przedmiotu obowiązuje studentów rozpoczynających studia w roku akademickim 2013/2014 Wydział Inżynierii i Technologii Chemicznej Kierunek studiów: Inżynieria
Politechnika Krakowska im. Tadeusza Kościuszki Karta przedmiotu obowiązuje studentów rozpoczynających studia w roku akademickim 2013/2014 Wydział Inżynierii i Technologii Chemicznej Kierunek studiów: Inżynieria
PRZYKŁADOWE ZADANIA KWASY
 PRZYKŁADOWE ZADANIA KWASY Zadanie 1014 (3 pkt) Pr.XII/2004 A2 Określ typ podanych niżej reakcji: I. C 17 H 33 COOH + Br 2 C 17 H 33 Br 2 COOH Al 2O 3, temp II. C 2 H 5 OH C 2 H 4 + H 2 O hγ III. CH 4 +
PRZYKŁADOWE ZADANIA KWASY Zadanie 1014 (3 pkt) Pr.XII/2004 A2 Określ typ podanych niżej reakcji: I. C 17 H 33 COOH + Br 2 C 17 H 33 Br 2 COOH Al 2O 3, temp II. C 2 H 5 OH C 2 H 4 + H 2 O hγ III. CH 4 +
Wymagania edukacyjne na poszczególne oceny z chemii dla klasy II gimnazjum oparte na programie nauczania Chemia Nowa Era
 Wymagania edukacyjne na poszczególne oceny z chemii dla klasy II gimnazjum oparte na programie nauczania Chemia Nowa Era IV. Kwasy Opracowała mgr Agnieszka Para Ocena dopuszczająca [1] wymienia zasady
Wymagania edukacyjne na poszczególne oceny z chemii dla klasy II gimnazjum oparte na programie nauczania Chemia Nowa Era IV. Kwasy Opracowała mgr Agnieszka Para Ocena dopuszczająca [1] wymienia zasady
Instrukcja dla uczestnika
 II edycja Konkursu Chemicznego Chemik dla uczniów szkół gimnazjalnych rok szkolny 2016/2017 Instrukcja dla uczestnika I etap Konkursu (etap szkolny) 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś
II edycja Konkursu Chemicznego Chemik dla uczniów szkół gimnazjalnych rok szkolny 2016/2017 Instrukcja dla uczestnika I etap Konkursu (etap szkolny) 1. Sprawdź, czy arkusz konkursowy, który otrzymałeś
XXIII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY 2015/2016
 IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 21 maja 2016 Im. Jana Kasprowicza INOWROCŁAW XXIII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
IMIĘ I NAZWISKO PUNKTACJA SZKOŁA KLASA NAZWISKO NAUCZYCIELA CHEMII I LICEUM OGÓLNOKSZTAŁCĄCE Inowrocław 21 maja 2016 Im. Jana Kasprowicza INOWROCŁAW XXIII KONKURS CHEMICZNY DLA GIMNAZJALISTÓW ROK SZKOLNY
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015
 Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
Wojewódzki Konkurs Przedmiotowy z Chemii dla uczniów gimnazjów województwa śląskiego w roku szkolnym 2014/2015 PRZYKŁADOWE ROZWIĄZANIA WRAZ Z PUNKTACJĄ Maksymalna liczba punktów możliwa do uzyskania po
CHEMIA. Treści nauczania- wymagania szczegółowe. Substancje i ich właściwości. Uczeń: Wewnętrzna budowa materii. Uczeń:
 CHEMIA Treści nauczania- wymagania szczegółowe Substancje i ich właściwości. Uczeń: Podaje przykłady zastosować chemii w życiu codziennym Nazywa wybrane szkło i sprzęt laboratoryjny oraz określa jego przeznaczenie
CHEMIA Treści nauczania- wymagania szczegółowe Substancje i ich właściwości. Uczeń: Podaje przykłady zastosować chemii w życiu codziennym Nazywa wybrane szkło i sprzęt laboratoryjny oraz określa jego przeznaczenie
KWASY I WODOROTLENKI. 1. Poprawne nazwy kwasów H 2 S, H 2 SO 4, HNO 3, to:
 KWASY I WODOROTLENKI 1. Poprawne nazwy kwasów H 2 S, H 2 SO 4, HNO 3, to: 1. kwas siarkowy (IV), kwas siarkowy (VI), kwas azotowy, 2. kwas siarkowy (VI), kwas siarkowy (IV), kwas azotowy (V), 3. kwas siarkowodorowy,
KWASY I WODOROTLENKI 1. Poprawne nazwy kwasów H 2 S, H 2 SO 4, HNO 3, to: 1. kwas siarkowy (IV), kwas siarkowy (VI), kwas azotowy, 2. kwas siarkowy (VI), kwas siarkowy (IV), kwas azotowy (V), 3. kwas siarkowodorowy,
11. Reakcje alkoholi, eterów, epoksydów, amin i tioli
 11. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas 1 11.1. Reakcja
11. Reakcje alkoholi, eterów, epoksydów, amin i tioli gr. odchodząca wymaga aktywacji gr. najłatwiej odchodząca gr. najtrudniej odchodząca najmocniejszy kwas X = Cl, Br, I najsłabszy kwas 1 11.1. Reakcja
Protokół: Reakcje charakterystyczne cukrowców
 Protokół: Reakcje charakterystyczne cukrowców 1. Rekcja na obecność cukrów: próba Molischa z -naftolem Jest to najbardziej ogólna reakcja na cukrowce, tak wolne jak i związane. Ujemny jej wynik wyklucza
Protokół: Reakcje charakterystyczne cukrowców 1. Rekcja na obecność cukrów: próba Molischa z -naftolem Jest to najbardziej ogólna reakcja na cukrowce, tak wolne jak i związane. Ujemny jej wynik wyklucza
Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7
 Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7 W tabeli zostały wyróżnione y z doświadczeń zalecanych do realizacji w szkole podstawowej. Temat w podręczniku Tytuł Typ
Lista materiałów dydaktycznych dostępnych w Multitece Chemia Nowej Ery dla klasy 7 W tabeli zostały wyróżnione y z doświadczeń zalecanych do realizacji w szkole podstawowej. Temat w podręczniku Tytuł Typ
