Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń
|
|
|
- Lidia Kaźmierczak
- 6 lat temu
- Przeglądów:
Transkrypt
1 25 January 2018 EMA/PRAC/35597/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach 8-11 stycznia 2018 r. Informacje o produkcie leczniczym, zawarte w niniejszym dokumencie, pochodzą z dokumentu zatytułowanego Zalecenia PRAC dotyczące zgłoszeń, zawierającego pełną treść zaleceń PRAC dotyczących aktualizacji druków informacyjnych produktu leczniczego, a także pewne ogólne wskazówki odnoszące się do zgłoszeń. Dokument jest dostępny tutaj (wyłącznie w angielskiej wersji językowej). Nowy tekst, który ma być dodany w drukach informacyjnych produktu, jest podkreślony. Bieżący tekst, który ma być usunięty, jest przekreślony. 1. Dulaglutyd zwężenie i niedrożność przewodu pokarmowego (EPITT nr 18931) Zaburzenia żołądka i jelit Częstość nieznana : niemechaniczna niedrożność jelit Częstość nieznana Niedrożność jelit ciężka postać zaparcia z takimi dodatkowymi objawami, jak ból brzucha, wzdęcia lub wymioty 30 Churchill Place Canary Wharf London E14 5EU United Kingdom Telephone +44 (0) Facsimile +44 (0) An agency of the European Union European Medicines Agency, Reproduction is authorised provided the source is acknowledged.
2 2. Metotreksat krwawienie pęcherzykowe (EPITT nr 18850) 2.1. Dotyczy produktów leczniczych zawierających metotreksat, dopuszczonych do obrotu we wskazaniach nieonkologicznych Ocena układu oddechowego Należy zapytać pacjenta o możliwe zaburzenia czynności płuc i, w razie konieczności, wykonać badania czynności płuc. Może wystąpić ostre lub przewlekłe śródmiąższowe zapalenie płuc, często przebiegające z eozynofilią; również notowano przypadki śmiertelne. Typowe objawy obejmują duszność, kaszel (szczególnie suchy kaszel bez wydzieliny), ból w klatce piersiowej oraz gorączkę co należy kontrolować u pacjenta podczas każdej wizyty. Należy poinformować pacjenta o ryzyku zapalenia płuc i zalecić niezwłoczny kontakt z lekarzem, jeśli wystąpi przewlekły kaszel lub duszność. związane z zapaleniem naczyń krwionośnych oraz innymi współistniejącymi chorobami. Jeśli podejrzewa się krwawienie pęcherzykowe, należy rozważyć niezwłoczne przeprowadzenie badań Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Częstość nieznana: krwawienie z nosa, krwawienie pęcherzykowe zasadniczą chorobą reumatologiczną. Jeśli u pacjenta wystąpi krwioplucie, czyli odkrztuszanie wydzieliny z krwią, należy niezwłocznie zwrócić się do lekarza. Ciężkie działania niepożądane Należy natychmiast skontaktować się z lekarzem, jeśli wystąpią wymienione poniżej działania niepożądane: zapalenie płuc (objawem może być ogólne złe samopoczucie, suchy, drażniący kaszel, skrócenie oddechu, duszność podczas spoczynku, ból w klatce piersiowej lub gorączka) krwioplucie, czyli odkrztuszanie wydzieliny z krwią Zgłaszano również następujące działania niepożądane: EMA/PRAC/35597/2018 Strona 2/5
3 Częstość nieznana (częstość nie może być określona na podstawie dostępnych danych): krwawienie z płuc 2.2. Dotyczy produktów leczniczych zawierających metotreksat, dopuszczonych do obrotu we wskazaniach onkologicznych Układ oddechowy Może wystąpić ostre lub przewlekłe śródmiąższowe zapalenie płuc, często przebiegające z eozynofilią; również notowano przypadki śmiertelne. Typowe objawy obejmują duszność, kaszel (szczególnie suchy kaszel bez wydzieliny), ból w klatce piersiowej oraz gorączkę co należy kontrolować u pacjenta podczas każdej wizyty. Należy poinformować pacjenta o ryzyku zapalenia płuc i zalecić niezwłoczny kontakt z lekarzem, jeśli wystąpi przewlekły kaszel lub duszność. związane z zapaleniem naczyń krwionośnych oraz innymi współistniejącymi chorobami. jeśli podejrzewa się krwawienia pęcherzykowe, należy rozważyć niezwłoczne przeprowadzenie badań zasadniczą chorobą reumatologiczną Dotyczy produktów leczniczych zawierających metotreksat, dopuszczonych do obrotu zarówno we wskazaniach nieonkologicznych, jak i onkologicznych Układ oddechowy Może wystąpić ostre lub przewlekłe śródmiąższowe zapalenie płuc, często przebiegające z eozynofilią; również notowano przypadki śmiertelne. Typowe objawy obejmują duszność, kaszel (szczególnie suchy kaszel bez wydzieliny), ból w klatce piersiowej oraz gorączkę co należy kontrolować u pacjenta podczas każdej wizyty. Należy poinformować pacjenta o ryzyku zapalenia płuc i zalecić niezwłoczny kontakt z lekarzem, jeśli wystąpi przewlekły kaszel lub duszność. związane z zapaleniem naczyń krwionośnych oraz innymi współistniejącymi chorobami. Jeśli EMA/PRAC/35597/2018 Strona 3/5
4 podejrzewa się krwawienie pęcherzykowe, należy rozważyć niezwłoczne przeprowadzenie badań Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Częstość nieznana: krwawienie z nosa, krwawienie pęcherzykowe* * (notowane podczas stosowania metotreksatu w leczeniu chorób reumatologicznych i w powiązanych wskazaniach) zasadniczą chorobą reumatologiczną. Jeśli u pacjenta wystąpi krwioplucie, czyli odkrztuszanie wydzieliny z krwią, należy niezwłocznie zwrócić się do lekarza. Ciężkie działania niepożądane Należy natychmiast skontaktować się z lekarzem, jeśli wystąpią wymienione poniżej działania niepożądane: zapalenie płuc (objawem może być ogólne złe samopoczucie, suchy, drażniący kaszel, skrócenie oddechu, duszność podczas spoczynku, ból w klatce piersiowej lub gorączka) krwioplucie, czyli odkrztuszanie wydzieliny z krwią* *(zgłaszane podczas stosowania metotreksatu u pacjentów z zasadniczą chorobą reumatologiczną) Zgłaszano również następujące działania niepożądane: Częstość nieznana (częstość nie może być określona na podstawie dostępnych danych): krwawienie z płuc* *(notowane podczas stosowania metotreksatu u pacjentów z zasadniczą chorobą reumatologiczną). EMA/PRAC/35597/2018 Strona 4/5
5 3. Pemetreksed nefrogenna moczówka prosta (EPITT nr 18930) Po podaniu pemetreksedu w monoterapii lub w skojarzeniu z innymi lekami chemioterapeutycznymi notowano wystąpienie ciężkich zaburzeń czynności nerek, w tym ostrej niewydolności nerek. U większości pacjentów, u których pojawiły się te zaburzenia, stwierdzono czynniki ryzyka zaburzeń czynności nerek, w tym odwodnienie, wcześniej występujące nadciśnienie lub cukrzycę. Po wprowadzeniu do obrotu, podczas stosowania pemetreksedu w monoterapii lub w skojarzeniu z innymi lekami chemioterapeutycznymi, notowano również występowanie nefrogennej moczówki prostej i martwicy cewek nerkowych. Większość z tych zaburzeń ustępowała po odstawieniu pemetreksedu. Należy regularnie kontrolować, czy u pacjenta nie występują: ostra martwica cewek nerkowych, zaburzenia czynności nerek oraz przedmiotowe i podmiotowe objawy nefrogennej moczówki prostej (np. hipernatremia). Po zastosowaniu pemetreksedu w monoterapii lub w skojarzeniu z innymi lekami chemioterapeutycznymi niezbyt często notowano przypadki ostrej niewydolności nerek (patrz punkt 4.4). Po wprowadzeniu do obrotu notowano również przypadki nefrogennej moczówki prostej i martwicy cewek nerkowych o nieznanej częstości występowania. Częstość nieznana: nie może być określona na podstawie dostępnych danych Zwiększone wydalanie moczu Odczuwanie pragnienia i zwiększone picie wody Hipernatremia zwiększone stężenie sodu we krwi EMA/PRAC/35597/2018 Strona 5/5
Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń
 17 December 2015 EMA/PRAC/835763/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęto w dniach od 30 listopada
17 December 2015 EMA/PRAC/835763/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęto w dniach od 30 listopada
Zalecenia PRAC dotyczące przesłanek do aktualizacji informacji o produkcie
 23 April 2015 EMA/PRAC/273915/2015 Pharmacovigilance Risk Assessment Committee Zalecenia PRAC dotyczące przesłanek do aktualizacji informacji o produkcie Przyjęte na posiedzeniu PRAC w dniach 7 10 kwietnia
23 April 2015 EMA/PRAC/273915/2015 Pharmacovigilance Risk Assessment Committee Zalecenia PRAC dotyczące przesłanek do aktualizacji informacji o produkcie Przyjęte na posiedzeniu PRAC w dniach 7 10 kwietnia
Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń
 25 February 2016 EMA/PRAC/137769/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
25 February 2016 EMA/PRAC/137769/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń
 10 November 2016 EMA/PRAC/730052/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
10 November 2016 EMA/PRAC/730052/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń
 15 September 2016 EMA/PRAC/603539/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
15 September 2016 EMA/PRAC/603539/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie
 brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
brygatynib Informacje dla pacjenta i fachowych pracowników ochrony zdrowia zaangażowanych w opiekę medyczną lub leczenie Imię i nazwisko pacjenta: Dane lekarza (który przepisał lek Alunbrig ): Numer telefonu
Zalecenia PRAC dotyczące przesłanek do aktualizacji informacji o produkcie
 22 stycznia 2015 r. EMA/PRAC/63315/2015 Komitet ds. Oceny Ryzyka w ramach Nadzoru nad Bezpieczeństwem Farmakoterapii Zalecenia PRAC dotyczące przesłanek do aktualizacji informacji o produkcie Przyjęte
22 stycznia 2015 r. EMA/PRAC/63315/2015 Komitet ds. Oceny Ryzyka w ramach Nadzoru nad Bezpieczeństwem Farmakoterapii Zalecenia PRAC dotyczące przesłanek do aktualizacji informacji o produkcie Przyjęte
Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń
 12 October 2017 EMA/PRAC/662548/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
12 October 2017 EMA/PRAC/662548/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
Simponi jest lekiem o działaniu przeciwzapalnym. Preparat stosuje się w leczeniu następujących chorób u osób dorosłych:
 EMA/411054/2015 EMEA/H/C/000992 Streszczenie EPAR dla ogółu społeczeństwa golimumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego produktu.
EMA/411054/2015 EMEA/H/C/000992 Streszczenie EPAR dla ogółu społeczeństwa golimumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego produktu.
Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
EMA/115257/2019 EMEA/H/C/000992 Przegląd wiedzy na temat leku Simponi i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Simponi i w jakim celu się go stosuje Simponi jest
Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń
 4 January 2019 1 EMA/PRAC/854990/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
4 January 2019 1 EMA/PRAC/854990/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
W szpiczaku mnogim, nowotworze pewnego typu białych krwinek zwanych komórkami plazmatycznymi, Revlimid stosuje się:
 EMA/113870/2017 EMEA/H/C/000717 Streszczenie EPAR dla ogółu społeczeństwa lenalidomid Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/113870/2017 EMEA/H/C/000717 Streszczenie EPAR dla ogółu społeczeństwa lenalidomid Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/489091/2018 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest
EMA/489091/2018 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest
Materiały edukacyjne dla pracowników służby zdrowia i pacjentów stosujących lek przeciwcukrzycowy Suliqua
 19 stycznia 2017 r. EMA/747766/2016 Materiały edukacyjne dla pracowników służby zdrowia i pacjentów stosujących lek Środki mające na celu zmniejszenie ryzyka pomylenia dwóch wstrzykiwaczy o różnej mocy
19 stycznia 2017 r. EMA/747766/2016 Materiały edukacyjne dla pracowników służby zdrowia i pacjentów stosujących lek Środki mające na celu zmniejszenie ryzyka pomylenia dwóch wstrzykiwaczy o różnej mocy
Pradaxa jest lekiem zawierającym substancję czynną eteksylan dabigatranu. Lek jest dostępny w postaci kapsułek (75, 110 i 150 mg).
 EMA/47517/2015 EMEA/H/C/000829 Streszczenie EPAR dla ogółu społeczeństwa eteksylan dabigatranu Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego
EMA/47517/2015 EMEA/H/C/000829 Streszczenie EPAR dla ogółu społeczeństwa eteksylan dabigatranu Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego
zaawansowanym rakiem nerkowokomórkowym, rodzajem raka nerki, u pacjentów, którzy byli wcześniej leczeni lekami przeciwnowotworowymi;
 EMA/303208/2017 EMEA/H/C/003985 Streszczenie EPAR dla ogółu społeczeństwa niwolumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
EMA/303208/2017 EMEA/H/C/003985 Streszczenie EPAR dla ogółu społeczeństwa niwolumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń
 5 August 2019 1 EMA/PRAC/408018/2019 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
5 August 2019 1 EMA/PRAC/408018/2019 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń
 1 October 2018 1 EMA/PRAC/621111/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
1 October 2018 1 EMA/PRAC/621111/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nowa treść informacji o produkcie fragmenty zaleceń PRAC dotyczących zgłoszeń Przyjęte na posiedzeniu PRAC w dniach
Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
Aneks II Zmiany w drukach informacyjnych produktów leczniczych zarejestrowanych w procedurze narodowej
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną immunoglobulinę anty-t limfocytarną pochodzenia króliczego stosowaną u ludzi [rabbit anti-human thymocyte] (proszek
Revolade. eltrombopag. Co to jest Revolade? W jakim celu stosuje się produkt Revolade? Streszczenie EPAR dla ogółu społeczeństwa
 EMA/33466/2016 EMEA/H/C/001110 Streszczenie EPAR dla ogółu społeczeństwa eltrombopag Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
EMA/33466/2016 EMEA/H/C/001110 Streszczenie EPAR dla ogółu społeczeństwa eltrombopag Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
czerniak (nowotwór skóry), który rozprzestrzenił się lub którego nie można usunąć chirurgicznie;
 EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Lek Avastin stosuje się u osób dorosłych w leczeniu następujących rodzajów nowotworów w skojarzeniu z innymi lekami przeciwnowotworowymi:
 EMA/175824/2015 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/175824/2015 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
zaawansowany rak nerki lub rak nerki z przerzutami, w skojarzeniu z interferonem alfa-2a;
 EMA/302947/2017 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/302947/2017 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
6.2. Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego DUOKOPT przeznaczone do wiadomości publicznej
 6.2. Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego DUOKOPT przeznaczone do wiadomości publicznej 6.2.1. Podsumowanie korzyści wynikających z leczenia Co to jest T2488? T2488
6.2. Podsumowanie planu zarządzania ryzykiem dotyczącego produktu leczniczego DUOKOPT przeznaczone do wiadomości publicznej 6.2.1. Podsumowanie korzyści wynikających z leczenia Co to jest T2488? T2488
Ograniczenia stosowania leków zawierających domperidon
 1 września 2014 r. EMA/465179/2014 W dniu 23 kwietnia 2014 r. grupa koordynacyjna ds. procedur wzajemnego uznania i zdecentralizowanej produkty stosowane u ludzi (CMDh) zatwierdziła nowe zalecenia o ograniczeniu
1 września 2014 r. EMA/465179/2014 W dniu 23 kwietnia 2014 r. grupa koordynacyjna ds. procedur wzajemnego uznania i zdecentralizowanej produkty stosowane u ludzi (CMDh) zatwierdziła nowe zalecenia o ograniczeniu
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Poradnik dotyczący interpretacji spontanicznych zgłoszeń przypadków podejrzewanych działań niepożądanych leków
 30 styczeń 2017 r. Wydział ds. inspekcji, nadzoru nad bezpieczeństwem stosowania produktów leczniczych u ludzi i komisji EMA/749446/2016 Zmiana nr 1* Poradnik dotyczący interpretacji spontanicznych zgłoszeń
30 styczeń 2017 r. Wydział ds. inspekcji, nadzoru nad bezpieczeństwem stosowania produktów leczniczych u ludzi i komisji EMA/749446/2016 Zmiana nr 1* Poradnik dotyczący interpretacji spontanicznych zgłoszeń
EMA potwierdza zalecenia mające na celu jak największe ograniczenie ryzyka wystąpienia zakażenia mózgu PML w trakcie stosowania leku Tysabri
 25/04/2016 EMA/266665/2016 EMA potwierdza zalecenia mające na celu jak największe ograniczenie ryzyka wystąpienia zakażenia mózgu PML w trakcie stosowania leku Tysabri U pacjentów z grupy zwiększonego
25/04/2016 EMA/266665/2016 EMA potwierdza zalecenia mające na celu jak największe ograniczenie ryzyka wystąpienia zakażenia mózgu PML w trakcie stosowania leku Tysabri U pacjentów z grupy zwiększonego
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA
 ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 42 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 42 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Europejska Agencja Leków potwierdza zmiany w stosowaniu metoklopramidu
 Europejska Agencja Leków potwierdza zmiany w stosowaniu metoklopramidu Zmiany mają przede wszystkim na celu zmniejszenie ryzyka neurologicznych działań niepożądanych Komitet ds. Produktów Leczniczych Stosowanych
Europejska Agencja Leków potwierdza zmiany w stosowaniu metoklopramidu Zmiany mają przede wszystkim na celu zmniejszenie ryzyka neurologicznych działań niepożądanych Komitet ds. Produktów Leczniczych Stosowanych
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ostrym reumatoidalnym zapaleniem stawów (choroba powodująca stan zapalny stawów), gdzie produkt MabThera podaje się dożylnie z metotreksatem;
 EMA/614203/2010 EMEA/H/C/000165 Streszczenie EPAR dla ogółu społeczeństwa rytuksymab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
EMA/614203/2010 EMEA/H/C/000165 Streszczenie EPAR dla ogółu społeczeństwa rytuksymab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
Ulotka dołączona do opakowania: informacja dla użytkownika. TUSSAL EXPECTORANS 30 mg, tabletki Ambroxoli hydrochloridum
 Ulotka dołączona do opakowania: informacja dla użytkownika TUSSAL EXPECTORANS 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Ulotka dołączona do opakowania: informacja dla użytkownika TUSSAL EXPECTORANS 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
SKRÓCONA INFORMACJA O LEKU
 Mucosolvan inhalacje, 15 mg/2 ml, roztwór do nebulizacji; 2 ml roztworu do nebulizacji zawierają 15 mg ambroksolu chlorowodorku (Ambroxoli hydrochloridum). Substancje pomocnicze o znanym działaniu: chlorek
Mucosolvan inhalacje, 15 mg/2 ml, roztwór do nebulizacji; 2 ml roztworu do nebulizacji zawierają 15 mg ambroksolu chlorowodorku (Ambroxoli hydrochloridum). Substancje pomocnicze o znanym działaniu: chlorek
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13- walentna, adsorbowana)
 EMA/90006/2015 EMEA/H/C/001104 Streszczenie EPAR dla ogółu społeczeństwa szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13- walentna, adsorbowana) Niniejszy dokument jest streszczeniem
EMA/90006/2015 EMEA/H/C/001104 Streszczenie EPAR dla ogółu społeczeństwa szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13- walentna, adsorbowana) Niniejszy dokument jest streszczeniem
Ulotka dołączona do opakowania: informacja dla użytkownika. Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
20 września 2013 r. EMA/564255/2013. 7 Westferry Circus Canary Wharf London E14 4HB United Kingdom
 20 września 2013 r. EMA/564255/2013 Zawieszenie pozwolenia na dopuszczenie do obrotu produktu leczniczego Numeta G13%E i wprowadzenie nowych działań służących zminimalizowaniu ryzyka stosowania produktu
20 września 2013 r. EMA/564255/2013 Zawieszenie pozwolenia na dopuszczenie do obrotu produktu leczniczego Numeta G13%E i wprowadzenie nowych działań służących zminimalizowaniu ryzyka stosowania produktu
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Przewodnik użytkownika raportu internetowego
 Ochrona zdrowia pacjentów zawiera informacje dotyczące elementów składowych danych, układu, interpretacji i funkcji w raporcie internetowym. 1. Elementy składowe danych... 2 2. Dodatkowe informacje dotyczące
Ochrona zdrowia pacjentów zawiera informacje dotyczące elementów składowych danych, układu, interpretacji i funkcji w raporcie internetowym. 1. Elementy składowe danych... 2 2. Dodatkowe informacje dotyczące
30 saszetek po 5,0 g Kod kreskowy EAN UCC: Wskazania do stosowania: Zaparcia. Stany, w których wskazane jest ułatwienie wypróżnienia.
 INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH PUDEŁKO TEKTUROWE Nasienie płesznika Psyllii semen Skład saszetki: Nasienie płesznika (Psyllii semen) 5,0 g Zioła, 5,0 g/saszetkę 30 saszetek po 5,0
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH ZEWNĘTRZNYCH PUDEŁKO TEKTUROWE Nasienie płesznika Psyllii semen Skład saszetki: Nasienie płesznika (Psyllii semen) 5,0 g Zioła, 5,0 g/saszetkę 30 saszetek po 5,0
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alverock, 60 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 60 mg alweryny cytrynianu (Alverini citras). Substancje
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Alverock, 60 mg, kapsułki twarde 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każda kapsułka zawiera 60 mg alweryny cytrynianu (Alverini citras). Substancje
zaburzeniem widzenia spowodowanym obrzękiem plamki wywołanym cukrzycą;
 EMA/677928/2015 EMEA/H/C/002392 Streszczenie EPAR dla ogółu społeczeństwa aflibercept Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/677928/2015 EMEA/H/C/002392 Streszczenie EPAR dla ogółu społeczeństwa aflibercept Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Wnioski naukowe Uwzględniając sprawozdanie oceniające PRAC w sprawie okresowych raportów o bezpieczeństwie (PSUR) dotyczących
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwoleń na dopuszczenie do obrotu Wnioski naukowe Uwzględniając sprawozdanie oceniające PRAC w sprawie okresowych raportów o bezpieczeństwie (PSUR) dotyczących
Aneks C. (zmiany do krajowych pozwoleń na dopuszczenie do obrotu produktów leczniczych)
 Aneks C (zmiany do krajowych pozwoleń na dopuszczenie do obrotu produktów leczniczych) 1 Aneks I Wnioski naukowe i podstawy do zmiany warunków pozwolenia na dopuszczenie do obrotu 2 Wnioski naukowe Po
Aneks C (zmiany do krajowych pozwoleń na dopuszczenie do obrotu produktów leczniczych) 1 Aneks I Wnioski naukowe i podstawy do zmiany warunków pozwolenia na dopuszczenie do obrotu 2 Wnioski naukowe Po
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Agomelatyna. Broszura dla pacjenta
 Istotne informacje Nie wyrzucaj! Agomelatyna w leczeniu dużych epizodów depresyjnych u dorosłych Broszura dla pacjenta Informacje dotyczące leku Agomelatyna jest lekiem przeciwdepresyjnym, który pomoże
Istotne informacje Nie wyrzucaj! Agomelatyna w leczeniu dużych epizodów depresyjnych u dorosłych Broszura dla pacjenta Informacje dotyczące leku Agomelatyna jest lekiem przeciwdepresyjnym, który pomoże
Notyfikacja nr EMA/CHMP/188871/2015 z dnia 27.03.2015 zmiana EMEA/H/C/002221/IB/0019/G Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Dacogen 50 mg proszek do sporządzania koncentratu roztworu do infuzji Decytabina Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi
Ulotka dołączona do opakowania: informacja dla użytkownika Dacogen 50 mg proszek do sporządzania koncentratu roztworu do infuzji Decytabina Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi
Przegląd wiedzy na temat leku Eylea i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/481361/2018 EMEA/H/C/002392 Przegląd wiedzy na temat leku Eylea i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Eylea i w jakim celu się go stosuje Eylea jest lekiem
EMA/481361/2018 EMEA/H/C/002392 Przegląd wiedzy na temat leku Eylea i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Eylea i w jakim celu się go stosuje Eylea jest lekiem
GRYPA CO POWINIENEŚ WIEDZIEĆ NA TEN TEMAT? CZY WYKORZYSTAŁŚ WSZYSTKIE DOSTĘPNE ŚRODKI BY USTRZEC SIĘ PRZED GRYPĄ?
 GRYPA CO POWINIENEŚ WIEDZIEĆ NA TEN TEMAT? CZY WYKORZYSTAŁŚ WSZYSTKIE DOSTĘPNE ŚRODKI BY USTRZEC SIĘ PRZED GRYPĄ? ZDOBĄDŹ INFORMACJE! ZASZCZEP SIĘ! ZDOBĄDŹ OCHRONĘ! SZCZEPIONKA PRZECIW GRYPIE CZYM JEST
GRYPA CO POWINIENEŚ WIEDZIEĆ NA TEN TEMAT? CZY WYKORZYSTAŁŚ WSZYSTKIE DOSTĘPNE ŚRODKI BY USTRZEC SIĘ PRZED GRYPĄ? ZDOBĄDŹ INFORMACJE! ZASZCZEP SIĘ! ZDOBĄDŹ OCHRONĘ! SZCZEPIONKA PRZECIW GRYPIE CZYM JEST
Wyniki procedur na mocy art. 20 rozporządzenia (WE) nr 726/2004 oraz art. 31 dyrektywy 2001/83/WE
 28 lutego 2013 r. EMA/136606/2013 wer.1 EMEA/H/A-31/1333 EMEA/H/C/000604/A20/45 EMEA/H/C/000622/A20/60 EMEA/H/C/000674/A20/52 Pytania i odpowiedzi dotyczące ponownej oceny monowalentnych i poliwalentnych
28 lutego 2013 r. EMA/136606/2013 wer.1 EMEA/H/A-31/1333 EMEA/H/C/000604/A20/45 EMEA/H/C/000622/A20/60 EMEA/H/C/000674/A20/52 Pytania i odpowiedzi dotyczące ponownej oceny monowalentnych i poliwalentnych
Zakażenia wywołane przez paciorkowce z grupy A. Informacje dla pacjentów
 Zakażenia wywołane przez paciorkowce z grupy A. Informacje dla pacjentów Health Protection Scotland Co to są zakażenia wywołane przez paciorkowce z grupy A? Paciorkowce z grupy A (ang. Group A Streptococcus,
Zakażenia wywołane przez paciorkowce z grupy A. Informacje dla pacjentów Health Protection Scotland Co to są zakażenia wywołane przez paciorkowce z grupy A? Paciorkowce z grupy A (ang. Group A Streptococcus,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1.NAZWA PRODUKTU LECZNICZEGO Transpulmin S, (10 g + 3 g)/100 g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 100 mg olejku eukaliptusowego (Eucalypti aetheroleum)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1.NAZWA PRODUKTU LECZNICZEGO Transpulmin S, (10 g + 3 g)/100 g, krem 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 g kremu zawiera 100 mg olejku eukaliptusowego (Eucalypti aetheroleum)
KEYTRUDA (pembrolizumab)
 Poradnik dotyczący leku KEYTRUDA (pembrolizumab) Informacja dla Pacjentów Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie.
Poradnik dotyczący leku KEYTRUDA (pembrolizumab) Informacja dla Pacjentów Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Woodward s Gripe Water, płyn doustny, (0,46 mg + 10,5 mg)/ml 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancje czynne zawartość w 5 ml (1 łyżeczka)
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks III. Zmiany odpowiednich punktów Charakterystyki Produktu Leczniczego i ulotek dołączonych do opakowania
 Aneks III Zmiany odpowiednich punktów Charakterystyki Produktu Leczniczego i ulotek dołączonych do opakowania Uwaga: Niniejsza Charakterystyka Produktu Leczniczego i ulotka dołączona do opakowania są wynikiem
Aneks III Zmiany odpowiednich punktów Charakterystyki Produktu Leczniczego i ulotek dołączonych do opakowania Uwaga: Niniejsza Charakterystyka Produktu Leczniczego i ulotka dołączona do opakowania są wynikiem
KEYTRUDA (pembrolizumab)
 Poradnik dotyczący leku KEYTRUDA (pembrolizumab) Informacja dla Pacjentów Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie.
Poradnik dotyczący leku KEYTRUDA (pembrolizumab) Informacja dla Pacjentów Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacji o bezpieczeństwie.
Ulotka dołączona do opakowania: informacja dla użytkownika. Dacogen 50 mg proszek do sporządzania koncentratu roztworu do infuzji decytabina
 Ulotka dołączona do opakowania: informacja dla użytkownika Dacogen 50 mg proszek do sporządzania koncentratu roztworu do infuzji decytabina Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika Dacogen 50 mg proszek do sporządzania koncentratu roztworu do infuzji decytabina Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA. Rimantin, 50 mg, tabletki. Rymantadyny chlorowodorek
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Rimantin, 50 mg, tabletki Rymantadyny chlorowodorek Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta. Należy zachować
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Rimantin, 50 mg, tabletki Rymantadyny chlorowodorek Należy przeczytać uważnie całą ulotkę, ponieważ zawiera ona informacje ważne dla pacjenta. Należy zachować
Aneks I. Wnioski naukowe i podstawy do zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
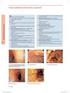 Aneks I Wnioski naukowe i podstawy do zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy do zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę.
 Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę. Aneks III Poprawki do odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
Aktualizacja ChPL i ulotki dla produktów leczniczych zawierających jako substancję czynną hydroksyzynę. Aneks III Poprawki do odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA
 ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 25 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
ANEKS III UZUPEŁNIENIA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ORAZ ULOTKI PLA PACJENTA 25 UZUPEŁNIENIA ZAWARTE W ODPOWIEDNICH PUNKTACH CHARAKTERYSTYKI PRODUKTU LECZNICZEGO DLA PRODUKTÓW ZAWIERAJĄCYCH
ANEKS I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 ANEKS I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ANEKS I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks III. Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta
 Aneks III Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta Uwaga: Charakterystyka Produktu Leczniczego i Ulotka dla pacjenta są wynikiem zakończenia procedury
Aneks III Uzupełnienia odpowiednich punktów Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta Uwaga: Charakterystyka Produktu Leczniczego i Ulotka dla pacjenta są wynikiem zakończenia procedury
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg, tabletki Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
LOPERAMID WZF 2 mg, tabletki Loperamidi hydrochloridum
 Ulotka dołączona do opakowania: informacja dla pacjenta LOPERAMID WZF 2 mg, tabletki Loperamidi hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta LOPERAMID WZF 2 mg, tabletki Loperamidi hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta. Binabic, 50 mg, tabletki powlekane Bicalutamidum
 Ulotka dołączona do opakowania: informacja dla pacjenta Binabic, 50 mg, tabletki powlekane Bicalutamidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Binabic, 50 mg, tabletki powlekane Bicalutamidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg/5 ml, syrop Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Ulotka dołączona do opakowania: informacja dla pacjenta Mucosolvan, 30 mg/5 ml, syrop Ambroxoli hydrochloridum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Ulotka dołączona do opakowania: informacja dla pacjenta
 Ulotka dołączona do opakowania: informacja dla pacjenta Sitagliptin Polpharma, 25 mg, tabletki powlekane Sitagliptin Polpharma, 50 mg, tabletki powlekane Sitagliptin Polpharma, 100 mg, tabletki powlekane
Ulotka dołączona do opakowania: informacja dla pacjenta Sitagliptin Polpharma, 25 mg, tabletki powlekane Sitagliptin Polpharma, 50 mg, tabletki powlekane Sitagliptin Polpharma, 100 mg, tabletki powlekane
Ulotka dołączona do opakowania: informacja dla pacjenta ERDOMED. 35 mg/ml, proszek do sporządzania zawiesiny doustnej. Erdosteinum
 Ulotka dołączona do opakowania: informacja dla pacjenta ERDOMED 35 mg/ml, proszek do sporządzania zawiesiny doustnej Erdosteinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Ulotka dołączona do opakowania: informacja dla pacjenta ERDOMED 35 mg/ml, proszek do sporządzania zawiesiny doustnej Erdosteinum Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
LEGIONELOZA INFORMACJE DLA OSÓB PODRÓŻUJĄCYCH
 1 LEGIONELOZA INFORMACJE DLA OSÓB PODRÓŻUJĄCYCH I. CO TO JEST LEGIONELOZA I LEGIONELOZOWE ZAPALENIE PŁUC, JAK MOŻE SIĘ OBJAWIAĆ? KIEDY DOCHODZI DO ZAKAŻENIA? JAK ZMNIEJSZYĆ RYZYKO ZACHOROWANIA? LEGIONELOZA
1 LEGIONELOZA INFORMACJE DLA OSÓB PODRÓŻUJĄCYCH I. CO TO JEST LEGIONELOZA I LEGIONELOZOWE ZAPALENIE PŁUC, JAK MOŻE SIĘ OBJAWIAĆ? KIEDY DOCHODZI DO ZAKAŻENIA? JAK ZMNIEJSZYĆ RYZYKO ZACHOROWANIA? LEGIONELOZA
Ulotka dołączona do opakowania: informacja dla użytkownika. SALOFALK 250, 250 mg, czopki Mesalazinum
 Ulotka dołączona do opakowania: informacja dla użytkownika SALOFALK 250, 250 mg, czopki Mesalazinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla użytkownika SALOFALK 250, 250 mg, czopki Mesalazinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Symago (agomelatyna)
 Ważne informacje nie wyrzucać! Symago (agomelatyna) w leczeniu dużych epizodów depresyjnych u dorosłych Poradnik dla lekarzy Informacja dla fachowych pracowników ochrony zdrowia Zalecenia dotyczące: -
Ważne informacje nie wyrzucać! Symago (agomelatyna) w leczeniu dużych epizodów depresyjnych u dorosłych Poradnik dla lekarzy Informacja dla fachowych pracowników ochrony zdrowia Zalecenia dotyczące: -
Ulotka dołączona do opakowania: informacja dla pacjenta. Binabic, 150 mg, tabletki powlekane Bicalutamidum
 Ulotka dołączona do opakowania: informacja dla pacjenta Binabic, 150 mg, tabletki powlekane Bicalutamidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
Ulotka dołączona do opakowania: informacja dla pacjenta Binabic, 150 mg, tabletki powlekane Bicalutamidum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA
 ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Irprestan, 75 mg, tabletki powlekane Irprestan, 150 mg, tabletki powlekane Irprestan, 300 mg, tabletki powlekane (Irbesartanum) Należy zapoznać się z treścią
ULOTKA DLA PACJENTA: INFORMACJA DLA UŻYTKOWNIKA Irprestan, 75 mg, tabletki powlekane Irprestan, 150 mg, tabletki powlekane Irprestan, 300 mg, tabletki powlekane (Irbesartanum) Należy zapoznać się z treścią
Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości
 Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości Omówienie rozpowszechnienia choroby Rosnąca oczekiwana długość życia i starzejące się społeczeństwo
Podsumowanie u zarządzania rzyzkiem dla produktu leczniczego Cartexan przeznaczone do publicznej wiadomości Omówienie rozpowszechnienia choroby Rosnąca oczekiwana długość życia i starzejące się społeczeństwo
Przegląd wiedzy na temat leku Metacam i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/CVMP/259397/2006 EMEA/V/C/000033 Przegląd wiedzy na temat leku Metacam i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Metacam i w jakim celu się go stosuje? Metacam
EMA/CVMP/259397/2006 EMEA/V/C/000033 Przegląd wiedzy na temat leku Metacam i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Metacam i w jakim celu się go stosuje? Metacam
ANEKS WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO I SKUTECZNEGO UŻYWANIA PRODUKTÓW LECZNICZYCH DO SPEŁNIENIA PRZEZ PAŃSTWA CZŁONKOWSKIE
 ANEKS WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO I SKUTECZNEGO UŻYWANIA PRODUKTÓW LECZNICZYCH DO SPEŁNIENIA PRZEZ PAŃSTWA CZŁONKOWSKIE 1/5 WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO
ANEKS WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO I SKUTECZNEGO UŻYWANIA PRODUKTÓW LECZNICZYCH DO SPEŁNIENIA PRZEZ PAŃSTWA CZŁONKOWSKIE 1/5 WARUNKI LUB OGRANICZENIA W ODNIESIENIU DO BEZPIECZNEGO
Wywiady z zakresu układu moczowego. Klinika Medycyny Transplantacyjnej, Nefrologii i Chorób Wewnętrznych WUM
 Wywiady z zakresu układu moczowego Klinika Medycyny Transplantacyjnej, Nefrologii i Chorób Wewnętrznych WUM Dyzuria Częstomocz Główne objawy Zmiany wyglądu moczu - krwiomocz - pienienie się moczu Zaburzenia
Wywiady z zakresu układu moczowego Klinika Medycyny Transplantacyjnej, Nefrologii i Chorób Wewnętrznych WUM Dyzuria Częstomocz Główne objawy Zmiany wyglądu moczu - krwiomocz - pienienie się moczu Zaburzenia
Aneks III. Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta
 Uwaga: Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka dla pacjenta jest wynikiem
Uwaga: Aneks III Zmiany w odpowiednich punktach Charakterystyki Produktu Leczniczego i Ulotki dla Pacjenta Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka dla pacjenta jest wynikiem
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
ULOTKA DLA PACJENTA 1
 ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla pacjenta PENTASA, 1 g, czopki Mesalazinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
ULOTKA DLA PACJENTA 1 Ulotka dołączona do opakowania: informacja dla pacjenta PENTASA, 1 g, czopki Mesalazinum Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
ANEKS III POPRAWKA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO I ULOTKI DLA PACJENTA
 ANEKS III POPRAWKA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO I ULOTKI DLA PACJENTA 1 POPRAWKI DO WSTAWIENIA W ODPOWIEDNIE CZĘŚCI CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ZAWIERAJĄCEGO MOKSYFLOKSACYNĘ poprawki
ANEKS III POPRAWKA DO CHARAKTERYSTYKI PRODUKTU LECZNICZEGO I ULOTKI DLA PACJENTA 1 POPRAWKI DO WSTAWIENIA W ODPOWIEDNIE CZĘŚCI CHARAKTERYSTYKI PRODUKTU LECZNICZEGO ZAWIERAJĄCEGO MOKSYFLOKSACYNĘ poprawki
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
