Podstawowe mechanizmy snu i czuwania: udział głównych układów neurotransmiterowych mózgu
|
|
|
- Janina Dobrowolska
- 8 lat temu
- Przeglądów:
Transkrypt
1 PRACA POGLĄDOWA ISSN Sen 2002, Tom 2, Nr 1, SEN Podstawowe mechanizmy snu i czuwania: udział głównych układów neurotransmiterowych mózgu Basic mechanisms of sleep and waking: role of the main neurotransmitter systems of the brain Edyta Jurkowlaniec Katedra Fizjologii Zwierząt Uniwersytetu Gdańskiego n Abstract Neurotransmittery regulation of sleep and waking Groups of neurons initiating and maintaining the phases of sleep and wakefulness form a multi-centre system, which activity is a function of influences exerted by its elements. Waking depends on the ascending reticular system, which influences the cortex through the dorsal (via thalamus) and the ventral (via hypothalamus and basal forebrain) paths. The gigantocellular reticular nuclei of the medulla and pons, raphe nuclei, reticular nucleus of the thalamus, preoptic and anterior hypothalamus and the orbito-frontal cortex are the most important structures for induction of slow wave sleep (SWS). The structures crucial for the generation of paradoxical sleep (PS) and accompanying muscular atonia encompass the caudal part of midbrain and the anterior pons (including the nucleus pontis oralis). Different neurotransmitter and neuromodulatory systems of changeable activity level are involved in the regulation of phases of sleep and wakefulness. Cholinergic transmission is increased during activation the cortex in waking (mainly neurons ACh 4 of the basal forebrain) and in PS (mainly neurons Ach 5 and Ach 6 of the pedunculo-pontine and laterodorsal tegmental nuclei). Monoamine neurons decrease firing in SWS and PS, which triggers the activity of the mesencephalo-pontis and the medullar structures important for PS induction. Regulatory role of GABA consists in synchronizing the activities of various brain structures in sleep and wakefulness. Recently, the role of excitatory neuropeptides (orexins/hypocretins) produced in the lateral hypothalamus in the regulation of wakefulness states, has been stressed. Their deficiency leads to narcolepsy in humans and animals. Key words: slow wave sleep, paradoxical sleep, waking, EEG Adres do korespondencji: Edyta Jurkowlaniec Katedra Fizjologii Zwierząt Uniwersytetu Gdańskiego ul. Kładki 24, Gdańsk tel. (0 58) faks: (0 58) ejk@biotech.univ.gda.pl n Neuroanatomiczne podłoże stanów czuwania i snu Według klasycznych poglądów Moruzziego i Magouna za aktywację kory podczas czuwania (W, waking) odpowiada wstępujący układ siatkowaty pnia mózgu [1]. Grupy komórek w opuszkowej, mostowej i śródmózgowiowej części tworu siatkowatego przez grzbietową drogę przewodzenia impulsów aktywują niespecyficzne jądra wzgórza oraz jądra linii pośrodkowej i śródblaszkowe, a te z kolei korę mózgową [2]. Druga droga aktywacji (brzuszna) prowadzi do podwzgórza (zwłaszcza do jego tylnej części) i podstawnego przodomózgowia, następnie do kory i hipokampa [3]. Dla snu wolnofalowego (SWS, slow wave sleep) najważniejsze struktury mózgo- 21
2 SEN 2002, Tom 2, Nr 1 we to: jądro pasma samotnego w rdzeniu przedłużonym, jądra szwu, siatkowate jądro wzgórza, obszar przedwzrokowy i przednie podwzgórze, podstawne przodomózgowie oraz obszary kory oczodołowo-czołowej [4, 5]. Powstawanie snu paradoksalnego (PS, parodoxical sleep) (PS/REM) wiąże się z aktywnością tylnej części śródmózgowia oraz mostu, a zwłaszcza przedniego jądra mostu [6, 7]. Przecięcie pnia mózgu na poziomie mostu (lub nieco poniżej) nie ogranicza zdolności kory do reakcji desynchronizacyjnych, podczas gdy cięcie wykonane tylko nieco wyżej, w śródmózgowiu, na granicy wzgórków czworaczych górnych i dolnych, wywołuje stan ciągłego snu mimo zachowanych wstępujących dróg czuciowych [8, 9]. Te historyczne doświadczenia przez lata inspirowały badaczy poszukujących struktur/transmiterów wybiórczo odpowiadających za indukcję czuwania i snu. Obecnie wydaje się oczywiste, że cykl sen-czuwanie jest złożonym zjawiskiem i nie ma pojedynczej struktury ani jednego transmitera regulującego fazy aktywności [4, 7, 10]. Niemal każda struktura uczestnicząca w powstawaniu czuwania zawiera również neurony aktywne podczas snu, i odwrotnie, czego dowodzą elektrofizjologiczne badania czynności pojedynczych neuronów. W podstawnym przodomózgowiu, strukturze wiązanej głównie z aktywacją korową [11], znajdują się również neurony aktywne podczas SWS [12], co wskazuje na udział tej okolicy w czuwaniu i śnie [13]. W obrębie okolicy przedwzrokowej i przedniego podwzgórza, istotnych dla indukcji snu [14], znajdują się neurony zwiększające swoje wyładowania nie tylko podczas SWS, ale również takie, które nasilają czynność w czasie czuwania [14, 15]. Tylne podwzgórze, w którym jednym z ważniejszych transmiterów jest kwas glutaminowy [16], zawiera neurony o bezpośrednich, dokorowych projekcjach [17] wykazujących zwiększoną czynność w trakcie aktywacji korowej (czuwania i PS) oraz reakcjach ruchowych [18]; raczej nie ma tam neuronów aktywnych w SWS [19]. W obszarze okołosklepieniowym tylnej części bocznego podwzgórza występują neurony aktywne podczas czuwania i REM (około 53% badanych neuronów) lub tylko podczas czuwania (38%), przy czym wyładowania tych drugich są większe w trakcie reakcji ruchowych; neuronów aktywnych podczas SWS nie opisano [20]. Zwykle zwiększanie lub zahamowanie aktywności dotyczy większych grup neuronów w danej strukturze, wydzielających przynajmniej ten sam główny transmiter, ale na przykład w nakrywce śródmózgowia i mostu przemieszane są cholinergiczne neurony aktywne tylko podczas czuwania, tylko w REM lub w obu tych stanach [21 23]. Różnicowanie aktywności tych neuronów w jądrze konarowomostowym nakrywki zależy od serotonergicznych neuronów jąder szwu, których zwiększona aktywność w trakcie czuwania przypuszczalnie hamuje neurony REM-zależne, zaś spadek wyładowań wyzwala PS z hipokampalnym rytmem theta [23]. Zależnie od swoich projekcji, GABA-ergiczne neurony w podstawnym przodomózgowiu mogą uczestniczyć (wraz z innymi transmiterami) w aktywacji korowej [24], odhamowując piramidowe komórki w korze, działając przez hamujące interneurony korowe [25], lub w SWS, wpływając hamująco na struktury pnia istotne dla czuwania [26]. Stany aktywacji kory mózgowej w obrazie elektroencefalograficznym cechują się obecnością wysokoczęstotliwych rytmów beta i gamma [27, 28], a podczas odbioru bodźców czuciowych także alfa [29]. Występowanie tych rytmów jest skorelowane z pojawianiem się w zapisach czynności elektrycznej hipokampa u zwierząt rytmu theta [30 32]. Ta wysoce zsynchronizowana aktywność stosunkowo łatwo przenosi się na obszary korowe i może być rejestrowana także u ludzi, zwłaszcza w odprowadzeniach z kory czołowej [33, 34], jak również odprowadzeniach centralnych i potylicznych [35]. Aktywację kory mózgowej, występującą podczas czuwania i PS, zastępuje czynność synchroniczna w trakcie snu wolnofalowego. Zapis EEG podczas SWS, zależnie od głębokości fazy, zdominowały fale obejmujące niższe częstotliwości alfa, wrzeciona senne i fale delta [29, 36] oraz niskoczęstotliwe oscylacje (< 1 Hz) [37, 38]. W czasie PS czynność kory mózgowej wykazuje wysoką aktywację (występowanie rytmów beta i gamma, jak w trakcie czuwania) [29] oraz obecność fal PGO (pontogeniculo-occipitalis) [39]. Występuje kompletna atonia mięśniowa, która dotyczy większości mięśni, z wyjątkiem okoruchowych i przepony. Grupy neuronalne inicjujące i podtrzymujące kolejne fazy cyklu snu i czuwania składają się na wieloośrodkowy system, którego funkcja jest wypadkową wpływów poszczególnych jego składowych. Wybiórcze ograniczone lub stopniowe zniszczenie struktur tego systemu tylko przejściowo zaburza poszczególne fazy [40]. Świadczy to nie tylko o regeneracji i plastyczności ośrodków mózgowych, lecz również o kompensacyjnym przejmowaniu funkcji uszkodzonej struktury przez inne składowe złożonego systemu powstawania i utrzymywania stanu czuwania lub snu. Do struktur o istotnym znaczeniu dla stopnia aktywności mózgu zalicza się podwzgórze, ponieważ znajduje się na przebiegu brzusznej drogi aktywacji korowej, a także bierze udział zarówno w mechanizmach snu, jak i czuwania. Zlokalizowane są tu dwa przeciwstawne ośrodki neuronalne: okolica przedwzrokowa/przednie podwzgórze (POAH, preoptic/anterior hypothalamic area), zaangażowane w utrzymaniu synchronizacji korowej, oraz obszar tylnego podwzgórza (PH, posterior hypothalamic area) biorący udział w jej aktywacji. Obie części pozostają w relacji ujemnego sprzężenia zwrotnego i wpływają zarówno na wyżej, jak i niżej leżące okolice mózgu, otrzymując równocześnie zwrotną 22
3 Edyta Jurkowlaniec, Neurotransmiterowa regulacja snu i czuwania SEN impulsację z tych struktur [4, 14, 41]. Z anatomicznego punktu widzenia komunikację między tymi funkcjonalnie różnymi częściami podwzgórza może zapewniać boczne podwzgórze (LH, lateral hypothalamus), które uczestniczy między innymi w reakcjach autonomicznych i hormonalnych, w regulacji reakcji ruchowych i dobowego rytmu aktywności. Boczne podwzgórze stanowi część jednego z głównych systemów integracyjnych mózgu pęczka przyśrodkowego przodomózgowia (MFB, medial forebrain bundle). Zawiera on obukierunkowe włókna łączące ze sobą struktury korowe i podkorowe (głównie limbiczne) przodomózgowia, poszczególne jądra podwzgórza oraz jądra limbiczne nakrywki śródmózgowia, a także liczne projekcje podwzgórza do pnia mózgu [42, 43]. Uszkodzenia bocznego podwzgórza wywołują zespół objawów, z których najważniejsze to afagia, adipsja, somnolencja oraz zaburzenia integracji czuciowo-ruchowej [44 46]. Elektroencefalograficzne objawy zespołu LH obejmują również hiposomnię [47 49] oraz zmiany hipokampalnego rytmu theta [50]. W znacznym stopniu wynikają one z uszkodzenia włókien MFB, reprezentujących większość układów neurotransmiterowych i modulatorowych mózgu. n Regulacja poziomu aktywności kory mózgowej udział głównych neurotransmiterów Acetylocholina (Ach) Stan czuwania powstaje w wyniku aktywacji struktur zlokalizowanych w obrębie całego pnia mózgu, od mostu do przodomózgowia. W znacznej mierze zależy od transmisji cholinergicznej [51, 52], której źródłem są cholinergiczne komórki Ach 1 Ach 6 [53]. Tworzą one dwa główne skupiska w podstawnej części przodomózgowia oraz w tylnym śródmózgowiu/przednim moście. Pierwsze z nich obejmuje neurony grupy Ach 4, rozproszone w obrębie istoty bezimiennej, przednim podwzgórzu i okolicy przedwzrokowej oraz w gałce bladej, torebce wewnętrznej i jądrze śródkonarowym. Wchodzą one w skład tak zwanego jądra podstawnego Meynerta (NB, nucleus basalis) i unerwiają bezpośrednio wszystkie obszary kory mózgowej [53 56] oraz wzgórze [57 59]. Do rozległych obszarów kory i hipokampa swoje aksony wysyłają także neurony cholinergiczne z grupy Ach 1 i Ach 2, które znajdują się w przegrodzie i pęczku przekątnym Broca [60, 61]. Elektryczna stymulacja NB wywołuje aktywację korową oraz wzrost uwalniania Ach w korze [62, 63], natomiast iniekcje skopolaminy lub cytotoksyczne lezje tego obszaru powodują wzrost widma mocy w paśmie delta [64]. Według Buzsakiego cholinergiczne neurony NB mogą aktywować korę bezpośrednio lub pośrednio, tłumiąc generatorowe mechanizmy dla fal delta w jądrze siatkowatym wzgórza. W tylnym śródmózgowiu i przednim moście (jądra nakrywki: boczne grzbietowe i konarowo-mostowe, LDT i PPN) znajdują się grupy neuronów Ach 5 i Ach 6, które są (poprzez tor grzbietowy przepływu impulsów aktywujących) najważniejszym źródłem cholinergicznego unerwienia jąder wzgórza (specyficznych i niespecyficznych) [65]. Prawdopodobnie stamtąd pochodzą projekcje cholinergiczne i glutaminergiczne do obszarów korowych. Część aksonów cholinergicznych komórek śródmózgowia i mostu omija wzgórze i wstępuje do przodomózgowia torem brzusznym przez warstwę niepewną i grzbietową okolicę bocznego podwzgórza [56, 66]. Wykazano, że neurony nakrywkowe (w znacznej części cholinergiczne) podlegają wyładowaniom tonicznym podczas czuwania oraz PS (w trakcie aktywacji korowej), przy czym wyładowania są silniejsze podczas PS [21, 67, 68]. Aminokwasy pobudzające (EAAs, excitatory amino acids) W podstawnym przodomózgowiu (przyśrodkowa przegroda [MS, medial septum], pęczek przekątny Broca [DBB, diagonal band Broca], okolica przedwzrokowa i istota bezimienna) znajdują się liczne neurony o projekcjach do obszarów korowych (m.in. kory śródwęchowej), które syntetyzują nie tylko Ach lub GABA, ale także kwas glutaminowy [69]. Mogą one uczestniczyć w aktywacji korowej. Jak się okazało, stymulacja receptorów NMDA na neuronach podstawnych przodomózgowia powoduje wzrost widma mocy w paśmie gamma i theta oraz zwiększa ekspresję protoonkogenu c-fos w cholinergicznych (choć nie tylko) neuronach tego obszaru [70]. Również w obrębie podwzgórza pobudzająca transmisja w znacznym stopniu zależy od EAA, szczególnie od kwasu glutaminowego [71]. Zewnątrzkomórkowe stężenie tego kwasu w okolicy przedwzrokowej wzrasta w trakcie czuwania i obniża się podczas snu [72]. Stężenie kwasu glutaminowego wzrasta (wraz z Ach) również w PPN, zarówno podczas czuwania, jak i PS [73]. Glutaminergiczna transmisja z tej struktury [74, 75] oraz wielkokomórkowych neuronów tworu siatkowatego nakrywki [76] dociera do podwzgórza i wzgórza. Kwas g-aminomasłowy (GABA) Innym neurotransmiterem regulującym sen i czuwanie jest GABA [77 79]. Około 20 50% neuronów w mózgu ssaków zawiera GABA [80]; występowanie receptorów GABA-ergicznych stwierdzono w korze i prawie wszystkich ośrodkach podkorowych [81, 82]. Dwa główne typy receptorów GABA-ergicznych (GABA A i GABA B ) występują na większości neuronów ośrodkowego układu nerwowego [83]. Aktywacja receptora GABA A przez GABA zwiększa przewodnictwo błony dla anionów (szczególnie jonów chlorkowych), powodując zwykle hiperpolaryzację. Receptory GABA A pełnią istotną rolę 23
4 SEN 2002, Tom 2, Nr 1 w wywoływaniu SWS; ich aktywacja agonistą (muscimolem) zwiększa moc fal delta i ilość PS [77]. Modulatory tych receptorów barbiturany i benzodiazepiny są lekami nasennymi (pierwszej i drugiej generacji), które redukują latencję SWS i zwiększają jego ilość [84]. Receptory GABA B (o wolniejszym, metabotropowym mechanizmie działania) uczestniczą również raczej w indukcji snu. Dootrzewnowe podanie antagonisty receptora GABA B powoduje zmniejszenie ilości SWS i wzrost czuwania, a w dawkach wyższych także wzrost ilości PS [79]. Inhibicja transaminazy GABA hamuje rozkład tego związku, powodując wzrost ilości snu [85]. Opisano 8 podtypów interneuronów GABA-ergicznych znajdujących się w korze mózgowej, którym przypisuje się istotną rolę w mechanizmach organizowania funkcji korowych i plastyczności [86]. Część z nich wykazuje maksymalną aktywność w SWS [4, 87], część w PS [51]. Projekcyjne neurony GABA znalezione w podwzgórzu, podstawnym przodomózgowiu i przegrodzie przodomózgowia, wysyłające aksony do kory i hipokampa [88, 89] albo wzgórza [59], mogą uczestniczyć w odmiennych pętlach aktywacji. GABA-ergiczne neurony podstawnego przodomózgowia unerwiają interneurony hamujące w rozległych obszarach korowych [25], a te z kolei odhamowują piramidowe komórki kory. Z badań prowadzonych w pracowni Jones [24] wynika, że mechanizm ten, łącznie z cholinergicznym pobudzeniem, prowadziłby do aktywacji korowej. Natomiast bezpośrednie projekcje z GABA-ergicznych neuronów podstawnego przodomózgowia i POAH (a także z przednich części LH) do jądra przyśrodkowogrzbietowego wzgórza (MD, mediodorsal nucleus of the thalonus) mogą uczestniczyć w indukcji fal delta podczas SWS [59]. Wzgórzowo-korowe neurony MD odpowiadają za generowanie wrzecion sennych w SWS; ich specyficzną cechą jest aktywacja podczas hiperpolaryzacji (zależna od wolnego napływu sodu) prowadząca do rytmicznych wyładowań w tych neuronach [90]. Wyładowania te wywołują synchroniczne, postsynaptyczne potencjały w neuronach korowych (hamujące i pobudzające, IPSP i EPSP), których zsumowana aktywność składa się na synchronizację korową. Według Steriade [90] hiperpolaryzacja neuronów MD zależy głównie od GABA-ergicznych neuronów jądra siatkowatego wzgórza, co nie wyklucza wpływów pozawzgórzowych. Podczas czuwania oraz PS nie powstają ani wolne fale, ani wrzeciona, co wynika z obecności cholinergicznych (a także z monoaminowych) aktywujących wpływów ze śródmózgowia i grzbietowej części mostu (LDT, PPN), zawierających liczne neurony aktywne w trakcie czuwania i PS. Depolaryzacja GABA-ergicznych neuronów wzgórzowych zapobiega generowaniu fal wolnych i wrzecion [75]. Wówczas aktywność w neuronach wzgórzowo- -korowych ma charakter niskonapięciowy i wysokoczęstotliwy, a więc taki jak podczas aktywacji korowej [91]. W czasie PS spadki aktywności w monoaminowych neuronach miejsca sinawego, jądra guzowo-suteczkowatego oraz jądrach szwu są skorelowane ze wzrostem stężenia GABA w tych strukturach [92 94]. Powyższe przykłady wskazują, że udział hamowania GABA-ergicznego może być istotny zarówno dla indukcji snu (jak ma to miejsce we wzgórzu), jak również aktywacji korowej (w podstawnym przodomózgowiu podczas czuwania i PS), taką rolę pełnią głównie neurony projekcyjne. Interneurony działają natomiast lokalnie w poszczególnych strukturach, co przyczynia się do zwiększenia bądź zmniejszenia aktywności tych struktur. Według Buzsakiego [95] rola interneuronów GABA-ergicznych może polegać na synchronizowaniu czynności całych grup neuronalnych, co wykazano w przypadku hipokampa [96, 97] i kory [98]. Serotonina (5-HT) Wstępujące serotonergiczne projekcje unerwiające struktury śród- i międzymózgowia oraz korę mózgową i hipokamp pochodzą z jąder szwu górnej części pnia mózgu (grupy komórek B5 B9) [99 102]. Dla regulacji SWS i PS ważne są grzbietowe (DR, clorsal raphe) i przyśrodkowe (MR, median raphe) jądro szwu. Źródłem projekcji zstępujących do rdzenia kręgowego i móżdżku ważnych dla regulacji napięcia mięśniowego [103] są jądra szwu w rdzeniu przedłużonym (grupy B1 B4) [99 102]. Około neuronów serotonergicznych w samym DR i MR wydziela mediator nie tylko aksonalnie, ale i z licznych żylakowatości (u szczura pojedynczy neuron o dokorowej projekcji może posiadać żylakowatości na aksonie), a dzięki wszechobecnym receptorom (opisano 14 różnych typów receptorów) 5-HT działa różnokierunkowo [104]. System serotonergiczny działa oscylacyjnie, częstość wyładowań neuronów 5-HT jest skorelowana z cyklem czuwania i snu: wysoka w czuwaniu (5 7 Hz), maleje podczas SWS (3 5 Hz) i zanika w trakcie PS [105]. Częstotliwość wyładowań zależy od autoreceptorów 5-HT 1A, obniża się podczas ich aktywacji (hamującej wydzielanie 5-HT) [106]. Amplituda oscylacji (ilość wydzielonego mediatora) zależy od aktywacji autoreceptorów 5-HT 1B na zasadzie ujemnego sprzężenia zwrotnego [107] i reguluje ją endogenny ligand 5-HT 1 -modulina, której przyłączenie prowadzi do inaktywacji receptora [104]. Prawdopodobnie serotonergiczne neurony grzbietowego jądra szwu ważne dla regulacji REM [108] podczas tej fazy można hamować GABA-ergicznie z interneuronów DR oraz neuronów okołowodociągowej istoty szarej mostu, a podczas SWS z bocznego podwzgórza [109]. Natomiast ich aktywność w trakcie czuwania hamuje neurony wyładowujące podczas PS w PPN [23]. Neurony MR są istotne dla czynności hipokampa; ich aktywność desynchronizuje wyładowania w tej strukturze, natomiast 24
5 Edyta Jurkowlaniec, Neurotransmiterowa regulacja snu i czuwania SEN blokada autoreceptorów 5-HT 1A wyzwala rytm theta w hipokampie i przegrodzie [110, 111]. Domózgowe lub ogólnoukładowe podawanie agonistów i antagonistów serotoniny odpowiednio wzmaga lub osłabia sen [2, ]. Elektryczna stymulacja jąder szwu prowadzi do snu [115], natomiast ich lezje powodują spadek czasu trwania snu [116]. Inhibitor syntezy serotoniny (parachlorofenyloalanina PCPA) stosuje się standardowo w celu eksperymentalnego wywołania insomnii odwracanej podawaniem agonistów serotoniny [117, 118]. Indukcja snu po 5-HT lub jej prekursorach występuje jednak z długą (ok. 40-minutową) latencją [117] i prawdopodobnie zachodzi dzięki obniżaniu poziomu ogólnego wzbudzenia. Jouvet [119], podsumowując wyniki badań własnych oraz innych autorów dotyczące udziału serotoniny w regulacji czuwania i snu, stwierdził, że jej uwalnianie w przednim podwzgórzu podczas czuwania zapoczątkowuje kaskadę procesów prowadzących do wyzwolenia snu. Zgodnie z homeostatyczną koncepcją snu Borbely ego [120] potrzeba snu (tzw. proces S ) narasta w trakcie czuwania i maleje podczas snu, odpowiadając za intensywność snu, którą mierzy się wielkością mocy fal delta. Aktywność przynajmniej części neuronów serotonergicznych prawdopodobnie jest z tym procesem skorelowana [119]. Po deprywacji sennej ilość SWS wzrasta; w tym czasie (podanie PCPA) zaburzenie syntezy 5-HT tłumi SWS, nie wpływając na ilość PS [121]. Porównanie stężenia 5-HT w różnych strukturach mózgu aktywowanych podczas cyklu czuwanie-sen [122] koreluje z aktywnością neuronalną serotonergicznych jąder szwu; jest ono najwyższe podczas czuwania, zmniejszone w SWS i najniższe w trakcie PS. Portas i wsp. [122] wskazują na istotną rolę 5-HT w procesach wzbudzenia i przygotowania do snu. Możliwy jest również współudział serotoniny (z Ach) w aktywacji korowej [2, 123] lub w torowaniu wyjść motorycznych [103]. Noradrenalina (NA) Do innego systemu aktywującego czynność korową należą katecholaminergiczne neurony pnia mózgu zlokalizowane w miejscu sinawym (LC, locus coerules). Noradrenergiczne neurony LC w sposób rozproszony unerwiają korę [100, 124] i prawdopodobnie uczestniczą głównie w procesach aktywacji korowej, choć nie jest to działanie zasadnicze w desynchronizacji EEG [2]. Neurony te wykazują zwiększoną aktywność podczas czuwania, mniejszą w SWS, a cichną podczas PS [125]; wzrost uwalniania GABA w LC [93] mógłby odpowiadać za hamowanie tej struktury w trakcie snu [126]. Po podaniu 6-hydroksydopaminy (obniża o 90% korowe stężenie NA) występuje hipokampalny rytm theta i desynchronizacja korowa [127], co wskazuje, że NA nie jest niezbędna w procesach aktywacji korowej. Noradrenalina i jej antagoniści mogą wpływać na synchronizacyjne ośrodki podwzgórzowe [128]; wykazano jej udział w hamowaniu neuronów okolicy przedwzrokowej, uczestniczących w indukcji SWS [15]. Histamina (Hi) Jądro guzowo-suteczkowate (TMN, tuberomamillary nucleus) tylnego podwzgórza, struktura uczestnicząca w procesach aktywacyjnych, jest prawie wyłącznym źródłem histaminy mózgowej [129]. Komórki histaminergiczne wysyłają projekcje bezpośrednio do kory [130] oraz do wzgórza, hipokampa i pnia mózgu [131]. Neurony TMN otrzymują zwrotnie impulsację z innych okolic podwzgórza i podstawnego przodomózgowia [132] oraz kory [133]. Podobnie jak w innych neuronach monoaminowych liczba wyładowań zwiększa się w pojedynczych neuronach histaminergicznych podczas czuwania, a zmniejsza się zwłaszcza podczas PS [134]. Histamina, modulując działanie aminokwasów pobudzających (np. kwasu glutaminowego przez receptory NMDA), bierze udział w wielu procesach ośrodkowych wzbudzenie, niepokój, reakcje stresowe oraz aktywacja układu współczulnego w różnych sytuacjach behawioralnych [129], przy czym działanie Hi przez różne typy jej receptorów jest odmienne. Postsynaptyczne receptory typu H 1 licznie występują w układzie limbicznym, na przykład w przednim podwzgórzu szczurów, a receptory H 2 w hipokampie, ciele migdałowatym i zwojach podstawy. Ich aktywacja prowadzi do wzrostu czuwania, natomiast pobudzenie autoreceptorów H 3 (hamujące uwalnianie histaminy) do jego spadku, efekty blokuje podanie antagonistów tych receptorów [135]. Wykazano zwiększone wydzielanie Hi w podwzgórzu oraz prążkowiu podczas czuwania [136], a po stymulacji histaminergicznej wydłużenie czuwania [137]. Przypuszczano, że neurony aktywne w trakcie czuwania w tylnym podwzgórzu są histaminowe [134], jednak zdaniem Steininger i wsp. [19] nie są to tylko neurony histaminowe i nie leżą wyłącznie w obrębie TMN. Bezpośrednie działanie Hi na aktywację EEG jest kwestionowane [138], chociaż zwraca się uwagę na jej udział w procesach poznawczych [139]. Adenozyna (A) Zmniejszenie czasu czuwania i wzrost ilości snu następuje zarówno po systemowym podaniu adenozyny [140], jak i po lokalnych iniekcjach do podstawnego przodomózgowia lub do LDT (laterodorsal tegmental nucleus) [141]. Prawdopodobnie nasenne działanie adenozyny zachodzi poprzez receptory A 1 [142], których liczba w podstawnym przodomózgowiu wzrasta podczas deprywacji sennej [143]. Receptory A 2a również mogą uczestniczyć w somnogenicznym działaniu A [144]. Natomiast ksantyny (do których należą teofilina i kofeina), będące blokerami receptorów adenozynowych, wywołują stan 25
6 SEN 2002, Tom 2, Nr 1 wzbudzenia ośrodkowego [145]. Zewnątrzkomórkowe stężenie A w okolicy podstawnego przodomózgowia wzrasta podczas spontanicznego czuwania i obniża się podczas snu. Adenozyna akumuluje się w tej strukturze (i w nieco mniejszym stopniu w korze mózgowej) w pierwszych godzinach deprywacji sennej, natomiast w strukturach istotnych dla indukcji snu (w przednim podwzgórzu, DR, PPN, przednio-brzusznych jądrach wzgórza) jej stężenie nie zmienia się [146]. Według Streckera i wsp. [147] nasenny efekt A może wynikać z jej bezpośredniego wpływu hamującego na cholinergiczne neurony podstawnego przodomózgowia (aktywne podczas czuwania), jak również niebezpośredniego, polegającego na odhamowaniu neuronów, obszaru przedwzrokowego (aktywnych podczas SWS). Drugi mechanizm zachodziłby na drodze presynaptycznego obniżania inhibicji GABA w tym obszarze. Dopamina (DA) Zgromadzono dowody farmakologiczne dotyczące udziału systemu dopaminergicznego w aktywacji EEG. Nasilenie transmisji dopaminergicznej (przez stymulację postsynaptycznych receptorów DA lub blokadę autoreceptorów) wiąże się ze wzrostem poziomu aktywności kory mózgowej i zwiększeniem czasu czuwania [148]. Obniżenie transmisji dopaminergicznej (blokada receptorów postsynaptycznych, stymulacja autoreceptorów DA) zwiększa ilość SWS, redukując czuwanie [149]. Podobne wyniki uzyskał Sebban i wsp. [150], który stwierdził obniżenie mocy sygnału EEG w korze przedczołowej po środkach farmakologicznych zwiększających transmisję DA oraz wzrost mocy po blokadzie dopaminergicznej. Wykazano, że związki zwiększające uwalnianie synaptyczne katecholamin (amfetamina) oraz agoniści receptorów dopaminowych (apomorfina) tłumiąco wpływają na sen [151, 152]. Efekt ten blokuje haloperidol (antagonista receptorów DA). Początkowo uważano, że działanie amfetaminy wiąże się z towarzyszącą dopaminie aktywacją noradrenergiczną, jednak aktywujący EEG wpływ amfetaminy nie zanika po lezjach LC, głównego skupiska neuronów noradrenergicznych [153], zatem działanie to może być swoiste dla dopaminy [154]. Efekt wzbudzenia korowego prawdopodobnie w większym stopniu wyzwalają dopaminowe receptory D 1 niż D 2 [155]. Desynchronizacji czynności kory mózgowej towarzyszy wzrost aktywności lokomotorycznej, chociaż przypuszcza się, że reakcje ruchowe i aktywację korową mogą kontrolować oddzielne systemy transmiterowe. Na przykład, ograniczone lezje nakrywki śródmózgowia powodowały synchronizację korową bez utraty reaktywności behawioralnej na bodźce [156], podczas gdy lezje bocznego podwzgórza wywoływały somnolencję i areaktywność behawioralną przy zachowanej aktywności korowej [ ]. Układy modulacyjne Neuromodulatory, takie jak CRH (kortykoliberyna) i ACTH (hormon kortykotropowy), współwystępujące często z omawianymi wyżej mediatorami, można włączyć w regulację stanu czuwania [160]. Podobne własności posiadają także niektóre syntetyczne analogi ACTH [161]. Wykazano również, że neurotensyna wpływa na pobudzenie czuwania: jej iniekcje do podstawnego przodomózgowia obniżają moc sygnału w paśmie delta, powodują wzrost widma mocy w paśmie theta i gamma, równocześnie zwiększają czas czuwania i PS kosztem SWS [162]. Działanie neurotensyny odbywa się przez jej bezpośredni pobudzający wpływ na neurony cholinergiczne, bogate w receptory neurotensynowe [163]. Sen wolnofalowy modulują również neuropeptydy, działanie hipnogeniczne wywierają na przykład GH RH somatoliberyna, POMC proopiomelanokortyna i jej pochodne: CLIP (ACTH peptyd kortykotropopodobny), VIP wazoaktywny peptyd jelitowy, oraz a-msh (ACTH 1-13 hormon a-melanotropowy) [ ]. Działanie neuromodulacyjne wywierają również prostaglandyny, w różny sposób zmieniając aktywność neuronów obszaru przedwzrokowego oraz podstawnego przodomózgowia [167]. Hormony i neuromodulatory wpływają także na regulację PS, zaś iniekcje prolaktyny i VIP nasilają PS [168]. VIP jest neuromodulatorem współwystępującym z acetylocholiną w wielu strukturach mózgowych [169], między innymi w LDT i jądrze przednim mostu (RPO). Podanie VIP do RPO działa podobnie jak iniekcje karbacholu do tej struktury indukuje REM [170]. Hormon wzrostu, melatonina i somatostatyna nasilają PS [ ]. Sen wyrównawczy występujący po deprywacji PS może następować z udziałem POMC i jej pochodnych: CLIP i alfa-msh [174]. Te neuropeptydy prawdopodobnie uczestniczą także w indukcji PS, występującego po długotrwałej stymulacji elektrycznej jąder szwu [175]. Taka stymulacja aktywuje podwzgórze (wytwarzanie CLIP w jądrze łukowatym), które może zwrotnie pobudzać jądra szwu do somatodendrytycznego uwalniania serotoniny (hamowanie jąder szwu przez autoreceptory 5-HT 1A ), co z kolei zmniejsza uwalnianie serotoniny w strukturach docelowych i ułatwia rozpoczęcie epizodu PS. n Rola oreksyn/hypokretyn (Ox/Hcrt, oxerin/hypocertin) w procesach aktywacyjnych Nowo odkryte neuropeptydy pobudzające, nazwane oreksynami (ze względu na ich aktywację związaną z zachowaniami pokarmowymi) [176] lub hypokretynami (ze względu na podobieństwo ich budowy do hormonu jelitowego sekretyny) [177] mają ogromne znaczenie w regulacji stanów czuwania i snu. U szczura wytwarza 26
7 Edyta Jurkowlaniec, Neurotransmiterowa regulacja snu i czuwania SEN je niewielka liczba (ok. 1200) neuronów bocznego podwzgórza, jądra grzbietowo-przyśrodkowego i obszaru okołosklepieniowego podwzgórza, wykazujących jednak bardzo szerokie projekcje zarówno wstępujące, jak i zstępujące [ ]. U ludzi obecność neuronów oreksynowych wykazano w bocznym podwzgórzu oraz obszarze okołosklepieniowym tylnego podwzgórza. Prawdopodobnie w większym stopniu unerwiają one obszary kory asocjacyjnej niż przedruchowej i ruchowej [182]. Podobnie jak u szczura, wykazano silne projekcje tych neuronów zarówno do struktur międzymózgowia (okolice pęczka przekątnego/jąder podstawnych, przyśrodkowego wzgórza), jak i pnia mózgu (jądra szwu, miejsce sinawe). Początkowo badania neuronów oreksynowych koncentrowały się wokół ich roli w pobieraniu pokarmu i wody [183, 184]. Jednakże oreksyny nie tylko zwiększają spożycie pokarmu, ale stymulują wiele reakcji ważnych dla homeostazy organizmu, na przykład zwiększają ciśnienie tętnicze i wydzielanie hormonów, zwiększają aktywność ruchową, wywołują stan czuwania [185, 186]. Obecność oreksynowych/hypokretynowych receptorów typów Ox 1 i Ox 2 (lub A i B)/Hctr 1 i Hctr 2, o nieco odmiennym rozmieszczeniu, wykazano w różnych obszarach korowych mózgu szczura (kora prefrontalna i paralimbiczna, hipokamp), we wzgórzu (jądra grupy środkowej, przykomorowe), podwzgórzu (obszar guzowo-suteczkowy, jądro grzbietowo-przyśrodkowe, jądro przykomorowe i inne), w przegrodzie, jądrach szwu i miejsca sinawego, przy czym obecność receptorów Ox 2 wydaje się bardziej powszechna niż Ox 1 [187]. Badania ekspresji białka Fos wskazują na dodatnią korelację aktywności neuronów oreksynowych ze stanem czuwania oraz ujemną ze snem wolnofalowym [188]. Niedobór oreksyn jest przyczyną narkolepsji u zwierząt [189, 190] oraz u ludzi [191, 192]. U człowieka stan ten powstaje w następstwie (lub podczas) silnych emocji bądź wysiłku fizycznego [193]. Dwa najważniejsze objawy narkolepsji: katapleksja (porażenie ruchowe) i nagłe napady snu REM cechują się obecnością aktywacji korowej przy braku reakcji ruchowych, występują w nieodpowiednich sytuacjach i porach doby, bez normalnie obecnych stadiów przejściowych. Różni je obecność lub brak świadomości, a dobowa ilość snu jest raczej prawidłowa, a w każdym razie niezwiększona [181]. Z badań przeprowadzonych na zwierzętach wynika, że w obu objawach narkolepsji występuje hamowanie motoneuronów rdzenia kręgowego zależne od aktywacji wielkokomórkowego jądra mostu [194]. Jak się okazało, u ludzi z narkolepsją dochodzi do obniżenia stężenia hypokretyn w płynie mózgowo-rdzeniowym i degeneracji neuronów oreksynowych [195, 196], co wskazuje na ich bezpośredni udział w procesach regulacji czuwania i snu. n Podsumowanie Behawioralne i elektroencefalograficzne przejawy czuwania i snu są wynikiem kompleksowego współdziałania struktur zlokalizowanych na różnych poziomach mózgu. Każda struktura włączona w aktywację korową reprezentuje tylko jedną składową szerokiego systemu wstępującego. Organizacja i hierarchia elementów tego systemu pozostaje w dalszym ciągu mało znana, o czym świadczy ciągła niezgodność badaczy w kwestii przyczyn niedoboru snu: zaburzenia funkcji wzgórza (z racji udziału w tworzeniu rytmów mózgowych), podwzgórza (ze względu na udział w regulacji cyklu sen i czuwanie) czy tworu siatkowatego, zapewniającego niespecyficzne pobudzenie struktur podkorowych i korowych. Mimo że zarówno obraz pętli neuronalnych indukujących fazy snu, a także odpowiadających za wystąpienie różnorodnych reakcji behawioralnych, jak również rola poszczególnych struktur mózgowych w ich wywołaniu są już stosunkowo dobrze poznane, to ich wzajemne powiązania i przełączanie między formami behawioru wymagają przeprowadzenia dalszych badań. n Streszczenie Grupy neuronalne inicjujące i podtrzymujące kolejne fazy snu i czuwania składają się na wieloośrodkowy system, którego funkcja jest wypadkową wpływów poszczególnych jego składowych. Czuwanie zależy od wstępującego systemu siatkowatego, którego wpływy docierają do kory mózgowej drogą grzbietową (przez wzgórze) oraz brzuszną (przez podwzgórze i podstawne przodomózgowie). Najważniejsze dla indukcji snu wolnofalowego (SWS, slow wave sleep) są wielkokomórkowe jądra siatkowate rdzenia przedłużonego i mostu, jądra szwu, jądro siatkowate wzgórza, okolica przedwzrokowa i przednie podwzgórze oraz oczodołowo-czołowe okolice kory mózgowej. Struktury istotne dla wywoływania snu paradoksalnego (PS, paradoxical sleep) i towarzyszącej mu atonii mięśniowej obejmują tylną część śródmózgowia i przedniego mostu (z jądrem przednim mostu). Regulacja faz snu i czuwania odbywa się przy udziale różnych układów transmiterowych i neuromodulacyjnych ze zmiennym poziomem aktywności. Zwiększenie transmisji cholinergicznej pojawia się podczas aktywacji kory mózgowej w trakcie czuwania (głównie w neuronach Ach 4 podstawnego przodomózgowia) i PS (głównie w neuronach Ach 5 i Ach 6 jądra konarowomostowego i boczno-grzbietowego nakrywki). Neurony monoaminowe obniżają wyładowania podczas SWS i PS, wyzwalając 27
8 SEN 2002, Tom 2, Nr 1 aktywność w ważnych dla indukcji PS strukturach śródmózgowiowo-mostowych i opuszkowych. Regulacyjna rola GABA polega na synchronizowaniu czynności struktur mózgowych zarówno we śnie, jak i podczas czuwania. Ostatnio podkreślano rolę neuropeptydów pobudzających (oreksyn/hypokretyn), produkowanych w bocznym podwzgórzu, w regulacji stanów czuwania. Ich niedobór jest przyczyną narkolepsji u ludzi i zwierząt. Słowa kluczowe: sen wolnofalowy, sen paradoksalny, czuwanie, EEG n Piśmiennictwo 1. Moruzzi G., Magoun H.W. Brainstem reticular formation and activation of the EEG. Electroencephalogr. Clin. Neurophysiol. 1948; 1: Dringenberg H.C., Vanderwolf C.H. Involvement of direct and indirect pathways in electrocorticographic activation. Neurosci. Biobehav. Rev. 1998; 22: Saper C.B., Chou T.C., Scammell T.E. The sleep switch: hypothalamic control of sleep and wakefulness. Trends Neurosci. 2001; 24: Jones B.E. Basic mechanisms of sleep-wake states. W: Kryger M.H., Roth T., Dement, W.C. red. Principles and practice of sleep medicine. W.B. Saunders Co. Philadelphia 1989: Jones B.E. Basis mechanisms of sleep-wake states. W: Kryger M.H., Roth T., Dement W.C. red. Principles and practice of sleep medicine. W.B. Saunders Co. Philadelphia 2000; Vertes R.P. Brainstem control of the events of REM sleep. Prog. Neurobiol. 1984; 22: Jones B.E. Paradoxical sleep and its chemical/structural substrates in the brain. Neurosci. 1991; 40: Moruzzi G. The sleep-waking cycle. Ergeb. Physiol. Biol. Chem. Exp. Pharmacol. 1972; 64: Bremer F. Preoptic hypnogenic area and reticular activating system. Arch. Ital. Biol. 1973; 111: Culebras A. Normal sleep physiology and neurobiology. W: Lee- Chiong T.L., Sateia M.J., Carskadon M.A. red. Sleep medicine. Hanley and Belfus Inc., Philadelphia 2002; Buzsaki G., Gage F.H. The cholinergic nucleus basalis: a key structure in neocortical arousal. EXS 1989; 57: Szymusiak R., McGinty D. Sleep-related neuronal discharge in the basal forebrain of cats. Brain Res. 1986; 370: Szymusiak R. Magnocellular nuclei of the basal forebrain: substrates of sleep and arousal regulation. Sleep 1995; 18: Szymusiak R., Alam N., Steininger T.L., McGinty D. Sleep-waking discharge patterns of ventrolateral preoptic/anterior hypothalamic neurons in rats. Brain Res. 1998; 803: Osaka T., Matsumura H. Noradrenergic inputs to sleep-related neurons in the preoptic area from the locus coeruleus and the ventrolateral medulla in the rat. Neurosci. Res. 1994; 19: Abrahamson E.E., Moore R.Y. The posterior hypothalamic area: chemoarchitecture and afferent connections. Brain Res. 2001; 889: Saper C.B. Hypothalamic connections with the cerebral cortex. Prog. Brain Res. 2000; 126: Szymusiak R., Iriye T., McGinty D. Sleep-waking discharge of neurons in the posterior lateral hypothalamic area of cats. Brain Res. Bull. 1989; 23: Steininger T.L., Alam M.N., Gong H., Szymusiak R., McGinty D. Sleep-waking discharge of neurons in the posterior lateral hypothalamus of the albino rat. Brain Res. 1999; 840: Alam M.N., Gong H., Alam T., Jaganath R., McGinty D., Szymusiak R. Sleep-waking discharge patterns of neurons recorded in the rat perifornical lateral hypothalamic area. J. Physiol. 2002; 538: El Mansari M., Sakai K., Jouvet M. Unitary characteristics of presumptive cholinergic tegmental neurons during the sleep-waking cycle in freely moving cats. Exp. Brain Res. 1989; 76: Steriade M., McCarley R.W. Brainstem control of wakefulness and sleep. Plenum Press. New York 1990; Thakkar M.M., Strecker R.E., McCarley R.W. Behavioral state control through differential serotonergic inhibition in the mesopontine cholinergic nuclei: a simultaneous unit recording and microdialysis study. J. Neurosci. 1998; 18: Gritti I., Mainville L., Jones B.E. GABAergic and other noncholinergic basal forebrain neurons, together with cholinergic neurons, project to the mesocortex and isocortex in the rat. J. Comp. Neurol. 1997; 383: Freund T.F., Meskenaite V. Gamma-aminobutyric acid-containing basal forebrain neurons innervate inhibitory interneurons in the neocortex. Proc. Natl. Acad. Sci. USA 1992; 89: Detari L., Vanderwolf C.H. Activity of identified cortically projecting and other basal forebrain neurones during large slow waves and cortical activation in anaesthetized rats. Brain Res. 1987; 437: Pulvermuller F., Birbaumer N., Lutzenberger W., Mohr B. Highfrequency brain activity: its possible role in attention, perception and language processing. Prog. Neurobiol. 1997; 52: Traub R.D., Spruston N., Soltesz I., Konnerth A., Whittington M.A., Jefferys J.G.R. Gamma-frequency oscillations: a neuronal population phenomenon, regulated by synaptic and intrinsic cellular processes, and inducing synaptic plasticity. Prog. Neurobiol. 1998; 55: Kavanau J.L. Memory, sleep, and the evolution of mechanisms of synaptic efficacy maintenance. UCLA Document Services. Los Angeles 1998; Maloney K.J., Cape E.G., Gotman J., Jones B.E. High-frequency gamma electroencephalogram activity in association with sleep-wake states and spontaneous behaviors in the rat. Neurosci. 1997; 76: Steriade M. Synchronized activities of coupled oscillators in cerebral cortex and thalamus at different levels of vigilance. Cerebr. Cortex 1997; 7: Leung L.S. Generation of theta and gamma rhythms in the hippocampus. Neurosci. Biobehav. Rev. 1998; 22: Burgess A.P., Gruzelier J.H. Short duration synchronization of human theta rhythm during recognition memory. Neuroreport 1997; 8: Klimesch W., Doppelmayr M., Schimke H., Ripper B. Theta synchronization and alpha desynchronization in a memory task. Psychophysiol. 1997; 34: Cacot P., Tesolin B., Sebban C. Diurnal variations of EEG power in healthy adults. Electroencephalogr. Clin. Neurophysiol. 1995; 94: Creutzfeldt O.D. The different types of EEG waves. W: Creutzfeldt M. red. Cortex Cerebri. Oxford Univ. Press, New York 1995; Steriade M., Contreras D., Curro Dossi R., Nunes A. The slow (< 1 Hz) oscillation in reticular thalamic and thalamocortical neurons: scenario of sleep rhythm generation in interacting thalamic and neocortical networks. J. Neurosci. 1993; 13: Kubicki S., Herrmann W.M. The future of computer-assisted investigation of the polysomnogram: sleep microstructure. J. Clin. Neurophysiol. 1996; 13:
9 Edyta Jurkowlaniec, Neurotransmiterowa regulacja snu i czuwania SEN 39. McCarley R.W., Winkelman J.W., Duffy F.H. Human cerebral potentials associated with REM sleep rapid eye movements: links to PGO waves and waking potentials. Brain Res. 1983; 274: Denoyer M., Sallanon M., Buda C., Kitahama K., Jouvet M. Neurotoxic lesion of the mesencephalic reticular formation and/or the posterior hypothalamus does not alter waking in the cat. Brain Res. 1991; 539: Chou T.C., Bjorkum A.A., Gaus S.E., Lu J., Scammell T.E., Saper C.B. Afferents to the ventrolateral preoptic nucleus. J. Neurosci. 2002; 22: Nieuwenhuys R., Geeraedts L.M.C., Veening J.G. The medial forebrain bundle of the rat: I. General introduction. J. Comp. Neurol. 1982; 206: Geeraedts L.M., Nieuwenhuys R., Veening J.G. Medial forebrain bundle of the rat: IV. Cytoarchitecture of the caudal (lateral hypothalamic) part of the medial forebrain bundle bed nucleus. J. Comp. Neurol. 1990; 294: Teitelbaum P., Epstein A.N. The lateral hypothalamic syndrome: recovery of feeding and drinking after lateral hypothalamic lesions. Psychol. Rev. 1962; 69: Marshall J.F., Turner B.H., Teitelbaum P. Sensory neglect produced by lateral hypothalamic damage. Science 1971; 174: Trojniar W. Analiza podłoża morfologicznego wybranych objawów zespołu bocznego podwzgórza u szczura. Wydawnictwo Uniwersytetu Gdańskiego, Gdańsk Danguir J., Nicolaidis S. Cortical activity and sleep in the rat lateral hypothalamic syndrome. Brain Res. 1980; 185: Trojniar W., Jurkowlaniec E., Orzeł-Gryglewska J., Tokarski J. The effect of lateral hypothalamic lesions on spontaneous EEG pattern in rats. Acta Neurobiol. Exp. 1987; 47: Jurkowlaniec E., Trojniar W., Tokarski J. Daily pattern of EEG activity in rats with lateral hypothalamic lesions. J. Physiol. Pharmacol. 1994; 45: Jurkowlaniec E., Trojniar W., Ozorowska T., Tokarski J. Differential effect of the damage to the lateral hypothalamic area on hippocampal theta rhythm during waking and paradoxical sleep. Acta Neurobiol. Exp. 1989; 49: Steriade M. Mechanisms underlying cortical activation: neuronal organization and properties of the midbrain reticular core and intralaminar thalamic nuclei. W: Pompeiano O., Marsam C.A. red. Brain mechanisms and perceptual awareness. Raven Press, New York 1981; Woolf N.J. Cholinergic systems in mammalian brain and spinal cord. Prog. Neurobiol. 1991; 37: Mesulam M.M., Mufson E.J., Wainer B.H., Levey A.I. Central cholinergic pathways in the rat: an overview based on an alternative nomenclature (Ch1-Ch6). Neurosci. 1983; 10: Wenk H., Bigl V., Meyer U. Cholinergic projections from magnocellular nuclei of the basal forebrain to cortical areas in rats. Brain Res. 1980; 2: Fibiger H.C. The organization and some projections of cholinergic neurons of the mammalian forebrain. Brain Res. 1982; 257: Wainer B.H., Steininger T.L., Roback J.D., Burke-Watson M.A., Mufson E.J., Kordower J. Ascending cholinergic pathways: functional organization and implications for disease models. Prog. Brain Res. 1993; 98: Steriade M., Parent A., Pare D., Smith Y. Cholinergic and noncholinergic neurons of cat basal forebrain project to reticular and mediodorsal thalamic nuclei. Brain Res. 1987; 408: Hallanger A.E., Price S.D., Lee H.J., Steininger T.L., Wainer B.H. Ultrastructure of cholinergic synaptic terminals in the thalamic anteroventral, ventroposterior, and dorsal lateral geniculate nuclei of the rat. J. Comp. Neurol. 1990; 299: Gritti I., Mariotti M., Mancia M. GABAergic and cholinergic basal forebrain and preoptic-anterior hypothalamic projections to the mediodorsal nucleus of the thalamus in the cat. Neurosci. 1998; 85: Saper C.B. Organization of cerebral cortical afferent systems in the rat. II. Magnocellular basal nucleus. J. Comp. Neurol. 1984; 222: Mesulam M.M. Central cholinergic pathways. Neuroanatomy and some behavioral implications. W: Avoli M., Reader T.A., Dykes R.W., Gloor P. red. Neurotransmitters and Cortical Function. Plenum Publ. Corp. Boston, Massachusetts 1988; Casamenti F., Deffenu G., Abbamondi A.L., Pepeu G. Changes in cortical acetylcholine output induced by modulation of the nucleus basalis. Brain Res. Bull. 1986; 16: Kurosawa M., Sato A., Sato Y. Stimulation of the nucleus basalis of Meynert increases acetylcholine release in the cerebral cortex in rats. Neurosci. Lett. 1989; 98: Buzsaki G., Bickford R.G., Ponomareff G., Thal L.J., Mandel R., Gage F.H. Nucleus basalis and thalamic control of neocortical activity in the freely moving rat. J. Neurosci. 1988; 8: Rye D.B., Saper C.B., Lee H.J., Wainer B.H. Pedunculopontine tegmental nucleus of the rat: cytoarchitecture, cytochemistry, and some extrapyramidal connections of the mesopontine tegmentum. J. Comp. Neurol. 1987; 259: Jones B.E., Yang T.Z. The efferent projections from the reticular formation and the locus coeruleus studied by anterograde and retrograde axonal transport in the rat. J. Comp. Neurol. 1985; 56: Steriade M., Datta S., Pare D., Oakson G., Curro Dossi R.C. Neuronal activities in brain-stem cholinergic nuclei related to tonic activation processes in thalamocortical systems. J. Neurosci. 1990; 10: Kayama Y., Ohta M., Jodo E. Firing of possibly cholinergic neurons in the rat laterodorsal tegmental nucleus during sleep and wakefulness. Brain Res. 1992; 569: Manns I.D., Mainville L., Jones B.E. Evidence for glutamate, in addition to acetylcholine and GABA, neurotransmitter synthesis in basal forebrain neurons projecting to the entorhinal cortex. Neurosci. 2001; 107: Cape E.G., Jones B.E. Effects of glutamate agonist versus procaine microinjections into the basal forebrain cholinergic cell area upon gamma and theta EEG activity and sleep-wake state. Eur. J. Neurosci. 2000; 12: Van den Pol A.N. Glutamate and aspartate immunoreactivity in hypothalamic presynaptic axons. J. Neurosci. 1991; 11: Azuma S., Kodama T., Honda, K. Inoue S. State-dependent changes of extracellular glutamate in the medial preoptic area in freely behaving rats. Neurosci. Lett. 1996; 214: Kodama T., Honda Y. Acetylcholine and glutamate release during sleep-wakefulness in the pedunculopontine tegmental nucleus and norepinephrine changes regulated by nitric oxide. Psychiatry Clin. Neurosci. 1999; 53: Inglis W.L., Winn P. The pedunculopontine tegmental nucleus: where the striatum meets the reticular formation. Prog. Neurobiol. 1995; 47: Rye D.B. Contributions of the pedunculopontine region to normal and altered REM sleep. Sleep 1997; 20: Jones B.E. Reticular formation. Cytoarchitecture, transmitters and projections. W: Paxinos G. red. The Rat Nervous System. Academic Press. New South Wales, Australia 1994; Lancel M., Cronlein T. A.M., Faulhaber J. Role of GABA A receptors in sleep regulation. Differential effects of muscimol and midazolam on sleep in rats. Neuropsychopharmacol. 1996; 15: Faulhaber J., Steiger A., Lancel M. The GABA A agonist THIP produces slow wave sleep and reduces spindling activity in NREM sleep in humans. Psychopharmacol. 1997; 130: Gauthier P., Arnaud C., Gandolfo G., Gottesmann C. Influence of a GABA(B) receptor antagonist on the sleep-waking cycle in the rat. Brain Res. 1997; 773:
10 SEN 2002, Tom 2, Nr Paredes R.G., Agmo A. GABA and behavior: the role of receptor subtypes. Neurosci. Biobehav. Rev. 1992; 16: Palacios J.M., Wamsley J.K., Kuhar M.J. High affinity GABA receptors-autoradiographic localization. Brain Res. 1981; 222: Bowery N.G., Hudson A.L., Price G.W. GABA A and GABA B receptor site distribution in the rat central nervous system. Neurosci. 1987; 20: De Luka S.R., Protic S., Vrbaski S.R. Gamma aminobutyric acid its function, disorders and their sequelae. Med. Pregl. 1998; 51: Gottesmann C. GABA mechanisms and sleep. Neurosci. 2002; 111: McIntyre T.D., Alpern H.P. GABAergic drugs can enhance or attenuate chlordiazepoxide-induced sleep time in a heterogeneous strain of mice. Pharmacol. Biochem. Behav. 1986; 25: Jones E.G. GABAergic neurons and their role in cortical plasticity in primates. Cereb. Cortex 1993; 3: Krnjevic K., Schwartz S. The action of gamma-aminobutyric acid on cortical neurones. Exp. Brain Res. 1967; 3: Vincent S.R., Kimura H., McGeer E.G. A histochemical study of GABA-transaminase in the efferents of the pallidum. Brain Res. 1982; 241: Vincent S.R., Hokfelt T., Skirboll L.R., Wu J.Y. Hypothalamic gamma-aminobutyric acid neurons project to the neocortex. Science 1983; 220: Steriade M. Corticothalamic networks, oscillations, and plasticity. Adv. Neurol. 1998; 77: McCormick D.A., Bal T. Sleep and arousal: thalamocortical mechanisms. Annu. Rev. Neurosci. 1997; 20: Nitz D., Siegel J.M. GABA release in the dorsal raphe nucleus: role in the control of REM sleep. Am. J. Physiol. 1997; 273: R451 R Nitz D., Siegel J.M. GABA release in the locus coeruleus as a function of sleep/wake state. Neurosci. 1997; 78: Sherin J.E., Elmquist J.K., Torrealba F., Saper C.B. Innervation of histaminergic tuberomammillary neurons by GABAergic and galaninergic neurons in the ventrolateral preoptic nucleus of the rat. J. Neurosci. 1998; 18: Buzsaki G. Functions for interneuronal nets in the hippocampus. Can. J. Physiol. Pharmacol. 1997; 75: Buzsaki G., Chrobak J.J. Temporal structure in spatially organized neuronal ensembles: a role for interneuronal networks. Curr. Opin. Neurobiol. 1995; 5: Cobb S.R., Buhl E.H., Halasy K., Paulsen O., Somogyi P. Synchronization of neuronal activity in hippocampus by individual GABAergic interneurons. Nature 1995; 378: Tamas G., Buhl E.H., Lorincz A., Somogyi P. Proximally targeted GABAergic synapses and gap junctions synchronize cortical interneurons. Nat. Neurosci. 2000; 3: Dahlstrom A., Fuxe K. Localization of monoamines in the lower brain stem. Experientia 1964; 20: Ungerstedt U. Stereotaxic mapping of the monoamine pathways in the rat brain. Acta Physiol. Scand. 1971; 367: Steinbusch H.W. Distribution of serotonin-immunoreactivity in the central nervous system of the rat-cell bodies and terminals. Neurosci. 1981; 6: Jacobs B.L., Azmitia E.C. Structure and function of the brain serotonin system. Physiol. Rev. 1992; 72: Jacobs B.L., Fornal C.A. Activation of 5-HT neuronal activity during motor behavior. Semin. Neurosci. 1995; 7: Grimaldi B., Fillion G. 5-HT-moduline controls serotonergic activity: implication in neuroimmune reciprocal regulation mechanisms. Prog. Neurobiol. 2000; 60: Jacobs B.L., Fornal C.A. Activity of brain serotonergic neurons in the behaving animal. Pharmacol. Rev. 1991; 43: Sprouse J.S., Aghajanian G.K. Electrophysiological responses of serotoninergic dorsal raphe neurons to 5-HT1A and 5-HT1B agonists. Synapse 1987; 1: Galzin A.M., Poirier M.F., Lista A., Chodkiewicz J.P., Blier P., Ramdine R. i wsp. Characterization of the 5-hydroxytryptamine receptor modulating the release of 5-[3H]hydroxytryptamine in slices of the human neocortex. J. Neurochem. 1992; 59: Monti J.M., Monti D. Role of dorsal raphe nucleus serotonin 5- HT1A receptor in the regulation of REM sleep. Life Sci. 2000; 66: Gervasoni D., Peyron C., Rampon C., Barbagli B., Chouvet G., Urbain N. i wsp. Role and origin of the GABAergic innervation of dorsal raphe serotonergic neurons. J. Neurosci. 2000; 20: Vertes R.P., Kinney G.G., Kocsis B., Fortin W.J. Pharmacological suppression of the median raphe nucleus with serotonin 1A agonists, 8-OH-DPAT and buspirone, produces hippocampal theta rhythm in the rat. Neurosci. 1994; 60: Vinogradova O.S., Kitchigina V.F., Kudina T.A., Zenchenko K.I. Spontaneous activity and sensory responses of hippocampal neurons during persistent theta-rhythm evoked by median raphe nucleus blockade in rabbit. Neurosci. 1999; 94: Vanderwolf C.H., Leung L.W.S., Baker G.B., Stewart D.J. The role of serotonin in the control of cerebral activity: studies with intracerebral 5,7-dihydroxytryptamine. Brain Res. 1989; 504: Bjorvatn B., Fagerland S., Eid T., Ursin R. Sleep/waking effects of a selective 5-HT1A receptor agonist given systemically as well as perfused in the dorsal raphe nucleus in rats. Brain Res. 1997; 770: Seifritz E., Stahl S.M., Gillin J.C. Human sleep EEG following the 5-HT1A antagonist pindolol: possible disinhibition of raphe neuron activity. Brain Res. 1997; 759: Peck B.K., Vanderwolf C.H. Effects of raphe stimulation on hippocampal and neocortical activity and behaviour. Brain Res. 1991; 568: Jouvet M., Bobillier P., Pujol J.F., Renault J. Permanent insomnia and diminution of cerebral serotonin due to lesion of the raphe system in cats. J. Physiol. 1967; 59: Denoyer M., Sallanon M., Kitahama K., Aubert C., Jouvet M. Reversibility of para-chlorophenylalanine-induced insomnia by intrahypothalamic microinjection of L-5-hydroxytryptophan. Neurosci. 1989; 28: Touret M., Sarda N., Gharib A., Geffard M., Jouvet M. The role of 5-hydroxytryptophan (5-HTP) in the regulation of the sleep/ wake cycle in parachlorophenylalanine (p-cpa) pretreated rat: a multiple approach study. Exp. Brain Res. 1991; 86: Jouvet M. Sleep and serotonin: an unfinished story. Neuropsychopharmacol. 1999; 21: 24S 27S Borbely A.A., Achermann P. Concepts and models of sleep regulation: an overview. J. Sleep Res. 1992; 1: Sallanon M., Janin M., Buda C., Jouvet M. Serotoninergic mechanisms and sleep rebound. Brain Res. 1983; 268: Portas C.M., Bjorvatn B., Ursin R. Serotonin and the sleep/wake cycle: special emphasis on microdialysis studies. Prog. Neurobiol. 2000; 60: Dringenberg H.C., Vanderwolf C.H. 5-hydroxytryptamine (5-HT) agonists: effects on neocortical slow wave activity after combined muscarinic and serotonergic blockade. Brain Res. 1996; 728: Morrison J.H., Foote S.L. Noradrenergic and serotoninergic innervation of cortical, thalamic, and tectal visual structures in Old and New World monkeys. J. Comp. Neurol. 1986; 243: Aston-Jones G., Bloom F.E. Activity of norepinephrine-containing locus coeruleus neurons in behaving rats anticipates fluctuations in the sleep-waking cycle. J. Neurosci. 1981; 1: Gervasoni D., Darracq L., Fort P., Souliere F., Chouvet G., Luppi P.H. Electrophysiological evidence that noradrenergic neurons 30
Sen i czuwanie rozdział 9. Zaburzenia mechanizmów kontroli ruchowej rozdział 8
 Sen i czuwanie rozdział 9 Zaburzenia mechanizmów kontroli ruchowej rozdział 8 SEN I CZUWANIE SEN I RYTMY OKOŁODOBOWE FAZY SNU CHARAKTERYSTYKA INDUKOWANIE SNU MECHANIZM I STRUKTURY MÓZGOWE RYTMY OKOŁODOBOWE
Sen i czuwanie rozdział 9 Zaburzenia mechanizmów kontroli ruchowej rozdział 8 SEN I CZUWANIE SEN I RYTMY OKOŁODOBOWE FAZY SNU CHARAKTERYSTYKA INDUKOWANIE SNU MECHANIZM I STRUKTURY MÓZGOWE RYTMY OKOŁODOBOWE
SEN I CZUWANIE NEUROFIZJOLOGIA
 SEN I CZUWANIE NEUROFIZJOLOGIA Sen i Czuwanie U ludzi dorosłych występują cyklicznie w ciągu doby dwa podstawowe stany fizjologiczne : SEN i CZUWANIE SEN I CZUWANIE Około 2/3 doby przypada na czuwanie.
SEN I CZUWANIE NEUROFIZJOLOGIA Sen i Czuwanie U ludzi dorosłych występują cyklicznie w ciągu doby dwa podstawowe stany fizjologiczne : SEN i CZUWANIE SEN I CZUWANIE Około 2/3 doby przypada na czuwanie.
Substancja P w jądrze konarowo-mostowym nakrywki a hipokampalny rytm theta
 PRACA ORYGINALNA ISSN 1641 6007 Sen 2004, Tom 4, Nr 4, 105 110 SEN Substancja P w jądrze konarowo-mostowym nakrywki a hipokampalny rytm theta Substance P in the pedunculopontine tegmental nucleus and hippocampal
PRACA ORYGINALNA ISSN 1641 6007 Sen 2004, Tom 4, Nr 4, 105 110 SEN Substancja P w jądrze konarowo-mostowym nakrywki a hipokampalny rytm theta Substance P in the pedunculopontine tegmental nucleus and hippocampal
Neurofizjologiczne uwarunkowania procesów snu, czuwania, świadomości i przytomności. Część 1
 PRACE POGLĄDOWE Anestezjologia Intensywna Terapia 2015, tom 47, numer 2, 167 173 ISSN 0209 1712 www.ait.viamedica.pl Neurofizjologiczne uwarunkowania procesów snu, czuwania, świadomości i przytomności.
PRACE POGLĄDOWE Anestezjologia Intensywna Terapia 2015, tom 47, numer 2, 167 173 ISSN 0209 1712 www.ait.viamedica.pl Neurofizjologiczne uwarunkowania procesów snu, czuwania, świadomości i przytomności.
Neuroanatomia. anatomia móżdżku i kresomózgowia jądra podstawy układ limbiczny. dr Marek Binder
 Neuroanatomia anatomia móżdżku i kresomózgowia jądra podstawy układ limbiczny dr Marek Binder 4 móżdżek funkcje utrzymanie równowagi i napięcia mięśniowego dostrojenie precyzji ruchów (objawy uszkodzenia:
Neuroanatomia anatomia móżdżku i kresomózgowia jądra podstawy układ limbiczny dr Marek Binder 4 móżdżek funkcje utrzymanie równowagi i napięcia mięśniowego dostrojenie precyzji ruchów (objawy uszkodzenia:
Dywergencja/konwergencja połączeń między neuronami
 OD NEURONU DO SIECI: MODELOWANIE UKŁADU NERWOWEGO Własności sieci, plastyczność synaps Stefan KASICKI SWPS, SPIK wiosna 2007 s.kasicki@nencki.gov.pl Dywergencja/konwergencja połączeń między neuronami 1
OD NEURONU DO SIECI: MODELOWANIE UKŁADU NERWOWEGO Własności sieci, plastyczność synaps Stefan KASICKI SWPS, SPIK wiosna 2007 s.kasicki@nencki.gov.pl Dywergencja/konwergencja połączeń między neuronami 1
Układy cholinergiczne i monoaminergiczne w mózgu. Ich rola fizjologiczna i w procesach patologicznych
 Układy cholinergiczne i monoaminergiczne w mózgu. Ich rola fizjologiczna i w procesach patologicznych Ogólne uwagi Układy cholinergiczne i monoaminergiczne mózgu charakteryzują się tym, że: neurony (ściślej,
Układy cholinergiczne i monoaminergiczne w mózgu. Ich rola fizjologiczna i w procesach patologicznych Ogólne uwagi Układy cholinergiczne i monoaminergiczne mózgu charakteryzują się tym, że: neurony (ściślej,
INDUKOWANIE SNU MECHANIZM I STRUKTURY MÓZGOWE
 RYTMY OKOŁODOBOWE SEN I CZUWANIE FAZY SNU CHARAKTERYSTYKA INDUKOWANIE SNU MECHANIZM I STRUKTURY MÓZGOWE Karolina Świder, Zakład Psychofizjologii UJ BMZ II BMZ II Wprowadzenie Zegar biologiczny autonomiczny
RYTMY OKOŁODOBOWE SEN I CZUWANIE FAZY SNU CHARAKTERYSTYKA INDUKOWANIE SNU MECHANIZM I STRUKTURY MÓZGOWE Karolina Świder, Zakład Psychofizjologii UJ BMZ II BMZ II Wprowadzenie Zegar biologiczny autonomiczny
Czucie bólu z zębów człowieka. dr n. med. Marcin Lipski dr n. med. Jarosław Zawiliński
 Czucie bólu z zębów człowieka dr n. med. Marcin Lipski dr n. med. Jarosław Zawiliński Nerwy Nerw trójdzielny Nerw szczękowy i nerw żuchwowy Gałęzie zębowy ww nerwów Miazga Włókna aferentne czuciowe Włókna
Czucie bólu z zębów człowieka dr n. med. Marcin Lipski dr n. med. Jarosław Zawiliński Nerwy Nerw trójdzielny Nerw szczękowy i nerw żuchwowy Gałęzie zębowy ww nerwów Miazga Włókna aferentne czuciowe Włókna
MÓZGOWIOWE MECHANIZMY REGULACJI SNU I CZUWANIA
 Dorota Badowska MISMaP UW : biotechnologia + psychologia Studenckie Koło Naukowe Neurobiologii UW MÓZGOWIOWE MECHANIZMY REGULACJI SNU I CZUWANIA Sen jest stanem świadomości, którego doświadczamy każdej
Dorota Badowska MISMaP UW : biotechnologia + psychologia Studenckie Koło Naukowe Neurobiologii UW MÓZGOWIOWE MECHANIZMY REGULACJI SNU I CZUWANIA Sen jest stanem świadomości, którego doświadczamy każdej
Neurobiologia snu. Neurobiology of sleep. Waldemar Szelenberger
 PRACA ORYGINALNA Waldemar Szelenberger Katedra i Klinika Psychiatryczna Akademii Medycznej w Warszawie Neurobiologia snu Neurobiology of sleep Sen jest występującym spontanicznie i okresowo stanem fizjologicznym,
PRACA ORYGINALNA Waldemar Szelenberger Katedra i Klinika Psychiatryczna Akademii Medycznej w Warszawie Neurobiologia snu Neurobiology of sleep Sen jest występującym spontanicznie i okresowo stanem fizjologicznym,
BIOLOGICZNE MECHANIZMY ZACHOWANIA II JĄDRA PODSTAWY KRESOMÓZGOWIA I KONTROLA RUCHOWA
 BIOLOGICZNE MECHANIZMY ZACHOWANIA II JĄDRA PODSTAWY KRESOMÓZGOWIA I KONTROLA RUCHOWA MECHANIZMY KONTROLI RUCHOWEJ SYSTEMY ZSTĘPUJĄCE Korowe ośrodki motoryczne Kora motoryczna (planowanie, inicjacja i kierowanie
BIOLOGICZNE MECHANIZMY ZACHOWANIA II JĄDRA PODSTAWY KRESOMÓZGOWIA I KONTROLA RUCHOWA MECHANIZMY KONTROLI RUCHOWEJ SYSTEMY ZSTĘPUJĄCE Korowe ośrodki motoryczne Kora motoryczna (planowanie, inicjacja i kierowanie
BIOLOGICZNE MECHANIZMY ZACHOWANIA II JĄDRA PODSTAWY KRESOMÓZGOWIA I KONTROLA RUCHOWA
 BIOLOGICZNE MECHANIZMY ZACHOWANIA II JĄDRA PODSTAWY KRESOMÓZGOWIA I KONTROLA RUCHOWA MECHANIZMY KONTROLI RUCHOWEJ SYSTEMY ZSTĘPUJĄCE Korowe ośrodki motoryczne Kora motoryczna (planowanie, inicjacja i kierowanie
BIOLOGICZNE MECHANIZMY ZACHOWANIA II JĄDRA PODSTAWY KRESOMÓZGOWIA I KONTROLA RUCHOWA MECHANIZMY KONTROLI RUCHOWEJ SYSTEMY ZSTĘPUJĄCE Korowe ośrodki motoryczne Kora motoryczna (planowanie, inicjacja i kierowanie
Tom 63 2014 Numer 2 (303) Strony 181 187
 Tom 63 2014 Numer 2 (303) Strony 181 187 Edyta Jurkowlaniec Katedra Fizjologii Zwierząt i Człowieka Wydział Biologii Uniwersytetu Gdańskiego Wita Stwosza 59, 80-308 Gdańsk E-mail: edyta.jurkowlaniec@biol.ug.edu.pl
Tom 63 2014 Numer 2 (303) Strony 181 187 Edyta Jurkowlaniec Katedra Fizjologii Zwierząt i Człowieka Wydział Biologii Uniwersytetu Gdańskiego Wita Stwosza 59, 80-308 Gdańsk E-mail: edyta.jurkowlaniec@biol.ug.edu.pl
Układ limbiczny. Przetwarzanie informacji przez mózg. kognitywistyka III. Jacek Salamon Tomasz Starczewski
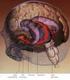 Jacek Salamon Tomasz Starczewski Przetwarzanie informacji przez mózg kognitywistyka III Co to takiego? Inaczej układ rąbkowy lub układ brzeżny. Jest zbiorczą nazwą dla różnych struktur korowych i podkorowych.
Jacek Salamon Tomasz Starczewski Przetwarzanie informacji przez mózg kognitywistyka III Co to takiego? Inaczej układ rąbkowy lub układ brzeżny. Jest zbiorczą nazwą dla różnych struktur korowych i podkorowych.
BIOLOGICZNE MECHANIZMY ZACHOWANIA I UKŁADY WYKONAWCZE SYSTEM MOTORYCZNY. SYSTEMY ZSTĘPUJĄCE Korowe ośrodki motoryczne
 BIOLOGICZNE MECHANIZMY ZACHOWANIA I UKŁADY WYKONAWCZE SYSTEM MOTORYCZNY SYSTEMY ZSTĘPUJĄCE Korowe ośrodki motoryczne Kora motoryczna (planowanie, inicjacja i kierowanie ruchami dowolnymi) Ośrodki pnia
BIOLOGICZNE MECHANIZMY ZACHOWANIA I UKŁADY WYKONAWCZE SYSTEM MOTORYCZNY SYSTEMY ZSTĘPUJĄCE Korowe ośrodki motoryczne Kora motoryczna (planowanie, inicjacja i kierowanie ruchami dowolnymi) Ośrodki pnia
Autoreferat Specjalista biolog. Zakład Fizjologii Zwierząt, Wydział Biologii i Nauk o Ziemi, Uniwersytet Gdański w Gdańsku
 Autoreferat 1. Imię i nazwisko: 2. Posiadane dyplomy, stopnie naukowe: 12.02.1981 - Dyplom ukończenia studiów wyższych magisterskich na Wydziale Biologii i Nauk o Ziemi Uniwersytetu Gdańskiego w Gdańsku
Autoreferat 1. Imię i nazwisko: 2. Posiadane dyplomy, stopnie naukowe: 12.02.1981 - Dyplom ukończenia studiów wyższych magisterskich na Wydziale Biologii i Nauk o Ziemi Uniwersytetu Gdańskiego w Gdańsku
Uwaga: wykład autorski do bezpośredniego wykorzystania, bez możliwości rozpowszechniania i powielania. Świadomość. Michał Biały
 Uwaga: wykład autorski do bezpośredniego wykorzystania, bez możliwości rozpowszechniania i powielania Świadomość Michał Biały Aspekty świadomości: tło i doznania bieżące Tło poczucie odrębności jako osoby,
Uwaga: wykład autorski do bezpośredniego wykorzystania, bez możliwości rozpowszechniania i powielania Świadomość Michał Biały Aspekty świadomości: tło i doznania bieżące Tło poczucie odrębności jako osoby,
Biorytmy, sen i czuwanie
 Biorytmy, sen i czuwanie Rytmika zjawisk biologicznych określana jako biorytm przyporządkowuje zmiany stanu organizmu do okresowych zmian otaczającego środowiska. Gdy rytmy biologiczne mają charakter wewnątrzustrojowy
Biorytmy, sen i czuwanie Rytmika zjawisk biologicznych określana jako biorytm przyporządkowuje zmiany stanu organizmu do okresowych zmian otaczającego środowiska. Gdy rytmy biologiczne mają charakter wewnątrzustrojowy
OŚRODKI UKŁADU POZAPIRAMIDOWEGO: podkorowego układu ruchu
 OŚRODKI UKŁADU POZAPIRAMIDOWEGO: podkorowego układu ruchu 1. Nadrzędne dne ośrodki o układu pozapiramidowego; jądra kresomózgowia (jj podstawy mózgu, jj podstawne) - corpus striatum: jądro ogoniaste, skorupa
OŚRODKI UKŁADU POZAPIRAMIDOWEGO: podkorowego układu ruchu 1. Nadrzędne dne ośrodki o układu pozapiramidowego; jądra kresomózgowia (jj podstawy mózgu, jj podstawne) - corpus striatum: jądro ogoniaste, skorupa
Fizjologia człowieka
 Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
I ICH ZNACZENIE DLA SNU CZŁOWIEKA*
 N e u r o k o g n i t y w i s t y k a w p a t o l o g i i i z d r o w i u, 2 0 0 9 2 0 1 1 P o m o r s k i U n i w e r s y t e t M e d y c z n y w S z c z e c i n i e 36 42 MARIA LIZAK-NITSCH ROLA NORADRENALINY
N e u r o k o g n i t y w i s t y k a w p a t o l o g i i i z d r o w i u, 2 0 0 9 2 0 1 1 P o m o r s k i U n i w e r s y t e t M e d y c z n y w S z c z e c i n i e 36 42 MARIA LIZAK-NITSCH ROLA NORADRENALINY
Oreksyny. Dwa peptydy by rządzić wszystkimi, czyli neurobiologia rytmów dobowych. Dorota Badowska III rok MISMaP: biotech + psych Warszawa 2008
 Oreksyny Dwa peptydy by rządzić wszystkimi, czyli neurobiologia rytmów dobowych Dorota Badowska III rok MISMaP: biotech + psych Warszawa 2008 Copyright statement This presentation has been prepared for
Oreksyny Dwa peptydy by rządzić wszystkimi, czyli neurobiologia rytmów dobowych Dorota Badowska III rok MISMaP: biotech + psych Warszawa 2008 Copyright statement This presentation has been prepared for
Reakcje obronne a agresja. Dr Irena Majkutewicz
 Reakcje obronne a agresja Dr Irena Majkutewicz Popędy wyzwalające reakcje obronne Strach emocjonalna reakcja na realne zagrożenie Lęk emocjonalna reakcja na przewidywany, wyobrażany lub wspominany bodziec
Reakcje obronne a agresja Dr Irena Majkutewicz Popędy wyzwalające reakcje obronne Strach emocjonalna reakcja na realne zagrożenie Lęk emocjonalna reakcja na przewidywany, wyobrażany lub wspominany bodziec
Neurofizjologiczne uwarunkowania procesów snu, czuwania, świadomości i przytomności. Część 2
 PRACE POGLĄDOWE Anestezjologia Intensywna Terapia 2015, tom 47, numer 2, 174 180 ISSN 0209 1712 www.ait.viamedica.pl Neurofizjologiczne uwarunkowania procesów snu, czuwania, świadomości i przytomności.
PRACE POGLĄDOWE Anestezjologia Intensywna Terapia 2015, tom 47, numer 2, 174 180 ISSN 0209 1712 www.ait.viamedica.pl Neurofizjologiczne uwarunkowania procesów snu, czuwania, świadomości i przytomności.
Co to są wzorce rytmów?
 Sieci neuropodobne XII, Centralne generatory wzorców 1 Co to są wzorce rytmów? Centralne generatory rytmów są układami neuronowymi powodujących cykliczną aktywację odpowiednich mięśni, mogą działać w pewnym
Sieci neuropodobne XII, Centralne generatory wzorców 1 Co to są wzorce rytmów? Centralne generatory rytmów są układami neuronowymi powodujących cykliczną aktywację odpowiednich mięśni, mogą działać w pewnym
Kresomózgowie 2. Krzysztof Gociewicz
 Kresomózgowie 2 Krzysztof Gociewicz krzysztof.gociewicz@doctoral.uj.edu.pl Czas na Ciebie! :-) Kora mózgowa funkcje percepcja kontrola ruchowa uwaga pamięć emocje myślenie główne struktury płaty:
Kresomózgowie 2 Krzysztof Gociewicz krzysztof.gociewicz@doctoral.uj.edu.pl Czas na Ciebie! :-) Kora mózgowa funkcje percepcja kontrola ruchowa uwaga pamięć emocje myślenie główne struktury płaty:
BIOLOGICZNE MECHANIZMY ZACHOWANIA II
 BIOLOGICZNE MECHANIZMY ZACHOWANIA II MÓZGOWE MECHANIZMY FUNKCJI PSYCHICZNYCH 1.1. ZMYSŁY CHEMICZNE (R.7.3) 1.2. REGULACJA WEWNĘTRZNA (R.10) Zakład Psychofizjologii UJ ZMYSŁY CHEMICZNE Chemorecepcja: smak,
BIOLOGICZNE MECHANIZMY ZACHOWANIA II MÓZGOWE MECHANIZMY FUNKCJI PSYCHICZNYCH 1.1. ZMYSŁY CHEMICZNE (R.7.3) 1.2. REGULACJA WEWNĘTRZNA (R.10) Zakład Psychofizjologii UJ ZMYSŁY CHEMICZNE Chemorecepcja: smak,
Mózgowiowe mechanizmy regulacji snu i czuwania
 Mózgowiowe mechanizmy regulacji snu i czuwania Dorota Badowska Uniwersytet Warszawski II rok biotechnologia + psychologia 1 Copyright statement This presentation has been prepared for the meeting of the
Mózgowiowe mechanizmy regulacji snu i czuwania Dorota Badowska Uniwersytet Warszawski II rok biotechnologia + psychologia 1 Copyright statement This presentation has been prepared for the meeting of the
Autonomiczny i Ośrodkowy Układ Nerwowy
 Autonomiczny i Ośrodkowy Układ Nerwowy System Nerwowy Ośrodkowy System Nerwowy Analizuje, interpretuje i przechowuje informacje Zarządza organami Obwodowy System Nerwowy Transmisja informacji z i do OSN
Autonomiczny i Ośrodkowy Układ Nerwowy System Nerwowy Ośrodkowy System Nerwowy Analizuje, interpretuje i przechowuje informacje Zarządza organami Obwodowy System Nerwowy Transmisja informacji z i do OSN
Ćwiczenie VIII Wzgórze i układy niespecyficznego pobudzenia
 Ćwiczenie VIII Wzgórze i układy niespecyficznego pobudzenia WZGÓRZE - leży w międzymózgowiu i stanowi jego największą część - otrzymuje informacje czuciowe ze wszystkich układów czuciowych za wyjątkiem
Ćwiczenie VIII Wzgórze i układy niespecyficznego pobudzenia WZGÓRZE - leży w międzymózgowiu i stanowi jego największą część - otrzymuje informacje czuciowe ze wszystkich układów czuciowych za wyjątkiem
Wprowadzenie. ROZDZIAŁ 2 Neuroanatomia. Wprowadzenie 85 Układ ruchowy 86 Układ czuciowy 90 Układ wzrokowy 93 Pień mózgu 96 Móżdżek 100 Kora mózgu 103
 ROZDZIAŁ 2 Neuroanatomia Wprowadzenie 85 Układ ruchowy 86 Układ czuciowy 90 Układ wzrokowy 93 Pień mózgu 96 Móżdżek 100 Kora mózgu 103 Wprowadzenie Udar mózgu jest schorzeniem uszkadzającym mózg. W związku
ROZDZIAŁ 2 Neuroanatomia Wprowadzenie 85 Układ ruchowy 86 Układ czuciowy 90 Układ wzrokowy 93 Pień mózgu 96 Móżdżek 100 Kora mózgu 103 Wprowadzenie Udar mózgu jest schorzeniem uszkadzającym mózg. W związku
NEUROHORMONALNA REGULACJA PRZYJMOWANIA POKARMU
 NEUROHORMONALNA REGULACJA PRZYJMOWANIA POKARMU Za kontrolę pobierania pokarmu, równowagi energetycznej i masy ciała odpowiadają mechanizmy regulacyjne, integrowane w podwzgórzu: jądro łukowate, boczne
NEUROHORMONALNA REGULACJA PRZYJMOWANIA POKARMU Za kontrolę pobierania pokarmu, równowagi energetycznej i masy ciała odpowiadają mechanizmy regulacyjne, integrowane w podwzgórzu: jądro łukowate, boczne
Jolanta Orzeł-Gryglewska
 Tom 63 2014 Numer 2 (303) Strony 189 200 Jolanta Orzeł-Gryglewska Katedra Fizjologii Zwierząt i Człowieka Wydział Biologii Uniwersytetu Gdańskiego Wita Stwosza 59, 80-308 Gdańsk E-mail: jolanta.orzel@biol.ug.edu.pl
Tom 63 2014 Numer 2 (303) Strony 189 200 Jolanta Orzeł-Gryglewska Katedra Fizjologii Zwierząt i Człowieka Wydział Biologii Uniwersytetu Gdańskiego Wita Stwosza 59, 80-308 Gdańsk E-mail: jolanta.orzel@biol.ug.edu.pl
ZAJĘCIA 1. uczenie się i pamięć mechanizmy komórkowe. dr Marek Binder Zakład Psychofizjologii
 ZAJĘCIA 1 uczenie się i pamięć mechanizmy komórkowe dr Marek Binder Zakład Psychofizjologii problem engramu dwa aspekty poziom systemowy które części mózgu odpowiadają za pamięć gdzie tworzy się engram?
ZAJĘCIA 1 uczenie się i pamięć mechanizmy komórkowe dr Marek Binder Zakład Psychofizjologii problem engramu dwa aspekty poziom systemowy które części mózgu odpowiadają za pamięć gdzie tworzy się engram?
Części OUN / Wzgórze / Podwzgórze / Śródmózgowie / Most / Zespoły naprzemienne
 Części OUN / Wzgórze / Podwzgórze / Śródmózgowie / Most / Zespoły naprzemienne 1) Schemat OUN: Ośrodkowy Układ Nerwowy składa się z: a) Kresomózgowia b) Międzymózgowia: - wzgórze; -zawzgórze; -nadwzgórze;
Części OUN / Wzgórze / Podwzgórze / Śródmózgowie / Most / Zespoły naprzemienne 1) Schemat OUN: Ośrodkowy Układ Nerwowy składa się z: a) Kresomózgowia b) Międzymózgowia: - wzgórze; -zawzgórze; -nadwzgórze;
Autonomiczny układ nerwowy - AUN
 Autonomiczny układ nerwowy - AUN AUN - różnice anatomiczne część współczulna część przywspółczulna włókna nerwowe tworzą odrębne nerwy (nerw trzewny większy) wchodzą w skład nerwów czaszkowych lub rdzeniowych
Autonomiczny układ nerwowy - AUN AUN - różnice anatomiczne część współczulna część przywspółczulna włókna nerwowe tworzą odrębne nerwy (nerw trzewny większy) wchodzą w skład nerwów czaszkowych lub rdzeniowych
Wybrane układy neurotransmiterowe i neuromodulacyjne w układzie nerwowym
 Wybrane układy neurotransmiterowe i neuromodulacyjne w układzie nerwowym Przekaźnictwo synaptyczne: synapsy elektryczne - zespoły kanałów jonowych (koneksonów) sprzęgające elektrycznie sąsiadujące neurony.
Wybrane układy neurotransmiterowe i neuromodulacyjne w układzie nerwowym Przekaźnictwo synaptyczne: synapsy elektryczne - zespoły kanałów jonowych (koneksonów) sprzęgające elektrycznie sąsiadujące neurony.
Deprywacja snu jako metoda prowokacji napadów padaczkowych. Piotr Walerjan (Warszawa)
 Deprywacja snu jako metoda prowokacji napadów padaczkowych Piotr Walerjan (Warszawa) Rutynowe zapisy EEG 40 50% zapisów EEG u pacjentów cierpiących na padaczkę nie zawiera grafoelementów padaczkorodnych
Deprywacja snu jako metoda prowokacji napadów padaczkowych Piotr Walerjan (Warszawa) Rutynowe zapisy EEG 40 50% zapisów EEG u pacjentów cierpiących na padaczkę nie zawiera grafoelementów padaczkorodnych
biologia w gimnazjum OBWODOWY UKŁAD NERWOWY
 biologia w gimnazjum 2 OBWODOWY UKŁAD NERWOWY BUDOWA KOMÓRKI NERWOWEJ KIERUNEK PRZEWODZENIA IMPULSU NEROWEGO DENDRYT ZAKOŃCZENIA AKSONU CIAŁO KOMÓRKI JĄDRO KOMÓRKOWE AKSON OSŁONKA MIELINOWA Komórka nerwowa
biologia w gimnazjum 2 OBWODOWY UKŁAD NERWOWY BUDOWA KOMÓRKI NERWOWEJ KIERUNEK PRZEWODZENIA IMPULSU NEROWEGO DENDRYT ZAKOŃCZENIA AKSONU CIAŁO KOMÓRKI JĄDRO KOMÓRKOWE AKSON OSŁONKA MIELINOWA Komórka nerwowa
MóŜdŜek dole tylnym namiotem
 MóŜdŜek znajduje się w dole tylnym czaszki, nad mostem i rdzeniem przedłuŝonym leŝy pod namiotem móŝdŝku pomiędzy płatami: skroniowym i potylicznym, a pniem mózgu wraz z z konarami tworzy strop komory
MóŜdŜek znajduje się w dole tylnym czaszki, nad mostem i rdzeniem przedłuŝonym leŝy pod namiotem móŝdŝku pomiędzy płatami: skroniowym i potylicznym, a pniem mózgu wraz z z konarami tworzy strop komory
Mechanoreceptory (dotyk, słuch) termoreceptory i nocyceptory
 Mechanoreceptory (dotyk, słuch) termoreceptory i nocyceptory Iinformacja o intensywności bodźca: 1. Kodowanie intensywności bodźca (we włóknie nerwowym czuciowym) odbywa się za pomocą zmian częstotliwość
Mechanoreceptory (dotyk, słuch) termoreceptory i nocyceptory Iinformacja o intensywności bodźca: 1. Kodowanie intensywności bodźca (we włóknie nerwowym czuciowym) odbywa się za pomocą zmian częstotliwość
Najnowsze osiągnięcia w neurobiologii. wykłady pracowników Katedry Fizjologii Zwierząt i Człowieka 2017/2018
 Najnowsze osiągnięcia w neurobiologii wykłady pracowników Katedry Fizjologii Zwierząt i Człowieka 2017/2018 Znaczenie obwodu Papeza dla procesów uczenia się i pamięci wykład 18.04.2018 (dr Witold Żakowski)
Najnowsze osiągnięcia w neurobiologii wykłady pracowników Katedry Fizjologii Zwierząt i Człowieka 2017/2018 Znaczenie obwodu Papeza dla procesów uczenia się i pamięci wykład 18.04.2018 (dr Witold Żakowski)
Znaczenie czynnościowe ośrodkowych rytmów synchronicznych ze szczególnym uwzględnieniem rytmu theta
 PRACA POGLĄDOWA Znaczenie czynnościowe ośrodkowych rytmów synchronicznych ze szczególnym uwzględnieniem rytmu theta The functional role of central synchronous rhythms, especially theta rhythm Emilia Leszkowicz
PRACA POGLĄDOWA Znaczenie czynnościowe ośrodkowych rytmów synchronicznych ze szczególnym uwzględnieniem rytmu theta The functional role of central synchronous rhythms, especially theta rhythm Emilia Leszkowicz
Multimedial Unit of Dept. of Anatomy JU
 Multimedial Unit of Dept. of Anatomy JU Ośrodkowy układ nerwowy zaczyna się rozwijać na początku 3. tygodnia w postaci płytki nerwowej, położonej w pośrodkowo-grzbietowej okolicy, ku przodowi od węzła
Multimedial Unit of Dept. of Anatomy JU Ośrodkowy układ nerwowy zaczyna się rozwijać na początku 3. tygodnia w postaci płytki nerwowej, położonej w pośrodkowo-grzbietowej okolicy, ku przodowi od węzła
Somatosensoryka. Marcin Koculak
 Somatosensoryka Marcin Koculak Systemy czucia somatycznego CZUCIE POWIERZCHNIOWE DOTYK, BÓL, TEMPERATURA CZUCIE GŁĘBOKIE PROPRIOCEPCJA MIĘŚNIE, STAWY, ŚCIĘGNA CZUCIE Z NARZĄDÓW RUCHU CZUCIE TRZEWNE WISCEROCEPCJA
Somatosensoryka Marcin Koculak Systemy czucia somatycznego CZUCIE POWIERZCHNIOWE DOTYK, BÓL, TEMPERATURA CZUCIE GŁĘBOKIE PROPRIOCEPCJA MIĘŚNIE, STAWY, ŚCIĘGNA CZUCIE Z NARZĄDÓW RUCHU CZUCIE TRZEWNE WISCEROCEPCJA
Od neuronu do sieci: modelowanie układu nerwowego
 Od neuronu do sieci: modelowanie układu nerwowego Modelowanie realistyczne dużych sieci na przykładzie modelu kory węchowej Jamesa Bowera i współpracowników dr Daniel Wójcik Symulacje kory węchowej J.
Od neuronu do sieci: modelowanie układu nerwowego Modelowanie realistyczne dużych sieci na przykładzie modelu kory węchowej Jamesa Bowera i współpracowników dr Daniel Wójcik Symulacje kory węchowej J.
Poszukiwanie potencjalnej terapii drżenia samoistnego; badania ligandów receptorów dopaminowych i adenozynowych w modelu harmalinowym u szczurów
 Mgr inż. Barbara Kosmowska Zakład Neuropsychofarmakologii Instytut Farmakologii PAN, Kraków Promotor: Recenzenci: dr hab. Jadwiga Wardas, prof. IF PAN, Kraków dr hab. Agata Adamczyk, prof. IMDiK PAN (Zakład
Mgr inż. Barbara Kosmowska Zakład Neuropsychofarmakologii Instytut Farmakologii PAN, Kraków Promotor: Recenzenci: dr hab. Jadwiga Wardas, prof. IF PAN, Kraków dr hab. Agata Adamczyk, prof. IMDiK PAN (Zakład
NEUROFIZJOLOGIA WYKŁAD 9 Kontrola ruchów u kręgowców. Prof. dr hab. Krzysztof Turlejski Uniwersytet Kardynała Stefana Wyszyńskiego
 NEUROFIZJOLOGIA WYKŁAD 9 Kontrola ruchów u kręgowców. Prof. dr hab. Krzysztof Turlejski Uniwersytet Kardynała Stefana Wyszyńskiego Głównym zadaniem ośrodkowego układu nerwowego jest generacja i kontrola
NEUROFIZJOLOGIA WYKŁAD 9 Kontrola ruchów u kręgowców. Prof. dr hab. Krzysztof Turlejski Uniwersytet Kardynała Stefana Wyszyńskiego Głównym zadaniem ośrodkowego układu nerwowego jest generacja i kontrola
Regulacja snu i czuwania
 Regulacja snu i czuwania Nie ma jednego transmitera ani pojedynczej struktury wybiórczo odpowiadającej za indukcję snu lub czuwania. W regulację następujących po sobie faz włączone są neurony o różnych
Regulacja snu i czuwania Nie ma jednego transmitera ani pojedynczej struktury wybiórczo odpowiadającej za indukcję snu lub czuwania. W regulację następujących po sobie faz włączone są neurony o różnych
Współdziałanie i konkurencja połączeń wychodzących z makrosystemów
 5 Współdziałanie i konkurencja połączeń wychodzących z makrosystemów 5.1 Układy czynnościowo-anatomiczne (makrosystemy) części podstawnej przodomózgowia 5.2 Twór siatkowaty i tworzenie wzorców zachowań
5 Współdziałanie i konkurencja połączeń wychodzących z makrosystemów 5.1 Układy czynnościowo-anatomiczne (makrosystemy) części podstawnej przodomózgowia 5.2 Twór siatkowaty i tworzenie wzorców zachowań
Układ nerwowy. /Systema nervosum/
 Układ nerwowy /Systema nervosum/ Autonomiczny układ nerwowy Autonomiczny układ nerwowy = = wegetatywny -jest częścią UN kontrolującą i wpływającą na czynności narządów wewnętrznych, w tym mięśni gładkich,
Układ nerwowy /Systema nervosum/ Autonomiczny układ nerwowy Autonomiczny układ nerwowy = = wegetatywny -jest częścią UN kontrolującą i wpływającą na czynności narządów wewnętrznych, w tym mięśni gładkich,
UKŁAD POZAPIRAMIDOWY. OŚRODKI INTEGRACJI FUNKCJI RUCHOWYCH
 UKŁAD POZAPIRAMIDOWY. OŚRODKI INTEGRACJI FUNKCJI RUCHOWYCH Poziomy integracji funkcji ruchowych Sterowanie ruchami dowolnymi, mimowolnymi, lub wyuczonymi poszczególnych mięśni lub ich grup, Planowanie
UKŁAD POZAPIRAMIDOWY. OŚRODKI INTEGRACJI FUNKCJI RUCHOWYCH Poziomy integracji funkcji ruchowych Sterowanie ruchami dowolnymi, mimowolnymi, lub wyuczonymi poszczególnych mięśni lub ich grup, Planowanie
Potencjał spoczynkowy i czynnościowy
 Potencjał spoczynkowy i czynnościowy Marcin Koculak Biologiczne mechanizmy zachowania https://backyardbrains.com/ Powtórka budowy komórki 2 Istota prądu Prąd jest uporządkowanym ruchem cząstek posiadających
Potencjał spoczynkowy i czynnościowy Marcin Koculak Biologiczne mechanizmy zachowania https://backyardbrains.com/ Powtórka budowy komórki 2 Istota prądu Prąd jest uporządkowanym ruchem cząstek posiadających
RYTM THETA WE ŚNIE I W CZUWANIU WSTĘP
 Tom 63 2014 Numer 2 (303) Strony 201 209 Paweł Matulewicz Katedra Fizjologii Zwierząt i Człowieka Uniwersytet Gdański Wita Stwosza 59, 80-308 Gdańsk e-mail: pawel.matulewicz@biol.ug.edu.pl RYTM THETA WE
Tom 63 2014 Numer 2 (303) Strony 201 209 Paweł Matulewicz Katedra Fizjologii Zwierząt i Człowieka Uniwersytet Gdański Wita Stwosza 59, 80-308 Gdańsk e-mail: pawel.matulewicz@biol.ug.edu.pl RYTM THETA WE
Sopockie Centrum Terapii Poznawczo-Behawioralnej Michał Kuchczyński
 Sopockie Centrum Terapii Poznawczo-Behawioralnej Michał Kuchczyński 81-703 Sopot; ul. Marii Skłodowskiej-Curie 7/1, tel. kom. 604 858 808; e-mail: michal@terapiasopot-sctpb.pl www.terapiasopot-sctpb.pl
Sopockie Centrum Terapii Poznawczo-Behawioralnej Michał Kuchczyński 81-703 Sopot; ul. Marii Skłodowskiej-Curie 7/1, tel. kom. 604 858 808; e-mail: michal@terapiasopot-sctpb.pl www.terapiasopot-sctpb.pl
Biologiczne mechanizmy zachowania - fizjologia. zajecia 1 :
 Biologiczne mechanizmy zachowania - fizjologia zajecia 1 : 8.10.15 Kontakt: michaladammichalowski@gmail.com https://mmichalowskiuwr.wordpress.com/ II gr 08:00 10:0 III gr 10:15 11:45 IV gr 12:00 13:30
Biologiczne mechanizmy zachowania - fizjologia zajecia 1 : 8.10.15 Kontakt: michaladammichalowski@gmail.com https://mmichalowskiuwr.wordpress.com/ II gr 08:00 10:0 III gr 10:15 11:45 IV gr 12:00 13:30
Wykład 3. metody badania mózgu I. dr Marek Binder Zakład Psychofizjologii
 Wykład 3 metody badania mózgu I dr Marek Binder Zakład Psychofizjologii ośrodkowy układ nerwowy (OUN) mózgowie rdzeń kręgowy obwodowy układ nerwowy somatyczny układ nerwowy: przewodzi informacje z i do
Wykład 3 metody badania mózgu I dr Marek Binder Zakład Psychofizjologii ośrodkowy układ nerwowy (OUN) mózgowie rdzeń kręgowy obwodowy układ nerwowy somatyczny układ nerwowy: przewodzi informacje z i do
BIOLOGICZNE MECHANIZMY ZACHOWANIA II ZABURZENIA PSYCHICZNE DEPRESJA I SCHIZOFRENIA
 BIOLOGICZNE MECHANIZMY ZACHOWANIA II ZABURZENIA PSYCHICZNE DEPRESJA I SCHIZOFRENIA DEPRESJA CHARAKTERYSTYKA ZABURZENIA Epizod depresyjny rozpoznaje się gdy pacjent jest w stanie obniżonego nastroju, anhedonii
BIOLOGICZNE MECHANIZMY ZACHOWANIA II ZABURZENIA PSYCHICZNE DEPRESJA I SCHIZOFRENIA DEPRESJA CHARAKTERYSTYKA ZABURZENIA Epizod depresyjny rozpoznaje się gdy pacjent jest w stanie obniżonego nastroju, anhedonii
Grzegorz Satała, Tomasz Lenda, Beata Duszyńska, Andrzej J. Bojarski. Instytut Farmakologii Polskiej Akademii Nauk, ul.
 Grzegorz Satała, Tomasz Lenda, Beata Duszyńska, Andrzej J. Bojarski Instytut Farmakologii Polskiej Akademii Nauk, ul. Smętna 12, Kraków Plan prezentacji: Cel naukowy Podstawy teoretyczne Przyjęta metodyka
Grzegorz Satała, Tomasz Lenda, Beata Duszyńska, Andrzej J. Bojarski Instytut Farmakologii Polskiej Akademii Nauk, ul. Smętna 12, Kraków Plan prezentacji: Cel naukowy Podstawy teoretyczne Przyjęta metodyka
Nutraceutyki wpływające na zachowanie zwierząt. Nutraceutyki-
 Nutraceutyki wpływające na zachowanie zwierząt. Nutraceutyki- środki spożywcze łączące w sobie wartości żywieniowe i cechy środków farmaceutycznych. Są to poszczególne składniki żywności, jak i substancje
Nutraceutyki wpływające na zachowanie zwierząt. Nutraceutyki- środki spożywcze łączące w sobie wartości żywieniowe i cechy środków farmaceutycznych. Są to poszczególne składniki żywności, jak i substancje
Biologiczne mechanizmy zachowania
 Biologiczne mechanizmy zachowania Przekaźnictwo chemiczne w mózgu mgr Monika Mazurek IPs UJ Odkrycie synaps Ramon y Cajal (koniec XIX wieku) neurony nie łączą się między sobą, między nimi jest drobna szczelina.
Biologiczne mechanizmy zachowania Przekaźnictwo chemiczne w mózgu mgr Monika Mazurek IPs UJ Odkrycie synaps Ramon y Cajal (koniec XIX wieku) neurony nie łączą się między sobą, między nimi jest drobna szczelina.
BIOLOGICZNE MECHANIZMY ZACHOWANIA II ZABURZENIA PSYCHICZNE DEPRESJA
 BIOLOGICZNE MECHANIZMY ZACHOWANIA II ZABURZENIA PSYCHICZNE DEPRESJA van Gogh 1890 DEPRESJA CHARAKTERYSTYKA ZABURZENIA Epizod depresyjny rozpoznaje się gdy pacjent jest w stanie obniżonego nastroju, anhedonii
BIOLOGICZNE MECHANIZMY ZACHOWANIA II ZABURZENIA PSYCHICZNE DEPRESJA van Gogh 1890 DEPRESJA CHARAKTERYSTYKA ZABURZENIA Epizod depresyjny rozpoznaje się gdy pacjent jest w stanie obniżonego nastroju, anhedonii
Konkurs neurobiologiczny BrainBee 2015
 Konkurs neurobiologiczny BrainBee 2015 1. Kalozotomia to: a. Zabieg usunięcia jednej półkuli b. Usunięcie hipokampa c. Przecięcie spoidła wielkiego d. Przecięcie rdzenia przedłużonego 2. Trójjodotyronina
Konkurs neurobiologiczny BrainBee 2015 1. Kalozotomia to: a. Zabieg usunięcia jednej półkuli b. Usunięcie hipokampa c. Przecięcie spoidła wielkiego d. Przecięcie rdzenia przedłużonego 2. Trójjodotyronina
Podsieci rozległe: Sieć wzbudzeń podstawowych. Andrzej Rutkowski
 Podsieci rozległe: Sieć wzbudzeń podstawowych Andrzej Rutkowski Default mode Mózg ciągle aktywny (wiadomo od czasu wynalezienia EEG) W trakcie spoczynku pochłania stosunkowo dużo energii Wiele regionów
Podsieci rozległe: Sieć wzbudzeń podstawowych Andrzej Rutkowski Default mode Mózg ciągle aktywny (wiadomo od czasu wynalezienia EEG) W trakcie spoczynku pochłania stosunkowo dużo energii Wiele regionów
NEUROHORMONALNA REGULACJA PRZYJMOWANIA POKARMU
 NEUROHORMONALNA REGULACJA PRZYJMOWANIA POKARMU Za kontrolę pobierania pokarmu, równowagi energetycznej i masy ciała odpowiadają mechanizmy regulacyjne, integrowane w podwzgórzu: jądro łukowate, boczne
NEUROHORMONALNA REGULACJA PRZYJMOWANIA POKARMU Za kontrolę pobierania pokarmu, równowagi energetycznej i masy ciała odpowiadają mechanizmy regulacyjne, integrowane w podwzgórzu: jądro łukowate, boczne
Molekuły Miłości. Borys Palka Katarzyna Pyzik. www.agh.edu.pl
 Molekuły Miłości Borys Palka Katarzyna Pyzik www.agh.edu.pl Zakochanie Przyczyną Hormonalnych Zmian Grupa zakochanych, 24 osoby (12 mężczyzn, 12 kobiet ) Grupa kontrolna, 24 osoby (12 mężczyzn, 12 kobiet)
Molekuły Miłości Borys Palka Katarzyna Pyzik www.agh.edu.pl Zakochanie Przyczyną Hormonalnych Zmian Grupa zakochanych, 24 osoby (12 mężczyzn, 12 kobiet ) Grupa kontrolna, 24 osoby (12 mężczyzn, 12 kobiet)
REGULACJA WYDZIELANIA HORMONÓW
 REGULACJA WYDZIELANIA HORMONÓW Regulacja nerwowa wpływ układu wegetatywnego na czynność endokrynną gruczołów wydzielania dokrewnego wytwarzanie i uwalnianie hormonów z zakończeń neuronów np.wazopresyny
REGULACJA WYDZIELANIA HORMONÓW Regulacja nerwowa wpływ układu wegetatywnego na czynność endokrynną gruczołów wydzielania dokrewnego wytwarzanie i uwalnianie hormonów z zakończeń neuronów np.wazopresyny
Ćwiczenie 1. Fizjologia i patofizjologia komórki. Komórka nerwowa.
 WARSZAWSKI UNIWERSYTET MEDYCZNY MEDICAL UNIVERSITY OF WARSAW ZAKŁAD FIZJOLOGII DOŚWIADCZALNEJ I KLINICZNEJ DEPARTAMENT OF EXPERIMENTAL AND CLINICAL PHYSIOLOGY Zawartość Ćwiczenie 1. Fizjologia i patofizjologia
WARSZAWSKI UNIWERSYTET MEDYCZNY MEDICAL UNIVERSITY OF WARSAW ZAKŁAD FIZJOLOGII DOŚWIADCZALNEJ I KLINICZNEJ DEPARTAMENT OF EXPERIMENTAL AND CLINICAL PHYSIOLOGY Zawartość Ćwiczenie 1. Fizjologia i patofizjologia
Budowa i funkcje komórek nerwowych
 Budowa i funkcje komórek nerwowych Fizjologia Komórki nerwowe neurony w organizmie człowieka około 30 mld w większości skupione w ośrodkowym układzie nerwowym podstawowa funkcja przekazywanie informacji
Budowa i funkcje komórek nerwowych Fizjologia Komórki nerwowe neurony w organizmie człowieka około 30 mld w większości skupione w ośrodkowym układzie nerwowym podstawowa funkcja przekazywanie informacji
Ćwiczenie 1. Fizjologia i patofizjologia komórki. Komórka nerwowa.
 Zawartość Ćwiczenie 1. Fizjologia i patofizjologia komórki. Komórka nerwowa.... 1 Ćwiczenie 2. Układy neurotransmisyjne mózgu. Autonomiczny układ nerwowy.... 2 Ćwiczenie 3. Fizjologia układów sensorycznych.
Zawartość Ćwiczenie 1. Fizjologia i patofizjologia komórki. Komórka nerwowa.... 1 Ćwiczenie 2. Układy neurotransmisyjne mózgu. Autonomiczny układ nerwowy.... 2 Ćwiczenie 3. Fizjologia układów sensorycznych.
7. W warunkach prawidłowych stężenie jonów potasu w przestrzeni zewnątrzkomórkowej wynosi: A. 142 mmol/l B. 12 mmol/l C. 4 mmol/l D.
 1. Wskaż właściwe stwierdzenie: A. Potencjał równowagi dla określonych jonów jest to potencjał elektryczny równoważący siłę dyfuzji tych jonów. B. Potencjał spoczynkowy błony komórkowej jest zbliżony do
1. Wskaż właściwe stwierdzenie: A. Potencjał równowagi dla określonych jonów jest to potencjał elektryczny równoważący siłę dyfuzji tych jonów. B. Potencjał spoczynkowy błony komórkowej jest zbliżony do
EEG Biofeedback. Metoda EEG-Biofeedback wykorzystuje mechanizm sprzężenia zwrotnego do treningu i usprawniania pracy mózgu
 EEG Biofeedback Metoda EEG-Biofeedback wykorzystuje mechanizm sprzężenia zwrotnego do treningu i usprawniania pracy mózgu EEG Biofeedback to skuteczna metoda terapeutyczna zwiększająca skuteczność funkcjonowania
EEG Biofeedback Metoda EEG-Biofeedback wykorzystuje mechanizm sprzężenia zwrotnego do treningu i usprawniania pracy mózgu EEG Biofeedback to skuteczna metoda terapeutyczna zwiększająca skuteczność funkcjonowania
Neurologiczne podłoże zachowań emocjonalnych. Halszka Kwiatkowska
 Neurologiczne podłoże zachowań emocjonalnych Halszka Kwiatkowska Co to są emocje? Termin wywodzi się od łacińskiego czasownika movere oznaczającego poruszyć Każde poruszenie czy zakłócenie umysłu, każdy
Neurologiczne podłoże zachowań emocjonalnych Halszka Kwiatkowska Co to są emocje? Termin wywodzi się od łacińskiego czasownika movere oznaczającego poruszyć Każde poruszenie czy zakłócenie umysłu, każdy
Fizjologia człowieka
 Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
STAROSTWO POWIATOWE W SOKÓŁCE
 STAROSTWO POWIATOWE W SOKÓŁCE DIAGNOZA TRUDNOŚCI NOWATORSKIE NARZĘDZIA - neuromodulacja (EEG Biofeedback), - neuroobrazowanie (EEG/QEEG), - rehabilitacja funkcji poznawczych (FORBRAIN), - diagnostyka i
STAROSTWO POWIATOWE W SOKÓŁCE DIAGNOZA TRUDNOŚCI NOWATORSKIE NARZĘDZIA - neuromodulacja (EEG Biofeedback), - neuroobrazowanie (EEG/QEEG), - rehabilitacja funkcji poznawczych (FORBRAIN), - diagnostyka i
JAKO POWIKŁANIE BLOKAD CENTRALNYCH. Andrzej Daszkiewicz, Aleksandra Kwosek, Hanna Misiołek
 NADMIERNA SEDACJA JAKO POWIKŁANIE BLOKAD CENTRALNYCH Andrzej Daszkiewicz, Aleksandra Kwosek, Hanna Misiołek Katedra Anestezjologii, Intensywnej Terapii i Medycyny Ratunkowej Wydziału Lekarskiego z Oddziałem
NADMIERNA SEDACJA JAKO POWIKŁANIE BLOKAD CENTRALNYCH Andrzej Daszkiewicz, Aleksandra Kwosek, Hanna Misiołek Katedra Anestezjologii, Intensywnej Terapii i Medycyny Ratunkowej Wydziału Lekarskiego z Oddziałem
Sen wpływa na nasze emocje, reakcje i gwarantuje dobre zdrowie. Dobrze przespana noc zapewnia jasność myślenia, szybsze reakcje i dobry nastrój.
 TIENS SLEEPING DUO DLACZEGO SEN its influence JEST TAKI WAŻNY? on human body Sen wpływa na nasze emocje, reakcje i gwarantuje dobre zdrowie. Dobrze przespana noc zapewnia jasność myślenia, szybsze reakcje
TIENS SLEEPING DUO DLACZEGO SEN its influence JEST TAKI WAŻNY? on human body Sen wpływa na nasze emocje, reakcje i gwarantuje dobre zdrowie. Dobrze przespana noc zapewnia jasność myślenia, szybsze reakcje
Podstawowe zagadnienia. Mgr Monika Mazurek Instytut Psychologii Uniwersytet Jagielloński
 Podstawowe zagadnienia Mgr Monika Mazurek Instytut Psychologii Uniwersytet Jagielloński NEUROPLASTYCZNOŚĆ - zdolność neuronów do ulegania trwałym zmianom w procesie uczenia się (Konorski,, 1948) Główne
Podstawowe zagadnienia Mgr Monika Mazurek Instytut Psychologii Uniwersytet Jagielloński NEUROPLASTYCZNOŚĆ - zdolność neuronów do ulegania trwałym zmianom w procesie uczenia się (Konorski,, 1948) Główne
Móżdżek. Móżdżek położony jest w dole tylnym czaszki pod namiotem móżdżku. Sąsiaduje z płatem skroniowym, potylicznym oraz z pniem mózgu.
 Móżdżek 1) Budowa i położenie Móżdżek położony jest w dole tylnym czaszki pod namiotem móżdżku. Sąsiaduje z płatem skroniowym, potylicznym oraz z pniem mózgu. Składa się z dwóch półkul oddzielonych od
Móżdżek 1) Budowa i położenie Móżdżek położony jest w dole tylnym czaszki pod namiotem móżdżku. Sąsiaduje z płatem skroniowym, potylicznym oraz z pniem mózgu. Składa się z dwóch półkul oddzielonych od
Zagadnienia do opracowania
 Wykład Wybrane aspekty plastyczności Prowadząca: prof. UG, Edyta Jurkowlaniec Literatura wymagana do zaliczenia zajęć (zdania egzaminu): 1. Kossut M. (red.) 1994. Mechanizmy plastyczności mózgu. Wydawnictwo
Wykład Wybrane aspekty plastyczności Prowadząca: prof. UG, Edyta Jurkowlaniec Literatura wymagana do zaliczenia zajęć (zdania egzaminu): 1. Kossut M. (red.) 1994. Mechanizmy plastyczności mózgu. Wydawnictwo
GABA, a neurotransmitter crucial for the development of neuronal circuits: involvement in autism spectrum disorders
 1 czerwca (piątek) 9:00 9:15 Uroczyste otwarcie 9:15 10:00 Wykład plenarny Enrico Cherubini Neurobiology Sector, International School For Advaced Studies, Triest, Włochy GABA, a neurotransmitter crucial
1 czerwca (piątek) 9:00 9:15 Uroczyste otwarcie 9:15 10:00 Wykład plenarny Enrico Cherubini Neurobiology Sector, International School For Advaced Studies, Triest, Włochy GABA, a neurotransmitter crucial
Fizjologia człowieka
 Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
PODSTAWY NEUROANATOMII
 ROZDZIAŁ 1 PODSTAWY NEUROANATOMII Urok neurologii, w porównaniu z innymi dziedzinami medycyny praktycznej, polega na sposobie, w jaki zmusza nas do codziennego kontaktu z naukami podstawowymi. Aby wyjaśnić
ROZDZIAŁ 1 PODSTAWY NEUROANATOMII Urok neurologii, w porównaniu z innymi dziedzinami medycyny praktycznej, polega na sposobie, w jaki zmusza nas do codziennego kontaktu z naukami podstawowymi. Aby wyjaśnić
BIOLOGICZNE MECHANIZMY ZACHOWANIA II ZABURZENIA PSYCHICZNE DEPRESJA
 BIOLOGICZNE MECHANIZMY ZACHOWANIA II ZABURZENIA PSYCHICZNE DEPRESJA DEPRESJA CHARAKTERYSTYKA ZABURZENIA Epizod depresyjny rozpoznaje się gdy pacjent jest w stanie obniżonego nastroju, anhedonii oraz występują
BIOLOGICZNE MECHANIZMY ZACHOWANIA II ZABURZENIA PSYCHICZNE DEPRESJA DEPRESJA CHARAKTERYSTYKA ZABURZENIA Epizod depresyjny rozpoznaje się gdy pacjent jest w stanie obniżonego nastroju, anhedonii oraz występują
NEUROBIOLOGIA MOTYWACJI
 NEUROBIOLOGIA MOTYWACJI O ASYMETRYCZNEJ NATURZE KAR I NAGRÓD Marek Kaczmarzyk, Pracownia Dydaktyki Biologii Uniwersytet Śląski marek.kaczmarzyk@us.edu.pl Materiały XIII Kongresu Zarządzania Oświatą www.oskko.edu.pl/kongres/materialy/
NEUROBIOLOGIA MOTYWACJI O ASYMETRYCZNEJ NATURZE KAR I NAGRÓD Marek Kaczmarzyk, Pracownia Dydaktyki Biologii Uniwersytet Śląski marek.kaczmarzyk@us.edu.pl Materiały XIII Kongresu Zarządzania Oświatą www.oskko.edu.pl/kongres/materialy/
PROWADZĄCY: Prof. Nadzieja Drela Prof. Krystyna Skwarło-Sońta dr Magdalena Markowska dr Paweł Majewski
 PROWADZĄCY: Prof. Nadzieja Drela Prof. Krystyna Skwarło-Sońta dr Magdalena Markowska dr Paweł Majewski Rok akad. 2015/2016 Semestr zimowy, czwartek, 8.30-10.00, sala 301A PLAN WYKŁADU Kontrola przebiegu
PROWADZĄCY: Prof. Nadzieja Drela Prof. Krystyna Skwarło-Sońta dr Magdalena Markowska dr Paweł Majewski Rok akad. 2015/2016 Semestr zimowy, czwartek, 8.30-10.00, sala 301A PLAN WYKŁADU Kontrola przebiegu
Stres DR ROBERT MERONKA ZAKŁAD EKOLOGII INSTYTUT ZOOLOGII WYDZIAŁ BIOLOGII UNIWERSYTET WARSZAWSKI
 Stres DR ROBERT MERONKA ZAKŁAD EKOLOGII INSTYTUT ZOOLOGII WYDZIAŁ BIOLOGII UNIWERSYTET WARSZAWSKI Wydatkowanie energii Wszystkie narządy i układy potrzebują energii do działania Nie wszystkie narządy i
Stres DR ROBERT MERONKA ZAKŁAD EKOLOGII INSTYTUT ZOOLOGII WYDZIAŁ BIOLOGII UNIWERSYTET WARSZAWSKI Wydatkowanie energii Wszystkie narządy i układy potrzebują energii do działania Nie wszystkie narządy i
Rytm theta rejestrowany w formacji hipokampa w warunkach pozaustrojowych* Theta rhythm recorded in the hippocampal formation in vitro
 Postepy Hig Med Dosw (online), 2013; 67: 618-630 e-issn 1732-2693 www.phmd.pl Review Received: 2012.09.11 Accepted: 2013.04.05 Published: 2013.07.15 Rytm theta rejestrowany w formacji hipokampa w warunkach
Postepy Hig Med Dosw (online), 2013; 67: 618-630 e-issn 1732-2693 www.phmd.pl Review Received: 2012.09.11 Accepted: 2013.04.05 Published: 2013.07.15 Rytm theta rejestrowany w formacji hipokampa w warunkach
Dział II. TKANKI POBUDLIWE. UKŁAD NERWOWY. FIZJOLOGIA NARZĄDÓW ZMYSŁÓW.
 Dział II. TKANKI POBUDLIWE. UKŁAD NERWOWY. FIZJOLOGIA NARZĄDÓW ZMYSŁÓW. Ćw. 1. Pobudliwość, pobudzenie. Tkanki pobudliwe. Tkanka nerwowa. (13-16 XI 2018) 1. Doświadczenia z wykorzystaniem animacji i symulacji
Dział II. TKANKI POBUDLIWE. UKŁAD NERWOWY. FIZJOLOGIA NARZĄDÓW ZMYSŁÓW. Ćw. 1. Pobudliwość, pobudzenie. Tkanki pobudliwe. Tkanka nerwowa. (13-16 XI 2018) 1. Doświadczenia z wykorzystaniem animacji i symulacji
Anatomia pamięci. Systemy pamięci a przetwarzanie informacji. Opracowała: Karolina Finc
 Anatomia pamięci Systemy pamięci a przetwarzanie informacji Opracowała: Karolina Finc Zagadnienia Jakie są główne systemy pamięci w mózgach ssaków i jak jest przetwarzana w nich informacja? Jaki jest sens
Anatomia pamięci Systemy pamięci a przetwarzanie informacji Opracowała: Karolina Finc Zagadnienia Jakie są główne systemy pamięci w mózgach ssaków i jak jest przetwarzana w nich informacja? Jaki jest sens
O C E N A. rozprawy doktorskiej Pana magistra Bartosza CABANA pt. Rytm Theta w Obszarze Tylnego Podwzgórza u Szczura: Badania in Vitro
 Prof. dr hab. Marian H. Lewandowski Zakład Neurofizjologii i Chronobiologii Katedra Fizjologii Zwierząt Instytut Zoologii Uniwersytet Jagielloński Gronostajowa 9, 30-387 Kraków (+48-12) 664-53-73 E-mail:
Prof. dr hab. Marian H. Lewandowski Zakład Neurofizjologii i Chronobiologii Katedra Fizjologii Zwierząt Instytut Zoologii Uniwersytet Jagielloński Gronostajowa 9, 30-387 Kraków (+48-12) 664-53-73 E-mail:
Hormony Gruczoły dokrewne
 Hormony Gruczoły dokrewne Dr n. biol. Urszula Wasik Zakład Biologii Medycznej HORMON Przekazuje informacje między poszczególnymi organami regulują wzrost, rozwój organizmu efekt biologiczny - niewielkie
Hormony Gruczoły dokrewne Dr n. biol. Urszula Wasik Zakład Biologii Medycznej HORMON Przekazuje informacje między poszczególnymi organami regulują wzrost, rozwój organizmu efekt biologiczny - niewielkie
Badanie procesów poznawczych na modelu szczurzym. The study of cognitive behavior in a rat model. MAGORZATA J. WĘSIERSKA
 Badanie procesów poznawczych na modelu szczurzym. The study of cognitive behavior in a rat model. MAGORZATA J. WĘSIERSKA II Konferencja Zwierzęta w badaniach naukowych Warszawa, SGGW- 5-7-września 2011
Badanie procesów poznawczych na modelu szczurzym. The study of cognitive behavior in a rat model. MAGORZATA J. WĘSIERSKA II Konferencja Zwierzęta w badaniach naukowych Warszawa, SGGW- 5-7-września 2011
Mechanizmy biologiczne i psychologiczno społeczne regulujace zachowanie człowieka. Dariusz Mazurkiewicz
 Mechanizmy biologiczne i psychologiczno społeczne regulujace zachowanie człowieka Dariusz Mazurkiewicz Podejście biologiczne: Zachowanie człowieka jest zdeterminowane czynnikami natury biologicznej: neuroprzekaźniki
Mechanizmy biologiczne i psychologiczno społeczne regulujace zachowanie człowieka Dariusz Mazurkiewicz Podejście biologiczne: Zachowanie człowieka jest zdeterminowane czynnikami natury biologicznej: neuroprzekaźniki
Warszawski Uniwersytet Medyczny II Wydział Lekarski Oddział Fizjoterapii
 Warszawski Uniwersytet Medyczny II Wydział Lekarski Oddział Fizjoterapii Zastosowanie neuromobilizacji rdzenia kręgowego i korzeni rdzeniowych w leczeniu niedowładów spastycznych u pacjentów po udarach
Warszawski Uniwersytet Medyczny II Wydział Lekarski Oddział Fizjoterapii Zastosowanie neuromobilizacji rdzenia kręgowego i korzeni rdzeniowych w leczeniu niedowładów spastycznych u pacjentów po udarach
Drgawki czy mioklonie??? Iwona Terczyńska IMID
 Drgawki czy mioklonie??? Iwona Terczyńska IMID Termin mioklonia u pacjenta z JME został po raz pierwszy zaproponowany przez Herpina w 1867 Mioklonie przysenne opisał Friedreich 1881 Nadal.nie ma powszechnie
Drgawki czy mioklonie??? Iwona Terczyńska IMID Termin mioklonia u pacjenta z JME został po raz pierwszy zaproponowany przez Herpina w 1867 Mioklonie przysenne opisał Friedreich 1881 Nadal.nie ma powszechnie
Fizjologia człowieka
 Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Leki przeciwbólowe (analgetica)
 255 Rozdział 11 (analgetica) 11.1. Definicje bólu Ból to odczucie subiektywne, trudne do pełnego zdefiniowania. Powstaje na skutek uświadomienia (u człowieka) dotarcia do mózgu impulsów nerwowych, wywołanych
255 Rozdział 11 (analgetica) 11.1. Definicje bólu Ból to odczucie subiektywne, trudne do pełnego zdefiniowania. Powstaje na skutek uświadomienia (u człowieka) dotarcia do mózgu impulsów nerwowych, wywołanych
Ból z tkanki nerwowej a ból odbierany przez tkankę nerwową - dwa sposoby terapeutyczne
 Ból z tkanki nerwowej a ból odbierany przez tkankę nerwową - dwa sposoby terapeutyczne Dr n. med. Michał Dwornik Ból z tkanki nerwowej Rdzeń kręgowy Zwoje współczulne Korzenie rdzeniowe Nerwy rdzeniowe
Ból z tkanki nerwowej a ból odbierany przez tkankę nerwową - dwa sposoby terapeutyczne Dr n. med. Michał Dwornik Ból z tkanki nerwowej Rdzeń kręgowy Zwoje współczulne Korzenie rdzeniowe Nerwy rdzeniowe
