W tym systemie wykorzystano na mocy licencji technologię opracowaną przez firmę NEN Life Science Products, Inc. (patent USA nr 5,196,306).
|
|
|
- Artur Grzelak
- 5 lat temu
- Przeglądów:
Transkrypt
1 CSA II Biotin-free Tyramide Signal Amplification System Nr kat. K1497 Do uŝytku z pierwotnymi przeciwciałami mysimi Ograniczona licencja na uŝytkowanie W tym systemie wykorzystano na mocy licencji technologię opracowaną przez firmę NEN Life Science Products, Inc. (patent USA nr 5,196,306). Ten produkt jest rozpowszechniany i sprzedawany UŜytkownikowi Końcowemu zgodnie z licencją udzieloną przez NEN LIFE SCIENCE PRODUCTS, INC., uprawniającą UŜytkownika Końcowego do wykorzystania produktu w procesie ręcznego lub zautomatyzowanego przetwarzania wyłącznie szkiełek mikroskopowych lub innych materiałów pomocniczych (z wyjątkiem mikromacierzy i biochipów) zawierających próbki komórkowe lub tkankowe przy uŝyciu przyrządów Dako do mikroskopowego badania tych próbek (takŝe przy uŝyciu zautomatyzowanych systemów akwizycji i analizy obrazów) w celu wykrywania określonych kwasów nukleinowych lub białek. Zakup nie jest równoznaczny z uzyskaniem lub przeniesieniem prawa do odsprzedaŝy lub przenoszenia prawa własności do tego produktu jako do produktu autonomicznego lub jako do składnika innego produktu. Wykorzystanie produktu w sposób inny niŝ określony w licencji bez wyraźnej pisemnej zgodny NEN LIFE SCIENCE PRODUCTS, INC. jest surowo zabronione. Przeznaczenie Do stosowania w diagnostyce in vitro. Niniejsze instrukcje dotyczą produktu CSA II (nr kat K1497). CSA II to niezawierający biotyny tyramidowy system amplifikacji odczynów do badań immunohistochemicznych. Opisywany system jest przeznaczony do stosowania z pierwotnymi przeciwciałami mysimi wybranymi przez UŜytkownika, w celu jakościowej identyfikacji antygenów w preparatach tkanek prawidłowych i zmienionych chorobowo utrwalanych w formalinie i zatapianych w parafinie. Identyfikację prowadzi się w mikroskopie świetlnym. Ten system moŝe być uŝywany w procedurach ręcznych i/lub w urządzeniach firmy Dako. W dokumencie General Instructions for Immunohistochemical Staining ( Instrukcje wykonywania odczynów immunohistochemicznych ) opisano następujące zagadnienia: (1) Zasady procedury, (2) Niezbędne materiały niedostarczone z zestawem, (3) Przechowywanie, (4) Przygotowanie preparatu, (5) Wykonanie odczynu, (6) Kontrola jakości, (7) Rozwiązywanie problemów, (8) Interpretacja wyniku odczynu, (9) Ograniczenia metody. Streszczenie i informacje ogólne Zasady procedury CSA II System to wysoce czuła procedura wykonywania odczynu immunohistochemicznego (IHC), w której wykorzystywana jest metoda amplifikacji oparta na katalizowanym przez peroksydazę odkładaniu się znakowanego fluoresceiną związku fenolowego, po której następuje reakcja wtórna ze skoniugowanym z peroksydazą przeciwciałem przeciwko fluoresceinie. 1-5 W ramach procedury najpierw pierwotne przeciwciało mysie jest wykrywane przy uŝyciu skoniugowanego z peroksydazą przeciwciała wtórnego. W następnym kroku związana peroksydaza jest wykorzystywana jako katalizator utleniania fenolu skoniugowanego z fluoresceiną (fluorescyl-tyramid), który następnie wytrąca się na próbce. W dalszych etapach procedury następuje detekcja związanej fluoresceiny przez skoniugowane z peroksydazą przeciwciało przeciwko fluoresceinie. Wykonywanie odczynu kończy uŝycie diaminobenzydyny/nadtlenku wodoru w charakterze chromogenu/substratu, zaś wynik moŝna obserwować w mikroskopii świetlnej. W porównaniu ze standardowymi metodami immunohistochemicznymi, takimi jak znakowanie streptawidyną-biotyną (LSAB) lub kompleksami awidyna-biotyna (ABC), metody amplifikacji z wykorzystaniem tyramidu są, jak stwierdzono w badaniach, wielokrotnie bardziej czułe. 3,4 CSA II System to uproszczona wersja niezwykle czułego systemu amplifikacji Catalyzed Signal Amplification System (nr kat. K1500), w którym wykorzystywany jest odczynnik Biotinyl-Tyramide. Wysoce czuły CSA II System umoŝliwia detekcję bardzo małych ilości białka docelowego, a takŝe zastosowanie przeciwciał o słabym powinowactwie. UŜywanym odczynnikiem jest Fluorescyl- Tyramide, a nie Biotinyl-Tyramide, zaś system nie obejmuje odczynników zawierających awidynę/biotynę, co eliminuje ewentualny odczyn tła spowodowany reaktywnością z biotyną endogenną. 6,7 Próbki najpierw inkubowane są przez pięć minut w obecności odczynnika blokującego peroksydazę w celu wygaszenia aktywności endogennej peroksydazy. Następnie próbki inkubowane są przez pięć minut w obecności odczynnika blokującego białko w celu wyeliminowania nieswoistego wiązania następnych odczynników; po tej inkubacji następuje 15-minutowa inkubacja z prawidłowo dobranymi i rozcieńczonymi pierwotnymi przeciwciałami mysimi lub kontrolą ujemną (nie wchodzi w skład zestawu). Po tym etapie następuje seria 15-minutowych inkubacji z przeciwciałami skierowanymi przeciw antygenom mysim skoniugowanymi z peroksydazą chrzanową (HRP), odczynnikiem amplifikującym (Fluorescyl-Tyramide z nadtlenkiem wodoru) i przeciwciałami przeciwko fluoresceinie skoniugowanymi z peroksydazą chrzanową. Wykonywanie odczynu kończy pięciominutowa inkubacja z tetrachlorowodorkiem 3,3'-diaminobenzydyny (DAB)/nadtlenkiem wodoru, która skutkuje wytrąceniem się brązowego osadu w miejscu występowania antygenu. ( ) P04037PL_01/K1497/ s. 1/10
2 Dostarczany odczynnik Nr kat. K1497 W skład tego zestawu wchodzą następujące materiały: Ilość 1x15 ml Opis Odczynnik blokujący peroksydazę 3% roztwór nadtlenku wodoru w wodzie. 1x15 ml Odczynnik blokujący białko Białko niesurowicze w buforze z azydkiem sodu w stęŝeniu 0,015 mol/l. 1x15 ml Przeciwciała przeciwko mysiej immunoglobulinie skoniugowane z HRP Przeciwciała przeciwko mysiej immunoglobulinie skoniugowane z peroksydazą chrzanową w buforze zawierającym białko stabilizujące i środek przeciwbakteryjny. 1x15 ml Odczynnik amplifikujący Fluorescyl-Tyramide i nadtlenek wodoru w buforze zawierającym białko stabilizujące i środek przeciwbakteryjny. 1x15 ml Przeciwciała przeciwko fluoresceinie skoniugowane z HRP Przeciwciała przeciwko fluoresceinie skoniugowane z peroksydazą chrzanową w buforze zawierającym białko stabilizujące i środek przeciwbakteryjny. 1x18 ml Substrat w buforze Bufor zawierający nadtlenek wodoru i konserwant. 1x1 ml Płynny chromogen DAB+ Roztwór chromogenu, 3,3'-diaminobenzydyny Materiały wymagane, ale niedostarczane Rozcieńczalnik do przeciwciał, taki jak Antibody Diluent with Background Reducing Components (nr kat. S3022) Próbki kontrolne, kontrola dodatnia i ujemna Barwnik kontrastowy, taki jak Lillie s Modified Mayer s Hematoxylin (nr kat. S3301 do aparatów Dako Autostainer lub S3302 do ręcznego wykonywania odczynów) Mikroskop świetlny Środki do zatapiania, np.glycergel Mounting Medium (nr kat. C0563), Faramount, Aqueous Mounting Medium, Ready-to-use (nr kat. S3025) lub bezwodny środek do trwałego zatapiania, np. Permanent Mounting Media (nr kat. S3026) Mysie przeciwciała pierwotne i odczynniki do kontroli ujemnej Bufor płuczący, taki jak TBST (Tris Buffered Saline With Tween), 10x Concentrate (nr kat. S3306) Automatyczne wykonywanie odczynu Dako Autostainer (nr kat. S3400) lub Autostainer Plus (nr kat. S3800). Koniecznie elementy przedstawiono w instrukcji dla uŝytkownika aparatu Dako Autostainer. Materiały dodatkowe wymagane, ale niedostarczane Zob. karta specyfikacji przeciwciał pierwotnych. Roztwór do odmaskowania antygenu, zmodyfikowany bufor cytrynianowy (ph 6,1), taki jak Target Retrieval Solution, Ready-to-use (nr kat. S1700) lub 10x Concentrate (nr kat. S1699) Kąpiel wodna (utrzymująca temperaturę C), kąpiel parowa, szybkowar lub autoklaw do odmaskowania antygenu. ( ) P04037PL_01/K1497/ s. 2/10
3 Środki ostroŝności Dotyczące opisywanego produktu 1. Odczynniki są przeznaczone dla przeszkolonych UŜytkowników. 2. Opisywany produkt zawiera silnie toksyczny związek azydek sodu (NaN 3), w czystej postaci. StęŜenie NaN 3 występujące w produkcie nie jest klasyfikowane jako niebezpieczne. Jednak w wyniku reakcji NaN 3 z ołowiem lub miedzią, wchodzącymi w skład instalacji kanalizacyjnych, mogą powstawać silnie wybuchowe azydki metali. Przy usuwaniu resztek odczynników naleŝy uŝywać duŝych ilości wody do przepłukiwania, aby uniknąć gromadzenia się azydku w instalacji kanalizacyjnej. 8,24 3. Unikać zanieczyszczeń mikrobiologicznych odczynnika. W przeciwnym razie moŝe dojść do nasilenia nieswoistego barwienia. 4. Podobnie jak w przypadku kaŝdego produktu otrzymywanego z materiału biologicznego, naleŝy stosować odpowiednie procedury postępowania. 5. NaleŜy stosować właściwe wyposaŝenie ochronne, zabezpieczające przed kontaktem odczynnika ze skórą bądź oczami. 6. Niewykorzystany odczynnik naleŝy usuwać zgodnie ze stosownymi przepisami lokalnymi i krajowymi. 7. Karta Charakterystyki Substancji Niebezpiecznej jest dostępna na Ŝądanie. Ogólne 1. Nie naleŝy uŝywać odczynników po upływie terminu waŝności. 2. Nie uŝywać odczynników zamiennych pochodzących od innych producentów. 3. Nie naleŝy przechowywać składników systemu ani wykonywać barwienia w silnym oświetleniu, takim jak bezpośrednie światło słoneczne. Uwaga: W etapie inkubacji z odczynnikiem amplifikującym szkiełka naleŝy chronić przed światłem. Uwaga Amplification Reagent: 10-30% Glycerol H320 Wywołuje podraŝnienie oczu. P280 Stosować rękawice ochronne. Nosić okulary ochronne lub ochronę twarzy. Stosować odzieŝ ochronną. P264 Dokładnie umyć ręce po uŝyciu. P305 + P351 + W PRZYPADKU DOSTANIA SIĘ DO OCZU: OstroŜnie płukać wodą przez kilka P338 minut. Wyjąć soczewki kontaktowe, jeŝeli są i moŝna je łatwo usunąć. Nadal płukać. P337 + P313 Jeśli podraŝnienie oczu się utrzymuje: Zgłosić się do lekarza po poradę. Przechowywanie Niebezpieczeństwo DAB Chromogen: 1-5% biphenyl-3,3',4,4'-tetrayltetraammonium tetrachloride H350 MoŜe powodować raka. H341 Podejrzewa się, Ŝe powoduje wady genetyczne. P201 Przed uŝyciem zapoznać się ze specjalnymi środkami ostroŝności. P202 Nie uŝywać przed zapoznaniem się i zrozumieniem wszystkich środków bezpieczeństwa. P281 Stosować wymagane środki ochrony indywidualnej. P308 + P313 W PRZYPADKU naraŝenia lub styczności: Zwrócić się o pomoc lekarską. P405 Przechowywać pod zamknięciem. P501 Zawartość i pojemnik usuwać zgodnie z lokalnymi, regionalnymi, krajowymi i międzynarodowymi przepisami. Odczynniki CSA II System naleŝy przechowywać w temperaturze 2 8 C. Nie zamraŝać. Nie naleŝy uŝywać produktów po upływie daty waŝności wydrukowanej na fiolkach odczynników i etykiecie zestawu. Nie ma jednoznacznych oznak świadczących o niestabilności odczynników. Dlatego, równolegle z odczynami na materiale pochodzącym od pacjentów, naleŝy wykonywać dodatnie i ujemne próby kontrolne. W wypadku nieoczekiwanego wyniku odczynu, którego nie moŝna wyjaśnić róŝnicami w procedurach laboratoryjnych, gdy podejrzewa się problem z zestawem, naleŝy się skontaktować z działem wsparcia technicznego firmy Dako. Przygotowanie odczynników Bufor płuczący Badania wykazały, Ŝe roztwór Tris-HCl o stęŝeniu 0,05 mol/l i ph 7,6, zawierający NaCl w ilości 0,3 mol/l oraz 0,1% preparatu Tween 20, bez azydku sodu, znacząco pomaga w osłabianiu odczynu tła podczas barwienia przy uŝyciu tego systemu. Zalecany bufor płuczący to TBST 10x (nr kat. S3306). Bufory płuczące zawierające azydek sodu unieczynniają peroksydazę chrzanową i powodują odczyn ujemny. NieuŜywany bufor przechowywać w temperaturze 2 8 C. Nie uŝywać buforu, jeśli wystąpiło jego zmętnienie. Zautomatyzowane wykonywanie odczynu Jako uniwersalny bufor płuczący w aparacie Dako Autostainer realizującym protokół zautomatyzowany CSA II moŝe być uŝywany Automation Buffer, 10x (nr kat. S3006), jednak po zastosowaniu nadtlenku wodoru, przeciwciał pierwotnych i przeciwciał przeciwko antygenom mysim skoniugowanym z HRP, naleŝy zastosować przez 5 10 minut płukanie dodatkowe roztworem TBST (nr kat. S3306). Do płukania po zastosowaniu substratu-chromogenu i barwieniu kontrastowym moŝna uŝyć wody destylowanej lub dejonizowanej. ( ) P04037PL_01/K1497/ s. 3/10
4 Ręczne wykonywanie odczynu Między poszczególnymi etapami protokołu CSA II skrawki tkankowe naleŝy płukać przez 3 5 minut w maksymalnie trzech świeŝych partiach TBST (nr kat. S3306). Roztwór substrat-chromogen DAB Jeden ml substratu-chromogenu wystarcza na maksymalnie dziesięć skrawków tkankowych. ETAP 1 ETAP 2 W zaleŝności od liczby barwionych szkiełek przenieść odpowiednią liczbę porcji 1 ml z butelki z substratem w buforze do probówki. Na kaŝdy 1 ml substratu w buforze dodać 1 kroplę (20 µl) z butelki Liquid DAB Chromogen. Natychmiast zmieszać. Przygotowany substrat-chromogen jest stabilny przez około pięć dni, jeśli przechowywany jest w temperaturze 2 8 C. Odczynnik ten naleŝy dokładnie wymieszać przed uŝyciem. Wytrącanie się osadu w odczynniku nie wpływa na jakość odczynu. Rozcieńczanie stęŝonych przeciwciał pierwotnych i kontroli ujemnej Przeciwciała pierwotne naleŝy rozcieńczyć roztworem zawierającym białko stabilizujące. Zdecydowanie zalecane jest uŝycie odczynnika Antibody Diluent with Background Reducing Components (nr kat. S3022), który umoŝliwia zminimalizowanie odczynu tła. Odpowiednia kontrola ujemna zawiera immunoglobulinę mysią naleŝącą do tego samego izotypu, co przeciwciała pierwotne, rozcieńczoną do stęŝenia odpowiadającego stęŝeniu przeciwciała pierwotnego. Przygotowanie próbek Przygotowanie preparatów zatopionych w parafinie Przed rozpoczęciem odczynu IHC naleŝy wykonać utrwalenie i przeprowadzenie tkanki. Utrwalenie zabezpiecza przed autolizą i rozkładem wycinków, utrzymuje antygenowość, zwiększa współczynnik załamania światła przez struktury tkankowe i zwiększa odporność składników komórek na przeprowadzenie. Przeprowadzenie tkanki polega na odwodnieniu, usunięciu środków odwadniających, przepojeniu substancją zatapiającą, zatopieniu i wykonaniu wycinków. Utrwalacze najczęściej stosowane podczas przygotowania tkanek do diagnostyki IHC przedstawiono w dokumencie General Instructions for Immunohistochemical Staining (Ogólne instrukcje wykonywania odczynów immunohistochemicznych). Podane informacje mają charakter wyłącznie orientacyjny. Optymalna procedura powinna zostać ustalona i zweryfikowana przez UŜytkownika. Trwałość antygenów w próbkach tkanek uŝywanych do badań immunohistochemicznych moŝe zaleŝeć od typu i stęŝenia środka utrwalającego, czasu utrwalania oraz od wielkości utrwalanej próbki Dla uzyskania powtarzalnych wyników waŝne jest zachowanie, w miarę moŝliwości, optymalnych, znormalizowanych warunków utrwalania. Tam, gdzie jest to moŝliwe, naleŝy uŝywać cieńszych próbek i skracać czas utrwalania. Długi kontakt ze środkami utrwalającymi moŝe spowodować zamaskowanie antygenów i osłabić odczyn. Po utrwaleniu próbki są odwadniane przy uŝyciu roztworów alkoholu o rosnących stęŝeniach, płukane ksylenem lub substytutem ksylenu i nasączane woskiem parafinowym. Następnie tkanka jest utrwalana w wosku parafinowym w foremkach lub kasetach w celu ułatwienia przygotowania skrawków. Aby zminimalizować denaturację antygenów, podczas obróbki nie naleŝy wystawiać tkanek na działanie temperatur przekraczających 60 C. Po zakończeniu utrwalania bloczki tkanek mogą być przechowywane lub pocięte na skrawki. Prawidłowo utrwalone tkanki moŝna przechowywać w chłodnym miejscu (15 22 C) przez nieograniczony czas. Zatapianie skrawków tkankowych Skrawki tkankowe odcięte z bloczków parafinowych są umieszczane na czystych szkiełkach. NaleŜy strząsnąć ze szkiełek jak najwięcej wody. Kropelki wody pozostałe na tkance w trakcie schnięcia mogą negatywnie wpłynąć na proces barwienia. Suszyć w piecu przez jedną-dwie godziny w temperaturze nie wyŝszej niŝ 60 C lub pozostawić do wyschnięcia w temperaturze pokojowej na godzin. Aby uzyskać lepsze przyleganie skrawków tkankowych podczas wykonywania odczynów IHC, zalecamy stosowanie szkiełek powlekanych poli-l-lizyną, szkiełek z ładunkiem elektrostatycznym lub silanizowanych szkiełek Silanized Slides (nr kat. S3003). W przypadku badań wymagających odmaskowania antygenu zdecydowanie zalecane jest uŝycie szkiełek silanizowanych. Zautomatyzowane i ręczne wykonywanie odczynu Uwagi dotyczące procedury Przed przystąpieniem do wykonania odczynu UŜytkownik powinien uwaŝnie przeczytać podane instrukcje i zapoznać się z zawartością zestawu. Przed wykonaniem odczynu immunohistochemicznego wszystkie odczynniki naleŝy doprowadzić do temperatury pokojowej (20 25 C); równieŝ parametry wszystkich inkubacji zoptymalizowano pod kątem temperatury pokojowej. Odczynniki i instrukcje dostarczane w zestawie opracowano w celu uzyskania optymalnych wyników. Rozcieńczanie odczynników gotowych do uŝytku moŝe doprowadzić do uzyskania błędnych wyników. ( ) P04037PL_01/K1497/ s. 4/10
5 Uwaga: W przypadku zautomatyzowanego wykonywania odczynu pokrywa aparatu Dako Autostainer powinna być zamknięta podczas stosowania odczynnika amplifikującego, co pozwoli na uzyskanie optymalnych wyników. W przypadku ręcznego wykonywania odczynu szkiełka naleŝy chronić przed światłem podczas inkubacji z odczynnikiem amplifikującym. Podczas wykonywania barwienia nie moŝna dopuścić do wysychania skrawków tkankowych. Wysuszone skrawki tkankowe mogą powodować występowanie nieswoistego odczynu. NaleŜy osłonić szkiełka nakrywkowe znajdujące się w miejscach naraŝonych na przeciągi. JeŜeli stosuje się długie czasy inkubacji, preparaty powinny się znajdować w środowisku o odpowiedniej wilgotności. W celu ograniczenia nieswoistego odczynu tła zaleca się opłukanie skrawków tkankowych roztworem TBST zgodnie z zaleceniami dotyczącymi buforu płuczącego w sekcji Przygotowanie odczynników. Odparafinowanie skrawków tkankowych Przed przystąpieniem do wykonania odczynu naleŝy odparafinować preparaty w celu usunięcia środka zatapiającego i ponownego uwodnienia. NaleŜy unikać niecałkowitego usunięcia parafiny poniewaŝ pozostałości środka zatapiającego powodują nasilenie nieswoistego odczynu. Trawienie proteolityczne i odmaskowanie antygenu Wiadomo, Ŝe formaldehyd wywołuje zmiany struktury konformacyjnej molekuł przeciwciał, tworząc wiązania międzymolekularne. Długotrwałe utrwalenie w formalinie moŝe zamaskować miejsca występowania antygenów i osłabić odczyn swoisty. W standardowych procedurach immunohistochemicznych miejsca te moŝna odmaskować poprzez trawienie proteolityczne poprzedzające właściwy odczyn. Uwaga: Trawienie proteolityczne moŝe w CSA II System wywołać silny odczyn tła i dlatego nie jest zalecane. Preferowaną alternatywą dla trawienia proteolitycznego jest odmaskowanie antygenu metodą termiczną, które spowoduje nieznaczne wzmocnienie odczynu tła przy jednoczesnym silnym wzmocnieniu odczynu swoistego z wieloma przeciwciałami pierwotnymi. Aby sprawdzić, czy konieczna jest wstępna obróbka tkanek w celu odmaskowania antygenu, naleŝy zapoznać się z kartą specyfikacji dołączoną do przeciwciała pierwotnego; w przypadku niektórych przeciwciał pierwotnych obróbka taka jest konieczna. Zalecana procedura odmaskowania antygenu polega na zanurzeniu zatopionych na szkiełkach skrawków tkankowych w zmodyfikowanym buforze cytrynianowym (ph 6,1), takim jak Target Retrieval Solution, Ready-to-use (nr kat. S1700) lub 10x Concentrate (nr kat. S1699); kompletne instrukcje ogrzewania przed wykonaniem odczynu IHC moŝna znaleźć na ulotce dołączonej do opakowania. Dokładnie opłukać roztworem buforu płuczącego i kontynuować procedurę wykonania odczynu. Uwaga: Nie zaleca się uŝywania z CSA II System roztworów do odmaskowywania antygenu o wysokim ph (ph 10), gdyŝ mogą one wywoływać silny odczyn tła. Zautomatyzowane wykonanie odczynu ETAP 1 Wybrać funkcję Protocol Template Auto Program (automatyczne programowanie wzoru protokołu). ETAP 2 Umieścić odczynniki i bufor w statywie na odczynniki aparatu Dako Autostainer. ETAP 3 Umieścić szkiełka w aparacie Dako Autostainer. ETAP 4 Rozpocząć serię odczynów. ETAP 5 Wyjąć szkiełka z aparatu Dako Autostainer. ETAP 6 Przejść do zatapiania. Uwaga: Zalecana tabela programowania obejmuje barwienie kontrastowe. Alternatywnym rozwiązaniem jest ręczne przeprowadzenie barwienia kontrastowego na stole laboratoryjnym. Ręczne wykonanie odczynu ETAP 1 ODCZYNNIK BLOKUJĄCY PEROKSYDAZĘ Strząsnąć nadmiar cieczy. Posługując się chusteczką niepozostawiającą nitek ostroŝnie otrzeć szkiełko wokół preparatu tak, by usunąć pozostałości płynu i utrzymywać odczynniki w obszarze zgodnym z zaleceniami. Dodać tyle nadtlenku wodoru, aby zakryć próbkę. Inkubować przez 5 (±1) minut. OstroŜnie przepłukać wodą destylowaną lub roztworem buforowym z butelki na płyn płuczący (nie naleŝy kierować strumienia płynu bezpośrednio na tkankę), a następnie umieścić preparat w świeŝej kąpieli z buforem płuczącym. ETAP 2 ODCZYNNIK BLOKUJĄCY BIAŁKA Strząsnąć nadmiar cieczy i przetrzeć preparat jak poprzednio. Dodać tyle odczynnika blokującego białka, aby zakryć próbkę. Inkubować przez 5 (±1) minut. Nie spłukiwać odczynnika blokującego białka. ( ) P04037PL_01/K1497/ s. 5/10
6 ETAP 3 ETAP 4 ETAP 5 ETAP 6 ETAP 7 ETAP 8 PRZECIWCIAŁA PIERWOTNE LUB ODCZYNNIK DO KONTROLI UJEMNEJ Strząsnąć nadmiar cieczy i przetrzeć preparat jak poprzednio. Nanieść przygotowany we własnym zakresie roztwór przeciwciał pierwotnych lub odczynnika do kontroli ujemnej, aŝ próbka zostanie zakryta. Inkubować przez 15 (±1) minut, o ile na karcie specyfikacji przeciwciał pierwotnych nie wskazano inaczej. Delikatnie przemyć roztworem buforu z butelki na płyn płuczący i umieścić w maksymalnie trzech kąpielach ze świeŝego buforu TBST, po 3 5 minut kaŝda. PRZECIWCIAŁO PRZECIWKO MYSIEJ IMMUNOGLOBULINIE SKONIUGOWANE Z HRP Wytrzeć preparat jak poprzednio. Dodać tyle przeciwciał przeciwko mysiej immunoglobulinie skoniugowanych z peroksydazą chrzanową, aby zakryć próbkę. Inkubować przez 15 (±1) minut. Przemyć szkiełko jak w Etapie 3. Umieścić w maksymalnie trzech kąpielach ze świeŝego buforu, po 3 5 minut kaŝda. ODCZYNNIK AMPLIFIKUJĄCY Uwaga: W celu uzyskania optymalnego odczynu naleŝy w trakcie tego etapu chronić szkiełka przed światłem. Wytrzeć preparat jak poprzednio. Dodać tyle odczynnika amplifikującego, aby zakryć próbkę. Inkubować przez 15 (±1) minut, chroniąc przed światłem. Przemyć preparat jak poprzednio. Umieścić w maksymalnie trzech świeŝych kąpielach z buforu płuczącego, po 3 5 minut kaŝda. PRZECIWCIAŁA SKIEROWANE PRZECIWKO FLUORESCEINIE SKONIUGOWANE Z HRP Wytrzeć preparat jak poprzednio. Dodać tyle odczynnika Anti-Fluorescein-HRP, aby zakryć próbkę. Inkubować przez 15 (±1) minut. Przemyć preparaty jak poprzednio. Umieścić w maksymalnie trzech świeŝych kąpielach z buforu płuczącego, po 3 5 minut kaŝda. PŁYNNY SUBSTRAT-CHROMOGEN DAB Wytrzeć preparat jak poprzednio. Dodać tyle płynnego substratu chromogenu DAB, by przykryć próbkę. Inkubować przez 5 (±1) minut. Przemyć wodą destylowaną lub dejonizowaną. WYKONAĆ BARWIENIE KONTRASTOWE I ZATAPIANIE Tabela programowania aparatu Dako Autostainer na potrzeby systemu CSA II PowyŜsza tabela programowania to szablon protokołu Dako zawierający elementy niezbędne do wykonania procedury CSA II. W przykładzie tym uwzględniono zalecane odczynniki i czasy inkubacji pozwalające na optymalne wykonanie serii odczynów CSA II w aparatach Autostainer (nr kat. S3004) i Autostainer Plus (nr kat. S3800). NaleŜy przygotować szablon protokołu i konfigurację programowania obejmującą te zalecane etapy i czasy inkubacji. W przykładzie uwzględniono przeciwciało pierwotne i obróbkę wstępną. Zastosowanie środka do odmaskowania antygenu jest konieczne tylko w przypadku niektórych przeciwciał. ( ) P04037PL_01/K1497/ s. 6/10
7 Kontrola jakości RóŜnice w metodach obróbki tkanek i procedurach technicznych stosowanych w laboratorium UŜytkownika mogą powodować istotne róŝnice wyników, wymagające regularnego wykonywania wewnętrznej kontroli jakości. Dodatkowe informacje na temat kontroli jakości zawierają pozycje literaturowe nr Tkanka do dodatniej próby kontrolnej Do monitorowania wyników badanych tkanek oraz działania odczynników naleŝy w charakterze kontroli dodatniej stosować tkanki dające potwierdzony odczyn dodatni. JeŜeli nie udaje się potwierdzić dodatniego odczynu w preparatach dodatnich kontroli tkankowych naleŝy uznać, Ŝe wyniki preparatów testowych są niewaŝne. Odczynnik do kontroli ujemnej W celu oceny występowania odczynu nieswoistego i ułatwienia interpretacji swoistego odczynu w miejscach występowania antygenów w miejsce przeciwciał pierwotnych naleŝy stosować odczynnik do kontroli ujemnej. Jeśli do skrawków seryjnych uŝywane są panele przeciwciał, obszary jednego szkiełka dające odczyn ujemny mogą słuŝyć jako kontrola ujemna/wiązania nieswoistego dla innych przeciwciał. Dalsze informacje na temat kontroli dodatnich i ujemnych przedstawiono w dokumencie General Instructions for Immunohistochemical Staining (Ogólne instrukcje wykonywania odczynów immunohistochemicznych). Interpretacja odczynu W pierwszej kolejności naleŝy zbadać próbki kontroli dodatniej, aby upewnić się, Ŝe wszystkie odczynniki działają prawidłowo. Obecność produktu końcowego o zabarwieniu brązowym w miejscu występowania antygenu docelowego wskazuje na reaktywność dodatnią. JeŜeli nie udaje się potwierdzić dodatniego odczynu w preparatach kontroli dodatnich naleŝy uznać, Ŝe wyniki preparatów testowych są niewaŝne. NaleŜy zbadać próbki kontroli ujemnej w celu zweryfikowania swoistego znakowania antygenu docelowego przez przeciwciało pierwotne. Brak swoistego odczynu w próbkach kontroli ujemnej potwierdzi swoistość przeciwciała pierwotnego uŝywanego w badaniu. Ewentualny odczyn nieswoisty będzie miał postać kropek lub rozlanego zabarwienia. Wysoka czułość tego systemu wynika z jego wysokiego poziomu amplifikacji; amplifikacji ulegną jednak równieŝ wszelkie nieswoiste odczyny tła. Dlatego zaleca się uŝycie odczynników do kontroli ujemnej z kontrolnymi i badanymi próbkami, co pomoŝe w interpretacji właściwego odczynu (bardziej szczegółowe omówienie odczynów nieswoistych zamieszczono w punkcie Ograniczenia). W preparatach tkanek poddawanych nadmiernemu utrwalaniu w formalinie moŝe niekiedy występować odczyn w obrębie tkanki łącznej. Interpretację odczynu naleŝy prowadzić w oparciu o komórki nieuszkodzone Komórki zmienione martwiczo lub uszkodzone często wykazują nieswoisty odczyn. Wiązanie odczynników w skrawkach tkankowych na drodze mechanizmów innych niŝ immunologiczne moŝe być przyczyną wyników fałszywie dodatnich. Ograniczenia metody Aby uzyskać optymalne nasilenie odczynu, naleŝy chronić szkiełka przed światłem podczas inkubacji z odczynnikiem amplifikującym (Etap 5). Trawienie proteolityczne moŝe w CSA II System wywołać silny odczyn tła i dlatego nie jest zalecane. W celu ograniczenia nieswoistego odczynu tła zaleca się, by przed kaŝdym etapem protokołu CSA II System płukać próbki roztworem płuczącym (zob. Przygotowanie odczynników) i inkubować przez pięć minut w temperaturze pokojowej w maksymalnie trzech świeŝych kąpielach buforu płuczącego. Endogenna immunoglobulina obecna w ludzkich próbkach tkankowych moŝe wykazywać róŝne poziomy reaktywności krzyŝowej z wtórnymi przeciwciałami przeciwko immunoglobulinie. Stosowane w tym systemie wtórne przeciwciała skierowane przeciwko immunoglobulinie mysiej skoniugowane z HRP zostały poddane absorpcji w surowicy ludzkiej w celu ograniczenia reaktywności krzyŝowej. Jednak z uwagi na duŝą czułość tego systemu w niektórych próbkach nadal moŝe być wykrywana reaktywność krzyŝowa z immunoglobuliną endogenną. Odczyn tła pochodzący od immunoglobuliny endogennej jest najlepiej rozpoznawalny jako barwienie kontroli ujemnej wokół naczyń krwionośnych i limfatycznych, w tkance łącznej i w pozanaczyniowych przestrzeniach tkankowych. Niektóre typy nabłonka, zwłaszcza w układzie trawiennym, równieŝ mogą zawierać immunoglobulinę endogenną. Odczyn pochodzący od immunoglobuliny endogennej moŝe być wzmacniany przez niektóre metody odmaskowywania antygenów. Dlatego w sytuacjach, w których podejrzewa się występowanie immunoglobuliny endogennej, do prawidłowej interpretacji wyników dodatnich niezbędne jest zastosowanie odpowiednich odczynników i tkanek kontroli ujemnej. Endogenna aktywność peroksydazy lub o podobnym charakterze moŝe występować w hemoproteinach np. hemoglobinie, mioglobinie, cytochromach i katalazie oraz w niektórych leukocytach. 19,20 Tego rodzaju aktywność moŝna wyeliminować, przed zastosowaniem przeciwciał pierwotnych przez 5 minut inkubując próbki z odczynnikiem blokującym aktywność peroksydazy (Etap 1 protokołu CSA II) System. Tkanki zawierające antygen powierzchniowy wirusa zapalenia wątroby typu B (HbsAg) mogą dawać odczyn nieswoisty z peroksydazą chrzanową. 21 ( ) P04037PL_01/K1497/ s. 7/10
8 Rozwiązywanie problemów procedura zautomatyzowana Problem Prawdopodobna przyczyna Zalecane postępowanie 1. Brak barwienia 1a. Błąd programowania. 1a. Sprawdzić sposób uŝycia odczynników. preparatów. Odczynniki nie są uŝywane we 2. Słabe barwienie preparatów. 3. Nadmierne barwienie tła w preparatach. 4. Tkanka oddziela się od szkiełka. właściwej kolejności. 1b. Fiolki z odczynnikami nie zostały wprowadzone we właściwe połoŝenia w statywach odczynników. 1c. Niedostateczna ilość odczynników w fiolce. 1b. Sprawdzić mapę odczynników zweryfikować odpowiednie połoŝenie fiolek z odczynnikami. 1c. Przed rozpoczęciem serii, naleŝy dopilnować, by w fiolce znajdowała się odpowiednia ilość odczynników. Wymagane objętości przedstawiono w Mapie odczynników. 1d. UŜyć świeŝego buforu niezawierającego azydku. 2a. Sprawdzić zalecany czas inkubacji. 1d. Azydek sodu obecny w kąpieli z buforem. 2a. Preparaty nie są inkubowane wystarczająco długo z przeciwciałami lub substratem. 2b. Badany antygen wymaga 2b. Przeprowadzić odmaskowanie antygenów. odmaskowania. 2c. Próbki były wystawione na 2c. Chronić próbki przed światłem podczas działanie światła podczas inkubacji z odczynnikiem amplifikującym. inkubacji z odczynnikiem amplifikującym. 2d. Za niskie stęŝenie przeciwciał. 2d. Powtórzyć miareczkowanie roztworu przeciwciał. 3a. Próbki o duŝym stęŝeniu 3a. Porównać badaną tkankę z tkanką do endogennej immunoglobuliny. kontroli ujemnej w celu określenia róŝnic. 3b. W próbkach występuje duŝa aktywność endogennej peroksydazy. 3b. WydłuŜyć czas inkubacji z nadtlenkiem wodoru (Etap 1). 3c. Niecałkowicie usunięta parafina. 3c. Zastosować świeŝą kąpiel z ksylenu lub toluenu. W przypadku jednoczesnego wykonywania odczynu kilku preparatów, druga kąpiel z ksylenu powinna zawierać świeŝy ksylen. 3d. Preparaty nie są odpowiednio przemywane. 3e. Wysychanie skrawków podczas wykonywania odczynu. 3f. Dochodzi do wysuszenia szkiełek podczas wkładania do aparatu Dako Autostainer. 3g. Nieswoiste wiązanie odczynników do skrawka tkanki. 3h. Nieswoiste wiązanie przeciwciał pierwotnych z próbką. 3i. Do termicznego odmaskowania antygenu przed barwieniem uŝyto roztworu o wysokim ph. 3j. Przed wykonaniem odczynu przeprowadzono trawienie proteolityczne. 4a. Zastosowano niewłaściwe szkiełka mikroskopowe. 3d. Dopilnować, by aparat Dako Autostainer został odpowiednio przygotowany do serii. Dopilnować, aby dostępna była wystarczająca ilość buforu, wystarczająca na przeprowadzenie całej serii. Uwzględnić pomocnicze płukania roztworem TBST (nr kat. S3306) zgodnie z instrukcją. 3e. Dopilnować, by na szkiełka były nanoszone odpowiednie objętości odczynnika. NaleŜy dopilnować, by podczas pracy aparatu Dako Autostainer, pokrywa była zamknięta, a aparat nie był naraŝony na działanie nadmiernie wysokich temperatur lub przeciągów. 3f. NaleŜy dopilnować, by szkiełka pozostały zwilŝone buforem podczas wkładania do aparatu i przed rozpoczęciem badania serii. 3g. WydłuŜyć czas inkubacji z odczynnikiem blokującym peroksydazę (Etap 2). 3h. Rozcieńczyć przeciwciała pierwotne w roztworze zawierającym białko nośnikowe. Zalecany jest roztwór Antibody Diluent with Background Reducing Components (nr kat. S3022). 3i. Do odmaskowania uŝyć zmodyfikowanego buforu cytrynianowego (ph 6,1). 3j. Unikać trawienia proteolitycznego próbek badanych tym systemem. 4a. Stosować szkiełka elektrostatyczne (SuperFrost Plus) lub silanilizowane, Dako Silanized Slides (nr kat. S3003). ( ) P04037PL_01/K1497/ s. 8/10
9 Rozwiązywanie problemów procedura ręczna Problem Prawdopodobna przyczyna Zalecane postępowanie 1. Brak barwienia 1a. Odczynniki nie są uŝywane we 1a. Sprawdzić sposób uŝycia odczynników. preparatów. właściwej kolejności. 1b. Azydek sodu obecny w kąpieli z buforem. 1b. UŜyć świeŝego buforu niezawierającego azydku. 2. Słabe barwienie preparatów. 2a. Skrawki zawierają zbyt duŝo roztworu po kąpieli płuczącej. 2a. OstroŜnie usunąć nadmiar roztworu przed wytarciem szkiełka. 2b. Preparaty nie są inkubowane 2b. Sprawdzić zalecany czas inkubacji. wystarczająco długo z przeciwciałami lub substratem. 2c. Badany antygen wymaga 2c. Przeprowadzić odmaskowanie antygenów. odmaskowania. 2d. Próbki były wystawione na działanie światła podczas 2d. Chronić próbki przed światłem podczas inkubacji z odczynnikiem amplifikującym. inkubacji z odczynnikiem amplifikującym. 2e. Za niskie stęŝenie przeciwciał. 2e. Powtórzyć miareczkowanie roztworu 3. Nadmierne barwienie tła w preparatach. 4. Tkanka oddziela się od szkiełka. 5. Nasilenie odczynu zmienne pomiędzy seriami. 3a. Próbki o duŝym stęŝeniu endogennej immunoglobuliny. 3b. W próbkach występuje duŝa aktywność endogennej peroksydazy. przeciwciał. 3a. Porównać badaną tkankę z tkanką do kontroli ujemnej w celu określenia róŝnic. 3b. WydłuŜyć czas inkubacji z nadtlenkiem wodoru (Etap 1). 3c. Niecałkowicie usunięta parafina. 3c. Zastosować świeŝą kąpiel z ksylenu lub toluenu. W przypadku jednoczesnego wykonywania odczynu kilku preparatów, druga kąpiel z ksylenu powinna zawierać świeŝy ksylen. 3d. Preparaty nie są odpowiednio przemywane. 3e. Szybsza niŝ zwykle reakcja substratu-chromogenu ze względu na nadmierną temperaturę w pomieszczeniu. 3f. Wysychanie skrawków podczas wykonywania odczynu. 3g. Nieswoiste wiązanie odczynników do skrawka tkanki. 3h. Nieswoiste wiązanie przeciwciał pierwotnych z próbką. 3i. Do termicznego odmaskowania antygenu przed barwieniem uŝyto roztworu o wysokim ph. 3j. Przed wykonaniem odczynu przeprowadzono trawienie proteolityczne. 4a. Zastosowano niewłaściwe szkiełka mikroskopowe. 5a. Zmiany temperatury w pomieszczeniu. 3d. Zastosować świeŝe roztwory w kąpielach z buforem i butelkach z roztworem płuczącym. Zalecany jest roztwór TBST. Przed kaŝdym etapem protokołu inkubować skrawki przez 3 5 minut w maksymalnie trzech kąpielach ze świeŝego TBST. 3e. Stosować krótszy czas inkubacji w roztworze barwiącym chromogensubstrat. 3f. Stosować komorę nawilŝającą. Wycierać tylko trzy do czterech szkiełek w czasie pomiędzy nanoszeniem odczynnika. 3g. WydłuŜyć czas inkubacji z odczynnikiem blokującym peroksydazę (Etap 2). 3h. Rozcieńczyć przeciwciała pierwotne w roztworze zawierającym białko stabilizujące. Zalecany jest roztwór Antibody Diluent with Background Reducing Components (nr kat. S3022). 3i. Do odmaskowania uŝyć zmodyfikowanego buforu cytrynianowego (ph 6,1). 3j. Unikać trawienia proteolitycznego próbek badanych tym systemem. 4a. Stosować szkiełka elektrostatyczne (SuperFrost Plus) lub silanilizowane, Dako Silanized Slides (nr kat. S3003). 5a. Ograniczyć zakres zmian temperatury w pomieszczeniu. 5b. Nieznaczne róŝnice w czasie 5b. Stosować zawsze takie same czasy inkubacji z odczynnikami. inkubacji. 5c. RóŜne liczby i czasy inkubacji 5c. W kaŝdej serii postępować dokładnie kąpieli w buforze płuczącym. w takiego samego protokołu. UWAGA: NaleŜy zapoznać się z rozdziałem dot. rozwiązywania problemów w podręczniku Handbook Immunochemical Staining Methods, 3rd Edition, 14 Atlas of Immunohistology 21 lub Immunoperoxidase Techniques, A Practical Approach to Tumor Diagnosis. 23 W razie stwierdzenia niezwykłego odczynu naleŝy skontaktować się z działem wsparcia technicznego firmy Dako. ( ) P04037PL_01/K1497/ s. 9/10
10 Piśmiennictwo 1. Bobrow MN, Harris TD, Shaughnessy KJ, Litt GJ. Catalyzed reporter deposition, a novel method of signal amplification. Application to immunoassays. J Immunol Methods 1989; 125: Bobrow MN, Shaughnessy KJ, Litt GJ. Catalyzed reporter deposition, a novel method of signal amplification. II. Application to membrane immunoassays. J Immunol Methods 1991; 137: Van Gijlswijk RPM, Zijlmans HJMAA, Wiegant J, Bobrow MN, Erickson TJ, Adler KE, Tanke HJ, Raap AK. Fluorochrome-labeled tyramides: use in immunocytochemistry and fluorescence in situ hybridization. J Histochem Cytochem 1997; 45(3): Von Wasielewski R, Mengel M, Gignac S, Wilkens L, Werner M, Georgii A. Tyramine amplification technique in routine immunohistochemistry. J Histochem Cytochem 1997; 45(11): Bobrow MN, Litt GJ, Shaughnessy KJ, Mayer PC, Conlon J. The use of catalyzed reporter deposition as a means of signal amplification in a variety of formats. J Immunol Methods 1992; 150: Wood GS and Warnke R. Suppression of endogenous avidin-biotin activity in tissues and its relevance to biotin-avidin detection systems. J Histochem Cytochem 1981; 29(10): Banerjee D and Pettit S. Endogenous avidin-binding activity in human lymphoid tissue. J Clin Pathol 1984; 37: Department of Health, Education and Welfare, National Institute for Occupational Safety and Health, Rockville, MD. Procedures for the decontamination of plumbing systems containing copper and/or lead azides. DHHS (NIOSH) Publ. No , Current 13. August 16, National Committee for Clinical Laboratory Standards. Protection of laboratory workers from instrument biohazards and infectious disease transmitted by blood, body fluids and tissue; approved guideline. Villanova, PA. 1997; Order Code M29-A 10. Kiernan JA. Histological and histochemical methods: Theory and practice. New York: Pergamon Press 1981; Boenisch T. In: Naish SJ, ed. Handbook immunochemical staining methods. Carpinteria: Dako Nadji M and Morales AR. Immunoperoxidase: I. The technique and its pitfalls. Lab Med 1983; 14: Banks PM. Diagnostic applications of an immunoperoxidase method in hematopathology. J Histochem Cytochem 1979; 27: Culling CFA, Reid PE, Sinnott NM. The effect of various fixatives and trypsin digestion upon the staining of routine paraffin-embedded sections by the peroxidase-antiperoxidase and immunofluorescent technique. J Histotech 1980; 3: Carson FL (ed). Histotechnology: A self-instructional text. Chicago: ASCP Press 1990: Elias JM, Gown AM, Nakamura RM, Wilbur DC, Herman GE, Jaffe ES, Battifora H, Brigati DJ. Special report: Quality control in immunohistochemistry. Amer J Clin Pathol 1989; 92: National Committee for Clinical Laboratory Standard. Internal quality control testing: principles and definitions; approved guideline. Villanova, PA 1991; Order code C24-A:4 18. Herman GE and Elfont EA. The taming of immunohistochemistry: The new era of quality control. Biotech & Histochem 1991; 66: Escribano LM, Gabriel LC, Villa E, Navarro JL. Endogenous peroxidase activity in human cutaneous and adenoidal mast cells. J Histochem Cytochem 1987; 35: Elias JM. Immunohistopathology: A practical approach to diagnosis. Chicago: Amer Soc Clin Pathol Press 1990; Omata M, Liew C-T, Ashcavai M, Peters RL. Nonimmunologic binding of horseradish peroxidase to hepatitis B surface antigen: A possible source of error in immunohistochemistry. Amer J Pathol 1980; 73: Tubbs RR, Gephardt GN, Petras RE. Atlas of immunohistology. Chicago: Amer Soc Clin Pathol Press Nadji M and Morales AR. Immunoperoxidase techniques, a practical approach to tumor diagnosis. Chicago: Amer Soc Clin Pathol Press Centers for Disease Control Manual Guide Safety Management, No. CDC-22, Atlanta, GA. Decontamination of laboratory sink drains to remove azide salts. April 30, 1976 Edition 07/15 ( ) P04037PL_01/K1497/ s. 10/10
Dako REAL Detection System, Peroxidase/DAB+, Rabbit/Mouse
 Dako REAL Detection System, Peroxidase/DAB+, Rabbit/Mouse Nr kat. K5001 Wydanie 6. Do uŝytku z automatami firmy Dako do wykonywania odczynów immunohistochemicznych. Zestaw zawiera odczynniki wystarczające
Dako REAL Detection System, Peroxidase/DAB+, Rabbit/Mouse Nr kat. K5001 Wydanie 6. Do uŝytku z automatami firmy Dako do wykonywania odczynów immunohistochemicznych. Zestaw zawiera odczynniki wystarczające
0,3% nadtlenek wodoru z azydkiem sodu i lewamizolem.
 Dako EnVision + Dual Link System-HRP (DAB+) Nr kat. K4065 Przeznaczenie Do stosowania w diagnostyce in vitro. PoniŜsze instrukcje dotyczą Dako EnVision+ Dual Link System-HRP (DAB+). Opisywany system jest
Dako EnVision + Dual Link System-HRP (DAB+) Nr kat. K4065 Przeznaczenie Do stosowania w diagnostyce in vitro. PoniŜsze instrukcje dotyczą Dako EnVision+ Dual Link System-HRP (DAB+). Opisywany system jest
Dako LSAB2 System-HRP. Nr kat. K ml Nr kat. K ml Nr kat. K ml. Przeznaczenie Do stosowania w diagnostyce in vitro.
 Dako LSAB2 System-HRP Nr kat. K0672 15 ml Nr kat. K0673 15 ml Nr kat. K0675 110 ml Przeznaczenie Do stosowania w diagnostyce in vitro. Instrukcje dotyczą uniwersalnego systemu Dako Labelled Streptavidin-Biotin2
Dako LSAB2 System-HRP Nr kat. K0672 15 ml Nr kat. K0673 15 ml Nr kat. K0675 110 ml Przeznaczenie Do stosowania w diagnostyce in vitro. Instrukcje dotyczą uniwersalnego systemu Dako Labelled Streptavidin-Biotin2
EnVision FLEX+, Mouse, High ph, (Link)
 EnVision FLEX+, Mouse, High ph, (Link) Nr kat. K8002 piąta edycja Zestaw zawiera odczynniki wystarczające do wykonania 400-600 testów. Do aparatów Autostainer Link. Odczynniki opcjonalne Nr kat. Nazwa
EnVision FLEX+, Mouse, High ph, (Link) Nr kat. K8002 piąta edycja Zestaw zawiera odczynniki wystarczające do wykonania 400-600 testów. Do aparatów Autostainer Link. Odczynniki opcjonalne Nr kat. Nazwa
EnVision FLEX Mini Kit, High ph, (Dako Autostainer/Autostainer Plus)
 EnVision FLEX Mini Kit, High ph, (Dako Autostainer/Autostainer Plus) Nr kat. K8024 Wydanie 3. Zestaw zawiera odczynniki wystarczające do wykonania 125-190 testów. Do aparatu Dako Autostainer/Autostainer
EnVision FLEX Mini Kit, High ph, (Dako Autostainer/Autostainer Plus) Nr kat. K8024 Wydanie 3. Zestaw zawiera odczynniki wystarczające do wykonania 125-190 testów. Do aparatu Dako Autostainer/Autostainer
EnVision DuoFLEX Doublestain System, (Link)
 EnVision DuoFLEX Doublestain System, (Link) Nr kat. SK110 Wydanie 06/15 Zestaw zawiera odczynniki wystarczające do wykonania 100-150 testów. Dla urządzeń Autostainer Link. (127835-001) P04070PL_01/SK110/2015.06
EnVision DuoFLEX Doublestain System, (Link) Nr kat. SK110 Wydanie 06/15 Zestaw zawiera odczynniki wystarczające do wykonania 100-150 testów. Dla urządzeń Autostainer Link. (127835-001) P04070PL_01/SK110/2015.06
Dako EnVision+ System-HRP Znakowany polimer Przeciwmysi. Kod K ml Kod K ml. Przeznaczenie. Do badań diagnostycznych in vitro.
 Dako EnVision+ System-HRP Znakowany polimer Przeciwmysi Kod K4000 115 ml Kod K4001 110 ml Przeznaczenie Do badań diagnostycznych in vitro. Wskazówki te dotyczą EnVision+ System-HRP firmy Dako. Produkt
Dako EnVision+ System-HRP Znakowany polimer Przeciwmysi Kod K4000 115 ml Kod K4001 110 ml Przeznaczenie Do badań diagnostycznych in vitro. Wskazówki te dotyczą EnVision+ System-HRP firmy Dako. Produkt
Catalyzed Signal Amplification (CSA) System Nr katalogowy K1500 Licencja ograniczonego ytkowania Przeznaczenie
 Catalyzed Signal Amplification (CSA) System Do uŝycia z pierwszymi mysimi przeciwciałami Nr katalogowy K1500 15 ml Licencja ograniczonego uŝytkowania Niniejszy produkt moŝe być rozpowszechniany i sprzedawany
Catalyzed Signal Amplification (CSA) System Do uŝycia z pierwszymi mysimi przeciwciałami Nr katalogowy K1500 15 ml Licencja ograniczonego uŝytkowania Niniejszy produkt moŝe być rozpowszechniany i sprzedawany
EnVision FLEX, High ph (Dako Omnis)
 EnVision FLEX, High ph (Dako Omnis) Nr kat. GV800 Wydanie 2. Zestaw zawiera odczynniki wystarczające do wykonania 600 testów. Dla urządzeń Dako Omnis. Odczynniki opcjonalne: Nr kat. Nazwa produktu Testy
EnVision FLEX, High ph (Dako Omnis) Nr kat. GV800 Wydanie 2. Zestaw zawiera odczynniki wystarczające do wykonania 600 testów. Dla urządzeń Dako Omnis. Odczynniki opcjonalne: Nr kat. Nazwa produktu Testy
Dako EnVision+ System- HRP Labelled Polymer Anti-Rabbit. Nr katalogowy K ml Nr katalogowy K ml. Przeznaczenie
 Dako EnVision+ System- HRP Labelled Polymer Anti-Rabbit Nr katalogowy K4002 15 ml Nr katalogowy K4003 110 ml Przeznaczenie Do badań diagnostycznych in vitro. Niniejsze instrukcje odnoszą się do zestawu
Dako EnVision+ System- HRP Labelled Polymer Anti-Rabbit Nr katalogowy K4002 15 ml Nr katalogowy K4003 110 ml Przeznaczenie Do badań diagnostycznych in vitro. Niniejsze instrukcje odnoszą się do zestawu
Zawiadomienie o wyborze oferty zostanie zamieszczone na naszej stronie internetowej oraz rozesłane mailowo do Oferentów w dniu r.
 ZAPYTANIE OFERTOWE ROCZNE nr 07/2017/M/CELONKO z dnia 15.02.2017 NA MATERIAŁY ZUŻYWALNE I ODCZYNNIKI DLA FIRMY CELON PHARMA SA Z SIEDZIBĄ W Kiełpinie w ramach programu STRATEGMED II, projektu pod nazwą
ZAPYTANIE OFERTOWE ROCZNE nr 07/2017/M/CELONKO z dnia 15.02.2017 NA MATERIAŁY ZUŻYWALNE I ODCZYNNIKI DLA FIRMY CELON PHARMA SA Z SIEDZIBĄ W Kiełpinie w ramach programu STRATEGMED II, projektu pod nazwą
Dako EnVision+ System-HRP (Dwuaminobenzydyna) Do stosowania z podstawowymi przeciwciałami mysimi
 Dako EnVision+ System-HRP (Dwuaminobenzydyna) Do stosowania z podstawowymi przeciwciałami mysimi Kod K4006 15 ml Kod K4007 110 ml Przeznaczenie Do badań diagnostycznych in vitro. Wskazówki te dotyczą EnVision
Dako EnVision+ System-HRP (Dwuaminobenzydyna) Do stosowania z podstawowymi przeciwciałami mysimi Kod K4006 15 ml Kod K4007 110 ml Przeznaczenie Do badań diagnostycznych in vitro. Wskazówki te dotyczą EnVision
Dako EnVision+ System-HRP (AEC) Do stosowania z podstawowymi przeciwciałami mysimi. Kod K ml Kod K ml
 Dako EnVision+ System-HRP (AEC) Do stosowania z podstawowymi przeciwciałami mysimi Kod K4004 115 ml Kod K4005 110 ml Przeznaczenie Do badań diagnostycznych in vitro. Wskazówki te dotyczą EnVision+ System-
Dako EnVision+ System-HRP (AEC) Do stosowania z podstawowymi przeciwciałami mysimi Kod K4004 115 ml Kod K4005 110 ml Przeznaczenie Do badań diagnostycznych in vitro. Wskazówki te dotyczą EnVision+ System-
Dako EnVision+ System-HRP (Dwuaminobenzydyna) Do stosowania z podstawowymi przeciwciałami króliczymi
 Dako EnVision+ System-HRP (Dwuaminobenzydyna) Do stosowania z podstawowymi przeciwciałami króliczymi Kod K4010 15 ml Kod K4011 110 ml Przeznaczenie Do badań diagnostycznych in vitro. Wskazówki te dotyczą
Dako EnVision+ System-HRP (Dwuaminobenzydyna) Do stosowania z podstawowymi przeciwciałami króliczymi Kod K4010 15 ml Kod K4011 110 ml Przeznaczenie Do badań diagnostycznych in vitro. Wskazówki te dotyczą
Dako DuoCISH. Nr kat. SK108. Wydanie 2.
 Dako DuoCISH Nr kat. SK108 Wydanie 2. Zestaw zawiera odczynniki wystarczające do wykonania 20 testów. Do uŝytku ręcznego lub zautomatyzowanego w aparatach Dako Autostainer. (115912-002) SK108/PL/ULH 20090810
Dako DuoCISH Nr kat. SK108 Wydanie 2. Zestaw zawiera odczynniki wystarczające do wykonania 20 testów. Do uŝytku ręcznego lub zautomatyzowanego w aparatach Dako Autostainer. (115912-002) SK108/PL/ULH 20090810
ZAMAWIAJĄCY: Nazwa: Celon Pharma SA ul. Ogrodowa 2a, Kiełpin
 ZAPYTANIE OFERTOWE ROCZNE nr 07/2017/M/CELONKO z dnia 15.02.2017r. na odczynniki i materiały zużywalne dla firmy CELON PHARMA SA z siedzibą w Kiełpinie. W ramach programu Opracowanie nowoczesnych biomarkerów
ZAPYTANIE OFERTOWE ROCZNE nr 07/2017/M/CELONKO z dnia 15.02.2017r. na odczynniki i materiały zużywalne dla firmy CELON PHARMA SA z siedzibą w Kiełpinie. W ramach programu Opracowanie nowoczesnych biomarkerów
HercepTest for Automated Link Platforms
 HercepTest for Automated Link Platforms Nr kat. SK001 Wydanie 22 (129287-001) P04456PL_01_SK00121-2/2016.05 s. 1/40 Spis treści Strona Przeznaczenie...3 Streszczenie i informacje ogólne - sutek...4 Zasady
HercepTest for Automated Link Platforms Nr kat. SK001 Wydanie 22 (129287-001) P04456PL_01_SK00121-2/2016.05 s. 1/40 Spis treści Strona Przeznaczenie...3 Streszczenie i informacje ogólne - sutek...4 Zasady
HercepTest Nr kat. K5204
 HercepTest Nr kat. K5204 Wydanie 21 Do barwienia immunocytochemicznego. Zestaw na 35 testów (70 szkiełek). (129260-001) P04454PL_01/K520421-2/2016.05 s. 1/56 Spis treści Strona Przeznaczenie... 4 Streszczenie
HercepTest Nr kat. K5204 Wydanie 21 Do barwienia immunocytochemicznego. Zestaw na 35 testów (70 szkiełek). (129260-001) P04454PL_01/K520421-2/2016.05 s. 1/56 Spis treści Strona Przeznaczenie... 4 Streszczenie
HercepTest for the Dako Autostainer
 HercepTest for the Dako Autostainer Nr kat. K5207 Wydanie 19 Do barwienia immunocytochemicznego. Zestaw na 50 testów (100 szkiełek). (128391-001) P04087PL_K520721-2/2015.05 s. 1/53 Spis treści Strona Przeznaczenie
HercepTest for the Dako Autostainer Nr kat. K5207 Wydanie 19 Do barwienia immunocytochemicznego. Zestaw na 50 testów (100 szkiełek). (128391-001) P04087PL_K520721-2/2015.05 s. 1/53 Spis treści Strona Przeznaczenie
PODSTAWY IMMUNOHISTOCHEMII. Determinanty antygenowe (epitopy) Surowice. Antygeny. Otrzymywanie przeciwciał poliklonalnych. poliwalentne monowalentne
 PODSTAWY IMMUNOHISTOCHEMII Antygeny substancje obce dla organizmu, najczęściej o strukturze wielkocząsteczkowej zdolne do wywołania odpowiedzi immunologicznej (tu: produkcji przeciwciał) - IMMUNOGENNOŚĆ
PODSTAWY IMMUNOHISTOCHEMII Antygeny substancje obce dla organizmu, najczęściej o strukturze wielkocząsteczkowej zdolne do wywołania odpowiedzi immunologicznej (tu: produkcji przeciwciał) - IMMUNOGENNOŚĆ
Streptavidin Alkaline Phosphatase
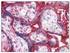 Dako LSAB 2 System-AP Code K0674 110 ml Code K0676 15 ml Cel uŝycia Tylko do diagnostyki in vitro. Instrukcje przedstawione poniŝej dotyczą systemu wizualizacji Dako LSAB 2 System, Alkaline Phosphatase
Dako LSAB 2 System-AP Code K0674 110 ml Code K0676 15 ml Cel uŝycia Tylko do diagnostyki in vitro. Instrukcje przedstawione poniŝej dotyczą systemu wizualizacji Dako LSAB 2 System, Alkaline Phosphatase
EGFR pharmdx. Nr kat. K testów metodą manualną Wydanie 05/2015. Przeznaczenie Do stosowania w diagnostyce in vitro.
 EGFR pharmdx Nr kat. K1492 35 testów metodą manualną Wydanie 05/2015 Przeznaczenie Do stosowania w diagnostyce in vitro. Zestaw EGFR pharmdx jest przeznaczony do jakościowych testów immunohistochemicznych
EGFR pharmdx Nr kat. K1492 35 testów metodą manualną Wydanie 05/2015 Przeznaczenie Do stosowania w diagnostyce in vitro. Zestaw EGFR pharmdx jest przeznaczony do jakościowych testów immunohistochemicznych
Przeciwciała królicze w zestawie c-kit pharmdx pozwalają na swoistą detekcję białka c-kit w komórkach wykazujących ekspresję antygenu CD117.
 c-kit pharmdx Nr kat. K1906 25 testów metodą manualną Przeznaczenie Do stosowania w diagnostyce in vitro. Zestaw c-kit pharmdx jest przeznaczony do jakościowych testów immunohistochemicznych (IHC) w celu
c-kit pharmdx Nr kat. K1906 25 testów metodą manualną Przeznaczenie Do stosowania w diagnostyce in vitro. Zestaw c-kit pharmdx jest przeznaczony do jakościowych testów immunohistochemicznych (IHC) w celu
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA)
 Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
Karta charakterystyki (91/155/EWG) DERUSTIT Środek do czyszczenia cynku 1680
 Karta charakterystyki (91/155/EWG) DERUSTIT Środek do czyszczenia cynku 1680 1. Identyfikacja substancji/ dostawca- producent Informacja o produkcie Nazwa handlowa: DERUSTIT Środek do czyszczenia cynku
Karta charakterystyki (91/155/EWG) DERUSTIT Środek do czyszczenia cynku 1680 1. Identyfikacja substancji/ dostawca- producent Informacja o produkcie Nazwa handlowa: DERUSTIT Środek do czyszczenia cynku
Histology FISH Accessory Kit Nr kat. K5799
 Histology FISH Accessory Kit Nr kat. K5799 Wydanie 6 Stosować do hybrydyzacji fluorescencyjnej in situ (technika FISH) skrawków utrwalanych w formalinie i zatapianych w parafinie. Zestaw zawiera odczynniki
Histology FISH Accessory Kit Nr kat. K5799 Wydanie 6 Stosować do hybrydyzacji fluorescencyjnej in situ (technika FISH) skrawków utrwalanych w formalinie i zatapianych w parafinie. Zestaw zawiera odczynniki
Artisan Jones Basement Membrane H&E Stain Kit. Nr kat. AR480. Przeznaczenie Do stosowania w diagnostyce in vitro.
 Artisan Jones Basement Membrane H&E Stain Kit Nr kat. AR480 Przeznaczenie Do stosowania w diagnostyce in vitro. Zestaw Jones Basement Membrane H&E Stain Kit jest przeznaczony do zastosowań laboratoryjnych
Artisan Jones Basement Membrane H&E Stain Kit Nr kat. AR480 Przeznaczenie Do stosowania w diagnostyce in vitro. Zestaw Jones Basement Membrane H&E Stain Kit jest przeznaczony do zastosowań laboratoryjnych
KARTA CHARAKTERYSTYKI
 Zgodnie z Dz.U. Nr 140 poz. 1171 z 2002r. Dystrybutor: Data aktualizacji: 01.12.2004 METTLER-TOLEDO Sp. z o.o. ul. Poleczki 21 02-822 WARSZAWA tel. (22) 545 06 80 fax. (22) 545 06 88 1. Identyfikacja substancji
Zgodnie z Dz.U. Nr 140 poz. 1171 z 2002r. Dystrybutor: Data aktualizacji: 01.12.2004 METTLER-TOLEDO Sp. z o.o. ul. Poleczki 21 02-822 WARSZAWA tel. (22) 545 06 80 fax. (22) 545 06 88 1. Identyfikacja substancji
INSTRUKCJA STOSOWANIA
 Strona 1 z 6 INSTRUKCJA STOSOWANIA Zawiesiny pasożytów w formalinie PRZEZNACZENIE Zawiesiny pasożytów oferowane przez Microbiologics przeznaczone są do programów zapewnienia jakości tam, gdzie do przeprowadzenia
Strona 1 z 6 INSTRUKCJA STOSOWANIA Zawiesiny pasożytów w formalinie PRZEZNACZENIE Zawiesiny pasożytów oferowane przez Microbiologics przeznaczone są do programów zapewnienia jakości tam, gdzie do przeprowadzenia
FLEX Monoclonal Rabbit Anti-Human Estrogen Receptor α Klon EP1 Gotowy do uŝycia (Dako Autostainer/Autostainer Plus) Nr kat. IS084.
 FLEX Monoclonal Rabbit Anti-Human Estrogen Receptor α Klon EP1 Gotowy do uŝycia (Dako Autostainer/Autostainer Plus) Nr kat. IS084 Przeznaczenie Synonimy antygenu Podsumowanie i wyjaśnienie Odczynnik dostarczony
FLEX Monoclonal Rabbit Anti-Human Estrogen Receptor α Klon EP1 Gotowy do uŝycia (Dako Autostainer/Autostainer Plus) Nr kat. IS084 Przeznaczenie Synonimy antygenu Podsumowanie i wyjaśnienie Odczynnik dostarczony
EGFR pharmdx. Nr kat. K1494 50 testów do stosowania w aparacie Dako Autostainer Wydanie 9/27/2006. Przeznaczenie Do stosowania w diagnostyce in vitro.
 1 EGFR pharmdx Nr kat. K1494 50 testów do stosowania w aparacie Dako Autostainer Wydanie 9/27/2006 Przeznaczenie Do stosowania w diagnostyce in vitro. Zestaw EGFR pharmdx jest przeznaczony do jakościowych
1 EGFR pharmdx Nr kat. K1494 50 testów do stosowania w aparacie Dako Autostainer Wydanie 9/27/2006 Przeznaczenie Do stosowania w diagnostyce in vitro. Zestaw EGFR pharmdx jest przeznaczony do jakościowych
MATERIAŁY SZKOLENIOWE DLA ZAKŁADÓW HIGIENY WETERYNARYJNEJ W ZAKRESIE LABORATORYJNEJ DIAGNOSTYKI AFRYKAŃSKIEGO POMORU ŚWIŃ
 MATERIAŁY SZKOLENIOWE DLA ZAKŁADÓW HIGIENY WETERYNARYJNEJ W ZAKRESIE LABORATORYJNEJ DIAGNOSTYKI AFRYKAŃSKIEGO POMORU ŚWIŃ Puławy 2013 Opracowanie: Prof. dr hab. Iwona Markowska-Daniel, mgr inż. Kinga Urbaniak,
MATERIAŁY SZKOLENIOWE DLA ZAKŁADÓW HIGIENY WETERYNARYJNEJ W ZAKRESIE LABORATORYJNEJ DIAGNOSTYKI AFRYKAŃSKIEGO POMORU ŚWIŃ Puławy 2013 Opracowanie: Prof. dr hab. Iwona Markowska-Daniel, mgr inż. Kinga Urbaniak,
Artisan Reticulin-Nuclear Fast Red Stain Kit. Nr kat. AR179. Przeznaczenie Do stosowania w diagnostyce in vitro.
 Artisan Reticulin-Nuclear Fast Red Stain Kit Nr kat. AR179 Przeznaczenie Do stosowania w diagnostyce in vitro. Zestaw Reticulin-Nuclear Fast Red Stain Kit jest przeznaczony do zastosowań laboratoryjnych
Artisan Reticulin-Nuclear Fast Red Stain Kit Nr kat. AR179 Przeznaczenie Do stosowania w diagnostyce in vitro. Zestaw Reticulin-Nuclear Fast Red Stain Kit jest przeznaczony do zastosowań laboratoryjnych
data ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1
 Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1 Cel: Wyznaczanie klirensu endogennej kreatyniny. Miarą zdolności nerek do usuwania i wydalania
Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1 Cel: Wyznaczanie klirensu endogennej kreatyniny. Miarą zdolności nerek do usuwania i wydalania
INSTRUKCJA UŻYTKOWANIA
 INSTRUKCJA UŻYTKOWANIA n Parasite Suspensions w formalinie PRZEZNACZENIE Preparaty Parasite Suspensions firmy Microbiologics są wykorzystywane w programach zapewniania jakości jako materiały porównawcze
INSTRUKCJA UŻYTKOWANIA n Parasite Suspensions w formalinie PRZEZNACZENIE Preparaty Parasite Suspensions firmy Microbiologics są wykorzystywane w programach zapewniania jakości jako materiały porównawcze
Genomic Mini AX Plant Spin
 Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
Zestaw przeznaczony jest do całkowitej izolacji RNA z bakterii, drożdży, hodowli komórkowych, tkanek oraz krwi świeżej (nie mrożonej).
 Total RNA Mini Plus Zestaw do izolacji całkowitego RNA. Procedura izolacji nie wymaga użycia chloroformu wersja 0517 25 izolacji, 100 izolacji Nr kat. 036-25, 036-100 Zestaw przeznaczony jest do całkowitej
Total RNA Mini Plus Zestaw do izolacji całkowitego RNA. Procedura izolacji nie wymaga użycia chloroformu wersja 0517 25 izolacji, 100 izolacji Nr kat. 036-25, 036-100 Zestaw przeznaczony jest do całkowitej
II.1.4) Określenie przedmiotu oraz wielkości lub zakresu zamówienia: 3.1. Przedmiotem zamówienia jest dostawa produktów do żywienia pozajelitowego
 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: bip.usdk.pl Kraków: Dostawa odczynników do oznaczeń immunohistochemicznych Numer ogłoszenia: 391598-2014;
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: bip.usdk.pl Kraków: Dostawa odczynników do oznaczeń immunohistochemicznych Numer ogłoszenia: 391598-2014;
ACCESS Immunoassay System. HIV combo QC4 & QC5. Do monitorowania wydajności testu Access HIV combo. B71116A - [PL] - 2015/01
![ACCESS Immunoassay System. HIV combo QC4 & QC5. Do monitorowania wydajności testu Access HIV combo. B71116A - [PL] - 2015/01 ACCESS Immunoassay System. HIV combo QC4 & QC5. Do monitorowania wydajności testu Access HIV combo. B71116A - [PL] - 2015/01](/thumbs/25/4516998.jpg) ACCESS Immunoassay System HIV combo QC4 & QC5 B22822 Do monitorowania wydajności testu Access HIV combo. - [PL] - 2015/01 Spis treści Access HIV combo QC4 & QC5 1 Przeznaczenie... 3 2 Podsumowanie i objaśnienie
ACCESS Immunoassay System HIV combo QC4 & QC5 B22822 Do monitorowania wydajności testu Access HIV combo. - [PL] - 2015/01 Spis treści Access HIV combo QC4 & QC5 1 Przeznaczenie... 3 2 Podsumowanie i objaśnienie
PCR bez izolacji testujemy Direct PCR Kits od ThermoFisher Scientific
 PCR bez izolacji testujemy Direct PCR Kits od ThermoFisher Scientific Specjalnie dla Was przetestowaliśmy w naszym laboratorium odczynniki firmy Thermo Scientific umożliwiające przeprowadzanie reakcji
PCR bez izolacji testujemy Direct PCR Kits od ThermoFisher Scientific Specjalnie dla Was przetestowaliśmy w naszym laboratorium odczynniki firmy Thermo Scientific umożliwiające przeprowadzanie reakcji
Roztwór buforowy zawierający nadtlenek wodoru, detergent i azydek sodu o stężeniu 0,015 mol/l.
 PD-L1 IHC 22C3 pharmdx SK006 50 testów do stosowania w urządzeniu Autostainer Link 48 Przeznaczenie Do badań diagnostycznych in vitro. PD-L1 IHC 22C3 pharmdx jest jakościowym testem immunohistochemicznym
PD-L1 IHC 22C3 pharmdx SK006 50 testów do stosowania w urządzeniu Autostainer Link 48 Przeznaczenie Do badań diagnostycznych in vitro. PD-L1 IHC 22C3 pharmdx jest jakościowym testem immunohistochemicznym
Genomic Mini AX Milk Spin
 Genomic Mini AX Milk Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z próbek mleka. wersja 1017 100 izolacji Nr kat. 059-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg. Produkt
Genomic Mini AX Milk Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z próbek mleka. wersja 1017 100 izolacji Nr kat. 059-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg. Produkt
Gel-Out. 50 izolacji, 250 izolacji. Nr kat , Zestaw do izolacji DNA z żelu agarozowego. wersja 0617
 Gel-Out Zestaw do izolacji DNA z żelu agarozowego. wersja 0617 50 izolacji, 250 izolacji Nr kat. 023-50, 023-250 Pojemność kolumny do izolacji DNA - do 20 µg DNA, minimalna pojemność - 2 µg DNA (przy zawartości
Gel-Out Zestaw do izolacji DNA z żelu agarozowego. wersja 0617 50 izolacji, 250 izolacji Nr kat. 023-50, 023-250 Pojemność kolumny do izolacji DNA - do 20 µg DNA, minimalna pojemność - 2 µg DNA (przy zawartości
Cytology FISH Accessory Kit Nr kat. K 5499
 Cytology FISH Accessory Kit Nr kat. K 5499 Wydanie 2 Do fluorescencyjnej hybrydyzacji in situ (FISH) na próbce cytologicznej. Zestaw zawiera odczynniki wystarczające do wykonania 20 badań. Spis treści
Cytology FISH Accessory Kit Nr kat. K 5499 Wydanie 2 Do fluorescencyjnej hybrydyzacji in situ (FISH) na próbce cytologicznej. Zestaw zawiera odczynniki wystarczające do wykonania 20 badań. Spis treści
Genomic Mini AX Bacteria+ Spin
 Genomic Mini AX Bacteria+ Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z bakterii Gram-dodatnich. wersja 1017 100 izolacji Nr kat. 060-100MS Pojemność kolumny do oczyszczania DNA wynosi
Genomic Mini AX Bacteria+ Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z bakterii Gram-dodatnich. wersja 1017 100 izolacji Nr kat. 060-100MS Pojemność kolumny do oczyszczania DNA wynosi
Monoclonal Rabbit Anti-Human Cytokeratin 8/18 Clone EP17/EP30. Nr kat. M3652. Przeznaczenie
 Monoclonal Rabbit Anti-Human Cytokeratin 8/18 Clone EP17/EP30 Nr kat. M3652 Przeznaczenie Do badań diagnostycznych in vitro. Przeciwciała Monoclonal Rabbit Anti-Human Cytokeratin 8/18, Clone EP17/EP30,
Monoclonal Rabbit Anti-Human Cytokeratin 8/18 Clone EP17/EP30 Nr kat. M3652 Przeznaczenie Do badań diagnostycznych in vitro. Przeciwciała Monoclonal Rabbit Anti-Human Cytokeratin 8/18, Clone EP17/EP30,
Polska-Kraków: Odczynniki i środki kontrastowe 2015/S
 1/5 Niniejsze ogłoszenie w witrynie TED: http://ted.europa.eu/udl?uri=ted:notice:260518-2015:text:pl:html Polska-Kraków: Odczynniki i środki kontrastowe 2015/S 142-260518 Centrum Onkologii Instytut im.
1/5 Niniejsze ogłoszenie w witrynie TED: http://ted.europa.eu/udl?uri=ted:notice:260518-2015:text:pl:html Polska-Kraków: Odczynniki i środki kontrastowe 2015/S 142-260518 Centrum Onkologii Instytut im.
Artisan Grocott s Methenamine Silver Eosin Stain Kit. Nr kat. AR376. Przeznaczenie Do stosowania w diagnostyce in vitro.
 Artisan Grocott s Methenamine Silver Eosin Stain Kit Nr kat. AR376 Przeznaczenie Do stosowania w diagnostyce in vitro. Zestaw Grocott s Methenamine Silver (GMS) Eosin Stain Kit jest przeznaczony do zastosowań
Artisan Grocott s Methenamine Silver Eosin Stain Kit Nr kat. AR376 Przeznaczenie Do stosowania w diagnostyce in vitro. Zestaw Grocott s Methenamine Silver (GMS) Eosin Stain Kit jest przeznaczony do zastosowań
KARTA CHARAKTERYSTYKI
 KARTA CHARAKTERYSTYKI Producent: ul. Wiosenna 22 05-092 ŁOMIANKI tel./ fax. (0-81) 749 44 34, 749 44 00 w godzinach: 7 00-15 00 Data sporządzenia karty: 10.09.2007 Data aktualizacji karty: 09.03.2009 1.
KARTA CHARAKTERYSTYKI Producent: ul. Wiosenna 22 05-092 ŁOMIANKI tel./ fax. (0-81) 749 44 34, 749 44 00 w godzinach: 7 00-15 00 Data sporządzenia karty: 10.09.2007 Data aktualizacji karty: 09.03.2009 1.
W testach Western blot lizatu komórek MCF-7 przeciwciało znakuje duŝe pasmo 67 kda odpowiadające oczekiwanej masie cząsteczkowej ER α (4).
 FLEX Przeciwciało Monoclonal Rabbit Anti-Human Estrogen Receptor α Clone SP1 Ready-to-Use (Dako Autostainer/Autostainer Plus) Nr kat. IS151 Przeznaczenie Synonimy antygenu Podsumowanie i wyjaśnienie Odczynnik
FLEX Przeciwciało Monoclonal Rabbit Anti-Human Estrogen Receptor α Clone SP1 Ready-to-Use (Dako Autostainer/Autostainer Plus) Nr kat. IS151 Przeznaczenie Synonimy antygenu Podsumowanie i wyjaśnienie Odczynnik
Genomic Maxi AX Direct
 Genomic Maxi AX Direct Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura bez etapu precypitacji. wersja 0517 10 izolacji Nr kat. 995-10D Pojemność kolumny
Genomic Maxi AX Direct Uniwersalny zestaw o zwiększonej wydajności do izolacji genomowego DNA z różnych materiałów. Procedura bez etapu precypitacji. wersja 0517 10 izolacji Nr kat. 995-10D Pojemność kolumny
KINETYKA REAKCJI ENZYMATYCZNYCH
 ĆWICZENIE 8 KINETYKA REAKCJI ENZYMATYCZNYCH Wyznaczanie stałej Michaelisa i szybkości maksymalnej reakcji utleniania gwajakolu przez H 2 2, katalizowanej przez peroksydazę chrzanową. Badanie wpływu siarczanu
ĆWICZENIE 8 KINETYKA REAKCJI ENZYMATYCZNYCH Wyznaczanie stałej Michaelisa i szybkości maksymalnej reakcji utleniania gwajakolu przez H 2 2, katalizowanej przez peroksydazę chrzanową. Badanie wpływu siarczanu
Zestaw do oczyszczania DNA po reakcjach enzymatycznych
 Cat. No. EM07.1 Wersja: 1.2017 NOWA WERSJA Zestaw do oczyszczania DNA po reakcjach enzymatycznych EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM07.1 I. PRZEZNACZENIE
Cat. No. EM07.1 Wersja: 1.2017 NOWA WERSJA Zestaw do oczyszczania DNA po reakcjach enzymatycznych EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM07.1 I. PRZEZNACZENIE
KARTA CHARAKTERYSTYKI
 KARTA CHARAKTERYSTYKI Producent:. ul. Wiosenna 22 05-092 ŁOMIANKI tel./ fax. (0-81) 749 44 34, 749 44 00 w godzinach: 7 00-15 00 Data sporządzenia karty: 21.10.2008 Data aktualizacji karty: 21.09.2009
KARTA CHARAKTERYSTYKI Producent:. ul. Wiosenna 22 05-092 ŁOMIANKI tel./ fax. (0-81) 749 44 34, 749 44 00 w godzinach: 7 00-15 00 Data sporządzenia karty: 21.10.2008 Data aktualizacji karty: 21.09.2009
Novabeads Food DNA Kit
 Novabeads Food DNA Kit Novabeads Food DNA Kit jest nowej generacji narzędziem w technikach biologii molekularnej, umożliwiającym izolację DNA z produktów spożywczych wysoko przetworzonych. Metoda oparta
Novabeads Food DNA Kit Novabeads Food DNA Kit jest nowej generacji narzędziem w technikach biologii molekularnej, umożliwiającym izolację DNA z produktów spożywczych wysoko przetworzonych. Metoda oparta
Polska-Kraków: Odczynniki i środki kontrastowe 2015/S
 1/5 Niniejsze ogłoszenie w witrynie TED: http://ted.europa.eu/udl?uri=ted:notice:234697-2015:text:pl:html Polska-Kraków: Odczynniki i środki kontrastowe 2015/S 128-234697 Centrum Onkologii Instytut im.
1/5 Niniejsze ogłoszenie w witrynie TED: http://ted.europa.eu/udl?uri=ted:notice:234697-2015:text:pl:html Polska-Kraków: Odczynniki i środki kontrastowe 2015/S 128-234697 Centrum Onkologii Instytut im.
Instrukcja ogólna dotycząca postępowania z substancjami niebezpiecznymi
 DOKUMENTACJA ZINTEGROWANEGO SYSTEMU ZARZĄDZANIA OPERATORA GAZOCIĄGÓW PRZESYŁOWYCH GAZ-SYSTEM S.A. Instrukcja ogólna dotycząca postępowania z substancjami niebezpiecznymi Opracował: Zespół ds. Zintegrowanego
DOKUMENTACJA ZINTEGROWANEGO SYSTEMU ZARZĄDZANIA OPERATORA GAZOCIĄGÓW PRZESYŁOWYCH GAZ-SYSTEM S.A. Instrukcja ogólna dotycząca postępowania z substancjami niebezpiecznymi Opracował: Zespół ds. Zintegrowanego
Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215
 Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215 20 izolacji Nr kat. 895-20D Pojemność kolumny do oczyszczania DNA wynosi 100 µg 1 Skład zestawu Składnik
Genomic Midi AX Direct zestaw do izolacji genomowego DNA (procedura bez precypitacji) wersja 1215 20 izolacji Nr kat. 895-20D Pojemność kolumny do oczyszczania DNA wynosi 100 µg 1 Skład zestawu Składnik
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika
 PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
RONT PRODUCTION Farba bezołowiowa o bardzo dobrych właściwościach kryjących
 Data: 13/12/00 Wersja nr 1 Karta danych bezpieczeństwa produktu 1. IDENTYFIKACJA PRODUKTU ORAZ FIRMY NAZWA HANDLOWA DOSTAWCA RONT PRODUCTION Farba bezołowiowa o bardzo dobrych właściwościach kryjących
Data: 13/12/00 Wersja nr 1 Karta danych bezpieczeństwa produktu 1. IDENTYFIKACJA PRODUKTU ORAZ FIRMY NAZWA HANDLOWA DOSTAWCA RONT PRODUCTION Farba bezołowiowa o bardzo dobrych właściwościach kryjących
FORMULARZ OFERTOWY ZAŁĄCZNIK NR 2 DO SIWZ. 1 szt. wraz z oprogramowaniem i osprzętem ODCZYNNIKI DO BADAŃ IMMUNOHISTOCHEMICZNYCH
 SIWZ TP.382.30.2017 JK FORMULARZ OFERTOWY ZAŁĄCZNIK NR 2 DO SIWZ DZIERŻAWA SPRZĘTU DO WYKONYWANIA BADAŃ IMMUNOHISTOCHEMICZNYCH Przedmiot zamówienia Producent, typ, nr kat. Ilość Dzierżawa sprzętu do wykonywania
SIWZ TP.382.30.2017 JK FORMULARZ OFERTOWY ZAŁĄCZNIK NR 2 DO SIWZ DZIERŻAWA SPRZĘTU DO WYKONYWANIA BADAŃ IMMUNOHISTOCHEMICZNYCH Przedmiot zamówienia Producent, typ, nr kat. Ilość Dzierżawa sprzętu do wykonywania
KARTA CHARAKTERYSTYKI
 KARTA CHARAKTERYSTYKI Producent: ul. Wiosenna 22 05-092 ŁOMIANKI tel./ fax. (0-81) 749 44 34, 749 44 00 w godzinach: 7 00-15 00 Data sporządzenia karty: 25.05.2007 Data aktualizacji karty: 15.09.2009 1.
KARTA CHARAKTERYSTYKI Producent: ul. Wiosenna 22 05-092 ŁOMIANKI tel./ fax. (0-81) 749 44 34, 749 44 00 w godzinach: 7 00-15 00 Data sporządzenia karty: 25.05.2007 Data aktualizacji karty: 15.09.2009 1.
Roztwór buforowy zawierający nadtlenek wodoru, detergent i azydek sodu o stężeniu 0,015 mol/l.
 PD-L1 IHC 22C3 pharmdx SK006 50 testów do stosowania w urządzeniu Autostainer Link 48 Przeznaczenie Do badań diagnostycznych in vitro. PD-L1 IHC 22C3 pharmdx jest jakościowym testem immunohistochemicznym
PD-L1 IHC 22C3 pharmdx SK006 50 testów do stosowania w urządzeniu Autostainer Link 48 Przeznaczenie Do badań diagnostycznych in vitro. PD-L1 IHC 22C3 pharmdx jest jakościowym testem immunohistochemicznym
KARTA CHARAKTERYSTYKI LUDWIK balsam
 Podstawa prawna: Rozporządzenie (WE) nr 1907/2006 Parlamentu Europejskiego i Rady z dnia 18 grudnia 2006r w sprawie rejestracji, oceny, udzielania zezwoleń i stosowanych ograniczeń w zakresie chemikaliów
Podstawa prawna: Rozporządzenie (WE) nr 1907/2006 Parlamentu Europejskiego i Rady z dnia 18 grudnia 2006r w sprawie rejestracji, oceny, udzielania zezwoleń i stosowanych ograniczeń w zakresie chemikaliów
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2019 CZĘŚĆ PRAKTYCZNA. Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2019 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 01
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2019 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 01
KARTA CHARAKTERYSTYKI
 KARTA CHARAKTERYSTYKI Producent:. ul. Wiosenna 22 05-092 ŁOMIANKI tel./ fax. (0-81) 749 44 34, 749 44 00 w godzinach: 7 00-15 00 Data sporządzenia karty: 11.06.2007 Data aktualizacji karty:09.03.2009 1.
KARTA CHARAKTERYSTYKI Producent:. ul. Wiosenna 22 05-092 ŁOMIANKI tel./ fax. (0-81) 749 44 34, 749 44 00 w godzinach: 7 00-15 00 Data sporządzenia karty: 11.06.2007 Data aktualizacji karty:09.03.2009 1.
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2019 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 01
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 01
1. IDENTYFIKACJA PREPARATU, IDENTYFIKACJA PRODUCENTA
 Data sporządzenia 09.07.2001 Data aktualizacji 25.01.2005 Data kolejnej aktualizacji 02.07.2007 1. IDENTYFIKACJA PREPARATU, IDENTYFIKACJA PRODUCENTA Identyfikacja preparatu nazwa handlowa Zastosowanie
Data sporządzenia 09.07.2001 Data aktualizacji 25.01.2005 Data kolejnej aktualizacji 02.07.2007 1. IDENTYFIKACJA PREPARATU, IDENTYFIKACJA PRODUCENTA Identyfikacja preparatu nazwa handlowa Zastosowanie
YC4001/YC4005. Technical Data Sheet. YC4001/YC4005 Suncoat Horizon
 Suncoat Horizon OPIS: Suncoat Horizon jest emulsją o podwójnie zwiększonej czułości umożliwiającą wytwarzanie fotoszablonów o wyjątkowo wysokiej jakości. Emulsja powinna być stosowana w przypadkach, w
Suncoat Horizon OPIS: Suncoat Horizon jest emulsją o podwójnie zwiększonej czułości umożliwiającą wytwarzanie fotoszablonów o wyjątkowo wysokiej jakości. Emulsja powinna być stosowana w przypadkach, w
KARTA CHARAKTERYSTYKI PREPARATU
 PRZEDSIĘBIORSTWO PRODUKCYJNO HANDLOWE AS TOMASZ SŁODOWNIK 05-402 OTWOCK, UL POGODNA 38 NIP 532 102 23 96 22 788 21 73 KARTA CHARAKTERYSTYKI PREPARATU Producent : P.P.H. AS Tomasz Słodownik Adres: ul. Pogodna
PRZEDSIĘBIORSTWO PRODUKCYJNO HANDLOWE AS TOMASZ SŁODOWNIK 05-402 OTWOCK, UL POGODNA 38 NIP 532 102 23 96 22 788 21 73 KARTA CHARAKTERYSTYKI PREPARATU Producent : P.P.H. AS Tomasz Słodownik Adres: ul. Pogodna
QMS Quality in Microbiology Scheme Wydanie 14 Data wydania: czerwiec 2018
 Przyjęcie i przechowywanie Po otrzymaniu materiału do badań należy zapisać datę otrzymania, a następnie przechowywać w lodówce w temperaturze 2-8 º C do momentu przeprowadzenia badania. Materiał do badań
Przyjęcie i przechowywanie Po otrzymaniu materiału do badań należy zapisać datę otrzymania, a następnie przechowywać w lodówce w temperaturze 2-8 º C do momentu przeprowadzenia badania. Materiał do badań
lutego 2012
 Dlaczego mikrodysekcja laserowa? Agnieszka Łoboda Zakład Biotechnologii Medycznej Wydział Biochemii, Biofizyki i Biotechnologii UJ, Kraków Mikrodysekcja laserowa szybka metoda izolacji komórek z preparatów
Dlaczego mikrodysekcja laserowa? Agnieszka Łoboda Zakład Biotechnologii Medycznej Wydział Biochemii, Biofizyki i Biotechnologii UJ, Kraków Mikrodysekcja laserowa szybka metoda izolacji komórek z preparatów
Genomic Mini. 50 izolacji, 250 izolacji. Uniwersalny zestaw do izolacji genomowego DNA z różnych materiałów. wersja Nr kat.
 Genomic Mini Uniwersalny zestaw do izolacji genomowego DNA z różnych materiałów. wersja 0517 50 izolacji, 250 izolacji Nr kat. 116-50, 116-250 Zestaw do izolacji DNA z tkanek, bakterii, hodowli komórkowych.
Genomic Mini Uniwersalny zestaw do izolacji genomowego DNA z różnych materiałów. wersja 0517 50 izolacji, 250 izolacji Nr kat. 116-50, 116-250 Zestaw do izolacji DNA z tkanek, bakterii, hodowli komórkowych.
RT31-020, RT , MgCl 2. , random heksamerów X 6
 RT31-020, RT31-100 RT31-020, RT31-100 Zestaw TRANSCRIPTME RNA zawiera wszystkie niezbędne składniki do przeprowadzenia syntezy pierwszej nici cdna na matrycy mrna lub całkowitego RNA. Uzyskany jednoniciowy
RT31-020, RT31-100 RT31-020, RT31-100 Zestaw TRANSCRIPTME RNA zawiera wszystkie niezbędne składniki do przeprowadzenia syntezy pierwszej nici cdna na matrycy mrna lub całkowitego RNA. Uzyskany jednoniciowy
ARKUSZ EGZAMINACYJNY ETAP PRAKTYCZNY EGZAMINU POTWIERDZAJĄCEGO KWALIFIKACJE ZAWODOWE CZERWIEC 2010
 Zawód: technik analityk Symbol cyfrowy zawodu: 311[02] Numer zadania: Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu 311[02]-0-102 Czas trwania egzaminu: 240 minut ARKUSZ EGZAMINACYJNY
Zawód: technik analityk Symbol cyfrowy zawodu: 311[02] Numer zadania: Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu 311[02]-0-102 Czas trwania egzaminu: 240 minut ARKUSZ EGZAMINACYJNY
KARTA CHARAKTERYSTYKI LUDWIK
 Podstawa prawna: Rozporządzenie (WE) nr 1907/2006 Parlamentu Europejskiego i Rady z dnia 18 grudnia 2006r w sprawie rejestracji, oceny, udzielania zezwoleń i stosowanych ograniczeń w zakresie chemikaliów
Podstawa prawna: Rozporządzenie (WE) nr 1907/2006 Parlamentu Europejskiego i Rady z dnia 18 grudnia 2006r w sprawie rejestracji, oceny, udzielania zezwoleń i stosowanych ograniczeń w zakresie chemikaliów
KARTA CHARAKTERYSTYKI
 Zgodnie z Dz.U. Nr 140 poz. 1171 z 2002r. Dystrybutor: Data aktualizacji: 01.12.2004 METTLER-TOLEDO Sp. z o.o. ul. Poleczki 21 02-822 WARSZAWA tel. (22) 545 06 80 fax. (22) 545 06 88 1. Identyfikacja substancji
Zgodnie z Dz.U. Nr 140 poz. 1171 z 2002r. Dystrybutor: Data aktualizacji: 01.12.2004 METTLER-TOLEDO Sp. z o.o. ul. Poleczki 21 02-822 WARSZAWA tel. (22) 545 06 80 fax. (22) 545 06 88 1. Identyfikacja substancji
Total RNA Zol-Out. 25 izolacji, 100 izolacji
 Total RNA Zol-Out Zestaw do szybkiej izolacji ultraczystego, całkowitego RNA z odczynników opartych na mieszaninie fenolu oraz rodanku lub chlorowodorku guanidyny (TRIzol, TRI Reagent, RNAzol, QIAzol,
Total RNA Zol-Out Zestaw do szybkiej izolacji ultraczystego, całkowitego RNA z odczynników opartych na mieszaninie fenolu oraz rodanku lub chlorowodorku guanidyny (TRIzol, TRI Reagent, RNAzol, QIAzol,
HER2 IQFISH pharmdx (Dako Omnis)
 HER2 IQFISH pharmdx (Dako Omnis) Nr kat. GM333 Wydanie 2. Test HER2 IQFISH pharmdx (Dako Omnis) jest bezpośrednim testem hybrydyzacji fluorescencyjnej in-situ (ang. fluorescence in situ hybridization,
HER2 IQFISH pharmdx (Dako Omnis) Nr kat. GM333 Wydanie 2. Test HER2 IQFISH pharmdx (Dako Omnis) jest bezpośrednim testem hybrydyzacji fluorescencyjnej in-situ (ang. fluorescence in situ hybridization,
KARTA CHARAKTERYSTYKI
 Strona: 1 Data opracowania: 17.06.2011 Nr weryfikacji: 1 Sekcja 1: Identyfikacja substancji/mieszaniny i identyfikacja przedsiębiorstwa 1.1. Identyfikator produktu Nazwa produktu: Kod produktu: 776, 777,
Strona: 1 Data opracowania: 17.06.2011 Nr weryfikacji: 1 Sekcja 1: Identyfikacja substancji/mieszaniny i identyfikacja przedsiębiorstwa 1.1. Identyfikator produktu Nazwa produktu: Kod produktu: 776, 777,
KARTA CHARAKTERYSTYKI
 KARTA CHARAKTERYSTYKI Producent:. ul. Wiosenna 22 05-092 ŁOMIANKI tel./ fax. (0-81) 749 44 34, 749 44 00 w godzinach: 7 00-15 00 Data sporządzenia karty: 11.06.2007 Data aktualizacji karty:09.03.2009 1.
KARTA CHARAKTERYSTYKI Producent:. ul. Wiosenna 22 05-092 ŁOMIANKI tel./ fax. (0-81) 749 44 34, 749 44 00 w godzinach: 7 00-15 00 Data sporządzenia karty: 11.06.2007 Data aktualizacji karty:09.03.2009 1.
Pobieranie próbek owoców
 Strona 1 z 5 1. Cel i zakres: Pobieranie próbek owoców Celem procedury jest określenie zasad pobierania próbek owoców. Procedura obowiązuje wszystkie osoby odpowiedzialne za wykonywanie tej czynności.
Strona 1 z 5 1. Cel i zakres: Pobieranie próbek owoców Celem procedury jest określenie zasad pobierania próbek owoców. Procedura obowiązuje wszystkie osoby odpowiedzialne za wykonywanie tej czynności.
Zwroty wskazujące środki ostrożności ogólne P101 W razie konieczności zasięgnięcia porady lekarza, należy pokazać pojemnik lub etykietę.
 Zwroty wskazujące środki ostrożności ogólne P101 W razie konieczności zasięgnięcia porady lekarza, należy pokazać pojemnik lub etykietę. P102 P103 Chronić przed dziećmi. Przed użyciem przeczytać etykietę.
Zwroty wskazujące środki ostrożności ogólne P101 W razie konieczności zasięgnięcia porady lekarza, należy pokazać pojemnik lub etykietę. P102 P103 Chronić przed dziećmi. Przed użyciem przeczytać etykietę.
Pełen tekst zwrotów R zawartych w tej sekcji umieszczono w sekcji 16.
 Data sporządzenia: 02.02.2009 Strona 1 z 7 1. IDENTYFIKACJA PREPARATU 1. Identyfikacja preparatu 2. Zastosowanie preparatu Preparat przeznaczony do mycia karoserii samochodowych 3. Identyfikacja dystrybutora/producenta
Data sporządzenia: 02.02.2009 Strona 1 z 7 1. IDENTYFIKACJA PREPARATU 1. Identyfikacja preparatu 2. Zastosowanie preparatu Preparat przeznaczony do mycia karoserii samochodowych 3. Identyfikacja dystrybutora/producenta
Odczynniki do barwień immunohistochemicznych na okres 36 misięcy (2 400 barwień) Nazwa własna asort.
 Pakiet nr Załącznik nr Odczynniki do barwień immunohistochemicznych na okres 36 misięcy (2 400 barwień) L.p System wizualizacyjny wraz ze wszystkimi potrzebnymi odczynnikami i materiałami zużywalnymi Nazwa
Pakiet nr Załącznik nr Odczynniki do barwień immunohistochemicznych na okres 36 misięcy (2 400 barwień) L.p System wizualizacyjny wraz ze wszystkimi potrzebnymi odczynnikami i materiałami zużywalnymi Nazwa
Specyfikacja techniczna Zgodnie z Dyrektywą 91/155 EC. le
 Strona 1 z 1 1. PRODUKT I PRODUCENT Nazwa handlowa Producent / dostawca Więcej informacji moŝna uzyskać od: Specyfikacja techniczna Zgodnie z Dyrektywą 91/155 EC Emaille Bison International Dr. A. F. Philipsstraat
Strona 1 z 1 1. PRODUKT I PRODUCENT Nazwa handlowa Producent / dostawca Więcej informacji moŝna uzyskać od: Specyfikacja techniczna Zgodnie z Dyrektywą 91/155 EC Emaille Bison International Dr. A. F. Philipsstraat
Produkty z włókien szklanych ciągłych
 SEKCJI 0. INFORMACJE OGÓLNE Zgodnie z artykułem 3.3 rozporządzenia (WE) nr 1907/2008 (REACH) produkty te są wyrobami: Nie zawierają one substancji, które mogą zostać uwolnione podczas normalnych lub racjonalnie
SEKCJI 0. INFORMACJE OGÓLNE Zgodnie z artykułem 3.3 rozporządzenia (WE) nr 1907/2008 (REACH) produkty te są wyrobami: Nie zawierają one substancji, które mogą zostać uwolnione podczas normalnych lub racjonalnie
KARTA CHARAKTERYSTYKI
 Data sporządzenia: 2008-06-02 KARTA CHARAKTERYSTYKI Data aktualizacji: 2009-03-16 Podstawa prawna: Rozporządzenie (WE) nr 1907/2006 Parlamentu Europejskiego i Rady z dnia 18 grudnia 2006r w sprawie rejestracji,
Data sporządzenia: 2008-06-02 KARTA CHARAKTERYSTYKI Data aktualizacji: 2009-03-16 Podstawa prawna: Rozporządzenie (WE) nr 1907/2006 Parlamentu Europejskiego i Rady z dnia 18 grudnia 2006r w sprawie rejestracji,
Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616
 Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616 10 izolacji Nr kat. 995-10 Pojemność kolumny do oczyszczania DNA wynosi 500 µg 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
Genomic Maxi AX zestaw do izolacji genomowego DNA wersja 0616 10 izolacji Nr kat. 995-10 Pojemność kolumny do oczyszczania DNA wynosi 500 µg 1 Skład zestawu Składnik Ilość Temp. Przechowywania Kolumny
ELISA PeliClass human IgG subclass kit REF M1551
 Sanquin Reagents Plesmanlaan 5 0 CX Amsterdam The Netherlands Phone: +.0.5.599 Fax: +.0.5.570 Email: reagents@sanquin.nl Website: www.sanquinreagents.com M55/ November 007 ELISA PeliClass human IgG subclass
Sanquin Reagents Plesmanlaan 5 0 CX Amsterdam The Netherlands Phone: +.0.5.599 Fax: +.0.5.570 Email: reagents@sanquin.nl Website: www.sanquinreagents.com M55/ November 007 ELISA PeliClass human IgG subclass
HER2 IQFISH pharmdx Nr kat. K5731
 HER2 IQFISH pharmdx Nr kat. K5731 Wydanie 3. HER2 IQFISH pharmdx jest bezpośrednim testem hybrydyzacji fluorescencyjnej in situ (FISH), słuŝącym do ilościowego oznaczania amplifikacji genu HER2 w utrwalonych
HER2 IQFISH pharmdx Nr kat. K5731 Wydanie 3. HER2 IQFISH pharmdx jest bezpośrednim testem hybrydyzacji fluorescencyjnej in situ (FISH), słuŝącym do ilościowego oznaczania amplifikacji genu HER2 w utrwalonych
Karta charakterystyki preparatu zgodnie z 1907/2006/WE, Artykuł 31
 strona: 1/5 * 1 Identyfikacja preparatu i identyfikacja przedsiębiorstwa Informacje o preparacie Zastosowanie preparatu: Preparat do utrzymania czystości, do profesjonalnego stosowania Producent / Dystrybutor:
strona: 1/5 * 1 Identyfikacja preparatu i identyfikacja przedsiębiorstwa Informacje o preparacie Zastosowanie preparatu: Preparat do utrzymania czystości, do profesjonalnego stosowania Producent / Dystrybutor:
+ ± ± + + + (+) + + (+) Jak uzyskać dobry wynik patomorfologiczny? Virchow 2020(50) Andrzej Marszałek. utrwalanie ROZPOZNANIE.
 Virchow 2020(50) Jak uzyskać dobry wynik patomorfologiczny? Andrzej Marszałek makroskopowo + ± mikroskopowo ± + + + (+) IHC + + (+) badania genetyczne + + (?) Katedra I Zakład Pathomorfologii Klinicznej
Virchow 2020(50) Jak uzyskać dobry wynik patomorfologiczny? Andrzej Marszałek makroskopowo + ± mikroskopowo ± + + + (+) IHC + + (+) badania genetyczne + + (?) Katedra I Zakład Pathomorfologii Klinicznej
Zestaw do wykrywania Babesia spp. i Theileria spp. w kleszczach, krwi i hodowlach komórkowych
 Nr kat. PK25N Wersja zestawu: 1.2012 Zestaw do wykrywania spp. i Theileria spp. w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Zestaw
Nr kat. PK25N Wersja zestawu: 1.2012 Zestaw do wykrywania spp. i Theileria spp. w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Zestaw
Liquid Ice Spray Czyszczący
 KARTA CHARAKTERYSTYKI BEZPIECZEŃSTWA (MSDS) Liquid Ice Spray Czyszczący SEKCJA 1 IDENTYFIKACJA SUBSTANCJI I PRODUCENTA Nazwa produktu: Spray czyszczący Kod produktu: 42082 Numer (Producenta) Karty Charakterystyki:
KARTA CHARAKTERYSTYKI BEZPIECZEŃSTWA (MSDS) Liquid Ice Spray Czyszczący SEKCJA 1 IDENTYFIKACJA SUBSTANCJI I PRODUCENTA Nazwa produktu: Spray czyszczący Kod produktu: 42082 Numer (Producenta) Karty Charakterystyki:
KARTA CHARAKTERYSTYKI
 KARTA CHARAKTERYSTYKI Producent: ul. Wiosenna 22 05-092 ŁOMIANKI tel./ fax. (0-81) 749 44 34, 749 44 00 Tel. Alarmowy: 998 Data wydania karty: 09.10.2005 999 Data aktualizacji karty: 10.09.2007 1. Identyfikacja
KARTA CHARAKTERYSTYKI Producent: ul. Wiosenna 22 05-092 ŁOMIANKI tel./ fax. (0-81) 749 44 34, 749 44 00 Tel. Alarmowy: 998 Data wydania karty: 09.10.2005 999 Data aktualizacji karty: 10.09.2007 1. Identyfikacja
AE/ZP-27-74/16 Załącznik Nr 6
 AE/ZP-27-74/16 Załącznik Nr 6 Wymagania dla UWAGA! Oferta nie spełniająca poniższych wymagań będzie odrzucona L.p. Wymagane parametry Wymagania wobec przedmiotu zmówienia oferowanego w Pakiecie Nr 1 Wszystkie
AE/ZP-27-74/16 Załącznik Nr 6 Wymagania dla UWAGA! Oferta nie spełniająca poniższych wymagań będzie odrzucona L.p. Wymagane parametry Wymagania wobec przedmiotu zmówienia oferowanego w Pakiecie Nr 1 Wszystkie
Data: Poprzednia data: --
 X KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ FORMULARZ INFORMACJI DANYCH SUBSTANCJI CHEMICZNEJ Data: 03.03.2009 Poprzednia data: 1. DANE SUBSTANCJI/PREPARATU ORAZ FIRMY/PRZEDSIĘBIORSTWA 1.1 Dane substancji
X KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ FORMULARZ INFORMACJI DANYCH SUBSTANCJI CHEMICZNEJ Data: 03.03.2009 Poprzednia data: 1. DANE SUBSTANCJI/PREPARATU ORAZ FIRMY/PRZEDSIĘBIORSTWA 1.1 Dane substancji
