Bayer HealthCare Public Relations Al.Jerozolimskie Warszawa Polska. Informacja prasowa
|
|
|
- Zofia Antczak
- 8 lat temu
- Przeglądów:
Transkrypt
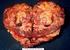
1 Informacja prasowa Bayer HealthCare Public Relations Al.Jerozolimskie Warszawa Polska W badaniu klinicznym III fazy z udziałem chorych na przerzutowe nowotwory podścieliskowe przewodu pokarmowego (GIST) osiągnięto pierwszorzędowy punkt końcowy polegający na poprawie wskaźnika czasu przeżycia bez progresji Berlin, 3 kwietnia 2012 r. Firma Bayer HealthCare ogłosiła pozytywne wyniki badania klinicznego fazy III pod nazwą GRID (GIST Regorafenib In Progressive Disease), w którym oceniano cząsteczkę regorafenib (BAY ) w leczeniu chorych na przerzutowe i (lub) nieoperacyjne nowotwory podścieliskowe przewodu pokarmowego (GIST), u których doszło do progresji choroby pomimo uprzedniego podawania imatynibu i sunitynibu. Osiągnięto pierwszorzędowy punkt końcowy badania w postaci statystycznie znamiennej poprawy wskaźnika przeżycia wolnego od progresji. W badaniu tym bezpieczeństwo i tolerancja regorafenibu zasadniczo kształtowały się na oczekiwanym poziomie. Szczegółowe dane z badania mają zostać przedstawione na nadchodzących spotkaniach naukowych. Badanie kliniczne GRID było sponsorowane przez firmę Bayer i prowadzone pod kierunkiem głównego badacza dr. George a Demetri, dyrektora Ludwig Center w Dana-Farber Cancer Institute i Harvard Medical School w Bostonie w amerykańskim stanie Massachusetts. Badanie rozpoczęto w styczniu 2011 r, a rekrutację pacjentów zakończono w lipcu 2011 r. Potrzebne są dodatkowe opcje leczenia chorych na GIST, u których stosowanie obecnie zatwierdzonych leków zakończyło się niepowodzeniem powiedział dr med. Kemal Malik, szef działu ds. globalnego opracowywania produktów i członek komitetu wykonawczego firmy Bayer HealthCare. Uzyskane dane mogą stanowić ważny element postępu w prowadzeniu tej trudnej do leczenia choroby, leczonej jak dotąd w warunkach dużych i niezaspokojonych potrzeb pacjentów. Na podstawie tych danych firma Bayer planuje złożyć wniosek o dopuszczenie regorafenibu do stosowania w leczeniu przerzutowego i(lub) nieoperacyjnego GIST. - 1/5 -
2 Uzyskano również pozytywne wyniki w badaniu klinicznym III fazy nad stosowaniem regorafenibu u chorych na przerzutowego raka jelita grubego (mcrc), u których doszło do progresji choroby po zastosowaniu zatwierdzonych standardowych metod leczenia. Firma Bayer planuje złożyć wniosek o dopuszczenie regorafenibu do stosowania w leczeniu mcrc w pierwszej połowie 2012 r. Badanie kliniczne GRID GRID (GIST Regorafenib In Progressive Disease) to randomizowane, prowadzone metodą podwójnie ślepej próby ze skrzyżowaniem, kontrolowane placebo, wieloośrodkowe badanie III fazy leczenia GIST z zastosowaniem regorafenibu. Wzięło w nim udział 199 chorych, u których doszło do progresji choroby pomimo uprzedniego przyjmowania imatynibu i sunitynibu. Aby ocenić skuteczność i bezpieczeństwo stosowania regorafenibu, osoby biorące udział w badaniu przydzielono losowo, w stosunku 2:1, do grupy, w której stosowano regorafenib (160 mg raz na dobę, 3 tygodnie leczenia / 1 tydzień przerwy) wraz z najkorzystniejszym standardowym leczeniem podtrzymującym albo do grupy placebo wraz z najkorzystniejszym standardowym leczeniem podtrzymującym. Uczestnikom badania otrzymującym placebo, u których doszło do progresji choroby, zaoferowano możliwość przyjmowania regorafenibu. Pierwszorzędowym punktem końcowym jest wskaźnik czasu przeżycia bez progresji, a drugorzędowe punkty końcowe obejmują wskaźnik przeżycia ogólnego, czas do progresji, wskaźnik kontroli choroby, współczynnik odpowiedzi ze strony nowotworu i czasu utrzymywania się tej odpowiedzi. GIST GIST to najczęstsza postać mięsaka (rodzaju nowotworu złośliwego rozwijającego się z różnych tkanek, takich jak kości lub mięśnie) obejmująca przewód pokarmowy. GIST to potencjalnie zagrażający życiu nowotwór złośliwy, jeżeli rozprzestrzeni się do innych części ciała (przerzuty) lub nie będzie mógł zostać trwale usunięty operacyjnie. Zapadalność na GIST szacuje się na 11 do 20 osób na milion rocznie. W USA rozpoznaje się co roku około nowych przypadków GIST, z czego miało postać przerzutową w momencie rozpoznania. GIST jest chorobą trudną do rozpoznania i zwykle odkrywana jest przypadkowo podczas leczenia innych problemów zdrowotnych. W ciągu ostatniej dekady leczenie GIST stało się modelem spersonalizowanej medycyny onkologicznej, ponieważ odkryto, że większość przypadków GIST wynika z aktywacji - 2/5 -
3 mutacji w receptorze KIT lub PDGFR-α, co prowadzi do niekontrolowanej sygnalizacji wewnątrz komórek nowotworowych. Na podstawie tej wiedzy wypracowano podejścia do leczenia GIST polegające na hamowaniu zmutowanych cząsteczek receptorowych (terapia celowana molekularnie). Imatynib i sunitynib, które hamują onkogenne kinazy KIT, są obecnie jedynymi lekami dopuszczonymi do stosowania w leczeniu pierwszego i drugiego rzutu, odpowiednio, GIST przerzutowych i(lub) nieoperacyjnych. Po pewnym czasie organizm chorego przestaje reagować na te leki, ponieważ pojawiają się mutacje wtórne w obrębie KIT lub PDGFR-α, lub w alternatywnych kaskadach sygnałowych, takich jak RAF. Regorafenib Regorafenib jest obecnie badanym, doustnym inhibitorem multikinazy, który działa na kinazy angiogenne, stromalne i onkogenne. Regorafenib blokuje kilka angiogennych receptorów VEGF kinazy tyrozynowej, które odgrywają główną rolę w neoangiogenezie i limfangiogenezie nowotworów. Blokuje również różne kinazy onkogenne i stromalne, w tym KIT, RET, PDFGR oraz FGFR. Regorafenib jest obecnie sprawdzany w oparciu o te wyniki za pomocą badań klinicznych pod kątem potencjału dla leczenia pacjentów z różnymi rodzajami nowotworów. Regorafenib jest nadal badanym produktem leczniczym i nie został zatwierdzony przez amerykańską Agencję ds. Żywności i Leków (FDA), Europejską Agencję ds. Leków (EMA) czy jakiekolwiek inne organy ds. zdrowia. Regorafenib otrzymał oznaczenie leku sierocego od amerykańskiej Agencji ds. Żywności i Leków w odniesieniu do leczenia pacjentów z nowotworami podścieliskowymi przewodu pokarmowego. Celem nadania statusu leku sierocego jest zachęcenie do opracowywania leków służących do diagnozowania, prewencji lub leczenia schorzeń dotykających mniej niż osób w całym kraju. Regorafenib otrzymał oznaczenie postępowania w trybie tzw. krótkiej ścieżki amerykańskiej Agencji ds. Żywności i Leków w odniesieniu do leczenia pacjentów z rakiem jelita grubego z przerzutami, u których doszło do postępu choroby po zastosowaniu zatwierdzonych, standardowych sposobów leczenia, jak również w przypadku leczenia pacjentów z nowotworami podścieliskowymi przewodu pokarmowego, które są nieoperacyjne, lub które skutkują przerzutami oraz u których doszło do postępu choroby pomimo zastosowania przynajmniej imatynibu i sunitynibu jako leczenia - 3/5 -
4 poprzedzającego. Krótka ścieżka jest procesem stworzonym w celu ułatwienia opracowania, jak również przyspieszenia oceny leków, służących do leczenia poważnych schorzeń oraz będących odpowiedzią na niezaspokojone potrzeby medyczne. W 2011 roku firma Bayer zawarła porozumienie z Onyx Pharmaceuticals, Inc., zgodnie z którym Onyx otrzyma tantiemy z tytułu jakiejkolwiek przyszłej globalnej sprzedaży netto regorafenibu w zakresie zastosowań onkologicznych. Regorafenib w leczeniu raka jelita grubego (badanie kliniczne CORRECT) Uzyskano również pozytywne wyniki w badaniu klinicznym III fazy stosowania regorafenibu u chorych na przerzutowego raka jelita grubego (mcrc), u których doszło do progresji choroby po zastosowaniu zatwierdzonych standardowych metod leczenia. W badaniu CORRECT (Colorectal cancer treated with regorafenib or placebo after failure of standard therapy) osiągnięto pierwszorzędowy punkt końcowy polegający na statystycznie znamiennej poprawie wskaźnika ogólnego przeżycia, jak również drugorzędowy punkt końcowy polegający na statystycznie znamiennej poprawie wskaźnika przeżycia bez progresji. W badaniu tym bezpieczeństwo i tolerancja regorafenibu zasadniczo kształtowały się na oczekiwanym poziomie. Nie odnotowano nowych lub nieoczekiwanych przypadków toksyczności. Dane z tego badania przedstawiono jako pilne doniesienie przełomowe (ang. late breaking abstract) podczas ustnej sesji abstraktowej na Dorocznym Sympozjum Nowotworów Układu Pokarmowego Amerykańskiego Towarzystwa Onkologii Klinicznej (ASCO-GI) w styczniu 2012 r. Bayer HealthCare Grupa Bayer jest globalnym przedsiębiorstwem o kluczowych obszarach kompetencji w dziedzinie opieki zdrowotnej, środków ochrony roślin i wysokospecjalistycznych materiałów. Bayer HealthCare, podgrupa Bayer AG o rocznej sprzedaży w wysokości 17,2 miliarda euro (dane z 2011 r.) jest jedną z wiodących, innowacyjnych firm światowych, działających w branży opieki zdrowotnej i produktów medycznych z siedzibą w Leverkusen w Niemczech. Bayer HealthCare działa w zakresie Weterynarii, Consumer Care, Medical Care oraz działu Farmaceutycznego. Celem Bayer HealthCare jest odkrywanie i wytwarzanie produktów poprawiających jakość życia i zdrowie ludzi i zwierząt na świecie. Bayer HealthCare zatrudnia na całym świecie pracowników (dane z 31 grudnia 2011 r.) i jest reprezentowana w ponad 100 krajach. Więcej informacji można znaleźć na stronie - 4/5 -
5 Kontakt w firmie Bayer: Monika Lechowska, tel monika.lechowska@bayer.com Więcej informacji można znaleźć pod adresem Oświadczenia dotyczące przyszłości Niniejsze informacje mogą zawierać oświadczenia dotyczące przyszłości, oparte na bieżących założeniach i prognozach autorstwa kierownictwa Grupy Bayer lub jednej z jej podgrup. W wyniku różnych rodzajów znanego i nieznanego ryzyka, niepewnych sytuacji i innych czynników może dojść do znaczących różnic pomiędzy faktycznymi wynikami w przyszłości, sytuacją finansową, rozwojem lub wynikami firmy a założeniami przedstawionymi w niniejszym dokumencie. Niektóre z tych czynników zostały wymienione w publicznie dostępnych sprawozdaniach firmy Bayer, dostępnych na stronie Firma niniejszym zrzeka się wszelkiej odpowiedzialności związanej z aktualizowaniem wspomnianych oświadczeń dotyczących przyszłości lub z ich dostosowaniem do przyszłych wydarzeń bądź kierunków rozwoju. - 5/5 -
Wyniki zasadniczego badania fazy III u pacjentów z rakiem jelita grubego z przerzutami:
 Informacja prasowa Bayer HealthCare Public Relations Al.Jerozolimskie 158 02-326 Warszawa Polska Wyniki zasadniczego badania fazy III u pacjentów z rakiem jelita grubego z przerzutami: Pozytywne dane z
Informacja prasowa Bayer HealthCare Public Relations Al.Jerozolimskie 158 02-326 Warszawa Polska Wyniki zasadniczego badania fazy III u pacjentów z rakiem jelita grubego z przerzutami: Pozytywne dane z
Terapeutyczne Programy Zdrowotne 2009 Leczenie nowotworów podścieliska przewodu pokarmowego (GIST) Załącznik nr 9
 Załącznik nr 9 Nazwa programu: do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Załącznik nr 9 Nazwa programu: do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Terapeutyczne Programy Zdrowotne 2012 Leczenie nowotworów podścieliska przewodu pokarmowego (GIST) Załącznik nr 8
 Załącznik nr 8 Nazwa programu: do Zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Załącznik nr 8 Nazwa programu: do Zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48)
 Dziennik Urzędowy Ministra Zdrowia 492 Poz. 66 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Dziennik Urzędowy Ministra Zdrowia 492 Poz. 66 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
L E G E N D A SESJE EDUKACYJNE SESJE PATRONACKIE SESJE SPONSOROWANE, SESJE LUNCHOWE, WARSZTATY SESJA PROGRAMU EDUKACJI ONKOLOGICZNEJ
 PROGRAM RAMOWY L E G E N D A SESJE EDUKACYJNE SESJE PATRONACKIE SESJE SPONSOROWANE, SESJE LUNCHOWE, WARSZTATY SESJA PROGRAMU EDUKACJI ONKOLOGICZNEJ WYDARZENIA TOWARZYSZĄCE CZWARTEK, 30 SIERPNIA 2018 ROKU
PROGRAM RAMOWY L E G E N D A SESJE EDUKACYJNE SESJE PATRONACKIE SESJE SPONSOROWANE, SESJE LUNCHOWE, WARSZTATY SESJA PROGRAMU EDUKACJI ONKOLOGICZNEJ WYDARZENIA TOWARZYSZĄCE CZWARTEK, 30 SIERPNIA 2018 ROKU
Data rozpoczęcia badania klinicznego i przewidywan y czas jego trwania. Przewidywana liczba uczestników badania klinicznego i kryteria ich rekrutacji
 Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
Nowotwór złośliwy oskrzela i płuca
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy oskrzela i płuca Bevacizumab Bewacyzumab w skojarzeniu z chemioterapią opartą na pochodnych platyny jest wskazany w leczeniu pierwszego
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy oskrzela i płuca Bevacizumab Bewacyzumab w skojarzeniu z chemioterapią opartą na pochodnych platyny jest wskazany w leczeniu pierwszego
Ewaluacja ex ante programu sektorowego INNOMED
 Ewaluacja ex ante programu sektorowego INNOMED PLAN PREZENTACJI 1. Krótki opis Programu 2. Cele i zakres ewaluacji 3. Kryteria ewaluacji 4. Metodologia badania 5. Wnioski 6.Analiza SWOT 7.Rekomendacje
Ewaluacja ex ante programu sektorowego INNOMED PLAN PREZENTACJI 1. Krótki opis Programu 2. Cele i zakres ewaluacji 3. Kryteria ewaluacji 4. Metodologia badania 5. Wnioski 6.Analiza SWOT 7.Rekomendacje
LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48)
 Dziennik Urzędowy Ministra Zdrowia 546 Poz. 71 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Dziennik Urzędowy Ministra Zdrowia 546 Poz. 71 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Piotr Potemski. Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi
 Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Lepiej skazać stu niewinnych ludzi, niż jednego
Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Lepiej skazać stu niewinnych ludzi, niż jednego
Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego. Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa
 Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa RAK TRZUSTKI U 50% chorych w momencie rozpoznania stwierdza się
Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa RAK TRZUSTKI U 50% chorych w momencie rozpoznania stwierdza się
Elotuzumab jest pierwszym w swojej klasie przeciwciałem immunostymulującym
 Europejska Agencja Leków przyznała tryb przyspieszonej oceny wniosku o dopuszczenie do obrotu produktu elotuzumab w leczeniu szpiczaka plazmocytowego u pacjentów, którzy wcześniej otrzymali jedną lub więcej
Europejska Agencja Leków przyznała tryb przyspieszonej oceny wniosku o dopuszczenie do obrotu produktu elotuzumab w leczeniu szpiczaka plazmocytowego u pacjentów, którzy wcześniej otrzymali jedną lub więcej
Wydłużenie życia chorych z rakiem płuca - nowe możliwości
 Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Terapie dla kobiet z zaawansowanym rakiem piersi w Polsce
 Warszawa, 27.01.2016 Seminarium naukowe: Terapie przełomowe w onkologii i hematoonkologii a dostępność do leczenia w Polsce na tle Europy Terapie dla kobiet z zaawansowanym rakiem piersi w Polsce Dr n.
Warszawa, 27.01.2016 Seminarium naukowe: Terapie przełomowe w onkologii i hematoonkologii a dostępność do leczenia w Polsce na tle Europy Terapie dla kobiet z zaawansowanym rakiem piersi w Polsce Dr n.
Data zakończenia badania klinicznego
 Lp. Numer protokołu badania Nazwa sponsora/cro Skład zespołu badawczego Data rozpoczęcia badania klinicznego w ośrodku Data zakończenia badania klinicznego 1 2 3 6 6 12 1. NR001-03 Faza III rejestracyjna
Lp. Numer protokołu badania Nazwa sponsora/cro Skład zespołu badawczego Data rozpoczęcia badania klinicznego w ośrodku Data zakończenia badania klinicznego 1 2 3 6 6 12 1. NR001-03 Faza III rejestracyjna
Praktyczne stosowanie terapii celowanej w hematologii aktualne problemy
 Prof. Andrzej Hellmann Katedra i Klinika Hematologii i Transplantologii Gdański Uniwersytet Medyczny Praktyczne stosowanie terapii celowanej w hematologii aktualne problemy Seminarium Edukacyjne Innowacje
Prof. Andrzej Hellmann Katedra i Klinika Hematologii i Transplantologii Gdański Uniwersytet Medyczny Praktyczne stosowanie terapii celowanej w hematologii aktualne problemy Seminarium Edukacyjne Innowacje
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Wyniki badania CLARINET w jelitowotrzustkowych nowotworach neuroendokrynnych GEP-NET/NEN bez czynności wydzielniczej
 Wyniki badania CLARINET w jelitowotrzustkowych nowotworach neuroendokrynnych GEP-NET/NEN bez czynności wydzielniczej Jarosław B. Ćwikła UWM Olsztyn i CMKP Warszawa jbcwikla@interia.pl Wieloośrodkowe, randomizowane
Wyniki badania CLARINET w jelitowotrzustkowych nowotworach neuroendokrynnych GEP-NET/NEN bez czynności wydzielniczej Jarosław B. Ćwikła UWM Olsztyn i CMKP Warszawa jbcwikla@interia.pl Wieloośrodkowe, randomizowane
Postępy w leczeniu uogólnionego raka jelita grubego
 Postępy w leczeniu uogólnionego raka jelita grubego Lucjan Wyrwicz Klinika Gastroenterologii Onkologicznej Centrum Onkologii Instytut im. M. Skłodowskiej-Curie w Warszawie Słowo wstępne: 30 mies. oraz
Postępy w leczeniu uogólnionego raka jelita grubego Lucjan Wyrwicz Klinika Gastroenterologii Onkologicznej Centrum Onkologii Instytut im. M. Skłodowskiej-Curie w Warszawie Słowo wstępne: 30 mies. oraz
Data zakończenia badania klinicznego
 Lp. Numer protokołu badania Nazwa sponsora/cro Skład zespołu badawczego Data rozpoczęcia badania klinicznego w ośrodku Data zakończenia badania klinicznego 1 2 3 6 6 12 1. EMRII200037-014 Otwarte, randomizowane,
Lp. Numer protokołu badania Nazwa sponsora/cro Skład zespołu badawczego Data rozpoczęcia badania klinicznego w ośrodku Data zakończenia badania klinicznego 1 2 3 6 6 12 1. EMRII200037-014 Otwarte, randomizowane,
Warszawa, 31.10.2007r.
 Warszawa, 31.10.2007r. Lek Taxotere otrzymuje pozytywną opinię Komitetu ds. Produktów Leczniczych stosowanych u Ludzi (CHMP), zalecającą rejestrację w Unii Europejskiej do leczenia indukcyjnego miejscowo
Warszawa, 31.10.2007r. Lek Taxotere otrzymuje pozytywną opinię Komitetu ds. Produktów Leczniczych stosowanych u Ludzi (CHMP), zalecającą rejestrację w Unii Europejskiej do leczenia indukcyjnego miejscowo
Data rozpoczęcia badania klinicznego i przewidywan y czas jego trwania. Przewidywana liczba uczestników badania klinicznego i kryteria ich rekrutacji
 Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
Richter i Allergan przedstawiają bieżące informacje nt. programu dotyczącego kariprazyny
 BUDAPESZT, Węgry i DUBLIN, Irlandia 5 sierpnia 2016 r Richter i Allergan przedstawiają bieżące informacje nt. programu dotyczącego kariprazyny Spółka Allergan plc (AGN), wiodąca globalna firma farmaceutyczna
BUDAPESZT, Węgry i DUBLIN, Irlandia 5 sierpnia 2016 r Richter i Allergan przedstawiają bieżące informacje nt. programu dotyczącego kariprazyny Spółka Allergan plc (AGN), wiodąca globalna firma farmaceutyczna
Badania laboratoryjne (i inne) są wykonywane w jednych z najlepszych na świecie laboratoriów.
 {jcomments off} BADANIA KLINICZNE 1. W badaniach klinicznych testuje się nowe leki. 2. Badania kliniczne są często jedyną okazją do podjęcia leczenia w przypadku nieskuteczności lub niskiej sktutecznosći
{jcomments off} BADANIA KLINICZNE 1. W badaniach klinicznych testuje się nowe leki. 2. Badania kliniczne są często jedyną okazją do podjęcia leczenia w przypadku nieskuteczności lub niskiej sktutecznosći
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 130/2013 z dnia 22 lipca 2013 w sprawie oceny leku Afinitor (ewerolimus), tabletki, 5 mg, 30 tabl., kod EAN 5909990711567
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 130/2013 z dnia 22 lipca 2013 w sprawie oceny leku Afinitor (ewerolimus), tabletki, 5 mg, 30 tabl., kod EAN 5909990711567
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 199/2014 z dnia 18 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 199/2014 z dnia 18 sierpnia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia z wykazu świadczeń gwarantowanych
Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
EMA/55246/2019 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest lekiem
Data rozpoczęcia badania klinicznego i przewidywan y czas jego trwania. Przewidywana liczba uczestników badania klinicznego i kryteria ich rekrutacji
 Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
RAK NERKOWO-KOMÓRKOWY UOGÓLNIONE STADIUM PRZEWLEKŁA CHOROBA // DŁUGOŚĆ LECZENIA
 RAK NERKOWO-KOMÓRKOWY PRZEWLEKŁA CHOROBA // DŁUGOŚĆ LECZENIA Maciej Krzakowski Centrum Onkologii-Instytut im. Marii Skłodowskiej-Curie Warszawa 1 SYGNAŁOWE SZLAKI // TERAPEUTYCZNE CELE * Oudard i wsp.
RAK NERKOWO-KOMÓRKOWY PRZEWLEKŁA CHOROBA // DŁUGOŚĆ LECZENIA Maciej Krzakowski Centrum Onkologii-Instytut im. Marii Skłodowskiej-Curie Warszawa 1 SYGNAŁOWE SZLAKI // TERAPEUTYCZNE CELE * Oudard i wsp.
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 30/2014 z dnia 28 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 30/2014 z dnia 28 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Aneks III Zmiany w charakterystyce produktu leczniczego oraz w ulotce dla pacjenta
 Aneks III Zmiany w charakterystyce produktu leczniczego oraz w ulotce dla pacjenta Uwaga: Niniejsze zmiany do streszczenia charakterystyki produktu leczniczego i ulotki dla pacjenta są wersją obowiązującą
Aneks III Zmiany w charakterystyce produktu leczniczego oraz w ulotce dla pacjenta Uwaga: Niniejsze zmiany do streszczenia charakterystyki produktu leczniczego i ulotki dla pacjenta są wersją obowiązującą
Klinika Endokrynologii [1]
![Klinika Endokrynologii [1] Klinika Endokrynologii [1]](/thumbs/60/44417095.jpg) Klinika Endokrynologii [1] Dane kontaktowe: tel. 41 36 74 181 fax 41 3456882 Kierownik kliniki: dr. hab. n. med. Aldona Kowalska (specjalista chorób wewnętrznych, specjalista medycyny nuklearnej, endokrynolog
Klinika Endokrynologii [1] Dane kontaktowe: tel. 41 36 74 181 fax 41 3456882 Kierownik kliniki: dr. hab. n. med. Aldona Kowalska (specjalista chorób wewnętrznych, specjalista medycyny nuklearnej, endokrynolog
Nowotwór złośliwy piersi
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy piersi Lapatinib Refundacja z ograniczeniami Lapatinib jest wskazany do leczenia dorosłych pacjentów z rakiem piersi, u których nowotwór
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy piersi Lapatinib Refundacja z ograniczeniami Lapatinib jest wskazany do leczenia dorosłych pacjentów z rakiem piersi, u których nowotwór
Data rozpoczęcia badania klinicznego i przewidywan y czas jego trwania. Przewidywana liczba uczestników badania klinicznego i kryteria ich rekrutacji
 Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzić Skład zespołu badawczego rozpoczęcia
INFORMACJA O BADANIACH KLINICZNYCH PROWADZONYCH W CENTRUM ONKOLOGII INSTYTUCIE IM. MARII SKŁODOWSKIEJ-CURIE, ODDZIALE W GLIWICACH
 I KLINIKA RADIOTERAPII I CHEMIOTERAPII /komórka organizacyjna/ Załącznik do Zarządzenia Nr 25/2014 z dnia 20.06.2014 INFORMACJA O BADANIACH KLINICZNYCH PROWADZONYCH W CENTRUM ONKOLOGII INSTYTUCIE IM. MARII
I KLINIKA RADIOTERAPII I CHEMIOTERAPII /komórka organizacyjna/ Załącznik do Zarządzenia Nr 25/2014 z dnia 20.06.2014 INFORMACJA O BADANIACH KLINICZNYCH PROWADZONYCH W CENTRUM ONKOLOGII INSTYTUCIE IM. MARII
Leczenie zaawansowanych (nieresekcyjnych i/lub przerzutowych) GIST Nieoperacyjny lub rozsiany GIST jest oporny na konwencjonalną chemioterapię.
 Leczenie zaawansowanych (nieresekcyjnych i/lub przerzutowych) GIST Nieoperacyjny lub rozsiany GIST jest oporny na konwencjonalną chemioterapię. Rola radioterapii nie jest ostatecznie ustalona. Dotychczasowe
Leczenie zaawansowanych (nieresekcyjnych i/lub przerzutowych) GIST Nieoperacyjny lub rozsiany GIST jest oporny na konwencjonalną chemioterapię. Rola radioterapii nie jest ostatecznie ustalona. Dotychczasowe
Terapeutyczne Programy Zdrowotne 2010 Leczenie raka nerki Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku
 Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny: Nowotwór złośliwy nerki za wyjątkiem miedniczki
Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny: Nowotwór złośliwy nerki za wyjątkiem miedniczki
NOWE ZWIĄZKI PRZECIWNOWOTWOROWE Z GRUPY INHIBITORÓW KINAZY TYROZYNOWEJ EGFR STOSOWANE W TERAPII CELOWANEJ. Joanna Rozegnał
 NOWE ZWIĄZKI PRZECIWNOWOTWOROWE Z GRUPY INHIBITORÓW KINAZY TYROZYNOWEJ EGFR STOSOWANE W TERAPII CELOWANEJ Joanna Rozegnał TERAPIA CELOWANA: Jedna z najbardziej nowoczesnych metod leczenia nowotworów Skierowana
NOWE ZWIĄZKI PRZECIWNOWOTWOROWE Z GRUPY INHIBITORÓW KINAZY TYROZYNOWEJ EGFR STOSOWANE W TERAPII CELOWANEJ Joanna Rozegnał TERAPIA CELOWANA: Jedna z najbardziej nowoczesnych metod leczenia nowotworów Skierowana
czerniak (nowotwór skóry), który rozprzestrzenił się lub którego nie można usunąć chirurgicznie;
 EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/524789/2017 EMEA/H/C/003820 Streszczenie EPAR dla ogółu społeczeństwa pembrolizumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Data rozpoczęcia badania klinicznego i przewidywan y czas jego trwania. Przewidywana liczba uczestników badania klinicznego i kryteria ich rekrutacji
 Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzid Skład zespołu badawczego rozpoczęcia
Lp. Tytuł Nazwa sponsora lub przedstawiciela sponsora Dane identyfikujące koordynatora /lub badacza, w tym czy prowadzi on równolegle inne kliniczne lub zamierza je prowadzid Skład zespołu badawczego rozpoczęcia
Keytruda (pembrolizumab)
 EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
EMA/235911/2019 EMEA/H/C/003820 Przegląd wiedzy na temat leku Keytruda i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Keytruda i w jakim celu się go stosuje Keytruda
Europejski Tydzień Walki z Rakiem
 1 Europejski Tydzień Walki z Rakiem 25-31 maj 2014 (http://www.kodekswalkizrakiem.pl/kodeks/) Od 25 do 31 maja obchodzimy Europejski Tydzień Walki z Rakiem. Jego celem jest edukacja społeczeństwa w zakresie
1 Europejski Tydzień Walki z Rakiem 25-31 maj 2014 (http://www.kodekswalkizrakiem.pl/kodeks/) Od 25 do 31 maja obchodzimy Europejski Tydzień Walki z Rakiem. Jego celem jest edukacja społeczeństwa w zakresie
Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków
 Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków 1 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej kwasu nikotynowego/laropiprantu
Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków 1 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej kwasu nikotynowego/laropiprantu
Promocja konsultacji społecznych w ochronie zdrowia
 Promocja konsultacji społecznych w ochronie zdrowia PROJEKT WSPÓŁFINANSOWANY PRZEZ SZWAJCARIĘ W RAMACH SZWAJCARSKIEGO PROGRAMU WSPÓŁPRACY Z NOWYMI KRAJAMI CZŁONKOWSKIMI UNII EUROPEJSKIEJ Maria Libura Instytut
Promocja konsultacji społecznych w ochronie zdrowia PROJEKT WSPÓŁFINANSOWANY PRZEZ SZWAJCARIĘ W RAMACH SZWAJCARSKIEGO PROGRAMU WSPÓŁPRACY Z NOWYMI KRAJAMI CZŁONKOWSKIMI UNII EUROPEJSKIEJ Maria Libura Instytut
PARLAMENT EUROPEJSKI
 PARLAMENT EUROPEJSKI 2004 Dokument z posiedzenia 2009 30.11.2007 B6-0000/2007 PROJEKT REZOLUCJI w odpowiedzi na pytanie wymagające ustnej odpowiedzi B6-0000/2007 zgodnie z art. 108 ust. 5 regulaminu złożyli
PARLAMENT EUROPEJSKI 2004 Dokument z posiedzenia 2009 30.11.2007 B6-0000/2007 PROJEKT REZOLUCJI w odpowiedzi na pytanie wymagające ustnej odpowiedzi B6-0000/2007 zgodnie z art. 108 ust. 5 regulaminu złożyli
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka szpikowa
Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka szpikowa
LECZENIE CHORYCH NA PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE CHORYCH NA PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka
Załącznik B.14. LECZENIE CHORYCH NA PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Dziennik Urzędowy Ministra Zdrowia 624 Poz. 71 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Dziennik Urzędowy Ministra Zdrowia 624 Poz. 71 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE
 EMA/489091/2018 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest
EMA/489091/2018 EMEA/H/C/003985 Przegląd wiedzy na temat leku Opdivo i uzasadnienie udzielenia Pozwolenia na dopuszczenie do obrotu w UE Co to jest lek Opdivo i w jakim celu się go stosuje Opdivo jest
Dlaczego potrzebne było badanie?
 Badanie mające na celu zbadanie czy lek BI 409306 polepsza sprawność umysłową u osób z łagodną postacią choroby Alzheimera oraz trudności z funkcjonowaniem psychicznym Jest to podsumowanie badania klinicznego
Badanie mające na celu zbadanie czy lek BI 409306 polepsza sprawność umysłową u osób z łagodną postacią choroby Alzheimera oraz trudności z funkcjonowaniem psychicznym Jest to podsumowanie badania klinicznego
Lek BI w porównaniu z lekiem Humira u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą
 Lek w porównaniu z lekiem u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą Jest to podsumowanie badania klinicznego dotyczącego łuszczycy plackowatej. Podsumowanie sporządzono dla ogółu społeczeństwa.
Lek w porównaniu z lekiem u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą Jest to podsumowanie badania klinicznego dotyczącego łuszczycy plackowatej. Podsumowanie sporządzono dla ogółu społeczeństwa.
Piotr Potemski. Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi
 Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Obserwowane są samoistne regresje zmian przerzutowych
Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Obserwowane są samoistne regresje zmian przerzutowych
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2237783 (96) Data i numer zgłoszenia patentu europejskiego: 21.01.09 0970426.8 (13) (1) T3 Int.Cl. A61K 31/06 (06.01) A61P
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 2237783 (96) Data i numer zgłoszenia patentu europejskiego: 21.01.09 0970426.8 (13) (1) T3 Int.Cl. A61K 31/06 (06.01) A61P
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Dziennik Urzędowy Ministra Zdrowia 618 Poz. 51 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Dziennik Urzędowy Ministra Zdrowia 618 Poz. 51 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Press Release. Rozpoczęto realizację pierwszych dedykowanych badań dotyczących stosowania empagliflozyny u chorych na przewlekłą niewydolność serca
 Rozpoczęto realizację pierwszych dedykowanych badań dotyczących stosowania empagliflozyny u chorych na przewlekłą niewydolność serca Program badań klinicznych EMPEROR HF przeprowadzony zostanie w celu
Rozpoczęto realizację pierwszych dedykowanych badań dotyczących stosowania empagliflozyny u chorych na przewlekłą niewydolność serca Program badań klinicznych EMPEROR HF przeprowadzony zostanie w celu
Sytuacja ginekologii onkologicznej w Polsce. Prof. dr hab. Zbigniew Kojs
 Sytuacja ginekologii onkologicznej w Polsce Prof. dr hab. Zbigniew Kojs CONCORD Globalny nadzór nad przeżyciami chorych na raka w latach 1995 2009: analiza indywidualnych danych dla 25 676 887 pacjentów
Sytuacja ginekologii onkologicznej w Polsce Prof. dr hab. Zbigniew Kojs CONCORD Globalny nadzór nad przeżyciami chorych na raka w latach 1995 2009: analiza indywidualnych danych dla 25 676 887 pacjentów
Pierwsze badanie dla nowego leku przeprowadził (chociaż incydentalnie) chirurg Ambroise Pare w 1537.
 BADANIA KLINICZNE W myśl Ustawy o zawodach lekarza i lekarza dentysty (Dz.U. z 2008 r. Nr 136, poz. 857) badanie kliniczne zalicza się do eksperymentów medycznych. Ustawa wyróżnia dwa rodzaje eksperymentów
BADANIA KLINICZNE W myśl Ustawy o zawodach lekarza i lekarza dentysty (Dz.U. z 2008 r. Nr 136, poz. 857) badanie kliniczne zalicza się do eksperymentów medycznych. Ustawa wyróżnia dwa rodzaje eksperymentów
Ocena Pracy Doktorskiej mgr Moniki Aleksandry Ziętarskiej
 Prof. dr hab. n. med. Robert Słotwiński Warszawa 30.07.2018 Zakład Immunologii Biochemii i Żywienia Wydziału Nauki o Zdrowiu Warszawski Uniwersytet Medyczny Ocena Pracy Doktorskiej mgr Moniki Aleksandry
Prof. dr hab. n. med. Robert Słotwiński Warszawa 30.07.2018 Zakład Immunologii Biochemii i Żywienia Wydziału Nauki o Zdrowiu Warszawski Uniwersytet Medyczny Ocena Pracy Doktorskiej mgr Moniki Aleksandry
Forum Organizacji Pacjentów Onkologicznych. Problemy dostępu do leczenia
 Forum Organizacji Pacjentów Onkologicznych Problemy dostępu do leczenia Warszawa, 26 kwietnia 2012 1. CIĄGŁOŚĆ LECZENIA ONKOLOGICZNEGO 2. REGULACJA DOSTĘPU DO LECZENIA NA POZIOMIE ROZPORZĄDZEŃ/ZARZĄDZEŃ
Forum Organizacji Pacjentów Onkologicznych Problemy dostępu do leczenia Warszawa, 26 kwietnia 2012 1. CIĄGŁOŚĆ LECZENIA ONKOLOGICZNEGO 2. REGULACJA DOSTĘPU DO LECZENIA NA POZIOMIE ROZPORZĄDZEŃ/ZARZĄDZEŃ
Mefelor 50/5 mg Tabletka o przedłużonym uwalnianiu. Metoprololtartrat/Felodipi n AbZ 50 mg/5 mg Retardtabletten
 ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCÓW, POSIADACZY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH Państwo członkowskie Podmiot
ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCÓW, POSIADACZY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH Państwo członkowskie Podmiot
ANEKS I. Strona 1 z 5
 ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC WETERYNARYJNYCH PRODUKTÓW LECZNICZYCH, GATUNKI ZWIERZĄT, DROGA PODANIA, PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH
ANEKS I WYKAZ NAZW, POSTAĆ FARMACEUTYCZNA, MOC WETERYNARYJNYCH PRODUKTÓW LECZNICZYCH, GATUNKI ZWIERZĄT, DROGA PODANIA, PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH
Spółki Sanofi i Regeneron ogłosiły wstępne pozytywne wyniki badań fazy II nad przeciwciałem przeciwko PCSK9 w hipercholesterolemii
 INFORMACJA PRASOWA Spółki Sanofi i Regeneron ogłosiły wstępne pozytywne wyniki badań fazy II nad przeciwciałem przeciwko PCSK9 w hipercholesterolemii Paryż, Francja i Tarrytown, NY 10 listopada 2011 r.
INFORMACJA PRASOWA Spółki Sanofi i Regeneron ogłosiły wstępne pozytywne wyniki badań fazy II nad przeciwciałem przeciwko PCSK9 w hipercholesterolemii Paryż, Francja i Tarrytown, NY 10 listopada 2011 r.
Onkologia - opis przedmiotu
 Onkologia - opis przedmiotu Informacje ogólne Nazwa przedmiotu Onkologia Kod przedmiotu 12.0-WL-Lek-On Wydział Wydział Lekarski i Nauk o Zdrowiu Kierunek Lekarski Profil praktyczny Rodzaj studiów jednolite
Onkologia - opis przedmiotu Informacje ogólne Nazwa przedmiotu Onkologia Kod przedmiotu 12.0-WL-Lek-On Wydział Wydział Lekarski i Nauk o Zdrowiu Kierunek Lekarski Profil praktyczny Rodzaj studiów jednolite
Przegląd publikacji z roku 2013 Cancer New England Journal of Medicine Annals of Oncology
 Przegląd publikacji z roku 2013 Cancer New England Journal of Medicine Annals of Oncology Renata Zaucha HOT TOPICS 2014 w Onkologii Ginekologicznej Warszawa Wybrane publikacje 1 Annals of Oncology 2013;
Przegląd publikacji z roku 2013 Cancer New England Journal of Medicine Annals of Oncology Renata Zaucha HOT TOPICS 2014 w Onkologii Ginekologicznej Warszawa Wybrane publikacje 1 Annals of Oncology 2013;
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1773451 (96) Data i numer zgłoszenia patentu europejskiego: 08.06.2005 05761294.7 (13) (51) T3 Int.Cl. A61K 31/4745 (2006.01)
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1773451 (96) Data i numer zgłoszenia patentu europejskiego: 08.06.2005 05761294.7 (13) (51) T3 Int.Cl. A61K 31/4745 (2006.01)
 W badaniu 4S (ang. Scandinavian Simvastatin Survivat Study), oceniano wpływ symwastatyny na całkowitą śmiertelność u 4444 pacjentów z chorobą wieńcową i z wyjściowym stężeniem cholesterolu całkowitego
W badaniu 4S (ang. Scandinavian Simvastatin Survivat Study), oceniano wpływ symwastatyny na całkowitą śmiertelność u 4444 pacjentów z chorobą wieńcową i z wyjściowym stężeniem cholesterolu całkowitego
Aneks II. Niniejsza Charakterystyka Produktu Leczniczego oraz ulotka dla pacjenta stanowią wynik procedury arbitrażowej.
 Aneks II Zmiany dotyczące odpowiednich punktów Charakterystyki Produktu Leczniczego oraz ulotki dla pacjenta przedstawione przez Europejską Agencję Leków (EMA) Niniejsza Charakterystyka Produktu Leczniczego
Aneks II Zmiany dotyczące odpowiednich punktów Charakterystyki Produktu Leczniczego oraz ulotki dla pacjenta przedstawione przez Europejską Agencję Leków (EMA) Niniejsza Charakterystyka Produktu Leczniczego
Część A Programy lekowe
 Wymagania wobec świadczeniodawców udzielających z zakresu programów zdrowotnych (lekowych) Część A Programy lekowe 1.1 WARUNKI 1. LECZENIE PRZEWLEKŁEGO WZW TYPU B 1.1.1 wymagania formalne Wpis w rejestrze
Wymagania wobec świadczeniodawców udzielających z zakresu programów zdrowotnych (lekowych) Część A Programy lekowe 1.1 WARUNKI 1. LECZENIE PRZEWLEKŁEGO WZW TYPU B 1.1.1 wymagania formalne Wpis w rejestrze
Warszawa, 20 kwietnia - Mirosław Zieliński LEKI SIEROCE. Dostępność Ograniczenia Wyzwania
 Warszawa, 20 kwietnia - Mirosław Zieliński LEKI SIEROCE Dostępność Ograniczenia Wyzwania Rzadka choroba - Rozporządzenie UE 141/2000 art. 3 : za rzadką chorobę uważa się stan chorobowy występujący nie
Warszawa, 20 kwietnia - Mirosław Zieliński LEKI SIEROCE Dostępność Ograniczenia Wyzwania Rzadka choroba - Rozporządzenie UE 141/2000 art. 3 : za rzadką chorobę uważa się stan chorobowy występujący nie
Ginekolodzy onkolodzy z całej Polski debatowali w ŚCO
 Ginekolodzy onkolodzy z całej Polski debatowali w ŚCO O tym jak skutecznie leczyć nowotwory ginekologiczne oraz jak planować rodzinę w obliczu choroby nowotworowej rozmawiali ginekolodzy z ośrodków onkologicznych
Ginekolodzy onkolodzy z całej Polski debatowali w ŚCO O tym jak skutecznie leczyć nowotwory ginekologiczne oraz jak planować rodzinę w obliczu choroby nowotworowej rozmawiali ginekolodzy z ośrodków onkologicznych
Kwestie etyczne związane z leczeniem chorób rzadkich w Polsce. Prezes KFO - Mirosław Zieliński
 Kwestie etyczne związane z leczeniem chorób rzadkich w Polsce Prezes KFO - Mirosław Zieliński Imperatyw etyczny: Pomoc innemu w potrzebie jest wpisana w naturę człowieka... Etyka a prawo... w przypadku
Kwestie etyczne związane z leczeniem chorób rzadkich w Polsce Prezes KFO - Mirosław Zieliński Imperatyw etyczny: Pomoc innemu w potrzebie jest wpisana w naturę człowieka... Etyka a prawo... w przypadku
Działalnośd GlaxoSmithKline w Polsce. Krzysztof Kępioski Dyrektor Relacji Zewnętrznych
 Działalnośd GlaxoSmithKline w Polsce Krzysztof Kępioski Dyrektor Relacji Zewnętrznych GSK na świecie Globalna firma farmaceutyczna, działająca w blisko 100 krajach 96 tys. pracowników, w tym 12 tys. naukowców
Działalnośd GlaxoSmithKline w Polsce Krzysztof Kępioski Dyrektor Relacji Zewnętrznych GSK na świecie Globalna firma farmaceutyczna, działająca w blisko 100 krajach 96 tys. pracowników, w tym 12 tys. naukowców
Warszawa, 22 marca Mirosław Zieliński LEKI SIEROCE. Dostępność w Polsce i innych krajach UE
 Warszawa, 22 marca 2016 - Mirosław Zieliński LEKI SIEROCE Dostępność w Polsce i innych krajach UE Warszawa, 22 marca 2016 - Mirosław Zieliński LEKI SIEROCE Dostępność, ograniczenia i wyzwania dla Polski
Warszawa, 22 marca 2016 - Mirosław Zieliński LEKI SIEROCE Dostępność w Polsce i innych krajach UE Warszawa, 22 marca 2016 - Mirosław Zieliński LEKI SIEROCE Dostępność, ograniczenia i wyzwania dla Polski
Innowacje w hematoonkologii ocena dostępności w Polsce
 Warszawa, 22 maja 2012 r. Seminarium edukacyjne pt.: Podsumowanie Seminarium 22 maja 2012 r. miało miejsce w Warszawie ósme z kolei seminarium Fundacji Watch Health Care pt.: " - ocena dostępności w Polsce".
Warszawa, 22 maja 2012 r. Seminarium edukacyjne pt.: Podsumowanie Seminarium 22 maja 2012 r. miało miejsce w Warszawie ósme z kolei seminarium Fundacji Watch Health Care pt.: " - ocena dostępności w Polsce".
www.aotm.gov.pl Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 84/2013 z dnia 22 czerwca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Afinitor
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 84/2013 z dnia 22 czerwca 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Afinitor
zaawansowanym rakiem nerkowokomórkowym, rodzajem raka nerki, u pacjentów, którzy byli wcześniej leczeni lekami przeciwnowotworowymi;
 EMA/303208/2017 EMEA/H/C/003985 Streszczenie EPAR dla ogółu społeczeństwa niwolumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
EMA/303208/2017 EMEA/H/C/003985 Streszczenie EPAR dla ogółu społeczeństwa niwolumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku. Wyjaśnia,
Jarosław B. Ćwikła. Wydział Nauk Medycznych Uniwersytet Warmińsko-Mazurski w Olsztynie
 Nowe algorytmy oceny odpowiedzi na leczenie w badaniach strukturalnych, dużo dalej niż klasyczne kryteria RECIST Jarosław B. Ćwikła Wydział Nauk Medycznych Uniwersytet Warmińsko-Mazurski w Olsztynie Radiologiczna
Nowe algorytmy oceny odpowiedzi na leczenie w badaniach strukturalnych, dużo dalej niż klasyczne kryteria RECIST Jarosław B. Ćwikła Wydział Nauk Medycznych Uniwersytet Warmińsko-Mazurski w Olsztynie Radiologiczna
Katarzyna Pogoda Warszawa, 23 marca 2017 roku
 Chemioterapia doustna i podskórne metody podawania leków w raku piersi. Lepsza jakość życia pacjentek Katarzyna Pogoda Warszawa, 23 marca 2017 roku Rak piersi - heterogenna choroba Stopień zaawansowania
Chemioterapia doustna i podskórne metody podawania leków w raku piersi. Lepsza jakość życia pacjentek Katarzyna Pogoda Warszawa, 23 marca 2017 roku Rak piersi - heterogenna choroba Stopień zaawansowania
Cykl kształcenia 2013-2016
 203-206 SYLABUS Nazwa Fizjoterapia kliniczna w chirurgii, onkologii i medycynie paliatywnej. Nazwa jednostki prowadzącej przedmiot Wydział Medyczny, Instytut Fizjoterapii Kod Studia Kierunek studiów Poziom
203-206 SYLABUS Nazwa Fizjoterapia kliniczna w chirurgii, onkologii i medycynie paliatywnej. Nazwa jednostki prowadzącej przedmiot Wydział Medyczny, Instytut Fizjoterapii Kod Studia Kierunek studiów Poziom
Białaczka limfatyczna
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Białaczka limfatyczna OBEJMUJE PRZEWLEKŁĄ BIAŁACZKĘ LIMFOCYTOWĄ (PBL) I OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ALL) Clofarabine Leczenie ostrej białaczki limfoblastycznej
zaawansowany rak nerki lub rak nerki z przerzutami, w skojarzeniu z interferonem alfa-2a;
 EMA/302947/2017 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/302947/2017 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
NOWOTWORY TRZUSTKI KLUCZOWE DANE, EPIDEMIOLOGIA. Dr n. med. Janusz Meder Prezes Polskiej Unii Onkologii 4 listopada 2014 r.
 NOWOTWORY TRZUSTKI KLUCZOWE DANE, EPIDEMIOLOGIA Dr n. med. Janusz Meder Prezes Polskiej Unii Onkologii 4 listopada 2014 r. Najczęstsza postać raka trzustki Gruczolakorak przewodowy trzustki to najczęstsza
NOWOTWORY TRZUSTKI KLUCZOWE DANE, EPIDEMIOLOGIA Dr n. med. Janusz Meder Prezes Polskiej Unii Onkologii 4 listopada 2014 r. Najczęstsza postać raka trzustki Gruczolakorak przewodowy trzustki to najczęstsza
Akupunktura Trudności w projektowaniu badań klinicznych
 Akupunktura Trudności w projektowaniu badań klinicznych AKUPUNKTURA TRUDNOŚCI W PROJEKTOWANIU BADAŃ KLINICZNYCH Bartosz Chmielnicki słowa kluczowe: Akupunktura, metodologia, medycyna oparta na faktach,
Akupunktura Trudności w projektowaniu badań klinicznych AKUPUNKTURA TRUDNOŚCI W PROJEKTOWANIU BADAŃ KLINICZNYCH Bartosz Chmielnicki słowa kluczowe: Akupunktura, metodologia, medycyna oparta na faktach,
Aneks. Wnioski naukowe i podstawy do odmowy przedstawione przez Europejską Agencję Leków
 Aneks Wnioski naukowe i podstawy do odmowy przedstawione przez Europejską Agencję Leków Wnioski naukowe i podstawy do odmowy przedstawione przez Europejską Agencję Leków Produkt leczniczy Folotyn roztwór
Aneks Wnioski naukowe i podstawy do odmowy przedstawione przez Europejską Agencję Leków Wnioski naukowe i podstawy do odmowy przedstawione przez Europejską Agencję Leków Produkt leczniczy Folotyn roztwór
Agencja Oceny Technologii Medycznych i Taryfikacji
 Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Rekomendacja nr 19/2015 z dnia 23 marca 2015 r. Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie objęcia refundacją
Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Rekomendacja nr 19/2015 z dnia 23 marca 2015 r. Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji w sprawie objęcia refundacją
Nazwa programu: PROGRAM LECZENIA W RAMACH ŚWIADCZENIA CHEMIOTERAPII NIESTANDARDOWEJ
 Załącznik nr 38 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: PROGRAM LECZENIA W RAMACH ŚWIADCZENIA CHEMIOTERAPII NIESTANDARDOWEJ ZAKRES ŚWIADCZENIA GWARANTOWANEGO
Załącznik nr 38 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: PROGRAM LECZENIA W RAMACH ŚWIADCZENIA CHEMIOTERAPII NIESTANDARDOWEJ ZAKRES ŚWIADCZENIA GWARANTOWANEGO
LECZENIE KOBIET Z ROZSIANYM, HORMONOZALEŻNYM, HER2 UJEMNYM RAKIEM PIERSI. Maria Litwiniuk Warszawa 28 maja 2019
 LECZENIE KOBIET Z ROZSIANYM, HORMONOZALEŻNYM, HER2 UJEMNYM RAKIEM PIERSI Maria Litwiniuk Warszawa 28 maja 2019 Konflikt interesów Wykłady sponsorowane dla firm: Teva, AstraZeneca, Pfizer, Roche Sponorowanie
LECZENIE KOBIET Z ROZSIANYM, HORMONOZALEŻNYM, HER2 UJEMNYM RAKIEM PIERSI Maria Litwiniuk Warszawa 28 maja 2019 Konflikt interesów Wykłady sponsorowane dla firm: Teva, AstraZeneca, Pfizer, Roche Sponorowanie
typ 3, sporadyczny; Techniki Obrazowe
 Guz neuroendokrynny żołądka typ 3, sporadyczny; Techniki Obrazowe Mariusz I.Furmanek CSK MSWiA i CMKP Warszawa Ocena wyjściowa, metody strukturalne WHO 2 (rak wysoko zróżnicowany); Endoskopia i/lub EUS;
Guz neuroendokrynny żołądka typ 3, sporadyczny; Techniki Obrazowe Mariusz I.Furmanek CSK MSWiA i CMKP Warszawa Ocena wyjściowa, metody strukturalne WHO 2 (rak wysoko zróżnicowany); Endoskopia i/lub EUS;
WYNIKI. typu 2 są. Wpływ linagliptyny na ryzyko sercowo-naczyniowe i czynność nerek u pacjentów z cukrzycą typu 2 z ryzykiem
 Wpływ linagliptyny na ryzyko sercowo-naczyniowe i czynność nerek u pacjentów z cukrzycą typu 2 z ryzykiem sercowo-naczyniowym (badanie CARMELINA, 1218.22) Osoby z cukrzycą typu 2 są narażone na 2 do 4-krotnie
Wpływ linagliptyny na ryzyko sercowo-naczyniowe i czynność nerek u pacjentów z cukrzycą typu 2 z ryzykiem sercowo-naczyniowym (badanie CARMELINA, 1218.22) Osoby z cukrzycą typu 2 są narażone na 2 do 4-krotnie
Płynna biopsja Liquid biopsy. Rafał Dziadziuszko Klinika Onkologii i Radioterapii Gdański Uniwersytet Medyczny
 Płynna biopsja Liquid biopsy Rafał Dziadziuszko Klinika Onkologii i Radioterapii Gdański Uniwersytet Medyczny Podstawowe pojęcia Biopsja uzyskanie materiału tkankowego lub komórkowego z guza celem ustalenia
Płynna biopsja Liquid biopsy Rafał Dziadziuszko Klinika Onkologii i Radioterapii Gdański Uniwersytet Medyczny Podstawowe pojęcia Biopsja uzyskanie materiału tkankowego lub komórkowego z guza celem ustalenia
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Rekomendacja nr 185/2013 z dnia 30 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Agencja Oceny Technologii Medycznych Rada Przejrzystości Rekomendacja nr 185/2013 z dnia 30 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Biologiczne leki biopodobne w pytaniach
 Biologiczne leki biopodobne w pytaniach Dlaczego pacjent powinien wiedzieć więcej? W związku z rozwojem współczesnej medycyny, my pacjenci jesteśmy informowani o jej osiągnięciach, które bezpośrednio mają
Biologiczne leki biopodobne w pytaniach Dlaczego pacjent powinien wiedzieć więcej? W związku z rozwojem współczesnej medycyny, my pacjenci jesteśmy informowani o jej osiągnięciach, które bezpośrednio mają
Dlaczego potrzebne było badanie?
 Badanie mające na celu zbadanie czy lek BI 409306 polepsza sprawność umysłową u osób z chorobą Alzheimera we wczesnym stadium Jest to podsumowanie badania klinicznego przeprowadzonego z udziałem pacjentów
Badanie mające na celu zbadanie czy lek BI 409306 polepsza sprawność umysłową u osób z chorobą Alzheimera we wczesnym stadium Jest to podsumowanie badania klinicznego przeprowadzonego z udziałem pacjentów
Lek Avastin stosuje się u osób dorosłych w leczeniu następujących rodzajów nowotworów w skojarzeniu z innymi lekami przeciwnowotworowymi:
 EMA/175824/2015 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
EMA/175824/2015 EMEA/H/C/000582 Streszczenie EPAR dla ogółu społeczeństwa bewacyzumab Niniejszy dokument jest streszczeniem Europejskiego Publicznego Sprawozdania Oceniającego (EPAR) dotyczącego leku.
Leczenie systemowe raka nie-jasnokomórkowego
 Leczenie systemowe raka nie-jasnokomórkowego Piotr Tomczak Uniwersytet Medyczny w Poznaniu Klinika Onkologii Jastrzębia Góra Nie-jasnokomórkowy rak nerki (ncc RCC) niejednorodna grupa o zróżnicowanej histologii
Leczenie systemowe raka nie-jasnokomórkowego Piotr Tomczak Uniwersytet Medyczny w Poznaniu Klinika Onkologii Jastrzębia Góra Nie-jasnokomórkowy rak nerki (ncc RCC) niejednorodna grupa o zróżnicowanej histologii
dr n. med. Paweł Nurzyński, prof. dr hab. n. med. Andrzej Deptała Klinika Onkologii i Hematologii, Centralny Szpital Kliniczny MSW w Warszawie
 Ewerolimus w codziennej praktyce klinicznej. Omówienie niemieckiego nieinterwencyjnego badania ewerolimusu w terapii przerzutowego raka nerki po niepowodzeniu leczenia inhibitorami kinaz tyrozynowych Everolimus
Ewerolimus w codziennej praktyce klinicznej. Omówienie niemieckiego nieinterwencyjnego badania ewerolimusu w terapii przerzutowego raka nerki po niepowodzeniu leczenia inhibitorami kinaz tyrozynowych Everolimus
