Termodynamika 09/01/2017. Definicje. Układ i otoczenie
|
|
|
- Ludwik Grzelak
- 8 lat temu
- Przeglądów:
Transkrypt
1 Definicje Termodynamika Termodynamika (z greckiego thermo = ciepło) dział fizyki zajmujący się badaniem energetycznych efektów wszelkich przemian fizycznych i chemicznych, które wpływają na zmiany energii wewnętrznej analizowanych układów. Dział ten nie zajmuje się wyjaśnieniem procesów termodynamicznych w oparciu o mikroskopową budowę ciał. Tymi procesami zajmuje się fizyka statyczna. Termodynamika chemiczna obejmuje termochemię oraz statykę chemiczną. Termochemia, dział chemii fizycznej zajmujący się efektami cieplnymi towarzyszącymi reakcjom chemicznym. Podstawowymi prawami w termochemii są: prawo Hessa i prawo Kirchhoffa. Układ i otoczenie układ układ granice Statyka chemiczna, dział chemii fizycznej zajmujący się przyczynami biegu reakcji chemicznych oraz badaniem układów, w których występuje równowaga chemiczna. granice otoczenie otoczenie 1
2 Typy układów Układ otwarty Układ zamknięty 1. Otwarty, wymienia ciepło(energię), pracę i masę z otoczeniem 2. Zamknięty wymienia tylko pracę i energię z otoczeniem 3. Izolowany-(odosobniony) nie wymienia nic z otoczeniem Układ izolowany Podsumowanie Pytania sprawdzające: 1.Układ zamknięty zawiera 2 g lodu. Następne 2 g lodu są dodane do układu. Jaka jest końcowa masa układu? 2.Izolowany układ ma początkową temperaturę 30 o C. Układ ten umieszczono nad palniku (temp. ok.1000 o C) i utrzymano w tej pozycji przez 1 godzinę. Jaka jest końcowa temperatura układu? 2
3 Faza, rodzaje, parametry stanu Faza jest to część układu spełniająca następujące wymagania: Właściwości każdego elementu objętości w obrębie fazy są jednakowe Istnieje granica dzieląca fazy układu, na której występuje skokowa zmiana właściwości. Rodzaje faz: gazowa, ciekła, stała; jednoskładnikowa, wieloskładnikowa. Parametry stanu Parametr stanu jest to bezpośrednio mierzalna lub bezpośrednio niemierzalna wielkość fizyczna charakteryzująca się następującymi właściwościami: Parametr stanu jest jedynie funkcją innych parametrów stanu. Wartość parametru stanu nie zależy od sposobu w jaki osiągnięto ten stan. Przyrost parametru stanu jest równy różnicy jego wartości na końcu i początku przemiany. Różniczka parametru stanu jest różniczką zupełną. Parametry stanu, które nie są bezpośrednio mierzalne nazywamy także funkcjami stanu. Intensywnymi parametrami stanu są m.in.: temperatura, ciśnienie, objętość właściwa, entalpia właściwa. Parametry stanu, których wartość zależy od ilości substancji nazywamy ekstensywnymi, natomiast te, których wartość nie zależy od ilości substancji intensywnymi. Przykładowe parametry ekstensywne to: ilość substancji, entalpia, energia. Nie są natomiast parametrami stanu takie wielkości fizyczne jak praca, moc, ciepło. 3
4 Z termodynamicznego punktu widzenia stan układu jest zdefiniowany przez zbiór warunków które dokładnie i jednoznacznie określają wszystkie właściwości układu. Należą do nich: temperatura (T) ciśnienie (p) skład (jakościowy i ilościowy t. j. liczbę moli każdego ze składników układu (n) i stężenie składników w układzie (c)) stan fizyczny (gaz, ciecz, ciało stałe) każdego ze składników układu liczba faz (f) objętość (V) Te wielkości nazywane są parametrami stanu. Zbiór parametrów stanu określają pewne funkcje zwane funkcjami stanu. Różne stany fizyczne wody i ich właściwości Lód (ciało stałe) T < 0 o C D = g/cm 3 P = 610 Pa Para wodna (gaz) T=100 o C D = g/cm 3 P = 1013 Pa Woda (ciecz) T > 0 o C D =1 g/cm 3 P = 656 Pa Zmiany objętości wody w funkcji temperatury Energia, ciepło Energia (U) jest wielkością fizyczną przedstawiającą zdolność układu (obiektu) do wykonania pracy lub wymiany ciepła. Sumę wszystkich rodzajów energii cząsteczek w układzie nazywa się energią wewnętrzną. Jednostka J. Ciepło (Q) jest formą energii przekazywaną z jednego układu do drugiego. Układ pierwszy charakteryzuje wyższa temperatura natomiast drugi niższa. Ciepło zawsze przepływa z układu o wyższej temperaturze do układu o niższej temperaturze nigdy odwrotnie. Jednostka J. Prawo zachowania masy i energii Wiele eksperymentów wykazało, że wszelka energia czy masa zaangażowana w jakąkolwiek reakcję chemiczną czy przemianę fizyczną pojawia się w jakiejś formie po reakcji lub przemianie. Np. chemicznie Mg + Cl 2 MgCl 2 Masa substratów: Mg = 24 g/mol; 2Cl = 2x 35.5 g/mol; całość = 95 g/mol Masa produktów MgCl 2 = 95 g/mol 4
5 Fizyczne; E = mc 2 Przykład: 1 mg = 1 *10-6 kg = 9 * J 1* 10-6 kg * (2,998 * 10 8 m/s) 2 = 9* kg*m 2 *s 2 (J) Prawo zachowania masy po przekształceniu Einsteina Podczas przemian zachodzących w układach zamkniętych (takich, które nie wymieniają z otoczeniem ani masy, ani energii) suma mas i masowych równoważników wszystkich form energii jest stała. Można to też przedstawić następująco: Energia nie może być stworzona lub zniszczona podczas reakcji chemicznej lub przemiany fizycznej. Jedna forma energii jest przekształcana w drugą. 5
6 Praca (W) - równa jest energii jaką układ termodynamiczny wymienia z otoczeniem przy zmianie swoich parametrów makroskopowych (objętość, położenie, natężenie pola, itp. ). Pracą jest np. działanie układu wywołujące w otoczeniu przesunięcie tłoka, przepływ prądu elektrycznego. W termodynamice chemicznej praca najczęściej jest związana ze zmianą objętości układu w wyniku działania zewnętrznego ciśnienia lub działająca w kierunku przeciwnym do kierunku działania ciśnienia. Jednostką pracy jest J. W = F. D F- siła [N] D- przesunięcie [m] Praca objętościowa W = p. ΔV Energia wewnętrzna układu (U) jest to całkowita energia układu. Jest to suma wszystkich udziałów energii kinetycznej, potencjalnej wszystkich atomów, jonów i cząsteczek tworzących układ. Energia wewnętrzna jest funkcją stanu. Energię wewnętrzną układu można zmienić poprzez wykonanie na nim pracy (mechanicznie) lub przez jego ogrzanie (niemechanicznie). Po wykonaniu tych czynności na układzie energia układu zostaje zmagazynowana w postaci dodatkowej energii kinetycznej i potencjalnej cząsteczek (np. w gazie zwiększa się ich szybkość poruszania). W podobny sposób w przypadku utraty energii przez układ np. poprzez jego oziębienie cząstki układu zmniejszają swoją energię kinetyczną i potencjalną (np. w gazie poruszają się wolniej). Z powodu zbytniego skomplikowania całkowita energia wewnętrzna układu jest trudna do zmierzenia. Natomiast można mierzyć jej zmiany (ΔU) poprzez określenie energii dostarczonej do układu lub utraconej przez niego na sposób ciepła lub pracy. 6
7 Energia potencjalna 09/01/2017 Zmagazynowana energia chemiczna może być uwolniona przez związek chemiczny podczas zmian chemicznych takich jak spalanie lub metabolizm. Reakcje w których energia jest uwalniana na sposób ciepła nazywane są egzotermicznymi. Ilość energii potrzebna do rozpoczęcia reakcji (energia aktywacji) Węglowodory takie jak metan główny składnik gazu ziemnego i oktan składnik benzyny ulegają spaleniu przy dostępie nadmiaru tlenu do CO 2 i H 2 O. CH 4 + 2O 2 CO 2 + 2H 2 O + Q Ta reakcje uwalnia energię w postaci ciepła, Q. Uwolnione ciepło substraty Postęp reakcji Produkty Ilość ciepła przedstawiona na tym wykresie jest związana z reakcją chemiczną i ilością moli substratów i produktów określoną poprzez współczynniki reakcji. Reakcje endotermiczne Proces w którym dochodzi do absorbowania energii z otoczenia nazywa się endotermicznym. Dla tego typu reakcji końcowy poziom energii jest wyższy od poziomu początkowego. Energia potencjalna Reakcja pomiędzy stałym Ba(OH) 2 8H 2O i nadmiarem stałego NH 4NO 3 Proces rozpuszczania jest procesem tak endotermicznym i obniża znacznie temperaturę. Gdy więc umieścimy kolbę z mieszaniną reagentów na mokrym kawałku drewna, woda zamarza i przytwierdza kolbkę do drewna. substraty Produkty Postęp reakcji Fig. Przykład endotermicznej reakcji. 7
8 Egzotermiczny proces Zamarzanie wody Fermentacja z wykorzystaniem kwasu mlekowego (kiszenie ogórków, kapusty, kwaszenie mleka, śmietany) Fermentacja octowa Grillowanie (spalanie węgla w tlenie) Mieszanie siarczku sodu z wybielaczem Rdzewienie stali Mieszanie wody z mocnym kwasem Endotermiczny proces Topnienie wody Konwersja lodu w parę wodną Parowanie wody Rozpuszczanie cukru w szklance z gorącą wodą Pieczenie (chleba, ciast) Gotowanie (jajka, smażenie kotletów) Mieszanie wody z azotanem amonu Spalanie benzyny w silniku samochodowym Otrzymywanie metanolu z wody i CO 2 Przepłukiwanie rur udrażniaczem (Kret) Trwała ondulacja z wykorzystaniem reakcji redukcji (proces z tioglikolanem amonu, a później nadtlenek wodoru i lanolina) Prostowanie włosów Kwasowa trwała ondulacja wymagająca podgrzania włosów lub też te wykorzystujące siarczek amonu czy wodorosiarczek amonu Test: 1. U organizmów samożywnych przemiany biochemiczne są: a) zawsze endoenergetyczne b) egzo- i endoenergetyczne c) zawsze obojętne energetycznie. d) zawsze egzoenergetyczne 2. Spalanie cukru w organizmie jest: a) Reakcją egzoenergetyczne b) Reakcją obojętną energetycznie c) Reakcją endoenergetyczną d) Brak prawidłowej odpowiedzi. Technologia self heating aplikacji kosmetyków I zasada termodynamiki Pierwsza zasada termodynamiki określa zależność zmiany energii wewnętrznej od dostarczonego ciepła i pracy. U = Q + W U - zmiana energii wewnętrznej ciała/układu Q - ciepło dostarczone do ciała/układu W -praca wykonana nad ciałem/układem Treść tego wzoru (a więc i I zasady termodynamiki) można przedstawić w postaci sformułowania: Zmiana energii wewnętrznej ciała lub układu ciał jest równa sumie dostarczonego ciepła lub pracy wykonanej nad ciałem lub układem ciał. Zmiana energii wewnętrznej układu może się odbyć jedynie na sposób ciepła lub pracy. 8
9 U = Q + W Przykłady: 1. Proste zastosowanie wzoru Podczas prasowania żelazko podgrzało tkaninę energią 200 J, a w wyniku tarcia została do niego dodatkowo dostarczona energia 10 J (zakładamy, że nie było ubytków ciepła). W rezultacie energia wewnętrzna tkaniny wzrosła o: U = Q + W = 200 J + 10 J = 210 J 2. Podgrzewanie ciała, bez wykonywania pracy Podczas podgrzewania ciała bez wykonywania pracy (np. podczas podgrzewania wody na herbatę) mamy: Q > 0 (bo ciepło jest dostarczane do ciała / układu) W = 0 (bo praca nie jest wykonywana ani przez siły zewnętrzne, ani przez układ) U = Q + 0 = Q > 0 - energia wewnętrzna układu wzrasta (czyli najczęściej także wzrasta temperatura). 3. Oziębianie ciała, bez wykonywania pracy Podczas oziębiania ciała bez wykonywania pracy (np. podczas chłodzenia masła w lodówce) mamy: Q < 0 (bo ciepło jest odbierane od ciała / układu) W = 0 (bo praca nie jest wykonywana ani przez siły zewnętrzne, ani przez układ) U = Q + 0 = Q < 0 - energia wewnętrzna układu maleje (czyli najczęściej także maleje temperatura). 4. Podgrzewanie ciała z wykonywaniem pracy przez siły zewnętrzne Podczas podgrzewania ciała wraz z wykonywaniem pracy (np. podczas uderzania młotem kowalskim w kawał żelaza ogrzewany w palenisku w kuźni) mamy: Q > 0 (bo ciepło jest dostarczane do ciała / układu) W > 0 (praca jest wykonywana siły zewnętrzne - kowala) U = Q + W > 0 - energia wewnętrzna układu rośnie (w opisanym przykładzie rośnie temperatura żelaza). Entalpia układu Ciepło przemiany chemicznej przebiegającej pod stałym ciśnieniem równe jest zmianie entalpii układu (H). Wartości bezwzględnych entalpii i energii wewnętrznej układu nie można wyznaczyć bezpośrednio. Z tego względu przyjęto konwencję względnego układu odniesienia tzw. stanów standardowych. A obliczone wartości są określane jako zmiany. Standardowe ciepło tworzenia związku chemicznego pod stałym ciśnieniem (ΔH 0 tw) nazywane jest entalpią standardową. Entalpia jest funkcją termodynamiczną i jednocześnie funkcją (parametrem) stanu. Wartości funkcji termodynamicznych 1 mola substancji prostej (pierwiastków), trwałej w temperaturze 298 K i pod ciśnieniem Pa (warunki standardowe), są równe zero. 9
10 Termodynamiczny standardowy stan danej substancji jest to jej najbardziej stabilna, czysta forma występująca w standardowych warunkach. Ciśnienie jedna atmosfera (1013 hpa, 760 mm Hg) i w specyficznej temperaturze (25 C or 298 K). Przykłady stanów skupienia pierwiastków w 25 C: wodór gaz, bezbarwny, diatomowy, H 2(g) ; rtęć ciecz, srebrzysta, metal, Hg (l) ; sód ciało stałe, srebrzysto białe, metal, Na (s) ; węgiel ciało stałe, szaro-czarne, niemetal, C (grafit). TERMODYNAMICZNY STAN STANDARDOWY, TSS TSS 1. Jeżeli czysta substancja w TSS jest w postaci cieczy lub ciała stałego to jej stan TSS jest cieczą lub ciałem stałym. 2. Ciśnienie czystego gazu w TSS jest równe 1 atm, natomiast dla mieszaniny gazów ich suma ciśnień cząstkowych musi być równa 1 atm. 3. Dla roztworów wodnych, TSS odnosi się do stężenia 1 mol/l. TSS - zasady Wybierz odpowiedź/ odpowiedzi dotyczące TSS: Odpowiedź Quiz Substancja rozpuszczona/ mieszanina Warunki a) NaOH (aq) C = 0.1 M/L b) mieszanina O 2 i N 2 P O2 = 0.7atm; P N2 = 0.3atm c) mieszanina He i Ar P He = 0.8 atm; P Ar = 1.3 atm d) HCl aq C = 1 M/L 10
11 STANDARDOWA ZMIANA ENTALPII Dla ułatwienia porównania i w tabelach dotyczących termochemicznych lub termodynamicznych zmian zmiany standardowe są oznaczone poprzez zero w indeksie górnym np. H 0. Standardowe entalpie tworzenia niektórych związków nieorganicznych, 298 K Zmiana standardowej entalpii, H 0 rxn, dla danej reakcji: substraty produkty dotyczy H gdy określona ilość moli substratów wszystkich w standardowych stanach zostanie przekształcona w określoną ilość moli produktów wszystkich występujących w standardowych stanach. H 0 rxn, Standardowa molowa entalpia tworzenia, H tw0, substancji jest zmianą entalpii dla reakcji w której 1 mol substancji w standardowym stanie jest tworzony z pierwiastków będących w ich standardowych stanach. Wartość H tw0 dla każdego pierwiastka w ich standardowym stanie jest równa 0. Standardowa molowa entalpia tworzenia 11
12 Prawo Hessa Niezależnie od tego, czy reakcja chemiczna przebiega od stanu początkowego do stanu końcowego bezpośrednio czy przez reakcje pośrednie, całkowity efekt cieplny reakcji jest w obu przypadkach taki sam. Wychodząc z gazowego amoniaku i chlorowodoru oraz ciekłej wody otrzymujemy dwoma metodami ten sam produkt Metoda I NH 3(g) + HCl (g) --> NH 4 Cl (s) DH = -176,15 kj/mol NH 4 Cl (s) + H 2 O (c) -->NH 4 Cl (aq) DH = +16,32 kj/mol ogólny efekt cieplny DH = -159,83 kj/mol Metoda II NH 3(g) + H 2 O (c) --> NH 3(aq) DH = -35,15 kj/mol HCl (g) + H 2 O (c) --> HCl (aq) NH 3(aq) + HCl (aq) --> NH 4 Cl (aq) DH = -72,38 kj/mol DH = -52,30 kj/mol Prawo Hessa wykorzystuje się do wyznaczenia nieznanych efektów cieplnych reakcji chemicznych na podstawie innych reakcji, których efekty cieplne są znane. ogólny efekt cieplny: DH = -159,83 kj/mol 12
13 Rozważ następującą reakcję: Prawo Kirchhoffa W obliczeniach można również wykorzystać stabelaryzowane wartości standardowych molowych entalpii tworzenia (ΔH tw ) lub standardowych molowych entalpii spalania (ΔH sp )(dla substancji organicznych): ΔH 0 reakcji = Σ (n i ΔH 0 tw ) produkty Σ (n i ΔH0 tw ) substraty ΔH 0 reakcji = Σ (n i ΔH 0 sp ) substraty Σ (n i ΔH0 sp ) produkty C (grafit) + 1/2 O 2(g) CO (g) H 0 rxn =? Zmiana entalpii dla tej reakcji nie może być zmierzona dokładnie. Nawet gdy CO (g) jest dominującym produktem reakcji grafitu z ograniczoną ilością O 2(g), pewna ilość CO 2(g) jest zawsze tworzona. C (grafit) + O 2(g) CO 2(g) CO (g) + ½ O 2(g) CO 2(g) ΔH 0 rxn = kj/mol rxn (1) ΔH 0 rxn = kj/mol rxn (2) C (grafit) + O 2(g) CO 2(g) ΔH 0 rxn = -393,5 kj/mol rxn (1) CO 2(g) ½ O 2(g) + CO (g) ΔH 0 rxn = +283,0 kj/mol rxn (2) ΔH 0 rxn = - 110,5 kj/mol rxn Obliczyć standardową entalpię reakcji spalania etanu. Rozwiązanie. W zadaniu mowa jest o reakcji: Zgodnie z prawem Hessa efekt cieplny reakcji spalania metanu pod stałym ciśnieniem (entalpia reakcji) nie zależy od drogi przemiany, a jedynie od stanu początkowego i końcowego układu. Stąd reakcję spalania można przeprowadzić na innej drodze, a efekt cieplny reakcji będzie ten sam. Dogodnym sposobem przeprowadzenia reakcji będzie rozkład substratów reakcji na pierwiastki i synteza produktów reakcji z pierwiastków. Należy pamiętać, że entalpia rozkładu związku chemicznego jest równa, co do wartości bezwzględnej entalpii tworzenia, a przeciwna, co do znaku. 13
14 Zatem można zapisać trzy etapy: 1.rozkład 1 mola etanu na pierwiastki; entalpia tworzenia etanu wynosi 84,60kJ/mol 2.synteza 2 moli dwutlenku węgla z węgla i tlenu; entalpia tworzenia CO 2 wynosi kj/mol 3.synteza 3 moli wody w stanie pary; entalpia tworzenia H 2 O (g) = -241,60 kj/mol Dodając równania stronami wraz z entalpiami oraz redukując wyrażenia podobne otrzyma się w wyniku reakcję: Spalaniu 1 mola etanu towarzyszy entalpia ΔH r = -1426,46 kj. Znak minus oznacza, że układ traci energię, a więc jest to reakcja egzotermiczna. Na zmianę entalpii układu można popatrzeć na dwa sposoby: Jeżeli reakcja jest egzotermiczna produkty mają mniejszą entalpię od entalpii substratów. Wówczas tworzenie produktów jest uprzywilejowane i reakcja przebiega w stronę ich tworzenia (czyli w prawo), ΔH tej reakcji jest ujemna. Jeżeli reakcja jest endotermiczna wówczas substraty reakcji maja mniejszą entalpię od produktów i tworzenie produktów jest nieuprzywilejowane natomiast uprzywilejowane jest tworzenie substratów i w związku z tym reakcja biegnie w stronę ich tworzenia (reakcja w lewo). ΔH tej reakcji jest dodatnia. 14
15 Oblicz zmianę entalpii dla następującej reakcji i określ czy reakcja jest endo- czy egzotermiczna. Standardowe entalpie of tworzenia Związek ΔH 0 MgCl 2(s) -642 kj/mol H 2O (l) -286 kj/mol MgO (S) -602 kj/mol HCl (g) -92 kj/mol Określając zmiany energii związane z chemicznym lub fizycznym procesem stosujemy eksperymentalna technikę zwaną kalorymetrią. Jest ona oparta na obserwacji zmian temperatury gdy układ absorbuje lub uwalnia energię na sposób ciepła. Zmiany temperatury zaś są związane bezpośrednio z badanym procesem chemicznym lub fizycznym. Ciepło właściwe substancji ilość ciepła potrzebna do zwiększenia temperatury 1 g substancji o 1 stopień celsjusza lub 1 kelwin bez zmiany stanu skupienia tej substancji. Badanie ciepła zaabsorbowanego przez przedmiot. A) pomiar temperatury zlewki z wodą i podgrzanie przedmiotu. B) pomiar zmiany temperatury zlewki po włożeniu do niej przedmiotu. 15
16 Ciepło właściwe [c] Q. Jaka ilość ciepła jest potrzebna do podgrzania 10g ciekłej wody z temperatury 10 o C do 40 o C. [c w ciekłej wody wynosi 4.18 J g -1 o C -1 ]. a) 418 J; b) 1254 J; c) 1672 J Zadanie Do przygotowania kąpieli o temperaturze końcowej t k wynoszącej 38 o C użyto 20 litrów wody o temperaturze t 1 wynoszącej 14 o C oraz pewnej objętości gorącej wody o temperaturze t 2 wynoszącej 70 o C. Ile litrów gorącej wody użyto? Ciepło właściwe wody C w = J/kg K Dane: t k = 38 o C t 1 = 14 o C, V 1 = 20 l = m 1 = 20 kg (bowiem gęstość wody to 1g/ml) t 2 = 70 o C, V 2 =? m 2 =? Q pobrane + Q oddane = 0 Q pobrane = C w m 1 t t = (t k -t 1 ) Q oddane = C w m 2 t t = t k t 2 Q pobrane + Q oddane = 0 16
17 Q pobrane = 4189,9 J 20 kg kg o C 24o C = J Q oddane = 4189,9 J x kg kg o C 32o C = y Ciepło oddane = ciepło pobrane Więc Q pobrane = J J = 4189,9 J kg o C m kg 32o C J = ,8 J m kg kg Inne jednostki ciepła ilość ciepła konieczna do podniesienia temperatury 1 g wody z 14.5 C do 15.5 C, wynosi J i jednocześnie jest to 1 kaloria. Duże kalorie są używane do określenia wartości energetycznej żywności i w rzeczywistości odpowiadają kilokaloriom. (1kcal) m = 15 kg 17
18 Spontaniczność reakcji Spontaniczne reakcje zachodzą w sposób naturalny i preferują powstawanie produktów w specyficznych warunkach. Samozapłonu stogu siana czy magazynu z mąką. Reakcja pomiędzy azotanem kadmu a siarczkiem sodu jest spontaniczna. Rozprzestrzenianie się kropli barwnika w wodzie też jest spontaniczne. Każdy proces zachodzący bez zewnętrznego wpływu jest procesem spontanicznym (samorzutnym). Przykłady procesów samorzutnych: Kiedy upuścimy jajka spontanicznie się zbiją. Odwrócenie tej reakcji (reakcja w drugą stronę tzn. ze skorupek i rozbitego jajka do całego jaja) jest niemożliwa. Taka reakcja jest niespontaniczna. Spontaniczne procesy mogą być szybkie lub powolne Spalanie gazu. Reakcja spontaniczna i wybuchowa (szybka). Korozja metali. Reakcja spontaniczna ale powolna. Reakcje (procesy) odwracalne Procesy odwracalne zachodzą w obie strony po tej samej drodze. Procesy odwracalne mogą zachodzić tylko wtedy, gdy układ jest odizolowany albo znajduje się w stanie równowagi z otoczeniem. Gdy 1 mol ciekłej wody zamarza przy ciśnieniu 1 atm i 0 C tworząc 1 mol lodu ciepło q = H krzepnięcia jest uwalniane. Natomiast w tych samych warunkach odwrotny proces pochłania ciepło q = H topnienia H krzepnięcia = H topnienia 18
19 Reakcje nieodwracalne Procesy, które są nie odwracalne nazywamy nieodwracalnymi. Procesy rzeczywiste są wyłącznie nieodwracalne. Nieodwracalność procesów wiąże się często z rozpraszaniem energii w postaci ciepła. Przykłady procesów nieodwracalnych: przepływ ciepła pomiędzy dwiema częściami układu o różnych temperaturach, dyfuzja w roztworach, przemiany fazowe, przemieszczanie się wody z poziomu wyższego na niższy. Proces micelizacji Niespontaniczne reakcje nie sprzyjają tworzeniu produktów w specyficznych warunkach. Przykładem takiej reakcji jest fotosynteza, do zajścia której potrzebny jest dodatkowy wydatek energii. Czynniki warunkujące spontaniczność reakcji chemicznej lub przemiany fizycznej 1. reakcja jest spontaniczna gdy podczas niej ciepło jest uwalniane (reakcja jest egzotermiczna) 2. reakcja jest spontaniczna prowadzi do wzrostu nieuporządkowania układu. A Non-natural Process: Steinberg's Famous New Yorker Cartoon Source: Boundless. Spontaneous and Nonspontaneous Processes. Boundless Chemistry. Boundless, 21 Jul Retrieved 16 Sep from 19
20 Wzrost entropii Wzrost entropii Termodynamiczna funkcja stanu entropia, S, mierzy nieuporządkowanie układu. Im większa jest entropia tym większe jest nieuporządkowanie układu. Przykłady układów o wzrastającej entropii. Wzrost entropii Prąd elektryczny Prąd elektryczny Wzrost entropii Elektroliza wody W przemianach spontanicznych wszechświat dąży do stanu o większym nieuporządkowaniu. (Bałagan na biurku robi się łatwiej niż porządek). Entropia wszechświata jako izolowanego układu będzie zawsze wzrastała. Zmiany entropii we wszechświecie nigdy nie będą ujemne. Kosmos Otoczenie Układ S (całk.) = S (układ) + S (otoczenie) S (całk., 2) > S (całk., 1) 20
21 Uwalnianie ciepła (sprzyjająca) Wzrost entropii (sprzyjająca) Reakcja spontaniczna Wzrost entropii (sprzyjająca) Absorpcja ciepła (niesprzyjająca) Reakcja spontaniczna Uwalnianie ciepła (sprzyjająca) Spadek entropii (niesprzyjająca) Reakcja spontaniczna Reakcje spontaniczne Reakcje niespontaniczne Absorpcja ciepła (niesprzyjająca) Wzrost entropii (sprzyjająca) Reakcja niespontaniczna Spadek entropii (niesprzyjająca) Uwalnianie ciepła (sprzyjająca) Reakcja niespontaniczna Absorpcja ciepła (niesprzyjająca) Spadek entropii (niesprzyjająca) Reakcja niespontaniczna Druga zasada termodynamiki Wszystkie zjawiska w przyrodzie, obejmujące dostatecznie dużą liczbę cząsteczek przebiegają w jednym kierunku, którego nie można odwrócić. Zjawiska w przyrodzie są nieodwracalne: Ciepło samoistnie płynie od ciała cieplejszego do chłodniejszego. Nigdy odwrotnie. Dwa gazy lub dwie ciecze po zmieszaniu ze sobą nie rozdzielą się samodzielnie. Hamujący samochód całkowicie zamienia swoją energię mechaniczną na wewnętrzną (hamulce się ogrzewają). Nie obserwujemy procesu odwrotnego. Gaz samoistnie rozpręży się z jednego do drugiego pustego naczynia. Sam nie wróci do pierwszego. Aromat perfum rozpylonych w pokoju rozprzestrzeni się. Nie można cząstek zapachowych skierować z powrotem do opakowania. Druga zasada termodynamiki określa kierunek przemian termodynamicznych w przyrodzie. 21
22 09/01/2017 II zasada termodynamiki a procesy starzenia Zgodnie z II zasadą termodynamiki w układzie zamkniętym entropia nie może maleć. Wszelkie złożone układy np. związki chemiczne mają tendencję do degradacji (co powoduje wzrost entropii). Temu procesowi ulegają różne struktury budujące organelle komórkowe pobudzając organizm do syntezy nowych organelli, ale proces ten nie jest nieograniczony w czasie. Z czasem w komórkach gromadzą się produkty przemiany materii w takich ilościach, że ich usunięcie pociąga za sobą zbyt duży wydatek energetyczny. Prowadzi to do degeneracji i rozpadu komórek. Ponieważ w stosowanym wzorze temperatura w kelwinach jest zawsze dodatnia, znak związany z entropią wskazuje czy dany proces/reakcja jest spontaniczny czy też nie (jeżeli takowy zachodzi w stałej temperaturze). Znak związany z energią swobodną wskazuje czy Entalpia swobodna, energia swobodna Gibbsa (ΔG) jest maksymalną ilością energii która może zostać połączona z innym procesem aby wykonać użyteczną pracę. Jest to kolejna funkcja stanu. Proces jest spontaniczny gdy Δ G ma ma wartość ujemną ponieważ układ traci energię swobodną. 19 Czy przemiana jest samorzutna w danej temperaturze, zależy to od znaku i wielkości entalpii DH i entropii DS proces/ reakcja jest spontaniczny. Jeżeli ΔScałk > 0 proces jest spontaniczny ponieważ ΔG = - (+T) czyli ma wartość ujemną Jeżeli ΔScałk < 0 proces jest niespontaniczny ponieważ ΔG = + (+T) czyli ma wartość dodatnią Jeżeli ΔG < 0 (jest ujemna) to reakcja/proces jest spontaniczny Jeżeli ΔG > 0 (jest dodatnia) to reakcja/proces jest niespontaniczny (proces zachodzący DH T*DS DG Kierunek przemiany Przemiana nie jest samorzutna - Przemiana jest samorzutna + / - Przemiana jest samorzutna jeżeli TDS > DH -/+ Przemiana jest samorzutna jeżeli TDS > DH w stronę przeciwną jest spontaniczny) Jeżeli ΔG = 0 to reakcja/ proces jest w równowadze 22
23 Spalanie acetylenu C 2 H 2 (g) + 5/2 O 2 (g) --> 2 CO 2 (g) + H 2 O(g) Entalpia tworzenia H o rxn = kj Standardowa molowa entropia S o rxn = J/K or kj/k G o rxn = kj - (298 K)( J/K) = kj Reakcja biegnie w kierunku produktów w skutek ujemnej wartości S o rxn. Reakcja jest napędzana entalpią NH 4 NO 3 (s) + Q ---> NH 4 NO 3 (aq) W tabeli można znaleźć dane termodynamiczne tej reakcji H o rxn = kj S o rxn = J/K or kj/k G o rxn = kj - (298 K)( kj/k) = -6.7 kj Reakcja jest w kierunku produktów na skutek dodatniej wartości H o rxn. Reakcja jest napędzana entropią : Powstawanie amoniaku w procesie Habera zachodzi wg reakcji N 2 + 3H 2 2 NH 3 W jakiej temperaturze reakcja będzie spontaniczna? Entalpia i entropia tego procesu wynosi odpowiednio: ΔH = -93 kj/mol; ΔS= -198 J/ mol K Obie wartości są ujemne to znaczy, że entalpia swobodna jest zależna od temperatury: ΔG = ΔH - TΔS ΔG = (T x -198) Należy pamiętać, że entalpia jest w kj Jeżeli ΔG = 0 wówczas układ jest najmniej spontaniczny Gdy ΔG = 0 wówczas (T x -198) = i T = 93000/198 Kelvin Zatem reakcja zacznie być spontaniczna gdy T = 469 K (196 ºC) Powyżej tej temperatury reakcja jest spontaniczna. 23
24 Wpływ temperatury na energię swobodną Gibbsa Zmiany ΔG 0 pod wpływem temperatury określane są przez równanie Gibbsa-Helmholtza: G0 2 - G 0 1 T 2 T 1 = H 0 1 T 2 1 T 1 Oblicz temperaturę wody powyżej której proces koagulacji białka jest procesem nieodwracalnym. Standardowa entalpia procesu koagulacji jajka (zmian w wiązaniach wodorowych) wynosi 35 kj/mol. Temperatura początkowa 298K, ΔG 0 1 = +5,7 kj/mol; Energia swobodna Gibbsa w temperaturze T 2 ΔG 2 0 = 0 kj/mol (proces jest w równowadze, układ jest najmniej spontaniczny) G G 0 1 T 2 0kJ/mol T 2 T 1 = H T 2 1 T 1 + 5,7 kj/mol 298 = 35 kj/mol 1 1 T Energia swobodna a stała równowagi G 0 = RT ln K G = G 0 + RT ln K Izoterma van t Hoffa T 2 = 357,1K Ogrzewanie jajka w temperaturze powyżej 83,95 o C spowoduje ścinanie białka. W roztworze doskonałym lub idealnie rozcieńczonym panuje stan równowagi chemicznej, to iloczyn ułamków molowych reagentów podniesionych do potęg równych ich współczynnikom stechiometrycznym jest wielkością stałą, niezależną od stężenia tych reagentów. Wartość stałej równowagi dla danej reakcji chemicznej analogicznie jak zależy tylko od temperatury i ciśnienia. 24
25 Oblicz ΔG o reakcji dysocjacji kwasu octowego jeżeli stała dysocjacji tego kwasu w temperaturze 298 K wynosi 2x10-5. G 0 = RT ln K G 0 = 8, 314 J K 1 mol K ln ΔG 0 = J mol -1 x (-10.8) = J/mol = + 26,8 kj/mol Energia swobodna Gibbsa (entalpia swobodna) i równowaga chemiczna Zmiana standardowej entalpii swobodnej (ΔG 0 ) dotyczy tylko warunków standardowych (ciśnienie gazu 1 atm, temperatura 25 o C, 1 mol). W ten sposób ΔG 0 pozwala przewidzieć spontaniczność reakcji tylko w warunkach standardowych. Natomiast jeżeli reakcja zachodzi w innych warunkach, niestandardowych zmiana energii swobodnej Gibbsa (ΔG) pozwala przewidzieć czy reakcja jest spontaniczna czy też nie. ΔG = ΔG 0 + RT ln Q R- stała gazowa ( J/mol K); T temperatura w Kelwinach Q stosunek iloczynów produktów reakcji do iloczynu substratów reakcji (reaction quotient) w danym momencie. Oblicz czy reakcja tworzenia jodowodoru jest spontaniczna gdy stężenia substratów i produktu są następujące: [H 2 ] = 0.01 mol/l ; [I 2 ] = 0.02 mol/l; [HI] = 0.05 mol/l. Standardowa entalpia swobodna reakcji ΔG 0 = 1.71 kj/mol, a temperatura reakcji wynosi 30 o C. HI 0.05 mo l l Q = H 2 I 2 = = mol 0.02 mol l l ΔG = ΔG 0 + RT ln Q ΔG = 1710 (J/mol) (J/mol K) 303(K) ln 25 ΔG = = J/mol. Entalpia swobodna reakcji jest dodatnia więc ta reakcja nie jest spontaniczna w podanej temperaturze. DG = - z F SEM Oblicz entalpię swobodną dla ogniwa złożonego z następujących półogniw CuΙCu 2+ E 0 = 0,34 V Zn Ι Zn 2+ E 0 = -0,76 V F= A s mol -1 z= 2 mole SEM = 0,34 V (- 0,76)V = 1,1 V ΔG = -2 x x 1,1 = J = -212,3 kj 1 J = 1 W s = 1 V A s 25
26 Niektóre przykłady zastosowania termodynamiki w kosmetologii Aplikacja substancji czynnej podczas technologii self- heating. Oziębianie ciała po jego kontakcie z mentolem (rozpuszczalnie się mentolu w wodzie jest procesem endotermicznym). Podnoszenie energii wewnętrznej ciała poprzez masaż (pracę wykonaną) Maski algowe (nanoszone na ciepło) Krioterapia Diatermia 26
Termodynamika 26/10/2015. Definicje. Układ i otoczenie. Typy układów. układ
 Termodynamika Definicje Termodynamika dział fizyki zajmujący się badaniem energetycznych efektów wszelkich przemian fizycznych i chemicznych, które wpływają na zmiany energii wewnętrznej analizowanych
Termodynamika Definicje Termodynamika dział fizyki zajmujący się badaniem energetycznych efektów wszelkich przemian fizycznych i chemicznych, które wpływają na zmiany energii wewnętrznej analizowanych
Termodynamika 25/10/2017. Definicje. Układ i otoczenie
 Definicje Termodynamika Termodynamika dział fizyki zajmujący się badaniem energetycznych efektów wszelkich przemian fizycznych i chemicznych, które wpływają na zmiany energii wewnętrznej analizowanych
Definicje Termodynamika Termodynamika dział fizyki zajmujący się badaniem energetycznych efektów wszelkich przemian fizycznych i chemicznych, które wpływają na zmiany energii wewnętrznej analizowanych
TERMODYNAMIKA I TERMOCHEMIA
 TERMODYNAMIKA I TERMOCHEMIA Termodynamika - opisuje zmiany energii towarzyszące przemianom chemicznym; dział fizyki zajmujący się zjawiskami cieplnymi. Termochemia - dział chemii zajmujący się efektami
TERMODYNAMIKA I TERMOCHEMIA Termodynamika - opisuje zmiany energii towarzyszące przemianom chemicznym; dział fizyki zajmujący się zjawiskami cieplnymi. Termochemia - dział chemii zajmujący się efektami
Termochemia elementy termodynamiki
 Termochemia elementy termodynamiki Termochemia nauka zajmująca się badaniem efektów cieplnych reakcji chemicznych Zasada zachowania energii Energia całkowita jest sumą energii kinetycznej i potencjalnej.
Termochemia elementy termodynamiki Termochemia nauka zajmująca się badaniem efektów cieplnych reakcji chemicznych Zasada zachowania energii Energia całkowita jest sumą energii kinetycznej i potencjalnej.
ZADANIA Z CHEMII Efekty energetyczne reakcji chemicznej - prawo Hessa
 Prawo zachowania energii: ZADANIA Z CHEMII Efekty energetyczne reakcji chemicznej - prawo Hessa Ogólny zasób energii jest niezmienny. Jeżeli zwiększa się zasób energii wybranego układu, to wyłącznie kosztem
Prawo zachowania energii: ZADANIA Z CHEMII Efekty energetyczne reakcji chemicznej - prawo Hessa Ogólny zasób energii jest niezmienny. Jeżeli zwiększa się zasób energii wybranego układu, to wyłącznie kosztem
Podstawy termodynamiki
 Podstawy termodynamiki Organizm żywy z punktu widzenia termodynamiki Parametry stanu Funkcje stanu: U, H, F, G, S I zasada termodynamiki i prawo Hessa II zasada termodynamiki Kierunek przemian w warunkach
Podstawy termodynamiki Organizm żywy z punktu widzenia termodynamiki Parametry stanu Funkcje stanu: U, H, F, G, S I zasada termodynamiki i prawo Hessa II zasada termodynamiki Kierunek przemian w warunkach
I piętro p. 131 A, 138
 CHEMIA NIEORGANICZNA Dr hab. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I piętro p. 131 A, 138 WYKŁAD - 4 RÓWNOWAGA Termochemia i termodynamika funkcje termodynamiczne, prawa termodynamiki,
CHEMIA NIEORGANICZNA Dr hab. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I piętro p. 131 A, 138 WYKŁAD - 4 RÓWNOWAGA Termochemia i termodynamika funkcje termodynamiczne, prawa termodynamiki,
DRUGA ZASADA TERMODYNAMIKI
 DRUGA ZASADA TERMODYNAMIKI Procesy odwracalne i nieodwracalne termodynamicznie, samorzutne i niesamorzutne Proces nazywamy termodynamicznie odwracalnym, jeśli bez spowodowania zmian w otoczeniu możliwy
DRUGA ZASADA TERMODYNAMIKI Procesy odwracalne i nieodwracalne termodynamicznie, samorzutne i niesamorzutne Proces nazywamy termodynamicznie odwracalnym, jeśli bez spowodowania zmian w otoczeniu możliwy
Zadania pochodzą ze zbioru zadań P.W. Atkins, C.A. Trapp, M.P. Cady, C. Giunta, CHEMIA FIZYCZNA Zbiór zadań z rozwiązaniami, PWN, Warszawa 2001
 Zadania pochodzą ze zbioru zadań P.W. Atkins, C.A. Trapp, M.P. Cady, C. Giunta, CHEMIA FIZYCZNA Zbiór zadań z rozwiązaniami, PWN, Warszawa 2001 I zasada termodynamiki - pojęcia podstawowe C2.4 Próbka zawierająca
Zadania pochodzą ze zbioru zadań P.W. Atkins, C.A. Trapp, M.P. Cady, C. Giunta, CHEMIA FIZYCZNA Zbiór zadań z rozwiązaniami, PWN, Warszawa 2001 I zasada termodynamiki - pojęcia podstawowe C2.4 Próbka zawierająca
Wykład 10 Równowaga chemiczna
 Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
Wykład 10 Równowaga chemiczna REAKCJA CHEMICZNA JEST W RÓWNOWADZE, GDY NIE STWIERDZAMY TENDENCJI DO ZMIAN ILOŚCI (STĘŻEŃ) SUBSTRATÓW ANI PRODUKTÓW RÓWNOWAGA CHEMICZNA JEST RÓWNOWAGĄ DYNAMICZNĄ W rzeczywistości
DRUGA ZASADA TERMODYNAMIKI
 DRUGA ZASADA TERMODYNAMIKI Procesy odwracalne i nieodwracalne termodynamicznie, samorzutne i niesamorzutne Proces nazywamy termodynamicznie odwracalnym, jeśli bez spowodowania zmian w otoczeniu możliwy
DRUGA ZASADA TERMODYNAMIKI Procesy odwracalne i nieodwracalne termodynamicznie, samorzutne i niesamorzutne Proces nazywamy termodynamicznie odwracalnym, jeśli bez spowodowania zmian w otoczeniu możliwy
Warunki izochoryczno-izotermiczne
 WYKŁAD 5 Pojęcie potencjału chemicznego. Układy jednoskładnikowe W zależności od warunków termodynamicznych potencjał chemiczny substancji czystej definiujemy następująco: Warunki izobaryczno-izotermiczne
WYKŁAD 5 Pojęcie potencjału chemicznego. Układy jednoskładnikowe W zależności od warunków termodynamicznych potencjał chemiczny substancji czystej definiujemy następująco: Warunki izobaryczno-izotermiczne
Odwracalność przemiany chemicznej
 Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
Odwracalność przemiany chemicznej Na ogół wszystkie reakcje chemiczne są odwracalne, tzn. z danych substratów tworzą się produkty, a jednocześnie produkty reakcji ulegają rozkładowi na substraty. Fakt
Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2018/19)
 Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2018/19) Uwaga! Uzyskane wyniki mogą się nieco różnić od podanych w materiałach, ze względu na uaktualnianie wartości zapisanych
Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2018/19) Uwaga! Uzyskane wyniki mogą się nieco różnić od podanych w materiałach, ze względu na uaktualnianie wartości zapisanych
TERMOCHEMIA. TERMOCHEMIA: dział chemii, który bada efekty cieplne towarzyszące reakcjom chemicznym w oparciu o zasady termodynamiki.
 1 TERMOCHEMIA TERMOCHEMIA: dział chemii, który bada efekty cieplne towarzyszące reakcjom chemicznym w oparciu o zasady termodynamiki. TERMODYNAMIKA: opis układu w stanach o ustalonych i niezmiennych w
1 TERMOCHEMIA TERMOCHEMIA: dział chemii, który bada efekty cieplne towarzyszące reakcjom chemicznym w oparciu o zasady termodynamiki. TERMODYNAMIKA: opis układu w stanach o ustalonych i niezmiennych w
Termochemia efekty energetyczne reakcji
 Termochemia efekty energetyczne reakcji 1. Podstawowe pojęcia termodynamiki chemicznej a) Układ i otoczenie Układ, to wyodrębniony obszar materii, oddzielony od otoczenia wyraźnymi granicami (np. reagenty
Termochemia efekty energetyczne reakcji 1. Podstawowe pojęcia termodynamiki chemicznej a) Układ i otoczenie Układ, to wyodrębniony obszar materii, oddzielony od otoczenia wyraźnymi granicami (np. reagenty
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA
 SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
SZYBKOŚĆ REAKCJI CHEMICZNYCH. RÓWNOWAGA CHEMICZNA Zadania dla studentów ze skryptu,,obliczenia z chemii ogólnej Wydawnictwa Uniwersytetu Gdańskiego 1. Reakcja między substancjami A i B zachodzi według
WYKŁAD 3 TERMOCHEMIA
 WYKŁAD 3 TERMOCHEMIA Termochemia jest działem termodynamiki zajmującym się zastosowaniem pierwszej zasady termodynamiki do obliczania efektów cieplnych procesów fizykochemicznych, a w szczególności przemian
WYKŁAD 3 TERMOCHEMIA Termochemia jest działem termodynamiki zajmującym się zastosowaniem pierwszej zasady termodynamiki do obliczania efektów cieplnych procesów fizykochemicznych, a w szczególności przemian
Jak mierzyć i jak liczyć efekty cieplne reakcji?
 Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia Zdolność do wykonywania pracy lub do produkowania ciepła Praca objętościowa praca siła odległość 06_73 P F A W F h N m J P F A Area A ciśnienie
Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia Zdolność do wykonywania pracy lub do produkowania ciepła Praca objętościowa praca siła odległość 06_73 P F A W F h N m J P F A Area A ciśnienie
Wykład 1. Anna Ptaszek. 5 października Katedra Inżynierii i Aparatury Przemysłu Spożywczego. Chemia fizyczna - wykład 1. Anna Ptaszek 1 / 36
 Wykład 1 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 5 października 2015 1 / 36 Podstawowe pojęcia Układ termodynamiczny To zbiór niezależnych elementów, które oddziałują ze sobą tworząc integralną
Wykład 1 Katedra Inżynierii i Aparatury Przemysłu Spożywczego 5 października 2015 1 / 36 Podstawowe pojęcia Układ termodynamiczny To zbiór niezależnych elementów, które oddziałują ze sobą tworząc integralną
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Ćwiczenia rachunkowe z termodynamiki technicznej i chemicznej Zalecane zadania kolokwium 1. (2014/15)
 Ćwiczenia rachunkowe z termodynamiki technicznej i chemicznej Zalecane zadania kolokwium 1. (2014/15) (Uwaga! Liczba w nawiasie przy odpowiedzi oznacza numer zadania (zestaw.nr), którego rozwiązanie dostępne
Ćwiczenia rachunkowe z termodynamiki technicznej i chemicznej Zalecane zadania kolokwium 1. (2014/15) (Uwaga! Liczba w nawiasie przy odpowiedzi oznacza numer zadania (zestaw.nr), którego rozwiązanie dostępne
(1) Równanie stanu gazu doskonałego. I zasada termodynamiki: ciepło, praca.
 (1) Równanie stanu gazu doskonałego. I zasada termodynamiki: ciepło, praca. 1. Aby określić dokładną wartość stałej gazowej R, student ogrzał zbiornik o objętości 20,000 l wypełniony 0,25132 g gazowego
(1) Równanie stanu gazu doskonałego. I zasada termodynamiki: ciepło, praca. 1. Aby określić dokładną wartość stałej gazowej R, student ogrzał zbiornik o objętości 20,000 l wypełniony 0,25132 g gazowego
relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
 1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
1 STECHIOMETRIA INTERPRETACJA ILOŚCIOWA ZJAWISK CHEMICZNYCH relacje ilościowe ( masowe,objętościowe i molowe ) dotyczące połączeń 1. pierwiastków w związkach chemicznych 2. związków chemicznych w reakcjach
Podstawy termodynamiki.
 Podstawy termodynamiki. Termodynamika opisuje ogólne prawa przemian energetycznych w układach makroskopowych. Określa kierunki procesów zachodzących w przyrodzie w sposób samorzutny, jak i stanów końcowych,
Podstawy termodynamiki. Termodynamika opisuje ogólne prawa przemian energetycznych w układach makroskopowych. Określa kierunki procesów zachodzących w przyrodzie w sposób samorzutny, jak i stanów końcowych,
Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych
 Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych I. Reakcje egzoenergetyczne i endoenergetyczne 1. Układ i otoczenie Układ - ogół substancji
Materiał powtórzeniowy do sprawdzianu - reakcje egzoenergetyczne i endoenergetyczne, szybkość reakcji chemicznych I. Reakcje egzoenergetyczne i endoenergetyczne 1. Układ i otoczenie Układ - ogół substancji
1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego:
 1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego: 2. Określ w którą stronę przesunie się równowaga reakcji rozkładu
1. Określ, w którą stronę przesunie się równowaga reakcji syntezy pary wodnej z pierwiastków przy zwiększeniu objętości zbiornika reakcyjnego: 2. Określ w którą stronę przesunie się równowaga reakcji rozkładu
Projekt Inżynier mechanik zawód z przyszłością współfinansowany ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego
 Zajęcia wyrównawcze z fizyki -Zestaw 4 -eoria ermodynamika Równanie stanu gazu doskonałego Izoprzemiany gazowe Energia wewnętrzna gazu doskonałego Praca i ciepło w przemianach gazowych Silniki cieplne
Zajęcia wyrównawcze z fizyki -Zestaw 4 -eoria ermodynamika Równanie stanu gazu doskonałego Izoprzemiany gazowe Energia wewnętrzna gazu doskonałego Praca i ciepło w przemianach gazowych Silniki cieplne
Fizyka Termodynamika Chemia reakcje chemiczne
 Termodynamika zajmuje się badaniem efektów energetycznych towarzyszących procesom fizykochemicznym i chemicznym. Termodynamika umożliwia: 1. Sporządzanie bilansów energetycznych dla reakcji chemicznych
Termodynamika zajmuje się badaniem efektów energetycznych towarzyszących procesom fizykochemicznym i chemicznym. Termodynamika umożliwia: 1. Sporządzanie bilansów energetycznych dla reakcji chemicznych
Inżynieria Biomedyczna Wykład V
 Inżynieria Biomedyczna Wykład V 1 Plan Reakcje samorzutne Entropia II zasada termodynamiki Entalpia i energia swobodna Kryteria samorzutności Termodynamika a stała równowagi K r 2 Woda zawsze spływa w
Inżynieria Biomedyczna Wykład V 1 Plan Reakcje samorzutne Entropia II zasada termodynamiki Entalpia i energia swobodna Kryteria samorzutności Termodynamika a stała równowagi K r 2 Woda zawsze spływa w
= = Budowa materii. Stany skupienia materii. Ilość materii (substancji) n - ilość moli, N liczba molekuł (atomów, cząstek), N A
 Budowa materii Stany skupienia materii Ciało stałe Ciecz Ciała lotne (gazy i pary) Ilość materii (substancji) n N = = N A m M N A = 6,023 10 mol 23 1 n - ilość moli, N liczba molekuł (atomów, cząstek),
Budowa materii Stany skupienia materii Ciało stałe Ciecz Ciała lotne (gazy i pary) Ilość materii (substancji) n N = = N A m M N A = 6,023 10 mol 23 1 n - ilość moli, N liczba molekuł (atomów, cząstek),
I. Podstawowe pojęcia termodynamiki Termodynamika (nauka o transformacjach energii; zajmuje się badaniem efektów energetycznych przemian fizycznych i
 I. Podstawowe pojęcia termodynamiki Termodynamika (nauka o transformacjach energii; zajmuje się badaniem efektów energetycznych przemian fizycznych i chemicznych) Termodynamika chemiczna - nauka zajmująca
I. Podstawowe pojęcia termodynamiki Termodynamika (nauka o transformacjach energii; zajmuje się badaniem efektów energetycznych przemian fizycznych i chemicznych) Termodynamika chemiczna - nauka zajmująca
Materiały do zajęć dokształcających z chemii nieorganicznej i fizycznej. Część IV - Elementy termodynamiki i kinetyki chemicznej
 Materiały do zajęć dokształcających z chemii nieorganicznej i fizycznej Część IV - Elementy termodynamiki i kinetyki chemicznej Wydział Chemii UAM Poznań 2011 POJĘCIA CIA PODSTAWOWE UKŁAD AD pewna część
Materiały do zajęć dokształcających z chemii nieorganicznej i fizycznej Część IV - Elementy termodynamiki i kinetyki chemicznej Wydział Chemii UAM Poznań 2011 POJĘCIA CIA PODSTAWOWE UKŁAD AD pewna część
Czy równowaga jest procesem korzystnym? dr hab. prof. nadzw. Małgorzata Jóźwiak
 Czy równowaga jest procesem korzystnym? dr hab. prof. nadzw. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga ciało
Czy równowaga jest procesem korzystnym? dr hab. prof. nadzw. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga ciało
prof. dr hab. Małgorzata Jóźwiak
 Czy równowaga w przyrodzie i w chemii jest korzystna? prof. dr hab. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga
Czy równowaga w przyrodzie i w chemii jest korzystna? prof. dr hab. Małgorzata Jóźwiak 1 Pojęcie równowagi łańcuch pokarmowy równowagi fazowe równowaga ciało stałe - ciecz równowaga ciecz - gaz równowaga
Wykład 4. Przypomnienie z poprzedniego wykładu
 Wykład 4 Przejścia fazowe materii Diagram fazowy Ciepło Procesy termodynamiczne Proces kwazistatyczny Procesy odwracalne i nieodwracalne Pokazy doświadczalne W. Dominik Wydział Fizyki UW Termodynamika
Wykład 4 Przejścia fazowe materii Diagram fazowy Ciepło Procesy termodynamiczne Proces kwazistatyczny Procesy odwracalne i nieodwracalne Pokazy doświadczalne W. Dominik Wydział Fizyki UW Termodynamika
Jak mierzyć i jak liczyć efekty cieplne reakcji?
 Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia Zdolność do wykonywania pracy lub produkowania ciepła Praca objętościowa praca siła odległość 06_73 P F A W F h N m J P F A Area A ciśnienie siła/powierzchnia
Jak mierzyć i jak liczyć efekty cieplne reakcji? Energia Zdolność do wykonywania pracy lub produkowania ciepła Praca objętościowa praca siła odległość 06_73 P F A W F h N m J P F A Area A ciśnienie siła/powierzchnia
TERMOCHEMIA SPALANIA
 TERMOCHEMIA SPALANIA I ZASADA TERMODYNAMIKI dq = dh Vdp W przemianach izobarycznych: dp = 0 dq = dh dh = c p dt dq = c p dt Q = T 2 T1 c p ( T)dT Q ciepło H - entalpia wewnętrzna V objętość P - ciśnienie
TERMOCHEMIA SPALANIA I ZASADA TERMODYNAMIKI dq = dh Vdp W przemianach izobarycznych: dp = 0 dq = dh dh = c p dt dq = c p dt Q = T 2 T1 c p ( T)dT Q ciepło H - entalpia wewnętrzna V objętość P - ciśnienie
Wykład z Chemii Ogólnej i Nieorganicznej
 Wykład z Chemii Ogólnej i Nieorganicznej Część 5 ELEMENTY STATYKI CHEMICZNEJ Katedra i Zakład Chemii Fizycznej Collegium Medicum w Bydgoszczy Uniwersytet Mikołaja Kopernika w Toruniu Prof. dr hab. n.chem.
Wykład z Chemii Ogólnej i Nieorganicznej Część 5 ELEMENTY STATYKI CHEMICZNEJ Katedra i Zakład Chemii Fizycznej Collegium Medicum w Bydgoszczy Uniwersytet Mikołaja Kopernika w Toruniu Prof. dr hab. n.chem.
Podstawowe prawa opisujące właściwości gazów zostały wyprowadzone dla gazu modelowego, nazywanego gazem doskonałym (idealnym).
 Spis treści 1 Stan gazowy 2 Gaz doskonały 21 Definicja mikroskopowa 22 Definicja makroskopowa (termodynamiczna) 3 Prawa gazowe 31 Prawo Boyle a-mariotte a 32 Prawo Gay-Lussaca 33 Prawo Charlesa 34 Prawo
Spis treści 1 Stan gazowy 2 Gaz doskonały 21 Definicja mikroskopowa 22 Definicja makroskopowa (termodynamiczna) 3 Prawa gazowe 31 Prawo Boyle a-mariotte a 32 Prawo Gay-Lussaca 33 Prawo Charlesa 34 Prawo
1. PIERWSZA I DRUGA ZASADA TERMODYNAMIKI TERMOCHEMIA
 . PIERWSZA I DRUGA ZASADA ERMODYNAMIKI ERMOCHEMIA Zadania przykładowe.. Jeden mol jednoatomowego gazu doskonałego znajduje się początkowo w warunkach P = 0 Pa i = 300 K. Zmiana ciśnienia do P = 0 Pa nastąpiła:
. PIERWSZA I DRUGA ZASADA ERMODYNAMIKI ERMOCHEMIA Zadania przykładowe.. Jeden mol jednoatomowego gazu doskonałego znajduje się początkowo w warunkach P = 0 Pa i = 300 K. Zmiana ciśnienia do P = 0 Pa nastąpiła:
CIEPŁO ZNANE CZY NIEZNANE? dr hab. prof. nadzw. UŁ Małgorzata Jóźwiak
 CIEPŁO ZNANE CZY NIEZNANE? dr hab. prof. nadzw. UŁ Małgorzata Jóźwiak 1 Temperatura 2 Temperatura jest wielkością charakteryzującą stopień nagrzania danego ciała. 3 Temperaturę ciała można określić jako
CIEPŁO ZNANE CZY NIEZNANE? dr hab. prof. nadzw. UŁ Małgorzata Jóźwiak 1 Temperatura 2 Temperatura jest wielkością charakteryzującą stopień nagrzania danego ciała. 3 Temperaturę ciała można określić jako
WNIOSEK REKRUTACYJNY NA ZAJĘCIA KÓŁKO OLIMPIJSKIE Z CHEMII - poziom PG
 WNIOSEK REKRUTACYJNY NA ZAJĘCIA KÓŁKO OLIMPIJSKIE Z CHEMII - poziom PG Imię i nazwisko: Klasa i szkoła*: Adres e-mail: Nr telefonu: Czy uczeń jest już uczestnikiem projektu? (odp. otoczyć kółkiem) Ocena
WNIOSEK REKRUTACYJNY NA ZAJĘCIA KÓŁKO OLIMPIJSKIE Z CHEMII - poziom PG Imię i nazwisko: Klasa i szkoła*: Adres e-mail: Nr telefonu: Czy uczeń jest już uczestnikiem projektu? (odp. otoczyć kółkiem) Ocena
Temperatura jest wspólną własnością dwóch ciał, które pozostają ze sobą w równowadze termicznej.
 1 Ciepło jest sposobem przekazywania energii z jednego ciała do drugiego. Ciepło przepływa pod wpływem różnicy temperatur. Jeżeli ciepło nie przepływa mówimy o stanie równowagi termicznej. Zerowa zasada
1 Ciepło jest sposobem przekazywania energii z jednego ciała do drugiego. Ciepło przepływa pod wpływem różnicy temperatur. Jeżeli ciepło nie przepływa mówimy o stanie równowagi termicznej. Zerowa zasada
TERMOCHEMIA SPALANIA
 TERMOCHEMIA SPALANIA I ZASADA TERMODYNAMIKI dq = dh Vdp W przemianach izobarycznych: dp = 0 dq = dh dh = c p dt dq = c p dt Q = T 2 T1 c p ( T)dT Q ciepło H - entalpia wewnętrzna V objętość P - ciśnienie
TERMOCHEMIA SPALANIA I ZASADA TERMODYNAMIKI dq = dh Vdp W przemianach izobarycznych: dp = 0 dq = dh dh = c p dt dq = c p dt Q = T 2 T1 c p ( T)dT Q ciepło H - entalpia wewnętrzna V objętość P - ciśnienie
TERMODYNAMIKA. przykłady zastosowań. I.Mańkowski I LO w Lęborku
 TERMODYNAMIKA przykłady zastosowań I.Mańkowski I LO w Lęborku 2016 UKŁAD TERMODYNAMICZNY Dla przykładu układ termodynamiczny stanowią zamknięty cylinder z ruchomym tłokiem, w którym znajduje się gaz tak
TERMODYNAMIKA przykłady zastosowań I.Mańkowski I LO w Lęborku 2016 UKŁAD TERMODYNAMICZNY Dla przykładu układ termodynamiczny stanowią zamknięty cylinder z ruchomym tłokiem, w którym znajduje się gaz tak
Inżynieria Biomedyczna. Wykład IV Elementy termochemii czyli o efektach cieplnych reakcji
 Inżynieria Biomedyczna Wykład IV Elementy termochemii czyli o efektach cieplnych reakcji Plan Terminologia i jednostki energii Pojemność cieplna Reaktywność chemiczna I prawo termodynamiki Entalpia Prawo
Inżynieria Biomedyczna Wykład IV Elementy termochemii czyli o efektach cieplnych reakcji Plan Terminologia i jednostki energii Pojemność cieplna Reaktywność chemiczna I prawo termodynamiki Entalpia Prawo
Kryteria samorzutności procesów fizyko-chemicznych
 Kryteria samorzutności procesów fizyko-chemicznych 2.5.1. Samorzutność i równowaga 2.5.2. Sens i pojęcie entalpii swobodnej 2.5.3. Sens i pojęcie energii swobodnej 2.5.4. Obliczanie zmian entalpii oraz
Kryteria samorzutności procesów fizyko-chemicznych 2.5.1. Samorzutność i równowaga 2.5.2. Sens i pojęcie entalpii swobodnej 2.5.3. Sens i pojęcie energii swobodnej 2.5.4. Obliczanie zmian entalpii oraz
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru
 1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
1. Stechiometria 1.1. Obliczenia składu substancji na podstawie wzoru Wzór związku chemicznego podaje jakościowy jego skład z jakich pierwiastków jest zbudowany oraz liczbę atomów poszczególnych pierwiastków
GAZ DOSKONAŁY. Brak oddziaływań między cząsteczkami z wyjątkiem zderzeń idealnie sprężystych.
 TERMODYNAMIKA GAZ DOSKONAŁY Gaz doskonały to abstrakcyjny, matematyczny model gazu, chociaż wiele gazów (azot, tlen) w warunkach normalnych zachowuje się w przybliżeniu jak gaz doskonały. Model ten zakłada:
TERMODYNAMIKA GAZ DOSKONAŁY Gaz doskonały to abstrakcyjny, matematyczny model gazu, chociaż wiele gazów (azot, tlen) w warunkach normalnych zachowuje się w przybliżeniu jak gaz doskonały. Model ten zakłada:
VIII Podkarpacki Konkurs Chemiczny 2015/2016
 III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
III Podkarpacki Konkurs Chemiczny 015/016 ETAP I 1.11.015 r. Godz. 10.00-1.00 Uwaga! Masy molowe pierwiastków podano na końcu zestawu. Zadanie 1 (10 pkt) 1. Kierunek której reakcji nie zmieni się pod wpływem
Opracował: dr inż. Tadeusz Lemek
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria i Gospodarka Wodna w ramach projektu Era inżyniera pewna lokata na przyszłość Opracował:
Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych
 Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych 1. Równanie kinetyczne, szybkość reakcji, rząd i cząsteczkowość reakcji. Zmiana szybkości reakcji na skutek zmiany
Zagadnienia do pracy klasowej: Kinetyka, równowaga, termochemia, chemia roztworów wodnych 1. Równanie kinetyczne, szybkość reakcji, rząd i cząsteczkowość reakcji. Zmiana szybkości reakcji na skutek zmiany
1. Kryształy jonowe omówić oddziaływania w kryształach jonowych oraz typy struktur jonowych.
 Tematy opisowe 1. Kryształy jonowe omówić oddziaływania w kryształach jonowych oraz typy struktur jonowych. 2. Dlaczego do kadłubów statków, doków, falochronów i filarów mostów przymocowuje się płyty z
Tematy opisowe 1. Kryształy jonowe omówić oddziaływania w kryształach jonowych oraz typy struktur jonowych. 2. Dlaczego do kadłubów statków, doków, falochronów i filarów mostów przymocowuje się płyty z
Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2016/17)
 Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2016/17) Uwaga! Uzyskane wyniki mogą się nieco różnić od podanych w materiałach, ze względu na uaktualnianie wartości zapisanych
Ćwiczenia audytoryjne z Chemii fizycznej 1 Zalecane zadania kolokwium 1. (2016/17) Uwaga! Uzyskane wyniki mogą się nieco różnić od podanych w materiałach, ze względu na uaktualnianie wartości zapisanych
Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 1, zadanie nr 1 1
 Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 1, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący Uwaga! Proszę stosować się do następującego sposobu wprowadzania tekstu w ramkach : pola szare
Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 1, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący Uwaga! Proszę stosować się do następującego sposobu wprowadzania tekstu w ramkach : pola szare
1. Od czego i w jaki sposób zależy szybkość reakcji chemicznej?
 Tematy opisowe 1. Od czego i w jaki sposób zależy szybkość reakcji chemicznej? 2. Omów pomiar potencjału na granicy faz elektroda/roztwór elektrolitu. Podaj przykład, omów skale potencjału i elektrody
Tematy opisowe 1. Od czego i w jaki sposób zależy szybkość reakcji chemicznej? 2. Omów pomiar potencjału na granicy faz elektroda/roztwór elektrolitu. Podaj przykład, omów skale potencjału i elektrody
CIEPŁO O ZNANE CZY NIEZNANE?
 CIEPŁO O ZNANE CZY NIEZNANE? prof. dr hab. Małgorzata Jóźwiak 1 Temperatura 2 Temperatura jest wielkości cią charakteryzującą stopień nagrzania danego ciała. a. 3 Temperaturę ciała można określić jako
CIEPŁO O ZNANE CZY NIEZNANE? prof. dr hab. Małgorzata Jóźwiak 1 Temperatura 2 Temperatura jest wielkości cią charakteryzującą stopień nagrzania danego ciała. a. 3 Temperaturę ciała można określić jako
Równowagi fazowe. Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny
 Równowagi fazowe Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Równowaga termodynamiczna Przemianom fazowym towarzyszą procesy, podczas których nie zmienia się skład chemiczny układu, polegają
Równowagi fazowe Zakład Chemii Medycznej Pomorski Uniwersytet Medyczny Równowaga termodynamiczna Przemianom fazowym towarzyszą procesy, podczas których nie zmienia się skład chemiczny układu, polegają
Termodynamika techniczna i chemiczna, 2015/16, zadania do kol. 1, zadanie nr 1 1
 Termodynamika techniczna i chemiczna, 2015/16, zadania do kol. 1, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący 1. Obliczyć zmianę entalpii dla izobarycznej (p = 1 bar) reakcji chemicznej zapoczątkowanej
Termodynamika techniczna i chemiczna, 2015/16, zadania do kol. 1, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący 1. Obliczyć zmianę entalpii dla izobarycznej (p = 1 bar) reakcji chemicznej zapoczątkowanej
CIEPŁO ZNANE CZY NIEZNANE? dr hab. prof. nadzw. UŁ Małgorzata Jóźwiak
 CIEPŁO ZNANE CZY NIEZNANE? dr hab. prof. nadzw. UŁ Małgorzata Jóźwiak 1 Temperatura 2 Temperatura jest wielkością charakteryzującą stopień nagrzania danego ciała. 3 Temperaturę ciała można określić jako
CIEPŁO ZNANE CZY NIEZNANE? dr hab. prof. nadzw. UŁ Małgorzata Jóźwiak 1 Temperatura 2 Temperatura jest wielkością charakteryzującą stopień nagrzania danego ciała. 3 Temperaturę ciała można określić jako
Praca objętościowa - pv (wymiana energii na sposób pracy) Ciepło reakcji Q (wymiana energii na sposób ciepła) Energia wewnętrzna
 Energia - zdolność danego układu do wykonania dowolnej pracy. Potencjalna praca, którą układ może w przyszłości wykonać. Praca wykonana przez układ jak i przeniesienie energii może manifestować się na
Energia - zdolność danego układu do wykonania dowolnej pracy. Potencjalna praca, którą układ może w przyszłości wykonać. Praca wykonana przez układ jak i przeniesienie energii może manifestować się na
CIEPLNE I MECHANICZNE WŁASNOŚCI CIAŁ
 CIEPLNE I MECHANICZNE WŁASNOŚCI CIAŁ Ciepło i temperatura Pojemność cieplna i ciepło właściwe Ciepło przemiany Przejścia między stanami Rozszerzalność cieplna Sprężystość ciał Prawo Hooke a Mechaniczne
CIEPLNE I MECHANICZNE WŁASNOŚCI CIAŁ Ciepło i temperatura Pojemność cieplna i ciepło właściwe Ciepło przemiany Przejścia między stanami Rozszerzalność cieplna Sprężystość ciał Prawo Hooke a Mechaniczne
c. Oblicz wydajność reakcji rozkładu 200 g nitrogliceryny, jeśli otrzymano w niej 6,55 g tlenu.
 Zadanie 1. Nitrogliceryna (C 3H 5N 3O 9) jest środkiem wybuchowym. Jej rozkład można opisać następującym schematem: 4 C 3 H 5 N 3 O 9 (c) 6 N 2 (g) + 12 CO 2 (g) + 10 H 2 O (g) + 1 O 2 (g) H rozkładu =
Zadanie 1. Nitrogliceryna (C 3H 5N 3O 9) jest środkiem wybuchowym. Jej rozkład można opisać następującym schematem: 4 C 3 H 5 N 3 O 9 (c) 6 N 2 (g) + 12 CO 2 (g) + 10 H 2 O (g) + 1 O 2 (g) H rozkładu =
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym
 1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
1. Zaproponuj doświadczenie pozwalające oszacować szybkość reakcji hydrolizy octanu etylu w środowisku obojętnym 2. W pewnej chwili szybkość powstawania produktu C w reakcji: 2A + B 4C wynosiła 6 [mol/dm
a) 1 mol b) 0,5 mola c) 1,7 mola d) potrzebna jest znajomość objętości zbiornika, aby można było przeprowadzić obliczenia
 1. Oblicz wartość stałej równowagi reakcji: 2HI H 2 + I 2 w temperaturze 600K, jeśli wiesz, że stężenia reagentów w stanie równowagi wynosiły: [HI]=0,2 mol/dm 3 ; [H 2 ]=0,02 mol/dm 3 ; [I 2 ]=0,024 mol/dm
1. Oblicz wartość stałej równowagi reakcji: 2HI H 2 + I 2 w temperaturze 600K, jeśli wiesz, że stężenia reagentów w stanie równowagi wynosiły: [HI]=0,2 mol/dm 3 ; [H 2 ]=0,02 mol/dm 3 ; [I 2 ]=0,024 mol/dm
13 TERMODYNAMIKA. Sprawdzono w roku 2015 przez A. Chomickiego
 13 TERMODYNAMIKA Zagadnienia teoretyczne Układ i otoczenie. Wielkości intensywne i ekstensywne. Pojęcie energii, ciepła, pracy, temperatury. Zasady termodynamiki (pierwsza, druga, trzecia). Funkcje termodynamiczne
13 TERMODYNAMIKA Zagadnienia teoretyczne Układ i otoczenie. Wielkości intensywne i ekstensywne. Pojęcie energii, ciepła, pracy, temperatury. Zasady termodynamiki (pierwsza, druga, trzecia). Funkcje termodynamiczne
Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12
 Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12 atomu węgla 12 C. Mol - jest taką ilością danej substancji,
Podstawowe pojęcia Masa atomowa (cząsteczkowa) - to stosunek masy atomu danego pierwiastka chemicznego (cząsteczki związku chemicznego) do masy 1/12 atomu węgla 12 C. Mol - jest taką ilością danej substancji,
a) jeżeli przedstawiona reakcja jest reakcją egzotermiczną, to jej prawidłowy przebieg jest przedstawiony na wykresie za pomocą linii...
 1. Spośród podanych reakcji wybierz reakcję egzoenergetyczną: a) Redukcja tlenku miedzi (II) wodorem b) Otrzymywanie tlenu przez rozkład chloranu (V) potasu c) Otrzymywanie wapna palonego w procesie prażenia
1. Spośród podanych reakcji wybierz reakcję egzoenergetyczną: a) Redukcja tlenku miedzi (II) wodorem b) Otrzymywanie tlenu przez rozkład chloranu (V) potasu c) Otrzymywanie wapna palonego w procesie prażenia
Opracowała: mgr inż. Ewelina Nowak
 Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Materiały dydaktyczne na zajęcia wyrównawcze z chemii dla studentów pierwszego roku kierunku zamawianego Inżynieria Środowiska w ramach projektu Era inżyniera pewna lokata na przyszłość Opracowała: mgr
Zadanie 1. Zadanie: Odpowiedź: ΔU = 2,8663 10 4 J
 Tomasz Lubera Zadanie: Zadanie 1 Autoklaw zawiera 30 dm 3 azotu o temperaturze 15 o C pod ciśnieniem 1,48 atm. Podczas ogrzewania autoklawu ciśnienie wzrosło do 3800,64 mmhg. Oblicz zmianę energii wewnętrznej
Tomasz Lubera Zadanie: Zadanie 1 Autoklaw zawiera 30 dm 3 azotu o temperaturze 15 o C pod ciśnieniem 1,48 atm. Podczas ogrzewania autoklawu ciśnienie wzrosło do 3800,64 mmhg. Oblicz zmianę energii wewnętrznej
Termodynamiczny opis przejść fazowych pierwszego rodzaju
 Wykład II Przejścia fazowe 1 Termodynamiczny opis przejść fazowych pierwszego rodzaju Woda występuje w trzech stanach skupienia jako ciecz, jako gaz, czyli para wodna, oraz jako ciało stałe, a więc lód.
Wykład II Przejścia fazowe 1 Termodynamiczny opis przejść fazowych pierwszego rodzaju Woda występuje w trzech stanach skupienia jako ciecz, jako gaz, czyli para wodna, oraz jako ciało stałe, a więc lód.
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II
 TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
TEST PRZYROSTU KOMPETENCJI Z CHEMII DLA KLAS II Czas trwania testu 120 minut Informacje 1. Proszę sprawdzić czy arkusz zawiera 10 stron. Ewentualny brak należy zgłosić nauczycielowi. 2. Proszę rozwiązać
... imię i nazwisko,nazwa szkoły, miasto
 Zadanie 1. (3 pkt) Aspirynę czyli kwas acetylosalicylowy można otrzymać w reakcji kwasu salicylowego z bezwodnikiem kwasu etanowego (octowego). a. Zapisz równanie reakcji, o której mowa w informacji wstępnej
Zadanie 1. (3 pkt) Aspirynę czyli kwas acetylosalicylowy można otrzymać w reakcji kwasu salicylowego z bezwodnikiem kwasu etanowego (octowego). a. Zapisz równanie reakcji, o której mowa w informacji wstępnej
WYKAZ NAJWAŻNIEJSZYCH SYMBOLI
 SPIS TREŚCI WYKAZ NAJWAŻNIEJSZYCH SYMBOLI...7 PRZEDMOWA...8 1. WSTĘP...9 2. MATEMATYCZNE OPRACOWANIE WYNIKÓW POMIARÓW...10 3. LEPKOŚĆ CIECZY...15 3.1. Pomiar lepkości...16 3.2. Lepkość względna...18 3.3.
SPIS TREŚCI WYKAZ NAJWAŻNIEJSZYCH SYMBOLI...7 PRZEDMOWA...8 1. WSTĘP...9 2. MATEMATYCZNE OPRACOWANIE WYNIKÓW POMIARÓW...10 3. LEPKOŚĆ CIECZY...15 3.1. Pomiar lepkości...16 3.2. Lepkość względna...18 3.3.
Kinetyka reakcji chemicznych. Dr Mariola Samsonowicz
 Kinetyka reakcji chemicznych Dr Mariola Samsonowicz 1 Czym zajmuje się kinetyka chemiczna? Badaniem szybkości reakcji chemicznych poprzez analizę eksperymentalną i teoretyczną. Zdefiniowanie równania kinetycznego
Kinetyka reakcji chemicznych Dr Mariola Samsonowicz 1 Czym zajmuje się kinetyka chemiczna? Badaniem szybkości reakcji chemicznych poprzez analizę eksperymentalną i teoretyczną. Zdefiniowanie równania kinetycznego
Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 2, zadanie nr 1 1
 Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 2, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący Uwaga! Proszę stosować się do następującego sposobu wprowadzania tekstu w ramkach : pola szare
Chemia fizyczna/ termodynamika, 2015/16, zadania do kol. 2, zadanie nr 1 1 [Imię, nazwisko, grupa] prowadzący Uwaga! Proszę stosować się do następującego sposobu wprowadzania tekstu w ramkach : pola szare
a. Dobierz współczynniki w powyższym schemacie tak, aby stał się równaniem reakcji chemicznej.
 Zadanie 1. Nitrogliceryna (C 3 H 5 N 3 O 9 ) jest środkiem wybuchowym. Jej rozkład można opisać następującym schematem: C 3 H 5 N 3 O 9 (c) N 2 (g) + CO 2 (g) + H 2 O (g) + O 2 (g) H rozkładu = - 385 kj/mol
Zadanie 1. Nitrogliceryna (C 3 H 5 N 3 O 9 ) jest środkiem wybuchowym. Jej rozkład można opisać następującym schematem: C 3 H 5 N 3 O 9 (c) N 2 (g) + CO 2 (g) + H 2 O (g) + O 2 (g) H rozkładu = - 385 kj/mol
Termodynamika. Energia wewnętrzna ciał
 ermodynamika Energia wewnętrzna ciał Cząsteczki ciał stałych, cieczy i gazów znajdują się w nieustannym ruchu oddziałując ze sobą. Sumę energii kinetycznej oraz potencjalnej oddziałujących cząsteczek nazywamy
ermodynamika Energia wewnętrzna ciał Cząsteczki ciał stałych, cieczy i gazów znajdują się w nieustannym ruchu oddziałując ze sobą. Sumę energii kinetycznej oraz potencjalnej oddziałujących cząsteczek nazywamy
3. Przyrost temperatury gazu wynosi 20 C. Ile jest równy ten przyrost w kelwinach?
 1. Która z podanych niżej par wielkości fizycznych ma takie same jednostki? a) energia i entropia b) ciśnienie i entalpia c) praca i entalpia d) ciepło i temperatura 2. 1 kj nie jest jednostką a) entropii
1. Która z podanych niżej par wielkości fizycznych ma takie same jednostki? a) energia i entropia b) ciśnienie i entalpia c) praca i entalpia d) ciepło i temperatura 2. 1 kj nie jest jednostką a) entropii
Prowadzący. http://luberski.w.interia.pl telefon PK: 126282746 Pokój 210A (Katedra Biotechnologii i Chemii Fizycznej C-5)
 Tomasz Lubera dr Tomasz Lubera mail: luberski@interia.pl Prowadzący http://luberski.w.interia.pl telefon PK: 126282746 Pokój 210A (Katedra Biotechnologii i Chemii Fizycznej C-5) Konsultacje: we wtorki
Tomasz Lubera dr Tomasz Lubera mail: luberski@interia.pl Prowadzący http://luberski.w.interia.pl telefon PK: 126282746 Pokój 210A (Katedra Biotechnologii i Chemii Fizycznej C-5) Konsultacje: we wtorki
WNIOSEK REKRUTACYJNY NA ZAJĘCIA KÓŁKO OLIMPIJSKIE Z CHEMII - poziom PG
 WNIOSEK REKRUTACYJNY NA ZAJĘCIA KÓŁKO OLIMPIJSKIE Z CHEMII - poziom PG Imię i nazwisko: Klasa i szkoła*: Adres e-mail: Nr telefonu: Czy uczeń jest już uczestnikiem projektu Zdolni z Pomorza - Uniwersytet
WNIOSEK REKRUTACYJNY NA ZAJĘCIA KÓŁKO OLIMPIJSKIE Z CHEMII - poziom PG Imię i nazwisko: Klasa i szkoła*: Adres e-mail: Nr telefonu: Czy uczeń jest już uczestnikiem projektu Zdolni z Pomorza - Uniwersytet
Zadanie 1. Zadanie: Odpowiedź: ΔU = 2, J
 Tomasz Lubera Zadanie: Zadanie 1 Autoklaw zawiera 30 dm 3 azotu o temperaturze 15 o C pod ciśnieniem 1,48 atm. Podczas ogrzewania autoklawu ciśnienie wzrosło do 3800,64 mmhg. Oblicz zmianę energii wewnętrznej
Tomasz Lubera Zadanie: Zadanie 1 Autoklaw zawiera 30 dm 3 azotu o temperaturze 15 o C pod ciśnieniem 1,48 atm. Podczas ogrzewania autoklawu ciśnienie wzrosło do 3800,64 mmhg. Oblicz zmianę energii wewnętrznej
Termodynamika. Część 4. Procesy izoparametryczne Entropia Druga zasada termodynamiki. Janusz Brzychczyk, Instytut Fizyki UJ
 Termodynamika Część 4 Procesy izoparametryczne Entropia Druga zasada termodynamiki Janusz Brzychczyk, Instytut Fizyki UJ Pierwsza zasada termodynamiki procesy kwazistatyczne Zgodnie z pierwszą zasadą termodynamiki,
Termodynamika Część 4 Procesy izoparametryczne Entropia Druga zasada termodynamiki Janusz Brzychczyk, Instytut Fizyki UJ Pierwsza zasada termodynamiki procesy kwazistatyczne Zgodnie z pierwszą zasadą termodynamiki,
13 TERMODYNAMIKA. Sprawdzono w roku 2017 przez A. Chomickiego
 13 TERMODYNAMIKA Zagadnienia teoretyczne Układ i otoczenie. Wielkości intensywne i ekstensywne. Pojęcie energii, ciepła, pracy, temperatury. Zasady termodynamiki (pierwsza, druga, trzecia). Funkcje termodynamiczne
13 TERMODYNAMIKA Zagadnienia teoretyczne Układ i otoczenie. Wielkości intensywne i ekstensywne. Pojęcie energii, ciepła, pracy, temperatury. Zasady termodynamiki (pierwsza, druga, trzecia). Funkcje termodynamiczne
Przemiany substancji
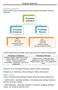 Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Przemiany substancji Poniżej przedstawiono graf pokazujący rodzaje przemian jaki ulegają substancje chemiczne. Przemiany substancji Przemiany chemiczne Przemiany fizyczne Objawy: - zmiania barwy, - efekty
Wykład 6. Klasyfikacja przemian fazowych
 Wykład 6 Klasyfikacja przemian fazowych JS Klasyfikacja Ehrenfesta Ehrenfest klasyfikuje przemiany fazowe w oparciu o potencjał chemiczny. nieciągłość Przemiany fazowe pierwszego rodzaju pochodne potencjału
Wykład 6 Klasyfikacja przemian fazowych JS Klasyfikacja Ehrenfesta Ehrenfest klasyfikuje przemiany fazowe w oparciu o potencjał chemiczny. nieciągłość Przemiany fazowe pierwszego rodzaju pochodne potencjału
CHEMIA. Wymagania szczegółowe. Wymagania ogólne
 CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
CHEMIA Wymagania ogólne Wymagania szczegółowe Uczeń: zapisuje konfiguracje elektronowe atomów pierwiastków do Z = 36 i jonów o podanym ładunku, uwzględniając rozmieszczenie elektronów na podpowłokach [
Kiedy przebiegają reakcje?
 Kiedy przebiegają reakcje? Thermodynamics lets us predict whether a process will occur but gives no information about the amount of time required for the process. CH 4(g) + 2O 2(g) substraty 2(g) egzotermiczna
Kiedy przebiegają reakcje? Thermodynamics lets us predict whether a process will occur but gives no information about the amount of time required for the process. CH 4(g) + 2O 2(g) substraty 2(g) egzotermiczna
Podstawy termodynamiki
 Podstawy termodynamiki Temperatura i ciepło Praca jaką wykonuje gaz I zasada termodynamiki Przemiany gazowe izotermiczna izobaryczna izochoryczna adiabatyczna Co to jest temperatura? 40 39 38 Temperatura
Podstawy termodynamiki Temperatura i ciepło Praca jaką wykonuje gaz I zasada termodynamiki Przemiany gazowe izotermiczna izobaryczna izochoryczna adiabatyczna Co to jest temperatura? 40 39 38 Temperatura
Inżynieria procesów przetwórstwa węgla, zima 15/16
 Inżynieria procesów przetwórstwa węgla, zima 15/16 Ćwiczenia 1 7.10.2015 1. Załóżmy, że balon ma kształt sfery o promieniu 3m. a. Jaka ilość wodoru potrzebna jest do jego wypełnienia, aby na poziomie morza
Inżynieria procesów przetwórstwa węgla, zima 15/16 Ćwiczenia 1 7.10.2015 1. Załóżmy, że balon ma kształt sfery o promieniu 3m. a. Jaka ilość wodoru potrzebna jest do jego wypełnienia, aby na poziomie morza
1 Kinetyka reakcji chemicznych
 Podstawy obliczeń chemicznych 1 1 Kinetyka reakcji chemicznych Szybkość reakcji chemicznej definiuje się jako ubytek stężenia substratu lub wzrost stężenia produktu w jednostce czasu. ν = c [ ] 2 c 1 mol
Podstawy obliczeń chemicznych 1 1 Kinetyka reakcji chemicznych Szybkość reakcji chemicznej definiuje się jako ubytek stężenia substratu lub wzrost stężenia produktu w jednostce czasu. ν = c [ ] 2 c 1 mol
Kiedy przebiegają reakcje?
 Kiedy przebiegają reakcje? Thermodynamics lets us predict whether a process will occur but gives no information about the amount of time required for the process. Termodynamika dziedzina termodynamiki
Kiedy przebiegają reakcje? Thermodynamics lets us predict whether a process will occur but gives no information about the amount of time required for the process. Termodynamika dziedzina termodynamiki
CHEMIA NIEORGANICZNA. Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I pietrop. 131 A. WYKŁAD -3
 CHEMIA NIEORGANICZNA Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I pietrop. 131 A http://www.chemia.uj.edu.pl/kotarba/ WYKŁAD -3 RÓWNOWAGA Termochemia i termodynamika funkcje termodynamiczne,
CHEMIA NIEORGANICZNA Andrzej Kotarba Zakład Chemii Nieorganicznej Wydział Chemii I pietrop. 131 A http://www.chemia.uj.edu.pl/kotarba/ WYKŁAD -3 RÓWNOWAGA Termochemia i termodynamika funkcje termodynamiczne,
WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe
 kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
kod ŁÓDZKIE CENTRUM DOSKONALENIA NAUCZYCIELI I KSZTAŁCENIA PRAKTYCZNEGO Uzyskane punkty.. WOJEWÓDZKI KONKURS PRZEDMIOTOWY Z CHEMII DLA UCZNIÓW GIMNAZJÓW - rok szkolny 2016/2017 eliminacje rejonowe Zadanie
13. TERMODYNAMIKA WYZNACZANIE ENTALPII REAKCJI ZOBOJĘTNIANIA MOCNEJ ZASADY MOCNYMI KWASAMI I ENTALPII PROCESU ROZPUSZCZANIA SOLI
 Wykonanie ćwiczenia 13. TERMODYNAMIKA WYZNACZANIE ENTALPII REAKCJI ZOBOJĘTNIANIA MOCNEJ ZASADY MOCNYMI KWASAMI I ENTALPII PROCESU ROZPUSZCZANIA SOLI Zadania do wykonania: 1. Wykonać pomiar temperatury
Wykonanie ćwiczenia 13. TERMODYNAMIKA WYZNACZANIE ENTALPII REAKCJI ZOBOJĘTNIANIA MOCNEJ ZASADY MOCNYMI KWASAMI I ENTALPII PROCESU ROZPUSZCZANIA SOLI Zadania do wykonania: 1. Wykonać pomiar temperatury
Maszyny cieplne substancja robocza
 Maszyny cieplne cel: zamiana ciepła na pracę (i odwrotnie) pracują cyklicznie pracę wykonuje substancja robocza (np.gaz, mieszanka paliwa i powietrza) która: pochłania ciepło dostarczane ze źródła ciepła
Maszyny cieplne cel: zamiana ciepła na pracę (i odwrotnie) pracują cyklicznie pracę wykonuje substancja robocza (np.gaz, mieszanka paliwa i powietrza) która: pochłania ciepło dostarczane ze źródła ciepła
Termodynamika (1) Bogdan Walkowiak. Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka. poniedziałek, 23 października 2017
 Wykład 1 Termodynamika (1) Bogdan Walkowiak Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka Biofizyka 1 Zaliczenie Aby zaliczyć przedmiot należy: uzyskać pozytywną ocenę z laboratorium
Wykład 1 Termodynamika (1) Bogdan Walkowiak Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka Biofizyka 1 Zaliczenie Aby zaliczyć przedmiot należy: uzyskać pozytywną ocenę z laboratorium
Termodynamika Część 6 Związki i tożsamości termodynamiczne Potencjały termodynamiczne Warunki równowagi termodynamicznej Potencjał chemiczny
 Termodynamika Część 6 Związki i tożsamości termodynamiczne Potencjały termodynamiczne Warunki równowagi termodynamicznej Potencjał chemiczny Janusz Brzychczyk, Instytut Fizyki UJ Związek pomiędzy równaniem
Termodynamika Część 6 Związki i tożsamości termodynamiczne Potencjały termodynamiczne Warunki równowagi termodynamicznej Potencjał chemiczny Janusz Brzychczyk, Instytut Fizyki UJ Związek pomiędzy równaniem
Przemiany gazowe. 4. Który z poniższych wykresów reprezentuje przemianę izobaryczną: 5. Który z poniższych wykresów obrazuje przemianę izochoryczną:
 Przemiany gazowe 1. Czy możliwa jest przemiana gazowa, w której temperatura i objętość pozostają stałe, a ciśnienie rośnie: a. nie b. jest możliwa dla par c. jest możliwa dla gazów doskonałych 2. W dwóch
Przemiany gazowe 1. Czy możliwa jest przemiana gazowa, w której temperatura i objętość pozostają stałe, a ciśnienie rośnie: a. nie b. jest możliwa dla par c. jest możliwa dla gazów doskonałych 2. W dwóch
