BIOINFORMATYKA I JEJ PERSPEKTYWY
|
|
|
- Ludwika Zielińska
- 8 lat temu
- Przeglądów:
Transkrypt
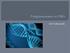
1 prof. dr hab. inż. Jacek Błażewicz Instytut Informatyki, Politechnika Poznańska 1. Wstęp BIOINFORMATYKA I JEJ PERSPEKTYWY Bioinformatyka jest jedną z najmłodszych nauk, której burzliwy rozwój został wymuszony przez postęp w dziedzinie nauk biologicznych, a umożliwiły go dokonane przełomowe osiągnięcia i wdrożenia w samej informatyce. Tak jak wiek XIX był wiekiem węgla, pary i mechaniki, a wiek XX wiekiem atomu i fizyki, tak wszystko wskazuje na to, że wiek XXI będzie wiekiem biologii i właśnie informatyki. Świadczy o tym między innymi fakt, iż większość przełomowych prac publikowanych w ostatnich dziesięcioleciach w prestiżowych czasopismach naukowych Science i Nature dotyczy biologii, a do uzyskania tych rezultatów w większości przypadków wykorzystano skomplikowane narzędzia bioinformatyczne. Przełomowym odkryciem II połowy XX wieku, stymulującym powyższy rozwój nauki było podanie w 1953 r. przez Watsona i Cricka (wykorzystujących także prace Wilkinsa i Franklin) modelu podwójnej helisy łańcucha DNA (por. Rys. 1), przechowującego (kodującego) informację genetyczną we wszystkich organizmach żywych [41], [19] i [42]. Za osiągnięcie to badacze uzyskali kilka lat później nagrodę Nobla. Odkrycie budowy helisy zrewolucjonizowało nasze spojrzenie na biologię, w szczególności biologię molekularną, której rozwój znacząco przyspieszył. Jej wpływ na informatykę też był bardzo znaczący. Po pierwsze, ilość generowanych danych z eksperymentów biologicznych okazała się za duża do zapamiętania i przetworzenia ręcznego. Niezbędna była pomoc informatyki. Z drugiej strony łańcuch DNA okazał się zakodowaną informacją dotyczącą budowy i funkcjonowania organizmów Rys. 1. Podwójna helisa DNA.
2 58 Biuletyn inauguracyjny PP PAŹDZIERNIK 2011 żywych. Niezbędne okazało się zatem wykorzystanie informatyki co najmniej na dwóch poziomach pracy biologów: na etapie gromadzenia i efektywnego zapisywania, przechowywania i wydobywania informacji, co prowadziło do wykorzystywania istniejących, a później stymulacji rozwoju nowych systemów baz danych; na etapie przetwarzania informacji zawartej w łańcuchach DNA, a także RNA i białek, modelowania struktur przestrzennych tych molekuł, a także przewidywania ich funkcjonalności i wzajemnych powiązań, co wymagało zastosowania dostępnych i rozwoju nowych narzędzi informatycznych i matematycznych, w szczególności, kombinatoryki, probabilistyki, statystyki, geometrii przestrzennej i wielu innych. Możemy zatem powiedzieć, że bioinformatyka to dziedzina wiedzy, która sytuuje się na pograniczu informatyki, biologii i matematyki. Wymaga znajomości tych trzech obszarów badawczych, ale w tej chwili jest traktowana jako samodzielna dyscyplina naukowa. Przepływ idei jest tu następujący: biologia, która jak powiedzieliśmy, jest w tej chwili motorem napędowym nauki, kreuje pewien problem, a informatyka próbuje (wykorzystując także matematykę) pomóc w jego rozwiązaniu. Należy podkreślić tutaj istotność aspektu obliczeniowego, a więc wykorzystanie komputerów. Samo zamodelowanie pewnego zjawiska, np. przy wykorzystaniu równań matematycznych, nie wystarczy! Potrzebne są efektywne algorytmy i programy komputerowe konstruujące rozwiązanie, choćby nie zawsze optymalne. To między innymi przyczyna wielkiego sukcesu bioinformatyki i stosunkowo niewielkiego zainteresowania biomatematyką. Warto w tym miejscu również wspomnieć o niesłychanym postępie nauk obliczeniowych (nie tylko związanych z biologią i bioinformatyką), który został spowodowany rozwojem Internetu i wielu różnorodnych technik obliczeń równoległych. Wspomniany wyżej aspekt konstrukcyjny doprowadził też do często występującego podziału interesującej nas dziedziny na biologię obliczeniową i właściwą bioinformatykę, w zgodzie z obowiązującym rozróżnieniem: nauka a technologia (science vs technology). Zgodnie z tym podziałem biologia obliczeniowa opracowuje modele ilościowe zagadnień biologicznych, często bardzo teoretyczne, bazujące na sformułowaniach matematycznych, bioinformatyka natomiast korzystając z tych modeli (lub znacznie je upraszczając) buduje algorytmy konstruujące interesujące biologów rozwiązania. Nie jest to jednak jedyne możliwe rozróżnienie między tymi dwiema dziedzinami, np. J. Xiong [43] proponuje taki podział: Bioinformatyka różni się od powiązanej z nią dziedziny zwanej biologią obliczeniową, gdyż ogranicza się do analizy sekwencji, struktury oraz funkcji genów i genomów oraz odpowiadających im produktów ekspresji. Dlatego często określa
3 WYKŁAD INAUGURACYJNY BIOINFORMATYKA I JEJ PERSPEKTYWY 59 się ją mianem molekularnej biologii obliczeniowej. Biologia obliczeniowa natomiast obejmuje wszystkie obszary biologii, które wymagają obliczeń. Na przykład w modelowaniu matematycznym ekosystemów i dynamiki populacji, w zastosowaniu teorii gier do analiz behawioralnych i rekonstrukcjach filogenetycznych wykorzystujących dane kopalne stosuje się narzędzia obliczeniowe, które nie muszą mieć związku z makrocząsteczkami biologicznymi. Wydaje nam się jednak, że pierwszy podział lepiej pasuje do ogólnej metodologii nauk, przypomnianej niedawno na jednym z wykładów inauguracyjnych przez L. Pacholskiego [29]. Trawestując cytowaną tam anegdotę pochodzącą od prof. Jana Kaczmarka, biologia obliczeniowa zajmuje się poznaniem tego co jest, natomiast bioinformatyka tworzeniem tego, czego jeszcze nie ma. Zatem przyjmiemy dalej, iż bioinformatyka rozwija narzędzia do analiz sekwencji (kwasów nukleinowych i białek), strukturalnych, funkcjonalnych oraz systemowych (por. zmodyfikowany podział dziedziny na Rys. 2, pierwotnie zaproponowany w [43]), a także narzędzia do ekstrakcji informacji przechowywanej w bazach danych. Rys. 2. Podział bioinformatyki. Celem bioinformatyki jest pomoc w zakresie zrozumienia funkcjonowania mechanizmów organizmów żywych poprzez budowę i wykorzystanie narzędzi ilościowych. Zastosowania tych badań znacząco wykraczają jednak poza nakreślony powyżej obszar, obejmując także wiele pokrewnych dziedzin jak biotechnologię czy medycynę, przyczyniając się np. do szybszego projektowania leków, wykonywania analiz DNA w medycynie sądowej, czy też przybliżając moment, w którym każdy z nas będzie mógł korzystać z dobrodziejstw medycyny spersonalizowanej.
4 60 Biuletyn inauguracyjny PP PAŹDZIERNIK 2011 W niniejszym studium znajdą się, choć oczywiście omówione bardzo skrótowo, powyższe aspekty dotyczące zakresu badawczego i zastosowań bioinformatyki, ze szczególnym uwzględnieniem wyników środowiska poznańskiego i perspektyw jej rozwoju na Politechnice Poznańskiej. 2. Biologiczne podstawy Biorąc pod uwagę fakt, że wykład ma miejsce na Politechnice Poznańskiej, niezbędne wydaje się przypomnienie podstawowych praw i odkryć biologii. W świetle tych ostatnich można stwierdzić, że wszystkie żyjące organizmy składają się z jednej lub wielu komórek. Stąd jednym z najważniejszych działów biologii jest biologia komórkowa (a idąc dalej tym śladem obliczeniowa biologia komórkowa, którą niektórzy utożsamiają z bioinformatyką). Jednym z najważniejszych obiektów, którymi zajmuje się biologia są łańcuchy DNA (molekuły kwasu nukleinowego DNA), kodujące informację genetyczną opisującą budowę i funkcjonowanie nie tylko pojedynczych komórek, ale i całych organizmów. Należy podkreślić, że budowa komórek różnych organizmów, a jeszcze bardziej kodujących je łańcuchów DNA wykazuje zadziwiające podobieństwa. DNA jest ciągiem nukleotydów (dla wygody informatyk może o nich myśleć jak o literach), przybierających zaledwie cztery wartości: A, C, G, T. Nie analizując bliżej ich budowy, możemy powiedzieć, iż różnią się one zasadą azotową wchodzącą w ich skład. Krótkie, pojedyncze łańcuchy DNA nazywane są oligonukleotydami. Cała informacja genetyczna organizmu skupiona w jednym lub kilku łańcuchach DNA, nazywana jest genomem. Dzięki wspomnianemu, fundamentalnemu odkryciu Watsona i Cricka [41] wiadomo, że łańcuch ten ma postać podwójnej helisy, a co więcej zawsze naprzeciwko A w jednym łańcuchu występuje T w drugim, a naprzeciwko C mamy G (por. Rys. 1). Znając zatem jeden z łańcuchów, drugi komplementarny, można zawsze odtworzyć. Korzysta z tej właściwości sam organizm przy rozmnażaniu, korzystają też biolodzy w laboratoriach. Długość genomu człowieka przekracza trzy miliardy par zasad bp (nukleotydów w takich jednostkach mierzony jest genom). Warto podkreślić, że kopia genomu znajduje się w każdej komórce organizmu i w przypadku człowieka jest to ponad 400 bilionów kopii. Jedną z ciekawych właściwości pojedynczego łańcucha DNA jest jego dążenie do połączenia się w helisę z łańcuchem komplementarnym. Właściwość ta wykorzystywana bywa bardzo często w laboratoriach. Wspomnianym badaczom zawdzięczamy też Centralny Dogmat Biologii Molekularnej, który określa związki miedzy DNA, a białkami będącymi budulcem organizmu, jak i elementami odpowiedzialnymi za jego działanie. Otóż, w procesie transkrypcji odpowiedni fragment genomu jest przepisywany
5 WYKŁAD INAUGURACYJNY BIOINFORMATYKA I JEJ PERSPEKTYWY 61 na łańcuch RNA (nietrwały, pośredniczący, pojedynczy łańcuch innego kwasu nukleinowego), który przechodząc następnie do rybosomu jest tłumaczony (podlega translacji) na odpowiadający łańcuch białkowy (por. Rys. 3, gdzie przedstawiono przebieg procesów transkrypcji i translacji). Należy podkreślić, że fragment łańcucha DNA odpowiadający jednemu łańcuchowi białka nosi nazwę genu. Warto dodać, że trzem nukleotydom odpowiada jeden aminokwas (element budowy białka), chociaż przypisanie to (nazywane kodem genetycznym) nie jest wzajemnie jednoznaczne. Rys. 3. Centralny Dogmat Biologii Molekularnej. Zadziwiające jest, że powyższy schemat odpowiada w zasadzie wszystkim organizmom żywym, a stosowany kod genetyczny w dużej mierze jest taki sam w większości przypadków. Powyższy schemat, powszechnie przyjmowany jeszcze kilkanaście lat temu, zakładał, że tylko ok. 5% genomu DNA zawierało informację kodującą białko. Resztą było tzw. DNA śmieciowe. Komputerową metaforę genetyczną tego modelu można przedstawić, przyjmując, że DNA to pamięć długookresowa (np. dyskowa), RNA to pamięć krótkookresowa (RAM, lub pamięć notatnikowa), a białka to procesory, wykonujące w systemie różne programy. Rozwój biologii pokazał jednak, że powyższy schemat jest zdecydowanie za prosty (trudno było przypuścić, że Natura marnotrawi 95% genomów organizmów życiowych). Nowe teorie zakładają znacząco większy udział małych łańcuchów RNA (transkrybowanych z nieopisanych dotychczas fragmentów genomu) we wszystkich procesach organizmów żywych. W naszej komputerowej metaforze, RNA spełniałoby zatem (oprócz pamięci notatnikowej) także rolę specjalizowanych mikroprocesorów wykonujących różne operacje pomocnicze w systemie.
6 62 Biuletyn inauguracyjny PP PAŹDZIERNIK 2011 Powyższa metafora winna przybliżyć informatykom (a ogólniej ludziom techniki) zasady funkcjonowania organizmów żywych. Trzeba jednakże podkreślić, że jest ona bardzo uproszczona, bo działanie systemów komputerowych jest z zasady linearne, tzn. zakodowane ciągi znaków są odczytywane i wykonywany jest odpowiedni program. I chociaż w działaniu organizmów żywych można się dopatrzyć elementów takiego typu działań (same procesy transkrypcji i translacji), to jednak wiele funkcji spełnianych zwłaszcza przez łańcuchy białkowe i RNA zależy od ich kształtu przestrzennego. Analiza zatem i predykcja funkcji poszczególnych elementów takiego systemu jest znacząco trudniejsza od analizy systemów informatycznych. (Por. Rys. 4, na którym przedstawiono przykład dokowania przestrzennego domeny RNazy IIIb białka Dicer i cząsteczki dwuniciowego RNA (dsrna). Rybonukleaza o aktywności RNazy III (zwana Dicer w komórkach ludzkich) umożliwia degradację dwuniciowych, liniowych fragmentów RNA do sirna.) Rys. 4. Przykład dokowania przestrzennego domeny RNazy IIIb białka Dicer i cząsteczki dwuniciowego RNA (dsrna). W dalszej części naszego opracowania dla ilustracji zastosowań bioinformatyki w biologii, omówimy proces sekwencjonowania (czytania) genomów DNA, a także zagadnienia przewidywania struktur przestrzennych molekuł. Pokazany zostanie także wpływ bioinformatyki na zagadnienia projektowania leków i problemy medycyny spersonalizowanej.
7 WYKŁAD INAUGURACYJNY BIOINFORMATYKA I JEJ PERSPEKTYWY Czytanie genomów DNA Historycznie rzecz biorąc, czytanie genomu DNA dokonywane było na 3 poziomach [40], [31], [37], [25]: sekwencjonowanie (sequencing), asemblacja (assembling) i mapowanie (mapping). Wzajemne zależności przedstawiono schematycznie na Rys. 5. Rys. 5. Trzy poziomy odczytu genomu. Oczywiste jest, że długiego fragmentu genomu (zwykle mówimy tak o chromosomach o długości rzędu 10 8 bp, na które podzielone są genomy) nie można bezpośrednio odczytać. Proces ten zwykle przebiegał na trzech wspomnianych poziomach i bardzo przypominał informatyczną procedurę rekurencyjną. W etapie pierwszym mapowaniu, dzielono chromosom na mniejsze fragmenty o długości ok. miliona par zasad (bp) za pomocą enzymów restrykcyjnych, tracąc oczywiście informację o kolejności występowania poszczególnych fragmentów. W kolejnym etapie asemblacji, powyższe fragmenty ponownie były dzielone na mniejsze, tym razem przy wykorzystaniu techniki śrutowania (shotgun technique). W zależności od stosowanej później metody odczytu tych najmniejszych fragmentów sekwencjonowania, długość tych ostatnich wahała się od 1000 bp dla sekwencjonowania na żelu, poprzez ok. 500 bp dla sekwencjonowania przez hybrydyzację (SBH), do 50 bp w przypadku najnowszych sekwenatorów NGS. Składanie genomu odbywało (odbywa) się w odwrotnej kolejności (jak już wspomnieliśmy nieomal tak jak przy rekurencji): zsekwencjonowane (przeczytane) małe fragmenty DNA łączy się w większe na etapie asemblacji, wykorzystując w tym celu podejścia grafowe i algorytmy heurystyczne, otrzymane zaś duże fragmenty mapuje się (składa) w całe chromosomy, rozwiązując bardzo ciekawe problemy z teorii liczb.
8 64 Biuletyn inauguracyjny PP PAŹDZIERNIK 2011 Omówimy poniżej metodę sekwencjonowania przez hybrydyzację (sequencing by hybridization) SBH, gdyż jest ona związana z badaniami ośrodka poznańskiego (W. Markiewicz), a ponadto wymaga sporego wkładu bioinformatyki i stosowane tu podejścia można w dużej mierze wykorzystać na etapie asemblacji. (Ze względu na pewne trudności związane z techniczną stroną tego pomysłu, metoda ta nie weszła do szerokiej praktyki laboratoryjnej mimo jej opatentowania [38] i [10].) Metoda SBH składa się z dwóch etapów. W etapie pierwszym biochemicznym, wykorzystuje się właściwość pojedynczej nici DNA do przyłączenia nici komplementarnej w celu utworzenia struktury helisy. Pojedynczą nić badanego (nieznanego) łańcucha DNA (o długości w przypadku SBH ok. 500 bp) uzyskuje się, rozdzielając helisę poprzez stworzenie warunków umożliwiających rozpad (np. wysoka temperatura, rozpuszczalnik organiczny o dużej sile jonowej). Następnie do roztworu wprowadza się badany pojedynczy łańcuch DNA o długości n oraz pełną bibliotekę oligonukleotydów o długości l (wszystkie oligonukleotydy oligomery, l-mery o tej długości). Bibliotekę oligomerów można zrealizować w postaci czipa, czyli matrycy l-merów, do których przyłącza się badaną nić. Te l-mery, które przyłączą się do badanego łańcucha tworzą spektrum, które jest podstawą jego rekonstrukcji. Dzięki reakcji polimerazy (PCR) można barwnik fluorescencyjny dodać tylko do jednej nici (takiej samej w każdym przypadku) badanego łańcucha DNA [1], [17]. Schematyczny przebieg eksperymentu pokazano na Rys. 6. Rys. 6. Przebieg eksperymentu hybrydyzacyjnego w metodzie SBH.
9 WYKŁAD INAUGURACYJNY BIOINFORMATYKA I JEJ PERSPEKTYWY 65 Załóżmy teraz, że udało się przeprowadzić eksperyment biochemiczny bezbłędnie, a powstałe spektrum jest idealne. (Z punktu widzenia biologii jest to mało prawdopodobne, ale taka idealizacja jest niezbędna dla właściwego zamodelowania informatycznego całego procesu.) W celu ilustracji fazy biochemicznej SBH rozpatrzmy Przykład 1. Przykład 1. Załóżmy, że oryginalna sekwencja, którą chcemy zsekwencjonować ma postać ACTCTGG, oraz, że udało się przeprowadzić eksperyment bez błędu, odczytując tę sekwencję z macierzy czipowej zawierającej 3-mery. Uzyskamy zatem następujące spektrum S={ACT,CTC,CTG,TCT,TGG}, co wynika z następującego wyniku hybrydyzacji (tworzenia helis częściowych z trójkami macierzy): Spektrum S nie daje w ogólności informacji o kolejności występowania oligonukleotydów w odczytywanym łańcuchu. I tu pomaga bioinformatyka, która akurat w tym przypadku wykorzystuje teorię grafów. Pierwszy algorytm rozwiązujący powyższy przypadek bioinformatycznej fazy SBH podał Lysov ze współpracownikami [26]. Algorytm ten jest następujący. Algorytm Lysowa 1. Skonstruuj graf H, w którym wierzchołki odpowiadają l-merom ze spektrum. Dwa wierzcholki są połączone łukiem skierowanym wtedy i tylko wtedy gdy l-1 nukleotydów końcowych pierwszego l-meru jest dokładnie równych l-1 początkowym nukleotydom drugiego l-meru. 2. Znajdź w grafie H drogę Hamiltona, to jest drogę przechodzącą dokładnie jeden raz przez każdy z wierzchołków H. Przykład zastosowania tego algorytmu pokazano na Rys. 7.
10 66 Biuletyn inauguracyjny PP PAŹDZIERNIK 2011 Rys. 7. Droga Hamiltona w grafie Lysova dla spektrum z Przykładu 1. Niestety zaproponowane rozwiązanie okazało się bardzo pracochłonne, bo problem drogi Hamiltona w grafie skierowanym jest NP-trudny [20], [3], zatem nie istnieje algorytm wielomianowy rozwiązujący ten problem grafowy. Jednak już w następnym roku, Pevzner zaproponował znacząco szybsze podejście [30]. Algorytm Pevznera 1. Skonstruuj graf G, w którym łuki skierowane odpowiadają l-merom, łącząc każdorazowo wierzchołek odpowiadający l-1 nukleotydom początkowym z wierzchołkiem odpowiadającym l-1 nukleotydom końcowym. 2. Znajdź w grafie G drogę Eulera, to jest drogę przechodzącą dokładnie jeden raz przez każdy z łuków G. Zastosowanie powyższego algorytmu do spektrum z Przykładu 1 pokazano na Rys. 8. Rys. 8. Graf Pevznera dla spektrum z Przykładu 1. Co ciekawe okazało się, że powyższy problem można rozwiązać w czasie wielomianowym, gdyż taka jest złożoność znalezienia drogi Eulera w grafie skierowanym. Rodziło to dalsze pytania, bo z jednej strony problem grafowy odpowiadający SBH był NP-trudny, z drugiej zaś łatwy obliczeniowo, co mogło prowadzić do zaskakujących wniosków [20], [3]. (W swej oryginalnej pracy
11 WYKŁAD INAUGURACYJNY BIOINFORMATYKA I JEJ PERSPEKTYWY 67 Pevzner nie wytłumaczył tego faktu.) Problem SBH w wersji idealnej był zatem bardzo interesujący z punktu widzenia teorii złożoności i grafów, a jego nieidealne uogólnienie także dla biologii (bo przypomnijmy, że zarówno podejście Lysova jak i Pevznera dotyczyły idealnego przypadku, trudnego do uzasadnienia biologicznie). Oba te kierunki badawcze związane były następnie w dużej mierze z ośrodkiem poznańskim. Problem teoretyczny udało się rozwiązać w 1999 r. [13]. W pracy tej pokazano równoważność obu modeli, wykorzystując w tym celu pojęcie skierowanych grafów liniowych. Mówiąc bardziej formalnie, w skierowanym grafie liniowym H (model Lysowa) istnieje droga Hamiltona wtedy i tylko wtedy, gdy w jego grafie oryginalnym (model Pevznera) istnieje droga Eulera. Analiza powyższych zależności zaowocowała też wprowadzeniem do literatury przedmiotu koncepcji grafów DNA wykorzystywanych do reprezentacji wyników idealnych eksperymentów hybrydyzacyjnych. Bardziej formalnie, są to indukowane podgrafy grafów de Bruijna [13]. Ich analizie poświęconych jest ostatnio wiele prac (por. m.in. [30]). Równie interesująca okazała się analiza zagadnienia sekwencjonowania SBH z błędami wynikającymi z eksperymentu biochemicznego. Istnieją dwa typy błędów eksperymentalnych: Negatywne w spektrum brakuje pewnych (k) oligonukleotydów w porównaniu z przypadkiem idealnym, Pozytywne w spektrum występują oligonukleotydy nadmiarowe. Błędy negatywne mogły mieć przy tym dwojaką naturę. Po pierwsze mogły pochodzić z samego eksperymentu i niedokładnego odczytu świecących punktów. Po drugie mogły też wynikać z powtórzeń krótkich l-merów, które znajdowały się w odczytywanym łańcuchu, a których to podejście nie było w stanie uwzględnić. Duży przełom w podejściu do rozwiązania problemu stanowiła praca [11]. Sformułowano w niej problem sekwencjonowania z dowolnymi błędami jako problem komiwojażera z wyborem (lub inaczej z premiami) Prize Collecting Traveling Salesman Problem (PCTSP), w specjalnym grafie skonstruowanym na bazie spektrum. Problem PCTSP różni się od klasycznego problemu komiwojażera [3] istnieniem współczynników zysku (premii) w wierzchołkach, oprócz standardowych kosztów (odległości) przypisanych skierowanym łukom grafu [24]. Celem jest tutaj znalezienie drogi prostej (niekoniecznie będącej drogą Hamiltona) o maksymalnym zysku, przy nieprzekroczeniu zadanego kosztu (długości drogi). W przypadku SBH, został użyty graf Lysowa, ale tym razem dopuszczono także możliwość połączenia pomiędzy wszystkimi wierzchołkami grafu (a nie tylko pomiędzy tymi, które różnią się etykietą oligonukleotydem, przesuniętą o jeden). Koszt każdego łuku określa teraz przesunięcie pomiędzy etykietami połączonych wierzchołków, a zysk z dołączenia każdego
12 68 Biuletyn inauguracyjny PP PAŹDZIERNIK 2011 wierzchołka wynosi 1. W takim grafie poszukuje się drogi prostej o maksymalnym zysku (a więc maksymalnej liczbie nukleotydów ze spektrum), której sumaryczny koszt nie przekracza n-l, gdzie n jest znaną długością poszukiwanej sekwencji, a l długością oligonukleotydów w bibliotece umieszczonej na czipie. Przykład 2 ilustruje tę konstrukcję. Przykład 2. Wykorzystamy raz jeszcze spektrum z Przykładu 1, lecz tym razem wprowadzimy błędy: negatywne oligonukleotyd CTC nie pojawia się w spektrum i pozytywne pojawia się dodatkowy nukleotyd (błąd) GAT. Nasze (błędne) spektrum będzie zatem miało postać S ={ACT,CTG, GAT,TCT,TGG}. Odpowiadający mu graf pokazano na Rys. 9. Rys. 9. Transformacja błędnego spektrum z Przykładu 2 do problemu PCTSP. Łuki ciągłe mają przypisany koszt 1, a przerywane koszt 2. Pominięto łuki o koszcie 3. Zauważmy, że także w tym przypadku udaje się zrekonstruować poszukiwaną sekwencję ACTCTGG pomimo obu typów błędów. W oryginalnej pracy zaproponowano algorytm rozwiązania problemu bazujący na metodzie podziału i ograniczeń. Ponieważ jednak otrzymany problem PCTSP jest NP-trudny, więc właściwsze wydawało się rozwiązanie go za pomocą algorytmów heurystycznych. Szereg takich algorytmów zaproponowano w późniejszym czasie, między innymi w pracach [5], [12], [14], [6]. W efekcie rozwiązano rzeczywisty problem biologiczny (z błędami) uzyskując dobrą dokładność rekonstruowanych sekwencji, za wyjątkiem jednego przypadku błędów negatywnych pochodzących z powtórzeń. Biblioteka l-merów nie była bowiem w stanie przekazać liczby świecących, powtarzających się oligonukleotydów. Ponieważ liczne powtórzenia są immanentną cechą sekwencji DNA, więc przesądziło to o stosunkowo niewielkim wykorzystaniu praktycznym tego podejścia. Ostatnio, wraz z rozwojem Projektu Genomu Człowieka znacząco rozwinął się przemysł produkujący sekwenatory DNA nowej generacji (Next Generation Sequencers). Znacząco przyśpieszyły one sekwencjonowanie DNA, eliminując
13 WYKŁAD INAUGURACYJNY BIOINFORMATYKA I JEJ PERSPEKTYWY 69 równocześnie konieczność korzystania z obliczeń algorytmicznych na tym etapie. I tak na przykład sekwenator firmy Illumina umożliwia równoległe odczytanie wielu milionów sekwencji. Sekwencjonowanie przez syntezę odbywa się poprzez dołączanie kolejnych nukleotydów do drugiej komplementarnej nici DNA. Każdy z czterech różnych nukleotydów generuje inny sygnał świetlny rejestrowany przez kamerę. Analizując kolejne obrazy z kamery, można odczytać każdą sekwencję. Długość sekwencjonowanych fragmentów DNA wynosi nukleotydów, a w ciągu kilku dni można zsekwencjonować cały genom np. człowieka. (Tu należy podkreślić, że uzyskuje się tylko ogromną liczbę tych niewielkich sekwencji składowych, podobnie jednak jak uprzednio traci się informację o kolejności ich występowania w genomie.) Na Rys. 10 przedstawiono przykładowy sekwenator Illuminy Genome Analyzer II. Paradoksalnie okazało się, że chociaż podejście do sekwencjonowania przez hybrydyzację (SBH), nie znalazło dużego zastosowania w praktyce, to jego rozbudowana i znacznie ulepszona część algorytmiczna (bioinformatyczna) jest podstawowym elementem asemblacji, czyli składania małych sekwencji DNA (uzyskanych przez sekwenatory NGS) w sekwencje genomowe. Schematyczną ilustrację procesu asemblacji pokazano na Rys. 11. Jak łatwo sobie wyobrazić, proces asemblacji jest dużo bardziej skomplikowany (mimo formalnie bardzo podobnej natury) od bioinformatycznej fazy SBH, poprzez znacząco większą skalę procesu (terabajtowe zbiory danych sekwencji, podlegające asemblacji) oraz dodatkowe błędy wynikające Rys. 10. Sekwenator firma Illumina Genome Analyzer II. Rys. 11. Ilustracja procesu asemblacji
14 70 Biuletyn inauguracyjny PP PAŹDZIERNIK 2011 z niedokładności procesu sekwencjonowania. (Oprócz standardowych błędów odczytu mamy tu do czynienia także np. z chimerami czy też ze zmienną orientacją łańcucha DNA lub zanieczyszczeniami pochodzącymi od innych organizmów niż aktualnie sekwencjonowany.) Mimo tych komplikacji, zespół nasz dzięki doświadczeniu zdobytemu przy okazji rozwiązywania problemu SBH, skonstruował także jeden z lepszych algorytmów asemblacji dotyczących sekwenatora 454 [7], [8]. Prace te są aktualnie kontynuowane w ośrodku poznańskim, także dla innych typów sekwenatorów. Stosunkowo niewiele mówiliśmy tu o mapowaniu. Wydaje się, że problem ten, choć bardzo interesujący z teoretycznego punktu widzenia i wykorzystujący w swej fazie algorytmicznej pewne twierdzenia z teorii liczb [40], [9], nie jest ostatnio często wykorzystywany w praktyce laboratoryjnej. Wynika to z faktu, że mapy większości genomów już istnieją, a moc nowoczesnych sekwenatorów jest bardzo duża. Warto jednakże nadmienić, że część problemów teoretycznych związanych z problemem mapowania jest nadal otwarta [4]. Należy w tym momencie wspomnieć o kolejnej fazie czytania genomów DNA, jak byśmy mogli powiedzieć czytania ze zrozumieniem. Otóż, wiadomo już, że genomy różnych przedstawicieli danego gatunku (np. ludzi) różnią się między sobą. Te często nieznaczne różnice w sekwencji DNA (SNP single nucleotide polymorphism) mogą prowadzić do znaczących różnic w odporności na choroby, czy też wręcz do wystąpienia groźnych chorób genetycznych. Aby stwierdzić występowanie określonego polimorfizmu, genom danej osoby należy po zsekwencjonowaniu interesujących fragmentów porównać z genomem referencyjnym. Czyni się tak często, wykorzystując macierze DNA czipy, o których mówiliśmy w kontekście SBH. Omówione w tym rozdziale podstawowe problemy bioinformatyczne dotyczyły łańcuchów DNA i ich analizy, czyli można by powiedzieć bioinformatyki dotyczącej struktur pierwszorzędowych, linearnych. W funkcjonowaniu organizmów żywych dużą rolę odgrywają też struktury przestrzenne biomolekuł zwłaszcza białek i RNA; zależą od tego wykonywane przez nie funkcje. Omówimy bardzo krótko to zagadnienie w następnym rozdziale. 4. Struktury przestrzenne białek i kwasów nukleinowych analiza, predykcja Jak wspomniano, struktury przestrzenne biomolekuł odgrywają decydującą rolę w sprawowanych przez nie funkcjach. Zatem analiza i określenie (znajdowanie) struktur drugo- i trzeciorzędowych odgrywa ogromną rolę w biologii. Można ująć to zagadnienie tak jak na Rys. 12 zrobiono to w odniesieniu do białek.
15 WYKŁAD INAUGURACYJNY BIOINFORMATYKA I JEJ PERSPEKTYWY 71 Rys. 12. Struktura trzeciorzędowa białka. A zatem droga do poznania funkcji białka (jak wspomnieliśmy pełni ono rolę procesora w organizmie) wiedzie przez odkrycie jego struktury. (Ponieważ roli RNA wcześniej nie doceniono, więc nie badano zbyt intensywnie jego struktury przestrzennej.) W biologii strukturę przestrzenną białek najczęściej ustala się, wykorzystując jedną z dwóch technik doświadczalnych albo krystalografię rentgenowską albo spektroskopię magnetycznego rezonansu jądrowego (NMR). Techniki te są jednak bardzo kosztowne i wymagają długiego czasu, nic zatem dziwnego, że po parudziesięciu latach ich stosowania, mimo zaangażowania wielu zespołów badawczych z całego świata, udało się odnaleźć zaledwie struktur (zdeponowane w Protein Data Bank PDB [28]; stan w dniu r.). Biorąc pod uwagę, że łańcuchów białkowych (struktura pierwszorzędowa) rozpoznano już kilkaset tysięcy, widać wyraźnie, że samo podejście eksperymentalne tu nie wystarczy. Z pomocą przychodzi bioinformatyka strukturalna (por. Rys. 2), która oferuje alternatywne sposoby określenia struktur białek. Powyższe sposoby można przedstawić schematycznie tak jak to uczyniono na Rys. 13 (por. także [15] i [39]), prawdziwym także w przypadku struktur RNA. Otóż, podejścia te można sklasyfikować jako metody ab initio i metody modelowania homologicznego (porównawczego). Te pierwsze (wywodzące się w jakiejś mierze od prac Boltzmanna) polegają na stworzeniu pełnoatomowego modelu białka na podstawie sekwencji, bez korzystania z wiedzy o innych strukturach białkowych. W tym celu wykorzystuje się tutaj prawa fizykochemiczne określające zwijanie się łańcuchów białek. Nie są one jednak w wystarczającym stopniu zbadane, stąd też uzyskiwane rezultaty nie są najwyższej jakości. Stosunkowo najlepsze wyniki uzyskuje tutaj grupa D. Bakera [2],
16 72 Biuletyn inauguracyjny PP PAŹDZIERNIK 2011 Rys. 13. Predykcja przestrzennych struktur białkowych. a program Robetta bazujący na tych pracach jest dostępny w sieci [35]. Druga grupa metod przewiduje struktury analizowanych, nowych łańcuchów białek na podstawie podobieństwa do białek, których struktury są znane (a więc niejako wykorzystuje prawa ewolucji Darwina). Wychodzi się tu z założenia, że jeżeli dwa białka wykazują duże podobieństwo w zakresie swoich sekwencji, to podobne winny być również ich struktury trzeciorzędowe. Budowa modelu przebiega w 5 zasadniczych etapach: znajdowanie szablonu w bazie danych, przyrównanie sekwencji białka analizowanego i szablonu, budowa kręgosłupa modelu białka, dodawanie pętli i łańcuchów bocznych, optymalizacja modelu. To podejście wykorzystuje w bardzo dużym stopniu metody badań operacyjnych, w tym w szczególności: sieci neuronowe, programowanie dynamiczne i różne metody klastryzacji. Warto podkreślić, że duże sukcesy odnieśli tutaj naukowcy z Polski, w szczególności: A. Koliński, K. Ginalski, J. Bujnicki i J. Rychlewski [23], [22], [21] (por. praca przeglądowa [15]). Sytuacja w dziedzinie analizy struktur RNA wygląda dużo gorzej niż w przypadku białek: jak dotychczas określono i zdeponowano w PDB tylko 887 struktur trzeciorzędowych. Wynika to ze stosunkowo krótkiego okresu,
17 WYKŁAD INAUGURACYJNY BIOINFORMATYKA I JEJ PERSPEKTYWY 73 w którym je analizowano jak i dużo bardziej nietrwałej struktury trzeciorzędowej RNA, którą trudno zbadać eksperymentalnie. W zasadzie wszystkie podejścia są tu bardzo podobne do omówionych w przypadku białek, lecz ze względu na większy stopień złożoności samego problemu nie ma zbyt wielu metod. Jednak i tutaj prace autorów polskich należą do wyróżniających się w dziedzinie modelowania homologicznego, a w szczególności warte podkreślenia są prace zespołów J. Bujnickiego i R. Adamiaka [36], [33], [34]. Przykładowo na Rys. 14 przedstawiono stronę tytułową serwisu WWW, w którym możliwe jest odszukanie fragmentów trzeciorzędowej struktury analizowanego łańcucha RNA, co jak wspomniano powyżej jest jednym z etapów modelowania homologicznego trzeciorzędowej struktury całego łańcucha RNA. Rys. 14. RNAFrabase serwis WWW. Omówione pokrótce w tym rozdziale problemy to jedne z najważniejszych zagadnień, którymi aktualnie zajmuje się bioinformatyka i biologia obliczeniowa. Od ich poprawnego rozwiązania zależy w dużej mierze zrozumienie funkcji spełnianych przez określone białka i łańcuchy RNA. W efekcie proces ten przyczyni się do postępu w medycynie, a w szczególności do przyśpieszenia zagadnień projektowania leków i diagnostyki medycznej prowadzącej do medycyny spersonalizowanej. 5. Wpływ bioinformatyki na medycynę W rozdziale tym omówimy wpływ bioinformatyki na rozwój medycyny, a w szczególności na proces projektowania nowych leków i na diagnostykę medyczną. Rozpatrzmy w tym celu oficjalne dane dotyczące procesu projektowania nowych leków, opublikowane przez Stowarzyszenie PhRMA The
18 74 Biuletyn inauguracyjny PP PAŹDZIERNIK 2011 Pharmaceutical Research and Manufacturers of America, skupiające najważniejsze firmy farmaceutyczne w Stanach Zjednoczonych (por. Rys. 15 i 16). Rys. 15. Proces projektowania nowego leku. Rys. 16. Fazy odkrycia i testowania leków w firmach zrzeszonych w PhRMA. Jak wynika z przedstawionych rysunków projektowanie i zatwierdzanie jednego leku przy jasno określonym celu badawczym zajmowało średnio ok. 16,5 roku i kosztowało ok. 1,5 mld $. Nakłady na rozwój i badania (R&D) wszystkich firm skupionych w PhRMA wynosiły w 2003 r. ok. 33 mld $, natomiast w roku 2010 wyniosły ok. 49 mld $. Są to zatem kwoty bardzo
19 WYKŁAD INAUGURACYJNY BIOINFORMATYKA I JEJ PERSPEKTYWY 75 znaczące. Analizując przebieg procesu projektowania leków (Rys. 15) widzimy, że bardzo dużą część czasu (i finansów) pochłaniają analizy związane z genomiką i bioinformatyką strukturalną. W szczególności kluczowe znaczenie ma tu rozpoznanie trzeciorzędowej struktury i funkcji określonych białek. Każde przyśpieszenie tego procesu jest bezcenne, gdyż może owocować opracowaniem leku na choroby trapiące ludzkość od zarania dziejów. Stąd wynika wielka waga, jaką przykładają firmy farmaceutyczne do rozwoju badań i dydaktyki w wybranych uczelniach w dziedzinie bioinformatyki i genomiki. Rozwój tych badań ma oczywiście znaczenie dużo większe niż tylko przyśpieszenie procesu opracowywania nowych leków. Badania te przyczyniają się bowiem również do lepszego zrozumienia istoty funkcjonowania organizmu człowieka, sprawiając, iż możliwa staje się prewencja medyczna prowadząca w kolejnym etapie do tzw. medycyny spersonalizowanej [16]. Jak już wspomnieliśmy, genetycznie wszyscy ludzie się różnią. Dzięki poznaniu naszego genomu, a w zasadzie wspomnianych punktowych różnic (SNP) w DNA, będzie można lepiej sterować przebiegiem procesu leczenia, a nawet efektywniej zapobiegać chorobom. W swojej znakomitej książce Francis Collins (były szef Projektu Genomu Człowieka; aktualnie dyrektor NIH National Institute of Health) daje szereg przykładów skuteczności terapii uwzględniającej znajomość genomu człowieka [16]. Powstaje nowy paradygmat w medycynie, który ujmują poniższe punkty: Każdy człowiek jest genetycznie inny i ma inne predyspozycje do zapadania na różne choroby. Należy zatem dostosować leczenie do konkretnego pacjenta (jego genomu). Stosunkowo niegroźne pojedyncze wady genetyczne mogą zostać wzmocnione i prowadzić do ciężkich chorób, gdy nałożą się na nie inne genetyczne mutacje i/lub zagrożenia środowiskowe. Możliwa będzie wspólna terapia dla wielu chorób naraz; np. niektóre leki na raka mogą leczyć także artretyzm lub chorobę Alzheimera. W ogólności dobrze znana jest zasada, że lepiej zapobiegać chorobom, niż je później leczyć. Niestety, nawet w Stanach Zjednoczonych tylko niewielka część z 2 bilionów $ przeznaczonych rocznie na lecznictwo, trafia na prewencje medyczną, a leczenie rozpoczyna się dopiero po wystąpieniu symptomów (często zaawansowanych) choroby. Aby przeciwdziałać tej tendencji, uruchomiono w USA specjalny program prewencji medycznej Family Health History Initiative [18], który wraz z możliwościami poznania własnego genomu DNA (usługa oferowana także przez firmy prywatne) daje pacjentom i lekarzom znaczące korzyści i możliwość wyboru najlepszej strategii leczenia choroby, a często także unikania samego zachorowania. Powyższe tendencje znajdują także wyraz w badaniach i dydaktyce prowadzonych na Politechnice Poznańskiej.
20 76 Biuletyn inauguracyjny PP PAŹDZIERNIK Europejskie Centrum Bioinformatyki i Genomiki Europejskie Centrum Bioinformatyki i Genomiki (ECBiG) to unikalna na terenie Wielkopolski jednostka badawczo-rozwojowa, powstała na bazie konsorcjum zawiązanego pomiędzy Politechniką Poznańską a Instytutem Chemii Bioorganicznej PAN w Poznaniu, jako następstwo współpracy pomiędzy tymi jednostkami podjętej w 2004 roku w ramach Centrum Doskonałości CENAT ICHB (ang. Center of Excellence for Nucleic Acid-based Technologies). Wówczas to stworzone zostało pierwsze w Polsce centrum dysponujące odpowiednim przygotowaniem umożliwiającym wprowadzenie na terenie naszego kraju nowatorskich technik genomicznych (np. projektowanie, wykonywanie i analiza mikromacierzy DNA). Idea stworzenia centrum łączącego badania genomiczne i bioinformatyczne, jest konsekwentnie realizowana już od kilku lat. Dzięki grantom wspólnie zdobytym przez IChB PAN (zespoły prof. prof. W. Markiewicza, M. Figlerowicza, R. Adamiaka) oraz Politechnikę Poznańską została zakupiona część sprzętu niezbędnego dla zainicjowania działalności Europejskiego Centrum Bioinformatyki i Genomiki. Szczególnie cennym osiągnięciem organizacyjnym było skompletowanie prawie pełnego zestawu urządzeń i programów komputerowych potrzebnych do samodzielnego projektowania, wytwarzania i analizy mikromacierzy DNA, systemu do rozdziału i analizy białek metodą elektroforezy dwukierunkowej oraz zestawu aparatów umożliwiających analizę wpływu ekspresji wybranych genów lub trans genów na metabolizm komórkowy (chromatograf cieczowy, chromatograf gazowy, spektrometr mas typu MALDI TOF wraz z reflektronem, zwiększającym rozdzielczość pomiaru). Coraz szerszy zakres badań centrum oraz olbrzymie zainteresowanie współpracą ze strony licznych ośrodków badawczych w Polsce i za granicą wiążą się jednak z koniecznością jeszcze większego zacieśnienia współpracy biologów z bioinformatykami, jak również dokonania dalszych istotnych inwestycji aparaturowych (w ramach grantu aparaturowego POIG 2.2.) Głównym zadaniem ECBiG jest prowadzenie badań podstawowych w zakresie bioinformatyki, genomiki strukturalnej, genomiki funkcjonalnej i proteomiki, rozwój i wdrażanie nowych oraz już istniejących metod badawczych, jak i praktyczne wykorzystanie uzyskanych wyników w medycynie, biotechnologii oraz rolnictwie. Obecnie w ramach ECBiG prowadzone są prace z następujących dziedzin: projektowanie, produkcja i praktyczne wykorzystanie mikromacierzy DNA i RNA; zastosowanie mikromacierzy DNA oraz technologii RNAi w badaniach genomu ludzkiego oraz wybranych genomów roślinnych; zastosowanie metod bioinformatycznych w analizie genomów, opracowanie i implementacja algorytmów umożliwiających projektowanie i analizę mikromacierzy DNA i RNA;
21 WYKŁAD INAUGURACYJNY BIOINFORMATYKA I JEJ PERSPEKTYWY 77 obliczeniowa analiza strukturalna i sekwencyjna białek i RNA; algorytmiczna analiza sekwencjonowania i asemblacji DNA; identyfikacja nowych regulatorowych RNA, a szczególnie mikrorna; masowa identyfikacja i analiza białek; terapeutyczne wykorzystanie technologii RNAi (sirna, mikrorna) [27]. Dzięki pozytywnej decyzji Rektora Politechniki Poznańskiej cała dotychczasowa infrastruktura ECBiG, jak i ta zakupiona w ramach projektu, została przeniesiona do nowo wybudowanego Centrum Wykładowego Politechniki Poznańskiej. Do końca tego roku zostaną uruchomione laboratoria sekwencjonowania i genomiki strukturalnej, proteomiki, genomiki funkcjonalnej oraz bioinformatyki. Będą one tworzyły efektywną strukturę badawczą, skupiając całą ścieżkę badań genomicznych i bioinformatycznych w jednym miejscu oraz umożliwiając powiązanie wszystkich poziomów analiz strukturalnych, funkcjonalnych i proteomicznych. Strukturę tę w poglądowym skrócie prezentuje Rys. 17. Rys. 17. Schemat badawczo-sprzętowy Europejskiego Centrum Bioinformatyki i Genomiki. W perspektywie długookresowej rezultaty prowadzonych badań w ECBiG mogą pozwolić na stosowanie medycyny spersonalizowanej w leczeniu chorób nowotworowych i wirusowych. Rozbudowana baza genomiczna pozwoli w przyszłości na skuteczne dopasowanie leku do profilu genetycznego danej osoby: technologie rozwijane w ECBiG pozwolą stwierdzić, w jakim zakresie u danego człowieka genom jest uszkodzony bądź dysfunkcyjny. Pozwolą określić także, jaka konfiguracja białek odpowiada za rozwój danej jednostki chorobowej [27].
22 78 Biuletyn inauguracyjny PP PAŹDZIERNIK 2011 Oprócz współpracy badawczej z Instytutem Chemii Bioorganicznej w ramach ECBiG, Politechnika Poznańska rozwija także bioinformatykę na polu dydaktycznym. Rezultatem tego jest uruchomienie w październiku 2010 roku makrokierunku bioinformatyka, wspólnie z Uniwersytetem im. Adama Mickiewicza w Poznaniu. Podziękowania Autor pragnie bardzo podziękować pp. Agnieszce Rybarczyk, Marcie Szachniuk, Aleksandrze Świercz oraz Barbarze Błażewicz za pomoc w przygotowaniu wykładu i weryfikację treści. Literatura [1] W. Bains, G.C. Smith, A novel method for nucleic acid sequence determination, Journal of Theoretical Biology, 135, 1988, pp [2] D. Baker, A. Sali, Protein structure prediction and structural genomics, Science 294, 2001, pp [3] J. Błażewicz, Złożoność obliczeniowa problemów kombinatorycznych, WNT, Warszawa, [4] J. Błażewicz, E.K. Burke, M. Kasprzak, A. Kovalev, M. Kovalyov, The Simplified Partial Digest Problem: approximation and a graph-theoretic model, European Journal of Operational Research 208, 2011, pp [5] J. Błażewicz, C. Oğuz, A. Świercz, J. Węglarz, DNA sequencing by hybridization via genetic search, Operations Research 54, 2006, pp [6] J. Błażewicz, P. Formanowicz, F. Guinand, M. Kasprzak, A heuristic managing errors for DNA sequencing, Bioinformatics 18, 2002, pp [7] J. Błażewicz, M. Kasprzak, Graph reduction and its application to DNA sequence assembly, Bulletin of the Polish Academy of Sciences, Tech. Sci.56, 2008, pp [8] J. Błażewicz, M. Bryja, M. Figlerowicz, P. Gawron, M. Kasprzak, E. Kirton, D. Platt, J. Przybytek, A. Świercz, L. Szajkowski, Whole genome assembly from 454 sequencing output via modified DNA graph concept, Computational Biology and Chemistry 33, 2009, pp [9] J. Błażewicz, P. Formanowicz, M. Kasprzak, Selected combinatorial problems of computational biology, European Journal of Operational Research 161, 2005, pp [10] J. Błażewicz, P. Formanowicz, M. Kasprzak, W.T. Markiewicz, Method of sequencing of nucleic acids, The Patent Office of the Republic of Poland, Patent No. P335786, 1999.
23 WYKŁAD INAUGURACYJNY BIOINFORMATYKA I JEJ PERSPEKTYWY 79 [11] J. Błażewicz, P. Formanowicz, M. Kasprzak, W.T. Markiewicz, J. Węglarz, DNA sequencing with positive and negative errors, Journal of Computational Biology 6, 1999, pp [12] J. Błażewicz, F. Glover, M. Kasprzak, DNA sequencing tabu search and scatter search combined, INFORMS Journal on Computing 16, 2004, pp [13] J. Błażewicz, A. Hertz, D. Kobler, D.de Werra, On some properties of DNA graphs, Discrete Applied Mathematics 98, 1999, pp [14] J. Błażewicz, M. Kasprzak, W. Kuroczycki, Hybrid genetic algorithm for DNA sequencing with errors, Journal of Heuristcs 8, 2002, pp [15] M. Bujnicki, Protein structure prediction: Boltzman and Darwin, Kosmos 54, 2005, pp [16] F.S. Collins, The Language of Life, Harper Perennial, New York, [17] R. Drmanac, I. Labat, R. Crkvenjakov, An algorithm for DNA sequence generation from k-tuple word contents of the minimal number of random fragments, Journal of Biomolecular Structure and Dynamics 8, 1991, pp [18] Family Health History. familyhistory.hhs.gov/ [19] R.E. Franklin, R.G. Gosling, Molecular configuration in sodium thymonucleate, Nature 171, 1953, pp [20] M.R. Garey, D.S. Johnson, Computers and Intractability: A Guide to the Theory of NP-completeness,W.H. Freeman, San Francisco, [21] K. Ginalski, N.V. Grishin, A. Godzik, L. Rychlewski, Practical lessons from protein structure prediction, Nucleic Acids Res. 33, 2005, pp [22] A. Koliński, J.M. Bujnicki, Combination of fold-recognition with de novo folding and evaluation of models. 2004, upload/2165.pdf [23] A. Koliński, J. Skolnick, Reduced models of proteins and their applications, Polymer 45, 2004, pp [24] M. Laporte, S. Martello, The selective travelling salesman problem, Discrete Applied Mathematics 26, 1990, pp [25] A.M. Lesk, Introduction to Bioinformatics, Oxford University Press, Oxford, [26] P.Y. Lysov, V.L. Florentiev, A.A. Khorlin, K.R. Khrapko, V.V. Shik, A.D. Mirzabekov, Determination of the nucleotide sequence of DNA using hybridization with oligonucleotides. A new method, Doklady Akademii Nauk SSSR 303, 1988, pp [27] A. Majewski, Sojusz na rzecz bioinformatyki i genomiki, Dziennik Gazeta Prawna,
24 80 Biuletyn inauguracyjny PP PAŹDZIERNIK 2011 [28] Protein Data Bank. [29] L. Pacholski, Czynnik ludzki w inżynierii produkcji, Wykład Inauguracyjny, Wyd. Politechniki Poznańskiej, Poznań, 2006, pp [30] R. Pendavingh, P. Schuurman, G.J. Woeginger, Recognizing DNA graphs is difficult, Discrete Applied Mathemtics 127, 2003, pp [31] P.A. Pevzner, l-tuple DNA sequencing: Computer analysis, Journal of Biomolecular Structure and Dynamics 7, 1989, pp [32] P.A. Pevzner, Computational Molecular Biology. An Algorithmic Approach, The MIT Press, Cambridge, MA, [33] M. Popenda, M. Błażewicz, M. Szachniuk, R.W. Adamiak, RNA FRABASE version 1.0: an engine with a database to search for the three-dimensional fragments within RNA structures, Nucleic Acids Res. 36, 2008, pp. D386 D391. [34] M. Popenda, M. Szachniuk, M. Błażewicz, S. Wasik, E.K. Burke, J. Błażewicz, R.W. Adamiak, RNA FRABASE 2.0: an advanced webaccessible database with the capacity to search the three-dimensional fragments within RNA structures, BMC Bioinformatics 11, 2010, p.231. [35] Robetta. [36] M. Rother, K. Rother, T. Puton, J.M. Bujnicki, ModeRNA: a tool for comparative modeling of RAIH 3D structure, Nucleic Acids Res. 39, 2011, pp [37] J. Setubal, J. Meidanis, Introduction to Computational Molecular Biology, PWS Publishing Company, Boston, [38] E.M. Southern, United Kingdom Patent Application GB , [39] M. Szachniuk, RNA tertiary structures, Proc. ICOLE 2010, Lessach, [40] M.S. Waterman, Introduction to Computational Biology. Maps, Sequences and Genomes, Chapman & Hall, London, [41] J.D. Watson, F.H.C. Crick, Genetic implications of the structure of deoxyribonucleic acid, Nature 171, 1953, pp [42] M.H. Wilkins, A.R. Stokes, H.R. Wilson, Molecular structure of deoxypentose nucleic acids, Nature 171, 1953, pp [43] J. Xiong, Podstawy bioinformatyki, Wydawnictwo Uniwersytetu Warszawskiego, Warszawa, 2011.
Algorytmy kombinatoryczne w bioinformatyce
 Algorytmy kombinatoryczne w bioinformatyce wykład 2: sekwencjonowanie cz. 1 prof. dr hab. inż. Marta Kasprzak Instytut Informatyki, Politechnika Poznańska Poznawanie sekwencji genomowej Poznawanie sekwencji
Algorytmy kombinatoryczne w bioinformatyce wykład 2: sekwencjonowanie cz. 1 prof. dr hab. inż. Marta Kasprzak Instytut Informatyki, Politechnika Poznańska Poznawanie sekwencji genomowej Poznawanie sekwencji
prof. dr hab. inż. Marta Kasprzak Instytut Informatyki, Politechnika Poznańska Poznawanie sekwencji genomowej
 Bioinformatyka wykład 2: sekwencjonowanie cz. 1 prof. dr hab. inż. Marta Kasprzak Instytut Informatyki, Politechnika Poznańska Poznawanie sekwencji genomowej Poznawanie sekwencji genomów na trzech poziomach
Bioinformatyka wykład 2: sekwencjonowanie cz. 1 prof. dr hab. inż. Marta Kasprzak Instytut Informatyki, Politechnika Poznańska Poznawanie sekwencji genomowej Poznawanie sekwencji genomów na trzech poziomach
października 2013: Elementarz biologii molekularnej. Wykład nr 2 BIOINFORMATYKA rok II
 10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
Spis treści. Przedmowa... XI. Wprowadzenie i biologiczne bazy danych. 1 Wprowadzenie... 3. 2 Wprowadzenie do biologicznych baz danych...
 Przedmowa... XI Część pierwsza Wprowadzenie i biologiczne bazy danych 1 Wprowadzenie... 3 Czym jest bioinformatyka?... 5 Cele... 5 Zakres zainteresowań... 6 Zastosowania... 7 Ograniczenia... 8 Przyszłe
Przedmowa... XI Część pierwsza Wprowadzenie i biologiczne bazy danych 1 Wprowadzenie... 3 Czym jest bioinformatyka?... 5 Cele... 5 Zakres zainteresowań... 6 Zastosowania... 7 Ograniczenia... 8 Przyszłe
BIOINFORMATYKA. edycja 2016 / wykład 11 RNA. dr Jacek Śmietański
 BIOINFORMATYKA edycja 2016 / 2017 wykład 11 RNA dr Jacek Śmietański jacek.smietanski@ii.uj.edu.pl http://jaceksmietanski.net Plan wykładu 1. Rola i rodzaje RNA 2. Oddziaływania wewnątrzcząsteczkowe i struktury
BIOINFORMATYKA edycja 2016 / 2017 wykład 11 RNA dr Jacek Śmietański jacek.smietanski@ii.uj.edu.pl http://jaceksmietanski.net Plan wykładu 1. Rola i rodzaje RNA 2. Oddziaływania wewnątrzcząsteczkowe i struktury
Kombinatoryczna analiza widm 2D-NOESY w spektroskopii Magnetycznego Rezonansu Jądrowego cząsteczek RNA. Marta Szachniuk
 Kombinatoryczna analiza widm 2D-NOESY w spektroskopii Magnetycznego Rezonansu Jądrowego cząsteczek RNA Marta Szachniuk Plan prezentacji Wprowadzenie do tematyki badań Teoretyczny model problemu Złożoność
Kombinatoryczna analiza widm 2D-NOESY w spektroskopii Magnetycznego Rezonansu Jądrowego cząsteczek RNA Marta Szachniuk Plan prezentacji Wprowadzenie do tematyki badań Teoretyczny model problemu Złożoność
Możliwości współczesnej inżynierii genetycznej w obszarze biotechnologii
 Możliwości współczesnej inżynierii genetycznej w obszarze biotechnologii 1. Technologia rekombinowanego DNA jest podstawą uzyskiwania genetycznie zmodyfikowanych organizmów 2. Medycyna i ochrona zdrowia
Możliwości współczesnej inżynierii genetycznej w obszarze biotechnologii 1. Technologia rekombinowanego DNA jest podstawą uzyskiwania genetycznie zmodyfikowanych organizmów 2. Medycyna i ochrona zdrowia
Plan wykładów. A. Świercz ANALIZA DANYCH WYSOKOPRZEPUSTOWYCH 2
 ALEKSANDRA ŚWIERCZ Plan wykładów Wprowadzenie do różnych metod sekwencjonowania Resekwencjonowanie mapowanie do genomu referencyjnego Sekwencjonowanie de novo asemblacja Różnica w ekspresji genów, alternatywny
ALEKSANDRA ŚWIERCZ Plan wykładów Wprowadzenie do różnych metod sekwencjonowania Resekwencjonowanie mapowanie do genomu referencyjnego Sekwencjonowanie de novo asemblacja Różnica w ekspresji genów, alternatywny
Analizy wielkoskalowe w badaniach chromatyny
 Analizy wielkoskalowe w badaniach chromatyny Analizy wielkoskalowe wykorzystujące mikromacierze DNA Genotypowanie: zróżnicowane wewnątrz genów RNA Komórka eukariotyczna Ekspresja genów: Które geny? Poziom
Analizy wielkoskalowe w badaniach chromatyny Analizy wielkoskalowe wykorzystujące mikromacierze DNA Genotypowanie: zróżnicowane wewnątrz genów RNA Komórka eukariotyczna Ekspresja genów: Które geny? Poziom
Dane mikromacierzowe. Mateusz Markowicz Marta Stańska
 Dane mikromacierzowe Mateusz Markowicz Marta Stańska Mikromacierz Mikromacierz DNA (ang. DNA microarray) to szklana lub plastikowa płytka (o maksymalnych wymiarach 2,5 cm x 7,5 cm) z naniesionymi w regularnych
Dane mikromacierzowe Mateusz Markowicz Marta Stańska Mikromacierz Mikromacierz DNA (ang. DNA microarray) to szklana lub plastikowa płytka (o maksymalnych wymiarach 2,5 cm x 7,5 cm) z naniesionymi w regularnych
Wzorcowe efekty kształcenia dla kierunku studiów biotechnologia studia pierwszego stopnia profil ogólnoakademicki
 Załącznik nr 2 do Uchwały Rady Wydziału Biochemii, Biofizyki i Biotechnologii UJ z dnia 19 czerwca 2018 r. w sprawie programu i planu studiów na kierunku BIOTECHNOLOGIA na poziomie studiów pierwszego stopnia
Załącznik nr 2 do Uchwały Rady Wydziału Biochemii, Biofizyki i Biotechnologii UJ z dnia 19 czerwca 2018 r. w sprawie programu i planu studiów na kierunku BIOTECHNOLOGIA na poziomie studiów pierwszego stopnia
Rok akademicki: 2014/2015 Kod: EIB-2-206-BN-s Punkty ECTS: 3. Kierunek: Inżynieria Biomedyczna Specjalność: Bionanotechnologie
 Nazwa modułu: Genetyka molekularna Rok akademicki: 2014/2015 Kod: EIB-2-206-BN-s Punkty ECTS: 3 Wydział: Elektrotechniki, Automatyki, Informatyki i Inżynierii Biomedycznej Kierunek: Inżynieria Biomedyczna
Nazwa modułu: Genetyka molekularna Rok akademicki: 2014/2015 Kod: EIB-2-206-BN-s Punkty ECTS: 3 Wydział: Elektrotechniki, Automatyki, Informatyki i Inżynierii Biomedycznej Kierunek: Inżynieria Biomedyczna
KARTA PRZEDMIOTU. (pieczęć wydziału)
 (pieczęć wydziału) KARTA PRZEDMIOTU 1. Nazwa przedmiotu: Eksploracja danych w bioinformatyce 2. Kod przedmiotu: EksDaBio 3. Karta przedmiotu ważna od roku akademickiego: 2017/2018 4. Forma kształcenia:
(pieczęć wydziału) KARTA PRZEDMIOTU 1. Nazwa przedmiotu: Eksploracja danych w bioinformatyce 2. Kod przedmiotu: EksDaBio 3. Karta przedmiotu ważna od roku akademickiego: 2017/2018 4. Forma kształcenia:
Jest to dziedzina biologiczna wywodząca się z biotechnologii. Bioinformatyka
 Wstęp do obsługi biologicznych baz danych i analizy porównawczej białek i genów Katedra Fizjologii i Biotechnologii Roślin Pok. 113 CB jan.jastrzebski@uwm.edu.pl bioinformatyka@gmail.com www.ebiology.net
Wstęp do obsługi biologicznych baz danych i analizy porównawczej białek i genów Katedra Fizjologii i Biotechnologii Roślin Pok. 113 CB jan.jastrzebski@uwm.edu.pl bioinformatyka@gmail.com www.ebiology.net
Nowoczesne systemy ekspresji genów
 Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
ZASTOSOWANIA FIZYKI W BIOLOGII I MEDYCYNIE Specjalność: Biofizyka molekularna. 3-letnie studia I stopnia (licencjackie)
 ZASTOSOWANIA FIZYKI W BIOLOGII I MEDYCYNIE Specjalność: Biofizyka molekularna 3-letnie studia I stopnia (licencjackie) 1. OGÓLNA CHARAKTERYSTYKA STUDIÓW Biofizyka to uznana dziedzina nauk przyrodniczych
ZASTOSOWANIA FIZYKI W BIOLOGII I MEDYCYNIE Specjalność: Biofizyka molekularna 3-letnie studia I stopnia (licencjackie) 1. OGÓLNA CHARAKTERYSTYKA STUDIÓW Biofizyka to uznana dziedzina nauk przyrodniczych
Wybrane techniki badania białek -proteomika funkcjonalna
 Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu w porównaniu z analizą trankryptomu:
Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu w porównaniu z analizą trankryptomu:
SYLABUS DOTYCZY CYKLU KSZTAŁCENIA
 SYLABUS DOTYCZY CYKLU KSZTAŁCENIA 2015-2021 1.1. PODSTAWOWE INFORMACJE O PRZEDMIOCIE/MODULE Nazwa przedmiotu/ modułu Techniki biologii molekularnej Kod przedmiotu/ modułu* Wydział (nazwa jednostki prowadzącej
SYLABUS DOTYCZY CYKLU KSZTAŁCENIA 2015-2021 1.1. PODSTAWOWE INFORMACJE O PRZEDMIOCIE/MODULE Nazwa przedmiotu/ modułu Techniki biologii molekularnej Kod przedmiotu/ modułu* Wydział (nazwa jednostki prowadzącej
PODSTAWY BIOINFORMATYKI
 PODSTAWY BIOINFORMATYKI Prowadzący: JOANNA SZYDA ADRIAN DROśDś WSTĘP 1. Katedra Genetyki badania bioinformatyczne 2. Tematyka przedmiotu 3. Charakterystyka wykładów 4. Charakterystyka ćwiczeń 5. Informacje
PODSTAWY BIOINFORMATYKI Prowadzący: JOANNA SZYDA ADRIAN DROśDś WSTĘP 1. Katedra Genetyki badania bioinformatyczne 2. Tematyka przedmiotu 3. Charakterystyka wykładów 4. Charakterystyka ćwiczeń 5. Informacje
STUDIA I STOPNIA NA KIERUNKU ZASTOSOWANIA FIZYKI W BIOLOGII I MEDYCYNIE. specjalność Biofizyka molekularna
 STUDIA I STOPNIA NA KIERUNKU ZASTOSOWANIA FIZYKI W BIOLOGII I MEDYCYNIE 1. CELE KSZTAŁCENIA specjalność Biofizyka molekularna Biofizyka to uznana dziedzina nauk przyrodniczych o wielkich tradycjach, która
STUDIA I STOPNIA NA KIERUNKU ZASTOSOWANIA FIZYKI W BIOLOGII I MEDYCYNIE 1. CELE KSZTAŁCENIA specjalność Biofizyka molekularna Biofizyka to uznana dziedzina nauk przyrodniczych o wielkich tradycjach, która
Wybrane techniki badania białek -proteomika funkcjonalna
 Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu np. w porównaniu z analizą trankryptomu:
Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu np. w porównaniu z analizą trankryptomu:
Bioinformatyka Laboratorium, 30h. Michał Bereta
 Laboratorium, 30h Michał Bereta mbereta@pk.edu.pl www.michalbereta.pl Zasady zaliczenia przedmiotu Kolokwia (3 4 ) Ocena aktywności i przygotowania Obecnośd Literatura, materiały i ewolucja molekularna
Laboratorium, 30h Michał Bereta mbereta@pk.edu.pl www.michalbereta.pl Zasady zaliczenia przedmiotu Kolokwia (3 4 ) Ocena aktywności i przygotowania Obecnośd Literatura, materiały i ewolucja molekularna
Objaśnienia oznaczeń w symbolach K przed podkreślnikiem kierunkowe efekty kształcenia W kategoria wiedzy
 Efekty kształcenia dla kierunku studiów FIZYKA - studia II stopnia, profil ogólnoakademicki - i ich odniesienia do efektów kształcenia w obszarze nauk ścisłych Kierunek studiów fizyka należy do obszaru
Efekty kształcenia dla kierunku studiów FIZYKA - studia II stopnia, profil ogólnoakademicki - i ich odniesienia do efektów kształcenia w obszarze nauk ścisłych Kierunek studiów fizyka należy do obszaru
Wstęp. Jak programować w DNA? Idea oraz przykład. Problem FSAT charakterystyka i rozwiązanie za pomocą DNA. Jak w ogólności rozwiązywać problemy
 Ariel Zakrzewski Wstęp. Jak programować w DNA? Idea oraz przykład. Problem FSAT charakterystyka i rozwiązanie za pomocą DNA. Jak w ogólności rozwiązywać problemy matematyczne z użyciem DNA? Gdzie są problemy?
Ariel Zakrzewski Wstęp. Jak programować w DNA? Idea oraz przykład. Problem FSAT charakterystyka i rozwiązanie za pomocą DNA. Jak w ogólności rozwiązywać problemy matematyczne z użyciem DNA? Gdzie są problemy?
Specjalność (studia II stopnia) Oczyszczanie i analiza produktów biotechnologicznych
 Specjalność (studia II stopnia) Oczyszczanie i analiza produktów biotechnologicznych Studia magisterskie przedmioty specjalizacyjne Bioinformatyka w analizie genomu Diagnostyka molekularna Elementy biosyntezy
Specjalność (studia II stopnia) Oczyszczanie i analiza produktów biotechnologicznych Studia magisterskie przedmioty specjalizacyjne Bioinformatyka w analizie genomu Diagnostyka molekularna Elementy biosyntezy
S YL AB US MODUŁ U ( PRZEDMIOTU) I nforma c j e ogólne
 Załącznik Nr 3 do Uchwały Senatu PUM 14/2012 S YL AB US MODUŁ U ( PRZEDMIOTU) I nforma c j e ogólne Kod modułu Rodzaj modułu Wydział PUM Kierunek studiów Specjalność Poziom studiów Nazwa modułu INŻYNIERIA
Załącznik Nr 3 do Uchwały Senatu PUM 14/2012 S YL AB US MODUŁ U ( PRZEDMIOTU) I nforma c j e ogólne Kod modułu Rodzaj modułu Wydział PUM Kierunek studiów Specjalność Poziom studiów Nazwa modułu INŻYNIERIA
ZASTOSOWANIA FIZYKI W BIOLOGII I MEDYCYNIE Specjalność: Projektowanie molekularne i bioinformatyka. 2-letnie studia II stopnia (magisterskie)
 ZASTOSOWANIA FIZYKI W BIOLOGII I MEDYCYNIE Specjalność: Projektowanie molekularne i bioinformatyka 2-letnie studia II stopnia (magisterskie) 1. OGÓLNA CHARAKTERYSTYKA STUDIÓW Wieloskalowe metody molekularnego
ZASTOSOWANIA FIZYKI W BIOLOGII I MEDYCYNIE Specjalność: Projektowanie molekularne i bioinformatyka 2-letnie studia II stopnia (magisterskie) 1. OGÓLNA CHARAKTERYSTYKA STUDIÓW Wieloskalowe metody molekularnego
Co to jest transkryptom? A. Świercz ANALIZA DANYCH WYSOKOPRZEPUSTOWYCH 2
 ALEKSANDRA ŚWIERCZ Co to jest transkryptom? A. Świercz ANALIZA DANYCH WYSOKOPRZEPUSTOWYCH 2 Ekspresja genów http://genome.wellcome.ac.uk/doc_wtd020757.html A. Świercz ANALIZA DANYCH WYSOKOPRZEPUSTOWYCH
ALEKSANDRA ŚWIERCZ Co to jest transkryptom? A. Świercz ANALIZA DANYCH WYSOKOPRZEPUSTOWYCH 2 Ekspresja genów http://genome.wellcome.ac.uk/doc_wtd020757.html A. Świercz ANALIZA DANYCH WYSOKOPRZEPUSTOWYCH
CHARAKTERYSTYKA PRZEDMIOTU Pracownia Informatyczna 1 PRACOWNIA INFORMATYCZNA 2018/2019 MAGDA MIELCZAREK 1
 CHARAKTERYSTYKA PRZEDMIOTU Pracownia Informatyczna 1 PRACOWNIA INFORMATYCZNA 2018/2019 MAGDA MIELCZAREK 1 PRACOWNIA INFORMATYCZNA PROWADZĄCY: Dr Magda Mielczarek (biolog) Katedra Genetyki, pokój nr 21
CHARAKTERYSTYKA PRZEDMIOTU Pracownia Informatyczna 1 PRACOWNIA INFORMATYCZNA 2018/2019 MAGDA MIELCZAREK 1 PRACOWNIA INFORMATYCZNA PROWADZĄCY: Dr Magda Mielczarek (biolog) Katedra Genetyki, pokój nr 21
Techniki biologii molekularnej Kod przedmiotu
 Techniki biologii molekularnej - opis przedmiotu Informacje ogólne Nazwa przedmiotu Techniki biologii molekularnej Kod przedmiotu 13.9-WB-BMD-TBM-W-S14_pNadGenI2Q8V Wydział Kierunek Wydział Nauk Biologicznych
Techniki biologii molekularnej - opis przedmiotu Informacje ogólne Nazwa przedmiotu Techniki biologii molekularnej Kod przedmiotu 13.9-WB-BMD-TBM-W-S14_pNadGenI2Q8V Wydział Kierunek Wydział Nauk Biologicznych
Grafy i sieci wybrane zagadnienia wykład 2: modele służące rekonstrukcji sekwencji
 Grafy i sieci wybrane zagadnienia wykład 2: modele służące rekonstrukcji sekwencji prof. dr hab. inż. Marta Kasprzak Instytut Informatyki, Politechnika Poznańska Plan wykładu. Modele grafowe problemu sekwencjonowania
Grafy i sieci wybrane zagadnienia wykład 2: modele służące rekonstrukcji sekwencji prof. dr hab. inż. Marta Kasprzak Instytut Informatyki, Politechnika Poznańska Plan wykładu. Modele grafowe problemu sekwencjonowania
Modele i narzędzia optymalizacji w systemach informatycznych zarządzania
 Politechnika Poznańska Modele i narzędzia optymalizacji w systemach informatycznych zarządzania Joanna Józefowska POZNAŃ 2010/11 Spis treści Rozdział 1. Metoda programowania dynamicznego........... 5
Politechnika Poznańska Modele i narzędzia optymalizacji w systemach informatycznych zarządzania Joanna Józefowska POZNAŃ 2010/11 Spis treści Rozdział 1. Metoda programowania dynamicznego........... 5
Bioinformatyka Laboratorium, 30h. Michał Bereta mbereta@pk.edu.pl www.michalbereta.pl
 Laboratorium, 30h Michał Bereta mbereta@pk.edu.pl www.michalbereta.pl Zasady zaliczenia przedmiotu Kolokwia (3 4 ) Ocena aktywności i przygotowania Obecnośd Literatura, materiały Bioinformatyka i ewolucja
Laboratorium, 30h Michał Bereta mbereta@pk.edu.pl www.michalbereta.pl Zasady zaliczenia przedmiotu Kolokwia (3 4 ) Ocena aktywności i przygotowania Obecnośd Literatura, materiały Bioinformatyka i ewolucja
Efekt kształcenia. Ma uporządkowaną, podbudowaną teoretycznie wiedzę ogólną w zakresie algorytmów i ich złożoności obliczeniowej.
 Efekty dla studiów pierwszego stopnia profil ogólnoakademicki na kierunku Informatyka w języku polskim i w języku angielskim (Computer Science) na Wydziale Matematyki i Nauk Informacyjnych, gdzie: * Odniesienie-
Efekty dla studiów pierwszego stopnia profil ogólnoakademicki na kierunku Informatyka w języku polskim i w języku angielskim (Computer Science) na Wydziale Matematyki i Nauk Informacyjnych, gdzie: * Odniesienie-
Efekty kształcenia. dla kierunku Biotechnologia medyczna. studia drugiego stopnia. Załącznik nr 3 do uchwały nr 265/2017. I.
 Efekty kształcenia Załącznik nr 3 do uchwały nr 265/2017 dla kierunku Biotechnologia medyczna studia drugiego stopnia I. Informacja ogólne 1. Jednostka prowadząca kierunek: Wydział Lekarski II, Uniwersytet
Efekty kształcenia Załącznik nr 3 do uchwały nr 265/2017 dla kierunku Biotechnologia medyczna studia drugiego stopnia I. Informacja ogólne 1. Jednostka prowadząca kierunek: Wydział Lekarski II, Uniwersytet
LABORATORIUM 7: Problem komiwojażera (TSP) cz. 2
 Instytut Mechaniki i Inżynierii Obliczeniowej Wydział Mechaniczny Technologiczny, Politechnika Śląska www.imio.polsl.pl OBLICZENIA EWOLUCYJNE LABORATORIUM 7: Problem komiwojażera (TSP) cz. 2 opracował:
Instytut Mechaniki i Inżynierii Obliczeniowej Wydział Mechaniczny Technologiczny, Politechnika Śląska www.imio.polsl.pl OBLICZENIA EWOLUCYJNE LABORATORIUM 7: Problem komiwojażera (TSP) cz. 2 opracował:
Zagadnienia (1/3) Data-flow diagramy przepływów danych ERD diagramy związków encji Diagramy obiektowe w UML (ang. Unified Modeling Language)
 Zagadnienia (1/3) Rola modelu systemu w procesie analizy wymagań (inżynierii wymagań) Prezentacja różnego rodzaju informacji o systemie w zależności od rodzaju modelu. Budowanie pełnego obrazu systemu
Zagadnienia (1/3) Rola modelu systemu w procesie analizy wymagań (inżynierii wymagań) Prezentacja różnego rodzaju informacji o systemie w zależności od rodzaju modelu. Budowanie pełnego obrazu systemu
Przybliżone algorytmy analizy ekspresji genów.
 Przybliżone algorytmy analizy ekspresji genów. Opracowanie i implementacja algorytmu analizy danych uzyskanych z eksperymentu biologicznego. 20.06.04 Seminarium - SKISR 1 Wstęp. Dane wejściowe dla programu
Przybliżone algorytmy analizy ekspresji genów. Opracowanie i implementacja algorytmu analizy danych uzyskanych z eksperymentu biologicznego. 20.06.04 Seminarium - SKISR 1 Wstęp. Dane wejściowe dla programu
Fizyka komputerowa(ii)
 Instytut Fizyki Fizyka komputerowa(ii) Studia magisterskie Prowadzący kurs: Dr hab. inż. Włodzimierz Salejda, prof. PWr Godziny konsultacji: Poniedziałki i wtorki w godzinach 13.00 15.00 pokój 223 lub
Instytut Fizyki Fizyka komputerowa(ii) Studia magisterskie Prowadzący kurs: Dr hab. inż. Włodzimierz Salejda, prof. PWr Godziny konsultacji: Poniedziałki i wtorki w godzinach 13.00 15.00 pokój 223 lub
BUDOWA I FUNKCJA GENOMU LUDZKIEGO
 BUDOWA I FUNKCJA GENOMU LUDZKIEGO Magdalena Mayer Katedra i Zakład Genetyki Medycznej UM w Poznaniu 1. Projekt poznania genomu człowieka: Cele programu: - skonstruowanie szczegółowych map fizycznych i
BUDOWA I FUNKCJA GENOMU LUDZKIEGO Magdalena Mayer Katedra i Zakład Genetyki Medycznej UM w Poznaniu 1. Projekt poznania genomu człowieka: Cele programu: - skonstruowanie szczegółowych map fizycznych i
ZASTOSOWANIA FIZYKI W BIOLOGII I MEDYCYNIE Specjalność: Projektowanie molekularne i bioinformatyka. 3-letnie studia I stopnia (licencjackie)
 ZASTOSOWANIA FIZYKI W BIOLOGII I MEDYCYNIE Specjalność: Projektowanie molekularne i bioinformatyka 3-letnie studia I stopnia (licencjackie) 1. OGÓLNA CHARAKTERYSTYKA STUDIÓW Projektowanie molekuł biologicznie
ZASTOSOWANIA FIZYKI W BIOLOGII I MEDYCYNIE Specjalność: Projektowanie molekularne i bioinformatyka 3-letnie studia I stopnia (licencjackie) 1. OGÓLNA CHARAKTERYSTYKA STUDIÓW Projektowanie molekuł biologicznie
zna metody matematyczne w zakresie niezbędnym do formalnego i ilościowego opisu, zrozumienia i modelowania problemów z różnych
 Grupa efektów kierunkowych: Matematyka stosowana I stopnia - profil praktyczny (od 17 października 2014) Matematyka Stosowana I stopień spec. Matematyka nowoczesnych technologii stacjonarne 2015/2016Z
Grupa efektów kierunkowych: Matematyka stosowana I stopnia - profil praktyczny (od 17 października 2014) Matematyka Stosowana I stopień spec. Matematyka nowoczesnych technologii stacjonarne 2015/2016Z
Informatyka w medycynie Punkt widzenia kardiologa
 Informatyka w medycynie Punkt widzenia kardiologa Lech Poloński Mariusz Gąsior Informatyka medyczna Dział informatyki zajmujący się jej zastosowaniem w ochronie zdrowia (medycynie) Stymulacja rozwoju informatyki
Informatyka w medycynie Punkt widzenia kardiologa Lech Poloński Mariusz Gąsior Informatyka medyczna Dział informatyki zajmujący się jej zastosowaniem w ochronie zdrowia (medycynie) Stymulacja rozwoju informatyki
Metody odczytu kolejności nukleotydów - sekwencjonowania DNA
 Metody odczytu kolejności nukleotydów - sekwencjonowania DNA 1. Metoda chemicznej degradacji DNA (metoda Maxama i Gilberta 1977) 2. Metoda terminacji syntezy łańcucha DNA - klasyczna metoda Sangera (Sanger
Metody odczytu kolejności nukleotydów - sekwencjonowania DNA 1. Metoda chemicznej degradacji DNA (metoda Maxama i Gilberta 1977) 2. Metoda terminacji syntezy łańcucha DNA - klasyczna metoda Sangera (Sanger
Sekwencjonowanie, przewidywanie genów
 Instytut Informatyki i Matematyki Komputerowej UJ, opracowanie: mgr Ewa Matczyńska, dr Jacek Śmietański Sekwencjonowanie, przewidywanie genów 1. Technologie sekwencjonowania Genomem nazywamy sekwencję
Instytut Informatyki i Matematyki Komputerowej UJ, opracowanie: mgr Ewa Matczyńska, dr Jacek Śmietański Sekwencjonowanie, przewidywanie genów 1. Technologie sekwencjonowania Genomem nazywamy sekwencję
OPTYMALIZACJA HARMONOGRAMOWANIA MONTAŻU SAMOCHODÓW Z ZASTOSOWANIEM PROGRAMOWANIA W LOGICE Z OGRANICZENIAMI
 Autoreferat do rozprawy doktorskiej OPTYMALIZACJA HARMONOGRAMOWANIA MONTAŻU SAMOCHODÓW Z ZASTOSOWANIEM PROGRAMOWANIA W LOGICE Z OGRANICZENIAMI Michał Mazur Gliwice 2016 1 2 Montaż samochodów na linii w
Autoreferat do rozprawy doktorskiej OPTYMALIZACJA HARMONOGRAMOWANIA MONTAŻU SAMOCHODÓW Z ZASTOSOWANIEM PROGRAMOWANIA W LOGICE Z OGRANICZENIAMI Michał Mazur Gliwice 2016 1 2 Montaż samochodów na linii w
Efekty kształcenia dla kierunku studiów CHEMIA studia pierwszego stopnia profil ogólnoakademicki
 Załącznik nr 1 Efekty kształcenia dla kierunku studiów CHEMIA studia pierwszego stopnia profil ogólnoakademicki Umiejscowienie kierunku w obszarze kształcenia Kierunek studiów chemia należy do obszaru
Załącznik nr 1 Efekty kształcenia dla kierunku studiów CHEMIA studia pierwszego stopnia profil ogólnoakademicki Umiejscowienie kierunku w obszarze kształcenia Kierunek studiów chemia należy do obszaru
Struktury danych i złożoność obliczeniowa Wykład 7. Prof. dr hab. inż. Jan Magott
 Struktury danych i złożoność obliczeniowa Wykład 7 Prof. dr hab. inż. Jan Magott Problemy NP-zupełne Transformacją wielomianową problemu π 2 do problemu π 1 (π 2 π 1 ) jest funkcja f: D π2 D π1 spełniająca
Struktury danych i złożoność obliczeniowa Wykład 7 Prof. dr hab. inż. Jan Magott Problemy NP-zupełne Transformacją wielomianową problemu π 2 do problemu π 1 (π 2 π 1 ) jest funkcja f: D π2 D π1 spełniająca
Programowanie celowe #1
 Programowanie celowe #1 Problem programowania celowego (PC) jest przykładem problemu programowania matematycznego nieliniowego, który można skutecznie zlinearyzować, tzn. zapisać (i rozwiązać) jako problem
Programowanie celowe #1 Problem programowania celowego (PC) jest przykładem problemu programowania matematycznego nieliniowego, który można skutecznie zlinearyzować, tzn. zapisać (i rozwiązać) jako problem
BIOLOGICZNE BAZY DANYCH SYLABUS
 BIOLOGICZNE BAZY DANYCH SYLABUS Elementy składowe sylabusu Nazwa jednostki prowadzącej kierunek Nazwa kierunku studiów Poziom kształcenia Profil studiów Forma studiów Kod Język Rodzaj Rok studiów /semestr
BIOLOGICZNE BAZY DANYCH SYLABUS Elementy składowe sylabusu Nazwa jednostki prowadzącej kierunek Nazwa kierunku studiów Poziom kształcenia Profil studiów Forma studiów Kod Język Rodzaj Rok studiów /semestr
Dr. habil. Anna Salek International Bio-Consulting 1 Germany
 1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
Wersja pliku: v.10, 13 kwietnia 2019 zmiany: dodany punkt na temat testów do sprawozdania. Biologia, bioinformatyka:
 Wersja pliku: v.10, 13 kwietnia 2019 zmiany: - 13.04 dodany punkt na temat testów do sprawozdania Biologia, bioinformatyka: 1. DNA kwas deoksyrybonukleinowy. Zbudowany z 4 rodzajów nukleotydów: adeniny,
Wersja pliku: v.10, 13 kwietnia 2019 zmiany: - 13.04 dodany punkt na temat testów do sprawozdania Biologia, bioinformatyka: 1. DNA kwas deoksyrybonukleinowy. Zbudowany z 4 rodzajów nukleotydów: adeniny,
Opis zakładanych efektów kształcenia OPIS ZAKŁADANYCH EFEKTÓW KSZTAŁCENIA
 Załącznik nr 2 do Uchwały Rady Wydziału Biochemii, Biofizyki i Biotechnologii UJ z dnia 19czerwca 2018 r. w sprawie zmian programu i planu na BIOCHEMIA na poziomie pierwszego stopnia (według wzoru zawartego
Załącznik nr 2 do Uchwały Rady Wydziału Biochemii, Biofizyki i Biotechnologii UJ z dnia 19czerwca 2018 r. w sprawie zmian programu i planu na BIOCHEMIA na poziomie pierwszego stopnia (według wzoru zawartego
Wprowadzenie do bioinformatyki
 Metody bioinformatyki Wprowadzenie do bioinformatyki prof. dr hab. Jan Mulawka Czym jest bioinformatyka Bioinformatyka to dyscyplina zajmująca się stosowaniem narzędzi matematycznych i informatycznych
Metody bioinformatyki Wprowadzenie do bioinformatyki prof. dr hab. Jan Mulawka Czym jest bioinformatyka Bioinformatyka to dyscyplina zajmująca się stosowaniem narzędzi matematycznych i informatycznych
Przetarg nieograniczony na zakup specjalistycznej aparatury laboratoryjnej Znak sprawy: DZ-2501/6/17
 Część nr 2: SEKWENATOR NASTĘPNEJ GENERACJI Z ZESTAWEM DEDYKOWANYCH ODCZYNNIKÓW Określenie przedmiotu zamówienia zgodnie ze Wspólnym Słownikiem Zamówień (CPV): 38500000-0 aparatura kontrolna i badawcza
Część nr 2: SEKWENATOR NASTĘPNEJ GENERACJI Z ZESTAWEM DEDYKOWANYCH ODCZYNNIKÓW Określenie przedmiotu zamówienia zgodnie ze Wspólnym Słownikiem Zamówień (CPV): 38500000-0 aparatura kontrolna i badawcza
Metrologia: organizacja eksperymentu pomiarowego
 Metrologia: organizacja eksperymentu pomiarowego (na podstawie: Żółtowski B. Podstawy diagnostyki maszyn, 1996) dr inż. Paweł Zalewski Akademia Morska w Szczecinie Teoria eksperymentu: Teoria eksperymentu
Metrologia: organizacja eksperymentu pomiarowego (na podstawie: Żółtowski B. Podstawy diagnostyki maszyn, 1996) dr inż. Paweł Zalewski Akademia Morska w Szczecinie Teoria eksperymentu: Teoria eksperymentu
prof. dr hab. inż. Marta Kasprzak Instytut Informatyki, Politechnika Poznańska Dopasowanie sekwencji
 Bioinformatyka wykład 5: dopasowanie sekwencji prof. dr hab. inż. Marta Kasprzak Instytut Informatyk Politechnika Poznańska Dopasowanie sekwencji Badanie podobieństwa sekwencji stanowi podstawę wielu gałęzi
Bioinformatyka wykład 5: dopasowanie sekwencji prof. dr hab. inż. Marta Kasprzak Instytut Informatyk Politechnika Poznańska Dopasowanie sekwencji Badanie podobieństwa sekwencji stanowi podstawę wielu gałęzi
O ISTOTNYCH OGRANICZENIACH METODY
 O ISTOTNYCH OGRANICZENIACH METODY ALGORYTMICZNEJ Dwa pojęcia algorytmu (w informatyce) W sensie wąskim Algorytmem nazywa się każdy ogólny schemat procedury możliwej do wykonania przez uniwersalną maszynę
O ISTOTNYCH OGRANICZENIACH METODY ALGORYTMICZNEJ Dwa pojęcia algorytmu (w informatyce) W sensie wąskim Algorytmem nazywa się każdy ogólny schemat procedury możliwej do wykonania przez uniwersalną maszynę
Do uzyskania kwalifikacji pierwszego stopnia (studia inżynierskie) na kierunku BIOTECHNOLOGIA wymagane są wszystkie poniższe efekty kształcenia
 Kierunek studiów: BIOTECHNOLOGIA Forma studiów: stacjonarne Rodzaj studiów: studia pierwszego stopnia - inżynierskie Czas trwania studiów: 3,5 roku (7 semestrów, 1 semestr - 15 tygodni) Liczba uzyskanych
Kierunek studiów: BIOTECHNOLOGIA Forma studiów: stacjonarne Rodzaj studiów: studia pierwszego stopnia - inżynierskie Czas trwania studiów: 3,5 roku (7 semestrów, 1 semestr - 15 tygodni) Liczba uzyskanych
Grafy i sieci wybrane zagadnienia wykład 3: modele służące porównywaniu sieci
 Grafy i sieci wybrane zagadnienia wykład 3: modele służące porównywaniu sieci prof. dr hab. inż. Marta Kasprzak Instytut Informatyki, Politechnika Poznańska Plan wykładu 1. Sieci jako modele interakcji
Grafy i sieci wybrane zagadnienia wykład 3: modele służące porównywaniu sieci prof. dr hab. inż. Marta Kasprzak Instytut Informatyki, Politechnika Poznańska Plan wykładu 1. Sieci jako modele interakcji
Technologie cyfrowe. Artur Kalinowski. Zakład Cząstek i Oddziaływań Fundamentalnych Pasteura 5, pokój 4.15
 Technologie cyfrowe Artur Kalinowski Zakład Cząstek i Oddziaływań Fundamentalnych Pasteura 5, pokój 4.15 Artur.Kalinowski@fuw.edu.pl Semestr letni 2014/2015 Zadanie algorytmiczne: wyszukiwanie dane wejściowe:
Technologie cyfrowe Artur Kalinowski Zakład Cząstek i Oddziaływań Fundamentalnych Pasteura 5, pokój 4.15 Artur.Kalinowski@fuw.edu.pl Semestr letni 2014/2015 Zadanie algorytmiczne: wyszukiwanie dane wejściowe:
Bioinformatyka Laboratorium, 30h. Michał Bereta
 Laboratorium, 30h Michał Bereta mbereta@pk.edu.pl www.michalbereta.pl Zasady zaliczenia przedmiotu Kolokwia (3 4 ) Ocena aktywności i przygotowania Obecność Literatura, materiały Bioinformatyka i ewolucja
Laboratorium, 30h Michał Bereta mbereta@pk.edu.pl www.michalbereta.pl Zasady zaliczenia przedmiotu Kolokwia (3 4 ) Ocena aktywności i przygotowania Obecność Literatura, materiały Bioinformatyka i ewolucja
Mechatronika i inteligentne systemy produkcyjne. Modelowanie systemów mechatronicznych Platformy przetwarzania danych
 Mechatronika i inteligentne systemy produkcyjne Modelowanie systemów mechatronicznych Platformy przetwarzania danych 1 Sterowanie procesem oparte na jego modelu u 1 (t) System rzeczywisty x(t) y(t) Tworzenie
Mechatronika i inteligentne systemy produkcyjne Modelowanie systemów mechatronicznych Platformy przetwarzania danych 1 Sterowanie procesem oparte na jego modelu u 1 (t) System rzeczywisty x(t) y(t) Tworzenie
Centrum Badań DNA - przykład start-up u w biotechnologii
 Krajowy Lider Innowacji 2008,2009 Centrum Badań DNA - przykład start-up u w biotechnologii Poznański Park Naukowo-Technologiczny Siedziba: Poznań, Laboratorium: Poznań, ul. Mickiewicza 31 Kim jesteśmy?
Krajowy Lider Innowacji 2008,2009 Centrum Badań DNA - przykład start-up u w biotechnologii Poznański Park Naukowo-Technologiczny Siedziba: Poznań, Laboratorium: Poznań, ul. Mickiewicza 31 Kim jesteśmy?
Recenzja pracy doktorskiej mgr Tomasza Świsłockiego pt. Wpływ oddziaływań dipolowych na własności spinorowego kondensatu rubidowego
 Prof. dr hab. Jan Mostowski Instytut Fizyki PAN Warszawa Warszawa, 15 listopada 2010 r. Recenzja pracy doktorskiej mgr Tomasza Świsłockiego pt. Wpływ oddziaływań dipolowych na własności spinorowego kondensatu
Prof. dr hab. Jan Mostowski Instytut Fizyki PAN Warszawa Warszawa, 15 listopada 2010 r. Recenzja pracy doktorskiej mgr Tomasza Świsłockiego pt. Wpływ oddziaływań dipolowych na własności spinorowego kondensatu
OSTASZEWSKI Paweł (55566) PAWLICKI Piotr (55567) Algorytmy i Struktury Danych PIŁA
 OSTASZEWSKI Paweł (55566) PAWLICKI Piotr (55567) 16.01.2003 Algorytmy i Struktury Danych PIŁA ALGORYTMY ZACHŁANNE czas [ms] Porównanie Algorytmów Rozwiązyjących problem TSP 100 000 000 000,000 10 000 000
OSTASZEWSKI Paweł (55566) PAWLICKI Piotr (55567) 16.01.2003 Algorytmy i Struktury Danych PIŁA ALGORYTMY ZACHŁANNE czas [ms] Porównanie Algorytmów Rozwiązyjących problem TSP 100 000 000 000,000 10 000 000
Algorytmy genetyczne
 Algorytmy genetyczne Motto: Zamiast pracowicie poszukiwać najlepszego rozwiązania problemu informatycznego lepiej pozwolić, żeby komputer sam sobie to rozwiązanie wyhodował! Algorytmy genetyczne służą
Algorytmy genetyczne Motto: Zamiast pracowicie poszukiwać najlepszego rozwiązania problemu informatycznego lepiej pozwolić, żeby komputer sam sobie to rozwiązanie wyhodował! Algorytmy genetyczne służą
Algorytm Genetyczny. zastosowanie do procesów rozmieszczenia stacji raportujących w sieciach komórkowych
 Algorytm Genetyczny zastosowanie do procesów rozmieszczenia stacji raportujących w sieciach komórkowych Dlaczego Algorytmy Inspirowane Naturą? Rozwój nowych technologii: złożone problemy obliczeniowe w
Algorytm Genetyczny zastosowanie do procesów rozmieszczenia stacji raportujących w sieciach komórkowych Dlaczego Algorytmy Inspirowane Naturą? Rozwój nowych technologii: złożone problemy obliczeniowe w
WSTĘP DO BIOINFORMATYKI Konspekt wykładu - wiosna 2018/19
 WSTĘP DO BIOINFORMATYKI Konspekt wykładu - wiosna 2018/19 Witold Dyrka 14 marca 2019 1 Wprowadzenie 1.1 Definicje bioinformatyki Według polskiej Wikipedii [1], Bioinformatyka interdyscyplinarna dziedzina
WSTĘP DO BIOINFORMATYKI Konspekt wykładu - wiosna 2018/19 Witold Dyrka 14 marca 2019 1 Wprowadzenie 1.1 Definicje bioinformatyki Według polskiej Wikipedii [1], Bioinformatyka interdyscyplinarna dziedzina
M T E O T D O ZI Z E E A LG L O G R O Y R TM
 O ALGORYTMACH I METODZIE ALGORYTMICZNEJ Czym jest algorytm? Czym jest algorytm? przepis schemat zestaw reguł [ ] program ALGORYTM (objaśnienie ogólne) Algorytm Pojęcie o rodowodzie matematycznym, oznaczające
O ALGORYTMACH I METODZIE ALGORYTMICZNEJ Czym jest algorytm? Czym jest algorytm? przepis schemat zestaw reguł [ ] program ALGORYTM (objaśnienie ogólne) Algorytm Pojęcie o rodowodzie matematycznym, oznaczające
Optymalizacja ciągła
 Optymalizacja ciągła 5. Metoda stochastycznego spadku wzdłuż gradientu Wojciech Kotłowski Instytut Informatyki PP http://www.cs.put.poznan.pl/wkotlowski/ 04.04.2019 1 / 20 Wprowadzenie Minimalizacja różniczkowalnej
Optymalizacja ciągła 5. Metoda stochastycznego spadku wzdłuż gradientu Wojciech Kotłowski Instytut Informatyki PP http://www.cs.put.poznan.pl/wkotlowski/ 04.04.2019 1 / 20 Wprowadzenie Minimalizacja różniczkowalnej
Lingwistyczny system definicyjny wykorzystujący korpusy tekstów oraz zasoby internetowe.
 Lingwistyczny system definicyjny wykorzystujący korpusy tekstów oraz zasoby internetowe. Autor: Mariusz Sasko Promotor: dr Adrian Horzyk Plan prezentacji 1. Wstęp 2. Cele pracy 3. Rozwiązanie 3.1. Robot
Lingwistyczny system definicyjny wykorzystujący korpusy tekstów oraz zasoby internetowe. Autor: Mariusz Sasko Promotor: dr Adrian Horzyk Plan prezentacji 1. Wstęp 2. Cele pracy 3. Rozwiązanie 3.1. Robot
Programowanie komputerów
 Programowanie komputerów Wykład 1-2. Podstawowe pojęcia Plan wykładu Omówienie programu wykładów, laboratoriów oraz egzaminu Etapy rozwiązywania problemów dr Helena Dudycz Katedra Technologii Informacyjnych
Programowanie komputerów Wykład 1-2. Podstawowe pojęcia Plan wykładu Omówienie programu wykładów, laboratoriów oraz egzaminu Etapy rozwiązywania problemów dr Helena Dudycz Katedra Technologii Informacyjnych
ZASTOSOWANIA FIZYKI W BIOLOGII I MEDYCYNIE Specjalność: Biofizyka molekularna. 2-letnie studia II stopnia (magisterskie)
 ZASTOSOWANIA FIZYKI W BIOLOGII I MEDYCYNIE Specjalność: Biofizyka molekularna 2-letnie studia II stopnia (magisterskie) 1. OGÓLNA CHARAKTERYSTYKA STUDIÓW Biofizyka to uznana dziedzina nauk przyrodniczych
ZASTOSOWANIA FIZYKI W BIOLOGII I MEDYCYNIE Specjalność: Biofizyka molekularna 2-letnie studia II stopnia (magisterskie) 1. OGÓLNA CHARAKTERYSTYKA STUDIÓW Biofizyka to uznana dziedzina nauk przyrodniczych
na podstawie artykułu: Modeling Complex RNA Tertiary Folds with Rosetta Clarence Yu Cheng, Fang-Chieh Chou, Rhiju Das
 na podstawie artykułu: Modeling Complex RNA Tertiary Folds with Rosetta Clarence Yu Cheng, Fang-Chieh Chou, Rhiju Das wykonała: Marta Szynczewska bioinformatyka Uniwersytet Jagielloński Struktura I-rzędowa
na podstawie artykułu: Modeling Complex RNA Tertiary Folds with Rosetta Clarence Yu Cheng, Fang-Chieh Chou, Rhiju Das wykonała: Marta Szynczewska bioinformatyka Uniwersytet Jagielloński Struktura I-rzędowa
SCENARIUSZ LEKCJI. TEMAT LEKCJI: Podstawowe techniki inżynierii genetycznej. Streszczenie
 SCENARIUSZ LEKCJI OPRACOWANY W RAMACH PROJEKTU: INFORMATYKA MÓJ SPOSÓB NA POZNANIE I OPISANIE ŚWIATA. PROGRAM NAUCZANIA INFORMATYKI Z ELEMENTAMI PRZEDMIOTÓW MATEMATYCZNO-PRZYRODNICZYCH Autorzy scenariusza:
SCENARIUSZ LEKCJI OPRACOWANY W RAMACH PROJEKTU: INFORMATYKA MÓJ SPOSÓB NA POZNANIE I OPISANIE ŚWIATA. PROGRAM NAUCZANIA INFORMATYKI Z ELEMENTAMI PRZEDMIOTÓW MATEMATYCZNO-PRZYRODNICZYCH Autorzy scenariusza:
Sylabus Biologia molekularna
 Sylabus Biologia molekularna 1. Metryczka Nazwa Wydziału Program kształcenia Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Analityka Medyczna, studia jednolite magisterskie, studia stacjonarne
Sylabus Biologia molekularna 1. Metryczka Nazwa Wydziału Program kształcenia Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej Analityka Medyczna, studia jednolite magisterskie, studia stacjonarne
Efekty kształcenia dla kierunku studiów biotechnologia i ich odniesienie do efektów obszarowych
 Załącznik do uchwały nr 374/2012 Senatu UP Efekty kształcenia dla kierunku studiów biotechnologia i ich odniesienie do efektów obszarowych Wydział prowadzący kierunek: Wydział Rolnictwa i Bioinżynierii
Załącznik do uchwały nr 374/2012 Senatu UP Efekty kształcenia dla kierunku studiów biotechnologia i ich odniesienie do efektów obszarowych Wydział prowadzący kierunek: Wydział Rolnictwa i Bioinżynierii
Politechnika Krakowska im. Tadeusza Kościuszki. Karta przedmiotu. obowiązuje w roku akademickim 2012/2013. Algorytmy i struktury danych
 Politechnika Krakowska im. Tadeusza Kościuszki Karta przedmiotu Wydział Inżynierii Elektrycznej i Komputerowej obowiązuje w roku akademickim 2012/2013 Kierunek studiów: Elektrotechnika Forma studiów: Niestacjonarne
Politechnika Krakowska im. Tadeusza Kościuszki Karta przedmiotu Wydział Inżynierii Elektrycznej i Komputerowej obowiązuje w roku akademickim 2012/2013 Kierunek studiów: Elektrotechnika Forma studiów: Niestacjonarne
INFORMATYKA POZIOM ROZSZERZONY
 EGZAMIN MATURALNY W ROKU SZKOLNYM 2015/2016 FORMUŁA DO 2014 ( STARA MATURA ) INFORMATYKA POZIOM ROZSZERZONY ZASADY OCENIANIA ROZWIĄZAŃ ZADAŃ ARKUSZ MIN-R1, R2 MAJ 2016 Uwaga: Akceptowane są wszystkie odpowiedzi
EGZAMIN MATURALNY W ROKU SZKOLNYM 2015/2016 FORMUŁA DO 2014 ( STARA MATURA ) INFORMATYKA POZIOM ROZSZERZONY ZASADY OCENIANIA ROZWIĄZAŃ ZADAŃ ARKUSZ MIN-R1, R2 MAJ 2016 Uwaga: Akceptowane są wszystkie odpowiedzi
INFORMATYKA POZIOM ROZSZERZONY
 EGZAMIN MATURALNY W ROKU SZKOLNYM 2015/2016 FORMUŁA DO 2014 ( STARA MATURA ) INFORMATYKA POZIOM ROZSZERZONY ZASADY OCENIANIA ROZWIĄZAŃ ZADAŃ ARKUSZ MIN-R1, R2 MAJ 2016 Uwaga: Akceptowane są wszystkie odpowiedzi
EGZAMIN MATURALNY W ROKU SZKOLNYM 2015/2016 FORMUŁA DO 2014 ( STARA MATURA ) INFORMATYKA POZIOM ROZSZERZONY ZASADY OCENIANIA ROZWIĄZAŃ ZADAŃ ARKUSZ MIN-R1, R2 MAJ 2016 Uwaga: Akceptowane są wszystkie odpowiedzi
Przewidywanie struktur białek
 Łukasz Ołdziejewski Wydział Chemii UW Przewidywanie struktur białek czyli droga do projektowania indywidualnych leków Sprawozdanie studenckie 2007/2008 1 Indywidualność jednostki KaŜdy człowiek jest indywidualnym
Łukasz Ołdziejewski Wydział Chemii UW Przewidywanie struktur białek czyli droga do projektowania indywidualnych leków Sprawozdanie studenckie 2007/2008 1 Indywidualność jednostki KaŜdy człowiek jest indywidualnym
Transformacja wiedzy w budowie i eksploatacji maszyn
 Uniwersytet Technologiczno Przyrodniczy im. Jana i Jędrzeja Śniadeckich w Bydgoszczy Wydział Mechaniczny Transformacja wiedzy w budowie i eksploatacji maszyn Bogdan ŻÓŁTOWSKI W pracy przedstawiono proces
Uniwersytet Technologiczno Przyrodniczy im. Jana i Jędrzeja Śniadeckich w Bydgoszczy Wydział Mechaniczny Transformacja wiedzy w budowie i eksploatacji maszyn Bogdan ŻÓŁTOWSKI W pracy przedstawiono proces
Mikrosatelitarne sekwencje DNA
 Mikrosatelitarne sekwencje DNA Małgorzata Pałucka Wykorzystanie sekwencji mikrosatelitarnych w jądrowym DNA drzew leśnych do udowodnienia pochodzenia materiału dowodowego w postępowaniu sądowym 27.09.2012
Mikrosatelitarne sekwencje DNA Małgorzata Pałucka Wykorzystanie sekwencji mikrosatelitarnych w jądrowym DNA drzew leśnych do udowodnienia pochodzenia materiału dowodowego w postępowaniu sądowym 27.09.2012
Podsumowanie wyników ankiety
 SPRAWOZDANIE Kierunkowego Zespołu ds. Programów Kształcenia dla kierunku Informatyka dotyczące ankiet samooceny osiągnięcia przez absolwentów kierunkowych efektów kształcenia po ukończeniu studiów w roku
SPRAWOZDANIE Kierunkowego Zespołu ds. Programów Kształcenia dla kierunku Informatyka dotyczące ankiet samooceny osiągnięcia przez absolwentów kierunkowych efektów kształcenia po ukończeniu studiów w roku
Wprowadzenie do teorii systemów ekspertowych
 Myślące komputery przyszłość czy utopia? Wprowadzenie do teorii systemów ekspertowych Roman Simiński siminski@us.edu.pl Wizja inteligentnych maszyn jest od wielu lat obecna w literaturze oraz filmach z
Myślące komputery przyszłość czy utopia? Wprowadzenie do teorii systemów ekspertowych Roman Simiński siminski@us.edu.pl Wizja inteligentnych maszyn jest od wielu lat obecna w literaturze oraz filmach z
dr inż. Jarosław Forenc
 Informatyka 2 Politechnika Białostocka - Wydział Elektryczny Elektrotechnika, semestr III, studia stacjonarne I stopnia Rok akademicki 2010/2011 Wykład nr 7 (24.01.2011) dr inż. Jarosław Forenc Rok akademicki
Informatyka 2 Politechnika Białostocka - Wydział Elektryczny Elektrotechnika, semestr III, studia stacjonarne I stopnia Rok akademicki 2010/2011 Wykład nr 7 (24.01.2011) dr inż. Jarosław Forenc Rok akademicki
Podstawy biologiczne - komórki. Podstawy biologiczne - cząsteczki. Model komórki eukariotycznej. Wprowadzenie do Informatyki Biomedycznej
 Wprowadzenie do Informatyki Biomedycznej Wykład 1: Podstawy bioinformatyki Wydział Informatyki PB Podstawy biologiczne - komórki Wszystkie organizmy zbudowane są z komórek komórka jest skomplikowanym systemem
Wprowadzenie do Informatyki Biomedycznej Wykład 1: Podstawy bioinformatyki Wydział Informatyki PB Podstawy biologiczne - komórki Wszystkie organizmy zbudowane są z komórek komórka jest skomplikowanym systemem
Minister van Sociale Zaken en Volksgezondheid
 http://www.maggiedeblock.be/2005/11/18/resolutie-inzake-de-klinischebiologie/ Minister van Sociale Zaken en Volksgezondheid Obecna Minister Zdrowia Maggy de Block wraz z Yolande Avontroodt, i Hilde Dierickx
http://www.maggiedeblock.be/2005/11/18/resolutie-inzake-de-klinischebiologie/ Minister van Sociale Zaken en Volksgezondheid Obecna Minister Zdrowia Maggy de Block wraz z Yolande Avontroodt, i Hilde Dierickx
istocie dziedzina zajmująca się poszukiwaniem zależności na podstawie prowadzenia doświadczeń jest o wiele starsza: tak na przykład matematycy
 MODEL REGRESJI LINIOWEJ. METODA NAJMNIEJSZYCH KWADRATÓW Analiza regresji zajmuje się badaniem zależności pomiędzy interesującymi nas wielkościami (zmiennymi), mające na celu konstrukcję modelu, który dobrze
MODEL REGRESJI LINIOWEJ. METODA NAJMNIEJSZYCH KWADRATÓW Analiza regresji zajmuje się badaniem zależności pomiędzy interesującymi nas wielkościami (zmiennymi), mające na celu konstrukcję modelu, który dobrze
XQTav - reprezentacja diagramów przepływu prac w formacie SCUFL przy pomocy XQuery
 http://xqtav.sourceforge.net XQTav - reprezentacja diagramów przepływu prac w formacie SCUFL przy pomocy XQuery dr hab. Jerzy Tyszkiewicz dr Andrzej Kierzek mgr Jacek Sroka Grzegorz Kaczor praca mgr pod
http://xqtav.sourceforge.net XQTav - reprezentacja diagramów przepływu prac w formacie SCUFL przy pomocy XQuery dr hab. Jerzy Tyszkiewicz dr Andrzej Kierzek mgr Jacek Sroka Grzegorz Kaczor praca mgr pod
Modelowanie jako sposób opisu rzeczywistości. Katedra Mikroelektroniki i Technik Informatycznych Politechnika Łódzka
 Modelowanie jako sposób opisu rzeczywistości Katedra Mikroelektroniki i Technik Informatycznych Politechnika Łódzka 2015 Wprowadzenie: Modelowanie i symulacja PROBLEM: Podstawowy problem z opisem otaczającej
Modelowanie jako sposób opisu rzeczywistości Katedra Mikroelektroniki i Technik Informatycznych Politechnika Łódzka 2015 Wprowadzenie: Modelowanie i symulacja PROBLEM: Podstawowy problem z opisem otaczającej
Politechnika Wrocławska. Dopasowywanie sekwencji Sequence alignment
 Dopasowywanie sekwencji Sequence alignment Drzewo filogenetyczne Kserokopiarka zadanie: skopiować 300 stron. Co może pójść źle? 2x ta sama strona Opuszczona strona Nadmiarowa pusta strona Strona do góry
Dopasowywanie sekwencji Sequence alignment Drzewo filogenetyczne Kserokopiarka zadanie: skopiować 300 stron. Co może pójść źle? 2x ta sama strona Opuszczona strona Nadmiarowa pusta strona Strona do góry
Instytut Politechniczny Państwowa Wyższa Szkoła Zawodowa. Diagnostyka i niezawodność robotów
 Instytut Politechniczny Państwowa Wyższa Szkoła Zawodowa Diagnostyka i niezawodność robotów Laboratorium nr 6 Model matematyczny elementu naprawialnego Prowadzący: mgr inż. Marcel Luzar Cele ćwiczenia:
Instytut Politechniczny Państwowa Wyższa Szkoła Zawodowa Diagnostyka i niezawodność robotów Laboratorium nr 6 Model matematyczny elementu naprawialnego Prowadzący: mgr inż. Marcel Luzar Cele ćwiczenia:
Odniesienie do efektów kształcenia dla obszaru nauk EFEKTY KSZTAŁCENIA Symbol
 KIERUNKOWE EFEKTY KSZTAŁCENIA Wydział Informatyki i Zarządzania Kierunek studiów INFORMATYKA (INF) Stopień studiów - pierwszy Profil studiów - ogólnoakademicki Projekt v1.0 z 18.02.2015 Odniesienie do
KIERUNKOWE EFEKTY KSZTAŁCENIA Wydział Informatyki i Zarządzania Kierunek studiów INFORMATYKA (INF) Stopień studiów - pierwszy Profil studiów - ogólnoakademicki Projekt v1.0 z 18.02.2015 Odniesienie do
Ćwiczenie 12. Diagnostyka molekularna. Poszukiwanie SNPs Odczytywanie danych z sekwencjonowania. Prof. dr hab. Roman Zieliński
 Ćwiczenie 12 Diagnostyka molekularna. Poszukiwanie SNPs Odczytywanie danych z sekwencjonowania Prof. dr hab. Roman Zieliński 1. Diagnostyka molekularna 1.1. Pytania i zagadnienia 1.1.1. Jak definiujemy
Ćwiczenie 12 Diagnostyka molekularna. Poszukiwanie SNPs Odczytywanie danych z sekwencjonowania Prof. dr hab. Roman Zieliński 1. Diagnostyka molekularna 1.1. Pytania i zagadnienia 1.1.1. Jak definiujemy
SCHEMAT ROZWIĄZANIA ZADANIA OPTYMALIZACJI PRZY POMOCY ALGORYTMU GENETYCZNEGO
 SCHEMAT ROZWIĄZANIA ZADANIA OPTYMALIZACJI PRZY POMOCY ALGORYTMU GENETYCZNEGO. Rzeczywistość (istniejąca lub projektowana).. Model fizyczny. 3. Model matematyczny (optymalizacyjny): a. Zmienne projektowania
SCHEMAT ROZWIĄZANIA ZADANIA OPTYMALIZACJI PRZY POMOCY ALGORYTMU GENETYCZNEGO. Rzeczywistość (istniejąca lub projektowana).. Model fizyczny. 3. Model matematyczny (optymalizacyjny): a. Zmienne projektowania
