AMINOKWASY I POCHODNE
|
|
|
- Lech Borkowski
- 8 lat temu
- Przeglądów:
Transkrypt
1 13. AMINKWASY I PDNE Iwona śak Aminokwasy są najmniejszymi elementami strukturalnymi białek, polipeptydów i peptydów we wszystkich organizmach Ŝywych, od bakterii do człowieka włącznie. Występują równieŝ w stanie wolnym, pełniąc inne funkcje biologiczne. Mogą być substratami w utlenianiu komórkowym, w syntezie róŝnorodnych związków waŝnych biologicznie, np. zasad azotowych. Aminokwasy lub ich pochodne są neuroprzekaźnikami, neurohormonami lub klasycznymi hormonami. Podstawowych aminokwasów białkowych jest 20 (tab. 1), wszystkie one posiadają własne kodony genetyczne, warunkujące wbudowanie ich w łańcuch polipeptydowy. Aminokwasy określa się za pomocą nazw zwyczajowych, chemicznych oraz trójliterowymi lub jednoliterowymi skrótami międzynarodowymi. Te ostatnie są szczególnie uŝyteczne do zapisywania sekwencji polipeptydowej. Aminokwasy stanowią róŝnorodną grupę cząsteczek, ale mają wspólny element strukturalny. Wspólnym elementem wszystkich aminokwasów białkowych jest węgiel α, do którego przyłączona jest grupa α-karboksylowa i pierwszorzędowa grupa α-aminowa lub drugorzędowa grupa α-aminowa (tylko w prolinie). Związanie grupy aminowej proliny w strukturze pierścieniowej łańcucha bocznego sprawia, Ŝe jest iminokwasem. Wszystkie aminokwasy występujące w białkach są α-aminokwasami. Węgiel α jest atomem asymetrycznym we wszystkich aminokwasach białkowych, z wyjątkiem glicyny, dlatego aminokwasy są związkami optycznie czynnymi, skręcają płaszczyznę światła spolaryzowanego w prawo () lub w lewo (-) oraz występują w dwóch stereoizomerycznych formach L i D. Wszystkie aminokwasy występujące w organizmach wyŝszych zwierząt, roślin i człowieka są enancjomerami o konfiguracji L, dlatego pominięto ten symbol w nazwie przedstawionych wzorów aminokwasów. 221
2 Tabela 1. Aminokwasy białkowe Nazwy Skróty Typ Łańcuchy boczne aminokwasów (R) Grupy α-aminokwasowe Glicyna (glikokol) kwas aminooctowy Alanina kw.()2-aminopropionowy Walina kw.()2-amino-3- -metylomasłowy Gly (G) Ala (A) Val (V) N 3 - N 3 - N 3 Leucyna kw.(-)2-amino-4- metylowalerianowy Leu (L) N 3 Izoleucyna kw.()2-amino-3- -metylowalerianowy Ile (I) N 3 Metionina kw.(-)2-amino-2- -metylotiomasłowy Fenyloalanina kw.(-)2-amino-3- -fenylopropionowy Tyrozyna kw.(-)2-amino- -3-(4- hydroksyfenylo) propionowy Tryptofan kw.(-)2-amino-3- -(3-indolylo)-propionowy Prolina kw.(-)2- -pirolidynokarboksylowy Met (M) Phe (F) Tyr (Y) Trp (W) Pro (P) 3 S N N N N 3 N N 2-222
3 Nazwy Skróty Typ Seryna kw.(-)2-amino-3- -hydroksypropionowy Ser (S) Łańcuchy boczne aminokwasów (R) 2 Grupy α-aminokwasowe - N 3 Treonina kw.(-)2-amino-3- -hydroksymasłowy Thr (T) 3 - N 3 ysteina kw.()2-amino-3- -merkaptopropionowy ys () S 2 - N 3 Kwas asparaginowy kw()2-aminobursztynowy Asp (D) N 3 Kwas glutaminowy kw.()2-aminoglutarowy Glu (E) N 3 Asparagina kwas 2-aminobursztynoamowy Asn (N) 2 N 2 - N 3 Glutamina kwas 2-amino-glutaroamowy Gln (Q) 2 N N 3 istydyna kw.(-)α-amino-β- -imidazolo-4-propionowy is () N N 2 - N 3 Lizyna kw.()2,6-diamino- -heksanowy Lys (K) 3 N N 3 Arginina kw.()2-amino-5- -guanidynowalerianowy Arg (R) 2 N N 2 N N 3 gdzie: endogenne, egzogenne 223
4 Aminokwas naleŝy do szeregu L wówczas, gdy jego konfiguracja przy atomie węgla α jest taka sama, jak konfiguracja L-seryny i tym samym aldehydu L- -glicerynowego. We wzorze Fischera, czyli pionowym zapisie atomów łańcucha węglowego aminokwasu z grupą karboksylową na górnym końcu, konfigurację L przedstawia się w ten sposób, Ŝe grupa aminowa znajduje się po lewej stronie, natomiast gdy znajduje się po prawej stronie, to aminokwas jest konfiguracji D. Wszystkim L-aminokwasom białkowym odpowiada konfiguracja absolutna S, wg reguł pierwszeństwa, z wyjątkiem L-cysteiny, która ma konfigurację R. D-Aminokwasy występują sporadycznie, jedynie w niektórych antybiotykach peptydowych lub w ścianie komórek bakteryjnych. Przedstawiając nazwę takiego aminokwasu, zawsze naleŝy zamieścić symbol szeregu D. Termin aminoacyl oznacza grupę acylową α-aminokwasu, która jest pozbawiona grupy wodorotlenowej, naleŝącej do grupy karboksylowej. Nazwy takich grup tworzy się przez zastąpienie końcówki nazwy aminokwasu (-yna, -ina, -an) końcówką yl, przykładowo: glicyl, alanyl, tryptofyl. Grupa aminoacylowa, która po- 2 N wstała z kwasu asparaginowego, nazywa się aspartyl, a powstała z kwasu glutaminowego R glutamyl. Reszty α-aminokwasów są to struktury, w których nie występuje jeden z atomów z grupy aminowej (-NR) lub w których równocześnie nie stwierdza się z grupy karboksylowej (-NR-). W nazewnictwie reszt α-aminokwasowych stosuje się zwyczajowe nazwy aminokwasów. Grupy funkcyjne przyłączone do atomu węgla α w roztworze o odczynie obojętnym (p~7) występują w formie zjonizowanej jako jony obojnacze z protonowaną grupą aminową (N 3 ) oraz zjonizowaną grupą karboksylową ( - ). Jon obojnaczy ma wypadkowy ładunek równy 0 i nie wędruje w polu elektrycznym. KATIN JN BJNAZY ANIN 3 N R p<pi N R p=pi N R p>pi Dysocjacja grupy α-aminowej określona wartością pk wynosi 8,9 10,6, natomiast wartość pk grupy α-karboksylowej 1,7 2,6. Wraz ze zmianą p środowiska zmienia się stan zjonizowania tych grup. 224
5 W środowisku kwaśnym (p<pi) cofnięta jest dysocjacja grupy karboksylowej, uprotonowana pozostaje grupa aminowa, która nadaje ugrupowaniu α-aminokwasowemu charakter kationu. W środowisku zasadowym (p>pi) zostaje cofnięta dysocjacja grupy aminowej, natomiast zjonizowana pozostaje grupa karboksylowa, nadająca ugrupowaniu α-aminokwasowemu charakter anionu. Dzięki tym grupom aminokwasy monoaminomonokarboksylowe są amfolitami, czyli w obecności zasad reagują jak aniony, natomiast w obecności kwasów jak kationy. Jednak grupy funkcyjne przyłączone do atomu węgla α mogą reagować, jak kation lub aniony tylko w wolnych aminokwasach, poniewaŝ w peptydach, polipeptydach, białkach one właśnie tworzą wiązania peptydowe i dlatego nie mają wpływu na stan jonizacji związanej cząsteczki aminokwasu (z wyjątkiem N-końcowych i -końcowych aminokwasów). Aminokwasy róŝnią się natomiast między sobą łańcuchem bocznym (R) połączonym z atomem węgla α. W najmniejszym aminokwasie, glicynie, pojedynczy atom wodoru zajmuje miejsce łańcucha bocznego, zwykle tworzonego przez róŝne łańcuchy alifatyczne lub aromatyczne w innych aminokwasach (tab. 1). W łańcuchach bocznych aminokwasów mogą być obecne róŝne grupy zdolne do jonizacji (np. N 2, -). Grupy te, niezaleŝnie od postaci aminokwasu (wolnej lub związanej w polipeptydzie), mają wpływ na stan jonizacji cząsteczki aminokwasu, ale takŝe makrocząsteczki, w której występują, dlatego natura łańcuchów bocznych odpowiedzialna jest za własności fizykochemiczne aminokwasów. Aminokwasy hydrofobowe stanowią waŝną grupę wśród aminokwasów białkowych. Alifatyczne łańcuchy boczne, chemicznie niereaktywne i hydrofobowe mają aminokwasy: alanina, walina, leucyna, izoleucyna, metionina i prolina. W tym ostatnim aminokwasie łańcuch węglowodorowy jest zamknięty poprzez grupę α-aminową. yklizacja usztywnia konformację proliny. Alifatyczny łańcuch boczny cysteiny jest równieŝ hydrofobowy, lecz zawiera bardzo reaktywną grupę tiolową S. Wartość pk grupy S (ys) wynosi 8,3. Dwie takie grupy łatwo tworzą disulfidy w reakcji łagodnego utleniania. Wytworzone wiązanie disulfidowe w cystynie stosunkowo łatwo ulega rozszczepieniu przez łagodną redukcję, z odtworzeniem dwóch tioli. Aminokwasy z aromatycznymi łańcuchami bocznymi są równieŝ hydrofobowe. harakter silnie hydrofobowy mają fenyloalanina i tryptofan, mniej hydrofobowa jest tyrozyna, poniewaŝ zawiera reaktywną grupę hydroksylową, która moŝe uczestniczyć w tworzeniu wiązań wodorowych lub w fosfoestryfikacji. Wartość pk grupy hydroksylowej (Tyr) wynosi 10,1. Aminokwasy polarne moŝna zróŝnicować na obdarzone ładunkiem i pozbawione ładunku. Do obdarzonych ładunkiem naleŝą aminokwasy z łańcuchami bocznymi, zawierającymi grupy kwasowe lub zasadowe. 225
6 Aminokwasami kwasowymi są aminokwasy monoaminodikarboksylowe: kwas asparaginowy i glutaminowy, których łańcuchy boczne w warunkach fizjologicznego (obojętnego) p są niemal zawsze ujemnie naładowane, dlatego często określa się je nazwami soli: asparaginian i glutaminian. Wartość pk grupy β-karboksylowej (Asp) wynosi 3,9, natomiast pk grupy γ-karboksylowej (Glu) 4,3. Aminokwasami zasadowymi są lizyna (o długim łańcuchu bocznym, zawierającym grupę aminową) i arginina (zawierająca w łańcuchu bocznym grupę guanidynową), które w p obojętnym obdarzone są ładunkiem dodatnim. Wartość pk grupy ε-aminowej (Lys) wynosi 10,5, natomiast grupy guanidynowej (Arg) 12,5. Pierścień imidazolowy łańcucha bocznego zasadowej histydyny moŝe mieć ładunek dodatni lub obojętny, łatwo teŝ przechodzić moŝe z jednego stanu w drugi, zaleŝnie od lokalnego otoczenia. Wartość pk grupy imidazolowej (is) wynosi 6,0. Aminokwasami polarnymi, pozbawionymi ładunku, są seryna i treonina, które charakter polarny zawdzięczają obecności grupy hydroksylowej w swych łańcuchach bocznych. Dzięki temu mogą uczestniczyć w tworzeniu wiązań wodorowych. Grupy hydroksylowe tych aminokwasów mogą podlegać fosfoestryfikacji. Łańcuchy boczne pozbawione ładunku posiadają asparagina i glutamina, skutkiem obecności w nich grup amidowych, które zdolne są do tworzenia wiązań wodorowych. W organizmie zwierząt wyŝszych i człowieka niektóre aminokwasy białkowe są endogenne (syntetyzowane w organizmie) inne egzogenne. Aminokwasy egzogenne nie mogą być syntetyzowane w organizmie człowieka i zwierząt wyŝszych, dlatego muszą być dostarczane z zewnątrz wraz z pokarmem białkowym. NaleŜą do nich leucyna, izoleucyna, lizyna, fenyloalanina, metionina, walina, treonina, tryptofan, histydyna i arginina. Arginina wprawdzie powstaje w cyklu mocznikowym, ale po odszczepieniu od niej cząsteczki mocznika przekształcana jest w ornitynę aminokwas niewykorzystywany do syntezy białek. Prawidłowy wzrost dzieci wymaga dostarczania argininy z zewnątrz, poniewaŝ jej ilości powstające w cyklu mocznikowym są niewystarczające. Dla ludzi dorosłych wystarczające mogą być ilości argininy powstające w cyklu mocznikowym. Największe dzienne zapotrzebowanie człowieka dorosłego jest na leucynę, a najmniejsze na tryptofan. Pozostałe aminokwasy białkowe naleŝą do endogennych, poniewaŝ są syntetyzowane w organizmie zwierząt wyŝszych i człowieka. Wśród nich są tzw. względnie endogenne, które mogą być syntetyzowane w organizmie tylko pod warunkiem dostarczenia ich egzogennego prekursora, z którego powstają. Tyrozyna jest takim aminokwasem endogennym, powstającym w organizmie z egzogennej fenyloalaniny. Jeśli jednak nie zostanie dostarczone poŝywienie, które zawiera odpowiednie ilości fenyloalaniny, nastąpi w organizmie deficyt tyrozyny (której obecność w poŝywieniu nie jest konieczna). Podobnie (lecz w mniejszym stopniu) 226
7 moŝe być z cysteiną, która powstaje z egzogennej metioniny, lecz równieŝ z endogennej seryny. W przypadku braku nawet jednego aminokwasu, w organizmie zaczynają przewaŝać procesy rozkładu białek nad ich syntezą, czego konsekwencją jest ujemny bilans azotu. W organizmie zwierzęcym niektóre aminokwasy białkowe są glukogenne, inne ketogenne. Aminokwasami glukogennymi są te, które mogą być substratami w szlaku glukoneogenezy, odpowiedzialnym za syntezę glukozy z niecukrowych prekursorów. NaleŜą do nich glicyna, alanina, walina, seryna, cysteina, metionina, treonina, asparaginian, glutaminian, histydyna, arginina i prolina. Aminokwasy ketogenne to te, których przemiany dostarczają β-ketokwas acetooctan, który jest prekursorem ciał ketonowych. Spontaniczna dekarboksylacja acetooctanu dostarcza aceton, natomiast redukcja acetooctanu przekształca go w 3- -hydroksymaślan. Ketogennymi aminokwasami są fenyloalanina, tyrozyna, leucyna, izoleucyna, lizyna i tryptofan. Aminokwas białkowy jako donor aktywnych grup metylowych. Wśród aminokwasów białkowych jest metionina, która, poza swą rolą w tworzeniu struktury pierwszorzędowej polipeptydów i białek, występuje równieŝ w formie pochodnej S-adenozylometioniny (S-5-[(3-amino-3-karboksypropylo)-metylenosulfonio]-5 -deoksyadenozyny), pełniącej rolę donora aktywnego metylu w reakcjach metylacji. S-adenozylometionina powstaje w wyniku adenylacji metioniny przy udziale ATP. N 2 N N 3 2 S 2 - ATP N 3 - P i PP i N S 3 N 2 N metionina S-adenozylometionina Aminokwasy rzadkie, których występowanie ograniczone jest wyłącznie do białek typu kolagenu i do elastyny, głównych białek tkanki łącznej. Aminokwasami charakterystycznymi dla kolagenu są 5-hydroksylizyna i 4-hydroksyprolina, które nie mają własnych kodonów odpowiedzialnych za ich wbudowanie w łańcuch polipeptydowy, poniewaŝ są produktami modyfikacji posttranslacyjnych. 227
8 3 N N 3 N 2 5-hydroksylizyna 4-hydroksyprolina Grupy hydroksylowe hydroksylizyn są zwykle podstawione, poniewaŝ stanowią miejsca akceptorowe dla jednostek cukrowych podczas procesu glikozylacji enzymatycznej kolagenu. Jednostkami cukrowymi połączonymi wiązaniem -glikozydowym z hydroksylizyną są pojedyncze reszty β-galaktozy albo disacharydy składające się z glukozy i galaktozy. Grupy hydroksylowe hydroksyprolin kolagenu są wolne, niepodstawione. Allizyna (6-oksonorleucyna, kwas 2-aminoadypoaldehydowy), aldehydowa pochodna lizyny, z której powstaje w wyniku reakcji oksydacyjnej ε-dezaminacji katalizowanej przez oksydazę lizylową, jest charakterystyczna dla kolagenu i elastyny. Reszty allizyny uczestniczą w tworzeniu wiązań krzyŝowych w kolagenie i elastynie. Poliaminokwasy, desmozyna (4-(4-amino-4-karboksybutylo)-1-(5-amino-5- -karboksypentenylo)-3,5-bis(3-amino-3-karboksypropylo)pirydynium) lub jej izomer izodesmozyna (2-(4-amino-4-karboksybutylo)-1-(5-amino-5-karboksypentenylo)-3,5-bis(3-amino-3-karboksypropylo)pirydynium), są charakterystyczne dla elastyny, drugiego po kolagenie, białka tkanki łącznej. Desmozyna tworzona jest z trzech reszt allizyn pochodzących z trzech róŝnych łańcuchów polipeptydowych oraz jednej reszty lizyny z czwartego polipeptydu N 3 ( 2 ) 2 ( 2 ) 3 ( 2 ) 2 N ( 2 ) 4 allizyna desmozyna W elastynie obecna moŝe być równieŝ hydroksyprolina, ale w ilościach znacznie mniejszych niŝ w kolagenie. Elastyna nie zawiera hydroksylizyny w ilościach analitycznie wymierzalnych. 228
9 Aminokwasy niebiałkowe stanowią liczną i róŝnorodną grupę związków, które nigdy nie występują w białkach, natomiast pełnią inne waŝne biologicznie funkcje. Wszystkie aminokwasy, które nie są α-aminokwasami naleŝą do aminokwasów niebiałkowych, jak np. β-alanina i kwas γ-aminomasłowy (GABA) N 3 β-alanina N 3 kwas γ-aminomasłowy (GABA) β-alanina w organizmie ssaków powstaje podczas przemian zasad pirymidynowych. Rola biologiczna β-alaniny wynika z jej udziału w strukturze kwasu pantotenowego, koenzymu A (oa) oraz karnozyny. Kwas γ-aminomasłowy (GABA) powstaje z glutaminianu w mózgu. Pełni rolę hamującego neuroprzekaźnika w synapsach, który stymuluje otwieranie kanałów chlorkowych w błonie postsynaptycznej. W ten sposób utrzymuje wysoką ujemną wartość potencjału błonowego komórki postsynaptycznej, utrudniając wytworzenie potencjału czynnościowego. Aminokwasy niebiałkowe mogą pełnić rolę metabolitów pośrednich w przemianach biologicznie waŝnych dla organizmu. Takimi metabolitami są ornityna (kwas 2,5-diaminowalerianowy) i cytrulina (kwas 2-amino-5-ureidowalerianowy), które uczestniczą w biosyntezie mocznika, lub kwas δ-aminolewulinowy, kluczowy metabolit pośredni w syntezie porfiryn. 3 N ornityna N N N 2 cytrulina N 3 2 N kwas δ-aminolewulinowy Aminokwasy niebiałkowe mogą być równieŝ metabolitami pośrednimi przemian aminokwasów białkowych, które dodatkowo pełnią jeszcze inne swoiste funkcje biologiczne. omocysteina (kwas 2-amino-4-merkaptomasłowy) jest zarówno produktem demetylacji metioniny, jak równieŝ metabolitem pośrednim bio- 229
10 syntezy metioniny. Z przemian cysteiny powstaje tauryna (kwas 2-aminoetanosulfonowy), występująca w Ŝółci w połączeniu z kwasami Ŝółciowymi. S N S 3 - N 3 homocysteina tauryna Dopa, czyli 3,4-dihydroksyfenyloalanina jest produktem hydroksylacji tyrozyny i jednocześnie prekursorem noradrenaliny i adrenaliny. 2 - N 3 dopa Karnityna (β-hydroksy-γ-trimetyloaminomaślan), pochodna aminokwasowa, która powstaje z lizyny i metioniny w wątrobie i nerkach, pełni rolę nośnika długołańcuchowych kwasów tłuszczowych przez błonę wewnętrzną mitochondrium. 3 3 N acylo-oa oa 3 3 N R karnityna acylokarnityna Wśród aminokwasów niebiałkowych są takie, które ujawniają aktywność hormonów tarczycy, mianowicie 3,5,3 -trijodotyronina (T 3 ) i tyroksyna, czyli 3,5,3 5 -tetrajodotyronina (T 4 ), które powstają z aminokwasu białkowego tyrozyny. J J J J J N 3 J J 3,5,3 -trijodotyronina tyroksyna N 3 230
11 Niektóre aminokwasy niebiałkowe są antybiotykami, produkowanymi przez niektóre szczepy bakterii, np. chloramfenikol, cykloseryna (4-amino-3-izooksazolidynon) i azaseryna (3-(diazoacetyloksy)alanina lub diazooctan seryny). N 2 - N l 2 N 2-3 N - N 3 N N 2 chloramfenikol cykloseryna azaseryna hloramfenikol jest antybiotykiem, który wytwarzają szczepy Streptomyces. ykloseryna i azaseryna są antybiotykami pochodzącymi z seryny. Azaseryna hamuje wzrost tkanki nowotworowej. AMINY BIGENNE Aminy biogenne, to pochodne aminokwasów, które są związkami o róŝnych funkcjach biologicznych, wśród nich są przede wszystkim substancje o charakterze hormonalnym, ale równieŝ o własnościach toksycznych. Aminy biogenne powstają w reakcji dekarboksylacji aminokwasów obojętnych lub zasadowych. Monoaminy pierwszorzędowe powstają z aminokwasów obojętnych, natomiast z aminokwasów zasadowych diaminy pierwszorzędowe. Aminy biogenne dzieli się na: alifatyczne, fenolowe i heterocykliczne. Aminy alifatyczne dzieli się na monoaminy, diaminy i poliaminy. Monoaminą alifatyczną jest etanoloamina (kolamina), która występuje jako składnik kefalin kolaminowych, powstaje z seryny. 3 N - dekarboksylacja 3 N 2 seryna etanoloamina Inną monoaminą jest cysteamina, powstająca w wyniku reakcji dekarboksylacji cysteiny, waŝny składnik pantoteiny koenzymu A (oa) i AP (białka przenoszącego acyle kompleksu syntazy kwasów tłuszczowych). 231
12 Do diamin alifatycznych naleŝą: 1,3-diaminopropan, kadaweryna (1,5-diaminopentan) i putrescyna (1,4-diaminobutan), które są związkami o właściwościach trujących. Stanowią powszechne produkty działania bakterii gnilnych i mają bardzo nieprzyjemny zapach. ząsteczki te powstają równieŝ w tkankach ssaków, gdzie występują jako składniki naturalnych poliamin. - 3 N 3 N dekarboksylacja N 3 N 3 lizyna kadaweryna - 3 N 3 N N 2 3 N 3 ornityna dekarboksylacja 2 putrescyna (1,4-diaminobutan) Naturalne poliaminy, spermidyna i spermina, są alifatycznymi polikationami, które asocjują odwracalnie z wewnątrzkomórkowymi polianionami, szczególnie z DNA i RNA. Wykazują działanie biologiczne, polegające na stymulacji syntezy DNA i RNA, wpływają na proliferację, wzrost i róŝnicowanie komórek oraz stymulują agregację rybosomów. Jednocześnie są inhibitorami niektórych enzymów, wśród nich kinaz białkowych. Farmakologiczne dawki poliamin obniŝają temperaturę i ciśnienie. spermidyna 3 N 2 N 2 2 1,3-diaminopropan N 3 putrescyna 232
13 spermina 3 N 2 2 N N N 3 1,3-diaminopropan putrescyna 2 1,3-diaminopropan Ponadto, poliaminy mogą być wbudowywane nieodwracalnie do białek w procesie modyfikacji postranslacyjnej, który prowadzi do specyficznego sieciowania białek. Modyfikacje z udziałem poliamin zmieniają właściwości i funkcje białek, np. stabilizują cytoszkielet komórki. Reakcje sieciowania białek katalizują transglutaminazy, które tworzą wiązanie γ-glutamyloaminowe między pierwszorzędową grupą aminową poliaminy, a resztą glutamylową białka. Aminy fenolowe to katecholaminy, czyli dopamina, noradrenalina i adrenalina. Powstają w rdzeniu nadnerczy z tyrozyny, po jej hydroksylacji do dopa, czyli dihydroksyfenyloalaniny. 3- β- 2 N
14 Dekarboksylacja dopa dostarcza dopaminy, czyli hydroksytyraminy, której atom węgla w łańcuchu bocznym jest utleniany poprzez przyłączenie tlenu, w wyniku czego powstaje noradrenalina. Metylacja noradrenaliny przekształca ją w adrenalinę. Dopamina wykazuje działanie biologiczne, jest hamującym neuroprzekaźnikiem. Noradrenalina, poza rdzeniem nadnerczy, powstaje i jest uwalniana jako neurotransmiter w zakończeniach włókien współczulnych, pozazwojowych, pod wpływem impulsów nerwowych. Jako hormon, jej działanie fizjologiczne jest słabsze niŝ adrenaliny i nie uczestniczy w regulacji glikogenolizy, czyli rozpadu glikogenu. Adrenalina jest hormonem metabolizmu cukrowców, który przyczynia się do aktywacji glikogenolizy w wątrobie, prowadzącej do wzrostu stęŝenia glukozy we krwi. Jest hormonem wymaganym do szybkiej reakcji w nagłych przypadkach stresowych. Pobudza akcję serca i zwęŝa naczynia krwionośne obwodowe, czego konsekwencją jest wzrost ciśnienia krwi w obiegu duŝym. Rozszerza natomiast naczynia wieńcowe, zabezpieczając w ten sposób zwiększony przepływ przez nie krwi. Jednocześnie wzmaga czynności oddechowe, rozszerzając oskrzela. Adrenalina naśladuje skutki pobudzenia współczulnej części układu wegetatywnego w danym narządzie. Wynikiem jej działania są reakcje walki, obrony lub ucieczki. Aminy heterocykliczne to aminy imidazolowe pochodne histydyny i aminy indolowe pochodne tryptofanu. istamina powstająca z histydyny odgrywa waŝną rolę w reakcjach alergicznych i stanach zapalnych. 3 N N N N histydyna dekarboksylacja 3 N 2 N histamina Produkują ją głównie bazofile i komórki tuczne, znajdujące się na terenie róŝnych narządów, szczególnie w tkankach uszkodzonych, np. skutkiem oparzenia, odmroŝenia lub zmiaŝdŝenia. istamina powstaje równieŝ pod wpływem bodźców psychicznych. Działanie biologiczne histaminy polega na rozszerzaniu naczyń krwionośnych włosowatych i obniŝaniu ciśnienia krwi. W błonie śluzowej Ŝołądka stymuluje wydzielanie protonów. Ponadto, wpływa znieczulająco na zakończenia czuciowych nerwów obwodowych. Właściwość ta została wykorzystana do produkcji maści znieczulających. Inaktywacja histaminy polega głównie na metylacji 234
15 jej atomu azotu w pierścieniu imidazolowym, najbardziej odległego od łańcucha bocznego. Indolowymi aminami heterocyklicznymi są serotonina, czyli 5-hydroksytryptamina i tryptamina. Tryptamina powstaje bezpośrednio z tryptofanu po jego dekarboksylacji. Serotonina równieŝ powstaje z tryptofanu, ale dopiero po jego 5- -hydroksylacji, a następnie dekarboksylacji. ~ 3 Serotonina jest stymulatorem skurczu mięśni gładkich i czynnikiem zwęŝającym naczynia krwionośne. Jest neuroprzekaźnikiem w niektórych synapsach w mózgu. Pochodną serotoniny jest melatonina powstająca w szyszynce w wyniku jej N-acetylacji i -metylacji grupy hydroksylowej przy 5. Melatonina powoduje skupianie barwnika w komórkach pigmentowych, melanocytach. Działa w tym zakresie antagonistycznie do intermedyny, czyli malanotropiny. Ponadto, melatonina hamuje wydzielanie gonadotropin poprzez wpływ hamujący na receptory liberyn. amuje funkcje jajników do okresu pokwitania, zapobiegając przedwczesnemu dojrzewaniu płciowemu. Synteza melatoniny odbywa się głównie w nocy, natomiast w dzień jest zablokowana pod wpływem światła. W krajach południowych, o duŝym nasłonecznieniu, wydzielanie melatoniny przez szyszynkę jest obniŝone. Niskie stęŝenie melatoniny w mniejszym stopniu hamuje uwalnianie gonadotropin, przypuszczalnie dlatego dojrzewanie płciowe młodzieŝy jest szybsze w tych krajach. 235
Aminotransferazy. Dehydrogenaza glutaminianowa. Szczawiooctan. Argininobursztynian. Inne aminokwasy. asparaginian. fumaran. Arginina.
 Inne aminokwasy Szczawiooctan Aminotransferazy asparaginian Cytrulina Argininobursztynian Cykl mocznikowy Arginina fumaran Ornityna Aminotransferazy -ketoglutaran karbamoilofosforan Mocznik kwas glutaminowy
Inne aminokwasy Szczawiooctan Aminotransferazy asparaginian Cytrulina Argininobursztynian Cykl mocznikowy Arginina fumaran Ornityna Aminotransferazy -ketoglutaran karbamoilofosforan Mocznik kwas glutaminowy
Metabolizm białek. Ogólny schemat metabolizmu bialek
 Metabolizm białek Ogólny schemat metabolizmu bialek Trawienie białek i absorpcja aminokwasów w przewodzie pokarmowym w żołądku (niskie ph ~2, rola HCl)- hydratacja, homogenizacja, denaturacja białek i
Metabolizm białek Ogólny schemat metabolizmu bialek Trawienie białek i absorpcja aminokwasów w przewodzie pokarmowym w żołądku (niskie ph ~2, rola HCl)- hydratacja, homogenizacja, denaturacja białek i
Przegląd budowy i funkcji białek
 Przegląd budowy i funkcji białek Co piszą o białkach? Wyraz wprowadzony przez Jönsa J. Berzeliusa w 1883 r. w celu podkreślenia znaczenia tej grupy związków. Termin pochodzi od greckiego słowa proteios,
Przegląd budowy i funkcji białek Co piszą o białkach? Wyraz wprowadzony przez Jönsa J. Berzeliusa w 1883 r. w celu podkreślenia znaczenia tej grupy związków. Termin pochodzi od greckiego słowa proteios,
46 i 47. Wstęp do chemii -aminokwasów
 46 i 47. Wstęp do chemii -aminokwasów Chemia rganiczna, dr hab. inż. Mariola Koszytkowska-Stawińska, WChem PW; 2017/2018 1 21.1. Budowa ogólna -aminokwasów i klasyfikacja peptydów H 2 H H 2 R H R R 1 H
46 i 47. Wstęp do chemii -aminokwasów Chemia rganiczna, dr hab. inż. Mariola Koszytkowska-Stawińska, WChem PW; 2017/2018 1 21.1. Budowa ogólna -aminokwasów i klasyfikacja peptydów H 2 H H 2 R H R R 1 H
Materiały pochodzą z Platformy Edukacyjnej Portalu www.szkolnictwo.pl
 Materiały pochodzą z Platformy Edukacyjnej Portalu www.szkolnictwo.pl Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą byd wykorzystywane przez jego Użytkowników
Materiały pochodzą z Platformy Edukacyjnej Portalu www.szkolnictwo.pl Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą byd wykorzystywane przez jego Użytkowników
21. Wstęp do chemii a-aminokwasów
 21. Wstęp do chemii a-aminokwasów Chemia rganiczna, dr hab. inż. Mariola Koszytkowska-Stawińska, WChem PW; 2016/2017 1 21.1. Budowa ogólna a-aminokwasów i klasyfikacja peptydów H 2 N H kwas 2-aminooctowy
21. Wstęp do chemii a-aminokwasów Chemia rganiczna, dr hab. inż. Mariola Koszytkowska-Stawińska, WChem PW; 2016/2017 1 21.1. Budowa ogólna a-aminokwasów i klasyfikacja peptydów H 2 N H kwas 2-aminooctowy
Aminokwasy, peptydy, białka
 Aminokwasy, peptydy, białka Aminokwasy KWAS 1-AMINOCYKLOPROPANOKARBOKSYLOWY α AMINOKWAS KWAS 3-AMINOPROPANOWY β AMINOKWAS KWAS 4-AMINOPROPANOWY γ AMINOKWAS KWAS 2-AMINOETANOSULFONOWY β AMINOKWAS Aminokwasy
Aminokwasy, peptydy, białka Aminokwasy KWAS 1-AMINOCYKLOPROPANOKARBOKSYLOWY α AMINOKWAS KWAS 3-AMINOPROPANOWY β AMINOKWAS KWAS 4-AMINOPROPANOWY γ AMINOKWAS KWAS 2-AMINOETANOSULFONOWY β AMINOKWAS Aminokwasy
Informacje. W sprawach organizacyjnych Slajdy z wykładów
 Biochemia Informacje W sprawach organizacyjnych malgorzata.dutkiewicz@wum.edu.pl Slajdy z wykładów www.takao.pl W sprawach merytorycznych Takao Ishikawa (takao@biol.uw.edu.pl) Kiedy? Co? Kto? 24 lutego
Biochemia Informacje W sprawach organizacyjnych malgorzata.dutkiewicz@wum.edu.pl Slajdy z wykładów www.takao.pl W sprawach merytorycznych Takao Ishikawa (takao@biol.uw.edu.pl) Kiedy? Co? Kto? 24 lutego
Ćwiczenie 4. Reakcja aminokwasów z ninhydryną. Opisz typy reakcji przebiegających w tym procesie i zaznacz ich miejsca przebiegu.
 azwisko i imię grupa data Protokół z ćwiczenia: eakcje chemiczne związków biologicznych: aminokwasy i peptydy. Definicja punktu izoelektrycznego pi. Formy jonowe aminokwasów w różnym ph. ph < pi ph = pi
azwisko i imię grupa data Protokół z ćwiczenia: eakcje chemiczne związków biologicznych: aminokwasy i peptydy. Definicja punktu izoelektrycznego pi. Formy jonowe aminokwasów w różnym ph. ph < pi ph = pi
Aminokwasy. COO - l. H 3 N C H l R
 Aminokwasy COO - l + H 3 N C H l R Aminokwasy hydrofobowe z alifatycznymi grupami R glicyna alanina walina leucyna izoleucyna prolina metionina cysteina Aminokwasy hydrofobowe z aromatycznymi grupami R
Aminokwasy COO - l + H 3 N C H l R Aminokwasy hydrofobowe z alifatycznymi grupami R glicyna alanina walina leucyna izoleucyna prolina metionina cysteina Aminokwasy hydrofobowe z aromatycznymi grupami R
Slajd 1. Slajd 2. Proteiny. Peptydy i białka są polimerami aminokwasów połączonych wiązaniem amidowym (peptydowym) Kwas α-aminokarboksylowy aminokwas
 Slajd 1 Proteiny Slajd 2 Peptydy i białka są polimerami aminokwasów połączonych wiązaniem amidowym (peptydowym) wiązanie amidowe Kwas α-aminokarboksylowy aminokwas Slajd 3 Aminokwasy z alifatycznym łańcuchem
Slajd 1 Proteiny Slajd 2 Peptydy i białka są polimerami aminokwasów połączonych wiązaniem amidowym (peptydowym) wiązanie amidowe Kwas α-aminokarboksylowy aminokwas Slajd 3 Aminokwasy z alifatycznym łańcuchem
Chemiczne składniki komórek
 Chemiczne składniki komórek Pierwiastki chemiczne w komórkach: - makroelementy (pierwiastki biogenne) H, O, C, N, S, P Ca, Mg, K, Na, Cl >1% suchej masy - mikroelementy Fe, Cu, Mn, Mo, B, Zn, Co, J, F
Chemiczne składniki komórek Pierwiastki chemiczne w komórkach: - makroelementy (pierwiastki biogenne) H, O, C, N, S, P Ca, Mg, K, Na, Cl >1% suchej masy - mikroelementy Fe, Cu, Mn, Mo, B, Zn, Co, J, F
protos (gr.) pierwszy protein/proteins (ang.)
 Białka 1 protos (gr.) pierwszy protein/proteins (ang.) cząsteczki życia materiał budulcowy materii ożywionej oraz wirusów wielkocząsteczkowe biopolimery o masie od kilku tysięcy do kilku milionów jednostek
Białka 1 protos (gr.) pierwszy protein/proteins (ang.) cząsteczki życia materiał budulcowy materii ożywionej oraz wirusów wielkocząsteczkowe biopolimery o masie od kilku tysięcy do kilku milionów jednostek
etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
 Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
Temat: Białka Aminy Pochodne węglowodorów zawierające grupę NH 2 Wzór ogólny amin: R NH 2 Przykład: CH 3 -CH 2 -NH 2 etyloamina Aminy mają właściwości zasadowe i w roztworach kwaśnych tworzą jon alkinowy
WYKŁAD 4: MOLEKULARNE MECHANIZMY BIOSYNTEZY BIAŁEK. Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej.
 Pierwsza litera Trzecia litera 2018-10-26 WYKŁAD 4: MOLEKULARNE MECHANIZMY BIOSYNTEZY BIAŁEK Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Druga litera 1 Enancjomery para nienakładalnych
Pierwsza litera Trzecia litera 2018-10-26 WYKŁAD 4: MOLEKULARNE MECHANIZMY BIOSYNTEZY BIAŁEK Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Druga litera 1 Enancjomery para nienakładalnych
IZOMERIA Izomery - związki o takim samym składzie lecz różniące się budową
 IZMERIA Izomery - związki o takim samym składzie lecz różniące się budową TAK zy atomy są tak samo połączone? NIE izomery konstytucyjne stereoizomery zy odbicie lustrzane daje się nałożyć na cząsteczkę?
IZMERIA Izomery - związki o takim samym składzie lecz różniące się budową TAK zy atomy są tak samo połączone? NIE izomery konstytucyjne stereoizomery zy odbicie lustrzane daje się nałożyć na cząsteczkę?
Aminokwasy, peptydy i białka. Związki wielofunkcyjne
 Aminokwasy, peptydy i białka Związki wielofunkcyjne Aminokwasy, peptydy i białka Aminokwasy, peptydy i białka: - wiadomości ogólne Aminokwasy: - ogólna charakterystyka - budowa i nazewnictwo - właściwości
Aminokwasy, peptydy i białka Związki wielofunkcyjne Aminokwasy, peptydy i białka Aminokwasy, peptydy i białka: - wiadomości ogólne Aminokwasy: - ogólna charakterystyka - budowa i nazewnictwo - właściwości
Created by Neevia Document Converter trial version
 TEST VII PRZEMIANA AMINOKWASÓW 1. Aminokwasy egzogenne (niezbędne) dla człowieka to: c) trzy d) cztery (+) (1, 2, 3, 5) e) pięć: 1 Leu 2 Met 3 Trp 4 Cys 5 Phe 6 Asp 2. Aminokwasami niezbędnymi dla człowieka
TEST VII PRZEMIANA AMINOKWASÓW 1. Aminokwasy egzogenne (niezbędne) dla człowieka to: c) trzy d) cztery (+) (1, 2, 3, 5) e) pięć: 1 Leu 2 Met 3 Trp 4 Cys 5 Phe 6 Asp 2. Aminokwasami niezbędnymi dla człowieka
1.1. AMINOKWASY BIAŁKOWE
 1 ĆWICZENIE 1 BUDOWA I WŁAŚCIWOŚCI AMINOKWASÓW 1.1. AMINOKWASY BIAŁKOWE Aminokwasy są związkami organicznymi zawierającymi co najmniej jedną grupę karboksylową -COOH oraz co najmniej jedną grupę aminową
1 ĆWICZENIE 1 BUDOWA I WŁAŚCIWOŚCI AMINOKWASÓW 1.1. AMINOKWASY BIAŁKOWE Aminokwasy są związkami organicznymi zawierającymi co najmniej jedną grupę karboksylową -COOH oraz co najmniej jedną grupę aminową
AMINOKWASY. I. Wprowadzenie teoretyczne. Aminokwasy są to związki, które w łańcuchu węglowym zawierają zarówno grupę aminową jak i grupę karboksylową.
 AMIKWASY I. Wprowadzenie teoretyczne Aminokwasy są to związki, które w łańcuchu węglowym zawierają zarówno grupę aminową jak i grupę karboksylową. 2 3 WZY GÓLE ATUALY AMIKWASÓW WYSTĘPUJĄY W BIAŁKA Zalicza
AMIKWASY I. Wprowadzenie teoretyczne Aminokwasy są to związki, które w łańcuchu węglowym zawierają zarówno grupę aminową jak i grupę karboksylową. 2 3 WZY GÓLE ATUALY AMIKWASÓW WYSTĘPUJĄY W BIAŁKA Zalicza
Budowa aminokwasów i białek
 Biofizyka Ćwiczenia 1. E. Banachowicz Zakład Biofizyki Molekularnej IF UAM http://www.amu.edu.pl/~ewas Budowa aminokwasów i białek E.Banachowicz 1 Ogólna budowa aminokwasów α w neutralnym p α N 2 COO N
Biofizyka Ćwiczenia 1. E. Banachowicz Zakład Biofizyki Molekularnej IF UAM http://www.amu.edu.pl/~ewas Budowa aminokwasów i białek E.Banachowicz 1 Ogólna budowa aminokwasów α w neutralnym p α N 2 COO N
Właściwości aminokwasów i białek
 Właściwości aminokwasów i białek el ćwiczenia Ćwiczenie ma na celu poznanie niektórych typowych reakcji aminokwasów i białek. Reakcje te pozwalają odróżnić wolne aminokwasy od białek i innych związków
Właściwości aminokwasów i białek el ćwiczenia Ćwiczenie ma na celu poznanie niektórych typowych reakcji aminokwasów i białek. Reakcje te pozwalają odróżnić wolne aminokwasy od białek i innych związków
Budowa i funkcje białek
 Budowa i funkcje białek Białka Wszystkie organizmy zawierają białko Każdy organizm wytwarza własne białka Podstawowe składniki białek - aminokwasy Roślinne mogą wytwarzać aminokwasy ze związków nieorganicznych
Budowa i funkcje białek Białka Wszystkie organizmy zawierają białko Każdy organizm wytwarza własne białka Podstawowe składniki białek - aminokwasy Roślinne mogą wytwarzać aminokwasy ze związków nieorganicznych
Ćwiczenie nr 7. Aminokwasy i peptydy. Repetytorium. Repetytorium
 Repetytorium Ćwiczenie nr 7 dr Mariola Krawiecka Aminokwasy i peptydy 1. Podział aminokwasów. 2. Właściwości aminokwasów-aminokwasy jako jony obojnacze. 3. Reaktywność aminokwasów. 4. Biologicznie ważne
Repetytorium Ćwiczenie nr 7 dr Mariola Krawiecka Aminokwasy i peptydy 1. Podział aminokwasów. 2. Właściwości aminokwasów-aminokwasy jako jony obojnacze. 3. Reaktywność aminokwasów. 4. Biologicznie ważne
BUDOWA I WŁAŚCIWOŚCI AMINOKWASÓW. 1.1. Aminokwasy białkowe
 BUDOWA I WŁAŚCIWOŚCI AMINOKWASÓW 1.1. Aminokwasy białkowe Aminokwasy są związkami organicznymi, zawierającymi co najmniej jedną grupę karboksylową COOH oraz co najmniej jedną grupę aminową NH 2. W zależności
BUDOWA I WŁAŚCIWOŚCI AMINOKWASÓW 1.1. Aminokwasy białkowe Aminokwasy są związkami organicznymi, zawierającymi co najmniej jedną grupę karboksylową COOH oraz co najmniej jedną grupę aminową NH 2. W zależności
Ćwiczenie 1. Właściwości aminokwasów i białek
 Ćwiczenie 1. Właściwości aminokwasów i białek el ćwiczenia elem ćwiczenia jest poznanie niektórych reakcji charakterystycznych stosowanych przy wykrywaniu aminokwasów i białek. eakcje te umoŝliwiają odróŝnienie
Ćwiczenie 1. Właściwości aminokwasów i białek el ćwiczenia elem ćwiczenia jest poznanie niektórych reakcji charakterystycznych stosowanych przy wykrywaniu aminokwasów i białek. eakcje te umoŝliwiają odróŝnienie
spektroskopia elektronowa (UV-vis)
 spektroskopia elektronowa (UV-vis) rodzaje przejść elektronowych Energia σ* π* 3 n 3 π σ σ σ* daleki nadfiolet (λ max < 200 nm) π π* bliski nadfiolet jednostki energii atomowa jednostka energii = energia
spektroskopia elektronowa (UV-vis) rodzaje przejść elektronowych Energia σ* π* 3 n 3 π σ σ σ* daleki nadfiolet (λ max < 200 nm) π π* bliski nadfiolet jednostki energii atomowa jednostka energii = energia
Profil metaboliczny róŝnych organów ciała
 Profil metaboliczny róŝnych organów ciała Uwaga: tkanka tłuszczowa (adipose tissue) NIE wykorzystuje glicerolu do biosyntezy triacylogliceroli Endo-, para-, i autokrynna droga przekazu informacji biologicznej.
Profil metaboliczny róŝnych organów ciała Uwaga: tkanka tłuszczowa (adipose tissue) NIE wykorzystuje glicerolu do biosyntezy triacylogliceroli Endo-, para-, i autokrynna droga przekazu informacji biologicznej.
Ćwiczenie 6 Aminokwasy
 Ćwiczenie 6 Aminokwasy Aminokwasy są to związki dwufunkcyjne, których cząsteczki zawierają grupy karboksylowe i aminowe: grupa aminowa:nh 2 grupa karboksylowa COOH Nomenklatura aminokwasów: Naturalne aminokwasy
Ćwiczenie 6 Aminokwasy Aminokwasy są to związki dwufunkcyjne, których cząsteczki zawierają grupy karboksylowe i aminowe: grupa aminowa:nh 2 grupa karboksylowa COOH Nomenklatura aminokwasów: Naturalne aminokwasy
Związki biologicznie aktywne
 Związki biologicznie aktywne Tematyka wykładów 1. Chemia związków biologicznie aktywnych pojęcia ogólne, klasyfikacja leków. 2. Związki biologicznie aktywne jako związki pochodzenia naturalnego, półsyntetycznego
Związki biologicznie aktywne Tematyka wykładów 1. Chemia związków biologicznie aktywnych pojęcia ogólne, klasyfikacja leków. 2. Związki biologicznie aktywne jako związki pochodzenia naturalnego, półsyntetycznego
Bliskie spotkania z biologią METABOLIZM. dr hab. Joanna Moraczewska, prof. UKW. Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki
 Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
Białka Aminokwasy Przemiany
 Białka Aminokwasy Przemiany Profil białkowy osocza Oznaczanie osoczowego stężenia białka i profili białkowych ma duże znaczenie diagnostyczne. Pierwszym sygnałem jest zwykle zmiana stosunku Albuminy:Globuliny.
Białka Aminokwasy Przemiany Profil białkowy osocza Oznaczanie osoczowego stężenia białka i profili białkowych ma duże znaczenie diagnostyczne. Pierwszym sygnałem jest zwykle zmiana stosunku Albuminy:Globuliny.
Przemiana materii i energii - Biologia.net.pl
 Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
Substancje o Znaczeniu Biologicznym
 Substancje o Znaczeniu Biologicznym Tłuszcze Jadalne są to tłuszcze, które może spożywać człowiek. Stanowią ważny, wysokoenergetyczny składnik diety. Z chemicznego punktu widzenia głównym składnikiem tłuszczów
Substancje o Znaczeniu Biologicznym Tłuszcze Jadalne są to tłuszcze, które może spożywać człowiek. Stanowią ważny, wysokoenergetyczny składnik diety. Z chemicznego punktu widzenia głównym składnikiem tłuszczów
Spis treści. CZĘŚĆ I: Budowa i funkcja białek. CZĘŚĆ II: Bioenergetyka i metabolizm weglowodanów. CZĘŚĆ IV: Metabolizm azotu
 Spis treści ZĘŚĆ I: Budowa i funkcja białek Rozdział 1: Aminokwasy.....................................................................1 Rozdział 2: Struktura białek.................................................................15
Spis treści ZĘŚĆ I: Budowa i funkcja białek Rozdział 1: Aminokwasy.....................................................................1 Rozdział 2: Struktura białek.................................................................15
Repetytorium z wybranych zagadnień z chemii
 Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Repetytorium z wybranych zagadnień z chemii Mol jest to liczebność materii występująca, gdy liczba cząstek (elementów) układu jest równa liczbie atomów zawartych w masie 12 g węgla 12 C (równa liczbie
Czy białka zbudowane są tylko z 20 rodzajów aminokwasów?
 Czy białka zbudowane są tylko z 20 rodzajów aminokwasów? mgr Adrian Jasiński Seminarium Zakładu Biofizyki i Fizyki Medycznej Plan prezentacji Wstęp Niestandardowe aminokwasy Wariacje standardowego kodu
Czy białka zbudowane są tylko z 20 rodzajów aminokwasów? mgr Adrian Jasiński Seminarium Zakładu Biofizyki i Fizyki Medycznej Plan prezentacji Wstęp Niestandardowe aminokwasy Wariacje standardowego kodu
ĆWICZENIE 1 BUDOWA I WŁAŚCIWOŚCI AMINOKWASÓW
 ĆWICZENIE 1 BUDWA I WŁAŚCIWŚCI AMINKWASÓW 1.1. CEL ĆWICZENIA Zapoznanie się z budową i właściwościami aminokwasów i białek. Identyfikacja aminokwasów za pomocą reakcji charakterystycznych. 1.2. AMINKWASY
ĆWICZENIE 1 BUDWA I WŁAŚCIWŚCI AMINKWASÓW 1.1. CEL ĆWICZENIA Zapoznanie się z budową i właściwościami aminokwasów i białek. Identyfikacja aminokwasów za pomocą reakcji charakterystycznych. 1.2. AMINKWASY
Miarą zwiększenia lub utraty zasobu białek organizmu jest BILANS AZOTOWY:
 Aminokwasy Miarą zwiększenia lub utraty zasobu białek organizmu jest BILANS AZOTOWY: STAN RÓWNOWAGI AZOTOWEJ ilość azotu białkowego pobranego z pokarmem = ilość azotu wydalonego DODATNI występuje u rosnących
Aminokwasy Miarą zwiększenia lub utraty zasobu białek organizmu jest BILANS AZOTOWY: STAN RÓWNOWAGI AZOTOWEJ ilość azotu białkowego pobranego z pokarmem = ilość azotu wydalonego DODATNI występuje u rosnących
Reakcje charakterystyczne aminokwasów
 KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Reakcje charakterystyczne aminokwasów BIOCHEMIA STRUKTURALNA ĆWICZENIE 1 REAKCJE CHARAKTERYSTYCZNE AMINOKWASÓW A) REAKCJE OGÓLNE ZADANIE 1 WYKRYWANIE
KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Reakcje charakterystyczne aminokwasów BIOCHEMIA STRUKTURALNA ĆWICZENIE 1 REAKCJE CHARAKTERYSTYCZNE AMINOKWASÓW A) REAKCJE OGÓLNE ZADANIE 1 WYKRYWANIE
Chemia organiczna. Aminokwasy. Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego
 Chemia organiczna Aminokwasy Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego 1 Aminokwasy aminokwasy zawierają przynajmniej jedną grupę aminową i jedną karboksylową wzajemne ułożenie grupy
Chemia organiczna Aminokwasy Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego 1 Aminokwasy aminokwasy zawierają przynajmniej jedną grupę aminową i jedną karboksylową wzajemne ułożenie grupy
Nukleotydy w układach biologicznych
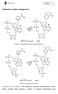 Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
Bioinformatyka. z sylabusu... (wykład monograficzny) wykład 1. E. Banachowicz. Wykład monograficzny Bioinformatyka.
 Bioinformatyka (wykład monograficzny) wykład 1. E. Banachowicz Zakład Biofizyki Molekularnej IF UAM http://www.amu.edu.pl/~ewas z sylabusu... Wykład 1, 2006 1 Co to jest Bioinformatyka? Zastosowanie technologii
Bioinformatyka (wykład monograficzny) wykład 1. E. Banachowicz Zakład Biofizyki Molekularnej IF UAM http://www.amu.edu.pl/~ewas z sylabusu... Wykład 1, 2006 1 Co to jest Bioinformatyka? Zastosowanie technologii
Spis treści. 1. Wiadomości wstępne Skład chemiczny i funkcje komórki Przedmowa do wydania czternastego... 13
 Przedmowa do wydania czternastego... 13 Częściej stosowane skróty... 15 1. Wiadomości wstępne... 19 1.1. Rys historyczny i pojęcia podstawowe... 19 1.2. Znaczenie biochemii w naukach rolniczych... 22 2.
Przedmowa do wydania czternastego... 13 Częściej stosowane skróty... 15 1. Wiadomości wstępne... 19 1.1. Rys historyczny i pojęcia podstawowe... 19 1.2. Znaczenie biochemii w naukach rolniczych... 22 2.
AMINOKWASY. BUDOWA I WŁAŚCIWOŚCI
 Ćwiczenie 1 AMINOKWASY. BUDOWA I WŁAŚCIWOŚCI Część doświadczalna obejmuje: rozdział aminokwasów metodą chromatografii podziałowej (technika chromatografii bibułowej wstępującej) wykonanie reakcji charakterystycznych
Ćwiczenie 1 AMINOKWASY. BUDOWA I WŁAŚCIWOŚCI Część doświadczalna obejmuje: rozdział aminokwasów metodą chromatografii podziałowej (technika chromatografii bibułowej wstępującej) wykonanie reakcji charakterystycznych
Elementy bioinformatyki. Aminokwasy, białka, receptory. Andrzej Bąk Instytut Chemii UŚ chemoinformatyka wykład 1
 Elementy bioinformatyki. Aminokwasy, białka, receptory Andrzej Bąk Instytut Chemii UŚ chemoinformatyka wykład 1 Tematy istoria odkrywania białek Budowa białek Budowa aminokwasów Właściwości aminokwasów
Elementy bioinformatyki. Aminokwasy, białka, receptory Andrzej Bąk Instytut Chemii UŚ chemoinformatyka wykład 1 Tematy istoria odkrywania białek Budowa białek Budowa aminokwasów Właściwości aminokwasów
AMINOKWASY BUDOWA I WŁAŚCIWOŚCI BIAŁKA BUDOWA I FUNKCJE
 Ćwiczenie 1 AMINOKWASY BUDOWA I WŁAŚCIWOŚCI BIAŁKA BUDOWA I FUNKCJE Część doświadczalna obejmuje: rozdział aminokwasów metodą chromatografii podziałowej (technika chromatografii bibułowej wstępującej)
Ćwiczenie 1 AMINOKWASY BUDOWA I WŁAŚCIWOŚCI BIAŁKA BUDOWA I FUNKCJE Część doświadczalna obejmuje: rozdział aminokwasów metodą chromatografii podziałowej (technika chromatografii bibułowej wstępującej)
Reakcje charakterystyczne aminokwasów
 KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Reakcje charakterystyczne aminokwasów BIOCHEMIA STRUKTURALNA ĆWICZENIE 1 REAKCJE CHARAKTERYSTYCZNE AMINOKWASÓW A) REAKCJE OGÓLNE ZADANIE 1 WYKRYWANIE
KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska Reakcje charakterystyczne aminokwasów BIOCHEMIA STRUKTURALNA ĆWICZENIE 1 REAKCJE CHARAKTERYSTYCZNE AMINOKWASÓW A) REAKCJE OGÓLNE ZADANIE 1 WYKRYWANIE
SEMINARIUM 8:
 SEMINARIUM 8: 24.11. 2016 Mikroelementy i pierwiastki śladowe, definicje, udział w metabolizmie ustroju reakcje biochemiczne zależne od aktywacji/inhibicji przy udziale mikroelementów i pierwiastków śladowych,
SEMINARIUM 8: 24.11. 2016 Mikroelementy i pierwiastki śladowe, definicje, udział w metabolizmie ustroju reakcje biochemiczne zależne od aktywacji/inhibicji przy udziale mikroelementów i pierwiastków śladowych,
Kwasy nukleinowe i białka
 Metody bioinformatyki Kwasy nukleinowe i białka prof. dr hab. Jan Mulawka Kwasy nukleinowe DNA Kwas dezoksyrybonukleinowy jest to należący do kwasów nukleinowych wielkocząsteczkowy organiczny związek chemiczny,
Metody bioinformatyki Kwasy nukleinowe i białka prof. dr hab. Jan Mulawka Kwasy nukleinowe DNA Kwas dezoksyrybonukleinowy jest to należący do kwasów nukleinowych wielkocząsteczkowy organiczny związek chemiczny,
Zastosowanie metody Lowry ego do oznaczenia białka w cukrze białym
 Zastosowanie metody Lowry ego do oznaczenia białka w cukrze białym Dr inż. Bożena Wnuk Mgr inż. Anna Wysocka Seminarium Aktualne zagadnienia dotyczące jakości w przemyśle cukrowniczym Łódź 10 11 czerwca
Zastosowanie metody Lowry ego do oznaczenia białka w cukrze białym Dr inż. Bożena Wnuk Mgr inż. Anna Wysocka Seminarium Aktualne zagadnienia dotyczące jakości w przemyśle cukrowniczym Łódź 10 11 czerwca
BADANIE WŁAŚCIWOŚCI FIZYKOCHEMICZNYCH AMINOKWASÓW
 BADANIE WŁAŚIWŚI FIZYKEMIZNY AMINKWASÓW IDENTYFIKAJA AMINKWASÓW BIAŁKA, JAK I WLNE AMINKWASY REAGUJĄ ZA PŚREDNITWEM GRUP: -N 2 I Z NINYDRYNĄ, DINITRFLURBENZENEM I KWASEM AZTWYM (III). WYSTĘPWANIE W STRUKTURZE
BADANIE WŁAŚIWŚI FIZYKEMIZNY AMINKWASÓW IDENTYFIKAJA AMINKWASÓW BIAŁKA, JAK I WLNE AMINKWASY REAGUJĄ ZA PŚREDNITWEM GRUP: -N 2 I Z NINYDRYNĄ, DINITRFLURBENZENEM I KWASEM AZTWYM (III). WYSTĘPWANIE W STRUKTURZE
Czy białka zbudowane są z 20 rodzajów aminokwasów? jak radzi sobie z tym problemem modelowanie molekularne.
 Czy białka zbudowane są z 20 rodzajów aminokwasów? jak radzi sobie z tym problemem modelowanie molekularne. mgr Adrian Jasiński Zespół Teoretycznej Biofizyki Molekularnej Plan prezentacji Wstęp Niestandardowe
Czy białka zbudowane są z 20 rodzajów aminokwasów? jak radzi sobie z tym problemem modelowanie molekularne. mgr Adrian Jasiński Zespół Teoretycznej Biofizyki Molekularnej Plan prezentacji Wstęp Niestandardowe
Integracja metabolizmu
 Integracja metabolizmu 1 Kluczowe związki w metabolizmie Glukozo- 6 -fosforan Pirogronian AcetyloCoA 2 Glukoza po wejściu do komórki ulega fosforylacji Metaboliczne przemiany glukozo- 6-fosforanu G-6-P
Integracja metabolizmu 1 Kluczowe związki w metabolizmie Glukozo- 6 -fosforan Pirogronian AcetyloCoA 2 Glukoza po wejściu do komórki ulega fosforylacji Metaboliczne przemiany glukozo- 6-fosforanu G-6-P
Program zajęć z biochemii dla studentów kierunku weterynaria I roku studiów na Wydziale Lekarskim UJ CM w roku akademickim 2013/2014
 Program zajęć z biochemii dla studentów kierunku weterynaria I roku studiów na Wydziale Lekarskim UJ CM w roku akademickim 2013/2014 S E M E S T R II Tydzień 1 24.02-28.02 2 03.03-07.03 3 10.03-14.03 Wykłady
Program zajęć z biochemii dla studentów kierunku weterynaria I roku studiów na Wydziale Lekarskim UJ CM w roku akademickim 2013/2014 S E M E S T R II Tydzień 1 24.02-28.02 2 03.03-07.03 3 10.03-14.03 Wykłady
AMINOKWASY. BUDOWA I WŁAŚCIWOŚCI
 Ćwiczenie 1 AMINOKWASY. BUDOWA I WŁAŚCIWOŚCI Część doświadczalna obejmuje: - rozdział aminokwasów metodą chromatografii podziałowej (technika chromatografii bibułowej wstępującej) - miareczkowanie alaniny
Ćwiczenie 1 AMINOKWASY. BUDOWA I WŁAŚCIWOŚCI Część doświadczalna obejmuje: - rozdział aminokwasów metodą chromatografii podziałowej (technika chromatografii bibułowej wstępującej) - miareczkowanie alaniny
Fizjologia człowieka
 Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Struktura i funkcja białek (I mgr)
 Struktura i funkcja białek (I mgr) Dr Filip Jeleń fj@protein.pl http://www.protein.pl/ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer Biochemia Carl Branden, John Tooze Introduction to Protein Structure
Struktura i funkcja białek (I mgr) Dr Filip Jeleń fj@protein.pl http://www.protein.pl/ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer Biochemia Carl Branden, John Tooze Introduction to Protein Structure
Rozdział 7 PRZEMIANA BIAŁEK
 Rozdział 7 PRZEMIAA BIAŁEK Przemiany białek mają zasadnicze znaczenie dla wszystkich procesów metabolicznych typowych dla żywej materii. Z punktu widzenia dialektyki samo zjawisko życia można uznać za
Rozdział 7 PRZEMIAA BIAŁEK Przemiany białek mają zasadnicze znaczenie dla wszystkich procesów metabolicznych typowych dla żywej materii. Z punktu widzenia dialektyki samo zjawisko życia można uznać za
Bliskie spotkania z biologią. METABOLIZM część II. dr hab. Joanna Moraczewska, prof. UKW
 Bliskie spotkania z biologią METABOLIZM część II dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki METABOLIZM KATABOLIZM - rozkład związków chemicznych
Bliskie spotkania z biologią METABOLIZM część II dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki METABOLIZM KATABOLIZM - rozkład związków chemicznych
Model : - SCITEC 100% Whey Protein Professional 920g
 Białka > Model : - Producent : Scitec 100% Whey Protein Professional - jest najwyższej jakości, wolnym od laktozy, czystym koncentratem i izolat białek serwatkowych (WPC + WPI) o bardzo dobrej rozpuszczalności
Białka > Model : - Producent : Scitec 100% Whey Protein Professional - jest najwyższej jakości, wolnym od laktozy, czystym koncentratem i izolat białek serwatkowych (WPC + WPI) o bardzo dobrej rozpuszczalności
Aminokwasy Peptydy Białka
 Aminokwasy Peptydy Białka Podręczniki Bańkowski Biochemia zwierząt Malinowska Biochemia zwierząt Minakowski Biochemia kręgowców Filipowicz, Więckowski Biochemia t.i Biochemia Harpera Stryer Biochemia Lehninger
Aminokwasy Peptydy Białka Podręczniki Bańkowski Biochemia zwierząt Malinowska Biochemia zwierząt Minakowski Biochemia kręgowców Filipowicz, Więckowski Biochemia t.i Biochemia Harpera Stryer Biochemia Lehninger
data Wstęp merytoryczny
 Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 4 ANALIZA JAKOŚCIOWA AMINOKWASÓW Wstęp merytoryczny Aminokwasy (kwasy aminowe) to grupa organicznych związków zawierających
Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 4 ANALIZA JAKOŚCIOWA AMINOKWASÓW Wstęp merytoryczny Aminokwasy (kwasy aminowe) to grupa organicznych związków zawierających
Metabolizm wysiłkowy białek. Zajęcia nr 2
 Metabolizm wysiłkowy białek Zajęcia nr 2 Źródła aminokwasów białko pokarmowe aminokwasy Hydroliza w przewodzie pokarmowym krew aminokwasy synteza białko mięsień Trawienie białek w przewodzie pokarmowym
Metabolizm wysiłkowy białek Zajęcia nr 2 Źródła aminokwasów białko pokarmowe aminokwasy Hydroliza w przewodzie pokarmowym krew aminokwasy synteza białko mięsień Trawienie białek w przewodzie pokarmowym
Chemia organiczna. Aminokwasy. Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego
 Chemia organiczna Aminokwasy Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego 1 Aminokwasy aminokwasy zawierają przynajmniej jedną grupę aminową i jedną karboksylową wzajemne ułożenie grupy
Chemia organiczna Aminokwasy Zakład Chemii Medycznej Pomorskiego Uniwersytetu Medycznego 1 Aminokwasy aminokwasy zawierają przynajmniej jedną grupę aminową i jedną karboksylową wzajemne ułożenie grupy
Zagadnienia do egzaminu z biochemii (studia niestacjonarne)
 Zagadnienia do egzaminu z biochemii (studia niestacjonarne) Aminokwasy, białka, cukry i ich metabolizm 1. Aminokwasy, wzór ogólny i charakterystyczne grupy. 2. Wiązanie peptydowe. 3. Białka, ich struktura.
Zagadnienia do egzaminu z biochemii (studia niestacjonarne) Aminokwasy, białka, cukry i ich metabolizm 1. Aminokwasy, wzór ogólny i charakterystyczne grupy. 2. Wiązanie peptydowe. 3. Białka, ich struktura.
Związki biologicznie czynne
 Związki biologicznie czynne Aminokwasy Antybiotyki Aminokwasy egzogenne: fenyloalanina histydyna izoleucyna leucyna lizyna metionina treonina tryptofan walina Aminokwasy endogenne: alanina arginina asparagina
Związki biologicznie czynne Aminokwasy Antybiotyki Aminokwasy egzogenne: fenyloalanina histydyna izoleucyna leucyna lizyna metionina treonina tryptofan walina Aminokwasy endogenne: alanina arginina asparagina
Analiza jakościowa wybranych aminokwasów
 Ćwiczenie 14 Analiza jakościowa wybranych aminokwasów I. Aminokwasy Aminokwasy są jednostkami strukturalnymi peptydów i białek. W swojej cząsteczce mają co najmniej 2 grupy funkcyjne: grupę aminową NH
Ćwiczenie 14 Analiza jakościowa wybranych aminokwasów I. Aminokwasy Aminokwasy są jednostkami strukturalnymi peptydów i białek. W swojej cząsteczce mają co najmniej 2 grupy funkcyjne: grupę aminową NH
Antyoksydanty pokarmowe a korzyści zdrowotne. dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW
 Antyoksydanty pokarmowe a korzyści zdrowotne dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW Warszawa, dn. 14.12.2016 wolne rodniki uszkodzone cząsteczki chemiczne w postaci wysoce
Antyoksydanty pokarmowe a korzyści zdrowotne dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW Warszawa, dn. 14.12.2016 wolne rodniki uszkodzone cząsteczki chemiczne w postaci wysoce
prof. dr hab. Maciej Ugorski Efekty kształcenia 2 Posiada podstawowe wiadomości z zakresu enzymologii BC_1A_W04
 BIOCHEMIA (BC) Kod przedmiotu Nazwa przedmiotu Kierunek Poziom studiów Profil Rodzaj przedmiotu Semestr studiów 2 ECTS 5 Formy zajęć Osoba odpowiedzialna za przedmiot Język Wymagania wstępne Skrócony opis
BIOCHEMIA (BC) Kod przedmiotu Nazwa przedmiotu Kierunek Poziom studiów Profil Rodzaj przedmiotu Semestr studiów 2 ECTS 5 Formy zajęć Osoba odpowiedzialna za przedmiot Język Wymagania wstępne Skrócony opis
Oznaczanie aktywności proteolitycznej trypsyny Zajęcia 3-godzinne część A, zajęcia 4-godzinne część A i B
 znaczanie aktywności proteolitycznej trypsyny Zajęcia 3-godzinne część A, zajęcia 4-godzinne część A i B el ćwiczenia elem ćwiczenia jest zapoznanie się z metodą oznaczania aktywności endopeptydaz na przykładzie
znaczanie aktywności proteolitycznej trypsyny Zajęcia 3-godzinne część A, zajęcia 4-godzinne część A i B el ćwiczenia elem ćwiczenia jest zapoznanie się z metodą oznaczania aktywności endopeptydaz na przykładzie
WĘGLOWODORY. Uczeń: Przykłady wymagań nadobowiązkowych Uczeń:
 WĘGLOWODORY Wymagania na ocenę dopuszczającą dostateczną dobrą bardzo dobrą pisze wzory sumaryczne, zna nazwy czterech początkowych węglowodorów nasyconych; zna pojęcie: szereg homologiczny; zna ogólny
WĘGLOWODORY Wymagania na ocenę dopuszczającą dostateczną dobrą bardzo dobrą pisze wzory sumaryczne, zna nazwy czterech początkowych węglowodorów nasyconych; zna pojęcie: szereg homologiczny; zna ogólny
Źródła energii dla mięśni. mgr. Joanna Misiorowska
 Źródła energii dla mięśni mgr. Joanna Misiorowska Skąd ta energia? Skurcz włókna mięśniowego wymaga nakładu energii w postaci ATP W zależności od czasu pracy mięśni, ATP może być uzyskiwany z różnych źródeł
Źródła energii dla mięśni mgr. Joanna Misiorowska Skąd ta energia? Skurcz włókna mięśniowego wymaga nakładu energii w postaci ATP W zależności od czasu pracy mięśni, ATP może być uzyskiwany z różnych źródeł
Cukry. C x H 2y O y lub C x (H 2 O) y
 Cukry Cukry organiczne związki chemiczne składające się z atomów węgla oraz wodoru i tlenu, zazwyczaj w stosunku H:O = 2:1. Zawierają liczne grupy hydroksylowe, karbonylowe a czasami mostki półacetalowe.
Cukry Cukry organiczne związki chemiczne składające się z atomów węgla oraz wodoru i tlenu, zazwyczaj w stosunku H:O = 2:1. Zawierają liczne grupy hydroksylowe, karbonylowe a czasami mostki półacetalowe.
Suplementy. Wilkasy 2014. Krzysztof Gawin
 Suplementy Wilkasy 2014 Krzysztof Gawin Suplementy diety - definicja Suplement diety jest środkiem spożywczym, którego celem jest uzupełnienie normalnej diety, będący skoncentrowanym źródłem witamin lub
Suplementy Wilkasy 2014 Krzysztof Gawin Suplementy diety - definicja Suplement diety jest środkiem spożywczym, którego celem jest uzupełnienie normalnej diety, będący skoncentrowanym źródłem witamin lub
Biochemia zwierząt - A. Malinowska
 Spis treści Biochemia zwierząt - A. Malinowska 1. Wstęp 1.1. Wpływ środowiska zewnętrznego na organizm zwierzęcy 1.2. Podstawowe składniki organizmu zwierzęcego 1.3. Woda 1.4. Składniki mineralne 1.4.1.
Spis treści Biochemia zwierząt - A. Malinowska 1. Wstęp 1.1. Wpływ środowiska zewnętrznego na organizm zwierzęcy 1.2. Podstawowe składniki organizmu zwierzęcego 1.3. Woda 1.4. Składniki mineralne 1.4.1.
Azotowe związki organiczne
 strona 1/1 Azotowe związki organiczne Krystyna Bogdanowicz-Szwed Procesy zachodzące w żywych organizmach są ściśle związane z chemią wielofunkcyjnych związków organicznych zawierających w swoich cząsteczkach
strona 1/1 Azotowe związki organiczne Krystyna Bogdanowicz-Szwed Procesy zachodzące w żywych organizmach są ściśle związane z chemią wielofunkcyjnych związków organicznych zawierających w swoich cząsteczkach
Droga impulsu nerwowego w organizmie człowieka
 Droga impulsu nerwowego w organizmie człowieka Impuls nerwowy Impuls nerwowy jest zjawiskiem elektrycznym zachodzącym na powierzchni komórki nerwowej i pełni podstawową rolę w przekazywaniu informacji
Droga impulsu nerwowego w organizmie człowieka Impuls nerwowy Impuls nerwowy jest zjawiskiem elektrycznym zachodzącym na powierzchni komórki nerwowej i pełni podstawową rolę w przekazywaniu informacji
Plan działania opracowała Anna Gajos
 Plan działania 15.09-15.10 opracowała Anna Gajos Jakie zagadnienia trzeba opanować z następujących działów: 1. Budowa chemiczna organizmów. 2. Budowa i funkcjonowanie komórki 3. Cykl komórkowy 4. Metabolizm
Plan działania 15.09-15.10 opracowała Anna Gajos Jakie zagadnienia trzeba opanować z następujących działów: 1. Budowa chemiczna organizmów. 2. Budowa i funkcjonowanie komórki 3. Cykl komórkowy 4. Metabolizm
właściwości i zalety
 właściwości i zalety Funkcje aminokwasów Kwas asparginowy, Treonina Kwas glutaminowy Arginina Cysteina, Histydyna Fenyloalanina Glicyna Alanina Lizyna Metionina Prolina i hydroksyprolina Seryna Tryptofan,
właściwości i zalety Funkcje aminokwasów Kwas asparginowy, Treonina Kwas glutaminowy Arginina Cysteina, Histydyna Fenyloalanina Glicyna Alanina Lizyna Metionina Prolina i hydroksyprolina Seryna Tryptofan,
ETYKIETA. Fitmax Easy GainMass proszek
 ETYKIETA Fitmax Easy GainMass proszek smak waniliowy, truskawkowy, czekoladowy Środek spożywczy zaspokajający zapotrzebowanie organizmu przy intensywnym wysiłku fizycznym, zwłaszcza sportowców. FitMax
ETYKIETA Fitmax Easy GainMass proszek smak waniliowy, truskawkowy, czekoladowy Środek spożywczy zaspokajający zapotrzebowanie organizmu przy intensywnym wysiłku fizycznym, zwłaszcza sportowców. FitMax
Układ wewnątrzwydzielniczy
 Układ wewnątrzwydzielniczy 1. Gruczoły dokrewne właściwe: przysadka mózgowa, szyszynka, gruczoł tarczowy, gruczoły przytarczyczne, nadnercza 2. Gruczoły dokrewne mieszane: trzustka, jajniki, jądra 3. Inne
Układ wewnątrzwydzielniczy 1. Gruczoły dokrewne właściwe: przysadka mózgowa, szyszynka, gruczoł tarczowy, gruczoły przytarczyczne, nadnercza 2. Gruczoły dokrewne mieszane: trzustka, jajniki, jądra 3. Inne
WHEY CORE BCAA Amino Mega Strong - 2,3kg + 500ml
 Utworzono: 2017-01-20 19:50:01 WHEY CORE 100 + BCAA Amino Mega Strong - 2,3kg + 500ml Cena produktu: 198,90 PLN 157,00 PLN Wyjątkowy w smaku koktajl proteinowy ze 100% białkiem serwatkowym (WPC, WPI) o
Utworzono: 2017-01-20 19:50:01 WHEY CORE 100 + BCAA Amino Mega Strong - 2,3kg + 500ml Cena produktu: 198,90 PLN 157,00 PLN Wyjątkowy w smaku koktajl proteinowy ze 100% białkiem serwatkowym (WPC, WPI) o
CORAZ BLIŻEJ ISTOTY ŻYCIA WERSJA A. imię i nazwisko :. klasa :.. ilość punktów :.
 CORAZ BLIŻEJ ISTOTY ŻYCIA WERSJA A imię i nazwisko :. klasa :.. ilość punktów :. Zadanie 1 Przeanalizuj schemat i wykonaj polecenia. a. Wymień cztery struktury występujące zarówno w komórce roślinnej,
CORAZ BLIŻEJ ISTOTY ŻYCIA WERSJA A imię i nazwisko :. klasa :.. ilość punktów :. Zadanie 1 Przeanalizuj schemat i wykonaj polecenia. a. Wymień cztery struktury występujące zarówno w komórce roślinnej,
(Tekst mający znaczenie dla EOG)
 L 53/134 PL 23.2.2018 ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) 2018/249 z dnia 15 lutego 2018 r. dotyczące na stosowanie tauryny, beta-alaniny, L-alaniny, L-argininy, kwasu L-asparaginowego, L-histydyny,
L 53/134 PL 23.2.2018 ROZPORZĄDZENIE WYKONAWCZE KOMISJI (UE) 2018/249 z dnia 15 lutego 2018 r. dotyczące na stosowanie tauryny, beta-alaniny, L-alaniny, L-argininy, kwasu L-asparaginowego, L-histydyny,
11. Związki heterocykliczne w codziennym życiu
 11. Związki heterocykliczne w codziennym życiu a podstawie: J. A. Joule, K. Mills eterocyclic chemistry at a glace, 2nd ed., Wiley 2013. S. Rolski Chemia środków leczniczych, wyd. III, PZWL 1968. Związki
11. Związki heterocykliczne w codziennym życiu a podstawie: J. A. Joule, K. Mills eterocyclic chemistry at a glace, 2nd ed., Wiley 2013. S. Rolski Chemia środków leczniczych, wyd. III, PZWL 1968. Związki
Makrocząsteczki. Przykłady makrocząsteczek naturalnych: -Polisacharydy skrobia, celuloza -Białka -Kwasy nukleinowe
 Makrocząsteczki Przykłady makrocząsteczek naturalnych: -Polisacharydy skrobia, celuloza -Białka -Kwasy nukleinowe Syntetyczne: -Elastomery bardzo duża elastyczność charakterystyczna dla gumy -Włókna długie,
Makrocząsteczki Przykłady makrocząsteczek naturalnych: -Polisacharydy skrobia, celuloza -Białka -Kwasy nukleinowe Syntetyczne: -Elastomery bardzo duża elastyczność charakterystyczna dla gumy -Włókna długie,
AMINOPRIM. ORGANICZNY STYMULATOR WZROSTU ROŚLIN nr.s-644/17
 AMINOPRIM ORGANICZNY STYMULATOR WZROSTU ROŚLIN nr.s-644/17 Każdy żywy organizm potrzebuje aminokwasów do wielu kluczowych procesów rozwoju m.in tworzenia komórek, witamin, białek Każda komórka roślinna
AMINOPRIM ORGANICZNY STYMULATOR WZROSTU ROŚLIN nr.s-644/17 Każdy żywy organizm potrzebuje aminokwasów do wielu kluczowych procesów rozwoju m.in tworzenia komórek, witamin, białek Każda komórka roślinna
REAKCJE CHARAKTERYSTYCZNE AMINOKWASÓW. 1. Deaminacja aminokwasów kwasem azotowym (III)
 11. REAKJE ARAKTERYSTYZE AMIKWASÓW 1. Deaminacja aminokwasów kwasem azotowym (III) Aminokwasy pod wpływem kwasu azotowego (III), tworzącego się wg reakcji pierwszej, ulegają reakcji deaminacji, której
11. REAKJE ARAKTERYSTYZE AMIKWASÓW 1. Deaminacja aminokwasów kwasem azotowym (III) Aminokwasy pod wpływem kwasu azotowego (III), tworzącego się wg reakcji pierwszej, ulegają reakcji deaminacji, której
Autonomiczny układ nerwowy - AUN
 Autonomiczny układ nerwowy - AUN AUN - różnice anatomiczne część współczulna część przywspółczulna włókna nerwowe tworzą odrębne nerwy (nerw trzewny większy) wchodzą w skład nerwów czaszkowych lub rdzeniowych
Autonomiczny układ nerwowy - AUN AUN - różnice anatomiczne część współczulna część przywspółczulna włókna nerwowe tworzą odrębne nerwy (nerw trzewny większy) wchodzą w skład nerwów czaszkowych lub rdzeniowych
Spis treści 1. Struktura elektronowa związków organicznych 2. Budowa przestrzenna cząsteczek związków organicznych
 Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Spis treści 1. Struktura elektronowa związków organicznych 13 2. Budowa przestrzenna cząsteczek związków organicznych 19 2.1. Zadania... 28 3. Zastosowanie metod spektroskopowych do ustalania struktury
Chemiczne składniki komórek
 Chemiczne składniki komórek Komórki wykorzystują prawa fizyki i chemii, aby przeżyć Zbudowane z takich samych pierwiastków i związków jak materia nieożywiona Chemia komórki dominują: H 2 O związki organiczne
Chemiczne składniki komórek Komórki wykorzystują prawa fizyki i chemii, aby przeżyć Zbudowane z takich samych pierwiastków i związków jak materia nieożywiona Chemia komórki dominują: H 2 O związki organiczne
Fizjologia człowieka
 Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra Promocji Zdrowia Zakład Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra Promocji Zdrowia Zakład Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
TIENS L-Karnityna Plus
 TIENS L-Karnityna Plus Zawartość jednej kapsułki Winian L-Karnityny w proszku 400 mg L-Arginina 100 mg Niacyna (witamina PP) 16 mg Witamina B6 (pirydoksyna) 2.1 mg Stearynian magnezu pochodzenia roślinnego
TIENS L-Karnityna Plus Zawartość jednej kapsułki Winian L-Karnityny w proszku 400 mg L-Arginina 100 mg Niacyna (witamina PP) 16 mg Witamina B6 (pirydoksyna) 2.1 mg Stearynian magnezu pochodzenia roślinnego
Struktura biomakromolekuł chemia biologiczna III rok
 truktura biomakromolekuł chemia biologiczna III rok jak są zbudowane białka? dlaczego białka są tak zbudowane? co z tego wynika? 508 13 604 liczba struktur dostępnych w Protein Data Bank wynosi aktualnie
truktura biomakromolekuł chemia biologiczna III rok jak są zbudowane białka? dlaczego białka są tak zbudowane? co z tego wynika? 508 13 604 liczba struktur dostępnych w Protein Data Bank wynosi aktualnie
Addycje Nukleofilowe do Grupy Karbonylowej
 J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
J 1 Addycje kleofilowe do Grupy Karbonylowej H H +H H H Slides 1 to 29 J 2 Addycja vs Substytucja Atom w grupie karbonylowej (δ( + ) jest podatny na atak odczynnika nukleofilowego ; w zaleŝno ności od
Aminokwasy Peptydy Białka
 Aminokwasy Peptydy Białka Aminokwasy Związki organiczne pochodne kwasów karboksylowych zawierające grupę aminową NH 2 R - C - COOH H Reakcje grup funkcyjnych Deaminacja powstają ketokwasy Transaminacja
Aminokwasy Peptydy Białka Aminokwasy Związki organiczne pochodne kwasów karboksylowych zawierające grupę aminową NH 2 R - C - COOH H Reakcje grup funkcyjnych Deaminacja powstają ketokwasy Transaminacja
Wymagania edukacyjne z chemii oraz sposoby sprawdzania wiedzy i umiejętności
 Wymagania edukacyjne z chemii oraz sposoby sprawdzania wiedzy i umiejętności Kwasy Wymagania edukacyjne z podstawy programowej - klasa VIII Uczeń: definiuje pojęcie kwasy zgodnie z teorią Arrheniusa opisuje
Wymagania edukacyjne z chemii oraz sposoby sprawdzania wiedzy i umiejętności Kwasy Wymagania edukacyjne z podstawy programowej - klasa VIII Uczeń: definiuje pojęcie kwasy zgodnie z teorią Arrheniusa opisuje
Rewolucja kolagenowa
 Rewolucja kolagenowa Kolagen Najważniejsze białko ludzkiego organizmu Podstawowy budulec: skóry, paznokci, włosów, ścięgien, kości, stawów, chrząstek, rogówki oka, naczyń krwionośnych i limfatycznych Fundament
Rewolucja kolagenowa Kolagen Najważniejsze białko ludzkiego organizmu Podstawowy budulec: skóry, paznokci, włosów, ścięgien, kości, stawów, chrząstek, rogówki oka, naczyń krwionośnych i limfatycznych Fundament
TEST - BIOLOGIA WERONIKA GMURCZYK
 TEST - BIOLOGIA WERONIKA GMURCZYK Temat: Układ nerwowy i hormonalny Zadanie 1. Zaznacz poprawną odpowiedź. Co to są hormony? a) związki chemiczne wytwarzane w gruczołach łojowych, które regulują pracę
TEST - BIOLOGIA WERONIKA GMURCZYK Temat: Układ nerwowy i hormonalny Zadanie 1. Zaznacz poprawną odpowiedź. Co to są hormony? a) związki chemiczne wytwarzane w gruczołach łojowych, które regulują pracę
