RIDA QUICK IFX Monitoring GN3041. RIDA QUICK IFX Monitoring
|
|
|
- Paweł Laskowski
- 6 lat temu
- Przeglądów:
Transkrypt
1 RIDA QUICK IFX Monitoring GN3041 R-Biopharm AG, An der neuen Bergstraße 17, Darmstadt, Niemcy Tel.: +49 (0) / Faks: +49 (0) RIDA QUICK IFX Monitoring
2 Polski RIDA QUICK IFX Monitoring GN Przeznaczenie Do diagnostyki in vitro. Ten test jest oznaczeniem immunochromatograficznym przepływu bocznego, przeznaczonym do ilościowego wykrywania infliksymabu (IFX, Remicade ) w surowicy i osoczu krwi człowieka. 2. Podsumowanie i wyjaśnienie testu Terapeutyczne monitorowanie leku Infliksymab (IFX) jest chimerycznym terapeutycznym przeciwciałem monoklonalnym, które jest ukierunkowane na cytokinę prozapalną, TNFα. Wprowadzenie infliksymabu zrewolucjonizowało leczenie przewlekłych chorób zapalnych, takich jak nieswoiste zapalenie jelit (IBD), reumatoidalne zapalenie stawów (RZS) i zesztywniające zapalenie stawów kręgosłupa. Wiadomo, że infliksymab może wywołać głęboką remisję i poprawić jakość życia pacjenta. [1] Niektórzy pacjenci nie reagują na leczenie IFX po indukcji (pierwotny brak odpowiedzi), podczas gdy u innych dochodzi do utraty odpowiedzi z czasem (wtórna utrata odpowiedzi). [2] Lek może wywoływać efekt farmakologiczny wyłącznie po osiągnięciu odpowiednich stężeń w krążeniu. Stężenie infliksymabu w surowicy krwi tuż przed kolejnym wlewem, zdefiniowane jako stężenie minimalne, było wykorzystywane do terapeutycznego monitorowania leków (TDM). Niedawne dane dotyczące TDM wykazały, że dobra odpowiedź kliniczna jest związana z wystarczającymi stężeniami minimalnymi u pacjentów z IBD [3] oraz RZS [4, 5]. TDM może w związku z tym stanowić instrument umożliwiający optymalizację leczenia i wyeliminowanie problemu wtórnej utraty odpowiedzi. RIDA QUICK IFX Monitoring wykorzystuje bardzo swoiste przeciwciało monoklonalne (MA-IFX6B7), które zostało wyizolowane i scharakteryzowane w KU Leuven. [6] Test ten RIDA QUICK IFX Monitoring
3 wykrywa tylko infliksymab (Remicade ) oraz leki biopodobne, Remsima, Inflectra i Flixabi. [7] Nieswoiste zapalenie jelit Diagnostyczna wartość TDM u pacjentów z IBD została opisana poniżej zarówno w przypadku fazy terapii indukcyjnej, jak i fazy leczenia podtrzymującego. Faza leczenia indukcyjnego: Wykazano, że minimalne stężenia IFX w trakcie leczenia po(indukcyjnego) są związane z trwałą odpowiedzią kliniczną. [8, 9] Pomiar minimalnych stężeń infliksymabu w trakcie i bezpośrednio po fazie leczenia indukującego może pomóc zidentyfikować pacjentów poddanych zbyt małej ekspozycji oraz ułatwić optymalizację dawki indywidualnej. [10] Faza leczenia podtrzymującego: Wykazano, że u pacjentów, u których w trakcie fazy leczenia podtrzymującego występują trwałe stężenia infliksymabu istnieje większe prawdopodobieństwo pozostania w remisji niż u pacjentów z niewykrywalnymi stężeniami minimalnymi. [11] Regularne monitorowanie stężenia minimalnego w trakcie fazy leczenia podtrzymującego jest przydatne w celu optymalizacji schematu dawkowania oraz poprawy wyników leczenia. [12] W przypadku RIDA QUICK IFX Monitoring zalecane docelowe okno terapeutyczne stężenia minimalnego wynosi 3-7 µg/ml, zgodnie z algorytmem TAXIT. [12] Ponadto wykazano, że w przypadku pacjentów, którzy przestali reagować na IFX bardziej przydatna jest indywidualna modyfikacja leczenia na podstawie pomiarów stężenia IFX w surowicy krwi niż strategia empiryczna, która polega na wykorzystaniu innych opcji terapeutycznych. [13] Próbki pobrane od pacjentów w trakcie fazy leczenia indukcyjnego (zwykle w tygodniu 2. i tygodniu 6.) charakteryzują się zwykle wyższymi stężeniami minimalnymi niż próbki pobrane w fazie leczenia podtrzymującego (począwszy od tygodnia 12-14). W związku z tym zaleca się stosowanie większego rozcieńczenia w przypadku próbek pobranych od pacjentów w fazie leczenia indukującego. Immunogenność Wtórna utrata odpowiedzi wynika często z pojawienia się przeciwciał przeciwlekowych z powodu immunogennego charakteru leku. [14] W przypadku niewykrywalnych stężeń minimalnych późniejszy pomiar przeciwciał przeciwlekowych może być przydatny do ustalenia optymalnej strategii leczenia. RIDA QUICK IFX Monitoring
4 Do tej analizy można użyć RIDASCREEN Anti-IFX Antibodies (G09042) ELISA. 3. Zasada testu IFX jest wykrywany poprzez utworzenie kompleksu przeciwciało antygen (kanapki) MA- IFX6B7 i TNFα. Zostaje on uwidoczniony poprzez użycie znakowanych nanocząsteczek złota koloidalnego. Wygenerowany sygnał jest odczytywany za pomocą RIDA QUICK SCAN II, a stężenie IFX jest obliczane z wykorzystaniem krzywej wzorcowej przechowywanej w aparacie. 4. Dostarczane odczynniki Każdy zestaw zawiera odczynniki w ilości wystarczającej do wykonania 25 testów. Cassette 1 szt. 25 kaset testowych Sample diluent 25 ml Bufor do rozcieńczania próbek; zawiera 0,09 % NaN3; gotowy do użycia Reagent A 2,5 ml Odczynnik A; zawiera 0,09 % NaN3; gotowy do użycia Reagent B 2,5 ml Odczynnik B; zawiera 0,09 % NaN3; gotowy do użycia Informacje na temat substancji niebezpiecznych są zgodne z wymaganiami dotyczącymi oznakowania. Dalsze informacje można znaleźć w kartach charakterystyki substancji na stronie Odczynniki dostępne dodatkowo Kontrole do RIDA QUICK IFX Monitoring można zamówić osobno. RIDA QUICK IFX Monitoring Control Set (nr kat. GP3041) zawiera 2 kontrole. Są one stosowane tak samo jak próbki pobrane od pacjentów i można je wykorzystać do sprawdzenia odczynników testowych i procedury testu. Zawartość RIDA QUICK IFX Monitoring Control Set High control Specyficzna dla partii kontrola wysoko dodatnia 1,2 ml Low control Specyficzna dla partii kontrola nisko dodatnia 1,2 ml RIDA QUICK IFX Monitoring
5 5. Instrukcje dotyczące przechowywania Przechowywać zestaw w temperaturze 2-8 C. Zawartość zestawu jest stabilna do terminu ważności nadrukowanego na etykiecie produktu. Odczynniki można pozostawiać w temperaturze pokojowej wyłącznie na krótko. Po użyciu należy od razu umieścić je w temperaturze 2-8 C. Nie można zagwarantować jakości produktu po upływie terminu ważności. Podobnie użyteczności kaset nie można zagwarantować, jeśli opakowanie kasety jest uszkodzone. 6. Odczynniki wymagane, niedostarczone Probówka reakcyjna Probówka do przygotowania zawiesiny próbki (dwie dla każdej próbki pobranej od pacjenta) Mikropipety z jednorazowymi końcówkami µl i µl Stoper Pojemnik na odpady zawierający 0,5 % roztwór podchlorynu sodu RIDA QUICK SCAN II (dostępny w R-Biopharm AG, nr kat.: ZRQS2-KD) Worteks 7. Ostrzeżenia i środki ostrożności dla użytkowników Wyłącznie do diagnostyki in vitro. Ten test musi być wykonywany wyłącznie przez przeszkolony personel laboratoryjny. Należy przestrzegać wytycznych dotyczących pracy w laboratoriach medycznych oraz instrukcji dotyczących wykonania testu. Nie wolno mieszać odczynników z zestawów oznaczonych różnymi numerami partii. Próbek ani odczynników nie wolno pipetować ustami oraz nie wolno dopuszczać do kontaktu z uszkodzoną skórą lub błonami śluzowymi. W trakcie pracy z próbkami należy nosić jednorazowe rękawiczki, a po zakończeniu testu należy umyć ręce. W miejscu, w którym wykorzystywane są próbki lub odczynniki testowe nie wolno palić, jeść ani pić. Odczynniki zawierają NaN3 jako środek konserwujący. Nie wolno dopuszczać do zetknięcia się tej substancji ze skórą oraz błonami śluzowymi. RIDA QUICK IFX Monitoring
6 8. Pobieranie i przechowywanie próbek Do tego oznaczenia można wykorzystać próbki osocza pobrane na EDTA, próbki osocza pobrane na cytrynian oraz próbki surowicy. Po pobraniu surowicę należy jak najszybciej oddzielić od skrzepu, aby uniknąć hemolizy. Przenieść surowicę do czystej probówki do przechowywania. Próbki można przechowywać w temperaturze 2-8 C przez 3-4 dni lub w temperaturze -20 C przez co najmniej rok. Należy unikać wielokrotnego zamrażania i rozmrażania. 9. Procedura testu 9.1. Informacje ogólne Przed użyciem próbki, bufor do rozcieńczania próbek, odczynniki A i B oraz paski testowe należy doprowadzić do temperatury pokojowej (20-25 C). Po użyciu pasków testowych nie wolno używać ponownie. Testu nie wolno wykonywać w warunkach bezpośredniego nasłonecznienia. Nadmiaru odczynników nie wolno umieszczać z powrotem w pojemnikach, ponieważ mogłoby to doprowadzić do zanieczyszczenia. RIDA QUICK SCAN II należy włączyć przed rozpoczęciem testu. Metodę testu można zeskanować przed pierwszym użyciem za pomocą czytnika kodów kreskowych, a następnie zostanie ona zapisana na potrzeby dalszych pomiarów za pomocą RIDA QUICK SCAN II. Parametry specyficzne dla partii muszą także zostać zeskanowane raz dla każdej partii przed rozpoczęciem testu. Kody QR dla metody testu oraz parametrów specyficznych dla partii można znaleźć w świadectwie analizy dołączonym do zestawu (patrz także podręcznik RIDA QUICK SCAN II) Przygotowanie próbek Rozcieńczanie próbki Zakres pomiaru RIDA QUICK IFX Monitoring wynosi od 0,5 do 10 µg/ml po zastosowaniu rozcieńczenia standardowego (faza leczenia podtrzymującego). Zakres pomiaru można rozszerzyć do 2-40 µg/ml dzięki dodatkowemu rozcieńczeniu (faza indukcyjna) RIDA QUICK IFX Monitoring
7 a) Pomiar stężenia minimalnego w trakcie fazy leczenia podtrzymującego Aby zmierzyć stężenie minimalne (stężenie leku bezpośrednio przed podaniem kolejnej dawki) w trakcie fazy leczenia podtrzymującego (począwszy od tygodnia 12 14), należy rozcieńczyć próbkę w stosunku 1:50. Rozcieńczyć 20 µl próbki w 980 µl bufora do rozcieńczania próbek Sample diluent (1:50). Po wykonaniu procedury testu opisanej w punkcie próbka zostanie dodatkowo rozcieńczona w stosunku 1:10, przez co ostateczne rozcieńczenie próbki wynosi 1:500. b) Pomiar stężenia minimalnego w trakcie fazy leczenia indukcyjnego Aby zmierzyć stężenie minimalne w fazie leczenia indukcyjnego (zazwyczaj w tygodniu 2 i tygodniu 6) lub zmierzyć pośrednie stężenia leku bądź stężenia > 10 µg/ml, należy rozcieńczyć próbkę w stosunku 1:200. Najpierw rozcieńczyć 20 µl próbki w 980 µl bufora do rozcieńczania próbek Sample diluent (1:50). Na etapie można także wykorzystać rozcieńczenie 1:50 z fazy leczenia podtrzymującego. Następnie rozcieńczyć 100 µl tego roztworu w 300 µl Sample diluent (1:4) tak, aby ogółem rozcieńczenie próbki początkowej wynosiło 1:200. Po wykonaniu procedury testu opisanej w punkcie próbka zostanie dodatkowo rozcieńczona w stosunku 1:10, przez co ostateczne rozcieńczenie próbki wynosi 1: Inkubacja próbki W osobnym naczyniu reakcyjnym zmieszać 90 μl Reagent A (niebieski płyn, butelka z niebieską pokrywką) i 90 μl Reagent B (żółty płyn, butelka z przezroczystą pokrywką). W przypadku przetwarzania wielu pasków testowych roztwór można także zastosować z kilkoma próbkami jednocześnie. Mieszanina Reagent A (niebieski płyn) i Reagent B (żółty płyn) utworzy zielony roztwór. Odpipetować 20 μl rozcieńczonego roztworu próbki do 180 µl mieszaniny odczynników A i B, co odpowiada dalszemu rozcieńczeniu próbki wynoszącemu 1:10 (patrz a) i b)). W ten sposób ostateczne rozcieńczenie próbki początkowej wyniesie 1:500 (faza leczenia podtrzymującego) lub 1:2000 (faza leczenia indukcyjnego). Dokładnie wymieszać roztwory poprzez odwracanie lub worteksowanie, aby zhomogenizować mieszaninę próbki. RIDA QUICK IFX Monitoring
8 Następnie inkubować mieszaninę reakcyjną w temperaturze pokojowej przed dokładnie 5 minut Testowanie próbki Wyjąć kasetę testową Cassette z opakowania i umieścić na równej powierzchni. 100 µl preparatu próbki z probówki reakcyjnej przygotowanego na etapie odpipetować do studzienki na próbkę na kasecie testowej. Wynik testu należy zawsze odczytywać po upływie 15 (+ maks. 2) minut za pomocą RIDA QUICK SCAN II. Należy ściśle przestrzegać ograniczeń czasowych. Rozwój koloru pasma może ulec zmianie w trakcie całego czasu reakcji i po wysuszeniu. W trakcie wysychania paska kolor pasma może ulegać zmianie, od czerwonego po niebiesko-fioletowy/szary. Pomiary przed lub po upływie 15 (+ maks. 2) minut czasu inkubacji mogą doprowadzić do uzyskania nieprawidłowych wyników. 10. Kontrola jakości wskazanie niestabilności lub upływu terminu ważności odczynników Test można ocenić wyłącznie, jeśli kaseta testowa jest nieuszkodzona oraz jeśli nie ma zmian koloru ani pasm przed nałożeniem zawiesiny próbki. Pasmo kontrolne (oznaczone literą C na kasecie testowej) musi pojawić się przy każdym teście. W sytuacji braku tego pasma przed powtórzeniem testu należy sprawdzić następujące elementy: - Termin ważności odczynników i użytej kasety testowej - Prawidłowość procedury testu - Zanieczyszenie odczynników Jeśli po powtórzeniu testu z wykorzystaniem innej kasety testowej pasmo kontrolne nadal nie jest widoczne, należy skontaktować się z producentem lub lokalnym dystrybutorem firmy R-Biopharm. 11. Ocena i interpretacja Odczyt wykonuje się za pomocą RIDA QUICK SCAN II (patrz także podręcznik RIDA QUICK SCAN II) RIDA QUICK IFX Monitoring
9 Uwaga: Jeśli próbka została wcześniej rozcieńczona o współczynnik wynoszący 4 (rozcieńczenie ostateczne 1:2000), wynik RIDA QUICK SCAN II należy pomnożyć razy cztery, aby uzyskać rzeczywiste stężenie IFX (w μg/ml) we krwi. Pasmo kontrolne (oznaczone literą C na kasecie testowej) musi pojawić się przy każdym teście. W przypadku braku tego pasma należy postępować zgodnie z instrukcjami podanymi w rozdziale 10. Pojawia się pasmo testowe (oznaczone na kasecie literą T) o różnej intensywności w zależności od stężenia infliksymabu w próbce przy różnych czasach inkubacji. Ostateczny wynik testu można określić dopiero po upływie 15 (+ maks. 2) minut przy użyciu RIDA QUICK SCAN II. Należy ściśle przestrzegać czasów inkubacji i odczytu. Podczas okresu inkubacji pasma mogą ulec zmianie i mogą również się zmienić po osuszeniu. Kolor pasma może być różny, od czerwonego po niebiesko-fioletowy/szary. 12. Ograniczenia metody Test RIDA QUICK IFX Monitoring wykrywa wolną, aktywną funkcjonalnie część IFX, a nie część IFX związaną z przeciwciałami przeciwko infliksymabowi z powodu immunogenności. Indywidualnych stężeń infliksymabu, mierzonych za pomocą RIDA QUICK IFX Monitoring nie można wykorzystywać jako jedynego wskaźnika przy podejmowaniu zmian w schemacie leczenia, a każdego pacjenta należy poddać dokładnej ocenie klinicznej przed wprowadzeniem zmian do schematu terapii. W fazie leczenia podtrzymującego zalecane docelowe okno terapeutyczne stężenia minimalnego wynosi 3 7 µg/ml. Jednakże wartości progowe, które są związane z remisją mogą być różne u poszczególnych pacjentów, co wynika ze zmienności u danego pacjenta i pomiędzy pacjentami w zakresie farmakokinetyki i farmakodynamiki. Ponadto sugerowano, że wyższe stężenia minimalne są związane z odpowiedzią i remisją u pacjentów z określonymi fenotypami choroby, np. u pacjentów ze zmianami w okolicy odbytu lub w przypadku ukierunkowania na gojenie endoskopowe. [15,16] RIDA QUICK IFX Monitoring
10 13. Charakterystyka działania Precyzja Precyzja w obrębie oznaczenia Precyzję w obrębie oznaczenia badano z wykorzystaniem pięciu próbek referencyjnych po 20 powtórzeń. Stężenia IFX ustalano za pomocą RIDA QUICK SCAN II, a dla każdej próbki obliczono wartości średnie (MV), odchylenia standardowe (SD) i współczynnik zmienności (CV) odczytów. Wyniki zestawiono w poniższej tabeli. Próbka referencyjna MV (µg/ml) 0,93 3,12 5,23 7,09 8,76 SD 0,10 0,51 0,82 0,74 0,89 CV (%) 11,2 16,5 15,6 10,4 10, Precyzja pomiędzy oznaczeniami Precyzję pomiędzy oznaczeniami badano z wykorzystaniem pięciu próbek referencyjnych po 40 powtórzeń. Testy zostały przeprowadzone przez trzech różnych operatorów w ciągu dziesięciu dni po dwie analizy dziennie (rano i popołudniu). Stężenia IFX ustalano za pomocą RIDA QUICK SCAN II, a dla każdej próbki obliczono wartości średnie (MV), odchylenia standardowe (SD) i współczynnik zmienności (CV) odczytów. Wyniki zestawiono w poniższej tabeli. Próbka referencyjna MV (µg/ml) 0,95 2,77 4,52 6,28 8,31 SD 0,13 0,41 0,74 0,82 1,30 CV (%) 13,7 14,7 16,3 13,0 15, RIDA QUICK IFX Monitoring
11 13.2. Czułość analityczna W celu ustalenia czułości analitycznej trzy próbki kontrolne zbadano w jednej serii rozcieńczeń, każda w dwóch partiach, a stężenia IFX ustalono za pomocą RIDA QUICK SCAN II. Granica wykrywalności wynosi poniżej 0,5 µg/ml IFX Swoistość zakłócenia Bilirubina (50 mg/l), cholesterol (2,5 g/l), trójglicerydy (5 g/l) i hemoglobina (200 mg/l) nie miały wpływu na wyniki testu, kiedy były obecne w próbkach surowicy ludzkiej we wskazanych stężeniach. RIDA QUICK IFX Monitoring
12 13.4. Wskaźnik wykrywalności Wskaźnik wykrywalności w przypadku produktu leczniczego Remicade Trzy próbki zmieszano z każdą z czterech różnych ilości produktu leczniczego Remicade, a stężenia IFX ustalono za pomocą RIDA QUICK SCAN II. Średni wskaźnik wykrywalności wynosi 100 %. Wyniki zestawiono w poniższej tabeli. Próbka (µg/ml) 1 1,07 2 1,14 3 1,07 Wskaźnik Dodatek zmierzona docelowa wykrywalności IFX (µg/ml) (µg/ml) (µg/ml) (%) 6,24 7,61 7, ,56 2,47 2, ,46 6,56 6, ,90 5,32 4, ,42 6,12 6, ,64 5,88 5, ,77 1,84 1, ,87 5,30 5, ,02 7,73 8, ,34 3,45 3, ,90 5,43 4, ,12 4,16 4, RIDA QUICK IFX Monitoring
13 Wskaźnik wykrywalności w przypadku leków biopodobnych a) Wskaźnik wykrywalności w przypadku produktu leczniczego Remsima Trzy próbki zmieszano z każdą z czterech różnych ilości produktu leczniczego Remsima, a stężenia IFX ustalono za pomocą RIDA QUICK SCAN II. Średni wskaźnik wykrywalności wynosi 106 %. Wyniki zestawiono w poniższej tabeli. Próbka (µg/ml) 1 1,29 2 1,31 3 1,30 Wskaźnik Dodatek zmierzona docelowa wykrywalności IFX (µg/ml) (µg/ml) (µg/ml) (%) 6,96 8,59 8, ,74 2,93 3, ,09 7,55 7, ,35 6,18 5, ,08 8,05 7, ,21 6,89 6, ,87 2,13 2, ,34 6,27 5, ,82 9,43 9, ,61 4,21 3, ,35 6,47 5, ,48 5,20 4, RIDA QUICK IFX Monitoring
14 b) Wskaźnik wykrywalności w przypadku produktu leczniczego Inflectra Trzy próbki zmieszano z każdą z czterech różnych ilości produktu leczniczego Inflectra, a stężenia IFX ustalono za pomocą RIDA QUICK SCAN II. Średni wskaźnik wykrywalności wynosi 103 %. Wyniki zestawiono w poniższej tabeli. Próbka (µg/ml) 1 0,76 2 0,76 3 0,80 Wskaźnik Dodatek zmierzona docelowa wykrywalności IFX (µg/ml) (µg/ml) (µg/ml) (%) 4,95 6,14 5, ,24 2,15 2, ,33 4,87 5, ,09 3,80 3, ,33 5,00 5, ,71 4,35 4, ,62 1,49 1, ,09 4,16 3, ,53 6,80 6, ,84 2,67 2, ,07 4,01 3, ,46 3,55 3, RIDA QUICK IFX Monitoring
15 c) Wskaźnik wykrywalności w przypadku produktu leczniczego Flixabi Trzy próbki zmieszano z każdą z czterech różnych ilości produktu leczniczego Flixabi, a stężenia IFX ustalono za pomocą RIDA QUICK SCAN II. Średni wskaźnik wykrywalności wynosi 93 %. Wyniki zestawiono w poniższej tabeli. Próbka (µg/ml) 1 1,02 2 1,14 3 1,14 Wskaźnik Dodatek zmierzona docelowa wykrywalności IFX (µg/ml) (µg/ml) (µg/ml) (%) 7,57 7,04 8, ,89 2,49 2, ,62 6,72 7, ,73 5,43 5, ,53 7,06 7, ,60 6,16 6, ,93 2,18 2, ,67 5,24 5, ,40 9,62 9, ,80 3,89 3, ,67 5,36 5, ,73 4,41 4, RIDA QUICK IFX Monitoring
16 Korelacja z oznaczeniem próbki referencyjnej Stężenie 20 próbek dodatnich pod względem IFX w zakresie stężeń wynoszącym od 1 µg/ml do 12 µg/ml zmierzono za pomocą RIDASCREEN IFX oraz RIDA QUICK IFX Monitoring. Współczynnik korelacji wynosił R 2 = 0,98 (Rysunek 1). Rysunek 1. RIDA QUICK IFX Monitoring charakteryzuje się doskonałą korelacją (R 2 = 0,98) z RIDASCREEN IFX Monitoring (n = 20). 14. Historia zmian Numer wersji Rozdział i opis Wydanie pierwsze Zmiany ogólne Ograniczenia metody 13. Charakterystyka działania Swoistość zakłócenia Wskaźnik wykrywalności 14. Historia zmian 15. Objaśnienie symboli RIDA QUICK IFX Monitoring
17 15. Objaśnienie symboli Symbole ogólne Do diagnostyki in vitro Sprawdź w instrukcji użycia Numer serii Termin ważności Temperatura przechowywania Numer artykułu Liczba testów Data produkcji Producent Symbole specyficzne dla testu Cassette Sample diluent Reagent A Reagent B Kaseta testowa Rozcieńczalnik do próbek Odczynnik A Odczynnik B 16. Piśmiennictwo 1. Vogelaar L, Spijker AV, van der Woude CJ. The impact of biologics on health-related quality of life in patients with inflammatory bowel disease. Clin Exp Gastroenterol 2009;2: Yanai H, Hanauer SB. Assessing response and loss of response to biological therapies in IBD. Am J Gastroenterol 2011;106: Vermeire S, Gils A. Value of drug level testing and antibody assays in optimising biological therapy. Frontline Gastroenterol 2013;4: Ducourau E, Mulleman D, Paintaud G, et al. Antibodies toward infliximab are associated with low infliximab concentration at treatment initiation and poor infliximab maintenance in rheumatic diseases. Arthritis Res Ther 2011;13:R105. RIDA QUICK IFX Monitoring
18 5. Mulleman D, Meric JC, Paintaud G, et al. Infliximab concentration monitoring improves the control of disease activity in rheumatoid arthritis. Arthritis Res Ther 2009;11:R Van Stappen T, Brouwers E, Tops S, et al. Generation of a highly specific monoclonal antibody standard for harmonization of TNF-coated infliximab assays. Ther Drug Monit 2015;37: Gils A, Van Stappen T, Dreesen E, et al. Harmonization of infliximab and antiinfliximab assays facilitates the comparison between originators and biosimilars in clinical samples. Inflamm Bowel Dis. 2016;22: Cornillie F, Hanauer SB, Diamond RH, et al. Postinduction serum infliximab trough level and decrease of C-reactive protein level are associated with durable sustained response to infliximab: a retrospective analysis of the ACCENT I trial. Gut 2014;63: Vande Casteele N, Ballet V, Van Assche G, et al. Early serial trough and antidrug antibody level measurements predict clinical outcome of infliximab and adalimumab treatment. Gut. 2012:321; author reply Van Stappen T, Bollen L, Vande Casteele N, et al. Rapid test for infliximab drug concentration allows immediate dose adaptation. Clin Transl Gastroenterol 2016;7:e Maser EA, Villela R, Silverberg MS, et al. Association of trough serum infliximab to clinical outcome after scheduled maintenance treatment for Crohn's disease. Clin Gastroenterol Hepatol 2006;4: Vande Casteele N, Ferrante M, Van Assche G, et al. Trough concentrations of infliximab guide dosing for patients with inflammatory bowel disease. Gastroenterology 2015;148: Steenholdt C, Brynskov J, Thomsen OO, et al. Individualised therapy is more costeffective than dose intensification in patients with Crohn's disease who lose response to anti-tnf treatment: a randomised, controlled trial. Gut 2014;63: Baert F, Noman M, Vermeire S, et al. Influence of immunogenicity on the long-term efficacy of infliximab in Crohn's disease. N Engl J Med 2003;348: Yarur AJ, Kanagala V, Stein DJ, et al. Higher infliximab trough levels are associated with perianal fistula healing in patients with Crohn's disease. Aliment Pharmacol Ther 2017;45: RIDA QUICK IFX Monitoring
19 16. Ungar B, Levy I, Yavne Y, et al. Optimizing anti-tnf-α therapy: Serum levels of infliximab and adalimumab associate with mucosal healing in patients with inflammatory bowel diseases. Clin Gastroenterol Hepatol 2016;14: RIDA QUICK IFX Monitoring
Oznaczanie stężenia leków biologicznych w leczeniu chorób zapalnych jelit znaczenie w praktyce klinicznej
 Gastroenterologia Kliniczna 2014, tom 6, nr 3, 92 96 Copyright 2014 Via Medica ISSN 2081 1020 www.gastroenterologia.viamedica.pl Tomasz Rawa Klinika Gastroenterologii, Hepatologii i Onkologii Klinicznej,
Gastroenterologia Kliniczna 2014, tom 6, nr 3, 92 96 Copyright 2014 Via Medica ISSN 2081 1020 www.gastroenterologia.viamedica.pl Tomasz Rawa Klinika Gastroenterologii, Hepatologii i Onkologii Klinicznej,
Test Immunoenzymatyczny DRG Kortyzol dostarcza materiałów do oznaczania kortyzolu w surowicy i osoczu.
 WSTĘP Test Immunoenzymatyczny DRG Kortyzol dostarcza materiałów do oznaczania kortyzolu w surowicy i osoczu. Test jest przeznaczony wyłącznie do stosowania ZASADA OZNACZENIA Ten test immunoenzymatyczny
WSTĘP Test Immunoenzymatyczny DRG Kortyzol dostarcza materiałów do oznaczania kortyzolu w surowicy i osoczu. Test jest przeznaczony wyłącznie do stosowania ZASADA OZNACZENIA Ten test immunoenzymatyczny
Ulotka dołączona do opakowania: informacja dla użytkownika. Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych
 Ulotka dołączona do opakowania: informacja dla użytkownika Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
ROTA-ADENO Virus Combo Test Device
 Kod produktu: 8.04.73.0.0020 ROTA-ADENO Virus Combo Test Device Tylko do diagnostyki in vitro Przechowywać w 2-30 C ZASTOSOWANIE Wykrywanie antygenów Rotawirusów i Adenowirusów w próbkach kału. WSTĘP Rotawirusy
Kod produktu: 8.04.73.0.0020 ROTA-ADENO Virus Combo Test Device Tylko do diagnostyki in vitro Przechowywać w 2-30 C ZASTOSOWANIE Wykrywanie antygenów Rotawirusów i Adenowirusów w próbkach kału. WSTĘP Rotawirusy
Zasady diagnostyki laboratoryjnej u pacjenta otrzymującego lek Hemlibra Edyta Odnoczko
 Zasady diagnostyki laboratoryjnej u pacjenta otrzymującego lek Hemlibra Edyta Odnoczko 23 marzec 2019r. HEMLIBRA = EMICIZUMAB (ACE 910) Działanie: naśladuje (mimics) in vitro oraz in vivo FVIIIa Nie wymaga
Zasady diagnostyki laboratoryjnej u pacjenta otrzymującego lek Hemlibra Edyta Odnoczko 23 marzec 2019r. HEMLIBRA = EMICIZUMAB (ACE 910) Działanie: naśladuje (mimics) in vitro oraz in vivo FVIIIa Nie wymaga
AmpliTest Babesia spp. (PCR)
 AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
Samodzielny Publiczny Zespół... Zakładów Opieki Zdrowotnej w Kozienicach... ul. Al. Wł. Sikorskiego 10
 Załącznik nr 2 do SIWZ Wykonawca:... Samodzielny Publiczny Zespół... Zakładów Opieki Zdrowotnej w Kozienicach... ul. Al. Wł. Sikorskiego 10 tel.:/fax:... 26-900 Kozienice tel.:/fax: (48) 382 88 00/ (48)
Załącznik nr 2 do SIWZ Wykonawca:... Samodzielny Publiczny Zespół... Zakładów Opieki Zdrowotnej w Kozienicach... ul. Al. Wł. Sikorskiego 10 tel.:/fax:... 26-900 Kozienice tel.:/fax: (48) 382 88 00/ (48)
Test DRG DHEA-S ELISA jest testem immunoenzymatycznym do ilościowego diagnostycznego oznaczania DHEA-S w surowicy i osoczu w warunkach in vitro.
 WSTĘP 1.1 Przeznaczenie Test DRG DHEA-S ELISA jest testem immunoenzymatycznym do ilościowego diagnostycznego oznaczania DHEA-S w surowicy i osoczu w warunkach in vitro. 1.2 Streszczenie i Wyjaśnienia Dehydroepiandrosteron
WSTĘP 1.1 Przeznaczenie Test DRG DHEA-S ELISA jest testem immunoenzymatycznym do ilościowego diagnostycznego oznaczania DHEA-S w surowicy i osoczu w warunkach in vitro. 1.2 Streszczenie i Wyjaśnienia Dehydroepiandrosteron
1. PRZYGOTOWANIE ROZTWORÓW KOMPLEKSUJĄCYCH
 1. PRZYGOTOWANIE ROZTWORÓW KOMPLEKSUJĄCYCH 1.1. przygotowanie 20 g 20% roztworu KSCN w wodzie destylowanej 1.1.1. odważenie 4 g stałego KSCN w stożkowej kolbie ze szlifem 1.1.2. odważenie 16 g wody destylowanej
1. PRZYGOTOWANIE ROZTWORÓW KOMPLEKSUJĄCYCH 1.1. przygotowanie 20 g 20% roztworu KSCN w wodzie destylowanej 1.1.1. odważenie 4 g stałego KSCN w stożkowej kolbie ze szlifem 1.1.2. odważenie 16 g wody destylowanej
AE/ZP-27-74/16 Załącznik Nr 6
 AE/ZP-27-74/16 Załącznik Nr 6 Wymagania dla UWAGA! Oferta nie spełniająca poniższych wymagań będzie odrzucona L.p. Wymagane parametry Wymagania wobec przedmiotu zmówienia oferowanego w Pakiecie Nr 1 Wszystkie
AE/ZP-27-74/16 Załącznik Nr 6 Wymagania dla UWAGA! Oferta nie spełniająca poniższych wymagań będzie odrzucona L.p. Wymagane parametry Wymagania wobec przedmiotu zmówienia oferowanego w Pakiecie Nr 1 Wszystkie
CEL ĆWICZENIA: Zapoznanie się z przykładową procedurą odsalania oczyszczanych preparatów enzymatycznych w procesie klasycznej filtracji żelowej.
 LABORATORIUM 3 Filtracja żelowa preparatu oksydazy polifenolowej (PPO) oczyszczanego w procesie wysalania siarczanem amonu z wykorzystaniem złoża Sephadex G-50 CEL ĆWICZENIA: Zapoznanie się z przykładową
LABORATORIUM 3 Filtracja żelowa preparatu oksydazy polifenolowej (PPO) oczyszczanego w procesie wysalania siarczanem amonu z wykorzystaniem złoża Sephadex G-50 CEL ĆWICZENIA: Zapoznanie się z przykładową
Specyfikacja techniczno-cenowa. Wymagania dla aparatury przeznaczonej do badań mikrometodą kolumnową
 Specyfikacja techniczno-cenowa Zał. nr 1 do SIWZ Dostawa odczynników diagnostycznych i materiałów zużywalnych do mikrometody wraz z dzierżawą aparatury do badań immunohematologicznych z zakresu serologii
Specyfikacja techniczno-cenowa Zał. nr 1 do SIWZ Dostawa odczynników diagnostycznych i materiałów zużywalnych do mikrometody wraz z dzierżawą aparatury do badań immunohematologicznych z zakresu serologii
Laboratorium 5. Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna
 Laboratorium 5 Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Szybkość reakcji enzymatycznej zależy przede wszystkim od stężenia substratu
Laboratorium 5 Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Szybkość reakcji enzymatycznej zależy przede wszystkim od stężenia substratu
Zał Nr 1- Pak Nr 7- Analizator parametrów krytycznych 1 sztuka. Parametry oferowane. Parametry wymagane. Opis / Parametry wymagane
 Zał Nr 1- Pak Nr 7- Analizator parametrów krytycznych 1 sztuka Lp Opis / Parametry wymagane Parametry wymagane Parametry oferowane /podać zakresy lub opisać 1 Producent 2 Model 3 Rok produkcji min 2018
Zał Nr 1- Pak Nr 7- Analizator parametrów krytycznych 1 sztuka Lp Opis / Parametry wymagane Parametry wymagane Parametry oferowane /podać zakresy lub opisać 1 Producent 2 Model 3 Rok produkcji min 2018
VES TEC VACU TEC VACU CODE. Producent: DIESSE Diagnostica Senese Via delle Rose 10 53035 Monteriggioni (Siena) - Włochy
 PL 1/5 VES TEC VACU TEC VACU CODE Producent: DIESSE Diagnostica Senese Via delle Rose 10 53035 Monteriggioni (Siena) - Włochy Paragraf Zmiany wprowadzone w aktualnej wersji 1 6 8 PL 2/5 1. ZASTOSOWANIE
PL 1/5 VES TEC VACU TEC VACU CODE Producent: DIESSE Diagnostica Senese Via delle Rose 10 53035 Monteriggioni (Siena) - Włochy Paragraf Zmiany wprowadzone w aktualnej wersji 1 6 8 PL 2/5 1. ZASTOSOWANIE
Kiedy lekarz powinien decydować o wyborze terapii oraz klinicznej ocenie korzyści do ryzyka stosowania leków biologicznych lub biopodobnych?
 Kiedy lekarz powinien decydować o wyborze terapii oraz klinicznej ocenie korzyści do ryzyka stosowania leków biologicznych lub biopodobnych? prof. dr hab. med.. Piotr Fiedor Warszawski Uniwersytet Medyczny
Kiedy lekarz powinien decydować o wyborze terapii oraz klinicznej ocenie korzyści do ryzyka stosowania leków biologicznych lub biopodobnych? prof. dr hab. med.. Piotr Fiedor Warszawski Uniwersytet Medyczny
Zestaw do wykrywania Chlamydia trachomatis w moczu lub w kulturach komórkowych
 Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
Nr kat. PK15 Wersja zestawu: 1.2016 Zestaw do wykrywania w moczu lub w kulturach komórkowych na 50 reakcji PCR (50µl), włączając w to kontrole Detekcja oparta jest na amplifikacji fragmentu genu crp (cysteine
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika
 PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
PathogenFree DNA Isolation Kit Zestaw do izolacji DNA Instrukcja użytkownika Spis treści 1. Zawartość 2 1.1 Składniki zestawu 2 2. Opis produktu 2 2.1 Założenia metody 2 2.2 Instrukcja 2 2.3 Specyfikacja
Dotyczy: przetargu nieograniczonego na dostawa odczynników, krwinek wzorcowych do serologii grup krwi- metody probówkowe/szkiełkowe
 Numer sprawy: DTZ.382.10.2018 Golub-Dobrzyń, dn. 23.03.2018r. Dotyczy: przetargu nieograniczonego na dostawa odczynników, krwinek wzorcowych do serologii grup krwi- metody probówkowe/szkiełkowe W związku
Numer sprawy: DTZ.382.10.2018 Golub-Dobrzyń, dn. 23.03.2018r. Dotyczy: przetargu nieograniczonego na dostawa odczynników, krwinek wzorcowych do serologii grup krwi- metody probówkowe/szkiełkowe W związku
Wojewódzka Stacja Sanitarno-Epidemiologiczna w Poznaniu
 Wojewódzka Stacja Sanitarno-Epidemiologiczna w Poznaniu PROGRAM WHO ELIMINACJI ODRY/RÓŻYCZKI Program eliminacji odry i różyczki został uchwalony przez Światowe Zgromadzenie Zdrowia 28 maja 2003 roku. Realizacja
Wojewódzka Stacja Sanitarno-Epidemiologiczna w Poznaniu PROGRAM WHO ELIMINACJI ODRY/RÓŻYCZKI Program eliminacji odry i różyczki został uchwalony przez Światowe Zgromadzenie Zdrowia 28 maja 2003 roku. Realizacja
KOAGULOLOGIA. Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice.
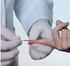 KOAGULOLOGIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi.
KOAGULOLOGIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi.
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA)
 Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
Oznaczanie mocznika w płynach ustrojowych metodą hydrolizy enzymatycznej
 Oznaczanie mocznika w płynach ustrojowych metodą hydrolizy enzymatycznej Wprowadzenie: Większość lądowych organizmów kręgowych część jonów amonowych NH + 4, produktu rozpadu białek, wykorzystuje w biosyntezie
Oznaczanie mocznika w płynach ustrojowych metodą hydrolizy enzymatycznej Wprowadzenie: Większość lądowych organizmów kręgowych część jonów amonowych NH + 4, produktu rozpadu białek, wykorzystuje w biosyntezie
Tytuł: Kontrola glukometrów
 Data obowiązywania: Wydanie: 1 Strona 1 z 6 Karta zmian 1. CEL: Nr Punktu Podpunktu rozdziału Zmiany Akapitu lub fragmentu tekstu ze strony nr Opis Data Podpis autora ZATWIERDZIŁ Dyrektor Szpitala Dr n.
Data obowiązywania: Wydanie: 1 Strona 1 z 6 Karta zmian 1. CEL: Nr Punktu Podpunktu rozdziału Zmiany Akapitu lub fragmentu tekstu ze strony nr Opis Data Podpis autora ZATWIERDZIŁ Dyrektor Szpitala Dr n.
SZCZEGÓŁOWY OPIS PRZEDMIOTU ZAMÓWIENIA Część I
 Część I 1. API 20 E zastosowanie: identyfikacja Salmonella, Yersinia; opakowanie zawiera 25 pasków 2. Suspension Medium (5ml) zastosowanie: identyfikacja Salmonella; produkt płynny; składowe do zestawu
Część I 1. API 20 E zastosowanie: identyfikacja Salmonella, Yersinia; opakowanie zawiera 25 pasków 2. Suspension Medium (5ml) zastosowanie: identyfikacja Salmonella; produkt płynny; składowe do zestawu
ZAŁĄCZNIK NR 1. Cena jedn. brutto. netto
 PAKIET NR 1 Odczynniki hematologiczne do aparatu ABX MICROS 60 Lp. Nazwa/postać/stężenie Opakowanie Ilość do 1. Roztwór roboczy ( diluent) /8-866/ 1 opakowanie 7 = 20 l. 2. Roztwór roboczy ( diluent) /8-866/
PAKIET NR 1 Odczynniki hematologiczne do aparatu ABX MICROS 60 Lp. Nazwa/postać/stężenie Opakowanie Ilość do 1. Roztwór roboczy ( diluent) /8-866/ 1 opakowanie 7 = 20 l. 2. Roztwór roboczy ( diluent) /8-866/
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY, proszek do sporządzania roztworu na skórę 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 kg proszku do sporządzania roztworu
ALGALTOXKIT F Procedura testu
 ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
TaqNovaHS. Polimeraza DNA RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925
 TaqNovaHS RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 TaqNovaHS Polimeraza TaqNovaHS jest mieszaniną termostabilnej polimerazy DNA
TaqNovaHS RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 RP902A, RP905A, RP910A, RP925A RP902, RP905, RP910, RP925 TaqNovaHS Polimeraza TaqNovaHS jest mieszaniną termostabilnej polimerazy DNA
Zawiadomienie o zmianie treści specyfikacji istotnych warunków zamówienia
 nr sprawy: WIW.AD.I.271.16.2011 Siedlce, dn. 21 kwietnia 2011 r. Wykonawcy wszyscy Zawiadomienie o zmianie treści specyfikacji istotnych warunków zamówienia Zgodnie z art. 38 ust. 4 ustawy z dnia 29 stycznia
nr sprawy: WIW.AD.I.271.16.2011 Siedlce, dn. 21 kwietnia 2011 r. Wykonawcy wszyscy Zawiadomienie o zmianie treści specyfikacji istotnych warunków zamówienia Zgodnie z art. 38 ust. 4 ustawy z dnia 29 stycznia
B. ULOTKA INFORMACYJNA
 B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
AE/ZP-27-03/16 Załącznik Nr 6
 AE/ZP--0/ Załącznik Nr Wymagania dla przedmiotu zamówienia oferowanego w Pakietach Nr - Lp Parametry wymagane Wymagania dla przedmiotu zamówienia oferowanego w Pakiecie Nr poz..... Surowica antyglobulinowa
AE/ZP--0/ Załącznik Nr Wymagania dla przedmiotu zamówienia oferowanego w Pakietach Nr - Lp Parametry wymagane Wymagania dla przedmiotu zamówienia oferowanego w Pakiecie Nr poz..... Surowica antyglobulinowa
AmpliTest GMO screening-nos (Real Time PCR)
 AmpliTest GMO screening-nos (Real Time PCR) Zestaw do wykrywania sekwencji DNA terminatora NOS techniką Real Time PCR Nr kat.: GMO03-50 GMO03-100 Wielkość zestawu: 50 reakcji 100 reakcji Objętość pojedynczej
AmpliTest GMO screening-nos (Real Time PCR) Zestaw do wykrywania sekwencji DNA terminatora NOS techniką Real Time PCR Nr kat.: GMO03-50 GMO03-100 Wielkość zestawu: 50 reakcji 100 reakcji Objętość pojedynczej
Skuteczność i bezpieczeństwo terapii biologicznej. w przebiegu choroby Leśniowskiego-Crohna.
 Artykuł oryginalny/original paper Skuteczność i bezpieczeństwo terapii biologicznej w przebiegu choroby Leśniowskiego-Crohna doświadczenia własne Efficacy and safety of biological treatment in Crohn s
Artykuł oryginalny/original paper Skuteczność i bezpieczeństwo terapii biologicznej w przebiegu choroby Leśniowskiego-Crohna doświadczenia własne Efficacy and safety of biological treatment in Crohn s
RT31-020, RT , MgCl 2. , random heksamerów X 6
 RT31-020, RT31-100 RT31-020, RT31-100 Zestaw TRANSCRIPTME RNA zawiera wszystkie niezbędne składniki do przeprowadzenia syntezy pierwszej nici cdna na matrycy mrna lub całkowitego RNA. Uzyskany jednoniciowy
RT31-020, RT31-100 RT31-020, RT31-100 Zestaw TRANSCRIPTME RNA zawiera wszystkie niezbędne składniki do przeprowadzenia syntezy pierwszej nici cdna na matrycy mrna lub całkowitego RNA. Uzyskany jednoniciowy
Leczenie biologiczne w nieswoistych zapaleniach jelit - Dlaczego? Co? Kiedy? VI Małopolskie Dni Edukacji w Nieswoistych Zapaleniach Jelit
 Leczenie biologiczne w nieswoistych zapaleniach jelit - Dlaczego? Co? Kiedy? VI Małopolskie Dni Edukacji w Nieswoistych Zapaleniach Jelit Co to są nieswoiste zapalenia jelit? Grupa chorób w których dochodzi
Leczenie biologiczne w nieswoistych zapaleniach jelit - Dlaczego? Co? Kiedy? VI Małopolskie Dni Edukacji w Nieswoistych Zapaleniach Jelit Co to są nieswoiste zapalenia jelit? Grupa chorób w których dochodzi
1.2. Zlecenie może być wystawione w formie elektronicznej z zachowaniem wymagań, o których mowa w poz. 1.1.
 Załączniki do rozporządzenia Ministra Zdrowia z dnia 2005 r. (poz. ) Załącznik Nr 1 Podstawowe standardy jakości w czynnościach laboratoryjnej diagnostyki medycznej, ocenie ich jakości i wartości diagnostycznej
Załączniki do rozporządzenia Ministra Zdrowia z dnia 2005 r. (poz. ) Załącznik Nr 1 Podstawowe standardy jakości w czynnościach laboratoryjnej diagnostyki medycznej, ocenie ich jakości i wartości diagnostycznej
Laboratorium z bionanostruktur. Prowadzący: mgr inż. Jan Procek Konsultacje: WT D- 1 8A
 Laboratorium z bionanostruktur Prowadzący: mgr inż. Jan Procek Konsultacje: WT 9.00-10.00 D- 1 8A Regulamin Studenci są dopuszczeni do wykonywania ćwiczenia jeżeli posiadają: Buty na płaskim obcasie, Fartuchy,
Laboratorium z bionanostruktur Prowadzący: mgr inż. Jan Procek Konsultacje: WT 9.00-10.00 D- 1 8A Regulamin Studenci są dopuszczeni do wykonywania ćwiczenia jeżeli posiadają: Buty na płaskim obcasie, Fartuchy,
w kale oraz innych laboratoryjnych markerów stanu zapalnego (białka C-reaktywnego,
 1. Streszczenie Wstęp: Od połowy XX-go wieku obserwuje się wzrost zachorowalności na nieswoiste choroby zapalne jelit (NChZJ), w tym chorobę Leśniowskiego-Crohna (ChLC), zarówno wśród dorosłych, jak i
1. Streszczenie Wstęp: Od połowy XX-go wieku obserwuje się wzrost zachorowalności na nieswoiste choroby zapalne jelit (NChZJ), w tym chorobę Leśniowskiego-Crohna (ChLC), zarówno wśród dorosłych, jak i
wielkość opakowania ilość opakowań rocznie
 Pakiet I. Odczynniki i akcesoria do analizatora hematologicznego Cell -Dyn 3700 Lp Asortyment nr kat. firmy ABBOTT nr kat. wielkość opakowania ilość opakowań 1. Isotonic Diluent a 20 L 99231 13 2. Detergent
Pakiet I. Odczynniki i akcesoria do analizatora hematologicznego Cell -Dyn 3700 Lp Asortyment nr kat. firmy ABBOTT nr kat. wielkość opakowania ilość opakowań 1. Isotonic Diluent a 20 L 99231 13 2. Detergent
TESTY IMMUNOCHROMATOGRAFICZNE
 TESTY IMMUNOCHROMATOGRAFICZNE Wśród innowacyjnych technologii warto zwrócić uwagę na szybkie testy diagnostyczne (ang. rapid diagnostic test). Ze względu na krótki czas wykonania coraz szerzej zyskują
TESTY IMMUNOCHROMATOGRAFICZNE Wśród innowacyjnych technologii warto zwrócić uwagę na szybkie testy diagnostyczne (ang. rapid diagnostic test). Ze względu na krótki czas wykonania coraz szerzej zyskują
DRG International, Inc., USA Fax: (973)
 1. WSTĘP 1.1. Zastosowanie Zestaw DRG Leptin ELISA jest testem immunoenzymatycznym do pomiaru leptyny w surowicy i osoczu. 2. ZASADA TESTU Zestaw DRG leptin ELISA jest testem immunoenzymatycznym stałej
1. WSTĘP 1.1. Zastosowanie Zestaw DRG Leptin ELISA jest testem immunoenzymatycznym do pomiaru leptyny w surowicy i osoczu. 2. ZASADA TESTU Zestaw DRG leptin ELISA jest testem immunoenzymatycznym stałej
Walidacja metod analitycznych Raport z walidacji
 Walidacja metod analitycznych Raport z walidacji Małgorzata Jakubowska Katedra Chemii Analitycznej WIMiC AGH Walidacja metod analitycznych (według ISO) to proces ustalania parametrów charakteryzujących
Walidacja metod analitycznych Raport z walidacji Małgorzata Jakubowska Katedra Chemii Analitycznej WIMiC AGH Walidacja metod analitycznych (według ISO) to proces ustalania parametrów charakteryzujących
Opis przedmiotu zamówienia wraz z wymaganiami technicznymi i zestawieniem parametrów
 Załącznik nr 1 do SIWZ Nazwa i adres Wykonawcy Opis przedmiotu zamówienia wraz z wymaganiami technicznymi i zestawieniem parametrów Przedmiot zamówienia; automatyczny system do diagnostyki molekularnej:
Załącznik nr 1 do SIWZ Nazwa i adres Wykonawcy Opis przedmiotu zamówienia wraz z wymaganiami technicznymi i zestawieniem parametrów Przedmiot zamówienia; automatyczny system do diagnostyki molekularnej:
Mycoplasma pneumoniae IgG ELISA
 Instrukcja Użytkownika Mycoplasma pneumoniae IgG ELISA EIA-3499 96 wells DRG Instruments GmbH, Germany Frauenbergstr. 18, D-35039 Marburg Telefon: +49 (0)64 21-1 700 0, Fax: +49-(0)6 42 1-170 0 50 Internet:
Instrukcja Użytkownika Mycoplasma pneumoniae IgG ELISA EIA-3499 96 wells DRG Instruments GmbH, Germany Frauenbergstr. 18, D-35039 Marburg Telefon: +49 (0)64 21-1 700 0, Fax: +49-(0)6 42 1-170 0 50 Internet:
Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI
 Załącznik nr 11 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4, D80.5,
Załącznik nr 11 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4, D80.5,
ZP/220/106/17 Parametry wymagane dla zadania nr 1 załącznik nr 4 do formularza oferty PO MODYFIKACJI
 Zadanie nr 1 odczynniki do badań serologicznych UWAGA: wszystkie metodyki badań opracowane przez producentów powinny być zgodne z obowiązującymi przepisami. Lp. Nazwa PARAMETRY WYMAGANE TAK / NIE Reagujący
Zadanie nr 1 odczynniki do badań serologicznych UWAGA: wszystkie metodyki badań opracowane przez producentów powinny być zgodne z obowiązującymi przepisami. Lp. Nazwa PARAMETRY WYMAGANE TAK / NIE Reagujący
FORMULARZ CENOWY CZĘŚĆ I. Jedn. miary
 FORMULARZ CENOWY CZĘŚĆ I 1. API 20 E zastosowanie: identyfikacja Salmonella, Yersinia; opakowanie zawiera 25 pasków; 2. Suspension Medium (5ml) zastosowanie: identyfikacja Salmonella; produkt płynny; składowe
FORMULARZ CENOWY CZĘŚĆ I 1. API 20 E zastosowanie: identyfikacja Salmonella, Yersinia; opakowanie zawiera 25 pasków; 2. Suspension Medium (5ml) zastosowanie: identyfikacja Salmonella; produkt płynny; składowe
Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI
 Załącznik nr 12 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4,
Załącznik nr 12 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu: LECZENIE PIERWOTNYCH NIEDOBORÓW ODPORNOŚCI U DZIECI ICD 10 D80 w tym D80.0, D80.1, D80.3, D80.4,
MATERIAŁY SZKOLENIOWE DLA ZAKŁADÓW HIGIENY WETERYNARYJNEJ W ZAKRESIE LABORATORYJNEJ DIAGNOSTYKI AFRYKAŃSKIEGO POMORU ŚWIŃ
 MATERIAŁY SZKOLENIOWE DLA ZAKŁADÓW HIGIENY WETERYNARYJNEJ W ZAKRESIE LABORATORYJNEJ DIAGNOSTYKI AFRYKAŃSKIEGO POMORU ŚWIŃ Puławy 2013 Opracowanie: Prof. dr hab. Iwona Markowska-Daniel, mgr inż. Kinga Urbaniak,
MATERIAŁY SZKOLENIOWE DLA ZAKŁADÓW HIGIENY WETERYNARYJNEJ W ZAKRESIE LABORATORYJNEJ DIAGNOSTYKI AFRYKAŃSKIEGO POMORU ŚWIŃ Puławy 2013 Opracowanie: Prof. dr hab. Iwona Markowska-Daniel, mgr inż. Kinga Urbaniak,
Zestaw do wykrywania Babesia spp. i Theileria spp. w kleszczach, krwi i hodowlach komórkowych
 Nr kat. PK25N Wersja zestawu: 1.2012 Zestaw do wykrywania spp. i Theileria spp. w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Zestaw
Nr kat. PK25N Wersja zestawu: 1.2012 Zestaw do wykrywania spp. i Theileria spp. w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Zestaw
ELIMINACJA ODRY/RÓŻYCZKI
 PAŃSTWOWY ZAKŁAD HIGIENY INSTYTUT NAUKOWO-BADAWCZY ELIMINACJA ODRY/RÓŻYCZKI PROGRAM WHO REALIZACJA W POLSCE - ZASADY - INSTRUKCJE ZAKŁAD WIRUSOLOGII UL. CHOCIMSKA 24 00-791 WARSZAWA PROGRAM ELIMINACJI
PAŃSTWOWY ZAKŁAD HIGIENY INSTYTUT NAUKOWO-BADAWCZY ELIMINACJA ODRY/RÓŻYCZKI PROGRAM WHO REALIZACJA W POLSCE - ZASADY - INSTRUKCJE ZAKŁAD WIRUSOLOGII UL. CHOCIMSKA 24 00-791 WARSZAWA PROGRAM ELIMINACJI
Załącznik nr 1A do siwz Część I - Zestaw testowy do szybkiej identyfikacji Escherichia coli
 Część I - Zestaw testowy do szybkiej identyfikacji Escherichia coli 1. Zestaw testowy do szybkiej identyfikacji Escherichia coli zestaw zawiera: - 50 pasków testowych, - 50 pojemników z tworzywa sztucznego,
Część I - Zestaw testowy do szybkiej identyfikacji Escherichia coli 1. Zestaw testowy do szybkiej identyfikacji Escherichia coli zestaw zawiera: - 50 pasków testowych, - 50 pojemników z tworzywa sztucznego,
DOKUMENTACJA SYSTEMU ZARZĄDZANIA LABORATORIUM. Procedura szacowania niepewności
 DOKUMENTACJA SYSTEMU ZARZĄDZANIA LABORATORIUM Procedura szacowania niepewności Szacowanie niepewności oznaczania / pomiaru zawartości... metodą... Data Imię i Nazwisko Podpis Opracował Sprawdził Zatwierdził
DOKUMENTACJA SYSTEMU ZARZĄDZANIA LABORATORIUM Procedura szacowania niepewności Szacowanie niepewności oznaczania / pomiaru zawartości... metodą... Data Imię i Nazwisko Podpis Opracował Sprawdził Zatwierdził
Zestaw do oczyszczania DNA po reakcjach enzymatycznych
 Cat. No. EM07.1 Wersja: 1.2017 NOWA WERSJA Zestaw do oczyszczania DNA po reakcjach enzymatycznych EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM07.1 I. PRZEZNACZENIE
Cat. No. EM07.1 Wersja: 1.2017 NOWA WERSJA Zestaw do oczyszczania DNA po reakcjach enzymatycznych EXTRACTME jest zarejestrowanym znakiem towarowym BLIRT S.A. www.blirt.eu Nr kat. EM07.1 I. PRZEZNACZENIE
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO. Aqua pro injectione Baxter 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aqua pro injectione Baxter 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Każdy worek zawiera wodę do wstrzykiwań 100% m/v 3. POSTAĆ
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Aqua pro injectione Baxter 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ Każdy worek zawiera wodę do wstrzykiwań 100% m/v 3. POSTAĆ
Gel-Out. 50 izolacji, 250 izolacji. Nr kat , Zestaw do izolacji DNA z żelu agarozowego. wersja 0617
 Gel-Out Zestaw do izolacji DNA z żelu agarozowego. wersja 0617 50 izolacji, 250 izolacji Nr kat. 023-50, 023-250 Pojemność kolumny do izolacji DNA - do 20 µg DNA, minimalna pojemność - 2 µg DNA (przy zawartości
Gel-Out Zestaw do izolacji DNA z żelu agarozowego. wersja 0617 50 izolacji, 250 izolacji Nr kat. 023-50, 023-250 Pojemność kolumny do izolacji DNA - do 20 µg DNA, minimalna pojemność - 2 µg DNA (przy zawartości
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN
 ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
ĆWICZENIE 5 MECHANIZMY PROMUJĄCE WZROST ROŚLIN CZĘŚĆ TEORETYCZNA Mechanizmy promujące wzrost rośli (PGP) Metody badań PGP CZĘŚĆ PRAKTYCZNA 1. Mechanizmy promujące wzrost roślin. Odczyt. a) Wytwarzanie
Diagnostyka i monitorowanie cukrzycy i chorób nerek
 Diagnostyka i monitorowanie cukrzycy i chorób nerek Business Development Manager Konferencja naukowo-szkoleniowa Ryn Badania laboratoryjne w chorobach nerek Wyzwaniem dla współczesnej medycyny jest badanie
Diagnostyka i monitorowanie cukrzycy i chorób nerek Business Development Manager Konferencja naukowo-szkoleniowa Ryn Badania laboratoryjne w chorobach nerek Wyzwaniem dla współczesnej medycyny jest badanie
Alkomat 4 w 1, AT 6389ET, 2 wyświetlacze LCD, zakres 0-1,9 promila
 INSTRUKCJA OBSŁUGI Alkomat 4 w 1, AT 6389ET, 2 wyświetlacze LCD, zakres 0-1,9 promila Nr produktu 856992 Strona 1 z 7 Przeznaczenie produktu Zastosowanie alkomatu obejmuje pomiar poziomu alkoholu w wydychanym
INSTRUKCJA OBSŁUGI Alkomat 4 w 1, AT 6389ET, 2 wyświetlacze LCD, zakres 0-1,9 promila Nr produktu 856992 Strona 1 z 7 Przeznaczenie produktu Zastosowanie alkomatu obejmuje pomiar poziomu alkoholu w wydychanym
PL.EDU.ELI PRZEWODNIK DLA LEKARZY
 PRZEWODNIK DLA LEKARZY Przewodnik dla Lekarzy Produkt leczniczy CERDELGA jest wskazany do długotrwałego leczenia dorosłych pacjentów z chorobą Gauchera typu 1, ze słabym (PM, ang. poor metaboliser), średnim
PRZEWODNIK DLA LEKARZY Przewodnik dla Lekarzy Produkt leczniczy CERDELGA jest wskazany do długotrwałego leczenia dorosłych pacjentów z chorobą Gauchera typu 1, ze słabym (PM, ang. poor metaboliser), średnim
Czym są biologiczne leki referencyjne i biopodobne. Dr nauk farm Leszek Borkowski Szpital Wolski Warszawa , godz. 10,00
 Czym są biologiczne leki referencyjne i biopodobne Dr nauk farm Leszek Borkowski Szpital Wolski Warszawa 27.02.2018, godz. 10,00 Nie biorównoważne a biopodobne W przypadku produktów biologicznych oraz
Czym są biologiczne leki referencyjne i biopodobne Dr nauk farm Leszek Borkowski Szpital Wolski Warszawa 27.02.2018, godz. 10,00 Nie biorównoważne a biopodobne W przypadku produktów biologicznych oraz
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY A. Leczenie infliksymabem 1. Leczenie choroby Leśniowskiego-Crohna (chlc)
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY A. Leczenie infliksymabem 1. Leczenie choroby Leśniowskiego-Crohna (chlc)
Leki chemiczne a leki biologiczne
 Leki chemiczne a leki biologiczne LEKI CHEMICZNE A LEKI BIOLOGICZNE Produkt syntezy chemicznej Produkt roślinny Produkt immunologiczny BIOLOGICZNE Produkt homeopatyczny Produkt z krwi/osocza - BIOLOGICZNE
Leki chemiczne a leki biologiczne LEKI CHEMICZNE A LEKI BIOLOGICZNE Produkt syntezy chemicznej Produkt roślinny Produkt immunologiczny BIOLOGICZNE Produkt homeopatyczny Produkt z krwi/osocza - BIOLOGICZNE
Aneks III. Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Aneks III Zmiany, które należy wprowadzić w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Ta Charakterystyka Produktu Leczniczego, oznakowanie opakowań i ulotka
Grupa SuperTaniaApteka.pl Utworzono : 30 wrzesień 2016
 TESTY CIĄŻOWE I DIAGNOSTYCZNE > Model : 9048435 Producent : HYDREX PRZED.TECH.HANDL. Testy paskowe Insight BIAŁKO Test są przeznaczone do wykonania ogólnego badania moczu w warunkach domowych. Testy BIAŁKO
TESTY CIĄŻOWE I DIAGNOSTYCZNE > Model : 9048435 Producent : HYDREX PRZED.TECH.HANDL. Testy paskowe Insight BIAŁKO Test są przeznaczone do wykonania ogólnego badania moczu w warunkach domowych. Testy BIAŁKO
LEKI CHEMICZNE A LEKI BIOLOGICZNE
 LEKI CHEMICZNE A LEKI BIOLOGICZNE PRODUKT LECZNICZY - DEFINICJA Art. 2 pkt.32 Ustawy - Prawo farmaceutyczne Substancja lub mieszanina substancji, przedstawiana jako posiadająca właściwości: zapobiegania
LEKI CHEMICZNE A LEKI BIOLOGICZNE PRODUKT LECZNICZY - DEFINICJA Art. 2 pkt.32 Ustawy - Prawo farmaceutyczne Substancja lub mieszanina substancji, przedstawiana jako posiadająca właściwości: zapobiegania
(Akty o charakterze nieustawodawczym) DECYZJE
 19.7.2019 PL L 193/1 II (Akty o charakterze nieustawodawczym) DECYZJE DECYZJA WYKONAWCZA KOMISJI (UE) 2019/1244 z dnia 1 lipca 2019 r. zmieniająca decyzję 2002/364/WE w odniesieniu do wymogów dotyczących
19.7.2019 PL L 193/1 II (Akty o charakterze nieustawodawczym) DECYZJE DECYZJA WYKONAWCZA KOMISJI (UE) 2019/1244 z dnia 1 lipca 2019 r. zmieniająca decyzję 2002/364/WE w odniesieniu do wymogów dotyczących
Lek BI w porównaniu z lekiem Humira u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą
 Lek w porównaniu z lekiem u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą Jest to podsumowanie badania klinicznego dotyczącego łuszczycy plackowatej. Podsumowanie sporządzono dla ogółu społeczeństwa.
Lek w porównaniu z lekiem u pacjentów z umiarkowaną lub ciężką łuszczycą plackowatą Jest to podsumowanie badania klinicznego dotyczącego łuszczycy plackowatej. Podsumowanie sporządzono dla ogółu społeczeństwa.
Technologie szybkich analiz. Szybkie oznaczenie kinetyczne zawartości mykotoksyn
 Technologie szybkich analiz Szybkie oznaczenie kinetyczne zawartości mykotoksyn Przegląd aokin AG Rapid Kinetic Assay innowacyjna metoda w analizach śladowych Oznaczanie mykotoksyn w systemie aokinmycontrol
Technologie szybkich analiz Szybkie oznaczenie kinetyczne zawartości mykotoksyn Przegląd aokin AG Rapid Kinetic Assay innowacyjna metoda w analizach śladowych Oznaczanie mykotoksyn w systemie aokinmycontrol
SPEŁNIENIE DRUGIEGO KRYTERIUM OCENY OFERT
 PN/9OL/09/0 Załącznik nr 8 SPEŁNIENIE DRUGIEGO KRYTERIUM OCENY OFERT PRZEDMIOT ZAMÓWIENIA: dostawy odczynników. Kryterium jakości odczynników (pakiety nr: -, 0-, 7) Nr Nazwa Parametry oceniane Wartość
PN/9OL/09/0 Załącznik nr 8 SPEŁNIENIE DRUGIEGO KRYTERIUM OCENY OFERT PRZEDMIOT ZAMÓWIENIA: dostawy odczynników. Kryterium jakości odczynników (pakiety nr: -, 0-, 7) Nr Nazwa Parametry oceniane Wartość
Ulotka dołączona do opakowania: informacja dla użytkownika. Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab
 Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem tego
Ulotka dołączona do opakowania: informacja dla użytkownika Synagis 100 mg/ml roztwór do wstrzykiwań Substancja czynna: paliwizumab Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem tego
Procedura szacowania niepewności
 DOKUMENTACJA SYSTEMU ZARZĄDZANIA LABORATORIUM Procedura szacowania niepewności Stron 7 Załączniki Nr 1 Nr Nr 3 Stron Symbol procedury PN//xyz Data Imię i Nazwisko Podpis Opracował Sprawdził Zatwierdził
DOKUMENTACJA SYSTEMU ZARZĄDZANIA LABORATORIUM Procedura szacowania niepewności Stron 7 Załączniki Nr 1 Nr Nr 3 Stron Symbol procedury PN//xyz Data Imię i Nazwisko Podpis Opracował Sprawdził Zatwierdził
Mycoplasma pneumoniae IgM ELISA
 Instrukcja Użytkownika Mycoplasma pneumoniae IgM ELISA EIA-3500 96 wells DRG Instruments GmbH, Germany Frauenbergstr. 18, D-35039 Marburg Telefon: +49 (0)64 21-1 700 0, Fax: +49-(0)6 42 1-170 0 50 Internet:
Instrukcja Użytkownika Mycoplasma pneumoniae IgM ELISA EIA-3500 96 wells DRG Instruments GmbH, Germany Frauenbergstr. 18, D-35039 Marburg Telefon: +49 (0)64 21-1 700 0, Fax: +49-(0)6 42 1-170 0 50 Internet:
ELIMINACJA ODRY/RÓŻYCZKI PROGRAM WHO REALIZACJA W POLSCE ZASADY INSTRUKCJE
 NARODOWY INSTYTUT ZDROWIA PUBLICZNEGO - PAŃSTWOWY ZAKŁAD HIGIENY ELIMINACJA ODRY/RÓŻYCZKI PROGRAM WHO REALIZACJA W POLSCE ZASADY INSTRUKCJE ZAKŁAD WIRUSOLOGII NIZP-PZH UL. CHOCIMSKA 24 00-791 WARSZAWA
NARODOWY INSTYTUT ZDROWIA PUBLICZNEGO - PAŃSTWOWY ZAKŁAD HIGIENY ELIMINACJA ODRY/RÓŻYCZKI PROGRAM WHO REALIZACJA W POLSCE ZASADY INSTRUKCJE ZAKŁAD WIRUSOLOGII NIZP-PZH UL. CHOCIMSKA 24 00-791 WARSZAWA
AmpliTest Salmonella spp. (Real Time PCR)
 AmpliTest Salmonella spp. (Real Time PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla bakterii z rodzaju Salmonella techniką Real Time PCR Nr kat.: BAC01-50 Wielkość zestawu: 50 oznaczeń Objętość
AmpliTest Salmonella spp. (Real Time PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla bakterii z rodzaju Salmonella techniką Real Time PCR Nr kat.: BAC01-50 Wielkość zestawu: 50 oznaczeń Objętość
Problemy płodności i ciąży w nieswoistych zapalnych chorobach jelit. Maria Kłopocka Bydgoszcz
 Problemy płodności i ciąży w nieswoistych zapalnych chorobach jelit Maria Kłopocka Bydgoszcz Płodność Przebieg ciąży i poród Bezpieczeństwo leczenia w okresie ciąży i karmienia Sytuacje szczególne Edukacja
Problemy płodności i ciąży w nieswoistych zapalnych chorobach jelit Maria Kłopocka Bydgoszcz Płodność Przebieg ciąży i poród Bezpieczeństwo leczenia w okresie ciąży i karmienia Sytuacje szczególne Edukacja
Teoria błędów. Wszystkie wartości wielkości fizycznych obarczone są pewnym błędem.
 Teoria błędów Wskutek niedoskonałości przyrządów, jak również niedoskonałości organów zmysłów wszystkie pomiary są dokonywane z określonym stopniem dokładności. Nie otrzymujemy prawidłowych wartości mierzonej
Teoria błędów Wskutek niedoskonałości przyrządów, jak również niedoskonałości organów zmysłów wszystkie pomiary są dokonywane z określonym stopniem dokładności. Nie otrzymujemy prawidłowych wartości mierzonej
Genomic Micro AX Blood Gravity 96-well
 Genomic Micro AX Blood Gravity 96-well Zestaw do izolacji DNA z krwi w formacie płytek na 96 studzienek dedykowany do pracy z pipetą wielokanałową lub automatem typu liquid handler. 960 izolacji Nr kat.
Genomic Micro AX Blood Gravity 96-well Zestaw do izolacji DNA z krwi w formacie płytek na 96 studzienek dedykowany do pracy z pipetą wielokanałową lub automatem typu liquid handler. 960 izolacji Nr kat.
Ulotka dołączona do opakowania: informacja dla pacjenta. DISTREPTAZA Streptokinaza + Streptodornaza j.m j.m. Czopki doodbytnicze
 Ulotka dołączona do opakowania: informacja dla pacjenta DISTREPTAZA Streptokinaza + Streptodornaza 15 000 j.m. + 1250 j.m. Czopki doodbytnicze Należy zapoznać się z treścią ulotki przed zastosowaniem leku,
Ulotka dołączona do opakowania: informacja dla pacjenta DISTREPTAZA Streptokinaza + Streptodornaza 15 000 j.m. + 1250 j.m. Czopki doodbytnicze Należy zapoznać się z treścią ulotki przed zastosowaniem leku,
INFORMACJE ZAMIESZCZANE NA OPAKOWANIACH BEZPOŚREDNICH
 WOREK 10 KG 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY proszek do sporządzania roztworu na skórę produkt złożony 2. ZAWARTOŚĆ SUBSTANCJI CZYNNYCH Co zawiera Ciechociński szlam leczniczy
WOREK 10 KG 1. NAZWA PRODUKTU LECZNICZEGO CIECHOCIŃSKI SZLAM LECZNICZY proszek do sporządzania roztworu na skórę produkt złożony 2. ZAWARTOŚĆ SUBSTANCJI CZYNNYCH Co zawiera Ciechociński szlam leczniczy
data ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1
 Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1 Cel: Wyznaczanie klirensu endogennej kreatyniny. Miarą zdolności nerek do usuwania i wydalania
Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 12 BIOCHEMIA MOCZU Doświadczenie 1 Cel: Wyznaczanie klirensu endogennej kreatyniny. Miarą zdolności nerek do usuwania i wydalania
Wpływ warunków przechowywania na wyniki oznaczeń poziomu przeciwciał w próbkach ludzkiej surowicy
 MED. DOŚW. MIKROBIOL., 2011, 63: 189-193 Wiesław Truszkiewicz Wpływ warunków przechowywania na wyniki oznaczeń poziomu przeciwciał w próbkach ludzkiej surowicy Wojewódzka Stacja Sanitarno-Epidemiologiczna
MED. DOŚW. MIKROBIOL., 2011, 63: 189-193 Wiesław Truszkiewicz Wpływ warunków przechowywania na wyniki oznaczeń poziomu przeciwciał w próbkach ludzkiej surowicy Wojewódzka Stacja Sanitarno-Epidemiologiczna
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gleptosil, 200 mg/ml, roztwór do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Gleptosil, 200 mg/ml, roztwór do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY 1 ml produktu
SNAP* BVD. Bovine Virus Diarrhea Antigen Test Kit. Zestaw diagnostyczny do wykrywania antygenu wirusa biegunki i choroby błon śluzowych bydła (BVD-MD)
 SNAP* BVD Bovine Virus Diarrhea Antigen Test Kit Zestaw diagnostyczny do wykrywania antygenu wirusa biegunki i choroby błon śluzowych bydła (BVD-MD) 06-20814-01 Bovine Virus Diarrhea Antigen Test Kit
SNAP* BVD Bovine Virus Diarrhea Antigen Test Kit Zestaw diagnostyczny do wykrywania antygenu wirusa biegunki i choroby błon śluzowych bydła (BVD-MD) 06-20814-01 Bovine Virus Diarrhea Antigen Test Kit
Kontrola i zapewnienie jakości wyników
 Kontrola i zapewnienie jakości wyników Kontrola i zapewnienie jakości wyników QA : Quality Assurance QC : Quality Control Dobór systemu zapewnienia jakości wyników dla danego zadania fit for purpose Kontrola
Kontrola i zapewnienie jakości wyników Kontrola i zapewnienie jakości wyników QA : Quality Assurance QC : Quality Control Dobór systemu zapewnienia jakości wyników dla danego zadania fit for purpose Kontrola
Dokładność i precyzja wydajności systemu Accu-Chek Active. Wprowadzenie. Metoda
 Dokładność i precyzja wydajności systemu Accu-Chek Active I. DOKŁADNOŚĆ Ocena dokładności systemu została przeprowadzona w odniesieniu do normy ISO 15197. Wprowadzenie Celem badania było określenie dokładności
Dokładność i precyzja wydajności systemu Accu-Chek Active I. DOKŁADNOŚĆ Ocena dokładności systemu została przeprowadzona w odniesieniu do normy ISO 15197. Wprowadzenie Celem badania było określenie dokładności
Genomic Mini AX Plant Spin
 Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
Genomic Mini AX Plant Spin Zestaw o zwiększonej wydajności do izolacji genomowego DNA z materiału roślinnego. wersja 1017 100 izolacji Nr kat. 050-100S Pojemność kolumny do oczyszczania DNA wynosi 15 μg.
Laboratorium Podstaw Biofizyki
 CEL ĆWICZENIA Celem ćwiczenia jest zbadanie procesu adsorpcji barwnika z roztworu oraz wyznaczenie równania izotermy Freundlicha. ZAKRES WYMAGANYCH WIADOMOŚCI I UMIEJĘTNOŚCI: widmo absorpcyjne, prawo Lamberta-Beera,
CEL ĆWICZENIA Celem ćwiczenia jest zbadanie procesu adsorpcji barwnika z roztworu oraz wyznaczenie równania izotermy Freundlicha. ZAKRES WYMAGANYCH WIADOMOŚCI I UMIEJĘTNOŚCI: widmo absorpcyjne, prawo Lamberta-Beera,
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
INSPEKCJA WETERYNARYJNA
 Poznań, dnia 17 kwietnia 2015 r. INSPEKCJA WETERYNARYJNA WIELKOPOLSKI WOJEWÓDZKI LEKARZ WETERYNARII Lesław Szabłoński do wszystkich wykonawców, którym przekazano SIWZ Nasz znak: AD-O.272.6.2015 Dot. sprawy
Poznań, dnia 17 kwietnia 2015 r. INSPEKCJA WETERYNARYJNA WIELKOPOLSKI WOJEWÓDZKI LEKARZ WETERYNARII Lesław Szabłoński do wszystkich wykonawców, którym przekazano SIWZ Nasz znak: AD-O.272.6.2015 Dot. sprawy
marketinginformacja Diagnostyka weterynaryjna Szybkie testy dla rolnictwa +++ dostępne w SalesPlusie +++
 marketinginformacja Data 24.10.2014 Numer Autor MI_FS_13_2014_Testy weterynaryjne Philipp Peters Diagnostyka weterynaryjna Szybkie testy dla rolnictwa +++ dostępne w SalesPlusie +++ Dzięki szybkim testom
marketinginformacja Data 24.10.2014 Numer Autor MI_FS_13_2014_Testy weterynaryjne Philipp Peters Diagnostyka weterynaryjna Szybkie testy dla rolnictwa +++ dostępne w SalesPlusie +++ Dzięki szybkim testom
Walidacja metod wykrywania, identyfikacji i ilościowego oznaczania GMO. Magdalena Żurawska-Zajfert Laboratorium Kontroli GMO IHAR-PIB
 Walidacja metod wykrywania, identyfikacji i ilościowego oznaczania GMO Magdalena Żurawska-Zajfert Laboratorium Kontroli GMO IHAR-PIB Walidacja Walidacja jest potwierdzeniem przez zbadanie i przedstawienie
Walidacja metod wykrywania, identyfikacji i ilościowego oznaczania GMO Magdalena Żurawska-Zajfert Laboratorium Kontroli GMO IHAR-PIB Walidacja Walidacja jest potwierdzeniem przez zbadanie i przedstawienie
Aneks III. Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta.
 Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Zestaw do wykrywania Anaplasma phagocytophilum w kleszczach, krwi i hodowlach komórkowych
 Nr kat. PK24N Wersja zestawu: 1.2016 Zestaw do wykrywania phagocytophilum w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Detekcja
Nr kat. PK24N Wersja zestawu: 1.2016 Zestaw do wykrywania phagocytophilum w kleszczach, krwi i hodowlach komórkowych dwie oddzielne reakcje PCR 2x50 reakcji PCR (50 µl), włączając w to kontrole Detekcja
Badanie uwalniania paracetamolu z tabletki. Mgr farm. Piotr Podsadni
 Badanie uwalniania paracetamolu z tabletki Mgr farm. Piotr Podsadni Co będziemy badać? Dlaczego jest to tak ważne? Metody Badania Produktu Aby produkt był zaakceptowany przez odbiorcę musi spełniać narzucone
Badanie uwalniania paracetamolu z tabletki Mgr farm. Piotr Podsadni Co będziemy badać? Dlaczego jest to tak ważne? Metody Badania Produktu Aby produkt był zaakceptowany przez odbiorcę musi spełniać narzucone
D I V I D E N D 030 FS
 Załącznik do decyzji MRiRW nr R-238/2012d z dnia 03.10.2012 r. zmieniającej zezwolenie MRiRW nr R-73/2008 z dnia 10.11.2008 r. Posiadacz zezwolenia: Syngenta Polska Sp. z o.o., ul. Powązkowska 44 c, 01-797
Załącznik do decyzji MRiRW nr R-238/2012d z dnia 03.10.2012 r. zmieniającej zezwolenie MRiRW nr R-73/2008 z dnia 10.11.2008 r. Posiadacz zezwolenia: Syngenta Polska Sp. z o.o., ul. Powązkowska 44 c, 01-797
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA HANDLOWA LEKU GOTOWEGO SALICYLOL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH (W PRZELICZENIU NA 100g)
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA HANDLOWA LEKU GOTOWEGO SALICYLOL 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH (W PRZELICZENIU NA 100g)
Pozostałe zapisy SIWZ nie ulegają zmianie.
 Znak sprawy: ZP/72/83/2017/PN/72 Dotyczy: Modyfikacji SIWZ Zabrze, 13.12.2017r. Dyrektor dr n. med. Dariusz Budziński ul. 3-go Maja 13-15 41-800 Zabrze SEKRETARIAT fax: (32) 370 45 22 sekretariat@szpital.zabrze.pl
Znak sprawy: ZP/72/83/2017/PN/72 Dotyczy: Modyfikacji SIWZ Zabrze, 13.12.2017r. Dyrektor dr n. med. Dariusz Budziński ul. 3-go Maja 13-15 41-800 Zabrze SEKRETARIAT fax: (32) 370 45 22 sekretariat@szpital.zabrze.pl
