LOKALIZACJA KOMÓRKOWA CYKLU ŻYCIOWEGO WIRUSÓW ROŚLINNYCH Z JEDNONICIOW YM RNA
|
|
|
- Stanisław Włodarczyk
- 6 lat temu
- Przeglądów:
Transkrypt
1 KOSMOS, 1992, 41 (2/3): ANNA RUDZIŃSKA-LANGWALD GRAŻYNA GARBACZEWSKA Wydział Rolniczy Katedra Botaniki SGGW Warszawa LOKALIZACJA KOMÓRKOWA CYKLU ŻYCIOWEGO WIRUSÓW ROŚLINNYCH Z JEDNONICIOW YM RNA Wirus infekując roślinę wprowadza do jednej z jej komórek swój genom i korzystając z układów enzymatycznych i organelli komórkowych odbywa swój cykl życiowy kończący się wytworzeniem potomnych cząstek wirusa. W opracowaniu zebrano dane dotyczące cyklu życiowego wirusów zawierających jako materiał genetyczny jednoniciowe RNA (ssrna). Wirusy tego typu stanowią ponad 75% wszystkich wirusów roślin wyższych. Ich cykl życiowy można podzielić na kilka etapów. Wirus realizuje program zawarty w jego genomie, a roślina dostarcza podłoża i środków do tego cyklu. Jest to dwustronny układ, w którym każdy z procesów zachodzi tylko wtedy efektywnie, gdy potrzeby wirusa napotykają na odpowiednie warunki danej rośliny. Poniższa tabela oraz rysunek przedstawiają kolejne etapy cyklu życiowego wirusa, oraz to, jakie przedziały komórki roślinnej stanowią obszar niezbędny do przebiegu tych etapów Wirus wejście wirusa, usunięcie płaszcza białkowego translacja białek wirusa replikacja RNA wirusa odłożenie gotowych cząstek oraz białek kodowanych przez genom wirusa i stanowiących inkluzje przemieszczanie się czynnika infekcyjnego do innych komórek Komórka roślinna ściana komórkowa, plazmalemma i cytoplazma system translacyjny komórki rybosomy, enzymy, trna struktury błoniaste komórki, podjednostki polimerazy miejsce gromadzenia cząstek cytoplazma, wakuola, jądro, mitochondria, chloroplasty struktury umożliwiające transport plazm odesmy
2 204 Anna Rudzińska-Langwald, Grażyna Garbaczewska W W j i n II'" ' ^i I I Y IfcUl Lokalizacja cyklu życiowego wirusów roślin z Jodnonlciowym RNA wnikanie wirusa tra n s la c ja k ie łe k w irusa rep lik acja wirusowego RNA (strzałk i wskazują Miejsca lo k alizacji dwuniciowego RNA) Miejsc* odkładania gotowych cząstek przehitszozani* się ozynni infekcyjnego-plazmodesma CHL - c h lo ro p la s t M - MitochondriuM CU - ścia n a komórkowa N - jąd ro CY - cu topi m m PL - plaimlomml ER - p łtlk u lu * endoplazwatyczn* U " wakuola
3 Lokalizacja komórkowa cyklu życiowego wirusów roślinnych Poszczególne procesy związane z replikacją wirusa przystosowują metabolizm komórki do potrzeb cyklu życiowego wirusa. Wynikiem tego jest powstanie wtrątów obcych białek w protoplaście oraz modyfikacja struktur komórkowych. Suma tych zjawisk przyczynia się do uruchomienia reakcji autoregulacyjnych i obronnych. Ta część reakcji rośliny została pominięta w powyższym opracowaniu. WNIKANIE GENOM U WIRUSA DO KOMÓREK ROŚLINY GOSPODARZA Proces wnikania cząstki wirusa do komorki roślinnej łączy się z pokonaniem bariery pomiędzy komórką gospodarza a środowiskiem zewnętrznym, jaką jest ściana^komórkowa. Z racji specyfiki budowy roślin, przy rozprzestrzenianiu się infekcji z komórki do komórki w obrębie jednej rośliny wirusy napotykają na zupełnie inne uwarunkowania niż przy pierwotnym wnikaniu do rośliny. Przez proces wnikania genomu wirusa rozumiemy te zjawiska, które związane są z pierwotną infekcją rośliny i zachodzą w trakcie cyklu życiowego wirusa w pojedynczym osobniku rośliny tylko jeden raz. Stanowi to zasadniczą różnicę w sposobie infekcji wirus roślina, w odróżnieniu od relacji wirus zwierzę lub bakteriofag bakteria, gdzie wniknięcie do każdej następnej komórki łączy się z powtarzającymi się procesami forsowania barier otaczających te komórki. Wirusy roślin mogą być wprowadzane do komórek przez: 1) adsorbcję na powierzchni liścia (inokulacja mechaniczna); 2) owady posiadające zarówno aparat gębowy ssący jak i gryzący; 3) nicienie; 4) grzyby; 5) kaniankę; 6) szczepienie oraz 7) przez pyłek i nasiona. Jednym z najbardziej kontrowersyjnych problemów związanych z wnikaniem wirusa do komórek roślin jest zagadnienie, co właściwie dostaje się do cytoplazmy cała cząstka wirusa, czy też tylko sam kwas nukleinowy. Jeżeli do cytoplazmy wnika tylko RNA wirusa, to usunięcie białek wirionu musi się odbywać poza protoplastem komórek. Proponowanymi miejscami odbiałczania RNA jest ściana komórkowa lub plazmolema. Wiązania hydrofobowe są związane z oddzieleniem wirusowego RNA od płaszcza białkowego in vitro. W komórce właśnie takimi hydrofobowymi miejscami mogą się okazać tłuszczowce kutikuli i/lub fosfolipidy plazmolemy. Hipoteza ta stała się szczególnie atrakcyjna w momencie, gdy stwierdzono, że wirusy pałeczkowate jednym końcem przyłączają się do kutikuli ściany komórkowej [27, 54]. Shaw [60,61] stwierdził, że proces oddzielania białek płaszcza cząstki wirusa mozaiki tytoniu (tobacco mosaic virus) odbywający się na kutikuli jest procesem dwustopniowym. Pierwszy etap jest biofizyczny, a dalsze są czułe na temperaturę i są związane z działaniem enzymów. Niestety Kurtz-Frisch i H i r t h [42] nie stwierdzili drugiego, wrażliwego na temperaturę etapu dla wirusów polihedrycznych.
4 206 Anna Rudzińska-Langwald, Grażyna Garbaczewska Obserwowano przyłączanie się wirionów również do powierzchni ściany komórkowej w przestrzeniach międzykomórkowych miękiszu asymilacyjnego [25]. W tego typu ścianach nie stwierdza się lipidów. Teren ten stanowi apoplast dostępny dla dyfuzji wody, a więc nie ma właściwości hydrofobowych. Po oddzieleniu cząsteczki RNA od płaszcza białek kapsydu pozostaje konieczność przedostania się nagiego RNA przez znaczne obszary ściany komórkowej, co wydaje się procesem dość trudnym. Wprawdzie w zewnętrznych ścianach skórki występują ektodesmy rozstępy nie zawierające żadnych utworów błoniastych ani plasmodesm, a wypełnione lipidami. Są to struktury pojawiające się i znikające w fibryllarnej konfiguracji ściany. Ze względu na swą budowę mogą stanowić kanały umożliwiające przejście wirionu lub RNA wirusa w kierunku protoplastu komórki. Proponowano je jako miejsca infekcji [5, 50, 65]. Merkens i de Zoeten (1979) nie stwierdzili cząstek wirusa X ziemniaka (potato virus X PVX) w ektodesmach ani w ścianie komórkowej, ale nie wyklucza to przemieszczania się nagiego RNA wirusowego w tych strukturach. Innym prawdopodobnym miejscem oddzielania białek kapsydu jest plazmolema. Potwierdzają to badania nad izolowanymi fosfolipidami błon [39], C o o k i n g [11] obserwował przyłączanie się jednym końcem cząstek TMV do błon protoplastów owoców pomidora. D u r n g h a m [16] proponował, że TMV i inne wirusy mogą być odbiałczane na plazmolemie dzięki różnicy stężeń jonów wapnia pomiędzy wnętrzem komórki a otoczeniem. Poza komórką stężenie jonów wapniowych wynosi średnio 10~3 M jonów wapniowych, a w komórce stężenie to spada do 10-7 M. Wiele wirusów jest stabilizowanych tymi jonami. Zmniejszenie ich stężenia może w istotny sposób wpłynąć na rozluźnienie wiązań wewnątrzcząsteczkowych. Jednak nie wszystkie wirusy wiążą jony wapnia. Nie wydaje się więc, by zjawisko to miało charakter uniwersalny. Wydaje się, że wnikanie wirusów roślin do komórki nie jest związane ze specjalnymi miejscami adsorpcji na plazmolemie, jak to ma miejsce przy wnikaniu RNA bakteriofagów do komórek bakterii, czy też wirusów zwierzęcych do komórek ich gospodarzy [6]. Spośród wirusów roślin zawierających w cząstce ssrna większość ma w budowie wirionu tylko jeden rodzaj polipeptydu (z wyjątkiem grupy wirusa ostrej mozaiki grochu pea enation mosaic virus PEMV oraz comowirusów, w których cząstkach są dwa rodzaje białka). Nie występują również ani glikolipidy, ani glikoproteidy [52], które w wypadku wirusów zwierzęcych uznane zostały za receptory, dzięki którym cząstki wirusa adsorbują się na powierzchni komórek. Powierzchnia komórek roślinnych wygląda inaczej przede wszystkim ze względu na istnienie ściany komórkowej. Po drugie, nawet jeśli istnieje glikokaliks na powierzchni plazmolemy komórek roślinnych, to nie jest on specjalnie rozbudowany [32]. W tej warstwie z kolei występują receptory komórkowe powodujące adsorpcję cząstek wirusa na powierzchni komórek zwierzęcych i bakteryjnych.
5 Lokalizacja komórkowa cyklu życiowego wirusów roślinnych Pewnych informacji na temat wnikania wirusów dostarczają badania protoplastów komórek roślinnych. Zaobserwowano tworzenie się pęcherzyków pinocytotycznych, wewnątrz których znajdowały się cząstki wirusa. Wskazuje to na pinocytozę jako możliwą drogę wnikania cząstek wirusów do cytoplazmy [7, 11, 38, 64]. Nie wiadomo jednak jak odbywa się przejście cząstki wirusa z pęcherzyka pinocytotycznego do cytoplazmy i co się z nią dzieje w trakcie tego procesu. Wyniki te przypominają w znacznym stopniu wnikanie do komórek zwierzęcych takich małych RNA wirusów jak picornawirusy. Jednak jest to zjawisko sztuczne, ponieważ nastąpiło usunięcie ściany komórkowej, a także z powodu dodania do pożywki związku uszkadzającego plazmolemę i powodującego powstawanie pęcherzyków pinocytotycznych poly-l-ornityny (PLO). Drugą możliwą drogą wnikania cząstek wirusa do protoplastów są uszkodzenia plazmolemy pod wpływem kompleksu wirus PLO. Tak więc wnikanie cząstek wirusów roślinnych do protoplastów jest procesem biernym, głównie związanym z fizycznymi (elektrostatycznymi) siłami pomiędzy protoplastem a cząstką wirusa i to różni ten proces w porównaniu z wnikaniem picomawirusów. Inną możliwością jest to, że do cytoplazmy dostaje się cała cząstka wirusa. Fakt ten pozostawałby w sprzeczności ze sposobem wnikania bakteriofagów i wirusów zwierzęcych. Jednak założenie, że dochodzi do kontaktu między cytoplazmą i całą cząstką wirusa, wydaje się logiczne, jeśli traktować różne sposoby rozprzestrzeniania się wirusów jako jednolity proces. Przenoszenie wirusa przez owady, nicienie i grzyby odbywa się w swym założeniu z uszkodzeniem komórki. Istnieje szereg pośrednich dowodów sugerujących, że do cytoplazmy wnika cała cząstka wirusa. Naświetlanie ultrafioletem inaktywuje kwasy nukleinowe, gdy nie są one osłonięte białkami. Naświetlanie UV roślin inokulowanych wirusem mozaiki tytoniu TMV hamowało infekcję, dopiero gdy wykonano je w trzy godziny po inokulacji. Natomiast jeśli inokulowano rośliny samym RNA wirusa, to osiągnięto efekt hamujący infekcję przy naświetlaniu ultrafioletem bezpośrednio po inokulacji. Z drugiej strony fakt, że możliwa jest inokulacja roślin nagim RNA wirusowym znaczy, że przy procesie wnikania wirusa do komórek nie jest potrzebne białko płaszcza. Możliwe jest jednak, że białko płaszcza potrzebne jest przy dalszych etapach cyklu życiowego wirusa, odbywającego się w cytoplazmie komórek. Obecność białek płaszcza lub odcinka RNA kodującego to białko jest niezbędna do namnażania się wirusa mozaiki lucerny (alfalfa mosaic virus AMV) oraz wirusów z grupy ilarvirus. Białko to prawdopodobnie umożliwia rozpoznanie RNA tych wirusów przez polimerazę. Interesującą hipotezę wysuwa W i 1 s o n [70]. Łączy ona oddzielanie białek kapsydu od wirusowego RNA z dalszymi etapami cyklu życiowego. Przy końcu 5 RNA znajduje się informacja dotycząca tworzenia się polipeptydów polimerazy RNA. Odbiałczanie cząstki (dla wirusów nitkowatych) zaczyna się od końca 5, o czym wiemy z badań in vitro. Gdy nienaruszona cząstka wirusa wniknie do cytoplazmy, jej proces odbiałczania zaczyna się podobnie. Powoduje to odsłonięcie odcinka RNA kodującego polimerazę, przyłączenie się do niego
6 208 Anna Rudzińska-Langwald, Grażyna Garbaczewska rybosomów i powstanie polimerazy. W tym czasie odbywa się odbialczanie przesuwające się do końca 3. Gdy ten proces zostanie zakończony, polimeraza przesuwa się do końca 3', hamuje translację i zaczyna się tworzenie nici (-)RNA. Tłumaczy to fakt, że polimeraza powstaje jako jedno z białek wczesnych i że powstaje jej stosunkowo mało. Machida i Kiho (1970) i K i h o (1970 i 1972) inokulowali tytoń TMV, którego RNA był znakowany pierwiastkami radioaktywnymi Stwierdzili, że w cytoplazmie komórek znajduje się opłaszczony RNA wirusowy. Taki niecałkowicie odbiałczony RNA przyłącza się do rybosomów osadzonych na błonach retikulum endoplazmatycznego. Jeśli inokuluje się rośliny nagim RNA wirusa, to przyłączy się on wyłącznie do wolnych rybosomów, występujących w cytoplazmie. PRODUKCJA BIAŁEK WCZESNYCH WIRUSA Genom wirusa po wniknięciu do komórki roślinnej i uwolnieniu z białek kapsydu działa jako matryca do produkcji białek. Koduje on 4 7 polipeptydów w zależności od wirusa. Białka otoczki powstają w końcowej fazie cyklu życiowego. Natomiast wczesnym i kluczowym białkiem dla dalszych etapów cyklu życiowego wirusa jest polimeraza RNA zależna od RNA. Indukowaną przez infekcję wirusową aktywność polimerazy stwierdzili Z a i t 1 i n i wsp. [72], Z a b e 1 i wsp. [73] i L e R o y i wsp. [77]. Cząsteczka polimerazy jest stosunkowo duża. Jej wielkość często przekracza pojemność informacyjną wirusowego RNA. Dlatego przypuszcza się, że tylko jeden z polipeptydów wchodzących w skład polimerazy jest kodowany przez genom wirusa, pozostałe zaś przez genom komórki [33]. Wyniki te korespondują z tym co wiemy o replikazie produkowanej przez RNA bakteriofagi, takie jak Qß i MS2. Polimeraza tych wirusów jest heterooligomerem zbudowanym z czterech podjednostek. Trzy z tych polipeptydów kodowane są przez genom bakterii, jeden przez genom wirusa. Polipeptydy kodowane przez komórkę bakterii w niezakażonych komórkach spełniają zupełnie inną rolę. Jeden z tych polipeptydów jest białkiem rybosomowym, odpowiedzialnym za rozpoznanie przez rybosomy regionów inicjalnych mrna. Dwa pozostałe białka to faktory elongacyjne uczestniczące przy wydłużaniu łańcucha polipeptydowego. Polimeraza RNA wirusów roślinnych związana jest z frakcją membranową komórki. Ten związek enzymu z błonami jest również charakterystyczny dla analogicznej polimerazy produkowanej przez wirusy zwierzęce pikornawirusy. Fakt związania polimerazy z błonami sugeruje, że polipeptydy wchodzące w jej skład i kodowane przez roślinę są białkami błon komórkowych. Produkcja białek na matrycy wirusowego RNA odbywa się z użyciem rybosomów cytoplazmatycznych, gdyż większość tego typu translacji jest podatna na cykloheksamid, a nie podatna na chloramfenikol.
7 Lokalizacja komórkowa cyklu życiowego wirusów roślinnych Zostało jednak udowodnione w warunkach in vitro, że białka otoczki TMV mogą być syntetyzowane na rybosomach 70S pochodzących zarówno z Escherichia coli [29], jak i na rybosomach chloroplastów szpinaku [9]. W trakcie infekcji wzmaga się produkcja rybosomów. L a f 1 e t h e i Bove [43] stwierdzili wzrost inkorporacji H 3 tymidyny do jąderka komórek podlegających infekcji wirusem żółtej mozaiki rzepy (turnip yellow mosaic virus TYMV) i TMV. Wzrost ilości rybosomowego RNA przypada na okres przed powstaniem potomnych cząstek wirusa [24]. Wczesnymi zmianami zachodzącymi w komórkach roślin zainfekowanych przez większość wirusów roślinnych jest pojawienie się w cytoplazmie regionów bogatych w polisomy oraz w cysterny szorstkiego retikulum endoplazmatycznego. REPLIKACJA WIRUSOWEGO RNA Polimeraza RNA specyficzna dla replikacji wirusowego genomu jest enzymem związanym z błonami. Wiele grup wirusów roślinnych powoduje powstawanie w komórce pęcherzyków w wyniku inwaginacji błon różnych struktur komórkowych. Pęcherzyki te zawierają wewnątrz fibryllarny materiał. W niektórych wypadkach stwierdzono, że jest to jedno- i dwuniciowy RNA. Szczepy wirusa żółtej mozaiki rzepy (turnip yellow mosaic virus TYMV) powodują tworzenie się pęcherzyków będących wpukleniem zewnętrznych błon chloroplastu. Pęcherzyki te nie tracą kontaktu z błoną, z której powstały i otwierają się szyjką do cytoplazmy. Hatta i Matthews [36] proponują kolejne zmiany w komórkach chińskiej kapusty wywołane namnażaniem się TYMV. Najwcześniej tworzą się pęcherzyki w peryferycznych częściach chloroplastów. W cytoplazmie przylegającej do chloroplastów pojawiają się male ilości błon o nieznanym pochodzeniu, prawdopodobnie retikulum endoplazmatycznego. W chloroplastach zwiększa się liczba pęcherzyków. Jednocześnie w cytoplazmie przylegającej do zmieniających się chloroplastów pojawiają się cysterny retikulum endoplazmatycznego, gładkie do strony chloroplastu i z rybosomami po stronie przeciwnej. W następnej fazie cysterny te zanikają, a pojawiają się przestrzenie cytoplazmy przepuszczalne dla elektronów. W przestrzeniach tych znajduje się białko otoczki wirusa. W dalszych etapach następuje skupianie się chloroplastów w większe agregaty, a w cytoplazmie pojawiają się cząstki wirusa. Autorzy sugerują, że do cytoplazmy wydostają się z pęcherzyków replikacyjnych potomne nici ( ) wirusowego RNA. W trakcie przesuwania się RNA przez szyjkę pęcherzyka zostaje ono opłaszczone przez białka kapsydu zgromadzone w cytoplazmie. W ustawianiu podjednostek białkowych przy montażu cząstek uczestniczy błona tworząca szyjkę pęcherzyka. Poniższa tabela obrazuje udział błon różnych struktur komórkowych w powstawaniu pęcherzyków.
8 210 Anna Rudzińska-Langwald, Grażyna Garbaczewska Grupa wirusów Występowanie wirusów i ich pochodzenie cząstki o symetrii helikalnej genom wirusa zawarty w jednej cząsteczce R N A Tobamowirusy długość cząsteczki 300nm Brak doniesień o pęcherzykach zawierających to bacco mosaic virus MTV RNA Potexwirusy długość cząsteczki nm Brak doniesień o pęcherzykach zawierających potato virus X RNA Carla wirusy długość cząsteczki nm Brak doniesień o pęcherzykach zawierających potato virus M PVM RNA potato virus Y PVS W cytoplazmie pojedyncze pęcherzyki niewia domego pochodzenia Potywirusy długość cząsteczki nm potato virus Y PVY Closterowirusy długość cząsteczki nm Pęcherzyki w grupach otoczone zewnętrzną beet yellows virus BYV błoną. Pochodzenie ich nie jest jasne [17, 18] Tobra wirusy długość cząsteczki 185 i 48nm (można zna leźć również cząsteczki o dł. loonm) tobacco rattle virus TRV pepper ringspot virus PRV Hordeiwirusy długość cząsteczkillonm, 126nm i 148nm barley stripe mosaic virus BSMV genom dwudzielny genom trójdzielny Pęcherzyki pochodzące z inwaginacji błon otaczających chloroplast [13, 53] cząstki o symetrii icosahedrycznej Tombuswirusy średnica cząstki 30nm tomato bushy stunt virus TBSV tobacco necrosis virus średnica cząstki 25 30nm Sobemo wirusy średnica cząstki 30nm southern bean mosaic virus velvet tobacco mottle virus virusoid Pęcherzyki pochodzące z błon mitochon- driów [34] genom wirusa zawarty w jednej cząsteczce RNA Duże owalne, wielopęcherzykowe struktury pochodzące z peroksyzomów [58] i mitochondriów [59] Brak doniesień o pęcherzykach zawierających RNA Pęcherzyki pochodzące z retikulum endoplazmatycznego [69] Dwuniciowe RNA wirusa obserwowane w cytoplazmie, nie otoczone błonami [21] Tymowirusy średnica cząstki 30nm turnip yellow mosaic virus TYMV Pęcherzyki pochodzące z zewnętrznej błony chloroplastu [45]
9 Luteowirusy średnica cząstki 25nm barley yellow dwarf v. BYDV beet western yellows v. BWYV potato leafroll virus PLRV maize chlorotic dwarf virus średnica cząstki 30nm pea enation mosaic virus średnica cząstek 29 i 34nm Lokalizacja komórkowa cyklu życiowego wirusów roślinnych Comowirusy średnica cząstek 25nm broadbean true mosaic virus BBTMV cowpea mosaic virus CMV BYDV ma dwie podgrupy; 1. jednobłonowe pęcherzyki w cytoplazmie i cząstki wirusa najwcześniej obserwowane w cytoplazmie, 2. pęcherzyki dodatkowo otoczone błoną retikulum endoplazmatyczneego [28] BWYV pęcherzyki pochodzące z retikulum endoplazmatycznego [19]. PLRV pęcherzyki otoczone pojedynczą błoną w cytoplazmie oraz otoczone błonami retikulum endoplazmatycznego i w przestrzeni perynukleamej [62] Brak doniesień o pęcherzykach zawierających RNA genom dwudzielny Pęcherzyki pochodzące z wewnętrznej błony jądrowej przemieszczają się do cytoplazmy dodatkowo otoczone zewnętrzną błoną jądrową [7] Jednobłonowe pęcherzyki których, pochodzenie jest niepewne: diktiosomy, retikulum endoplazmatyczne lub zewnętrzna błona jądrowa [51] Nepowirusy średnica cząstek 28nm Pochodzenie pęcherzyków jak comowirusów Cucumowirusy średnia cząstek 30nm cucumber mosaic virus CMV tomato aspermy virus TAV peanut strunt virus PSV Bromowirusy średnica cząstek 26nm brom mosaic virus BMV cowpea chlorotic mottle V CCMV Ilarwirusy średnica cząstek 27nm, 30nm, 35nm tobacco streak virus TSV alfalfa mosaic virus cząstki pałeczkowate genom trójdzielny Pęcherzyki powstają przez wpuklenie się tonoplastu do wakuoli [35] CMV i TAV [41] PSV. Ponieważ obecne są również pęcherzyki jednobłonowe w cytoplazmie, możliwe jest, że powstają przez oderwanie się z retikulum endoplazmatycznego i migrują do tonoplastu, z którym się łączą. W dwóch wypadkach powstają z diktiosomów: TAV w Chrysanthemum murifolium [46] i CCMV w Nicotiana glutinosa [26] Pęcherzyki pochodzące z błon retikulum endoplazmatycznego i błony jądrowej, występujące z przestrzeni wewnątrz retikulum [8, 40] Jednobłonowe pęcherzyki pochodzące z diktiosomów lub retikulum endoplazmatycznego [10] Jednobłonowe pęcherzyki w cytoplazmie i na tonoplaście [15, 57] -f
10 212 Anna Rudzińska-Langwald, Grażyna Garbaczewska Przegląd ten wskazuje, że właściwie wszystkie rodzaje błon występujące w protoplaście komórki mogą uczestniczyć w procesach replikacji wirusa. W dużej mierze jest to zależne od wirusa, gdyż obserwuje się, że ten sam wirus w różnych gatunkch roślin gospodarzy powoduje powstanie podobnych zmian cytologicznych. Jednak istnieją i takie przykłady, gdzie określony wirus w różnych gospodarzach powoduje proliferacje różnych rodzajów błon komórki. Pęcherzyki zachowujące ciągłość z błoną, z której powstały, mogą funkcjonować tak jak opisano dla TYMV. Otwierają się one kanalikiem do cytoplazmy, niezależnie od tego z jakich struktur pochodzą. Jest to logiczne ze względu na fakt translacji wirusowego RNA przez rybosomy cytoplazmatyczne. Jednak pęcherzyki wytwarzane przez luteowirusy podlegają licznym metamorfozom i ich mechanizm działania nie jest już tak oczywisty. Natomiast jednobłonowe pęcherzyki np. comowirusów, powstające przez oderwanie się fragmentu retikulum endoplazmatycznego lub od diktiosomu, stanowią zamkniętą przestrzeń ograniczoną ciągłą błoną. Wydaje się, że uwolnienie się z pęcherzyka produktów replikacji powinno się odbywać przez rozerwanie błony otaczającej pęcherzyk i co za tym idzie zniszczenie go. Dla pięciu grup wirusów roślin pęcherzyków w komórkach zainfekowanych nie znaleziono. Są to przede wszystkim wirusy o symetrii helikalnej i genomie zawartym w jednej nici. Przyczyny tego mogą być dwojakie. Najprostszym wytłumaczeniem tego byłaby niedostatecznie wnikliwa obserwacja lub niewłaściwy czas tej obserwacji. Z drugiej strony dla TMY nie opisano struktur pęcherzykowatych, a wirus ten był badany bardzo wnikliwie i przez wielu badaczy. Wiemy, że polimeraza indukowana przez TMV jest związana z błonami, na których występują rybosomy. Powodowane przez TMV zmiany w komórkach (poza agregatami cząstek wirusa) ograniczają się do powstania regionów cytoplazmy zawierających kompleks rybosomów, cystern retikulum endoplazmatycznego, małe pęcherzyki lub wakuole, białka wirusa w granularnej lub tubularnej formie oraz niewielkie ilości cząstek wirusa. Wśród struktur tych nie zaobserwowano pęcherzyków z flbryllarnym materiałem. W wypadku velvet tobacco mottle virus (VTMV) zaobserwowano jednoniciowy i dwumciowy RNA występujący bezpośrednio w cytoplazmie, nie otoczony żadnymi błonami. Tak więc wydaje się, że nie dla wszystkich wirusów roślinnych mających ssrna występuje model replikacji z pęcherzykami tworzonymi z błon komórek roślin gospodarzy. PRZEMIESZCZANIE SIĘ WIRUSÓW W ROŚLINIE Cykl wirusów zwierzęcych i bakteriofagów kończy się lizą komórki, w której się namnażały. Uwolnione do płynu ustrojowego lub podłoża cząstki wirusów są zdolne do infekowania następnych komórek. W cyklu życiowym omawianych wirusów roślinnych nie występuje ten etap. W całym okresie infekcji rośliny wirus nie opuszcza jej symplastu. Korzysta on z połączeń wewnątrzsymplastowych jako dróg transportu i inwazji następnych komórek. Przemieszczając się
11 Lokalizacja komórkowa cyklu życiowego wirusów roślinnych z komórki do komórki, korzysta z istniejących pomiędzy komórkami plasmodesm. Taki typ rozprzestrzeniania się nazywamy transportem z komórki do komórki lub krótkodystansowym. Drugi rodzaj transportu to transport długodystansowy z wykorzystaniem tkanek przewodzących. Najszerzej uznawaną i prawdopodobnie jedyną drogą translokacji wirusa z komórki do komórki są plasmodesmy. Liczba tych struktur w ścianie komórkowej oraz ich umiejscowienie wpływa na kierunek rozprzestrzeniania się infekcji. Ich średnica wynosi nm. W najprostszym typie występuje tylko cytoplazma podstawowa. Zwykle budowa plasmodesmy jest bardziej złożona. Według jednego z modeli przez światło plasmodesmy przebiega desmotubula będąca przekształceniem siateczki retikulum endoplazmatycznego [56]. Powoduje to zawężenie światła. W wielu wypadkach średnica cząstki wirusa lub grubość cząstek nitkowatych przekracza szerokość przestrzeni wewnątrz plasmodesmy dostępnej do penetracji przez te cząstki. Wiele danych wskazuje ponadto, że proces przechodzenia substancji przez plasmodesmy nie jest mechaniczny, gdyż obserwacja struktury zwężonych części plasmodesmy wskazuje, że przy końcach występuje skomplikowany mechanizm przepustowy decydujący, jakiej wielkości i jakie cząstki mogą być transportowane przez światło plasmodesmy. Cytologiczne obserwacje wskazują, że wiele grup wirusów zmienia strukturę plasmodesm. Comowirusy i nepowirusy powodują powstanie tubuli, wewnątrz których ułożone są cząstki wirusa. Kompleksy wirusowych cząstek i tubul znajdują się w sąsiedztwie plasmodesmy, wchodząc do jej środka jednym końcem i konfiguracji tej towarzyszy przerost ściany komórkowej. Następuje więc modyfikacja kształtu plasmodesmy. Również inne wirusy modyfikują kształt i wielkość plasmodesm, szczególnie powiększając przestrzeń znajdującą się w środkowej jej części. Łączy się to zwykle z występowaniem cząstek w ich świetle. Jednak dla wielu wirusów, mimo licznych prac związanych z cytologicznymi zmianami powodowanymi przez te wirusy, nie zaobserwowano ich cząstek w plasmodesmach. Dobrym przykładem jest tutaj TMV. Abstrahując od morfologii samych plazmodesm, coraz więcej mamy danych o tym, że transport wirusów jest związany ze specyficznymi białkami kodowanymi przez wirusa. Pierwsze sugestie dotyczące istnienia wirusowych białek transportowych dotyczyły badań nad mutantami wirusa mozaiki tytoniu TMV. Przemieszczanie się cząstek wirusa w roślinie było zależne od tego, w jakich temperaturach następował rozwój roślin. Wirus rozprzestrzeniał się na całą roślinę, gdy rośliny rosły w niskich temperaturach, a nie przemieszczał się, gdy wzrost roślin zachodził w wysokich temperaturach. Zależne to było od kodowanego przez genom wirusa białka, które było wrażliwe na temperaturę [55]. Mutanty mające upośledzony w wyższych temperaturach transport miały zmienioną sekwencję aminokwasów w białku 30Da w stosunku do szczepu dzikiego. Białku temu zaczęto przypisywać funkcje transportowe.
12 214 Anna Rudzińska-Langwald, Grażyna Garbaczewska Oczyszczono i zbadano szereg różnych białek, którym przypisuje się funkcje transportowe. Są to: 30 kda białko produkowane przez wirus mozaiki tytoniu (TMV), 32kDa białko produkowane przez wirus mozaiki lucerny (ALMV, 48/58 kda białka produkowane przez comowirusy, 35 kda białko produkowane przez wirusa nekrotycznej mozaiki koniczyny czerwonej (red clover necrotic mosaic virus RCNMV) oraz 46,42 i 38 kda białka produkowane przez wirusa mozaiki kalafiora CaMV. (CaMV jest wirusem ds DNA, dane o białku transportowym tego wirusa przytaczane są tu ze względu na analogie z RNA wirusami). Porównawcze badania białek transportowych produkowanych przez ALMV, brome mosaic virus BMV i TMV, wskazują na brak homologii w sekwencji aminokwasów między tymi białkami, mimo ich zbliżonej wielkości [12]. Może to być wynikiem gatunkowej odrębności roślin gospodarzy dla wirusów produkujących te białka. Z drugiej jednak strony może również odzwierciedlać różnice w funkcjonowaniu białek transportowych. H ull i Atabekov i Tali a n s k y [37] podzielili wirusy roślinne na szereg odrębnych grup biorąc pod uwagę właściwości białek transportowych. Białko 30kDa produkowane przez TMV lokalizowane jest specyficznie w świetle plasmodesm [66]. Białka transportowe produkowane przez comowirusy specyficznie lokalizowane są wokół tworzących się tubul z wirusami. Ponieważ tubule te wchodzą w kontakt z plazmodesmami, zasocjowane z nimi białko również znajduje się w płasmodesmach. 32 kda białko produkowane przez CaMV lokalizowane jest w ścianie komórkowej dookoła zmodyfikowanych plasmodesm [49]. Białko transportowe 32 kda produkowane przez ALMV lokalizowane są w blaszce środkowej, nie tworząc specyficznego zgrupowania przy płasmodesmach [30,63]. Ponadto białko 30 K TMV i białko produkowane przez wirusa mozaiki ogórka (Cucumber Mosaic Virus CMv) lokalizowane jest na terenie jądra. Mechanizm działania wirusowych białek transportowych w chwili obecnej jest nie w pełni zrozumiały. A tabekov i Dorokhov [1] sugerowali dwa możliwe sposoby działania tych białek. Jeden z nich polegałby na stworzeniu przepustowości plasmodesm dla cząstek wirusa. Rzeczywiście białko 30 kda produkowane przez TMV w roślinach transgenicznych zmienia przepuszczalność plazmodesm, pozwalając na przenikanie przez nie znacznie większych cząstek desktranów [71]. Drugi mechanizm polegałby na modyfikacji lub zahamowaniu reakcji komórki na wirusową replikację, reakcji zmierzającej do ograniczenia wirusa do jednej komórki. Lokalizacja białek transportowych w jądrze wskazuje na realność tej ewentualności. Niezależnie od mechanizmu działania samych białek transportowych kodowanych przez genom wirusa transport wirusa wymaga ekspresji dwóch genomów: wirusowego i roślinnego. Białka transportowe powinny znaleźć w roślinie pewne kodowane przez nią faktory po to, aby móc wypełnić swoją funkcję transportową. Poszczególne wirusy mogą sobie wzajemnie pomagać w transporcie, nawet jeśli należą do odrębnych grup transportowych. Pomocniczy wirus wprowadzo
13 Lokalizacja komórkowa cyklu życiowego wirusów roślinnych ny do rośliny zmienia rodzaj infekcji, np. wirus X ziemniaka (potato virus X PVX) pomaga TMV przemieszczać się w roślinach pomidora mających gen odporności m2 na wirusa mozaiki tytoniu. Wydaje się ponadto, że w symplaście rośliny, mimo połączenia poszczególnych protoplastów plasmodesmami, istnieją pewne regiony wydzielone. Cloris striate mosaic wirus CSMV namnaża się w liściach Cloris z wyjątkiem komórek epidermy [22]. Wirus liściozwoju ziemniaka PLRV jest wirusem ograniczonym do łyka. Namnaża się on w mających jądro komórkach łyka i może się przemieszczać w całej roślinie w obrębie łyka. Znaczy to, że jest on w stanie przechodzić przez plasmodesmy łączące komórki łyka. Znany jest również fakt, że PLRV namnaża się w protoplastach pochodzących z komórek miękiszu asymilacyjnego. Jednak w warunkach całej rośliny wirus ten nie namnaża się poza łykiem. Sądzi się [3, 4], że wspólna inokulacja wirusem Y ziemniaka (potato virus Y PYV) i PLRV powoduje przemieszczanie się PLRV do komórek mezofilu. Drugim typem przemieszczania się wirusów jest transport na duże odległości. Istnieją dwie możliwe drogi tego transportu: przez elementy łyka i przez elementy drewna. Główną drogą tego typu transportu wydaje się łyko. W rurkach sitowych obserwowano cząstki różnych wirusów. Raczej do rzadkości należą dane o przemieszczaniu się wirusów przez elementy drewna jak to ma miejsce przy wirusach przenoszonych przez chrząszcze. O ile transport w łyku odbywa się w obrębie symplastu rośliny, o tyle transport przez cewki i naczynia to transport apoplastowy. Nie ma jednak żadnych informacji jak wirusy dostają się do apoplastu i jak przemieszczają się z drewna do protoplastów komórek podtrzymujących ich replikację. Dotychczas nie stwierdzono, co stanowi czynnik przemieszczany zarówno w trakcie transportu krótko-jak i długodystansowego. Najprościej jest założyć, że są to cząstki wirusa. Występowanie cząstek wirusa w plasmodesmach i w świetle rurek sitowych wydaje się potwierdzać to założenie. Jednak doświadczenia z TMV i ALMV wskazują, że infekcja sąsiednich komórek odbywa się zanim w komórce stanowiącej źrodło infekcji pojawi się znacząco duża liczba cząstek wirusa. Ponadto mutanty wirusów, które nie mają zdolności tworzenia całkowitych cząstek, mogą przemieszczać się z komórki do komórki. W tej sytuacji przemieszczać się powinien nagi RNA wirusa. Jednak taki RNA jest bardzo podatny na trawienie endonukleazami znajdującymi się w komórce. Mutanty takie nie dają na ogół infekcji systemicznej, gdyż upośledzony jest ich transport na długie odległości. A tabekov i Dorokhov[l] sugerowali, że transportowi podlegają wirusowo specyficzne rybonukleoproteidy inne niż cząstki wirusa. Zagadnienia transportu wirusa w obrębie jednej rośliny są nadal jeszcze słabo poznane. Wiele faktów wskazuje jednak na to, że dwa rodzaje tego transportu z komórki do komórki i transport na dalsze odległości podlegają innym uwarunkowaniom i stanowią dwa odrębne procesy.
14 216 Anna Rudzińska-Langwald, Grażyna Garbaczewska INKLUZJE BIAŁEK WIRUSOWYCH W trakcie wirusowej replikacji pojawiają się inkluzje różnego rodzaju białek. Ze względu na specyficzne kształty tych inkluzji i miejsce ich odkładania stanowią one charakterystyczną cechę dla infekcji danym wirusem lub grupą wirusów [45]. Jednak obecnie nie wiadomo jaka jest funkcja tych białek. Do najbardziej znanych należą inkluzje cylindryczne tworzone przez grupę potywirusów. Są to struktury utworzone z płaskich agregatów białkowych tworzących arkusze. Arkusze takie są nieco zgięte i w klasycznym wypadku przylegają krawędziami do siebie, tworząc strukturę na kształt koła statku parowego. Na przekrojach poprzecznych wygląda to jak rodzaj rozety. W innych wypadkach struktury te nie są tak regularne i tworzą różnego rodzaju zwitki lub płaskie struktury. Białka inkluzji cylindrycznych są kodowane przez genom wirusa, nie są jednak białkami kapsydu. Obserwowano kontakt inkluzji cylindrycznych z plazmolemą, do której inkluzje te przylegają jednym końcem. Obserwacja ta była przyczyną łączenia funkcji białek inkluzji z białkiem transportowym [44], co jednak dotychczas nie zostało potwierdzone. Wirus X ziemniaka (potato virus X PVX) wywołuje powstawanie specyficznych utworów składających się z białkowych płaszczyzn, na których osadzone są lub nie kuliste granule. Białka te nie są spokrewnione z białkami otoczki, a funkcja ich nie jest znana. Inkluzje białkowe pojawiają się w protoplaście komórki później niż cząstki wirusa i to sugeruje, że nie są istotne dla procesu replikacji. Inne wirusy należące do grupy potexwirusow (argentine plantago virus APV i boussingaulta mosaic virus BMV) powodują powstanie charakterystycznych inkluzji krystalicznych o regularnym wzorze i nieznanym składzie chemicznym [31]. Występują one nie tylko na terenie cytoplazmy, ale również w jądrze komórki. Powstawanie inkluzji białkowych na terenie jądra jest również charakterystyczne dla innych wirusów, np. potywirusów. Wtrąty te złożone są z ciemno barwiących się globularnych lub bezkształtnych złogów zgrupowanych po kilkanaście razem. Rzadziej występują regularne układy tubul jak to ma miejsce przy inkluzjach jądrowych powodowanych przez wirusa żółtej mozaiki selera (celery yellow mosaic virus CYMV) i wirusa mozaiki selera (celery mosaic virus CMV). Powyższy przegląd nie wyczerpuje różnorodnych form inkluzji powodanych przez infekcję wirusową, a nie będących zmienionymi organellami komórki i cząstkami wirusa. Niekiedy występowanie inkluzji białkowych towarzyszy określonemu etapowi namnażania się, np. ciemne pasma występujące pomiędzy skupiskami cystern retikulum endoplazmatycznego powodowanymi przez TMV. W innych wypadkach inkluzje białkowe gromadzą się w wydzielonych przestrzennie regionach protoplastu komórki. Czas pojawiania się ich jest również różny. Przeważnie jednak pojawiają się w późniejszych etapach cyklu życiowego wirusa.
15 Lokalizacja komórkowa cyklu życiowego wirusów roślinnych Porażenie wieloma wirusami nie powoduje tworzenia żadnych inkluzji białkowych, np. carlawirusy. Wiadomo, że inkluzje cylindryczne potywirusów są kodowane przez genom wirusa. Nie można jednak wykluczyć, że inkluzje towarzyszące infekcji wywołanej przez inne grupy wirusów mogą być kodowane przez genom komórki, a odkładanie ich jest efektem zaburzeń w procesach regulacji produkcji białek rośliny pod wpływem infekcji wirusem. INKLUZJE CZĄSTEK WIRUSA W wyniku procesów namnażania się wirusa w cytoplazmie powstają białka kapsydu wirusa i do cytoplazmy uwalniane są nici pozytywowe wirusowego RNA. Z tych dwóch komponentów powstają gotowe cząstki wirusa. W bezpośrednim sąsiedztwie cytoplazmatycznych struktur związanych z poprzednimi etapami cyklu życiowego występują cząstki wirusa. Liczba cząstek wytworzonych w komórce zależna jest od izolatu wirusa oraz wzajemnych relacji roślina wirus. Dalszym etapem jest tworzenie się inkluzji zbudowanych z gotowych cząstek. Inkluzje takie mogą się składać z wielu cząstek i ich powstanie ma tylko jeden cel, jakim jest zgromadzenie cząstek potrzebnych do porażenia innych roślin. Proces eskalacji porażenia jest procesem związanym z przypadkowymi zdarzeniami takimi, jak żerowanie wektorów, uszkodzenia mechaniczne, ocieranie się sąsiednich roślin o siebie itp., doprowadzającymi do przeniesienia cząstek wirusa z uszkodzonych komórek na inne rośliny. W protoplaście komórki wiele wirusów tworzy regularne układy jednakowo odległych od siebie cząstek, ustawionych równolegle w wypadku wirusów pałeczkowatych i nitkowatych lub tworzących regularny układ przestrzenny w wypadku wirusów kulistych. Przyjęto nazywać takie układy inkluzjami krystalicznymi, choć w rzeczywistości nie są to kryształy. Inkluzje krystaliczne mogą mieć pokaźne rozmiary. Obserwowane w mikroskopie świetlnym inkluzje krystaliczne cząstek TMV miały długość 300 /im. W porównaniu z długością cząstki TMV (300 nm) jest to bardzo duża wartość, porównywalna w rzędzie wielkości z rozmiarami jądra komórkowego. Jednak większości inkluzji nie można zaobserwować z zastosowaniem mikroskopu świetlnego, gdyż ich wielkość ma wartość mniejszą od zdolności rozdzielczej tego mikroskopu. Układ cząstek wirusa w inkluzji krystalicznej jest charakterystyczny dla danego wirusa. Inkluzje tworzone przez cząstki TMV składają się z warstw grubości jednej cząstki. Ułożenie cząstek w każdej następnej warstwie jest skośne w stosunku do poprzedniej i tworzy układ przypominający ości w szkielecie ryby. Dla carlawirusów charakterystyczne są inkluzje powstałe z pęczków cząstek ułożonych równolegle względem siebie. W sąsiedztwie może występować wiele takich inkluzji ustawionych jedna za drugą. Daje to efekt prążkowania, przy dużych inkluzjach jest on widoczny w mikroskopie świetlnym. Wirus mozaiki ogórka (CMV cucumowirus) tworzy układy krystaliczne cząstek stanowiące sześcioboczną strukturę.
16 218 Anna Rudzińska-Langwald, Grażyna Garbaczewska Niektóre szczepy TMV nie formują regularnych inkluzji. Gromadzą się wtedy grupy bezładnie rozrzuconych cząstek. Najczęstszym miejscem gromadzenia się cząstek jest cytoplazma komórki. W niej gromadzone są inkluzje cząstek takich wirusów jak carlawirusy, hordeiwirusy, bromowirusy, i inne. Comowirusy i nepowirusy tworzą tubule, wewnątrz których występują kuliste cząstki wirusa, natomiast cząstki hordeiwirusów gromadzą się przez przyłączanie się jednym końcem do błony zewnętrznej otoczki chloroplastów. Wirus M ziemniaka (PVM carlawirus) tworzy inkluzje, w których cząstki jednym końcem przylegają do tonoplastu. Niektóre potywirusy tworzą wąskie mostki cytoplazmatyczne na terenie wakuoli, w których pomiędzy tonoplastem występuje jedna warstwa wirionów. Innym, częstym miejscem akumulacji cząstek jest wakuola. Wspomniany wirus mozaiki ogórka (CMV) powoduje powstawanie krystalicznych układów cząstek wirusa w wakuoli, podczas gdy w cytoplazmie cząstki CMV tworzą bezładny układ [59]. W niektórych wypadkach cząstki wirusa mogą być gromadzone w jądrze komórki, np. parakrystaliczne inkluzje cząstek hordeiwirusów, tobamowirusów i luteowirusów. TMV tworzy agretaty cząstek w chloroplastach, a niektóre tombuswirusy w mitochondriach. Wszystkie zmiany zachodzące w komórkach porażonych przez wirusy stanowią pewien wspólny zespół zjawisk. Wprawdzie w wielu wypadkach zmiany związane z wczesnymi etapami cyklu życiowego wirusa, jak np. wytworzenie regionu bogatego w rybosomy, zanikają w komórkach, w których występują już inkluzje cząstek wirusa. Jednak deformacje organelli komórkowych związane z pojawieniem się pęcherzyków replikacyjnych trwale zmieniają wygląd organelli. W komórkach są równocześnie rezultaty różnych etapów cyklu życiowego wirusów. Taki zmieniony wygląd komórki może być obserwowany w mikroskopie świetlnym i pierwsze doniesienia pochodzą z początków naszego wieku. Dodatkowo na zmiany w strukturze komórek powstałe bezpośrednio z namnażania się w nich wirusa nakładają się takie, które są reakcją odpornościową rośliny na porażenie. Należą tu również zmiany w strukturze chloroplastów związane z reakcją chlorotyczną lub związane z powstawaniem nekrozy. W sumie wszystkie te zmiany składają się na cytopatologiczny obraz i sklasyfikowanie poszczególnych zmian jest trudnym zadaniem. LITERATURA 1. Atabekov J. G., Dorokhov Y. L. Plant virus-specific transport function and resistance o f plants to viruses. Adv. Virus Res. 29, , Atabekov J. G, Taliansky M. E. Expression o f a plant virus coded transport function o f different viral genomes. Adv. Virus Res. 38, , Barker H. Invasion o f non-phloem in Nicotiana clevelandii by potato leaf roll virus is ennanced in plants also infected with potato virus Y poty virus. J. Gen. Virol. 68, , Barker H. Specificity of the effect o f sap-transmissible viruses in increasing the accumulation o f luteovirus in coinfected plants. Ann. App. Biol. 115, 71-78, 1989.
17 Lokalizacja komórkowa cyklu życiowego wirusów roślinnych B r a n t s D.H. The susceptibility o f tobacco and bean leaves to tobacco mosaic virus infection in relation to the condition o f ectodesmata. Virology 23, , Bukrinskaaya A A.G. Penetration o f viral genetic material into host cell. /Adv. Virus Res , Burges J. M otoyoshi F., Fleming E.N. The mechanism o f infection ofplant protoplasts by viruses. Planta 112, Burges J M otoyoshi F., Fleming E.N. Structural changes accompanying infection o f tobacco protoplasts with two spherical viruses. Planta 117, , CamarinoG, Savi A., Ciferri O. A chloroplast system capable to transport heterologous mrnas. FEBS L ett 150, 94 98, Christie R. G Edwardson J. R. Light and electron microscopy o f plant virus inclusions. FLA Agric. Exp. Stn. Monogr. no. 9, Cooking EC.. An electron microscope study o f the initial stages o f infection o f isolated tomato fruit protoplasts by tobacco mosaic virus. Planta 68, , C o r n e 1 i s s e n B. J. C, B o 1 J. F. Homology between the proteins encoded by tobacco mosaic virus and two tricornaviruses. Plant Molecular Biology 3, , C a r r o 1 1 T. W. Relation o f barley stripe mosaic virus to plastids. Virology D e ZoetenG. A. Early events in plant virus infection [w:] Plant Diseases and Vectors: wyd. M a r a m o r o s c h, K., H a r r i s, K., F., New York, Academic Press, D e Z o e t e n G. A. Possibilities for inter- and intracellular translocation o f some icosahedral plant viruses. J. CelL BioL 40, , D u r h a m A. C. H. The roles o f small ions especially calcium in virus disassembly takeover and transformation. Biomedicine 28, E s a u K., Cytological and histological symptoms o f beet yellows. Virology 10, 73-77, E s a u K., H o e f e r t L. L. Development o f infection with beet western yellows virus in the sugarbeet. Virology 48, 724, E s a u K., H oefert L.L. Ultrastructure o f sugarbeet leaves infected with beet western yellows virus. J. Ultrastruct. Res. 40, 556, E s a u K., H o e f e r t L. L. Cytology o f beet yellows virus infection in Tetragonia. I. Parenchyma cells in infected leaves. Protoplasma , F r a n c k i R. L B. Encapsidated viroidlike RNA [w:] de Diener T.O. The viroids, Plenum Press, F r a n c k i R. L B., H a 11 a T, G r y 11 s N. E., G r i v e 11 C. J. The particle morphology and some others properties o f chloris striate mosaic virus. Ann. Appl. BioL 91,51 59, F r a n c k i R. I. B, M i 1 n e L.S,Hatta T. Atlas ofplant viruses. Vols. I and II. CRC Press, Boca Raton, FI, Fraser R. S. S. The synthesis o f tobacco mosaic virus RNA and ribosomal RNA in tobacco leaves. J. Gen. ViroL 18, , G a a r d G, d e ZoetenG. A. Plant virus uncoating as a result o f virus-cell wall interaction. Virology , G e r o 1 a F. M, B a s s i M., B elli G. Some observations on the shape and location of different viruses in experimentaly infected planst and on the fine structure o f the host cells II. Nicoliana glutinosa systemically infected with cucumber mosaic virus strain y. Caryologia 18, , G e r o 1 a F.M.,B a s s i M.,F a v a 1 i M.A,B e 11 o E. An electron microscope study o f the penetration o f tobacco mosaic virus into leaves following experimental inoculation. Virology 68, , G i 11 C. C, C h o n g J. Cytological evidence fo r the division o f barley yellow dwarf virus isolates into two subgroups. Virology 95, 59, 1979.
18 220 Anna Rudzińska-Langwald, Grażyna Garbaczewska 29. Glover J.F, W ilson T. M. A. Efficient translation o f the coat protein cistron tobacco mosaic virus in a cell free system from Escherichia coli. Eur. J. Biol. 122, , G odefroy-colburnt, GageyM. J, Berna A., Stussi/Gar a n d C. A non-structural protein o f alfalfa mosaic virus in the walls o f infected tobacco cells. J. Gen. Virol. 67, , Gracia O., Koening R, L a s e m a n n D. E. J. Properities and classification of a potexvirus isolated from three species in Argentine. Phytopathology 73, 1488, Gunning B.E.S., Steer M.W. The plasma membran [w:] Ultrastructure and the biology o f plant celle. Edward Arnold Ltd. London, 23 26, HariharasubramanianV., HadidiA., Singer B, Fraenkel- -C o n r a t H. Possible identification o f protein in brom mosaic virus infected barley as a component o f viral RNA polimerase. Virology 54, , Harrison B. D., StefanlZ., Roberts I. M., Role o f mitochondria in the formalin o f X-bodies in cells o f Nicotiana clevelandi infected by tobacco rattle virus. J. Gen. Virol. 6, 127, H a 11 a T, F r a n c k i R. I. B. Cytopathic structures associated with tonoplast of plant cells infected with cucumber mosaic and tomato aspermy viruses. J. Gen. Virol. 53, , H a 11 a T., M a t t h e w s R. E. F. The sequence o f early cytological changes in chinies cabbage leafcellsfollowing systemic infection with turnip yellow mosaic virus. Virology 59, , H u 1 1 R. The movement o f viruses in plants. Annu. Rev. Phytopath 27, , K a s s a n i s B., W h i t e R. F., T u r n e r R. H., W o o d s R. D. The mechanism of virus entry during infection of tobacco protoplast with TMV. Phytopathol. Z. 88, , K i h o Y., A b e T, O h a s h i Y. Dissasembly o f tobacco mosaic virus by membrane lipid isolatedfrom tobacco leaves andpoly-l-ornotine, Microbiology and Immunology 23, , K i m K. S., An ultras true tural study o f inclusions and disease development in plant cells infected by cowpea chlorotic mottlle virus. J. Gen. Virol. 35, , KraevV. G., SemernikovaL. I, VutenkoS. I., ParembskayaN. V. Certaain structural changes induced by peanut stunt virus in cells o f host plants. Mikrobiol. Zh. (Kiev) 37, , Kurtz-Fritsch C^Hirth L. Uncoating o f two spherical plant viruses. Virology 47, , L a f 1 e t h e O., B o v e J. M. Sites incorporation de uridine tritiee dans les cellues du parenchme foliare de Brassica chinensis, saines on infectees par le virus de la mosaique jaune du navet. C.R. Hebd.. Seances Acad. Sei. 266, , L a n g e n b e r g W. G., Virus protein association with cylindrical inclusions o f two viruses that infect wheat. J. Gen. Virol. 67, , L a s e m a n n D. E. Cytopathology [w:] The plant viruses Vol. 4, The filamentous plant viruses (red. R., G., M i 1 1 n e) Plenum Press, , Lawson R. H., H e a r o n S. Subcellular localisation o f chrysanthemum aspermy virus in tobacco and chrysanthemum leaf tissue. Virology 41, 30 37, L e R o y C., S tussi-garaud C., H i r t h L. RNA-dependent RNA polimerases in uninfected and in alfalfa mosaic virus infected tobacco plants. Virology 82, 48 62, L e s e m a n n D. E. Virus group-specific and virus specific cytological alternations induced by the members o f the tymovirus group. Phytopath. Z. 90, 315, L i n s t e a d P. J., H i 1 1 s G. J., P 1 a s k i 11 K. A., W i 1 s o n J. G., H a r k e r C. L., Maule A. J, The subcellular location o f the gene 1 product o f cauliflower mosaic virus is consistent with a function associated with virus spread. J. Gen. Virol. 69, , L i t z R. F. K i m m i n s W.C., Interpretation ofectodesmata in relation to susceptibility to plant viruses. Can. J. BoL 49, 88 90, 1971.
19 Lokalizacja komórkowa cyklu życiowego wirusów roślinnych M a r t e 1 1 i G.P,Russo M. Use o f thin sectioningfor visualisation and identyfication o f plant viruses. Methods in Virology VIII, , Matthews R. E. F. The groups o f plant viruses [w:] Plant Virology. Academic Press, , M e Mullen C. R.,G a r d n e r W.S., M y e r s G.A., Aberrant plastids in barley leaf tissues infected with barley stripe mosaic virus. Phytopathology 68, , Merkens W. S. W, de ZoetenG. A., GaardG. Observations on ectodesmata and the virus infection process, S. Ultrastruct. Res. 41, , N i s h i g u c h i M., M otoyoshi F., OshimaN. Behaviour o f a temperature sensitive strain o f tobacco mosaic virus in tomato leaves and protoplasts. J. Gen. Virol. 39, 53 61, R o b a r d s A.W. A new interpretation o f plasmodesmal ultrastructure, Planta 82, , Rubio-H uertos M. Atlas on ultrastructure o f plant tissue infected with viruses. Consejo Superior De Investigationes Cientificas, Madrid, Russo M., Di Franco A., MartelliG. P. The fine structure o f cymbidiwn ringspot virus infections in host tissues III. Role o f peroxisome in the genesis o f multivesicular bodies. J. UltrastucL Res. 82, 52, R u s s o M., M a r t e 11 i G. P., Ultrastructure o f turnip crincle and saguaro cactus virus infected tissues. Virology 118, S h a w J. C., In vivo removal ofprotein from tobacco mosaic virus after inoculation of tobacco leaves. Virology 31, , Shaw J. C., In vivo removal ofprotein from tobacco mosaic virus after inoculation of tobacco leaves II. Some characteristics o f the reaction. Virology 37, , Shepardson S., Esau K., mc Crum Ultrastructure ofpotato leafphloem infected with potato leafroll virus. Virology 105, 379, Stussi-GaraudC., GaraudJ. C., Berna A, Godefroy-Colb u m T. In situ location of an alfalfa mosaic virus non-structural protein in plant cell walb: correlation with virus transport. J. Gen. Virol. 68, T a k e b e I. Protoplast in the study ofplant virus replication. Compr.Virol.il, , T h o m a s P. E., F u 1 t o n R. W. Correlatin o f ectodesmata number with nonspecific resbtance to initial virus infection. Virology 34, , T om esius L, ClaphamD., MeshiT. Localization by immunogold cytochembtry o f the virus-coded 30K protein in plasmodesmata o f leaves infected with tobacco mosaic virus. Virology 160, , von Wettstein D., Zech H. The structure o f the nucleus and cytoplasm in hair cells during tobacco mosaic virus reproduction. Z. Naturforsch, Feilb 17, , W a t t s J. W., K i n g J. M. The effect o f change on infection of tobacco protoplasts by bromoviruses. J. Gen. Virol. 65, , Weintraub M., R a g e 11 i H. W. J. Electron microscopy o f the bean and cowpea stains o f southern bean mosaic virus within leaf celb. J. Ultrastr. Res. 32, 167, W i 1 s o n T. M. A., Nucleocapsid dbassembly and early gene expression by positive-strand RNA viruses. J. Gen. Virol. 66, , W o 1 f S., D e o m C. M., B e a c h y R.N,Lucas W. J. Movement protein o f tobacco mosaic virus modified plasmodesmal size exclusion limit. Science 246, , Z a i 1 1 i n M., D u d a C. T, P e 11 i M., A. Replication o f tobacco mosaic virus V. Properties of the bound and solubilized replicase. Virology 53, , ZabelP, Jongen-NevehJ., van Kämmen A. In vittro replicatin of cowpea mosaic virus RNA. II. Solubilbation o f membrane-bond replicase and the partial purification o f the solubilized enzyme. J. Virol. 17, , 1976.
Dr. habil. Anna Salek International Bio-Consulting 1 Germany
 1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
1 2 3 Drożdże są najprostszymi Eukariontami 4 Eucaryota Procaryota 5 6 Informacja genetyczna dla każdej komórki drożdży jest identyczna A zatem każda komórka koduje w DNA wszystkie swoje substancje 7 Przy
CORAZ BLIŻEJ ISTOTY ŻYCIA WERSJA A. imię i nazwisko :. klasa :.. ilość punktów :.
 CORAZ BLIŻEJ ISTOTY ŻYCIA WERSJA A imię i nazwisko :. klasa :.. ilość punktów :. Zadanie 1 Przeanalizuj schemat i wykonaj polecenia. a. Wymień cztery struktury występujące zarówno w komórce roślinnej,
CORAZ BLIŻEJ ISTOTY ŻYCIA WERSJA A imię i nazwisko :. klasa :.. ilość punktów :. Zadanie 1 Przeanalizuj schemat i wykonaj polecenia. a. Wymień cztery struktury występujące zarówno w komórce roślinnej,
Zawartość. Wstęp 1. Historia wirusologii. 2. Klasyfikacja wirusów
 Zawartość 139585 Wstęp 1. Historia wirusologii 2. Klasyfikacja wirusów 3. Struktura cząstek wirusowych 3.1. Metody określania struktury cząstek wirusowych 3.2. Budowa cząstek wirusowych o strukturze helikalnej
Zawartość 139585 Wstęp 1. Historia wirusologii 2. Klasyfikacja wirusów 3. Struktura cząstek wirusowych 3.1. Metody określania struktury cząstek wirusowych 3.2. Budowa cząstek wirusowych o strukturze helikalnej
DNA musi współdziałać z białkami!
 DNA musi współdziałać z białkami! Specyficzność oddziaływań między DNA a białkami wiążącymi DNA zależy od: zmian konformacyjnych wzdłuż cząsteczki DNA zróżnicowania struktury DNA wynikającego z sekwencji
DNA musi współdziałać z białkami! Specyficzność oddziaływań między DNA a białkami wiążącymi DNA zależy od: zmian konformacyjnych wzdłuż cząsteczki DNA zróżnicowania struktury DNA wynikającego z sekwencji
TATA box. Enhancery. CGCG ekson intron ekson intron ekson CZĘŚĆ KODUJĄCA GENU TERMINATOR. Elementy regulatorowe
 Promotory genu Promotor bliski leży w odległości do 40 pz od miejsca startu transkrypcji, zawiera kasetę TATA. Kaseta TATA to silnie konserwowana sekwencja TATAAAA, występująca w większości promotorów
Promotory genu Promotor bliski leży w odległości do 40 pz od miejsca startu transkrypcji, zawiera kasetę TATA. Kaseta TATA to silnie konserwowana sekwencja TATAAAA, występująca w większości promotorów
Komórka - budowa i funkcje
 Komórka - budowa i funkcje Komórka - definicja Komórka to najmniejsza strukturalna i funkcjonalna jednostka organizmów żywych zdolna do przeprowadzania wszystkich podstawowych procesów życiowych (takich
Komórka - budowa i funkcje Komórka - definicja Komórka to najmniejsza strukturalna i funkcjonalna jednostka organizmów żywych zdolna do przeprowadzania wszystkich podstawowych procesów życiowych (takich
Informacje dotyczące pracy kontrolnej
 Informacje dotyczące pracy kontrolnej Słuchacze, którzy z przyczyn usprawiedliwionych nie przystąpili do pracy kontrolnej lub otrzymali z niej ocenę negatywną zobowiązani są do dnia 06 grudnia 2015 r.
Informacje dotyczące pracy kontrolnej Słuchacze, którzy z przyczyn usprawiedliwionych nie przystąpili do pracy kontrolnej lub otrzymali z niej ocenę negatywną zobowiązani są do dnia 06 grudnia 2015 r.
Rośliny modyfikowane genetycznie (GMO)
 Rośliny modyfikowane genetycznie (GMO) Organizmy modyfikowane genetycznie Organizm zmodyfikowany genetycznie (międzynarodowy skrót: GMO Genetically Modified Organizm) to organizm o zmienionych cechach,
Rośliny modyfikowane genetycznie (GMO) Organizmy modyfikowane genetycznie Organizm zmodyfikowany genetycznie (międzynarodowy skrót: GMO Genetically Modified Organizm) to organizm o zmienionych cechach,
Wykład 14 Biosynteza białek
 BIOCHEMIA Kierunek: Technologia Żywności i Żywienie Człowieka semestr III Wykład 14 Biosynteza białek WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH MATERIAŁÓW OPAKOWANIOWYCH
BIOCHEMIA Kierunek: Technologia Żywności i Żywienie Człowieka semestr III Wykład 14 Biosynteza białek WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH MATERIAŁÓW OPAKOWANIOWYCH
Transport przez błony
 Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Temat: Tkanki roślinne. 1. Tkanki miękiszowe.
 Temat: Tkanki roślinne. 1. Tkanki miękiszowe. Są obecne we wszystkich organach rośliny i stanowią główną ich część. Należą do tkanek stałych, jednak nieraz dają początek wtórnym tkankom twórczym. Zbudowane
Temat: Tkanki roślinne. 1. Tkanki miękiszowe. Są obecne we wszystkich organach rośliny i stanowią główną ich część. Należą do tkanek stałych, jednak nieraz dają początek wtórnym tkankom twórczym. Zbudowane
Bezpośrednia embriogeneza somatyczna
 Bezpośrednia embriogeneza somatyczna Zarodki somatyczne formują się bezpośrednio tylko z tych komórek roślinnych, które są kompetentne już w momencie izolowania z rośliny macierzystej, czyli z proembriogenicznie
Bezpośrednia embriogeneza somatyczna Zarodki somatyczne formują się bezpośrednio tylko z tych komórek roślinnych, które są kompetentne już w momencie izolowania z rośliny macierzystej, czyli z proembriogenicznie
Organelle komórkowe. mgr Zofia Ostrowska
 Organelle komórkowe mgr Zofia Ostrowska 1. Wyróżniamy dwa typy komórek 2. Eucaryota Zadanie 34. (2 pkt) Matura 2006 p.r. Komórki żywych organizmów są bardzo różnorodne. Poniższe rysunki przedstawiają komórkę
Organelle komórkowe mgr Zofia Ostrowska 1. Wyróżniamy dwa typy komórek 2. Eucaryota Zadanie 34. (2 pkt) Matura 2006 p.r. Komórki żywych organizmów są bardzo różnorodne. Poniższe rysunki przedstawiają komórkę
G C C A T C A T C C T T A C C
 Praca kontrolna z biologii LO dla dorosłych semestr III Poniższa praca składa się z 25 zadań. Przy każdym poleceniu podano liczbę punktów możliwą do uzyskania za prawidłową odpowiedź. Za rozwiązanie zadań
Praca kontrolna z biologii LO dla dorosłych semestr III Poniższa praca składa się z 25 zadań. Przy każdym poleceniu podano liczbę punktów możliwą do uzyskania za prawidłową odpowiedź. Za rozwiązanie zadań
TRANSKRYPCJA - I etap ekspresji genów
 Eksparesja genów TRANSKRYPCJA - I etap ekspresji genów Przepisywanie informacji genetycznej z makrocząsteczki DNA na mniejsze i bardziej funkcjonalne cząsteczki pre-mrna Polimeraza RNA ETAP I Inicjacja
Eksparesja genów TRANSKRYPCJA - I etap ekspresji genów Przepisywanie informacji genetycznej z makrocząsteczki DNA na mniejsze i bardziej funkcjonalne cząsteczki pre-mrna Polimeraza RNA ETAP I Inicjacja
Tematy- Biologia zakres rozszerzony, klasa 2TA,2TŻ-1, 2TŻ-2
 Tematy- Biologia zakres rozszerzony, klasa 2TA,2TŻ-1, 2TŻ-2 Nr lekcji Temat Zakres treści 1 Zapoznanie z PSO, wymaganiami edukacyjnymi i podstawą programową PSO, wymagania edukacyjne i podstawa programowa
Tematy- Biologia zakres rozszerzony, klasa 2TA,2TŻ-1, 2TŻ-2 Nr lekcji Temat Zakres treści 1 Zapoznanie z PSO, wymaganiami edukacyjnymi i podstawą programową PSO, wymagania edukacyjne i podstawa programowa
Geny i działania na nich
 Metody bioinformatyki Geny i działania na nich prof. dr hab. Jan Mulawka Trzy królestwa w biologii Prokaryota organizmy, których komórki nie zawierają jądra, np. bakterie Eukaryota - organizmy, których
Metody bioinformatyki Geny i działania na nich prof. dr hab. Jan Mulawka Trzy królestwa w biologii Prokaryota organizmy, których komórki nie zawierają jądra, np. bakterie Eukaryota - organizmy, których
Podział komórkowy u bakterii
 Mitoza Podział komórkowy u bakterii Najprostszy i najszybszy podział komórkowy występuje u bakterii, które nie mają jądra komórkowego, lecz jedynie pojedynczy chromosom tzw. chromosom bakteryjny. Podczas
Mitoza Podział komórkowy u bakterii Najprostszy i najszybszy podział komórkowy występuje u bakterii, które nie mają jądra komórkowego, lecz jedynie pojedynczy chromosom tzw. chromosom bakteryjny. Podczas
Nowoczesne systemy ekspresji genów
 Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
Podstawy mikrobiologii. Wirusy bezkomórkowe formy materii oŝywionej
 Podstawy mikrobiologii Wykład 3 Wirusy bezkomórkowe formy materii oŝywionej Budowa wirusów Wirusy nie mają budowy komórkowej, zatem pod względem biologicznym nie są organizmami Ŝywymi! Są to twory nukleinowo
Podstawy mikrobiologii Wykład 3 Wirusy bezkomórkowe formy materii oŝywionej Budowa wirusów Wirusy nie mają budowy komórkowej, zatem pod względem biologicznym nie są organizmami Ŝywymi! Są to twory nukleinowo
Wprowadzenie do biologii molekularnej.
 Wprowadzenie do biologii molekularnej. Materiały dydaktyczne współfinansowane ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego. Biologia molekularna zajmuje się badaniem biologicznych
Wprowadzenie do biologii molekularnej. Materiały dydaktyczne współfinansowane ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego. Biologia molekularna zajmuje się badaniem biologicznych
Fizjologia nauka o czynności żywego organizmu
 nauka o czynności żywego organizmu Stanowi zbiór praw, jakim podlega cały organizm oraz poszczególne jego układy, narządy, tkanki i komórki prawa rządzące żywym organizmem są wykrywane doświadczalnie określają
nauka o czynności żywego organizmu Stanowi zbiór praw, jakim podlega cały organizm oraz poszczególne jego układy, narządy, tkanki i komórki prawa rządzące żywym organizmem są wykrywane doświadczalnie określają
Komórka organizmy beztkankowe
 Grupa a Komórka organizmy beztkankowe Poniższy test składa się z 12 zadań. Przy każdym poleceniu podano liczbę punktów możliwą do uzyskania za prawidłową odpowiedź. Za rozwiązanie całego testu możesz otrzymać
Grupa a Komórka organizmy beztkankowe Poniższy test składa się z 12 zadań. Przy każdym poleceniu podano liczbę punktów możliwą do uzyskania za prawidłową odpowiedź. Za rozwiązanie całego testu możesz otrzymać
wykład dla studentów II roku biotechnologii Andrzej Wierzbicki
 Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 5 Droga od genu do
Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 5 Droga od genu do
Budowa i rodzaje tkanek zwierzęcych
 Budowa i rodzaje tkanek zwierzęcych 1.WskaŜ prawidłową kolejność ukazującą stopniowe komplikowanie się budowy organizmów. A. komórka tkanka organizm narząd B. organizm narząd komórka tkanka C. komórka
Budowa i rodzaje tkanek zwierzęcych 1.WskaŜ prawidłową kolejność ukazującą stopniowe komplikowanie się budowy organizmów. A. komórka tkanka organizm narząd B. organizm narząd komórka tkanka C. komórka
Organelle komórkowe. mgr Zofia Ostrowska
 Organelle komórkowe mgr Zofia Ostrowska 1. Wyróżniamy dwa typy komórek 2. Eucaryota Zadanie 34. (2 pkt) Matura 2006 p.r. Komórki żywych organizmów są bardzo różnorodne. Poniższe rysunki przedstawiają komórkę
Organelle komórkowe mgr Zofia Ostrowska 1. Wyróżniamy dwa typy komórek 2. Eucaryota Zadanie 34. (2 pkt) Matura 2006 p.r. Komórki żywych organizmów są bardzo różnorodne. Poniższe rysunki przedstawiają komórkę
WPROWADZENIE DO GENETYKI MOLEKULARNEJ
 WPROWADZENIE DO GENETYKI MOLEKULARNEJ Replikacja organizacja widełek replikacyjnych Transkrypcja i biosynteza białek Operon regulacja ekspresji genów Prowadzący wykład: prof. dr hab. Jarosław Burczyk REPLIKACJA
WPROWADZENIE DO GENETYKI MOLEKULARNEJ Replikacja organizacja widełek replikacyjnych Transkrypcja i biosynteza białek Operon regulacja ekspresji genów Prowadzący wykład: prof. dr hab. Jarosław Burczyk REPLIKACJA
Eukariota - błony wewnątrzkomórkowe. Błony wewnętrzne stanowiące granice poszczególnych. przedziałów komórki i otaczające organelle komórkowe
 Błona komórkowa (błona plazmatyczna, plazmolema) Występuje u wszystkich organizmów żywych (zarówno eukariota, jak i prokariota) Stanowią naturalną barierę między wnętrzem komórki a środowiskiem zewnętrznym
Błona komórkowa (błona plazmatyczna, plazmolema) Występuje u wszystkich organizmów żywych (zarówno eukariota, jak i prokariota) Stanowią naturalną barierę między wnętrzem komórki a środowiskiem zewnętrznym
Właściwości błony komórkowej
 płynność asymetria Właściwości błony komórkowej selektywna przepuszczalność Płynność i stan fazowy - ruchy rotacyjne: obrotowe wokół długiej osi cząsteczki - ruchy fleksyjne zginanie łańcucha alifatycznego
płynność asymetria Właściwości błony komórkowej selektywna przepuszczalność Płynność i stan fazowy - ruchy rotacyjne: obrotowe wokół długiej osi cząsteczki - ruchy fleksyjne zginanie łańcucha alifatycznego
Prokariota i Eukariota
 Prokariota i Eukariota W komórkach organizmów żywych ilość DNA jest zazwyczaj stała i charakterystyczna dla danego gatunku. ILOŚĆ DNA PRZYPADAJĄCA NA APARAT GENETYCZNY WZRASTA WRAZ Z BARDZIEJ FILOGENETYCZNIE
Prokariota i Eukariota W komórkach organizmów żywych ilość DNA jest zazwyczaj stała i charakterystyczna dla danego gatunku. ILOŚĆ DNA PRZYPADAJĄCA NA APARAT GENETYCZNY WZRASTA WRAZ Z BARDZIEJ FILOGENETYCZNIE
TECHNIKI ANALIZY RNA TECHNIKI ANALIZY RNA TECHNIKI ANALIZY RNA
 DNA 28SRNA 18/16S RNA 5SRNA mrna Ilościowa analiza mrna aktywność genów w zależności od wybranych czynników: o rodzaju tkanki o rodzaju czynnika zewnętrznego o rodzaju upośledzenia szlaku metabolicznego
DNA 28SRNA 18/16S RNA 5SRNA mrna Ilościowa analiza mrna aktywność genów w zależności od wybranych czynników: o rodzaju tkanki o rodzaju czynnika zewnętrznego o rodzaju upośledzenia szlaku metabolicznego
Nośnikiem informacji genetycznej są bardzo długie cząsteczki DNA, w których jest ona zakodowana w liniowej sekwencji nukleotydów A, T, G i C
 MATERIAŁ GENETYCZNY KOMÓRKI BIOSYNTEZA BIAŁEK MATERIAŁ GENETYCZNY KOMÓRKI Informacja genetyczna - instrukcje kierujące wszystkimi funkcjami komórki lub organizmu zapisane jako określone, swoiste sekwencje
MATERIAŁ GENETYCZNY KOMÓRKI BIOSYNTEZA BIAŁEK MATERIAŁ GENETYCZNY KOMÓRKI Informacja genetyczna - instrukcje kierujące wszystkimi funkcjami komórki lub organizmu zapisane jako określone, swoiste sekwencje
Temat: Komórka jako podstawowa jednostka strukturalna i funkcjonalna organizmu utrwalenie wiadomości.
 SCENARIUSZ LEKCJI BIOLOGII DLA KLASY I GIMNAZJUM Temat: Komórka jako podstawowa jednostka strukturalna i funkcjonalna organizmu utrwalenie wiadomości. Cele: Utrwalenie pojęć związanych z budową komórki;
SCENARIUSZ LEKCJI BIOLOGII DLA KLASY I GIMNAZJUM Temat: Komórka jako podstawowa jednostka strukturalna i funkcjonalna organizmu utrwalenie wiadomości. Cele: Utrwalenie pojęć związanych z budową komórki;
Translacja i proteom komórki
 Translacja i proteom komórki 1. Kod genetyczny 2. Budowa rybosomów 3. Inicjacja translacji 4. Elongacja translacji 5. Terminacja translacji 6. Potranslacyjne zmiany polipeptydów 7. Translacja a retikulum
Translacja i proteom komórki 1. Kod genetyczny 2. Budowa rybosomów 3. Inicjacja translacji 4. Elongacja translacji 5. Terminacja translacji 6. Potranslacyjne zmiany polipeptydów 7. Translacja a retikulum
Interfaza to niemal 90% cyklu komórkowego. Dzieli się na 3 fazy: G1, S i G2.
 W wyniku podziału komórki powstaje komórka potomna, która ma o połowę mniej DNA od komórki macierzystej i jest o połowę mniejsza. Aby komórka potomna była zdolna do kolejnego podziału musi osiągnąć rozmiary
W wyniku podziału komórki powstaje komórka potomna, która ma o połowę mniej DNA od komórki macierzystej i jest o połowę mniejsza. Aby komórka potomna była zdolna do kolejnego podziału musi osiągnąć rozmiary
wykład dla studentów II roku biotechnologii Andrzej Wierzbicki
 Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ 1. Gen to odcinek DNA odpowiedzialny
Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ 1. Gen to odcinek DNA odpowiedzialny
Substancje o Znaczeniu Biologicznym
 Substancje o Znaczeniu Biologicznym Tłuszcze Jadalne są to tłuszcze, które może spożywać człowiek. Stanowią ważny, wysokoenergetyczny składnik diety. Z chemicznego punktu widzenia głównym składnikiem tłuszczów
Substancje o Znaczeniu Biologicznym Tłuszcze Jadalne są to tłuszcze, które może spożywać człowiek. Stanowią ważny, wysokoenergetyczny składnik diety. Z chemicznego punktu widzenia głównym składnikiem tłuszczów
ZADANIE1.6. Gromadzenie i przechowywanie kolekcji patogenów ziemniaka. Jadwiga Śliwka IHAR-PIB O/Młochów 2013
 ZADANIE1.6 Gromadzenie i przechowywanie kolekcji patogenów ziemniaka Jadwiga Śliwka IHAR-PIB O/Młochów 2013 1 Realizacja w Pracowniach: 1. Badania Odporności na Grzyby i Bakterie (POGB); Młochów: Jadwiga
ZADANIE1.6 Gromadzenie i przechowywanie kolekcji patogenów ziemniaka Jadwiga Śliwka IHAR-PIB O/Młochów 2013 1 Realizacja w Pracowniach: 1. Badania Odporności na Grzyby i Bakterie (POGB); Młochów: Jadwiga
POLIMERAZY DNA- PROCARYOTA
 Enzymy DNA-zależne, katalizujące syntezę DNA wykazują aktywność polimerazy zawsze w kierunku 5 3 wykazują aktywność polimerazy zawsze wobec jednoniciowej cząsteczki DNA do utworzenia kompleksu z ssdna
Enzymy DNA-zależne, katalizujące syntezę DNA wykazują aktywność polimerazy zawsze w kierunku 5 3 wykazują aktywność polimerazy zawsze wobec jednoniciowej cząsteczki DNA do utworzenia kompleksu z ssdna
października 2013: Elementarz biologii molekularnej. Wykład nr 2 BIOINFORMATYKA rok II
 10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
KOMÓRKA 2 KOMÓRKA 1. Budowa komórki zwierzęcej i roślinnej
 INSTRUKCJA - Jak wykonać samodzielnie fiszki? Na stronie 2 i 3 są fiszki z pytaniami. Wydrukuj je na osobnych kartkach. Następnie wytnij fiszki (tnij wzdłuż cienkich linii konturowych). Na odwrocie każdej
INSTRUKCJA - Jak wykonać samodzielnie fiszki? Na stronie 2 i 3 są fiszki z pytaniami. Wydrukuj je na osobnych kartkach. Następnie wytnij fiszki (tnij wzdłuż cienkich linii konturowych). Na odwrocie każdej
Na początek przyjrzymy się więc, jak komórka rośliny produkuje ATP, korzystając z energii światła w fazie jasnej fotosyntezy.
 Fotosynteza jako forma biosyntezy Bogactwo molekuł biologicznych przedstawionych w poprzednim rozdziale to efekt ich wytwarzania w komórkach w wyniku różnorodnych powiązanych ze sobą procesów chemicznych.
Fotosynteza jako forma biosyntezy Bogactwo molekuł biologicznych przedstawionych w poprzednim rozdziale to efekt ich wytwarzania w komórkach w wyniku różnorodnych powiązanych ze sobą procesów chemicznych.
Sprawdź swoją wiedzę i umiejętności TKANKI ROŚLINNE. 1. Uzupełnij schemat ilustrujący hierarchiczną budowę organizmu roślin. komórka...
 Sprawdź swoją wiedzę i umiejętności TKANKI ROŚLINNE. 1. Uzupełnij schemat ilustrujący hierarchiczną budowę organizmu roślin. komórka...... organizm 2. Na rysunku komórki roślinnej wskaż i podpisz następujące
Sprawdź swoją wiedzę i umiejętności TKANKI ROŚLINNE. 1. Uzupełnij schemat ilustrujący hierarchiczną budowę organizmu roślin. komórka...... organizm 2. Na rysunku komórki roślinnej wskaż i podpisz następujące
Przemiana materii i energii - Biologia.net.pl
 Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
6. Z pięciowęglowego cukru prostego, zasady azotowej i reszty kwasu fosforowego, jest zbudowany A. nukleotyd. B. aminokwas. C. enzym. D. wielocukier.
 ID Testu: F5679R8 Imię i nazwisko ucznia Klasa Data 1. Na indywidualne cechy danego osobnika ma (maja) wpływ A. wyłacznie czynniki środowiskowe. B. czynniki środowiskowe i materiał genetyczny. C. wyłacznie
ID Testu: F5679R8 Imię i nazwisko ucznia Klasa Data 1. Na indywidualne cechy danego osobnika ma (maja) wpływ A. wyłacznie czynniki środowiskowe. B. czynniki środowiskowe i materiał genetyczny. C. wyłacznie
WYKŁAD: Klasyczny przepływ informacji ( Dogmat) Klasyczny przepływ informacji. Ekspresja genów realizacja informacji zawartej w genach
 WYKŁAD: Ekspresja genów realizacja informacji zawartej w genach Prof. hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Klasyczny przepływ informacji ( Dogmat) Białka Retrowirusy Białka Klasyczny
WYKŁAD: Ekspresja genów realizacja informacji zawartej w genach Prof. hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Klasyczny przepływ informacji ( Dogmat) Białka Retrowirusy Białka Klasyczny
WPROWADZENIE DO GENETYKI MOLEKULARNEJ
 WPROWADZENIE DO GENETYKI MOLEKULARNEJ Replikacja organizacja widełek replikacyjnych Transkrypcja i biosynteza białek Operon regulacja ekspresji genów Prowadzący wykład: prof. dr hab. Jarosław Burczyk REPLIKACJA
WPROWADZENIE DO GENETYKI MOLEKULARNEJ Replikacja organizacja widełek replikacyjnych Transkrypcja i biosynteza białek Operon regulacja ekspresji genów Prowadzący wykład: prof. dr hab. Jarosław Burczyk REPLIKACJA
SPRAWDZIAN klasa II ORGANELLA KOMÓRKOWE, MITOZA, MEJOZA
 SPRAWDZIAN klasa II ORGANELLA KOMÓRKOWE, MITOZA, MEJOZA 1. Najwięcej Aparatów Golgiego będzie w komórkach: Mięśnia Trzustki Serca Mózgu 2. Podaj 3 cechy transportu aktywnego... 3. Czym się różni dyfuzja
SPRAWDZIAN klasa II ORGANELLA KOMÓRKOWE, MITOZA, MEJOZA 1. Najwięcej Aparatów Golgiego będzie w komórkach: Mięśnia Trzustki Serca Mózgu 2. Podaj 3 cechy transportu aktywnego... 3. Czym się różni dyfuzja
Transportowane cząsteczki CO O, 2, NO, H O, etanol, mocznik... Zgodnie z gradientem: stężenia elektrochemicznym gradient stężeń
 Transportowane cząsteczki Transport przez błony Transport bierny szybkość transportu gradien t stężeń kanał nośnik Transport z udziałem nośnika: dyfuzja prosta dyfuzja prosta CO 2, O 2, NO,, H 2 O, etanol,
Transportowane cząsteczki Transport przez błony Transport bierny szybkość transportu gradien t stężeń kanał nośnik Transport z udziałem nośnika: dyfuzja prosta dyfuzja prosta CO 2, O 2, NO,, H 2 O, etanol,
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU Transkrypcja RNA
 SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU Transkrypcja RNA SPIS TREŚCI: I. Wprowadzenie. II. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. III. Karty pracy. 1. Karta
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU Transkrypcja RNA SPIS TREŚCI: I. Wprowadzenie. II. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. III. Karty pracy. 1. Karta
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU
 SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU Czy priony zawsze są szkodliwe? SPIS TREŚCI: Wprowadzenie. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. Karty pracy. 1.
SCENARIUSZ LEKCJI BIOLOGII Z WYKORZYSTANIEM FILMU Czy priony zawsze są szkodliwe? SPIS TREŚCI: Wprowadzenie. Części lekcji. 1. Część wstępna. 2. Część realizacji. 3. Część podsumowująca. Karty pracy. 1.
Wykład 1. Od atomów do komórek
 Wykład 1. Od atomów do komórek Skład chemiczny komórek roślinnych Składniki mineralne (nieorganiczne) - popiół Substancje organiczne (sucha masa) - węglowodany - lipidy - kwasy nukleinowe - białka Woda
Wykład 1. Od atomów do komórek Skład chemiczny komórek roślinnych Składniki mineralne (nieorganiczne) - popiół Substancje organiczne (sucha masa) - węglowodany - lipidy - kwasy nukleinowe - białka Woda
Wpływ soli drogowej na rośliny środowisk ruderalnych.
 Wpływ soli drogowej na rośliny środowisk ruderalnych. Skład grupy: Kaja Kurasz, Barbara Kobak, Karolina Śliwka, Zuzanna Michowicz, Eryk Sowa, Sławomir Ziarko Opiekun projektu: Wojciech Stawarczyk Plan
Wpływ soli drogowej na rośliny środowisk ruderalnych. Skład grupy: Kaja Kurasz, Barbara Kobak, Karolina Śliwka, Zuzanna Michowicz, Eryk Sowa, Sławomir Ziarko Opiekun projektu: Wojciech Stawarczyk Plan
KLONOWANIE DNA REKOMBINACJA DNA WEKTORY
 KLONOWANIE DNA Klonowanie DNA jest techniką powielania fragmentów DNA DNA można powielać w komórkach (replikacja in vivo) W probówce (PCR) Do przeniesienia fragmentu DNA do komórek gospodarza potrzebny
KLONOWANIE DNA Klonowanie DNA jest techniką powielania fragmentów DNA DNA można powielać w komórkach (replikacja in vivo) W probówce (PCR) Do przeniesienia fragmentu DNA do komórek gospodarza potrzebny
Podziały komórkowe cz. I
 Podziały komórkowe cz. I Tam gdzie powstaje komórka, musi istnieć komórka poprzednia, tak samo jak zwierzęta mogą powstawać tylko ze zwierząt, a rośliny z roślin. Ta doktryna niesie głębokie przesłanie
Podziały komórkowe cz. I Tam gdzie powstaje komórka, musi istnieć komórka poprzednia, tak samo jak zwierzęta mogą powstawać tylko ze zwierząt, a rośliny z roślin. Ta doktryna niesie głębokie przesłanie
Poziomy organizacji żywej materii 1. Komórkowy- obejmuje struktury komórkowe (organelle) oraz komórki 2. Organizmalny tworzą skupienia komórek
 Poziomy organizacji żywej materii 1. Komórkowy- obejmuje struktury komórkowe (organelle) oraz komórki 2. Organizmalny tworzą skupienia komórek (tkanki), narządy (organy), ich układy i całe organizmy wielokomórkowe
Poziomy organizacji żywej materii 1. Komórkowy- obejmuje struktury komórkowe (organelle) oraz komórki 2. Organizmalny tworzą skupienia komórek (tkanki), narządy (organy), ich układy i całe organizmy wielokomórkowe
Biologia molekularna wirusów. Materiały dydaktyczne współfinansowane ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego.
 Biologia molekularna wirusów Materiały dydaktyczne współfinansowane ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego. Co to jest wirus? Cząsteczka złożona z kwasu nukleinowego (DNA
Biologia molekularna wirusów Materiały dydaktyczne współfinansowane ze środków Unii Europejskiej w ramach Europejskiego Funduszu Społecznego. Co to jest wirus? Cząsteczka złożona z kwasu nukleinowego (DNA
Wykład: 2 JĄDRO KOMÓRKOWE I ORGANIZACJA CHROMATYNY. Jądro komórkowe. Prof. hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej.
 Wykład: 2 JĄDRO KOMÓRKOWE I ORGANIZACJA CHROMATYNY Prof. hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Jądro komórkowe Jądro komórkowe Otoczka jądrowa zewnętrzna membrana jądrowa wewnętrzna
Wykład: 2 JĄDRO KOMÓRKOWE I ORGANIZACJA CHROMATYNY Prof. hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Jądro komórkowe Jądro komórkowe Otoczka jądrowa zewnętrzna membrana jądrowa wewnętrzna
Transport pęcherzykowy
 Transport pęcherzykowy sortowanie przenoszonego materiału zachowanie asymetrii zachowanie odrębności organelli precyzyjne oznakowanie Transport pęcherzykowy etapy transportu Transport pęcherzykowy przemieszczanie
Transport pęcherzykowy sortowanie przenoszonego materiału zachowanie asymetrii zachowanie odrębności organelli precyzyjne oznakowanie Transport pęcherzykowy etapy transportu Transport pęcherzykowy przemieszczanie
Budowa komórkowa organizmów Składniki plazmatyczne i nieplazmatyczne komórki - budowa i funkcje
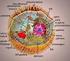 Budowa komórkowa organizmów Składniki plazmatyczne i nieplazmatyczne komórki - budowa i funkcje KOMÓRKA najmniejszy samoodtwarzający się żywy układ biologiczny ciało komórki tworzy protoplazma, którą oddziela
Budowa komórkowa organizmów Składniki plazmatyczne i nieplazmatyczne komórki - budowa i funkcje KOMÓRKA najmniejszy samoodtwarzający się żywy układ biologiczny ciało komórki tworzy protoplazma, którą oddziela
Recenzja pracy. BIOLOGIA poziom podstawowy. pieczątka/nazwa szkoły. klasa 1 LO PK nr 1 semestr I /2011/2012
 pieczątka/nazwa szkoły BIOLOGIA poziom podstawowy klasa 1 LO PK nr 1 semestr I /2011/2012 Uwaga! Strona tytułowa stanowi integralną część pracy kontrolnej. Wypełnij wszystkie pola czytelnie drukowanymi
pieczątka/nazwa szkoły BIOLOGIA poziom podstawowy klasa 1 LO PK nr 1 semestr I /2011/2012 Uwaga! Strona tytułowa stanowi integralną część pracy kontrolnej. Wypełnij wszystkie pola czytelnie drukowanymi
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej
 Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Badanie dynamiki białek jądrowych w żywych komórkach metodą mikroskopii konfokalnej PRAKTIKUM Z BIOLOGII KOMÓRKI () ćwiczenie prowadzone we współpracy z Pracownią Biofizyki Komórki Badanie dynamiki białek
Właściwości błony komórkowej
 Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Cząsteczki < 150Da Błony - selektywnie przepuszczalne RóŜnice składu jonowego między wnętrzem komórki ssaka
Właściwości błony komórkowej płynność asymetria selektywna przepuszczalność Transport przez błony Cząsteczki < 150Da Błony - selektywnie przepuszczalne RóŜnice składu jonowego między wnętrzem komórki ssaka
WITAMY NA KURSIE HISTOLOGII
 KOMÓRKA WITAMY NA KURSIE HISTOLOGII www.histologia.cm-uj.krakow.pl Wielkość komórek ZróŜnicowanie komórek Jednostki: 1 µm = 10-3 mm, 1 nm = 10-3 µm kształt najmniejsze komórki (komórki przytarczyc, niektóre
KOMÓRKA WITAMY NA KURSIE HISTOLOGII www.histologia.cm-uj.krakow.pl Wielkość komórek ZróŜnicowanie komórek Jednostki: 1 µm = 10-3 mm, 1 nm = 10-3 µm kształt najmniejsze komórki (komórki przytarczyc, niektóre
Antyoksydanty pokarmowe a korzyści zdrowotne. dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW
 Antyoksydanty pokarmowe a korzyści zdrowotne dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW Warszawa, dn. 14.12.2016 wolne rodniki uszkodzone cząsteczki chemiczne w postaci wysoce
Antyoksydanty pokarmowe a korzyści zdrowotne dr hab. Agata Wawrzyniak, prof. SGGW Katedra Żywienia Człowieka SGGW Warszawa, dn. 14.12.2016 wolne rodniki uszkodzone cząsteczki chemiczne w postaci wysoce
JĄDRO KOMÓRKOWE I ORGANIZACJA CHROMATYNY
 Wykład: 2 JĄDRO KOMÓRKOWE I ORGANIZACJA CHROMATYNY Prof. hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Jądro komórkowe 1 Jądro komórkowe Otoczka jądrowa zewnętrzna membrana jądrowa wewnętrzna
Wykład: 2 JĄDRO KOMÓRKOWE I ORGANIZACJA CHROMATYNY Prof. hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej Jądro komórkowe 1 Jądro komórkowe Otoczka jądrowa zewnętrzna membrana jądrowa wewnętrzna
Wybrane techniki badania białek -proteomika funkcjonalna
 Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu np. w porównaniu z analizą trankryptomu:
Wybrane techniki badania białek -proteomika funkcjonalna Proteomika: umożliwia badanie zestawu wszystkich (lub prawie wszystkich) białek komórkowych Zalety analizy proteomu np. w porównaniu z analizą trankryptomu:
POLIMERAZY DNA- PROCARYOTA
 Enzymy DNA-zależne, katalizujące syntezę DNA wykazują aktywność polimerazy zawsze w kierunku 5 3 wykazują aktywność polimerazy zawsze wobec jednoniciowej cząsteczki DNA do utworzenia kompleksu z ssdna
Enzymy DNA-zależne, katalizujące syntezę DNA wykazują aktywność polimerazy zawsze w kierunku 5 3 wykazują aktywność polimerazy zawsze wobec jednoniciowej cząsteczki DNA do utworzenia kompleksu z ssdna
Transport makrocząsteczek
 Komórka eukariotyczna cytoplazma + jądro komórkowe = protoplazma W cytoplazmie odbywa się: cała przemiana materii, dzięki której organizm uzyskuje energię biosynteza białka i innych związków Transport
Komórka eukariotyczna cytoplazma + jądro komórkowe = protoplazma W cytoplazmie odbywa się: cała przemiana materii, dzięki której organizm uzyskuje energię biosynteza białka i innych związków Transport
Streszczenie wykładu AUTOSTOPEM DO JĄDRA KOMÓRKOWEGO CZYLI MECHANIZMY ZAKAŻENIA WIRUSEM HPV16
 Dr n. biol. Małgorzata Bieńkowska-Haba Streszczenie wykładu AUTOSTOPEM DO JĄDRA KOMÓRKOWEGO CZYLI MECHANIZMY ZAKAŻENIA WIRUSEM HPV16 Podstawowym celem każdego wirusa jest bezpieczne dostarczenie genomu
Dr n. biol. Małgorzata Bieńkowska-Haba Streszczenie wykładu AUTOSTOPEM DO JĄDRA KOMÓRKOWEGO CZYLI MECHANIZMY ZAKAŻENIA WIRUSEM HPV16 Podstawowym celem każdego wirusa jest bezpieczne dostarczenie genomu
ROLA WAPNIA W FIZJOLOGII KOMÓRKI
 ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
BIOLOGIA KOMÓRKI - KARIOKINEZY
 BIOLOGIA KOMÓRKI - KARIOKINEZY M A Ł G O R Z A T A Ś L I W I Ń S K A 60 µm 1. KOMÓRKI SĄ ZBYT MAŁE, BY OBSERWOWAĆ JE BEZ POWIĘKSZENIA Wymiary komórek podaje się w mikrometrach (µm): 1 µm = 10-6 m; 1000
BIOLOGIA KOMÓRKI - KARIOKINEZY M A Ł G O R Z A T A Ś L I W I Ń S K A 60 µm 1. KOMÓRKI SĄ ZBYT MAŁE, BY OBSERWOWAĆ JE BEZ POWIĘKSZENIA Wymiary komórek podaje się w mikrometrach (µm): 1 µm = 10-6 m; 1000
I BIOLOGIA JAKO NAUKA
 I BIOLOGIA JAKO NAUKA Zadanie. Rozwiąż krzyżówkę, a następnie odczytaj i wyjaśnij hasło. 0. Bada skład chemiczny organizmów i zachodzące w nich reakcje.. Zajmuje się procesami dziedziczenia.. Przedmiotem
I BIOLOGIA JAKO NAUKA Zadanie. Rozwiąż krzyżówkę, a następnie odczytaj i wyjaśnij hasło. 0. Bada skład chemiczny organizmów i zachodzące w nich reakcje.. Zajmuje się procesami dziedziczenia.. Przedmiotem
Historia informacji genetycznej. Jak ewolucja tworzy nową informację (z ma ą dygresją).
 Historia informacji genetycznej. Jak ewolucja tworzy nową informację (z ma ą dygresją). Czym jest życie? metabolizm + informacja (replikacja) 2 Cząsteczki organiczne mog y powstać w atmosferze pierwotnej
Historia informacji genetycznej. Jak ewolucja tworzy nową informację (z ma ą dygresją). Czym jest życie? metabolizm + informacja (replikacja) 2 Cząsteczki organiczne mog y powstać w atmosferze pierwotnej
Materiały dydaktyczne do kursów wyrównawczych z przedmiotu biologia
 Człowiek najlepsza inwestycja Materiały dydaktyczne do kursów wyrównawczych z przedmiotu biologia Autor: dr inż. Anna Kostka Projekt współfinansowany ze środków Unii Europejskiej w ramach Europejskiego
Człowiek najlepsza inwestycja Materiały dydaktyczne do kursów wyrównawczych z przedmiotu biologia Autor: dr inż. Anna Kostka Projekt współfinansowany ze środków Unii Europejskiej w ramach Europejskiego
wykład dla studentów II roku biotechnologii Andrzej Wierzbicki
 Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 4 Jak działają geny?
Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Wykład 4 Jak działają geny?
Czy żywność GMO jest bezpieczna?
 Instytut Żywności i Żywienia dr n. med. Lucjan Szponar Czy żywność GMO jest bezpieczna? Warszawa, 21 marca 2005 r. Od ponad połowy ubiegłego wieku, jedną z rozpoznanych tajemnic życia biologicznego wszystkich
Instytut Żywności i Żywienia dr n. med. Lucjan Szponar Czy żywność GMO jest bezpieczna? Warszawa, 21 marca 2005 r. Od ponad połowy ubiegłego wieku, jedną z rozpoznanych tajemnic życia biologicznego wszystkich
Inżynieria genetyczna- 6 ECTS. Inżynieria genetyczna. Podstawowe pojęcia Część II Klonowanie ekspresyjne Od genu do białka
 Inżynieria genetyczna- 6 ECTS Część I Badanie ekspresji genów Podstawy klonowania i różnicowania transformantów Kolokwium (14pkt) Część II Klonowanie ekspresyjne Od genu do białka Kolokwium (26pkt) EGZAMIN
Inżynieria genetyczna- 6 ECTS Część I Badanie ekspresji genów Podstawy klonowania i różnicowania transformantów Kolokwium (14pkt) Część II Klonowanie ekspresyjne Od genu do białka Kolokwium (26pkt) EGZAMIN
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI. Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
Budowa anatomiczna liścia roślin okrytonasiennych.
 Organy wegetatywne roślin nasiennych: liście, pędy, korzenie. Budowa anatomiczna liścia roślin okrytonasiennych. Budowa morfologiczna liścia. Przekrój przez blaszkę liściową. Budowa anatomiczna liścia.
Organy wegetatywne roślin nasiennych: liście, pędy, korzenie. Budowa anatomiczna liścia roślin okrytonasiennych. Budowa morfologiczna liścia. Przekrój przez blaszkę liściową. Budowa anatomiczna liścia.
Praca kontrolna z biologii LO dla dorosłych semestr III
 Praca kontrolna z biologii LO dla dorosłych semestr III Poniższa praca składa się z 25 zadań. Przy każdym poleceniu podano liczbę punktów możliwą do uzyskania za prawidłową odpowiedź. Za rozwiązanie zadań
Praca kontrolna z biologii LO dla dorosłych semestr III Poniższa praca składa się z 25 zadań. Przy każdym poleceniu podano liczbę punktów możliwą do uzyskania za prawidłową odpowiedź. Za rozwiązanie zadań
Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie
 Tkanka mięśniowa Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie Tkanka mięśniowa poprzecznie prążkowana poprzecznie prążkowana serca gładka Tkanka mięśniowa Podstawową własnością
Tkanka mięśniowa Podział tkanki mięśniowej w zależności od budowy i lokalizacji w organizmie Tkanka mięśniowa poprzecznie prążkowana poprzecznie prążkowana serca gładka Tkanka mięśniowa Podstawową własnością
Proplastydy. Plastydy. Chloroplasty biogeneza. Plastydy
 Plastydy Proplastydy rodzina organelli powstających w toku ontogenezy rośliny drogą różnicowania form prekursorowych proplastydów w tkankach merystematycznych sferyczne; 0.5-2 μm otoczka (2 błony) stroma
Plastydy Proplastydy rodzina organelli powstających w toku ontogenezy rośliny drogą różnicowania form prekursorowych proplastydów w tkankach merystematycznych sferyczne; 0.5-2 μm otoczka (2 błony) stroma
KARTA ODPOWIEDZI - KONKURS BIOLOGICZNY ETAP SZKOLNY 2015/16
 KARTA ODPOWIEDZI - KONKURS BIOLOGICZNY ETAP SZKOLNY 2015/16 Nr Max ilość zad. punktów 1. 4 pkt A. WIRUSY ROŚLINNE Jako materiał genetyczny mają RNA. Do komórki gospodarza wnikają całe, po wcześniejszym
KARTA ODPOWIEDZI - KONKURS BIOLOGICZNY ETAP SZKOLNY 2015/16 Nr Max ilość zad. punktów 1. 4 pkt A. WIRUSY ROŚLINNE Jako materiał genetyczny mają RNA. Do komórki gospodarza wnikają całe, po wcześniejszym
TEST Z CYTOLOGII GRUPA II
 TEST Z CYTOLOGII GRUPA II Zad. 1 (4p.) Rysunek przedstawia schemat budowy pewnej struktury komórkowej. a/ podaj jej nazwę i określ funkcję w komórce, b/ nazwij elementy oznaczone cyframi 2 i 5 oraz określ
TEST Z CYTOLOGII GRUPA II Zad. 1 (4p.) Rysunek przedstawia schemat budowy pewnej struktury komórkowej. a/ podaj jej nazwę i określ funkcję w komórce, b/ nazwij elementy oznaczone cyframi 2 i 5 oraz określ
TEORIA KOMÓRKI (dlaczego istnieją osobniki?)
 Wstęp do biologii 2. TEORIA KOMÓRKI (dlaczego istnieją osobniki?) Jerzy Dzik Instytut Paleobiologii PAN Instytut Zoologii UW 2015 WSPÓLNE WŁAŚCIWOŚCI dzisiejszych organizmów procesy życiowe katalizowane
Wstęp do biologii 2. TEORIA KOMÓRKI (dlaczego istnieją osobniki?) Jerzy Dzik Instytut Paleobiologii PAN Instytut Zoologii UW 2015 WSPÓLNE WŁAŚCIWOŚCI dzisiejszych organizmów procesy życiowe katalizowane
Hybrydyzacja kwasów nukleinowych
 Hybrydyzacja kwasów nukleinowych Jaka jest lokalizacja tego genu na chromosomie? Jakie jest jego sąsiedztwo? Hybrydyzacja - powstawanie stabilnych struktur dwuniciowych z cząsteczek jednoniciowych o komplementarnych
Hybrydyzacja kwasów nukleinowych Jaka jest lokalizacja tego genu na chromosomie? Jakie jest jego sąsiedztwo? Hybrydyzacja - powstawanie stabilnych struktur dwuniciowych z cząsteczek jednoniciowych o komplementarnych
The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna
 Streszczenie rozprawy doktorskiej pt. The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna mgr Tomasz Turowski, promotor prof. dr hab.
Streszczenie rozprawy doktorskiej pt. The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna mgr Tomasz Turowski, promotor prof. dr hab.
Zadania maturalne z biologii - 3
 Koło Biologiczne Liceum Ogólnokształcące nr II w Gliwicach 2015-2016 Zadania maturalne z biologii - 3 Zadania: Zad. 1(Wiktoria Wnuk, Weronika Żak, Tomasz Gojowy 2D) Na podstawie wykresu odpowiedz na pytania.
Koło Biologiczne Liceum Ogólnokształcące nr II w Gliwicach 2015-2016 Zadania maturalne z biologii - 3 Zadania: Zad. 1(Wiktoria Wnuk, Weronika Żak, Tomasz Gojowy 2D) Na podstawie wykresu odpowiedz na pytania.
Transport pęcherzykowy i plazmodesmy
 Transport pęcherzykowy i plazmodesmy 1 Rola plazmodesmów (desmosomy, złącza szczelinowe) Zambryski & Crawford 2000 PD kanały ciągłości cytoplazmatyczno-jądrowej w ścianie komórkowej zapewniające komunikację
Transport pęcherzykowy i plazmodesmy 1 Rola plazmodesmów (desmosomy, złącza szczelinowe) Zambryski & Crawford 2000 PD kanały ciągłości cytoplazmatyczno-jądrowej w ścianie komórkowej zapewniające komunikację
Przedziały komórkowe siateczka endoplazmatyczna (ER)
 Przedziały komórkowe siateczka endoplazmatyczna (ER) Pochodzenie ER inwaginacja błony - (kanały trnslokacyjne) i rozrost cysterny spłaszczone woreczki tubule Siateczka śródplazmatyczna retikulum endoplazmatyczne
Przedziały komórkowe siateczka endoplazmatyczna (ER) Pochodzenie ER inwaginacja błony - (kanały trnslokacyjne) i rozrost cysterny spłaszczone woreczki tubule Siateczka śródplazmatyczna retikulum endoplazmatyczne
1.8. Funkcje biologiczne wody wynikają z jej właściwości fizycznych i chemicznych. Oceń
 1 1.8. Funkcje biologiczne wody wynikają z jej właściwości fizycznych i chemicznych. Oceń każdą podaną w tabeli informację, wybierając Prawdę, jeśli jest ona prawdziwa, lub, jeśli jest fałszywa. 1) Ilość
1 1.8. Funkcje biologiczne wody wynikają z jej właściwości fizycznych i chemicznych. Oceń każdą podaną w tabeli informację, wybierając Prawdę, jeśli jest ona prawdziwa, lub, jeśli jest fałszywa. 1) Ilość
TEORIA KOMÓRKI (dlaczego istnieją osobniki?)
 Wstęp do biologii 2. TEORIA KOMÓRKI (dlaczego istnieją osobniki?) Jerzy Dzik Instytut Paleobiologii PAN Instytut Zoologii UW 2017 WSPÓLNE WŁAŚCIWOŚCI dzisiejszych organizmów procesy życiowe katalizowane
Wstęp do biologii 2. TEORIA KOMÓRKI (dlaczego istnieją osobniki?) Jerzy Dzik Instytut Paleobiologii PAN Instytut Zoologii UW 2017 WSPÓLNE WŁAŚCIWOŚCI dzisiejszych organizmów procesy życiowe katalizowane
 UNIWERSYTET JAGIELLŃSKI, WYDZIAŁ CHEMII, ZAKŁAD CHEMII FIZYCZNEJ I ELEKTRCHEMII, ZESPÓŁ FIZYKCHEMII PWIERZCHNI MNWARSTWY LANGMUIRA JAK MDEL BŁN BILGICZNYCH Paweł Wydro Seminarium Zakładowe 25.I.28 PLAN
UNIWERSYTET JAGIELLŃSKI, WYDZIAŁ CHEMII, ZAKŁAD CHEMII FIZYCZNEJ I ELEKTRCHEMII, ZESPÓŁ FIZYKCHEMII PWIERZCHNI MNWARSTWY LANGMUIRA JAK MDEL BŁN BILGICZNYCH Paweł Wydro Seminarium Zakładowe 25.I.28 PLAN
Możliwości współczesnej inżynierii genetycznej w obszarze biotechnologii
 Możliwości współczesnej inżynierii genetycznej w obszarze biotechnologii 1. Technologia rekombinowanego DNA jest podstawą uzyskiwania genetycznie zmodyfikowanych organizmów 2. Medycyna i ochrona zdrowia
Możliwości współczesnej inżynierii genetycznej w obszarze biotechnologii 1. Technologia rekombinowanego DNA jest podstawą uzyskiwania genetycznie zmodyfikowanych organizmów 2. Medycyna i ochrona zdrowia
DR ŻANETA PACUD Zdolność patentowa roślin
 DR ŻANETA PACUD Zdolność patentowa roślin czyli rzecz o brokułach i pomidorach Sposoby ochrony prawnej roślin wprowadzenie Ochrona prawna odmian roślin - Międzynarodowa konwencja o ochronie nowych odmian
DR ŻANETA PACUD Zdolność patentowa roślin czyli rzecz o brokułach i pomidorach Sposoby ochrony prawnej roślin wprowadzenie Ochrona prawna odmian roślin - Międzynarodowa konwencja o ochronie nowych odmian
Biotechnologia i inżynieria genetyczna
 Wersja A Test podsumowujący rozdział II i inżynieria genetyczna..................................... Imię i nazwisko.............................. Data Klasa oniższy test składa się z 16 zadań. rzy każdym
Wersja A Test podsumowujący rozdział II i inżynieria genetyczna..................................... Imię i nazwisko.............................. Data Klasa oniższy test składa się z 16 zadań. rzy każdym
wykład dla studentów II roku biotechnologii Andrzej Wierzbicki
 Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Budowa rybosomu Translacja
Genetyka ogólna wykład dla studentów II roku biotechnologii Andrzej Wierzbicki Uniwersytet Warszawski Wydział Biologii andw@ibb.waw.pl http://arete.ibb.waw.pl/private/genetyka/ Budowa rybosomu Translacja
WARUNKI ZALICZENIA PRZEDMIOTU- 5 ECTS
 WARUNKI ZALICZENIA PRZEDMIOTU- 5 ECTS KOLOKWIA; 15% KOLOKWIA-MIN; 21% WEJŚCIÓWKI; 6% WEJŚCIÓWKI-MIN; 5% EGZAMIN; 27% EGZAMIN-MIN; 26% WARUNKI ZALICZENIA PRZEDMIOTU- 5 ECTS kolokwium I 12% poprawa kolokwium
WARUNKI ZALICZENIA PRZEDMIOTU- 5 ECTS KOLOKWIA; 15% KOLOKWIA-MIN; 21% WEJŚCIÓWKI; 6% WEJŚCIÓWKI-MIN; 5% EGZAMIN; 27% EGZAMIN-MIN; 26% WARUNKI ZALICZENIA PRZEDMIOTU- 5 ECTS kolokwium I 12% poprawa kolokwium
Temat: Budowa i funkcje korzenia.
 Temat: Budowa i funkcje korzenia. Korzeń to część podziemna organizmu roślinnego (organ wegetatywny) przystosowana do wypełniania określonych funkcji: Umocowania rośliny w podłożu. Pobierania z gleby wody
Temat: Budowa i funkcje korzenia. Korzeń to część podziemna organizmu roślinnego (organ wegetatywny) przystosowana do wypełniania określonych funkcji: Umocowania rośliny w podłożu. Pobierania z gleby wody
