Zasady postępowania diagnostyczno-terapeutycznego u chorych na nowotwory podścieliskowe przewodu pokarmowego (GIST)
|
|
|
- Kinga Kot
- 9 lat temu
- Przeglądów:
Transkrypt
1 NOWOTWORY Journal of Oncology 2011 volume 61 Number Zasady postępowania diagnostyczno-terapeutycznego u chorych na nowotwory podścieliskowe przewodu pokarmowego (GIST) Piotr Rutkowski 1*, Jan Kulig 2, Maciej Krzakowski 3, Czesław Osuch 2, Janusz A. Siedlecki 4, Anna Nasierowska-Guttmejer 5, Jacek Sygut 6, Janusz Limon 7, Arkadiusz Jeziorski 8, Urszula Grzesiakowska 9, Konrad Ptaszyński 10, Janusz Słuszniak 11, Wojciech Polkowski 12, Elżbieta Starosławska 13, Marcin Polkowski 14, Marek Bębenek 15, Maciej Matłok 16, Katarzyna Urbańczyk 17, Włodzimierz Olszewski 10, Stanisław Głuszek 18, Zbigniew I. Nowecki 19 Nowotwory podścieliskowe przewodu pokarmowego (gastrointestinal stromal tumors GIST) są najczęstszymi nowotworami pochodzenia mezenchymalnego w obrębie przewodu pokarmowego. Nowotwory te, dzięki postępom w diagnostyce patologiczno-molekularnej, powszechnie rozpoznawane są dopiero od kilku lat. W pracy przedstawiono zalecenia dotyczące diagnostyki i terapii tych nowotworów, opracowane na podstawie danych naukowych oraz doświadczenia ekspertów, które są powszechnie akceptowane i warte rekomendacji. Nadekspresja błonowego receptora KIT, będąca następstwem 1 Klinika Nowotworów Tkanek Miękkich, Kości i Czerniaków 2 I Katedra Chirurgii Ogólnej i Klinika Chirurgii Gastroenterologicznej Collegium Medicum UJ w Krakowie 3 Klinika Nowotworów Płuca i Klatki Piersiowej 4 Zakład Biologii Molekularnej 5 Zakład Patologii Szpital MSWiA w Warszawie 6 Zakład Patologii Świętokrzyskie Centrum Onkologii w Kielcach 7 Katedra i Zakład Biologii i Genetyki Gdański Uniwersytet Medyczny w Gdańsku 8 Klinika Chirurgii Onkologicznej Uniwersytet Medyczny w Łodzi 9 Zakład Radiodiagnostyki 10 Zakład Patologii 11 Dział Chirurgii Onkologicznej Świętokrzyskie Centrum Onkologii w Kielcach 12 Klinika Chirurgii Onkologicznej Uniwersytet Medyczny w Lublinie 13 Centrum Onkologii Ziemi Lubelskiej 14 Klinika Gastroenterologii 15 Klinika Chirurgii Onkologicznej Dolnośląskie Centrum Onkologii we Wrocławiu 16 II Katedra Chirurgii Ogólnej Collegium Medicum UJ w Krakowie 17 Katedra Patomorfologii Collegium Medicum UJ w Krakowie 18 Kliniczny Oddział Chirurgii Ogólnej Onkologicznej i Endokrynologicznej WSzZ, WNoZ Uniwersytet im. Jana Kochanowskiego w Kielcach 19 Klinika Nowotworów Układu Pokarmowego W imieniu Rejestru Klinicznego GIST, którego spotkanie odbyło się w dniu 9 października 2010 r., pełny wykaz uczestników umieszczono na końcu tej pracy
2 71 mutacji protoonkogenu KIT, jest wysoce specyficzna dla GIST i możliwa do wykrycia metodami immunohistochemicznymi (CD117) w preparatach histopatologicznych z guza, stanowiąc najważniejsze kryterium w jego diagnostyce mikroskopowej i wskazaniach do leczenia drobnocząsteczkowymi inhibitorami kinaz tyrozynowych. W każdym przypadku zalecane jest przesłanie materiału do badań molekularnych (w celu analizy mutacji genów KIT i PDGFRA). Radykalne leczenie operacyjne jest nadal najskuteczniejszą metodą leczenia pierwotnych GIST, jednakże nowotwór ten cechuje duży potencjał nawrotowości. W przypadkach zmian nieoperacyjnych/rozsianych leczeniem z wyboru jest zastosowanie inhibitora kinaz tyrozynowych - imatynibu, leku, który stanowi pierwsze efektywne leczenie systemowe w zaawansowanym GIST CD117(+). Zalecana dawka początkowa powinna wynosić 400 mg raz dziennie (800 mg dziennie w przypadku mutacji w eksonie 9 KIT). Monitorowanie leczenia musi opierać się na powtarzanym badaniu tomografii komputerowej jamy brzusznej, z uwzględnieniem zmian wielkości i gęstości. W przypadku progresji zaleca się zwiększenie dawki imatynibu do 800 mg na dobę, a w przypadku braku skuteczności, zastosowanie sunitynibu w dawce początkowej 50 mg dziennie. Obecnie trwają badania kliniczne nad ustaleniem roli leczenia chirurgicznego w skojarzeniu z imatynibem oraz skuteczności innych leków celowanych molekularnie w przypadku występowania oporności w czasie leczenia imatynibem. Dostępne dane odnośnie leczenia uzupełniającego wskazują na poprawę przeżyć wolnych od nawrotu, zwłaszcza w grupie chorych o istotnym ryzyku nawrotu choroby. Przedstawione zasady postępowania diagnostyczno-terapeutycznego powinny być wprowadzane praktycznie przez lekarzy zajmujących się chorymi na GIST w Polsce. Zaleca się rejestrowanie przypadków chorych na GIST w ramach narodowego Rejestru Klinicznego ( oraz standardowe leczenie chorych w wielodyscyplinarnych zespołach, mających doświadczenie w terapii GIST, oraz włączanie nowych przypadków do prospektywnych badań klinicznych. Recommendations for diagnostics and therapy of gastrointestinal stromal tumors (GIST) in 2010 Gastrointestinal stromal tumors (GIST) are the most common mesenchymal tumors of the gastrointestinal tract. Over the last years advances in the understanding of the molecular mechanisms of GIST pathogenesis have resulted in the emerging of GIST as a distinct sarcoma entity. This paper presents the guidelines for diagnostics and therapy of these tumors based on scientific research and experts experience, These guidelines are commonly accepted and worthy of recommendation. Overexpression of the KIT receptor, as a consequence of mutation of the KITprotooncogene is highly specific for GIST and enables immunohistochemilcal detection staining (CD117) in tumor specimens. It is the most important criterion in microscopic diagnostics and for indicating treatment with small-molecule tyrosine kinase inhibitors. Sending material for molecular analysis is strongly recommended (for KIT and PDGFRA genotyping). Radical surgery is still the mainstay treatment for primary, localized, resectable GISTs, although although a significant ratio of patients after potentially curative operations develop recurrent or metastatic disease. In inoperable/metastatic lesions the treatment of choice is a tyrosine kinase inhibitor imatynib mesylate the first effective systemic therapy in advanced CD117(+) GIST. The recommended initial dose should be 400 mg daily (800 mg for exon 9 KIT mutants). Tretament monitoring should be based on serial computed tomography imaging of the abdominal cavity with the assessment of changes of tumor size and density. In case of disease progression the increase of imatynib dose to 800 mg daily is recommended and - if progression maintains sunitinib in the initial dose of 50 mg daily should be introduced. Clinical trials evaluating the role of surgery combined with imatynib and the efficacy of other molecular targeted drugs in resistant cases are ongoing. Existing data indicate the beneficial role of adjuvant imatynib therapy in terms of relapse-free survival, especially in the group of patients with a significant risk of relapse. The presented recommendations for the diagnostics and therapy of GIST should be practically implemented by physicians involved in the management of GIST patients in Poland. Entering all GIST cases in the National Clinical Registry ( gist.coi.waw.pl) and standardising patient treatment in multidisciplinary teams with expertise in GIST therapy, as well as enrollment of new cases into prospective clinical trials, are recommended. Słowa kluczowe: nowotwory podścieliskowe przewodu pokarmowego, CD117, diagnostyka molekularna, imatynib, sunitynib Key words: gastrointestinal stromal tumor, CD117, molecular diagnostics, imatynib, sunitinib Wstęp Nowotwory podścieliskowe przewodu pokarmowego (gastrointestinal stromal tumors GIST) stanowią odrębną grupę najczęstszych nowotworów mezenchymalnych przewodu pokarmowego. Wywodzą się one najprawdopodobniej z prekursorów komórek rozrusznikowych Cajala (odpowiedzialnych za ruch perystaltyczny jelit). Czynnikiem inicjującym proces nowotworowy jest mutacja aktywująca w genach kodujących błonowe receptory KIT lub PDGFRA (receptor α płytkopochodnego czynnika wzrostu platelet-derived growth factor receptor α). Nadekspresja tych receptorów, będąca następstwem tej mutacji, jest wysoce specyficzna dla GIST, zaś nadmierna ekspresja błonowego receptora KIT możliwa jest do wykrycia metodami immunohistochemicznymi (CD117) w preparatach histopatologicznych z guza, stanowiąc najważniejsze kryterium w jego diagnostyce mikroskopowej i wskazaniach do leczenia drobnocząsteczkowymi inhibitorami kinaz tyrozynowych [1-3]. Klinicznie GIST
3 72 reprezentują szerokie spektrum zmian, od małych guzów o łagodnym przebiegu, stwierdzanych przypadkowo w czasie badań endoskopowych lub zabiegów operacyjnych, do bardzo agresywnych nowotworów, prowadzących do masywnych przerzutów. Podstawową metodą leczenia pierwotnych GIST jest leczenie chirurgiczne, tak jak innych mezenchymalnych nowotworów tkanek miękkich. GIST w około 40% przypadków charakteryzują się dużym ryzykiem nawrotowości po pierwotnym leczeniu operacyjnym. Pierwsze w historii terapii guzów litych wprowadzenie do praktyki onkologicznej leczenia celowanego molekularnie drobnocząsteczkowym inhibitorem kinazy tyrozynowej, imatynibem, stanowiło jednocześnie przełom w leczeniu zaawansowanych przypadków GIST [4, 5]. Nowotwory te, dzięki postępom w diagnostyce patologiczno-molekularnej, powszechnie rozpoznawane są dopiero od kilku lat. Celem pracy jest przedstawienie aktualnych zaleceń dotyczących diagnostyki i terapii tych nowotworów, opracowanych na podstawie danych naukowych oraz doświadczeń ekspertów, które są powszechnie akceptowane i warte rekomendacji. 1 Podstawową i obowiązującą zasadą powinno być leczenie nieoperacyjnych i/lub przerzutów GIST w ramach wielodyscyplinarnych zespołów, mających doświadczenie w leczeniu mięsaków. Leczenie to powinno być ograniczone do kilku wyspecjalizowanych ośrodków w Polsce, ponieważ liczbę nowych chorych kwalifikujących się do leczenia inhibitorami kinaz tyrozynowych należy ocenić na przypadków rocznie. Epidemiologia Dotychczas opublikowane dane epidemiologiczne na temat nowotworów mezenchymalnych (mięsaków) podścieliska przewodu pokarmowego (GIST) są rzadkie i ostatecznie nieustalone. Dotychczas nie jest znana dokładna proporcja łagodnych i agresywnych postaci GIST (tzn. mięsaków, stwarzających potencjalne ryzyko nawrotu i/lub nieoperacyjnego rozsiewu). Ze szwedzkich, retrospektywnych badań populacyjnych wynika, że zachorowania na GIST (łącznie postacie łagodne i agresywne) wynoszą przypadków/rok/milion [6]. Z kolei dane z Holandii szacują liczbę przypadków GIST na 12,7/milion rocznie. Dla Polski oznaczałoby to ponad 600 nowych zachorowań rocznie. W USA liczbę rozsianych/nieoperacyjnych GIST szacuje się na ponad 1000 nowych zachorowań rocznie, co daje 3-4 przypadki na 1 milion mieszkańców. Nieco wyższą zachorowalność można przewidywać na podstawie proporcji liczby chorych na nieoperacyjny GIST, zgłoszonych w badaniu EORTC (Protokół 62005), w stosunku do liczby ludności w 14 krajach uczestniczących w tym badaniu (mediana z łącznej liczby zgłoszonych w ciągu 8 miesięcy rekrutacji chorych wynosi 3,2 chorych/1milion, co sugeruje liczbę 4-5 przypadków na 1 milion mieszkańców w tych krajach rocznie). Na tej 1 Spotkanie ekspertów i współautorów tego doniesienia odbyło się 9 października 2010 r. w Krakowie. podstawie w Polsce (około 39 mln mieszkańców) można spodziewać się nowych przypadków zachorowań na rozsiany GIST rocznie. Liczba rejestrowanych do leczenia imatynibem nowych chorych w Polsce rocznie jest jednak niższa, co wskazuje na wciąż istniejące niedodiagnozowanie części przypadków GIST. Mimo tego, z danych Rejestru Klinicznego GIST (gist@coi.waw.pl; wynika, że mięsaki typu GIST stały się w ciągu ostatnich 2-4 lat najczęściej rozpoznawanym złośliwym nowotworem mezenchymalnym przewodu pokarmowego [7]. GIST mogą występować w każdym wieku, ale większość chorych (75%) w momencie rozpoznania jest w wieku powyżej 50 lat (mediana: lat). Pierwotne umiejscowienie GIST dotyczy przede wszystkim przewodu pokarmowego (ok. 90%). Znacznie rzadziej mięsaki te występują w przestrzeni zaotrzewnowej lub nie udaje się ustalić pierwotnego umiejscowienia GIST, ze względu na wieloogniskowy rozsiew śródotrzewnowy (<10%). W badaniach populacyjnych, w obrębie przewodu pokarmowego, GIST występują najczęściej w żołądku (40-70%) i jelicie cienkim (20-50%), a znacznie rzadziej w jelicie grubym (około 5%) i przełyku (poniżej 5%). Kliniczne bazy danych o chorych na GIST wykazują, że GIST wymagające leczenia inhibitorami kinaz tyrozynowych występują najczęściej w obrębie jelita cienkiego i grubego. Diagnostyka Patomorfologia Guzy podścieliskowe przewodu pokarmowego charakteryzuje utkanie mikroskopowe, złożone z komórek epitelioidnych lub wrzecionowatych, albo mieszane i pleomorficzne. Wszystkie mutacje w genach KIT lub PDGFRA mają charakter aktywujący receptor i dlatego też guzy te w większości przypadków cechuje ekspresja antygenu CD117, epitopu białka produkowanego przez gen KIT, możliwa do wykrycia metodami immunohistochemicznymi. Nieliczne przypadki, poniżej 5%, mimo iż posiadają mutację w KIT lub PDGFRA, są CD117-ujemne. Ostateczne rozpoznanie histopatologiczne GIST-u powinno zawierać: 1) rozpoznanie nowotworu mezenchymalnego z komórek epitelioidnych, wrzecionowatych lub o budowie mieszanej; 2) potwierdzenie rozpoznania badaniem immunohistochemicznym, najlepiej z użyciem panelu przeciwciał: CD117 (Dako), CD34, DOG1, wimentyny (marker komórek mezenchymalnych), aktyny mięśni gładkich (SMA), desminy (marker komórek mięśniowych), białka S100 i HMB45; 3) ocenę stopnia agresywności guza na podstawie wielkości i lokalizacji guza oraz liczby figur mitotycznych, liczonych w 50 dużych polach widzenia, według kryteriów określonych przez consensus NCCN-AFIP- AJCC [8], (Tab. I); nie stosuje się pojęcia łagodnego GIST.
4 73 Tab. I. Proponowana ocena ryzyka nawrotu nowotworu u chorych po resekcji pierwotnego GIST według AFIP-NCCN [8] Parametry nowotworu Lokalizacja guza pierwotnego i ryzyko nawrotu/przerzutów Wielkość Liczba mitoz Żołądek Dwunastnica Jelito czcze/kręte Odbytnica 2 cm Brak Brak Brak Brak > 2 cm, 5 cm Bardzo niskie Niskie Niskie Niskie 5/50 HPF > 5 cm, 10 cm Niskie Pośrednie > 10 cm Pośrednie 2 cm Brak danych Brak danych Prawdopodobnie wysokie > 2 cm, 5 cm Pośrednie > 5/50 HPF > 5 cm, 10 cm > 10 cm HPF ( high power field) pole o dużym powiększeniu (x 400) Raport histopatologiczny niezawierający powyższych informacji musi być uzupełniony przed podjęciem decyzji o leczeniu imatynibem. Zaleca się również, aby wszystkie guzy rozpoznane jako GIST, które wypełniają kryteria histologiczne i wykazują ekspresję CD117, CD34, wimentyny, a ponadto któregokolwiek z pozostałych markerów (SMActin i/ lub S-100 i/lub HMB-45), były konsultowane w ośrodku dysponującym dużym doświadczeniem w rozpoznawaniu GIST metodami immunohistochemicznymi [9]. W guzach CD117-ujemnych niezbędne jest wykonanie badania obecności mutacji w genie KIT i PDGFR oraz ponownej konsultacji preparatów histologicznych w zakładzie patologii mającym doświadczenie w rozpoznawaniu GIST. Materiałem badawczym może być tkanka guza z bloczka parafinowego lub, najlepiej, mrożona tkanka. Diagnostyka obrazowa pierwotnych GIST Zalecaną techniką obrazowania rozsiewu GIST jest badanie tomografii komputerowej jamy brzusznej (TK) z kontrastem dożylnym i doustnym. Badanie to służy ocenie stopnia zaawansowania guza oraz postępowania chirurgicznego, łącznie z próbnym otwarciem jamy brzusznej i biopsją (R2). W przypadku GIST zlokalizowanych w odbytnicy alternatywnym badaniem może być rezonans magnetyczny (MRI). W przypadku podejrzenia GIST w badaniu endoskopowym pomocna jest ultrasonografia endoskopowa. Obraz kliniczny Objawy kliniczne GIST są niespecyficzne: bóle brzucha, objawy podniedrożności lub przewlekłego krwawienia z przewodu pokarmowego, wyczuwalny guz jamy brzusznej, czasami objawy ostrego brzucha. Niewielkie zmiany długo pozostają bezobjawowe i mogą być wykrywane przypadkowo. Część (ok. 40%) kobiet chorych na GIST jelita cienkiego jest operowana na oddziałach ginekologicznych ze wstępnym rozpoznaniem nowotworu narządu rodnego ( maska GIST w miednicy) [10]. Nawroty GIST, po doszczętnej operacji ogniska pierwotnego, dotyczą przede wszystkim jamy brzusznej. Przeważnie (54%) występują przerzuty do wątroby, izolowane (25%) lub współistniejące z rozsiewem śródotrzewnowym (29%). Rozsiew śródotrzewnowy bez przerzutów do wątroby dotyczy około 30% chorych. Izolowane wznowy miejscowe są rzadkie (15%), co sugeruje, że standardowe techniki chirurgiczne, stosowane podczas operacji GIST, są skuteczne w tych nowotworach. Biopsja W przypadku podejrzenia pierwotnego GIST i jeżeli jest to technicznie możliwe, można wykonać biopsję igłową pod kontrolą ultrasonografii endoskopowej albo gruboigłową przez powłoki lub otwartą przez laparotomię (wycinającą lub nacinającą), najlepiej z zachowaniem części świeżego materiału do zamrożenia (w temperaturze minimum -80 o C), w celu wykonania ewentualnych badań molekularnych. W przypadku niewielkich zmian ( 2 cm), zlokalizowanych w górnym odcinku przewodu pokarmowego, jedynym postępowaniem może być kontrola endoskopowa, zaś ewentualne usunięcie zmiany można zarezerwować dla przypadków powiększających się w czasie obserwacji. Diagnostyka molekularna Badania molekularne GIST ujawniły obecność mutacji w genach KIT i PDGFRA [10-12], kodujących receptory błonowe o aktywności kinazy tyrozynowej. Mutacje w obu genach mają charakter wykluczający się (tzn. nie występują w obu genach jednocześnie) i aktywujący, co oznacza, że receptory stają się aktywne metabolicznie, bez konieczności połączenia się z ligandem. Mutacje w GIST najczęściej obserwuje się w protoonkogenie KIT. Większość mutacji KIT występuje w eksonie 11 (około 70%), rzadziej w eksonie 9 (6-8%). Mutacje mogą też występować w eksonach 13 i 17 tego genu. W wielu GIST,
5 74 w których nie obserwuje się mutacji KIT, występują mutacje w genie PDGFRA. Mutacje te występują w 3 eksonach PDGFRA (głównie w 18 i w mniejszym stopniu w 12 i 14). W przypadkach GIST, w których nie obserwuje się dodatniego barwienia na CD117, zalecane jest wykonanie badań molekularnych (sekwencjonowanie całych genów) w celu poszukiwania mutacji. Obecność zmutowanego genu KIT lub PDGFRA w GIST jest istotna dla przewidywania odpowiedzi na leczenie imatynibem. Mimo, że imatynib skutecznie hamuje również prawidłowy KIT i PDGFRA, to chorzy na GIST, u których nie występują mutacje KIT i PDGFRA, rzadziej odpowiadają na leczenie imatynibem. Ostatnio pojawiły się dane wskazujące na rolę określonej mutacji w odpowiedzi na imatynib. Na podstawie analizy odpowiedzi na imatynib u ponad 300 chorych wykazano, że chorzy posiadający mutacje w eksonie 11 KIT odpowiadają na leczenie imatynibem, gdy stosowano dawkę 400 mg/dzień, i charakteryzują się najdłuższym czasem wolnym do progresji [11-13], podczas gdy chorzy z mutacją w eksonie 9 KIT wymagają dawki 800 mg/d, gdyż ich odpowiedź na leczenie dawką 400 mg dziennie jest gorsza [14]. Jak się wydaje, różnice w odpowiedzi na dawkę imatynibu są wynikiem zmian w konformacji receptora, spowodowanych mutacją w eksonie 11 (ekson kodujący część cytoplazmatyczną receptora) i eksonie 9 (ekson kodujący część transbłonową receptora). Jest to jak dotąd jedyny znany typ nowotworu, dla którego wykazano zależność między lokalizacją mutacji a sposobem leczenia. Tak więc w każdym przypadku rozpoznania GIST i po rozpoczęciu leczenia, zaleca się przesłanie materiału (najlepiej świeżo zamrożonego, ale mogą to być również bloczki parafinowe) do oznaczeń molekularnych (Zakład Biologii i Genetyki Akademii Medycznej w Gdańsku prof. J. Limon; katgen@gumed.edu. pl lub Zakład Biologii Molekularnej Centrum Onkologii Instytutu w Warszawie prof. J. Siedlecki; jas@ coi.waw.pl). Współczesną klasyfikację molekularną GIST przedstawiono w Tab. II. Leczenie Zasady postępowania diagnostyczno-terapeutycznego w mięsakach GIST przedstawia Ryc. 1. Zalecane jest leczenie chorych w wielodyscyplinarnych zespołach, mających doświadczenie w terapii GIST oraz włączanie nowych przypadków GIST do prospektywnych badań klinicznych. Leczenie chirurgiczne pierwotnych, resekcyjnych GIST Najskuteczniejszą metodą leczenia GIST jest radykalne leczenie operacyjne z zamiarem wyleczenia (35-65% przeżyć 5-letnich bez nawrotu choroby) [15-17], przeprowadzając otwartą resekcję żołądka, jelita cienkiego, jelita grubego lub usuwając guz śródotrzewnowy/zaotrzewnowy w granicach makroskopowo zdrowych tkanek. W przypadku GIST żołądka najczęściej wykonuje się wycięcie miejscowe nowotworu z fragmentem ściany żołądka (resekcja klinowa), rzadziej resekcję częściową lub totalną. Nie wydaje się, aby rozległość resekcji żołądka miała znaczenie dla ryzyka nawrotu nowotworu. Co ważniejsze, kolejne reoperacje nawrotów GIST nie prowadzą do wyleczenia chorych, co jest szczególnie widoczne w przypadkach dłużej obserwowanych (powyżej 2-3 lat). W innych umiejscowieniach stosuje się resekcję odcinkową jelita cienkiego lub hemikolektomię. W odróżnieniu od raków układu pokarmowego nie ma potrzeby usuwania lokoregionalnego układu chłonnego, gdyż przerzuty do węzłów chłonnych występują w przypadku GIST sporadycznie, tj. <3% chorych. W przypadku resekcji R1 (resekcja mikroskopowo nieradykalna) można rozważać wykonanie re-resekcji pod warunkiem możliwości ustalenia lokalizacji pierwotnego guza i niezwiązanych z nią poważnych następstw dla czynności przewodu pokarmowego, w innych przypadkach zalecana jest jedynie obserwacja po leczeniu chirurgicznym. Nie zaleca się wykonywania resekcji metodą laparoskopową w pierwotnych GIST o większych rozmiarach [4] (Tab. III). W usuwaniu ma- Tab. II. Klasyfikacja molekularna GIST Mutacje genu KIT Ekson 11 Ekson 9 Ekson 13 & 17 Mutacje genu PDGFRA Ekson 12 Ekson 14 Ekson % GIST Najczęstsza mutacja w sporadycznym GIST (ok. 60%), z najlepszą odpowiedzią na imatynib; obserwowana również w rodzinnych GIST Mutacja częściej występująca w GIST wywodzących się z jelita cienkiego; gorsza odpowiedź na imatynib, chorzy mogą odnieść korzyść z większej dawki imatynibu (800 mg); dobra odpowiedź na sunitynib Obserwowano odpowiedzi kliniczne na imatynib; bardzo rzadkie mutacje; opisywane w rodzinnych GIST 5-7% GIST Obserwowane odpowiedzi kliniczne na imatynib Opisano jedynie kilka przypadków Większość przypadków wywodzi się z żołądka; D842V jest oporna na imatynib i sunitynib; inne rodzaje mutacji są wrażliwe Wild-type brak mutacji 12-15% przypadków; słabe odpowiedzi na imatynib, lepsze na sunitynib; często w GIST pediatrycznych, typowo dla GIST związanych z NF 1 lub triadą Carney a (GIST żołądka + chrzęstniaki płuc +/- paraganglioma); w części przypadków amplifikacja IGFR-1
6 75 Zmiany wyjściowo nieresekcyjne i/lub przerzuty biopsja (R2) Pierwotny, resekcyjny GIST Leczenie operacyjne (R0, R1) Badanie histopatologiczne GIST Dodatnie barwienie immunohistochemiczne na CD117 (DAKO) (badania molekularne genów KIT ew. PDGFRA)* Badanie histopatologiczne GIST Dodatnie barwienie immunohistochemiczne na CD117 (DAKO) (badania molekularne)*; ocena kategorii ryzyka wg NCCN-AFIP Ocena zmian (zmiany mierzalne) w tomografii komputerowej (CT) jamy brzusznej i miednic Badania kontrolne: tomografia komputerowa jamy brzusznej miednicy z kontrastem dożylnym i doustnym Margines R2 i/lub Nawrót choroby = M1 Brak nawrotu (M0) dalsza obserwacja lub leczenie uzupełniające imatynibem przez minimum rok w przypadku znacznego ryzyka nawrotu Monitorowanie leczenia za pomocą seryjnych badań CT z oceną zmiany wielkości i gęstości zmian; ocena pod kątem ewentualnej resekcji zmian resztkowych * zalecane, ale nie wymagane Imatynib 400 mg dziennie (w przypadku mutacji w eksonie 9 KIT do rozważenia wcześniejsze zwiększenie dawki do 800 mg) progresja Imatynib 800 mg dziennie progresja Sunitynib 50 mg dziennie (dawka wyjściowa; schemat 4/2 tygodnie) progresja Postępowanie indywidualizowane (badania kliniczne, imatynib z doksorubicyną; leczenie skojarzone; postępowanie zabiegowe) Ryc. 1. Proponowany algorytm postępowania u chorych na GIST łych GIST żołądka prawdopodobnie coraz większą rolę będą odgrywały chirurgiczne techniki mało inwazyjne, jak resekcja laparoskopowa i techniki endoskopowe. Być może technika miejscowego wycięcia przez odbyt znajdzie zastosowanie przy usuwaniu niewielkich GIST, o niskim stopniu agresywności, o lokalizacji odbytniczej. W czasie operacji szczególne znaczenie ma niedopuszczenie do uszkodzenia lub pęknięcia nowotworu, w czym wielu autorów upatruje przyczynę rozsiewu śródotrzewnowego, prowadzącego do nieoperacyjnego peritonitis sarcomatosa. Dlatego samoistne pęknięcie guza nowotworowego, będące przyczyną operacji wykonywanej z reguły w trybie pilnym, jest uznane za niekorzystny czynnik rokowniczy. U chorych na zaawansowane miejscowo GIST, w przypadkach granicznie operacyjnych, powinno się unikać wykonywania rozległych, wielonarządowych resekcji, a szczególnie reoperacji nawrotów (rozpoznanie GIST jest już znane po pierwszej operacji). W takich sytuacjach należy rozważyć leczenie przedoperacyjne imatynibem w dawce 400 mg dziennie, pod ścisłą kontrolą tomografii komputerowej wykonywanej co 2 miesiące. Decyzję o leczeniu operacyjnym podejmujemy w przypadkach odpowiedzi na imatynib. Tab. III. Zasady leczenia chirurgicznego pierwotnych GIST Resekcja guza w granicach tkanek zdrowych (margines 1-2 cm; preferowane zabiegi oszczędzające, wycięcia klinowe) Unikanie śródoperacyjnego pęknięcia guza Limfadenektomia z reguły nie jest konieczna Rola laparoskopii niepewna, metoda ta jest przeciwwskazana w przypadku większych guzów Dokładna ocena pod kątem rozsiewu choroby (zwłaszcza eksploracja zachyłków otrzewnej) W przypadku GIST miejscowo zaawansowanych należy rozważyć leczenie neoadjuwantowe imatynibem zamiast okaleczających operacji Zabezpieczenie tkanek (zamrażanie) do badań molekularnych Ocena ryzyka nawrotu choroby i zasady obserwacji po leczeniu zmian pierwotnych U każdego chorego po operacji pierwotnego GIST i otrzymaniu ostatecznego wyniku badania histopatologicznego powinno się ocenić ryzyko nawrotu według klasyfikacji NCCN-AFIP-AJCC (Tab. I). Najistotniejsze czynniki, związane z ryzykiem nawrotu po wycięciu pierwotnego nowotworu, obejmują wskaźnik mitotyczny, wielkość guza, lokalizację guza, marginesy chirurgiczne (a zwłaszcza fakt śródoperacyjnego pęknięcia guza). Klasyfikacja NCCN-AFIP-AJCC odzwierciedla fakt, że GIST wywodzący się z żołądka charakteryzuje się lepszym rokowaniem, niż GIST w jelicie cienkim lub gru-
7 76 bym. Chory powinien być poinformowany o możliwości nawrotu choroby po długim okresie od wycięcia zmiany pierwotnej. Chorzy z grup o wysokim i pośrednim stopniu agresywności powinni być poddani ścisłej obserwacji, za pomocą kontrolnej tomografii komputerowej jamy brzusznej i miednicy z kontrastem, co 3-4 miesiące przez pierwsze 2 lata po resekcji pierwotnego guza, następnie co 6 miesięcy do 5 lat od pierwotnej operacji i po upływie 5 lat raz w roku. W przypadku resekcji GIST o niskim stopniu agresywności badania kontrolne mogą być wykonywane raz w roku. Leczenie uzupeł niają ce Rola leczenia uzupełniającego jest nadal przedmiotem kontrowersji, pomimo zarejestrowania terapii uzupełniającej imatynibem po resekcji GIST o znaczącym ryzyku nawrotu, na podstawie danych z badania ACO- SOG Z9001 [18, 19], wykazujących zmniejszenie ryzyka nawrotów choroby z 17% do 2% w ciągu pierwszego roku obserwacji, bez istotnego wpływu na przeżycia całkowite. Obecnie oczekuje się na wyniki badań EORTC i Scandinavian Sarcoma Group XVIII, oceniające stosowanie imatynibu uzupełniająco przez okres dłuższy niż rok oraz badające wpływ takiej terapii na przeżycia całkowite i czas do wtórnej oporności na imatynib. Największe korzyści z leczenia uzupełniającego odnoszą chorzy o największym ryzyku nawrotu choroby (powyżej 5 mitoz / 50 pól widzenia w dużym powiększeniu i/lub wielkość guza powyżej 5 cm, lokalizacja guza pierwotnego w innych częściach przewodu pokarmowego niż żołądek, resekcja w potwierdzonych mikroskopowo nacieczonych marginesach chirurgicznych (R1) lub pęknięcie guza w czasie operacji). W oparciu o dotychczasowe wyniki badań u chorych na GIST o granicznej operacyjności zaleca się podjęcie próby leczenia neoadiuwantowego imatynibem. Leczenie zaawansowanych (nieresekcyjnych i/lub przerzutowych) GIST Nieresekcyjny lub rozsiany GIST jest oporny na konwencjonalną chemioterapię. Rola radioterapii nie jest ostatecznie ustalona. Dotychczasowe doświadczenia, wynikające z paliatywnego napromieniania zmian nieresekcyjnych miejscowo (miednica mała) lub przerzutów do kości, wydają się być zachęcające. Do niedawna, rokowanie u chorych ze zmianami nieresekcyjnymi, nawrotowymi lub przerzutami było złe (mediana przeżycia poniżej 12 miesięcy). Przełomem było wprowadzenie do praktyki klinicznej metanosulfonianu imatynibu. Jest to drobnocząsteczkowy inhibitor kinazy tyrozynowej (m.in. KIT, PDGFR), lek celowany molekularnie, skutecznie zastosowany w przewlekłej białaczce szpikowej, GIST rozsianym i/lub nieoperacyjnym i w zaawansowanym włókniakomięsaku guzowatym skóry (DFSP dermatofibrosarcoma protuberans). Imatynib jest jedynym lekiem pierwszego rzutu, zarejestrowanym w Polsce do leczenia chorych na GIST i powinien być z wyboru stosowany w przypadkach zaawansowanych. Wyniki dotychczasowych (łącznie 5) prospektywnych badań klinicznych I-III fazy w leczeniu imatynibem nieoperacyjnych lub rozsianych GIST [5, 16, 20-22] wykazały, że: całkowita odpowiedź jest obserwowana rzadko (CR; około 5-7%); najczęściej występuje remisja częściowa (PR; około 40%) i stabilizacja choroby (SD; około 36%); pierwotna i wczesna oporność są rzadko obserwowane (około 10-15%); dla uzyskania odpowiedzi nie ma znaczenia liczba przerzutów. Ponadto, wraz z wydłużeniem czasu leczenia imatynibem w przypadkach nieoperacyjnych/rozsianych GIST wzrasta odsetek odpowiedzi częściowych u chorych ze stabilizacją stwierdzoną w pierwszych miesiącach leczenia i jednocześnie wzrasta odsetek progresji (7% przy medianie czasu leczenia poniżej 10 miesięcy i 23% przy medianie powyżej 17 miesięcy). Opublikowane wyniki odległe badania II fazy o okresie obserwacji przekraczającym 4 lata stwierdzają, że mediana przeżycia całkowitego w grupie chorych, na zaawansowany GIST wyniosła 4,8 lat [21], co stanowi około 4-krotne wydłużenie przeżyć chorych, w porównaniu z danymi historycznymi (gdzie mediana przeżyć wynosiła miesięcy). Podobne wyniki opublikowała polska wieloośrodkowa grupa w ramach Rejestru Klinicznego GIST. Analiza ta objęła 232 chorych na nieoperacyjny/rozsiany GIST, leczonych imatynibem (Ryc. 2) [23]. Obecnie powszechnie przyjmuje się, że to jedyne skuteczne leczenie należy kontynuować do chwili wystąpienia progresji nowotworu (nawet przez kilka lat), gdyż zaprzestanie leczenia imatynibem może powodować szybką progresję choroby. Działania niepożądane występują u większości chorych, ale zwykle w stopniu 1. lub 2. według skali WHO, i najczęściej obejmują: niedokrwistość, obrzęki (zwłaszcza tkanek oczodołów), osłabienie, biegunkę, nudności, granulocytopenię, kurcze mięśniowe i wysypkę skórną. Oszacowane prawdopodobieństwo przeżycia 1,0 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 PFS OS 0, Czas [dni] Ryc. 2. Przeżycia wolne od progresji (PFS) i przeżycia całkowite (OS) w grupie 232 chorych na nieoperacyjny i/lub rozsiany GIST, leczonych imatynibem w ramach Rejestru Klinicznego GIST 71% 54%
8 77 Część objawów toksycznych może ustępować samoistnie, bez konieczności przerwania leczenia, a znacznego stopnia niedokrwistość występuje rzadko (poniżej 15% chorych) i wymaga przetaczania krwi w warunkach szpitalnych. Przed rozpoczęciem leczenia należy wykonać badania morfologii i biochemii krwi, ocenić stan wydolności według WHO i monitorować chorego pod kątem toksyczności w czasie każdej wizyty kontrolnej podczas leczenia imatynibem, szczególnie podczas początkowego okresu leczenia (co 2-4 tygodnie przez pierwszy miesiąc; następnie co miesiąc przez 6 miesięcy; następnie w wypadku dobrej odpowiedzi i braku toksyczności leczenia można oceniać chorego co 3 miesiące). Chory powinien zażywać imatynib systematycznie, codziennie, w zalecanej dawce. Podczas leczenia imatynibem należy pamiętać o jego interakcjach z wieloma innymi lekami, zwłaszcza metabolizowanymi przez układ cytochromów wątroby. Kryteria kwalifikacji chorych na GIST do leczenia imatynibem obejmują nawroty po leczeniu chirurgicznym, pod postacią mnogich przerzutów do wątroby i/lub rozsiew śródotrzewnowy oraz nieresekcyjne ogniska pierwotne i/lub wznowy miejscowe. Warunkiem niezbędnym jest rozpoznanie morfologicznie GIST z dodatnim barwieniem IHC na CD117 (Tab. IV). Tab. IV. Kryteria kwalifikacji chorych na GIST do leczenia imatynibem rozpoznanie patologiczne GIST badanie immunohistochemiczne na CD117 dodatnie zmiany nieoperacyjne i/lub przerzuty w badaniu tomografii komputerowej (KT) lub rezonansu magnetycznego (MR) zmiany mierzalne w badaniu KT, (MR) stan sprawności 0-3 według WHO zachowane wchłanianie z przewodu pokarmowego odpowiednia wydolność nerek i wątroby uzyskanie pisemnej zgody chorego (wymóg Narodowego Funduszu Zdrowia) przestrzeganie zasad GCP (Good Clinical Practice) Leczenie rozpoczyna się od dawki 400 mg imatynibu doustnie 1 raz dziennie. Obecnie zaleca się, aby przy progresji choroby dawkę zwiększyć do 800 mg 2 razy dziennie 400 mg. W przypadkach wystąpienia toksyczności stopnia dawkę należy zmniejszyć do 600 mg 2 razy dziennie 300 mg. Istnieją dane sugerujące, aby w przypadku występowania określonej mutacji w eksonie 9 genu KIT rozpoczynać terapię u chorych na zaawansowany GIST od dawki 800 mg dziennie, ze względu na lepsze przeżycia wolne od progresji choroby [14, 24]. Skuteczność leczenia imatynibem monitoruje się wyłącznie na podstawie badań KT jamy brzusznej, z kontrastem dożylnym i doustnym. Badanie USG nie jest przydatne do monitorowania efektów leczenia imatynibem. Pierwsze badanie KT wykonuje się na kilka dni przed rozpoczęciem leczenia, co dwa miesiące przez pierwsze pół roku leczenia i następne co 3-4 miesiące. U części chorych korzyść kliniczna z terapii (clinical benefit CB) następuje powoli (mediana czasu do wystąpienia odpowiedzi na leczenie wynosi 4 miesiące) i pierwszą pełną ocenę odpowiedzi na leczenie należy przeprowadzić po czterech miesiącach i wykonaniu (minimum) kolejnych dwóch badań kontrolnych KT. Podstawowymi ocenianymi parametrami są wielkość zmian nowotworowych [kryteria RECIST (response evaluation criteria in solid tumors) ocena sumy najdłuższych wymiarów zmian mierzalnych przy ocenie maksymalnie 5 zmian/narządów i maksymalnie 10 narządów zmienionych przerzutowo [25]] oraz ich gęstość (tzw. kryteria Choi [26]). Odpowiedź powinna być oceniana niezwykle uważnie, zwłaszcza w odniesieniu do różnicowania między stabilizacją (zahamowanie progresji) a rzeczywistą progresją, gdyż chorzy ze stabilizacją choroby, ocenianą według klasycznych kryteriów RECIST, mają znaczną korzyść z leczenia, zbliżoną do chorych wykazujących częściową odpowiedź na leczenie. Ostrożność ta wynika z faktu, że w początkowym okresie leczenia zmniejszenie gęstości zmian nowotworowych, np. w mnogich przerzutach do wątroby, może powodować fałszywy obraz ujawniania się nowych zmian lub pozorne zwiększenie wielkości już występujących, co nie odpowiada progresji choroby, tylko jest wyrazem odpowiedzi na leczenie. Najszybszą ocenę odpowiedzi na leczenie można uzyskać przy pomocy badań PET-CT. Oporność (progresja choroby) w trakcie leczenia imatynibem W trakcie leczenia imatynibem u części chorych stwierdza się progresję choroby związaną z opornością na lek. Niewielka część chorych (około 10-15%) prawidłowo zakwalifikowanych do leczenia (GIST, CD117+) wykazuje pierwotną i wczesną oporność, tj. w okresie pierwszych 6 miesięcy leczenia. U chorych odpowiadających na leczenie, wraz z wydłużającym się czasem trwania leczenia, może pojawić się wtórna (nabyta) oporność na imatynib. Szacuje się, że w czasie 2-3 lat leczenia imatynibem około 40-50% chorych wykazuje cechy progresji choroby. W badaniach obrazowych może mieć postać progresji ograniczonej, np. progresja jednej lub dwóch zmian przy utrzymującej się regresji pozostałych przerzutów lub pojawienie się rosnącego guzka w obrębie martwiczo zmienionego przerzutu, (tzw. objaw guzka w obrębie guza ). Przeważnie jednak obserwuje się obrazy progresji wieloogniskowej. U niektórych chorych można uzyskać zahamowanie progresji poprzez zwiększenie dawki imatynibu z 400 mg do 800 mg dziennie [27], co może szczególnie dotyczyć chorych z obecnością mutacji w eksonie 9 genu KIT. Stwierdzono, że prawdopodobnie różne mechanizmy towarzyszą oporności pierwotnej i oporności wtórnej, pojawiającej się w czasie leczenia imatynibem [28, 29]. Najczęściej wtórna oporność jest wynikiem nabycia przez nowotwór dodatkowej (dodatkowych) mutacji KIT lub PDGFRA, które doprowadzają do zmiany konformacji receptora, tak że nie wiąże się on dłużej z imatynibem. Biorąc pod uwagę pierwotną charakterystykę molekularną GIST, najlepsze odpowiedzi na imatynib obserwuje się
9 78 w przypadku stwierdzenia najczęściej występującej mutacji w eksonie 11 (kodujący wewnątrzkomórkową okolicę przybłonową przezbłonowego receptora KIT), zaś znacznie gorsze w eksonie 9 lub braku mutacji w genie KIT (co niekiedy wiąże się z występowaniem mutacji w genie PDGFRA, zwłaszcza D842V) [12, 29]. Postę powanie w przypadkach progresji podczas leczenia imatynibem Tab. V. Podstawowe kryteria kwalifikacji chorych na GIST do leczenia sunitynibem rozpoznanie patologiczne GIST badanie immunohistochemiczne na CD117 dodatnie zmiany nieoperacyjne i/lub przerzuty w badaniu tomografii komputerowej (KT) lub rezonansu magnetycznego (MR) zmiany mierzalne w badaniu KT, (MR) udokumentowana progresja w czasie leczenia imatynibem (oporność) lub nietolerancja imatynibu (3.-4. stopień toksyczności) stan sprawności według WHO zachowane prawidłowe wchłanianie z przewodu pokarmowego W przypadkach progresji po zwiększeniu imatynibu do maksymalnej dawki 800 mg należy rozważyć zastosowanie inhibitorów kinaz tyrozynowych drugiego rzutu. Zastosowanie tych inhibitorów, działających na inne punkty uchwytu w szlaku metabolicznym niż mutacja związana z eksonem 11 KIT, może pomóc przezwyciężyć oporność na leczenie imatynibem. W chwili obecnej jedynym zarejestrowanym lekiem drugiego rzutu do leczenia chorych na nieoperacyjny i/lub rozsiany GIST, oporny na leczenie imatynibem lub w przypadku nietolerancji imatynibu, jest tyrozynowy inhibitor wielokinazowy jabłczan sunitynibu (Sutent ), działający m.in. na kinazy tyrozynowe receptora KIT, PDGFR, naczyniowo-śródbłonkowego czynnika wzrostu (VEGFR vascular-endothelial growth factor receptor) i FLT3 (Tab. V). Dostępne dane wskazują na możliwość uzyskania długotrwałych odpowiedzi u około 40% chorych na GIST, opornych na imatynib [30, 31] (Ryc. 4), zwłaszcza w obecności pierwotnej mutacji w eksonie 9 lub przy braku mutacji (wild type) w genie KIT (jak może mieć to miejsce, np. w GIST występujących w wieku dziecięcym) [32]. Mediana czasu do progresji chorych na GIST, leczonych sunitynibem, wynosi od 6 do 8 miesięcy [30, 31]. W przypadku leczenia sunitynibem leczenie należy rozpoczynać od dawki 50 mg dziennie, w schemacie dawkowania: 4 tygodnie aktywnego leczenia, 2 tygodnie przerwy. W przypadku wystąpienia toksyczności możliwe jest zmniejszenie dawki sunitynibu do 37,5, a nawet 25 mg dziennie lub przedłużenie przerwy w dawkowaniu leku. Coraz powszechniej akceptowany jest alternatywny schemat dawkowania ciągłego (37,5 mg codziennie, bez przerw), który wydaje się bardziej uzasadniony w przypadku inhibitorów kinaz tyrozynowych [33]. Objawy uboczne w stopniu toksyczności są częstsze, niż w przypadku leczenia imatynibem i obejmują głównie: zespół ręka-stopa, zmęczenie, neutropenię, trombocytopenię, biegunkę, nudności, zapalenie błon śluzowych, nadciśnienie tętnicze oraz niedoczynność tarczycy. W przypadku dalszej progresji zaleca się możliwość włączenia chorego do badań klinicznych z innymi inhibitorami kinaz tyrozynowych (np. nilotynib AMN107, sorafenib, dasatynib, masatynib, AMG706, PKC412, PTK787 rzadko bowiem występuje krzyżowa oporność między tymi lekami) lub innymi alternatywnymi lekami (np. inhibitorami HSP90, inhibitorami mtor, inhibitorami IGFR1, inhibitorami HDAC) (Tab. VI). W przypadku zmian objawowych lub rzadkiej ograniczonej progresji choroby można rozważać zastosowanie postępowania zabiegowego (termoablacja zmian falami radiowymi, resekcja chirurgiczna, chemioembolizacja gałęzi tętnicy wątrobowej). W rzadkiej sytuacji przerzutów do kości należy wziąć pod uwagę zastosowanie paliatywnej radioterapii. W wybranych przypadkach należy również rozważyć powrót do kontynuacji leczenia imatynibem w dawce 400 mg dziennie, gdyż wiadomo, że może to znacząco spowolnić postęp choroby (część zmian pozostaje wrażliwa na leczenie imatynibem). Tab. VI. Postępowanie w przypadku progresji podczas leczenia zaawansowanego GIST imatynibem W przypadku oporności wczesnej sprawdzenie rozpoznania (włącznie z diagnostyką molekularną) Zwiększenie dawki imatynibu do 800 mg dziennie (może to przynieść przynajmniej stabilizację choroby u około 30% pacjentów przez rok; kontrola innych leków przyjmowanych przez chorego, np. działających na układ enzymatyczny w wątrobie i poziom leku w surowicy) W przypadku ograniczonej progresji należy rozważyć leczenie chirurgiczne lub ablacyjne; nie przerywać leczenia imatynibem (jeżeli większość ognisk nowotworowych jest pod kontrolą) Zastosowanie jabłczanu sunitynibu jako leku drugiego rzutu W przypadku dalszej progresji włączenie chorego do prospektywnych badań klinicznych z nowymi lekami Leczenie chirurgiczne zmian resztkowych w trakcie leczenia celowanego molekularnie Niewielki odsetek całkowitych remisji obserwowanych w badaniach obrazowych w czasie terapii imatynibem, a jednocześnie rosnące z czasem odsetki chorych z progresją z powodu pojawiania się wtórnych mutacji (i klinicznie późnych oporności), skłaniają do sugestii zastosowania chirurgii w celu poprawy wyników leczenia imatynibem. Uzupełniające leczenie chirurgiczne w trakcie terapii inhibitorami kinaz tyrozynowych najlepiej jest planować u chorych, u których obserwuje się początkowo wyraźną częściową odpowiedź, a następnie stabilizację zmian w dwóch kolejnych badaniach TK (tzn. przez 4-6 miesięcy) i pod warunkiem ich resekcyjności. Proponowany przedział czasowy dla resekcji zmian resztkowych imatynibem to 6-18 miesięcy od rozpoczęcia leczenia imatynibem. Odpowiada to okresowi stabilizacji choroby
10 79 po uzyskaniu maksymalnej odpowiedzi, ale przed powstaniem wtórnej oporności na terapię celowaną. Obecnie publikowane wyniki badań wskazują na możliwość uzyskania zmian resekcyjnych w czasie leczenia imatynibem początkowo nieoperacyjnego/rozsianego GIST u około 15-24% chorych [34]. Potwierdzono, że w preparatach histopatologicznych z wyciętych zmian resztkowych (w czasie leczenia imatynibem/sunitynibem) całkowita odpowiedź patologiczna obserwowana jest niezwykle rzadko (do 5-7% chorych). Jednocześnie wiadomo już, że konieczna jest kontynuacja leczenia imatynibem i/lub sunitynibem po operacji zmian resztkowych, nawet makroskopowo radykalnej. Wstępne wyniki wykazują wydłużenie czasu wolnego od progresji choroby w przypadku zastosowania leczenia chirurgicznego zmian resztkowych po leczeniu GIST imatynibem (i kontynuacji imatynibu). Opublikowane wyniki wskazują również, że nie powinno się operować chorych w przypadkach wieloogniskowej progresji GIST w czasie leczenia imatynibem [34-36]. Wpływ leczenia operacyjnego na przeżycia chorych z zaawansowanymi GIST leczonych imatynibem nie jest ostatecznie ustalony. Podsumowanie GIST stanowią najczęstszą grupę mezenchymalnych nowotworów przewodu pokarmowego, w większości przypadków wykazując mutację genów KIT, a w części PDGFRA. Diagnostyka patologiczna opiera się o obraz morfologiczny i wykonanie badań immunohistochemicznych na CD117. W każdym przypadku zalecane jest przesłanie materiału do badań molekularnych. Radykalne leczenie operacyjne pozostaje nadal najskuteczniejszą metodą leczenia pierwotnych GIST, jednakże nowotwór ten cechuje duży potencjał nawrotowości. W przypadku znacznego ryzyka nawrotu należy rozważyć zastosowanie leczenia uzupełniającego imatynibem. W przypadkach zmian nieoperacyjnych/rozsianych leczeniem z wyboru jest zastosowanie inhibitora kinaz tyrozynowych imatynibu, który stanowi pierwsze efektywne leczenie systemowe w CD117(+) GIST [37]. Zalecana dawka początkowa powinna wynosić 400 mg 1 raz dziennie. Monitorowanie leczenia musi opierać się na powtarzalnym badaniu tomografii komputerowej jamy brzusznej, z uwzględnieniem zmian wielkości i gęstości guza. W przypadku progresji sugeruje się zwiększenie dawki imatynibu do 800 mg na dobę, a w przypadku braku skuteczności zastosowanie sunitynibu w dawce 50 mg dziennie. Obecnie trwają badania kliniczne nad ustaleniem roli leczenia chirurgicznego w skojarzeniu z imatynibem oraz skuteczności innych leków celowanych molekularnie w przypadku występowania oporności w czasie leczenia imatynibem. Przedstawione zasady postępowania diagnostyczno-terapeutycznego powinny być wprowadzane praktycznie przez lekarzy zajmujących się chorymi na GIST w Polsce. Zaleca się rejestrowanie przypadków chorych na GIST w ramach narodowego Rejestru Klinicznego (gist@coi. waw.pl; standardowe leczenie chorych w wielodyscyplinarnych zespołach mających doświadczenie w terapii GIST oraz włączanie nowych przypadków GIST do prospektywnych badań klinicznych. Lista pozostałych uczestników spotkania ekspertów w dniu 9 października 2010 r.: Marcin Bednarek, Marek Bienioszek, Grażyna Bierzyńska-Macoszyn, Ewa Bogusławska-Strój, Elżbieta Bylina, Jacek Calik, Ewa Chmielik, Aleksander Ciechański, Bożena Cybulska-Stopa, Bogumiła Czartoryska-Arłukowicz, Sebastian Fidler, Mariusz Frączek, Marek Gelej, Izabela Gładysz, Barbara Górnicka, Ewa Guz, Katarzyna Guzińska-Ustymowicz, Joanna Hołdy-Zaręba, Joanna Hudała-Klecha, Maciej ldzik, Katarzyna Iwanik, Ewa Iżycka-Świeszewska, Daniel Jajtner, Maria Jońca, Emilia Jurczewska, Michał Kąkol, Andrzej Kemona, Agnieszka Klimkowska, Ziemowit Koc, Konstanty Kolski, Jan Kulawik, Paweł Kurzawa, Michał Kwiatkowski, Janusz Legutko, Tadeusz Leśniak, Przemysław Majewski, Wanda Michej, Marek Mijal, Ewa Mikołajska, Paweł Mońka, Bartłomiej Morawski, Izolda Mrochen-Domin, Agnieszka Nowak, Tomasz Olesiński, Joanna Omyła-Staszewska, Tomasz Osiński, Jacek Pająk, Piotr Paleń, Michał Pędziwiatr, Joanna Pikiel, Barbara Radecka, Agnieszka Radowicz-Chil, Sławomir Rudzki, Monika Rychlik- Grabowska, Rafał Rylski, Marta Rzeszutko, Wojciech Rzeszutko, Tomasz Sędziak, Maciej Słodkowski, Marcin Strzałka, Jarosław Swatek, Jacek Szmeja, Anna Szumera- Ciećkiewicz, Ewa Śrutek, Daria Świniuch, Tomasz Świtaj, Radosław Tarkowski, Teresa Trzcińska, Agnieszka Werewka-Maczuga, Anatol Wodołaski, Joanna Wolańska- Karut, Alina Wołoszyn, Agnieszka Woźniak, Magdalena Woźniak, Piotr Wójcik, Marek Wroński, Radosław Zapart, Konrad Zaręba, Monika Zazula, Wojciech Zegarski, Ewa Zielińska-Pająk Prof. nadzw. dr hab. med. Piotr Rutkowski Klinika Nowotworów Tkanek Miękkich i Kości Centrum Onkologii Instytut im. Marii Skłodowskiej-Curie ul. Roentgena 5, Warszawa rutkowskip@coi.waw.pl Piśmiennictwo 1. Miettinen M, Lasota J. Gastrointestinal stromal tumors definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Arch 2001; 438: Fletcher CDM, Berman JJ, Corless C i wsp. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Human Pathology 2002; 33: Kindblom LG, Remotti HE, Aldenborg F i wsp. Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristic of the interstitial cell of Cajal. Am J Pathol 1998; 152: Casali PG, Jost L, Reichardt P i wsp. Gastrointestinal stromal tumors: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol 2009; 20 (Suppl 4): Demetri GD, von Mehren M, Blanke CD i wsp. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 2002; 347:
11 80 6. Nilsson B, Bumming P, Meis-Kindblom i wsp. Gastrointestinal stromal tumors: the incidence, prevalence, clinical course, and prognostication in preimatinib mesylate era. Cancer 2005; 103: Ruka W, Rutkowski P, Nowecki Z i wsp. Przeżycia chorych na rozsiany i nieoperacyjny GIST leczonych imatinibem analiza etapowa Klinicznego Rejestru GIST. The outcomes of patients with metastatic/ inoperable gastrointestinal stromal tumors (GIST) treated with imatinib an interim multicenter analysis of Polish Clinical GIST Registry. Nowotwory J Oncol 2005, 55: Miettinen M, Lasota J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med 2006; 130: Urbańczyk K, Limon J, Korobowicz E i wsp. Gastrointestinal stromal tumors: a multicenter experience. Pol J Pathol 2005; 56: Nowecki Z I, Rutkowski P, Lindner B i wsp. Nowotwory podścieliskowe przewodu pokarmowego (GIST- gastrointestinal stromal tumor) umiejscowione w jelicie cienkim i rozpoznawane przedoperacyjnie jako nowotwory narządu rodnego. Gin Pol 2005; 76: Debiec-Rychter M, Dumez H, Judson I i wsp. Use of c-kit/pdgfra mutational analysis to predict the clinical response to imatinib in patients with advanced gastrointestinal stromal tumours entered on phase I and II studies of the EORTC Soft Tissue and Bone Sarcoma Group. Eur J Cancer 2004; 40: Heinrich MC, Corless CL, Demetri GD i wsp. Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. J Clin Oncol 2003; 21: Wozniak A, Floris G, Debiec-Rychter M i wsp. Implications of mutational analysis for the management of patients with gastrointestinal stromal tumors and the application of targeted therapies. Cancer Invest 2010 (early online; DOI: / ). 14. Debiec-Rychter M, Sciot R, Le Cesne A i wsp. KIT mutations and dose selection for imatinib in patients with advanced gastrointestinal stromal tumours. Eur J Cancer 2006; 42: DeMatteo RP, Lewis JJ, Leung D i wsp. Two hundred gastrointestinal stromal tumors. Recurrence patterns and prognostic factors for survival. Ann Surg 2000; 231: Trent JC, Benjamin RS. New developments in gastrointestinal stromal tumor. Curr Opin Oncol 2006; 18: Rutkowski P, Nowecki ZI, Michej W i wsp. Risk criteria and prognostic factors for predicting recurrences after resection of primary gastrointestinal stromal tumors (GISTs). Ann Surg Oncol 2007; 14: Hohenberger P, Eisenberg B. Role of surgery combined with kinase inhibition in management of gastrointestinal stromal tumor (GIST). Ann Surg Oncol 2010; DOI /s DeMatteo R, Ballman KV, Antonescu CR i wsp. Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, double-blind, placebo-controlled trial. Lancet 2009; 373: Verweij J, Casali PG, Zalcberg J i wsp. Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib: randomised trial. Lancet 2004; 364: Blanke CD, Demetri GD, von Mehren M i wsp. Long-term results from a randomized phase II trial of standard versus higher-dose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumors expressing KIT. J Clin Oncol : Blanke CD, Rankin C, Demetri GD i wsp. Phase III randomized, intergroup trial assessing imatinib mesylate at two dose levels in patients with unresectable or metastatic gastrointestinal stromal tumors expressing the kit receptor tyrosine kinase: S0033. J Clin Oncol : Rutkowski P, Nowecki ZI, Dębiec-Rychter M i wsp. Predictive factors for long term effects of imatinib therapy in patients with inoperable/ metastatic CD117(+) gastrointestinal stromal tumors (GISTs). J Ca Res Clin Oncol 2007; 133: Gastrointestinal Stromal Tumor Meta-Analysis Group (MetaGIST). Comparison of two doses of imatinib for the treatment of unresectable or metastatic gastrointestinal stromal tumors: a meta-analysis of 1640 patients. J Clin Oncol 2010; 28: Therasse P, Arbuck SG, Eisenhauer EA i wsp. New guidelines to evaluate the response to treatment in solid tumors. J Natl Cancer Inst 2000; 92: Choi H, Charnsangavej C, de Castro Faria S i wsp. CT evaluation of the response of gastrointestinal stromal tumors after imatinib mesylate treatment: a quantitative analysis correlated with FDG PET findings. AJR Am J Roentgenol 2004; 183: Zalcberg JR, Verweij J, Casali PG i wsp. Outcome of patients with advanced gastro-intestinal stromal tumours crossing over to a daily imatinib dose of 800 mg after progression on 400 mg. Eur J Cancer 2005; 41: Van Glabbeke M, Verweij J, Casali PG i wsp. Initial and late resistance to imatinib in advanced gastrointestinal stromal tumors are predicted by different prognostic factors: a European Organisation for Research and Treatment of Cancer-Italian Sarcoma Group-Australasian Gastrointestinal Trials Group study. J Clin Oncol 2005; 23: Heinrich MC, Corless CL, Blanke DC i wsp. Molecular correlates of imatinib resistance in gastrointestinal stromal tumors. J Clin Oncol 2006; 29: Demetri GD, van Oosterom AT, Garrett CR i wsp. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomized controlled trial. Lancet 2006; 368: Reichardt P, Kang YK, Ruka W i wsp. Subpopulation analyses in a worldwide treatment-use trial of sunitinib (SU) in GIST patients (pts) with resistance or intolerance to prior imatinib (IM) therapy. J Clin Oncol (18S): Abs Heinrich MC, Maki RG, Corless CL i wsp. Primary and secondary kinase genotypes correlate with the biological and clinical activity of sunitynib in imatinib-resistant gastrointestinal stromal tumor. J Clin Oncol 2008; 26: George S, Blay JY, Casali PG i wsp. Clinical evaluation of continuous daily dosing of sunitinib mesylate in patients with advanced gastrointestinal stromal tumour after imatinib failure. Eur J Cancer 2009; 45: Rutkowski P, Nowecki ZI, Nyckowski P i wsp. Surgical treatment of patients with initially inoperable and/or metastatic gastrointestinal stromal tumors (GIST) during therapy with imatinib mesylate. J Surg Oncol 2006; 4: Raut CP, Posner M, Desai J i wsp. Surgical management of advanced gastrointestinal stromal tumors after treatment with targeted systemic therapy using kinase inhibitors. J Clin Oncol 2006; 24: Mussi C, Ronellenfitsch U, Jakob J i wsp. Post-imatinib surgery in advanced/metastatic GIST: is it worthwhile in all patients? Ann Oncol 2010; 21: Reichardt P, Blay JY, von Mehren M. Towards global consensus in the treatment of gastrointestinal stromal tumor. Expert Rev Anticancer Ther 2010; 10: Otrzymano i przyjęto do druku: 14 października 2010 r.
Leczenie zaawansowanych (nieresekcyjnych i/lub przerzutowych) GIST Nieoperacyjny lub rozsiany GIST jest oporny na konwencjonalną chemioterapię.
 Leczenie zaawansowanych (nieresekcyjnych i/lub przerzutowych) GIST Nieoperacyjny lub rozsiany GIST jest oporny na konwencjonalną chemioterapię. Rola radioterapii nie jest ostatecznie ustalona. Dotychczasowe
Leczenie zaawansowanych (nieresekcyjnych i/lub przerzutowych) GIST Nieoperacyjny lub rozsiany GIST jest oporny na konwencjonalną chemioterapię. Rola radioterapii nie jest ostatecznie ustalona. Dotychczasowe
GUZY PODŚCIELISKOWE PRZEWODU POKARMOWEGO. (Gastrointestinal Stromal Tumor (GIST)) Anna Nasierowska-Guttmejer, Katarzyna Guzińska-Ustynowicz
 Sformatowano GUZY PODŚCIELISKOWE PRZEWODU POKARMOWEGO (Gastrointestinal Stromal Tumor (GIST)) Anna Nasierowska-Guttmejer, Katarzyna Guzińska-Ustynowicz 1. Materiał chirurgiczny: przełyk, Ŝołądek, jelito
Sformatowano GUZY PODŚCIELISKOWE PRZEWODU POKARMOWEGO (Gastrointestinal Stromal Tumor (GIST)) Anna Nasierowska-Guttmejer, Katarzyna Guzińska-Ustynowicz 1. Materiał chirurgiczny: przełyk, Ŝołądek, jelito
Terapeutyczne Programy Zdrowotne 2009 Leczenie nowotworów podścieliska przewodu pokarmowego (GIST) Załącznik nr 9
 Załącznik nr 9 Nazwa programu: do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Załącznik nr 9 Nazwa programu: do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Terapeutyczne Programy Zdrowotne 2012 Leczenie nowotworów podścieliska przewodu pokarmowego (GIST) Załącznik nr 8
 Załącznik nr 8 Nazwa programu: do Zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Załącznik nr 8 Nazwa programu: do Zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48)
 Dziennik Urzędowy Ministra Zdrowia 492 Poz. 66 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Dziennik Urzędowy Ministra Zdrowia 492 Poz. 66 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48)
 Dziennik Urzędowy Ministra Zdrowia 546 Poz. 71 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Dziennik Urzędowy Ministra Zdrowia 546 Poz. 71 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Aktualne postępowanie diagnostyczno-terapeutyczne u chorych na nowotwory podścieliskowe przewodu pokarmowego (GIST)
 NOWOTWORY Journal of Oncology 2007 volume 57 Number 2 181 189 Rekomendacje Recommendations Aktualne postępowanie diagnostyczno-terapeutyczne u chorych na nowotwory podścieliskowe przewodu pokarmowego (GIST)
NOWOTWORY Journal of Oncology 2007 volume 57 Number 2 181 189 Rekomendacje Recommendations Aktualne postępowanie diagnostyczno-terapeutyczne u chorych na nowotwory podścieliskowe przewodu pokarmowego (GIST)
Ośrodki medyczne wykonujące procedury diagnostyczno-terapeutyczne powinny mieć następujące możliwości:
 REKOMENDACJE KONSULTANTA KRAJOWEGO W DZIEDZINIE CHIRURGII ONKOLOGICZNEJ ORAZ POLSKIEGO TOWARZYSTWA CHIRURGII ONKOLOGICZNEJ W ZAKRESIE DIAGNOSTYKI I LECZENIA CHORYCH NA RAKA JELITA GRUBEGO REKOMENDACJE
REKOMENDACJE KONSULTANTA KRAJOWEGO W DZIEDZINIE CHIRURGII ONKOLOGICZNEJ ORAZ POLSKIEGO TOWARZYSTWA CHIRURGII ONKOLOGICZNEJ W ZAKRESIE DIAGNOSTYKI I LECZENIA CHORYCH NA RAKA JELITA GRUBEGO REKOMENDACJE
Rekomendacje Recommendations
 NOWOTWORY Journal of Oncology 2008 volume 58 Number 6 537 548 Rekomendacje Recommendations Zasady postępowania diagnostyczno-terapeutycznego u chorych na nowotwory podścieliskowe przewodu pokarmowego (GIST)
NOWOTWORY Journal of Oncology 2008 volume 58 Number 6 537 548 Rekomendacje Recommendations Zasady postępowania diagnostyczno-terapeutycznego u chorych na nowotwory podścieliskowe przewodu pokarmowego (GIST)
Zasady postępowania diagnostyczno-terapeutycznego u chorych na nowotwory podścieliskowe przewodu pokarmowego (GIST) w 2010 roku
 stanowisko ekspertów Piotr Rutkowski 1*, Jan Kulig 2, Maciej Krzakowski 3, Czesław Osuch 2, Janusz A. Siedlecki 4, Anna Nasierowska-Guttmejer 5, Jacek Sygut 6, Janusz Limon 7, Arkadiusz Jeziorski 8, Urszula
stanowisko ekspertów Piotr Rutkowski 1*, Jan Kulig 2, Maciej Krzakowski 3, Czesław Osuch 2, Janusz A. Siedlecki 4, Anna Nasierowska-Guttmejer 5, Jacek Sygut 6, Janusz Limon 7, Arkadiusz Jeziorski 8, Urszula
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
This copy is for personal use only - distribution prohibited.
 - - - - - Zasady postępowania diagnostyczno- -terapeutycznego u chorych na nowotwory podścieliskowe przewodu pokarmowego (GIST) w 2010 roku Recommendations for diagnostics and therapy of gastrointestinal
- - - - - Zasady postępowania diagnostyczno- -terapeutycznego u chorych na nowotwory podścieliskowe przewodu pokarmowego (GIST) w 2010 roku Recommendations for diagnostics and therapy of gastrointestinal
Piotr Potemski. Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi
 Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Obserwowane są samoistne regresje zmian przerzutowych
Piotr Potemski Uniwersytet Medyczny w Łodzi, Szpital im. M. Kopernika w Łodzi VI Letnia Akademia Onkologiczna dla Dziennikarzy, Warszawa, 10-12.08.2016 1 Obserwowane są samoistne regresje zmian przerzutowych
Rak piersi. Doniesienia roku Renata Duchnowska Klinika Onkologii Wojskowy Instytut Medyczny w Warszawie
 Rak piersi Doniesienia roku 2014 Renata Duchnowska Klinika Onkologii Wojskowy Instytut Medyczny w Warszawie Miejscowe leczenie Skrócone napromienianie części piersi (accelerated partial breast irradiation;
Rak piersi Doniesienia roku 2014 Renata Duchnowska Klinika Onkologii Wojskowy Instytut Medyczny w Warszawie Miejscowe leczenie Skrócone napromienianie części piersi (accelerated partial breast irradiation;
Nowotwory podścieliskowe przewodu pokarmowego
 Gastroenterologia Kliniczna 2011, tom 3, nr 3, 127 135 Copyright 2011 Via Medica ISSN 2081 1020 Piotr Rutkowski www.gastroenterologia.viamedica.pl Klinika Nowotworów Tkanek Miękkich, Kości i Czerniaków,
Gastroenterologia Kliniczna 2011, tom 3, nr 3, 127 135 Copyright 2011 Via Medica ISSN 2081 1020 Piotr Rutkowski www.gastroenterologia.viamedica.pl Klinika Nowotworów Tkanek Miękkich, Kości i Czerniaków,
Czy wiemy jak u chorych na raka gruczołu krokowego optymalnie stosować leczenie systemowe w skojarzeniu z leczeniem miejscowym?
 Czy wiemy jak u chorych na raka gruczołu krokowego optymalnie stosować leczenie systemowe w skojarzeniu z leczeniem miejscowym? Piotr Potemski Klinika Chemioterapii Nowotworów Katedry Onkologii Uniwersytet
Czy wiemy jak u chorych na raka gruczołu krokowego optymalnie stosować leczenie systemowe w skojarzeniu z leczeniem miejscowym? Piotr Potemski Klinika Chemioterapii Nowotworów Katedry Onkologii Uniwersytet
Wydłużenie życia chorych z rakiem płuca - nowe możliwości
 Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Wydłużenie życia chorych z rakiem płuca - nowe możliwości Pulmonologia 2015, PAP, Warszawa, 26 maja 2015 1 Epidemiologia raka płuca w Polsce Pierwszy nowotwór w Polsce pod względem umieralności. Tendencja
Jarosław B. Ćwikła. Wydział Nauk Medycznych Uniwersytet Warmińsko-Mazurski w Olsztynie
 Nowe algorytmy oceny odpowiedzi na leczenie w badaniach strukturalnych, dużo dalej niż klasyczne kryteria RECIST Jarosław B. Ćwikła Wydział Nauk Medycznych Uniwersytet Warmińsko-Mazurski w Olsztynie Radiologiczna
Nowe algorytmy oceny odpowiedzi na leczenie w badaniach strukturalnych, dużo dalej niż klasyczne kryteria RECIST Jarosław B. Ćwikła Wydział Nauk Medycznych Uniwersytet Warmińsko-Mazurski w Olsztynie Radiologiczna
Znaczenie współpracy patomorfologa i onkologa w leczeniu guzów podścieliskowych przewodu pokarmowego (GIST)
 PRACA PRZEGLĄDOWA Katarzyna Guzińska-Ustymowicz 1, Anna Nasierowska-Guttmejer 2, Bogumiła Czartoryska-Arłukowicz 3 1 Zakład Patomorfologii Ogólnej, Uniwersytet Medyczny w Białymstoku; Zakład Patomorfologii,
PRACA PRZEGLĄDOWA Katarzyna Guzińska-Ustymowicz 1, Anna Nasierowska-Guttmejer 2, Bogumiła Czartoryska-Arłukowicz 3 1 Zakład Patomorfologii Ogólnej, Uniwersytet Medyczny w Białymstoku; Zakład Patomorfologii,
System IntelliSpace w codziennej praktyce prof. dr hab. n. med. Marek Dedecjus Centrum Onkologii- Instytut im. Marii Skłodwskiej Curie w Warszawie
 10.00 12.00 Sesja satelitarna Akademii Onkologii Nuklearnej 10.00 10.40 Jak porównać badania PET z FDG przed i po leczeniu systemowym? Metody oceny wizualnej i półilościowej dr n. med. Andrea d Amico Centrum
10.00 12.00 Sesja satelitarna Akademii Onkologii Nuklearnej 10.00 10.40 Jak porównać badania PET z FDG przed i po leczeniu systemowym? Metody oceny wizualnej i półilościowej dr n. med. Andrea d Amico Centrum
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne raka gruczołowego
Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne raka gruczołowego
typ 3, sporadyczny; Techniki Obrazowe
 Guz neuroendokrynny żołądka typ 3, sporadyczny; Techniki Obrazowe Mariusz I.Furmanek CSK MSWiA i CMKP Warszawa Ocena wyjściowa, metody strukturalne WHO 2 (rak wysoko zróżnicowany); Endoskopia i/lub EUS;
Guz neuroendokrynny żołądka typ 3, sporadyczny; Techniki Obrazowe Mariusz I.Furmanek CSK MSWiA i CMKP Warszawa Ocena wyjściowa, metody strukturalne WHO 2 (rak wysoko zróżnicowany); Endoskopia i/lub EUS;
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 825 Poz. 71 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 825 Poz. 71 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 731 Poz. 48 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 731 Poz. 48 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego. Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa
 Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa RAK TRZUSTKI U 50% chorych w momencie rozpoznania stwierdza się
Rak trzustki - chemioterapia i inne metody leczenia nieoperacyjnego Piotr Wysocki Klinika Onkologiczna Centrum Onkologii Instytut Warszawa RAK TRZUSTKI U 50% chorych w momencie rozpoznania stwierdza się
Terapeutyczne Programy Zdrowotne 2010 Leczenie raka nerki Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku
 Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny: Nowotwór złośliwy nerki za wyjątkiem miedniczki
Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny: Nowotwór złośliwy nerki za wyjątkiem miedniczki
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka szpikowa
Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka szpikowa
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Dziennik Urzędowy Ministra Zdrowia 624 Poz. 71 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Dziennik Urzędowy Ministra Zdrowia 624 Poz. 71 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4)
 Załącznik B.53. LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie wysoko zróżnicowanego nowotworu neuroendokrynnego
Załącznik B.53. LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie wysoko zróżnicowanego nowotworu neuroendokrynnego
LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4)
 Załącznik B.53..docx LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie wysoko zróżnicowanego nowotworu neuroendokrynnego
Załącznik B.53..docx LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie wysoko zróżnicowanego nowotworu neuroendokrynnego
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Dziennik Urzędowy Ministra Zdrowia 618 Poz. 51 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Dziennik Urzędowy Ministra Zdrowia 618 Poz. 51 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Zasady postępowania diagnostyczno- -terapeutycznego u chorych na nowotwory podścieliskowe przewodu pokarmowego (GIST) w 2010 roku
 Zasady postępowania diagnostyczno- -terapeutycznego u chorych na nowotwory podścieliskowe przewodu pokarmowego (GIST) w 2010 roku Recommendations for diagnostics and therapy of gastrointestinal stromal
Zasady postępowania diagnostyczno- -terapeutycznego u chorych na nowotwory podścieliskowe przewodu pokarmowego (GIST) w 2010 roku Recommendations for diagnostics and therapy of gastrointestinal stromal
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
BADANIA KONTROLNE CHORYCH NA NOWOTWORY ZŁOŚLIWE
 BADANIA KONTROLNE CHORYCH NA NOWOTWORY ZŁOŚLIWE Marian Reinfuss CENTRUM ONKOLOGII ODDZIAŁ W KRAKOWIE OCENA WARTOŚCI CENTRUM ONKOLOGII ODDZIAŁ W KRAKOWIE PROWADZENIA BADAŃ KONTROLNYCH 1. długość przeŝycia
BADANIA KONTROLNE CHORYCH NA NOWOTWORY ZŁOŚLIWE Marian Reinfuss CENTRUM ONKOLOGII ODDZIAŁ W KRAKOWIE OCENA WARTOŚCI CENTRUM ONKOLOGII ODDZIAŁ W KRAKOWIE PROWADZENIA BADAŃ KONTROLNYCH 1. długość przeŝycia
Rak pęcherza moczowego - chemioterapia jako element leczenia skojarzonego
 Rak pęcherza moczowego - chemioterapia jako element leczenia skojarzonego Elżbieta Senkus-Konefka Klinika Onkologii i Radioterapii Gdański Uniwersytet Medyczny Kliknij ikonę, aby dodać obraz 888 cystektomii
Rak pęcherza moczowego - chemioterapia jako element leczenia skojarzonego Elżbieta Senkus-Konefka Klinika Onkologii i Radioterapii Gdański Uniwersytet Medyczny Kliknij ikonę, aby dodać obraz 888 cystektomii
ZBYT PÓŹNE WYKRYWANIE RAKA NERKI ROLA LEKARZA PIERWSZEGO KONTAKTU
 ZBYT PÓŹNE WYKRYWANIE RAKA NERKI ROLA LEKARZA PIERWSZEGO KONTAKTU 14 czerwca 2012 r dr n. med. Piotr Tomczak Klinika Onkologii U.M. Poznań Epidemiologia raka nerki RCC stanowi 2 3% nowotworów złośliwych
ZBYT PÓŹNE WYKRYWANIE RAKA NERKI ROLA LEKARZA PIERWSZEGO KONTAKTU 14 czerwca 2012 r dr n. med. Piotr Tomczak Klinika Onkologii U.M. Poznań Epidemiologia raka nerki RCC stanowi 2 3% nowotworów złośliwych
LECZENIE CHORYCH NA PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE CHORYCH NA PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka
Załącznik B.14. LECZENIE CHORYCH NA PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka
S T R E S Z C Z E N I E
 STRESZCZENIE Cel pracy: Celem pracy jest ocena wyników leczenia napromienianiem chorych z rozpoznaniem raka szyjki macicy w Świętokrzyskim Centrum Onkologii, porównanie wyników leczenia chorych napromienianych
STRESZCZENIE Cel pracy: Celem pracy jest ocena wyników leczenia napromienianiem chorych z rozpoznaniem raka szyjki macicy w Świętokrzyskim Centrum Onkologii, porównanie wyników leczenia chorych napromienianych
c) poprawa jakości życia chorych z nieziarniczym chłoniakiem typu grudkowego w III i IV stopniu
 Nazwa programu: Terapeutyczne Programy Zdrowotne 2012 Załącznik nr 9 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011r. LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
Nazwa programu: Terapeutyczne Programy Zdrowotne 2012 Załącznik nr 9 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011r. LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008.
 załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
CZĘŚĆ SZCZEGÓŁOWA NAJCZĘSTSZE NOWOTWORY OBJAWY, ROZPOZNAWANIE I LECZENIE
 CZĘŚĆ SZCZEGÓŁOWA ROZDZIA 4 NAJCZĘSTSZE NOWOTWORY OBJAWY, ROZPOZNAWANIE I LECZENIE Arkadiusz Jeziorski W Polsce do lekarzy onkologów zgłasza się rocznie ponad 130 tysięcy nowych pacjentów; około 80 tysięcy
CZĘŚĆ SZCZEGÓŁOWA ROZDZIA 4 NAJCZĘSTSZE NOWOTWORY OBJAWY, ROZPOZNAWANIE I LECZENIE Arkadiusz Jeziorski W Polsce do lekarzy onkologów zgłasza się rocznie ponad 130 tysięcy nowych pacjentów; około 80 tysięcy
Terapeutyczne Programy Zdrowotne 2012 Leczenie glejaków mózgu Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r.
 Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE GLEJAKÓW MÓZGU ICD-10 C71 nowotwór złośliwy mózgu Dziedzina medycyny: Onkologia kliniczna,
Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE GLEJAKÓW MÓZGU ICD-10 C71 nowotwór złośliwy mózgu Dziedzina medycyny: Onkologia kliniczna,
Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki, pęcherza moczowego i prostaty 2011
 Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki, pęcherza moczowego i prostaty 2011 Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki,
Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki, pęcherza moczowego i prostaty 2011 Wytyczne postępowania dla lekarzy POZ i lekarzy medycyny pracy w zakresie raka nerki,
Część A Programy lekowe
 Wymagania wobec świadczeniodawców udzielających z zakresu programów zdrowotnych (lekowych) Część A Programy lekowe 1.1 WARUNKI 1. LECZENIE PRZEWLEKŁEGO WZW TYPU B 1.1.1 wymagania formalne Wpis w rejestrze
Wymagania wobec świadczeniodawców udzielających z zakresu programów zdrowotnych (lekowych) Część A Programy lekowe 1.1 WARUNKI 1. LECZENIE PRZEWLEKŁEGO WZW TYPU B 1.1.1 wymagania formalne Wpis w rejestrze
LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20)
 Dziennik Urzędowy Ministra Zdrowia 511 Poz. 42 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie zaawansowanego
Dziennik Urzędowy Ministra Zdrowia 511 Poz. 42 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie zaawansowanego
c) poprawa jakości życia chorych z nieziarniczym chłoniakiem typu grudkowego w III i IV stopniu
 Nazwa programu: Terapeutyczne Programy Zdrowotne 2009 Załącznik nr 10 do zarządzenia Nr 98/2008/DGL Prezesa NFZ z dnia 27 października 2008 roku LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
Nazwa programu: Terapeutyczne Programy Zdrowotne 2009 Załącznik nr 10 do zarządzenia Nr 98/2008/DGL Prezesa NFZ z dnia 27 października 2008 roku LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chłoniak grudkowy
Agencja Oceny Technologii Medycznych
 Rekomendacja nr 91/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 29 października 2012 r. w sprawie objęcia refundacją produktu leczniczego Glivec (imatynib), tabl. powl., 400 mg, 30 tabl., kod
Rekomendacja nr 91/2012 Prezesa Agencji Oceny Technologii Medycznych z dnia 29 października 2012 r. w sprawie objęcia refundacją produktu leczniczego Glivec (imatynib), tabl. powl., 400 mg, 30 tabl., kod
Praktyczne stosowanie terapii celowanej w hematologii aktualne problemy
 Prof. Andrzej Hellmann Katedra i Klinika Hematologii i Transplantologii Gdański Uniwersytet Medyczny Praktyczne stosowanie terapii celowanej w hematologii aktualne problemy Seminarium Edukacyjne Innowacje
Prof. Andrzej Hellmann Katedra i Klinika Hematologii i Transplantologii Gdański Uniwersytet Medyczny Praktyczne stosowanie terapii celowanej w hematologii aktualne problemy Seminarium Edukacyjne Innowacje
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Rekomendacja nr 185/2013 z dnia 30 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Agencja Oceny Technologii Medycznych Rada Przejrzystości Rekomendacja nr 185/2013 z dnia 30 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia opieki zdrowotnej
Efektywna kontrola chorych po leczeniu nowotworów jąder
 Efektywna kontrola chorych po leczeniu nowotworów jąder Marzena Wełnicka-Jaśkiewicz Klinika Onkologii i Radioterapii Gdańskiego Uniwersytetu Medycznego Efektywna kontrola ścisła obserwacja po leczeniu
Efektywna kontrola chorych po leczeniu nowotworów jąder Marzena Wełnicka-Jaśkiewicz Klinika Onkologii i Radioterapii Gdańskiego Uniwersytetu Medycznego Efektywna kontrola ścisła obserwacja po leczeniu
Nowotwór złośliwy oskrzela i płuca
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy oskrzela i płuca Bevacizumab Bewacyzumab w skojarzeniu z chemioterapią opartą na pochodnych platyny jest wskazany w leczeniu pierwszego
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy oskrzela i płuca Bevacizumab Bewacyzumab w skojarzeniu z chemioterapią opartą na pochodnych platyny jest wskazany w leczeniu pierwszego
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C-34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C-34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C-34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 272/2013 z dnia 30 grudnia 2013 r. w sprawie usunięcia świadczenia obejmującego podawanie sorafenibu w rozpoznaniach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 272/2013 z dnia 30 grudnia 2013 r. w sprawie usunięcia świadczenia obejmującego podawanie sorafenibu w rozpoznaniach
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 30/2014 z dnia 28 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 30/2014 z dnia 28 stycznia 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego obejmującego
WTÓRNE OPERACJE CYTOREDUKCYJNE - ZASADY KWALIFIKACJI
 WTÓRNE OPERACJE CYTOREDUKCYJNE - ZASADY KWALIFIKACJI Paweł Basta Klinika Ginekologii i Onkologii Szpitala Uniwersyteckiego w Krakowie Uniwersyteckie Centrum Leczenia Chorób Piersi I Katedra Chirurgii Ogólnej
WTÓRNE OPERACJE CYTOREDUKCYJNE - ZASADY KWALIFIKACJI Paweł Basta Klinika Ginekologii i Onkologii Szpitala Uniwersyteckiego w Krakowie Uniwersyteckie Centrum Leczenia Chorób Piersi I Katedra Chirurgii Ogólnej
Nazwa programu: LECZENIE RAKA WĄTROBOKOMÓRKOWEGO
 Załącznik nr 48 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE RAKA WĄTROBOKOMÓRKOWEGO ICD-10 C 22.0 Rak komórek wątroby Dziedzina medycyny: Onkologia
Załącznik nr 48 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE RAKA WĄTROBOKOMÓRKOWEGO ICD-10 C 22.0 Rak komórek wątroby Dziedzina medycyny: Onkologia
Spis treści. Przedmowa Barbara Czerska... 11 Autorzy... 17 Wykaz skrótów... 19
 Przedmowa Barbara Czerska.................................. 11 Autorzy.................................................... 17 Wykaz skrótów.............................................. 19 Rozdział I.
Przedmowa Barbara Czerska.................................. 11 Autorzy.................................................... 17 Wykaz skrótów.............................................. 19 Rozdział I.
Dzień 1 - Otwarcie Sympozjum ( )
 Godz. 9.00 Dzień 1 - Otwarcie Sympozjum (8. 06. 2018) prof. dr hab. Tomasz Grodzicki Zastępca Rektora Uniwersytetu Jagiellońskiego ds. Collegium Medicum prof. dr hab. Grzegorz Wallner Konsultant Krajowy
Godz. 9.00 Dzień 1 - Otwarcie Sympozjum (8. 06. 2018) prof. dr hab. Tomasz Grodzicki Zastępca Rektora Uniwersytetu Jagiellońskiego ds. Collegium Medicum prof. dr hab. Grzegorz Wallner Konsultant Krajowy
Analiza problemu decyzyjnego dla produktu leczniczego Glivec (imatynib) stosowanego w leczeniu adjuwantowym dorosłych pacjentów z wysokim ryzykiem
 Analiza problemu decyzyjnego dla produktu leczniczego Glivec (imatynib) stosowanego w leczeniu adjuwantowym dorosłych pacjentów z wysokim ryzykiem nawrotu po zabiegu usunięcia KIT (CD 117) - dodatnich
Analiza problemu decyzyjnego dla produktu leczniczego Glivec (imatynib) stosowanego w leczeniu adjuwantowym dorosłych pacjentów z wysokim ryzykiem nawrotu po zabiegu usunięcia KIT (CD 117) - dodatnich
Radioterapia w leczeniu raka pęcherza moczowego - zalecenia
 Radioterapia w leczeniu raka pęcherza moczowego - zalecenia Radioterapia w leczeniu raka pęcherza moczowego może być stosowana łącznie z leczeniem operacyjnym chemioterapią. Na podstawie literatury anglojęzycznej
Radioterapia w leczeniu raka pęcherza moczowego - zalecenia Radioterapia w leczeniu raka pęcherza moczowego może być stosowana łącznie z leczeniem operacyjnym chemioterapią. Na podstawie literatury anglojęzycznej
LECZENIE RAKA PIERSI (ICD-10 C 50)
 Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1. Leczenie
Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Podstawy diagnostyki onkologicznej. Podstawy diagnostyki onkologicznej. Marcin Stępie. pień
 Marcin Stępie pień Katedra Onkologii i Klinika Onkologii Ginekologicznej AM Wrocław, Dolnośląskie Centrum Onkologii we Wrocławiu. Cele diagnostyki rozpoznanie choroby nowotworowej; ocena zaawansowania
Marcin Stępie pień Katedra Onkologii i Klinika Onkologii Ginekologicznej AM Wrocław, Dolnośląskie Centrum Onkologii we Wrocławiu. Cele diagnostyki rozpoznanie choroby nowotworowej; ocena zaawansowania
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU I NINTEDANIBU (ICD- 10 C 34)
 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU I NINTEDANIBU (ICD- 10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne
Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU I NINTEDANIBU (ICD- 10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne
RAK NERKOWO-KOMÓRKOWY UOGÓLNIONE STADIUM PRZEWLEKŁA CHOROBA // DŁUGOŚĆ LECZENIA
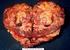 RAK NERKOWO-KOMÓRKOWY PRZEWLEKŁA CHOROBA // DŁUGOŚĆ LECZENIA Maciej Krzakowski Centrum Onkologii-Instytut im. Marii Skłodowskiej-Curie Warszawa 1 SYGNAŁOWE SZLAKI // TERAPEUTYCZNE CELE * Oudard i wsp.
RAK NERKOWO-KOMÓRKOWY PRZEWLEKŁA CHOROBA // DŁUGOŚĆ LECZENIA Maciej Krzakowski Centrum Onkologii-Instytut im. Marii Skłodowskiej-Curie Warszawa 1 SYGNAŁOWE SZLAKI // TERAPEUTYCZNE CELE * Oudard i wsp.
Ocena czynników rokowniczych w raku płaskonabłonkowym przełyku w materiale Kliniki Chirurgii Onkologicznej AM w Gdańsku doniesienie wstępne
 Ocena czynników rokowniczych w raku płaskonabłonkowym przełyku w materiale Kliniki Chirurgii Onkologicznej AM w Gdańsku doniesienie wstępne Świerblewski M. 1, Kopacz A. 1, Jastrzębski T. 1 1 Katedra i
Ocena czynników rokowniczych w raku płaskonabłonkowym przełyku w materiale Kliniki Chirurgii Onkologicznej AM w Gdańsku doniesienie wstępne Świerblewski M. 1, Kopacz A. 1, Jastrzębski T. 1 1 Katedra i
Typ histopatologiczny
 Typ histopatologiczny Wiek Stopieo zróżnicowania nowotworu Typ I (hormonozależny) Adenocarcinoma Adenoacanthoma Naciekanie przestrzeni naczyniowych Wielkośd guza Typ II (hormononiezależny) Serous papillary
Typ histopatologiczny Wiek Stopieo zróżnicowania nowotworu Typ I (hormonozależny) Adenocarcinoma Adenoacanthoma Naciekanie przestrzeni naczyniowych Wielkośd guza Typ II (hormononiezależny) Serous papillary
Przykłady opóźnień w rozpoznaniu chorób nowotworowych u dzieci i młodzieży Analiza przyczyn i konsekwencji
 PROGRAM POPRAWY WCZESNEGO WYKRYWANIA I DIAGNOZOWANIA NOWOTWORÓW U DZIECI W PIĘCIU WOJEWÓDZTWACH POLSKI Przykłady opóźnień w rozpoznaniu chorób nowotworowych u dzieci i młodzieży Analiza przyczyn i konsekwencji
PROGRAM POPRAWY WCZESNEGO WYKRYWANIA I DIAGNOZOWANIA NOWOTWORÓW U DZIECI W PIĘCIU WOJEWÓDZTWACH POLSKI Przykłady opóźnień w rozpoznaniu chorób nowotworowych u dzieci i młodzieży Analiza przyczyn i konsekwencji
Dr hab. med. Mirosław Dziuk, prof. nadzw. Kierownik Zakładu Medycyny Nuklearnej WIM Warszawa
 Dr hab. med. Mirosław Dziuk, prof. nadzw. Kierownik Zakładu Medycyny Nuklearnej WIM Warszawa ROZPOZNAWANIE: PET - CT W ONKOLOGII poszukiwanie ognisk choroby - wczesne wykrywanie różnicowanie zmian łagodnych
Dr hab. med. Mirosław Dziuk, prof. nadzw. Kierownik Zakładu Medycyny Nuklearnej WIM Warszawa ROZPOZNAWANIE: PET - CT W ONKOLOGII poszukiwanie ognisk choroby - wczesne wykrywanie różnicowanie zmian łagodnych
Nowotwory złośliwe skóry. Katedra Onkologii AM w Poznaniu
 Nowotwory złośliwe skóry Katedra Onkologii AM w Poznaniu Nowotwory złośliwe skóry Raki: rak podstawnokomórkowy rak kolczystokomórkowy rak płakonabłonkowy Czerniak Nowotwory złośliwe skóryrak podstawnokomórkowy
Nowotwory złośliwe skóry Katedra Onkologii AM w Poznaniu Nowotwory złośliwe skóry Raki: rak podstawnokomórkowy rak kolczystokomórkowy rak płakonabłonkowy Czerniak Nowotwory złośliwe skóryrak podstawnokomórkowy
Leczenie i przeżycia 5-letnie dolnośląskich kobiet chorych na nowotwory złośliwe piersi z lat 2004-2008
 Leczenie i przeżycia 5-letnie dolnośląskich kobiet chorych na nowotwory złośliwe piersi z lat 2004-2008 W latach 2004-2008 w Dolnośląskim Rejestrze Nowotworów zarejestrowaliśmy 6.125 zachorowań na inwazyjne
Leczenie i przeżycia 5-letnie dolnośląskich kobiet chorych na nowotwory złośliwe piersi z lat 2004-2008 W latach 2004-2008 w Dolnośląskim Rejestrze Nowotworów zarejestrowaliśmy 6.125 zachorowań na inwazyjne
leczenie miejscowe leczenie systemowe leczenie skojarzone Leczenie chirurgiczne wznowy miejscowej leczenie radykalne
 Leczenie W terapii raka jelita grubego stosuje się trzy podstawowe metody leczenia onkologicznego: chirurgię, radioterapię oraz chemioterapię. Dwie pierwsze określa się jako leczenie miejscowe, ostania
Leczenie W terapii raka jelita grubego stosuje się trzy podstawowe metody leczenia onkologicznego: chirurgię, radioterapię oraz chemioterapię. Dwie pierwsze określa się jako leczenie miejscowe, ostania
Lek. Marcin Polok. Katedra i Klinika Chirurgii i Urologii Dziecięcej UM we Wrocławiu. Ocena skuteczności operacyjnego leczenia wodonercza u dzieci
 Lek. Marcin Polok Katedra i Klinika Chirurgii i Urologii Dziecięcej UM we Wrocławiu Ocena skuteczności operacyjnego leczenia wodonercza u dzieci Rozprawa na stopień doktora nauk medycznych w zakresie medycyny
Lek. Marcin Polok Katedra i Klinika Chirurgii i Urologii Dziecięcej UM we Wrocławiu Ocena skuteczności operacyjnego leczenia wodonercza u dzieci Rozprawa na stopień doktora nauk medycznych w zakresie medycyny
Przerzut raka żołądka do migdałka podniebiennego
 Dariusz Kaczmarczyk Przerzut raka żołądka do migdałka podniebiennego Klinika Chirurgii Nowotworów Głowy i Szyi Uniwersytetu Medycznego w Łodzi Kierownik: Prof. dr hab. med. Alina Morawiec Sztandera Opis
Dariusz Kaczmarczyk Przerzut raka żołądka do migdałka podniebiennego Klinika Chirurgii Nowotworów Głowy i Szyi Uniwersytetu Medycznego w Łodzi Kierownik: Prof. dr hab. med. Alina Morawiec Sztandera Opis
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
Dokąd zmierza radioterapia w raku odbytnicy? Krzysztof Bujko Centrum Onkologii w Warszawie
 Dokąd zmierza radioterapia w raku odbytnicy? Krzysztof Bujko Centrum Onkologii w Warszawie Dokąd zmierza radioterapia w raku odbytnicy? W kierunku obserwacji bez chirurgii u chorych z kliniczną całkowitą
Dokąd zmierza radioterapia w raku odbytnicy? Krzysztof Bujko Centrum Onkologii w Warszawie Dokąd zmierza radioterapia w raku odbytnicy? W kierunku obserwacji bez chirurgii u chorych z kliniczną całkowitą
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Odrębności diagnostyki i leczenia raka piersi u młodych kobiet
 Odrębności diagnostyki i leczenia raka piersi u młodych kobiet Barbara Radecka Opolskie Centrum Onkologii Amadeo Modigliani (1884-1920) 1 Młode chore Kto to taki??? Daniel Gerhartz (1965-) 2 3 Grupy wiekowe
Odrębności diagnostyki i leczenia raka piersi u młodych kobiet Barbara Radecka Opolskie Centrum Onkologii Amadeo Modigliani (1884-1920) 1 Młode chore Kto to taki??? Daniel Gerhartz (1965-) 2 3 Grupy wiekowe
POSTĘPOWANIE OKOŁOOPERACYJNE W NOWOTWORACH JELITA GRUBEGO
 Andrzej W. SZAWŁOWSKI POSTĘPOWANIE OKOŁOOPERACYJNE W NOWOTWORACH z -Instytutu im. Marii Skłodowskiej-Curie w Warszawie Kroki milowe postępu w chirurgii ZNIECZULENIE leczenie bólu ANTYBIOTYKI leczenie zakażeń
Andrzej W. SZAWŁOWSKI POSTĘPOWANIE OKOŁOOPERACYJNE W NOWOTWORACH z -Instytutu im. Marii Skłodowskiej-Curie w Warszawie Kroki milowe postępu w chirurgii ZNIECZULENIE leczenie bólu ANTYBIOTYKI leczenie zakażeń
LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0)
 Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
c) poprawa jakości życia chorych z nieziarniczym chłoniakiem typu grudkowego w III i IV stopniu
 załącznik nr 10 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chloniak grudkowy C 83 chłoniaki nieziarniczy rozlane Dziedzina
załącznik nr 10 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE CHŁONIAKÓW ZŁOŚLIWYCH ICD-10 C 82 chloniak grudkowy C 83 chłoniaki nieziarniczy rozlane Dziedzina
GIST czym jest i jak stawić mu czoła?
 GIST czym jest i jak stawić mu czoła? Diagnoza Nowotwory należy leczyć u onkologa! A GIST należy leczyć w ośrodku onkologicznym, który specjalizuje się w leczeniu tego rzadkiego nowotworu!!! Powyższe stwierdzenie
GIST czym jest i jak stawić mu czoła? Diagnoza Nowotwory należy leczyć u onkologa! A GIST należy leczyć w ośrodku onkologicznym, który specjalizuje się w leczeniu tego rzadkiego nowotworu!!! Powyższe stwierdzenie
Czy potrzebne jest powołanie w Polsce wyspecjalizowanych ośrodków leczenia chorych na raka jelita grubego ("colorectal units")?
 Czy potrzebne jest powołanie w Polsce wyspecjalizowanych ośrodków leczenia chorych na raka jelita grubego ("colorectal units")? Lucjan Wyrwicz Centrum Onkologii Instytut im M. Skłodowskiej-Curie w Warszawie
Czy potrzebne jest powołanie w Polsce wyspecjalizowanych ośrodków leczenia chorych na raka jelita grubego ("colorectal units")? Lucjan Wyrwicz Centrum Onkologii Instytut im M. Skłodowskiej-Curie w Warszawie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 12/2011 z dnia 28 lutego 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany poziomu lub
Agencja Oceny Technologii Medycznych Rada Konsultacyjna Stanowisko Rady Konsultacyjnej nr 12/2011 z dnia 28 lutego 2011 r. w sprawie usunięcia z wykazu świadczeń gwarantowanych albo zmiany poziomu lub
Leczenie systemowe raka nie-jasnokomórkowego
 Leczenie systemowe raka nie-jasnokomórkowego Piotr Tomczak Uniwersytet Medyczny w Poznaniu Klinika Onkologii Jastrzębia Góra Nie-jasnokomórkowy rak nerki (ncc RCC) niejednorodna grupa o zróżnicowanej histologii
Leczenie systemowe raka nie-jasnokomórkowego Piotr Tomczak Uniwersytet Medyczny w Poznaniu Klinika Onkologii Jastrzębia Góra Nie-jasnokomórkowy rak nerki (ncc RCC) niejednorodna grupa o zróżnicowanej histologii
VII. ŚWIADCZENIA MEDYCYNY NUKLEARNEJ. LP. Nazwa świadczenia gwarantowanego Warunki realizacji świadczeń
 VII. ŚWIADCZENIA MEDYCYNY NUKLEARNEJ LP. Nazwa świadczenia gwarantowanego Warunki realizacji świadczeń 1. Scyntygrafia i radioizotopowe badanie czynnościowe tarczycy 1) gamma kamera planarna lub scyntygraf;
VII. ŚWIADCZENIA MEDYCYNY NUKLEARNEJ LP. Nazwa świadczenia gwarantowanego Warunki realizacji świadczeń 1. Scyntygrafia i radioizotopowe badanie czynnościowe tarczycy 1) gamma kamera planarna lub scyntygraf;
Katarzyna Pogoda Warszawa, 23 marca 2017 roku
 Chemioterapia doustna i podskórne metody podawania leków w raku piersi. Lepsza jakość życia pacjentek Katarzyna Pogoda Warszawa, 23 marca 2017 roku Rak piersi - heterogenna choroba Stopień zaawansowania
Chemioterapia doustna i podskórne metody podawania leków w raku piersi. Lepsza jakość życia pacjentek Katarzyna Pogoda Warszawa, 23 marca 2017 roku Rak piersi - heterogenna choroba Stopień zaawansowania
Neoadiuwantowe i adiuwantowe leczenie imatynibem chorych na nowotwory podścieliskowe przewodu pokarmowego: stan obecny i najnowsze osiągnięcia
 Neoadiuwantowe i adiuwantowe leczenie imatynibem chorych na nowotwory podścieliskowe przewodu pokarmowego: stan obecny i najnowsze osiągnięcia David Reynoso, Jonathan C. Trent Current Opinion in Oncology
Neoadiuwantowe i adiuwantowe leczenie imatynibem chorych na nowotwory podścieliskowe przewodu pokarmowego: stan obecny i najnowsze osiągnięcia David Reynoso, Jonathan C. Trent Current Opinion in Oncology
RECIST oczami radiologa. Katarzyna Steinhof-Radwańska
 RECIST oczami radiologa Katarzyna Steinhof-Radwańska RECIST-(Response Evaluation Criteria In Solid Tumors ) to zbiór zasad określających odpowiedź na zastosowane leczenie u pacjenta z chorobą nowotworową,
RECIST oczami radiologa Katarzyna Steinhof-Radwańska RECIST-(Response Evaluation Criteria In Solid Tumors ) to zbiór zasad określających odpowiedź na zastosowane leczenie u pacjenta z chorobą nowotworową,
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 519 Poz. 42 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza
Dziennik Urzędowy Ministra Zdrowia 519 Poz. 42 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza
Program Konferencji Otwarcie: J. Malicki (Dyrektor WCO Poznań) Rozpoczęcie: D. Murawa, J. Jankau, M. Litwiniuk, Z. Nowecki
 Program Konferencji 09.00 Otwarcie: J. Malicki (Dyrektor WCO Poznań) Rozpoczęcie: D. Murawa, J. Jankau, M. Litwiniuk, Z. Nowecki 09.10 10.40 Sesja ogólna State of the art AD 2016 Prowadzenie: Arkadiusz
Program Konferencji 09.00 Otwarcie: J. Malicki (Dyrektor WCO Poznań) Rozpoczęcie: D. Murawa, J. Jankau, M. Litwiniuk, Z. Nowecki 09.10 10.40 Sesja ogólna State of the art AD 2016 Prowadzenie: Arkadiusz
CZWARTEK r. INTERAKTYWNE WARSZTATY SZKOLENIOWE. Moderatorzy: prof. dr hab. med. Zbigniew Kojs prof. dr hab. med.
 CZWARTEK 08.09.2016 r. INTERAKTYWNE WARSZTATY SZKOLENIOWE Moderatorzy: prof. dr hab. med. Zbigniew Kojs prof. dr hab. med. Łukasz Wicherek 15:00-17:00 Miejsce wielonarządowej resekcji w leczeniu chorych
CZWARTEK 08.09.2016 r. INTERAKTYWNE WARSZTATY SZKOLENIOWE Moderatorzy: prof. dr hab. med. Zbigniew Kojs prof. dr hab. med. Łukasz Wicherek 15:00-17:00 Miejsce wielonarządowej resekcji w leczeniu chorych
Uzyskano wstępną akceptację dla tej procedury.
 W dniu 1 lutego 2017 roku profesorowie Tomasz Jastrzębski i Arkadiusz Jeziorski złożyli na ręce min. Krzysztofa Łandy dokumentację dotyczącą procedury HIPEC w intencji uznania jej jako procedury gwarantowanej
W dniu 1 lutego 2017 roku profesorowie Tomasz Jastrzębski i Arkadiusz Jeziorski złożyli na ręce min. Krzysztofa Łandy dokumentację dotyczącą procedury HIPEC w intencji uznania jej jako procedury gwarantowanej
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 8 grudnia 2011 r.
 Dziennik Ustaw Nr 269 15678 Poz. 1593 1593 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 8 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na podstawie
Dziennik Ustaw Nr 269 15678 Poz. 1593 1593 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 8 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na podstawie
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W BADANIA DIAGNOSTYCZNE WYKONYWANE W ŚWIADCZENIOBIORCY PROGRAMIE RAMACH
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W BADANIA DIAGNOSTYCZNE WYKONYWANE W ŚWIADCZENIOBIORCY PROGRAMIE RAMACH
Centrum Onkologii-Instytut im. Marii Skłodowskiej-Curie w Warszawie ul. Wawelska 15B, Warszawa, Polska
 C ertyfikat N r: 2 5 8 756-2018-AQ-POL-RvA Data pierws zej c ertyfikacji: 0 6 kwietnia 2 012 Ważnoś ć c ertyfikatu: 2 7 maja 2 0 1 9-0 5 kwietnia 2 021 Niniejszym potwierdza się, że system zarządzania
C ertyfikat N r: 2 5 8 756-2018-AQ-POL-RvA Data pierws zej c ertyfikacji: 0 6 kwietnia 2 012 Ważnoś ć c ertyfikatu: 2 7 maja 2 0 1 9-0 5 kwietnia 2 021 Niniejszym potwierdza się, że system zarządzania
CHIRURGICZNE LECZENIE GUZÓW NEUROENDOKRYNNYCH (NET) UKŁADU POKARMOWEGO:
 Andrzej W. SZAWŁOWSKI CHIRURGICZNE LECZENIE GUZÓW NEUROENDOKRYNNYCH (NET) UKŁADU POKARMOWEGO: Żołądka Jelit Trzustki GEP z Kliniki Nowotworów Górnego Odcinka Układu Pokarmowego -Instytut im. Marii Skłodowskiej-Curie
Andrzej W. SZAWŁOWSKI CHIRURGICZNE LECZENIE GUZÓW NEUROENDOKRYNNYCH (NET) UKŁADU POKARMOWEGO: Żołądka Jelit Trzustki GEP z Kliniki Nowotworów Górnego Odcinka Układu Pokarmowego -Instytut im. Marii Skłodowskiej-Curie
WCZESNE OBJAWY CHOROBY NOWOTWOROWEJ U DZIECI
 WCZESNE OBJAWY CHOROBY NOWOTWOROWEJ U DZIECI Elżbieta Adamkiewicz-Drożyńska Katedra i Klinika Pediatrii, Hematologii i Onkologii Początki choroby nowotworowej u dzieci Kumulacja wielu zmian genetycznych
WCZESNE OBJAWY CHOROBY NOWOTWOROWEJ U DZIECI Elżbieta Adamkiewicz-Drożyńska Katedra i Klinika Pediatrii, Hematologii i Onkologii Początki choroby nowotworowej u dzieci Kumulacja wielu zmian genetycznych
Dr hab. n. med. Paweł Blecharz
 BRCA1 zależny rak piersi i jajnika odmienności diagnostyczne i kliniczne (BRCA1 dependent breast and ovarian cancer clinical and diagnostic diversities) Paweł Blecharz Dr hab. n. med. Paweł Blecharz Dr
BRCA1 zależny rak piersi i jajnika odmienności diagnostyczne i kliniczne (BRCA1 dependent breast and ovarian cancer clinical and diagnostic diversities) Paweł Blecharz Dr hab. n. med. Paweł Blecharz Dr
