LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
|
|
|
- Bartosz Wojciechowski
- 8 lat temu
- Przeglądów:
Transkrypt
1 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W BADANIA DIAGNOSTYCZNE WYKONYWANE W ŚWIADCZENIOBIORCY PROGRAMIE RAMACH PROGRAMU Kryteria kwalifikacji 1. Pemetreksed 1. Badania przy kwalifikacji do leczenia 1.1 Zalecana dawka wynosi 500 mg/m 2 powierzchni ciała. 1.1 Pierwsza linia leczenia 1.1 Pemetreksed w pierwszej albo drugiej linii leczenia oraz 1.2 Podanie leku obejmuje 10-minutowy wlew dożylny w Leczenie przy wykorzystaniu substancji czynnej docetaksel w drugiej linii leczenia: pierwszym dniu każdego 21-dniowego cyklu leczenia. pemetreksed: 1) histologiczne potwierdzenie określonego typu 1.3 W dniu poprzedzającym zastosowanie pemetreksedu 1) rozpoznanie gruczolakoraka, wielkokomórkowego raka płuca niedrobnokomórkowego raka płuca zgodnie z kryteriami oraz w dniu zastosowania leku i w dniu następnym należy lub nowotworu z przewagą wymienionych typów włączenia; stosować lek z grupy kortykosteroidów w dawce histologicznych; 2) morfologia krwi z rozmazem; równoważnej 4 mg deksametazonu podawanego doustnie 2) zaawansowanie kliniczne w stopniach IIIB (z wyjątkiem 3) oznaczenia stężenia kreatyniny; 2 razy na dobę. przypadków, w których możliwe jest zastosowanie 4) oznaczenie stężenia bilirubiny; 1.4 W celu ograniczenia objawów toksyczności pacjenci radiochemioterapii lub radioterapii) albo IV; 5) oznaczenie aktywności aminotransferazy alaninowej; otrzymujący pemetreksed powinni również otrzymywać 3) zmiany nowotworowe możliwe do zmierzenia; 6) oznaczenie aktywności aminotransferazy suplementację witaminową: 4) w przypadku pojedynczej zmiany - umiejscowienie poza asparaginianowej; 1) kwas foliowy lub produkt multiwitaminowy obszarem wcześniejszego napromieniania; 7) oznaczenie aktywności fosfatazy zasadowej; zawierający ten związek: 5) wiek powyżej 18 roku życia; 8) test ciążowy u kobiet w wieku rozrodczym; a) codziennie, przez cały cykl leczenia i przez 21 dni po 6) sprawność w stopniu 0-1 wg klasyfikacji Zubroda-WHO lub 9) badanie tomografii komputerowej klatki piersiowej z podaniu ostatniej dawki pemetreksedu w dawce od 350 do ECOG; objęciem nadbrzusza lub klasyczne badanie RTG klatki 1000 mikrogramów doustnie, 7) brak przerzutów w ośrodkowym układzie nerwowym piersiowej w przypadku zmiany dobrze mierzalnej, otoczonej b) w ciągu 7 dni poprzedzających zastosowanie pierwszej pierwotnie albo po zastosowaniu wcześniejszego leczenia przez prawidłowo upowietrzniony miąższ płucny; dawki pemetreksedu - co najmniej 5 dawek kwasu miejscowego oraz brak objawów ze strony ośrodkowego układu 10) badanie tomografii komputerowej innej lokalizacji lub foliowego w ilości od 350 do 1000 mikrogramów nerwowego, a także stała lub zmniejszana dawka inne badania obrazowe (ultrasonografia - USG, rezonans doustnie; kortykosteroidów przez ostatnie 4 tygodnie w przypadku magnetyczny - MR, scyntygrafia) w zależności od sytuacji 2) witamina B12: konieczności ich stosowania; klinicznej. a) w tygodniu poprzedzającym pierwszą dawkę 8) nieobecność chorób współistniejących o istotnym klinicznie pemetreksedu mikrogramów domięśniowo, znaczeniu (niekontrolowane nadciśnienie tętnicze, niestabilna 1.2 Gefitynib w pierwszej i drugiej linii leczenia: b) co 3 cykle leczenia, tj. co 9 tygodni choroba wieńcowa, zawał mięśnia sercowego w ciągu 1) histologiczne lub cytologiczne potwierdzenie określonego mikrogramów domięśniowo w dniu zastosowania ostatniego roku, komorowe zaburzenia rytmu wymagające typu niedrobnokomórkowego raka płuca zgodnie z kryteriami pemetreksedu. leczenia); włączenia;
2 9) prawidłowa czynność układu krwiotwórczego: a) liczba granulocytów większa lub równa 1500/mm3, b) liczba trombocytów większa lub równa /mm3; 10) prawidłowa czynność nerek: a) stężenie kreatyniny nieprzekraczające 1,5-krotnie górnej b) klirens kreatyniny większy lub równy 45 ml/min; 11) prawidłowa czynność wątroby: a) stężenie bilirubiny nieprzekraczające 1,5-krotnie górnej b) aktywność transaminaz i zasadowej fosfatazy nieprzekraczająca 3-krotnie górnej granicy normy lub nieprzekraczająca 5-krotnie górnej granicy normy w przypadku wzrostu związanego z przerzutami w wątrobie; 12) brak przeciwwskazań do stosowania leku (nadwrażliwość na lek, ciąża, karmienie piersią, inne określone w Charakterystyce Produktu Leczniczego); 13) brak przeciwwskazań do stosowania cisplatyny (lek stosowany w skojarzeniu z pemetreksedem); 14) brak przeciwwskazań do stosowania deksametazonu, kwasu foliowego i witaminy B12. Kryteria kwalifikacji muszą być spełnione łącznie Leczenie przy wykorzystaniu substancji czynnej gefitynib: 1) rozpoznanie histologiczne lub cytologiczne raka gruczołowego (wraz z podtypami) lub raka niedrobnokomórkowego z przewagą raka gruczołowego lub raka wielkokomórkowego lub raka niedrobnokomórkowego bez ustalonego podtypu (ang. not otherwise specified, NOS); 2) potwierdzenie obecności mutacji aktywującej w genie EGFR kodującym receptor naskórkowego czynnika wzrostu (a.g. epidermal growth factor receptor, EGFR); 3) zaawansowanie miejscowe (stopień III z wyjątkiem przypadków, w których możliwe jest zastosowanie 1.5 Stosowanie pemetreksedu w ramach pierwszej linii leczenia obejmuje wyłącznie schemat z cisplatyną podawaną w dawce 75 mg/m2, w 2-godzinnym wlewie, 30 minut po zakończeniu podawania pemetreksedu, w pierwszym dniu każdego cyklu co 21 dni. 2. Docetaksel 2.1 Zalecana dawka docetakselu wynosi 75 mg/m2 powierzchni ciała. 2.2 Podanie leku obejmuje 60-minutowy wlew dożylny w pierwszym dniu 21-dniowego cyklu leczenia. 2.3 Premedykacja składa się z zastosowania doustnie deksametazonu w dobowej dawce 16 mg przez 3 dni, począwszy od dnia poprzedzającego rozpoczęcie stosowania docetakselu. 3. Gefitynib 3.1 Zalecana dawka dobowa gefitynibu wynosi 250 mg (1 tabletka) i powinna być przyjmowana z posiłkiem lub bez posiłku, codziennie o tej samej porze dnia. 3.2 Każdy cykl leczenia obejmuje 30 dni - 30 tabletek. 4. Erlotynib 4.1 Zalecana dawka dobowa erlotynibu wynosi 150 mg (1 tabletka) i powinna być przyjmowana przynajmniej 60 minut przed posiłkiem lub przynajmniej 120 minut po posiłku. 4.2 Każdy cykl leczenia obejmuje 30 dni 30 tabletek Jeżeli konieczna jest modyfikacja dawki, należy ją zmniejszać stopniowo po 50 mg. W przypadku jednoczesnego stosowania substratów i leków wpływających na CYP3A4 lub w przypadkach wystąpienia działań niepożądanych może być konieczna modyfikacja dawki (zgodnie z zapisami Charakterystyki Produktu Leczniczego). 2) potwierdzenie obecności aktywującej mutacji genu EGFR; 3) morfologia krwi z rozmazem; 4) oznaczenia stężenia kreatyniny; 5) oznaczenie stężenia bilirubiny; 6) oznaczenie aktywności aminotransferazy alaninowej; 7) oznaczenie aktywności aminotransferazy asparaginianowej; 8) oznaczenie aktywności fosfatazy zasadowej; 9) test ciążowy u kobiet w wieku rozrodczym; 10) badanie tomografii komputerowej klatki piersiowej z objęciem nadbrzusza lub klasyczne badanie RTG klatki piersiowej w przypadku zmiany dobrze mierzalnej, otoczonej przez prawidłowo upowietrzniony miąższ płucny; 11) badanie tomografii komputerowej innej lokalizacji lub inne badania obrazowe (ultrasonografia - USG, rezonans magnetyczny - MR, scyntygrafia) w zależności od sytuacji klinicznej. 1.3 Erlotynib w pierwszej i drugiej linii leczenia: 1) histologiczne lub cytologiczne potwierdzenie określonego typu niedrobnokomórkowego raka płuca zgodnie z kryteriami włączenia; 2) ocena obecności aktywującej mutacji genu EGFR; 3) morfologia krwi z rozmazem; 4) oznaczenia stężenia kreatyniny; 5) oznaczenie stężenia bilirubiny; 6) oznaczenie aktywności aminotransferazy alaninowej; 7) oznaczenie aktywności aminotransferazy asparaginianowej; 8) oznaczenie aktywności fosfatazy zasadowej; 9) test ciążowy u kobiet w wieku rozrodczym; 10) badanie tomografii komputerowej klatki piersiowej z objęciem nadbrzusza lub klasyczne badanie RTG klatki piersiowej w przypadku zmiany dobrze mierzalnej, otoczonej przez prawidłowo upowietrzniony miąższ płucny;
3 radiochemioterapii, radioterapii lub chirurgicznego leczenia) lub uogólnienie (stopień IV); 4) istnienie możliwości przeprowadzenia obiektywnej oceny odpowiedzi w badaniach obrazowych z zastosowaniem kryteriów oceny systemu RECIST 1.1 (ang. Response Evaluation Criteria In Solid Tumours, RECIST); 5) brak przerzutów w ośrodkowym układzie nerwowym lub cech progresji przerzutów w ośrodkowym układzie nerwowym u chorych po wcześniejszym leczeniu miejscowym (leczenie chirurgiczne lub radioterapia) oraz objawów neurologicznych i konieczności zwiększania dawki glikokortykosteroidów w ciągu ostatniego miesiąca przed włączeniem do programu; 6) wiek powyżej 18 roku życia; 7) sprawność w stopniu 0-1 według kryteriów WHO lub ECOG; 8) wykluczenie obecności istotnych klinicznie chorób współwystępujących (szczególnie niekontrolowane nadciśnienie tętnicze, niestabilna choroba wieńcowa, zawał mięśnia sercowego w ciągu ostatniego roku, komorowe zaburzenia rytmu wymagające leczenia); 9) potwierdzenie prawidłowej czynności układu krwiotwórczego umożliwiającej leczenie zgodnie z aktualną Charakterystyką Produktu Leczniczego; 10) potwierdzenie prawidłowej czynności nerek (stężenie kreatyniny nieprzekraczające 1,5-krotnie górnej granicy normy); 11) potwierdzenie prawidłowej czynności wątroby: a) stężenie bilirubiny nieprzekraczające 1,5-krotnie górnej b) aktywność transaminaz i zasadowej fosfatazy nieprzekraczająca 3-krotnie górnej granicy normy lub nieprzekraczająca 5-krotnie górnej granicy normy w przypadku wzrostu związanego z przerzutami w wątrobie; 12) wykluczenie przeciwwskazań do stosowania gefitynibu określonych w Charakterystyce Produktu Leczniczego; 13) wykluczenie stosowania jednoczesnej chemioterapii oraz 11) badanie tomografii komputerowej innej lokalizacji lub inne badania obrazowe (ultrasonografia - USG, rezonans magnetyczny - MR, scyntygrafia) w zależności od sytuacji klinicznej. 2. Monitorowanie bezpieczeństwa leczenia Pemetreksed w pierwszej albo drugiej linii leczenia oraz docetaksel w drugiej linii leczenia: 1) morfologia krwi z rozmazem; 2) oznaczenie stężenia kreatyniny - jedynie w przypadku leczenia pemetreksedem. Badania wykonywane są przed każdym podaniem leku. 3. Monitorowanie skuteczności leczenia: 3.1 Pemetreksed w pierwszej albo drugiej linii leczenia oraz docetaksel w drugiej linii leczenia: 1) badanie tomografii komputerowej klatki piersiowej z objęciem nadbrzusza lub klasyczne badanie RTG klatki piersiowej w przypadku zmiany dobrze mierzalnej, otoczonej przez prawidłowo upowietrzniony miąższ płucny; 2) badanie tomografii komputerowej innej lokalizacji lub inne badania obrazowe (ultrasonografia - USG, rezonans magnetyczny - MR, scyntygrafia) w zależności od sytuacji klinicznej. Badania wykonywane są po 2, 4 i 6 cyklu leczenia (w przypadku kontynuacji do 6 cykli). 3.2 Gefitynib w pierwszej i drugiej linii leczenia: 1) badanie tomografii komputerowej klatki piersiowej z objęciem nadbrzusza lub klasyczne badanie RTG klatki piersiowej w przypadku zmiany dobrze mierzalnej, otoczonej przez prawidłowo upowietrzniony miąższ płucny; 2) badanie tomografii komputerowej innej lokalizacji lub inne badania obrazowe (ultrasonografia - USG, rezonans magnetyczny - MR, scyntygrafia), konieczne do oceny zmian
4 innych leków ukierunkowanych molekularnie; 14) wykluczenie stosowania wcześniejszego leczenia farmakologicznego niedrobnokomórkowego raka płuca w stadium uogólnienia (obecność przerzutów) lub miejscowego zaawansowania; 15) wykluczenie współwystępowania innych nowotworów złośliwych leczonych z założeniem paliatywnym (niezależnie od uzyskanej odpowiedzi) oraz nieuzyskanie całkowitej odpowiedzi w przypadku nowotworów leczonych z założeniem radykalnym; 16) zmiany nowotworowe możliwe do zmierzenia według kryteriów RECIST 1.1 lub obecność policzalnych zmian niemierzalnych. Kryteria kwalifikacji muszą być spełnione łącznie Leczenie przy wykorzystaniu substancji czynnej erlotynib: 1) rozpoznanie gruczolakoraka lub nowotworu z przewagą wymienionego typu histologicznego; 2) zaawansowanie miejscowe (stopień III z wyjątkiem przypadków, w których możliwe jest zastosowanie radiochemioterapii, radioterapii lub chirurgicznego leczenia) lub uogólnienie (stopień IV); 3) brak wcześniejszego leczenia farmakologicznego niedrobnokomórkowego raka płuca w stadium uogólnienia (obecność przerzutów) lub miejscowego zaawansowania; 4) zmiany nowotworowe możliwe do zmierzenia; 5) w przypadku pojedynczej zmiany umiejscowienie poza obszarem wcześniejszego napromieniania; 6) potwierdzona mutacja aktywująca genu EGFR w komórkach raka; 7) zmiany nowotworowe umożliwiające ocenę odpowiedzi na leczenie według kryteriów RECIST 1.1; 8) wiek powyżej 18 roku życia; 9) sprawność w stopniu 0-1 wg klasyfikacji Zubroda-WHO lub ECOG; wg. kryteriów RECIST 1.1., w zależności od sytuacji klinicznej; 3) badanie czynności wątroby (aminotransferazy i bilirubina) Określenie odpowiedzi na leczenie powinno być wykonywane tą samą metodą co w momencie kwalifikacji do leczenia. Badania wykonywane są co 2 cykle leczenia. 3.3 Erlotynib w pierwszej i drugiej linii leczenia: 1) badanie tomografii komputerowej klatki piersiowej z objęciem nadbrzusza lub klasyczne badanie RTG klatki piersiowej w przypadku zmiany dobrze mierzalnej, otoczonej przez prawidłowo upowietrzniony miąższ płucny; 2) badanie tomografii komputerowej innej lokalizacji lub inne badania obrazowe (ultrasonografia USG, rezonans magnetyczny MR, scyntygrafia) w zależności od sytuacji klinicznej. 3) badanie czynności wątroby (aminotransferazy i bilirubina). Badania wykonywane są co 2 cykle leczenia.
5 10) nieobecność istotnych klinicznie chorób współwystępujących, w szczególności niekontrolowane nadciśnienie tętnicze, niestabilna choroba wieńcowa, zawał mięśnia sercowego w ciągu ostatniego roku, komorowe zaburzenia rytmu wymagające leczenia; 11) brak przerzutów w ośrodkowym układzie nerwowym lub cech progresji przerzutów w ośrodkowym układzie nerwowym po wcześniejszym leczeniu miejscowym (leczenie chirurgiczne lub radioterapia) oraz bez objawów neurologicznych i bez konieczności zwiększania dawki glikokortykosteroidów w ciągu ostatniego miesiąca przed włączeniem do programu; 12) prawidłowa czynność układu krwiotwórczego umożliwiająca leczenie zgodnie z aktualną Charakterystyką Produktu Leczniczego 13) prawidłowa czynność nerek: a) stężenie kreatyniny nieprzekraczające 1,5-krotnie górnej b) klirens kreatyniny większy lub równy 45ml/min; 14) prawidłowa czynność wątroby: a) stężenie bilirubiny nieprzekraczające 1,5-krotnie górnej b) aktywność transaminaz i zasadowej fosfatazy nieprzekraczająca 3-krotnie górnej granicy normy lub nieprzekraczająca 5-krotnie górnej granicy normy w przypadku wzrostu związanego z przerzutami w wątrobie; 15) brak przeciwwskazań do stosowania leku określonych w Charakterystyce Produktu Leczniczego; 16) wykluczone stosowanie jednoczesnej chemioterapii oraz innych leków ukierunkowanych molekularnie. Kryteria kwalifikacji muszą być spełnione łącznie. 1.2 Druga linia leczenia Leczenie przy wykorzystaniu substancji czynnej pemetreksed albo substancji czynnej docetaksel: 1) rozpoznanie gruczolakoraka, wielkokomórkowego raka płuca lub nowotworu z przewagą wymienionych typów
6 histologicznych w przypadku stosowania pemetreksedu albo rozpoznanie niedrobnokomórkowego raka płuca (każdy typ histologiczny) w przypadku stosowania docetakselu; 2) zaawansowanie kliniczne w stopniach IIIB (z wyjątkiem przypadków, w których możliwe jest zastosowanie radiochemioterapii lub radioterapii) albo IV; 3) zmiany nowotworowe możliwe do zmierzenia; 4) w przypadku pojedynczej zmiany - umiejscowienie poza obszarem wcześniejszego napromieniania; 5) brak przerzutów w ośrodkowym układzie nerwowym pierwotnie albo po zastosowaniu wcześniejszego leczenia miejscowego oraz nieobecność objawów ze strony ośrodkowego układu nerwowego, a także stała lub zmniejszana dawka kortykosteroidów przez ostatnie 4 tygodnie w przypadku konieczności ich stosowania; 6) wcześniejsze zastosowanie wielolekowej chemioterapii z udziałem pochodnych platyny (w przypadku pacjentów w wieku powyżej 70 roku życia - wcześniejsza monoterapia lekiem innym niż pochodna platyny); 7) potwierdzenie odpowiedzi na leczenie lub stabilizacji choroby po zastosowaniu wcześniejszej chemioterapii (czas trwania odpowiedzi na leczenie lub stabilizacji choroby musi wynosić co najmniej 3 miesiące); 8) progresja choroby po wcześniejszej chemioterapii obejmującej co najmniej jedną linię leczenia; 9) nieobecność działań niepożądanych po wcześniejszej chemioterapii z wyjątkiem wyłysienia; 10) wiek powyżej 18 roku życia; 11) sprawność w stopniu 0-1 wg klasyfikacji Zubroda-WHO lub ECOG; 12) nieobecność chorób współistniejących o istotnym klinicznie znaczeniu (niekontrolowane nadciśnienie tętnicze, niestabilna choroba wieńcowa, zawał mięśnia sercowego w ciągu ostatniego roku, komorowe zaburzenia rytmu wymagające leczenia);
7 13) prawidłowa czynność układu krwiotwórczego: a) liczba granulocytów większa lub równa 1500/mm3, b) liczba trombocytów większa lub równa /mm3; 14) prawidłowa czynność nerek: a) stężenie kreatyniny nieprzekraczające 1,5-krotnie górnej b) klirens kreatyniny większy lub równy 45 ml/min; 15) prawidłowa czynność wątroby: a) stężenie bilirubiny nieprzekraczające 1,5-krotnie górnej b) aktywność transaminaz i zasadowej fosfatazy nieprzekraczająca 3-krotnie górnej granicy normy lub nieprzekraczająca 5-krotnie górnej granicy normy w przypadku wzrostu związanego z przerzutami w wątrobie; 16) brak przeciwwskazań do stosowania leku (nadwrażliwość na lek, ciąża, karmienie piersią, inne określone w Charakterystyce Produktu Leczniczego); 17) brak przeciwwskazań do stosowania deksametazonu oraz - w przypadku pemetreksedu - kwasu foliowego i witaminy B12. Kryteria kwalifikacji muszą być spełnione łącznie Leczenie przy wykorzystaniu substancji czynnej erlotynib: 1) rozpoznanie gruczolakoraka lub nowotworu z przewagą wymienionego typu histologicznego; 2) zaawansowanie miejscowe (stopień III z wyjątkiem przypadków, w których możliwe jest zastosowanie radiochemioterapii, radioterapii lub chirurgicznego leczenia) lub uogólnienie (stopień IV); 3) zmiany nowotworowe możliwe do zmierzenia; 4) w przypadku pojedynczej zmiany umiejscowienie poza obszarem wcześniejszego napromieniania; 5) potwierdzona mutacja aktywująca genu EGFR w komórkach raka; 6) zmiany nowotworowe umożliwiające ocenę odpowiedzi na leczenie według RECIST 1.1;
8 4) wiek powyżej 18 roku życia; 5) nieobecność istotnych klinicznie chorób współistniejących, w szczególności niekontrolowane nadciśnienie tętnicze, niestabilna choroba wieńcowa, zawał mięśnia sercowego w ciągu ostatniego roku, komorowe zaburzenia rytmu wymagające leczenia; 6) progresja choroby po wcześniejszej chemioterapii obejmującej co najmniej jedną linię leczenia; 7) wcześniejsze zastosowanie wielolekowej chemioterapii z udziałem pochodnych platyny (w przypadku chorych powyżej 70. roku życia wcześniejsza monoterapia); 8) okres od zakończenia wcześniejszej chemioterapii co najmniej 3-4 tygodnie; 9) nieobecność działań niepożądanych po wcześniejszej chemioterapii z wyjątkiem wyłysienia; 10) brak przerzutów w ośrodkowym układzie nerwowym lub cech progresji przerzutów w ośrodkowym układzie nerwowym po wcześniejszym leczeniu miejscowym (leczenie chirurgiczne lub radioterapia) oraz bez objawów neurologicznych i bez konieczności zwiększania dawki glikokortykosteroidów w ciągu ostatniego miesiąca przed włączeniem do programu; 11) sprawność w stopniu 0-1 wg klasyfikacji Zubroda-WHO lub ECOG; 12) prawidłowa czynność układu krwiotwórczego umożliwiająca leczenie zgodnie z aktualną Charakterystyką Produktu Leczniczego 13) prawidłowa czynność nerek: a) stężenie kreatyniny nieprzekraczające 1,5-krotnie górnej b) klirens kreatyniny większy lub równy 45ml/min; 14) prawidłowa czynność wątroby: a) stężenie bilirubiny nieprzekraczające 1,5-krotnie górnej b) aktywność transaminaz i zasadowej fosfatazy nieprzekraczająca 3-krotnie górnej granicy normy lub
9 nieprzekraczająca 5-krotnie górnej granicy normy w przypadku wzrostu związanego z przerzutami w wątrobie; 15) brak przeciwwskazań do stosowania leku określonych w Charakterystyce Produktu Leczniczego; 16) wykluczone stosowanie jednoczesnej chemioterapii oraz innych leków ukierunkowanych molekularnie. Kryteria kwalifikacji muszą być spełnione łącznie Leczenie przy wykorzystaniu substancji czynnej gefitynib: 1) rozpoznanie histologiczne lub cytologiczne raka gruczołowego (wraz z podtypami) lub raka niedrobnokomórkowego z przewagą raka gruczołowego lub raka wielkokomórkowego lub raka niedrobnokomórkowego bez ustalonego podtypu (ang. not otherwise specified, NOS); 2) potwierdzenie obecności mutacji aktywującej w genie EGFR kodującym receptor naskórkowego czynnika wzrostu (a.g. epidermal growth factor receptor, EGFR); 3) zaawansowanie miejscowe (stopień III z wyjątkiem przypadków, w których możliwe jest zastosowanie radiochemioterapii, radioterapii lub chirurgicznego leczenia) lub uogólnienie (stopień IV); 4) istnienie możliwości przeprowadzenia obiektywnej oceny odpowiedzi w badaniach obrazowych z zastosowaniem kryteriów oceny systemu RECIST 1.1 (ang. Response Evaluation Criteria In Solid Tumours, RECIST); 5) brak przerzutów w ośrodkowym układzie nerwowym lub cech progresji przerzutów w ośrodkowym układzie nerwowym u chorych po wcześniejszym leczeniu miejscowym (leczenie chirurgiczne lub radioterapia) oraz objawów neurologicznych i konieczności zwiększania dawki glikokortykosteroidów w ciągu ostatniego miesiąca przed włączeniem do programu; 6) wiek powyżej 18 roku życia; 7) sprawność w stopniu 0-1 według kryteriów WHO lub ECOG; 8) wykluczenie obecności istotnych klinicznie chorób
10 współwystępujących (szczególnie niekontrolowane nadciśnienie tętnicze, niestabilna choroba wieńcowa, zawał mięśnia sercowego w ciągu ostatniego roku, komorowe zaburzenia rytmu wymagające leczenia); 9) potwierdzenie prawidłowej czynności układu krwiotwórczego umożliwiającej leczenie zgodnie z aktualną Charakterystyką Produktu Leczniczego; 10) potwierdzenie prawidłowej czynności nerek (stężenie kreatyniny nieprzekraczające 1,5-krotnie górnej granicy normy); 11) potwierdzenie prawidłowej czynności wątroby: a) stężenie bilirubiny nieprzekraczające 1,5-krotnie górnej b) aktywność transaminaz i zasadowej fosfatazy nieprzekraczająca 3-krotnie górnej granicy normy lub nieprzekraczająca 5-krotnie górnej granicy normy w przypadku wzrostu związanego z przerzutami w wątrobie; 12) wykluczenie przeciwwskazań do stosowania gefitynibu określonych w Charakterystyce Produktu Leczniczego; 13) wykluczenie uprzedniego stosowania inhibitorów kinazy tyrozynowej EGFR; 14) wykluczenie stosowania jednoczesnej chemioterapii oraz innych leków ukierunkowanych molekularnie; 15) potwierdzenie progresji choroby po wcześniejszej chemioterapii (przynajmniej jedna linia leczenia); 16) stosowanie wcześniej wielolekowej chemioterapii z udziałem pochodnych platyny (w przypadku chorych powyżej 70. roku życia wcześniejsza monoterapia) wymagany okres od zakończenia chemioterapii przynajmniej 4 tygodnie; 17) zmiany nowotworowe możliwe do zmierzenia według kryteriów RECIST 1.1 lub obecność policzalnych zmian niemierzalnych; 18) wykluczenie obecności istotnych klinicznie niepożądanych działań wcześniejszej chemioterapii z wyjątkiem wyłysienia; 19) wykluczenie współwystępowania innych nowotworów
11 złośliwych leczonych z założeniem paliatywnym (niezależnie od uzyskanej odpowiedzi) oraz nieuzyskanie całkowitej odpowiedzi w przypadku nowotworów leczonych z założeniem radykalnym. Kryteria kwalifikacji muszą być spełnione łącznie. 2. Określenie czasu leczenia w programie Leczenie trwa do czasu podjęcia przez lekarza prowadzącego decyzji o wyłączeniu świadczeniobiorcy z programu, zgodnie: 1) z zasadami terapii określonymi w ust. 2.1 i 2.2 oraz 2) z kryteriami wyłączenia z programu, o których mowa w ust Pemetreksed, docetaksel Stosowanie pemetreksedu w ramach pierwszej albo drugiej linii leczenia oraz docetakselu w ramach drugiej linii leczenia obejmuje: 1) 4 cykle - w sytuacjach innych niż opisane w pkt 2; 2) 6 cykli - w przypadku stwierdzenia: a) odpowiedzi całkowitej lub b) odpowiedzi częściowej, lub c) odpowiedzi większego stopnia, tj. odpowiedzi całkowitej po wcześniejszej odpowiedzi częściowej lub odpowiedzi częściowej po wcześniejszej stabilizacji choroby w kolejnych badaniach po drugim oraz czwartym cyklu leczenia Stosowanie pemetreksedu lub docetakselu może być krótsze w przypadku wystąpienia poważnych działań niepożądanych W czasie leczenia konieczne jest trzykrotne wykonanie badań obrazowych (dodatkowe badania obrazowe wykonuje się w zależności od sytuacji klinicznej): 1) przed leczeniem - nie wcześniej niż 28 dni przed zastosowaniem pierwszej dawki leku; 2) w połowie leczenia - po drugim cyklu; 3) po zakończeniu leczenia - po czwartym cyklu oraz nie
12 później niż 28 dni po podaniu ostatniej dawki leku W przypadku uzyskania odpowiedzi na leczenie i kontynuacji chemioterapii do 6 cykli należy wykonać dodatkowe badania obrazowe po szóstym cyklu oraz nie później niż 28 dni po podaniu ostatniej dawki leku Badania obrazowe obejmują ocenę: 1) zmiany pierwotnej: a) badanie tomografii komputerowej klatki piersiowej z objęciem nadbrzusza lub b) badanie RTG klatki piersiowej w przypadku zmiany dobrze mierzalnej, otoczonej przez prawidłowo upowietrzniony miąższ płucny; 2) zmian przerzutowych - w zależności od sytuacji klinicznej i lokalizacji badanie tomografii komputerowej lub inne badania obrazowe (USG, rezonans magnetyczny, scyntygrafia i inne) pozwalające na pomiar zmian mierzalnych Jeżeli pierwotny guz płuca nie istnieje (stan po resekcji płuca, nowotwór płuca bez ogniska pierwotnego), konieczne jest wykazanie w badaniach obrazowych przerzutowych zmian mierzalnych lub policzalnych zmian niemierzalnych Ocenę wyniku leczenia (odpowiedź) należy wykonywać według kryteriów skali RECIST (Response Evaluation Criteria in Solid Tumors) Przed rozpoczęciem leczenia konieczne jest wykonanie badania morfologii krwi i badań biochemicznych, a przed kolejnymi cyklami leczenia należy powtarzać badanie morfologii krwi. 2.2 Gefitynib, erlotynib Stosowanie gefitynibu i erlotynibu w ramach pierwszej i drugiej linii leczenia jest prowadzone do stwierdzenia progresji choroby lub wystąpienia poważnych działań niepożądanych W czasie leczenia konieczne jest wykonywanie badań obrazowych (dodatkowe badania obrazowe wykonuje się w zależności od sytuacji klinicznej): 1) przed leczeniem - nie wcześniej niż 28 dni przed
13 zastosowaniem pierwszej dawki leku; 2) w czasie leczenia - co 2 cykle leczenia - ważność badania - 14 dni; Badania obrazowe obejmują ocenę: 1) zmiany pierwotnej: a) badanie tomografii komputerowej klatki piersiowej z objęciem nadbrzusza lub b) badanie RTG klatki piersiowej w przypadku zmiany dobrze mierzalnej, otoczonej przez prawidłowo upowietrzniony miąższ płucny; 2) obecnych zmian przerzutowych - w zależności od sytuacji klinicznej i lokalizacji badanie tomografii komputerowej lub inne badania obrazowe (USG, rezonans magnetyczny, scyntygrafia i inne) pozwalające na pomiar zmian mierzalnych. Badania obrazowe w trakcie leczenia powinny obejmować ocenę zmian mierzalnych, które zostały opisane przed rozpoczęciem leczenia Jeżeli pierwotny guz płuca nie istnieje (stan po resekcji płuca, nowotwór płuca bez ogniska pierwotnego), konieczne jest wykazanie w badaniach obrazowych przerzutowych zmian mierzalnych lub policzalnych zmian niemierzalnych Ocenę wyniku leczenia (odpowiedź) należy wykonywać według kryteriów skali RECIST 1.1 (Response.Evaluation Criteria in Solid Tumors). 3. Kryteria wyłączenia z programu: 1) progresja choroby oceniona według kryteriów skali RECIST 1.1: a) powiększenie się istniejących zmian o przynajmniej 20% lub b) pojawienie się przynajmniej jednej nowej zmiany - potwierdzona w badaniu przedmiotowym lub obrazowym; 2) pogorszenie stanu pacjenta w związku z nowotworem bez progresji potwierdzonej w badaniu przedmiotowym lub obrazowym; 3) wystąpienie klinicznie istotnej toksyczności leczenia lub
14 wystąpienie przynajmniej jednego niepożądanego działania będącego zagrożeniem życia według kryteriów CTC (Common Toxity Criteria); 4) nawracająca lub nieakceptowalna toksyczność związana z leczeniem 3 lub 4 stopnia według kryteriów CTC (Common Toxicity Criteria Wznowienie leczenia jest uwarunkowane ustąpieniem objawów toksyczności lub zmniejszeniem stopnia nasilenia do CTC stopień I lub II); 5) nadwrażliwość na lek lub na substancję pomocniczą; 6) obniżenie sprawności do stopnia 3-4 (2, 3, 4 w przypadku stosowania erlotynibu i gefitynibu) według kryteriów WHO lub ECOG; 7) przerwa w przyjmowaniu erlotynibu lub gefitynibu dłuższa niż trzy tygodnie, która została spowodowana niepożądanym działaniem leczenia. 8) pogorszenie jakości życia o istotnym znaczeniu według oceny lekarza; 9) rezygnacja pacjenta - wycofanie zgody na udział w programie.
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C-34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C-34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C-34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 610 Poz. 79 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza
Dziennik Urzędowy Ministra Zdrowia 610 Poz. 79 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 519 Poz. 42 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza
Dziennik Urzędowy Ministra Zdrowia 519 Poz. 42 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 566 Poz. 71 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza
Dziennik Urzędowy Ministra Zdrowia 566 Poz. 71 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU I NINTEDANIBU (ICD- 10 C 34)
 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU I NINTEDANIBU (ICD- 10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne
Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU I NINTEDANIBU (ICD- 10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne
Załącznik do rozporządzenia Ministra Zdrowia z dnia 28 października 2011 r.
 Załącznik do rozporządzenia Ministra Zdrowia z dnia 28 października 2011 r. ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu substancji czynnej pemetreksed:
Załącznik do rozporządzenia Ministra Zdrowia z dnia 28 października 2011 r. ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu substancji czynnej pemetreksed:
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 825 Poz. 71 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 825 Poz. 71 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Dziennik Urzędowy Ministra Zdrowia 731 Poz. 48 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 731 Poz. 48 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34)
 Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne raka gruczołowego
Załącznik B.63. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA Z ZASTOSOWANIEM AFATYNIBU (ICD-10 C 34) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1) rozpoznanie histologiczne lub cytologiczne raka gruczołowego
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji 1.1 Pierwsza linia leczenia 1.1.1 Leczenie przy wykorzystaniu
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikowania chorych na niedrobnokomórkowego raka płuca do leczenia
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikowania chorych na niedrobnokomórkowego raka płuca do leczenia
ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 28 października 2011 r.
 Dziennik Ustaw Nr 244 14461 Poz. 1456 1456 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 28 października 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych
Dziennik Ustaw Nr 244 14461 Poz. 1456 1456 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 28 października 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych
LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34)
 Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikowania chorych na niedrobnokomórkowego raka płuca do leczenia
Załącznik B.6. LECZENIE NIEDROBNOKOMÓRKOWEGO RAKA PŁUCA (ICD-10 C 34) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Kryteria kwalifikowania chorych na niedrobnokomórkowego raka płuca do leczenia
LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20)
 Dziennik Urzędowy Ministra Zdrowia 511 Poz. 42 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie zaawansowanego
Dziennik Urzędowy Ministra Zdrowia 511 Poz. 42 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie zaawansowanego
LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4)
 Załącznik B.53..docx LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie wysoko zróżnicowanego nowotworu neuroendokrynnego
Załącznik B.53..docx LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie wysoko zróżnicowanego nowotworu neuroendokrynnego
LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4)
 Załącznik B.53. LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie wysoko zróżnicowanego nowotworu neuroendokrynnego
Załącznik B.53. LECZENIE WYSOKO ZRÓŻNICOWANEGO NOWOTWORU NEUROENDOKRYNNEGO TRZUSTKI (ICD-10 C25.4) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie wysoko zróżnicowanego nowotworu neuroendokrynnego
ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 8 grudnia 2011 r.
 Dziennik Ustaw Nr 269 15678 Poz. 1593 1593 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 8 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na podstawie
Dziennik Ustaw Nr 269 15678 Poz. 1593 1593 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 8 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na podstawie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Agencja Oceny Technologii Medycznych. Wydział Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Wydział Oceny Technologii Medycznych Wniosek o objęcie refundacją i ustalenie urzędowej ceny zbytu produktu leczniczego Alimta (pemetreksed) w ramach programu lekowego:
Agencja Oceny Technologii Medycznych Wydział Oceny Technologii Medycznych Wniosek o objęcie refundacją i ustalenie urzędowej ceny zbytu produktu leczniczego Alimta (pemetreksed) w ramach programu lekowego:
LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48)
 Dziennik Urzędowy Ministra Zdrowia 546 Poz. 71 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Dziennik Urzędowy Ministra Zdrowia 546 Poz. 71 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48)
 Dziennik Urzędowy Ministra Zdrowia 492 Poz. 66 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
Dziennik Urzędowy Ministra Zdrowia 492 Poz. 66 Załącznik B.3. LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) (ICD-10 C 15, C 16, C 17, C 18, C 20, C 48) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe
LECZENIE RAKA NERKI (ICD-10 C 64)
 Dziennik Urzędowy Ministra Zdrowia 538 Poz. 86 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
Dziennik Urzędowy Ministra Zdrowia 538 Poz. 86 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20)
 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY 1. Leczenie zaawansowanego raka jelita grubego przy wykorzystaniu substancji
Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES WIADCZENIA GWARANTOWANEGO WIADCZENIOBIORCY 1. Leczenie zaawansowanego raka jelita grubego przy wykorzystaniu substancji
LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20)
 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY I. Leczenie pierwszej linii chorych na zaawansowanego raka jelita grubego
Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY I. Leczenie pierwszej linii chorych na zaawansowanego raka jelita grubego
LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20)
 Dziennik Urzędowy Ministra Zdrowia 552 Poz. 71 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY I. Leczenie pierwszej linii
Dziennik Urzędowy Ministra Zdrowia 552 Poz. 71 Załącznik B.4. LECZENIE ZAAWANSOWANEGO RAKA JELITA GRUBEGO (ICD-10 C 18 C 20) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY I. Leczenie pierwszej linii
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Dziennik Urzędowy Ministra Zdrowia 671 Poz. 17 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
Dziennik Urzędowy Ministra Zdrowia 671 Poz. 17 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
LECZENIE RAKA NERKI (ICD-10 C 64)
 Dziennik Urzędowy Ministra Zdrowia 607 Poz. 71 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
Dziennik Urzędowy Ministra Zdrowia 607 Poz. 71 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE
Nazwa programu: LECZENIE RAKA WĄTROBOKOMÓRKOWEGO
 Załącznik nr 48 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE RAKA WĄTROBOKOMÓRKOWEGO ICD-10 C 22.0 Rak komórek wątroby Dziedzina medycyny: Onkologia
Załącznik nr 48 do zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE RAKA WĄTROBOKOMÓRKOWEGO ICD-10 C 22.0 Rak komórek wątroby Dziedzina medycyny: Onkologia
Terapeutyczne Programy Zdrowotne 2010 Leczenie raka nerki Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku
 Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny: Nowotwór złośliwy nerki za wyjątkiem miedniczki
Załącznik nr 42 do zarządzenia Nr 8/2010/DGL Prezesa NFZ z dnia 20 stycznia 2010 roku Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny: Nowotwór złośliwy nerki za wyjątkiem miedniczki
Terapeutyczne Programy Zdrowotne 2009 Leczenie nowotworów podścieliska przewodu pokarmowego (GIST) Załącznik nr 9
 Załącznik nr 9 Nazwa programu: do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Załącznik nr 9 Nazwa programu: do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
LECZENIE RAKA PIERSI (ICD-10 C 50)
 Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1. Leczenie
Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1. Leczenie
Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008.
 załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
załącznik nr 7 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Program dotyczy wyłącznie kontynuacji leczenia pacjentów włączonych do programu do dnia 30.03.2008. 1. Nazwa programu:
LECZENIE RAKA PIERSI (ICD-10 C 50)
 Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe raka piersi trastuzumabem 1.1 Kryteria kwalifikacji 1) histologiczne rozpoznanie raka piersi; 2) nadekspresja
Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ŚWIADCZENIOBIORCY 1. Leczenie adjuwantowe raka piersi trastuzumabem 1.1 Kryteria kwalifikacji 1) histologiczne rozpoznanie raka piersi; 2) nadekspresja
Terapeutyczne Programy Zdrowotne 2012 Leczenie nowotworów podścieliska przewodu pokarmowego (GIST) Załącznik nr 8
 Załącznik nr 8 Nazwa programu: do Zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
Załącznik nr 8 Nazwa programu: do Zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku LECZENIE NOWOTWORÓW PODŚCIELISKA PRZEWODU POKARMOWEGO (GIST) ICD 10 grupa rozpoznań obejmująca nowotwory
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY A. Leczenie infliksymabem 1. Leczenie choroby Leśniowskiego-Crohna (chlc)
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY A. Leczenie infliksymabem 1. Leczenie choroby Leśniowskiego-Crohna (chlc)
Terapeutyczne Programy Zdrowotne 2012 Leczenie raka nerki
 Załącznik nr 39 do zarządzenia nr 59/2011/DGL Prezesa NFZ Załącznik nr 8 do zarządzenia nr 10/2012/DGL Prezesa NFZ z dnia 15 lutego 2012 r. Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny:
Załącznik nr 39 do zarządzenia nr 59/2011/DGL Prezesa NFZ Załącznik nr 8 do zarządzenia nr 10/2012/DGL Prezesa NFZ z dnia 15 lutego 2012 r. Nazwa programu: LECZENIE RAKA NERKI ICD-10 C 64 Dziedzina medycyny:
Terapeutyczne Programy Zdrowotne 2012 Leczenie glejaków mózgu Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r.
 Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE GLEJAKÓW MÓZGU ICD-10 C71 nowotwór złośliwy mózgu Dziedzina medycyny: Onkologia kliniczna,
Załącznik nr 6 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE GLEJAKÓW MÓZGU ICD-10 C71 nowotwór złośliwy mózgu Dziedzina medycyny: Onkologia kliniczna,
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA NERKI (ICD-10 C 64)
 Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
Załącznik B.10. LECZENIE RAKA NERKI (ICD-10 C 64) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1 2 3 1. Leczenie
LECZENIE RAKA PIERSI ICD-10 C
 załącznik nr 5 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE RAKA PIERSI ICD-10 C 50 nowotwór złośliwy sutka Dziedzina medycyny: onkologia kliniczna I. Cel
załącznik nr 5 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE RAKA PIERSI ICD-10 C 50 nowotwór złośliwy sutka Dziedzina medycyny: onkologia kliniczna I. Cel
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0)
 Załącznik B.54. LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0) ŚWIADCZENIOBIORCY 1. Leczenie lenalidomidem chorych na opornego lub nawrotowego szpiczaka plazmocytowego.
Załącznik B.54. LECZENIE CHORYCH NA OPORNEGO LUB NAWROTOWEGO SZPICZAKA PLAZMOCYTOWEGO (ICD10 C90.0) ŚWIADCZENIOBIORCY 1. Leczenie lenalidomidem chorych na opornego lub nawrotowego szpiczaka plazmocytowego.
Terapeutyczne Programy Zdrowotne 2009 Leczenie raka piersi Załącznik nr 6 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku
 Załącznik nr 6 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE RAKA PIERSI ICD-10 C 50 nowotwór złośliwy sutka Dziedzina medycyny: onkologia kliniczna I. Cel
Załącznik nr 6 do Zarządzenia Nr 41/2009 Prezesa NFZ z dnia 15 września 2009 roku Nazwa programu: LECZENIE RAKA PIERSI ICD-10 C 50 nowotwór złośliwy sutka Dziedzina medycyny: onkologia kliniczna I. Cel
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte na kryteriach
LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.
 Dziennik Urzędowy Ministra Zdrowia 765 Poz. 42 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Dziennik Urzędowy Ministra Zdrowia 765 Poz. 42 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
LECZENIE RAKA PIERSI (ICD-10 C 50)
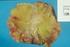 Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1. Leczenie
Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU 1. Leczenie
LECZENIE RAKA PIERSI (ICD-10 C 50)
 Dziennik Urzędowy Ministra Zdrowia 652 Poz. 133 Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie pooperacyjne (adjuwantowe) raka piersi
Dziennik Urzędowy Ministra Zdrowia 652 Poz. 133 Załącznik B.9. LECZENIE RAKA PIERSI (ICD-10 C 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie pooperacyjne (adjuwantowe) raka piersi
Nowotwór złośliwy oskrzela i płuca
 www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy oskrzela i płuca Bevacizumab Bewacyzumab w skojarzeniu z chemioterapią opartą na pochodnych platyny jest wskazany w leczeniu pierwszego
www.oncoindex.org SUBSTANCJE CZYNNE W LECZENIU: Nowotwór złośliwy oskrzela i płuca Bevacizumab Bewacyzumab w skojarzeniu z chemioterapią opartą na pochodnych platyny jest wskazany w leczeniu pierwszego
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Dziennik Urzędowy Ministra Zdrowia 589 Poz. 86 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie
Dziennik Urzędowy Ministra Zdrowia 589 Poz. 86 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie
LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0)
 Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
Załącznik B.65. LECZENIE CHORYCH NA OSTRĄ BIAŁACZKĘ LIMFOBLASTYCZNĄ (ICD-10 C91.0) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji do leczenia dazatynibem ostrej białaczki limfoblastycznej z obecnością chromosomu
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) 1. Kryteria kwalifikacji: ŚWIADCZENIOBIORCY 1.1. Leczenie interferonem beta: 1) rozpoznanie postaci rzutowej stwardnienia rozsianego oparte
LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.
 Dziennik Urzędowy Ministra Zdrowia 764 Poz. 86 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Dziennik Urzędowy Ministra Zdrowia 764 Poz. 86 Załącznik B.75. LECZENIE AKTYWNEJ POSTACI ZIARNINIAKOWATOŚCI Z ZAPALENIEM NACZYŃ (GPA) LUB MIKROSKOPOWEGO ZAPALENIA NACZYŃ (MPA) (ICD-10 M31.3, M 31.8) ŚWIADCZENIOBIORCY
Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny: hematologia.
 Załącznik nr 10 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny:
Załącznik nr 10 do Zarządzenia Nr 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 roku Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny:
LECZENIE OPORNEGO NA KASTRACJĘ RAKA GRUCZOŁU KROKOWEGO (ICD-10 C61)
 Załącznik B.56. LECZENIE OPORNEGO NA KASTRACJĘ RAKA GRUCZOŁU KROKOWEGO (ICD-10 C61) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie opornego na kastrację raka gruczołu krokowego octanem
Załącznik B.56. LECZENIE OPORNEGO NA KASTRACJĘ RAKA GRUCZOŁU KROKOWEGO (ICD-10 C61) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie opornego na kastrację raka gruczołu krokowego octanem
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej u dorosłych imatinibem 1.1 Kryteria kwalifikacji Świadczeniobiorcy
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 182/2013 z dnia 9 września 2013 r. w sprawie oceny leku Iressa (gefitynib) we wskazaniu leczenie niedrobnokomórkowego
LECZENIE CHOROBY POMPEGO (ICD-10 E 74.0)
 Załącznik B.22. LECZENIE CHOROBY POMPEGO (ICD-10 E 74.0) WIADCZENIOBIORCY Kwalifikacji świadczeniobiorców do terapii dokonuje Zespół Koordynacyjny ds. Chorób Ultrarzadkich powoływany przez Prezesa Narodowego
Załącznik B.22. LECZENIE CHOROBY POMPEGO (ICD-10 E 74.0) WIADCZENIOBIORCY Kwalifikacji świadczeniobiorców do terapii dokonuje Zespół Koordynacyjny ds. Chorób Ultrarzadkich powoływany przez Prezesa Narodowego
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Leczenie niedrobnokomórkowego raka płuca (NDRP) w stadium zaawansowania miejscowego lub rozsiewu w kontekście
 Leczenie niedrobnokomórkowego raka płuca (NDRP) w stadium zaawansowania miejscowego lub rozsiewu w kontekście programu lekowego Advanced or metastatic non-small-cell lung cancer treatment new Polish government
Leczenie niedrobnokomórkowego raka płuca (NDRP) w stadium zaawansowania miejscowego lub rozsiewu w kontekście programu lekowego Advanced or metastatic non-small-cell lung cancer treatment new Polish government
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Dziennik Urzędowy Ministra Zdrowia 875 Poz. 129 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji:
Dziennik Urzędowy Ministra Zdrowia 875 Poz. 129 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji:
LECZENIE OPORNEGO NA KASTRACJĘ RAKA GRUCZOŁU KROKOWEGO (ICD-10 C61)
 Załącznik B.56. LECZENIE OPORNEGO NA KASTRACJĘ RAKA GRUCZOŁU KROKOWEGO (ICD-10 C61) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie opornego na kastrację raka gruczołu krokowego octanem
Załącznik B.56. LECZENIE OPORNEGO NA KASTRACJĘ RAKA GRUCZOŁU KROKOWEGO (ICD-10 C61) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie opornego na kastrację raka gruczołu krokowego octanem
LECZENIE OPORNEGO NA KASTRACJĘ RAKA GRUCZOŁU KROKOWEGO (ICD-10 C61)
 Załącznik B.56. LECZENIE OPORNEGO NA KASTRACJĘ RAKA GRUCZOŁU KROKOWEGO (ICD-10 C61) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie opornego na kastrację raka gruczołu krokowego octanem
Załącznik B.56. LECZENIE OPORNEGO NA KASTRACJĘ RAKA GRUCZOŁU KROKOWEGO (ICD-10 C61) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie opornego na kastrację raka gruczołu krokowego octanem
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Dziennik Urzędowy Ministra Zdrowia 618 Poz. 51 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Dziennik Urzędowy Ministra Zdrowia 618 Poz. 51 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
LECZENIE PACJENTÓW Z WRZODZIEJĄCYM ZAPALENIEM JELITA GRUBEGO (WZJG) (ICD-10 K51)
 Załącznik B.55. LECZENIE PACJENTÓW Z WRZODZIEJĄCYM ZAPALENIEM JELITA GRUBEGO (WZJG) (ICD-10 K51) ZAKRES ŚWIADCZENIA GWARANTOWANEGO 1. Kryteria włączenia ŚWIADCZENIOBIORCY Do leczenia infliksymabem mogą
Załącznik B.55. LECZENIE PACJENTÓW Z WRZODZIEJĄCYM ZAPALENIEM JELITA GRUBEGO (WZJG) (ICD-10 K51) ZAKRES ŚWIADCZENIA GWARANTOWANEGO 1. Kryteria włączenia ŚWIADCZENIOBIORCY Do leczenia infliksymabem mogą
Terapeutyczne Programy Zdrowotne 2012 Leczenie raka piersi Załącznik nr 5 do zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r.
 Załącznik nr 5 do zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE RAKA PIERSI ICD-10 C 50 nowotwór złośliwy sutka Dziedzina medycyny: onkologia kliniczna I.
Załącznik nr 5 do zarządzenia 59/2011/DGL Prezesa NFZ z dnia 10 października 2011 r. Nazwa programu: LECZENIE RAKA PIERSI ICD-10 C 50 nowotwór złośliwy sutka Dziedzina medycyny: onkologia kliniczna I.
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH PROGRAMU
LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35)
 Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
Załącznik B.29. LECZENIE STWARDNIENIA ROZSIANEGO (ICD-10 G 35) ŚWIADCZENIOBIORCY 1.Kryteria kwalifikacji 1.1 Leczenia interferonem beta: 1) wiek od 12 roku życia; 2) rozpoznanie postaci rzutowej stwardnienia
ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 12 grudnia 2011 r.
 Dziennik Ustaw Nr 269 15687 Poz. 1597 1597 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 12 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na
Dziennik Ustaw Nr 269 15687 Poz. 1597 1597 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 12 grudnia 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych Na
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
LECZENIE MIĘSAKÓW TKANEK MIĘKKICH (ICD-10 C48, C49)
 Dziennik Urzędowy Ministra Zdrowia 525 Poz. 86 Załącznik B.8. LECZENIE MIĘSAKÓW TKANEK MIĘKKICH (ICD-10 C48, C49) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie mięsaków tkanek miękkich
Dziennik Urzędowy Ministra Zdrowia 525 Poz. 86 Załącznik B.8. LECZENIE MIĘSAKÓW TKANEK MIĘKKICH (ICD-10 C48, C49) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY 1. Leczenie mięsaków tkanek miękkich
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32.a. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE
Załącznik B.32.a. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE
LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD -10 C43)
 Dziennik Urzędowy Ministra Zdrowia 858 Poz. 133 Załącznik B.59. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD -10 C43) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKU W PROGRAMIE
Dziennik Urzędowy Ministra Zdrowia 858 Poz. 133 Załącznik B.59. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD -10 C43) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKU W PROGRAMIE
LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD -10 C43)
 Załącznik B.59. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD -10 C43) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKU W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
Załącznik B.59. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD -10 C43) ŚWIADCZENIOBIORCY ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKU W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W RAMACH
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka szpikowa
Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka szpikowa
LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1)
 Dziennik Urzędowy Ministra Zdrowia 624 Poz. 71 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
Dziennik Urzędowy Ministra Zdrowia 624 Poz. 71 Załącznik B.14. LECZENIE PRZEWLEKŁEJ BIAŁACZKI SZPIKOWEJ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria
LECZENIE CHOROBY GAUCHERA ICD-10 E
 załącznik nr 19 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE CHOROBY GAUCHERA ICD-10 E 75 Zaburzenia przemian sfingolipidów i inne zaburzenia spichrzania
załącznik nr 19 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu: LECZENIE CHOROBY GAUCHERA ICD-10 E 75 Zaburzenia przemian sfingolipidów i inne zaburzenia spichrzania
LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50)
 Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
Załącznik B.32. LECZENIE CHOROBY LEŚNIOWSKIEGO - CROHNA (chlc) (ICD-10 K 50) ZAKRES ŚWIADCZENIA GWARANTOWANEGO ŚWIADCZENIOBIORCY SCHEMAT DAWKOWANIA LEKÓW W PROGRAMIE BADANIA DIAGNOSTYCZNE WYKONYWANE W
LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2
 załącznik nr 11 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny: hematologia.
załącznik nr 11 do zarządzenia Nr 36/2008/DGL Prezesa NFZ z dnia 19 czerwca 2008 r. Nazwa programu LECZENIE NADPŁYTKOWOŚCI SAMOISTNEJ ICD - 10 D75.2 - nadpłytkowość samoistna Dziedzina medycyny: hematologia.
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD-10 C43)
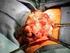 Dziennik Urzędowy Ministra Zdrowia 832 Poz. 79 Załącznik B.59. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD-10 C43) ŚWIADCZENIOBIORCY A. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH IPILIMUMABEM 1.
Dziennik Urzędowy Ministra Zdrowia 832 Poz. 79 Załącznik B.59. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH (ICD-10 C43) ŚWIADCZENIOBIORCY A. LECZENIE CZERNIAKA SKÓRY LUB BŁON ŚLUZOWYCH IPILIMUMABEM 1.
LECZENIE CHORYCH NA PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ (ICD-10 C 92.1)
 Załącznik B.14. LECZENIE CHORYCH NA PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka
Załącznik B.14. LECZENIE CHORYCH NA PRZEWLEKŁĄ BIAŁACZKĘ SZPIKOWĄ (ICD-10 C 92.1) ŚWIADCZENIOBIORCY 1. Leczenie przewlekłej białaczki szpikowej dazatynibem 1.1. Kryteria kwalifikacji 1) przewlekła białaczka
ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 28 października 2011 r.
 Dziennik Ustaw Nr 244 14447 Poz. 1455 1455 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 28 października 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych
Dziennik Ustaw Nr 244 14447 Poz. 1455 1455 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 28 października 2011 r. zmieniające rozporządzenie w sprawie świadczeń gwarantowanych z zakresu programów zdrowotnych
LECZENIE CIĘŻKIEJ, AKTYWNEJ POSTACI ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45)
 Załącznik B.36. LECZENIE CIĘŻKIEJ, AKTYWNEJ POSTACI ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45) ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW ŚWIADCZENIOBIORCY W PROGRAMIE
Załącznik B.36. LECZENIE CIĘŻKIEJ, AKTYWNEJ POSTACI ZESZTYWNIAJĄCEGO ZAPALENIA STAWÓW KRĘGOSŁUPA (ZZSK) (ICD-10 M 45) ZAKRES ŚWIADCZENIA GWARANTOWANEGO SCHEMAT DAWKOWANIA LEKÓW ŚWIADCZENIOBIORCY W PROGRAMIE
LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2)
 Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Załącznik B.71. LECZENIE PRZEWLEKŁEGO WIRUSOWEGO ZAPALENIA WĄTROBY TYPU C TERAPIĄ BEZINTERFERONOWĄ (ICD-10 B 18.2) ŚWIADCZENIOBIORCY 1. Kryteria kwalifikacji: 1) Do programu kwalifikowani są dorośli świadczeniobiorcy
Rak płuca. Magdalena Knetki-Wróblewska Klinika Nowotworów Płuca i Klatki Piersiowej Centrum Onkologii-Instytut
 Rak płuca Magdalena Knetki-Wróblewska Klinika Nowotworów Płuca i Klatki Piersiowej Centrum Onkologii-Instytut Rak płuca 22 196 tys. nowych zachorowań 23 812 tys. zgonów www.onkologia.org.pl Diagnostyka
Rak płuca Magdalena Knetki-Wróblewska Klinika Nowotworów Płuca i Klatki Piersiowej Centrum Onkologii-Instytut Rak płuca 22 196 tys. nowych zachorowań 23 812 tys. zgonów www.onkologia.org.pl Diagnostyka
LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0)
 Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacjiś WIADCZENIOBIORCY 1. Pacjent jest kwalifikowany do programu przez Zespół Koordynacyjny
Załącznik B.47. LECZENIE UMIARKOWANEJ I CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) A. Kryteria kwalifikacjiś WIADCZENIOBIORCY 1. Pacjent jest kwalifikowany do programu przez Zespół Koordynacyjny
LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM I EPOPROSTENOLEM (TNP) (ICD-10 I27, I27.0)
 Dziennik Urzędowy Ministra Zdrowia 719 Poz. 27 Załącznik B.68. LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM I EPOPROSTENOLEM (TNP) (ICD-10 I27, I27.0) ŚWIADCZENIOBIORCY I. Terapia sildenafilem
Dziennik Urzędowy Ministra Zdrowia 719 Poz. 27 Załącznik B.68. LECZENIE TĘTNICZEGO NADCIŚNIENIA PŁUCNEGO SILDENAFILEM I EPOPROSTENOLEM (TNP) (ICD-10 I27, I27.0) ŚWIADCZENIOBIORCY I. Terapia sildenafilem
LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0)
 Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) Kwalifikacja do programu ŚWIADCZENIOBIORCY A. Kryteria kwalifikacji do leczenia ustekinumabem albo adalimumabem w ramach
Załącznik B.47. LECZENIE CIĘŻKIEJ POSTACI ŁUSZCZYCY PLACKOWATEJ (ICD-10 L 40.0) Kwalifikacja do programu ŚWIADCZENIOBIORCY A. Kryteria kwalifikacji do leczenia ustekinumabem albo adalimumabem w ramach
