(72) Twórcy wynalazku:
|
|
|
- Karolina Lewicka
- 9 lat temu
- Przeglądów:
Transkrypt
1 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) (13) B 1 Urząd Patentowy Rzeczypospolitej Polskiej Numer zgłoszenia (22) Data zgłoszenia: (51) IntCl6: A61K 39/116 A61K 39/385 (54)Złożona szczepionka pediatryczna przeciwko błonicy, tężcowi, ksztuścowi oraz Haemophilus influenzae typu b (30) Pierwszeństwo: ,US,07/ (73) Uprawniony z patentu: American Cyanamid Company, Wayne, US (43) Zgłoszenie ogłoszono: BUP 09/94 (72) Twórcy wynalazku: Jill G. Hackell, New City, US Peter R. Paradiso, Pittsford, US Deborah A. Hogerman, Rochester, US Dace Viceps Madore, Pittsford, US (45) O udzieleniu patentu ogłoszono: WUP 06/98 (74) Pełnomocnik: Wydrzyńska Danuta, PATPOL Spółka z o.o. (57) 1. Złożona szczepionka pediatryczna przeciwko błonicy, tężcowi, krztuścowi oraz Haemophilus influenzae typu b, znamienna tym, że zawiera w pojedynczej dawce immunizacyjnej 7,5 LF antygenu błonicy, 5 Lfantygenu tężca i 16 OPU krztuśca oraz 10 μg koniugatu fragmentów otoczkowego polisacharydowego antygenu Haemophilus influenzae typu b i 25 μg białka CRM1 9 7, oraz akceptowany farmaceutycznie wodny nośnik. PL B1
2 Złożona szczepionka pediatryczna przeciwko błonicy, tężcowi, krztuścowi oraz Haemophilus influenzae typu b Zastrzeżenia patentowe 1. Złożona szczepionka pediatryczna przeciwko błonicy, tężcowi, krztuścowi oraz Haemophilus influenzae typu b, znamienna tym, że zawiera w pojedynczej dawce immunizacyjnej 7,5 LF antygenu błonicy, 5 Lf antygenu tężca i 16 OPU krztuśca oraz 10 μg koniugatu fragmentów otoczkowego polisacharydowego antygenu Haemophilus influenzae typu b i 25 μg białka CRM197, oraz akceptowany farmaceutycznie wodny nośnik. 2. Szczepionka według zastrz. 1, znamienna tym, że zawiera antygen błonicy w postaci toksoidu błonicy, antygen tężca w postaci toksoidu tężca, antygen krztuśca w postaci inaktywowanych komórek Bordetella pertussis. 3. Szczepionka według zastrz. 2, znamienna tym, że zawiera toksoid błonicy zaabsorbowany na fosforanie glinu, toksoid tężca zaabsorbowany na fosforanie glinu a inaktywowane komórki Bordetella pertussis zawieszone w roztworze zawierającym jednozasadowy fosforan potasu, dwuzasadowy fosforan sodu i chlorek sodu. * * * Przedmiotem wynalazku jest złożona szczepionka pediatryczna wywołująca wzmożoną odpowiedź immunologiczną u małych dzieci na każdy z jej składników takich jak błonica, tężec, krztusiec oraz Haemophilus influenzae typu b. Szczepionka według wynalazku składa się z antygenu błonicy, antygenu tężca, antygenu krztuśca oraz koniugatu fragmentów otoczkowego antygenu polisacharydowego Haemophilus influenzae typu b (Hib) i białka bakterii błonicy CRM 197 (CRM197) i stanowi pojedynczą dawkę uodporniającą. Szczepionka ta wykazuje wzmożone działanie uodporniające, względem każdego z czterech składników, w porównaniu z DTP i szczepionką zawierającą koniugat Haemophilus influenzae typu b (Hib) stosowanymi w jednym czasie lecz osobno. Szczepionki złożone dają wiele korzyści, tak że stosowanie ich jest ogólnie popierane. Optymalnym okresem do szczepień ochronnych przeciw wielu chorobom jest okres niemowlęctwa i wczesnego dzieciństwa. Zwykle w czasie tego okresu podaje się wiele szczepionek w krótkim przedziale czasu. Jednorazowe podawanie kilku szczepionek może powodować zmniejszenie kosztów związanych z przeprowadzeniem szczepień, może powodować wzrost poziomu tolerancji szczepionki i może spowodować wczesne i szerokie uodpornienie dzieci. Przykładem szczepionki złożonej jest szczepionka potrójna, będąca mieszaniną toksoidów błonicy i tężca oraz zabitych komórek Bordetella pertussis (DTP) Iub z bezkomórkowymi antygenami bakterii krztuśca, szczepionka przeciw śwince i różyczce (MMR); szczepionka zawierająca trzy serotypy poliovirusa (w postaci doustnej Iub nieaktywnej-ipv) oraz szczepionka będąca połączeniem DTP-IVP. Stosowane obecnie w USA zasady szczepień ochronnych wymagają szczepienia małych dzieci od 2 miesiąca życia zarówno: (1) szczepionką potrójną, będącą mieszaniną toksoidów błonicy, tężca i antygenów bakterii krztuśca (DTP) oraz (2) szczepionką zawierającą koniugat Haemophilus influenzae typu b. Dwiema dostępnymi handlowo szczepionkami, są Tri-ImmunolR (Lederle Laboratories) oraz HibTITERR (Praxis Biologics, Inc.). Obie te szczepionki są zalecane do stosowania w wieku dwu, czterech i sześciu miesięcy, z dawką przypominającą w wieku miesięcy. Dodatkowa dawka DTP jest zalecana w 4-6 roku życia. Obie wymienione szczepionki stosowane osobno okazały się być wyjątkowo skuteczne w zmniejszeniu zachorowań w USA.
3 Ponieważ połączenie DTP i szczepionki zawierającej koniugat Haemophilus influenzae typu b w jedną szczepionkę jest korzystne ze względu na zmniejszenie ilości koniecznych do przeprowadzenia szczepień otrzymywanych przez dziecko, taka złożona szczepionka musi być odpowiednio bezpieczna i mieć własności uodporniające nie mniejsze niż szczepionki stosowanej osobno. Złożona szczepionka pediatryczna, w pojedynczej dawce, składająca się z antygenu błonicy, antygenu tężca, antygenu krztuśca oraz koniugatu fragmentów otoczkowego antygenu polisacharydowego Haemophilus influenzae typu b (Hib) i białka bakterii błonicy CRM197 w dopuszczalnym farmaceutycznie nośniku wodnym, wykazuje wzmożone działanie uodporniające u małych dzieci, względem każdego z jej czterech składników. Szczepionka złożona według wynalazku składa się z jałowej mieszaniny toksoidu błonicy zaabsorbowanego na fosforanie glinu, toksoidu tężca zaabsorbowanego na fosforanie glinu, inaktywowanych komórek Bordetella pertussis oraz koniugatu fragmentów otoczkowego antygenu polisacharydowego Haemophilus influenzae typu b (Hib) i białka bakterii błonicy CRM197 w dopuszczalnym farmaceutycznie nośniku wodnym. Po wstrząśnięciu, szczepionka ta ma postać homogennej, białej zawiesiny. Ponadto składniki szczepionki są trwałe i wzajemnie zgodne, oraz nie wykazują względem siebie działania hamującego. Złożona szczepionka pediatryczna wywołująca wzmożoną odpowiedź immunologiczną u małych dzieci na każdy z jej składników takich jak błonica, tężec, krztusiec oraz Haemophilus influenzae typu b zawiera w pojedynczej dawce immunizacyjnej 7,5 LF antygenu błonicy, 5 Lf antygenu tężca i 16 OPU krztuśca oraz 10 μg koniugatu fragmentów otoczkowego polisacharydowego antygenu Haemophilus influenzae typu b i 25 μg białka CRM197 oraz akceptowany farmaceutycznie wodny nośnik. W przedstawianej szczepionce antygen błonicy jest toksoidem błonicy zaabsorbowanym na fosforanie glinu, antygen tężca jest toksoidem tężca zaabsorbowanym na fosforanie glinu. Toksoidy te mogą być przygotowywane znanymi metodami. Toksoidy błonicy i tężca otrzymywane są odpowiednio z Corynebacterium diphteriae i Clostridium tetani, rosnących na podłożach przygotowanych zgodnie z metodą Muellera i Millera, J. Immunol., 1941, 40: oraz J. Immunol., 1947, 56: , odtruwane następnie formaldehydem. Toksoidy oczyszczane są następnie metodą frakcjonowania alkoholowego wg. Pillemer'a, J. Immunol., 1946, 54: i są następnie rozcieńczane roztworem wodnym zawierającym jednozasadowy fosforan sodu, dwuzasadowy fosforan sodu, glicynę i timerosal (pochodną rtęci) jako substancję konserwującą. Antygeny krztuśca są z wyboru inaktywowanymi, całymi komórkami, przygotowanymi ze szczepu Iub kombinacji szczepów Bordetella pertussis. Preparat z całych komórek bakterii krztuśca przygotowywany jest z komórek Bordetella pertussis w fazie I wzrostu, rosnących na zmodyfikowanej pożywce Cohen-Wheeler'a, zawierającej kwaśny hydrolizat kazeiny. Komórki Bordetella pertussis unieczynniane są timerosalem, następnie zbierane i zawieszane w wodnym rozworze zawierającym jednozasadowy fosforan potasu, dwuzasadowy fosforan sodu, chlorek sodu i timerosal (pochodną rtęci) jako substancję konserwującą. Składnik DTP może być użyty jako mieszanka. Na przykład handlowo dostępne preparaty DTP, takie jak produkt Ledrerle Laboratories (o nazwie handlowej Tri-Immunol r), mogą wchodzić w skład szczepionki złożonej, będącej przedmiotem niniejszego wynalazku. Wchodzący w skład szczepionki według wynalazku koniugat Hib składa się z fragmentów polisacharydowego otoczkowego antygenu Haemophilus influenzae typu b, związanych kowalencyjnie z białkiem CRM 197. Fragmenty przygotowywane są metodą przecinania nadjodanem oczyszczonych polisacharydów otoczkowych, wyizolowanych z Haemophilus influenzae typu b, rosnącego na chemicznie zdefiniowanej pożywce. Białko C 197 jest nietoksycznym wariantem toksyny błonicy, wyizolowanym z kultur Corynebacterium diphteriae (szczep C7, Beta 197) rosnących na pożywce zawierającej kwasy kazaminowe i ekstrakt drożdżowy. Fragmenty Haemophilus influenzae typu b są kowalencyjnie przyłączane do białka CRM 197. Preferowana metoda przyłączania kowalencyjnego sacharydów do białka to aminacja redukcyjna.
4 Przygotowanie koniugatów Haemophilus influenzae typu b i białka CRM197 metodą aminacji redukcyjnej zostało przedstawione w opisach patentowych Stanów Zjednoczonych nr 4,673,574, nr 4,761,283 i nr 4,902,506. Konjugat jest następnie oczyszczany przez diafiltrację, w celu usunięcia niepołączonych fragmentów białkowych i polisacharydowych oraz odczynników, a następnie sterylizowany przez filtrację. Handlowo dostępne koniugaty Haemophilus influenzae typu b, np. z firmy Praxis Biologicals Inc. (o nazwie handlowej HibTITERR), mogą wchodzić w skład złożonej szczepionki według wynalazku. Szczepionka złożona, zawierająca każdy z czterech uodporniających składników (D, T, P oraz koniugat Hib) dostarczana jest w postaci wodnej mieszanki. Po wstrząśnięciu szczepionka jest homogenną, białą zawiesiną. Do szczepionki złożonej mogą być dodawane odpowiednie adjuwanty. Szczepionka jest podawana w postaci wstrzyknięcia domięśniowego. Czteroskładnikowa szczepionka złożona została przygotowana jak podano wyżej z wykorzystaniem DTP (Tri-ImmuneolR, Lederle Laboratories) i koniugatu Hib (HibTITER, Praxis Biologicals). Zwiększona immunogenność każdego z czterech składników w szczepionce złożonej wykazano drogą badań klinicznych. Przeprowadzono badania w kilku ośrodkach nad bezpieczeństwem i właściwościami uodporniającymi szczepionki wśród dzieci uczących się chodzić i niemowląt. Dodatkowo przeprowadzono na dużej próbce badania bezpieczeństwa szczepionki, w celu oceny występowania wśród małych dzieci możliwych, rzadkich, działań ubocznych. Dla obu grup dzieci uczących się chodzić i niemowląt, badania nad bezpieczeństwem stosowania i immunogennością szczepionki przeprowadzono na próbce dobranej losowo, tak by dzieci otrzymały albo pojedynczą dawkę 0,5 ml jednej z trzech serii próbek czteroskładnikowej szczepionki złożonej (D, T, P oraz koniugat Hib, zmieszane) Iub 0.5 ml dawki każdej ze szczepionek DTP i koniugatu Hib wybranych z trzech odpowiednich serii DTP i koniugatu Hib podawanych jednocześnie, jako oddzielne iniekcje (DTP-koniugat Hib, oddzielnie) w wieku 18+/-3 miesiąca życia Iub średnio w 2, 4 i 6 miesiącu życia. Tak więc dzieci badane zaklasyfikowano do jednej z sześciu grup doświadczalnych. Brak ostrych objawów ubocznych oceniano na podstawie relacji rodziców w okresie do 72 godzin po szczepieniu. Moc uodporniającą (immunogenność) określano metodą analizy serologicznej przeciwciał skierowanych przeciw polisacharydom Haemophilus influenzae typu b (polisacharydom Hib), oraz antygenom błonicy, tężca i krztuśca. Każdy protokół badawczy analizowany był niezależnie. Analiza ilościowa danych dotyczących bezpieczeństwa stosowania i mocy uodporniającej szczepionki wykazała, że wszystkie trzy próbki losowe dla czterech składników szczepionki złożonej były podobne względem wszystkich badanych parametrów, tak więc dane te pokrywały się ze sobą. Tak samo było w przypadku trzech odpowiednich próbek losowych DTP i koniugatu Hib, podawanych jednocześnie jako osobne iniekcje. Próba I Badania nad bezpieczeństwem stosowania szczepionki i jej immunogennością, przeprowadzone w grupie dzieci uczących się chodzić. Do badań zakwalifikowano 215 dzieci (szczepionka złożona n=107, DTP-koniugat Hib, osobno n=108) i dobrano losowo spośród dzieci uczących się chodzić w każdym z czterech ośrodków klinicznych. Charakterystyka demograficzna wszystkich dzieci była podobna. Analiza serologiczna próbek osocza przed i jeden miesiąc po szczepieniu nie wykazywała różnic w odpowiedzi immunologicznej na polisacharydy Hib, błonicę i tężca (patrz tabela 1). Odpowiedź immunologiczna na aglutyniny krztuśca była znacząco większa w grupie szczepionej szczepionką złożoną (142.58) w porównaniu do grupy szczepionej DTP-koniugatem Hib osobno (82.44; p=0.013). Próba II Badania nad bezpieczeństwem stosowania szczepionki i jej immunogennością wśród niemowląt Do badań zakwalifikowano grupę 378 dzieci (szczepionka złożona n=189, DTP-koniugat Hib, osobno n=189), dobranych losowo spośród niemowląt w każdym z pięciu ośrodków klinicznych. Charakterystyka demograficzna wszystkich dzieci była podobna.
5 Odpowiedź immunologiczna na polisacharyd Hib po każdym z trzech szczepień była większa w przypadku dzieci, które szczepiono szczepionkę złożoną (patrz tabela II). Po drugim szczepieniu średnie geometryczne miano (GMT) dla grupy otrzymującej szczepionkę złożoną wynosiło 0.66 fig/ml w porównaniu do 0.34 μg/ml w grupie otrzymującej DTP-koniugat Hib osobno (p < 0.001). Identyczny trend obserwowano po trzecim szczepieniu: 6.67 μl/ml w porównaniu do 4.42 μg/ml odpowiednio dla: szczepionki złożonej i DTP-koniugatu Hib podawanych osobno (p=0.034). Odpowiedź serologiczną na składniki szczepionki DTP mierzono w jeden miesiąc po podaniu trzeciej dawki szczepionki. GMT przeciwciał skierowanych przeciw błonicy (0.71 IU/ml vs IU/ml; p=0.009), tężca (8.20 vs. 4.51; p < 0.001) i aglutyninon krztuśca (51.93 vs ; p = 0.008) było we wszystkich przypadkach znacząco większe dla szczepionki złożonej w porównaniu do szczepionek podawanych osobno (patrz tabela 2). W przypadku błonicy i krztuśca różnica ta zanikała, gdy porównano stosunek odpowiedzi immunologicznej do podstawowego miana. Analizowano frakcje surowicy na przeciwciała skierowane przeciw specyficznym antygenom białkowym bakterii krztuśca: toksynie krztuścowej (PT), FHA i białku 69K. Odpowiedź immunologiczna na PT (85.92 vs ; p=0.001) i FHA (2.32 vs. 0.79; p=0.0001) była znacząco wyższa dla szczepionki złożonej w porównaniu z grupą otrzymującą osobne szczepionki (patrz tabela 3). Nie zaobserwowano takiej różnicy dla białka 69K (szczepionka złożona vs. osobne iniekcje 41.55; p=0.11). Próba III Badania na dużą skalę nad bezpieczeństwem stosowania szczepionki u niemowląt i immunogennością. Przeprowadzono badania na dużą skalę nad bezpieczeństwem stosowania szczepionki wśród niemowląt w Kaiser Permamente Medical Care Program w Płn. Kalifornii. Badano grupy dzieci dobranych i nie dobranych losowo. W pierwszym przypadku pozwoliło to na zgromadzenie danych o wpływie szczepionki złożonej, w dużej grupie dzieci (n=5777). Druga grupa stanowiła grupę kontrolną, gdzie bezpieczeństwo stosowania szczepionki złożonej (n=720) można było porównywać perspektywicznie z grupą otrzymującą DTP-koniugat Hib (n=691) w postaci osobowych iniekcji. Całkowita liczba 6497 dzieci otrzymała 3 dawki szczepionki złożonej (D, T, P i koniugat Hib) w około 2, 4 i 6 miesiącu życia. Badano możliwe przypadki lokalnych i systemicznych efektów ubocznych, zachodzących w czasie 24 godzin po szczepieniu. Rzadko występujące silne efekty uboczne (np. napady) oceniano sprawdzając przypadki hospitalizacji w ciągu 60 dni po szczepieniu oraz przypadki wzywania nagłej pomocy lekarskiej, w ciągu 30 dni. W trzech seriach badań zarówno lokalne, jak systemiczne efekty uboczne nie występowały częściej po podaniu szczepionki złożonej niż po podaniu DTP. Nie było ponadto znacznych różnic w poziomie efektów ubocznych w przypadkach hospitalizacji czy w przypadkach, w których wzywano pomocy lekarskiej. Wskaźnik umieralności SIDS był nawet nieco mniejszy w grupie, w której podawano szczepionkę złożoną (w porównaniu z grupą kontrolną). Odpowiedzi immunologiczne na polisacharyd Hib, błonicę, tężec i krztusiec mierzono w jeden miesiąc po podaniu trzeciej dawki szczepionki złożonej w podgrupie 123 dzieci. Otrzymane wartości były porównywalne z wynikami otrzymanymi w opisanych wyżej badaniach, przeprowadzonych w wielu ośrodkach (patrz tabela 4). Próba IV Procedury serologiczne Testy serologiczne dokonywano metodą ELISA dla przeciwciał skierowanych przeciw polisacharydowi Haemophilus influenzae typu b i tężca (dla badań przeprowadzonych w grupie niemowląt); metodą Vero (J. Biol. Stand. 2: ) dla przeciwciał skierowanych przeciw błonicy; metodą oceny śmiertelności myszy (Bull WHO 43: ; Minimum Requirements: Tetanus Toxoid Appendix A, June 15, 1953, Publ. Health Serv., NIH; Craig, 1986, Manual of Clinical Lab. Immunol., str , 3 wyd.) dla przeciwciał skierowanych przeciw tężcowi (badania przeprowadzone na grupie dzieci uczących się chodzić) i testem mikroaglutynacyjnym (Maclark i wsp., 1986, Manual of Clinical Lab. Immunol., str , 3-cie wyd.) dla przeciwciał skierowanych przeciw krztuścowi.
6 Jak wynika z przedstawionych wyżej badań klinicznych odpowiedź immunologiczna małych dzieci na każdy ze składników szczepionki, była wyższa w przypadku szczepionki złożonej niż dla podanych w jednym czasie lecz osobno szczepionek DTP i koniugatu-hib. Tak więc wykorzystanie szczepionki złożonej może zmniejszyć całkowitą ilość szczepień małych dzieci o połowę oraz stanowi ważny krok na drodze polepszenia sposobu podawania szczepionek. Tabela 1 Porównanie odpowiedzi immunologicznej na szczepionkę złożoną i szczepionki podawane osobno1 Składnik koniugat Hib (μg/ml) Miano przeciwciał (GMT) (n2) s złożona s. podawane osobno wartość (107) (108) P3 przed po błonica (IU/ml) przed ,812 po tężec (U/ml) przed po aglutyninu krztuśca (metodą rozcieńczeń) przed po Szczepionka złożona, czteroskładnikowa (D, T, P oraz koniugat-hib) lub szczepionki osobne (DTP-koniugat Hib) podawano w miesiącu życia; krew do badań serologicznych pobierano w miesiąc później. 2 Całkowita liczebność badanej grupy. 3. Oparte na efektach z pierwotnego (skorelowanego kowariantnie) modelu zawierającego: sposób traktowania, ośrodek medyczny, grupę, wiek, podstawowy poziom przeciwciał. Tabela 2 Porównanie odpowiedzi immunologicznej na szczepionkę złozoną i szczepionki podawane osobno1 Składnik koniugat Hib μ( g /m I) Miano przeciwciał (GMT) (n2) s. złozona s. podawane osobno wartość (189) (189) P przed po
7 błonica (IU/ml) Tabela 2 (ciąg dalszy) przed ,624 po tężec (U/ml) przed po aglutyninu krztuśca (metodą rozcieńczeń) przed po Szczepionka złozona, czteroskładnikowa (D, T, P oraz koniugat-hib) lub szczepionki osobne (DTP-koniugat Hib) podawano w 2,4 i 6 miesiącach życia. 2. Całkowita liczebność badanej grupy. 3. Oparte na efektach z pierwotnego (skorelowanego kowariantme) modelu zawierającego: sposób traktowania, ośrodek medyczny, grupę, wiek, podstawowy poziom przeciwciał. Tabela 3 Odpowiedź immunologiczna na trzy składowe szczepionki przeciw krztuścowi w szczepionce złozonej i szczepionkach podawanych osobno Miano przeciwciał (GM T)1 Szczepionka Składnik s. złożona s. podawane osobno wartość (n=52) 2 (n=34) P toksyna krztuśca przed po K przed po FHA przed po Miano przeciwciała w ELISA (U/ml). 2. Wartości p wyliczono wykorzystując dwustronny test Wilcoxona. Tabela 4 Odpowiedź immunologiczna na każdy składnik szczepionki złozonej (D, T, P oraz koniugat Hib) koniugat Hib Składnik n miano przeciwciała (GMT) (Hg/ml) błonica (IU/ml)
8 tężec (U/ml) aglutyniny krztuśca (metoda rozcieńczeń) Miano przeciwciał badano w jeden miesiąc po podaniu trzeciej dawki. Nic badano poziomu przeciwciał przedszczepiennych Tabela 4 (ciąg dalszy) P r z y k ł a d. Szczepionkę według wynalazku uzyskuje się przez dodanie koncentratu koniugatu Haemophilus influenzae typu b do preparatu DTP, w czasie rozcieńczania szczepionki DTP do objętości końcowej. Tym samym ostateczna dawka uodporniająca ma nadal objętość 0.5 ml. Każda pojedyncza dawka o objętości 0.5 ml szczepionki złożonej została opracowana tak, że zawiera minimum 7.5 Lf toksoidu błonicy, 5 Lf toksoidu tężca (oba toksoidy indukują powstawanie nie mniej niż 2 jednostek antytoksyny na ml, w teście in vivo mocy antytoksyn (świnka morska), 10 fxl oczyszczonego sacharydu z Haemophilus influenzae typu b i około 25 jig białka CRM 197. Każda dawka o objętości 0.5 ml szczepionki opracowana tak, że zawiera nie mniej niż 16 OPU unieczynnionych komórek bakterii krztuśca. Całkowita ludzka dawka uodporniająca (trzy pierwsze dawki po 0.5 ml) zawiera szacunkowo 12 jednostek szczepionki przeciwkrztuścowej (w tym szacunkowo 4 jednostki ochronne na pojedynczą dawkę ludzką). Każdy ze składników szczepionki - toksoid błonicy, toksoid tężca, koniugat antygenu krztuśca i Haemophilus influenzae typu b - spełnia wymagane standardy aktywności. Do szczepionki dodawany jest timerosal (jako konserwant) do stężenia końcowego 1: Zawartość glinu w produkcie końcowym nie przekracza 0.85 mg w 0.5 ml dawki według oznaczenia. Resztkowa zawartość wolnego formaldehydu według oznaczenia jest równa Iub mniejsza niż 0.02%. Składniki Ilość antygen błonicy 7,5 Lf antygen tężca 5 Lf unieczynnione komórki krztuśca 4 PU antygen Haemophilus influenzae typ b 10 μg białko CRM μg fosforan gliny 0,85 mg woda do 0,5 ml Składniki te miesza się uzyskując szczepionkę według wynalazku. Departament Wydawnictw UP RP. Nakład 90 egz. Cena 2,00 zł
Pakiet 1 Załącznik nr 5. Nazwa handlowa
 Pakiet 1 Załącznik nr 5 L..p j.m. Przedmiot zamówienia 1. Szczepionka skojarzona przeciw błonicy, tężcowi i krztuścowi acelularna zawierająca : antytoksynę błonniczą, antytoksynę tężcową i trzy antygeny
Pakiet 1 Załącznik nr 5 L..p j.m. Przedmiot zamówienia 1. Szczepionka skojarzona przeciw błonicy, tężcowi i krztuścowi acelularna zawierająca : antytoksynę błonniczą, antytoksynę tężcową i trzy antygeny
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem
 INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem Hiberix Vaccinum haemophili influenzae stripe b conjugatum Proszek i rozpuszczalnik do sporządzenia zawiesiny
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem Hiberix Vaccinum haemophili influenzae stripe b conjugatum Proszek i rozpuszczalnik do sporządzenia zawiesiny
Postać leku Dawka. Kod EAN oferowanego produktu / inny kod produktu Postać leku
 FORMULARZ CENOWY, OPIS PRZEDMIOTU ZAMÓWIENIA Składając w imieniu... ofertę na: dostawę leków i szczepionek w postępowaniu o zamówienie publiczne w trybie... dla Centrum Medycznego "Żelazna" Sp. z o.o.,
FORMULARZ CENOWY, OPIS PRZEDMIOTU ZAMÓWIENIA Składając w imieniu... ofertę na: dostawę leków i szczepionek w postępowaniu o zamówienie publiczne w trybie... dla Centrum Medycznego "Żelazna" Sp. z o.o.,
WYTYCZNE I ARTYKUŁY PRZEGLĄDOWE
 WYTYCZNE I ARTYKUŁY PRZEGLĄDOWE Stanowisko Zarządu Polskiego Towarzystwa Wakcynologii z dnia 10 marca 2017 roku w sprawie stosowania szczepionki Tetraxim w szczepieniu podstawowym przeciwko krztuścowi
WYTYCZNE I ARTYKUŁY PRZEGLĄDOWE Stanowisko Zarządu Polskiego Towarzystwa Wakcynologii z dnia 10 marca 2017 roku w sprawie stosowania szczepionki Tetraxim w szczepieniu podstawowym przeciwko krztuścowi
FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania
 Załącznik nr 1 do SIWZ FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania Zadanie nr 1 1 Szczepionka zapobiegająca wirusowemu zapaleniu wątroby typu
Załącznik nr 1 do SIWZ FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania Zadanie nr 1 1 Szczepionka zapobiegająca wirusowemu zapaleniu wątroby typu
(12) OPIS PATENTOWY (19)PL (11)188460
 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19)PL (11)188460 (21) Numer zgłoszenia: 333127 (13) B1 (22) Data zgłoszenia: 04.11.1997 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19)PL (11)188460 (21) Numer zgłoszenia: 333127 (13) B1 (22) Data zgłoszenia: 04.11.1997 (86) Data i numer zgłoszenia
ZP.II.3331-01/11 Załącznik nr 5 FORMULARZ CENOWY. Pakiet nr I
 Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. Postać farmaceutyczna: proszek i rozpuszczalnik do sporządzania zawiesiny doustnej. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi,
Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. Postać farmaceutyczna: proszek i rozpuszczalnik do sporządzania zawiesiny doustnej. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi,
FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów
 FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów Zadanie nr 1 kod CPV 33.65.16.00-4 Lp. Opis Ilo sztuk
FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów Zadanie nr 1 kod CPV 33.65.16.00-4 Lp. Opis Ilo sztuk
PL 204536 B1. Szczepanik Marian,Kraków,PL Selmaj Krzysztof,Łódź,PL 29.12.2003 BUP 26/03 29.01.2010 WUP 01/10
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 204536 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 354698 (22) Data zgłoszenia: 24.06.2002 (51) Int.Cl. A61K 38/38 (2006.01)
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 204536 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 354698 (22) Data zgłoszenia: 24.06.2002 (51) Int.Cl. A61K 38/38 (2006.01)
Wiek Szczepienie przeciw Uwagi
 Wiek Szczepienie przeciw Uwagi 1 życia w ciągu 24 godzin po urodzeniu WZW typu B - domięśniowo (pierwsza dawka) GRUŹLICY - śródskórnie szczepionką BCG Szczepienie noworodków przeciw gruźlicy powinno być
Wiek Szczepienie przeciw Uwagi 1 życia w ciągu 24 godzin po urodzeniu WZW typu B - domięśniowo (pierwsza dawka) GRUŹLICY - śródskórnie szczepionką BCG Szczepienie noworodków przeciw gruźlicy powinno być
ZP.II /13 Załącznik nr 5 FORMULARZ CENOWY. Pakiet nr I
 Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona), poliomyelitis (inaktywowana) i Haemophilus
Pakiet nr I Szczepionka przeciw rotawirusom, żywa, dwudawkowa. szt. 150 Pakiet nr II Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona), poliomyelitis (inaktywowana) i Haemophilus
SPGZOZ O F E R T A ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO PUBLICZNEGO GMINNEGO ZAKŁADU OPIEKI ZDROWOTNEJ W NADARZYNIE
 ... wykonawca (pieczęć firmowa) tel./fax:... e-mail: Załącznik nr 1 Do:...... O F E R T A W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO
... wykonawca (pieczęć firmowa) tel./fax:... e-mail: Załącznik nr 1 Do:...... O F E R T A W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO
FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów
 FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów Zadanie nr 1 kod CPV 33.65.16.00-4 Lp. Opis Ilo sztuk
FORMULARZ ASORTYMENTOWO-CENOWY/SPECYFIKACJA TECHNICZNA Załącznik nr 2 do zapytania ofertowego na: Sukcesywną dostawę szczepionek dla SP ZOZ Celestynów Zadanie nr 1 kod CPV 33.65.16.00-4 Lp. Opis Ilo sztuk
Historia i przyszłość szczepień
 IV Europejski Tydzień Szczepień 20-26 kwietnia 2009 Historia i przyszłość szczepień Prof. dr hab. Andrzej Zieliński Zakład Epidemiologii Narodowego Instytutu Zdrowia Publicznego Błonica Zapadalność i umieralność
IV Europejski Tydzień Szczepień 20-26 kwietnia 2009 Historia i przyszłość szczepień Prof. dr hab. Andrzej Zieliński Zakład Epidemiologii Narodowego Instytutu Zdrowia Publicznego Błonica Zapadalność i umieralność
Pieczęć Wykonawcy Załącznik nr 1 Nr sprawy SPZOZ.U.147/2016 FORMULARZ ASORTYMENTOWO CENOWY PAKIET NR I
 PAKIET NR I Lp Opis 1 Szczepionka skojarzona przeciwko błonicy, tężcowi, krztuścowi, polio i Haemophilus influenzae typ b,wzw - b zawierająca toksoid błoniczy, toksoid tężcowy, polio typ 1, 2 i 3, trzy
PAKIET NR I Lp Opis 1 Szczepionka skojarzona przeciwko błonicy, tężcowi, krztuścowi, polio i Haemophilus influenzae typ b,wzw - b zawierająca toksoid błoniczy, toksoid tężcowy, polio typ 1, 2 i 3, trzy
ZAMAWIAJĄCY: OFERTA. składam ofertę na wykonanie zamówienia na części. strona: posiada) (imię i nazwisko, tel., ew.
 ... pieczęć Wykonawcy ZAMAWIAJĄCY: Miejski Samodzielny Publiczny Zakład Opieki Zdrowotnej ul. Żymirskiego 2 05-230 Kobyłka OFERTA W nawiązaniu do ogłoszenia o przetargu nieograniczonym na: DOSTAWA SZCZEPIONEK
... pieczęć Wykonawcy ZAMAWIAJĄCY: Miejski Samodzielny Publiczny Zakład Opieki Zdrowotnej ul. Żymirskiego 2 05-230 Kobyłka OFERTA W nawiązaniu do ogłoszenia o przetargu nieograniczonym na: DOSTAWA SZCZEPIONEK
ZAMAWIAJĄCY: OFERTA. składam ofertę na wykonanie zamówienia na części. strona: posiada) (imię i nazwisko, tel., ew.
 ... pieczęć Wykonawcy ZAMAWIAJĄCY: Miejski Samodzielny Publiczny Zakład Opieki Zdrowotnej ul. Żymirskiego 2 05-230 Kobyłka OFERTA W nawiązaniu do ogłoszenia o przetargu nieograniczonym na: DOSTAWA SZCZEPIONEK
... pieczęć Wykonawcy ZAMAWIAJĄCY: Miejski Samodzielny Publiczny Zakład Opieki Zdrowotnej ul. Żymirskiego 2 05-230 Kobyłka OFERTA W nawiązaniu do ogłoszenia o przetargu nieograniczonym na: DOSTAWA SZCZEPIONEK
PL B1 (12) O P I S P A T E N T O W Y (19) P L (11) (13) B 1 A61K 9/20. (22) Data zgłoszenia:
 R Z E C Z PO SPO L IT A PO LSK A (12) O P I S P A T E N T O W Y (19) P L (11) 1 7 7 6 0 7 (21) Numer zgłoszenia: 316196 (13) B 1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.03.1995
R Z E C Z PO SPO L IT A PO LSK A (12) O P I S P A T E N T O W Y (19) P L (11) 1 7 7 6 0 7 (21) Numer zgłoszenia: 316196 (13) B 1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 13.03.1995
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Quintanrix, proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy, tężcowi, krztuścowi (pełnokomórkowa),
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Quintanrix, proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy, tężcowi, krztuścowi (pełnokomórkowa),
(12) OPIS PATENTOWY (19) PL (11)
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 190729 (21) Numer zgłoszenia: 344137 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej ( S ) Data zgłoszenia: 27.04.1999 (86) Data i numer zgłoszenia
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 190729 (21) Numer zgłoszenia: 344137 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej ( S ) Data zgłoszenia: 27.04.1999 (86) Data i numer zgłoszenia
Jedna dawka (0,5 ml) po rekonstytucji, zawiera: Polisacharyd otoczkowy Haemophilus influenzae typ b.. 10 mikrogramów
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Act-HIB, 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum haemophili stirpi b coniugatum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Act-HIB, 10 mikrogramów/0,5 ml, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Vaccinum haemophili stirpi b coniugatum
DANE O LUDNOŚCI w roku 2017. Część I Nazwa placówki
 Załącznik Nr 1 DANE O LUDNOŚCI w roku 2017 Część I Nazwa placówki Liczba ludności ogółem. Noworodki.. (szacunkowa liczba urodzeń w 2017 r.) Liczba dzieci urodzonych w 2016 r.... (szacunkowa liczba urodzeń
Załącznik Nr 1 DANE O LUDNOŚCI w roku 2017 Część I Nazwa placówki Liczba ludności ogółem. Noworodki.. (szacunkowa liczba urodzeń w 2017 r.) Liczba dzieci urodzonych w 2016 r.... (szacunkowa liczba urodzeń
OFERTA WYKONAWCY ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO GMINNEGO ZAKŁADU OPIEKI ZDROWOTNEJ W NADARZYNIE
 ... wykonawca (pieczęć firmowa) tel./fax:... e-mail:... Załącznik nr 1 Do:......... OFERTA WYKONAWCY W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK
... wykonawca (pieczęć firmowa) tel./fax:... e-mail:... Załącznik nr 1 Do:......... OFERTA WYKONAWCY W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PENTAXIM, proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań w ampułko-strzykawce Vaccinum diphtheriae, tetani, pertussis sine
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PENTAXIM, proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań w ampułko-strzykawce Vaccinum diphtheriae, tetani, pertussis sine
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO INFANRIX-IPV+Hib, proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Vaccinum diphtheriae, tetani, pertussis sine cellulis
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO INFANRIX-IPV+Hib, proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Vaccinum diphtheriae, tetani, pertussis sine cellulis
CZYM JEST SZCZEPIONKA?
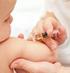 CZYM JEST SZCZEPIONKA? Szczepionka to preparat biologiczny, stosowany w celu uodpornienia organizmu. Ogólna zasada działania szczepionki polega na wprowadzeniu do organizmu antygenu, który jest rozpoznawany
CZYM JEST SZCZEPIONKA? Szczepionka to preparat biologiczny, stosowany w celu uodpornienia organizmu. Ogólna zasada działania szczepionki polega na wprowadzeniu do organizmu antygenu, który jest rozpoznawany
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO INFANRIX-IPV+Hib, proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Szczepionka przeciw błonicy (D), tężcowi (T), krztuścowi
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO INFANRIX-IPV+Hib, proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Szczepionka przeciw błonicy (D), tężcowi (T), krztuścowi
Charakterystyka produktu leczniczego. 1 NAZWA PRODUKTU LECZNICZEGO Tdap Szczepionka SSI, zawiesina do wstrzykiwań w ampułko-strzykawce.
 Charakterystyka produktu leczniczego 1 NAZWA PRODUKTU LECZNICZEGO Tdap Szczepionka SSI, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw błonicy, tężcowi i krztuścowi (bezkomórkowa, złożona),
Charakterystyka produktu leczniczego 1 NAZWA PRODUKTU LECZNICZEGO Tdap Szczepionka SSI, zawiesina do wstrzykiwań w ampułko-strzykawce. Szczepionka przeciw błonicy, tężcowi i krztuścowi (bezkomórkowa, złożona),
Szczepienia ochronne. Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak
 Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
OFERTA. 23.1. Załącznik nr 1 wzór formularza oferty NR SPRAWY : GK/34/12/15 WYKONAWCA :
 23.1. Załącznik nr 1 wzór formularza oferty NR SPRAWY : GK/34/12/15 WYKONAWCA :... (Nazwa i adres Wykonawcy lub jego pieczęć firmowa, adresowa) Adres do korespondencji:... Telefon: Faks:... e-mali:...
23.1. Załącznik nr 1 wzór formularza oferty NR SPRAWY : GK/34/12/15 WYKONAWCA :... (Nazwa i adres Wykonawcy lub jego pieczęć firmowa, adresowa) Adres do korespondencji:... Telefon: Faks:... e-mali:...
(62) Numer zgłoszenia, z którego nastąpiło wydzielenie: (86) Data i numer zgłoszenia międzynarodowego:
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 211911 (21) Numer zgłoszenia: 393585 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 28.03.2002 (62) Numer zgłoszenia, z którego
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19) PL (11) 211911 (21) Numer zgłoszenia: 393585 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (22) Data zgłoszenia: 28.03.2002 (62) Numer zgłoszenia, z którego
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DTP - Szczepionka błoniczo-tężcowo-krztuścowa adsorbowana, zawiesina do wstrzykiwań. Szczepionka przeciw błonicy, tężcowi i krztuścowi,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DTP - Szczepionka błoniczo-tężcowo-krztuścowa adsorbowana, zawiesina do wstrzykiwań. Szczepionka przeciw błonicy, tężcowi i krztuścowi,
Szczepienia u dzieci. Agnieszka Wegner MD, PhD Department of Pediatric Neurology Medical University of Warsaw
 Szczepienia u dzieci Agnieszka Wegner MD, PhD Department of Pediatric Neurology Medical University of Warsaw Szczepienia 1. Szczepienie uodpornienie czynne, immunizacja polegająca na wprowadzeniu do ciała
Szczepienia u dzieci Agnieszka Wegner MD, PhD Department of Pediatric Neurology Medical University of Warsaw Szczepienia 1. Szczepienie uodpornienie czynne, immunizacja polegająca na wprowadzeniu do ciała
DANE O LUDNOŚCI w roku 2016
 Załącznik Nr 1 DANE O LUDNOŚCI w roku 2016 Część I Nazwa placówki:. Liczba ludności ogółem. Noworodki.. (szacunkowa liczba urodzeń w 2016 r.) Liczba dzieci urodzonych w 2015 r.... (szacunkowa liczba urodzeń
Załącznik Nr 1 DANE O LUDNOŚCI w roku 2016 Część I Nazwa placówki:. Liczba ludności ogółem. Noworodki.. (szacunkowa liczba urodzeń w 2016 r.) Liczba dzieci urodzonych w 2015 r.... (szacunkowa liczba urodzeń
Odporność przeciwzakaźna. Profilaktyka chorób zakaźnych.
 Odporność przeciwzakaźna. Profilaktyka chorób zakaźnych. Odporność swoista Czynna naturalna przechorowanie lub przebycie zakażenia bezobjawowego sztuczna - szczepienie Bierna naturalna - matka - płód,
Odporność przeciwzakaźna. Profilaktyka chorób zakaźnych. Odporność swoista Czynna naturalna przechorowanie lub przebycie zakażenia bezobjawowego sztuczna - szczepienie Bierna naturalna - matka - płód,
FORMULARZ OFERTOWY. Termin wykonania zamówienia: od dnia zawarcia umowy do 31 grudnia 2015 roku. /nazwa firmy/ /adres siedziby/
 Załącznik nr 1 do SIWZ FORMULARZ OFERTOWY dotyczący postępowania o udzielenie zamówienia publicznego w trybie przetargu nieograniczonego na zakup i dostawę szczepionek do Samodzielnego Zakładu Opieki Zdrowotnej
Załącznik nr 1 do SIWZ FORMULARZ OFERTOWY dotyczący postępowania o udzielenie zamówienia publicznego w trybie przetargu nieograniczonego na zakup i dostawę szczepionek do Samodzielnego Zakładu Opieki Zdrowotnej
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań w ampułkostrzykawce. Szczepionka przeciwko błonicy
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań w ampułkostrzykawce. Szczepionka przeciwko błonicy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO - 1 - 1. NAZWA PRODUKTU LECZNICZEGO INFANRIX-DTPa, zawiesina do wstrzykiwań Vaccinum diphtheriae, tetani, pertussis sine cellulis ex elementis praeparatum adsorbatum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO - 1 - 1. NAZWA PRODUKTU LECZNICZEGO INFANRIX-DTPa, zawiesina do wstrzykiwań Vaccinum diphtheriae, tetani, pertussis sine cellulis ex elementis praeparatum adsorbatum
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. nie mniej niż 30 j.m. nie mniej niż 40 j.m.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DT - Szczepionka błoniczo - tężcowa adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy i tężcowi, adsorbowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DT - Szczepionka błoniczo - tężcowa adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy i tężcowi, adsorbowana 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań. Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań. Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Quintanrix, proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy, tężcowi, krztuścowi
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Quintanrix, proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy, tężcowi, krztuścowi
Załącznik nr 1do siwz formularz ofertowy
 Załącznik nr do siwz formularz ofertowy... wykonawca (pieczęć firmowa) tel./fax:... e-mail:... Do:......... OFERTA WYKONAWCY W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA
Załącznik nr do siwz formularz ofertowy... wykonawca (pieczęć firmowa) tel./fax:... e-mail:... Do:......... OFERTA WYKONAWCY W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA
SPGZOZ O F E R T A ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO PUBLICZNEGO GMINNEGO ZAKŁADU OPIEKI ZDROWOTNEJ W NADARZYNIE
 ... wykonawca (pieczęć firmowa) tel./fax:... e-mail: Załącznik nr 1 Do:...... O F E R T A W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO
... wykonawca (pieczęć firmowa) tel./fax:... e-mail: Załącznik nr 1 Do:...... O F E R T A W nawiązaniu do ogłoszenia o przetargu nieograniczonym na : ZAKUP ORAZ SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SAMODZIELNEGO
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia:
 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.bip.mzoz.pl Włocławek: ZP/11/2014 Sukcesywna dostawa szczepionek dla MZOZ Sp. z o. o. we Włocławku
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.bip.mzoz.pl Włocławek: ZP/11/2014 Sukcesywna dostawa szczepionek dla MZOZ Sp. z o. o. we Włocławku
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PENTAXIM, proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw błonicy, tężcowi, krztuścowi
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PENTAXIM, proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw błonicy, tężcowi, krztuścowi
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Produkt leczniczy bez ważnego pozwolenia na dopuszczenie do obrotu
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Quintanrix, proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy, tężcowi, krztuścowi (pełnokomórkowa),
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Quintanrix, proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy, tężcowi, krztuścowi (pełnokomórkowa),
DANE O LICZBIE LUDNOŚCI w roku 2018
 DANE O LICZBIE LUDNOŚCI w roku 2018 Nazwa placówki.. Liczba ludności ogółem. Noworodki.. (prognozowana liczba urodzeń w 2018 r.) Liczba dzieci urodzonych w 2017 r.... (prognozowana liczba urodzeń w 2017
DANE O LICZBIE LUDNOŚCI w roku 2018 Nazwa placówki.. Liczba ludności ogółem. Noworodki.. (prognozowana liczba urodzeń w 2018 r.) Liczba dzieci urodzonych w 2017 r.... (prognozowana liczba urodzeń w 2017
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań w ampułkostrzykawce. Szczepionka przeciwko błonicy
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań w ampułkostrzykawce. Szczepionka przeciwko błonicy
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hexacima, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona),
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hexacima, zawiesina do wstrzykiwań w ampułko-strzykawce Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona),
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. nie mniej niż 4 j.m.
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DTP - Szczepionka błoniczo-tężcowo-krztuścowa adsorbowana, zawiesina do wstrzykiwań. Szczepionka przeciw błonicy, tężcowi i krztuścowi,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO DTP - Szczepionka błoniczo-tężcowo-krztuścowa adsorbowana, zawiesina do wstrzykiwań. Szczepionka przeciw błonicy, tężcowi i krztuścowi,
Formularz asortymentowy. oznaczenie sprawy KC/AIDS/270-6/2011
 załącznik nr 1 Formularz asortymentowy nr zadania data dostawy do odbiorców docelowych nazwa i adres odbiorcy docelowego opis przedmiotu zamówienia - 14 dni od daty zawarcia umowy 30-06- 30-09- 15-11-
załącznik nr 1 Formularz asortymentowy nr zadania data dostawy do odbiorców docelowych nazwa i adres odbiorcy docelowego opis przedmiotu zamówienia - 14 dni od daty zawarcia umowy 30-06- 30-09- 15-11-
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia:
 Strona 1 z 9 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.pabianmed.pl Pabianice: Przetrag nieograniczony na dostawę szczepionek dla Samodzielnego
Strona 1 z 9 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.pabianmed.pl Pabianice: Przetrag nieograniczony na dostawę szczepionek dla Samodzielnego
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem
 INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem INFANRIX -IPV+Hib (Vaccinum diphtheriae, tetani et pertussis adsorbatum - Vaccinum poliomyelitidis inactivatum
INFORMACJA O LEKU DLA PACJENTA Należy zapoznać się z właściwościami leku przed zastosowaniem INFANRIX -IPV+Hib (Vaccinum diphtheriae, tetani et pertussis adsorbatum - Vaccinum poliomyelitidis inactivatum
PL B1. GlaxoSmithKline BIOLOGICALS S.A., Rixensart, BE , GB,
 PL 211958 B1 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 211958 (21) Numer zgłoszenia: 374106 (22) Data zgłoszenia: 28.03.2002 (86) Data i numer zgłoszenia
PL 211958 B1 RZECZPOSPOLITA POLSKA Urząd Patentowy Rzeczypospolitej Polskiej (12) OPIS PATENTOWY (19) PL (11) 211958 (21) Numer zgłoszenia: 374106 (22) Data zgłoszenia: 28.03.2002 (86) Data i numer zgłoszenia
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Szczepionka tężcowa adsorbowana (T), zawiesina do wstrzykiwań Szczepionka przeciw tężcowi, adsorbowana 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Szczepionka tężcowa adsorbowana (T), zawiesina do wstrzykiwań Szczepionka przeciw tężcowi, adsorbowana 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY
dres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia:
 dres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.spzozjozefow.pl Józefów: Przedmiotem zamówienia jest sprzedaż i sukcesywna dostawa szczepionek
dres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.spzozjozefow.pl Józefów: Przedmiotem zamówienia jest sprzedaż i sukcesywna dostawa szczepionek
WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE
 WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE Na podstawie analizy dokumentacji wybranych pacjentów szczepionych w NZOZ Przychodni Lekarskiej DOM MED w Pruszkowie
WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE Na podstawie analizy dokumentacji wybranych pacjentów szczepionych w NZOZ Przychodni Lekarskiej DOM MED w Pruszkowie
Formularz asortymentowo-cenowy pełna nazwa Wykonawcy. ... adres siedziby wykonawcy. Nr tel...; Nr faksu...; ... adres do korespondencji
 Nr 1 Nr 2 Nr 3 Nr 4 Nr 5 Nr 6 Nr 7 Nr 8 Nr 9 Nr 10 Nr 11 Nr 12 Nr 13 Nr 14 Nr 15 Nr 16 Samodzielny Publiczny Miejski Zakład Opieki Zdrowotnej 32-700 Bochnia, ul. Floris 16 tel. 14-612-44-67; 14-611-70-28;
Nr 1 Nr 2 Nr 3 Nr 4 Nr 5 Nr 6 Nr 7 Nr 8 Nr 9 Nr 10 Nr 11 Nr 12 Nr 13 Nr 14 Nr 15 Nr 16 Samodzielny Publiczny Miejski Zakład Opieki Zdrowotnej 32-700 Bochnia, ul. Floris 16 tel. 14-612-44-67; 14-611-70-28;
KALKULACJA CENY OFERTY. Część I Szczepionka p/wirusowemu zapaleniu wątroby typu B
 Część I Szczepionka p/wirusowemu zapaleniu wątroby typu B Szczepionka p/wirusowemu zapaleniu wątroby typu B - inaktywowana dla dorosłych i młodzieży powyżej 5 r. ż., cykl szczepień 0-6 m-cy, cykl przyspieszony,
Część I Szczepionka p/wirusowemu zapaleniu wątroby typu B Szczepionka p/wirusowemu zapaleniu wątroby typu B - inaktywowana dla dorosłych i młodzieży powyżej 5 r. ż., cykl szczepień 0-6 m-cy, cykl przyspieszony,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TRIPACEL, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, tężcowi i krztuścowi (bezkomórkowa, złożona), adsorbowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO TRIPACEL, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, tężcowi i krztuścowi (bezkomórkowa, złożona), adsorbowana 2. SKŁAD JAKOŚCIOWY
I. 1) NAZWA I ADRES: SP ZOZ Przychodnia Lekarska, ul. Hallera 21, Starogard Gdański, woj. pomorskie, tel , faks
 Starogard Gdański: ZP/02/14/PN SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SP ZOZ PRZYCHODNIA LEKARSKA W STAROGARDZIE GDAŃSKIM. Numer ogłoszenia: 273704-2014; data zamieszczenia: 18.08.2014 OGŁOSZENIE O ZAMÓWIENIU
Starogard Gdański: ZP/02/14/PN SUKCESYWNA DOSTAWA SZCZEPIONEK DLA SP ZOZ PRZYCHODNIA LEKARSKA W STAROGARDZIE GDAŃSKIM. Numer ogłoszenia: 273704-2014; data zamieszczenia: 18.08.2014 OGŁOSZENIE O ZAMÓWIENIU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. adsorbowany na wodorotlenku glinu, uwodnionym nie więcej niż 0,7 mg Al 3+
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO D - Szczepionka błonicza adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Szczepionka 20 - dawkowa 2. SKŁAD
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO D - Szczepionka błonicza adsorbowana, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, adsorbowana Szczepionka 20 - dawkowa 2. SKŁAD
B. ULOTKA INFORMACYJNA
 B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
B. ULOTKA INFORMACYJNA 1 ULOTKA INFORMACYJNA Versifel FeLV 1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY Podmiot odpowiedzialny: Zoetis
Szczepionka przeciwko anatoksynom błonicy, tężcowi i krztuścowi, adsorbowana Tripedia
 Monika Kurlapska, tłumacz przysięgły języka angielskiego przy Ministerstwie Sprawiedliwości, ul. Jana Kochanowskiego 33 m. 1, 96-500 Sochaczew, tel. kom.: 504 419 939 TŁUMACZENIE POŚWIADCZONE Z JĘZYKA
Monika Kurlapska, tłumacz przysięgły języka angielskiego przy Ministerstwie Sprawiedliwości, ul. Jana Kochanowskiego 33 m. 1, 96-500 Sochaczew, tel. kom.: 504 419 939 TŁUMACZENIE POŚWIADCZONE Z JĘZYKA
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO TETRAXIM, zawiesina do wstrzykiwań w ampułko-strzykawce, Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona) i
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO TETRAXIM, zawiesina do wstrzykiwań w ampułko-strzykawce, Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona) i
Anna Skop. Zachęcam do zapoznania się z prezentacja na temat szczepień.
 W ostatnim tygodniu kwietnia obchodziliśmy Europejski Tydzień Szczepień. Jest to inicjatywa Światowej Organizacji Zdrowia, WHO. W związku z tą inicjatywą w naszej szkole w maju prowadzona jest kampania,
W ostatnim tygodniu kwietnia obchodziliśmy Europejski Tydzień Szczepień. Jest to inicjatywa Światowej Organizacji Zdrowia, WHO. W związku z tą inicjatywą w naszej szkole w maju prowadzona jest kampania,
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy (D), tężcowi (T),
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy (D), tężcowi (T),
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia:
 z 5 2015-06-22 13:01 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.mspzozchelm.pl/przetargi.html Chełm: Sukcesywne dostawy szczepionek do wykonywania
z 5 2015-06-22 13:01 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.mspzozchelm.pl/przetargi.html Chełm: Sukcesywne dostawy szczepionek do wykonywania
Nazwa. Menitorix 5 µg Hib PRP + 12,5 µg TT + 5 µg MenC PSC
 ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCY, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
ANEKS I WYKAZ NAZW, POSTACI FARMACEUTYCZNYCH, MOCY PRODUKTÓW LECZNICZYCH, DRÓG PODANIA, WNIOSKODAWCY, PODMIOTY ODPOWIEDZIALNE POSIADAJĄCE POZWOLENIE NA DOPUSZCZENIE DO OBROTU W PAŃSTWACH CZŁONKOWSKICH
III. INFORMACJE UZUPEŁNIAJĄCE. A. SZCZEPIENIA PRZECIW WIRUSOWEMU ZAPALENIU WĄTROBY TYPU B (WZW typu B)
 III. INFORMACJE UZUPEŁNIAJĄCE A. SZCZEPIENIA PRZECIW WIRUSOWEMU ZAPALENIU WĄTROBY TYPU B (WZW typu B) 1. Szczepienia podstawowe noworodków i niemowląt wykonywane są trzema dawkami szczepionki w cyklu zbliżonym
III. INFORMACJE UZUPEŁNIAJĄCE A. SZCZEPIENIA PRZECIW WIRUSOWEMU ZAPALENIU WĄTROBY TYPU B (WZW typu B) 1. Szczepienia podstawowe noworodków i niemowląt wykonywane są trzema dawkami szczepionki w cyklu zbliżonym
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO ERYSIN SINGLE SHOT, emulsja do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO ERYSIN SINGLE SHOT, emulsja do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań w ampułkostrzykawce Szczepionka skoniugowana przeciw meningokokom
Menitorix, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw haemophilus typ b i meningokokom grupy C, skoniugowana
 1. NAZWA PRODUKTU LECZNICZEGO Menitorix, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw haemophilus typ b i meningokokom grupy C, skoniugowana 2. SKŁAD JAKOŚCIOWY
1. NAZWA PRODUKTU LECZNICZEGO Menitorix, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw haemophilus typ b i meningokokom grupy C, skoniugowana 2. SKŁAD JAKOŚCIOWY
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA HANDLOWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań. Szczepionka przeciwko błonicy (D), tężcowi
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA HANDLOWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzenia zawiesiny do wstrzykiwań. Szczepionka przeciwko błonicy (D), tężcowi
1 dawka (0,5 ml) zawiera: Oligosacharyd Neisseria meningitidis grupy C (szczep C11) 10 mikrogramów sprzężony z białkiem CRM 197
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Meningitec, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum meningococcale classis C coniugatum Szczepionka meningokokowa grupy
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO Meningitec, zawiesina do wstrzykiwań w ampułko-strzykawce Vaccinum meningococcale classis C coniugatum Szczepionka meningokokowa grupy
Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk
 Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk Częste pytania rodziców Dziecko miało kontakt z chorobą zakaźną czy szczepić, czy czekać? Dziecko przebyło infekcję, kiedy i czy szczepić?
Dziecko przebyło infekcję kiedy szczepić? Dr n. med. Ewa Duszczyk Częste pytania rodziców Dziecko miało kontakt z chorobą zakaźną czy szczepić, czy czekać? Dziecko przebyło infekcję, kiedy i czy szczepić?
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Parvoruvax, zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Parvoruvax, zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ(-YCH)
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia:
 Strona 1 z 7 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.mspzoz.metronet.pl Chełm: Sukcesywne dostawy szczepionek do wykonywania szczepień
Strona 1 z 7 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.mspzoz.metronet.pl Chełm: Sukcesywne dostawy szczepionek do wykonywania szczepień
LANGUAGE: NO_DOC_EXT: SOFTWARE VERSION: 9.2.1
 LANGUAGE: PL CATEGORY: ORIG FORM: F02 VERSION: R2.0.9.S01 SENDER: ENOTICES CUSTOMER: WSSEPOZNAN NO_DOC_EXT: 2016-134995 SOFTWARE VERSION: 9.2.1 ORGANISATION: ENOTICES COUNTRY: EU PHONE: / E-mail: miroslaw.piana@wssepoznan.pl
LANGUAGE: PL CATEGORY: ORIG FORM: F02 VERSION: R2.0.9.S01 SENDER: ENOTICES CUSTOMER: WSSEPOZNAN NO_DOC_EXT: 2016-134995 SOFTWARE VERSION: 9.2.1 ORGANISATION: ENOTICES COUNTRY: EU PHONE: / E-mail: miroslaw.piana@wssepoznan.pl
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy (D), tężcowi (T),
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Infanrix hexa, Proszek i zawiesina do sporządzania zawiesiny do wstrzykiwań Szczepionka przeciwko błonicy (D), tężcowi (T),
Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C, W135 i Y
 1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C, W135 i Y 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna
1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C, W135 i Y 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Jedna
Epidemiologia krztuśca w województwie śląskim w latach 2010-2014.
 Epidemiologia krztuśca w województwie śląskim w latach 2010-2014. Krztusiec (Pertussis) zwany potocznie kokluszem, jest ostrą, zakaźną chorobą dróg oddechowych, która szerzy się droga powietrzno-kropelkową.
Epidemiologia krztuśca w województwie śląskim w latach 2010-2014. Krztusiec (Pertussis) zwany potocznie kokluszem, jest ostrą, zakaźną chorobą dróg oddechowych, która szerzy się droga powietrzno-kropelkową.
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C,
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C,
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 12 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ADACEL, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, tężcowi i krztuścowi
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO Strona 1 z 12 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO ADACEL, zawiesina do wstrzykiwań Szczepionka przeciw błonicy, tężcowi i krztuścowi
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Suvaxyn M.hyo - Parasuis, zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Suvaxyn M.hyo - Parasuis, zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU LECZNICZEGO
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia:
 Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.zozwola.pl Warszawa: Sukcesywne dostawy szczepionek Numer ogłoszenia: 354866-2014; data zamieszczenia:
Adres strony internetowej, na której Zamawiający udostępnia Specyfikację Istotnych Warunków Zamówienia: www.zozwola.pl Warszawa: Sukcesywne dostawy szczepionek Numer ogłoszenia: 354866-2014; data zamieszczenia:
ULOTKA DLA PACJENTA. Spis treści ulotki:
 ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem szczepionki. Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. Należy zwrócić się do lekarza lub farmaceuty,
ULOTKA DLA PACJENTA Należy zapoznać się z treścią ulotki przed zastosowaniem szczepionki. Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać. Należy zwrócić się do lekarza lub farmaceuty,
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Porcilis ColiClos zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO Porcilis ColiClos zawiesina do wstrzykiwań dla świń 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY PRODUKTU
Toksoid błoniczy nie mniej niż 20 j.m. 2 Toksoid tężcowy nie mniej niż 40 j.m. 2 Antygeny Bordetella pertussis
 Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacjio bezpieczeństwie. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie
Niniejszy produkt leczniczy będzie dodatkowo monitorowany. Umożliwi to szybkie zidentyfikowanie nowych informacjio bezpieczeństwie. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie
(21) Numer zgłoszenia: (54) Sposób wytwarzania preparatu barwników czerwonych buraka ćwikłowego
 RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19)PL (11)167526 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 292733 (22) Data zgłoszenia: 10.12.1991 (51) IntCl6: C12P 1/00 C12N
RZECZPOSPOLITA POLSKA (12) OPIS PATENTOWY (19)PL (11)167526 (13) B1 Urząd Patentowy Rzeczypospolitej Polskiej (21) Numer zgłoszenia: 292733 (22) Data zgłoszenia: 10.12.1991 (51) IntCl6: C12P 1/00 C12N
(12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP (96) Data i numer zgłoszenia patentu europejskiego:
 RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1968711 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 05.01.2007 07712641.5
RZECZPOSPOLITA POLSKA (12) TŁUMACZENIE PATENTU EUROPEJSKIEGO (19) PL (11) PL/EP 1968711 Urząd Patentowy Rzeczypospolitej Polskiej (96) Data i numer zgłoszenia patentu europejskiego: 05.01.2007 07712641.5
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO POLIORIX, roztwór do wstrzykiwań Vaccinum poliomyelitidis inactivatum Szczepionka przeciw poliomyelitis, inaktywowana 2. SKŁAD JAKOŚCIOWY
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C,
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Menveo proszek i roztwór do sporządzania roztworu do wstrzykiwań Szczepionka skoniugowana przeciwko meningokokom grupy A, C,
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO. Produkt leczniczy bez ważnego pozwolenia na dopuszczenie do obrotu
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Tritanrix HepB, zawiesina do wstrzykiwań Szczepionka przeciwko błonicy (D), tężcowi (T), krztuścowi (pełnokomórkowa) (Pw) oraz
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Tritanrix HepB, zawiesina do wstrzykiwań Szczepionka przeciwko błonicy (D), tężcowi (T), krztuścowi (pełnokomórkowa) (Pw) oraz
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO EUVAX B, 20 mikrogramów, zawiesina do wstrzykiwań Vaccinum hepatitidis B (ADNr) Szczepionka przeciw wirusowemu zapaleniu wątroby typu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO EUVAX B, 20 mikrogramów, zawiesina do wstrzykiwań Vaccinum hepatitidis B (ADNr) Szczepionka przeciw wirusowemu zapaleniu wątroby typu
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 53/2014 z dnia 24 lutego 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Synflorix
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 53/2014 z dnia 24 lutego 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Synflorix
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO EUVAX B, 10 mikrogramów, zawiesina do wstrzykiwań Vaccinum hepatitidis B (ADNr) Szczepionka przeciw wirusowemu zapaleniu wątroby typu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO EUVAX B, 10 mikrogramów, zawiesina do wstrzykiwań Vaccinum hepatitidis B (ADNr) Szczepionka przeciw wirusowemu zapaleniu wątroby typu
SPECYFIKACJA ISTOTNYCH WARUNKÓW ZAMÓWIENIA
 spr. Nr ZP-I/07/10 SPECYFIKACJA ISTOTNYCH WARUNKÓW ZAMÓWIENIA Samodzielny Zespół Publicznych Zakładów Lecznictwa Otwartego Warszawa Ochota, 02-353 Warszawa, ul. Szczęśliwicka 36, tel. 22 822-88-53, fax.
spr. Nr ZP-I/07/10 SPECYFIKACJA ISTOTNYCH WARUNKÓW ZAMÓWIENIA Samodzielny Zespół Publicznych Zakładów Lecznictwa Otwartego Warszawa Ochota, 02-353 Warszawa, ul. Szczęśliwicka 36, tel. 22 822-88-53, fax.
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO BioBos Respi 4, zawiesina do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO 1 1. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO BioBos Respi 4, zawiesina do wstrzykiwań dla bydła 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNYCH
