Agencja Oceny Technologii Medycznych
|
|
|
- Władysława Wolska
- 9 lat temu
- Przeglądów:
Transkrypt
1 Agencja Oceny Technologii Medycznych Rekomendacja nr 53/2014 z dnia 24 lutego 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Synflorix (polisacharyd pneumokokowy serotyp 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F, 23F) we wskazaniu: czynne uodpornienie przeciwko chorobie inwazyjnej, zapaleniu płuc oraz ostremu zapaleniu ucha środkowego wywołanym przez Streptococcus pneumoniae u niemowląt rozpoczynających cykl szczepień od ukończenia 6 tygodnia życia do 6 miesiąca życia (schemat 3 + 1) Prezes Agencji rekomenduje objęcie refundacją produktu leczniczego Synflorix (polisacharyd pneumokokowy serotyp 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F, 23F) we wskazaniu: czynne uodpornienie przeciwko chorobie inwazyjnej, zapaleniu płuc oraz ostremu zapaleniu ucha środkowego wywołanym przez Streptococcus pneumoniae u niemowląt rozpoczynających cykl szczepień od ukończenia 6 tygodnia życia do 6 miesiąca życia (schemat 3 + 1), Uzasadnienie rekomendacji Prezes Agencji, uważa, że dostępne dowody naukowe w postaci wyników badań RCT, potwierdzają skuteczność i bezpieczeństwo stosowania leku we wnioskowanym wskazaniu. Światowa Organizacja Zdrowia (WHO) zaleca wprowadzenie szczepień przeciwko pneumokokom, również w opinii ekspertów klinicznych jest pilna potrzeba zwiększenia dostępności do szczepionek przeciwko pneumokokom wobec adekwatnej sytuacji epidemiologicznej w Polsce. Wczesna wyszczepialność dzieci zmniejsza ryzyko zachorowania na zapalenie płuc w wieku senioralnym, co ma istotne znaczenie w szczególności w odniesieniu do rosnącej oporności pneumokoków na antybiotykoterapię penicyliną. Odnalezione rekomendacje kliniczne potwierdzają zasadność finansowania ze środków publicznych szczepionki Synflorix. Agencja Oceny Technologii Medycznych ul. I. Krasickiego 26, Warszawa tel fax NIP REGON sekretariat@aotm.gov.pl
2 Przedmiot wniosku Podmiot odpowiedzialny, we wniosku o objęcie refundacją i ustalenie urzędowej ceny zbytu leku, zaproponował dla produktu leczniczego Synflorix cenę zbytu netto w wysokości Proponowana kategoria dostępności: dostępny w aptece na receptę we wskazaniu określonym stanem klinicznym: Czynne uodpornienie przeciwko chorobie inwazyjnej, zapaleniu płuc oraz ostremu zapaleniu ucha środkowego wywołanym przez Streptococcus pneumoniae u niemowląt rozpoczynających cykl szczepień od ukończenia 6 tygodnia życia do 6 miesiąca życia (schemat 3 + 1), Problem zdrowotny Streptococcus pneumoniae (pneumokoki, dwoinki zapalenia płuc) są patogenem, wywołującym zakażenia zarówno u dzieci, jak i dorosłych, które mogą przebiegać pod postacią inwazyjnej choroby pneumokokowej (IChP). Bakterie przenoszone są drogą kropelkową, a źródło zakażenia stanowi nosiciel. Inwazyjna choroba pneumokokowa stanowi zagrożenie dla życia i może mieć trudne do leczenia postacie: bakteriemia (zakażenie krwi), posocznica (sepsa), zapalenie opon mózgowo - rdzeniowych, zapalenie kości, stawów lub otrzewnej. Według danych Światowej Organizacji Zdrowia (WHO) i Pediatrycznego Zespołu Ekspertów do spraw Programu Szczepień Ochronnych zapadalność na IChP na terenie Polski u dzieci do 2 roku życia wynosi 19/100 tys., a do 5 roku życia 17,6/100 tys.; w grupie 2-5 lat 5,8/100 tys. Najlepszą metodą zapobiegania zachorowaniom jest szczepienie dzieci szczepionką przeciwko pneumokokom. Działanie szczepionki polega na wytworzeniu w organizmie swoistych przeciwciał przeciw bakteriom, co chroni dziecko przed zachorowaniem. Dostępne są dwa typy szczepionek przeciwko S. pneumoniae: poliwalentna szczepionka polisacharydowa (PPV Pneumococcal Polysacharide Vaccine), zawierająca 23 serotypy pneumokoków PPV-23, oraz skoniugowana (PCV - Pneumococcal Conjugate Vaccine) sprzężona z białkiem, trzynastowalentna PCV-13 oraz dziesięciowalentna PHiD-CV. Populację docelową dla wnioskowanej technologii stanowią zdrowe niemowlęta w wieku od ukończenia 6. tygodnia życia do ukończenia 6. miesiąca życia (predysponowane do zastosowania pełnego schematu szczepień, 3+1 w przypadku indywidualnych szczepień). Zgodnie z wnioskowanym wskazaniem w ramach niniejszej analizy pominięto również niemowlęta i dzieci w wieku od 2. miesiąca życia do 5. roku życia z grup wysokiego ryzyka, gdyż wśród nich realizowane są szczepienia przeciw pneumokokom w ramach Programu Szczepień Ochronnych. Wnioskodawca oszacował liczbę pacjentów ze wskazaniem określonym we wniosku na około 330 tys w skali roku. Opis wnioskowanego świadczenia Synflorix jest to polisacharydowa, skoniugowana, adsorbowana szczepionka przeciw pneumokokom. Należy do grupy farmakoterapeutycznej: szczepionki przeciw pneumokokom, o kodzie ATC: J07AL52. Jedna dawka (0,5 ml) zawiera: - Polisacharyd pneumokokowy serotyp 11,2 1 mikrogram - Polisacharyd pneumokokowy serotyp 41,2 3 mikrogramy 2
3 - Polisacharyd pneumokokowy serotyp 51,2 1 mikrogram - Polisacharyd pneumokokowy serotyp 6B1,2 1 mikrogram - Polisacharyd pneumokokowy serotyp 7F1,2 1 mikrogram - Polisacharyd pneumokokowy serotyp 9V1,2 1 mikrogram - Polisacharyd pneumokokowy serotyp 141,2 1 mikrogram - Polisacharyd pneumokokowy serotyp 18C1,3 3 mikrogramy - Polisacharyd pneumokokowy serotyp 19F1,4 3 mikrogramy - Polisacharyd pneumokokowy serotyp 23F1,2 1 mikrogram Alternatywna technologia medyczna Do alternatywnych technologii lekowych najczęściej rekomendowanych i stosowanych we wskazaniu: czynne uodpornienie przeciwko chorobie inwazyjnej, zapaleniu płuc oraz ostremu zapaleniu ucha środkowego wywołanym przez Streptococcus pneumoniae należą: szczepionki przeciwpneumokokowe stosowane w ramach profilaktyki zakażeń pneumokokowych, w tym szczepionki skoniugowane oraz szczepionki polisacharydowe. Obecnie wśród dostępnych w Polsce szczepionek przeciwko S. pneumoniae, poza wnioskowaną technologią wyróżnia się: Pneumovax 23 (Polyvaccinum pneumococcicum), szczepionka 23-walentna, polisacharydowa przeznaczona dla dzieci po 2 roku życia i dorosłych z grup ryzyka, szczepienie jednorazowe, ewentualna konieczność doszczepienia po 3-5 latach. Pneumo 23 (Polyvaccinum pneumococcicum), szczepionka 23-walentna, polisacharydowa przeznaczona dla dzieci po 2 roku życia i dorosłych z grup ryzyka, szczepienie jednorazowe, ewentualna konieczność doszczepienia po 3-5 latach. Prevenar (Pneumococcal saccharide conjug., vaccine), szczepionka 7-walentna, polisacharydowa, skoniugowana przeznaczona dla dzieci od 2 miesiąca życia do 5 roku życia, maksymalnie 3 dawki + dawka uzupełniająca Prevenar 13 (Pneumococcal saccharide conjug., vaccine), szczepionka 13-walentna, polisacharydowa, skoniugowana przeznaczona dla dzieci od 6 tygodnia życia do 5 roku życia, maksymalnie 3 dawki + dawka uzupełniająca. Skuteczność kliniczna Skuteczność kliniczna PHiD-CV w schemacie 3+1 była istotnie statystycznie (p<0,05) większa od szczepionki niezawierającej antygenów pneumokokowych w zakresie redukcji ryzyka zachorowania na pierwszy epizod: zapalenia płuc według definicji WHO o 23%, bakteryjnego zapalenia płuc o 18%, potwierdzonego radiologicznie zapalenia płuc o 10% w okresie obserwacji 33 miesięcy (średnia). PHiD-CV istotnie statystycznie (p<0,05) zmniejszała ryzyko zachorowania na inwazyjną chorobę pneumokokową wywołaną przez serotypy zawarte w PHiD-CV (skuteczność szczepionki 100%) i pierwszy epizod ostrego zapalenia ucha środkowego wywołanego przez serotypy zawarte w PHiD-CV lub przez jakikolwiek serotyp pneumokoka (skuteczność szczepionki 56% i 70%) lub klinicznie potwierdzonego ostrego zapalenia ucha środkowego (skuteczność 19%) w porównaniu ze szczepionką niezawierającej antygenów pneumokokowych w okresie obserwacji wynoszącym 33 miesiące (średnia). PHiD-CV podawana w schemacie 3+0 (trzy dawki do 6 miesiąca życia) była istotnie statystycznie (p<0,05) bardziej immunogenna w porównaniu ze szczepionki niezawierającej antygenów pneumokokowych, w odniesieniu do odsetka dzieci, który osiągnął minimalne stężenie ochronne ( 0,20 µg/ml, mierzone w teście ELISA) oraz aktywność opsonofagocytarną w mianie 8 (mierzoną w teście OPA) przeciwciał skierowanych przeciw wszystkim analizowanym serotypom pneumokokowym zawartym w szczepionce PHiD-CV (1., 4., 5., 6B., 7F., 9V., 14., 18C., 19F., 23F), jak i dodatkowym serotypom 6A. i 19A. (w ramach odporności krzyżowej). 3
4 PHiD-CV w schemacie 3+1 była istotnie statystycznie (p<0,05) bardziej immunogenna od szczepionki niezawierającej antygenów pneumokokowych w odniesieniu do odsetka dzieci, które osiągnęły minimalne stężenie ochronne ( 0,20 µg/ml) wszystkich analizowanych przeciwciał (przeciw serotypom zawartym w szczepionce PHiD-CV: 1., 4., 5., 6B., 7F., 9V., 14., 18C., 19F., 23F. i serotypom 6A. i 19A. w ramach odporności krzyżowej). PHiD-CV istotnie statystycznie (p<0,05) skuteczniej redukowała nosicielstwo pneumokoków w porównaniu ze szczepionką niezawierającą antygenów pneumokokowych. PHiD-CV w schemacie 3+1 w porównaniu z PHiD-CV w schemacie 2+1 w populacji ogólnej (porównanie bezpośrednie), PHiD-CV jest podobnie immunogenna, w odniesieniu do odsetka dzieci, które osiągnęły: minimalne stężenie ochronne 0,20 µg/ml oraz aktywność opsonofagocytarną w mianie 8 przeciwciał przeciw serotypom pneumokokowym zawartym w szczepionce PHiD-CV, jak i dodatkowym serotypom 6A. i 19A. (w ramach odporności krzyżowej), z wyjątkiem istotnego statystycznie większego (p<0,05) odsetka dzieci, które osiągnęły aktywność opsonofagocytarną w mianie 8 przeciwciał przeciw serotypom: 5., 6B., 23F. i 19A. w schemacie 3+1. W porównaniu PHiD-CV z PCV13 poprzez wspólny komparator PCV7 w schemacie 3+0 do 6 miesiąca życia (porównanie pośrednie), zastosowanie PHiD-CV istotnie statystycznie zwiększyło odsetek dzieci, które osiągnęły zakładane minimalne stężenie ochronne przeciwciał mierzone w teście ELISA dla antygenu serotypu pneumokokowego 5, 6B i 23F. Obie szczepionki PHiD-CV i PCV13 indukowały u podobnego odsetka zaszczepionych dzieci produkcję zakładanego minimalnego stężenia ochronnego przeciwciał mierzonego w teście ELISA dla antygenów pneumokokowych serotypów: 1., 4., 7F., 9V., 14., 18C. i 19F. Zastosowanie PHiD-CV w porównaniu z PCV13 istotnie statystycznie zwiększyło odsetek dzieci, które osiągnęły aktywność opsonofagocytarną w mianie 8 mierzoną w teście OPA przeciwciał anty-7f oraz istotnie statystycznie zmniejszyło odsetek dzieci, które osiągnęły aktywność opsonofagocytarną w mianie 8 mierzoną w teście OPA przeciwciał: anty-1, anty-6b, anty-18c i anty-23f. PHiD-CV w odniesieniu do PCV13 była równie immunogenna w zakresie aktywności opsonofagocytarnej w mianie 8 mierzonej w teście OPA przeciwciał: anty-4, anty-5, anty-9v, anty-14, anty-19f. Zastosowanie PHiD-CV w porównaniu z PCV13, wiązało się z istotnie statystycznie mniejszymi wartościami średniej geometrycznej stężenia (GMC) mierzonej w teście ELISA przeciwciał: anty-1, anty-4, anty-6b, anty-9v, anty-14 oraz anty-23f. PHiD-CV istotnie statystycznie zwiększało wartość średniej geometrycznej stężenia (GMC) mierzonej w teście ELISA przeciwciał anty-5 w odniesieniu do zastosowania szczepionki PCV13. W przypadku wartości średniej geometrycznej stężenia (GMC) mierzonej w teście ELISA pozostałych przeciwciał: anty-7f, anty-18c, anty-19f, nie wykazano istotnych statystycznie różnic. Szczepienie PHiD-CV wiązało się z istotnie statystycznie mniejszymi wartościami średniej geometrycznej miana opsonofagocytarnego (GMT) mierzonego w teście OPA przeciwciał: anty-1, anty-5, anty-6b, anty-23f, oraz z istotnie statystycznie większymi wartościami średniej geometrycznej miana opsonofagocytarnego (GMT) mierzonego w teście OPA przeciwciał anty-19f w odniesieniu do zastosowania szczepionki PCV13. Nie stwierdzono istotnych statystycznie różnic w wartościach średniej geometrycznej miana opsonofagocytarnego (GMT) mierzonego w teście OPA pozostałych przeciwciał: anty-4, anty-7f, anty-9v, anty-14 i anty-18c. PHiD-CV była istotnie statystycznie mniej immunogenna w porównaniu z PCV13, w odniesieniu do odsetka dzieci, które osiągnęły aktywność opsonofagocytarną w mianie 8 przeciwciał mierzoną w teście OPA oraz do wartości średniej geometrycznej miana opsonofagocytarnego przeciwciał (GMT) mierzonego w teście OPA skierowanych przeciwko serotypowi 6 A i 19A (szczepionka PHiD-CV nie zawiera wymienionych serotypów). PHiD-CV okazała się równie immunogenna, co szczepionka PCV13, jedynie w przypadku odsetka dzieci, które osiągnęły wymagane minimalne stężenie ochronne przeciwciał mierzone w teście ELISA i wartości średniej geometrycznej stężenia przeciwciał (GMC) mierzonej w teście ELISA skierowanych przeciwko serotypowi 19A, pomimo braku antygenu serotypu 19A w składzie PHiD-CV. Zjawisko odporności krzyżowej istniejącej między serotypem 19F obecnym w PHiD-CV oraz serotypem 19A. 4
5 obecnym w PCV13, może odpowiadać za podobną immunogenność obu szczepionek w odniesieniu do serotypu 19A. Podsumowując zestawienie wyników porównania pośredniego szczepionki PHiD-CV ze szczepionką PCV13 wykazało, że istotna klinicznie różnica w immunogenności mierzonej w teście ELISA i OPA porównywanych szczepionek dotyczyć będzie prawdopodobnie następujących serotypów Streptococcus pneumoniae: 1., 4., 6B., 9V., 14., 18C., 23F., 6A. i 19A. na korzyść szczepionki PCV13 oraz 7F. i 19F. na korzyść szczepionki PHiD-CV. Zastosowanie PHiD-CV w porównaniu z PCV13 poprzez wspólny komparator PCV7 w schemacie 3 dawek do 6 miesiąca życia i dawki uzupełniającej w miesiącu życia (porównanie pośrednie) istotnie statystycznie zwiększyło (p<0,05) odsetek dzieci, które osiągnęły minimalne stężenie ochronne przeciwciał mierzone w teście ELISA skierowanych przeciw serotypowi 5. Nie wykazano istotnych statystycznie różnic (p>0,05) odnośnie do immunogenności mierzonej w teście ELISA w oparciu o odsetek dzieci, które osiągnęły minimalne stężenie ochronne pozostałych przeciwciał: anty-1, anty-4, anty-6b, anty-7f, anty-9v, anty-14, anty-18c, anty-19f oraz anty-23f. Zastosowanie PHiD-CV w porównaniu z PCV13, nie wpływało istotnie statystycznie na immunogenność mierzoną w teście OPA w oparciu o odsetek dzieci, które osiągnęły aktywności opsonofagocytarną w mianie 8 wszystkich analizowanych przeciwciał (anty-1, anty-4, anty-5, anty- 6B, anty-7f, anty-9v, anty-14, anty-18c, anty-19f oraz anty-23f). Zastosowanie PHiD-CV w porównaniu z PCV13, wiązało się z istotnie statystycznie większą immunogennością mierzoną (w teście ELISA) średnią geometryczną stężenia przeciwciał (GMC): anty- 5, anty-7f, anty-18c i anty-19f oraz z istotnie statystycznie mniejszą immunogennością mierzoną średnią geometryczną stężenia przeciwciał: anty-6b, anty-9v, anty-14 oraz anty-23f. W przypadku średniej geometrycznej stężenia (GMC) pozostałych przeciwciał: anty-1 i anty-4, nie wykazano istotnych statystycznie różnic. Zastosowanie PHiD-CV w porównaniu z PCV13, wiązało się z istotnie statystycznie mniejszą immunogennością mierzoną (w teście OPA) średnią geometryczną miana opsonofagocytarnego (GMT) przeciwciał: anty-5, anty-6b, anty-9v i anty-23f. W przypadku średniej geometrycznej miana opsonofagocytarnego pozostałych przeciwciał: anty-1, anty-4, anty-7f, anty-14, anty-18c i anty-19f, nie wykazano istotnych statystycznie różnic. Wykazano istotnie statystycznie mniejszą immunogenność PHiD-CV w porównaniu z PCV13, w odniesieniu do odsetka dzieci, które osiągnęły minimalne stężenie ochronne i aktywność opsonofagocytarną w mianie 8 przeciwciał oraz wartości średniej geometrycznej stężenia (GMC) i średniej geometrycznej miana opsonofagocytarnego (GMT) przeciwciał skierowanych przeciwko serotypowi 6A. PHiD-CV w odniesieniu do PCV13, była istotnie statystycznie mniej immunogenna w odniesieniu do wartości średniej geometrycznej miana opsonofagocytarnego (GMT) przeciwciał skierowanych przeciwko serotypowi 19A (PHiD-CV, w odróżnieniu do szczepionki PCV13, nie zawiera wymienionych serotypów). Brak istotnych statystycznie różnic odnośnie immunogenności szczepionek mierzonej na podstawie odsetka dzieci, które osiągnęły minimalne stężenie ochronne przeciwciał i wartości średniej geometrycznej stężenia (GMC) przeciwciał skierowanych przeciwko serotypowi 19A, pomimo braku tego serotypu w składzie szczepionki PHiD-CV. Zjawisko odporności krzyżowej istniejącej między serotypem 19F. obecnym w szczepionce PHiD-CV oraz serotypem 19A. obecnym w szczepionce PCV13, może odpowiadać za podobną immunogenność obu szczepionek w odniesieniu do serotypu 19A. Wykazano istotnie statystycznie większą immunogenność PHiD-CV w odniesieniu do PCV13 w zakresie indukcji produkcji zakładanego minimalnego stężenia ochronnego przeciwciał skierowanych przeciwko serotypowi 19A.. Uzyskany wynik może być efektem istotnych statystycznie heterogeniczności uwzględnionych badań, jak również ograniczeń metodologicznych związanych z przeprowadzeniem porównania pośredniego. Na uzyskany wynik wpłynąć również mogło zjawisko odporności krzyżowej, opisane powyżej. 5
6 Podsumowując w ramach zestawienia wyników porównania pośredniego PHiD-CV i PCV13, istotna klinicznie różnica w immunogenności porównywanych szczepionek dotyczyć będzie następujących serotypów Streptococcus pneumoniae: 7F., 18C., 19F. na korzyść szczepionki PHiD-CV, 6B., 9V., 14., 23F., 6A., 19A. na korzyść szczepionki PCV13 oraz brak różnic w odniesieniu do serotypów 1. i 4. PHiD-CV w zestawieniu z PCV13 w schemacie 3+0 (porównanie bezpośrednie na podstawie nieopublikowanych wyników przedstawionych przez Wnioskodawcę), okazała się istotnie statystycznie (p<0,05) mniej immunogenna w zakresie odsetka dzieci, które osiągnęły minimalne stężenie ochronne przeciwciał skierowanych przeciw antygenom pneumokokowym serotypów: 23F., 3., 6A. i 19A., po podaniu 3 dawek szczepionki. Mniejsza immunogenność i PHiD-CV w zestawieniu z PCV13 w odniesieniu do serotypów 3., 6A. i 19A. wynika z ich braku w składzie PHiD-CV. W przypadku pozostałych analizowanych przeciwciał skierowanych przeciw antygenom serotypów pneumokokowych: 1., 4., 5., 6B., 7F., 9V., 14., 18C., 19F., nie stwierdzono istotnych statystycznie różnic (p>0,05) w zakresie immunogenności szczepionek PHiD-CV i PCV13, mierzonej w teście ELISA produkcją minimalnego stężenia ochronnego ( 0,2 µg/ml) przeciwciał. PHiD-CV okazała się istotnie statystycznie (p<0,05) mniej immunogenna w porównaniu z PCV13 w odniesieniu do odsetka dzieci, które osiągnęły aktywność opsonofagocytarną w mianie 8 przeciwciał skierowanych przeciw antygenom pneumokokowym serotypów: 3., 6A., 19A., po podaniu 3 dawek szczepionki, co jest konsekwencją nieobecności tych antygenów w składzie PHiD-CV. W przypadku pozostałych, wspólnych dla obu szczepionek (PHiD-CV i PCV13) przeciwciał skierowanych przeciw antygenom serotypów pneumokokowych: 1., 4., 5., 6B., 7F., 9V., 14., 18C., 19F., 23F., nie stwierdzono istotnych statystycznie różnic (p>0,05) w zakresie immunogenności, mierzonej za pomocą aktywności opsonofagocytarnej w mianie 8 przeciwciał. Skuteczność praktyczna Skuteczność rzeczywista szczepionki PHiD-CV w schemacie 3+0 / 3+1 w porównaniu ze szczepionką niezawierającą antygenów pneumokokowych w populacji ogólnej (porównanie bezpośrednie) była istotnie statystycznie (p<0,05) większa w odniesieniu do redukcji ryzyka zachorowania na: inwazyjną chorobę pneumokokową wywołaną przez serotypy zawarte w szczepionce PHiD-CV (skuteczność szczepionki 100%) i zapalenie płuc (skuteczność szczepionki 25,2%) w okresie obserwacji 25 miesięcy (średnia, zakres miesięcy). Obserwowano trend w kierunku większej skuteczności PHiD-CV (NS, p>0,05) względem szczepionki niezawierającej antygenów pneumokokowych w redukcji ryzyka zachorowania na ostre zapalenie ucha środkowego (skuteczność szczepionki 14%), nawrotu ostrego zapalenia ucha środkowego (skuteczność szczepionki 5,2%) oraz wystąpienia 1 epizodu ostrego zapalenia ucha środkowego wymagającego antybiotykoterapii (skuteczność szczepionki 13,5%). Bezpieczeństwo stosowania Według Charakterystyki Produktu Leczniczego (ChPL) Synflorix, do bardzo częstych ( 1/10) możliwych działań niepożądanych stosowania szczepionki zalicza się: ból, zaczerwienienie, obrzęk w miejscu iniekcji, gorączkę 38 C (wiek < 2 lata), senność, drażliwość, utratę łaknienia. Często ( 1/100 do <1/10) odnotowuje się: stwardnienie w miejscu ukłucia, gorączka >39 C (wiek < 2 lat), gorączkę 38 C (wiek 2 do 5 lat). Niezbyt często ( 1/1000 do < 1/100) obserwuje się biegunkę, wymioty, bezdech u bardzo niedojrzałych wcześniaków ( 28 tygodnia ciąży), ból głowy, nudności, gorączkę >40 C (wiek < 2 lat), gorączka >39 C (wiek 2 do 5 lat), rozlany obrzęk kończyny, w którą podano szczepionkę, czasem obejmujący sąsiedni staw, w miejscu ukłucia: krwiaki, krwawienie, guzek, świąd. Rzadko ( 1/ do <1/1 000) można zaobserwować reakcje alergiczne (takie jak alergiczne zapalenie skóry, atopowe zapalenie skóry, wyprysk), nietypowy płacz, drgawki (w tym drgawki gorączkowe), wysypka, pokrzywka, oraz epizody hipotoniczno-hiporeaktywne. Bardzo rzadko (<1/10000) natomiast występuje obrzęk naczynio-ruchowy i anafilaksja. PHiD-CV w schemacie 3+0 w porównaniu ze szczepionką niezawierającej antygenów pneumokokowych w populacji ogólnej (porównanie bezpośrednie) jest porównywalnie (p>0,05) bezpieczna i dobrze tolerowana, w odniesieniu do ryzyka wystąpienia następujących działań niepożądanych: bólu, zaczerwienienia lub obrzęku w miejscu iniekcji oraz gorączki. 6
7 W zakresie częstości występowania miejscowych i uogólnionych działań niepożądanych szczepionka PHiD-CV istotnie częściej wywołała: ospałość (p<0,0001), drażliwość (p<0,0001) i utratę apetytu (p<0,0001). Nie stwierdzono istotnych statystycznie różnic w częstości występowania ciężkich działań niepożądanych w grupie otrzymującej PHiD-CV w porównaniu z grupą otrzymującą szczepionkę niezawierającej antygenów pneumokokowych po podaniu 3 dawek (szczepienie pierwotne) w okresie obserwacji 3-5 miesięcy. W porównaniu PHiD-CV w schemacie 3+1 ze szczepionką niezawierającą antygenów pneumokokowych w populacji ogólnej (porównanie bezpośrednie), nie wykazano istotnej różnicy w ryzyku wystąpienia ciężkich działań niepożądanych w badanych grupach po podaniu 4 dawek w okresie obserwacji 18 miesięcy od przyjęcia 1. dawki szczepionki. PHiD-CV podawana w schemacie 3+1 w okresie 4 dni od podania 4 dawki, w porównaniu ze szczepionką niezawierającą antygenów pneumokokowych, istotnie statystycznie częściej wywoływała: ból, zaczerwienienie lub obrzęk w miejscu iniekcji, gorączkę co najmniej 38 C, drażliwość, utratę apetytu ospałość. W odniesieniu do występowania ciężkich działań niepożądanych w grupie badanej szczepionej PHiD- CV w schemacie 3+1, w porównaniu z grupą kontrolną otrzymującą szczepionkę niezawierającą antygenów pneumokokowych, odnotowano istotnie statystycznie (p<0,05): mniejszy odsetek dzieci, u których wystąpiły drgawki gorączkowe, większy odsetek dzieci, u których wystąpiło zapalenie płuc. W grupie przyjmującej PHiD-CV w schemacie 3+1, w odniesieniu do grupy kontrolnej otrzymującej szczepionkę niezawierającą antygenów pneumokokowych, ryzyko wystąpienia poszczególnych ciężkich działań niepożądanych było podobne w odniesieniu do: ciężkich działań niepożądanych (ogółem), ciężkich działań niepożądanych związanych z zastosowanym leczeniem, ciężkich działań niepożądanych prowadzących do zgonu oraz nieżytu żołądka i jelit, zapalenia oskrzelików, odwodnienia, przełomu astmatycznego, niedrożności oskrzeli, zapalenia oskrzeli, w okresie obserwacji 33 miesięcy (średnia) od przyjęcia 1. dawki szczepień pierwotnych. PHiD-CV w schemacie 3+1 w porównaniu z PHiD-CV w schemacie 2+1 w populacji ogólnej (porównanie bezpośrednie), wywołała istotnie statystycznie większe ryzyko wystąpienia po szczepieniu: zaczerwienienia w miejscu iniekcji (p=0,001), gorączki co najmniej 38,5 C (p=0,01), drażliwości (p<0,0001), utraty apetytu (p=0,0003),ospałości (p=0,0008). Szczepionka podawana w trzech dawkach w grupie badanej w odniesieniu do szczepionki podawanej w dwóch dawkach w grupie kontrolnej nie wpłynęła na ryzyko wystąpienia działań niepożądanych tj. ból w miejscu iniekcji czy obrzęk w miejscu iniekcji. Stosowanie 4 dawki PHiD-CV w porównaniu z 3 dawką PHiD-CV wiąże się z mniejszym ryzykiem wystąpienia: bólu w miejscu iniekcji (p=0,0009), zaczerwienienia w miejscu iniekcji (p=0,046), gorączki co najmniej 38,5 C (p=0,002),ospałości (p=0,02). Ponadto, podanie 4 dawki szczepionki nie wpłynęło również na wystąpienie ciężkich działań niepożądanych. Porównanie PHiD-CV z PCV13 poprzez wspólny komparator PCV7 w schemacie 3+0 do 6 miesiąca życia (porównanie pośrednie), wykazało, że obie szczepionki mają zbliżone działanie w zakresie częstości występowania: zaczerwienienia lub obrzęku w miejscu iniekcji oraz ospałości, drażliwości, utraty apetytu lub gorączki po każdej dawce szczepionki, jak również występowania bólu w miejscu iniekcji po 2. dawce szczepionki. PHiD-CV, w porównaniu z PCV13, wywoływała istotnie częściej ból w miejscu iniekcji po 1. dawce szczepionki oraz rzadziej ból w miejscu iniekcji po 3. dawce szczepionki w okresie obserwacji 4-15 dni do szczepienia. Nie wykazano różnic w zakresie ryzyka wystąpienia ciężkich działań niepożądanych po 3 dawkach szczepionki (szczepienie pierwotne) w okresie obserwacji 3-5 miesięcy. Porównanie PHiD-CV z PCV13 poprzez wspólny komparator PCV7 w schemacie 3 dawek do 6 miesiąca życia i dawki uzupełniającej w miesiąca życia (porównanie pośrednie), wykazało, że zastosowanie PHiD-CV istotnie zwiększało ryzyko wystąpienia bólu w miejscu iniekcji po 4 dawce w stosunku do zastosowania PCV13 w okresie obserwacji 4 dni po zaszczepieniu. W zakresie występowania innych działań niepożądanych, po 4 dawce (uzupełniającej) szczepionki, tj. zaczerwienienie w miejscu iniekcji, obrzęk w miejscu iniekcji, drażliwość, ospałość, gorączka, utrata 7
8 apetytu nie wykazano istotnej różnicy pomiędzy analizowanymi grupami. Nie wykazano również istotnej różnicy pomiędzy badanymi grupami w zakresie ryzyka wystąpienia ciężkich działań niepożądanych po 4. dawce (uzupełniającej) szczepionki w okresie obserwacji 1 miesiąca. W porównaniu PHiD-CV z PCV13 w schemacie 3+0 (porównanie bezpośrednie na podstawie nieopublikowanych wyników przedstawionych przez Wnioskodawcę), PHiD-CV istotnie zwiększało ryzyko wystąpienia gorączki po podaniu 1. dawki w okresie obserwacji 7 dni. W przypadku innych analizowanych działań niepożądanych tj. ból, zaczerwienienie, obrzęk w miejscu iniekcji, ospałość, drażliwość lub utrata apetytu nie stwierdzono różnic pomiędzy ocenianymi szczepionkami. Nie wykazano również różnic w częstości występowania ciężkich działań niepożądanych po podaniu 3 dawek. Propozycje instrumentów dzielenia ryzyka Stosunek kosztów do uzyskiwanych efektów zdrowotnych Analiza kosztów-użyteczności została wykonana w dożywotnim horyzoncie czasowym z perspektywy płatnika (NFZ), perspektywy wspólnej (NFZ i pacjent) dla porównania szczepionki Synflorix z brakiem szczepienia oraz ze szczepionką Prevenar 13 wśród zdrowych dzieci predysponowanych do pełnego schematu podstawowego szczepienia przeciw pneumokokom (niemowlęta od ukończenia 6. tygodnia do 6. miesiąca życia schemat 3 dawek podstawowych i dawki przypominającej, tj. 3+1). 8
9 Wskazanie czy zachodzą okoliczności, o których mowa w art. 13 ust. 3 ustawy z dnia 12 maja 2011 r. o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych (Dz. U. nr 122, poz.696 z późn. zm.) Wpływ na budżet płatnika publicznego Celem analizy wpływu na budżet była ocena wpływu na system ochrony zdrowia podjęcia decyzji o finansowaniu ze środków publicznych w ramach Wykazu refundowanych leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych produktu leczniczego Synflorix stosowanego w szczepieniach przeciw zakażeniom Streptococuss pneumoniae wśród zdrowych niemowląt rozpoczynających cykl szczepień w wieku od 6. tygodnia do 6. miesiąca życia, w kolejnych trzech latach refundacji. Wydatki z budżetu płatnika publicznego (NFZ) przeznaczone na refundację produktu Synflorix stosowanego w szczepieniach przeciw pneumokokom niemowląt w wieku od 6. tygodnia do 6. miesiąca życia, przy uwzględnieniu proponowanego sposobu. Uwagi do proponowanego instrumentu dzielenia ryzyka. 9
10 Uwagi do zapisów programu lekowego Nie dotyczy. Omówienie rozwiązań proponowanych w analizie racjonalizacyjnej ). Omówienie rekomendacji wydawanych w innych krajach w odniesieniu do ocenianej technologii Odnaleziono łącznie 4 rekomendacje kliniczne dotyczące stosowania szczepionek PHiD-CV10 lub PCV13 u dzieci w wieku od 6. tygodnia życia do 5. roku życia w profilaktyce zakażeń pneumokokowych, wydane przez Krajowy Ośrodek Referencyjny ds. Diagnostyki Bakteryjnych Zakażeń Ośrodkowego Układu Nerwowego (KOROUN 2011), Pediatryczny Zespół Ekspertów ds. Programu Szczepień Ochronnych (2010), Australian Technical Advisory Group on Immunisatio (ATAGI 2013), World Health Organization (WHO 2012).. W przypadku PVC-10 zaleca się schemat 3+1 w 2, 4 i 6 miesiącu życia oraz dawkę uzupełniającą w miesiąca życia W przypadku PVC-13 zaleca się schemat 3+0 w 2, 4 i 6 miesiącu życia, dawka uzupełniająca rekomendowana jest u dzieci z grup podwyższonego ryzyka. Odnaleziono łącznie 2 rekomendacje refundacyjne. Nowozelandzki Pharmacology and Therapeutics Advisory Committee (PTAC 2013)informuje, że z dniem 1 lipca 2014 r. 10-walentna szczepionka Synflorix zostanie zastąpiona 13 walentną szczepionką Prevenar 13 w krajowym schemacie szczepień. Natomiast australijski Pharmaceutical Benefits Advisory Committee (PBAC 2009) wydał pozytywną opinię w sprawie finansowania szczepionki Synflorix u dzieci w wieku od 8 tygodni do 2 lat 10
11 stosowanej w profilaktyce zakażeń spowodowanych przez Streptococcus pneumoniae serotypów 1., 4., 5., 6B., 7F., 9V., 14., 18C., 19F. i 23F. Podstawa przygotowania rekomendacji Rekomendacja została przygotowana na podstawie zlecenia Ministra Zdrowia z dnia r. (znak: MZ- PLR /KB/13), w sprawie objęcia refundacją produktu leczniczego Synflorix, kod EAN , na podstawie art. 35 ust 1. ustawy z dnia 12 maja 2011 roku o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych (Dz. U. Nr 122, poz. 696, z późn. zm.), po uzyskaniu Stanowiska Rady Przejrzystości nr 59/2014 z dnia 24 lutego 2014 r w sprawie oceny leku Synflorix (EAN ) we wskazaniu: czynne uodpornienie przeciwko chorobie inwazyjnej, zapaleniu płuc oraz ostremu zapaleniu ucha środkowego wywołanym przez Streptococcus pneumoniae u niemowląt rozpoczynających cykl szczepień od ukończenia 6 tygodnia życia do 6 miesiąca życia (schemat 3 + 1). Piśmiennictwo: 1. Stanowisko Rady Przejrzystości nr 59/2014 z dnia 24 lutego 2014 r w sprawie oceny leku Synflorix (EAN ) we wskazaniu: czynne uodpornienie przeciwko chorobie inwazyjnej, zapaleniu płuc oraz ostremu zapaleniu ucha środkowego wywołanym przez Streptococcus pneumoniae u niemowląt rozpoczynających cykl szczepień od ukończenia 6 tygodnia życia do 6 miesiąca życia (schemat 3 + 1) 2. Analiza weryfikacyjna nr: AOTM-OT /2013. Wniosek o objęcie refundacją leku Synflorix (polisacharyd pneumokokowy serotyp 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F, 23F) we wskazaniu: czynne uodpornienie przeciwko chorobie inwazyjnej, zapaleniu płuc oraz ostremu zapaleniu ucha środkowego wywołanym przez Streptococcus pneumoniae u niemowląt rozpoczynających cykl szczepień od ukończenia 6 tygodnia życia do 6 miesiąca życia (schemat 3 + 1). Analiza weryfikacyjna. 11
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 111/2013 z dnia 26 sierpnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Zoladex,
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Opinia Prezesa Agencji Oceny Technologii Medycznych nr 66/2014 z dnia 28 kwietnia 2014 r. o projekcie programu Program profilaktyki zakażeń pneumokokowych wśród dzieci
Agencja Oceny Technologii Medycznych Opinia Prezesa Agencji Oceny Technologii Medycznych nr 66/2014 z dnia 28 kwietnia 2014 r. o projekcie programu Program profilaktyki zakażeń pneumokokowych wśród dzieci
UCHWAŁA NR IV/35/2011 RADY GMINY W BOGORII. z dnia 16 lutego 2011 r.
 UCHWAŁA NR IV/35/2011 RADY GMINY W BOGORII z dnia 16 lutego 2011 r. w sprawie zatwierdzenia: Programu profilaktyki zakażeń pneumokokowych wśród dzieci zamieszkałych na terenie Gminy Bogoria Na podstawie
UCHWAŁA NR IV/35/2011 RADY GMINY W BOGORII z dnia 16 lutego 2011 r. w sprawie zatwierdzenia: Programu profilaktyki zakażeń pneumokokowych wśród dzieci zamieszkałych na terenie Gminy Bogoria Na podstawie
UCHWAŁA NR XL/279/10 RADY GMINY W BOGORII z dnia 28 stycznia 2010 r.
 UCHWAŁA NR XL/279/10 RADY GMINY W BOGORII z dnia 28 stycznia 2010 r. w sprawie zatwierdzenia: Programu profilaktyki zakażeń pneumokokowych wśród dzieci zamieszkałych na terenie Gminy Bogoria Na podstawie
UCHWAŁA NR XL/279/10 RADY GMINY W BOGORII z dnia 28 stycznia 2010 r. w sprawie zatwierdzenia: Programu profilaktyki zakażeń pneumokokowych wśród dzieci zamieszkałych na terenie Gminy Bogoria Na podstawie
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 133/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Prevenar
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 133/2014 z dnia 26 maja 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Prevenar
Załącznik nr 1 do Uchwały Nr XXVII164 /2008 Rady Gminy w Bogorii z dnia 30 grudnia 2008 roku Program profilaktyki zakażeń pneumokokowych wśród dzieci
 UCHWAŁA Nr XXVII/164/2008 Rady Gminy Bogoria z dnia 30 grudnia 2008 roku w sprawie zatwierdzenia: Programu profilaktyki zakażeń pneumokokowych wśród dzieci zamieszkałych na terenie Gminy Bogoria Na podstawie
UCHWAŁA Nr XXVII/164/2008 Rady Gminy Bogoria z dnia 30 grudnia 2008 roku w sprawie zatwierdzenia: Programu profilaktyki zakażeń pneumokokowych wśród dzieci zamieszkałych na terenie Gminy Bogoria Na podstawie
UCHWAŁA Nr XVI/153/2016 Rady Miejskiej w Policach z dnia 23 lutego 2016 r.
 UCHWAŁA Nr XVI/153/2016 Rady Miejskiej w Policach z dnia 23 lutego 2016 r. w sprawie realizacji w 2016 roku przez gminę Police programu profilaktyki zakażeń pneumokokowych wśród dzieci zamieszkałych na
UCHWAŁA Nr XVI/153/2016 Rady Miejskiej w Policach z dnia 23 lutego 2016 r. w sprawie realizacji w 2016 roku przez gminę Police programu profilaktyki zakażeń pneumokokowych wśród dzieci zamieszkałych na
UCHWAŁA Nr IV/18/2015 Rady Miejskiej w Policach z dnia 27 stycznia 2015 r.
 UCHWAŁA Nr IV/18/2015 Rady Miejskiej w Policach z dnia 27 stycznia 2015 r. w sprawie realizacji w 2015 roku przez gminę Police programu profilaktyki zakażeń pneumokokowych wśród dzieci zamieszkałych na
UCHWAŁA Nr IV/18/2015 Rady Miejskiej w Policach z dnia 27 stycznia 2015 r. w sprawie realizacji w 2015 roku przez gminę Police programu profilaktyki zakażeń pneumokokowych wśród dzieci zamieszkałych na
UCHWAŁA NR... RADY GMINY BOGORIA. z dnia 9 lutego 2012 r.
 UCHWAŁA NR... RADY GMINY BOGORIA z dnia 9 lutego 2012 r. w sprawie zatwierdzenia: Programu profilaktyki zakażeń pneumokokowych wśród dzieci zamieszkałych na terenie Gminy Bogoria Na podstawie art. 7 ust.
UCHWAŁA NR... RADY GMINY BOGORIA z dnia 9 lutego 2012 r. w sprawie zatwierdzenia: Programu profilaktyki zakażeń pneumokokowych wśród dzieci zamieszkałych na terenie Gminy Bogoria Na podstawie art. 7 ust.
Paulina Rolska. Monika Małowicka Katarzyna Mazur Monika Szałańska Maciej Ziobro
 HTA Consulting Spółka z Ograniczoną Odpowiedzialnością Spółka Komandytowa ul. Starowiślna 17/3, 31-038 Kraków Tel.: +48 (0) 12 421-88-32; Faks: +48 (0) 12 395-38-32 www.hta.pl Projekt zakończono: grudzień
HTA Consulting Spółka z Ograniczoną Odpowiedzialnością Spółka Komandytowa ul. Starowiślna 17/3, 31-038 Kraków Tel.: +48 (0) 12 421-88-32; Faks: +48 (0) 12 395-38-32 www.hta.pl Projekt zakończono: grudzień
szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13- walentna, adsorbowana)
 EMA/90006/2015 EMEA/H/C/001104 Streszczenie EPAR dla ogółu społeczeństwa szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13- walentna, adsorbowana) Niniejszy dokument jest streszczeniem
EMA/90006/2015 EMEA/H/C/001104 Streszczenie EPAR dla ogółu społeczeństwa szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13- walentna, adsorbowana) Niniejszy dokument jest streszczeniem
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Prevenar 13 zawiesina do wstrzykiwań Szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13-walentna, adsorbowana)
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Prevenar 13 zawiesina do wstrzykiwań Szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13-walentna, adsorbowana)
Uchwala nr. Rada Miasta Katowice. z dnia. w sprawie przyjęcia "Programu szczepień profilaktycznych przeciwko pneumokokom".
 PROJEKT Uchwala nr. UCHWAL y BIURO RADY MIASTA KATOWICE Wpł. 2012-10- 1 5 Rady Miasta Katowice z dnia. BRM....... w sprawie przyjęcia "Programu szczepień profilaktycznych przeciwko pneumokokom". Na podstawie
PROJEKT Uchwala nr. UCHWAL y BIURO RADY MIASTA KATOWICE Wpł. 2012-10- 1 5 Rady Miasta Katowice z dnia. BRM....... w sprawie przyjęcia "Programu szczepień profilaktycznych przeciwko pneumokokom". Na podstawie
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Prevenar 13 zawiesina do wstrzykiwań Szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13-walentna, adsorbowana)
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Prevenar 13 zawiesina do wstrzykiwań Szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13-walentna, adsorbowana)
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PNEUMO 23, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum pneumococcale polysaccharidicum Szczepionka przeciw pneumokokom, polisacharydowa
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO PNEUMO 23, roztwór do wstrzykiwań w ampułko-strzykawce Vaccinum pneumococcale polysaccharidicum Szczepionka przeciw pneumokokom, polisacharydowa
dystrybucji serotypów powodujących zakażenia inwazyjne w poszczególnych grupach wiekowych zapadalność na IChP w poszczególnych grupach wiekowych
 Warszawa, 15.06.2015 Rekomendacje Pediatrycznego Zespołu Ekspertów ds. Programu Szczepień Ochronnych (PZEdsPSO) dotyczące realizacji szczepień obowiązkowych, skoniugowaną szczepionką przeciwko pneumokokom;
Warszawa, 15.06.2015 Rekomendacje Pediatrycznego Zespołu Ekspertów ds. Programu Szczepień Ochronnych (PZEdsPSO) dotyczące realizacji szczepień obowiązkowych, skoniugowaną szczepionką przeciwko pneumokokom;
Agencja Oceny Technologii Medycznych i Taryfikacji
 Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Opinia Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji nr 31/2016 z dnia 24 lutego 2016 r. o projekcie programu polityki
Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Opinia Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji nr 31/2016 z dnia 24 lutego 2016 r. o projekcie programu polityki
Agencja Oceny Technologii Medycznych i Taryfikacji
 Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Opinia Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji nr 61/2016 z dnia 29 kwietnia 2016 r. o projekcie programu polityki
Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Opinia Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji nr 61/2016 z dnia 29 kwietnia 2016 r. o projekcie programu polityki
UCHWAŁA Nr XXXIII/332/2013
 UCHWAŁA Nr XXXIII/332/2013 Rady Miejskiej w Nowym Warpnie z dnia 26 września 2013 r. w sprawie realizacji w 2013 roku Programu profilaktycznego przeciwko zakażeniom pneumokokowym wśród dzieci po 2 r.ż.
UCHWAŁA Nr XXXIII/332/2013 Rady Miejskiej w Nowym Warpnie z dnia 26 września 2013 r. w sprawie realizacji w 2013 roku Programu profilaktycznego przeciwko zakażeniom pneumokokowym wśród dzieci po 2 r.ż.
Agencja Oceny Technologii Medycznych i Taryfikacji
 Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Opinia Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji nr 7/2015 z dnia 16 stycznia 2015 r. o projekcie programu Program
Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Opinia Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji nr 7/2015 z dnia 16 stycznia 2015 r. o projekcie programu Program
Rada Przejrzystości. Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 29/2012 z dnia 11 czerwca 2012 r. w sprawie zasadności finansowania środka spożywczego specjalnego przeznaczenia
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 29/2012 z dnia 11 czerwca 2012 r. w sprawie zasadności finansowania środka spożywczego specjalnego przeznaczenia
UCHWAŁA NR VIII/57/2011 RADY MIEJSKIEJ W PYSKOWICACH. z dnia 25 maja 2011 r.
 UCHWAŁA NR VIII/57/2011 RADY MIEJSKIEJ W PYSKOWICACH z dnia 25 maja 2011 r. w sprawie: Programu zdrowotnego na lata 2011 2014, dotyczącego szczepień profilaktycznych dzieci zamieszkałych na terenie Gminy
UCHWAŁA NR VIII/57/2011 RADY MIEJSKIEJ W PYSKOWICACH z dnia 25 maja 2011 r. w sprawie: Programu zdrowotnego na lata 2011 2014, dotyczącego szczepień profilaktycznych dzieci zamieszkałych na terenie Gminy
Warszawa,14 lutego 2017r. Pan Marek Kuchciński Marszałek Sejmu Rzeczypospolitej Polskiej. Szanowny Panie Marszałku,
 Warszawa,14 lutego 2017r. Pan Marek Kuchciński Marszałek Sejmu Rzeczypospolitej Polskiej Szanowny Panie Marszałku, w odpowiedzi na interpelację nr 9087 Posłów na Sejm RP: Krystyny Sibińskiej, Marii Janyska,
Warszawa,14 lutego 2017r. Pan Marek Kuchciński Marszałek Sejmu Rzeczypospolitej Polskiej Szanowny Panie Marszałku, w odpowiedzi na interpelację nr 9087 Posłów na Sejm RP: Krystyny Sibińskiej, Marii Janyska,
Uchwala nr. Rada Miasta Katowice. z dnia. w sprawie przyjęcia "Programu szczepień profilaktycznych oraz meningokokom".
 PROJEKTUCHWALY Uchwala nr. Rady Miasta Katowice z dnia. BIURO RADY MIASTA KATOWICE Wpl. 2012-09-., 2 BRM...... w sprawie przyjęcia "Programu szczepień profilaktycznych oraz meningokokom". przeciwko pneumokokom
PROJEKTUCHWALY Uchwala nr. Rady Miasta Katowice z dnia. BIURO RADY MIASTA KATOWICE Wpl. 2012-09-., 2 BRM...... w sprawie przyjęcia "Programu szczepień profilaktycznych oraz meningokokom". przeciwko pneumokokom
Czy AOTM uczestniczy w procesie kształtowania dostępności do szczepień ochronnych? Magdalena Władysiuk MD, MBA
 Czy AOTM uczestniczy w procesie kształtowania dostępności do szczepień ochronnych? Magdalena Władysiuk MD, MBA Immunoprofilaktyka chorób zakaźnych Uniknięcie negatywnych konsekwencji zdrowotnych związanych
Czy AOTM uczestniczy w procesie kształtowania dostępności do szczepień ochronnych? Magdalena Władysiuk MD, MBA Immunoprofilaktyka chorób zakaźnych Uniknięcie negatywnych konsekwencji zdrowotnych związanych
Opiekuńczo Wychowawczych w Bochni oraz Rodzinnego Domu Dziecka.
 Załącznik nr 1 do Uchwały Nr XXII/182/08 Rady Powiatu w Bochni z dnia 26. czerwca 2008 r. Program profilaktyki zakażeń pneumokokowych i meningokokowych wśród dzieci i młodzieży z grup największego ryzyka
Załącznik nr 1 do Uchwały Nr XXII/182/08 Rady Powiatu w Bochni z dnia 26. czerwca 2008 r. Program profilaktyki zakażeń pneumokokowych i meningokokowych wśród dzieci i młodzieży z grup największego ryzyka
Agencja Oceny Technologii Medycznych i Taryfikacji
 Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Opinia Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji nr 77/2016 z dnia 17 maja 2016 r. o projekcie programu polityki zdrowotnej
Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Opinia Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji nr 77/2016 z dnia 17 maja 2016 r. o projekcie programu polityki zdrowotnej
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Opinia Prezesa Agencji Oceny Technologii Medycznych nr 236/2014 z dnia 6 października 2014 r. o projekcie programu Promocja zdrowia w profilaktyce szczepień ochronnych
Agencja Oceny Technologii Medycznych Opinia Prezesa Agencji Oceny Technologii Medycznych nr 236/2014 z dnia 6 października 2014 r. o projekcie programu Promocja zdrowia w profilaktyce szczepień ochronnych
Szczepienia ochronne. Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak
 Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
Szczepienia ochronne Dr hab. med. Agnieszka Szypowska Dr med. Anna Taczanowska Lek. Katarzyna Piechowiak Klinika Pediatrii Warszawski Uniwersytet Medyczny Szczepienie (profilaktyka czynna) Podanie całego
dr n. med. Marian Patrzałek NZOZ PROMED Kielce
 Szczepienia dzieci przeciw pneumokokom i ich skutki populacyjne na przykładzie społeczności Kielc dr n. med. Marian Patrzałek NZOZ PROMED Kielce Szczepienia ochronne dla ludności Kielc -szczepienia p/grypie
Szczepienia dzieci przeciw pneumokokom i ich skutki populacyjne na przykładzie społeczności Kielc dr n. med. Marian Patrzałek NZOZ PROMED Kielce Szczepienia ochronne dla ludności Kielc -szczepienia p/grypie
Aktualne problemy systemu szczepień w Polsce
 Warszawa, 9 grudnia 2016 r. Aktualne problemy systemu szczepień w Polsce Zakażenia wirusowe, możliwości współczesnej wakcynologii Głównym zadaniem wszystkich szczepień jest indukowanie odporności na zakażenie.
Warszawa, 9 grudnia 2016 r. Aktualne problemy systemu szczepień w Polsce Zakażenia wirusowe, możliwości współczesnej wakcynologii Głównym zadaniem wszystkich szczepień jest indukowanie odporności na zakażenie.
SZCZEPIENIA PROFILAKTYCZNE DZIECI PRZECIWKO ZAKAŻENIOM MENINGOKOKOWYM TYPU C
 Załącznik do uchwały Nr XXIV/276/12 Rady Miejskiej w Czerwionce-Leszczynach z dnia 14 września 2012 roku SZCZEPIENIA PROFILAKTYCZNE DZIECI PRZECIWKO ZAKAŻENIOM MENINGOKOKOWYM TYPU C PROGRAM ZDROWOTNY NA
Załącznik do uchwały Nr XXIV/276/12 Rady Miejskiej w Czerwionce-Leszczynach z dnia 14 września 2012 roku SZCZEPIENIA PROFILAKTYCZNE DZIECI PRZECIWKO ZAKAŻENIOM MENINGOKOKOWYM TYPU C PROGRAM ZDROWOTNY NA
Streptococcus pneumoniae
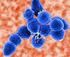 Streptococcus pneumoniae Bakteria Streptococcus pneumoniae jest Gram (+) dwoinką i należy do najgroźniejszych bateryjnych patogenów człowieka. Odpowiedzialna jest za szereg chorób inwazyjnych o wysokiej
Streptococcus pneumoniae Bakteria Streptococcus pneumoniae jest Gram (+) dwoinką i należy do najgroźniejszych bateryjnych patogenów człowieka. Odpowiedzialna jest za szereg chorób inwazyjnych o wysokiej
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań. Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań. Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
Agencja Oceny Technologii Medycznych i Taryfikacji
 Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Opinia Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji nr 30/2016 z dnia 18 lutego 2016 r. o projekcie programu polityki
Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Opinia Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji nr 30/2016 z dnia 18 lutego 2016 r. o projekcie programu polityki
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Synflorix zawiesina do wstrzykiwań Szczepionka przeciw pneumokokom, polisacharydowa, skoniugowana, adsorbowana 2. SKŁAD JAKOŚCIOWY
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Synflorix zawiesina do wstrzykiwań Szczepionka przeciw pneumokokom, polisacharydowa, skoniugowana, adsorbowana 2. SKŁAD JAKOŚCIOWY
PROFILAKTYKA PRZECIW GRYPIE
 PROFILAKTYKA PRZECIW GRYPIE Koordynator profilaktyki : mgr piel. Anna Karczewska CELE: zwiększanie świadomości pacjenta na temat szczepionek przeciwko grypie zapobieganie zachorowań na grypę zapobieganie
PROFILAKTYKA PRZECIW GRYPIE Koordynator profilaktyki : mgr piel. Anna Karczewska CELE: zwiększanie świadomości pacjenta na temat szczepionek przeciwko grypie zapobieganie zachorowań na grypę zapobieganie
Inwazyjna Choroba Meningokokowa
 Powiatowa Stacja Sanitarno Epidemiologiczna w m. st. Warszawie ul. Kochanowskiego 21,, ul. Cyrulików 35; tel. 22/311-80-07 08; e-mail: oswiatazdrowotna@pssewawa.pl Inwazyjna Choroba Meningokokowa Profilaktyka
Powiatowa Stacja Sanitarno Epidemiologiczna w m. st. Warszawie ul. Kochanowskiego 21,, ul. Cyrulików 35; tel. 22/311-80-07 08; e-mail: oswiatazdrowotna@pssewawa.pl Inwazyjna Choroba Meningokokowa Profilaktyka
Załącznik Nr 1 do Uchwały Nr XXXVI/223/12 Rady Miejskiej w Połańcu z dnia 29 listopada 2012 roku
 Załącznik Nr 1 do Uchwały Nr XXXVI/223/12 Rady Miejskiej w Połańcu z dnia 29 listopada 2012 roku Program profilaktyki zakażeń pneumokokowych wśród dzieci zamieszkałych na terenie Gminy Połaniec, przy zastosowaniu
Załącznik Nr 1 do Uchwały Nr XXXVI/223/12 Rady Miejskiej w Połańcu z dnia 29 listopada 2012 roku Program profilaktyki zakażeń pneumokokowych wśród dzieci zamieszkałych na terenie Gminy Połaniec, przy zastosowaniu
Sytuacja epidemiologiczna choroby meningokokowej w województwie
 Sytuacja epidemiologiczna choroby meningokokowej w województwie śląskim w latach 07-. Analizie poddano zgłoszenia zachorowań na chorobę meningokokową w latach 07- na terenie województwa śląskiego. ZakaŜenia
Sytuacja epidemiologiczna choroby meningokokowej w województwie śląskim w latach 07-. Analizie poddano zgłoszenia zachorowań na chorobę meningokokową w latach 07- na terenie województwa śląskiego. ZakaŜenia
AKTUALNOÂCI BINET. Nr 10/ Drogie Koleżanki i Koledzy. Inwazyjna choroba meningokokowa w 2015 roku
 www.koroun.edu.pl Drogie Koleżanki i Koledzy Witamy serdecznie, oddajemy w Państwa ręce kolejny numer Aktualności BINet. Jest on poświęcony epidemiologii inwazyjnych zakażeń wywoływanych przez Neisseria
www.koroun.edu.pl Drogie Koleżanki i Koledzy Witamy serdecznie, oddajemy w Państwa ręce kolejny numer Aktualności BINet. Jest on poświęcony epidemiologii inwazyjnych zakażeń wywoływanych przez Neisseria
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 90/2012 z dnia 15 października 2012 r. w sprawie zasadności finansowania leku Primacor (chlorowodorek lerkanidypiny)
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 90/2012 z dnia 15 października 2012 r. w sprawie zasadności finansowania leku Primacor (chlorowodorek lerkanidypiny)
MINISTER ZDROWIA Warszawa,
 MINISTER ZDROWIA Warszawa, 2015-07-22 MD-L.070.25.2015(BK) Pani Małgorzata Kidawa - Błońska Marszałek Sejmu Rzeczypospolitej Polskiej W związku z interpelacją nr 33138 przedłożoną przez Pana Jerzego Sądela,
MINISTER ZDROWIA Warszawa, 2015-07-22 MD-L.070.25.2015(BK) Pani Małgorzata Kidawa - Błońska Marszałek Sejmu Rzeczypospolitej Polskiej W związku z interpelacją nr 33138 przedłożoną przez Pana Jerzego Sądela,
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Synflorix zawiesina do wstrzykiwań w ampułkostrzykawce Synflorix zawiesina do wstrzykiwań Synflorix zawiesina do wstrzykiwań
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Synflorix zawiesina do wstrzykiwań w ampułkostrzykawce Synflorix zawiesina do wstrzykiwań Synflorix zawiesina do wstrzykiwań
Agencja Oceny Technologii Medycznych i Taryfikacji
 Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Opinia Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji nr 46/2015 z dnia 12 marca 2015 r. o projekcie programu Zapobieganie
Agencja Oceny Technologii Medycznych i Taryfikacji www.aotmit.gov.pl Opinia Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji nr 46/2015 z dnia 12 marca 2015 r. o projekcie programu Zapobieganie
PROGRAM SZCZEPIEŃ PROFILAKTYCZNYCH DZIECI I MŁODZIEŻY GMINY ZAGNAŃSK PRZECIWKO MENINGOKOKOM NA LATA 2013-2017
 Załącznik do Uchwały Nr 67/2013 Rady Gminy Zagnańsk z dnia 26 sierpnia 2013 roku PROGRAM SZCZEPIEŃ PROFILAKTYCZNYCH DZIECI I MŁODZIEŻY GMINY ZAGNAŃSK PRZECIWKO MENINGOKOKOM NA LATA 2013-2017 Autor programu:
Załącznik do Uchwały Nr 67/2013 Rady Gminy Zagnańsk z dnia 26 sierpnia 2013 roku PROGRAM SZCZEPIEŃ PROFILAKTYCZNYCH DZIECI I MŁODZIEŻY GMINY ZAGNAŃSK PRZECIWKO MENINGOKOKOM NA LATA 2013-2017 Autor programu:
Silny niepożądany odczyn poszczepienny u rocznego dziecka. Dr n. med. Ewa Duszczyk Pediatria przez przypadki, Warszawa, r.
 Silny niepożądany odczyn poszczepienny u rocznego dziecka Dr n. med. Ewa Duszczyk Pediatria przez przypadki, Warszawa, 18.11.2016 r. 2 Co to jest niepożądany odczyn poszczepienny Niepożądany odczyn poszczepienny
Silny niepożądany odczyn poszczepienny u rocznego dziecka Dr n. med. Ewa Duszczyk Pediatria przez przypadki, Warszawa, 18.11.2016 r. 2 Co to jest niepożądany odczyn poszczepienny Niepożądany odczyn poszczepienny
Uchwała Nr XIX/169/2008 Rady Miasta Marki z dnia 18 czerwca 2008 roku
 Uchwała Nr XIX/169/2008 Rady Miasta Marki z dnia 18 czerwca 2008 roku w sprawie wyrażenia zgody na realizację programu zdrowotnego w zakresie szczepień ochronnych przeciwko grypie, dla mieszkańców Miasta
Uchwała Nr XIX/169/2008 Rady Miasta Marki z dnia 18 czerwca 2008 roku w sprawie wyrażenia zgody na realizację programu zdrowotnego w zakresie szczepień ochronnych przeciwko grypie, dla mieszkańców Miasta
PROFIALKTYKA GRYPY W GMINIE CZAPLINEK W LATACH
 PROFIALKTYKA GRYPY W GMINIE CZAPLINEK W LATACH 2010-2016 CO WARTO WIEDZIEĆ O GRYPIE Każdego roku na całym świecie zaraża się 5-10% populacji osób dorosłych i 20-30%dzieci Wirusy grypy ludzkiej łatwiej
PROFIALKTYKA GRYPY W GMINIE CZAPLINEK W LATACH 2010-2016 CO WARTO WIEDZIEĆ O GRYPIE Każdego roku na całym świecie zaraża się 5-10% populacji osób dorosłych i 20-30%dzieci Wirusy grypy ludzkiej łatwiej
WZW TYPU B CO POWINIENEŚ WIEDZIEĆ? CZY WYKORZYSTAŁEŚ WSYSTKIE DOSTĘPNE ŚRODKI ABY USTRZEC SIĘ PRZED WIRUSOWYM ZAPALENIEM WĄTROBY TYPU B?
 WZW TYPU B CO POWINIENEŚ WIEDZIEĆ? CZY WYKORZYSTAŁEŚ WSYSTKIE DOSTĘPNE ŚRODKI ABY USTRZEC SIĘ PRZED WIRUSOWYM ZAPALENIEM WĄTROBY TYPU B? ZDOBĄDŹ INFORMACJE! ZASZCZEP SIĘ! ZDOBĄDŹ OCHRONĘ! szczepionka przeciw
WZW TYPU B CO POWINIENEŚ WIEDZIEĆ? CZY WYKORZYSTAŁEŚ WSYSTKIE DOSTĘPNE ŚRODKI ABY USTRZEC SIĘ PRZED WIRUSOWYM ZAPALENIEM WĄTROBY TYPU B? ZDOBĄDŹ INFORMACJE! ZASZCZEP SIĘ! ZDOBĄDŹ OCHRONĘ! szczepionka przeciw
WZW TYPU B CO POWINIENEŚ WIEDZIEĆ? CZY WYKORZYSTAŁEŚ WSZYSTKIE DOSTĘPNE ŚRODKI ABY USTRZEC SIĘ PRZED WIRUSOWYM ZAPALENIEM WĄTROBY TYPU B?
 SZCZEPIONKA WZW TYPU B CO POWINIENEŚ WIEDZIEĆ? CZY WYKORZYSTAŁEŚ WSZYSTKIE DOSTĘPNE ŚRODKI ABY USTRZEC SIĘ PRZED WIRUSOWYM ZAPALENIEM WĄTROBY TYPU B? ZDOBĄDŹ INFORMACJE! ZASZCZEP SIĘ! ZDOBĄDŹ OCHRONĘ!
SZCZEPIONKA WZW TYPU B CO POWINIENEŚ WIEDZIEĆ? CZY WYKORZYSTAŁEŚ WSZYSTKIE DOSTĘPNE ŚRODKI ABY USTRZEC SIĘ PRZED WIRUSOWYM ZAPALENIEM WĄTROBY TYPU B? ZDOBĄDŹ INFORMACJE! ZASZCZEP SIĘ! ZDOBĄDŹ OCHRONĘ!
Inwazyjna choroba meningokokowa. Posocznica (sepsa) meningokokowa
 Inwazyjna choroba meningokokowa Posocznica (sepsa) meningokokowa Sepsa, posocznica, meningokoki to słowa, które u większości ludzi wzbudzają niepokój. Każdy z nas: rodzic, opiekun, nauczyciel, dorosły
Inwazyjna choroba meningokokowa Posocznica (sepsa) meningokokowa Sepsa, posocznica, meningokoki to słowa, które u większości ludzi wzbudzają niepokój. Każdy z nas: rodzic, opiekun, nauczyciel, dorosły
Dr med. Paweł Grzesiowski
 DOSTĘPNOŚĆ DO SZCZEPIEŃ OCHRONNYCH W WYBRANYCH KRAJACH EUROPY CENTRALNEJ MECHANIZMY FINANSOWANIA SZCZEPIEŃ I OCENY ICH EFEKTYWNOŚCI Dr med. Paweł Grzesiowski FUNDACJA INSTYTUT PROFILAKTYKI ZAKAŻEŃ WARSZAWA,
DOSTĘPNOŚĆ DO SZCZEPIEŃ OCHRONNYCH W WYBRANYCH KRAJACH EUROPY CENTRALNEJ MECHANIZMY FINANSOWANIA SZCZEPIEŃ I OCENY ICH EFEKTYWNOŚCI Dr med. Paweł Grzesiowski FUNDACJA INSTYTUT PROFILAKTYKI ZAKAŻEŃ WARSZAWA,
UCHWAŁA NR XXV/289/16 RADY GMINY MIELNO. z dnia 2 września 2016 r.
 UCHWAŁA NR XXV/289/16 RADY GMINY MIELNO z dnia 2 września 2016 r. w sprawie zmiany uchwały w sprawie przyjęcia Programu profilaktyki i promocji zdrowia na lata 2014-2020 realizowanego przez Gminę Mielno
UCHWAŁA NR XXV/289/16 RADY GMINY MIELNO z dnia 2 września 2016 r. w sprawie zmiany uchwały w sprawie przyjęcia Programu profilaktyki i promocji zdrowia na lata 2014-2020 realizowanego przez Gminę Mielno
Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji
 Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 53/2015 z dnia 27 kwietnia 2015 roku w sprawie oceny leku Diohespan (diosminum),
Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 53/2015 z dnia 27 kwietnia 2015 roku w sprawie oceny leku Diohespan (diosminum),
FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania
 Załącznik nr 1 do SIWZ FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania Zadanie nr 1 1 Szczepionka zapobiegająca wirusowemu zapaleniu wątroby typu
Załącznik nr 1 do SIWZ FORMULARZ ASORTYMENTOWO-CENOWY do przetargu nieograniczonego na: Dostawę szczepionek w podziale na zadania Zadanie nr 1 1 Szczepionka zapobiegająca wirusowemu zapaleniu wątroby typu
Program profilaktyki zakażeń pneumokokowych w zakresie szczepień ochronnych przeciwko pneumokokom dla dzieci w wieku 3 lat na lata
 w sprawie powołania Komisji Konkursowej w celu przeprowadzenia konkursu ofert na realizację programów polityki zdrowotnej oraz ustalenia regulaminu jej pracy i szczegółowych warunków konkursu. Program
w sprawie powołania Komisji Konkursowej w celu przeprowadzenia konkursu ofert na realizację programów polityki zdrowotnej oraz ustalenia regulaminu jej pracy i szczegółowych warunków konkursu. Program
www.aotm.gov.pl Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 171/2013 z dnia 9 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Silgard,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 171/2013 z dnia 9 grudnia 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Silgard,
Pneumokoki wciąż groźne
 Marcin Wełnicki, 2016-03-29 00:00 Fot. Thinkstock/Getty Images Pneumokoki są jednym z trzech rodzajów bakterii otoczkowych wywołujących tak zwane zakażenia inwazyjne. Najbardziej niebezpieczne postaci
Marcin Wełnicki, 2016-03-29 00:00 Fot. Thinkstock/Getty Images Pneumokoki są jednym z trzech rodzajów bakterii otoczkowych wywołujących tak zwane zakażenia inwazyjne. Najbardziej niebezpieczne postaci
I. OPIS PROBLEMU ZDROWOTNEGO
 PROGRAM ZDROWOTNY PROGRAM PROFILAKTYCZNYCH SZCZEPIEŃ PRZECIWKO MENINGOKOKOM GRUPY C DZIECI ZAMIESZKAŁYCH NA TERENIE GMINY TRZEBNICA NA LATA 2017-2019 W RAMACH PROGRAMU TRZEBNICKA RODZINA 3+ PROGRAM ZDROWOTNY
PROGRAM ZDROWOTNY PROGRAM PROFILAKTYCZNYCH SZCZEPIEŃ PRZECIWKO MENINGOKOKOM GRUPY C DZIECI ZAMIESZKAŁYCH NA TERENIE GMINY TRZEBNICA NA LATA 2017-2019 W RAMACH PROGRAMU TRZEBNICKA RODZINA 3+ PROGRAM ZDROWOTNY
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 139/2014 z dnia 2 czerwca 2014 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie objęcia refundacją produktu leczniczego Giotrif,
Warszawa, dnia 11 kwietnia 2012 r. Poz. 388 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 2 kwietnia 2012 r.
 DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 11 kwietnia 2012 r. Poz. 388 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 2 kwietnia 2012 r. w sprawie minimalnych wymagań, jakie muszą spełniać analizy
DZIENNIK USTAW RZECZYPOSPOLITEJ POLSKIEJ Warszawa, dnia 11 kwietnia 2012 r. Poz. 388 ROZPORZĄDZENIE MINISTRA ZDROWIA 1) z dnia 2 kwietnia 2012 r. w sprawie minimalnych wymagań, jakie muszą spełniać analizy
Program szczepień profilaktycznych przeciwko meningokokom grupy C. na terenie powiatu kluczborskiego
 Program szczepień profilaktycznych przeciwko meningokokom grupy C dzieci sześcioletnich zamieszkałych na terenie powiatu kluczborskiego Okres realizacji programu: program wieloletni Autorzy programu: Iwona
Program szczepień profilaktycznych przeciwko meningokokom grupy C dzieci sześcioletnich zamieszkałych na terenie powiatu kluczborskiego Okres realizacji programu: program wieloletni Autorzy programu: Iwona
UCHWAŁA NR XLVII/551/14 RADY MIEJSKIEJ W TRZEBNICY. z dnia 18 czerwca 2014 r.
 UCHWAŁA NR XLVII/551/14 RADY MIEJSKIEJ W TRZEBNICY z dnia 18 czerwca 2014 r. w sprawie przyjęcia Programu profilaktycznego szczepień przeciwko meningokokom grupy C dzieci zamieszkałych na terenie Gminy
UCHWAŁA NR XLVII/551/14 RADY MIEJSKIEJ W TRZEBNICY z dnia 18 czerwca 2014 r. w sprawie przyjęcia Programu profilaktycznego szczepień przeciwko meningokokom grupy C dzieci zamieszkałych na terenie Gminy
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
Agencja Oceny Technologii Medycznych Rada Przejrzystości Opinia Rady Przejrzystości nr 380/2014 z dnia 29 grudnia 2014 r. w sprawie zasadności objęcia refundacją leku Mimpara (cinacalcetum) w zakresie
WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE
 WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE Na podstawie analizy dokumentacji wybranych pacjentów szczepionych w NZOZ Przychodni Lekarskiej DOM MED w Pruszkowie
WYTYCZNE ZESPOŁU W ZWIĄZKU ZE ZDARZENIEM W PRZYCHODNI DOM MED W PRUSZKOWIE REKOMENDACJE Na podstawie analizy dokumentacji wybranych pacjentów szczepionych w NZOZ Przychodni Lekarskiej DOM MED w Pruszkowie
Europejski Tydzień Szczepień kwietnia 2017 r.
 Europejski Tydzień Szczepień 24-30 kwietnia 2017 r. Europejski Tydzień Szczepień Inicjatywa Światowej Organizacji Zdrowia WHO (World Health Organization). Celem wydarzenia jest zwrócenie uwagi na znaczenie
Europejski Tydzień Szczepień 24-30 kwietnia 2017 r. Europejski Tydzień Szczepień Inicjatywa Światowej Organizacji Zdrowia WHO (World Health Organization). Celem wydarzenia jest zwrócenie uwagi na znaczenie
Meningokoki trzeba myśleć na zapas
 Meningokoki trzeba myśleć na zapas prof. dr hab. med. Jacek Wysocki dr n. med. Ilona Małecka Katedra i Zakład Profilaktyki Zdrowotnej Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Specjalistyczny
Meningokoki trzeba myśleć na zapas prof. dr hab. med. Jacek Wysocki dr n. med. Ilona Małecka Katedra i Zakład Profilaktyki Zdrowotnej Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Specjalistyczny
Rola AOTM w procesie kształtowania dostępności do szczepień ochronnych
 Rola AOTM w procesie kształtowania dostępności do szczepień ochronnych experience makes the difference Robert Plisko Świadczenie gwarantowane Świadczenie gwarantowane - świadczenie opieki zdrowotnej finansowane
Rola AOTM w procesie kształtowania dostępności do szczepień ochronnych experience makes the difference Robert Plisko Świadczenie gwarantowane Świadczenie gwarantowane - świadczenie opieki zdrowotnej finansowane
Inwazyjna choroba pneumokokowa w Polsce i w województwie śląskim w latach
 Inwazyjna choroba pneumokokowa w Polsce i w województwie śląskim w latach 2011-2017. Renata Cieślik Tarkota 1, 2 1 Wojewódzka Stacja Sanitarno-Epidemiologiczna w Katowicach 2 Śląski Uniwersytet Medyczny
Inwazyjna choroba pneumokokowa w Polsce i w województwie śląskim w latach 2011-2017. Renata Cieślik Tarkota 1, 2 1 Wojewódzka Stacja Sanitarno-Epidemiologiczna w Katowicach 2 Śląski Uniwersytet Medyczny
Szczepienia obowiązkowe osób narażonych w sposób szczególny na zakażenia
 Szczepienia obowiązkowe osób narażonych w sposób szczególny na zakażenia Tabela 2.2. Szczepienia obowiązkowe osób narażonych w sposób szczególny na zakażenia Szczepienie przeciw WZW typu B Zakażeniom Haemophilus
Szczepienia obowiązkowe osób narażonych w sposób szczególny na zakażenia Tabela 2.2. Szczepienia obowiązkowe osób narażonych w sposób szczególny na zakażenia Szczepienie przeciw WZW typu B Zakażeniom Haemophilus
 SZCZEPIENIA OCHRONNE U DOROSŁYCH lek. Kamil Chudziński Klinika Anestezjologii i Intensywnej Terapii CSK MSW w Warszawie 10.11.2015 Szczepionki Zabite lub żywe, ale odzjadliwione drobnoustroje/toksyny +
SZCZEPIENIA OCHRONNE U DOROSŁYCH lek. Kamil Chudziński Klinika Anestezjologii i Intensywnej Terapii CSK MSW w Warszawie 10.11.2015 Szczepionki Zabite lub żywe, ale odzjadliwione drobnoustroje/toksyny +
PROFILAKTYKA PRZECIW PNEUMOKOKOM
 PROFILAKTYKA PRZECIW PNEUMOKOKOM Koordynator profilaktyki : mgr piel. Anna Karczewska CELE: Zmniejszenie zapadalności i umieralności na inwazyjne choroby pneumokokowe wśród dzieci. Zmniejszenie chorobowości
PROFILAKTYKA PRZECIW PNEUMOKOKOM Koordynator profilaktyki : mgr piel. Anna Karczewska CELE: Zmniejszenie zapadalności i umieralności na inwazyjne choroby pneumokokowe wśród dzieci. Zmniejszenie chorobowości
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH
 DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
DEFERAZYROKS W LECZENIU PRZEWLEKŁEGO OBCIĄŻENIA ŻELAZEM W WYNIKU TRANSFUZJI KRWI U DOROSŁYCH ANALIZA WPŁYWU NA SYSTEM OCHRONY ZDROWIA Wersja 1.1 Wykonawca: MAHTA Sp. z o.o. ul. Rejtana 17/33 02-516 Warszawa
PROFILAKTYKA ZAGROŻEŃ MENINGOKOKOWYCH. 07.06.2010r
 PROFILAKTYKA ZAGROŻEŃ MENINGOKOKOWYCH 07.06.2010r MENINGOKOKI INFORMACJE OGÓLNE Meningokoki to bakterie z gatunku Neisseria meningitidis zwane również dwoinkami zapalenia opon mózgowych. Wyodrębniono kilka
PROFILAKTYKA ZAGROŻEŃ MENINGOKOKOWYCH 07.06.2010r MENINGOKOKI INFORMACJE OGÓLNE Meningokoki to bakterie z gatunku Neisseria meningitidis zwane również dwoinkami zapalenia opon mózgowych. Wyodrębniono kilka
 Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
Rada Przejrzystości działająca przy Prezesie Agencji Oceny Technologii Medycznych i Taryfikacji Stanowisko Rady Przejrzystości nr 95/2016 z dnia 29 sierpnia 2016 roku w sprawie zasadności wydawania zgody
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 158/2013 z dnia 5 sierpnia 2013 r. w sprawie oceny leku Signifor (pasyreotyd), kod EAN 5909990958238 we wskazaniu
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 158/2013 z dnia 5 sierpnia 2013 r. w sprawie oceny leku Signifor (pasyreotyd), kod EAN 5909990958238 we wskazaniu
Inwazyjna choroba pneumokokowa. w Polsce i w województwie śląskim w latach
 Inwazyjna choroba pneumokokowa w Polsce i w województwie śląskim w latach 2011-2016. Renata Cieślik Tarkota 1, 2 1 Wojewódzka Stacja Sanitarno-Epidemiologiczna w Katowicach 2 Śląski Uniwersytet Medyczny
Inwazyjna choroba pneumokokowa w Polsce i w województwie śląskim w latach 2011-2016. Renata Cieślik Tarkota 1, 2 1 Wojewódzka Stacja Sanitarno-Epidemiologiczna w Katowicach 2 Śląski Uniwersytet Medyczny
DANE O LUDNOŚCI w roku 2016
 Załącznik Nr 1 DANE O LUDNOŚCI w roku 2016 Część I Nazwa placówki:. Liczba ludności ogółem. Noworodki.. (szacunkowa liczba urodzeń w 2016 r.) Liczba dzieci urodzonych w 2015 r.... (szacunkowa liczba urodzeń
Załącznik Nr 1 DANE O LUDNOŚCI w roku 2016 Część I Nazwa placówki:. Liczba ludności ogółem. Noworodki.. (szacunkowa liczba urodzeń w 2016 r.) Liczba dzieci urodzonych w 2015 r.... (szacunkowa liczba urodzeń
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Hiberix, proszek i rozpuszczalnik do sporządzania zawiesiny do wstrzykiwań Vaccinum haemophili stirpi b coniugatum Szczepionka przeciwko
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Prevenar zawiesina do wstrzykiwań. Szczepionka przeciw pneumokokom sacharydowa, skoniugowana, adsorbowana 2. SKŁAD JAKOŚCIOWY
ANEKS I CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1 1. NAZWA PRODUKTU LECZNICZEGO Prevenar zawiesina do wstrzykiwań. Szczepionka przeciw pneumokokom sacharydowa, skoniugowana, adsorbowana 2. SKŁAD JAKOŚCIOWY
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 115/2012 z dnia 12 listopada w sprawie zasadności finansowania leku Procoralan (EAN 5909990340439) we wskazaniu:
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 115/2012 z dnia 12 listopada w sprawie zasadności finansowania leku Procoralan (EAN 5909990340439) we wskazaniu:
UCHWAŁA NR XXVII/183/2012 RADY GMINY MASŁÓW. z dnia 29 listopada 2012 roku. w sprawie: Programu zdrowotnego na lata , dotycz ą cego
 UCHWAŁA NR XXVII/183/2012 RADY GMINY MASŁÓW z dnia 29 listopada 2012 roku w sprawie: Programu zdrowotnego na lata 2013 2018, dotycz ą cego szczepie ń profilaktycznych dzieci zamieszkałych na terenie Gminy
UCHWAŁA NR XXVII/183/2012 RADY GMINY MASŁÓW z dnia 29 listopada 2012 roku w sprawie: Programu zdrowotnego na lata 2013 2018, dotycz ą cego szczepie ń profilaktycznych dzieci zamieszkałych na terenie Gminy
UCHWAŁA NR XIII/224/15 RADY MIASTA OPOLA. z dnia 2 lipca 2015 r. w sprawie przyjęcia Programu profilaktyki zakażeń pneumokokowych
 UCHWAŁA NR XIII/224/15 RADY MIASTA OPOLA z dnia 2 lipca 2015 r. w sprawie przyjęcia Programu profilaktyki zakażeń pneumokokowych Na podstawie art. 7 ust. 1 pkt 5 oraz art. 18 ust. 1 ustawy z dnia 8 marca
UCHWAŁA NR XIII/224/15 RADY MIASTA OPOLA z dnia 2 lipca 2015 r. w sprawie przyjęcia Programu profilaktyki zakażeń pneumokokowych Na podstawie art. 7 ust. 1 pkt 5 oraz art. 18 ust. 1 ustawy z dnia 8 marca
CZYM JEST SZCZEPIONKA?
 CZYM JEST SZCZEPIONKA? Szczepionka to preparat biologiczny, stosowany w celu uodpornienia organizmu. Ogólna zasada działania szczepionki polega na wprowadzeniu do organizmu antygenu, który jest rozpoznawany
CZYM JEST SZCZEPIONKA? Szczepionka to preparat biologiczny, stosowany w celu uodpornienia organizmu. Ogólna zasada działania szczepionki polega na wprowadzeniu do organizmu antygenu, który jest rozpoznawany
Xeplion (palmitynian paliperydonu) w leczeniu schizofrenii
 1 Wykonawca: Raport został wykonany na zlecenie i sfinansowany przez firmę Janssen-Cilag Polska Sp. z o.o. Autorzy nie zgłosili konfliktu interesów. Wersja 2.0 ostatnia aktualizacja dnia 4 sierpnia 2015
1 Wykonawca: Raport został wykonany na zlecenie i sfinansowany przez firmę Janssen-Cilag Polska Sp. z o.o. Autorzy nie zgłosili konfliktu interesów. Wersja 2.0 ostatnia aktualizacja dnia 4 sierpnia 2015
PROGRAM PROFILAKTYCZNYCH SZCZEPIEŃ PRZECIWKO PNEUMOKOKOM DZIECI
 GMINA PIASECZNO PROGRAM PROFILAKTYCZNYCH SZCZEPIEŃ PRZECIWKO PNEUMOKOKOM DZIECI ZAMIESZKAŁYCH NA TERENIE MIASTA I GMINY PIASECZNO NA LATA 2016 2018 Autor programu: Urząd Miasta i Gminie Piaseczno Spis
GMINA PIASECZNO PROGRAM PROFILAKTYCZNYCH SZCZEPIEŃ PRZECIWKO PNEUMOKOKOM DZIECI ZAMIESZKAŁYCH NA TERENIE MIASTA I GMINY PIASECZNO NA LATA 2016 2018 Autor programu: Urząd Miasta i Gminie Piaseczno Spis
Ulotka dołączona do opakowania: informacja dla użytkownika. POLIORIX, roztwór do wstrzykiwań
 Ulotka dołączona do opakowania: informacja dla użytkownika POLIORIX, roztwór do wstrzykiwań Szczepionka przeciw poliomyelitis, inaktywowana Szczepionka 1-dawkowa Należy uważnie zapoznać się z treścią ulotki
Ulotka dołączona do opakowania: informacja dla użytkownika POLIORIX, roztwór do wstrzykiwań Szczepionka przeciw poliomyelitis, inaktywowana Szczepionka 1-dawkowa Należy uważnie zapoznać się z treścią ulotki
POZA KLASYCZNYM DOSSIER I SPEŁNIANIEM WYMOGÓW FORMALNYCH WYKORZYSTANIE REAL WORLD DATA, PRZEGLĄDY BURDEN OF ILLNESS I UNMET NEED.
 POZA KLASYCZNYM DOSSIER I SPEŁNIANIEM WYMOGÓW FORMALNYCH WYKORZYSTANIE REAL WORLD DATA, PRZEGLĄDY BURDEN OF ILLNESS I UNMET NEED Izabela Pieniążek Klasyczne dossier? Rozporządzenie MZ w sprawie MINIMALNYCH
POZA KLASYCZNYM DOSSIER I SPEŁNIANIEM WYMOGÓW FORMALNYCH WYKORZYSTANIE REAL WORLD DATA, PRZEGLĄDY BURDEN OF ILLNESS I UNMET NEED Izabela Pieniążek Klasyczne dossier? Rozporządzenie MZ w sprawie MINIMALNYCH
MenB Information - Polish
 Meningokoki grupy B Na tej stronie można znaleźć krótkie podsumowanie informacji o zapobieganiu chorobie i szczepionce, która jest dostępna. Łącza do bardziej szczegółowych informacji można znaleźć u dołu
Meningokoki grupy B Na tej stronie można znaleźć krótkie podsumowanie informacji o zapobieganiu chorobie i szczepionce, która jest dostępna. Łącza do bardziej szczegółowych informacji można znaleźć u dołu
Rola i zadania AOTMiT w procesie refundacji leków Aneta Lipińska
 Rola i zadania AOTMiT w procesie refundacji leków Aneta Lipińska Agencja Oceny Technologii Medycznych i Taryfikacji (AOTMiT) Słów kilka o HTA HTA nie jest: nauką o ochronie zdrowia nauką / analizą dot.
Rola i zadania AOTMiT w procesie refundacji leków Aneta Lipińska Agencja Oceny Technologii Medycznych i Taryfikacji (AOTMiT) Słów kilka o HTA HTA nie jest: nauką o ochronie zdrowia nauką / analizą dot.
Ulotka dołączona do opakowania: informacja dla użytkownika
 Ulotka dołączona do opakowania: informacja dla użytkownika Prevenar 13 zawiesina do wstrzykiwań Szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13-walentna, adsorbowana) Należy uważnie zapoznać
Ulotka dołączona do opakowania: informacja dla użytkownika Prevenar 13 zawiesina do wstrzykiwań Szczepionka przeciw pneumokokom polisacharydowa, skoniugowana (13-walentna, adsorbowana) Należy uważnie zapoznać
UCHWAŁA NR... RADY MIEJSKIEJ W PIASECZNIE. z dnia... r.
 UCHWAŁA NR... RADY MIEJSKIEJ W PIASECZNIE z dnia...... r. w sprawie przyjęcia gminnego programu polityki zdrowotnej pod nazwą: Program profilaktycznych szczepień przeciwko pneumokokom dzieci zamieszkałych
UCHWAŁA NR... RADY MIEJSKIEJ W PIASECZNIE z dnia...... r. w sprawie przyjęcia gminnego programu polityki zdrowotnej pod nazwą: Program profilaktycznych szczepień przeciwko pneumokokom dzieci zamieszkałych
Neisseria meningitidis
 Neisseria meningitidis Wyłączny rezerwuar: : człowiek Źródło zakażenia: : nosiciel lub chory Kolonizacja: : jama nosowo-gardłowa Przenoszenie: : droga kropelkowa, bezpośredni kontakt Okres wylęgania: :
Neisseria meningitidis Wyłączny rezerwuar: : człowiek Źródło zakażenia: : nosiciel lub chory Kolonizacja: : jama nosowo-gardłowa Przenoszenie: : droga kropelkowa, bezpośredni kontakt Okres wylęgania: :
Jedna bakteria, wiele chorób
 Jedna bakteria, wiele chorób prof. dr hab. med. Jacek Wysocki dr n. med. Ilona Małecka Katedra i Zakład Profilaktyki Zdrowotnej, Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Specjalistyczny
Jedna bakteria, wiele chorób prof. dr hab. med. Jacek Wysocki dr n. med. Ilona Małecka Katedra i Zakład Profilaktyki Zdrowotnej, Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu Specjalistyczny
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
Agencja Oceny Technologii Medycznych www.aotm.gov.pl Rekomendacja nr 144/2013 z dnia 21 października 2013 r. Prezesa Agencji Oceny Technologii Medycznych w sprawie usunięcia świadczenia gwarantowanego
UCHWAŁA NR XXII/227/16 RADY MIEJSKIEJ W TRZEBNICY. z dnia 30 listopada 2016 r.
 UCHWAŁA NR XXII/227/16 RADY MIEJSKIEJ W TRZEBNICY z dnia 30 listopada 2016 r. w sprawie przyjęcia Programu profilaktycznego szczepień przeciwko meningokokom grupy C dzieci zamieszkałych na terenie Gminy
UCHWAŁA NR XXII/227/16 RADY MIEJSKIEJ W TRZEBNICY z dnia 30 listopada 2016 r. w sprawie przyjęcia Programu profilaktycznego szczepień przeciwko meningokokom grupy C dzieci zamieszkałych na terenie Gminy
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Agencja Oceny Technologii Medycznych
 Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 18/2013 z dnia 28 stycznia 2013 r. w sprawie zasadności finansowania leku Myozyme (alglukozydaza alfa) w ramach
Agencja Oceny Technologii Medycznych Rada Przejrzystości Stanowisko Rady Przejrzystości nr 18/2013 z dnia 28 stycznia 2013 r. w sprawie zasadności finansowania leku Myozyme (alglukozydaza alfa) w ramach
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
 CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO EUVAX B, 20 mikrogramów, zawiesina do wstrzykiwań Vaccinum hepatitidis B (ADNr) Szczepionka przeciw wirusowemu zapaleniu wątroby typu
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO 1. NAZWA PRODUKTU LECZNICZEGO EUVAX B, 20 mikrogramów, zawiesina do wstrzykiwań Vaccinum hepatitidis B (ADNr) Szczepionka przeciw wirusowemu zapaleniu wątroby typu
