Zakład Fizjologii Akademii Medycznej w Białymstoku
|
|
|
- Adam Owczarek
- 9 lat temu
- Przeglądów:
Transkrypt
1 Postepy Hig Med Dosw. (online), 2008; 62: e-issn Review Received: Accepted: Published: Udział białek transportujących (FAT/CD36, FABPpm, FATP) w metabolizmie lipidów w mięśniach szkieletowych The role of fatty-acid transport proteins (FAT/CD36, FABPpm, FATP) in lipid metabolism in skeletal muscles Ewa Harasim, Agnieszka Kalinowska, Tomasz Stępek, Adrian Chabowski Zakład Fizjologii Akademii Medycznej w Białymstoku Streszczenie Mięśnie szkieletowe, stanowią tkankę, która jest w istotny sposób zaangażowana w ogólnoustrojową homeostazę substratów energetycznych, m.in. glukozy i długołańcuchowych kwasów tłuszczowych (LCFA). Dzięki hydrofobowej naturze LCFA mogą przechodzić do wnętrza komórek mięśniowych za pośrednictwem dyfuzji prostej zgodnie z gradientem stężeń. Wykazano jednak, że w miocytach mięśni szkieletowych dokomórkowy transport LCFA zachodzi także z udziałem białkowych przenośników. Dotąd zidentyfikowano trzy rodzaje białek wspomagających transport długołańcuchowych kwasów tłuszczowych: translokazę kwasów tłuszczowych (FAT/CD36 fatty acid translocase), białko wiążące kwasy tłuszczowe (FABPpm plasma membrane associated fatty acid binding protein) oraz białka transportujące kwasy tłuszczowe (FATP1-6 fatty acid transport protein). W dotychczas przeprowadzonych badaniach stwierdzono, że zarówno całkowita ekspresja, jak i translokacja transporterów długołańcuchowych kwasów tłuszczowych jest procesem podlegającym regulacji. Wykazano, że wysiłek fizyczny powoduje nie tylko zwiększenie utleniania długołańcuchowych kwasów tłuszczowych, ale również warunkuje wzrost ekspresji białkowych transporterów (FAT/CD36 i FABPpm). Stwierdzono również, że wzrost aktywności skurczowej mięśni szkieletowych powoduje przemieszczanie się białek transportujących z puli wewnątrzkomórkowej do błony komórkowej, co w konsekwencji powoduje nasilenie przezbłonowego transportu dokomórkowego LCFA. Słowa kluczowe: mięśnie szkieletowe długołańcuchowe kwasy tłuszczowe FAT/CD36 FABPpm FATP1 wysiłek fizyczny Summary Skeletal muscles display an essential role in the regulation of whole-body energy homeostasis. Because of their hydrophobic nature, long-chain fatty acids (LCFAs) can enter cells via passive diffusion along the concentration gradient across the sarcolemma. However, it was also shown recently that protein-mediated transport of LCFAs occurs in skeletal muscles. So far, three groups of long-chain fatty-acid transport proteins have been identified that facilitate LCFA transport: fatty-acid translocase (FAT/CD36), plasma membrane-associated fatty-acid binding protein (FABPpm), and fatty-acid transport proteins (FATP) 1-6. Several studies revealed that both the expression and the translocation of FA transporters is process that can be highly regulated. Recent studies had shown that exercise training increases not only the oxidation of long-chain fatty acids, but also the expression of protein transporters. It was also shown that contractile activity of skeletal muscles is able to induce the translocation of protein transporters (FAT/CD36) 433
2 Postepy Hig Med Dosw (online), 2008; tom 62: Powszechnie wiadomo, że nasilenie czynności skurczowej mięśni szkieletowych powoduje zwiększenie zapotrzebofrom the intracellular compartment to the sarcolemma with a subsequent increase in LCFA transmembrane transport. Key words: skeletal muscle long-chain fatty acids FAT/CD36 FABPpm FATP1 exercise training Full-text PDF: Word count: 3606 Tables: Figures: 1 References: 80 Adres autorki: dr hab. Adrian Chabowski, Zakład Fizjologii Uniwersytetu Medycznego w Białymstoku, ul. Mickiewicza 2c, Białystok; adrian@amb.edu.pl 1. ROLA DŁUGOŁAŃCUCHOWYCH KWASÓW TŁUSZCZOWYCH W MIĘŚNIACH SZKIELETOWYCH 1.1 Metabolizm i energetyka mięśni szkieletowych 434 Mięśnie szkieletowe są tkanką istotnie zaangażowaną w proces utylizacji podstawowych substratów energetycznych: glukozy i długołańcuchowych kwasów tłuszczowych. Proces aktywności skurczowej miocytów wymaga ciągłego dostarczania energii w postaci adenozynotrifosforanu (ATP), którego zasoby w mięśniach szkieletowych są znikome (około 25 mm/kg suchej tkanki mięśniowej). Takie ilości wewnątrzmięśniowego ATP zapewniają energię do wykonania jedynie kilku skurczy. W celu utrzymania odpowiedniego stężenia ATP na względnie stałym poziomie wewnątrz miocytu musi zachodzić nieustanna synteza tego nukleotydu. Początkowo, szczególnie podczas wysiłków krótkotrwałych i intensywnych, w mięśniach szkieletowych resynteza adenozynotrifosforanu zachodzi w wyniku enzymatycznego przeniesienia na ADP bogatoenergetycznej grupy fosforanowej pochodzącej z zasobów fosfokreatyny wewnątrzmięśniowej. Należy jednak podkreślić, że resynteza ATP zachodzi głównie w wyniku procesu glikolizy tlenowej. Głównym źródłem glukozy w pracujących miocytach jest glukoza pochodząca z rozkładu glikogenu wewnątrzmięśniowego, ale wykorzystywana jest również glukoza krwiopochodna. W miarę przedłużania się wysiłku fizycznego znaczna część resyntetyzowanego ATP uzyskiwana jest w wyniku przemian tlenowych długołańcuchowych kwasów tłuszczowych (LCFA long chain fatty acid), dostarczanych z krwią, bądź pochodzących z hydrolizy triacylogliceroli wewnątrzmięśniowych. W niewielkim stopniu ATP może być resyntetyzowane z aminokwasów oraz w reakcji katalizowanej poprzez kinazę adenylanową (miokinazę). Należy zaznaczyć, że gdy zapewniona jest w kurczących się miocytach odpowiednia dostawa tlenu, przemiany tlenowe, czyli procesy fosforylacji oksydacyjnej, glukozy oraz LCFA są źródłem przeważającej ilości energii. W wyniku zachodzącej glikolizy tlenowej, z jednego mola glukozy powstaje około 38 moli ATP, zaś podczas utleniania jednej cząsteczki kwasu palmitynowego (główny przedstawiciel wolnych kwasów tłuszczowych) powstaje aż 129 moli ATP. Dla porównania, w wyniku procesów beztlenowych (glikoliza beztlenowa) zachodzących z wytworzeniem kwasu mlekowego powstają jedynie dwie cząsteczki ATP. Rodzaj czynności skurczowej, czas jej trwania oraz maksymalna siła rozwijana podczas wykonywanej pracy mięśniowej ma ogromny wpływ na grupę wykorzystywanych substratów energetycznych [52] Wykorzystanie długołańcuchowych kwasów tłuszczowych w mięśniach szkieletowych Mięśnie szkieletowe nie mogą syntetyzować de novo długołańcuchowych kwasów tłuszczowych, a w trakcie długotrwałego wysiłku fizycznego rozkład triacylogliceroli wewnątrzmięśniowych nie zapewnia wystarczającej ich ilości. Głównym źródłem LCFA jest zatem krew [66]. W trakcie wysiłku fizycznego miocyty zużywają prawie 90% wolnych kwasów tłuszczowych pochodzących z osocza krwi, a tylko w 10% źródłem energii są zmagazynowane wewnątrzmięśniowo triacyloglicerole [26]. Do wnętrza miocytu, LCFA dostają się za pośrednictwem dyfuzji biernej, bądź też w procesie transportu zachodzącego z udziałem białkowych przenośników (patrz rozdział Drogi transportu LCFA do komórek mięśniowych ). Po przejściu błony komórkowej, w cytoplazmie miocytów część długołańcuchowych kwasów tłuszczowych jest wiązana przez FABPc (białko wiążące kwasy tłuszczowe) i przenoszona w okolice mitochondriów, gdzie są uwalniane i łączą się z koenzymem A, z udziałem syntetazy acylo-coa. Pozostała część długołańcuchowych kwasów tłuszczowych podlega procesom estryfikacji głównie do puli triacylogliceroli (ryc. 1). Po wejściu do miocytów niewielka ilość długołańcuchowych kwasów tłuszczowych nie jest wiązana z FABPc i podlega bezpośredniej aktywacji przez połączenie się z koenzymem A (CoA), a powstały acylo-coa łączy się z białkiem wiążącym acylo-coa (ACBP acyl CoA binding protein) i jest transportowany w tej postaci do błony mitochondrialnej. Acylo-CoA łączy się następnie z karnityną za pomocą enzymu błony zewnętrznej mitochondrium, palmitoilotransferazy karnitynowej I (CPT I carnitine palmitoyltransferase I). Powstała acylokarnityna jest przenoszona do wnętrza mitochondrium, gdzie kolejny enzym palmitoilotransferaza karnitynowa II (CPT II carnitine palmitoyltransferase II) powoduje ponowne powstanie acylo-coa oraz wolnej karnityny. W kolejnych etapach acylo-coa podlega procesowi oksydacyjnej dekarboksylacji z wytworzeniem acetylo-coa, który włączany jest do cyklu Krebsa (cykl kwasu cytrynowego) [52].
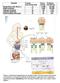
3 Harasim E. i wsp. Udział białek transportujących (FAT/CD36, FABPpm, FATP) Ryc. 1. Schemat przedstawiający transport i metabolizm długołańcuchowych kwasów tłuszczowych w miocytach mięśni szkieletowych; FAT/CD36 translokaza kwasów tłuszczowych, FABPpm białko wiążące kwasy tłuszczowe, FATP białko transportujące kwasy tłuszczowe, FABPc cytoplazmatyczne bialko wiążące kwasy tłuszczowe, ACS syntetaza acylo-coa, ACBP białko wiążące acylo-coa, CoA koenzym A, długołańcuchowe kwasy tłuszczowe wania energetycznego, co również zwiększa dokomórkowy transport i nasilenie utleniania LCFA [25]. Zarówno badania in vivo, jak i in vitro wykazały, że czynność skurczowa jest główną przyczyną zwiększonego dokomórkowego transportu LCFA [26,32]. Należy zaznaczyć, że długołańcuchowe kwasy tłuszczowe w kurczących się miocytach są poddawane głównie procesom utleniania, a nie procesom estryfikacji do triacylogliceroli. Natomiast procesy estryfikacji wolnych kwasów tłuszczowych dominują przede wszystkim podczas spoczynku i w przerwach między np. treningami [23,25]. Oprócz znaczenia czysto energetycznego, należy podkreślić, że wolne kwasy tłuszczowe w wielu tkankach, w tym także w mięśniach szkieletowych, uczestniczą w innych istotnych procesach komórkowych, m.in. w syntezie błony komórkowej, posttranslacyjnej modyfikacji białek, a także w modulacji przekazywania sygnałów wewnątrzkomórkowych [3,23,31,62,68]. 2. DROGI TRANSPORTU LCFA DO KOMÓREK MIĘŚNI SZKIELETOWYCH 2.1. Dokomórkowy transport LCFA Długołańcuchowe kwasy tłuszczowe są transportowane w osoczu głównie w połączeniu z albuminami. Z mikrokrążenia LCFA, aby dostać się do wnętrza miocytów mięśni szkieletowych, muszą pokonać wiele barier biologicznych. Wiadomo, że LCFA ze względu na hydrofobową naturę mogą przechodzić przez błonę komórkową na zasadzie dyfuzji prostej (tzw. mechanizm flip-flop), zgodnie z gradientem stężeń. Ten rodzaj transportu biernego LCFA doświadczalnie wykazano głównie w oparciu o sztuczne modele błon komórkowych pozbawionych wyspecjalizowanych cząsteczek białkowych, wspomagających wychwyt kwasów tłuszczowych [35,51] (ryc. 1). Dalsze badania wykazały, że na proces transportu dokomórkowego LCFA składają się trzy główne etapy: adsorpcja długołańcuchowych kwasów tłuszczowych do błony komórkowej, przejście ich przez błonę oraz uwolnienie LCFA po stronie wewnętrznej błony [36]. Na początku lat 80 ub.w. Abumrad i wsp. [2] stwierdzili, że dokomórkowe przechodzenie LCFA jest procesem podlegającym wysyceniu, co świadczyło, że w transport LCFA są zaangażowane białkowe przenośniki. W kolejnych badaniach in vitro wykazano, że zarówno obniżenie temperatury inkubacji, jak i dodanie do buforu inkubacyjnego związków blokujących białka błonowe hamuje transport przezbłonowy LCFA. W modelach in vivo stwierdzono natomiast, że mimo stale wysokiego gradientu stężeń długołańcuchowych kwasów tłuszczowych w poprzek błony komórkowej, dochodzi do zmiany wielkości transportu LCFA, co jest kolejnym argumentem potwierdzającym obecność białek wspomagających transport przezbłonowy kwasów tłuszczowych [36,37]. Kolejne badania potwierdziły, że transport LCFA do komórki zachodzi z udziałem białkowych przenośników, m.in. do adipocytów, enterocytów, hepatocytów, nefronów, kardiomiocytów serca oraz komórek mięśni szkieletowych [14]. 435
4 Postepy Hig Med Dosw (online), 2008; tom 62: Istotnych dowodów potwierdzających udział białkowych transporterów w dokomórkowym transporcie LCFA, dostarczyły badania przeprowadzone na myszach niemających jednego z białkowych przenośników (FAT/CD36 knock out), bądź też wykazujących jego nadekspresję (FAT/CD36 over expression). Brak białka błonowego FAT/CD36 powodował wzrost stężenia długołańcuchowych kwasów tłuszczowych (LCFA), triacylogliceroli oraz cholesterolu w surowicy krwi tych zwierząt [28]. Natomiast zwierzęta, które odznaczały się zwiększoną ekspresją w mięśniach szkieletowych białka FAT/CD36 miały zmniejszone stężenia w surowicy krwi LCFA, triacylogliceroli i cholesterolu [47]. Wykazano, że u myszy z nadekspresją translokazy kwasów tłuszczowych (FAT/CD36) w mięśniach szkieletowych (soleus) dochodzi do wzmożonego utleniania wolnych kwasów tłuszczowych, zwłaszcza w odpowiedzi na wzrost czynności skurczowej. Stwierdzono również, że u zwierząt z nadekspresją FAT/CD36 [47], oprócz wzrostu oksydacji LCFA, dochodzi do wzmożonego wychwytu LCFA do wnętrza miocytów. Natomiast u zwierząt z brakiem genu FAT/CD36 [19, 28] dokomórkowy transport długołańcuchowych kwasów tłuszczowych ulegał redukcji w mięśniu sercowym (50 80%), mięśniach szkieletowych (40 75%) i w tkance tłuszczowej (60 70%). Powyższe badania wykazały istotną rolę białkowych transporterów w przenoszeniu LCFA do wnętrza komórek. Jednocześnie stwierdzono, że zawartość białkowych transporterów (FAT/CD36,FABPpm,FATP) długołańcuchowych kwasów tłuszczowych jest szczególnie duża w tkankach o dużym metabolizmie i utlenianiu LCFA, czyli w mięśniach szkieletowych, sercu oraz tkance tłuszczowej [1]. 2.2 Translokaza kwasów tłuszczowych (FAT/CD36) Wyniki wielu prac z ostatnich lat potwierdzają istnienie trzech grup białkowych transporterów ułatwiających przezbłonowy transport wolnych kwasów tłuszczowych [13,14]. Zgodnie z obecną wiedzą, do białek transportujących zaliczono: translokazę kwasów tłuszczowych (FAT/CD36 fatty acid translocase), białko wiążące kwasy tłuszczowe (FABPpm plasma membrane associated fatty acid binding protein) oraz białka transportujące kwasy tłuszczowe (FATP1-6 fatty acid transport protein). Należy jednak zaznaczyć, że dokładny mechanizm działania, zwłaszcza sposób przechodzenia LCFA w poprzek błony komórkowej z udziałem poszczególnych transporterów nie jest jeszcze do końca poznany. FAT/CD36, czyli translokaza kwasów tłuszczowych należy do białek błonowych, jak dotąd najlepiej poznanych. Odkryta jako 88 kda białko transbłonowe występujące w błonie komórkowej adipocytów. Następnie okazało się, że przewidywana masa cząsteczkowa FAT/CD36 wynosi 53 kda, natomiast oznaczana wartość około 88 kda, jest prawdopodobnie skutkiem glikozylacji tego białka [1]. Wykazano także, że białko FAT/CD36 jest w 85% homologiczne z ludzką glikoproteiną IV (CD36) i jest obecne na wielu rodzajach komórek, m.in. płytkach krwi, komórkach hematopoetycznych, monocytach/makrofagach, adipocytach, komórkach śródbłonka naczyń, miocytach, kardiomiocytach, komórkach dendrytycznych, komórkach nabłonka barwnikowego siatkówki oraz gruczołu sutkowego, a także enterocytach [1,27,29,33,34,63,64,67,74]. W jednym z pierwszych doświadczeń wykazano, że FAT/CD łączy się swoiście z estrami długołańcuchowych kwasów tłuszczowych (SSO sulfo-n-bursztynyloimidylooleinian) i to swoiste związanie FAT/CD36 z SSO powodowało znaczny spadek transportu LCFA do wnętrza adipocytów [39,40]. Kolejne badania wykazały, że modyfikacja genetyczna i wprowadzenie genu białka FAT/CD36 do genomu fibroblastów, które w prawidłowych warunkach wykazują brak ekspresji FAT/CD36, spowodowało wzrost zawartości FAT/CD36 w błonie fibroblastów i skutkowało wzrostem wychwytu LCFA do wnętrza tych komórek. Istotnym było także stwierdzenie, że wielkość transportu dokomórkowego LCFA była wprost proporcjonalna do wielkości ekspresji translokazy kwasów tłuszczowych [48]. Kolejne badania prowadzone na izolowanych kompartmentach komórkowych, uzyskanych w wyniku przeprowadzonego procesu frakcjonowania komórek mięśni szkieletowych wykazały, że cząsteczki FAT/CD36 są obecne zarówno w błonie komórkowej, jak i w puli pęcherzyków cytoplazmatycznych. Stwierdzono następnie, że podczas czynności skurczowej, trwającej około 30 min, dochodzi do przemieszczania wewnątrzkomórkowych cząsteczek FAT/CD36 do powierzchni błony komórkowej. Translokacji FAT/CD36 towarzyszyło jednocześnie zwiększenie dokomórkowego transportu długołańcuchowych kwasów tłuszczowych. Podobne badania wykazujące wzrost zawartości plazmatycznego FAT/CD36 prowadzono także u ludzi, u których wykazano, że wysiłek fizyczny jest silnym bodźcem powodującym przemieszczanie się puli transportera FAT/CD36 do błony komórkowej mięśni szkieletowych [12,56,57]. Opisany mechanizm translokacji FAT/CD36 z puli pęcherzyków do błony komórkowej jest analogiczny w stosunku do wcześniej odkrytego przemieszczania się transportera glukozy GLUT-4 [16]. Zbadano także wpływ insuliny na możliwość translokacji białka FAT/CD36. Stwierdzono, że insulina, wskutek aktywacji sygnałów wewnątrzkomórkowych związanych z kaskadą fosfatydylo-inozytolo-3 kinazy (PI3K phosphoinositide-3 kinase), powoduje przemieszczanie FAT/CD36 z wnętrza komórki do powierzchni błony komórkowej, co warunkuje wzrost transportu dokomórkowego LCFA [38,56,57]. Podobnie jak w przypadku stymulacji elektrycznej mięśni szkieletowych, insulina zwiększała ekspresję białka CD36 w sarkoplazmie, ale oprócz zwiększonego transportu LCFA do wnętrza komórki powodowała wzrost estryfikacji LCFA i jednocześnie spadek ich utleniania w procesie b-oksydacji [56]. Stwierdzono również, że aktywacja innych sygnałów wewnątrzkomórkowych ma znaczenie w regulacji ekspresji FAT/CD36. Farmakologiczne (AICAR 5-aminoimidazole-4-carboxamide ribonucleoside) nasilenie aktywności kaskady kinazy zależnych od AMP (AMPK AMP activated protein kinase) powoduje translokację białka FAT/CD36 do błony komórkowej i wzmożenie transportu przezbłonowego LCFA [59]. Wyniki kolejnych badań wskazują, że także aktywacja ERK 1/2 (ERK extra-cellular signal-regulated kinase 1/2), która zachodzi podczas skurczy mięśni szkieletowych, podobnie jak aktywacja AMPK może powodować indukcję przemieszczania się białka FAT/CD36 z wnętrza komórek do powierzchni błony komórkowej [76]. Obecność translokazy kwasów tłuszczowych wykazano w błonie mitochondriów, zarówno w tkance mięśni szkie-
5 Harasim E. i wsp. Udział białek transportujących (FAT/CD36, FABPpm, FATP) letowych zwierząt [16], jak i ludzi [8,44]. Następnie stwierdzono, że wzrostowi mitochondrialnej ekspresji FAT/CD36, stymulowanej przez trening fizyczny (około 7 dni), towarzyszy jednoczesny wzrost b-oksydacji LCFA. W kolejnych badaniach zaobserwowano przemieszczenie się translokazy kwasów tłuszczowych do puli mitochondrialnej, a także jednoczesny wzrost utleniania LCFA w mitochondrium [16,44]. Stwierdzono również, że funkcjonalne zablokowanie translokazy kwasów tłuszczowych, przez zastosowanie SSO (sulfo-n-bursztynyloimidylooleinian swoisty inhibitor FAT/CD36) w wyizolowanych mitochondriach mięśni szkieletowych, powodowało prawie całkowite zahamowanie (do 90%) procesu b-oksydacji długołańcuchowych kwasów tłuszczowych, przy czym poziom utleniania krótkołańcuchowych kwasów pozostawał bez zmian [8,16,44]. Tym niemniej, rola jaką pełni FAT/CD36 w błonie mitochondriów nie jest do końca poznana, prawdopodobnie białko to współdziała z palmitoilotransferazą karnitynową I (CPT-I) w regulacji transportu LCFA do matrix mitochondrialnej [10], gdyż stwierdzono, że FAT/CD36 jest fizycznie połączone z CPT-I w błonie zewnętrznej mitochondriów. Translokaza kwasów tłuszczowych, wspólnie z CPT-I, jest prawdopodobnie odpowiedzialna za tempo utleniania (b-oksydacji) LCFA w mitochondriach mięśni szkieletowych [8]. Potwierdzeniem tych obserwacji były badania przeprowadzone u ludzi, u których stwierdzono, że aktywność skurczowa mięśni szkieletowych powoduje przemieszczanie białka FAT/CD36 do błony mitochondrialnej oraz nasila aktywność CPT-I, co warunkuje przyspieszenie procesu utleniania LCFA [69]. 2.3 Białko wiążące kwasy tłuszczowe (FABPpm) FABPpm jest kolejnym białkiem zaangażowanym w transport LCFA do komórek mięśni szkieletowych. Masa cząsteczkowa tego białka wynosi około 40 kda. Po raz pierwszy FABPpm zidentyfikowano na powierzchni hepatocytów [72]. Białko to zostało także wykryte w hodowanych miocytach mięśni szkieletowych, przez zastosowanie swoistych przeciwciał skierowanych przeciwko FABPpm. Użycie swoistych przeciwciał w tych hodowlach spowodowało znaczny spadek dokomórkowego transportu LCFA [21,71,72]. Należy podkreślić, że FABPpm [73] jest białkiem błonowym umiejscowionym prawdopodobnie na powierzchni zewnętrznej błony komórkowej, podczas gdy FAT/CD36 [1], jak i FATP [68] stanowią integralne składniki błon komórkowych (ryc. 1). W kolejnych badaniach stwierdzono obecność białka FABPpm w większości tkanek metabolicznie aktywnych [6,7,14,77,78], oraz wykazano, że sekwencja aminokwasowa transportera białkowego FABPpm jest identyczna z sekwencją mitochondrialnej aminotransferazy asparaginianowej (maspat) [73]. Dowodów na udział białka FABPpm w przezbłonowym transporcie LCFA dostarczyły badania przeprowadzane na fibroblastach linii 3T3-L1 [49] i miocytach mięśni szkieletowych [18] zawierających cytoplazmatyczne DNA mitochondrialnej aminotransferazy asparaginianowej (maspat jest homologiczna z FABPpm). Wykazano, że nadekspresja genu maspat/fabppm, w wymienionych liniach komórkowych, prowadzi do wzrostu ekspresji FABPpm na powierzchni fibroblastów i miocytów oraz następczego zwiększenia dokomórkowego napływu LCFA [18,49]. Wyniki prac z ostatnich lat stwierdzają, że aktywność skurczowa mięśni szkieletowych indukuje nie tylko translokację FAT/CD36, ale także FABPpm z puli wewnątrzkomórkowej do błony komórkowej miocytu [38]. Nie określono jednakże jednoznacznie procentowego udziału białka FABPpm w transporcie LCFA w porównaniu z innymi transporterami. Nie stwierdzono także czy białka transportujące kwasy tłuszczowe (FAT/CD36 i FABPpm) indywidualnie uczestniczą w transporcie LCFA, czy też tworzą wspólny system transportujący. Jak już wcześniej wspomniano przenośnik białkowy FABPpm ma identyczną sekwencję aminokwasową, jak mitochondrialna maspat, stąd jego obecność w mitochondriach [17]. Istotne wydaje się więc pytanie, czy białko wiążące kwasy tłuszczowe jest także zaangażowane w transport LCFA do mitochondrium i dalsze przemiany tlenowe (proces b-oksydacji) tych związków. Holloway i wsp. [45] zbadali wpływ FABPpm/mAspAT na zmiany mitochondrialnego transportu i procesu b-oksydacji długołańcuchowych kwasów tłuszczowych. W przeciwieństwie do FAT/ CD36, elektryczna stymulacja mięśni szkieletowych nie powodowała zmian w mitochondrialnej zawartości transportera białkowego FABPpm/mAspAT [16,45]. Podobne wyniki uzyskano podczas badań u ludzi poddanych 2-godzinnemu treningowi fizycznemu. Stwierdzono brak zmian w ilości białka FABPpm/mAspAT, z jednoczesnym wzrostem zawartości FAT/CD36 o ponad 33%, w izolowanych mitochondriach z mięśni szkieletowych [45], co sugeruje brak zaangażowania białka FABPpm w transport LCFA w poprzek błony mitochondrialnej Białka transportujące kwasy tłuszczowe (FATP) Kolejnymi białkowymi transporterami LCFA jest rodzina białek transportujących kwasy tłuszczowe (FATP). Stwierdzono, że białka transportujące kwasy tłuszczowe występują w 6 izoformach (FATP1-6), których ekspresja jest swoista tkankowo [43,68]. Z tej grupy transporterów jako pierwsze wykryto białko FATP1 (Schaffer i Lodish) w błonie komórkowej adipocytów [68]. Należy ono do integralnych białek błonowych i składa się z 646 aminokwasów, o łącznej masie cząsteczkowej 63 kda. U myszy i szczurów ekspresja FATP1 jest szczególnie wysoka w tkance tłuszczowej, mięśniach szkieletowych i mięśniu sercowym [43,68], zaś u ludzi występuje głównie w tkance tłuszczowej i mięśniach szkieletowych [9,14]. Pozostałe transportery białkowe z tej grupy wykazują zróżnicowaną ekspresję, FATP2 występuje głównie w wątrobie i nerkach [42], natomiast umiejscowienie i rola FATP3 są jak dotąd bardzo słabo poznane [22]. FATP4 występuje w mięśniach szkieletowych i tkance tłuszczowej ludzi oraz jest jedynym białkowym transporterem kwasów tłuszczowych umiejscowionym w jelicie cienkim [14,70]. Z kolei FATP5 jest obecny przede wszystkim w wątrobie [24], a FATP6 wykazuje największą ekspresję w mięśniu sercowym [30]. Badania przeprowadzane na drożdżach przez DiRusso i wsp. [22] wykazały, że transport LCFA zachodzący z udziałem poszczególnych izoform FATP zachodzi z różną efektywnością. Wykazano, że FATP1, 2 oraz 4 zwiększają wielkość dokomórkowego transportu LCFA odpowiednio 8,2-, 4,5- i 13,1-krotnie. Pozostałe przenośniki białkowe z tej grupy, FATP3 i FATP5, powodują jedynie 2-krotne zwiększenie transportu LCFA. Natomiast zmiana ekspresji FATP6 nie wpływała na wielkość transportu długołańcuchowych kwa- 437
6 Postepy Hig Med Dosw (online), 2008; tom 62: sów tłuszczowych [22]. Wydaje się, że dotychczas najlepiej określono funkcję FATP1. Wykazano bowiem, że początkowa sekwencja mysiego genu białka transportującego kwasy tłuszczowe (FATP1) jest homologiczna z poligenową rodziną enzymu syntetazy acylo-coa. Stwierdzono także, że białko FATP1 ma wewnętrzną aktywność syntetazy długołańcuchowych kwasów tłuszczowych [20,22], co wskazuje na zaangażowanie FATP1 nie tylko w dokomórkowy transport LCFA, ale także na udział w przekształcaniu cząsteczek długołańcuchowych kwasów tłuszczowych w acylo-coa już w cytoplazmie. Wykazano, że do prawidłowego funkcjonowania, FATP1 wymaga nakładu energii w postaci ATP, które jest niezbędne do wzmożenia aktywności syntetazy długołańcuchowych kwasów tłuszczowych [20] Stopień ekspresji białkowych transporterów FAT/CD36, FABPpm i FATP1 w zależności od rodzaju włókien mięśniowych W mięśniach szkieletowych zwierząt doświadczalnych (szczury i myszy) badania potwierdziły obecność zarówno mrna, jak i białkowych produktów (FAT/CD36, FABPpm, FATP1) [13]. Wykazano także obecność wyżej wymienionych transporterów (na poziomie translacyjnym, jak i posttranslacyjnym) w tkance mięśniowej u ludzi [14]. W mięśniach szkieletowych ludzi można wyróżnić różne typy włókien mięśniowych zależnie od dominujących procesów utylizacji substratów energetycznych. Wyodrębniono trzy zasadnicze grupy włókien mięśniowych: włókna SO (slow-twich oxidative) wolno kurczące się, oporne na zmęczenie, tlenowe (tzw. włókna czerwone), włókna FOG (fast-twich oxidative-glycolytic) szybko kurczące się, oporne na zmęczenie, tlenowo-glikolityczne (tzw. włókna mieszane), włókna FG (fast-twich glycolytic) szybko kurczące się, podatne na zmęczenie, glikolityczne (tzw. włókna białe). Stwierdzono, że ekspresja białkowych przenośników zależy od aktywności metabolicznej poszczególnych rodzajów włókien mięśni szkieletowych. Mięśnie szkieletowe z przeważającą liczbą włókien tlenowych odznaczają się dużym stopniem utleniania LCFA oraz dużą zawartością białkowych transporterów długołańcuchowych kwasów tłuszczowych (włókna czerwone > włókna białe) [13]. Kolejne badania wykazały także, że ilość mrna FATP1, FAT/CD36 oraz FABPpm była prawie 5-krotnie wyższa w czerwonych (przewaga włókien typu SO) aniżeli w białych włóknach mięśni szkieletowych [13]. Należy podkreślić, iż zgodnie z nasileniem ekspresji białkowych transporterów (FAT/CD36, FABPpm i FATP-1) dokomórkowy transport kwasów tłuszczowych jest także znacznie większy w czerwonych, aniżeli w białych włóknach mięśni szkieletowych [13] Regulacja transportu LCFA na poziomie transkrypcyjnym 438 W pojedynczych miocytach mięśni szkieletowych metabolizm lipidów na poziomie transkrypcyjnym jest regulowany głównie poprzez ligandozależne receptory jądrowe proliferatorów peroksysomów (PPAR peroxisome proliferator-activated receptors). PPAR po raz pierwszy zostały zidentyfikowane przez Issemanna i Greena [50] w wątrobie myszy. Dotychczas potwierdzono istnienie trzech typów receptorów jądrowych PPAR, a mianowicie a, d (zwany inaczej b bądź NUC-1) oraz g, które są kodowane przez oddzielne geny. Poszczególne typy PPAR wykazują (podobnie jak białkowe transportery kwasów tłuszczowych) zróżnicowaną ekspresję w zależności od rodzaju tkanki. Wątroba, serce czy nerki to narządy z intensywnym metabolizmem kwasów tłuszczowych, ale również z najbardziej zaznaczoną ekspresją PPARa [60]. Zasadniczą rolą tego receptora jest regulacja transkrypcji genów związanych zarówno z mitochondrialnym, jak i peroksysomalnym procesem b-oksydacji kwasów tłuszczowych [55]. Obie izoformy PPARg (g1 i g2) w największym stopniu zaangażowane są w proces różnicowania się preadipocytów do adipocytów w tkance tłuszczowej [4]. Z kolei ostatni z receptorów PPARb/d (NUC-1) pojawia się we wszystkich rodzajach tkanek [15]. Badano wpływ aktywacji receptorów PPAR na metabolizm LCFA w mięśniach szkieletowych. Benton i wsp. [5] wykazali, że w mięśniach szkieletowych zarówno aktywacja PPARa, jak i PPARg nie powodują zmian w ekspresji białka FAT/CD36. Stwierdzono natomiast, że aktywacja PPARg powoduje wybiórcze nasilenie ekspresji transportera FABPpm. Wykazano także, że wzmożony dokomórkowy transport LCFA spowodowany zwiększoną aktywnością skurczową nie jest wynikiem aktywacji PPARa i/lub PPARg [5]. Trwają badania określające rolę kolejnego receptora PPAR, PPARb/d w regulacji procesu b-oksydacji kwasów tłuszczowych w mięśniach szkieletowych. Dotychczas wykazano, że swoiści agoniści PPARb/d powodują wzrost ekspresji genów kodujących, takie białka jak FAT/CD36 oraz CPT-I, co pośrednio sugeruje wpływ aktywacji PPARb/d na dokomórkowy transport LCFA i ich wewnątrzmięśniowy metabolizm [46,61]. 3. WPŁYW WYSIŁKU FIZYCZNEGO NA EKSPRESJĘ TRANSPORTERÓW BIAŁKOWYCH (FAT/CD36, FABPpm, FATP1) I TRANSPORT LCFA Podstawowe mechanizmy regulujące transport LCFA do komórek mięśni szkieletowych, to zmiany ekspresji białek transportujących i/lub zmiany ich wewnątrzkomórkowego umiejscowienia. Z przeprowadzonych w ostatnich latach badań wynika, że najbardziej zaangażowane w transport LCFA do miocytów są białka błonowe: FAT/CD36 [1] oraz FABPpm [72,78,80]. Najmniej prac istnieje na temat roli FATP-1 w transporcie i metabolizmie długołańcuchowych kwasów tłuszczowych. Dotychczas wykazano związek między wielkością ekspresji FATP1, a stopniem estryfikacji LCFA i wewnątrzmięśniową zawartością triacylogliceroli. Stwierdzono, że cząsteczki wolnych kwasów tłuszczowych, które przeniesiono do miocytów mięśni szkieletowych przy współudziale FATP1, były głównie poddawane syntezie do triacylogliceroli [41]. Stwierdzono także, że myszy poddane 3-tygodniowej diecie bogatotłuszczowej oraz pozbawione FATP1 odznaczały się znaczną redukcją zawartości triacylogliceroli oraz diacylogliceroli w mięśniu czworogłowym uda w porównaniu z dzikimi myszami zawierającymi to białko [53]. Znacznie więcej doniesień opisuje zmiany ekspresji pozostałych dwóch białkowych transporterów (FAT/CD36 i FABPpm), zachodzących pod wpływem wysiłku fizycz-
7 Harasim E. i wsp. Udział białek transportujących (FAT/CD36, FABPpm, FATP) nego. Turcotte i wsp. [79] oceniali zarówno transport, jak i wielkość utleniania kwasu palmitynowego w wyizolowanych mięśniach, a także zawartość FABPpm w błonach komórkowych dwóch rodzajów włókien mięśniowych (tj. włóknach białych oraz czerwonych). W badaniach tych wykazano, że długotrwały trening powodował znaczny wzrost wychwytu LCFA z osocza do miocytów mięśni szkieletowych i zwiększenie utleniania wolnych kwasów tłuszczowych, głównie w grupie mięśni czerwonych. Stwierdzono również istotny statystycznie wzrost ilości białka wiążącego kwasy tłuszczowe, ale jedynie w włóknach czerwonych mięśni szkieletowych. Wykazano również, że długotrwały trening fizyczny powoduje zwiększenie ilości FABPpm [65,75,79] oraz wzrost szybkości utleniania długołańcuchowych kwasów tłuszczowych [79]. Otrzymane wyniki jednoznacznie wskazują na istotną rolę FABPpm w regulacji metabolizmu LCFA w mięśniach szkieletowych poddanych długotrwałemu wysiłkowi fizycznemu. Stwierdzono także, że podczas czynności skurczowej mięśni szkieletowych (wysiłek fizyczny trwający 5 7 dni) dochodzi do znacznego wzrostu ekspresji białka FAT/CD36, jak i jego błonowej zawartości, któremu towarzyszy wzrost transportu LCFA do miocytów, głównie w mięśniach o przewadze metabolizmu tlenowego (włóknach czerwonych) [14]. Przeprowadzono także doświadczenia z zastosowaniem swoistego inhibitora (SSO) blokującego zawarte w błonie komórkowej białko FAT/CD36. Podanie SSO powodowało zahamowanie przyrostu wychwytu kwasu palmitynowego indukowanego aktywnością skurczową mięśni szkieletowych [11,47]. Przeprowadzono także badania odnerwionych mięśni szkieletowych (7-dniowe odnerwienie), w których wykazano znaczną redukcję przezbłonowego transportu LCFA do miocytów [54]. Nie zaobserwowano zmian w mięśniowej ekspresji białka FAT/CD36, ale wydaje się, że spadek wychwytu LCFA był spowodowany stałym przemieszczaniem się FAT/CD36 z błony komórkowej do przedziałów wewnątrzkomórkowych [54]. Należy podkreślić, iż w przeprowadzonych badaniach zmiany w dokomórkowym transporcie LCFA zarówno podczas przewlekłej stymulacji, jak i podczas odnerwienia mięśni szkieletowych odzwierciedlały bardziej błonową zawartość FAT/CD36, niż całkowitą ekspresję tegoż transportera [54]. Z powyższych badań wynika, że stymulacja skurczów mięśniowych prowadzi głównie do zmian w błonowej zawartości przenośników białkowych (FAT/CD36,FABPpm) i jednoczesnych zmian w transporcie LCFA. 4. PODSUMOWANIE Mięśnie szkieletowe stanowią ważną metabolicznie tkankę w organizmie, ze względu na udział w utrzymaniu homeostazy zarówno gospodarki węglowodanowej, jak i lipidowej. Z obecnego stanu wiedzy wynika, że dokomórkowy transport wolnych długołańcuchowych kwasów tłuszczowych zachodzi ze współudziałem białkowych przenośników, tj. FAT/CD36, FABPpm oraz FATP1. Ważne znaczenie wydają się mieć zarówno zmiany ekspresji całkowitej, jak i błonowej puli transporterów białkowych (FAT/CD36, FABPpm). Stwierdzono, że wysiłek fizyczny powoduje nie tylko szybki wzrost utleniania długołańcuchowych kwasów tłuszczowych, ale również nasila ekspresję białkowych transporterów oraz indukuje przemieszczanie się tych przenośników do błony komórkowej z puli cytoplazmatycznej. Wykazano również obecność białkowych przenośników (FAT/CD36, FABPpm) w mitochondriach, co wydaje się także istotnie wpływać na szybkość procesu utleniania długołańcuchowych kwasów tłuszczowych. PIŚMIENNICTWO [1] Abumrad N.A., El-Maghrabi M.R., Amri E.Z., Lopez E., Grimaldi P.A.: Cloning of a rat adipocyte membrane protein implicated in binding or transport of long chain-fatty acids that is induced during preadipocyte differentiation. Homology with human CD36. J. Biol. Chem., 1993; 268: [2] Abumrad N.A., Perkins R.C., Park J.H., Park C.R.: Mechanism of long chain fatty acid permeation in the isolated adipocyte. J. Biol. Chem., 1981; 256: [3] Amri E.Z., Bonino F., Ailhaud G., Abumrad N.A., Grimaldi P.A.: Cloning of a protein that mediates transcriptional effects of fatty acids in preadipocytes. Homology to peroxisome proliferators-activated receptors. J. Biol. Chem., 1995; 270: [4] Auwerx J.: PPARgã, the ultimate thrifty gene. Diabetologia, 1999; 42: [5] Benton C.R., Koonen D.P., Calles-Escandon J., Tandon N.N., Glatz J.F., Luiken J.J., Heikkila J.J., Bonen A.: Differential effects of muscle contraction and PPAR agonists on the expression of fatty acid transporters in rat skeletal muscle. J. Physiol., 2006; 573: [6] Berk P.D., Bradbury M., Zhou S.L., Stump D., Han N.I.: Characterization of membrane transport processes: lessons from the study of BSP, bilirubin, and fatty acid uptake. Semin. Liver Dis., 1996; 16: [7] Berk P.D., Zhou S.L., Kiang C.L., Stump D., Bradbury M., Isola L.M.: Uptake of long chain fatty acids is selectively up-regulated in adipocytes of Zucker rats with genetic obesity and non-insulin-dependent diabetes mellitus. J. Biol. Chem., 1997; 272: [8] Bezaire V., Bruce C.R., Heigenhauser G.J., Tandon N.N., Glatz J.F., Luiken J.J., Bonen A., Spriet L.L.: Identification of fatty acid translocase on human skeletal muscle mitochondrial membranes: essential role in fatty acid oxidation. Am. J. Physiol. Endocrinol. Metab., 2006; 290: E509 E515 [9] Binnert C., Koistinen H.A., Martin G., Andreelli F., Ebeling P., Koivisto V.A., Laville M., Auwerx J., Vidal H.: Fatty acid transport protein-1 mrna expression in skeletal muscle and in adipose tissue in humans. Am. J. Physiol. Endocrinol. Metab., 2000; 279: E1072 E1079 [10] Bonen A., Campbell SE, Benton CR., Chabowski A., Coort S.L., Han X.X., Koonen D.P., Glatz J.F., Luiken J.J.: Regulation of fatty acid transport by fatty acid translocase/cd36. Proc. Nutr. Soc., 2004; 63: [11] Bonen A., Chabowski A., Luiken J.J., Glatz J.F.: Is membrane transport of FFA mediated by lipid, protein, or both? Mechanisms and regulation of protein-mediated cellular fatty acid uptake: molecular, biochemical, and physiological evidence. Physiology (Bethesda), 2007; 22: [12] Bonen A., Luiken J.J., Arumugam Y., Glatz J.F., Tandon N.N.: Acute regulation of fatty acid uptake involves the cellular redistribution of fatty acid translocase. J. Biol. Chem., 2000; 275: [13] Bonen A., Luiken J.J., Liu S., Dyck D.J., Kiens B., Kristiansen S., Turcotte L.P., Van Der Vusse G.J., Glatz J.F.: Palmitate transport and fatty acid transporters in red and white muscles. Am. J. Physiol. Endocrinol. Metab., 1998; 275: E471 E478 [14] Bonen A., Miskovic D., Kiens B.: Fatty acid transporters (FABPpm, FAT, FATP) in human muscle. Can. J. Appl. Physiol., 1999; 24: [15] Braissant O., Foufelle F., Scotto C., Dauca M., Wahli W.: Differential expression of peroxisome proliferators-activated receptors (PPARs): tissue distribution of PPAR-a, -b, and g in the adult rat. Endocrinology, 1996; 137:
8 Postepy Hig Med Dosw (online), 2008; tom 62: [16] Campbell S.E., Tandon N.N., Woldegiorgis G., Luiken J.J., Glatz J.F., Bonen A.: A novel function for fatty acid translocase (FAT)/CD36: involvement in long chain fatty acid transfer into the mitochondria. J. Biol. Chem., 2004; 279: [17] Cechetto J.D., Sadacharan S.K., Berk P.D., Gupta R.S.: Immunogold localization of mitochondrial aspartate aminotransferase in mitochondria and on the cell surface in normal rat tissues. Histol. Histopathol., 2002; 17: [18] Clarke D.C., Miskovic D., Han X.X., Calles-Escandon J., Glatz J.F., Luiken J.J., Heikkila J.J., Bonen A.: Overexpression of membraneassociated fatty acid binding protein (FABPpm) in vivo increases fatty acid sarcolemmal transport and metabolism. Physiol. Genomics., 2004; 17: [19] Coburn C.T., Knapp F.F., Febbraio M., Beets A.L., Silverstein R.L., Abumrad N.A.: Defective uptake and utilization of long chain fatty acids in muscle and adipose tissues of CD36 knockout mice. J. Biol. Chem., 2000; 275: [20] Coe N.R., Smith A.J., Frohnert B.I., Watkins P.A., Bernlohr D.A.: The fatty acid transport protein (FATP1) is a very long chain acyl-coa synthetase. J. Biol. Chem., 1999; 274: [21] Diede H.E., Rodilla-Sala E., Gunawan J., Manns M., Stremmel W.: Identification and characterization of a monoclonal antibody to the membrane fatty acid binding protein. Biochim. Biophys. Acta, 1992; 1125: [22] DiRusso C.C., Li H., Darwis D., Watkins P.A., Berger J., Black P.N.: Comparative biochemical studies of the murine fatty acid transport proteins (FATP) expressed in yeast. J. Biol. Chem., 2005; 280: [23] Distel R.J., Robinson G.S., Spiegelman B.M.: Fatty acid regulation of gene expression. Transcriptional and post-transcriptional mechanisms. J. Biol. Chem., 1992; 267: [24] Doege H., Stahl A.: Protein-mediated fatty acid uptake: novel insights from in vivo models. Physiology (Bethesda), 2006; 21: [25] Dyck D.J., Bonen A.: Muscle contraction increases palmitate esterification and oxidation and triacylglycerol oxidation. Am. J. Physiol. Endocrinol. Metab., 1998; 275: E888 E896 [26] Dyck D.J., Peters S.J., Glatz J.F., Górski J., Keizer H., Kiens B., Liu S., Richter E.A., Spriet L.L., Van Der Vusse G.J., Bonen A.: Functional differences in lipid metabolism in resting skeletal muscles of various fiber types. Am. J. Physiol. Endocrinol. Metab., 1997; 272: E340 E351 [27] Endemann G., Stanton L.W., Madden K.S., Bryant C.M., White R.T., Protter A.A.: CD36 is a receptor for oxidized low density lipoprotein. J. Biol. Chem., 1993; 268: [28] Febbraio M., Abumrad N.A., Hajjar D.P., Sharma K., Cheng W., Frieda S., Pearce S.F., Silverstein R.L.: A null mutation in murine CD36 reveals an important role in fatty acid and lipoprotein metabolism. J. Biol. Chem., 1999; 274: [29] Febbraio M., Hajjar D.P., Silverstein R.L.: CD36: a class B scavenger receptor involved in angiogenesis, atherosclerosis, inflammation, and lipid metabolism. J. Clin. Invest., 2001; 108: [30] Gimeno R.E., Ortegon A.M., Patel S., Punreddy S., Ge P., Sun Y., Lodish H.F., Stahl A.: Characterization of a heart-specific fatty acid transport protein. J. Biol. Chem., 2003; 278: [31] Glatz J.F., Börchers T., Spener F., Van Der Vusse G.J.: Fatty acids in cell signalling: modulation by lipid binding proteins. Prostaglandins Leukot. Essent. Fatty Acids, 1995; 52: [32] Górski J., Bonen A.: Palmitate incorpotation into lipid pools of contracting red and white muscle. Mol. Cell. Biochem., 1997; 166: [33] Greenwalt D.E., Lipsky R.H., Ockenhouse C.F., Ikeda H., Tandon N.N., Jamieson G.A.: Membrane glycoprotein CD36: a review of its roles in adherence, signal transduction, and transfusion medicine. Blood, 1992; 80: [34] Greenwalt D.E., Mather I.H.: Characterization of an apically derived epithelial membrane glycoprotein from bovine milk, which is expressed in capillary endothelia in diverse tissues. J. Cell. Biol., 1985; 100: [35] Hamilton J.A.: Fatty acid transport: difficult or easy? J. Lipid Res., 1998; 39: [36] Hamilton J.A., Guo W., Kamp F.: Mechanisms of cellular uptake of long-chain fatty acids: Do we need cellular proteins? Mol. Cell. Biochem., 2002; 239: [37] Hamilton J.A., Kamp F.: How are free fatty acids transported in membranes? Is it by proteins or by free diffusion through the lipids? Diabetes, 1999; 48: [38] Han X.X., Chabowski A., Tandon N.N., Calles-Escandon J., Glatz J.F., Luiken J.J., Bonen A.: Metabolic challenges reveal impaired fatty acid metabolism and translocation of FAT/CD36 but not FABPpm in obese Zucker rat muscle. Am. J. Physiol. Endocrinol. Metab., 2007; 293: E566 E575 [39] Harmon C.M., Abumrad N.A.: Binding of sulfosuccinimidyl fatty acids to adipocyte membrane proteins: isolation and amino-terminal sequence of an 88-kD protein implicated in transport of long-chain fatty acids. J. Membr. Biol., 1993; 133: [40] Harmon C.M., Luce P., Abumrad N.A.: Labelling of an 88 kda adipocyte membrane protein by sulpho-n-succinimidyl long-chain fatty acids: inhibition of fatty acid transport. Biochem. Soc. Trans., 1992; 20: [41] Hatch G.M., Smith A.J., Xu F.Y., Hall A.M., Bernlohr D.A.: FATP1 channels exogenous FA into 1,2,3-triacyl-sn-glycerol and down-regulates sphingomyelin and cholesterol metabolism in growing 293 cells. J. Lipid Res., 2002; 43: [42] Heinzer A.K., Watkins P.A., Lu J.F., Kemp S., Moser A.B., Li Y.Y., Mihalik S., Powers J.M., Smith K.D.: A very long-chain acyl-coa synthetase-deficient mouse and its relevance to X-linked adrenoleukodystrophy. Hum. Mol. Genet., 2003; 12: [43] Hirsch D., Stahl A., Lodish H.F.: A family of fatty acid transporters conserved from mycobacterium to man. Proc. Natl. Acad. Sci. USA, 1998; 95: [44] Holloway G.P., Bezaire V., Heigenhauser G.J., Tandon N.N., Glatz J.F., Luiken J.J., Bonen A., Spriet L.L.: Mitochondrial long chain fatty acid oxidation, fatty acid translocase/cd36 content and carnitine palmitoytransferase 1 activity in human skeletal muscle during aerobic exercise. J. Physiol., 2006; 571: [45] Holloway G.P., Lally J., Nickerson J.G., Alkhateeb H., Snook L.A., Heigenhauser G.J., Calles-Escandon J., Glatz J.F., Luiken J.J., Spriet L.L., Bonen A.: Fatty acid binding protein facilitates sarcolemmal fatty acid transport but not mitochondrial oxidation in rat and human skeletal muscle. J. Physiol., 2007; 582: [46] Holst D., Luquet S., Nogueira V., Kristiansen K., Leverve X., Grimaldi P.A.: Nutritional regulation and role of peroxisome proliferators-activated receptor d in fatty acid catabolism in skeletal muscle. Biochim. Biophys. Acta, 2003; 1633: [47] Ibrahimi A., Bonen A., Blinn W.D., Hajri T., Li X., Zhong K., Cameron R., Abumrad N.A.: Muscle-specific overexpression of FAT/CD36 enhances fatty acid oxidation by contacting muscles, reduces plasma triglycerides and fatty acids, and increases plasma glucose and insulin. J. Biol. Chem., 1999; 274: [48] Ibrahimi A., Sfeir Z., Magharaie H., Amri E.Z., Grimaldi P., Abumrad N.A.: Expression of the CD36 homolog (FAT) in fibroblast cells: effects on fatty acid transport. Proc. Natl. Acad. Sci. USA, 1996; 93: [49] Isola L.M., Zhou S.L., Kiang C.L., Stump D.D., Bradbury M.W., Berk P.D.: 3T3 fibroblasts transfected with a cdna for mitochondrial aspartate aminotransferase express plasma membrane fatty acid binding protein and saturable fatty acid uptake. Proc. Natl. Acad. Sci. USA, 1995; 92: [50] Issemann I., Green S.: Activation of a member of the steroid hormone receptor superfamily by peroxisome proliferators. Nature, 1990; 347: [51] Kamp F., Hamilton J.A., Westerhoff H.V.: Movement of fatty acids, fatty acid analogues, and bile acids across phospholipid bilayers. Biochemistry, 1993; 32: [52] Kiens B.: Skeletal muscle lipid metabolism in exercise and insulin resistance. Physiol. Rev., 2006; 86: [53] Kim J.K., Gimeno R.E., Higashimori T., Kim H.J., Choi H., Punreddy S., Mozell R.L., Tan G., Stricker-Krongrad A., Hirsch D.J., Fillmore J.J., Liu Z.X., Cline G., Stahl A., Lodish H.F., Shulman G.I.: Inactivation of fatty acid transport protein 1 prevents fat-induced insulin resistance in skeletal muscle. J. Clin. Invest., 2004; 113: [54] Koonen D.P., Benton C.R., Arumugam Y., Tandon N.N., Calles- Escandon J., Glatz J.F., Luiken J.J., Bonen A.: Different mechanisms can alter fatty acid transport when muscle contractile activity is chronically altered. Am. J. Physiol. Endocrinol. Metab., 2004; 286: E1042 E1049 [55] Latruffe N., Vamecq J.: Peroxisome proliferators and peroxisome proliferator activated receptors (PPARs) as regulators of lipid metabolism. Biochimie, 1997; 79: [56] Luiken J.J., Dyck D.J., Han X.X., Tandon N.N., Arumugam Y., Glatz J.F., Bonen A.: Insulin induces the translocation of the fatty acid transporter FAT/CD36 to the plasma membrane. Am. J. Physiol. Endocrinol. Metab., 2002; 282: E491 E495
9 Harasim E. i wsp. Udział białek transportujących (FAT/CD36, FABPpm, FATP) [57] Luiken J.J., Koonen D.P., Willems J., Zorzano A., Fischer Y., Van Der Vusse G.J., Bonen A., Glatz J.F.: Insulin stimulates long-chain fatty acid utilization by rat cardiac myocytes through cellular redistribution of FAT/CD36. Diabetes., 2002; 51: [58] Luiken J.J., Turcotte L.P., Bonen A.: Protein-mediated palmitate uptake and expression of fatty acid transport proteins in heart giant vesicles. J. Lipid. Res., 1999; 40: [59] Marotta M., Ferrer-Martnez A., Parnau J., Turini M., Macé K., Gomez FoiX A.M.: Fiber type- and fatty acid composition-dependent effects of high-fat diets on rat muscle triacylglyceride and fatty acid transporter protein-1 content. Metabolism., 2004; 53: [60] Mukherjee R., Jow L., Croston G.E., Paterniti J.R.Jr: Identification, characterization, and tissue distribution of human peroxisome-activeted receptor (PPAR) izoforms PPARg2 versus PPARg1 and activation with retinoid X receptor agonists and antagonists. J. Biol. Chem., 1997; 272: [61] Muoio D.M., MacLean P.S., Lang D.B., Li S., Houmard J.A., Way J.M., Winegar D.A., Corton J.C., Dohm G.L., Kraus W.E.: Fatty acid homeostasis and induction of lipid regulatory genes in skeletal muscles of peroxisome proliferators-activated receptor (PPAR) a knockout mice. Evidence for compensatory regulation by PPARä. J. Biol. Chem., 2002; 277: [62] Newsholme E.A., Calder P., Yaqoob P.: The regulatory, informational, and immunomodulatory roles of fat fuels. Am. J. Clin. Nutr., 1993; 57: 738S 751S [63] Nicholson A.C.: Expression of CD36 in macrophages and atherosclerosis: the role of lipid regulation of PPARg signaling. Trends Cardiovasc. Med., 2004; 14: 8 12 [64] Nicholson A.C., Hajjar D.P.: CD36, oxidized LDL and PPARg: pathological interactions in macrophages and atherosclerosis. Vascul. Pharmacol., 2004; 41: [65] Roepstorff C., Vistisen B., Roepstorff K., Kiens B.: Regulation of plasma long-chain fatty acid oxidation in relation to uptake in human skeletal muscle during exercise. Am. J. Physiol. Endocrinol. Metab., 2004; 287: E696 E705 [66] Romijn J.A., Coyle E.F., Sidossis L.S., Gastaldelli A., Horowitz J.F., Endert E., Wolfe R.R.: Regulation of endogenous fat and carbohydrate metabolism in relation to exercise intensity and duration. Am. J. Physiol. Endocrinol. Metab., 1993; 265: E380 E391 [67] Ryeom S.W., Sparrow J.R., Silverstein R.L.: CD36 participates in the phagocitosis of rod outer segments by retinal pigment epithelium. J. Cell Sci., 1996; 109: [68] Schaffer J.E., Lodish H.F.: Expression cloning and characterization of a novel adipocyte long chain fatty acid transport protein. Cell, 1994; 79: [69] Schenk S., Horowitz J.F.: Coimmunoprecipitation of FAT/CD36 and CPT I in skeletal muscle increases proportionally with fat oxidation after endurance exercise training. Am. J. Physiol. Endocrinol. Metab., 2006; 291: E254 E260 [70] Stahl A., Hirsch D.J., Gimeno R.E., Punreddy S., Ge P., Watson N., Patel S., Kotler M., Raimondi A., Tartaglia L.A., Lodish H.F.: Identification of the major intestinal fatty acid transport protein. Mol. Cell., 1999; 4: [71] Stremmel W., Strohmeyer G., Berk P.D.: Hepatocellular uptake of oleate is energy dependent, sodium linked, and inhibited by an antibody to a hepatocyte plasma membrane fatty acid binding protein. Proc. Natl. Acad. Sci. USA, 1986; 83: [72] Stremmel W., Strohmeyer G., Borchard F., Kochwa S., Berk P.D.: Isolation and partial characterization of a fatty acid binding protein in rat liver plasma membranes. Proc. Natl. Acad. Sci. USA, 1985; 82: 4 8 [73] Stump D.D., Zhou S.L., Berk P.D.: Comparison of plasma membrane FABP and mitochondrial isoform of aspartate aminotrasferase from rat liver. Am. J. Physiol., 1993; 265: G894 G902 [74] Swerlick R.A., Lee K.H., Wick T.M., Lawley T.J.: Human dermal microvascular endothelial but not human umbilical vein endothelial cells express CD36 in vivo and in vitro. J. Immunol., 1992; 148: [75] Tunstall R.J., Mehan K.A., Wadley G.D., Collier G.R., Bonen A., Hargreaves M., Cameron-Smith D.: Exercise training increases lipid metabolism gene expression in human skeletal muscle. Am. J. Physiol. Endocrinol. Metab., 2002; 283: E66 E72 [76] Turcotte L.P., Raney M.A., Todd M.K.: ERK 1/2 inhibition prevents contraction-induced increase in plasma membrane FAT/CD36 content and FA uptake in rodent muscle. Acta Physiol. Scand., 2005; 184: [77] Turcotte L.P., Srivastava A.K., Chiasson J.L.: Fasting increases plasma membrane fatty acid binding (FABPpm) in red skeletal muscle. Mol. Cell. Biochem., 1997; 166: [78] Turcotte L.P., Swenberger J.R., Tucker M.Z., Yee A.J., Trump G., Luiken J.J., Bonen A.: Muscle palmitate uptake and binding are saturable and inhibited by antibodies to FABPpm. Mol. Cell. Biochem., 2000; 210: [79] Turcotte L.P., Swenberger J.R., Tucker M.Z., Yee A.J.: Training-induced elevation in FABP(PM) is associated with increased palmitate use in contracting muscle. J. Appl. Physiol., 1999; 87: [80] Van der Vusse G.J., Glatz J.F., Van Nieuwenhoven F.A., Reneman R.S., Bassingthwaighte J.B.: Transport of long-chain fatty acids across the muscular endothelium. Adv. Exp. Med. Biol., 1998; 441:
Źródła energii dla mięśni. mgr. Joanna Misiorowska
 Źródła energii dla mięśni mgr. Joanna Misiorowska Skąd ta energia? Skurcz włókna mięśniowego wymaga nakładu energii w postaci ATP W zależności od czasu pracy mięśni, ATP może być uzyskiwany z różnych źródeł
Źródła energii dla mięśni mgr. Joanna Misiorowska Skąd ta energia? Skurcz włókna mięśniowego wymaga nakładu energii w postaci ATP W zależności od czasu pracy mięśni, ATP może być uzyskiwany z różnych źródeł
Bartłomiej Łukaszuk, Adrian Chabowski. Zakład Fizjologii Uniwersytetu Medycznego w Białymstoku
 Postepy Hig Med Dosw (online), 2010; 64: 31-37 e-issn 1732-2693 www.phmd.pl Review Received: 2009.09.21 Accepted: 2009.12.27 Published: 2010.02.02 Rola mitochondrialnych transporterów kwasów tłuszczowych
Postepy Hig Med Dosw (online), 2010; 64: 31-37 e-issn 1732-2693 www.phmd.pl Review Received: 2009.09.21 Accepted: 2009.12.27 Published: 2010.02.02 Rola mitochondrialnych transporterów kwasów tłuszczowych
Fizjologia wysiłku. Marta Kaczmarska, Anna Zielińska 30 XI 2015
 Fizjologia wysiłku Marta Kaczmarska, Anna Zielińska 30 XI 2015 Węglowodany (CHO) Węglowodany glikogen i glukoza są głównym źródłem energii dla skurczu mięśni podczas intensywnego wysiłku, a zmęczenie podczas
Fizjologia wysiłku Marta Kaczmarska, Anna Zielińska 30 XI 2015 Węglowodany (CHO) Węglowodany glikogen i glukoza są głównym źródłem energii dla skurczu mięśni podczas intensywnego wysiłku, a zmęczenie podczas
FIZJOLOGIA WYSIŁKU FIZYCZNEGO ENERGETYKA WYSIŁKU, ROLA KRĄŻENIA I UKŁADU ODDECHOWEGO
 FIZJOLOGIA WYSIŁKU FIZYCZNEGO ENERGETYKA WYSIŁKU, ROLA KRĄŻENIA I UKŁADU ODDECHOWEGO Dr hab. Andrzej Klusiewicz Zakład Fizjologii Instytutu Sportu Tematyka wykładu obejmuje trzy systemy energetyczne generujące
FIZJOLOGIA WYSIŁKU FIZYCZNEGO ENERGETYKA WYSIŁKU, ROLA KRĄŻENIA I UKŁADU ODDECHOWEGO Dr hab. Andrzej Klusiewicz Zakład Fizjologii Instytutu Sportu Tematyka wykładu obejmuje trzy systemy energetyczne generujące
Profil metaboliczny róŝnych organów ciała
 Profil metaboliczny róŝnych organów ciała Uwaga: tkanka tłuszczowa (adipose tissue) NIE wykorzystuje glicerolu do biosyntezy triacylogliceroli Endo-, para-, i autokrynna droga przekazu informacji biologicznej.
Profil metaboliczny róŝnych organów ciała Uwaga: tkanka tłuszczowa (adipose tissue) NIE wykorzystuje glicerolu do biosyntezy triacylogliceroli Endo-, para-, i autokrynna droga przekazu informacji biologicznej.
ATP. Slajd 1. Slajd 2 1997 rok Nagroda Nobla: P.D. Boyer (USA), J.E. Walker (GB) i J.C. Skou (D) Slajd 3. BIOENERGETYKA KOMÓRKI oddychanie i energia
 Slajd 1 BIOENERGETYKA KOMÓRKI oddychanie i energia WYKŁAD 6. Agnieszka Zembroń-Łacny 1. cukry, lipidy, aminokwasy 2. mitochondria 3. energia chemiczna (ATP) Slajd 2 1997 rok Nagroda Nobla: P.D. Boyer (USA),
Slajd 1 BIOENERGETYKA KOMÓRKI oddychanie i energia WYKŁAD 6. Agnieszka Zembroń-Łacny 1. cukry, lipidy, aminokwasy 2. mitochondria 3. energia chemiczna (ATP) Slajd 2 1997 rok Nagroda Nobla: P.D. Boyer (USA),
Nukleotydy w układach biologicznych
 Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
Nukleotydy w układach biologicznych Schemat 1. Dinukleotyd nikotynoamidoadeninowy Schemat 2. Dinukleotyd NADP + Dinukleotydy NAD +, NADP + i FAD uczestniczą w procesach biochemicznych, w trakcie których
B) podział (aldolowy) na 2 triozy. 2) izomeryzacja do fruktozo-6-p (aldoza w ketozę, dla umoŝliwienia kolejnych przemian)
 Glikoliza (Przegląd kluczowych struktur i reakcji) A) przygotowanie heksozy do podziału na dwie triozy: 1)fosforylacja glukozy (czyli przekształcenie w formę metabolicznie aktywną) 2) izomeryzacja do fruktozo-6-p
Glikoliza (Przegląd kluczowych struktur i reakcji) A) przygotowanie heksozy do podziału na dwie triozy: 1)fosforylacja glukozy (czyli przekształcenie w formę metabolicznie aktywną) 2) izomeryzacja do fruktozo-6-p
Akademia Wychowania Fizycznego i Sportu WYDZIAŁ WYCHOWANIA FIZYCZNEGO w Gdańsku ĆWICZENIE III. AKTYWNOŚĆ FIZYCZNA, A METABOLIZM WYSIŁKOWY tlenowy
 Akademia Wychowania Fizycznego i Sportu WYDZIAŁ WYCHOWANIA FIZYCZNEGO w Gdańsku ĆWICZENIE III AKTYWNOŚĆ FIZYCZNA, A METABOLIZM WYSIŁKOWY tlenowy AKTYWNOŚĆ FIZYCZNA W ujęciu fizjologicznym jest to: każda
Akademia Wychowania Fizycznego i Sportu WYDZIAŁ WYCHOWANIA FIZYCZNEGO w Gdańsku ĆWICZENIE III AKTYWNOŚĆ FIZYCZNA, A METABOLIZM WYSIŁKOWY tlenowy AKTYWNOŚĆ FIZYCZNA W ujęciu fizjologicznym jest to: każda
Integracja metabolizmu
 Integracja metabolizmu 1 Kluczowe związki w metabolizmie Glukozo- 6 -fosforan Pirogronian AcetyloCoA 2 Glukoza po wejściu do komórki ulega fosforylacji Metaboliczne przemiany glukozo- 6-fosforanu G-6-P
Integracja metabolizmu 1 Kluczowe związki w metabolizmie Glukozo- 6 -fosforan Pirogronian AcetyloCoA 2 Glukoza po wejściu do komórki ulega fosforylacji Metaboliczne przemiany glukozo- 6-fosforanu G-6-P
Zagadnienia do egzaminu z biochemii (studia niestacjonarne)
 Zagadnienia do egzaminu z biochemii (studia niestacjonarne) Aminokwasy, białka, cukry i ich metabolizm 1. Aminokwasy, wzór ogólny i charakterystyczne grupy. 2. Wiązanie peptydowe. 3. Białka, ich struktura.
Zagadnienia do egzaminu z biochemii (studia niestacjonarne) Aminokwasy, białka, cukry i ich metabolizm 1. Aminokwasy, wzór ogólny i charakterystyczne grupy. 2. Wiązanie peptydowe. 3. Białka, ich struktura.
OPTYMALNY POZIOM SPOŻYCIA BIAŁKA ZALECANY CZŁOWIEKOWI JANUSZ KELLER STUDIUM PODYPLOMOWE 2011
 OPTYMALNY POZIOM SPOŻYCIA BIAŁKA ZALECANY CZŁOWIEKOWI JANUSZ KELLER STUDIUM PODYPLOMOWE 2011 DLACZEGO DOROSŁY CZŁOWIEK (O STAŁEJ MASIE BIAŁKOWEJ CIAŁA) MUSI SPOŻYWAĆ BIAŁKO? NIEUSTAJĄCA WYMIANA BIAŁEK
OPTYMALNY POZIOM SPOŻYCIA BIAŁKA ZALECANY CZŁOWIEKOWI JANUSZ KELLER STUDIUM PODYPLOMOWE 2011 DLACZEGO DOROSŁY CZŁOWIEK (O STAŁEJ MASIE BIAŁKOWEJ CIAŁA) MUSI SPOŻYWAĆ BIAŁKO? NIEUSTAJĄCA WYMIANA BIAŁEK
Transport przez błony
 Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
Transport przez błony Transport bierny Nie wymaga nakładu energii Transport aktywny Wymaga nakładu energii Dyfuzja prosta Dyfuzja ułatwiona Przenośniki Kanały jonowe Transport przez pory w błonie jądrowej
ROLA WAPNIA W FIZJOLOGII KOMÓRKI
 ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
ROLA WAPNIA W FIZJOLOGII KOMÓRKI Michał M. Dyzma PLAN REFERATU Historia badań nad wapniem Domeny białek wiążące wapń Homeostaza wapniowa w komórce Komórkowe rezerwuary wapnia Białka buforujące Pompy wapniowe
Ocena. W latach 2008-2010 odbyła 2,5 roczny staż naukowy w Mayo Clinic, Rochester, USA.
 UNIWERSYTET MEDYCZNY W BIAŁYMSTOKU ZAKŁAD BIOCHEMII LEKARSKIEJ ul. A. Mickiewicza 2, 15-089 Białystok tel. (085) 748 55 78, faks (085) 748 55 78 e-mail: zdbioch@umwb.edu.pl Ocena osiągnięć naukowych, dydaktycznych
UNIWERSYTET MEDYCZNY W BIAŁYMSTOKU ZAKŁAD BIOCHEMII LEKARSKIEJ ul. A. Mickiewicza 2, 15-089 Białystok tel. (085) 748 55 78, faks (085) 748 55 78 e-mail: zdbioch@umwb.edu.pl Ocena osiągnięć naukowych, dydaktycznych
Bliskie spotkania z biologią METABOLIZM. dr hab. Joanna Moraczewska, prof. UKW. Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki
 Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
BIOENERGETYKA cz. II cykl Krebsa i fosforylacja oksydacyjna
 BIOENERGETYKA cz. II cykl Krebsa i fosforylacja oksydacyjna dr hab. prof. AWF Agnieszka Zembroń-Łacny Zamiejscowy Wydział Kultury Fizycznej w Gorzowie Wlkp. Akademii Wychowania Fizycznego w Poznaniu 1.
BIOENERGETYKA cz. II cykl Krebsa i fosforylacja oksydacyjna dr hab. prof. AWF Agnieszka Zembroń-Łacny Zamiejscowy Wydział Kultury Fizycznej w Gorzowie Wlkp. Akademii Wychowania Fizycznego w Poznaniu 1.
Choroby układu sercowo-naczyniowego związane są z takimi czynnikami ryzyka jak niewłaściwa dieta, brak aktywności fizycznej, otyłość, nadciśnienie
 Mgr Tomasz Bednarski Dziedzina: nauki biologiczne Dyscyplina: biologia Wszczęcie: 27.06.2014 r. Temat: Rola kwasów tłuszczowych w metabolizmie mięśnia sercowego oraz patogenezie przerostu lewej komory
Mgr Tomasz Bednarski Dziedzina: nauki biologiczne Dyscyplina: biologia Wszczęcie: 27.06.2014 r. Temat: Rola kwasów tłuszczowych w metabolizmie mięśnia sercowego oraz patogenezie przerostu lewej komory
Jak ocenić jakość białek
 Jak ocenić jakość białek NPU- Net Protein Utilization = Wykorzytanie Białka Netto określa ilość azotu zatrzymanego w ustroju. NPU= Nb - Nbo Nspoż X 100% Nb-N oznaczony w tuszkach zwierząt na badanej diecie,
Jak ocenić jakość białek NPU- Net Protein Utilization = Wykorzytanie Białka Netto określa ilość azotu zatrzymanego w ustroju. NPU= Nb - Nbo Nspoż X 100% Nb-N oznaczony w tuszkach zwierząt na badanej diecie,
Badano tzw.zakres 1) fat burning i 2) pracy tlenowej.
 Phys Sportsmed. 2009 Jun;37(2):51-8. Prescribing physical activity: applying the ACSM protocols for exercise type, intensity, and duration across 3 training frequencies. Westcott WL, Winett RA, Annesi
Phys Sportsmed. 2009 Jun;37(2):51-8. Prescribing physical activity: applying the ACSM protocols for exercise type, intensity, and duration across 3 training frequencies. Westcott WL, Winett RA, Annesi
Fizjologia człowieka
 Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra Promocji Zdrowia Zakład Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra Promocji Zdrowia Zakład Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Bliskie spotkania z biologią. METABOLIZM część II. dr hab. Joanna Moraczewska, prof. UKW
 Bliskie spotkania z biologią METABOLIZM część II dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki METABOLIZM KATABOLIZM - rozkład związków chemicznych
Bliskie spotkania z biologią METABOLIZM część II dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki METABOLIZM KATABOLIZM - rozkład związków chemicznych
dr hab. prof. AWF Agnieszka Zembroń-Łacny DOPING GENOWY 3 CIEMNA STRONA TERAPII GENOWEJ
 dr hab. prof. AWF Agnieszka Zembroń-Łacny DOPING GENOWY 3 CIEMNA STRONA TERAPII GENOWEJ KOMÓRKI SATELITARNE (ang. stem cells) potencjał regeneracyjny mięśni HIPERTROFIA MIĘŚNI University College London,
dr hab. prof. AWF Agnieszka Zembroń-Łacny DOPING GENOWY 3 CIEMNA STRONA TERAPII GENOWEJ KOMÓRKI SATELITARNE (ang. stem cells) potencjał regeneracyjny mięśni HIPERTROFIA MIĘŚNI University College London,
(węglowodanów i tłuszczów) Podstawowym produktem (nośnikiem energii) - ATP
 śycie - wymaga nakładu energii źródłem - promienie świetlne - wykorzystywane do fotosyntezy - magazynowanie energii w wiązaniach chemicznych Wszystkie organizmy (a zwierzęce wyłącznie) pozyskują energię
śycie - wymaga nakładu energii źródłem - promienie świetlne - wykorzystywane do fotosyntezy - magazynowanie energii w wiązaniach chemicznych Wszystkie organizmy (a zwierzęce wyłącznie) pozyskują energię
Reakcje zachodzące w komórkach
 Reakcje zachodzące w komórkach W każdej sekundzie we wszystkich organizmach żywych zachodzi niezliczona ilość reakcji metabolicznych. Metabolizm (gr. metabole - przemiana) to przemiany materii i energii
Reakcje zachodzące w komórkach W każdej sekundzie we wszystkich organizmach żywych zachodzi niezliczona ilość reakcji metabolicznych. Metabolizm (gr. metabole - przemiana) to przemiany materii i energii
Wazoprotekcyjne i antydiabetogenne działanie telmisartanu zależne od aktywacji receptora PPAR?
 Wazoprotekcyjne i antydiabetogenne działanie telmisartanu zależne od aktywacji receptora PPAR? Receptory aktywowane przez proliferatory peroksysomów Wśród receptorów PPAR wyróżnić można 3 izoformy, mianowicie:
Wazoprotekcyjne i antydiabetogenne działanie telmisartanu zależne od aktywacji receptora PPAR? Receptory aktywowane przez proliferatory peroksysomów Wśród receptorów PPAR wyróżnić można 3 izoformy, mianowicie:
BIOENERGETYKA cz. I METABOLIZM WĘGLOWODANÓW I LIPIDÓW. dr hab. prof. AWF Agnieszka Zembroń-Łacny
 BIOENERGETYKA cz. I METABOLIZM WĘGLOWODANÓW I LIPIDÓW dr hab. prof. AWF Agnieszka Zembroń-Łacny METABOLIZM/ENERGIA WĘGLOWODANY i LIPIDY WYKŁAD 6 Trawienie i wchłanianie WĘGLOWODANY TŁUSZCZE BIAŁKA Katabolizm
BIOENERGETYKA cz. I METABOLIZM WĘGLOWODANÓW I LIPIDÓW dr hab. prof. AWF Agnieszka Zembroń-Łacny METABOLIZM/ENERGIA WĘGLOWODANY i LIPIDY WYKŁAD 6 Trawienie i wchłanianie WĘGLOWODANY TŁUSZCZE BIAŁKA Katabolizm
Tłuszcze jako główny zapasowy substrat energetyczny
 Tłuszcze jako główny zapasowy substrat energetyczny Utlenienie 1 g tłuszczy pozwala na wyprodukowanie 37 kj (9 kcal) energii, podczas gdy utlenienie 1 g węglowodanów lub białek dostarcza tylko 17 kj (4
Tłuszcze jako główny zapasowy substrat energetyczny Utlenienie 1 g tłuszczy pozwala na wyprodukowanie 37 kj (9 kcal) energii, podczas gdy utlenienie 1 g węglowodanów lub białek dostarcza tylko 17 kj (4
Tkanka mięśniowa. Bogdan Walkowiak. Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka. 7 listopada 2014 Biofizyka 1
 Wykład 5 Tkanka mięśniowa Bogdan Walkowiak Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka 7 listopada 2014 Biofizyka 1 Trzy typy mięśni Mięśnie szkieletowe (Poprzecznie prążkowane)
Wykład 5 Tkanka mięśniowa Bogdan Walkowiak Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka 7 listopada 2014 Biofizyka 1 Trzy typy mięśni Mięśnie szkieletowe (Poprzecznie prążkowane)
CO WARUNKUJE SIŁĘ, MOC I WYTRZYMAŁOŚĆ MIĘŚNI
 CO WARUNKUJE SIŁĘ, MOC I WYTRZYMAŁOŚĆ MIĘŚNI SZKIELETOWYCH CZŁOWIEKA? Jerzy A. Żołądź Akademia Wychowania Fizycznego w Krakowie, Zakład Fizjologii Mięśni Siła mięśni szkieletowych, ich moc i wytrzymałość
CO WARUNKUJE SIŁĘ, MOC I WYTRZYMAŁOŚĆ MIĘŚNI SZKIELETOWYCH CZŁOWIEKA? Jerzy A. Żołądź Akademia Wychowania Fizycznego w Krakowie, Zakład Fizjologii Mięśni Siła mięśni szkieletowych, ich moc i wytrzymałość
Podkowiańska Wyższa Szkoła Medyczna im. Z. i J. Łyko. Syllabus przedmiotowy 2016/ /2019
 Podkowiańska Wyższa Szkoła Medyczna im. Z. i J. Łyko Syllabus przedmiotowy 2016/2017-2018/2019 Wydział Fizjoterapii Kierunek studiów Fizjoterapia Specjalność ----------- Forma studiów Stacjonarne / Niestacjonarne
Podkowiańska Wyższa Szkoła Medyczna im. Z. i J. Łyko Syllabus przedmiotowy 2016/2017-2018/2019 Wydział Fizjoterapii Kierunek studiów Fizjoterapia Specjalność ----------- Forma studiów Stacjonarne / Niestacjonarne
Komórka - budowa i funkcje
 Komórka - budowa i funkcje Komórka - definicja Komórka to najmniejsza strukturalna i funkcjonalna jednostka organizmów żywych zdolna do przeprowadzania wszystkich podstawowych procesów życiowych (takich
Komórka - budowa i funkcje Komórka - definicja Komórka to najmniejsza strukturalna i funkcjonalna jednostka organizmów żywych zdolna do przeprowadzania wszystkich podstawowych procesów życiowych (takich
Wskaźniki włóknienia nerek
 Wskaźniki włóknienia nerek u dzieci z przewlekłą chorobą nerek leczonych zachowawczo Kinga Musiał, Danuta Zwolińska Katedra i Klinika Nefrologii Pediatrycznej Uniwersytetu Medycznego im. Piastów Śląskich
Wskaźniki włóknienia nerek u dzieci z przewlekłą chorobą nerek leczonych zachowawczo Kinga Musiał, Danuta Zwolińska Katedra i Klinika Nefrologii Pediatrycznej Uniwersytetu Medycznego im. Piastów Śląskich
Rola białka AS160/TBC1D4 w transporcie glukozy do wnętrza miocytów The role of protein AS160/TBC1D4 in the transport of glucose into skeletal muscles
 Postepy Hig Med Dosw (online), 2011; 65: 270-276 e-issn 1732-2693 www.phmd.pl Review Received: 2010.12.29 Accepted: 2011.04.05 Published: 2011.05.06 Rola białka AS160/TBC1D4 w transporcie glukozy do wnętrza
Postepy Hig Med Dosw (online), 2011; 65: 270-276 e-issn 1732-2693 www.phmd.pl Review Received: 2010.12.29 Accepted: 2011.04.05 Published: 2011.05.06 Rola białka AS160/TBC1D4 w transporcie glukozy do wnętrza
Sucha masa(g. kj/g suchej masy
 Składnik Energia kj/g suchej masy Sucha masa(g Dostępna energia (kj) Kwasy tłuszcz.(tk. tłuszcz.) 37 15 000 555 000 Białko (mięśnie) 17 6 000 102 000 Glikogen (mięśnie) 16 120 1 920 Glikogen (wątroba)
Składnik Energia kj/g suchej masy Sucha masa(g Dostępna energia (kj) Kwasy tłuszcz.(tk. tłuszcz.) 37 15 000 555 000 Białko (mięśnie) 17 6 000 102 000 Glikogen (mięśnie) 16 120 1 920 Glikogen (wątroba)
wielkość, kształt, typy
 Mitochondria 0,5-1µm wielkość, kształt, typy 1-7µm (10µm) Filmowanie poklatkowe (w mikroskopie fluorescencyjnym) sieci mitochondrialnej w komórkach droŝdŝy (krok czasowy 3 min) Mitochondria liczebność,
Mitochondria 0,5-1µm wielkość, kształt, typy 1-7µm (10µm) Filmowanie poklatkowe (w mikroskopie fluorescencyjnym) sieci mitochondrialnej w komórkach droŝdŝy (krok czasowy 3 min) Mitochondria liczebność,
Wpływ wysiłku pływackiego na stężenie mitochondrialnego cholesterolu oraz metabolizm energetyczny w warunkach stresu oksydacyjnego
 Wpływ wysiłku pływackiego na stężenie mitochondrialnego cholesterolu oraz metabolizm energetyczny w warunkach stresu oksydacyjnego mgr Damian Józef Flis Rozprawa na stopień doktora nauk o zdrowiu Promotorzy:
Wpływ wysiłku pływackiego na stężenie mitochondrialnego cholesterolu oraz metabolizm energetyczny w warunkach stresu oksydacyjnego mgr Damian Józef Flis Rozprawa na stopień doktora nauk o zdrowiu Promotorzy:
Bliskie spotkania z biologią METABOLIZM. dr hab. Joanna Moraczewska, prof. UKW. Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki
 Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
Bliskie spotkania z biologią METABOLIZM dr hab. Joanna Moraczewska, prof. UKW Instytut Biologii Eksperymetalnej, Zakład Biochemii i Biologii Komórki Metabolizm całokształt przemian biochemicznych i towarzyszących
Grzegorz Satała, Tomasz Lenda, Beata Duszyńska, Andrzej J. Bojarski. Instytut Farmakologii Polskiej Akademii Nauk, ul.
 Grzegorz Satała, Tomasz Lenda, Beata Duszyńska, Andrzej J. Bojarski Instytut Farmakologii Polskiej Akademii Nauk, ul. Smętna 12, Kraków Plan prezentacji: Cel naukowy Podstawy teoretyczne Przyjęta metodyka
Grzegorz Satała, Tomasz Lenda, Beata Duszyńska, Andrzej J. Bojarski Instytut Farmakologii Polskiej Akademii Nauk, ul. Smętna 12, Kraków Plan prezentacji: Cel naukowy Podstawy teoretyczne Przyjęta metodyka
TIENS L-Karnityna Plus
 TIENS L-Karnityna Plus Zawartość jednej kapsułki Winian L-Karnityny w proszku 400 mg L-Arginina 100 mg Niacyna (witamina PP) 16 mg Witamina B6 (pirydoksyna) 2.1 mg Stearynian magnezu pochodzenia roślinnego
TIENS L-Karnityna Plus Zawartość jednej kapsułki Winian L-Karnityny w proszku 400 mg L-Arginina 100 mg Niacyna (witamina PP) 16 mg Witamina B6 (pirydoksyna) 2.1 mg Stearynian magnezu pochodzenia roślinnego
Program zajęć z biochemii dla studentów kierunku weterynaria I roku studiów na Wydziale Lekarskim UJ CM w roku akademickim 2013/2014
 Program zajęć z biochemii dla studentów kierunku weterynaria I roku studiów na Wydziale Lekarskim UJ CM w roku akademickim 2013/2014 S E M E S T R II Tydzień 1 24.02-28.02 2 03.03-07.03 3 10.03-14.03 Wykłady
Program zajęć z biochemii dla studentów kierunku weterynaria I roku studiów na Wydziale Lekarskim UJ CM w roku akademickim 2013/2014 S E M E S T R II Tydzień 1 24.02-28.02 2 03.03-07.03 3 10.03-14.03 Wykłady
Transportowane cząsteczki CO O, 2, NO, H O, etanol, mocznik... Zgodnie z gradientem: stężenia elektrochemicznym gradient stężeń
 Transportowane cząsteczki Transport przez błony Transport bierny szybkość transportu gradien t stężeń kanał nośnik Transport z udziałem nośnika: dyfuzja prosta dyfuzja prosta CO 2, O 2, NO,, H 2 O, etanol,
Transportowane cząsteczki Transport przez błony Transport bierny szybkość transportu gradien t stężeń kanał nośnik Transport z udziałem nośnika: dyfuzja prosta dyfuzja prosta CO 2, O 2, NO,, H 2 O, etanol,
MECHANIZM DZIAŁANIA HERBICYDÓW
 Uniwersytet Przyrodniczy w Poznaniu Grzegorz Skrzypczak MECHANIZM DZIAŁANIA HERBICYDÓW metabolizm herbicydów Nowe technologie uprawy wymagają aby herbicyd był: - skuteczny biologicznie i efektywny ekonomicznie
Uniwersytet Przyrodniczy w Poznaniu Grzegorz Skrzypczak MECHANIZM DZIAŁANIA HERBICYDÓW metabolizm herbicydów Nowe technologie uprawy wymagają aby herbicyd był: - skuteczny biologicznie i efektywny ekonomicznie
Temat: Pokarm budulec i źródło energii.
 Temat: Pokarm budulec i źródło energii. 1. Dlaczego musimy się odżywiać? Pokarm dostarcza nam energii niezbędnej do wykonywania czynności życiowych. Pokarm dostarcza substancji budulcowych potrzebnych
Temat: Pokarm budulec i źródło energii. 1. Dlaczego musimy się odżywiać? Pokarm dostarcza nam energii niezbędnej do wykonywania czynności życiowych. Pokarm dostarcza substancji budulcowych potrzebnych
Budowa i klasyfikacja lipidów
 Egzamin 3 pytania testowe na każdy temat (3 x 10 x 1 pkt) 5 pytań opisowych dot. całego zakresu (5 x 4 pkt) W sumie można uzyskać 50 pkt Zaliczenie egzaminu od 26 pkt Budowa i klasyfikacja lipidów Klasyfikacja
Egzamin 3 pytania testowe na każdy temat (3 x 10 x 1 pkt) 5 pytań opisowych dot. całego zakresu (5 x 4 pkt) W sumie można uzyskać 50 pkt Zaliczenie egzaminu od 26 pkt Budowa i klasyfikacja lipidów Klasyfikacja
ObciąŜenie treningowe wyraŝa wysiłek wykonywany przez sportowca w
 WYKŁAD III Struktura obciąŝeń treningowych Aby kierować treningiem sportowym naleŝy poznać relację pomiędzy przyczynami, a skutkami, pomiędzy treningiem, a jego efektami. Przez wiele lat trenerzy i teoretycy
WYKŁAD III Struktura obciąŝeń treningowych Aby kierować treningiem sportowym naleŝy poznać relację pomiędzy przyczynami, a skutkami, pomiędzy treningiem, a jego efektami. Przez wiele lat trenerzy i teoretycy
LIPIDY. Slajd 1 WYKŁAD 5. Slajd 2. Slajd 3. LIPIDY: budowa lecytyny (fosfatydylocholina) AGNIESZKA ZEMBROŃ-ŁACNY. Struktura kwasów tłuszczowych
 część hydrofobowa część hydrofilowa Slajd 1 WYKŁAD 5 LIPIDY AGNIESZKA ZEMBROŃ-ŁACNY Slajd 2 LIPIDY: budowa lecytyny (fosfatydylocholina) cholina fosforan azot wiązanie estrowe glicerol fosfor tlen węgiel
część hydrofobowa część hydrofilowa Slajd 1 WYKŁAD 5 LIPIDY AGNIESZKA ZEMBROŃ-ŁACNY Slajd 2 LIPIDY: budowa lecytyny (fosfatydylocholina) cholina fosforan azot wiązanie estrowe glicerol fosfor tlen węgiel
Lipidy (tłuszczowce)
 Lipidy (tłuszczowce) Miejsce lipidów wśród innych składników chemicznych Lipidy To niejednorodna grupa związków, tak pod względem składu chemicznego, jak i roli, jaką odrywają w organizmach. W ich skład
Lipidy (tłuszczowce) Miejsce lipidów wśród innych składników chemicznych Lipidy To niejednorodna grupa związków, tak pod względem składu chemicznego, jak i roli, jaką odrywają w organizmach. W ich skład
-Trening Personalny : -Trener Personalny: -Kulturystyka: -Sporty siłowe: -Trening motoryczny: -Zajęcia funkcjonalne: -Wysiłek fizyczny : -Zmęczenie:
 -Trening Personalny : -Trener Personalny: -Kulturystyka: -Sporty siłowe: -Trening motoryczny: -Zajęcia funkcjonalne: -Wysiłek fizyczny : -Zmęczenie: -Zakwaszenie: -Glikogen: Trening personalny: Indywidualnie
-Trening Personalny : -Trener Personalny: -Kulturystyka: -Sporty siłowe: -Trening motoryczny: -Zajęcia funkcjonalne: -Wysiłek fizyczny : -Zmęczenie: -Zakwaszenie: -Glikogen: Trening personalny: Indywidualnie
Biochemia Oddychanie wewnątrzkomórkowe
 Państwowa Wyższa Szkoła Zawodowa w Krośnie Biochemia Oddychanie wewnątrzkomórkowe Dr n. biol. Henryk Różański Laboratorium Biologii Przemysłowej i Eksperymentalnej Oddychanie Glikoliza beztlenowy, wewnątrzkomórkowy
Państwowa Wyższa Szkoła Zawodowa w Krośnie Biochemia Oddychanie wewnątrzkomórkowe Dr n. biol. Henryk Różański Laboratorium Biologii Przemysłowej i Eksperymentalnej Oddychanie Glikoliza beztlenowy, wewnątrzkomórkowy
Best Body. W skład FitMax Easy GainMass wchodzą:
 Gainery > Model : - Producent : Fitmax Easy GainMass - to produkt przeznaczony jest szczególnie dla sportowców trenujących dyscypliny siłowe, szybkościowo-siłowe oraz wytrzymałościowe. Doskonale dopracowany
Gainery > Model : - Producent : Fitmax Easy GainMass - to produkt przeznaczony jest szczególnie dla sportowców trenujących dyscypliny siłowe, szybkościowo-siłowe oraz wytrzymałościowe. Doskonale dopracowany
Oddychanie komórkowe. Pozyskiwanie i przetwarzanie energii w komórkach roślinnych. Oddychanie zachodzi w mitochondriach Wykład 7.
 Wykład 7. Pozyskiwanie i przetwarzanie energii w komórkach roślinnych Literatura dodatkowa: Oddychanie to wielostopniowy proces utleniania substratów związany z wytwarzaniem w komórce metabolicznie użytecznej
Wykład 7. Pozyskiwanie i przetwarzanie energii w komórkach roślinnych Literatura dodatkowa: Oddychanie to wielostopniowy proces utleniania substratów związany z wytwarzaniem w komórce metabolicznie użytecznej
Fizjologia człowieka
 Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
HORMONY STERYDOWE I PODOBNIE DZIAŁAJĄCE
 HORMONY STERYDOWE I PODOBNIE DZIAŁAJĄCE Są to związki należące do grupy steroidów, które charakteryzują się wykazywaniem istotnych aktywności biologicznych typu hormonalnego. Docierając do komórki docelowej,
HORMONY STERYDOWE I PODOBNIE DZIAŁAJĄCE Są to związki należące do grupy steroidów, które charakteryzują się wykazywaniem istotnych aktywności biologicznych typu hormonalnego. Docierając do komórki docelowej,
Wydział Rehabilitacji Katedra Nauk Przyrodniczych Kierownik: Prof. dr hab. Andrzej Wit BIOCHEMIA. Obowiązkowy
 Przedmiot: BIOCHEMIA I. Informacje ogólne Jednostka organizacyjna Nazwa przedmiotu Wydział Rehabilitacji Katedra Nauk Przyrodniczych Kierownik: Prof. dr hab. Andrzej Wit BIOCHEMIA Kod przedmiotu FI-07
Przedmiot: BIOCHEMIA I. Informacje ogólne Jednostka organizacyjna Nazwa przedmiotu Wydział Rehabilitacji Katedra Nauk Przyrodniczych Kierownik: Prof. dr hab. Andrzej Wit BIOCHEMIA Kod przedmiotu FI-07
MECHANIZM DZIAŁANIA HERBICYDÓW ORAZ WYBRANE ZAGADNIENIA Z ZAKRESU METABOLIZMU HERBICYDÓW W ROŚLINIE
 MECHANIZM DZIAŁANIA HERBICYDÓW ORAZ WYBRANE ZAGADNIENIA Z ZAKRESU METABOLIZMU HERBICYDÓW W ROŚLINIE Prof. dr hab. Grzegorz Skrzypczak Uniwersytet Przyrodniczy w Poznaniu e-mail: gsweed@up.poznan.pl 1.
MECHANIZM DZIAŁANIA HERBICYDÓW ORAZ WYBRANE ZAGADNIENIA Z ZAKRESU METABOLIZMU HERBICYDÓW W ROŚLINIE Prof. dr hab. Grzegorz Skrzypczak Uniwersytet Przyrodniczy w Poznaniu e-mail: gsweed@up.poznan.pl 1.
Metabolizm wysiłkowy tłuszczy
 Metabolizm wysiłkowy tłuszczy Metabolizm tłuszczów tłuszcz właściwy Kwasy tłuszczowe 2. uaktywnienie 1. lipoliza glicerol Aktywne Kwasy Tłuszczowe = AcyloCoA 3. transport AcyloCoA CO 2 i H 2 O 4. spalanie
Metabolizm wysiłkowy tłuszczy Metabolizm tłuszczów tłuszcz właściwy Kwasy tłuszczowe 2. uaktywnienie 1. lipoliza glicerol Aktywne Kwasy Tłuszczowe = AcyloCoA 3. transport AcyloCoA CO 2 i H 2 O 4. spalanie
Czynniki genetyczne sprzyjające rozwojowi otyłości
 Czynniki genetyczne sprzyjające rozwojowi otyłości OTYŁOŚĆ Choroba charakteryzująca się zwiększeniem masy ciała ponad przyjętą normę Wzrost efektywności terapii Czynniki psychologiczne Czynniki środowiskowe
Czynniki genetyczne sprzyjające rozwojowi otyłości OTYŁOŚĆ Choroba charakteryzująca się zwiększeniem masy ciała ponad przyjętą normę Wzrost efektywności terapii Czynniki psychologiczne Czynniki środowiskowe
ZAGADNIENIA KIERUNKOWE.
 ZAGADNIENIA KIERUNKOWE www.ams.wroclaw.pl Trening personalny Trener personalny Kulturystyka Sporty siłowe Trening motoryczny Zajęcia funkcjonalne Wysiłek fizyczny Zmęczenie Zakwasy; glikogen TRENING PERSONALNY
ZAGADNIENIA KIERUNKOWE www.ams.wroclaw.pl Trening personalny Trener personalny Kulturystyka Sporty siłowe Trening motoryczny Zajęcia funkcjonalne Wysiłek fizyczny Zmęczenie Zakwasy; glikogen TRENING PERSONALNY
Nowoczesne systemy ekspresji genów
 Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
Nowoczesne systemy ekspresji genów Ekspresja genów w organizmach żywych GEN - pojęcia podstawowe promotor sekwencja kodująca RNA terminator gen Gen - odcinek DNA zawierający zakodowaną informację wystarczającą
MODELOWANIE SZLAKÓW METABOLICZNYCH
 MODELOWANIE SZLAKÓW METABOLICZNYCH 1. Zagadnienia do samodzielnego przygotowania a. W jakiej postaci gromadzona jest energia w komórce? Dlaczego ATP może wykonać pracę? b. Na czym polega mechanizm syntezy
MODELOWANIE SZLAKÓW METABOLICZNYCH 1. Zagadnienia do samodzielnego przygotowania a. W jakiej postaci gromadzona jest energia w komórce? Dlaczego ATP może wykonać pracę? b. Na czym polega mechanizm syntezy
Mitochondria. siłownie komórki
 śycie - wymaga nakładu energii źródłem - promienie świetlne - wykorzystywane do fotosyntezy - magazynowanie energii w wiązaniach chemicznych Wszystkie organizmy ( a zwierzęce wyłącznie) pozyskują energię
śycie - wymaga nakładu energii źródłem - promienie świetlne - wykorzystywane do fotosyntezy - magazynowanie energii w wiązaniach chemicznych Wszystkie organizmy ( a zwierzęce wyłącznie) pozyskują energię
Spis treści. 1. Wiadomości wstępne Skład chemiczny i funkcje komórki Przedmowa do wydania czternastego... 13
 Przedmowa do wydania czternastego... 13 Częściej stosowane skróty... 15 1. Wiadomości wstępne... 19 1.1. Rys historyczny i pojęcia podstawowe... 19 1.2. Znaczenie biochemii w naukach rolniczych... 22 2.
Przedmowa do wydania czternastego... 13 Częściej stosowane skróty... 15 1. Wiadomości wstępne... 19 1.1. Rys historyczny i pojęcia podstawowe... 19 1.2. Znaczenie biochemii w naukach rolniczych... 22 2.
[IMIĘ I NAZWISKO: KLASA.NR..]
![[IMIĘ I NAZWISKO: KLASA.NR..] [IMIĘ I NAZWISKO: KLASA.NR..]](/thumbs/40/20678287.jpg) Zadanie 1 (1 pkt). Uzasadnij, za pomocą jednego argumentu, że: lizosomy są grabarzami obumarłych składników cytoplazmy lub całych komórek. Zadanie 2 (2 pkt.). Schemat przedstawia budowę komórki eukariotycznej.
Zadanie 1 (1 pkt). Uzasadnij, za pomocą jednego argumentu, że: lizosomy są grabarzami obumarłych składników cytoplazmy lub całych komórek. Zadanie 2 (2 pkt.). Schemat przedstawia budowę komórki eukariotycznej.
Zagadnienia seminaryjne w semestrze letnim I Błony biologiczne
 Zagadnienia seminaryjne w semestrze letnim 2019 I Błony biologiczne 1. Budowa i składniki błon biologicznych - fosfolipidy - steroidy - białka - glikoproteiny i glikolipidy 2. Funkcje błony komórkowej
Zagadnienia seminaryjne w semestrze letnim 2019 I Błony biologiczne 1. Budowa i składniki błon biologicznych - fosfolipidy - steroidy - białka - glikoproteiny i glikolipidy 2. Funkcje błony komórkowej
Dieta ketogenna ARKADIUSZ KOGUT
 Dieta ketogenna ARKADIUSZ KOGUT Odżywianie oparte na tłuszczach jest coraz częściej stosowane w sportach wytrzymałościowych. Jakie korzyści płyną ze wzrostu spożycia lipidów i kiedy można stosować taką
Dieta ketogenna ARKADIUSZ KOGUT Odżywianie oparte na tłuszczach jest coraz częściej stosowane w sportach wytrzymałościowych. Jakie korzyści płyną ze wzrostu spożycia lipidów i kiedy można stosować taką
Streszczenie. Summary. Review. Postepy Hig Med Dosw (online), 2016; 70: e-issn
 Postepy Hig Med Dosw (online), 2016; 70: 1142-1149 e-issn 1732-2693 www.phmd.pl Review Received: 2015.03.23 Accepted: 2012.09.15 Published: 2016.11.14 Udział kwasów tłuszczowych i tkanki tłuszczowej w
Postepy Hig Med Dosw (online), 2016; 70: 1142-1149 e-issn 1732-2693 www.phmd.pl Review Received: 2015.03.23 Accepted: 2012.09.15 Published: 2016.11.14 Udział kwasów tłuszczowych i tkanki tłuszczowej w
The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna
 Streszczenie rozprawy doktorskiej pt. The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna mgr Tomasz Turowski, promotor prof. dr hab.
Streszczenie rozprawy doktorskiej pt. The Role of Maf1 Protein in trna Processing and Stabilization / Rola białka Maf1 w dojrzewaniu i kontroli stabilności trna mgr Tomasz Turowski, promotor prof. dr hab.
Instytut Sportu. Biochemiczne wskaźniki przetrenowania. Zakład Biochemii. mgr Konrad Witek
 Instytut Sportu Zakład Biochemii Biochemiczne wskaźniki przetrenowania Przetrenowanie (overtraining)- długotrwałe pogorszenie się dyspozycji sportowej zawodnika, na skutek kumulowania się skutków stosowania
Instytut Sportu Zakład Biochemii Biochemiczne wskaźniki przetrenowania Przetrenowanie (overtraining)- długotrwałe pogorszenie się dyspozycji sportowej zawodnika, na skutek kumulowania się skutków stosowania
Ocena rozprawy doktorskiej
 Kraków, 05.09.2017 Ocena rozprawy doktorskiej Mgr. Tomasza Bednarskiego pt. Rola szlaków sygnałowych regulujących metabolizm lipidów w rozwoju przerostu lewej komory mięśnia sercowego Niewydolność serca
Kraków, 05.09.2017 Ocena rozprawy doktorskiej Mgr. Tomasza Bednarskiego pt. Rola szlaków sygnałowych regulujących metabolizm lipidów w rozwoju przerostu lewej komory mięśnia sercowego Niewydolność serca
Przemiana materii i energii - Biologia.net.pl
 Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
Ogół przemian biochemicznych, które zachodzą w komórce składają się na jej metabolizm. Wyróżnia się dwa antagonistyczne procesy metabolizmu: anabolizm i katabolizm. Szlak metaboliczny w komórce, to szereg
BIOCHEMICZNE WSKAŹNIKI PRZETRENOWANIA
 BIOCHEMICZNE WSKAŹNIKI PRZETRENOWANIA Dr hab. prof. AWF Elżbieta Hübner-Woźniak AWF, Warszawa W organizmie zawodniczek i zawodników uprawiających wyczynowo różne dyscypliny sportu dochodzi z jednej strony
BIOCHEMICZNE WSKAŹNIKI PRZETRENOWANIA Dr hab. prof. AWF Elżbieta Hübner-Woźniak AWF, Warszawa W organizmie zawodniczek i zawodników uprawiających wyczynowo różne dyscypliny sportu dochodzi z jednej strony
KARTA PRZEDMIOTU. 1. NAZWA PRZEDMIOTU: Biochemia wysiłku fizycznego KOD WF/II/st/16
 KARTA PRZEDMIOTU 1. NAZWA PRZEDMIOTU: Biochemia wysiłku fizycznego KOD WF/II/st/16 2. KIERUNEK: Wychowanie fizyczne 3. POZIOM STUDIÓW 1 : II stopień studia stacjonarne 4. ROK/ SEMESTR STUDIÓW: I rok/i
KARTA PRZEDMIOTU 1. NAZWA PRZEDMIOTU: Biochemia wysiłku fizycznego KOD WF/II/st/16 2. KIERUNEK: Wychowanie fizyczne 3. POZIOM STUDIÓW 1 : II stopień studia stacjonarne 4. ROK/ SEMESTR STUDIÓW: I rok/i
Transport. Bogdan Walkowiak. Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka. 7 listopada 2014 Biofizyka
 Wykład 4 Transport Bogdan Walkowiak Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka 1 Systemy transportu przez membrany Transport substancji pokarmowych, jonów i produktów przemiany
Wykład 4 Transport Bogdan Walkowiak Zakład Biofizyki Instytut Inżynierii Materiałowej Politechnika Łódzka 1 Systemy transportu przez membrany Transport substancji pokarmowych, jonów i produktów przemiany
oksydacyjna ADP + Pi + (energia z utleniania zredukowanych nukleotydów ) ATP
 Życie - wymaga nakładu energii źródłem - promienie świetlne - wykorzystywane do fotosyntezy - magazynowanie energii w wiązaniach chemicznych Wszystkie organizmy (a zwierzęce wyłącznie) pozyskują energię
Życie - wymaga nakładu energii źródłem - promienie świetlne - wykorzystywane do fotosyntezy - magazynowanie energii w wiązaniach chemicznych Wszystkie organizmy (a zwierzęce wyłącznie) pozyskują energię
Hormony Gruczoły dokrewne
 Hormony Gruczoły dokrewne Dr n. biol. Urszula Wasik Zakład Biologii Medycznej HORMON Przekazuje informacje między poszczególnymi organami regulują wzrost, rozwój organizmu efekt biologiczny - niewielkie
Hormony Gruczoły dokrewne Dr n. biol. Urszula Wasik Zakład Biologii Medycznej HORMON Przekazuje informacje między poszczególnymi organami regulują wzrost, rozwój organizmu efekt biologiczny - niewielkie
października 2013: Elementarz biologii molekularnej. Wykład nr 2 BIOINFORMATYKA rok II
 10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
10 października 2013: Elementarz biologii molekularnej www.bioalgorithms.info Wykład nr 2 BIOINFORMATYKA rok II Komórka: strukturalna i funkcjonalne jednostka organizmu żywego Jądro komórkowe: chroniona
Wykład 9: HUMAN GENOME PROJECT HUMAN GENOME PROJECT
 Wykład 9: Polimorfizm pojedynczego nukleotydu (SNP) odrębność genetyczna, która czyni każdego z nas jednostką unikatową Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej HUMAN GENOME
Wykład 9: Polimorfizm pojedynczego nukleotydu (SNP) odrębność genetyczna, która czyni każdego z nas jednostką unikatową Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej HUMAN GENOME
Zakład Medycyny Regeneracyjnej, Wojskowy Instytut Higieny i Epidemiologii w Warszawie 2/
 Lewicki Probl Hig S i Epidemiol wsp. Wpływ 2013, chromu 94(4): III, 825-830 estradiolu i genisteiny na komórkową lokalizację insulinozależnego białka... 825 Wpływ chromu III, estradiolu i genisteiny na
Lewicki Probl Hig S i Epidemiol wsp. Wpływ 2013, chromu 94(4): III, 825-830 estradiolu i genisteiny na komórkową lokalizację insulinozależnego białka... 825 Wpływ chromu III, estradiolu i genisteiny na
Mięśnie. dr Magdalena Markowska
 Mięśnie dr Magdalena Markowska Zjawisko ruchu 1) Jako możliwość przemieszczania przestrzennego mięśnie poprzecznie prążkowane 2) Pompa serce 3) Jako podstawa do utrzymywania czynności życiowych mięśnie
Mięśnie dr Magdalena Markowska Zjawisko ruchu 1) Jako możliwość przemieszczania przestrzennego mięśnie poprzecznie prążkowane 2) Pompa serce 3) Jako podstawa do utrzymywania czynności życiowych mięśnie
Kwasy tłuszczowe EPA i DHA omega-3 są niezbędne dla zdrowia serca i układu krążenia.
 Kwasy tłuszczowe EPA i DHA omega-3 są niezbędne dla zdrowia serca i układu krążenia. Kwasy tłuszczowe omega-3 jak pokazują wyniki wielu światowych badań klinicznych i epidemiologicznych na ludziach, są
Kwasy tłuszczowe EPA i DHA omega-3 są niezbędne dla zdrowia serca i układu krążenia. Kwasy tłuszczowe omega-3 jak pokazują wyniki wielu światowych badań klinicznych i epidemiologicznych na ludziach, są
CORAZ BLIŻEJ ISTOTY ŻYCIA WERSJA A. imię i nazwisko :. klasa :.. ilość punktów :.
 CORAZ BLIŻEJ ISTOTY ŻYCIA WERSJA A imię i nazwisko :. klasa :.. ilość punktów :. Zadanie 1 Przeanalizuj schemat i wykonaj polecenia. a. Wymień cztery struktury występujące zarówno w komórce roślinnej,
CORAZ BLIŻEJ ISTOTY ŻYCIA WERSJA A imię i nazwisko :. klasa :.. ilość punktów :. Zadanie 1 Przeanalizuj schemat i wykonaj polecenia. a. Wymień cztery struktury występujące zarówno w komórce roślinnej,
THE UNFOLDED PROTEIN RESPONSE
 THE UNFOLDED PROTEIN RESPONSE Anna Czarnecka Źródło: Intercellular signaling from the endoplasmatic reticulum to the nucleus: the unfolded protein response in yeast and mammals Ch. Patil & P. Walter The
THE UNFOLDED PROTEIN RESPONSE Anna Czarnecka Źródło: Intercellular signaling from the endoplasmatic reticulum to the nucleus: the unfolded protein response in yeast and mammals Ch. Patil & P. Walter The
Szafy, garderoby, zabudowy wnęk Rydułtowy ul. Bema 3 Turza Śląska ul.. Bogumińska 21 tel./fax (032) 451-41-29
 Odżywianie w konkurencjach wytrzymałościowych..część 2 Odżywianie jest nieodłącznym elementem procesu treningowego. Pozostałe elementy to trening i regeneracja. Wszystkie te elementy są jednakowo ważne
Odżywianie w konkurencjach wytrzymałościowych..część 2 Odżywianie jest nieodłącznym elementem procesu treningowego. Pozostałe elementy to trening i regeneracja. Wszystkie te elementy są jednakowo ważne
Ocena żywotności mięśnia sercowego w badniach 18FDG-PET
 Ocena żywotności mięśnia sercowego w badniach 18FDG-PET Dr n. med. Małgorzata Kobylecka Zakład Medycyny Nuklearnej WUM Międzynarodowa Szkoła Energetyki Jądrowej 26-30 Października 2015 Warszawa Frank M.
Ocena żywotności mięśnia sercowego w badniach 18FDG-PET Dr n. med. Małgorzata Kobylecka Zakład Medycyny Nuklearnej WUM Międzynarodowa Szkoła Energetyki Jądrowej 26-30 Października 2015 Warszawa Frank M.
Stanisław Poprzęcki Druga twarz kreatyny. Bibliotheca Nostra : śląski kwartalnik naukowy 2/2, 26-30
 Stanisław Poprzęcki Druga twarz kreatyny Bibliotheca Nostra : śląski kwartalnik naukowy 2/2, 26-30 2008 26 Bibliotheca Nostra Stanisław Poprzęcki Druga twarz kreatyny Kreatyna i fosfokreatyna jest substratem
Stanisław Poprzęcki Druga twarz kreatyny Bibliotheca Nostra : śląski kwartalnik naukowy 2/2, 26-30 2008 26 Bibliotheca Nostra Stanisław Poprzęcki Druga twarz kreatyny Kreatyna i fosfokreatyna jest substratem
Fizjologia nauka o czynności żywego organizmu
 nauka o czynności żywego organizmu Stanowi zbiór praw, jakim podlega cały organizm oraz poszczególne jego układy, narządy, tkanki i komórki prawa rządzące żywym organizmem są wykrywane doświadczalnie określają
nauka o czynności żywego organizmu Stanowi zbiór praw, jakim podlega cały organizm oraz poszczególne jego układy, narządy, tkanki i komórki prawa rządzące żywym organizmem są wykrywane doświadczalnie określają
Ruch i mięśnie. dr Magdalena Markowska
 Ruch i mięśnie dr Magdalena Markowska Zjawisko ruchu Przykład współpracy wielu układów Szkielet Szkielet wewnętrzny: szkielet znajdujący się wewnątrz ciała, otoczony innymi tkankami. U kręgowców składa
Ruch i mięśnie dr Magdalena Markowska Zjawisko ruchu Przykład współpracy wielu układów Szkielet Szkielet wewnętrzny: szkielet znajdujący się wewnątrz ciała, otoczony innymi tkankami. U kręgowców składa
Rola leptyny w regulacji metabolizmu lipidów i węglowodanów Role of leptin in the regulation of lipid and carbohydrate metabolism
 ostepy Hig Med Dosw (online), 2011; 65: 255-262 e-issn 1732-2693 www.phmd.pl Review Received: 2011.02.28 Accepted: 2011.04.05 ublished: 2011.04.26 Rola leptyny w regulacji metabolizmu lipidów i węglowodanów
ostepy Hig Med Dosw (online), 2011; 65: 255-262 e-issn 1732-2693 www.phmd.pl Review Received: 2011.02.28 Accepted: 2011.04.05 ublished: 2011.04.26 Rola leptyny w regulacji metabolizmu lipidów i węglowodanów
Wykład: HUMAN GENOME PROJECT HUMAN GENOME PROJECT
 Wykład: Polimorfizm pojedynczego nukleotydu (SNP) odrębność genetyczna, która czyni każdego z nas jednostką unikatową Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej HUMAN GENOME
Wykład: Polimorfizm pojedynczego nukleotydu (SNP) odrębność genetyczna, która czyni każdego z nas jednostką unikatową Prof. dr hab. n. med. Małgorzata Milkiewicz Zakład Biologii Medycznej HUMAN GENOME
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI. Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 3 ANALIZA TRANSPORTU SUBSTANCJI NISKOCZĄSTECZKOWYCH PRZEZ BŁONĘ KOMÓRKOWĄ I. WSTĘP TEORETYCZNY Każda komórka, zarówno roślinna,
Fizjologia człowieka
 Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Akademia Wychowania Fizycznego i Sportu w Gdańsku Katedra: Promocji Zdrowia Zakład: Biomedycznych Podstaw Zdrowia Fizjologia człowieka Osoby prowadzące przedmiot: Prof. nadzw. dr hab. Zbigniew Jastrzębski
Konspekt z przedmiotu biologia realizowany w klasie II gimnazjum przez nauczyciela Sabinę Gądek
 Konspekt z przedmiotu biologia realizowany w klasie II gimnazjum przez nauczyciela Sabinę Gądek TEMAT : Komórka najmniejsza funkcjonalna część organizmu. Cele: zdobycie wiadomości na temat najmniejszej
Konspekt z przedmiotu biologia realizowany w klasie II gimnazjum przez nauczyciela Sabinę Gądek TEMAT : Komórka najmniejsza funkcjonalna część organizmu. Cele: zdobycie wiadomości na temat najmniejszej
Długotrwały niedobór witaminy C (hipoascorbemia) powoduje miażdżycę oraz osadzanie się lipoproteiny(a) w naczyniach krwionośnych transgenicznych myszy
 Długotrwały niedobór witaminy C (hipoascorbemia) powoduje miażdżycę oraz osadzanie się lipoproteiny(a) w naczyniach krwionośnych transgenicznych myszy Nowa publikacja Instytutu Medycyny Komórkowej dr Ratha
Długotrwały niedobór witaminy C (hipoascorbemia) powoduje miażdżycę oraz osadzanie się lipoproteiny(a) w naczyniach krwionośnych transgenicznych myszy Nowa publikacja Instytutu Medycyny Komórkowej dr Ratha
SPRAWDZIAN klasa II ORGANELLA KOMÓRKOWE, MITOZA, MEJOZA
 SPRAWDZIAN klasa II ORGANELLA KOMÓRKOWE, MITOZA, MEJOZA 1. Najwięcej Aparatów Golgiego będzie w komórkach: Mięśnia Trzustki Serca Mózgu 2. Podaj 3 cechy transportu aktywnego... 3. Czym się różni dyfuzja
SPRAWDZIAN klasa II ORGANELLA KOMÓRKOWE, MITOZA, MEJOZA 1. Najwięcej Aparatów Golgiego będzie w komórkach: Mięśnia Trzustki Serca Mózgu 2. Podaj 3 cechy transportu aktywnego... 3. Czym się różni dyfuzja
Aleksandra Krystyna Ławniczak
 GDAŃSKI UNIWERSYTET MEDYCZNY WYDZIAŁ LEKARSKI Aleksandra Krystyna Ławniczak Ocena ekspresji sirtuin 1, 3 i 7 w mięśniu sercowym oraz szkieletowym młodych i starych szczurów w warunkach ograniczonej czasowo
GDAŃSKI UNIWERSYTET MEDYCZNY WYDZIAŁ LEKARSKI Aleksandra Krystyna Ławniczak Ocena ekspresji sirtuin 1, 3 i 7 w mięśniu sercowym oraz szkieletowym młodych i starych szczurów w warunkach ograniczonej czasowo
Czy żywność GMO jest bezpieczna?
 Instytut Żywności i Żywienia dr n. med. Lucjan Szponar Czy żywność GMO jest bezpieczna? Warszawa, 21 marca 2005 r. Od ponad połowy ubiegłego wieku, jedną z rozpoznanych tajemnic życia biologicznego wszystkich
Instytut Żywności i Żywienia dr n. med. Lucjan Szponar Czy żywność GMO jest bezpieczna? Warszawa, 21 marca 2005 r. Od ponad połowy ubiegłego wieku, jedną z rozpoznanych tajemnic życia biologicznego wszystkich
AUTOREFERAT. 2. Posiadane dyplomy, stopnie naukowe/ artystyczne z podaniem nazwy, miejsca i roku ich uzyskania oraz tytułu rozprawy doktorskiej
 AUTOREFERAT 1. Imię i nazwisko Dr Paweł Dobrzyń Pracownia Molekularnej Biochemii Medycznej Instytut Biologii Doświadczalnej im. M. Nenckiego PAN ul. Pasteura 3 02-093 Warszawa 2. Posiadane dyplomy, stopnie
AUTOREFERAT 1. Imię i nazwisko Dr Paweł Dobrzyń Pracownia Molekularnej Biochemii Medycznej Instytut Biologii Doświadczalnej im. M. Nenckiego PAN ul. Pasteura 3 02-093 Warszawa 2. Posiadane dyplomy, stopnie
Sylabus: Biochemia. 1. Metryczka II WYDZIAŁ LEKARSKI Z ODDZIAŁEM NAUCZANIA W JĘZYKU ANGIELSKIM ORAZ ODDZIAŁEM FIZJOTERAPII.
 Sylabus: Biochemia 1. Metryczka Nazwa Wydziału: Program kształcenia II WYDZIAŁ LEKARSKI Z ODDZIAŁEM NAUCZANIA W JĘZYKU ANGIELSKIM ORAZ ODDZIAŁEM FIZJOTERAPII FIZJOTERAPIA, STUDIA I STOPNIA, PROFIL PRAKTYCZNY,
Sylabus: Biochemia 1. Metryczka Nazwa Wydziału: Program kształcenia II WYDZIAŁ LEKARSKI Z ODDZIAŁEM NAUCZANIA W JĘZYKU ANGIELSKIM ORAZ ODDZIAŁEM FIZJOTERAPII FIZJOTERAPIA, STUDIA I STOPNIA, PROFIL PRAKTYCZNY,
Gdański Uniwersytet Medyczny. Polimorfizm genów receptorów estrogenowych (ERα i ERβ) a rozwój zespołu metabolicznego u kobiet po menopauzie
 Gdański Uniwersytet Medyczny Mgr Karolina Kuźbicka Polimorfizm genów receptorów estrogenowych (ERα i ERβ) a rozwój zespołu metabolicznego u kobiet po menopauzie Rozprawa doktorska Promotor: dr hab. n.
Gdański Uniwersytet Medyczny Mgr Karolina Kuźbicka Polimorfizm genów receptorów estrogenowych (ERα i ERβ) a rozwój zespołu metabolicznego u kobiet po menopauzie Rozprawa doktorska Promotor: dr hab. n.
