cykloheksan benzen p-nitrofenol
|
|
|
- Bogdan Niemiec
- 9 lat temu
- Przeglądów:
Transkrypt
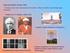
1 1 Ćwiczenie 19K. Interakcja światła z materią. Absorpcja światła. Wyznaczanie widm absorpcji wybranych biomolekuł. Część teoretyczna: Spektroskopia jest często stosowaną techniką w badaniach chemicznych i biochemicznych. Bardzo szerokie zastosowania znalazła spektroskopia elektronowa w zakresie światła widzialnego (VIS; nm) i nadfioletu (UV; nm). W widmach absorpcyjnych UV-VIS w wyniku przejścia światła (promieniowania elektromagnetycznego) przez roztwór danego związku chemicznego obserwuje się przejścia elektronów walencyjnych ze stanu podstawowego do wzbudzonego. W wyniku takiego przejścia promieniowanie elektromagnetyczne o pewnych długościach fali jest pochłaniane (absorbowane). Absorpcja promieniowania związana jest z przejściami elektronów na wyższe poziomy energetyczne. Jedną z przyczyn absorpcji jest obecność w związku chemicznym grup atomów zawierających elektrony o małych energiach wzbudzenia. Grupy takie, nazywane są chromoforami (z grec. niosący kolor ). Najczęściej są to pierścienie aromatyczne (aromatyczny sekstet elektronów), wiązania wielokrotne (wiązania typu π), czy też atomy zawierające wolne pary elektronowe (tzw. elektrony niewiążące n). Związki zawierające elektrony niewiążące (n) i elektrony typu π najczęściej absorbują światło w obszarze nadfioletu. Obok chromoforów w cząsteczkach mogą znajdować się inne grupy atomów określane mianem auksochromów. Wzmacniają one działanie chromoforów, oraz mogą przesuwać maksimum absorpcji w kierunku fal dłuższych (tzw. batochromy, np.: -NH 2, -OH, -OR), bądź w kierunku fal krótszych (tzw. hipsochromy, np.: CH 3, -CO-, -C 6 H 5 CO-). Efekt działania grup chromoforowych na widma absorpcyjne możemy zademonstrować porównując widma 3 związków: cykloheksanu, benzenu oraz p-nitrofenolu. OH NO 2 cykloheksan benzen p-nitrofenol Jak widzimy są to cykliczne związki zawierające 6 atomów węgla. Jeżeli jednak popatrzymy na ich widma to zaobserwujemy że cykloheksan wcale nie absorbuje światła, benzen silnie adsorbuje w nadfiolecie ( nm), a p-nitrofenol zarówno w zakresie UV, jak i światła widzialnego. Za absorpcję światła w zakresie UV odpowiada obecność pierścienia aromatycznego (grupy chromoforowej), natomiast przyłączenie batochromów (-OH, -NO 2 ) powoduje przesunięcie w kierunku fal dłuższych (czyli w zakres światła widzialnego).
2 2 Na rys. obok przedstawiono widma absorpcyjne 1 fenolu (C 6 H 5 OH; pierścień benzenowy z dodatkową grupę OH) i p-nitrofenolu (zawierającego zarówno grupę OH jak i NO 2 ). Jak widać na rys. fenol pochłania światło o długości poniżej 380 nm (dlatego jego roztwór jest bezbarwny), natomiast p-nitrofenol (zawierający 2 grupy auksochromowe) absorbuje zarówno światło UV i światło widzialne (maksymalną absorpcję wykazuje dla długości fali ok. 405 nm, która odpowiada barwie niebieskiej). Należy podkreślić, że barwa substancji zależy od selektywnej absorpcji określonej długości światła widzialnego i jest ona barwą dopełniającą do pochłoniętej. Ponieważ absorbowane jest światło o barwie niebieskiej to roztwór wykazuje żółte zabarwienie (barwa żółta jest barwą dopełniającą do niebieskiej, czerwona zielona; biała-czarna, itp.). Do innych substancji absorbujących w zakresie światła widzialnego należą związki pierwiastków bloku d. Cechą tych pierwiastków jest niecałkowicie zapełnienie podpowłoki d, w związku z czym elektron z łatwością może być przeniesiony w obrębie poziomów energetycznych podpowłoki d. Wartość energii przejścia pomiędzy poziomami d odpowiada energii promieniowania widzialnego ( nm). Dlatego też większość roztworów związków zawierających pierwiastki bloku wykazuje zabarwienie, co jest wykorzystywane do ich analizy (np. Cu 2+ - niebieskie, CrO żółte, Cr 2 O pomarańczowe, Cr 3+ - zielone, MnO fioletowe, Fe 2+ - jasnozielone, Fe 3+ - żółte). Przy całkowicie zapełnionej podpowłoce d lub braku na niej elektronów jony proste metali bloku d są bezbarwne (np.: bezbarwny Cu + ( natomiast Cu 2+ niebieskie), czy bezbarwny Ti 4+, w odróżnieniu od fioletowego Ti 3+ ). Prawa absorpcji Jeżeli na próbkę pada promieniowanie elektromagnetyczne (światło) o natężeniu I 0 to część tego promieniowania zostanie zaabsorbowana, a część przechodzi przez tą próbkę. Rejestrując natężenia promieniowania padającego (I 0 ) i przechodzącego (I T ) możemy wyznaczyć ilość światła która ulega pochłonięciu przez roztwór (absorbancja, A), lub która I 1 przeszła przez niego (trasmitancja, T): A = log 0 = log I T Absorbancja przy danej długości fali zależy od molowego współczynnika absorpcji (ε), grubości warstwy absorbującej (zwykle 1cm) i stężenia badanego roztworu. Zależność ta T 1 Widmo absorpcyjne związku chemicznego jest miarą ilości światła zaabsorbowanego przez ten związek (absorbancja) w zależności od długości fali świetlnej (λ).
3 3 matematycznie jest wyrażona przez prawo Lamberta-Beera (absorbancja jest wprost proporcjonalna do stężenia roztworu i grubości warstwy absorbującej), co możemy zapisać: A = ε l C gdzie: A absorbancja l grubość warstwy absorpcyjnej ε molowy współczynnik absorpcji [cm 2 /mol] C stężenie badanego roztworu [mol/dm 3 ] Molowy współczynnik absorpcji (ε) jest charakterystyczny dla danej substancji i ma stałą wartość przy określonej długości fali. Liczbowo przedstawia on absorbancję wykazywaną przez roztwór o stężeniu 1 mol/dm 3, przy grubości warstwy 1cm. Znajomość wartości molowego współczynnika absorpcji pozwala określić stężenie roztworu po oznaczeniu jego absorbancji (ekstynkcji) bądź też wykorzystywać do obliczania przewidywanej absorbancji substancji o znanym stężeniu. W tabeli zestawiono wartości molowego współczynnika absorpcji (ε) dla kilku związków: Substancja ε M -1 cm -1 ( 10 3 ) λ max (nm) Streptavidin Cascade Blue PerCP Oregon Green Fluorescein Texas Red Alexa Fluor NADH p-nitrofenol Prawo Lamberta Beera można też przedstawić w postaci graficznej jako zależność A= f (c). Będzie to linia prosta przechodząca przez początek układu współrzędnych (ryc. obok), gdzie dla danego stężenia zaznaczono odpowiadającą mu wartość absorbancji. Korzystając z krzywej wzorcowej sporządzonej dla danej substancji i zmierzeniu absorbancji próbki badanej można na podstawie wykresu określić stężenie tej substancji w badanej próbie.
4 4 Pomiar absorbancji Przy wykonywaniu pomiarów spektrofotometrycznych należy pamiętać, iż zmierzona wartość absorbancji jest sumą absorbancji próbki i absorbancji odnośnika. Jako odnośniki stosuje się: powietrze; roztwory nie absorbujące przy żadnej długości fali (roztwory buforowe, woda); roztwory absorbujące, ale nie wchodzące w reakcje z badaną substancją lub roztwory o znanym stężeniu, które będzie się zmieniało w wyniku zachodzących reakcji. Przed wykonaniem pomiaru absorbancji należy wykalibrować spektrofotometr poprzez ustawienie absorbancji na wartość równą zero, gdy w kuwecie znajduje się odnośnik. Jeżeli wykonuje się widmo jakiegoś związku, również należy wykonać widmo odnośnika, a końcowe widmo związku jest to widmo zmierzone pomniejszone o widmo odnośnika. Jeżeli roztwór (woda, bufor) będący odnośnikiem nie zawiera badanej substancji w żadnej z możliwych form, wówczas uzyskujemy widmo absolutne. Widmo różnicowe uzyskujemy, gdy roztwór odnośnika zawiera badaną substancję w takim samym stężeniu jak roztwór badany. Przeprowadza się wówczas reakcję w kuwecie z badaną substancją, w wyniku której stężenie jej zmienia się, natomiast w kuwecie z odnośnikiem nie zachodzi żadna reakcja, a zatem stężenie badanej substancji nie zmienia się. W tego rodzaju badaniach widmo przedstawia zmiany absorbancji ( absorbancji) w próbie badanej w porównaniu do odnośnika. Oba sposoby pomiaru absorbancji są wykorzystywane w laboratoriach do wyznaczania stężeń czy też kinetyki reakcji chemicznych. Przy wykonywaniu pomiarów spektrofotometrycznych należy pamiętać, iż na uzyskany wynik absorbancji wpływ ma również materiał, z jakiego wykonana jest kuweta pomiarowa. Przyczyną tego jest fakt, sama kuweta również może absorbować światło. Jeżeli wiązkę światła przepuścimy przez pustą kuwetę, to po dotarciu do detektora będzie ona miała mniejsze natężenie niż wiązka światła padającego. W związku z tym w zależności od zakresu długości fali, przy jakiej jest wykonywany pomiar należy stosować różnego rodzaju kuwety pomiarowe. Poniżej podano przepuszczalność światła dla materiałów, z których wykonuje się kuwety: Polistyren: nm Kwarc: nm Szkło: nm Polimetakrylan: nm W wielu oznaczeniach, gdzie długość fali stosowanej w pomiarze jest większa od 340 nm stosuje się zwykle plastikowe kuwety, które są tańsze i mniej ulegają kontaminacji przy zastosowaniu takich odczynników jak np.: coomasie blue. Jednak do pomiarów absorbancji roztworów białek przy 280 nm, czy też DNA przy 260 nm stosuje się kuwety kwarcowe. Należy pamiętać, iż przepuszczalność światła przez dwie kuwety (wykonane z tego samego materiału) może znacznie się różnić. Dlatego należy dobierać kuwety o zbliżonej przepuszczalności światła lub dokonywać pomiaru absorbancji próbki i odnośnika w tej samej kuwecie. Tego typu problemy mogą również wystąpić przy stosowaniu kuwet do małych objętości (<1 ml) i może to być związane z tym, iż wiązka światła nie trafia precyzyjnie w środek przedniej ściany kuwety. W tym wypadku występujące zakłócenia
5 5 można zniwelować poprzez zastosowanie kuwet, które są całe czarne poza szczeliną, którą dociera do próbki wiązka światła. Widzimy, zatem że kuweta pomiarowa ma ogromny wpływ na dokładność wykonywanych pomiarów. Kuwety pozwalające na pomiary z dużą precyzją są bardzo drogie i powinny być używane i przechowywane ze szczególną ostrożnością. Ścianek kuwety, przez które przechodzi wiązka światła nie należy dotykać palcami, a w przypadku zabrudzenia należy je przemyć wodą i delikatnie wytrzeć miękką chusteczką. Przed dłuższym przechowywaniem kuwetę należy opłukać woda dejonizowaną i etanolem, aby nie pozostały na niej zacieki. Interakcja światła z wybranymi biomolekułami Światło wchodząc w interakcję z powierzchnią skóry, może ulec odbiciu, rozproszeniu lub absorpcji (pochłanianiu). W skórze zawarte są różne rodzaje barwników, którą mogą odpowiadać za pochłanianie światła. Mogą nimi być składniki naturalne (np. melanina, hemoglobina) lub być wprowadzone z zewnątrz do organizmu (np. barwniki tatuaży, składniki kremów itp.). Kolor naszej skóry zależy od ukrwienia i grubości naskórka, a przede wszystkim od obecności melaniny - naturalnego barwnika skóry. Jej wytwarzanie uzależnione jest od czynników genetycznych i hormonalnych, oraz czynników zewnętrznych (np. promieniowanie ultrafioletowe). Zachodzi one w melanocytach komórkach usytuowanych w warstwie podstawnej naskórka. W odpowiedzi na rożne bodźce melanina przenoszona jest do bardziej zewnętrznych warstw naskórka. Pod wpływem promieniowania ultrafioletowego ilość melaniny w skórze zwiększa się, co możemy zaobserwować poprzez przejściową zmianę zabarwienia (opaleniznę). Pierwsze i najszybsze przebarwienie skóry jest wynikiem działania długofalowych promieni UVA. Za późniejszą i trwałą opaleniznę odpowiada promieniowanie UVB. Uwaga: duże dawki promieniowania UVB mogą doprowadzić do poparzenia skóry objawiającego się bolesnymi obrzękami i pęcherzami. Komórki naskórka wraz z zawartą w nich melaniną obumierają i złuszczają się, co sprawia że opalenizna po pewnym czasie zanika. Ludzka melanina zawiera eumelaninę (brązowo-czarny barwnik) i feomelaninę (czerwono-żółty barwnik), które odpowiadają za absorbcję promieniowanie w zakresie UVA ( nm), UVB ( nm) oraz w paśmie światła widzialnego. Najnowsze badania naukowe dowodzą, że światło widzialne także może być szkodliwe dla człowieka, podobnie jak promieniowanie UV. Dotyczy to zwłaszcza światła o wysokiej energii (ang. High Energy Visible Light, HEV) charakteryzującego się wysoką częstotliwością i długości fali nm. Światło to nie powoduje zaczerwienienia skóry, jak ma to miejsce podczas absorpcji promieniowania UV. Skutki działania HEV objawiają sie w późniejszym czasie, kiedy pod jego wpływem dochodzi do zwiększonego powstawania reaktywnych form tlenu (wolnych rodników). Przyczynia się to do pośredniego uszkodzenia DNA oraz aktywacji
6 6 metaloproteinaz, a tym samym przedwczesnego starzenia się skóry. Uważa się, że może to być również powodem powstawania przebarwień i pokrzywek słonecznych. W produktach kosmetycznych od dawna stosuje się preparaty zawierające melaninę. Ponieważ są to związki wielkocząsteczkowe mają one niewielką szansę, aby przeniknąć w głąb skóry i ich działanie ogranicza się do warstwy powierzchniowej. Obecnie obserwuje się zwiększone zainteresowanie przemysłu kosmetycznego frakcjonowaną melatoninę, która znacznie lepiej penetruje naskórek. Filtrujące i antyrodnikowe właściwości takiej melatoniny są podkreślane poprzez umieszczanie dopisku Liposhield HEV Melanin w nazwie produktu. W odróżnieniu od wody, krew cechuje się wyjątkowo silnym pochłanianiem fal o długościach odpowiadających barwie niebieskiej ( nm), zielonej ( nm) i żółtej ( nm). Dominującą rolę w absorpcji światła przez krew odgrywa hemoglobina. Hemoglobina występująca w formie utlenowanej (oksyhemoglobina, HbO 2 ) ma barwę jasnoczerwoną i badana na spektrofotometrze wykazuje największą absorpcję przy 414 nm oraz charakterystyczne piki absorpcyjne przy 542 nm i 578 nm. Hemoglobina odtlenowana (Hb) ma barwę czerwonofioletową i w spektrofotometrze obserwuje się piki absorpcyjne w zakresie nm i przy długości fali równej 565 nm (ryc. poniżej). Zmiany w widmie absorbancji można zaobserwować w roztworze hemoglobiny. W wyniku kontaktu z powietrzem hemoglobina nasyca się tlenem i możemy zaobserwować, że roztwór przyjmuje charakterystyczną czerwoną barwę. W wyniku oddania tlenu (możemy to uzyskać np. wrzucając kilka kryształków NaHSO 3 lub Na 2 S 2 O 4 do roztworu hemoglobiny) oksyhemoglobina przechodzi w deoksyhemoglobiną (hemoglobinę odtlenowaną) o czym świadczy zmiana barwy na czerwono-fioletową.
7 7 Część eksperymentalna: 1. Sporządzanie krzywej wzorcowej i jej wykorzystanie do oznaczania stężenia substancji badanej (substancja badana p-nitrofenol) Wykorzystując wyjściowy roztwór p-nitrofenolu o stężeniu 10 mm przygotować roztwory wzorcowe o następujących stężeniach: 50; 100; 200; 300 i 500 µm. Przygotowanie poszczególnych rozcieńczeń ułatwi poniższa tabela: Roztwór Objętość roztworu V Stężenie p-nitrofenolu V H2O [ml] [ml] C [mm] A 0,5 ml roztworu wyjściowego 9,5 0,5 B 0,3 ml roztworu wyjściowego 9,7 0,3 C 4,0 ml roztworu A 6,0 0,2 D 5,0 ml roztworu C 5,0 0,1 E 5,0 ml roztworu D 5,0 0,05 Następnie do czystych probówek lub kuwet spektrofotometrycznych odmierzyć po 0,5 ml uprzednio przygotowanych roztworów wzorcowych. Do wszystkich prób dodać po 2 ml 0,1M r-ru NaOH i wymieszać (w kuwetach za pomocą mieszadełka). P-nitrofenol w środowisku zasadowym tworzy żółto zabarwiony anion p-nitrofenolanowy. Zmierzyć wartość absorbancji (A) dla poszczególnych prób, przy długości fali 415 nm, stosując wodę jako odnośnik. Z uzyskanych wyników wykreślić krzywą wzorcową (zależność A = f (c)). Analogicznie wykonać pomiar absorbancji dla próbki o nieznanym stężeniu p-nitrofenolu. Do 0,5 ml roztworu próby o nieznanym stężeniu należy dodać 2 ml 0,1 M r-ru NaOH, wymieszać i zmierzyć absorbancję. Na podstawie wcześniej wykreślonej krzywej wzorcowej wyznaczyć stężenie p-nitrofenolu w badanej próbie. 2.Wyznaczanie widm absorpcji i określanie maximum absorpcji wybranych biomolekuł Przygotować roztwory badanych substancji w probówkach z korkiem o objętości 10 ml. Substancjami badanymi są: 1. Fluoresceina : 0,5 mg/ml roztwór wyjściowy (SPEKOL 11/SEMCO) Zakres badania nm. Wyznaczyć widma absorbancji dla roztworów fluoresceiny o stężeniu 0,1; 0,25; 0,5 mg/ml) Roztwór V H2O [ml] C końcowe fluoresceiny [mg/ml] A roztwór wyjściowy fluoresceiny - 0,5 B 3 ml roztworu wyjściowego 3 0,25 C 2 ml roztworu B 3 0,10
8 8 2. Melanina (ELMER PERKIN / HELIOS) 0,4 ml roztworu wyjściowego + 7,6 ml NaOH ( M) Zakres badania nm 3. Witamina A (ELMER PERKIN / HELIOS) 0,5 ml roztworu wyjściowego + 3,5 ml DMSO Zakres badania nm 4. Hemoglobina (ELMER PERKIN / HELIOS) Roztwór wyjściowy przenieść do kuwety pomiarowej (ew. rozcieńczyć 0,9% NaCl szczegóły ustala osoba prowadząca zajęcia) Zakres badania nm Widmo badanych substancji wykreślić przy pomocy aparatu Elmer Perkin. Po uruchomieniu programu wybieramy metodę (okno METHODS): MSC. Wybór potwierdzić dwukrotnym kliknięciem na nazwie metody. Pojawia się okno parametrów metody, gdzie podajemy początkową (start wevelenght) i końcową (end) długość fali, oraz interwał (data interwal; odstęp pomiędzy poszczególnymi pomiarami). Proszę zwrócić uwagę, że najpierw podajemy wyższą długość fali (jako start), a jako końcową - niższą wartość (co pokazuje rycina po prawej stronie): Początkowa i końcowa długość fali, jaką należy ustawić podane są w instrukcji (przy każdej substancji) jako zakres badania. Interwał ustawiamy na 5 nm (wartość interwału może być zmieniona przez prowadzącego ćwiczenia). Po ustawieniu wszystkich wartości i umieszczeniu kuwet z wodą (ok. 1 ml) w komorze pomiarowej i referencyjnej spektrofotometru wciskamy klawisz START (zaznaczony czerwoną strzałką na ryc. powyżej, po prawej stronie) Pojawia się okno informacyjne - proszące o wstawienie próby odniesienia (ang. BLANK tzw. ślepa próba). Po zatwierdzeniu poprzez kliknięcie na OK aparat przeprowadzi
9 9 automatyczną kalibrację dla podanego zakresu długości fal (wyznaczy tzw. linię bazową). Następnie po kalibracji pojawia się komunikat proszący o wstawienie badanej próby (SAMPLE). Do uchwytu oznaczonego jako próba wstawiamy kuwetę z roztworem badanej substancji. Próba z wodą jako odnośnikiem pozostaje w komorze oznaczonej jako refer. Zamykamy pokrywę spektrofotometru i wciskamy OK. Aparat automatycznie dokonuje pomiaru wykreślając widmo, które jest widoczne w oknie Graph 1 (ryc. poniżej). Zwrócić uwagę w jakim zakresie długości fal absorbują poszczególne substancje. Porównać barwę substancji z zakresem długości fali świetlnej, przy której obserwuje się największą absorpcję (pochłanianie) światła. Wyznaczyć długości fali (nm), przy której poszczególne związki wykazują najwyższą absorbancję (A). Klikając na ikonę umiejscowioną w pasku nad rysunkiem możemy dopasować odpowiednią skalę dla wykreślonego widma. Po kliknięciu na i wybraniu opcji Peak automatycznie zostanie wyznaczona długość fali przy której związek wykazuje maksymalna absorbancję. Po wybraniu pojawia się zielona linia, którą możemy przesuwać za pomocą znacznika myszki i ustawić w miejscu gdzie związek wykazuje maksymalną absorbancję. Program automatycznie wyświetli długość fali i wartość absorbancji, przy której został ustawimy wskaźnik (ryc. powyżej)
OZNACZANIE ŻELAZA METODĄ SPEKTROFOTOMETRII UV/VIS
 OZNACZANIE ŻELAZA METODĄ SPEKTROFOTOMETRII UV/VIS Zagadnienia teoretyczne. Spektrofotometria jest techniką instrumentalną, w której do celów analitycznych wykorzystuje się przejścia energetyczne zachodzące
OZNACZANIE ŻELAZA METODĄ SPEKTROFOTOMETRII UV/VIS Zagadnienia teoretyczne. Spektrofotometria jest techniką instrumentalną, w której do celów analitycznych wykorzystuje się przejścia energetyczne zachodzące
Spektroskopia molekularna. Ćwiczenie nr 1. Widma absorpcyjne błękitu tymolowego
 Spektroskopia molekularna Ćwiczenie nr 1 Widma absorpcyjne błękitu tymolowego Doświadczenie to ma na celu zaznajomienie uczestników ćwiczeń ze sposobem wykonywania pomiarów metodą spektrofotometryczną
Spektroskopia molekularna Ćwiczenie nr 1 Widma absorpcyjne błękitu tymolowego Doświadczenie to ma na celu zaznajomienie uczestników ćwiczeń ze sposobem wykonywania pomiarów metodą spektrofotometryczną
Jan Drzymała ANALIZA INSTRUMENTALNA SPEKTROSKOPIA W ŚWIETLE WIDZIALNYM I PODCZERWONYM
 Jan Drzymała ANALIZA INSTRUMENTALNA SPEKTROSKOPIA W ŚWIETLE WIDZIALNYM I PODCZERWONYM Światło słoneczne jest mieszaniną fal o różnej długości i różnego natężenia. Tylko część promieniowania elektromagnetycznego
Jan Drzymała ANALIZA INSTRUMENTALNA SPEKTROSKOPIA W ŚWIETLE WIDZIALNYM I PODCZERWONYM Światło słoneczne jest mieszaniną fal o różnej długości i różnego natężenia. Tylko część promieniowania elektromagnetycznego
ELEMENTY ANALIZY INSTRUMENTALNEJ. SPEKTROFOTOMETRII podstawy teoretyczne
 ELEMENTY ANALZY NSTRUMENTALNEJ Ćwiczenie 3 Temat: Spektrofotometria UV/ViS SPEKTROFOTOMETR podstawy teoretyczne SPEKTROFOTOMETRA jest techniką instrumentalną, w której do celów analitycznych wykorzystuje
ELEMENTY ANALZY NSTRUMENTALNEJ Ćwiczenie 3 Temat: Spektrofotometria UV/ViS SPEKTROFOTOMETR podstawy teoretyczne SPEKTROFOTOMETRA jest techniką instrumentalną, w której do celów analitycznych wykorzystuje
IR II. 12. Oznaczanie chloroformu w tetrachloroetylenie metodą spektrofotometrii w podczerwieni
 IR II 12. Oznaczanie chloroformu w tetrachloroetylenie metodą spektrofotometrii w podczerwieni Promieniowanie podczerwone ma naturę elektromagnetyczną i jego absorpcja przez materię podlega tym samym prawom,
IR II 12. Oznaczanie chloroformu w tetrachloroetylenie metodą spektrofotometrii w podczerwieni Promieniowanie podczerwone ma naturę elektromagnetyczną i jego absorpcja przez materię podlega tym samym prawom,
Kolorymetryczne oznaczanie stężenia Fe 3+ metodą rodankową
 Kolorymetryczne oznaczanie stężenia Fe 3+ metodą rodankową (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zapoznanie się z podstawami spektrofotometrii absorpcyjnej w świetle widzialnym (kolorymetrią)
Kolorymetryczne oznaczanie stężenia Fe 3+ metodą rodankową (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zapoznanie się z podstawami spektrofotometrii absorpcyjnej w świetle widzialnym (kolorymetrią)
Opracował dr inż. Tadeusz Janiak
 Opracował dr inż. Tadeusz Janiak 1 Uwagi dla wykonujących ilościowe oznaczanie metodami spektrofotometrycznymi 3. 3.1. Ilościowe oznaczanie w metodach spektrofotometrycznych Ilościowe określenie zawartości
Opracował dr inż. Tadeusz Janiak 1 Uwagi dla wykonujących ilościowe oznaczanie metodami spektrofotometrycznymi 3. 3.1. Ilościowe oznaczanie w metodach spektrofotometrycznych Ilościowe określenie zawartości
SPEKTROFOTOMETRYCZNA ANALIZA
 POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 8 SPEKTROFOTOMETRYCZNA ANALIZA LUDZKIEJ HEMOGLOBINY I. WSTĘP TEORETYCZNY Hemoglobina (Hb) jest białkiem złożonym z grupy prostetycznej
POLITECHNIKA ŁÓDZKA INSTRUKCJA Z LABORATORIUM W ZAKŁADZIE BIOFIZYKI Ćwiczenie 8 SPEKTROFOTOMETRYCZNA ANALIZA LUDZKIEJ HEMOGLOBINY I. WSTĘP TEORETYCZNY Hemoglobina (Hb) jest białkiem złożonym z grupy prostetycznej
Oznaczanie żelaza i miedzi metodą miareczkowania spektrofotometrycznego
 Oznaczanie żelaza i miedzi metodą miareczkowania spektrofotometrycznego Oznaczanie dwóch kationów obok siebie metodą miareczkowania spektrofotometrycznego (bez maskowania) jest możliwe, gdy spełnione są
Oznaczanie żelaza i miedzi metodą miareczkowania spektrofotometrycznego Oznaczanie dwóch kationów obok siebie metodą miareczkowania spektrofotometrycznego (bez maskowania) jest możliwe, gdy spełnione są
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego. Spektrofotometryczne oznaczanie stężenia jonów żelaza(iii) opiekun mgr K. Łudzik
 Katedra Chemii Fizycznej Uniwersytetu Łódzkiego Spektrofotometryczne oznaczanie stężenia jonów żelaza(iii) opiekun mgr K. Łudzik ćwiczenie nr 26 Zakres zagadnień obowiązujących do ćwiczenia 1. Prawo Lamberta
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego Spektrofotometryczne oznaczanie stężenia jonów żelaza(iii) opiekun mgr K. Łudzik ćwiczenie nr 26 Zakres zagadnień obowiązujących do ćwiczenia 1. Prawo Lamberta
ANALIZA SPEKTRALNA I POMIARY SPEKTROFOTOMETRYCZNE. Instrukcja wykonawcza
 ĆWICZENIE 72A ANALIZA SPEKTRALNA I POMIARY SPEKTROFOTOMETRYCZNE 1. Wykaz przyrządów Spektroskop Lampy spektralne Spektrofotometr SPEKOL Filtry optyczne Suwmiarka Instrukcja wykonawcza 2. Cel ćwiczenia
ĆWICZENIE 72A ANALIZA SPEKTRALNA I POMIARY SPEKTROFOTOMETRYCZNE 1. Wykaz przyrządów Spektroskop Lampy spektralne Spektrofotometr SPEKOL Filtry optyczne Suwmiarka Instrukcja wykonawcza 2. Cel ćwiczenia
Katedra Fizyki i Biofizyki instrukcje do ćwiczeń laboratoryjnych dla kierunku Lekarskiego
 Ćw. M8 Zjawisko absorpcji i emisji światła w analityce. Pomiar widm absorpcji i stężenia ryboflawiny w roztworach wodnych za pomocą spektrofotometru. Wyznaczanie stężeń substancji w roztworze metodą fluorescencyjną.
Ćw. M8 Zjawisko absorpcji i emisji światła w analityce. Pomiar widm absorpcji i stężenia ryboflawiny w roztworach wodnych za pomocą spektrofotometru. Wyznaczanie stężeń substancji w roztworze metodą fluorescencyjną.
SPEKTROFOTOMETRIA UV-Vis. - długość fali [nm, m], - częstość drgań [Hz; 1 Hz = 1 cykl/s]
![SPEKTROFOTOMETRIA UV-Vis. - długość fali [nm, m], - częstość drgań [Hz; 1 Hz = 1 cykl/s] SPEKTROFOTOMETRIA UV-Vis. - długość fali [nm, m], - częstość drgań [Hz; 1 Hz = 1 cykl/s]](/thumbs/32/15622407.jpg) SPEKTROFOTOMETRIA UV-Vis Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. Spektrofotometria w zakresie nadfioletu (UV) i promieniowania widzialnego (Vis) jest jedną
SPEKTROFOTOMETRIA UV-Vis Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. Spektrofotometria w zakresie nadfioletu (UV) i promieniowania widzialnego (Vis) jest jedną
Zastosowanie spektroskopii UV/VIS do określania struktury związków organicznych
 Zwiększenie liczby wysoko wykwalifikowanych absolwentów kierunków ścisłych Uniwersytetu Jagiellońskiego POKL.04.01.02-00-097/09-00 Zastosowanie spektroskopii UV/VIS do określania struktury związków organicznych
Zwiększenie liczby wysoko wykwalifikowanych absolwentów kierunków ścisłych Uniwersytetu Jagiellońskiego POKL.04.01.02-00-097/09-00 Zastosowanie spektroskopii UV/VIS do określania struktury związków organicznych
Ćw. 5 Absorpcjometria I
 Ćw. 5 Absorpcjometria I Absorpcja promieniowania elektromagnetycznego z obszaru widzialnego i nadfioletowego przez atomy i cząsteczki powoduje zmianę ich stanu elektronowego. Zjawiska te moŝna badać za
Ćw. 5 Absorpcjometria I Absorpcja promieniowania elektromagnetycznego z obszaru widzialnego i nadfioletowego przez atomy i cząsteczki powoduje zmianę ich stanu elektronowego. Zjawiska te moŝna badać za
E (2) nazywa się absorbancją.
 1/6 Celem ćwiczenia jest poznanie zjawiska absorpcji światła przez roztwory, pomiar widma absorpcji przy pomocy spektrofotometru oraz wyliczenie stężenia badanego roztworu. Promieniowanie elektromagnetyczne,
1/6 Celem ćwiczenia jest poznanie zjawiska absorpcji światła przez roztwory, pomiar widma absorpcji przy pomocy spektrofotometru oraz wyliczenie stężenia badanego roztworu. Promieniowanie elektromagnetyczne,
PRACOWNIA CHEMII. Równowaga chemiczna (Fiz2)
 PRACOWNIA CHEMII Ćwiczenia laboratoryjne dla studentów II roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Równowaga chemiczna (Fiz2)
PRACOWNIA CHEMII Ćwiczenia laboratoryjne dla studentów II roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Równowaga chemiczna (Fiz2)
BADANIE WŁASNOŚCI KOENZYMÓW OKSYDOREDUKTAZ
 KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska BADANIE WŁASNOŚCI KOENZYMÓW OKSYDOREDUKTAZ ĆWICZENIE 2 Nukleotydy pirydynowe (NAD +, NADP + ) pełnią funkcję koenzymów dehydrogenaz przenosząc jony
KATEDRA BIOCHEMII Wydział Biologii i Ochrony Środowiska BADANIE WŁASNOŚCI KOENZYMÓW OKSYDOREDUKTAZ ĆWICZENIE 2 Nukleotydy pirydynowe (NAD +, NADP + ) pełnią funkcję koenzymów dehydrogenaz przenosząc jony
spektroskopia UV Vis (cz. 2)
 spektroskopia UV Vis (cz. 2) spektroskopia UV-Vis dlaczego? wiele związków organicznych posiada chromofory, które absorbują w zakresie UV duża czułość: zastosowanie w badaniach kinetyki reakcji spektroskop
spektroskopia UV Vis (cz. 2) spektroskopia UV-Vis dlaczego? wiele związków organicznych posiada chromofory, które absorbują w zakresie UV duża czułość: zastosowanie w badaniach kinetyki reakcji spektroskop
OZNACZANIE STĘŻENIA BARWNIKÓW W WODZIE METODĄ UV-VIS
 OZNACZANE STĘŻENA BARWNKÓW W WODZE METODĄ UV-VS. SPEKTROFOTOMETRA UV-Vis Spektrofotometria w zakresie nadfioletu (ang. ultra-violet UV) i promieniowania widzialnego (ang. visible- Vis), czyli spektrofotometria
OZNACZANE STĘŻENA BARWNKÓW W WODZE METODĄ UV-VS. SPEKTROFOTOMETRA UV-Vis Spektrofotometria w zakresie nadfioletu (ang. ultra-violet UV) i promieniowania widzialnego (ang. visible- Vis), czyli spektrofotometria
3. Badanie kinetyki enzymów
 3. Badanie kinetyki enzymów Przy stałym stężeniu enzymu, a przy zmieniającym się początkowym stężeniu substratu, zmiany szybkości reakcji katalizy, wyrażonej jako liczba moli substratu przetworzonego w
3. Badanie kinetyki enzymów Przy stałym stężeniu enzymu, a przy zmieniającym się początkowym stężeniu substratu, zmiany szybkości reakcji katalizy, wyrażonej jako liczba moli substratu przetworzonego w
Ćwiczenie 1. Zagadnienia: spektroskopia absorpcyjna, prawa absorpcji, budowa i działanie. Wstęp. Część teoretyczna.
 Ćwiczenie 1 Metodyka poprawnych i dokładnych pomiarów absorbancji, wyznaczenie małych wartości absorbancji. Czynniki wpływające na mierzone widma absorpcji i wartości absorbancji dla wybranych długości
Ćwiczenie 1 Metodyka poprawnych i dokładnych pomiarów absorbancji, wyznaczenie małych wartości absorbancji. Czynniki wpływające na mierzone widma absorpcji i wartości absorbancji dla wybranych długości
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego. Wyznaczanie stałej szybkości i rzędu reakcji metodą graficzną. opiekun mgr K.
 Katedra Chemii Fizycznej Uniwersytetu Łódzkiego Wyznaczanie stałej szybkości i rzędu reakcji metodą graficzną opiekun mgr K. Łudzik ćwiczenie nr 27 Zakres zagadnień obowiązujących do ćwiczenia 1. Zastosowanie
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego Wyznaczanie stałej szybkości i rzędu reakcji metodą graficzną opiekun mgr K. Łudzik ćwiczenie nr 27 Zakres zagadnień obowiązujących do ćwiczenia 1. Zastosowanie
METODYKA POMIARÓW WIDM ABSORPCJI (WA) NA CARY-300 (Varian) i V-550 (JASCO)
 METODYKA POMIARÓW WIDM ABSORPCJI (WA) NA CARY-300 (Varian) i V-550 (JASCO) Czas od włączenia spektrofotometru Cary-300 do momentu uzyskania stabilnej pracy: ok 30 minut., w przypadku V-550 ok. 3h. WA widmo
METODYKA POMIARÓW WIDM ABSORPCJI (WA) NA CARY-300 (Varian) i V-550 (JASCO) Czas od włączenia spektrofotometru Cary-300 do momentu uzyskania stabilnej pracy: ok 30 minut., w przypadku V-550 ok. 3h. WA widmo
Techniki analityczne. Podział technik analitycznych. Metody spektroskopowe. Spektroskopia elektronowa
 Podział technik analitycznych Techniki analityczne Techniki elektrochemiczne: pehametria, selektywne elektrody membranowe, polarografia i metody pokrewne (woltamperometria, chronowoltamperometria inwersyjna
Podział technik analitycznych Techniki analityczne Techniki elektrochemiczne: pehametria, selektywne elektrody membranowe, polarografia i metody pokrewne (woltamperometria, chronowoltamperometria inwersyjna
WYZNACZANIE STAŁEJ DYSOCJACJI p-nitrofenolu METODĄ SPEKTROFOTOMETRII ABSORPCYJNEJ
 Ćwiczenie nr 13 WYZNCZNIE STŁEJ DYSOCJCJI p-nitrofenolu METODĄ SPEKTROFOTOMETRII BSORPCYJNEJ I. Cel ćwiczenia Celem ćwiczenia jest wyznaczenie metodą spektrofotometryczną stałej dysocjacji słabego kwasu,
Ćwiczenie nr 13 WYZNCZNIE STŁEJ DYSOCJCJI p-nitrofenolu METODĄ SPEKTROFOTOMETRII BSORPCYJNEJ I. Cel ćwiczenia Celem ćwiczenia jest wyznaczenie metodą spektrofotometryczną stałej dysocjacji słabego kwasu,
Spektrofotometryczne wyznaczanie stałej dysocjacji czerwieni fenolowej
 Spektrofotometryczne wyznaczanie stałej dysocjacji czerwieni fenolowej Metoda: Spektrofotometria UV-Vis Cel ćwiczenia: Celem ćwiczenia jest zapoznanie studenta z fotometryczną metodą badania stanów równowagi
Spektrofotometryczne wyznaczanie stałej dysocjacji czerwieni fenolowej Metoda: Spektrofotometria UV-Vis Cel ćwiczenia: Celem ćwiczenia jest zapoznanie studenta z fotometryczną metodą badania stanów równowagi
1. PRZYGOTOWANIE ROZTWORÓW KOMPLEKSUJĄCYCH
 1. PRZYGOTOWANIE ROZTWORÓW KOMPLEKSUJĄCYCH 1.1. przygotowanie 20 g 20% roztworu KSCN w wodzie destylowanej 1.1.1. odważenie 4 g stałego KSCN w stożkowej kolbie ze szlifem 1.1.2. odważenie 16 g wody destylowanej
1. PRZYGOTOWANIE ROZTWORÓW KOMPLEKSUJĄCYCH 1.1. przygotowanie 20 g 20% roztworu KSCN w wodzie destylowanej 1.1.1. odważenie 4 g stałego KSCN w stożkowej kolbie ze szlifem 1.1.2. odważenie 16 g wody destylowanej
Spektroskopia UV-VIS zagadnienia
 Spektroskopia absorbcyjna to dziedzina, która obejmuje metody badania materii przy użyciu promieniowania elektromagnetycznego, które może z tą materią oddziaływać. Spektroskopia UV-VS zagadnienia promieniowanie
Spektroskopia absorbcyjna to dziedzina, która obejmuje metody badania materii przy użyciu promieniowania elektromagnetycznego, które może z tą materią oddziaływać. Spektroskopia UV-VS zagadnienia promieniowanie
SZYBKOŚĆ REAKCJI JONOWYCH W ZALEŻNOŚCI OD SIŁY JONOWEJ ROZTWORU
 POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA FIZYKOCHEMII I TECHNOLOGII POLIMERÓW SZYBKOŚĆ REAKCI ONOWYCH W ZALEŻNOŚCI OD SIŁY ONOWE ROZTWORU Opiekun: Krzysztof Kozieł Miejsce ćwiczenia: Czerwona Chemia,
POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA FIZYKOCHEMII I TECHNOLOGII POLIMERÓW SZYBKOŚĆ REAKCI ONOWYCH W ZALEŻNOŚCI OD SIŁY ONOWE ROZTWORU Opiekun: Krzysztof Kozieł Miejsce ćwiczenia: Czerwona Chemia,
Spektroskopowe metody identyfikacji związków organicznych
 Spektroskopowe metody identyfikacji związków organicznych Wstęp Spektroskopia jest metodą analityczną zajmującą się analizą widm powstających w wyniku oddziaływania promieniowania elektromagnetycznego
Spektroskopowe metody identyfikacji związków organicznych Wstęp Spektroskopia jest metodą analityczną zajmującą się analizą widm powstających w wyniku oddziaływania promieniowania elektromagnetycznego
Metody spektroskopowe:
 Katedra Chemii Analitycznej Metody spektroskopowe: Absorpcyjna Spektrometria Atomowa Fotometria Płomieniowa Gdańsk, 2010 Opracowała: mgr inż. Monika Kosikowska 1 1. Wprowadzenie Spektroskopia to dziedzina
Katedra Chemii Analitycznej Metody spektroskopowe: Absorpcyjna Spektrometria Atomowa Fotometria Płomieniowa Gdańsk, 2010 Opracowała: mgr inż. Monika Kosikowska 1 1. Wprowadzenie Spektroskopia to dziedzina
ĆWICZENIE NR 3 POMIARY SPEKTROFOTOMETRYCZNE
 ĆWICZENIE NR 3 POMIARY SPEKTROFOTOMETRYCZNE Cel ćwiczenia Poznanie podstawowej metody określania biochemicznych parametrów płynów ustrojowych oraz wymagań technicznych stawianych urządzeniu pomiarowemu.
ĆWICZENIE NR 3 POMIARY SPEKTROFOTOMETRYCZNE Cel ćwiczenia Poznanie podstawowej metody określania biochemicznych parametrów płynów ustrojowych oraz wymagań technicznych stawianych urządzeniu pomiarowemu.
Własności optyczne materii. Jak zachowuje się światło w zetknięciu z materią?
 Własności optyczne materii Jak zachowuje się światło w zetknięciu z materią? Właściwości optyczne materiału wynikają ze zjawisk: Absorpcji Załamania Odbicia Rozpraszania Własności elektrycznych Refrakcja
Własności optyczne materii Jak zachowuje się światło w zetknięciu z materią? Właściwości optyczne materiału wynikają ze zjawisk: Absorpcji Załamania Odbicia Rozpraszania Własności elektrycznych Refrakcja
Instrukcja do ćwiczeń laboratoryjnych
 UNIWERSYTET GDAŃSKI WYDZIAŁ CHEMII Pracownia studencka Katedra Analizy Środowiska Instrukcja do ćwiczeń laboratoryjnych Ćwiczenie nr 2 ZASTOSOWANIE SPEKTROFOTOMETRII W NADFIOLECIE I ŚWIETLE WIDZIALNYM
UNIWERSYTET GDAŃSKI WYDZIAŁ CHEMII Pracownia studencka Katedra Analizy Środowiska Instrukcja do ćwiczeń laboratoryjnych Ćwiczenie nr 2 ZASTOSOWANIE SPEKTROFOTOMETRII W NADFIOLECIE I ŚWIETLE WIDZIALNYM
 Kolorymetria - dział spektrofotometrii absorpcyjnej (inaczej absorpcjometrii) Oznaczanie stężeń substancji barwnych na podstawie absorbcji ich roztworów w zakresie światła widzialnego Spektrofotometria
Kolorymetria - dział spektrofotometrii absorpcyjnej (inaczej absorpcjometrii) Oznaczanie stężeń substancji barwnych na podstawie absorbcji ich roztworów w zakresie światła widzialnego Spektrofotometria
Ćwiczenie 30. Zagadnienia: spektroskopia absorpcyjna w zakresie UV-VIS, prawa absorpcji, budowa i. Wstęp
 Ćwiczenie 30 Metodyka poprawnych i dokładnych pomiarów absorbancji w zakresie UV- VS, wyznaczenie małych wartości absorbancji. Czynniki wpływające na mierzone widma absorpcji i wartości absorbancji dla
Ćwiczenie 30 Metodyka poprawnych i dokładnych pomiarów absorbancji w zakresie UV- VS, wyznaczenie małych wartości absorbancji. Czynniki wpływające na mierzone widma absorpcji i wartości absorbancji dla
PRODUKTY CHEMICZNE Ćwiczenie nr 3 Oznaczanie zawartości oksygenatów w paliwach metodą FTIR
 PRODUKTY CHEMICZNE Ćwiczenie nr 3 Oznaczanie zawartości oksygenatów w paliwach metodą FTIR WSTĘP Metody spektroskopowe Spektroskopia bada i teoretycznie wyjaśnia oddziaływania pomiędzy materią będącą zbiorowiskiem
PRODUKTY CHEMICZNE Ćwiczenie nr 3 Oznaczanie zawartości oksygenatów w paliwach metodą FTIR WSTĘP Metody spektroskopowe Spektroskopia bada i teoretycznie wyjaśnia oddziaływania pomiędzy materią będącą zbiorowiskiem
Ćwiczenie 31. Zagadnienia: spektroskopia absorpcyjna, prawa absorpcji, budowa i działanie. Wstęp
 Ćwiczenie 31 Metodyka poprawnych i dokładnych pomiarów widm absorbancji w zakresie UV-VIS. Wpływ monochromatyczności promieniowania i innych parametrów pomiarowych na kształt widm absorpcji i wartości
Ćwiczenie 31 Metodyka poprawnych i dokładnych pomiarów widm absorbancji w zakresie UV-VIS. Wpływ monochromatyczności promieniowania i innych parametrów pomiarowych na kształt widm absorpcji i wartości
KREW: 1. Oznaczenie stężenia Hb. Metoda cyjanmethemoglobinowa: Zasada metody:
 KREW: 1. Oznaczenie stężenia Hb Metoda cyjanmethemoglobinowa: Hemoglobina i niektóre jej pochodne są utleniane przez K3 [Fe(CN)6]do methemoglobiny, a następnie przekształcane pod wpływem KCN w trwały związek
KREW: 1. Oznaczenie stężenia Hb Metoda cyjanmethemoglobinowa: Hemoglobina i niektóre jej pochodne są utleniane przez K3 [Fe(CN)6]do methemoglobiny, a następnie przekształcane pod wpływem KCN w trwały związek
Laboratorium Podstaw Biofizyki
 CEL ĆWICZENIA Celem ćwiczenia jest zbadanie procesu adsorpcji barwnika z roztworu oraz wyznaczenie równania izotermy Freundlicha. ZAKRES WYMAGANYCH WIADOMOŚCI I UMIEJĘTNOŚCI: widmo absorpcyjne, prawo Lamberta-Beera,
CEL ĆWICZENIA Celem ćwiczenia jest zbadanie procesu adsorpcji barwnika z roztworu oraz wyznaczenie równania izotermy Freundlicha. ZAKRES WYMAGANYCH WIADOMOŚCI I UMIEJĘTNOŚCI: widmo absorpcyjne, prawo Lamberta-Beera,
LABORATORIUM Z KATALIZY HOMOGENICZNEJ I HETEROGENICZNEJ WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI UTLENIANIA POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY
 POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA FIZYKOCHEMII I TECHNOLOGII POLIMERÓW WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI UTLENIANIA JONÓW TIOSIARCZANOWYCH Miejsce ćwiczenia: Zakład Chemii Fizycznej, sala
POLITECHNIKA ŚLĄSKA WYDZIAŁ CHEMICZNY KATEDRA FIZYKOCHEMII I TECHNOLOGII POLIMERÓW WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI UTLENIANIA JONÓW TIOSIARCZANOWYCH Miejsce ćwiczenia: Zakład Chemii Fizycznej, sala
Synteza nanocząstek Ag i pomiar widma absorpcyjnego
 Synteza nanocząstek Ag i pomiar widma absorpcyjnego Nanotechnologia jest nową, interdyscyplinarną dziedziną nauki łączącą osiągnięcia różnych nauk (m. in. chemii, biologii, fizyki, mechaniki, inżynierii)
Synteza nanocząstek Ag i pomiar widma absorpcyjnego Nanotechnologia jest nową, interdyscyplinarną dziedziną nauki łączącą osiągnięcia różnych nauk (m. in. chemii, biologii, fizyki, mechaniki, inżynierii)
ĆWICZENIE 2. Usuwanie chromu (VI) z zastosowaniem wymieniaczy jonowych
 ĆWICZENIE 2 Usuwanie chromu (VI) z zastosowaniem wymieniaczy jonowych Część doświadczalna 1. Metody jonowymienne Do usuwania chromu (VI) można stosować między innymi wymieniacze jonowe. W wyniku przepuszczania
ĆWICZENIE 2 Usuwanie chromu (VI) z zastosowaniem wymieniaczy jonowych Część doświadczalna 1. Metody jonowymienne Do usuwania chromu (VI) można stosować między innymi wymieniacze jonowe. W wyniku przepuszczania
spektropolarymetrami;
 Ćwiczenie 12 Badanie własności uzyskanych białek: pomiary dichroizmu kołowego Niejednakowa absorpcja prawego i lewego, kołowo spolaryzowanego promieniowania nazywa się dichroizmem kołowym (ang. circular
Ćwiczenie 12 Badanie własności uzyskanych białek: pomiary dichroizmu kołowego Niejednakowa absorpcja prawego i lewego, kołowo spolaryzowanego promieniowania nazywa się dichroizmem kołowym (ang. circular
Wyznaczanie zależności współczynnika załamania światła od długości fali światła
 Ćwiczenie O3 Wyznaczanie zależności współczynnika załamania światła od długości fali światła O3.1. Cel ćwiczenia Celem ćwiczenia jest zbadanie zależności współczynnika załamania światła od długości fali
Ćwiczenie O3 Wyznaczanie zależności współczynnika załamania światła od długości fali światła O3.1. Cel ćwiczenia Celem ćwiczenia jest zbadanie zależności współczynnika załamania światła od długości fali
METODYKA POMIARÓW WIDM FLUORESCENCJI (WF) NA MPF-3 (PERKIN-HITACHI)
 METODYKA POMIARÓW WIDM FLUORESCENCJI (WF) NA MPF-3 (PERKIN-HITACHI) (Uzupełnieniem do niniejszej metodyki jest instrukcja obsługi spektrofluorymetru MPF-3, która znajduje się do wglądu u prof. dr hab.
METODYKA POMIARÓW WIDM FLUORESCENCJI (WF) NA MPF-3 (PERKIN-HITACHI) (Uzupełnieniem do niniejszej metodyki jest instrukcja obsługi spektrofluorymetru MPF-3, która znajduje się do wglądu u prof. dr hab.
SKUTECZNOŚĆ IZOLACJI JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI? JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI?
 SKUTECZNOŚĆ IZOLACJI Wydajność izolacji- ilość otrzymanego kwasu nukleinowego Efektywność izolacji- jakość otrzymanego kwasu nukleinowego w stosunku do ilości Powtarzalność izolacji- zoptymalizowanie procedury
SKUTECZNOŚĆ IZOLACJI Wydajność izolacji- ilość otrzymanego kwasu nukleinowego Efektywność izolacji- jakość otrzymanego kwasu nukleinowego w stosunku do ilości Powtarzalność izolacji- zoptymalizowanie procedury
Ćwiczenie 8 Wyznaczanie stałej szybkości reakcji utleniania jonów tiosiarczanowych
 CHEMI FIZYCZN Ćwiczenie 8 Wyznaczanie stałej szybkości reakcji utleniania jonów tiosiarczanowych W ćwiczeniu przeprowadzana jest reakcja utleniania jonów tiosiarczanowych za pomocą jonów żelaza(iii). Przebieg
CHEMI FIZYCZN Ćwiczenie 8 Wyznaczanie stałej szybkości reakcji utleniania jonów tiosiarczanowych W ćwiczeniu przeprowadzana jest reakcja utleniania jonów tiosiarczanowych za pomocą jonów żelaza(iii). Przebieg
Podczerwień bliska: cm -1 (0,7-2,5 µm) Podczerwień właściwa: cm -1 (2,5-14,3 µm) Podczerwień daleka: cm -1 (14,3-50 µm)
 SPEKTROSKOPIA W PODCZERWIENI Podczerwień bliska: 14300-4000 cm -1 (0,7-2,5 µm) Podczerwień właściwa: 4000-700 cm -1 (2,5-14,3 µm) Podczerwień daleka: 700-200 cm -1 (14,3-50 µm) WIELKOŚCI CHARAKTERYZUJĄCE
SPEKTROSKOPIA W PODCZERWIENI Podczerwień bliska: 14300-4000 cm -1 (0,7-2,5 µm) Podczerwień właściwa: 4000-700 cm -1 (2,5-14,3 µm) Podczerwień daleka: 700-200 cm -1 (14,3-50 µm) WIELKOŚCI CHARAKTERYZUJĄCE
OBLICZENIA BIOCHEMICZNE
 OBLICZENIA BIOCHEMICZNE Praca w laboratorium biochemicznym wymaga umiejętności obliczania stężeń i rozcieńczeń odczynników stosowanych do doświadczeń. W podstawowym kursie biochemii nie ma czasu na przygotowywanie
OBLICZENIA BIOCHEMICZNE Praca w laboratorium biochemicznym wymaga umiejętności obliczania stężeń i rozcieńczeń odczynników stosowanych do doświadczeń. W podstawowym kursie biochemii nie ma czasu na przygotowywanie
SPEKTROFOTOMETRYCZNA ANALIZA ZAWARTOŚCI SUBSTANCJI W PRÓBCE
 SPEKTROFOTOMETRYCZNA ANALIZA ZAWARTOŚCI SUBSTANCJI W PRÓBCE Zakres materiału: roztwory - stężenia, rozcieńczanie; podstawy i podział spektroskopii; prawa absorpcji: współczynnik absorpcji, addytywność
SPEKTROFOTOMETRYCZNA ANALIZA ZAWARTOŚCI SUBSTANCJI W PRÓBCE Zakres materiału: roztwory - stężenia, rozcieńczanie; podstawy i podział spektroskopii; prawa absorpcji: współczynnik absorpcji, addytywność
Szkoła Letnia STC Łódź 2013 Oznaczanie zabarwienia cukru białego, cukrów surowych i specjalnych w roztworze wodnym i metodą MOPS przy ph 7,0
 Oznaczanie zabarwienia cukru białego, cukrów surowych i specjalnych w roztworze wodnym i metodą MOPS przy ph 7,0 1 Dr inż. Krystyna Lisik Inż. Maciej Sidziako Wstęp Zabarwienie jest jednym z najważniejszych
Oznaczanie zabarwienia cukru białego, cukrów surowych i specjalnych w roztworze wodnym i metodą MOPS przy ph 7,0 1 Dr inż. Krystyna Lisik Inż. Maciej Sidziako Wstęp Zabarwienie jest jednym z najważniejszych
Spektrometria w bliskiej podczerwieni - zastosowanie w cukrownictwie. Radosław Gruska Politechnika Łódzka Wydział Biotechnologii i Nauk o Żywności
 Spektrometria w bliskiej podczerwieni - zastosowanie w cukrownictwie Radosław Gruska Politechnika Łódzka Wydział Biotechnologii i Nauk o Żywności Spektroskopia, a spektrometria Spektroskopia nauka o powstawaniu
Spektrometria w bliskiej podczerwieni - zastosowanie w cukrownictwie Radosław Gruska Politechnika Łódzka Wydział Biotechnologii i Nauk o Żywności Spektroskopia, a spektrometria Spektroskopia nauka o powstawaniu
Spis treści. Wstęp. Twardość wody
 Spis treści 1 Wstęp 1.1 Twardość wody 1.2 Oznaczanie twardości wody 1.3 Oznaczanie utlenialności 1.4 Oznaczanie jonów metali 2 Część doświadczalna 2.1 Cel ćwiczenia 2.2 Zagadnienia do przygotowania 2.3
Spis treści 1 Wstęp 1.1 Twardość wody 1.2 Oznaczanie twardości wody 1.3 Oznaczanie utlenialności 1.4 Oznaczanie jonów metali 2 Część doświadczalna 2.1 Cel ćwiczenia 2.2 Zagadnienia do przygotowania 2.3
Fizykochemiczne metody w kryminalistyce. Wykład 7
 Fizykochemiczne metody w kryminalistyce Wykład 7 Stosowane metody badawcze: 1. Klasyczna metoda analityczna jakościowa i ilościowa 2. badania rentgenostrukturalne 3. Badania spektroskopowe 4. Metody chromatograficzne
Fizykochemiczne metody w kryminalistyce Wykład 7 Stosowane metody badawcze: 1. Klasyczna metoda analityczna jakościowa i ilościowa 2. badania rentgenostrukturalne 3. Badania spektroskopowe 4. Metody chromatograficzne
JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI? JAK ZMIERZYĆ ILOŚĆ KWASÓW NUKLEINOWYCH PO IZOLACJI?
 Podstawowe miary masy i objętości stosowane przy oznaczaniu ilości kwasów nukleinowych : 1g (1) 1l (1) 1mg (1g x 10-3 ) 1ml (1l x 10-3 ) 1μg (1g x 10-6 ) 1μl (1l x 10-6 ) 1ng (1g x 10-9 ) 1pg (1g x 10-12
Podstawowe miary masy i objętości stosowane przy oznaczaniu ilości kwasów nukleinowych : 1g (1) 1l (1) 1mg (1g x 10-3 ) 1ml (1l x 10-3 ) 1μg (1g x 10-6 ) 1μl (1l x 10-6 ) 1ng (1g x 10-9 ) 1pg (1g x 10-12
Widmo promieniowania
 Widmo promieniowania Spektroskopia Każde ciało wysyła promieniowanie. Promieniowanie to jest składa się z wiązek o różnych długościach fal. Jeśli wiązka światła pada na pryzmat, ulega ono rozszczepieniu,
Widmo promieniowania Spektroskopia Każde ciało wysyła promieniowanie. Promieniowanie to jest składa się z wiązek o różnych długościach fal. Jeśli wiązka światła pada na pryzmat, ulega ono rozszczepieniu,
PODSTAWY LABORATORIUM PRZEMYSŁOWEGO. ĆWICZENIE 3a
 PODSTAWY LABORATORIUM PRZEMYSŁOWEGO ĆWICZENIE 3a Analiza pierwiastkowa podstawowego składu próbek z wykorzystaniem techniki ASA na przykładzie fosforanów paszowych 1 I. CEL ĆWICZENIA Zapoznanie studentów
PODSTAWY LABORATORIUM PRZEMYSŁOWEGO ĆWICZENIE 3a Analiza pierwiastkowa podstawowego składu próbek z wykorzystaniem techniki ASA na przykładzie fosforanów paszowych 1 I. CEL ĆWICZENIA Zapoznanie studentów
Analiza spektralna i pomiary spektrofotometryczne
 Analiza spektralna i pomiary spektrofotometryczne Zagadnienia: 1. Absorbcja światła. 2. Współrzędne trójchromatyczne barwy, Prawa Gassmana. 3. Trójkąt barw. Trójkąt nasyceń. 4. Rozpraszanie światła. 5.
Analiza spektralna i pomiary spektrofotometryczne Zagadnienia: 1. Absorbcja światła. 2. Współrzędne trójchromatyczne barwy, Prawa Gassmana. 3. Trójkąt barw. Trójkąt nasyceń. 4. Rozpraszanie światła. 5.
Efekt fotoelektryczny
 Ćwiczenie 82 Efekt fotoelektryczny Cel ćwiczenia Celem ćwiczenia jest obserwacja efektu fotoelektrycznego: wybijania elektronów z metalu przez światło o różnej częstości (barwie). Pomiar energii kinetycznej
Ćwiczenie 82 Efekt fotoelektryczny Cel ćwiczenia Celem ćwiczenia jest obserwacja efektu fotoelektrycznego: wybijania elektronów z metalu przez światło o różnej częstości (barwie). Pomiar energii kinetycznej
PRACOWNIA CHEMII. Wygaszanie fluorescencji (Fiz4)
 PRACOWNIA CHEMII Ćwiczenia laboratoryjne dla studentów II roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Wygaszanie fluorescencji
PRACOWNIA CHEMII Ćwiczenia laboratoryjne dla studentów II roku kierunku Zastosowania fizyki w biologii i medycynie Biofizyka molekularna Projektowanie molekularne i bioinformatyka Wygaszanie fluorescencji
ĆWICZENIE Nr 4 LABORATORIUM FIZYKI KRYSZTAŁÓW STAŁYCH. Badanie krawędzi absorpcji podstawowej w kryształach półprzewodników POLITECHNIKA ŁÓDZKA
 POLITECHNIKA ŁÓDZKA INSTYTUT FIZYKI LABORATORIUM FIZYKI KRYSZTAŁÓW STAŁYCH ĆWICZENIE Nr 4 Badanie krawędzi absorpcji podstawowej w kryształach półprzewodników I. Cześć doświadczalna. 1. Uruchomić Spekol
POLITECHNIKA ŁÓDZKA INSTYTUT FIZYKI LABORATORIUM FIZYKI KRYSZTAŁÓW STAŁYCH ĆWICZENIE Nr 4 Badanie krawędzi absorpcji podstawowej w kryształach półprzewodników I. Cześć doświadczalna. 1. Uruchomić Spekol
Ćwiczenie O 13 -O 16 BADANIE ABSORPCJI ŚWIATŁA W MATERII Instrukcja dla studenta
 Ćwiczenie O 13 -O 16 BADANE ABSORPCJ ŚWATŁA W MATER nstrukcja dla studenta. WSTĘP Światło jest falą elektromagnetyczną jak i strumieniem fotonów, których energia jest w bezpośredni sposób związana z częstością
Ćwiczenie O 13 -O 16 BADANE ABSORPCJ ŚWATŁA W MATER nstrukcja dla studenta. WSTĘP Światło jest falą elektromagnetyczną jak i strumieniem fotonów, których energia jest w bezpośredni sposób związana z częstością
Stanowisko do badania zjawiska tłumienia światła w ośrodkach materialnych
 Stanowisko do badania zjawiska tłumienia światła w ośrodkach materialnych Na rys. 3.1 przedstawiono widok wykorzystywanego w ćwiczeniu stanowiska pomiarowego do badania zjawiska tłumienia światła w ośrodkach
Stanowisko do badania zjawiska tłumienia światła w ośrodkach materialnych Na rys. 3.1 przedstawiono widok wykorzystywanego w ćwiczeniu stanowiska pomiarowego do badania zjawiska tłumienia światła w ośrodkach
Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana Dobór metody analitycznej
 Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana Dobór metody analitycznej Oznaczanie żelaza metodą spektrofotometryczną Wstęp Żelazo jest pospolitym
Pracownia analizy ilościowej dla studentów II roku Chemii specjalność Chemia podstawowa i stosowana Dobór metody analitycznej Oznaczanie żelaza metodą spektrofotometryczną Wstęp Żelazo jest pospolitym
Spektroskopia molekularna. Spektroskopia w podczerwieni
 Spektroskopia molekularna Ćwiczenie nr 4 Spektroskopia w podczerwieni Spektroskopia w podczerwieni (IR) jest spektroskopią absorpcyjną, która polega na pomiarach promieniowania elektromagnetycznego pochłanianego
Spektroskopia molekularna Ćwiczenie nr 4 Spektroskopia w podczerwieni Spektroskopia w podczerwieni (IR) jest spektroskopią absorpcyjną, która polega na pomiarach promieniowania elektromagnetycznego pochłanianego
Załącznik nr 1. Wytyczne do konstrukcji fotochromowych dozymetrów promieniowania nadfioletowego
 Załącznik nr 1 Wytyczne do konstrukcji fotochromowych dozymetrów promieniowania nadfioletowego 1. Zasada działania dozymetrów fotochromowych Opracowana koncepcja wytwarzania dozymetrów promieniowania UV,
Załącznik nr 1 Wytyczne do konstrukcji fotochromowych dozymetrów promieniowania nadfioletowego 1. Zasada działania dozymetrów fotochromowych Opracowana koncepcja wytwarzania dozymetrów promieniowania UV,
ANALIZA INSTRUMENTALNA
 ANALIZA INSTRUMENTALNA TECHNOLOGIA CHEMICZNA STUDIA NIESTACJONARNE Sala 522 ul. Piotrowo 3 Studenci podzieleni są na cztery zespoły laboratoryjne. Zjazd 5 przeznaczony jest na ewentualne poprawy! Możliwe
ANALIZA INSTRUMENTALNA TECHNOLOGIA CHEMICZNA STUDIA NIESTACJONARNE Sala 522 ul. Piotrowo 3 Studenci podzieleni są na cztery zespoły laboratoryjne. Zjazd 5 przeznaczony jest na ewentualne poprawy! Możliwe
Spektroskop, rurki Plückera, cewka Ruhmkorffa, aparat fotogtaficzny, źródło prądu
 Imię i nazwisko ucznia Nazwa i adres szkoły Imię i nazwisko nauczyciela Tytuł eksperymentu Dział fizyki Potrzebne materiały do doświadczeń Kamil Jańczyk i Mateusz Kowalkowski I Liceum Ogólnokształcące
Imię i nazwisko ucznia Nazwa i adres szkoły Imię i nazwisko nauczyciela Tytuł eksperymentu Dział fizyki Potrzebne materiały do doświadczeń Kamil Jańczyk i Mateusz Kowalkowski I Liceum Ogólnokształcące
IR I 11. IDENTYFIKACJA GRUP FUNKCYJNYCH W WIDMACH IR
 IR I 11. IDENTYFIKACJA GRUP FUNKCYJNYCH W WIDMACH IR Celem ćwiczenia jest zapoznanie się z techniką wykonywania widm związków w postaci pastylek wykonanych z bromku potasu oraz interpretacja otrzymanych
IR I 11. IDENTYFIKACJA GRUP FUNKCYJNYCH W WIDMACH IR Celem ćwiczenia jest zapoznanie się z techniką wykonywania widm związków w postaci pastylek wykonanych z bromku potasu oraz interpretacja otrzymanych
Instrukcja do ćwiczeń laboratoryjnych
 UNIWERSYTET GDAŃSKI WYDZIAŁ CHEMII Pracownia studencka Katedra Analizy Środowiska Instrukcja do ćwiczeń laboratoryjnych Ćwiczenie nr 3 OZNACZANIE CHLORKÓW METODĄ SPEKTROFOTOMETRYCZNĄ Z TIOCYJANIANEM RTĘCI(II)
UNIWERSYTET GDAŃSKI WYDZIAŁ CHEMII Pracownia studencka Katedra Analizy Środowiska Instrukcja do ćwiczeń laboratoryjnych Ćwiczenie nr 3 OZNACZANIE CHLORKÓW METODĄ SPEKTROFOTOMETRYCZNĄ Z TIOCYJANIANEM RTĘCI(II)
ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1)
 ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1) z dnia 6 listopada 2002 r. w sprawie metodyk referencyjnych badania stopnia biodegradacji substancji powierzchniowoczynnych zawartych w produktach, których stosowanie
ROZPORZĄDZENIE MINISTRA ŚRODOWISKA 1) z dnia 6 listopada 2002 r. w sprawie metodyk referencyjnych badania stopnia biodegradacji substancji powierzchniowoczynnych zawartych w produktach, których stosowanie
Monochromatyzacja promieniowania molibdenowej lampy rentgenowskiej
 Uniwersytet Śląski Instytut Chemii Zakładu Krystalografii ul. Bankowa 14, pok. 133, 40 006 Katowice tel. (032)359 1503, e-mail: izajen@wp.pl, opracowanie: dr Izabela Jendrzejewska Laboratorium z Krystalografii
Uniwersytet Śląski Instytut Chemii Zakładu Krystalografii ul. Bankowa 14, pok. 133, 40 006 Katowice tel. (032)359 1503, e-mail: izajen@wp.pl, opracowanie: dr Izabela Jendrzejewska Laboratorium z Krystalografii
Adsorpcja błękitu metylenowego na węglu aktywnym w obecności acetonu
 Adsorpcja błękitu metylenowego na węglu aktywnym w obecności acetonu Cel ćwiczenia Celem ćwiczenia jest zbadanie procesu adsorpcji barwnika z roztworu, wyznaczenie równania izotermy Freundlicha oraz wpływu
Adsorpcja błękitu metylenowego na węglu aktywnym w obecności acetonu Cel ćwiczenia Celem ćwiczenia jest zbadanie procesu adsorpcji barwnika z roztworu, wyznaczenie równania izotermy Freundlicha oraz wpływu
Robert Zakrzewski Wydział Chemii UŁ
 Robert Zakrzewski Wydział Chemii UŁ http://pl.wikipedia.org/wiki/%c5%bbelazo Informacje ogólne Informacje ogólne Nazwa Symbol śelazo (łac. Ferrum) Fe Liczba atomowa 26 Grupa 8 Okres 4 Blok d Masa atomowa
Robert Zakrzewski Wydział Chemii UŁ http://pl.wikipedia.org/wiki/%c5%bbelazo Informacje ogólne Informacje ogólne Nazwa Symbol śelazo (łac. Ferrum) Fe Liczba atomowa 26 Grupa 8 Okres 4 Blok d Masa atomowa
Ćwiczenie 2 Przejawy wiązań wodorowych w spektroskopii IR i NMR
 Ćwiczenie 2 Przejawy wiązań wodorowych w spektroskopii IR i NMR Szczególnym i bardzo charakterystycznym rodzajem oddziaływań międzycząsteczkowych jest wiązanie wodorowe. Powstaje ono między molekułami,
Ćwiczenie 2 Przejawy wiązań wodorowych w spektroskopii IR i NMR Szczególnym i bardzo charakterystycznym rodzajem oddziaływań międzycząsteczkowych jest wiązanie wodorowe. Powstaje ono między molekułami,
Sporządzanie roztworów buforowych i badanie ich właściwości
 Sporządzanie roztworów buforowych i badanie ich właściwości (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zbadanie właściwości roztworów buforowych. Przygotujemy dwa roztwory buforowe: octanowy
Sporządzanie roztworów buforowych i badanie ich właściwości (opracowanie: Barbara Krajewska) Celem ćwiczenia jest zbadanie właściwości roztworów buforowych. Przygotujemy dwa roztwory buforowe: octanowy
Jod. Numer CAS:
 Podstawy i Metody Oceny Środowiska Pracy 2009, nr 1(59), s. 153 157 dr EWA GAWĘDA Centralny Instytut Ochrony Pracy Państwowy Instytut Badawczy 00-701 Warszawa ul. Czerniakowska 16 Jod metoda oznaczania
Podstawy i Metody Oceny Środowiska Pracy 2009, nr 1(59), s. 153 157 dr EWA GAWĘDA Centralny Instytut Ochrony Pracy Państwowy Instytut Badawczy 00-701 Warszawa ul. Czerniakowska 16 Jod metoda oznaczania
Absorpcja promieni rentgenowskich 2 godz.
 Uniwersytet Śląski - Instytut Chemii Zakład Krystalografii ul. Bankowa 14, pok. 133, 40-006 Katowice tel. (032)3591627, e-mail: joanna_palion@poczta.fm opracowanie: mgr Joanna Palion-Gazda Laboratorium
Uniwersytet Śląski - Instytut Chemii Zakład Krystalografii ul. Bankowa 14, pok. 133, 40-006 Katowice tel. (032)3591627, e-mail: joanna_palion@poczta.fm opracowanie: mgr Joanna Palion-Gazda Laboratorium
I. PROMIENIOWANIE CIEPLNE
 I. PROMIENIOWANIE CIEPLNE - lata '90 XIX wieku WSTĘP Widmo promieniowania elektromagnetycznego zakres "pokrycia" różnymi rodzajami fal elektromagnetycznych promieniowania zawartego w danej wiązce. rys.i.1.
I. PROMIENIOWANIE CIEPLNE - lata '90 XIX wieku WSTĘP Widmo promieniowania elektromagnetycznego zakres "pokrycia" różnymi rodzajami fal elektromagnetycznych promieniowania zawartego w danej wiązce. rys.i.1.
IM21 SPEKTROSKOPIA ODBICIOWA ŚWIATŁA BIAŁEGO
 IM21 SPEKTROSKOPIA ODBICIOWA ŚWIATŁA BIAŁEGO Cel ćwiczenia: Zapoznanie się z metodą pomiaru grubości cienkich warstw za pomocą interferometrii odbiciowej światła białego, zbadanie zjawiska pęcznienia warstw
IM21 SPEKTROSKOPIA ODBICIOWA ŚWIATŁA BIAŁEGO Cel ćwiczenia: Zapoznanie się z metodą pomiaru grubości cienkich warstw za pomocą interferometrii odbiciowej światła białego, zbadanie zjawiska pęcznienia warstw
ABSORPCYJNA SPEKTROMETRIA ATOMOWA
 ABSORPCYJNA SPEKTROMETRIA ATOMOWA Ćwiczenie 1. Badanie wpływu warunków pomiaru na absorbancję oznaczanego pierwiastka Ustalenie składu gazów płomienia i położenia palnika Do dwóch kolbek miarowych o pojemności
ABSORPCYJNA SPEKTROMETRIA ATOMOWA Ćwiczenie 1. Badanie wpływu warunków pomiaru na absorbancję oznaczanego pierwiastka Ustalenie składu gazów płomienia i położenia palnika Do dwóch kolbek miarowych o pojemności
Właściwości optyczne. Oddziaływanie światła z materiałem. Widmo światła widzialnego MATERIAŁ
 Właściwości optyczne Oddziaływanie światła z materiałem hν MATERIAŁ Transmisja Odbicie Adsorpcja Załamanie Efekt fotoelektryczny Tradycyjnie właściwości optyczne wiążą się z zachowaniem się materiałów
Właściwości optyczne Oddziaływanie światła z materiałem hν MATERIAŁ Transmisja Odbicie Adsorpcja Załamanie Efekt fotoelektryczny Tradycyjnie właściwości optyczne wiążą się z zachowaniem się materiałów
Doświadczenie nr 6 Pomiar energii promieniowania gamma metodą absorpcji elektronów komptonowskich.
 Doświadczenie nr 6 Pomiar energii promieniowania gamma metodą absorpcji elektronów komptonowskich.. 1. 3. 4. 1. Pojemnik z licznikami cylindrycznymi pracującymi w koincydencji oraz z uchwytem na warstwy
Doświadczenie nr 6 Pomiar energii promieniowania gamma metodą absorpcji elektronów komptonowskich.. 1. 3. 4. 1. Pojemnik z licznikami cylindrycznymi pracującymi w koincydencji oraz z uchwytem na warstwy
ELEKTROFOREZA. Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM
 Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM Zadania: 1. Wykonać elektroforezę poziomą wybranych barwników w żelu agarozowym przy trzech różnych wartościach ph roztworów buforowych.
Wykonanie ćwiczenia 8. ELEKTROFOREZA BARWNIKÓW W ŻELU AGAROZOWYM Zadania: 1. Wykonać elektroforezę poziomą wybranych barwników w żelu agarozowym przy trzech różnych wartościach ph roztworów buforowych.
EFEKT SOLNY BRÖNSTEDA
 EFEKT SLNY RÖNSTED Pojęcie eektu solnego zostało wprowadzone przez rönsteda w celu wytłumaczenia wpływu obojętnego elektrolitu na szybkość reakcji zachodzących między jonami. Założył on, że reakcja pomiędzy
EFEKT SLNY RÖNSTED Pojęcie eektu solnego zostało wprowadzone przez rönsteda w celu wytłumaczenia wpływu obojętnego elektrolitu na szybkość reakcji zachodzących między jonami. Założył on, że reakcja pomiędzy
ĆWICZENIE 2 KONDUKTOMETRIA
 ĆWICZENIE 2 KONDUKTOMETRIA 1. Oznaczanie słabych kwasów w sokach i syropach owocowych metodą miareczkowania konduktometrycznego Celem ćwiczenia jest ilościowe oznaczenie zawartości słabych kwasów w sokach
ĆWICZENIE 2 KONDUKTOMETRIA 1. Oznaczanie słabych kwasów w sokach i syropach owocowych metodą miareczkowania konduktometrycznego Celem ćwiczenia jest ilościowe oznaczenie zawartości słabych kwasów w sokach
Wykład XIV: Właściwości optyczne. JERZY LIS Wydział Inżynierii Materiałowej i Ceramiki Katedra Technologii Ceramiki i Materiałów Ogniotrwałych
 Wykład XIV: Właściwości optyczne JERZY LIS Wydział Inżynierii Materiałowej i Ceramiki Katedra Technologii Ceramiki i Materiałów Ogniotrwałych Treść wykładu: Treść wykładu: 1. Wiadomości wstępne: a) Załamanie
Wykład XIV: Właściwości optyczne JERZY LIS Wydział Inżynierii Materiałowej i Ceramiki Katedra Technologii Ceramiki i Materiałów Ogniotrwałych Treść wykładu: Treść wykładu: 1. Wiadomości wstępne: a) Załamanie
Ćwiczenie 3 Pomiar równowagi keto-enolowej metodą spektroskopii IR i NMR
 Ćwiczenie 3 Pomiar równowagi keto-enolowej metodą spektroskopii IR i NMR 1. Wstęp Związki karbonylowe zawierające w położeniu co najmniej jeden atom wodoru mogą ulegać enolizacji przez przesunięcie protonu
Ćwiczenie 3 Pomiar równowagi keto-enolowej metodą spektroskopii IR i NMR 1. Wstęp Związki karbonylowe zawierające w położeniu co najmniej jeden atom wodoru mogą ulegać enolizacji przez przesunięcie protonu
Zastosowanie spektroskopii UV/VIS w określaniu struktury związków organicznych Małgorzata Krasodomska
 Zastosowanie spektroskopii UV/VIS w określaniu struktury związków organicznych Małgorzata Krasodomska 1.1. Wprowadzenie do spektroskopii UV/VIS Spektroskopia w nadfiolecie, oraz świetle widzialnym UV/VIS
Zastosowanie spektroskopii UV/VIS w określaniu struktury związków organicznych Małgorzata Krasodomska 1.1. Wprowadzenie do spektroskopii UV/VIS Spektroskopia w nadfiolecie, oraz świetle widzialnym UV/VIS
Ćwiczenie II Roztwory Buforowe
 Ćwiczenie wykonać w parach lub trójkach. Ćwiczenie II Roztwory Buforowe A. Sporządzić roztwór buforu octanowego lub amonowego o określonym ph (podaje prowadzący ćwiczenia) Bufor Octanowy 1. Do zlewki wlej
Ćwiczenie wykonać w parach lub trójkach. Ćwiczenie II Roztwory Buforowe A. Sporządzić roztwór buforu octanowego lub amonowego o określonym ph (podaje prowadzący ćwiczenia) Bufor Octanowy 1. Do zlewki wlej
Oznaczanie mocznika w płynach ustrojowych metodą hydrolizy enzymatycznej
 Oznaczanie mocznika w płynach ustrojowych metodą hydrolizy enzymatycznej Wprowadzenie: Większość lądowych organizmów kręgowych część jonów amonowych NH + 4, produktu rozpadu białek, wykorzystuje w biosyntezie
Oznaczanie mocznika w płynach ustrojowych metodą hydrolizy enzymatycznej Wprowadzenie: Większość lądowych organizmów kręgowych część jonów amonowych NH + 4, produktu rozpadu białek, wykorzystuje w biosyntezie
Stałe : h=6, Js h= 4, eVs 1eV= J nie zależy
 T_atom-All 1 Nazwisko i imię klasa Stałe : h=6,626 10 34 Js h= 4,14 10 15 evs 1eV=1.60217657 10-19 J Zaznacz zjawiska świadczące o falowej naturze światła a) zjawisko fotoelektryczne b) interferencja c)
T_atom-All 1 Nazwisko i imię klasa Stałe : h=6,626 10 34 Js h= 4,14 10 15 evs 1eV=1.60217657 10-19 J Zaznacz zjawiska świadczące o falowej naturze światła a) zjawisko fotoelektryczne b) interferencja c)
KINETYKA HYDROLIZY SACHAROZY
 Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie z wytworzeniem -D-glukozy i -D-fruktozy. Jest to reakcja
Ćwiczenie nr 2 KINETYKA HYDROLIZY SACHAROZY I. Kinetyka hydrolizy sacharozy reakcja chemiczna Zasada: Sacharoza w środowisku kwaśnym ulega hydrolizie z wytworzeniem -D-glukozy i -D-fruktozy. Jest to reakcja
PODSTAWY BARWY, PIGMENTY CERAMICZNE
 PODSTAWY BARWY, PIGMENTY CERAMICZNE Barwa Barwą nazywamy rodzaj określonego ilościowo i jakościowo (długość fali, energia) promieniowania świetlnego. Głównym i podstawowym źródłem doznań barwnych jest
PODSTAWY BARWY, PIGMENTY CERAMICZNE Barwa Barwą nazywamy rodzaj określonego ilościowo i jakościowo (długość fali, energia) promieniowania świetlnego. Głównym i podstawowym źródłem doznań barwnych jest
Mikroskopia fluorescencyjna
 Mikroskopia fluorescencyjna Mikroskop fluorescencyjny to mikroskop świetlny, wykorzystujący zjawisko fluorescencji większość z nich to mikroskopy tzw. epi-fluorescencyjne zjawisko fotoluminescencji: fluorescencja
Mikroskopia fluorescencyjna Mikroskop fluorescencyjny to mikroskop świetlny, wykorzystujący zjawisko fluorescencji większość z nich to mikroskopy tzw. epi-fluorescencyjne zjawisko fotoluminescencji: fluorescencja
Laboratorium 4. Określenie aktywności katalitycznej enzymu. Wprowadzenie do metod analitycznych. 1. CZĘŚĆ TEORETYCZNA
 Laboratorium 4 Określenie aktywności katalitycznej enzymu. Wprowadzenie do metod analitycznych. Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Enzymy to wielkocząsteczkowe, w większości białkowe,
Laboratorium 4 Określenie aktywności katalitycznej enzymu. Wprowadzenie do metod analitycznych. Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Enzymy to wielkocząsteczkowe, w większości białkowe,
SPECYFIKACJA WYMAGAŃ UŻYTKOWNIKA URZĄDZENIA (URS) Urządzenie: Spektrofotometr (Propozycja zakupu)
 Strona1 Załącznik nr 1 do Zapytania ofertowego z dnia 16.04.2014 r. WYMAGAŃ UŻYTKOWNIKA ZĄDZENIA (S) Str.1/5 1. Wstęp Powstające Laboratorium Technologiczne w ramach działalności CBR planuje oprzeć swoją
Strona1 Załącznik nr 1 do Zapytania ofertowego z dnia 16.04.2014 r. WYMAGAŃ UŻYTKOWNIKA ZĄDZENIA (S) Str.1/5 1. Wstęp Powstające Laboratorium Technologiczne w ramach działalności CBR planuje oprzeć swoją
POMIARY SPEKTROFOTOMETRYCZNE
 Laboratorium Elektronicznej Aparatury Medycznej Katedra Inżynierii Biomedycznej Wydział Podstawowych Problemów Techniki Politechnika Wrocławska ĆWICZENIE NR 3 POMIARY SPEKTROFOTOMETRYCZNE Cel ćwiczenia
Laboratorium Elektronicznej Aparatury Medycznej Katedra Inżynierii Biomedycznej Wydział Podstawowych Problemów Techniki Politechnika Wrocławska ĆWICZENIE NR 3 POMIARY SPEKTROFOTOMETRYCZNE Cel ćwiczenia
