Test CEDIA Mycophenolic Acid
|
|
|
- Paulina Ludwika Pluta
- 8 lat temu
- Przeglądów:
Transkrypt
1 Test CEDIA Mycophenolic Acid Do badań diagnostycznych in vitro Przeznaczenie Test CEDIA Mycophenolic Acid (MPA) jest wyrobem medycznym do diagnostyki in vitro przeznaczonym do ilościowego oznaczania kwasu mykofenolowego w ludzkim osoczu za pomocą zautomatyzowanego analizatora do badań biochemicznych jako pomoc w leczeniu pacjentów po przeszczepie nerek i serca leczonych kwasem mykofenolowym. Informacje ogólne i objaśnienie testu Kwas mykofenolowy (MPA), metabolizowany z prekursora leku mykofenolanu mofetylu (MMF, CellCept ) lub mykofenolanu sodu, jest powszechnie stosowany w zapobieganiu odrzutom u pacjentów z przeszczepem nerek, serca lub wątroby 1-5. Po podaniu MMF i mykofenolan sodu są szybko i w dużej części wchłaniane i hydrolizowane do MPA 1-4. Pod względem biochemicznym MPA jest silnym i swoistym inhibitorem dehydrogenazy inozynomonofosforanu (IMPDH), enzymu dla syntezy de novo puryny wykorzystywanego przez limfocyty B i T 1-6. Hamowanie IMPDH przez MPA tłumi proliferację komórek B i T w związku z ich zależnością od de novo syntezy puryny i tym samym wywiera działanie immunosupresyjne. W stężeniach o znaczeniu klinicznym MPA wiąże się w około 97% z albuminą ludzkiej surowicy z niską stałą dysocjacji przy 13 µm 3, 7-8. U pacjentów MPA jest dalej metabolizowana przez UDP-glukuronosylotransferazę głównie do MPAG, glukuronidu fenolowego MPA, który jest farmakologicznie nieaktywny 1-3 i w mniejszym zakresie, do acyloglukuronidu MPA (AcMPAG). Pomiędzy pacjentami występuje duża zmienność w zakresie stosunku AcMPAG do MPA 9-11 na którą mogą mieć wpływ inne równocześnie podawane leki, czas pobierania próbek lub inne czynniki. Tedesco-Silva et al. wykazał, że molowy stosunek AcMPAG do MPA w oparciu o AUC (pole pod krzywą) wynosi około 17-20% (26-31% wagowo) 9 a Shipkova et al., że wynosi 10% (13-17% wagowo) 10. Kuypers et al. obserwował stosunek 5,7-15,4% 11. Monitorowanie stężenia MPA może być istotne dla skutecznego stosowania leku oraz dla zminimalizowania działań niepożądanych u pacjentów 1, 4. Test CEDIA MPA wykorzystuje technologię rekombinantu DNA (patent amerykański nr ) do wytwarzania wyjątkowego jednorodnego systemu immunoenzymatycznego 12. Test opiera się na enzymie -galaktozydazy, który został przygotowanym metodami inżynierii genetycznej w postaci dwóch nieaktywnych fragmentów określanych jako dawca enzymu (ED) i biorca enzymu (EA). Te fragmenty samoistnie ponownie się łączą tworząc w pełni aktywne enzymy, które w teście rozbijają substrat, powodując zmianę zabarwienia, którą można zmierzyć spektrofotometrycznie. W trakcie testu analit znajdujący się w próbce rywalizuje z analitem sprzężonym z ED -galaktozydazy o ograniczoną liczbę miejsc wiązania przeciwciała. Jeśli analit jest obecny w próbce, wiąże się z przeciwciałem, pozostawiając wolny koniugat ED do tworzenia aktywnych enzymów z EA. Jeżeli w próbce nie ma analitu, przeciwciało wiąże się z analitem skoniugowanym z ED, hamując ponowne połączenie ED z EA, i nie powstaje żaden aktywny enzym. Ilość powstałego aktywnego enzymu i wynikającej z tego zmiany absorbancji jest wprost proporcjonalna do ilości leku pierwotnie obecnego w próbce. Odczynniki/Kalibratory 1 Bufor rozpuszczenia EA: zawiera TES {kwas N-[Tris (hydroksymetylo) metylo]-2- aminoetan-sulfonowy}, przeciwciała poliklonalne przeciwko MPA, stabilizator i środek konserwujący (1 x 26 ml). 1a Odczynnik EA: zawiera 0,118 g/l EA (mikrobiologiczny), sole buforujące i środek konserwujący (liofilizowany). 2 Bufor rozpuszczenia ED: zawiera fosforan potasu, detergent i środek konserwujący (1 x 11 ml). 2a Odczynnik ED: zawiera 58 µg/l MPA skoniugowany z ED (mikrobiologiczny), 3,0 g/l chlorofenol czerwony- -D-galaktopiranozyd, środki stabilizujące i środek konserwujący (liofilizowany). Dodatkowe materiały dostarczone: Jedna (1) pusta butelka Hitachi z etykietą o poj. 50 ml. Wymagane materiały dodatkowe (nie dostarczone): Opis zestawu Zestaw kalibratorów kwasu mykofenolowego CEDIA Zestaw kontroli 1 kwasu mykofenolowego MAS Zestaw kontroli 2 kwasu mykofenolowego MAS Zestaw kontroli 3 kwasu mykofenolowego MAS Automatyczny analizator biochemiczny Ostrzeżenia oraz środki ostrożności Należy przestrzegać standardowych środków ostrożności obowiązujących podczas pracy ze wszystkimi odczynnikami laboratoryjnymi. PRZESTROGA OSTRZEŻENIE: Materiały ludzkiego pochodzenia, użyte do przygotowania kontroli MAS, badano w zakresie obecności HIV1 i 2, WZW typu B i WZW typu C metodami zatwierdzonymi przez FDA, a wyniki testów były ujemne. Niemniej, ponieważ żadna metoda badań nie może wykluczyć z całkowitą pewnością potencjalnego ryzyka zakażenia materiał należy traktować jako potencjalnie zakaźny zgodnie z normami OSHSA w sprawie czynników chorobotwórczych przenoszonych z krwią. W przypadku kontaktu należy postępować zgodnie z rozporządzeniami odpowiednich władz służby zdrowia. PRZESTROGA OSTRZEŻENIE: Odczynniki zawarte w teście CEDIA MPA zawierają mniej niż 0,1% azydku sodu. Unikać kontaktu ze skórą i błonami śluzowymi. Przepłukać skażone miejsca obfitą ilością wody. W przypadku połknięcia lub kontaktu z oczami, należy niezwłocznie uzyskać pomoc medyczną. Azydek sodu może reagować z elementami kanalizacji wykonanymi z miedzi lub ołowiu tworząc potencjalnie wybuchowe azydki metali. Po wylaniu do kanalizacji takich odczynników należy zawsze spłukiwać dużą ilością wody, aby zapobiec gromadzeniu się azydku w kanalizacji. Powierzchnie metalowe narażone na kontakt z azydkiem czyścić 10% roztworem wodorotlenku sodu. Przygotowanie odczynników Informacje na temat przygotowania odczynników dla analizatorów Hitachi podano w poniższych instrukcjach. W przypadku wszystkich innych analizatorów należy sprawdzić informacje podane w instrukcji obsługi analizatora. Przygotować następujące roztwory używając schłodzonych (2 8 C) odczynników i buforów. Wyjmować zestaw z chłodzonego miejsca przechowywania tuż przed przygotowaniem roztworów roboczych. Należy przygotowywać odczynniki w podanej kolejności w celu ograniczenia ewentualnego skażenia. R2 Roztwór ED: Połączyć butelkę 2a (odczynnik ED) z butelką 2 (bufor rozpuszczenia ED) za pomocą jednego z załączonych łączników. Mieszać za pomocą delikatnego odwracania, upewniając się, że cały liofilizowany materiał z butelki 2a został przeniesiony do butelki 2. Unikać tworzenia się piany. Butelkę 2a i łącznik odłączyć od butelki 2 i wyrzucić. Zamknąć korkiem napełnioną butelkę 2 i pozostawić na około 5 minut w temperaturze pokojowej (15 25 C). Delikatnie wymieszać ponownie i zapisać na etykiecie butelki datę rozpuszczenia. Umieścić butelkę bezpośrednio w komorze odczynników analizatora lub w chłodzonym miejscu przechowywania (2-8 C) i pozostawić na 15 minut przed użyciem. R1 Roztwór EA: Połączyć butelkę 1a (odczynnik EA) z butelką 1 (bufor rozpuszczenia EA) za pomocą jednego z załączonych łączników. Mieszać za pomocą delikatnego odwracania, upewniając się, że cały liofilizowany materiał z butelki 1a został przeniesiony do butelki 1. Unikać tworzenia się piany. Butelkę 1a odłączyć od łącznika i wyrzucić. Zamknąć korkiem napełnioną butelkę 1 i pozostawić na około 5 minut w temperaturze pokojowej (15-25 C). Delikatnie wymieszać ponownie i zapisać na etykiecie butelki datę rozpuszczenia. Umieścić butelkę bezpośrednio w komorze odczynników analizatora lub w chłodzonym miejscu przechowywania (2-8 C) i pozostawić na 15 minut przed użyciem. Uwaga 1: Komponenty testu dostarczone w tym zestawie są przeznaczone do wykorzystania jako jeden integralny zestaw. Nie wolno mieszać komponentów z różnych partii zestawów testów CEDIA MPA lub innych zestawów CEDIA. Uwaga 2: Należy unikać skażenia krzyżowego odczynników poprzez zakładanie właściwych korków na właściwe butelki odczynników. Roztwór R2 (odczynnik ED) powinien mieć barwę pomarańczowo-żółtą. Czerwona lub fioletowo-czerwona barwa wskazuje na skażenie odczynnika i należy go usunąć. Uwaga 3: Przed rozpoczęciem testu roztwory R1 i R2 muszą być w temperaturze komory przechowywania odczynnika analizatora. Dodatkowe informacje podano w instrukcji obsługi danego analizatora. Uwaga 4: Aby zapewnić trwałość rozpuszczonego odczynnika EA należy chronić go przed dłuższą ciągłą ekspozycją na jasne światło. Warunki przechowywania Przechowywać komponenty w odpowiednich temperaturach. NIE ZAMRAŻAĆ. Terminy ważności nieotwartych komponentów testu podano na pudełku lub etykietach butelek. R1 Roztwór: 60 dni chłodzony w analizatorze lub w temperaturze 2-8 C R2 Roztwór: 60 dni chłodzony w analizatorze lub w temperaturze 2-8 C Pobieranie i obchodzenie się z próbkami Należy użyć próbek osocza Na2EDTA lub K2EDTA. Należy podjąć środki ostrożności, aby zachować integralność próbki od momentu pobrania do wykonania testu. Próbki należy oznakować podając godzinę pobrania krwi i godzinę ostatniego podania leku. Próbki powinny być zamknięte korkami i badane w ciągu 14 dni, jeśli są przechowywane w temperaturze 2-8 C (kryteria akceptacji +/ - 10% odzysku) lub w ciągu 5 miesięcy, jeśli przechowywane w < -20 C 4,13. Unikać wielokrotnego zamrażania i rozmrażania. Nie powodować spieniania próbek.
2 Uwaga: Analizatory Hitachi Jeśli analizator nie odczytał kodu paskowego, można ręcznie za pomocą klawiatury wpisać kolejność liczb na etykiecie kodu paskowego. Test CEDIA MPA jest przeznaczony do stosowania na automatycznych analizatorach. Dane dotyczące wydajności zastosowania są przechowywane w Microgenics Corporation 14. Procedura analityczna Kalibracja Test CEDIA MPA przy użyciu odpowiednich kalibratorów zestawu CEDIA MPA tworzy krzywą wzorcową. Przed wykonaniem testu próbki pacjenta należy sprawdzić kalibrację testu poprzez wykonanie testu kontroli o ustalonych zakresach odzysku dla testu CEDIA MPA. Uwaga: Karta przydzielenia wartości kalibratorów znajduje się w każdym zestawie kalibratorów CEDIA MPA. Przed zastosowaniem nowego zestawu należy sprawdzić parametry chemiczne, aby upewnić się, że stężenia kalibratorów odpowiadają wartościom wydrukowanym na karcie przypisania wartości. Częstotliwość kalibracji Zaleca się wykonywanie ponownej kalibracji W razie potrzeby po wykonaniu procedur kontroli jakości laboratorium oraz Po zmianie butelki odczynnika Po zmianie serii (zestawu) kalibratora lub odczynnika Po wykonaniu co miesięcznej konserwacji analizatora Rejestrowany zakres Zakres testu CEDIA MPA wynosi od 0,3 do 10 µg/ml. Próbki poza zakresem Próbki o większym stężeniu niż 10 µg/ml mogą być podawane jako stężenie > 10 µg/ml lub rozcieńczone w stosunku jedna część oryginalnej próbki i jedna część kalibratora ujemnego i ponownie zbadane. Wartość uzyskana w ponownie wykonanym teście powinna być obliczona w następujący sposób: Rzeczywista wartość = 2 x rozcieńczona wartość Próbki z wynikiem poniżej czułości użytkowej testu są podawane jako < 0,3 µg/ml. Kontrola jakości i kalibracja Każde laboratorium powinno ustalić własną częstotliwość kontroli. Zgodnie z dobrą praktyką laboratoryjną każdego dnia, w którym badane są próbki pacjentów, i zawsze gdy wykonywana jest kalibracja, należy wykonać testy co najmniej dwóch stężeń (odpowiadające dolnym i górnym kryteriom decyzji odnośnie leczenia) w ramach kontroli jakości. Monitorować wartości kontroli w zakresie trendów lub zmian. W razie wykrycia trendów lub zmian lub braku odzysku w określonym zakresie należy wykonać przegląd wszystkich parametrów działania. W sprawie dodatkowej pomocy i zaleceń odnośnie odpowiedniego materiału kontroli należy skontaktować się z Działem Pomocy Technicznej firmy Microgenics. Wszystkie wymagania kontroli jakości powinny być wykonywane zgodnie z przepisami lokalnymi, regionalnymi lub państwowymi bądź warunkami akredytacji. Uwaga: Po zamianie serii odczynnika (zestawu) należy ponownie ocenić cele kontroli i zakresy. Ograniczenia substancje zakłócające Nie ustalono charakterystyki działania testu CEDIA MPA z płynami ustrojowymi innymi niż ludzkie osocze. Kryteria akceptacji: W odniesieniu do informacji o zakłóceniach podanych poniżej, działanie testu uznano za akceptowalne (bez istotnych zakłóceń), jeśli odzysk MPA wynosił ± 0,3 µg/ml przy początkowym stężeniu < 3 µg/ml lub ± 10% początkowego stężenia > 3 µg/ml. Żółtaczka: Nie stwierdzono żadnych poważnych zakłóceń powodowanych przez nieskoniugowaną bilirubinę o stężeniu do 20 mg/dl. Lipemia: Nie stwierdzono żadnych poważnych zakłóceń powodowanych przez trójglicerydy o stężeniu do 1600 mg/dl i cholesterol do 400 mg/dl. Białko całkowite: Nie stwierdzono żadnych poważnych zakłóceń powodowanych przez białko całkowite o stężeniu do 10 g/dl. Czynnik reumatoidalny: Nie stwierdzono żadnych poważnych zakłóceń powodowanych przez czynnik reumatoidalny o stężeniu do 2000 j.m./ml. Hemoglobina: Nie stwierdzono żadnych poważnych zakłóceń powodowanych przez hemoglobinę o stężeniu do 1000 mg/dl. Stężenie EDTA: Próbki osocza pobierane do probówki ze środkiem przeciwkrzepliwym EDTA były zalecane do badań MPA 15. Nie stwierdzono żadnych istotnych zakłóceń przy prawidłowej ilości próbek pobieranych do probówki VACUTAINER (fioletowy korek). Jednak jeśli pobrana stanowi mniej niż 1/3 probówki, powstałe duże stężenie EDTA spowoduje względne zawyżenie stężenia MPA. Inne środki przeciwkrzepliwe: Chociaż osocze zawierające środek przeciwkrzepliwy EDTA jest preferowaną matrycą dla pomiaru MPA, badano heparynę pod kątem zakłóceń. Nie stwierdzono istotnych zakłóceń w związku z użyciem tego środka. W przypadku wszystkich środków przeciwkrzepliwych pobrane próbki nie mogą stanowić mniej niż 1/3 probówki dla potrzeb testu CEDIA MPA, ponieważ powoduje to zawyżenie odzysku MPA. Przeciwciała przeciwko E. coli [ ]-galaktozydazie: Częstość pacjentów z przeciwciałami przeciwko [ ]-galaktozydazie E. coli jest bardzo mała. Niemniej jednak niektóre próbki zawierające takie przeciwciała mogą powodować błędnie zawyżone stężenia MPA, które mogą nie być zgodne z profilem klinicznym pacjenta. W razie podejrzewania takiej sytuacji należy skontaktować się w sprawie pomocy z Działem Pomocy Technicznej firmy Microgenics. Ograniczenia różnice i zmiany w teście Różne testy immunoenzymatyczne mogą dawać zmienne wyniki w przypadku tej samej próbki w związku ze zróżnicowaniami specyficznymi dla testu w zakresie reaktywności krzyżowej metabolitów. Największe zróżnicowania mogą występować u pacjentów z upośledzonym wydalaniem (np. niewydolność nerek). W przypadku takich pacjentów oprócz użycia tego testu można wykorzystać metodę chromatograficzną swoistą dla MPA. Biorąc pod uwagę możliwość odchylenia lub rozbieżności w przypadku porównania testu CEDIA MPA i metody HPLC w zakresie wykrywania stężenia MPA w próbkach, ważne jest, aby każde laboratorium ustaliło własny zakres terapeutyczny na podstawie własnej populacji pacjentów. Ograniczenia reaktywność krzyżowa AcMPAG Test ma reaktywność krzyżową wynoszącą 158% wobec AcMPAG, co może powodować pozytywne odchylenie w porównaniu do metod takich jak LC-MS/MS (chromatografia cieczowa/ spektrofotometria masowa), które nie są obciążone reaktywnością krzyżową. Odchylenie względem LCMS w przypadku każdej indywidualnej próbki pacjenta wiąże się częściowo ze stężeniem AcMPAG w danej próbce. Oczekiwane wartości Nie ustalano w pełni optymalnego zakresu terapeutycznego MPA w osoczu. Ponadto optymalne zakresy stężenia MPA u pacjenta mogą się wahać zależnie od reaktywności krzyżowej danego testu i jego metabolitu (patrz punkt dotyczący reaktywności krzyżowej poniżej, gdzie podano reaktywności krzyżowe obserwowane w tym teście). Dlatego należy ustalić optymalne zakresy dla każdego komercyjnego testu i wartości otrzymane przy użyciu różnych metod analitycznych nie mogą być stosowane zamiennie ani nie mogą być stosowane współczynniki korekcji. Laboratoria powinny podawać identyfikację testu na raportach wyników pacjentów w celu ułatwienia interpretacji wyników. Optymalne zakresy zależą od typu przeszczepu i równocześnie podawanych innych leków oraz stanu klinicznego pacjenta, indywidualnych różnic w zakresie wrażliwości na działanie immunosupresyjne i toksyczne MPA, czasu od wykonania przeszczepu i szeregu innych czynników. Dlatego indywidualne wartości stężenia MPA nie mogą być używane jako jedyny wskaźnik do wprowadzenia zmian w schemacie leczenia i każdego pacjenta należy dokładnie ocenić klinicznie przed wprowadzeniem zmian w schemacie leczenia. Każda placówka powinna ustalić optymalne zakresy na podstawie określonego używanego testu i innych czynników istotnych dla populacji pacjentów. Przykłady w piśmiennictwie dyskusji na temat obserwowanych optymalnych zakresów MPA podano w przypisach Należy zwrócić uwagę na czynniki takie jak określone testy, specjalne charakterystyki kliniczne i czas pobierania próbek w takich przypisach. Swoista charakterystyka działania Poniżej przedstawiono typowe dane działania uzyskane dla testu CEDIA MPA na analizatorze Hitachi Wyniki uzyskane w poszczególnych laboratoriach mogą się różnić od tych danych. W sprawie dodatkowych informacji dotyczących działania na określonym analizatorze należy sprawdzić protokół użycia tego analizatora lub skontaktować się z Działem Pomocy Technicznej firmy Microgenics. Precyzja Badania precyzji w ramach jednego testu i pomiędzy testami (odtwarzalność) przeprowadzono z użyciem próbek od pacjentów po przeszczepach przyjmujących MMF, osocza z dodanym MPA i kontroli. 2 została przygotowana z próbek od pacjentów po przeszczepach, a próbki zbiorcze 1 i 3 są próbkami osocza nie zawierającego MPA z dodanym MPA. Wszystkie próbki badano łącznie w 21 testach przez 11 dni stosując zmodyfikowany protokół z CLSI (EP5A). Dla każdego testu wykonano kalibrację. Wyniki przedstawiono w poniższej tabeli. 2
3 Precyzja w ramach jednego testu i pomiędzy testami (odtwarzalność) Tx osocze pacjentów Próbka N Średnia Odchylenie standardowe (SD) pacjentów 1 pacjentów 2 pacjentów 3 W jednym teście CV (współczynnik wariancji) % Odchylenie standardowe (SD) Wszystkie testy CV (współczynnik wariancji) % 126 1,0 0,06 5,6 0,08 7, ,4 0,07 2,8 0,09 4, ,0 0,09 1,5 0,14 2,3 Kontrola ,1 0,06 5,5 0,10 9,5 Kontrola ,7 0,06 2,2 0,13 4,8 Kontrola ,9 0,12 2,0 0,20 3,3 Liniowość W celu oceny liniowości testu próbkę osocza z dużym stężeniem rozcieńczono próbką osocza nie zawierającego MPA otrzymując serię próbek w zakresie dynamicznym testu. Każdą próbkę badano w 5 powtórzeniach i jako wyniki zmierzono przyjmowano wartość średnią. Następnie oznaczono procentowo odzysk przez podział wartości otrzymanego stężenia MPA przez wartość oczekiwanego stężenia. Oczekiwane stężenia oznaczono wykorzystując największe badane stężenie razy współczynnik rozcieńczenia. Pacjent 1 Pacjent 2 0,5 0,5-1,0 1, ,5 2, ,4 2,4-3,4 3,3 97 6,9 6,8 99 Swoistość Różne stężenia metabolitów glukuronidu MPA dodano do osocza zawierającego MPA w celu wykonania testu reaktywności krzyżowej. Szacunkową reaktywność krzyżową substancji obliczono za pomocą wzoru a wyniki podano w tabeli poniżej. (zmierzone stężenie stężenie kontroli) x 100% zbadane stężenie powodujące reaktywność krzyżową Reaktywność krzyżowa z metabolitami MPA Rozcieńczone próbki Poziom 1 9,8 9,8 - Poziom 2 7,4 7,4 100 Poziom 3 4,9 4,9 100 Poziom 4 3,4 3,3 97 Poziom 5 2,5 2,3 92 Poziom 6 1,0 0,9 90 Substancja 7-O-glukuronid kwasu mykofenolowego (MPAG) Acyloglukuronid kwasu mykofenolowego (AcMPAG) Badane stężenie, (µg/ml) Reaktywność krzyżowa (%) ,0 10,0 3,0 1,8 0,9 0,3 164,0 170,0 144,4 177,8 133,3 Średnia 158 Poziom 7 0,5 0,4 80 Poziom 8 0,0 0,0 - Odzysk W celu oceny odzysku testu dodano MPA do osocza zdrowej osoby nie zawierającego MPA i do próbek od pacjentów po przeszczepach zawierających MPA. Próbki badano w 21 powtórzeniach w przypadku matrycy osocza od zdrowych osób i w 5 powtórzeniach w przypadku matrycy osocza pacjentów po przeszczepach. Procentowy odzysk określono przez podział otrzymanego stężenia każdej próbki przez oczekiwane stężenie dodanego MPA plus MPA wcześniej obecny w próbkach. Osocze nie zawierające MPA Uwaga: W związku z reaktywnością krzyżową na AcMPAG w teście CEDIA MPA przewiduje się możliwość wystąpienia dodatniego odchylenia pomiędzy testem CEDIA MPA a LC-MS/MS. Badano inne leki immunosupresyjne w zakresie reaktywności krzyżowej na test. Substancje podane poniżej nie wykazywały reaktywności krzyżowej w badanym stężeniu w teście CEDIA MPA. Substancje Badane stężenie, µg/ml Sirolimus 0,3 Takrolimus 0,3 Cyklosporyna 10 0,0 0,0-0,5 0, ,0 0,9 90 2,5 2, ,5 3,2 91 7,0 6,5 93 3
4 Badano powszechnie stosowane leki w osoczu nie zawierającym MPA w zakresie reaktywności krzyżowej na test. Substancje podane poniżej nie wykazywały reaktywności krzyżowej w badanym stężeniu w teście CEDIA MPA. Substancje Badane stężenie, µg/ml Acetaminofen 100 N-acetyloprokainamid 100 Acyklawir 100 Amikacyna 100 Amfoteracyna B 50 Ampicylina 100 Azatiopryna 100 Karbamazepina 100 Chloramfenikol 100 Cymetydyna 100 Cyprofloksacyna 100 Digoksyna 10 Digitoksyna 10 Dizopiramid 100 Erytromycyna 100 Flukonazol 100 Flucytozyna 100 Furosemid 100 Gancyklowir 100 Gentamycyna 100 Hydrokortyzon 100 Itrakonazol 100 Kanamycyna A 100 Kanamycyna B 100 Ketokonazol 100 Lidokaina 100 Metylprednisolon 100 Morfina 100 Penicylina 100 Fenobarbital 100 Fenotyina 100 Prozasyna 100 Prednizolon 100 Prednison 100 Prokainamid 100 Chinidyna 100 Ryfampicyna 60 Salicylan sodu 50 Spektynomycyna 100 Streptomycyna 100 Teofilina 100 Tobramycyna 100 Triamteren 100 Kwas walproinowy 100 Wankomycyna 100 Werapamil 100 Czułość użytkowa Czułość użytkowa, określona jako najmniejsze stężenie leku, które daje współczynnik zmienności (CV%) wynoszący < 20%, dla testu CEDIA MPA wynosi 0,3 µg/ml. Przy takim stężeniu istnieje około 0,01 µg/ml odchylenie, 104% odzysk i 17,6% CV. Porównanie metod Łącznie 188 próbek przed podaniem dawki leku od dorosłych pacjentów po przeszczepach leczonych mykofenolanem mofetylu lub mykofenolanem sodu badano w badaniu porównania metod stosując LC-MS/MS jako metodą odnośną. W poniższej tabeli podsumowano wyniki badania zawierające odrębną analizę według typu przeszczepu i łącznie przy użyciu narzędzia EP Evaluator. W kolumnie regresji metody, wyniki nachylenia i wyrazu wolnego są podane z przedziałem ufności 95% w nawiasach. Próbka N Metoda regresji r Osocze serce 96 Osocze nerka 92 Osocze wszystkie narządy 188 1,114 (od 1,061 do 1,166) 0,20 (od 0,05 do 0,36) 1,147 (od 1,094 do 1,200) 0,12 (od -0,04 do 0,28) 1,127 (od 0,974 do 1,080) 0,16 (od -0,03 do 0,36) 1,060 (od 1,006 do 1,113) 0,06 (od -0,13 do 0,25) 1,054 (od 1,015 do 1,092) 0,22 (od 0,09 do 0,34) 1,089 (od 1,051 do 1,128) 0,12 (od -0,01 do 0,25) 0,9743 0,9711 0,9698 Większość pacjentów przyjmowała równocześnie takrolimus (n=153), przedstawiony na wykresie poniżej jako kółka. Inni pacjenci przyjmowali równocześnie cyklosporynę (n=34), przedstawioną na wykresie poniżej jako trójkąty. CEDIA Hitachi917 (µg/ml) Równocześnie podawany takrolimus Równocześnie podawana cyklosporyna 1:1 linia Regresja Deminga LC-MS/MS (µg/ml) Najmniejsza wykrywalna dawka LDD jest określana jako najmniejsze stężenie, które można odróżnić od zera z 95% ufnością. Dwadzieścia jeden próbek osocza nie zawierających MPA badano w zakresie najmniejszej wykrywalnej dawki (LDD) i LDD wynosi 0,2 µg/ml. 4
5 Wartość odchylenia (µg/ml) 2,0 1,0 0,0-1,0-2,0 Równocześnie podawany takrolimus Równocześnie podawana cyklosporyna Średnie odchylenie N = 188 Średnia (Y-X) = 0,37 SD (Y-X) = 0,47 1,96 SD (standardowe odchylenie) = 0,92 Średnia + 1,96 SD = 1,29 Średnia 1,96 SD = -0,55 LC-MS/MS (µg/ml) Piśmiennictwo 1. Shaw LM, Sollinger HW, Halloran P, et al. Mycophenolate mofetil: A report of the consensus panel. Ther Drug Monit. 1995; 17: Shaw LM, Korecka M, Breeman RV, et al. Analysis, pharmacokinetics and therapeutic drug monitoring of mycophenolic acid. Clin Biochem. 1998; 31(5): Oellerich M, Shipkova M, Schutz E, et al. Pharmacokinetic and metabolic investigations of mycophenolic acid in pediatric patients after renal transplantation: implications for therapeutic drug monitoring. Ther Drug Monit. 2000; 22(1): Shaw LM, Holt DW, Oellerich M, et al. Current issues in therapeutic drug monitoring of mycophenolic acid: report of a round table discussion. Ther Drug Monit. 2001; 23(4): Physicians Desk Reference, 58th ed. Thomson PDR at Montvale, NJ. 2004; CellCept : Stintchak MD, Fleming MA, Futer O, et al. Structure and mechanism of inosine monophosphate dehydrogenase in complex with the immunosuppressant mycophenolic acid. Cell. 1996; 85: Nowak I, Shaw LM. Mycophenolic acid binding to human serum albumin: characterization and relationship to pharmacodynamics. Clin Chem. 1995; 41: Shaw LM, Nowak I. Mycophenolic acid: Measurement and relationship to pharmacological effects. Ther Drug Monit. 1995; 17: Tedesco-silva H, Bastien MC, Choi L, Felipe C, Campestrini J, Picard F, Schmouder R. Mycophenolic acid metabolite profile in renal transplant patients receiving enteric-coated mycophenolate sodium or mycophenolate mofetil. Transplant Proc. 2005:37(2): Shipkova M, Armstrong VW, Weber L et al. Pharmacokinetics and protein adduct formation of the pharmacologically active acyl glucuronide metabolite of mycophenolic acid in pediatric renal transplant recipients. Ther Drug Monit 2002, 24: Kuypers DRJ, Vanrenterghem Y, Squifflet JP et al. Twelve-month evaluation of the clinical pharmacokinetics of total and free mycophenolic acid and its glucuronide metabolites in renal allograft recipients on low dose tacrolimus in combination with mycophenolate mofetil. Ther Drug Monit 2003; 25: Henderson DR, Friedman SB, Harris JD, et al. CEDIA, a new homogeneous immunoassay system. Clin chem. 1986; 32: De Loor H, Naesens M, Verbeke K, Vanrenterghem Y, Kuypers DR. Stability of mycophenolic acid and glucuronide metabolites in human plasma and the impact of deproteinization methodology. Clinica chimica Acta. 2008;389(1-2): Data on file at Microgenics Corporation. 15. Shaw LM, Nicholls A, Hale M, Armstrong VW, Oellerich M, et al. Therapeutic Monitoring of Mycophenolic Acid, A Consensus Panel Report. Clin Biochem. 1998; 31(5): Kuypers D, de Jonge H, Naesens M, et al. Current target ranges of mycophenolic acid exposure and drug-related adverse events: A 5-year, open-label, prospective, clinical follow-up study in renal allograft recipients. Clinical Therapeutics. 2008; 30(4): Weber LT, Shipkova M, Armstrong VW, et al. Comparison of the Emit Immunoassay with HPLC for Therapeutic Drug Monitoring of Mycophenolic Acid in Pediatric Renal-Transplant Recipients on Mycophenolate Mofetil Therapy. Clin Chem. 2002; 48(3): Kaczmarek I, Bigdeli AK, Vogeser M, et al. Defining Algorithms for Efficient Therapeutic Drug Monitoring of Mycophenolate Mofetil in Heart Transplant Recipients. Ther Drug Monit. 2008; 30(4): Van Gelder T, Meur YL, Shaw LM, et al. Therapeutic Drug Monitoring of Mycophenolate Mofetil in Transplantation. Ther Drug Monit. 2006; 28(2): Cox VC and Ensom MHH. Mycophenolate Mofetil for Solid Organ Transplantation: Does the Evidence Support the Need for Clinical Pharmacokinetic Monitoring? Ther Drug Monit. 2003; 25: Microgenics Corporation Fremont Blvd. Fremont, CA Stany Zjednoczone Dział Pomocy Technicznej i Obsługi Klientów na terenie Stanów Zjednoczonych: Microgenics GmbH Spitalhofstrasse 94 D Passau Niemcy Tel.: +49 (0) Faks: +49 (0) Aktualizacje ulotki są dostępne na: Inne kraje: Należy skontaktować się z przedstawicielem firmy Thermo Fisher Scientific
Walidacja metod analitycznych Raport z walidacji
 Walidacja metod analitycznych Raport z walidacji Małgorzata Jakubowska Katedra Chemii Analitycznej WIMiC AGH Walidacja metod analitycznych (według ISO) to proces ustalania parametrów charakteryzujących
Walidacja metod analitycznych Raport z walidacji Małgorzata Jakubowska Katedra Chemii Analitycznej WIMiC AGH Walidacja metod analitycznych (według ISO) to proces ustalania parametrów charakteryzujących
Test Immunoenzymatyczny DRG Kortyzol dostarcza materiałów do oznaczania kortyzolu w surowicy i osoczu.
 WSTĘP Test Immunoenzymatyczny DRG Kortyzol dostarcza materiałów do oznaczania kortyzolu w surowicy i osoczu. Test jest przeznaczony wyłącznie do stosowania ZASADA OZNACZENIA Ten test immunoenzymatyczny
WSTĘP Test Immunoenzymatyczny DRG Kortyzol dostarcza materiałów do oznaczania kortyzolu w surowicy i osoczu. Test jest przeznaczony wyłącznie do stosowania ZASADA OZNACZENIA Ten test immunoenzymatyczny
QMS Tacrolimus Immunoassay
 QMS Tacrolimus Immunoassay 115556 Wyłącznie do stosowania w diagnostyce in vitro Przed użyciem należy uważnie przeczytać niniejszą ulotkę informacyjną dołączoną do opakowania systemu mikrosfer do oznaczania
QMS Tacrolimus Immunoassay 115556 Wyłącznie do stosowania w diagnostyce in vitro Przed użyciem należy uważnie przeczytać niniejszą ulotkę informacyjną dołączoną do opakowania systemu mikrosfer do oznaczania
Annex I. Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia
 Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
Annex I Podsumowanie naukowe i uzasadnienie dla wprowadzenia zmiany w warunkach pozwolenia Podsumowanie naukowe Biorąc pod uwagę Raport oceniający komitetu PRAC dotyczący Okresowego Raportu o Bezpieczeństwie
(Akty o charakterze nieustawodawczym) DECYZJE
 19.7.2019 PL L 193/1 II (Akty o charakterze nieustawodawczym) DECYZJE DECYZJA WYKONAWCZA KOMISJI (UE) 2019/1244 z dnia 1 lipca 2019 r. zmieniająca decyzję 2002/364/WE w odniesieniu do wymogów dotyczących
19.7.2019 PL L 193/1 II (Akty o charakterze nieustawodawczym) DECYZJE DECYZJA WYKONAWCZA KOMISJI (UE) 2019/1244 z dnia 1 lipca 2019 r. zmieniająca decyzję 2002/364/WE w odniesieniu do wymogów dotyczących
Oznaczanie mocznika w płynach ustrojowych metodą hydrolizy enzymatycznej
 Oznaczanie mocznika w płynach ustrojowych metodą hydrolizy enzymatycznej Wprowadzenie: Większość lądowych organizmów kręgowych część jonów amonowych NH + 4, produktu rozpadu białek, wykorzystuje w biosyntezie
Oznaczanie mocznika w płynach ustrojowych metodą hydrolizy enzymatycznej Wprowadzenie: Większość lądowych organizmów kręgowych część jonów amonowych NH + 4, produktu rozpadu białek, wykorzystuje w biosyntezie
Test DRG DHEA-S ELISA jest testem immunoenzymatycznym do ilościowego diagnostycznego oznaczania DHEA-S w surowicy i osoczu w warunkach in vitro.
 WSTĘP 1.1 Przeznaczenie Test DRG DHEA-S ELISA jest testem immunoenzymatycznym do ilościowego diagnostycznego oznaczania DHEA-S w surowicy i osoczu w warunkach in vitro. 1.2 Streszczenie i Wyjaśnienia Dehydroepiandrosteron
WSTĘP 1.1 Przeznaczenie Test DRG DHEA-S ELISA jest testem immunoenzymatycznym do ilościowego diagnostycznego oznaczania DHEA-S w surowicy i osoczu w warunkach in vitro. 1.2 Streszczenie i Wyjaśnienia Dehydroepiandrosteron
Ważna informacja dotycząca bezpieczeństwa stosowania
 ADVIA Centaur ADVIA Centaur XP ADVIA Centaur CP Ważna informacja dotycząca bezpieczeństwa stosowania 10819674, Zmiana A Wrzesień 2014 r. Informacja dotycząca Kalibratora E przeznaczonego do użytku z Systemami
ADVIA Centaur ADVIA Centaur XP ADVIA Centaur CP Ważna informacja dotycząca bezpieczeństwa stosowania 10819674, Zmiana A Wrzesień 2014 r. Informacja dotycząca Kalibratora E przeznaczonego do użytku z Systemami
Symago (agomelatyna)
 Ważne informacje nie wyrzucać! Symago (agomelatyna) w leczeniu dużych epizodów depresyjnych u dorosłych Poradnik dla lekarzy Informacja dla fachowych pracowników ochrony zdrowia Zalecenia dotyczące: -
Ważne informacje nie wyrzucać! Symago (agomelatyna) w leczeniu dużych epizodów depresyjnych u dorosłych Poradnik dla lekarzy Informacja dla fachowych pracowników ochrony zdrowia Zalecenia dotyczące: -
CEL ĆWICZENIA: Zapoznanie się z przykładową procedurą odsalania oczyszczanych preparatów enzymatycznych w procesie klasycznej filtracji żelowej.
 LABORATORIUM 3 Filtracja żelowa preparatu oksydazy polifenolowej (PPO) oczyszczanego w procesie wysalania siarczanem amonu z wykorzystaniem złoża Sephadex G-50 CEL ĆWICZENIA: Zapoznanie się z przykładową
LABORATORIUM 3 Filtracja żelowa preparatu oksydazy polifenolowej (PPO) oczyszczanego w procesie wysalania siarczanem amonu z wykorzystaniem złoża Sephadex G-50 CEL ĆWICZENIA: Zapoznanie się z przykładową
Ulotka dołączona do opakowania: informacja dla użytkownika. Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych
 Ulotka dołączona do opakowania: informacja dla użytkownika Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Ulotka dołączona do opakowania: informacja dla użytkownika Woda do wstrzykiwań Baxter rozpuszczalnik do sporządzania leków pareneteralnych Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem
Interdyscyplinarny charakter badań równoważności biologicznej produktów leczniczych
 Interdyscyplinarny charakter badań równoważności biologicznej produktów leczniczych Piotr Rudzki Zakład Farmakologii, w Warszawie Kongres Świata Przemysłu Farmaceutycznego Łódź, 25 VI 2009 r. Prace badawczo-wdrożeniowe
Interdyscyplinarny charakter badań równoważności biologicznej produktów leczniczych Piotr Rudzki Zakład Farmakologii, w Warszawie Kongres Świata Przemysłu Farmaceutycznego Łódź, 25 VI 2009 r. Prace badawczo-wdrożeniowe
Zasady wykonania walidacji metody analitycznej
 Zasady wykonania walidacji metody analitycznej Walidacja metod badań zasady postępowania w LOTOS Lab 1. Metody badań stosowane w LOTOS Lab należą do następujących grup: 1.1. Metody zgodne z uznanymi normami
Zasady wykonania walidacji metody analitycznej Walidacja metod badań zasady postępowania w LOTOS Lab 1. Metody badań stosowane w LOTOS Lab należą do następujących grup: 1.1. Metody zgodne z uznanymi normami
I. Odczynniki i materiały zużywalne
 Pak Nr 10 Dzierżawa analizatora do badań pilnych wraz z odczynnikami i aparatem zastępczym I. Odczynniki i materiały zużywalne L/ Nazwa odczynnika p Ilość oznaczeń na 3 lata oznacz. netto oznacz. brutto
Pak Nr 10 Dzierżawa analizatora do badań pilnych wraz z odczynnikami i aparatem zastępczym I. Odczynniki i materiały zużywalne L/ Nazwa odczynnika p Ilość oznaczeń na 3 lata oznacz. netto oznacz. brutto
Aneks III. Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta
 Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
Aneks III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotkach dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja zmian w charakterystyce produktu leczniczego i ulotce
1.2. Zlecenie może być wystawione w formie elektronicznej z zachowaniem wymagań, o których mowa w poz. 1.1.
 Załączniki do rozporządzenia Ministra Zdrowia z dnia 2005 r. (poz. ) Załącznik Nr 1 Podstawowe standardy jakości w czynnościach laboratoryjnej diagnostyki medycznej, ocenie ich jakości i wartości diagnostycznej
Załączniki do rozporządzenia Ministra Zdrowia z dnia 2005 r. (poz. ) Załącznik Nr 1 Podstawowe standardy jakości w czynnościach laboratoryjnej diagnostyki medycznej, ocenie ich jakości i wartości diagnostycznej
PL.EDU.ELI PRZEWODNIK DLA LEKARZY
 PRZEWODNIK DLA LEKARZY Przewodnik dla Lekarzy Produkt leczniczy CERDELGA jest wskazany do długotrwałego leczenia dorosłych pacjentów z chorobą Gauchera typu 1, ze słabym (PM, ang. poor metaboliser), średnim
PRZEWODNIK DLA LEKARZY Przewodnik dla Lekarzy Produkt leczniczy CERDELGA jest wskazany do długotrwałego leczenia dorosłych pacjentów z chorobą Gauchera typu 1, ze słabym (PM, ang. poor metaboliser), średnim
JAK WYZNACZYĆ PARAMETRY WALIDACYJNE W METODACH INSTRUMENTALNYCH
 JAK WYZNACZYĆ PARAMETRY WALIDACYJNE W METODACH INSTRUMENTALNYCH dr inż. Agnieszka Wiśniewska EKOLAB Sp. z o.o. agnieszka.wisniewska@ekolab.pl DZIAŁALNOŚĆ EKOLAB SP. Z O.O. Akredytowane laboratorium badawcze
JAK WYZNACZYĆ PARAMETRY WALIDACYJNE W METODACH INSTRUMENTALNYCH dr inż. Agnieszka Wiśniewska EKOLAB Sp. z o.o. agnieszka.wisniewska@ekolab.pl DZIAŁALNOŚĆ EKOLAB SP. Z O.O. Akredytowane laboratorium badawcze
Walidacja metod wykrywania, identyfikacji i ilościowego oznaczania GMO. Magdalena Żurawska-Zajfert Laboratorium Kontroli GMO IHAR-PIB
 Walidacja metod wykrywania, identyfikacji i ilościowego oznaczania GMO Magdalena Żurawska-Zajfert Laboratorium Kontroli GMO IHAR-PIB Walidacja Walidacja jest potwierdzeniem przez zbadanie i przedstawienie
Walidacja metod wykrywania, identyfikacji i ilościowego oznaczania GMO Magdalena Żurawska-Zajfert Laboratorium Kontroli GMO IHAR-PIB Walidacja Walidacja jest potwierdzeniem przez zbadanie i przedstawienie
OZNACZANIE ŻELAZA METODĄ SPEKTROFOTOMETRII UV/VIS
 OZNACZANIE ŻELAZA METODĄ SPEKTROFOTOMETRII UV/VIS Zagadnienia teoretyczne. Spektrofotometria jest techniką instrumentalną, w której do celów analitycznych wykorzystuje się przejścia energetyczne zachodzące
OZNACZANIE ŻELAZA METODĄ SPEKTROFOTOMETRII UV/VIS Zagadnienia teoretyczne. Spektrofotometria jest techniką instrumentalną, w której do celów analitycznych wykorzystuje się przejścia energetyczne zachodzące
Laboratorium z bionanostruktur. Prowadzący: mgr inż. Jan Procek Konsultacje: WT D- 1 8A
 Laboratorium z bionanostruktur Prowadzący: mgr inż. Jan Procek Konsultacje: WT 9.00-10.00 D- 1 8A Regulamin Studenci są dopuszczeni do wykonywania ćwiczenia jeżeli posiadają: Buty na płaskim obcasie, Fartuchy,
Laboratorium z bionanostruktur Prowadzący: mgr inż. Jan Procek Konsultacje: WT 9.00-10.00 D- 1 8A Regulamin Studenci są dopuszczeni do wykonywania ćwiczenia jeżeli posiadają: Buty na płaskim obcasie, Fartuchy,
Dyrektywa 98/79/WE. Polskie Normy zharmonizowane opublikowane do 31.12.2013 Wykaz norm z dyrektywy znajduje się również na www.pkn.
 Dyrektywa 98/79/WE Załącznik nr 23 Załącznik nr 23 Polskie Normy zharmonizowane opublikowane do 31.12.2013 Wykaz norm z dyrektywy znajduje się również na www.pkn.pl Według Dziennika Urzędowego UE (2013/C
Dyrektywa 98/79/WE Załącznik nr 23 Załącznik nr 23 Polskie Normy zharmonizowane opublikowane do 31.12.2013 Wykaz norm z dyrektywy znajduje się również na www.pkn.pl Według Dziennika Urzędowego UE (2013/C
Ana n l a i l za z a i ns n tru r men e t n al a n l a
 Analiza instrumentalna rok akademicki 2014/2015 wykład: prof. dr hab. Ewa Bulska prof. dr hab. Agata Michalska Maksymiuk pracownia: dr Marcin Wojciechowski Slide 1 Analiza_Instrumentalna: 2014/2015 Analiza
Analiza instrumentalna rok akademicki 2014/2015 wykład: prof. dr hab. Ewa Bulska prof. dr hab. Agata Michalska Maksymiuk pracownia: dr Marcin Wojciechowski Slide 1 Analiza_Instrumentalna: 2014/2015 Analiza
Zasady diagnostyki laboratoryjnej u pacjenta otrzymującego lek Hemlibra Edyta Odnoczko
 Zasady diagnostyki laboratoryjnej u pacjenta otrzymującego lek Hemlibra Edyta Odnoczko 23 marzec 2019r. HEMLIBRA = EMICIZUMAB (ACE 910) Działanie: naśladuje (mimics) in vitro oraz in vivo FVIIIa Nie wymaga
Zasady diagnostyki laboratoryjnej u pacjenta otrzymującego lek Hemlibra Edyta Odnoczko 23 marzec 2019r. HEMLIBRA = EMICIZUMAB (ACE 910) Działanie: naśladuje (mimics) in vitro oraz in vivo FVIIIa Nie wymaga
1. PRZYGOTOWANIE ROZTWORÓW KOMPLEKSUJĄCYCH
 1. PRZYGOTOWANIE ROZTWORÓW KOMPLEKSUJĄCYCH 1.1. przygotowanie 20 g 20% roztworu KSCN w wodzie destylowanej 1.1.1. odważenie 4 g stałego KSCN w stożkowej kolbie ze szlifem 1.1.2. odważenie 16 g wody destylowanej
1. PRZYGOTOWANIE ROZTWORÓW KOMPLEKSUJĄCYCH 1.1. przygotowanie 20 g 20% roztworu KSCN w wodzie destylowanej 1.1.1. odważenie 4 g stałego KSCN w stożkowej kolbie ze szlifem 1.1.2. odważenie 16 g wody destylowanej
ZAKRES AKREDYTACJI LABORATORIUM MEDYCZNEGO Nr AM 006
 PCA ZAKRES AKREDYTACJI LABORATORIUM MEDYCZNEGO Nr AM 006 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 10 Data wydania: 10 lipca 2018 r. Nazwa i adres Diagnostyka
PCA ZAKRES AKREDYTACJI LABORATORIUM MEDYCZNEGO Nr AM 006 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 10 Data wydania: 10 lipca 2018 r. Nazwa i adres Diagnostyka
Laboratorium z biofizyki
 Laboratorium z biofizyki Regulamin Studenci są dopuszczeni do wykonywania ćwiczenia jeżeli posiadają: Buty na płaskim obcasie, Fartuchy, Rękawiczki bezpudrowe, Zeszyt 16-kartkowy. Zeszyt laboratoryjny
Laboratorium z biofizyki Regulamin Studenci są dopuszczeni do wykonywania ćwiczenia jeżeli posiadają: Buty na płaskim obcasie, Fartuchy, Rękawiczki bezpudrowe, Zeszyt 16-kartkowy. Zeszyt laboratoryjny
KREW: 1. Oznaczenie stężenia Hb. Metoda cyjanmethemoglobinowa: Zasada metody:
 KREW: 1. Oznaczenie stężenia Hb Metoda cyjanmethemoglobinowa: Hemoglobina i niektóre jej pochodne są utleniane przez K3 [Fe(CN)6]do methemoglobiny, a następnie przekształcane pod wpływem KCN w trwały związek
KREW: 1. Oznaczenie stężenia Hb Metoda cyjanmethemoglobinowa: Hemoglobina i niektóre jej pochodne są utleniane przez K3 [Fe(CN)6]do methemoglobiny, a następnie przekształcane pod wpływem KCN w trwały związek
Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków
 Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków 1 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej kwasu nikotynowego/laropiprantu
Aneks I Wnioski naukowe i podstawy zawieszenia pozwolenia na dopuszczenie do obrotu przedstawione przez Europejską Agencję Leków 1 Wnioski naukowe Ogólne podsumowanie oceny naukowej dotyczącej kwasu nikotynowego/laropiprantu
ZAKRES AKREDYTACJI LABORATORIUM MEDYCZNEGO Nr AM 006
 PCA Zakres akredytacji Nr AM 006 ZAKRES AKREDYTACJI LABORATORIUM MEDYCZNEGO Nr AM 006 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 10 Data wydania: 10 lipca
PCA Zakres akredytacji Nr AM 006 ZAKRES AKREDYTACJI LABORATORIUM MEDYCZNEGO Nr AM 006 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 10 Data wydania: 10 lipca
Tabela potwierdzenia informacji rejestracyjnych przedsiębiorstwa produkcji importowanego mleka pasteryzowanego
 Tabela potwierdzenia informacji rejestracyjnych przedsiębiorstwa produkcji importowanego mleka pasteryzowanego 1. Podstawowe informacje na temat przedsiębiorstwa (wypełnia przedsiębiorstwo ubiegające się)
Tabela potwierdzenia informacji rejestracyjnych przedsiębiorstwa produkcji importowanego mleka pasteryzowanego 1. Podstawowe informacje na temat przedsiębiorstwa (wypełnia przedsiębiorstwo ubiegające się)
WALIDACJA - ABECADŁO. OGÓLNE ZASADY WALIDACJI
 WALIDACJA - ABECADŁO. 1 OGÓLNE ZASADY WALIDACJI Piotr KONIECZKA Katedra Chemii Analitycznej Wydział Chemiczny Politechnika Gdańska ul. G. Narutowicza 11/12 80-233 GDAŃSK e-mail:piotr.konieczka@pg.gda.pl
WALIDACJA - ABECADŁO. 1 OGÓLNE ZASADY WALIDACJI Piotr KONIECZKA Katedra Chemii Analitycznej Wydział Chemiczny Politechnika Gdańska ul. G. Narutowicza 11/12 80-233 GDAŃSK e-mail:piotr.konieczka@pg.gda.pl
ALGALTOXKIT F Procedura testu
 ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
ALGALTOXKIT F Procedura testu 1 PRZYGOTOWANIE STANDARDOWEJ POŻYWKI A B C D - KOLBKA MIAROWA (1 litr) - FIOLKI Z ROZTWORAMI POŻYWEK A (2 fiolki), B, C, D - DESTYLOWANA (lub dejonizowana) WODA 2 A PRZENIEŚĆ
Acusera 24.7 - zarządzanie wynikami kontroli wewnątrzlaboratoryjnej
 Acusera 24.7 - zarządzanie wynikami kontroli wewnątrzlaboratoryjnej II Konferencja Diagnostów Laboratoryjnych Śląski Urząd Wojewódzki w Katowicach 14 września 2015 Acusera 24. 7 - główne funkcje: 1.Prowadzenie
Acusera 24.7 - zarządzanie wynikami kontroli wewnątrzlaboratoryjnej II Konferencja Diagnostów Laboratoryjnych Śląski Urząd Wojewódzki w Katowicach 14 września 2015 Acusera 24. 7 - główne funkcje: 1.Prowadzenie
wiczenie - Oznaczanie stenia magnezu w surowicy krwi metod kolorymetryczn
 wiczenie - Oznaczanie stenia magnezu w surowicy krwi metod kolorymetryczn Wprowadzenie Magnez wystpuje we wszystkich tkankach i pynach ustrojowych, a znaczna cz znajduje si w tkance kostnej. Razem z wapniem
wiczenie - Oznaczanie stenia magnezu w surowicy krwi metod kolorymetryczn Wprowadzenie Magnez wystpuje we wszystkich tkankach i pynach ustrojowych, a znaczna cz znajduje si w tkance kostnej. Razem z wapniem
Kontrola i zapewnienie jakości wyników
 Kontrola i zapewnienie jakości wyników Kontrola i zapewnienie jakości wyników QA : Quality Assurance QC : Quality Control Dobór systemu zapewnienia jakości wyników dla danego zadania fit for purpose Kontrola
Kontrola i zapewnienie jakości wyników Kontrola i zapewnienie jakości wyników QA : Quality Assurance QC : Quality Control Dobór systemu zapewnienia jakości wyników dla danego zadania fit for purpose Kontrola
Sterowanie jakości. cią w laboratorium problem widziany okiem audytora technicznego
 Sterowanie jakości cią w laboratorium problem widziany okiem audytora technicznego Ewa Bulska Piotr Pasławski W treści normy PN-EN ISO/IEC 17025:2005 zawarto następujące zalecenia dotyczące sterowania
Sterowanie jakości cią w laboratorium problem widziany okiem audytora technicznego Ewa Bulska Piotr Pasławski W treści normy PN-EN ISO/IEC 17025:2005 zawarto następujące zalecenia dotyczące sterowania
JAK UNIKAĆ PODWÓJNEGO LICZENIA SKŁADOWYCH NIEPEWNOŚCI? Robert Gąsior
 Robert Gąsior Omówię klasyczne, nieco zmodyfikowane, podejście do szacowania niepewności wewnątrz-laboratoryjnej, oparte na budżecie niepewności. Budżet taki zawiera cząstkowe niepewności, które są składane
Robert Gąsior Omówię klasyczne, nieco zmodyfikowane, podejście do szacowania niepewności wewnątrz-laboratoryjnej, oparte na budżecie niepewności. Budżet taki zawiera cząstkowe niepewności, które są składane
10) istotne kliniczne dane pacjenta, w szczególności: rozpoznanie, występujące czynniki ryzyka zakażenia, w tym wcześniejsza antybiotykoterapia,
 Załącznik nr 2 Standardy jakości w zakresie mikrobiologicznych badań laboratoryjnych, w tym badań technikami biologii molekularnej, oceny ich jakości i wartości diagnostycznej oraz laboratoryjnej interpretacji
Załącznik nr 2 Standardy jakości w zakresie mikrobiologicznych badań laboratoryjnych, w tym badań technikami biologii molekularnej, oceny ich jakości i wartości diagnostycznej oraz laboratoryjnej interpretacji
Tytuł: Kontrola glukometrów
 Data obowiązywania: Wydanie: 1 Strona 1 z 6 Karta zmian 1. CEL: Nr Punktu Podpunktu rozdziału Zmiany Akapitu lub fragmentu tekstu ze strony nr Opis Data Podpis autora ZATWIERDZIŁ Dyrektor Szpitala Dr n.
Data obowiązywania: Wydanie: 1 Strona 1 z 6 Karta zmian 1. CEL: Nr Punktu Podpunktu rozdziału Zmiany Akapitu lub fragmentu tekstu ze strony nr Opis Data Podpis autora ZATWIERDZIŁ Dyrektor Szpitala Dr n.
RT31-020, RT , MgCl 2. , random heksamerów X 6
 RT31-020, RT31-100 RT31-020, RT31-100 Zestaw TRANSCRIPTME RNA zawiera wszystkie niezbędne składniki do przeprowadzenia syntezy pierwszej nici cdna na matrycy mrna lub całkowitego RNA. Uzyskany jednoniciowy
RT31-020, RT31-100 RT31-020, RT31-100 Zestaw TRANSCRIPTME RNA zawiera wszystkie niezbędne składniki do przeprowadzenia syntezy pierwszej nici cdna na matrycy mrna lub całkowitego RNA. Uzyskany jednoniciowy
QMS Tacrolimus Immunoassay
 QMS Tacrolimus Immunoassay 115556 Wyłącznie do stosowania w diagnostyce in vitro Przed użyciem należy uważnie przeczytać niniejszą ulotkę informacyjną dołączoną do opakowania systemu mikrosfer do oznaczania
QMS Tacrolimus Immunoassay 115556 Wyłącznie do stosowania w diagnostyce in vitro Przed użyciem należy uważnie przeczytać niniejszą ulotkę informacyjną dołączoną do opakowania systemu mikrosfer do oznaczania
JAK WYZNACZA SIĘ PARAMETRY WALIDACYJNE
 JAK WYZNACZA SIĘ PARAMETRY WALIDACYJNE 1 Granica wykrywalności i granica oznaczalności Dr inż. Piotr KONIECZKA Katedra Chemii Analitycznej Wydział Chemiczny Politechnika Gdańska ul. G. Narutowicza 11/12
JAK WYZNACZA SIĘ PARAMETRY WALIDACYJNE 1 Granica wykrywalności i granica oznaczalności Dr inż. Piotr KONIECZKA Katedra Chemii Analitycznej Wydział Chemiczny Politechnika Gdańska ul. G. Narutowicza 11/12
Walidacja metody analitycznej podejście metrologiczne. Waldemar Korol Instytut Zootechniki-PIB, Krajowe Laboratorium Pasz w Lublinie
 Walidacja metody analitycznej podejście metrologiczne Waldemar Korol Instytut Zootechniki-PIB, Krajowe Laboratorium Pasz w Lublinie Walidacja potwierdzenie parametrów metody do zamierzonego jej zastosowania
Walidacja metody analitycznej podejście metrologiczne Waldemar Korol Instytut Zootechniki-PIB, Krajowe Laboratorium Pasz w Lublinie Walidacja potwierdzenie parametrów metody do zamierzonego jej zastosowania
Nieaktualna wersja Rozdziału 6 Zmieniona i aktualna wersja Rozdziału 6
 Zasada [Komentarze: Dodano pierwsze zdanie.] 6.2 Do zadań Działu Kontroli Jakości należy także opracowywanie, walidacja i wdrażanie wszystkich procedur kontroli jakości, przechowywanie prób referencyjnych
Zasada [Komentarze: Dodano pierwsze zdanie.] 6.2 Do zadań Działu Kontroli Jakości należy także opracowywanie, walidacja i wdrażanie wszystkich procedur kontroli jakości, przechowywanie prób referencyjnych
Laboratorium 5. Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna
 Laboratorium 5 Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Szybkość reakcji enzymatycznej zależy przede wszystkim od stężenia substratu
Laboratorium 5 Wpływ temperatury na aktywność enzymów. Inaktywacja termiczna Prowadzący: dr inż. Karolina Labus 1. CZĘŚĆ TEORETYCZNA Szybkość reakcji enzymatycznej zależy przede wszystkim od stężenia substratu
Teoria błędów. Wszystkie wartości wielkości fizycznych obarczone są pewnym błędem.
 Teoria błędów Wskutek niedoskonałości przyrządów, jak również niedoskonałości organów zmysłów wszystkie pomiary są dokonywane z określonym stopniem dokładności. Nie otrzymujemy prawidłowych wartości mierzonej
Teoria błędów Wskutek niedoskonałości przyrządów, jak również niedoskonałości organów zmysłów wszystkie pomiary są dokonywane z określonym stopniem dokładności. Nie otrzymujemy prawidłowych wartości mierzonej
Problemy przedstawione w prezentowanym przypadku: Odstawienie immunosupresji Przewlekłe odrzucanie Zwiększona immunosupresja Zakażenie
 Problemy przedstawione w prezentowanym przypadku: Odstawienie immunosupresji Przewlekłe odrzucanie Zwiększona immunosupresja Zakażenie Pytania Co było przyczyną zgonu dziecka? 1. Odstawienie leków przez
Problemy przedstawione w prezentowanym przypadku: Odstawienie immunosupresji Przewlekłe odrzucanie Zwiększona immunosupresja Zakażenie Pytania Co było przyczyną zgonu dziecka? 1. Odstawienie leków przez
KOAGULOLOGIA. Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice.
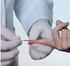 KOAGULOLOGIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi.
KOAGULOLOGIA POBIERANIE KRWI ŻYLNEJ Pobieranie krwi żylnej przy pomocy systemu otwartego: Przed każdym pobieraniem krwi należy umyć ręce i nałożyć rękawice. Wyszukać żyłę odpowiednią do pobrania krwi.
Aneks IV. Wnioski naukowe i podstawy do zmiany warunków pozwoleń na dopuszczenie do obrotu
 Aneks IV Wnioski naukowe i podstawy do zmiany warunków pozwoleń na dopuszczenie do obrotu 137 Wnioski naukowe CHMP rozważył poniższe zalecenie PRAC z dnia 5 grudnia 2013 r. odnoszące się do procedury zgodnej
Aneks IV Wnioski naukowe i podstawy do zmiany warunków pozwoleń na dopuszczenie do obrotu 137 Wnioski naukowe CHMP rozważył poniższe zalecenie PRAC z dnia 5 grudnia 2013 r. odnoszące się do procedury zgodnej
Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych Oznaczenie kwalifikacji: A.59 Numer zadania: 01
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2017 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2017 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Instrukcja do ćwiczeń laboratoryjnych
 UNIWERSYTET GDAŃSKI WYDZIAŁ CHEMII Pracownia studencka Katedra Analizy Środowiska Instrukcja do ćwiczeń laboratoryjnych Ćwiczenie nr 4 i 5 OCENA EKOTOKSYCZNOŚCI TEORIA Chemia zanieczyszczeń środowiska
UNIWERSYTET GDAŃSKI WYDZIAŁ CHEMII Pracownia studencka Katedra Analizy Środowiska Instrukcja do ćwiczeń laboratoryjnych Ćwiczenie nr 4 i 5 OCENA EKOTOKSYCZNOŚCI TEORIA Chemia zanieczyszczeń środowiska
Opis przedmiotu zamówienia wraz z wymaganiami technicznymi i zestawieniem parametrów
 Załącznik nr 1 do SIWZ Nazwa i adres Wykonawcy Opis przedmiotu zamówienia wraz z wymaganiami technicznymi i zestawieniem parametrów Przedmiot zamówienia; automatyczny system do diagnostyki molekularnej:
Załącznik nr 1 do SIWZ Nazwa i adres Wykonawcy Opis przedmiotu zamówienia wraz z wymaganiami technicznymi i zestawieniem parametrów Przedmiot zamówienia; automatyczny system do diagnostyki molekularnej:
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2017 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2017 Nazwa kwalifikacji: Przygotowywanie sprzętu, odczynników chemicznych i próbek do badań analitycznych
DOKUMENTACJA SYSTEMU ZARZĄDZANIA LABORATORIUM. Procedura szacowania niepewności
 DOKUMENTACJA SYSTEMU ZARZĄDZANIA LABORATORIUM Procedura szacowania niepewności Szacowanie niepewności oznaczania / pomiaru zawartości... metodą... Data Imię i Nazwisko Podpis Opracował Sprawdził Zatwierdził
DOKUMENTACJA SYSTEMU ZARZĄDZANIA LABORATORIUM Procedura szacowania niepewności Szacowanie niepewności oznaczania / pomiaru zawartości... metodą... Data Imię i Nazwisko Podpis Opracował Sprawdził Zatwierdził
Największe wyzwania w diagnostyce zaburzeń lipidowych. Cholesterol LDL oznaczany bezpośrednio, czy wyliczany ze wzoru Friedewalna, na czczo czy nie?
 Największe wyzwania w diagnostyce zaburzeń lipidowych. Cholesterol LDL oznaczany bezpośrednio, czy wyliczany ze wzoru Friedewalna, na czczo czy nie? Bogdan Solnica Katedra Biochemii Klinicznej Uniwersytet
Największe wyzwania w diagnostyce zaburzeń lipidowych. Cholesterol LDL oznaczany bezpośrednio, czy wyliczany ze wzoru Friedewalna, na czczo czy nie? Bogdan Solnica Katedra Biochemii Klinicznej Uniwersytet
Walidacja metod analitycznych
 Kierunki rozwoju chemii analitycznej Walidacja metod analitycznych Raport z walidacji Małgorzata Jakubowska Katedra Chemii Analitycznej WIMiC AGH oznaczanie coraz niŝszych w próbkach o złoŝonej matrycy
Kierunki rozwoju chemii analitycznej Walidacja metod analitycznych Raport z walidacji Małgorzata Jakubowska Katedra Chemii Analitycznej WIMiC AGH oznaczanie coraz niŝszych w próbkach o złoŝonej matrycy
ARKUSZ EGZAMINACYJNY ETAP PRAKTYCZNY EGZAMINU POTWIERDZAJĄCEGO KWALIFIKACJE ZAWODOWE CZERWIEC 2010
 Zawód: technik analityk Symbol cyfrowy zawodu: 311[02] Numer zadania: Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu 311[02]-0-102 Czas trwania egzaminu: 240 minut ARKUSZ EGZAMINACYJNY
Zawód: technik analityk Symbol cyfrowy zawodu: 311[02] Numer zadania: Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu 311[02]-0-102 Czas trwania egzaminu: 240 minut ARKUSZ EGZAMINACYJNY
ZESTAWIENIE PARAMETRÓW TECHNICZNYCH I WYMOGÓW GRANICZNYCH PAKIET Nr 1 Materiały kontrolne do programu sprawdzianów chemicznych
 PAKIET Nr 1 Materiały kontrolne do programu sprawdzianów chemicznych 1. Oba materiały kontrolne wyprodukowane wyłącznie na bazie surowicy ludzkiej (udokumentować w ulotce). Dwa materiały o różnych poziomach
PAKIET Nr 1 Materiały kontrolne do programu sprawdzianów chemicznych 1. Oba materiały kontrolne wyprodukowane wyłącznie na bazie surowicy ludzkiej (udokumentować w ulotce). Dwa materiały o różnych poziomach
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ. Ćwiczenie 5
 CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 5 Kompleksometryczne oznaczanie twardości wody w próbce rzeczywistej oraz mleczanu wapnia w preparacie farmaceutycznym Ćwiczenie
CHEMIA ŚRODKÓW BIOAKTYWNYCH I KOSMETYKÓW PRACOWNIA CHEMII ANALITYCZNEJ Ćwiczenie 5 Kompleksometryczne oznaczanie twardości wody w próbce rzeczywistej oraz mleczanu wapnia w preparacie farmaceutycznym Ćwiczenie
Komunikat Komisji w ramach wdrażania dyrektywy 98/79/WE Parlamentu Europejskiego i Rady w sprawie wyrobów medycznych używanych do diagnozy in vitro
 C 173/136 PL Dziennik Urzędowy Unii Europejskiej 13.5.2016 Komunikat Komisji w ramach wdrażania dyrektywy 98/79/WE Parlamentu Europejskiego i Rady w sprawie wyrobów medycznych używanych do diagnozy in
C 173/136 PL Dziennik Urzędowy Unii Europejskiej 13.5.2016 Komunikat Komisji w ramach wdrażania dyrektywy 98/79/WE Parlamentu Europejskiego i Rady w sprawie wyrobów medycznych używanych do diagnozy in
Laboratorium Podstaw Biofizyki
 CEL ĆWICZENIA Celem ćwiczenia jest zbadanie procesu adsorpcji barwnika z roztworu oraz wyznaczenie równania izotermy Freundlicha. ZAKRES WYMAGANYCH WIADOMOŚCI I UMIEJĘTNOŚCI: widmo absorpcyjne, prawo Lamberta-Beera,
CEL ĆWICZENIA Celem ćwiczenia jest zbadanie procesu adsorpcji barwnika z roztworu oraz wyznaczenie równania izotermy Freundlicha. ZAKRES WYMAGANYCH WIADOMOŚCI I UMIEJĘTNOŚCI: widmo absorpcyjne, prawo Lamberta-Beera,
Agomelatyna. Broszura dla pacjenta
 Istotne informacje Nie wyrzucaj! Agomelatyna w leczeniu dużych epizodów depresyjnych u dorosłych Broszura dla pacjenta Informacje dotyczące leku Agomelatyna jest lekiem przeciwdepresyjnym, który pomoże
Istotne informacje Nie wyrzucaj! Agomelatyna w leczeniu dużych epizodów depresyjnych u dorosłych Broszura dla pacjenta Informacje dotyczące leku Agomelatyna jest lekiem przeciwdepresyjnym, który pomoże
Cele farmakologii klinicznej
 Cele farmakologii klinicznej 1. Dążenie do zwiększenia bezpieczeństwa i skuteczności leczenia farmakologicznego, poprawa opieki nad pacjentem - maksymalizacja skuteczności i bezpieczeństwa (farmakoterapia
Cele farmakologii klinicznej 1. Dążenie do zwiększenia bezpieczeństwa i skuteczności leczenia farmakologicznego, poprawa opieki nad pacjentem - maksymalizacja skuteczności i bezpieczeństwa (farmakoterapia
Oznaczanie żelaza i miedzi metodą miareczkowania spektrofotometrycznego
 Oznaczanie żelaza i miedzi metodą miareczkowania spektrofotometrycznego Oznaczanie dwóch kationów obok siebie metodą miareczkowania spektrofotometrycznego (bez maskowania) jest możliwe, gdy spełnione są
Oznaczanie żelaza i miedzi metodą miareczkowania spektrofotometrycznego Oznaczanie dwóch kationów obok siebie metodą miareczkowania spektrofotometrycznego (bez maskowania) jest możliwe, gdy spełnione są
Stodal syrop jest lekiem stosowanym w leczeniu kaszlu różnego pochodzenia, towarzyszącego infekcjom górnych dróg oddechowych.
 Ulotka dołączona do opakowania: informacja dla pacjenta Stodal, syrop Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta. Lek ten
Ulotka dołączona do opakowania: informacja dla pacjenta Stodal, syrop Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta. Lek ten
DOSTAWA ODCZYNNIKÓW BIOCHEMICZNYCH WRAZ Z DZIERŻAWĄ ANALIZATORA BIOCHEMICZNEGO
 PAKIET NR 1 DOSTAWA ODCZYNNIKÓW BIOCHEMICZNYCH WRAZ Z DZIERŻAWĄ ANALIZATORA BIOCHEMICZNEGO Parametry graniczne Lp. Wymagane parametry graniczne dla oferowanego analizatora i odczynników 1. Wydajność aparatu
PAKIET NR 1 DOSTAWA ODCZYNNIKÓW BIOCHEMICZNYCH WRAZ Z DZIERŻAWĄ ANALIZATORA BIOCHEMICZNEGO Parametry graniczne Lp. Wymagane parametry graniczne dla oferowanego analizatora i odczynników 1. Wydajność aparatu
Aneks III. Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta.
 Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Aneks III Zmiany do odpowiednich części Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta. Uwaga: Poszczególne punkty Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta są wynikiem zakończenia
Aneks I. Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu
 Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Aneks I Wnioski naukowe i podstawy zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu 1 Wnioski naukowe Uwzględniając raport oceniający komitetu PRAC w sprawie okresowych raportów o bezpieczeństwie
Metoda analityczna oznaczania chlorku winylu uwalnianego z materiałów i wyrobów do żywności
 Załącznik nr 4 Metoda analityczna oznaczania chlorku winylu uwalnianego z materiałów i wyrobów do żywności 1. Zakres i obszar stosowania Metoda służy do urzędowej kontroli zawartości chlorku winylu uwalnianego
Załącznik nr 4 Metoda analityczna oznaczania chlorku winylu uwalnianego z materiałów i wyrobów do żywności 1. Zakres i obszar stosowania Metoda służy do urzędowej kontroli zawartości chlorku winylu uwalnianego
AmpliTest Babesia spp. (PCR)
 AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
AmpliTest Babesia spp. (PCR) Zestaw do wykrywania sekwencji DNA specyficznych dla pierwotniaków z rodzaju Babesia techniką PCR Nr kat.: BAC21-100 Wielkość zestawu: 100 oznaczeń Objętość pojedynczej reakcji:
Wysokosprawna chromatografia cieczowa w analizie jakościowej i ilościowej
 Wysokosprawna chromatografia cieczowa w analizie jakościowej i ilościowej W analizie ilościowej z zastosowaniem techniki HPLC wykorzystuje się dwa możliwe schematy postępowania: kalibracja zewnętrzna sporządzenie
Wysokosprawna chromatografia cieczowa w analizie jakościowej i ilościowej W analizie ilościowej z zastosowaniem techniki HPLC wykorzystuje się dwa możliwe schematy postępowania: kalibracja zewnętrzna sporządzenie
System Triage firmy Quidel
 System Triage firmy Quidel Automatyczny. Skalibrowany. Spójny. Profesjonalna diagnostyka w placówkach opieki medycznej System Triage firmy Quidel Czas oczekiwania na wynik ilościowy to ok. 15-20 min.* Analizator
System Triage firmy Quidel Automatyczny. Skalibrowany. Spójny. Profesjonalna diagnostyka w placówkach opieki medycznej System Triage firmy Quidel Czas oczekiwania na wynik ilościowy to ok. 15-20 min.* Analizator
Aneks II. Wnioski naukowe
 Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
Aneks II Wnioski naukowe 8 Wnioski naukowe Solu-Medrol 40 mg, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań (zwany dalej Solu-Medrol ) zawiera metyloprednisolon i (jako substancję pomocniczą)
ZESTAWIENIE PARAMETRÓW ANALIZATORA BIOCHEMICZNEGO. Parametry graniczne
 Pak Nr1 ZESTAWIENIE PARAMETRÓW ANALIZATORA BIOCHEMICZNEGO ANALIZATOR BIOCHEMICZNY,fabrycznie nowy, wyprodukowany w 2011r, podać nazwę, typ, rok produkcji. Parametry graniczne Lp Określenie parametru Tak/
Pak Nr1 ZESTAWIENIE PARAMETRÓW ANALIZATORA BIOCHEMICZNEGO ANALIZATOR BIOCHEMICZNY,fabrycznie nowy, wyprodukowany w 2011r, podać nazwę, typ, rok produkcji. Parametry graniczne Lp Określenie parametru Tak/
JAK WYZNACZA SIĘ PARAMETRY WALIDACYJNE
 JAK WYZNACZA SIĘ PARAMETRY WALIDACYJNE 1 Przykład walidacji procedury analitycznej Piotr KONIECZKA Katedra Chemii Analitycznej Wydział Chemiczny Politechnika Gdańska ul. G. Narutowicza 11/1 80-33 GDAŃSK
JAK WYZNACZA SIĘ PARAMETRY WALIDACYJNE 1 Przykład walidacji procedury analitycznej Piotr KONIECZKA Katedra Chemii Analitycznej Wydział Chemiczny Politechnika Gdańska ul. G. Narutowicza 11/1 80-33 GDAŃSK
KATALITYCZNE OZNACZANIE ŚLADÓW MIEDZI
 6 KATALITYCZNE OZNACZANIE ŚLADÓW MIEDZI CEL ĆWICZENIA Zapoznanie studenta z zagadnieniami katalizy homogenicznej i wykorzystanie reakcji tego typu do oznaczania śladowych ilości jonów Cu 2+. Zakres obowiązującego
6 KATALITYCZNE OZNACZANIE ŚLADÓW MIEDZI CEL ĆWICZENIA Zapoznanie studenta z zagadnieniami katalizy homogenicznej i wykorzystanie reakcji tego typu do oznaczania śladowych ilości jonów Cu 2+. Zakres obowiązującego
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA)
 Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
Techniki immunoenzymatycznego oznaczania poziomu hormonów (EIA) Wstęp: Test ELISA (ang. Enzyme-Linked Immunosorbent Assay), czyli test immunoenzymatyczny (ang. Enzyme Immunoassay - EIA) jest obecnie szeroko
Ważne informacje nie wyrzucać! Agolek. w leczeniu dużych epizodów depresyjnych u dorosłych. Broszura dla Pacjenta
 Ważne informacje nie wyrzucać! Agolek w leczeniu dużych epizodów depresyjnych u dorosłych Broszura dla Pacjenta 1 Agolek jest lekiem przeciwdepresyjnym, który pomaga leczyć depresję. Aby zoptymalizować
Ważne informacje nie wyrzucać! Agolek w leczeniu dużych epizodów depresyjnych u dorosłych Broszura dla Pacjenta 1 Agolek jest lekiem przeciwdepresyjnym, który pomaga leczyć depresję. Aby zoptymalizować
(Publikacja tytułów i odniesień do norm zharmonizowanych na mocy prawodawstwa harmonizacyjnego Unii) (Tekst mający znaczenie dla EOG) (2015/C 226/03)
 10.7.2015 PL Dziennik Urzędowy Unii Europejskiej C 226/43 Komunikat Komisji w ramach wdrażania dyrektywy Parlamentu Europejskiego i Rady nr 98/79/WE z dnia 27 października 1998 r. w sprawie wyrobów medycznych
10.7.2015 PL Dziennik Urzędowy Unii Europejskiej C 226/43 Komunikat Komisji w ramach wdrażania dyrektywy Parlamentu Europejskiego i Rady nr 98/79/WE z dnia 27 października 1998 r. w sprawie wyrobów medycznych
data ĆWICZENIE 7 DYSTRYBUCJA TKANKOWA AMIDOHYDROLAZ
 Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 7 DYSTRYBUCJA TKANKOWA AMIDOHYDROLAZ Amidohydrolazy (E.C.3.5.1 oraz E.C.3.5.2) są enzymami z grupy hydrolaz o szerokim powinowactwie
Imię i nazwisko Uzyskane punkty Nr albumu data /3 podpis asystenta ĆWICZENIE 7 DYSTRYBUCJA TKANKOWA AMIDOHYDROLAZ Amidohydrolazy (E.C.3.5.1 oraz E.C.3.5.2) są enzymami z grupy hydrolaz o szerokim powinowactwie
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 02
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.60 Numer zadania: 02
Rekomendacje dla medycznych laboratoriów w zakresie diagnostyki toksykologicznej
 Rekomendacje dla medycznych laboratoriów w zakresie diagnostyki toksykologicznej Ewa Gomółka 1, 2 1 Pracownia Informacji Toksykologicznej i Analiz Laboratoryjnych, Katedra Toksykologii i Chorób Środowiskowych,
Rekomendacje dla medycznych laboratoriów w zakresie diagnostyki toksykologicznej Ewa Gomółka 1, 2 1 Pracownia Informacji Toksykologicznej i Analiz Laboratoryjnych, Katedra Toksykologii i Chorób Środowiskowych,
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta
 ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
ANEKS III Zmiany w odpowiednich punktach charakterystyki produktu leczniczego i ulotki dla pacjenta Uwaga: Konieczna może być późniejsza aktualizacja charakterystyki produktu leczniczego i ulotki dla pacjenta
Instrukcja do ćwiczeń laboratoryjnych
 UNIWERSYTET GDAŃSKI WYDZIAŁ CHEMII Pracownia studencka Katedra Analizy Środowiska Instrukcja do ćwiczeń laboratoryjnych Ćwiczenie nr 3 OZNACZANIE CHLORKÓW METODĄ SPEKTROFOTOMETRYCZNĄ Z TIOCYJANIANEM RTĘCI(II)
UNIWERSYTET GDAŃSKI WYDZIAŁ CHEMII Pracownia studencka Katedra Analizy Środowiska Instrukcja do ćwiczeń laboratoryjnych Ćwiczenie nr 3 OZNACZANIE CHLORKÓW METODĄ SPEKTROFOTOMETRYCZNĄ Z TIOCYJANIANEM RTĘCI(II)
Procedura szacowania niepewności
 DOKUMENTACJA SYSTEMU ZARZĄDZANIA LABORATORIUM Procedura szacowania niepewności Stron 7 Załączniki Nr 1 Nr Nr 3 Stron Symbol procedury PN//xyz Data Imię i Nazwisko Podpis Opracował Sprawdził Zatwierdził
DOKUMENTACJA SYSTEMU ZARZĄDZANIA LABORATORIUM Procedura szacowania niepewności Stron 7 Załączniki Nr 1 Nr Nr 3 Stron Symbol procedury PN//xyz Data Imię i Nazwisko Podpis Opracował Sprawdził Zatwierdził
EGZAMIN POTWIERDZAJĄCY KWALIFIKACJE W ZAWODZIE Rok 2018 CZĘŚĆ PRAKTYCZNA
 Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.0 Numer zadania: 01 Wypełnia
Arkusz zawiera informacje prawnie chronione do momentu rozpoczęcia egzaminu Układ graficzny CKE 2018 Nazwa kwalifikacji: Wykonywanie badań analitycznych Oznaczenie kwalifikacji: A.0 Numer zadania: 01 Wypełnia
Dokładność i precyzja wydajności systemu Accu-Chek Active. Wprowadzenie. Metoda
 Dokładność i precyzja wydajności systemu Accu-Chek Active I. DOKŁADNOŚĆ Ocena dokładności systemu została przeprowadzona w odniesieniu do normy ISO 15197. Wprowadzenie Celem badania było określenie dokładności
Dokładność i precyzja wydajności systemu Accu-Chek Active I. DOKŁADNOŚĆ Ocena dokładności systemu została przeprowadzona w odniesieniu do normy ISO 15197. Wprowadzenie Celem badania było określenie dokładności
QMS Quality in Microbiology Scheme Wydanie 14 Data wydania: czerwiec 2018
 Przyjęcie i przechowywanie Po otrzymaniu materiału do badań należy zapisać datę otrzymania, a następnie przechowywać w lodówce w temperaturze 2-8 º C do momentu przeprowadzenia badania. Materiał do badań
Przyjęcie i przechowywanie Po otrzymaniu materiału do badań należy zapisać datę otrzymania, a następnie przechowywać w lodówce w temperaturze 2-8 º C do momentu przeprowadzenia badania. Materiał do badań
SPIS TREŚCI do książki pt. Metody badań czynników szkodliwych w środowisku pracy
 SPIS TREŚCI do książki pt. Metody badań czynników szkodliwych w środowisku pracy Autor Andrzej Uzarczyk 1. Nadzór nad wyposażeniem pomiarowo-badawczym... 11 1.1. Kontrola metrologiczna wyposażenia pomiarowego...
SPIS TREŚCI do książki pt. Metody badań czynników szkodliwych w środowisku pracy Autor Andrzej Uzarczyk 1. Nadzór nad wyposażeniem pomiarowo-badawczym... 11 1.1. Kontrola metrologiczna wyposażenia pomiarowego...
Leczenie immunosupresyjne po przeszczepieniu narządu unaczynionego
 Leczenie immunosupresyjne po przeszczepieniu narządu unaczynionego Cel leczenia Brak odrzucania czynnego przeszczepionego narządu Klasyfikacja odrzucania przeszczepionego narządu Leki immunosupresyjne
Leczenie immunosupresyjne po przeszczepieniu narządu unaczynionego Cel leczenia Brak odrzucania czynnego przeszczepionego narządu Klasyfikacja odrzucania przeszczepionego narządu Leki immunosupresyjne
Terapia monitorowana , Warszawa
 Terapia monitorowana Marian Filipek Pracownia Farmakokinetyki Zakład Biochemii i Medycyny Doświadczalnej Instytut Pomnik-Centrum Zdrowia Dziecka Warszawa 15.05.2009, Warszawa Wybór leku Dawka Droga podania
Terapia monitorowana Marian Filipek Pracownia Farmakokinetyki Zakład Biochemii i Medycyny Doświadczalnej Instytut Pomnik-Centrum Zdrowia Dziecka Warszawa 15.05.2009, Warszawa Wybór leku Dawka Droga podania
Grupa SuperTaniaApteka.pl Utworzono : 30 wrzesień 2016
 TESTY CIĄŻOWE I DIAGNOSTYCZNE > Model : 9048435 Producent : HYDREX PRZED.TECH.HANDL. Testy paskowe Insight BIAŁKO Test są przeznaczone do wykonania ogólnego badania moczu w warunkach domowych. Testy BIAŁKO
TESTY CIĄŻOWE I DIAGNOSTYCZNE > Model : 9048435 Producent : HYDREX PRZED.TECH.HANDL. Testy paskowe Insight BIAŁKO Test są przeznaczone do wykonania ogólnego badania moczu w warunkach domowych. Testy BIAŁKO
Interpretacja wyników analiz ilości i obecności drobnoustrojów zgodnie z zasadami badań mikrobiologicznych żywności i pasz?
 Wydział Biotechnologii i Nauk o Żywności Seminarium STC 2018 Interpretacja wyników analiz ilości i obecności drobnoustrojów zgodnie z zasadami badań mikrobiologicznych żywności i pasz? Dr inż. Agnieszka
Wydział Biotechnologii i Nauk o Żywności Seminarium STC 2018 Interpretacja wyników analiz ilości i obecności drobnoustrojów zgodnie z zasadami badań mikrobiologicznych żywności i pasz? Dr inż. Agnieszka
ZAKRES AKREDYTACJI LABORATORIUM MEDYCZNEGO Nr AM 007
 ZAKRES AKREDYTACJI LABORATORIUM MEDYCZNEGO Nr AM 007 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 9 Data wydania: 15 stycznia 2019 r. Nazwa i adres MEDYCZNE
ZAKRES AKREDYTACJI LABORATORIUM MEDYCZNEGO Nr AM 007 wydany przez POLSKIE CENTRUM AKREDYTACJI 01-382 Warszawa, ul. Szczotkarska 42 Wydanie nr 9 Data wydania: 15 stycznia 2019 r. Nazwa i adres MEDYCZNE
Techniki molekularne ćw. 1 1 z 6
 Techniki molekularne ćw. 1 1 z 6 Instrukcja do ćwiczeń Nr 1. Temat: Izolacja całkowitego DNA z tkanki ssaczej metodą wiązania DNA do kolumny krzemionkowej oraz spektrofotometryczna ocena jego czystości
Techniki molekularne ćw. 1 1 z 6 Instrukcja do ćwiczeń Nr 1. Temat: Izolacja całkowitego DNA z tkanki ssaczej metodą wiązania DNA do kolumny krzemionkowej oraz spektrofotometryczna ocena jego czystości
Samodzielny Publiczny Zespół... Zakładów Opieki Zdrowotnej w Kozienicach... ul. Al. Wł. Sikorskiego 10
 Załącznik nr 2 do SIWZ Wykonawca:... Samodzielny Publiczny Zespół... Zakładów Opieki Zdrowotnej w Kozienicach... ul. Al. Wł. Sikorskiego 10 tel.:/fax:... 26-900 Kozienice tel.:/fax: (48) 382 88 00/ (48)
Załącznik nr 2 do SIWZ Wykonawca:... Samodzielny Publiczny Zespół... Zakładów Opieki Zdrowotnej w Kozienicach... ul. Al. Wł. Sikorskiego 10 tel.:/fax:... 26-900 Kozienice tel.:/fax: (48) 382 88 00/ (48)
Ulotka dołączona do opakowania: informacja dla użytkownika. Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji
 Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
Ulotka dołączona do opakowania: informacja dla użytkownika Bendamustine Kabi, 2,5 mg/ml, proszek do sporządzania koncentratu roztworu do infuzji Bendamustini hydrochloridum Należy uważnie zapoznać się
